Фармацевтическая композиция леводопа/карбидопа/энтакапон
Номер патента: 4503
Опубликовано: 29.04.2004
Авторы: Ритала Марья, Каллиойнен Сари, Линтулааксо Ярмо, Виркки Матти, Лааксонен Марья, Кервинен Лассе, Вахервуо Кари, Нисканен Мерви, Партанен Марья
Формула / Реферат
1. Твердая композиция для перорального введения, включающая фармакологически эффективные количества энтакапона, леводопы и карбидопы или их фармацевтически приемлемых солей или гидратов и фармацевтически приемлемый наполнитель, в которой основная часть карбидопы отделена от энтакапона и леводопы.
2. Композиция по п.1, в которой энтакапон и леводопа находятся в форме гранул, а карбидопа находится в форме порошка.
3. Композиция по п.1, в которой энтакапон и леводопа находятся в форме первых гранул, а карбидопа находится в форме вторых гранул.
4. Твердая композиция для перорального введения, включающая фармакологически эффективные количества энтакапона, леводопы и карбидопы или их фармацевтически приемлемых солей или гидратов и включающая по меньшей мере один фармацевтически приемлемый наполнитель, представляющий собой сахарный спирт, или крахмал, или сахарный спирт и крахмал.
5. Композиция по п.4, в которой сахарный спирт представляет собой маннит.
6. Композиция по п.4, в которой крахмал представляет собой кукурузный крахмал.
7. Композиция по п.4, которая дополнительно включает гидрогенизированное растительное масло.
8. Композиция по п.7, в которой гидрогенизированное растительное масло представляет собой гидрогенизированное касторовое масло.
9. Композиция по п.4, которая дополнительно включает разрыхлитель.
10. Композиция по п.9, в которой разрыхлитель представляет собой натрий-кроскармеллозу.
11. Стабильная твердая композиция для перорального введения, включающая фармакологически эффективные количества энтакапона, леводопы и карбидопы или их фармацевтически приемлемых солей или гидратов и включающая по меньшей мере один фармацевтически приемлемый наполнитель, не являющийся микрокристаллической целлюлозой.
12. Способ изготовления твердой композиции для перорального введения, включающей энтакапон, леводопу и карбидопу или их фармацевтически приемлемые соли или гидраты, который включает сначала смешивание энтакапона и леводопы отдельно, добавление отдельно карбидопы и изготовление из смеси множества лекарственных форм.
13. Способ по п.12, в котором карбидопу добавляют в форме порошка экстрагранулярно к гранулам энтакапона и леводопы.
14. Способ по п.12, в котором карбидопу добавляют в форме гранул к партии гранул энтакапона и леводопы.
15. Способ по п.12, который включает
a) смешивание фармакологически эффективных количеств энтакапона и леводопы или их фармацевтически приемлемой соли или гидрата по меньшей мере с одним фармацевтически приемлемым наполнителем и разрыхлителем с получением первой смеси;
b) гранулирование первой смеси с получением первой партии гранул;
c) смешивание фармацевтически эффективного количества карбидопы или ее фармацевтически приемлемой соли или гидрата по меньшей мере с одним фармацевтически приемлемым наполнителем и разрыхлителем с получением второй смеси;
d) гранулирование второй смеси с получением второй партии гранул;
e) смешивание первой партии гранул, второй партии гранул, необязательно, смазывающего агента и, необязательно, одного или более фармацевтически приемлемых наполнителей с получением третьей смеси и
f) изготовление из третьей смеси множества лекарственных форм.
16. Способ по п.12, который включает
a) смешивание фармакологически эффективных количеств энтакапона и леводопы или их фармацевтически приемлемой соли или гидрата по меньшей мере с одним фармацевтически приемлемым наполнителем и разрыхлителем с получением первой смеси;
b) гранулирование первой смеси с получением партии гранул;
c) добавление фармакологически эффективного количества карбидопы или ее фармацевтически приемлемой соли или гидрата, необязательно, смазывающего агента и, необязательно, одного или более фармацевтически приемлемых наполнителей к партии гранул с получением второй смеси;
d) изготовление из второй смеси множества лекарственных форм.
17. Способ по п.15 или 16, в котором способом гранулирования является влажное гранулирование.
18. Фармацевтическая таблетка для перорального введения, включающая 200 мг энтакапона, 50-150 мг леводопы и 10-37,5 мг карбидопы и имеющая, по существу, следующие характеристики: вес 400-750 мг и объемный размер таблетки от 200 до 1000 мм3.
19. Фармацевтическая таблетка для перорального введения, включающая 200 мг энтакапона, 50-150 мг леводопы и 10-37,5 мг карбидопы и имеющая, по существу, следующие характеристики: вес 400-750 мг и объемный размер таблетки: длину 13-18 мм; ширину 6-9 мм и высоту 4-7 мм.
20. Способ лечения субъекта, страдающего болезнью Паркинсона, который включает введение композиции по любому из пп.1-11 или 18, 19 субъекту, нуждающемуся в указанном лечении.
Текст
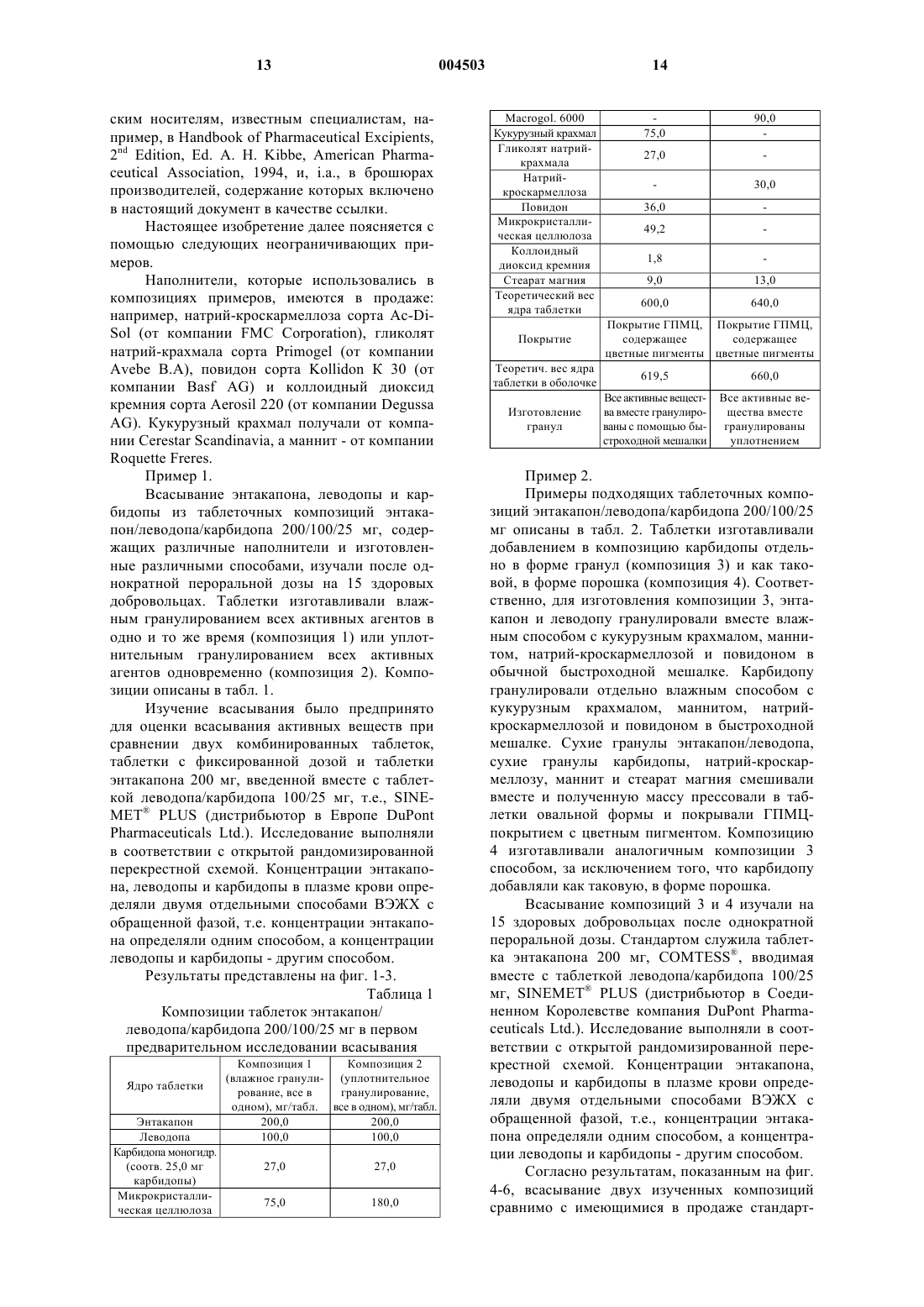
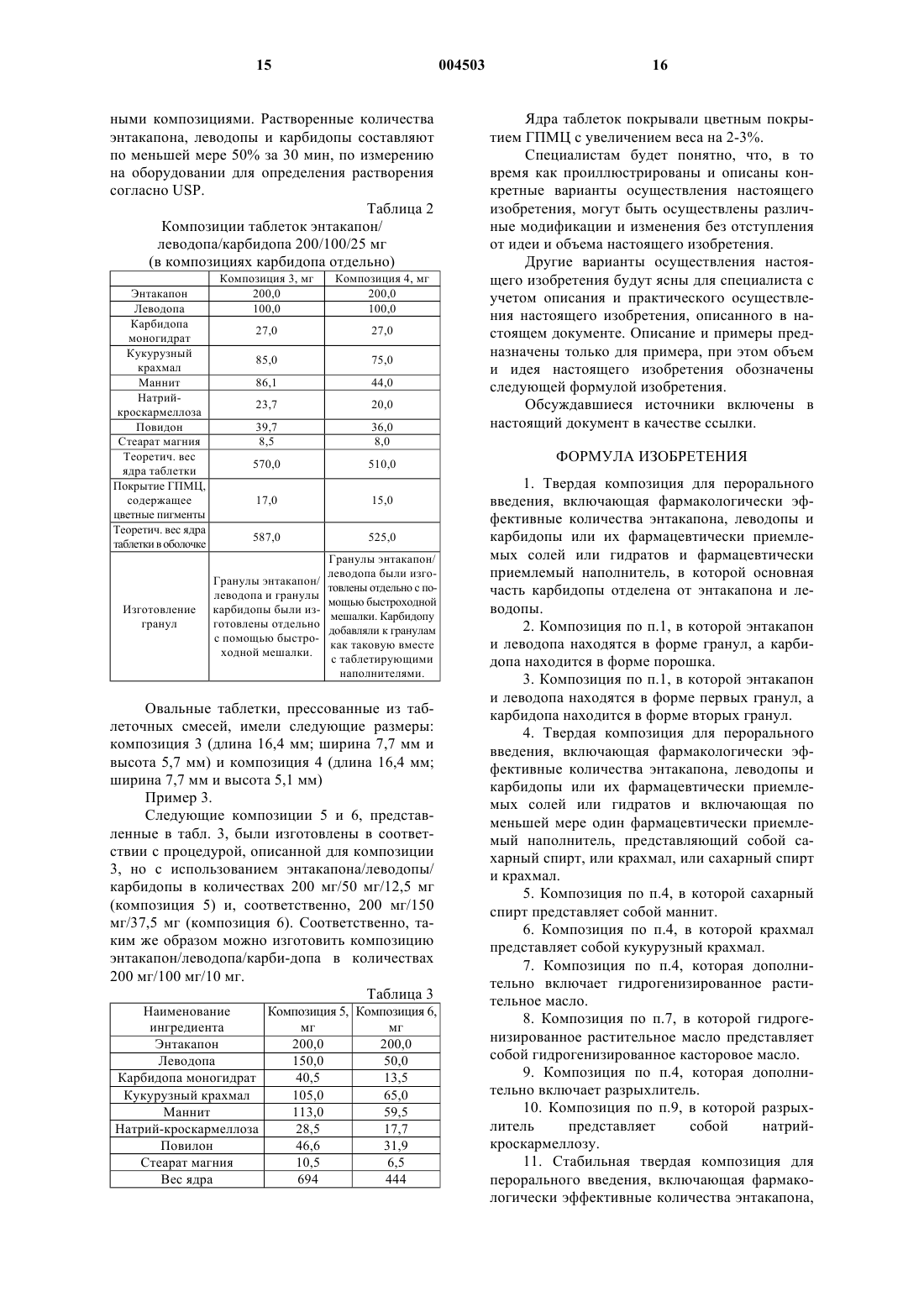
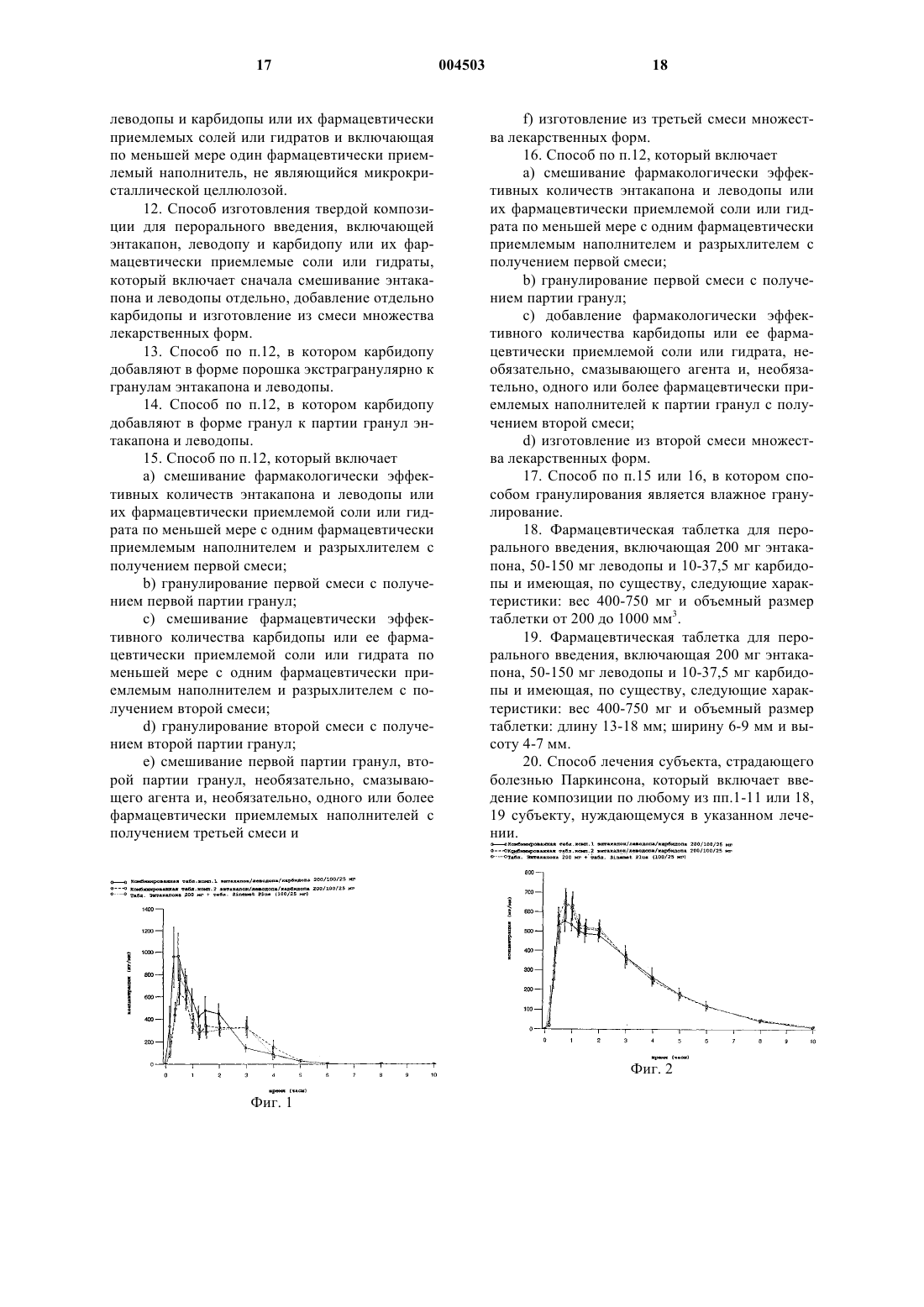
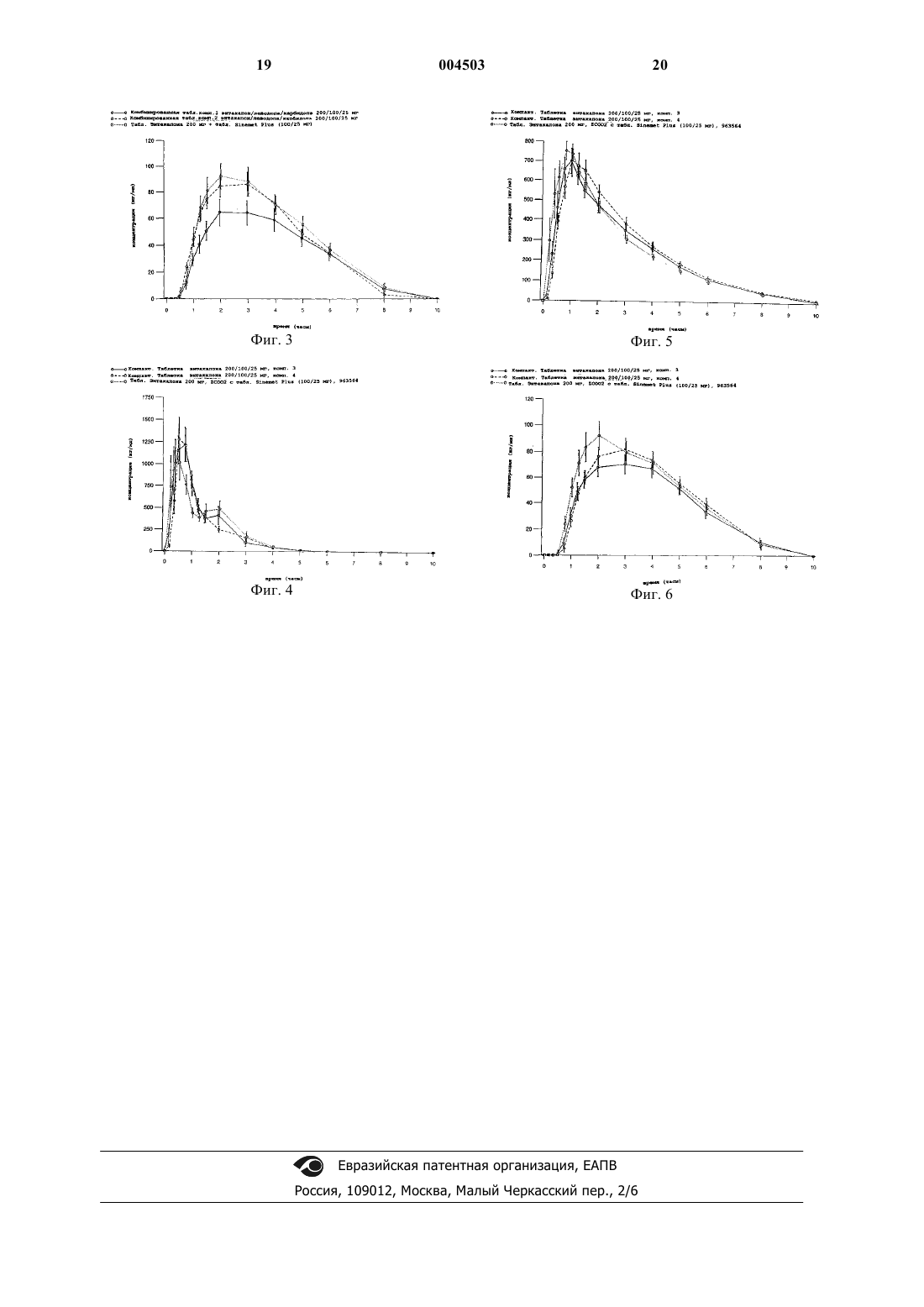
1 Область изобретения Настоящее изобретение относится к новым фармацевтическим композициям, включающим энтакапон, леводопу и карбидопу, или их фармацевтически приемлемую соль или гидрат, к способу изготовления указанных композиций и применению указанных композиций в терапевтическом способе. Настоящее изобретение относится также к применению энтакапона, леводопы и карбидопы или их фармацевтически приемлемых солей или гидратов для производства твердой комбинации для перорального введения с фиксированной дозой. Предпосылки к созданию изобретения Химическими названиями энтакапона, леводопы и карбидопы являются (Е)-2-циан-3(3,4-дигидрокси-5-нитрофенил)-N,N-диэтил-2 пропенамид,(-)-Lамин(3,4-дигидроксибензол)пропановая кислота и (-)-Lгидразин-метил(3,4-дигидроксибензол)пропановая кислота, например, в форме моногидрата, соответственно. Энтакапон описан в патенте США 5446194 как ингибитор катехол-O-метилтрансферазы (СОМТ). Энтеральные и парентеральные пути введения энтакапона обсуждаются в патенте США 5 446 194. Компактная композиция для перорального введения, содержащая энтакапон и натрий-кроскармеллозу,продается на европейском рынке под товарными знаками COMTESS и COMTAN производства компании Orion Corporation, Финляндия. Леводопа и карбидопа представляют собой лекарственные средства, наиболее широко применяемые для лечения болезни Паркинсона. Леводопа и карбидопа продаются в Европе в форме комбинированных таблеток, например, под следующими товарными знаками: NACOM (дистрибьютор DuPont Pharma), ISICOM (дистрибьютор Isis-Chemie), SINEMET (дистрибьютор DuPont Pharma), SINEMET PLUS (дистрибьютор DuPont Pharma в Соединенном Королевстве) и SINEMET LP 25 (дистрибьюторDuPont Pharma). При паркинсонизме лекарственные средства необходимо принимать несколько раз в день, чтобы у пациентов не появлялись симптомы болезни. Следовательно, соблюдение пациентами режима приема лекарственных средств можно значительно улучшить при использовании комбинации энтакапона, леводопы и карбидопы с фиксированной дозой, вместо приема двух отдельных таблеток, т.е.таблетки энтакапона и таблетки леводопа-карбидопа, несколько раз в день. Особенно это важно для пациентов,страдающих паркинсонизмом, имеющих тремор, а также для пациентов пожилого возраста. Заявители установили, что предпочтительно, если энтакапон, леводопа и карбидопа или их фармацевтически приемлемые соли или гидраты высвобождаются из пероральной композиции непосредственно после ее проглатывания. 2 Помимо этого, весьма трудно подобрать всасывание трех различных активных агентов из одной и той же пероральной твердой композиции. На практике обычно всасывание одного из активных агентов может снижаться, в то время как всасывание другого повышается. При выборе фармацевтических наполнителей, разрыхлителей и прочих вспомогательных агентов, предназначенных для использования в фармацевтической композиции в комбинации с несколькими активными агентами, следует учитывать множество факторов, например, химические и физические свойства активных агентов и вспомогательных агентов, биодоступность активных агентов, способ изготовления композиции, стабильность композиции и т.п. Ни один из упомянутых выше патентов или других патентов или публикаций, о которых известно заявителям, не описывает твердую композицию для перорального введения, включающую энтакапон, леводопу и карбидопу или их фармацевтически приемлемую соль или гидрат. Краткое описание существа изобретения Заявители установили, что энтакапон, леводопу и карбидопу или их фармацевтически приемлемые соли или гидраты можно комбинировать в единую твердую композицию для перорального введения, обладающую особенно интересными свойствами. Настоящее изобретение, таким образом,относится к твердой композиции с фиксированной дозой для перорального введения, включающей фармакологически эффективные количества энтакапона, леводопы и карбидопы или их фармацевтически приемлемых солей или гидратов, и включающей по меньшей мере один фармацевтически приемлемый наполнитель(далее упоминается как композиция по настоящему изобретению), которая обладает предпочтительными свойствами стабильности и биодоступности и которую легко проглотить. В частности, настоящее изобретение относится к твердой композиции для перорального введения, включающей фармакологически эффективные количества энтакапона, леводопы и карбидопы или их фармацевтически приемлемых солей или гидратов, и включающей по меньшей мере один фармацевтически приемлемый наполнитель, представляющий собой сахарный спирт, крахмал или сахарный спирт и крахмал. Предпочтительно, сахарный спирт представляет собой маннит, а крахмал представляет собой кукурузный крахмал. Настоящее изобретение относится также к стабильной твердой композиции для перорального введения, включающей фармакологически эффективные количества энтакапона, леводопы и карбидопы или их фармацевтически приемлемых солей или гидратов, и включающей по меньшей мере один фармацевтически приемле 3 мый наполнитель, не являющийся микрокристаллической целлюлозой. Заявители установили, что особенно интересным способом повышения биодоступности карбидопы из твердой композиции для перорального введения, включающей энтакапон,леводопу и карбидопу, является добавление карбидопы в отдельности, например, сначала гранулированием леводопы и энтакапона вместе, а затем отдельным добавлением карбидопы к полученным гранулам. Соответственно, настоящее изобретение относится также к твердой композиции для перорального введения, включающей фармакологически эффективные количества энтакапона,леводопы и карбидопы или их фармацевтически приемлемых солей или гидратов, и фармацевтически приемлемый наполнитель, в которой основная часть карбидопы отделена от энтакапона и/или леводопы. Существует несколько различных методик для отделения карбидопы от энтакапона и леводопы, например, смешиванием, например, гранулированием, энтакапона и леводопы вместе, и отдельным добавлением карбидопы. Карбидопу можно добавлять как таковую или в форме гранул. Таким образом, настоящее изобретение относится также к способу изготовления твердой композиции для перорального введения, включающей фармакологически эффективные количества энтакапона, леводопы и карбидопы или их фармацевтически приемлемой соли или гидрата, и фармацевтически приемлемый наполнитель, который включает сначала смешивание отдельно энтакапона и леводопы, а затем - отдельное добавление карбидопы. Твердая композиция для перорального введения по настоящему изобретению включает таблетку, капсулу и т.п. Предпочтительно, твердая композиция для перорального введения по настоящему изобретению имеет форму таблетки. Помимо этого, настоящее изобретение относится к способу лечения болезни Паркинсона,например, в конце периода времени, когда доза перестает действовать, введением пациенту,который в этом нуждается, твердой композиции для перорального введения по настоящему изобретению, например, до 8-10 раз в день. Настоящее изобретение относится также к применению энтакапона, леводопы и карбидопы или их фармацевтически приемлемых соли или гидрата, для производства твердой композиции для перорального введения для лечения болезни Паркинсона на различных стадиях указанной болезни. Дополнительные аспекты и преимущества настоящего изобретения далее будут частично перечислены в следующем описании и частично будут понятны из описания или могут быть поняты при практическом осуществлении настоя 004503 4 щего изобретения. Цели и преимущества настоящего изобретения будут поняты и достигнуты посредством элементов и комбинаций,особо указанных в прилагаемой формуле изобретения. Следует понимать, что как приведенное выше общее описание, так и следующее подробное описание служат только целям иллюстрации и пояснения и не ограничивают настоящее изобретение, в том виде, в котором оно заявлено. Краткое описание чертежей Фиг. 1 показывает концентрации энтакапона в плазме крови после однократной пероральной дозы композиции 1, композиции 2 и стандарта, который представлял компактную таблетку энтакапона 200 мг, COMTESS, вместе с таблеткой SINEMET PLUS 100/25. Фиг. 2 показывает концентрации леводопы в плазме крови после однократной пероральной дозы композиции 1, композиции 2 и стандарта,который представлял собой компактную таблетку энтакапона 200 мг, COMTESS, и таблетку SINEMET PLUS 100/25. Фиг. 3 показывает концентрации карбидопы в плазме крови после однократной пероральной дозы композиции 1, композиции 2 и стандарта, который представлял компактную таблетку энтакапона 200 мг, COMTESS, и таблетку SINEMET PLUS 100/25. Фиг. 4 показывает концентрации энтакапона в плазме крови после однократной пероральной дозы композиции 3, композиции 4 и стандарта, который представлял компактную таблетку энтакапона 200 мг, COMTESS, и таблетку SINEMET PLUS 100/25. Фиг. 5 показывает концентрации леводопы в плазме крови после однократной пероральной дозы композиции 3, композиции 4 и стандарта,который представлял компактную таблетку энтакапона 200 мг, COMTESS, и таблетку SINEMET PLUS 100/25. Фиг. 6 показывает концентрации карбидопы в плазме крови после однократной пероральной дозы композиции 3, композиции 4 и стандарта, который представлял компактную таблетку энтакапона 200 мг, COMTESS, вместе с таблеткой SINEMET PLUS 100/25. Подробное описание изобретения Заявители неожиданно обнаружили, что твердую композицию для перорального введения, способную обеспечить достаточное всасывание активных агентов, можно получить путем объединения энтакапона, леводопы и карбидопы или их фармацевтически приемлемой соли или гидрата, в единую композицию. Это достигалось, inter alia, улучшением биодоступности и стабильности композиции, а также улучшением способа изготовления композиции. Заявители установили, что всасывание леводопы, карбидопы и энтакапона из пищеварительного тракта широко варьирует. Биодоступ 5 ность леводопы и карбидопы варьирует как у одного индивидуума, так и у индивидуумов между собой. Биодоступность энтакапона также широко изучалась заявителем для создания настоящего изобретения. Весьма интересной является проблема гармонизации всасывания трех активных агентов из одной и той же твердой композиции для перорального введения. Заявители установили,что способ изготовления композиции оказывает значительное влияние на биодоступность карбидопы. Например, биодоступность карбидопы из композиции 1 (см. пример 1, табл. 1), в которой все активные ингредиенты смешивали влажным гранулированием, слишком мала по сравнению со стандартным продуктом, таблеткой SINEMET PLUS 100/25 мг. С другой стороны, биодоступность карбидопы из композиции 2 (см. пример 1, табл. 1), в которой все активные ингредиенты смешивали сухим гранулированием (уплотнительное гранулирование),являлась приемлемой. Однако, полиэтиленгликоль, использованный в композиции 2 в качестве вспомогательного агента для прессования,как оказалось, создает проблемы со стабильностью, как указано ниже. Данные по всасыванию из исследований биодоступности композиции 1 и 2 показаны на фиг. 1-3. Заявители установили, что предпочтительным путем повышения биодоступности карбидопы из твердой композиции для перорального введения, включающей энтакапон, леводопу и карбидопу, является смешивание, например,гранулирование, леводопы и энтакапона вместе,а затем добавление карбидопы к этой смеси,например, гранулам, отдельно. Настоящее изобретение, таким образом,относится к твердой композиции энтакапона,леводопы и карбидопы или их фармацевтически приемлемых солей или гидратов и фармацевтически приемлемого наполнителя, для перорального введения, в которой основная часть карбидопы отделена от энтакапона и леводопы. Композицию по настоящему изобретению,в которой "основная часть карбидопы отделена от энтакапона и леводопы", можно предпочтительно получать смешиванием, например, гранулированием, частиц энтакапона и леводопы отдельно и добавлением частиц карбидопы отдельно, как таковой или в форме гранул, необязательно, с добавлением одного или более наполнителей, и изготовлением из полученной таким способом смеси твердой композиции для перорального введения, например таблетки, по настоящему изобретению. Соответственно, настоящее изобретение относится также к способу изготовления твердой композиции для перорального введения,при котором карбидопу или ее фармацевтически приемлемую соль или гидрат добавляют в композицию отдельно, например, энтакапон и леводопу вместе с наполнителем (наполнителями) 6 сначала смешивают отдельно, а затем к полученной смеси отдельно добавляют карбидопу, и из смеси изготавливают, необязательно, вместе с наполнителем (наполнителями), различные лекарственные формы. Энтакапон и леводопу предпочтительно сначала гранулируют, или по отдельности или вместе. Карбидопу можно отделять от энтакапона и леводопы использованием отдельных гранул или добавлением карбидопы экстрагранулярно как таковой (в форме порошка) к смеси, предназначенной для дальнейшего изготовления, например, к таблеточной массе, предназначенной для прессования. Можно использовать как влажное гранулирование, так и сухое гранулирование, но предпочтительным способом гранулирования является влажное гранулирование. Подходящие способы гранулирования известны специалистам. Влажное гранулирование предпочтительно осуществляют с использованием, например, повидона. Повидон добавляют как таковой или в форме его водной коллоидной дисперсии. Примеры указанных видов композиций по настоящему изобретению описаны в примере 2. Изучалось всасывание энтакапона, леводопы и карбидопы из композиций 3 и 4. Результаты,представленные на фиг. 4-6, показывают, что всасывание изученных композиций было сравнимо с коммерческими стандартными композициями. Что касается совместимости ингредиентов композиций по настоящему изобретению, заявители установили, что энтакапон, леводопа и карбидопа как таковые совместимы друг с другом, например, как определено с помощью различных физико-химических методик, например ВЭЖХ или микрокалориметрического анализа. Однако было установлено также, что многие широко используемые наполнители не подходят для использования в твердых композициях для перорального введения, содержащих энтакапон, леводопу и карбидопу. Большинство композиций леводопа/карбидопа, имеющихся в продаже, содержит в качестве носителя микрокристаллическую целлюлозу. Также, композиции энтакапона COMTESS и COMTAN, которые появились в продаже в Европе недавно,содержат значительные количества микрокристаллической целлюлозы. Ранее микрокристаллическая целлюлоза представлялась приемлемым наполнителем. При использовании в композициях по настоящему изобретению, как неожиданно установили заявители, микрокристаллическая целлюлоза дестабилизирует композиции при длительном хранении, когда все три активных агента объединены вместе. Соответственно, настоящее изобретение относится к стабильной твердой композиции для перорального введения, включающей фармакологически эффективные количества энтакапона, леводопы и карбидопы или их фарма 7 цевтически приемлемых солей или гидратов, и включающей по меньшей мере один фармацевтически приемлемый наполнитель, не являющийся микрокристаллической целлюлозой. Помимо этого, использование полиэтиленгликоля в качестве наполнителя приводило к получению таблеток, которые оказались нестабильными при стандартном испытании на стабильность (см. композицию 2 в примере 1). Заявители полагают, что причиной проблем со стабильностью является поверхностная активность полиэтиленгликоля, которая может усиливать разложение активных веществ. Другие поверхностно-активные вещества, например, полисорбат и лаурилсульфат натрия, также, как было установлено, являются несовместимыми с комбинацией с фиксированной дозой, например,как показано в ходе стандартных испытаний на стабильность. Физико-химические испытания,упомянутые выше, также показали несовместимость лекарственной комбинации с коллоидным оксидом кремния, кополивидоном и ранее упомянутыми веществами, обладающими поверхностно-активными свойствами, т.е. полиэтиленгликолем, полисорбатом и лаурилсульфатом натрия. Соответственно, в предпочтительном варианте осуществления, настоящее изобретение относится к стабильной твердой композиции для перорального введения, включающей фармакологически эффективные количества энтакапона, леводопы и карбидопы или их фармацевтически приемлемой соли или гидрата и по меньшей мере один фармацевтически приемлемый наполнитель, не являющийся микрокристаллической целлюлозой и/или поверхностноактивными агентами и/или диоксидом кремния. Несмотря на несколько обнаруженных видов несовместимости, твердая композиция для перорального введения по настоящему изобретению все же может, как неожиданно оказалось,изготавливаться с использованием нескольких совместимых наполнителей в отдельности или двух или более вместе. Совместимые наполнители включают, например, сахарные спирты,предпочтительно, маннит, и крахмал, предпочтительно, кукурузный крахмал, а также другие подходящие наполнители, упомянутые в настоящем документе. Соответственно, настоящее изобретение относится к твердой композиции для перорального введения, включающей фармакологически эффективные количества энтакапона, леводопы и карбидопы или их фармацевтически приемлемой соли или гидрата и включающей по меньшей мере один фармацевтически приемлемый наполнитель, представляющий собой сахарный спирт, крахмал или сахарный спирт и крахмал. Количество сахарного спирта в композиции предпочтительно составляет приблизительно до 50 мас.%, более предпочтительно приблизительно от 5 до, например, приблизительно 40 8 мас.%, особенно, приблизительно от 7 до 25 мас.%. Количество крахмала в композиции предпочтительно составляет приблизительно до 50 мас.%, более предпочтительно, приблизительно от 2% до, например, приблизительно 35 мас.%, особенно, приблизительно от 5 до 25 мас.%. Твердая композиция для перорального введения по настоящему изобретению может дополнительно включать гидрогенизированное растительное масло предпочтительно гидрогенизированное касторовое масло, например, в виде интрагранулярного наполнителя. В этом случае предпочтительно количество гидрогенизированного растительного масла в композиции составляет приблизительно до 30 мас.%, и, например, по меньшей мере 5 мас.%, более предпочтительно, приблизительно до 20 мас.%, особенно, приблизительно до 15 мас.%. Композиция по настоящему изобретению предпочтительно содержит подходящий разрыхлитель, такой как гликолят натрийкрахмала, например, ММ (молекулярной массой) 500000-1000000 дальтон, например, типа А(например, Primogel от компании Avebe В.А.) или натрий-кроскармеллоза (например, Ac-DiSol от компании FMC Corporation). Предпочтительно, количество разрыхлителя, когда он присутствует в композиции, составляет приблизительно до 10 мас.%, например, приблизительно от 0,5 до, например, приблизительно 6 мас.%,например, приблизительно от 2 до 6 мас.%. Композиция может также содержать, кроме прочего, подходящий обычный связывающий агент и/или смазывающий агент в количествах, известных специалистам. Примеры подходящих смазывающих агентов, пригодных для настоящей композиции, включают, например,стеарат магния, стеарат кальция, гидрогенизированное растительное масло, тальк и т.п. Количество энтакапона, леводопы и карбидопы или их фармацевтически приемлемых солей или гидратов в композиции для перорального введения зависит от многочисленных факторов, известных специалистам, таких как тяжесть состояния пациента, желаемая продолжительность использования и т.п. Твердая композиция для перорального введения может также содержать один или более других фармакологически активных агентов. Количество энтакапона в композиции по настоящему изобретению составляет предпочтительно от 25 до 400 мг, например, от 25 до 300 мг, особенно, от 50 до 200 мг, количество леводопы составляет предпочтительно от 25 до 300 мг, особенно, от 50 до 250 мг, а количество карбидопы составляет предпочтительно от 5 до 75 мг, особенно, от 10 до 50 мг. Заявители установили, что следующий вариант осуществления настоящего изобретения является особенно предпочтительным, например, для значительного числа пациентов, вклю 9 чая пациентов с ранней и поздней стадией болезни Паркинсона:a) 200 мг энтакапона, 100 мг леводопы и 25 мг карбидопы. Другие предпочтительные варианты осуществления включаютe) 200 мг энтакапона, 250 мг леводопы и 25 мг карбидопы. В качестве еще одной особенности, настоящее изобретение относится к твердой композиции с фиксированной дозой для перорального введения, включающей фармакологически эффективные количества энтакапона, леводопы и карбидопы или их фармацевтически приемлемой соли или гидрата и включающей по меньшей мере один фармацевтически приемлемый наполнитель; причем терапевтический эффект,достигаемый с помощью указанной композиции при лечении болезни Паркинсона, является сравнимым, например, сходным, с эффектом,который достигается при использовании известных отдельных композиций энтакапона,леводопы и карбидопы, например, таблеток энтакапон и таблеток леводопа/карбидопа, упомянутых в настоящем документе, которые вводят совместно, в тех же дозах активных агентов, что и в комбинированной композиции по настоящему изобретению. В одном варианте осуществления указанной комбинированной композиции по настоящему изобретению указанная композиция является фармакокинетически сравнимой с известными композициями, например композициями энтакапона и леводопа-карбидопа, используемыми в настоящем документе в качестве ссылки, вводимыми совместно в тех же дозах активных агентов, что и в указанной композиции по настоящему изобретению. В еще одном варианте осуществления, указанная композиция по настоящему изобретению является практически биоэквивалентной известным композициям,например биодоступность, достигаемая композицией по настоящему изобретению находится на уровнях, сравнимых с теми, которые достигаются совместным введением тех же доз известных отдельных композиций энтакапона,леводопы и карбидопы, например, композиций энтакапона и леводопа-карбидопа, используемыми в настоящем документе в качестве ссылкиa) терапевтический эффект, такой как фармакокинетика, например биодоступность,достигаемая комбинированной композицией по настоящему изобретению с дозой 200 мг энтакапона/100 мг леводопы/25 мг карбидопы, явля 004503 10 ется сравнимым с эффектом известной композиции энтакапона и известной композиции леводопа-карбидопа, вводимых совместно в тех же дозах активных агентов, что и в настоящей комбинированной композиции;b) терапевтический эффект, такой как фармакокинетика, например биодоступность,достигаемая комбинированной композицией по настоящему изобретению с дозой 200 мг энтакапона/50 мг леводопы/12,5 мг карбидопы, является сравнимым с эффектом известной композиции энтакапона и известной композиции леводопа-карбидопа, вводимых совместно в тех же дозах активных агентов, что и в настоящей комбинированной композиции;c) терапевтический эффект, такой как фармакокинетика, например биодоступность,достигаемая комбинированной композицией по настоящему изобретению с дозой 200 мг энтакапона/150 мг леводопы/37,5 мг карбидопы,является сравнимым с эффектом известной композиции энтакапона и известной композиции леводопа-карбидопа, вводимых совместно в тех же дозах активных агентов, что и в настоящей комбинированной композиции;d) терапевтический эффект, такой как фармакокинетика, например биодоступность,достигаемая комбинированной композицией по настоящему изобретению с дозой 200 мг энтакапона/100 мг леводопы/10 мг карбидопы, является сравнимым с эффектом известной композиции энтакапона и известной композиции леводопа-карбидопа, вводимых совместно в тех же дозах активных агентов, что и в настоящей комбинированной композиции;e) терапевтический эффект, такой как фармакокинетика, например биодоступность,достигаемая комбинированной композицией по настоящему изобретению с дозой 200 мг энтакапона/250 мг леводопы/25 мг карбидопы, является сравнимым с эффектом известной композиции энтакапона и известной композиции леводопа-карбидопа, вводимых совместно в тех же дозах активных агентов, что и в настоящей комбинированной композиции. Энтакапон в отдельности продается в форме таблетки, при изготовлении которой применялся способ уплотнительного гранулирования, т.е. COMTESS и COMTAN. При использовании способа уплотнительного гранулирования необходимы большие количества наполнителей, чтобы получить пригодные для прессования гранул и таблеток, обладающих желательными быстрыми свойствами растворения композиции с немедленным высвобождением. Способность к уплотнению энтакапона достаточна для изготовления 200 мг таблетки, которую все же относительно легко проглотить. Заявители неожиданно установили, что способность к уплотнению комбинированных таблеток с фиксированной дозой хуже, чем у энтакапона в отдельности. Использование полиэтиленгли 11 коля как агента, облегчающего прессование,улучшает способность к уплотнению, но, с другой стороны, как упоминалось выше, использование указанного поверхностно-активного агента, как было установлено, приводит к получению таблеток, нестабильных при хранении. Также размер комбинированной таблетки с фиксированной дозой, включающей энтакапон,леводопу и карбидопу, изготовленной уплотнительным гранулированием, может оказаться слишком большим, особенно, для пациентов с паркинсонизмом, которые испытывают трудности при глотании. Таким образом, настоящее изобретение относится к способу изготовления твердой композиции для перорального введения по настоящему изобретению, который включает а) смешивание фармакологически эффективных количеств энтакапона и леводопы или их фармацевтически приемлемой соли или гидрата по меньшей мере с одним фармацевтически приемлемым наполнителем и, необязательно, разрыхлителем, с получением первой смеси; b) гранулирование первой смеси с получением первой серии гранул; с) смешивание фармакологически эффективного количества карбидопы или ее фармацевтически приемлемой соли или гидрата по меньшей мере с одним фармацевтически приемлемым наполнителем и, необязательно,разрыхлителем, с получением второй смеси; d) гранулирование второй смеси с получением второй серии гранул; е) смешивание первой серии гранул, второй серии гранул, необязательно, смазывающего агента и, необязательно одного или более фармацевтически приемлемых наполнителей с получением третьей смеси; f) изготовление из третьей смеси множества лекарственных форм, например прессование третьей смеси в множество таблеток и, необязательно, нанесение на таблетки покрытия. Твердую композицию для перорального введения по настоящему изобретению можно также изготовить следующим образом: а) смешиванием фармакологически эффективных количеств энтакапона и леводопы или их фармацевтически приемлемой соли или гидрата по меньшей мере с одним фармацевтически приемлемым наполнителем и, необязательно, разрыхлителем, с получением первой смеси; b) гранулированием первой смеси с получением множества гранул; с) добавлением фармакологически эффективного количества карбидопы или ее фармацевтически приемлемой соли или гидрата, необязательно, смазывающего агента и,необязательно, одного или более фармацевтически приемлемых наполнителей, к гранулам, с получением второй смеси; d) изготовлением из второй смеси множества лекарственных форм,например, прессованием второй смеси в множество таблеток и, необязательно, нанесением на таблетки покрытия. 12 Этап смешивания перед гранулированием можно осуществлять, например, в барабанном смесителе или в псевдоожиженном слое, но предпочтительно в быстроходной мешалке способом, известным специалистам. В случае, если для изготовления гранул используется влажное гранулирование, полученные гранулы сушат,если это необходимо, перед следующим этапом. Гранулы можно сушить, например, в текущем слое. Таблетки предпочтительно покрывают,например, оболочкой из ГПМЦ. Предпочтительно оболочка содержит цветные пигменты,например оксид железа. С помощью способа по настоящему изобретению можно изготовить таблетки, которые достаточно малы для содержащихся в них дозировок и удобны для введения. Они могут иметь самые разнообразные формы, хотя предпочтительной является овальная форма. Указанный малый размер является особенно удивительным,если принимать во внимание размер имеющихся в продаже таблеток энтакапона COMTAN/COMTESS и если принимать во внимание тот факт, что энтакапон трудно прессуется,и все же обеспечивает приемлемое высвобождение, особенно в присутствии леводопы и карбидопы. Помимо этого, заявители неожиданно установили, что композиция по настоящему изобретению обладает особенно хорошей текучестью. В качестве еще одной особенности, настоящее изобретение относится к фармацевтической таблетке для перорального введения,включающей 200 мг энтакапона, 50-150 мг леводопы и 10-37,5 мг карбидопы и имеющей предпочтительно главным образом, следующие характеристики: вес 400-750 мг, например, 550-590 мг,размеры объема для овальной таблетки предпочтительно от 200 до 1000 мм 3, например от 250 до 800 мм 3, такие как от 300 до 600 мм 3,например от 300 до 550 мм 3. В качестве еще одного аспекта, настоящее изобретение относится к фармацевтической таблетке для перорального введения, включающей 200 мг энтакапона, 50-150 мг леводопы и 10-37,5 мг карбидопы и имеющей, главным образом, следующие характеристики: вес 400-750 мг, например, 550-590 мг,размеры для определения объема овальной таблетки предпочтительно длина 13-18 мм, например, 14-18 мм,ширина 6-9 мм,высота 4-7 мм, на 5-6 мм. Форма таблетки по настоящему изобретению, разумеется, не ограничивается овальной формой, и форма может изменяться, например,в указанных пределах размеров объема. Поскольку подробности фармацевтических наполнителей в настоящем документе конкретно не описаны, их описание дополнительно приводится в руководствах по фармацевтиче 13 ским носителям, известным специалистам, например, в Handbook of Pharmaceutical Excipients,2nd Edition, Ed. A. H. Kibbe, American Pharmaceutical Association, 1994, и, i.a., в брошюрах производителей, содержание которых включено в настоящий документ в качестве ссылки. Настоящее изобретение далее поясняется с помощью следующих неограничивающих примеров. Наполнители, которые использовались в композициях примеров, имеются в продаже: например, натрий-кроскармеллоза сорта Ac-DiSol (от компании FMC Corporation), гликолят натрий-крахмала сорта Primogel (от компанииAvebe В.А), повидон сорта Kollidon К 30 (от компании Basf AG) и коллоидный диоксид кремния сорта Aerosil 220 (от компании DegussaAG). Кукурузный крахмал получали от компании Cerestar Scandinavia, а маннит - от компанииRoquette Freres. Пример 1. Всасывание энтакапона, леводопы и карбидопы из таблеточных композиций энтакапон/леводопа/карбидопа 200/100/25 мг, содержащих различные наполнители и изготовленные различными способами, изучали после однократной пероральной дозы на 15 здоровых добровольцах. Таблетки изготавливали влажным гранулированием всех активных агентов в одно и то же время (композиция 1) или уплотнительным гранулированием всех активных агентов одновременно (композиция 2). Композиции описаны в табл. 1. Изучение всасывания было предпринято для оценки всасывания активных веществ при сравнении двух комбинированных таблеток,таблетки с фиксированной дозой и таблетки энтакапона 200 мг, введенной вместе с таблеткой леводопа/карбидопа 100/25 мг, т.е., SINEMET PLUS (дистрибьютор в Европе DuPontPharmaceuticals Ltd.). Исследование выполняли в соответствии с открытой рандомизированной перекрестной схемой. Концентрации энтакапона, леводопы и карбидопы в плазме крови определяли двумя отдельными способами ВЭЖХ с обращенной фазой, т.е. концентрации энтакапона определяли одним способом, а концентрации леводопы и карбидопы - другим способом. Результаты представлены на фиг. 1-3. Таблица 1 Композиции таблеток энтакапон/ леводопа/карбидопа 200/100/25 мг в первом предварительном исследовании всасывания Ядро таблетки Энтакапон Леводопа Карбидопа моногидр.Macrogol. 6000 Кукурузный крахмал Гликолят натрийкрахмала Натрийкроскармеллоза Повидон Микрокристаллическая целлюлоза Коллоидный диоксид кремния Стеарат магния Теоретический вес ядра таблетки Покрытие Покрытие ГПМЦ, Покрытие ГПМЦ,содержащее содержащее цветные пигменты цветные пигменты Теоретич. вес ядра таблетки в оболочке Все активные вещества вместе гранулированы с помощью быстроходной мешалки Все активные вещества вместе гранулированы уплотнением Пример 2. Примеры подходящих таблеточных композиций энтакапон/леводопа/карбидопа 200/100/25 мг описаны в табл. 2. Таблетки изготавливали добавлением в композицию карбидопы отдельно в форме гранул (композиция 3) и как таковой, в форме порошка (композиция 4). Соответственно, для изготовления композиции 3, энтакапон и леводопу гранулировали вместе влажным способом с кукурузным крахмалом, маннитом, натрий-кроскармеллозой и повидоном в обычной быстроходной мешалке. Карбидопу гранулировали отдельно влажным способом с кукурузным крахмалом, маннитом, натрийкроскармеллозой и повидоном в быстроходной мешалке. Сухие гранулы энтакапон/леводопа,сухие гранулы карбидопы, натрий-кроскармеллозу, маннит и стеарат магния смешивали вместе и полученную массу прессовали в таблетки овальной формы и покрывали ГПМЦпокрытием с цветным пигментом. Композицию 4 изготавливали аналогичным композиции 3 способом, за исключением того, что карбидопу добавляли как таковую, в форме порошка. Всасывание композиций 3 и 4 изучали на 15 здоровых добровольцах после однократной пероральной дозы. Стандартом служила таблетка энтакапона 200 мг, COMTESS, вводимая вместе с таблеткой леводопа/карбидопа 100/25 мг, SINEMET PLUS (дистрибьютор в Соединенном Королевстве компания DuPont Pharmaceuticals Ltd.). Исследование выполняли в соответствии с открытой рандомизированной перекрестной схемой. Концентрации энтакапона,леводопы и карбидопы в плазме крови определяли двумя отдельными способами ВЭЖХ с обращенной фазой, т.е., концентрации энтакапона определяли одним способом, а концентрации леводопы и карбидопы - другим способом. Согласно результатам, показанным на фиг. 4-6, всасывание двух изученных композиций сравнимо с имеющимися в продаже стандарт 15 ными композициями. Растворенные количества энтакапона, леводопы и карбидопы составляют по меньшей мере 50% за 30 мин, по измерению на оборудовании для определения растворения согласно USP. Таблица 2 Композиции таблеток энтакапон/ леводопа/карбидопа 200/100/25 мг(в композициях карбидопа отдельно) Энтакапон Леводопа Карбидопа моногидрат Кукурузный крахмал Маннит Натрийкроскармеллоза Повидон Стеарат магния Теоретич. вес ядра таблетки Покрытие ГПМЦ,содержащее цветные пигменты Теоретич. вес ядра таблетки в оболочке Гранулы энтакапон/ леводопа и гранулы карбидопы были изготовлены отдельно с помощью быстроходной мешалки. Гранулы энтакапон/ леводопа были изготовлены отдельно с помощью быстроходной мешалки. Карбидопу добавляли к гранулам как таковую вместе с таблетирующими наполнителями. Овальные таблетки, прессованные из таблеточных смесей, имели следующие размеры: композиция 3 (длина 16,4 мм; ширина 7,7 мм и высота 5,7 мм) и композиция 4 (длина 16,4 мм; ширина 7,7 мм и высота 5,1 мм) Пример 3. Следующие композиции 5 и 6, представленные в табл. 3, были изготовлены в соответствии с процедурой, описанной для композиции 3, но с использованием энтакапона/леводопы/ карбидопы в количествах 200 мг/50 мг/12,5 мг(композиция 5) и, соответственно, 200 мг/150 мг/37,5 мг (композиция 6). Соответственно, таким же образом можно изготовить композицию энтакапон/леводопа/карби-допа в количествах 200 мг/100 мг/10 мг. Таблица 3 Наименование Композиция 5, Композиция 6,ингредиента мг мг Энтакапон 200,0 200,0 Леводопа 150,0 50,0 Карбидопа моногидрат 40,5 13,5 Кукурузный крахмал 105,0 65,0 Маннит 113,0 59,5 Натрий-кроскармеллоза 28,5 17,7 Повилон 46,6 31,9 Стеарат магния 10,5 6,5 Вес ядра 694 444 16 Ядра таблеток покрывали цветным покрытием ГПМЦ с увеличением веса на 2-3%. Специалистам будет понятно, что, в то время как проиллюстрированы и описаны конкретные варианты осуществления настоящего изобретения, могут быть осуществлены различные модификации и изменения без отступления от идеи и объема настоящего изобретения. Другие варианты осуществления настоящего изобретения будут ясны для специалиста с учетом описания и практического осуществления настоящего изобретения, описанного в настоящем документе. Описание и примеры предназначены только для примера, при этом объем и идея настоящего изобретения обозначены следующей формулой изобретения. Обсуждавшиеся источники включены в настоящий документ в качестве ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Твердая композиция для перорального введения, включающая фармакологически эффективные количества энтакапона, леводопы и карбидопы или их фармацевтически приемлемых солей или гидратов и фармацевтически приемлемый наполнитель, в которой основная часть карбидопы отделена от энтакапона и леводопы. 2. Композиция по п.1, в которой энтакапон и леводопа находятся в форме гранул, а карбидопа находится в форме порошка. 3. Композиция по п.1, в которой энтакапон и леводопа находятся в форме первых гранул, а карбидопа находится в форме вторых гранул. 4. Твердая композиция для перорального введения, включающая фармакологически эффективные количества энтакапона, леводопы и карбидопы или их фармацевтически приемлемых солей или гидратов и включающая по меньшей мере один фармацевтически приемлемый наполнитель, представляющий собой сахарный спирт, или крахмал, или сахарный спирт и крахмал. 5. Композиция по п.4, в которой сахарный спирт представляет собой маннит. 6. Композиция по п.4, в которой крахмал представляет собой кукурузный крахмал. 7. Композиция по п.4, которая дополнительно включает гидрогенизированное растительное масло. 8. Композиция по п.7, в которой гидрогенизированное растительное масло представляет собой гидрогенизированное касторовое масло. 9. Композиция по п.4, которая дополнительно включает разрыхлитель. 10. Композиция по п.9, в которой разрыхлитель представляет собой натрийкроскармеллозу. 11. Стабильная твердая композиция для перорального введения, включающая фармакологически эффективные количества энтакапона, 17 леводопы и карбидопы или их фармацевтически приемлемых солей или гидратов и включающая по меньшей мере один фармацевтически приемлемый наполнитель, не являющийся микрокристаллической целлюлозой. 12. Способ изготовления твердой композиции для перорального введения, включающей энтакапон, леводопу и карбидопу или их фармацевтически приемлемые соли или гидраты,который включает сначала смешивание энтакапона и леводопы отдельно, добавление отдельно карбидопы и изготовление из смеси множества лекарственных форм. 13. Способ по п.12, в котором карбидопу добавляют в форме порошка экстрагранулярно к гранулам энтакапона и леводопы. 14. Способ по п.12, в котором карбидопу добавляют в форме гранул к партии гранул энтакапона и леводопы. 15. Способ по п.12, который включает а) смешивание фармакологически эффективных количеств энтакапона и леводопы или их фармацевтически приемлемой соли или гидрата по меньшей мере с одним фармацевтически приемлемым наполнителем и разрыхлителем с получением первой смеси;b) гранулирование первой смеси с получением первой партии гранул;c) смешивание фармацевтически эффективного количества карбидопы или ее фармацевтически приемлемой соли или гидрата по меньшей мере с одним фармацевтически приемлемым наполнителем и разрыхлителем с получением второй смеси;d) гранулирование второй смеси с получением второй партии гранул;e) смешивание первой партии гранул, второй партии гранул, необязательно, смазывающего агента и, необязательно, одного или более фармацевтически приемлемых наполнителей с получением третьей смеси иf) изготовление из третьей смеси множества лекарственных форм. 16. Способ по п.12, который включаетa) смешивание фармакологически эффективных количеств энтакапона и леводопы или их фармацевтически приемлемой соли или гидрата по меньшей мере с одним фармацевтически приемлемым наполнителем и разрыхлителем с получением первой смеси;b) гранулирование первой смеси с получением партии гранул;c) добавление фармакологически эффективного количества карбидопы или ее фармацевтически приемлемой соли или гидрата, необязательно, смазывающего агента и, необязательно, одного или более фармацевтически приемлемых наполнителей к партии гранул с получением второй смеси;d) изготовление из второй смеси множества лекарственных форм. 17. Способ по п.15 или 16, в котором способом гранулирования является влажное гранулирование. 18. Фармацевтическая таблетка для перорального введения, включающая 200 мг энтакапона, 50-150 мг леводопы и 10-37,5 мг карбидопы и имеющая, по существу, следующие характеристики: вес 400-750 мг и объемный размер таблетки от 200 до 1000 мм 3. 19. Фармацевтическая таблетка для перорального введения, включающая 200 мг энтакапона, 50-150 мг леводопы и 10-37,5 мг карбидопы и имеющая, по существу, следующие характеристики: вес 400-750 мг и объемный размер таблетки: длину 13-18 мм; ширину 6-9 мм и высоту 4-7 мм. 20. Способ лечения субъекта, страдающего болезнью Паркинсона, который включает введение композиции по любому из пп.1-11 или 18,19 субъекту, нуждающемуся в указанном лечении.
МПК / Метки
МПК: A61K 31/198, A61P 25/16
Метки: фармацевтическая, композиция
Код ссылки
<a href="https://eas.patents.su/11-4503-farmacevticheskaya-kompoziciya-levodopa-karbidopa-entakapon.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтическая композиция леводопа/карбидопа/энтакапон</a>
Предыдущий патент: Фармацевтическая композиция антагониста рецептора серотонина и способ ее получения
Следующий патент: Устройство для электрического соединения двух электрических приборов и электрический прибор (варианты)
Случайный патент: Применение ингибиторов il-18