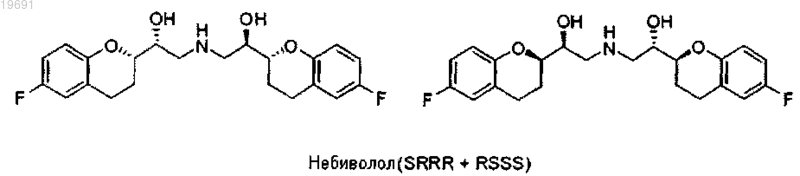
Способ получения небиволола
Номер патента: 19691
Опубликовано: 30.05.2014
Авторы: Бартоли Сандра, Фаттори Даниэла, Чиполлоне Амалия
Формула / Реферат
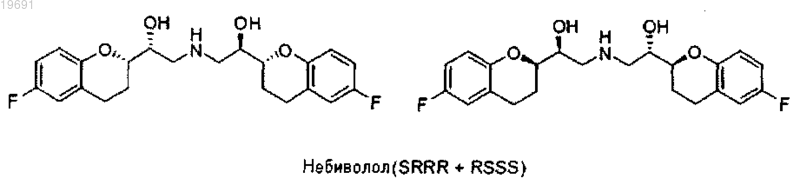
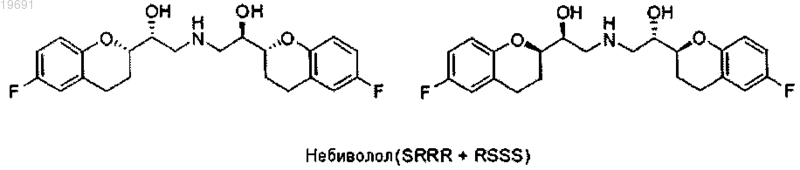
1. Способ получения Небиволола в форме рацемической смеси двух энантиомеров [2S[2R[R[R]]]] α,α'-[имино-бис-(метилен)] бис-[6-фтор-хроман-2-метанола] и [2R[2S[S[S]]]] α,α'-[имино-бис-(метилен)] бис-[6-фтор-хроман-2-метанола], имеющих следующие формулы:
содержащий следующие стадии, на которых:
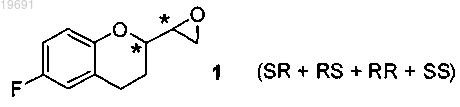
а) смесь четырех изомеров SR, RS, RR и SS эпоксида формулы 1
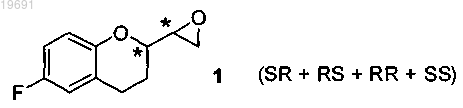
вводят в реакцию с амином R-NH2, где R представляет собой защитную группу, выбранную из метила, аллила, трет-бутила, бензила, дифенилметила, трифенилметила, флуоренила, 9,10-дигидроантрацен-9-ила, дибензила, где ароматические кольца, возможно, могут быть замещены одной или двумя группами, выбранными из галогена, нитро, С1-С4 алкильной цепи, CF3, CHF2, группы OR2, где R2 представляет собой водород, С1-С4 алкил, в растворителе, представленном стерически затрудненным спиртом, выбранным из iPrOH, втор-BuOH, трет-BuOH, изоамила, 2-метил-2-бутанола, 2-метил-2-пентанола, используемым отдельно или в смеси с неполярным растворителем, выбранным из группы петролейного эфира, пентана, гексана, циклогексана, метилциклогексана, гептана, бензола, толуола, с получением смеси четырех соединений 2-5, из которых пару 2/3 отделяют от пары 4/5
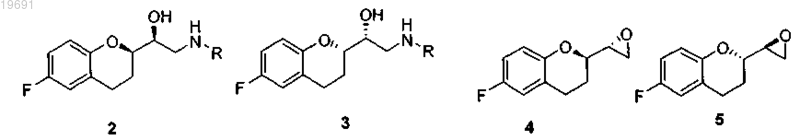
b) смесь аминов 2 и 3 вводят в реакцию с парой эпоксидов 4 и 5 в смеси, чтобы получить смесь четырех соединений 6-9
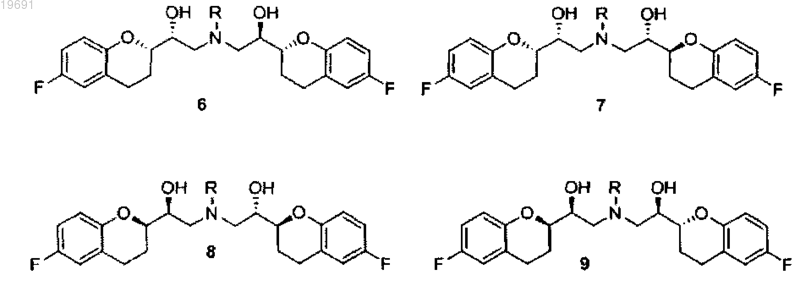
c) смесь соединений 6 и 8 (RSSS+SRRR) отделяют от 7 и 9 дробной кристаллизацией с помощью первого растворителя, выбранного из этанола, изопропанола, бутанола, трет-бутанола, 2-метил-2-бутанола, и затем с помощью смеси полярного апротонного растворителя, выбранного из метилацетата, этилацетата, изопропилацетата, ацетона, метилэтилкетона, ацетонитрила, изопропилового эфира, с неполярным растворителем, выбранным из пентана, гексана, циклогексана, метилциклогексана, гептана, бензола, толуола;
d) удаляют защитную группу R и необязательно затем получают гидрохлоридную соль с тем, чтобы получить конечный продукт Небиволол или Небиволол гидрохлорид.
2. Способ по п.1, в котором R представляет собой бензильную группу.
3. Способ по п.1, в котором амины 2 и 3 отделяют от эпоксидов 4 и 5 осаждением и фильтрацией.
4. Способ по п.1, в котором стерически затрудненный спирт, определенный в стадии а), выбирают из 2-метил-2-бутанола, трет-BuOH и 2-метил-2-пентанола.
5. Способ по п.1, в котором неполярный растворитель, определенный в стадии а), представляет собой циклогексан.
6. Способ по п.1, в котором растворители для дробной кристаллизации, определенные в стадии с), представляют собой 2-метил-2-бутанол и затем смесь этилацетат/циклогексан.
7. Способ получения Небиволола в форме рацемической смеси двух энантиомеров [2S[2R[R[R]]]] α,α'-[имино-бис-(метилен)] бис-[6-фтор-хроман-2-метанола] и [2R[2S[S[S]]]] α,α'-[имино-бис-(метилен)] бис-[6-фтор-хроман-2-метанола], имеющих следующие формулы:
содержащий стадии, на которых:
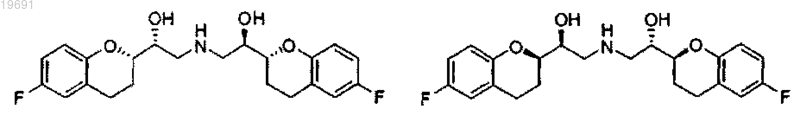
е) SR, RS, RR и SS смесь эпоксида 1 вводят в реакцию с аммиаком или с азидом с последующим восстановлением в случае азида до соответствующего первичного амина
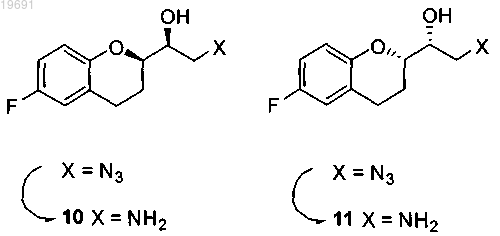
f) первичный амин отделяют от эпоксидов 4/5 экстракцией в подходящем растворителе или хроматографией;
g) проводят восстановительное аминирование с аминами 10/11 и альдегидом R1CHO, где R1 выбран из группы Н, винил, фенил, фенил, замещенный одной или двумя группами, выбранными из галогена, нитро, С1-С4 алкильной цепи, CF3, CHF2, OR2, где R2 представляет собой водород, С1-С4 алкил, чтобы получить смесь аминов 2/3;
а затем содержащий стадии b)-d) из п.1.
8. Способ по п.7, в котором R1 представляет собой фенильную группу.
9. Способ получения Небиволола в форме рацемической смеси двух энантиомеров [2S[2R[R[R]]]] α,α'-[имино-бис-(метилен)] бис-[6-фтор-хроман-2-метанола] и [2R[2S[S[S]]]] α,α'-[имино-бис-(метилен)] бис-[6-фтор-хроман-2-метанола], имеющих следующие формулы:

содержащий стадии, на которых
h) смесь SR, RS, RR и SS эпоксида 1 вводят в реакцию с гидроксиламином с последующим гидрированием связи N-O и получением аминов 10/11, а затем содержащий стадии f) и g) из п.7 с последующим осуществлением стадий b)-d) из п.1.
10. Способ получения Небиволола в форме рацемической смеси двух энантиомеров [2S[2R[R[R]]]] α,α'-[имино-бис-(метилен)] бис-[6-фтор-хроман-2-метанола] и [2R[2S[S[S]]]] α,α'-[имино-бис-(метилен)] бис-[6-фтор-хроман-2-метанола], имеющих следующие формулы:
содержащий стадию, на которой:
а) смесь четырех изомеров SR, RS, RR и SS эпоксида формулы 1
вводят в реакцию с амином R-NH2, где R представляет собой защитную группу, выбранную из метила, аллила, трет-бутила, бензила, дифенилметила, трифенилметила, флуоренила, 9,10-дигидроантрацен-9-ила, дибензила, где ароматические кольца, возможно, могут быть замещены одной или двумя группами, выбранными из галогена, нитро, С1-С4 алкильной цепи, CF3, CHF2, группы OR2, где R2 представляет собой водород, С1-С4 алкил, в растворителе, представленном стерически затрудненным спиртом, выбранным из iPrOH, втор-BuOH, трет-BuOH, изоамила, 2-метил-2-бутанола, 2-метил-2-пентанола, используемым отдельно или в смеси с неполярным растворителем, выбранным из группы петролейного эфира, пентана, гексана, циклогексана, метилциклогексана, гептана, бензола, толуола, с получением смеси четырех соединений 2-5, а затем проводят следующие стадии, на которых:
k) удаляют избыток непрореагировавшего амина RNH2;
i) добавляют спиртовой растворитель, выбранный из метанола или этанола, и затем соединения 2/3 оставляют взаимодействовать непосредственно с соединениями 4/5, как предусмотрено на стадии b) из п.1, с последующим осуществлением стадий с) и d) из п.1.
11. Способ получения Небиволола в форме рацемической смеси двух энантиомеров [2S[2R[R[R]]]] α,α'-[имино-бис-(метилен)] бис-[6-фтор-хроман-2-метанола] и [2R[2S[S[S]]]] α,α'-[имино-бис-(метилен)] бис-[6-фтор-хроман-2-метанола], имеющих следующие формулы:
содержащий стадии, на которых:
m) смесь четырех изомеров SR, RS, RR и SS эпоксида формулы 1
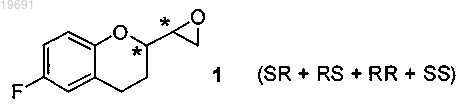
вводят в реакцию со вторичным амином типа RR3NH, где R представляет собой защитную группу, выбранную из метила, аллила, трет-бутила, бензила, дифенилметила, трифенилметила, флуоренила, 9,10-дигидроантрацен-9-ила, дибензила, где ароматические кольца, возможно, могут быть замещены одной или двумя группами, выбранными из галогена, нитро, С1-С4 алкильной цепи, CF3, CHF2, группы OR2, где R2 представляет собой водород, С1-С4 алкил и где R3 представляет собой бензильную группу, возможно замещенную одной или двумя группами, выбранными из галогена, нитро, С1-С4 алкильной цепи, CF3, CHF2, группы OR2, где R2 определен выше, в растворителе, представленном стерически затрудненным спиртом, выбранным из iPrOH, втор-BuOH, трет-BuOH, изоамила, 2-метил-2-бутанола, 2-метил-2-пентанола, используемым отдельно или в смеси с неполярным растворителем, выбранным из группы петролейного эфира, пентана, гексана, циклогексана, метилциклогексана, гептана, бензола, толуола, чтобы получить смесь четырех соединений 12, 13, 4 и 5, из которых пару 12/13 отделяют от пары 4/5
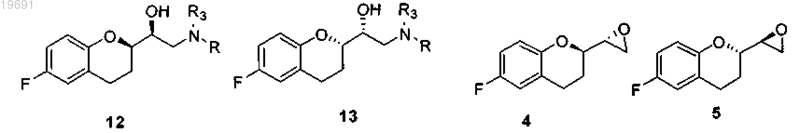
n) снимают защиту с группы R3, чтобы получить смесь соединений 2/3;
а затем содержащий стадии b)-d) из п.1.
12. Способ по п.11, в котором R3 представляет собой бензильную группу.
13. Способ по п.1, в котором снятие защиты, предусмотренное на стадии d), выполняют путем каталитического гидрирования с Pd(OH)2.
Текст
Изобретение относится к новому способу синтеза Небиволола, представленному на схеме (1),содержащему уменьшенное сокращенное число стадий, характеризующихся высокими выходами,и отличающемуся кинетическим разделением двух эпоксидных пар диастереоизомеров между собой (смесь 1), позволяющим избежать сложных хроматографических разделений.(71)(73) Заявитель и патентовладелец: МЕНАРИНИ ИНТЕРНЕШНЛ ОПЕРЕЙШНЗ ЛЮКСЕМБУРГ С.А. Область техники, к которой относится изобретение Настоящее изобретение относится к новому способу синтеза Небиволола. Небиволол представляет собой рацемическую смесь двух энантиомеров [2S[2R[R[R-,'[имино-бис-(метилен)] бис-[6-фтор-хроман-2-метанол] и [2R[2S[S[S-,'-[имино-бис-(метилен)] бис[6-фтор-хроман-2-метанол] (схема 2). В частности, сообщалось о кинетическом разделении двух диастереоизомерных пар RS/SR и SS/RR эпоксидов (схема 1, смесь 1) за счет обработки амином в подходящем растворителе. Схема 2 Уровень техники Небиволол известен в качестве антагониста адренергического бета-рецептора, антигипертензивного средства, ингибитора агрегации тромбоцитов и вазодилататора (сосудорасширяющего средства). Небиволол обладает основными свойствами и может быть превращен в фармацевтически приемлемую солевую форму путем обработки кислотой. На рынке он представлен в форме гидрохлоридной соли. Небиволол содержит четыре асимметричных центра, и, таким образом, теоретически возможно существование 16 его стереоизомеров. Однако из-за особой структуры молекулы (присутствие оси симметрии), только 10 стереоизомеров могут быть получены на самом деле (схема 3). Схема 3. Возможные стереоизомеры небиволола В действительности, симметрия молекулы приводит к тому, что RSSS=SSSR, RRSS=SSRR,SRSS=SSRS, RRSR=RSRR, SRSR=RSRS и RRRS=SRRR. Патент США 4654362 (ЕР 0145067, Janssen) описывает получение Небиволола с использованием изомеров эпоксида (схема 1, смесь 1: RS, SR, RR и SS) в качестве ключевых промежуточных соединений. Изомеры разделяют на хроматографической колонке на два эпоксидных рацемата (RS/SR) и (RR/SS). ЕР 334429 (Janssen) описывает тот же самый способ, что и описанный в ЕР 0145067, но с большим количеством экспериментальных подробностей. ЕР 0334449 описывает стереоселективный способ получения изомера [2R,S,2'S,'S]-,'-[имино-бис-(метилен)] бис-[6-фтор-3,4-дигидро-2 Н-1-бензопиран-2 метанол].WO 2006/016373 (Hetero Drags Limited) описывает методы дробной кристаллизации, применяемые к диастереоизомерной смеси бензилнебиволола в форме гидрохлоридной соли, но умалчивающий о раскрытии эпоксида или способах разделения (соединение 1).WO 2006/025070 (Torrent Pharmaceutical) также остается в рамках классического способа получения, описанного патентом США 4654362, и описывает только способ разделения диастереоизомерных пар на уровне бензилнебиволола в форме гидрохлоридной соли. В следующем WO 2007/083318 заявлено использование диизопропилового эфира для кристаллизации интермедиата бензилнебиволола в виде свободного основания.WO 2007/041805 (Egis Gygyszergyr) описывает способ получения [2S[R[R[R и[2R[S[S[S,'-[имино-бис-(метилен)] бис-[6-фтор-3,4-дигидро-2 Н-1-бензопиран-2-метанол] и его индивидуальных чистых [2S[R[R[R и [2R[S[S[S энантиомеров с использованием самых различных начальных реагентов. В WO 2008/010022 (Cimex Pharma) и WO 2008/064826 (Zach System) развиваются другие синтети-1 019691 ческие методы, в которых, однако, должны быть предусмотрены более или менее сложные процедуры разделения изомеров.WO 2008/064827 описывает разделение и энантиоселективный способ получения d- и l-небиволола. На основании литературных данных, имеющихся на сегодняшний день, способы получения Небиволола до сих пор влекут за собой многочисленные проблемы. Исходный способ получения Janssen, использующий эпоксиды (схема 1, смесь 1), безусловно, является более коротким, но требует разделения двух диастереоизомерных пар эпоксида методами препаративной ВЭЖХ. Другие способы, как правило,используют гораздо большее число стадий. Таким образом, необходимо разработать новый способ синтеза, подходящий для использования в промышленных масштабах и желательно позволяющий избежать использования препаративной ВЭЖХ без значительного увеличения числа стадий. Сущность изобретения Неожиданно был обнаружен более эффективный способ синтеза Небиволола, который обобщенно представлен на схеме 1. Данный способ позволяет исключить недостатки, отмеченные выше для известных ранее методов синтеза, а именно способ:a) позволяет избежать разделения пар (4RR/SS RS/SR) эпоксидов энантиомеров методом препаративной ВЭЖХ.b) не предусматривает отдельного параллельного синтеза различных энантиомеров. Взаимодействие смеси 1 с амином в первичных спиртах, таких как метанол, этанол, пропанол и т.д., протекает быстро и чисто, но почти без какой-либо диастереоселективности, а именно две пары эпоксидов, содержащиеся в 1 (SR+RS) и (RR+SS), характеризуются очень близкими скоростями реакции. Из исследований, отмеченных в литературе [Can. J. Chem. (1967), 45, 1597-1600] видно, что роль спирта в раскрытии эпоксида амином заключается не только в роли растворителя, но также в обеспечении кислотного катализа. С помощью конформационного анализа авторы изобретения смогли доказать, что два эпоксида обладают различными конформационными свойствами. Следовательно, специфического взаимодействия со спиртом может добиться, используя стерически затрудненный спирт. Неожиданно авторы изобретения продемонстрировали, что при использовании стерически затрудненных спиртов кинетика реакции раскрытия эпоксидов 1 аминами меняется таким образом, что реакция становится селективной к одному из двух эпоксидов. Этот тип кинетического разделения может также осуществляться и с другими азотными нуклеофильными реагентами, такими как аммиак, азид-ион (N3-), гидроксиламины. Оставшийся эпоксид и продукт раскрытия проявляют очень различные химико-физические характеристики, что позволяет легко разделить их экстракционными, хроматографическими или кристаллизационными методами. Таким образом, объектом изобретения является способ получения Небиволола, содержащий стадии,на которых: Схема 4 вводят в реакцию с амином R-NH2,где R представляет собой защитную группу, выбранную из метила, аллила, трет-бутила, бензила,дифенилметила, трифенилметила, флуоренила, 9,10-дигидроантрацен-9-ила, дибензила, где ароматические кольца, присутствующие в группах, необязательно могут быть моно- или дизамещенными группами, выбранными из галогена, нитро, С 1-С 4 алкильной цепи, CF3, CHF2, группы OR2, где R2 представляет собой водород, С 1-С 4 алкил, и предпочтительно бензильной группы,в подходящем растворителе, представленном стерически затрудненным спиртом, одним или в смеси с неполярным растворителем, чтобы получить смесь четырех соединений 2-5, из которой пару 2/3 отделяют от пары 4/5b) смесь аминов 2 и 3 вводят в реакцию со смесью эпоксидов 4 и 5, чтобы получить смесь 4 соединений (6-9)c) отделяют смесь 6 и 8 (RSSS+SRRR) от 7 и 9 методом дробной кристаллизации с помощью первого растворителя, выбранного из этанола, пропанола, изопропанола, трет-бутанола, 2-метил-2-бутанола(предпочтительно 2-метил-2-бутанола), и затем с помощью смеси полярного апротонного растворителя,выбранного из этилацетата, метилацетата, изопропилацетата, ацетона, метилэтилкетона, и неполярного ратворителя, выбранного из пентана, гексана, циклогексана, метилциклогексана, гептана, бензола, толуола (предпочтительно смеси этилацетат/циклогексан);d) защитную группу R удаляют с сопутствующим или последующим образованием гидрохлоридной соли. В качестве альтернативы реакция, описанная в пункте а), может быть проведена следующим образом:f) первичный амин отделяют от эпоксидов 4/5 экстракцией в подходящем растворителе или хроматографией;g) проводят восстановительное аминирование с аминами 10/11 и альдегидом R1CHO, где R1 представляет собой Н, винил, фенил, фенил, замещенный одной или двумя группами, выбранными из галогена, нитро, С 1-С 4 алкильной цепи, CF3, CHF2, группы OR2, где R2 представляет собой водород, С 1-С 4 алкил, предпочтительно фенил, чтобы получить смесь аминов 2/3,или в качестве альтернативы для реакции, описанной в пункте е):h) смесь эпоксида 1 вводят в реакцию с гидроксиламинами с последующим гидрированием N-O связи, чтобы получить амины 10/11. Специфическое решение настоящего изобретения заключается в способе, аналогичном тому, который описан выше, в котором в качестве частичной альтернативы пункту а) после взаимодействия аминаRNH2 с эпоксидной смесью 1 пару соединений 2/3 не отделяют от соединений 4/5, но:i) добавляют спиртовой растворитель, выбранный из метанола или этанола, и соединения оставляют реагировать, как описано в пункте b). Другое специфическое решение настоящего изобретения заключается в способе, аналогичном тому,который описано выше, в котором всегда в качестве альтернативы пункту а):m) осуществляют взаимодействие со вторичным амином типа RR3NH, где R имеет приведенные выше значения и R3 представляет собой бензильную группу, возможно замещенную одной или двумя группами, выбранными из галогена, нитро, С 1-С 4 алкильной цепи, CF3, CHF2, группы OR2, где R2 представляет собой водород, С 1-С 4 алкил; предпочтительно бензильную группу, чтобы получить смесь четырех соединений 12, 13, 4 и 5, из которых пару 12/13 отделяют от пары 4/5n) снимают защиту с группы R3, чтобы получить смесь соединений 2/3. Осуществление изобретения В соответствии с настоящим изобретением небиволол получают способом, описанным на схеме 1,исходя из смеси четырех изомеров SR, RS, RR и SS эпоксида формулы 1 Смесь эпоксида 1 растворяют в стерически затрудненном спирте, выбранном из iPrOH (изопропанола), втор-BuOH, трет-BuOH, изоамила, 2-метил-2-бутанола, 2-метил-2-пентанола, предпочтительно спирта, выбранного из 2-метил-2-бутанола, трет-BuOH и 2-метил-2-пентанола, используемого отдельно или содержащего различные количества неполярного растворителя, выбранного из группы петролейного эфира, пентана, гексана, циклогексана, метилциклогексана, гептана, бензола, толуола, предпочтительно циклогексана, при соотношении спирт:неполярный растворитель от 1:1 до 10:1. Раствор поддерживают при температуре между -20 и 60 С, предпочтительно между 0 и 40 С и еще более предпочтительно при 25 С с добавленным амином R-NH2, гдеR представляет собой группу, выбранную из метила, аллила, трет-бутила, бензила, дифенилметила,трифенилметила, флуоренила, 9,10-дигидроантрацен-9-ила, дибензила, где ароматические кольца возможно могут быть замещены одной или двумя группами, выбранными из галогена, нитро, С 1-С 4 алкильной цепи, CF3, CHF2, группы OR2, где R2 представляет собой водород, С 1-С 4 алкил, предпочтительно бензильной группы, в количестве от 1 до 10 экв., предпочтительно 2 до 3 экв., рассчитанных относительноRS/SR смеси эпоксида формулы 1. Полученную, таким образом, смесь перемешивают в течение 10-40 ч и предпочтительно в течение 12 ч. Образованный осадок (смесь соединений 2 и 3) отфильтровывают. Оставшийся раствор разбавляют неполярным растворителем, выбранным из группы петролейный эфир, пентан, гексан, циклогексан, метилциклогексан, гептан, бензол, толуол, преимущественно циклогексан, в количестве, которое может варьироваться от 1 до 40 об., и промывают водным раствором кислоты (предпочтительно NaHSO4 илиNaH2PO4). Органическую фазу, содержащую эпоксиды 4 и 5, концентрируют. Количества смесей соединений 2/3 и 4/5 взаимодействуют в соотношении, изменяющемся от 0,7:1 до 1:0,7, и преимущественно в эквимолярном количестве, в инертном растворителе, подобном ароматическому углеводороду, спирту с низкой молекулярной массой, такому как метанол, этанол, изопропанол,бутанол, кетону, простому эфиру или полярному апротонному растворителю, преимущественно в этаноле (как отмечается в US 4654362). Смесь, поддерживаемую при температуре между 40 и 120 С, преимущественно между 50 и 90 С, перемешивают до завершения реакции, затем растворитель выпаривают. Полученный, таким образом, осадок кристаллизуют из спирта, выбранного из этанола, пропанола,изопропанола, трет-бутанола, 2-метил-2-бутанола, предпочтительно 2-метил-2-бутанола, и затем из смеси полярного апротонного растворителя, выбранного из этилацетата, метилацетата, изопропилацетата,ацетона, метилэтилкетона, и неполярного растворителя, выбранного из пентана, гексана, циклогексана,метилциклогексана, гептана, бензола, толуола, предпочтительно смеси этилацетат/циклогексан, до достижения чистоты 99% в паре 6/8. Полученные, таким образом, соединения формулы 6/8, в случае, когда R означает бензильную группу, превращают в небиволол в виде свободного основания путем гидрогенолиза способами, известными квалифицированному в данной области техники специалисту, с катализатором, выбранным изPd/C, Pd(OH)2/C. Среди указанных катализаторов применение Pd(OH)2 является предпочтительным, так как этот катализатор обеспечивает преимущества в конечной чистоте продукта и скорости реакции. В случае, когда R представляет собой какую-то другую из возможных групп, снятие защиты осуществляют способами, известными в данной области техники, например в случае R=метил снятие защиты может быть осуществлено фотохимически, как описано в Tetrahedron Letters (1989), 3977, если R=аллил, может быть осуществлено каталитическое гидрирование с катализатором на основе Pd, для R=t-бутил выполняют обработку метанолом и хлористо-водородной кислотой, как описано в J. Org. Chem. (2002), 89288937. Свободное основание небиволола превращают в его гидрохлоридную соль после растворения в этаноле согласно методам, известным квалифицированному специалисту в данной области техники (WO 95/22325). В альтернативном варианте осуществления настоящего изобретения промежуточные соединения 2 и 3 получают через стадии (е) и (g). SR, RS, RR и SS смесь эпоксида 1 реагирует в стерически затрудненном спирте, как изложено выше, с аммиаком или азидом, предпочтительно азидом натрия, при температуре между -20 и 60 С, предпочтительно между 0 и 40 С и еще более предпочтительно при 25 С. В случае использования азида за взаимодействием следует промежуточная реакция в соответствии с методами, известными из уровня техники, предпочтительно за счет каталитического гидрирования с катализаторами типа Pd/C или Pd(OH)2/C с получением соответствующего первичного амина согласно следующей схеме (7): Затем первичный амин отделяют от эпоксидов 4/5 экстракцией в подходящем растворителе или хроматографией. Наконец, проводят восстановительное аминирование с аминами 10/11 и альдегидомR1CHO, где R1 выбран из группы Н, винил, фенил, фенил, замещенный одной или двумя группами, выбранными из галогена, нитро, С 1-С 4 алкильной цепи, CF3, CHF2, OR2, где R2 представляет собой водород,С 1-С 4 алкил, в соответствии с методами, известными из уровня техники, как правило с боргидридом. Таким образом получают смесь аминов 2/3. В другом альтернативном варианте осуществления изобретения SR, RS, RR и SS смесь эпоксида 1 взаимодействует с гидроксиламином с последующим гидрированием N-О связи, согласно способам, известным из уровня техники, как правило, путем каталитического гидрирования с катализатором на основе Pd, с получением аминов 10 и 11, которые затем вводят в реакцию восстановительного аминирования,как описано выше, с альдегидом R1CHO и боргидридом, таким как боргидрид натрия, боргидрид лития,цианоборгидрид натрия, триацетоксинатрий боргидрид. В другом отличном варианте осуществления изобретения пару соединений 2 и 3 не отделяют от соединений 4 и 5, а после удаления непрореагировавшего избытка амина RNH2 и добавления подходящего растворителя соединения 2 и 3 оставляют взаимодействовать с соединениями 4 и 5, как уже описано выше, непосредственно получая смесь соединений 6-9. Подходящий растворитель, добавляемый к смеси,представляет собой спиртовой растворитель, выбранный, например, из метанола и этанола. Способ по настоящему изобретению также может быть осуществлен согласно дополнительному варианту, в соответствии с которым SR, RS, RR и SS смесь эпоксида 1 взаимодействует всегда в стерически затрудненном спирте, аналогично тому, что описано в стадии синтеза а), со вторичным амином типаRR3NH, где R имеет приведенные выше значения, a R3 представляет собой бензильную группу, возможно замещенную одной или двумя группами, выбранными из галогена, нитро, С 1-С 4 алкильной цепи, CF3,CHF2, группы OR2, где R2 представляет собой водород, С 1-С 4 алкил, чтобы получить смесь из четырех соединений 12, 13, 4 и 5, из которых пару 12/13 отделяют от пары 4/5 Наконец, выполняют депротонирование группы R3 с получением смеси соединений 2/3. Депротонирование группы R3 может быть выполнено известными методами, например, через каталитическое гидрирование с известным катализатором, таким как Pd/C или Pd(OH)2/C. Примеры Далее изобретение изложено более подробно в виде следующих примеров, приведенных исключительно для иллюстрации, а не в целях ограничения, и со ссылкой на схему 9, приведенную ниже Схема 9 Пример 1. Раскрытие эпоксида 1 с бензиламином в 2-метил-2-бутаноле. Диастереомерную смесь (RR/SS)- и (RS/SR)-6-фтор-2-(оксиран-2-ил)хромана (смесь 1) (50 г, 88%,226,8 ммоль, соотношение эпоксидов 1:1) помещают в реакционный сосуд и растворяют в 2-метил-2 бутаноле (420 мл). Бензиламин (42,5 мл, 352,9 ммоль) однократно добавляют к раствору при перемешивании. Раствор выдерживают при перешивании в течение 12 ч. В конце реакции образованный амин 2 а/3 а отфильтровывают под вакуумом и сушат (чистота 96,2%, 18,2 г, 57,9 ммоль). Отфильтрованный раствор промывают с 1 М NaHSO4 и Н 2 О (200 мл 3) до рН 5-6 и затем концентрируют при пониженном давлении до 1/4 об. (110 мл). К полученной, таким образом, смеси добавляют циклогексан (420 мл, равно первоначальному объему реакции) при энергичном перемешивании. Затем раствор фильтруют, сушат(Na2SO4) и концентрируют, чтобы получить 18,4 г (чистота 80%, 74,2 ммоль, 65%) смеси 4/5. Амины, полученные в результате раскрытия эпоксидов 4/5 с бензиламином, образуются в очень низких процентных количествах и удаляются путем промывания органического раствора кислотой. Природу и чистоту полученных соединений устанавливают путем сравнения со стандартами мето-5 019691[М+НMeCN]+; 194,5 [М]+. Пример 2. Раскрытие эпоксида 1 с бензиламином в смеси 2-метил-2-бутанол/циклогексан. Смесь эпоксидов 1 (10 г, чистота 89,5%, 46,1 ммоль) растворяют в смеси циклогексана и 2-метил-2 бутанола 4:1 (50 мл), добавляют бензиламин (8,5 мл, 7,65 ммоль) и смесь смешивают при комнатной температуре. После приблизительно 10 ч образуется белый осадок. После 38 ч контроль методом ВЭЖХ показывает, что RS/SR пара эпоксидов полностью использована. Осадок отфильтровывают, получая 4,80 г амина 2 а/3 а (чистота: 99%, выход: 70%), в то время как добавляется фильтрат с циклогексаном (40 мл). Органический раствор промывают с 1 М NaHSO4 (3100 мл). В течение первого промывания желтое масло отделяют от раствора (указанное масло содержит возможные продукты диалкилирования и амины эпоксидов 4/5) и выделяют. Затем масло промывают водой (2100 мл) до нейтрального рН, сушат на Na2SO4, фильтруют и растворитель удаляют при пониженном давлении, чтобы получить 3,70 г смеси 4/5 (чистота: 76%, выход: 83%). Природу и чистоту полученных соединений устанавливают путем сравнения со стандартами методом ВЭЖХ с использованием Merck Symmetry C-8 хиральной колонки, 5 мкм, 2504,6 мм и подходящего бинарного градиента. Сравнительный пример 3. Синтез аминов, полученных из пары эпоксидов 4/5. Образец смеси 4/5 (0,5 г, 2,57 ммоль), полученный хроматографической очисткой смеси 1, растворяют в этаноле (5 мл) и объединяют с бензиламином (0,84 мл, 7,72 ммоль). Смесь кипятят с обратным холодильником до полного исчезновения исходных эпоксидов. Продукт выделяют путем осаждения из реакционной смеси, выдерживаемой при 4 С. 1H-NMR (DMSO-d6): 7,31 (5 Н, m), 6,88 (2 Н, m), 6,68 (1 Н, m), 4,85 (1H, brs), 3,95 (1H, m), 3,73 (2H, s),3,66 (1H, m), 2,75-2,60 (4H, m), 2,10 (1H, br), 1,90 (1H, m), 1,72 (1H, m). Пример 4. Взаимодействие аминов 2/3 с эпоксидами 4/5. Соединения -(RS/SR)-(2-бензиламино)-1-(6-фторхроман-2-ил)этанола 2 а/3 а (18,26 г) и (RR/SS)-6-фтор-2-(оксиран-2-ил)хромана 4/5 (18,4 г) растворяют в абсолютном этаноле (60 мл) и выдерживают при кипячении с обратным холодильником до полного исчезновения исходных реагентов. В конце реакции смесь оставляют, чтобы достичь комнатной температуры, и растворитель удаляют при пониженном давлении. Осадок помещают в 2-метил-2-бутанол (150 мл, 4 об.), нагревают до растворения(80 С) и оставляют при комнатной температуре в течение 24 ч при легком перемешивании. Полученный твердый осадок отфильтровывают, удаляют его с 2-метил-2-бутанолом (20 мл) и сушат на фильтре. Полученный, таким образом, твердый осадок (10,5 г) суспендируют в циклогексан/этилацетате 9/1 (100 мл,10 об.) и кипятят с обратным холодильником до растворения. Затем оставляют, чтобы достичь комнатной температуры, и полученный твердый осадок отфильтровывают с циклогексаном (20 мл). Осадок сушат на фильтре, получая 9,80 г смеси 6 а/8 а с чистотой выше 99%. Соединения 7 а/9 а оставались в кристаллизационных водах. Природу и чистоту полученных соединений устанавливают путем сравнения со стандартами методом ВЭЖХ с использованием Merck Symmetry C-8 хиральной колонки, 5 мкм, 2504,6 мм, и подходящего бинарного градиента. 1Pd(OH)2/C (50% влажности, 200 мг) к раствору в условиях инертной атмосферы (N2). Смесь выдерживают в условии водородной атмосферы. После исчезновения исходного соединения смесь отфильтровывают на целите или на материале, подходящем для данной цели, промывая ее реакционной смесью (50 мл). Растворители удаляют при пониженном давлении, получая белое твердое вещество в виде осадка (3,30 г) и используя его без очистки на последующей стадии. Природу и чистоту полученных соединений устанавливают путем сравнения со стандартами методом ВЭЖХ с использованием Merck Symmetry C-8 хиральной колонки, 5 мкм, 2504,6 мм, и подходящего бинарного градиента. 1MS (m/z): вычислено для C22H25F2NO4 405,2; обнаружено 406,6 [М+Н]+. Пример 6. Образование соли Небиволола. Свободное основание Небиволола (3,30 г, 8,70 ммоль) суспендируют в абсолютном этаноле (100 мл) и нагревают до полного растворения выпавшего осадка. К раствору добавляют 1,25 М этанольнойHCl (7,5 мл). Полученный раствор концентрируют при пониженном давлении, до получения продукта с 15% концентрацией. Во время выпаривания растворителя наблюдают постепенное образование белого осадка. Твердое вещество отфильтровывают промыванием с холодным абсолютным этанолом, чтобы получить 3,10 г гидрохлоридной соли небиволола. Хиральную чистоту продукта и соотношение между двумя энантиомерами вычисляют путем сравнения со стандартами методом ВЭЖХ с колонкой AKZO NOBEL, Kromasil 5-AmyCoat, 5 мкм, 250 мм 4,6, и подходящего бинарного градиента. 1MS (m/z): вычислено для C22H25F2NO4 405,2; обнаружено 406,6 [M+Н]+. Пример 7. Раскрытие эпоксидов 1 с азидом натрия. К смеси эпоксидов 1 (200 мг, 1,03 ммоль) и азида натрия (100 мг, 1,5 ммоль) в третичном амиловом спирте (2 мл) добавляют ДМФ по каплям до полного завершения растворения. Полученный таким образом раствор перемешивают при комнатной температуре до полного исчезновения пары RS/SR эпоксидов. Затем смесь промывают водой (5) и сушат на сульфате натрия; смесь фильтруют, растворители выпаривают при пониженном давлении и осадок очищают флэш-хроматографией, получая 90 мг (73%) пары азидов, полученной из RS/SR эпоксидов (схема 7, Х=N3) и 80 мг пары 4/5. MS (m/z): вычислено дляC11H12FN3O2 237,0; обнаружено 238,1 [М+Н]+. Пример 8. Восстановление азида и восстановительное аминирование. Раствор азидов, полученный в результате раскрытия RS/SR эпоксидов (90 мг, 0,38 ммоль), подвергают каталитическому гидрированию в EtOH в присутствии 5% Pd/C. Полученный таким образом раствор отфильтровывают и добавляют бензальдегид (440 мг, 0,38 ммоль) и боргидрид триацетоксинатрия(90 мг, 0,41 ммоль). В конце реакции растворители отгоняют при пониженном давлении и осадок удаляют с дихлорметаном и промывают с 5% Na2CO3, с последующим обезвоживанием на сульфате натрия. Хроматографическая очистка полученного таким образом осадка дала 68 мг (60%) смеси аминов 2 а/3 а. Пример 9. Раскрытие эпоксидов 1 с бензилгидроксиламином. К смеси эпоксидов 1 (200 мг, 1,03 ммоль) и О-бензилгидроксиламина (184 мг, 1,5 ммоль из коммерческой соли гидрохлорида) в третичном амиловом спирте (3 мл) добавляют ДМФ по каплям до полного завершения растворения. Полученный таким образом раствор перемешивают при комнатной температуре до полного исчезновения пары RS/SR эпоксидов. Затем смесь промывают водой (5) и после этого сушат на сульфате натрия. Смесь фильтруют, растворители выпаривают при пониженном давлении и осадок очищают флэш-хроматографией, получая 103 мг (65%) пары гидроксиламинов, полученной изMS (m/z): вычислено для C18H20F2NO3 317,1; обнаружено 318,2 [М+Н]+. С помощью обработки аналогично методу, раскрытому в примере 8, полученную таким образом пару гидроксиламинов превращают в амины 2 а/3 а. Пример 10. Раскрытие RS/SR эпоксидов с трет-бутиламином и взаимодействие in situ с эпоксидами 4/5. К смеси эпоксидов 1 (500 мг, 85%, 2,2 ммоль) в третичном амиловом спирте (5 мл) добавляют третбутиламин (0,34 мл, 3,28 ммоль) и смесь перемешивают до исчезновения смеси RS/SR эпоксидов. Раствор промывают с 0,1 N NaHSO4 (4), чтобы удалить избыток трет-бутиламина, к нему добавляют этанол(2 мл) и раствор кипятят с обратным холодильником до полного исчезновения пары эпоксидов 3/4. Растворители отгоняют при пониженном давлении и осадок очищают флэш-хроматографией, чтобы получить смесь соединений 6-9, где R=трет-бутил (363 мг, 72%).MS (m/z): вычислено для C27H35F2NO3 459,3; обнаружено 460,4 [М+Н]+. Пример 11. Раскрытие эпоксидов с дибензиламином и селективное снятие защиты бензильной группы. Раствор эпоксидов 1 (100 мг, 0,51 ммоль), дибензиламин (150 мкл, 0,70 ммоль) в третичном амиловом спирте (1 мл) перемешивают при комнатной температуре до исчезновения RS/SR эпоксидов. Затем сырой продукт реакции очищают с помощью флэш-хроматографии, получая 63 мг (63%) смеси амина,полученной из раскрытых RS/SR эпоксидов с дибензиламином и 51 мг (65%) пары эпоксида 4/5. Смесь дибензиламина растворяют в этаноле (5 мл) и гидрируют с 5% Pd/C, чтобы получить бензиламины 2 а/3 а в качестве основного продукта (29 мг, 74%). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения Небиволола в форме рацемической смеси двух энантиомеров [2S[2R[R[R,'-[имино-бис-(метилен)] бис-[6-фтор-хроман-2-метанол] и [2R[2S[S[S-,'-[имино-бис-(метилен)] бис-[6-фтор-хроман-2-метанол], имеющих следующие формулы: содержащий следующие стадии, на которых: а) смесь четырех изомеров SR, RS, RR и SS эпоксида формулы 1 вводят в реакцию с амином R-NH2, где R представляет собой защитную группу, выбранную из метила, аллила, трет-бутила, бензила, дифенилметила, трифенилметила, флуоренила, 9,10 дигидроантрацен-9-ила, дибензила, где ароматические кольца, возможно, могут быть замещены одной или двумя группами, выбранными из галогена, нитро, С 1-С 4 алкильной цепи, CF3, CHF2, группы OR2, гдеR2 представляет собой водород, С 1-С 4 алкил, в растворителе, представленном стерически затрудненным спиртом, выбранным из iPrOH, втор-BuOH, трет-BuOH, изоамила, 2-метил-2-бутанола, 2-метил-2 пентанола, используемым отдельно или в смеси с неполярным растворителем, выбранным из группы петролейного эфира, пентана, гексана, циклогексана, метилциклогексана, гептана, бензола, толуола, с получением смеси четырех соединений 2-5, из которых пару 2/3 отделяют от пары 4/5b) смесь аминов 2 и 3 вводят в реакцию с парой эпоксидов 4 и 5 в смеси, чтобы получить смесь четырех соединений 6-9c) смесь соединений 6 и 8 (RSSS+SRRR) отделяют от 7 и 9 дробной кристаллизацией с помощью первого растворителя, выбранного из этанола, изопропанола, бутанола, трет-бутанола, 2-метил-2 бутанола, и затем с помощью смеси полярного апротонного растворителя, выбранного из метилацетата,этилацетата, изопропилацетата, ацетона, метилэтилкетона, ацетонитрила, изопропилового эфира, с неполярным растворителем, выбранным из пентана, гексана, циклогексана, метилциклогексана, гептана, бензола, толуола;d) удаляют защитную группу R и необязательно затем получают гидрохлоридную соль с тем, чтобы получить конечный продукт Небиволол или Небиволол гидрохлорид. 2. Способ по п.1, в котором R представляет собой бензильную группу. 3. Способ по п.1, в котором амины 2 и 3 отделяют от эпоксидов 4 и 5 осаждением и фильтрацией. 4. Способ по п.1, в котором стерически затрудненный спирт, определенный в стадии а), выбирают из 2-метил-2-бутанола, трет-BuOH и 2-метил-2-пентанола. 5. Способ по п.1, в котором неполярный растворитель, определенный в стадии а), представляет собой циклогексан. 6. Способ по п.1, в котором растворители для дробной кристаллизации, определенные в стадии с),представляют собой 2-метил-2-бутанол и затем смесь этилацетат/циклогексан. 7. Способ получения Небиволола в форме рацемической смеси двух энантиомеров [2S[2R[R[R,'-[имино-бис-(метилен)] бис-[6-фтор-хроман-2-метанол] и [2R[2S[S[S-,'-[имино-бис-(метилен)] бис-[6-фтор-хроман-2-метанол], имеющих следующие формулы: содержащий стадии, на которых: е) SR, RS, RR и SS смесь эпоксида 1 вводят в реакцию с аммиаком или с азидом с последующим восстановлением в случае азида до соответствующего первичного аминаf) первичный амин отделяют от эпоксидов 4/5 экстракцией в подходящем растворителе или хроматографией;g) проводят восстановительное аминирование с аминами 10/11 и альдегидом R1CHO, где R1 выбран из группы Н, винил, фенил, фенил, замещенный одной или двумя группами, выбранными из галогена,нитро, С 1-С 4 алкильной цепи, CF3, CHF2, OR2, где R2 представляет собой водород, С 1-С 4 алкил, чтобы получить смесь аминов 2/3; а затем содержащий стадии b)-d) из п.1. 8. Способ по п.7, в котором R1 представляет собой фенильную группу. 9. Способ получения Небиволола в форме рацемической смеси двух энантиомеров [2S[2R[R[R,'-[имино-бис-(метилен)] бис-[6-фтор-хроман-2-метанол] и [2R[2S[S[S-,'-[имино-бис-(метилен)] бис-[6-фтор-хроман-2-метанол], имеющих следующие формулы:h) смесь SR, RS, RR и SS эпоксида 1 вводят в реакцию с гидроксиламином с последующим гидрированием связи N-O и получением аминов 10/11, а затем содержащий стадии f) и g) из п.7 с последующим осуществлением стадий b)-d) из п.1. 10. Способ получения Небиволола в форме рацемической смеси двух энантиомеров [2S[2R[R[R,'-[имино-бис-(метилен)] бис-[6-фтор-хроман-2-метанол] и [2R[2S[S[S-,'-[имино-бис-(метилен)] бис-[6-фтор-хроман-2-метанол], имеющих следующие формулы: содержащий стадию, на которой: а) смесь четырех изомеров SR, RS, RR и SS эпоксида формулы 1 вводят в реакцию с амином R-NH2, где R представляет собой защитную группу, выбранную из метила, аллила, трет-бутила, бензила, дифенилметила, трифенилметила, флуоренила, 9,10 дигидроантрацен-9-ила, дибензила, где ароматические кольца, возможно, могут быть замещены одной или двумя группами, выбранными из галогена, нитро, С 1-С 4 алкильной цепи, CF3, CHF2, группы OR2, гдеR2 представляет собой водород, С 1-С 4 алкил, в растворителе, представленном стерически затрудненным спиртом, выбранным из iPrOH, втор-BuOH, трет-BuOH, изоамила, 2-метил-2-бутанола, 2-метил-2 пентанола, используемым отдельно или в смеси с неполярным растворителем, выбранным из группы петролейного эфира, пентана, гексана, циклогексана, метилциклогексана, гептана, бензола, толуола, с получением смеси четырех соединений 2-5, а затем проводят следующие стадии, на которых:k) удаляют избыток непрореагировавшего амина RNH2;i) добавляют спиртовой растворитель, выбранный из метанола или этанола, и затем соединения 2/3 оставляют взаимодействовать непосредственно с соединениями 4/5, как предусмотрено на стадии b) из п.1, с последующим осуществлением стадий с) и d) из п.1. 11. Способ получения Небиволола в форме рацемической смеси двух энантиомеров [2S[2R[R[R,'-[имино-бис-(метилен)] бис-[6-фтор-хроман-2-метанол] и [2R[2S[S[S-,'-[имино-бис-(метилен)] бис-[6-фтор-хроман-2-метанол], имеющих следующие формулы:m) смесь четырех изомеров SR, RS, RR и SS эпоксида формулы 1 вводят в реакцию со вторичным амином типа RR3NH, где R представляет собой защитную группу,выбранную из метила, аллила, трет-бутила, бензила, дифенилметила, трифенилметила, флуоренила, 9,10 дигидроантрацен-9-ила, дибензила, где ароматические кольца, возможно, могут быть замещены одной или двумя группами, выбранными из галогена, нитро, С 1-С 4 алкильной цепи, CF3, CHF2, группы OR2, гдеR2 представляет собой водород, С 1-С 4 алкил и где R3 представляет собой бензильную группу, возможно замещенную одной или двумя группами, выбранными из галогена, нитро, С 1-С 4 алкильной цепи, CF3,CHF2, группы OR2, где R2 определен выше, в растворителе, представленном стерически затрудненным спиртом, выбранным из iPrOH, втор-BuOH, трет-BuOH, изоамила, 2-метил-2-бутанола, 2-метил-2 пентанола, используемым отдельно или в смеси с неполярным растворителем, выбранным из группы петролейного эфира, пентана, гексана, циклогексана, метилциклогексана, гептана, бензола, толуола, чтобы получить смесь четырех соединений 12, 13, 4 и 5, из которых пару 12/13 отделяют от пары 4/5n) снимают защиту с группы R3, чтобы получить смесь соединений 2/3; а затем содержащий стадии b)-d) из п.1. 12. Способ по п.11, в котором R3 представляет собой бензильную группу. 13. Способ по п.1, в котором снятие защиты, предусмотренное на стадии d), выполняют путем каталитического гидрирования с Pd(OH)2.
МПК / Метки
МПК: C07D 311/58
Метки: способ, небиволола, получения
Код ссылки
<a href="https://eas.patents.su/11-19691-sposob-polucheniya-nebivolola.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения небиволола</a>
Предыдущий патент: Фунгицидная смесь, фунгицидное средство и способ борьбы с фитопатогенными грибами на их основе
Следующий патент: Охладитель агломерата со сменными уплотнениями
Случайный патент: Трактор с валковой жаткой и с подвеской задних колес















