Новые соединения бензотиадиазина, способ их получения и фармацевтические композиции, которые их содержат
Формула / Реферат
1. Соединения формулы (I)

в которой
R1 представляет собой линейную или разветвленную C1-С6-алкильную группу, замещенную одним или несколькими атомами галогена,
R2 представляет собой атом водорода,
R3 представляет собой незамещенную фенильную группу или фенильную группу, замещенную группой, выбранной из линейного или разветвленного C1-С6-алкокси; циано; гидроксиамидиногруппы; аминокарбонила (необязательно замещенного линейной или разветвленной C1-С6-алкильной группой); C1-С6-алкилсульфониламино и линейного или разветвленного C1-С6-алкила, замещенного группой, выбранной из NR4R5, где
R4 представляет собой S(O)pR8 или COR9 группу,
R5 представляет собой атом водорода или линейную или разветвленную C1-С6-алкильную группу, а
R8 и R9, которые могут быть одинаковыми или разными, каждый представляет собой линейную или разветвленную C1-С6-алкильную группу,
р обозначает 2,
их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
2. Соединения формулы (I) по п.1, где R1 представляет собой галоэтильную группу.
3. Соединения формулы (I) по п.1, где R3 представляет собой незамещенную фенильную группу.
4. Соединения формулы (I) по п.1, где R3 представляет собой фенильную группу, замещенную гидроксиамидиногруппой, алкоксигруппой, алкилсульфониламиногруппой или алкильной группой, замещенной NH(SO)pR8 или NHCOR9 группой.
5. Соединения формулы (I) по п.1, которые представляют собой
N-(4-{[4-(2-фторэтил)-1,1-диоксидо-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ил]окси}бензил)метансульфонамид и
N-(4-{[4-(2-хлорэтил)-1,1-диоксидо-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ил]окси}бензил)метансульфонамид,
и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
6. Способ получения соединений формулы (I), определенных в п.1, заключающийся в том, что в качестве исходного вещества используют соединение формулы (II)
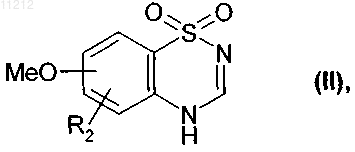
где R2 имеет значение, указанное для формулы (I),
с которым конденсируют в щелочной среде линейный или разветвленный C1-C6-галоалкил, несущий гидроксигруппу,
после этого его превращают в соответствующее галогенированное соединение с получением соединения формулы (III)
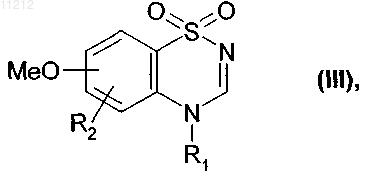
где R1 и R2 имеют значения, приведенные для формулы (I),
которое подвергают реакции деметилирования в присутствии BBr3 или BF3 с получением соединения формулы (IV)
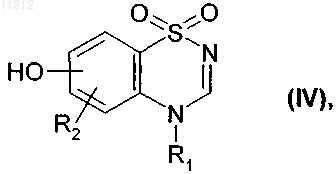
где R1 и R2 имеют значения, указанные выше,
с которым конденсируют в присутствии Cu(OAc)2 соединение бороновой кислоты формулы (V)
![]()
где R3 имеет значение, указанное для формулы (I),
с получением соединения формулы (VI)
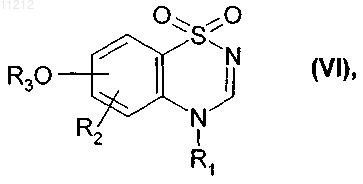
где R1, R2 и R3 имеют значения, указанные выше,
которое подвергают восстановлению посредством NaBH4 с получением соединения формулы (I)
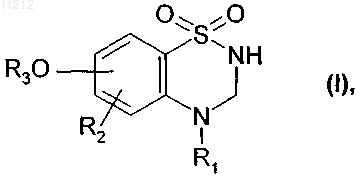
где R1, R2 и R3 имеют значения, указанные выше,
или соединение формулы (III) подвергают восстановлению в присутствии NaBH4 с получением соединения формулы (VII)
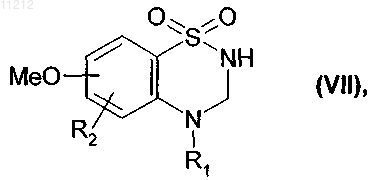
где R1 и R2 имеют значения, указанные выше,
которое подвергают реакции деметилирования в присутствии BBr3 или BF3 с получением соединения формулы (VIII)
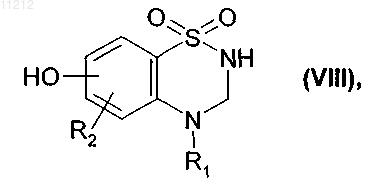
где R1 и R2 имеют значения, указанные выше,
с которым конденсируют в присутствии Cu(OAc)2 соединение бороновой кислоты формулы (V), как определено выше, с получением соединения формулы (I),
где соединения формулы (I) очищают, при необходимости, в соответствии с обычным способом очистки, разделяют, если это является подходящим, на их изомеры в соответствии с обычным способом разделения и превращают, если это является желательным, в их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
7. Соединения формулы (VIII), определенные в п.6
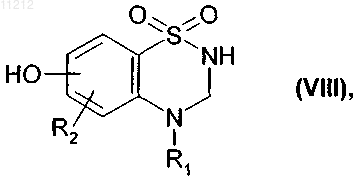
где R1 и R2 имеют значения, указанные в п.6, предназначенные для использования в качестве промежуточных продуктов для синтеза соединений формулы (I).
8. Соединения формулы (IX), частный случай соединений формулы (VIII) по п.8
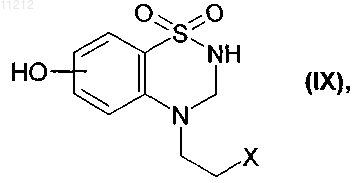
в которой X представляет собой атом фтора, хлора, брома или йода, предназначенные для использования в качестве промежуточных продуктов для синтеза соединений формулы (I).
9. Фармацевтическая композиция, обладающая активностью модуляторов AMPA, содержащая в качестве активного компонента соединение по любому из пп.1-5, 7 и 8 в сочетании с одним или несколькими инертными, нетоксичными, фармацевтически приемлемыми наполнителями или носителями.
10. Фармацевтическая композиция по п.9, предназначенная для использования в качестве лекарственного средства с модулирующим АМРА действием.
Текст
011212 Настоящее изобретение относится к новым соединениям бензотиадиазина, к способу их получения и к фармацевтическим композициям, которые их содержат. В настоящее время известно, что инициирующие аминокислоты, особенно глутамат, играют очень важную роль в физиологических процессах приспосабливаемости нейронов к воздействиям внешней среды и в механизмах, лежащих в основе обучения и памяти. Патофизиологические исследования свидетельствуют о том, что нарушение в глутаматэргической нейротрансмиссии тесно связано с развитием болезни Альцгеймера (Neuroscience and Biobehavioral reviews, 1992, 16, 13-24; Progress in Neurobiology, 1992, 39, 517-545). Кроме того, во многих исследованиях в последние годы показано, что существуют подтипы рецепторов инициирующих аминокислот и их функциональное взаимодействие (Molecular Neuropharmacology, 1992, 2, 15-31). Среди этих рецепторов рецептор АМРА (-амино-3-гидрокси-5-метил-4-изоксазолпропионовая кислота) в наибольшей степени вовлечен в процессы физиологической возбудимости нейронов и, в особенности, в те процессы, которые связаны с запоминанием. Например, было показано, что обучаемость связана с увеличением связывания АМРА с его рецептором в гиппокампе, одном из участков головного мозга, который отвечает за процессы памяти и распознавания. Также в последнее время описаны ноотропные средства, такие как анирацетам, в качестве положительных модуляторов рецепторов АМРА нейронов (Journal of Neurochemistry, 1992, 58, 1199-1204). В литературе описаны соединения, имеющие бензамидную структуру, в качестве средств, имеющих такой же механизм действия и улучшающих память (Synapse, 1993, 15, 326-329). Из этих новых фармакологических средств наиболее активным является, в частности, соединение ВА 74. Дополнительно, в патентной заявке ЕР 692484 описано соединение бензотиадиазина, которое способствует току, вызываемому АМРА, и в международной патентной заявке WO 99/42456 также описаны определенные соединения бензотиадиазина в качестве модуляторов рецепторов АМРА. Соединения бензотиадиазина, которые раскрыты в настоящем изобретении, кроме того, что являются новыми, неожиданно обнаруживают чрезвычайно ценное фармакологическое действие на ток, вызываемый АМРА. Они являются пригодными в качестве модуляторов АМРА для лечения или предотвращения нарушений памяти и распознавания, которые связаны с возрастом, с синдромами тревоги или депрессии, с прогрессирующими нейродегенеративными заболеваниями, с болезнью Альцгеймера, с болезнью Пика (предстарческая органическая атрофия мозга), с хореей Хантингтона, с шизофренией, с последствиями острых нейродегенеративных заболеваний, с последствиями ишемии и с последствиями эпилепсии. В частности, настоящее изобретение относится к соединениям формулы (I)R1 представляет собой линейную или разветвленную С 1-С 6-алкильную группу, замещенную одним или несколькими атомами галогена,R2 представляет собой атом водорода,R3 представляет собой незамещенную фенильную группу или фенильную группу, замещенную группой, выбранной из линейного или разветвленного С 1-С 6-алкокси; циано; гидроксиамидиногруппы; аминокарбонила (необязательно замещенного линейной или разветвленной С 1-С 6-алкильной группой); С 1-С 6-алкилсульфониламино и линейного или разветвленного С 1-С 6-алкила, замещенного группой, выбранной из NR4R5, гдеR4 представляет собой S(O)pR8 или COR9 группу,R5 представляет собой атом водорода или линейную или разветвленную С 1-С 6-алкильную группу, аR8 и R9, которые могут быть одинаковыми или разными, каждый представляет собой линейную или разветвленную С 1-С 6-алкильную группу,р обозначает 2,к их энантиомерам и диастереоизомерам, а также к их аддитивным солям с фармацевтически приемлемой кислотой или основанием. Среди фармацевтически приемлемых кислот можно отметить, но не ограничиваясь только ими, соляную кислоту, бромисто-водородную кислоту, серную кислоту, фосфоновую кислоту, уксусную кислоту, трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, метансульфоновую кислоту, камфорную кислоту и др. Среди фармацевтически приемлемых оснований можно отметить, но не ограничиваясь только ими,гидроокись натрия, гидроокись калия, триэтиламин, трет-бутиламин и др.-1 011212 Предпочтительным значением группы R1 является галоэтил, такой как фторэтил, хлорэтил или бромэтил, более предпочтительно фтор- или хлорэтил. Предпочтительным значением группы R3 является фенильная или замещенная фенильная группа,более предпочтительно замещенная алкоксигруппой, алкилсульфониламиногруппой или алкильной группой, замещенной NHS(O)pR8 или NHCOR9 группой. Наиболее предпочтительно изобретение относится к соединениям формулы (I), которые представляют собойN-(4-[4-(2-бромэтил)-1,1-диоксидо-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ил]оксибензил)метансульфонамид,N-(4-[4-(2-фторэтил)-1,1-диоксидо-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ил]оксибензил)метансульфонамид,N-(4-[4-(2-хлорэтил)-1,1-диоксидо-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ил]оксибензил)метансульфонамид,N-(3-[4-(2-фторэтил)-1,1-диоксидо-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ил]оксифенил)метансульфонамид,N-(4-[4-(2-фторэтил)-1,1-диоксидо-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ил]оксифенил)метансульфонамид,4-(2-фторэтил)-7-(3-метоксифенокси)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид,N-(3-[4-(2-фторэтил)-1,1-диоксидо-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ил]оксибензил)ацетамид,N-(3-[4-(2-фторэтил)-1,1-диоксидо-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ил]оксибензил)метансульфонамид,N-(4-[4-(2-фторэтил)-1,1-диоксидо-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ил]оксибензил)-Nметилметансульфонамид,4-(2-фторэтил)-7-фенокси-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид,3-[4-(2-фторэтил)-1,1-диоксидо-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ил]окси-N-гидроксибензолкарбоксимидамид и 3-[4-(2-фторэтил)-1,1-диоксидо-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ил]окси-N-метилбензамид. Изобретение также относится к способу получения соединений формулы (I), который характеризуется тем, что в качестве исходного вещества применяют соединение формулы (II) где R2 имеет значение, указанное для формулы (I),с которым конденсируют в щелочной среде линейный или разветвленный C1-С 6-галоалкил, несущий гидроксигруппу,после этого его превращают в соответствующее галогенированное соединение, получая соединение формулы (III) где R1 и R2 имеют значения, приведенные для формулы (I),которое подвергают реакции деметилирования в присутствии BBr3 или BF3, например, получая соединение формулы (IV) где R1 и R2 имеют значения, указанные выше,с которым конденсируют, в присутствии Cu(OAc)2, соединение бороновой кислоты формулы (V)(V),где R3 имеет значение, указанное для формулы (I),получая соединение формулы (VI) где R1, R2 и R3 имеют значения, указанные выше,которое подвергают восстановлению при помощи NaBH4, например, получая соединение формулы (I) где R1, R2 и R3 имеют значения, указанные выше,или соединение формулы (III) подвергают восстановлению в присутствии NaBH4, например, получая соединение формулы (VII) где R1 и R2 имеют значения, указанные выше,которое подвергают реакции деметилирования в присутствии BBr3 или BF3, например, получая соединение формулы (VIII) где R1 и R2 имеют значения, указанные выше,с которым конденсируют, в присутствии Cu(OAc)2, соединение бороновой кислоты формулы (V),как определено выше, получая соединение формулы (I),где соединения (I) очищают, при необходимости, в соответствии с обычным способом очистки,разделяют, если это является подходящим, на их изомеры в соответствии с обычным способом разделения и превращают, если это является желательным, в их аддитивные соли с фармацевтически приемлемой кислотой или основанием. Изобретение также относится к соединению формулы (VIII) как определено выше, которое пригодно в качестве промежуточного продукта для синтеза соединений формулы (I) и пригодно в качестве модулятора АМРА рецептора,и более предпочтительно к соединению формулы (IX), частному случаю соединений формулы (VIII) в которой X представляет собой атом фтора, хлора, брома или йода, которое пригодно в качестве промежуточного продукта для синтеза соединений формулы (I) и пригодно в качестве модулятора АМРА рецептора. Изобретение также относится к фармацевтическим композициям, которые содержат в качестве активного компонента соединение формулы (I) или (IX) с одним или более подходящими, инертными, нетоксичными наполнителями. Среди фармацевтических композиций согласно изобретению особенно можно отметить те, которые являются пригодными для перорального, парентерального (внутривенного-3 011212 или подкожного) или назального введения, таблетки или драже, подъязычные таблетки, желатиновые капсулы, лепешки, суппозитории, кремы, мази, кожные гели, составы для инъекций, суспензии для питья и др. Полезная дозировка может изменяться в зависимости от природы и тяжести расстройства, пути введения, а также от возраста и веса пациента, и находится в диапазоне от 1 до 500 мг в сутки на одно или больше введений. Последующие способы получения и примеры подтверждают изобретение, но никоим образом его не ограничивают. Используемые исходные вещества являются известными продуктами или их получают в соответствии с известными способами. Структуры соединений, описанных в примерах, были определены в соответствии с обычными спектрофотометрическими способами (инфракрасная спектрометрия, ядерный магнитный резонанс, массспектрометрия и др.). Получение 1. 4-(2-Бромэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ол 1,1-диоксид. Стадия А. 2-(7-Метокси-1,1-диоксидо-4H-1,2,4-бензотиадиазин-4-ил)этанол. К раствору 7-метокси-4H-1,2,4-бензотиадиазин 1,1-диоксида (4,0 г, 18,8 ммоль) в смеси 30 мл ДМФА и 30 мл CH3CN добавляли 8,6 г (56,6 ммоль) CsF и 1,47 мл (18,8 ммоль) 2-бромэтанола. Перемешивали в течение 2 ч при 75 С и добавляли 1,47 мл (18,8 ммоль) 2-бромэтанола. Еще через 6 ч при 75 С дополнительно добавляли 1,47 мл (18,8 ммоль) 2-бромэтанола и затем 2,8 г (18,8 ммоль) CsF и продолжали перемешивать при 75 С всю ночь. Соли отфильтровывали при температуре окружающей среды и промывали CH3CN; фильтрат упаривали насухо. Остаток ресуспендировали в CH2Cl2 и органическую фазу промывали насыщенным раствором NaCl и высушивали (MgSO4). После упаривания липкий остаток ресуспендировали в смеси этиловый эфир/CH2Cl2. Смолу растирали в порошок до получения твердого вещества, которое отфильтровывали, получая указанное в заглавии соединение. Точка плавления: 160-162 С. Элементный микроанализ: Стадия В. 4-(2-Фторэтил)-7-метокси-4H-1,2,4-бензотиадиазин 1,1-диоксид. К раствору 3,85 г (15,02 ммоль) соединения с предыдущей стадии в 100 мл CH2Cl2, охлажденного на ледяной бане, по каплям добавляли 3,97 мл (30,0 ммоль) DAST, разведенного 20 мл CH2Cl2. Затем реакционный раствор оставляли нагреться до температуры окружающей среды приблизительно в течение 1 ч; после этого вливали 100 мл насыщенного раствора NaCl и органическую фазу сливали, высушивали(MgSO4) и упаривали в вакууме. Остаток растирали в порошок в смеси этиловый эфир/CH2Cl2 до получения твердого вещества, которое отфильтровывали, получая указанное в заглавии соединение. Точка плавления: 123-128 С. Элементный микроанализ: Стадия С. 4-(2-Фторэтил)-7-метокси-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. 454 мг (12,0 ммоль) NaBH4 небольшими порциями добавляли к суспензии 2,77 г (10,7 ммоль) соединения с предыдущей стадии в 25 мл этанола. После перемешивания в течение 2 ч при температуре окружающей среды по каплям добавляли 1 н. HCl до образования белого осадка, который отфильтровывали для выделения указанного в заглавии соединения. Точка плавления: 91-93 С. Стадия D. 4-(2-Бромэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ол 1,1-диоксид. 17,6 мл (17,6 ммоль) 1 М раствора BBr3 в CH2Cl2 по каплям добавляли к раствору 1,53 г (5,88 ммоль) соединения с предыдущей стадии в 70 мл CH2Cl2, охлажденного на ледяной бане. Смесь перемешивали всю ночь, позволяя при этом нагреться до температуры окружающей среды. Реакционную суспензию охлаждали на ледяной бане и по каплям добавляли 50 мл воды. После перемешивания в течение 30 мин осадок отфильтровывали, промывали водой и высушивали в вакууме. Таким образом получали требуемое соединение в виде светло-коричневого порошка. Точка плавления: 144-148 С. Получение 2. 4-(2-Фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ол 1,1-диоксид. Стадия А. 4-(2-Фторэтил)-4H-1,2,4-бензотиадиазин-7-ол 1,1-диоксид. 100 мл (950 ммоль) комплекса ВР 3Me3S вносили в двугорлую колбу, которую продували азотом и соединяли с отделителем, содержащим гипохлорит натрия, при помощи канюли и под давлением азота.-4 011212 Затем при перемешивании и под легким потоком азота быстро небольшими порциями добавляли суспензию 5,63 г (21,8 ммоль) соединения со стадии В получения 1 в 75 мл CH2Cl2. Поток азота останавливали и реакционную суспензию перемешивали всю ночь при температуре окружающей среды. Реакционную смесь охлаждали на ледяной бане и добавляли лед и воду. Суспензию перемешивали в течение 30 мин,осадок отфильтровывали и промывали водой и гептаном. Твердое вещество высушивали и перекристаллизовывали из воды, получая указанное в заглавии соединение. Точка плавления: 230-235 С. Элементный микроанализ: Стадия В. 4-(2-Фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ол 1,1-диоксид. Осуществляли методику, описанную на стадии С получения 1, исходя из соединения, полученного на вышеописанной стадии А, за исключением того, что указанное в заглавии соединение не осаждали после добавления 1 н. НСl, а экстрагировали СН 2 Сl2. Точка плавления: 178-180 С. Элементный микроанализ: Получение 3. 4-(2-Хлорэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ол 1,1-диоксид. Стадия А. 4-(2-Хлорэтил)-7-метокси-4H-1,2,4-бензотиадиазин 1,1-диоксид. К суспензии 1,0 г (3,90 ммоль) соединения со стадии А получения 1 в 20 мл CH2Cl2 добавляли при температуре окружающей среды 0,1 мл ДМФА и затем по каплям раствор, содержащий 1,42 мл (19,5 ммоль) SOCl2 в 5 мл СН 2 Сl2. После окончания добавления получали раствор, который перемешивали в колбе с обратным холодильником для CH2Cl2 в течение 2 ч. CH2Cl2 упаривали в вакууме и остаток ресуспендировали в 5% растворе NаНСО 3. После растирания в порошок остатка получали твердое вещество, которое отфильтровывали, промывали водой и высушивали, получая указанное в заглавии соединение. Точка плавления: 126-130 С. Элементный микроанализ: Стадия В. 4-(2-Хлорэтил)-7-метокси-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Условия и обработка были идентичны стадии С получения 1. Точка плавления: 139-143 С. Элементный микроанализ: Стадия С. 4-(2-Хлорэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ол 1,1-диоксид. Условия и обработка были идентичны стадии D получения 1. Точка плавления: 171-173 С. Соединения из примеров 1-12 получали путем реакции O-арилирования, которую осуществляли при помощи промежуточных продуктов, описанных в получениях 1, 2 или 3, используя подходящую бороновую кислоту и согласно реакции и условиям обработки, описанным в примере 1 далее. Пример 1. N-(4-[4-(2-Бромэтил)-1,1-диоксидо-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ил]окси бензил)метансульфонамид. 80 мл CH2Cl2, 548 мкл (6,79 ммоль) пиридина, 700 мг (2,29 ммоль) соединения из получения 1, 8 г молекулярного сита 4, 786 мг (3,43 ммоль) 4-[(метилсульфонил)амино]метилфенил)бороновой кислоты и 623 мг (3,43 ммоль) Сu(ОАс)2 вносили в колбу Эрленмеера объемом 100 мл. Суспензию интенсивно перемешивали при температуре окружающей среды, колбу Эрленмеера оставляли открытой на воздухе. Через 4 ч 30 мин реакционную смесь разводили дополнительно при помощи 50 мл CH2Cl2 и суспензию фильтровали. Фильтрат упаривали насухо и остаток дважды хроматографировали на колонке диоксида кремния, последовательно элюируя CH2Cl2/МеОН (98/2) при осуществлении первого хроматографирова-5 011212 ния и CH2Cl2/ацетоном (95/5) при осуществлении второго хроматографирования, получая указанное в заглавии соединение. Точка плавления: 182-184 С. Элементный микроанализ: Пример 11. 3-[4-(2-Фторэтил)-1,1-диоксидо-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ил]окси-N'гидроксибензолкарбоксимидамид. Стадия А. 3-[4-(2-Фторэтил)-1,1-диоксидо-4H-1,2,4-бензотиадиазин-7-ил]оксибензнитрил. Осуществляли методику, описанную в примере 1, исходя из соединения, полученного на вышеописанной стадии А получения 2, и 3-цианофенилбороновой кислоты и увеличивая время реакции до 48 ч. Точка плавления: 202-208 С. Стадия В. 3-[4-(2-Фторэтил-1,1-диоксидо-4H-1,2,4-бензотиадиазин-7-ил]окси-N'-гидроксибензолкарбоксимидамид. 770 мкл (5,52 ммоль) триэтиламина добавляли к раствору гидрохлорида гидроксиламина (384 мг,5,52 ммоль) в 1,8 мл ДМСО и суспензию перемешивали в течение 20 мин при температуре окружающей среды. Осадок отфильтровывали и фильтрат концентрировали в вакууме. К полученному фильтрату добавляли 225 мг (0,921 ммоль) соединения с вышеописанной стадии А и раствор перемешивали при 75 С в течение 4 ч. Реакционную смесь охлаждали до температуры окружающей среды и реакционную смесь осаждали из воды. Получали белую, нефильтрирующуюся вязкую пасту, которую отделяли от водной фазы путем простого декантирования. Смолу растирали в порошок в этаноле до тех пор, пока происходила кристаллизация. Твердое вещество отфильтровывали, получая указанное в заглавии соединение. Точка плавления: 181-183 С. Стадия С. 3-[4-(2-Фторэтил)-1,1-диоксидо-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ил]-окси-N'гидроксибензолкарбоксимидамид. 10 мг (0,258 ммоль) NaBH4 добавляли к суспензии соединения, полученного на стадии В (75 мг,0,198 ммоль) в 1 мл этанола. Суспензию перемешивали в течение 30 мин при температуре окружающей среды и затем охлаждали на ледяной бане. Реакционную смесь нейтрализовали путем добавления 1 н.HCl и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором NaCl, высушивали (MgSO4) и упаривали в вакууме. Остаток после упаривания кристаллизовали из CH2Cl2. Тре-7 011212 буемое соединение выделяли путем фильтрации. Точка плавления: 160-163 С. Пример 12. 3-[4-(2-Фторэтил)-1,1-диоксидо-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ил]окси-Nметилбензамид. Осуществляли методику, описанную в примере 1, исходя из соединения, синтезированного в получении 2, и 3-[(метиламино)карбонил]фенилбороновой кислоты. Точка плавления: 194-196 С. Элементный микроанализ: Фармакологическое исследование соединений по изобретению Исследование возбуждающих токов, вызванных АМРА, на ооцитах лягушки. а - Способ. Получали мРНК из коры головного мозга самцов крыс Wistar при помощи способа с использованием тиоцианата гуанидиния/фенола/хлороформа. Выделяли поли-(А+) мРНК путем хроматографии на олиго-dT целлюлозе и вводили в дозе 50 нг на ооцит. Ооциты инкубировали 2-3 дня при 18 С, чтобы позволить проявиться экспрессии рецепторов и затем хранили при 8-10 С. Электрофизиологическую регистрацию осуществляли в камере Plexiglass при 20-24 С в среде OR2 (J. Exp. Zool., 1973, 184, 321-334) при помощи 2-электродного "voltage-clamp" метода, третий электрод, помещенный в ванну, был контрольным, как описано в ссылке. Все соединения применяли при помощи инкубационной среды и электрический ток измеряли в конце периода введения. АМРА использовали в концентрации 10 мкМ. Для каждого исследуемого соединения определяли концентрацию, которая вызывает двукратное увеличение (ЕС 2 Х) или пятикратное увеличение (ЕС 5 Х) интенсивности тока, вызванного одним АМРА (5-50 нА). б - Результаты. Соединения по изобретению в значительной степени усиливают возбуждающие действия АМРА и их активность существенно выше по сравнению с активностью сравнительных соединений. Например, соединение из примера 1 обеспечивает ЕС 2 Х при концентрации 0,04 мкМ. Фармацевтическая композицияR1 представляет собой линейную или разветвленную C1-С 6-алкильную группу, замещенную одним или несколькими атомами галогена,R2 представляет собой атом водорода,R3 представляет собой незамещенную фенильную группу или фенильную группу, замещенную группой, выбранной из линейного или разветвленного C1-С 6-алкокси; циано; гидроксиамидиногруппы; аминокарбонила (необязательно замещенного линейной или разветвленной C1-С 6-алкильной группой);C1-С 6-алкилсульфониламино и линейного или разветвленного C1-С 6-алкила, замещенного группой, выбранной из NR4R5, гдеR4 представляет собой S(O)pR8 или COR9 группу,R5 представляет собой атом водорода или линейную или разветвленную C1-С 6-алкильную группу, аR8 и R9, которые могут быть одинаковыми или разными, каждый представляет собой линейную или разветвленную C1-С 6-алкильную группу,р обозначает 2,их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 2. Соединения формулы (I) по п.1, где R1 представляет собой галоэтильную группу. 3. Соединения формулы (I) по п.1, где R3 представляет собой незамещенную фенильную группу. 4. Соединения формулы (I) по п.1, где R3 представляет собой фенильную группу, замещенную гидроксиамидиногруппой, алкоксигруппой, алкилсульфониламиногруппой или алкильной группой, замещенной NH(SO)pR8 или NHCOR9 группой. 5. Соединения формулы (I) по п.1, которые представляют собойN-(4-[4-(2-хлорэтил)-1,1-диоксидо-3,4-дигидро-2H-1,2,4-бензотиадиазин-7 ил]оксибензил)метансульфонамид,и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 6. Способ получения соединений формулы (I), определенных в п.1, заключающийся в том, что в качестве исходного вещества используют соединение формулы (II) где R2 имеет значение, указанное для формулы (I),с которым конденсируют в щелочной среде линейный или разветвленный C1-C6-галоалкил, несущий гидроксигруппу,после этого его превращают в соответствующее галогенированное соединение с получением соединения формулы (III) где R1 и R2 имеют значения, приведенные для формулы (I),которое подвергают реакции деметилирования в присутствии BBr3 или BF3 с получением соединения формулы (IV) где R1 и R2 имеют значения, указанные выше,с которым конденсируют в присутствии Cu(OAc)2 соединение бороновой кислоты формулы (V) где R3 имеет значение, указанное для формулы (I),с получением соединения формулы (VI) где R1, R2 и R3 имеют значения, указанные выше,которое подвергают восстановлению посредством NaBH4 с получением соединения формулы (I)-9 011212 где R1, R2 и R3 имеют значения, указанные выше,или соединение формулы (III) подвергают восстановлению в присутствии NaBH4 с получением соединения формулы (VII) где R1 и R2 имеют значения, указанные выше,которое подвергают реакции деметилирования в присутствии BBr3 или BF3 с получением соединения формулы (VIII) где R1 и R2 имеют значения, указанные выше,с которым конденсируют в присутствии Cu(OAc)2 соединение бороновой кислоты формулы (V), как определено выше, с получением соединения формулы (I),где соединения формулы (I) очищают, при необходимости, в соответствии с обычным способом очистки, разделяют, если это является подходящим, на их изомеры в соответствии с обычным способом разделения и превращают, если это является желательным, в их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 7. Соединения формулы (VIII), определенные в п.6 где R1 и R2 имеют значения, указанные в п.6, предназначенные для использования в качестве промежуточных продуктов для синтеза соединений формулы (I). 8. Соединения формулы (IX), частный случай соединений формулы (VIII) по п.8 в которой X представляет собой атом фтора, хлора, брома или йода, предназначенные для использования в качестве промежуточных продуктов для синтеза соединений формулы (I). 9. Фармацевтическая композиция, обладающая активностью модуляторов AMPA, содержащая в качестве активного компонента соединение по любому из пп.1-5, 7 и 8 в сочетании с одним или несколькими инертными, нетоксичными, фармацевтически приемлемыми наполнителями или носителями. 10. Фармацевтическая композиция по п.9, предназначенная для использования в качестве лекарственного средства с модулирующим АМРА действием.
МПК / Метки
МПК: A61K 31/549, A61P 25/28, C07D 285/24
Метки: содержат, которые, способ, композиции, фармацевтические, бензотиадиазина, новые, соединения, получения
Код ссылки
<a href="https://eas.patents.su/11-11212-novye-soedineniya-benzotiadiazina-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-kotorye-ih-soderzhat.html" rel="bookmark" title="База патентов Евразийского Союза">Новые соединения бензотиадиазина, способ их получения и фармацевтические композиции, которые их содержат</a>
Предыдущий патент: 7-фенилалкилзамещённые 2-хинолиноны и 2-хиноксалиноны в качестве ингибиторов поли(адф-рибоза)полимеразы
Следующий патент: Способ индуцирования овуляции с использованием ингибитора изоформы фосфодиэстеразы 4 (pde4)
Случайный патент: Производное 1,2,3,4-тетрагидрохинолина, подходящее для лечения диабета















