Стимуляция срт -1 как средство уменьшения веса
Номер патента: 7029
Опубликовано: 30.06.2006
Авторы: Лендри Лесли Э., Тупари Джаган Н., Роннетт Гэбриел, Кухаджда Фрэнсис П.
Формула / Реферат
1. Способ индукции потери веса, включающий введение агента, стимулирующего активность карнитин-пальмитоил-трансферазы-1 (СРТ-1).
2. Способ стабилизации веса, включающий систематическое введение агента, стимулирующего активность СРТ-1, в количестве, которое значительно не ингибирует FAS.
3. Способ скрининга агента, индуцирующего потерю веса, включает выяснение вопроса, стимулируется ли СРТ-1 активность агентом, потенциально вызывающим потерю веса; и отбор агента, стимулирующего активность СРТ-1.
4. Терапевтическая композиция, включающая агент, стимулирующий активность СРТ-1 и L-карнитин.
5. Пищевая композиция, включающая питательно достаточные количества жиров, углеводов и аминокислот, указанная композиция далее включает L-карнитин и антагонист ингибирования СРТ-1 малонил-коферментом А.
Текст
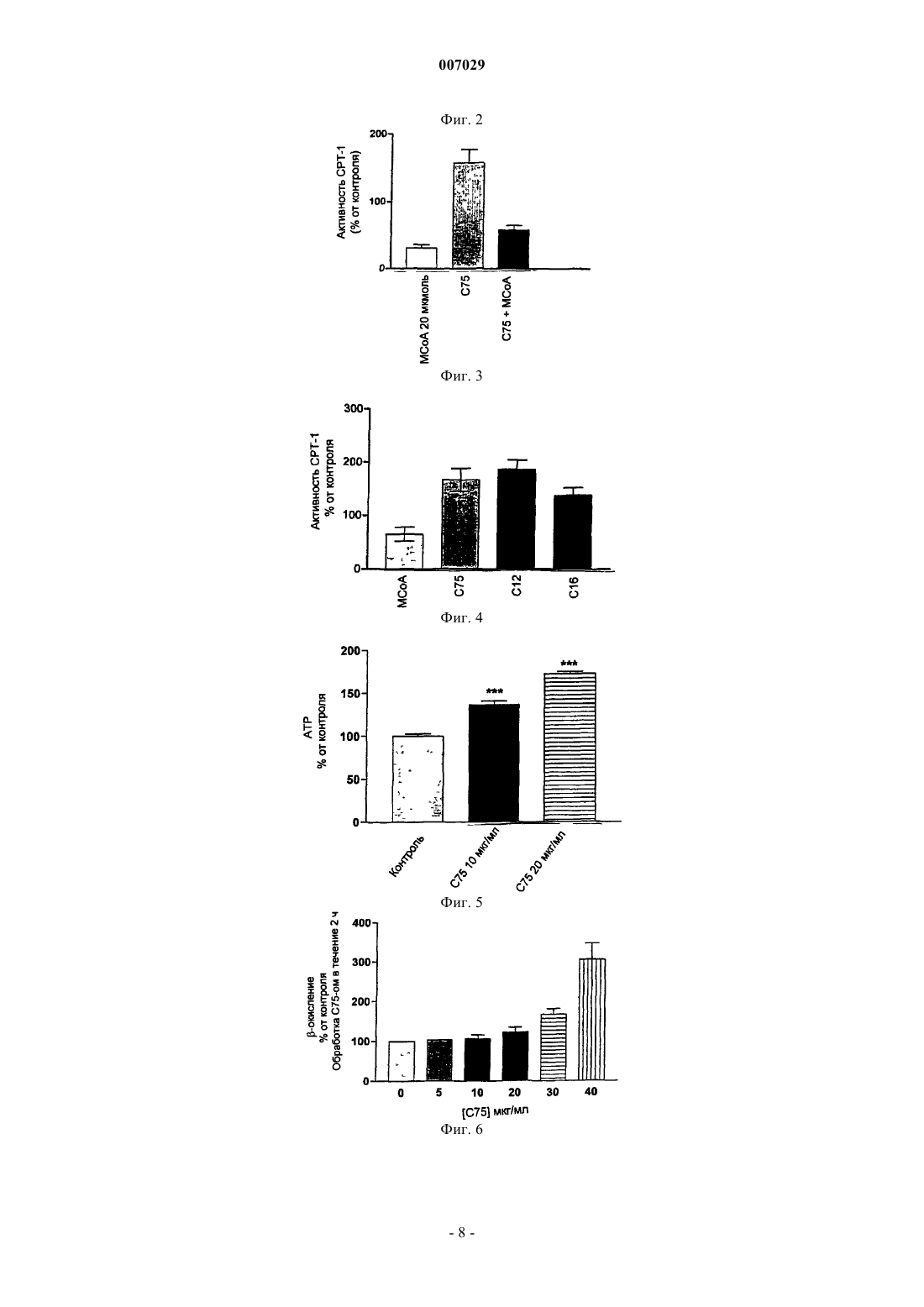
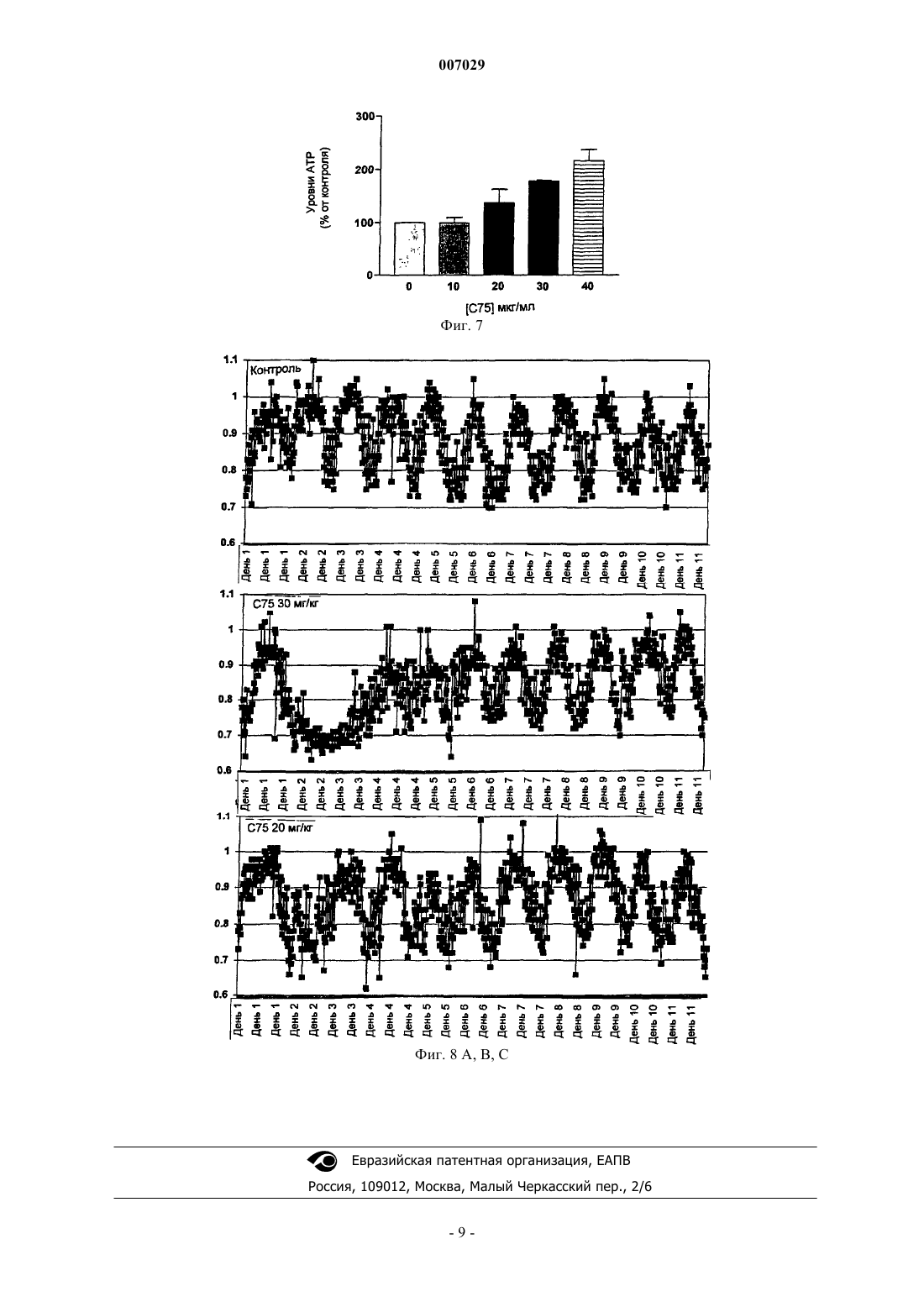
007029 Предпосылки Область изобретения Это изобретение посвящено способу развития лекарственных средств, которые, путем фармакологического стимулирования СРТ-1, выборочно усиливают окисление жирных кислот, способствуют производству энергии и уменьшают тучность, сохраняя уменьшенный вес. Обзор предпосылок данного изобретения Лечение грудных раковых MCF-7 клеток человека церуленином in vitro значительно ингибирует окисление жирных кислот, вероятно, через увеличение уровней малонил-кофермента A (Loftus, и другие,(2000) Science, 288:2379-2381). С 75 - член семейства -метиленбутиролактонов, являющихся известными ингибиторами синтазы жирных кислот (FAS) (Kuhajda, и другие, (2000) Proc. Natl. Acad. Sci. USA,97:3450-3454). Лечение мышей при помощи С 75 ведет к ингибированию синтеза жирных кислот в печени и к высоким уровням малонил-кофермента A (Loftus, и другие, (2000); Pizer, и другие, (2000) CancerRes., 60:213-218). В мозге С 75 уменьшает экспрессию гипоталамического нейропептида-Y (NPY) и ведет к обратимому истощению (Loftus, и другие, 2000). В условиях лечения подопытных мышей in vivo при помощи С 75 наблюдалась существенная потеря жира в печени и периферийных тканях, несмотря на повышенные уровни в печени малонил-кофермента А (Loftus, и другие, 2000). Малонил-кофермент А - мощный ингибитор окисления жирных кислот, который действует как ингибитор карнитин-пальмитоил-трансферазы-1 (СРТ-1) (Witters, и другие, (1992) J. Biol. Chem., 267:28642867). СРТ-1 позволяет длинноцепным ацетил-коферментам А проникнуть в митохондрию с целью окисления жирных кислот. При лечении ингибиторами FAS генетически тучные и полученные посредством диеты тучные мыши селективно и существенно теряют жировую ткань, несмотря на индуцированныеFAS-ом высокие уровни малонил-кофермента А. Так как малонил-кофермент А является мощным ингибитором окисления жирных кислот, который действует как ингибитор карнитин-пальмитоилтрансферазы-1 (СРТ-1), то селективная и существенная потеря жировой ткани была неожиданной. Вместо этого, из-за индуцированного С 75-ом истощения, следовало ожидать, что высокие системные уровни малонил-кофермента А будут ингибировать окисление жирных кислот, ведущее к селективной потере истощенной массы. Резюме изобретения Целью данного изобретения является создание способов и композиций для стимулирования потери веса и поддержания оптимального веса, которые не требуют ингибирования синтеза жирных кислот. Эти и другие цели достигнуты посредством следующих способов осуществления данного изобретения. В одном из осуществлений предлагается способ потери веса, который включает введение пациенту,подвергающемуся лечению, агента, стимулирующего активность карнитин-пальмитоил-трансферазы-1(СРТ-1). В предпочтительном способе агент вводится в количестве, достаточном для усиления окисления жирных кислот. В другом предпочтительном способе агент вводится в количестве, достаточном для противодействования ингибированию СРТ-1 малонил-коферментом А. Еще в одном предпочтительном способе агент вводится в количестве, достаточном для повышения уровня малонил-кофермента А; еще в другом предпочтительном способе введением агента уровень малонил-кофермента А существенно не повышается. Как предполагается, существенное повышение уровня малонил-кофермента А эквивалентно приблизительно половине значения Ki для ингибирования СРТ-1 малонил-коферментом А. Еще в одном предпочтительном способе агент, который стимулирует активность СРТ-1, ингибирует также и синтазу жирных кислот (FAS). В альтернативном способе FAS значительно не ингибируется. Согласно приведенным здесь данным указанное незначительное ингибирование меньше чем 15%, предпочтительно меньше чем 10% и более предпочтительно меньше чем 5%. Методы для определения активности FAS описаны в патенте США 5,981,575, который включен здесь в виде ссылки. В предпочтительных вышеупомянутых способах осуществления агент, который стимулирует активность СРТ-1, является соединением формулы(а) предельных линейных или разветвленных алкильных групп, состоящих из 3-18 углеродных атомов,(b) непредельных линейных или разветвленных алкильных групп, состоящих из 3-18 углеродных атомов,где R1 и R2 одинаковы или различны и представляют собой Н, СН 3, С 2 Н 5, С 3 Н 7, С 4 Н 9, СF3, ОСН 3, F, Cl или Вr;Z представляет собой СН 2, О, NH или S;i имеет значение от 1 до 5;j имеет значение от 0 до 10; к имеет значение от 1 до 10;m имеет значение от 1 до 13;n имеет значение от 1 до 15. В другом осуществлении это изобретение предоставляет способ стабилизации веса, включающий систематическое введение агента, стимулирующего активность СРТ-1, в количестве, которое значительно не ингибирует FAS. В предпочтительном способе агент вводится в количестве, достаточном для усиления окисления жирных кислот. В другом предпочтительном способе агент вводится в количестве, достаточном для противодействия ингибированию СРТ-1 малонил-коферментом А. Еще в одном предпочтительном способе агент вводится в количестве, достаточном для повышения уровня малонил-кофермента А; еще в другом предпочтительном способе введением агента уровень малонил-кофермента А существенно не повышается. Как предполагается, существенное повышение уровня малонил-кофермента А эквивалентно приблизительно половине значения Ki для ингибирования СРТ-1 малонил-коферментом А. Еще в одном осуществлении это изобретение предоставляет способ скрининга агентов, вызывающих потерю веса, который включает также и выяснение вопроса, стимулирует ли активность СРТ-1 агент, потенциально вызывающий потерю веса, и отбор агента, стимулирующего активность СРТ-1. Предпочтительно этот способ далее включает определение, является ли агент, потенциально вызывающий потерю веса, антагонистом ингибирования СРТ-1, обусловленного малонил-коферментом А, и от-2 007029 бор агентов, потенциально вызывающих потерю веса, которые устраняют ингибирование СРТ-1, обусловленное малонил-коферментом А. Еще в одном осуществлении это изобретение предоставляет терапевтическую композицию, включающую агент, который стимулирует активность СРТ-1 и L-карнитин. Предпочтительно терапевтическая композиция включает антагонист ингибирования СРТ-1 малонил-коферментом А. В другом осуществлении это изобретение предоставляет пищевую композицию, включающую питательно достаточные количества жиров, углеводов и аминокислот; указанная композиция далее включает антагонист ингибирования СРТ-1 малонил-коферментом А и L-карнитина. В одном из способов пищевая композиция приспособлена для парентерального введения. Чтобы исследовать механизм действия, ведущего к парадоксальному сокращению жирной печени,при регулировании высоких уровней в печени малонил-кофермента А во время лечения С 75-ом было изучено влияние С 75 на активность СРТ-1. Неожиданно выяснилось, что С 75 и родственные ему соединения одновременно стимулируют активность СРТ-1 и окисление жирных кислот in vitro, a FAS - ингибируют. В дополнение к его полной аллостерической активации СРТ-1 С 75 снимает ингибирующее влияние малонил-кофермента А на активность СРТ-1 in vitro. В результате усиленного окисления жирных кислот С 75 увеличивал клеточные уровни АТР. Для изучения влияния С 75 на окисление жирных кислот in vivo была использована калориметрия целого животного с целью измерения коэффициента газообмена (RER) в мышах, подвергавшихся лечению С 75. После лечения С 75 в течение 2 ч RER снизился в пределах 0,7, что указывало на окисление жирных кислот. Эта величина снижения RER была подобна эффекту изъятия пищи у животных, вскормленных мышиной едой ad libitum. Эти исследования показывают, что, несмотря на высокие уровни малонилкофермента А в печени, животные, подвергавшиеся лечению С 75, свободно окисляют жирные кислоты. Эти данные позволяют предполагать, что С 75 блокирует ингибирующее действие малонилкофермента А на активность СРТ-1 in vivo, что ведет к сокращению жировой ткани печени и жировой массы при ингибировании FAS. Это изобретение описывает способ создания лекарственных средств,которые селективно уменьшают тучность, сохраняя при этом уменьшенный вес путем фармакологического стимулирования активности СРТ-1. Краткое описание фигур Фиг. 1 показывает влияние С 75 на окисление жирных кислот в клетках MCF-7 по сравнению с влиянием этомоксира. Фиг. 2 показывает зависимую от концентрации С 75 стимуляцию активности СРТ-1 и ингибирование этой активности малонил-коферментом А. Фиг. 3 показывает обратимую стимуляцию СРТ-1 С 75-ом. Фиг. 4 показывает стимуляцию СРТ-1 различными аналогами С 75. Фиг. 5 показывает зависимое от концентрации С 75 повышение концентрации клеточных уровней АТР в клетках MCF-7. Фиг. 6 показывает зависимую от концентрации С 75 стимуляцию окисления жирных кислот в адипоцитах мыши. Фиг. 7 показывает зависимое от концентрации С 75 повышение клеточных уровней АТР в адипоцитах мыши. Фиг. 8 показывает коэффициент газообмена (RER), измеренный непрямой калориметрией для мышей в отсутствие (А) и в присутствии (В, С) С 75. Детальное описание предпочтительных осуществлений Было показано, что ингибирование синтазы жирных кислот (FAS) in vivo вызывает быструю и основательную потерю веса. Как церуленин, естественный продукт, так и С-75, синтетическая маленькая молекула, вызывают подобную потерю веса при их введении крысам интрацеребровентрикулярно (i.c.v). В случае систематического введения (например, интраперитонеально), С-75 вызывает основательную потерю веса, даже более сильную потерю веса, чем у морившихся голодом животных. Согласно этим данным С-75 оказывает более сильный периферийный (не-CNS) эффект на потерю веса, чем церуленин. При изучении механизма действия этого глубокого периферийного эффекта С-75 изобретатели недавно обнаружили, что в дополнение к ингибированию FAS С-75 и его семейство -метиленбутиролактонов непосредственно стимулируют карнитин-пальмитоил-трансферазу-1 (СРТ-1), что ведет к усиленному митохондриальному окислению жирных кислот. Церуленин, через генерирование высоких уровней малонил-кофермента А в результате ингибирования FAS, напротив, ведет к снижению активности СРТ-1 и уменьшению окисления жирных кислот. Обработка MCF-7 клеток С 75-ом in vitro стимулировала активность СРТ-1 на 150-160%. Наблюдалось также сопутствующее усиление окисления жирных кислот. Среди аналогов С 75 длина углеродной цепи С 6-С 16 была оптимальна для стимулирующей активности СРТ-1. В присутствии С 75 малонилкофермент А больше не способен ингибировать активность СРТ-1; предполагается, что в дополнение к ее стимулирующему влиянию С 75 также предотвращает ингибирование СРТ-1 малонил-коферментом А. Не обнаружено никакого ковалентного взаимодействия между СРТ-1 и С 75.-3 007029 Таким образом, периферийный (не-CNS) эффект потери веса С-75 происходит, по крайней мере частично, в результате стимуляции СРТ-1 и усиления окисления жирных кислот и сопутствующего ингибирования синтеза жирных кислот. Эти данные идентифицируют семейство -метиленбутиролактонов как миметических малонату или малонил-коферменту А агентов и СРТ-1 как мишень для лекарственных препаратов, вызывающих потерю веса. Более широко, эти данные наводят на мысль, что могут быть разработаны и синтезированы другие препараты, миметические малонату или малонил-коферменту А, которые будут функционировать как эффективные агенты для потери веса. Данные демонстрируют, что С-75 и его семейство -метиленбутиролактонов непосредственно взаимодействуют с СРТ-1, вызывая усиление ферментной активности СРТ-1 и окисление жирных кислот. Химическая структура С 75 и его многочисленных аналогов, так же как и методы синтеза этих аналогов, описаны в патенте США 5,981,575, который включен сюда в виде ссылки. Стимулирующий эффект С 75 связан с длиной насыщенной углеродной боковой цепи, с оптимальной длиной 6-18 углеродных атомов. В аспекте обсуждения данного изобретения, С 75 - агент-прототип для стимуляции СРТ-1; если специально не указано в контексте, ссылка на С 75 в дальнейшем включает и другие подходящие агенты, которые стимулируют активность СРТ-1. В дополнение к его прямому эффекту на СРТ-1 С-75 снимает ингибирующее влияние малонилкофермента А на СРТ-1. Хотя С 75 показывает кинетические особенности ингибитора, который медленно связывается с очищенным FAS (1), его взаимодействие с СРТ-1 кажется быстрым и конкурентоспособным. Таким образом, стимулирующий эффект С 75 на окисление жирных кислот может быть результатом прямого стимулирования им активности СРТ-1, или его вмешательства в обусловленное малонил-коферментом А ингибирование СРТ-1, или обоих. Интересно, что эффекты С 75 не ограничены крысиным СРТ-1,поскольку человеческий СРТ-1 также подвергается подобному воздействию. Вследствие усиления окисления жирных кислот С 75, увеличивались также уровни АТР как в человеческих, так и в крысиных клетках. Влияние С 75 на метаболизм жирных кислот in vivo отражает изменения, зарегистрированные на клеточном уровне. Лечение С 75 тощих мышей вело к основательному и быстрому усилению окисления жирных кислот, несмотря на высокие уровни малонил-кофермента А, которые были обеспечены С 75 invivo. Таким образом, оказывается, что С 75 и его семейство -метиленбутиролактонов действуют как конкурентоспособные агонисты СРТ-1. Эта активность С 75 как агониста, кажется, компенсирует ингибирующее влияние малонил-кофермента А, оказываемое на тот же самый фермент. Индуцированное С 75 усиленное окисление жирных кислот - важный механизм, объясняющий отмеченное уменьшение тучности, наблюдаемое при лечении мышей С 75-ом. В общем, данное изобретение описывает способ разработки терапевтических средств, которые селективно усиливают окисление жирных кислот, увеличивают производство энергии и уменьшают тучность при сохранении уменьшенного веса путем фармакологического стимулирования активности СРТ-1. Формулирование терапевтических составов, содержащих С 75 и/или другие агенты, которые стимулируют СРТ-1, и разработка способов введения этих агентов зависят от квалификации, особенно на фоне содержания патента США 5,981,575, который включен сюда в виде ссылки. Использование агентов, стимулирующих СРТ-1 с целью увеличения производства энергии, путем введения агентов совместно с жирными кислотами или соединениями, содержащими остатки жирных кислот, также зависит от квалификации, особенно из-за пищевых композиций, раскрытых в патенте США 4,434,160, который включен сюда в виде ссылки. Примеры Для облегчения более полного понимания данного изобретения ниже приводится ряд примеров. Однако возможности данного изобретения не ограничены конкрентыми осуществлениями, раскрытыми в этих примерах, которые приведены лишь для иллюстративных целей. Пример 1. Парадоксальные эффекты ингибирования синтазы жирных кислот. Как ингибитор FAS, церуленин увеличивает количество малонил-кофермента А в клетках MCF-7(3). Вследствие основательного увеличения малонил-кофермента А, церуленин вызывает ингибирование окисления жирных кислот через ингибирование СРТ-1 малонил-коферментом A (Thupari, и другие,(2001) Biochem. Biophys. Res. Comm., 285:217-223). Предварительно показано, что обработка MCF-7 клеток С 75-ом вызывает 5-кратное увеличение малонил-кофермента А через ингибирование С 75-ом синтазы жирных кислот (FAS) (3). Влияние С-75 на окисление жирных кислот было изучено следующим образом. Клетки линии MCF-7 рака молочной железы человека были получены от Американской Коллекции Типов Культур. 1 х 106 клеток MCF-7 были культивированы в Т-25 колбах в трех экземплярах и инкубированы в течение ночи при 37 С. После этого были добавлены лекарства, приготовленные путем разбавления основного раствора, начиная от концентрации 5 мг/мл, в DMSO. Спустя 2 ч среда с лекарствами была удалена и клетки были преинкубированы на 30 мин с 1,5 мл следующего буфера: 114 ммоль NaCl,4,7 ммоль КСl, 1,2 ммоль КН 2 РO4, 1,2 ммоль MgSO4, глюкоза 11 ммоль. После прединкубации добавлялись 200 мкл буфера для анализа, который содержал: 114 ммоль NaCl, 4,7 ммоль КСl, 1,2 ммоль КН 2 РO4,1,2 ммоль MgSO4, глюкозу 11 ммоль, 2,5 ммоль пальмитата (содержащего 10 Сi [l-14C] пальмитата) связанного с альбумином, 0,8 ммоль L-карнитина, и далее клетки были инкубированы при 37 С в течение 2 ч.-4 007029 После инкубации для поглощения выделившегося 14 СО 2 в центральную ячейку добавлялись 400 мкл гидрохлорида бензтиония. Реакция немедленно была остановлена путем добавления к клеткам 500 мкл 7% хлорной кислоты. Далее колбы с ячейками были инкубированы в течение 2 ч при 37 С, после чего гидрохлорид бензтиония был удален и была измерена радиоактивность 14C. Контрольные пробы были приготовлены путем добавления 500 мкл 7% хлорной кислоты к клеткам до инкубации последних с буфером для анализа в течение 2 ч. За 2 ч до того, как клетки были обработаны С 75, было измерено окисление жирных кислот; оказалось,что по сравнению с контролем обработка С 75 усиливалa окисление жирных кислот на 156% (см. фиг. 1; р=0,0012, критерий на основе двойной t-выборки, призма 3.0). Напротив, этомоксир, известный ингибитор окисления жирных кислот и неконкурентный ингибитор СРТ-1, уменьшал окисление жирных кислот на 32% по сравнению с контролем (р=0,0006, критерий на основе двойной t-выборки, призма 3.0). Повторная обработка MCF-7 клеток С-75-ом приводила к усилению окисления жирных кислот, начиная с доз в 5-20 мкг/мл. Парадоксально, но несмотря на увеличение малонил-кофермента А, вызванное аналогичным образом церуленином, обработка С 75 увеличивала, а не уменьшала окисление жирных кислот в клеткахMCF-7. Это указывает на прямое влияние С 75 на карнитин-пальмитоил-трансферазу-1 (СРТ-1). Пример 2. С 75 стимулирует активность СРТ-1 человека. Активность СРТ-1 в клетках MCF-7 была определена согласно следующей известной процедуре: клетки MCF-7 были культивированы в DMEM с 10%-ой эмбриональной бычьей сывороткой, 106 клеток на планшетах с 24 ячейками в трех экземплярах. После инкубации в течение ночи при 37 С среда была удалена и заменена 700 мкл среды испытания, состоящей из: имидазола 50 мкмоль, КСl 70 мкмоль, сахарозы 80 мкмоль, EGTA 1 мкмоль, MgCl2 2 мкмоль, DTT 1 мкмоль, KCN 1 мкмоль, АТР 1 мкмоль, свободного от жирных кислот 0,1%-ного бычьего сывороточного альбумина, 70 мкмоль малонилкофермента А, 0,25 Ci [метил-14 С] L-карнитина, 40 мкг дигитонина с 20 мкмоль малонил-кофермента А или без него. После инкубации в течение 6 мин при 37 С реакция была остановлена путем добавления 500 мкл охлажденной льдом хлорной кислоты. Далее клетки были собраны и центрифугированы при 13.000 хg в течение 5 мин. Осадок был отмыт 500 мкл охлажденной льдом хлорной кислоты и снова центрифугирован. Полученный осадок был повторно суспендирован в 800 мкл d H2O и экстрагирован 150 мкл бутанола. Радиоактивность бутаноловой фазы была измерена на жидкостном сцинтилляционном счетчике и представляет собой радиоактивность деривата ацилкарнитина. Клетки MCF-7 были обработаны 10 или 20 мкг/мл С 75 в течение 1 ч перед определением активности СРТ-1. Определение было выполнено с использованием С 75 и при указанных концентрациях малонил-кофермента А ("М" указывает концентрацию малонил-кофермента А в 20 мкмоль). Обработка одним малонил-коферментом А вызывала 46%-ное уменьшение активности СРТ-1, подобное предыдущему эксперименту (см. фиг. 2; р=0,02, критерий на основе двойной t-выборки, призма 3.0). Уровень ингибирования активности СРТ-1 малонил-коферментом А в клетках MCF-7 совместим с активностью изоформы СРТ-1 печени. Ki малонил-кофермента А для изоформы СРТ-1 печени равняется 7 мкмоль, в то время как Kj для изоформы СРТ-1 мышцы равняется 0,07 мкмоль. Таким образом, клетки MCF-7 предпочтительно выражают изоформу СРТ-1 печени (что согласуется с иммуноблот-анализом). Не было статистически существенного различия в активности СРТ-1 между клетками, обработанными С 75 или С 75 и малонил-коферментом А (фиг. 2). Таким образом, в присутствии С 75 малонилкофермент А терял свое ингибирующее влияние на СРТ-1; напротив, стимуляция СРТ-1 С 75 происходила независимо от присутствия малонил-кофермента А. Таким образом, в присутствии С 75 нормальная ингибирующая активность малонил-кофермента А теряется. Ингибирование активности СРТ-1 малонилкоферментом А показало, что С 75 и родственные ему соединения активизировали СРТ-1, но не СРТ-2,активность которого не ингибируется малонил-коферментом А. В последующем эксперименте (данные на фиг. 3) клетки MCF-7 не были обработаны (левый столб) или были обработаны 20 мкг/мл С 75 в течение 1 ч до того, как была измерена активность СРТ-1 (средний и правый столбы). В течение 6 мин определения СРТ-1 буфер для анализа был удален от С 75 и заменен буфером (средний столб), или был добавлен 20 мкмоль малонил-кофермента А (левый и правый столбы). Обработка одним малонил-коферментом А во время анализа приводила к ингибированию СРТ-1 на 70%(левый столб) (р=0,0045, критерий на основе двойной t-выборки, призма 3.0). Обработка буфером для анализа без С 75, предшествующая обработке С 75, приводила к активности СРТ-1 в 158% от контроля(р=0,028, критерий на основе двойной t-выборки, призма 3.0); подобные результаты получаются, когда буфер для анализа содержит С 75 (см. вышеописанный эксперимент). Однако, когда С 75 удален из буфера для анализа и малонил-кофермент А заменен, стимулирующая активность С 75 теряется (правый столб). Таким образом, фактически С-75 ковалентно не связывается с СРТ-1-ом и, вероятно, является конкурентоспособным антагонистом малонил-кофермента А. На основе этих данных можно также предложить, что С-75 взаимодействует с СРТ-1 через сайт, связывающий малонил-кофермент А. Пример 3. Структура эффективных стимуляторов СРТ-1. Аналоги -метиленбутиролактонов, отличающиеся друг от друга только длиной их насыщенного углеродного хвоста, были получены согласно патенту США 5,981,575, который включен сюда в виде ссылки. С 75 имеет хвост с 8 углеродными атомами, С 12 и С 16 имеют хвосты с 12 и 16 углеродными-5 007029 атомами, соответственно. Клетки обрабатывались С 75 и аналогами С 75 в количестве 20 мкг/мл в течение 1 ч перед определением активности СРТ-1. Малонил-кофермент А добавлялся только к буферу для анализа реакции, так как целая клетка непроницаема для малонил-кофермента А. С 75, в дозе 20 мкг/мл,стимулировал активность СРТ-1 на 166% от контроля (см. фиг. 4; р=0,0092, критерий на основе двойнойt-выборки, призма 3.0). С 12 аналог стимулировал на 186% (р=0,0099, критерий на основе двойной tвыборки, призма 3.0), а С 16 аналог стимулировал на 138% от контроля (р=0,055, критерий на основе двойной t-выборки, призма 3.0). Малонил-кофермент А, внутриклеточный конкурентоспособный ингибитор СРТ-1, в концентрации 20 мкмоль, уменьшал активность СРТ-1 на 64% от контроля (р=0,023, критерий на основе двойной t-выборки, призма 3.0). Оптимальная длина углеродной цепи для активации СРТ-1 - между 6 и 16 углеродными атомами. Пример 4. Усиление окисления жирных кислот в результате стимуляции СРТ-1 приводит к образованию АТР. В клетках MCF-7 после их обработки С 75-ом вследствие усиления окисления жирных кислот повышался уровень АТР. 1 х 105 клеток MCF-7 были помещены на планшетах с 96 ячейками. Клетки обрабатывались С 75 или носителем. Спустя 2 ч АТР был измерен с помощью люциферазного теста с использованием Комплекта АТР Bioluminescence Kit CLS II (Roche) согласно прописи изготовителя. Планшеты анализировались на люминометре Perkin Elmer Wallac Victor2 1420. Обработка 10 мкг/мл и 20 мкг/мл С 75 приводила к существенному увеличению общего клеточного АТР (см. фиг. 5; р=0,0001; р 0,0001 сравнительно с контролем, критерий на основе двойной t-выборки, призма 3.0). Подобные результаты были получены после 1-часовой инкубации с С 75. Таким образом, производство клеточной энергии увеличилось в результате обусловленного С 75-ом усиления окисления жирных кислот. Пример 5. С 75 стимулирует активность СРТ-1 мышечной формы. Исследования по изучению влияния С 75 на метаболизм жирных кислот были расширены. Кроме раковых клеток, в этом аспекте были исследованы нормальные адипоциты. Были проведены подобные выполненным с клетками СРТ-1 эксперименты, в которых были использованы дифференцированные (не трансформированные) адипоциты NIH 3T3-L1 мыши. Клетки 3T3-L1 были получены от Американской Коллекции Типов Культур. Клетки были культивированы в DMEM с высоким содержанием глюкозы (4,5 г/л)(Gibco 12100-046), с 10%-ой эмбриональной сывороткой теленка и биотином (сигма В-4639) 0,008 г/л. Дифференцирование было начато спустя 3 дня после слияния клеток, когда стандартная среда культивирования была заменена средой дифференцирования. Среда дифференцирования содержала стандартную среду культивирования, к которой для достижения конечных концентраций добавлялись следующие компоненты: метилизобутилксантин (MIX) 0,5 мкмоль, дексаметазон (DEX) 1 мкмоль и инсулин 10 мкг/мл. Спустя 48 ч среда дифференцирования была заменена средой постдифференцирования, которая содержала инсулин в вышеупомянутой концентрации, без MIX и DEX. Дифференцированные клетки были готовы к использованию в экспериментах через 7-10 дней. С 75 усиливал активность СРТ-1 и метаболизм жирных кислот в клетках NIH 3T3-L1, дифференцированных в адипоциты. Через 1 неделю после дифференцирования клетки обрабатывались контрольным носителем или С 75 в течение 2 ч в дозах, обозначенных ниже. Активность СРТ-1, окисление жирных кислот и общий клеточный АТР измеряли, как описано в примерах 2, 1 и 4. С 75. Обработка 3T3-L1 адипоцитов С 75-ом вела к 377%-ому увеличению активности СРТ-1 выше контроля (р 0,0001, критерий на основе двойной t-выборки, призма 3.0). В результате повышения активности СРТ-1 С 75 в дозах 20 мкг/мл или выше значительно усиливал окисление жирных кислот (см. фиг. 6; 20 мкг/мл, р=0,007; 20 мкг/мл,р 0,0001; критерий на основе двойной t-выборки, призма 3.0). Кроме того, усиление окисления жирных кислот вело к значительному повышению уровней АТР при дозах С 75 20 мкг/мл или выше (см. фиг. 7; 20 мкг/мл, р=0,05; 30 мкг/мл, р 0,01; 40 мкг/мл, р 0,0001; критерий на основе двойной t-выборки, призма 3.0). По-видимому, индуцированное С 75 усиление окисления жирных кислот, при введении С 75 invivo, ответственно за отмеченное сокращение массы жировой ткани. Пример 6. In vivo стимуляция СРТ-1 сдвигает метаболизм в сторону окисления жирных кислот. В соответствии с эффектом С 75 на человеческий и крысиный СРТ-1, а также на метаболизм жирных кислот, С 75 вызывает глубокую и быструю стимуляцию окисления жирных кислот in vivo. Мыши были помещены в калориметре системы Охуmах (Охуmах Equal Flow System, Columbus Instruments, Columbus,ОН). Поглощение кислорода и образование СО 2 были измерены у 4 мышей путем одновременного использования косвенного калориметра. Измерения регистрировались каждые 15 мин по полному курсу экспериментов. Коэффициент газообмена (RER) был рассчитан с помощью компьютерной программы Охуmах версии 5.9 программного обеспечения. RER был определен, как отношение СО 2 к О 2, для любого данного интервала времени, независимо от того, было ли достигнуто равновесие или нет. Мышей содержали на воде и мышиной еде ad libitum. У контрольных мышей (фиг. 8 А) наблюдалась суточная вариация RER,указывающая на циклы кормления и отдыха животных. Значение RER 1 совпадает с окислением углеводов, а 0,7 указывает на окисление жирных кислот. Мыши были обработаны С 75 и помещены в калориметре Охуmах, где было зафиксировано быстрое уменьшение коэффициента газообмена (RER) 0,7 (фиг. 8 В). Обработка С 75 дозой 30 мг/кг разрушает-6 007029 суточный ритм у контрольных мышей, сопровождаясь быстрым снижением RER, что приводит к завершению окисления жирных кислот в течение приблизительно 2 ч. Точно так же при обработке С 75 дозой 20 мг/кг наблюдается аналогичная скорость снижения RER, но без длительного эффекта (фиг. 8 С). Важно, что скорость снижения RER была такая же, что и у голодающих животных (данные не показаны). Несмотря на повышенные уровни малонил-кофермента А, обусловленные С 75 in vivo, согласно измерениям RER, обработка С 75-ом вела к быстрому существенному увеличению окисления жирных кислот. Таким образом, обработанные С 75 животные были способны значительно уменьшить жировую массу и полностью изменить жирную печень, поддерживая процесс окисления жирных кислот, несмотря на высокие уровни малонил-кофермента А, который образуется при ингибировании FAS in vivo. Несмотря на то, что с целью ясности и понимания данное изобретение было описано в некоторых деталях посредством иллюстраций и примеров, очевидно, что в пределах приложенной формулы изобретения можно осуществить некоторые изменения и модификации. Эти модификации вышеуказанных способов с целью осуществления изобретения, которые являются очевидными для специалистов медиков,иммунологов, специалистов, занимающихся лечением гибридом, фармакологов, и/или родственных областей, включены в пределы представленной формулы изобретения. Все публикации и патентные заявки, упомянутые в этом описании, являются показательными на уровне навыка специалиста, имеющего отношение к данному изобретению. Все такие публикации и патентные заявки включены здесь таким образом, что каждая индивидуальная публикация или патентная заявка определенно и индивидуально обозначена для включения в виде ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ индукции потери веса, включающий введение агента, стимулирующего активность карнитин-пальмитоил-трансферазы-1 (СРТ-1). 2. Способ стабилизации веса, включающий систематическое введение агента, стимулирующего активность СРТ-1, в количестве, которое значительно не ингибирует FAS. 3. Способ скрининга агента, индуцирующего потерю веса, включает выяснение вопроса, стимулируется ли СРТ-1 активность агентом, потенциально вызывающим потерю веса; и отбор агента, стимулирующего активность СРТ-1. 4. Терапевтическая композиция, включающая агент, стимулирующий активность СРТ-1 и L-карнитин. 5. Пищевая композиция, включающая питательно достаточные количества жиров, углеводов и аминокислот, указанная композиция далее включает L-карнитин и антагонист ингибирования СРТ-1 малонил-коферментом А.
МПК / Метки
МПК: A61K 31/34, A61K 31/195
Метки: веса, стимуляция, уменьшения, средство, срт
Код ссылки
<a href="https://eas.patents.su/10-7029-stimulyaciya-srt-1-kak-sredstvo-umensheniya-vesa.html" rel="bookmark" title="База патентов Евразийского Союза">Стимуляция срт -1 как средство уменьшения веса</a>
Предыдущий патент: Метод определения степени метилирования специфических цитозинов в геномной днк в контексте последовательности 5′-cpg-3′
Следующий патент: Гонадотропины для фолликулогенеза
Случайный патент: Пробирка с механизмом открывания крышки