Композиции с пролонгированным высвобождением, содержащие производное 2-оксо-1-пирролидина
Формула / Реферат
1. Фармацевтическая композиция с замедленным высвобождением, включающая гранулят, который содержит активный ингредиент и который покрыт слоем с регулируемым высвобождением, причем активный ингредиент представляет собой производное 2-оксо-1-пирролидина формулы (I)
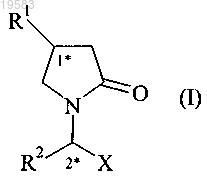
где R1 обозначает н-пропил или 2,2-дифторвинил,
R2 обозначает этил,
X обозначает -CONH2.
2. Фармацевтическая композиция по п.1, где содержание слоя с регулируемым высвобождением составляет от 1,0 до 60 мас.% в расчете на массу фармацевтической композиции.
3. Фармацевтическая композиция по п.1 или 2, где слой с регулируемым высвобождением содержит, по крайней мере, полимер, выбранный из сополимеров аммониоалкилметакрилата и этилакрилата, или сополимера этилакрилата и метилметакрилата, или этилцеллюлозы, или ацетат целлюлозы, в котором содержание ацетильных групп составляет от 32 до 44%, или их смеси.
4. Фармацевтическая композиция по п.3, где полимер с регулируемым высвобождением выбирается из сополимера аммониоалкилметакрилата и этилакрилата, средняя молекулярная масса которого составляет от 75000 до 200000 Да, а содержание остатков аммониоалкилметакрилата составляет от 6 до 14%, или из сополимера этилакрилата и метилметакрилата в молярном соотношении двух мономеров 2:1, средняя молекулярная масса которого составляет от 500000 до 1000000.
5. Фармацевтическая композиция по п.1, где слой с регулируемым высвобождением содержит, по крайней мере, эксципиент, такой как связующее, агент, уменьшающий липкость, пеногаситель, ароматизатор, пигмент, технологическая добавка, например пластификатор, эмульгатор или стабилизатор.
6. Фармацевтическая композиция по любому из пп.1-5, где гранулятом является активное ядро, которое включает активный ингредиент и по крайней мере один эксципиент.
7. Фармацевтическая композиция по п.6, где активное ядро характеризуется степенью сферичности от 0,5 до 1,0 и средний размер частиц активного ядра составляет от 75 до 1400 мкм.
8. Фармацевтическая композиция по любому из предшествующих пунктов, где гранулят покрыт промежуточным слоем.
9. Фармацевтическая композиция по любому из предшествующих пунктов, где гранулят покрыт слоем с регулируемым высвобождением и дополнительно на него нанесен конечный слой, который включает связующее, агент, уменьшающий липкость, пигменты и/или технологические добавки.
10. Фармацевтическая композиция по любому из предшествующих пунктов, в которую добавлена внешняя фаза, представляющая собой фармацевтически приемлемые эксципиенты.
Текст
В патенте фармацевтическая композиция, включающая в качестве активного ингредиента бриварацетам или селетрацетам, а также более подробно композиция с пролонгированным высвобождением, которая получена из гранул, содержащих активный ингредиент во внутреннем ядре указанной композиции. Изобретение относится к пероральной фармацевтической композиции производных 2-оксо-1 пирролидина, способу их получения и их терапевтического применения. В опубликованной заявке WO 01/62726 описаны производные 2-оксо-1-пирролидина и способы их получения. Прежде всего описано соединение, (2S)-2-[(4R)-2-оксо-4-пропилпирролидин-1-ил]бутанамид,известное международное непатентованное название - бриварацетам. В опубликованной заявке WO 2005/121082 описан способ получения производных 2-оксо-1 пирролидина и прежде всего способ получения (2S)-2-[(4S)-4-(2,2-дифторвинил)-2-оксопирролидин-1 ил]бутанамида, известное международное непатентованное название - селетрацетам. Следовательно, производные 2-оксо-1-пирролидина в настоящее время используются в фармацевтической промышленности. Бриварацетам проявляет эффективность при лечении эпилепсии. В ходе клинических испытаний оценивали эффективность и безопасность бриварацетама (5, 20 и 50 мг в сут) при дополнительном лечении взрослых пациентов, у которых парциальные судороги с вторичной генерализацией или без нее при эпилепсии не поддаются лечению. Бриварацетам также проявляет эффективность при лечении пациентов с постгерпетической невралгией. Селетрацетам проявляет эффективность при лечении эпилепсии. Проводили два испытания селетрацетама для лечения эпилепсии и оценивали эффективность и безопасность селетрацетама при дополнительном лечении взрослых пациентов, у которых парциальные судороги не поддаются лечению и которым в ходе испытаний вводили до трех противоэпилептических лекарственных средств. Таким образом, существует необходимость в композициях с пролонгированным высвобождением для введения некоторым пациентам. Преимущество композиции с пролонгированным высвобождением заключается в снижении различий между величинами Смакс и Смин в плазме и, следовательно, в снижении побочных действий. Кроме того, композиция с пролонгированным высвобождением повышает согласие пациентов с курсом лечения, так как при этом снижается частота введения. Существует также необходимость в такой композиции, в которую можно включать различные дозы активного ингредиента. Кроме того, необходимы композиции, которые могут легко проглатывать дети, а также некоторые взрослые пациенты старшего возраста. Прежде всего необходимы композиции с пролонгированным высвобождением, которые вводят один раз в день. В заявках WO 2006/088864 и US 2007/298098 описаны композиции с регулируемым высвобождением, которые доставляют леветирацетам, (S)-(-)этил-2-оксо-1-пирролидинацетамид, в пульсирующем режиме, содержащие первый компонент, включающий первое множество частиц леветирацетама, и второй компонент, включающий другое множество частиц леветирацетама, покрытых слоем с модифицированным высвобождением. Неожиданно было установлено, что режим замедленного высвобождения можно обеспечить с использованием частиц достаточно малого размера, а точный контроль высвобождения можно обеспечить за счет покрытия с регулируемым высвобождением. В одном объекте настоящего изобретения предлагается фармацевтическая композиция, которую можно вводить перорально и обеспечивать регулируемое высвобождение фармацевтически активных веществ таким образом, чтобы доза вводилась в виде нескольких суточных доз, в идеальном случае в виде одной суточной дозы, и при этом обеспечивалось терапевтическое действие в течение по крайней мере 16 ч после введения пациенту. Учитывая, что согласно биофармацевтической классификационной системе бриварацетам и селетрацетам относятся к классу BCS I, и чтобы обеспечить пролонгированное терапевтическое действие, уровень лекарственного средства в плазме после растворения in vitro (прибор USP 711 n2) в водном буферном растворе должен соответствовать высвобождению лекарственного средства не более 40% после растворения в течение 1 ч, 25-80% после растворения в течение 4 ч и не более 80% после растворения в течение 16 ч. Предпочтительный профиль составляет не более 35% после растворения в течение 1 ч, 3575% после растворения в течение 4 ч и не более 80% после растворения в течение 16 ч. Более предпочтительный профиль составляет не более 30% после растворения в течение 1 ч, 45-70% после растворения в течение 4 ч и не более 80% после растворения в течение 16 ч. Однако поскольку бриварацетам и селетрацетам характеризуются чрезвычайно высокой водорастворимостью (их растворимость превышает 500 мг/мл), представляет проблему замедлить их высвобождение до такой высокой степени, прежде всего, если используются немонолитные формы, так как общая площадь поверхности значительно возрастает. Для поддержания требуемой концентрации бриварацетама и селетрацетама в плазме не требуется введение высоких доз. Соответственно, настоящее изобретение относится к фармацевтической композиции, включающей гранулят, который содержит активный ингредиент и который покрыт слоем с регулируемым высвобождением, а активным ингредиентом является производное 2-оксо-1-пирролидина формулы (I) где R1 обозначает н-пропил или 2,2-дифторвинил,R2 обозначает этил,X обозначает -CONH2. Термин "активный ингредиент", использованный в данном контексте, обозначает вещество или лекарственное средство, которое оказывает терапевтическое действие. Этот термин может также обозначать смесь веществ, оказывающих терапевтическое действие. Количество активного ингредиента, присутствующего в фармацевтической композиции по изобретению, в значительной степени зависит от пациента, которому вводят данную композицию и от заболевания, подлежащего лечению. Соединения формулы (I) содержат по крайней мере два стереогенных центра в своей структуре, которые обозначены (1) и (2). Указанные стереогенные центры могут существовать в R или S конфигурации, указанные обозначения R и S соответствуют правилам, описанным в статье Pure. Appl. Chem.,T. 45, cc. 11-30 (1976). Наилучшие результаты были получены с использованием бриварацетама и селетрацетама. Соответственно, настоящее изобретение относится к фармацевтической композиции, включающей гранулят, который содержит активный ингредиент и который покрыт слоем с регулируемым высвобождением. Обычно массовое содержание слоя с регулируемым высвобождением составляет от 1,0% до 60% в расчете на массу фармацевтической композиции. Предпочтительно массовое содержание слоя с регулируемым высвобождением составляет от 2,0 до 50%. Более предпочтительно массовое содержание слоя с регулируемым высвобождением составляет от 5,0 до 40% в расчете на массу фармацевтической композиции. Согласно изобретению слой с регулируемым высвобождением включает по крайней мере полимер с регулируемым высвобождением. Полимер с регулируемым высвобождением обозначает полимер, который может контролировать скорость высвобождения активного ингредиента за счет его свойств растворимости/проницаемости в водной окружающей среде. Обычно полимер с регулируемым высвобождением включает сополимеры аммониоалкилметакрилата и этилакрилата аммония или сополимеры этилакрилата и метилметакрилата, или этилцеллюлозы,или ацетата целлюлозы, содержание ацетильных групп в которой составляет от 32 до 44%, или их смеси. Предпочтительно полимер с регулируемым высвобождением выбирают из сополимера аммониоалкилметакрилата и этилакрилата аммония, средняя молекулярная масса которого составляет от 75000 до 200000 Да, а содержание остатков аммониоалкилметакрилата от 6 до 14%, или из сополимера этилакрилата аммония и метилметакрилата в молярном соотношении мономеров 2:1, средняя молекулярная масса которого составляет от 500000 до 1000000. Наилучшие результаты были получены с использованием сополимеров аммониоалкилметакрилата и этилакрилата аммония, выпускаемого под торговым названием эудрагит RS или эудрагит RL фирмы Evonik Industries AG, и с использованием сополимера этилакрилата и метилметакрилата, выпускаемого под торговым названием эудрагит NE 30 D фирмы Evonik Industries AG в виде 30% водной дисперсии. Обычно слой с регулируемым высвобождением содержит по крайней мере эксципиент, такой как связующее, агент, уменьшающий липкость, пеногаситель, ароматизатор, пигмент, технологическую добавку, такую как пластификатор, эмульгатор или стабилизатор. Обычно слой с регулируемым высвобождением содержит связующее. В основном связующее выбирают из производных целлюлозы, поливинилового спирта или поливинилпирролидона или их смеси. Предпочтительно связующим является производное целлюлозы. Более предпочтительно им является гидроксипропилметилцеллюлоза (ГПМЦ). Наилучшие результаты были получены с использованием гидроксипропилметилцеллюлозы USP 28, тип 2910 в качестве связующего. Обычно слой с регулируемым высвобождением содержит агент, уменьшающий липкость. В основном агент, уменьшающий липкость, выбирают из талька, коллоидного диоксида кремния, трисиликата магния, крахмала, трехосновного фосфата кальция или их смеси. Предпочтительным является тальк. Обычно фармацевтическая композиция по настоящему изобретению содержит от 30 до 100 мас.% полимера с регулируемым высвобождением в расчете на общую массу слоя с регулируемым высвобождением. Предпочтительно фармацевтическая композиция по настоящему изобретению содержит от 40 до 90 мас.% полимера с регулируемым высвобождением, более предпочтительно от 60 до 75 мас.% полимера с регулируемым высвобождением в расчете на общую сухую массу слоя с регулируемым высвобождением. Обычно фармацевтическая композиция по настоящему изобретению содержит от 0 до 15 мас.% связующего в расчете на общую сухую массу слоя с регулируемым высвобождением. Предпочтительно фармацевтическая композиция по настоящему изобретению содержит от 1 до 10 мас.% связующего, более предпочтительно от 3 до 5 мас.% связующего в расчете на общую сухую массу слоя с регулируемым высвобождением. Обычно фармацевтическая композиция по настоящему изобретению содержит от 0 до 50 мас.% агента, уменьшающего липкость, в расчете на общую сухую массу слоя с регулируемым высвобождением. Предпочтительно фармацевтическая композиция по настоящему изобретению содержит от 10 до 45 мас.% агента, уменьшающего липкость, более предпочтительно от 25 до 35 мас.% агента, уменьшающего липкость, в расчете на общую сухую массу слоя с регулируемым высвобождением. Согласно изобретению гранулят обозначает активное ядро, которое включает активный ингредиент и по крайней мере один эксципиент. Обычно активное ядро характеризуется степенью сферичности от 0,5 до 1,0, предпочтительно от 0,6 до 1,0 мкм. Обычно средний размер частиц активного ядра составляет от 75 до 1400 мкм. Предпочтительно средний размер частиц активного ядра составляет от 400 до 1100 мкм. Более предпочтительно средний размер частиц активного ядра составляет от 500 до 1000 мкм. Обычно активное ядро содержит один или несколько связующих в качестве эксципиента. Термин"связующее", использованный в данном контексте, обозначает агент, который применяют для увеличения когезии гранул или используют в качестве технологической добавки в ходе процесса грануляции. Связующее может присутствовать в фармацевтической композиции в виде одного соединения или в виде смеси соединений. Примеры связующих включают, но не ограничиваясь только ими, крахмал, предварительно желатинизированный крахмал, желатин, поливинилпирролидон, метилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, натриевую соль карбоксиметилцеллюлозы, этилцеллюлозу, микрокристаллическую целлюлозу, сахаридные остатки, например, гидрированной палатинозы,гидрированной мальтозы, полидекстрозы или сахарозы, полиакриламид, поливинилоксазолидон, поливиниловые спирты, поливинилпирролидон-винилацетат. Предпочтительные связующие включают поливинилпирролидон, гидроксипропилметилцеллюлозу и микрокристаллическую целлюлозу. Обычно активное ядро содержит в качестве эксципиента один или несколько разбавителей. Термин"разбавители", использованный в данном контексте, обозначает агент, используемый в качестве эксципиента для обеспечения требуемого объема или массы. Разбавитель может присутствовать в фармацевтической композиции в виде одного соединения или в виде смеси соединений. Разбавители могут также играть роль связующего или модулятора скорости высвобождения лекарственного средства. Примеры разбавителей включают, но не ограничиваясь только ими, лактозу, предварительно желатинизированный крахмал, микрокристаллическую целлюлозу, силицифицированную микрокристаллическую целлюлозу,ацетат целлюлозы, декстрозу, маннит, фосфат натрия, фосфат калия, фосфат кальция, фруктозу, мальтозу, сорбит или сахарозу. Предпочтительными разбавителями являются микрокристаллическая целлюлоза, лактоза и крахмал. Необязательно активное ядро содержит консервант. Примеры консервантов включают, но не ограничиваясь только ими, эдетат динатрия (динатриевая соль ЭДТУ), метабисульфит натрия, аскорбиновую кислоту, лимонную кислоту или их смесь. Необязательно активное ядро содержит органическую или неорганическую соль в качестве модулятора высвобождения лекарственного средства. Модулятор высвобождения лекарственного средства обозначает ингредиент, который может модулировать скорость высвобождения активного ингредиента за счет его специфического действия на свойства полимера с регулируемым высвобождением. Примеры солей включают, но не ограничиваясь только ими, ацетат, цитрат, сукцинат или хлорид. Необязательно активное ядро содержит агент, уменьшающий липкость. Примеры агента, уменьшающего липкость, включают, но не ограничиваясь только ими, тальк, коллоидный диоксид кремния,трисиликат магния, крахмал, трехосновный фосфат кальция или их смесь. Обычно фармацевтическая композиция по настоящему изобретению содержит от 0 до 98 мас.% связующего в расчете на сухую массу активного ядра. Предпочтительно фармацевтическая композиция по настоящему изобретению содержит от 0,5 до 80 мас.% связующего в расчете на сухую массу активного ядра. Обычно фармацевтическая композиция по настоящему изобретению содержит от 0 до 98 мас.% разбавителей в расчете на сухую массу активного ядра. Предпочтительная фармацевтическая композиция по настоящему изобретению содержит от 0,5 до 80 мас.% разбавителей, более предпочтительно от 1 до 60 мас.% разбавителей в расчете на сухую массу активного ядра. Необязательно фармацевтическая композиция по настоящему изобретению содержит от 0 до 40 мас.% агента, уменьшающего липкость, в расчете на сухую массу активного ядра. Предпочтительно фармацевтическая композиция по настоящему изобретению содержит от 5 до 30 мас.% агента, уменьшающего липкость, более предпочтительно от 10 до 20 мас.% агента, уменьшающего липкость, в расчете на сухую массу активного ядра. Необязательно фармацевтическая композиция по настоящему изобретению содержит от 0 до 5 мас.% консерванта в расчете на сухую массу активного ядра. Предпочтительно фармацевтическая ком-3 019583 позиция по настоящему изобретению содержит от 0 до 3 мас.% консерванта, более предпочтительно от 0 до 2 мас.% консерванта в расчете на сухую массу активного ядра. Необязательно фармацевтическая композиция по настоящему изобретению содержит от 0 до 80 мас.% модулятора высвобождения лекарственного средства в расчете на сухую массу активного ядра. Предпочтительно фармацевтическая композиция по настоящему изобретению содержит от 0 до 60 мас.% модулятора высвобождения, более предпочтительно от 0 до 40 мас.% модулятора высвобождения лекарственного средства в расчете на сухую массу активного ядра. В другом варианте осуществления настоящего изобретения перед добавлением слоя с регулируемым высвобождением добавляют промежуточный слой, чтобы защитить любую диффузию активного ингредиента в слой с регулируемым высвобождением или в еще большей степени защитить активный ингредиент от действия химически агрессивных агентов из окружающей среды. Гранулят покрывают промежуточным слоем. Обычно промежуточный слой включает связующее, агент, уменьшающий липкость, пигменты и/или технологические добавки, такие как пластификаторы. Обычно содержание промежуточного слоя составляет от 1,0 до 30 мас.% в расчете на общую массу ядра и первого слоя. Предпочтительно содержание промежуточного слоя составляет от 2,5 до 20 мас.% в расчете на общую массу ядра и первого слоя. Более предпочтительно содержание промежуточного слоя составляет от 5% до 15% в расчете на общую массу ядра и первого слоя. Обычно промежуточный слой покрытия содержит связующее. В основном связующее выбирают из производных целлюлозы, поливинилового спирта, поливинилпирролидона или их смесей. Предпочтительно связующим является производное целлюлозы. Более предпочтительно связующим является гидроксипропилметилцеллюлоза (ГПМЦ). Наилучшие результаты были получены с использованием гидроксипропилметилцеллюлозы USP 28, тип 2910. Обычно промежуточный слой покрытия содержит агент, уменьшающий липкость. В основном агент, уменьшающий липкость, выбирают из талька, коллоидного диоксида кремния, трисиликата магния, крахмала, трехосновного фосфата кальция или их смесей. Предпочтительным является тальк. Обычно промежуточный слой содержит пластификатор. В основном пластификатор выбирают из глицерина, жирных кислот, фталата, низкомолекулярного полиэтиленгликоля, цитрата или их смесей. Предпочтительным является полиэтиленгликоль."Низкомолекулярный полиэтиленгликоль" обозначает полимер с молекулярной массой менее 12000 Да. Обычно фармацевтическая композиция по настоящему изобретению содержит от 30 до 95 мас.% связующего в расчете на сухую массу промежуточного слоя. Предпочтительно фармацевтическая композиция по настоящему изобретению содержит от 40 до 90 мас.% связующего, более предпочтительно от 60 до 80 мас.% связующего в расчете на сухую массу промежуточного слоя. Обычно фармацевтическая композиция по настоящему изобретению содержит от 0 до 40 мас.% агента, уменьшающего липкость, в расчете на сухую массу промежуточного слоя. Предпочтительно фармацевтическая композиция по настоящему изобретению содержит от 5 до 35 мас.% агента, уменьшающего липкость, более предпочтительно от 15 до 25 мас.% агента, уменьшающего липкость, в расчете на сухую массу промежуточного слоя. Обычно фармацевтическая композиция по настоящему изобретению содержит от 0 до 30 мас.% пластификатора в расчете на сухую массу промежуточного слоя. Предпочтительно фармацевтическая композиция по настоящему изобретению содержит от 2 до 25 мас.% пластификатора, более предпочтительно от 5 до 15 мас.% пластификатора в расчете на сухую массу промежуточного слоя. В другом варианте конечный слой добавляют после нанесения слоя с регулируемым высвобождением. На гранулят, покрытый слоем с регулируемым высвобождением, наносят конечный слой. Конечный слой включает связующее, агент, уменьшающий липкость, пигменты и/или технологические добавки. Обычно массовое содержание конечного слоя составляет от 1,0 до 30 мас.% в расчете на общую массу фармацевтической композиции. Предпочтительно содержание конечного слоя составляет от 2,5 до 20%. Более предпочтительно содержание конечного слоя составляет от 5 до 15% в расчете на общую массу фармацевтической композиции. В еще одном варианте внешнюю фазу добавляют в пеллеты с покрытием. В качестве ингредиента внешней фазы в композицию можно добавлять некоторые фармацевтически приемлемые эксципиенты,такие как пигмент, консерванты или технологические добавки. Примеры технологических добавок включают тальк, крахмалы, стеариновую кислоту и безводный коллоидный диоксид кремния. Предпочтительной технологической добавкой по настоящему изобретению является безводный коллоидный диоксид кремния, такой как аэросил 200. Обычно фармацевтическая композиция по настоящему изобретению содержит от 0,0 до 3,0 мас.% технологической добавки. Предпочтительно фармацевтическая композиция по настоящему изобретению содержит от 0,0 до 2,0 мас.% технологической добавки, более предпочтительно от 0,25 до 1,0 мас.% технологической добавки в расчете на общую массу композиции. Согласно изобретению композиция необязательно также содержит подсластители, ароматизаторы,улучшающие вкус агенты. В другом варианте фармацевтическая композиция включает активное ядро, содержащее бриварацетам или селетрацетам, средний размер частиц которого составляет от 75 до 1400 мкм, слой с регулируемым высвобождением, содержание которого составляет в расчете на общую массу фармацевтической композиции от 1,0 до 60 мас.%, и содержащий от 30 до 100 мас.% сополимера с контролируемым высвобождением, от 1 до 15 мас.% связующего, от 0 до 50 мас.% агента, уменьшающего липкость, в расчете на общую массу слоя с регулируемым высвобождением, и внешнюю фазу, содержащую технологическую добавку, содержание которой составляет от 0,0 до 3,0 мас.% в расчете на общую массу фармацевтической композиции. Прежде всего настоящее изобретение относится к фармацевтической композиции, которая включает активное ядро, содержащее бриварацетам или селетрацетам, средний размер частиц которого составляет от 400 до 1100 мкм, слой с регулируемым высвобождением, содержание которого составляет в расчете на общую массу фармацевтической композиции составляет от 2,0 до 50 мас.%, и содержащий от 40 до 90 мас.% сополимера с контролируемым высвобождением, от 1 до 10 мас.% связующего, от 10 до 45 мас.% агента, уменьшающего липкость, в расчете на общую массу слоя с регулируемым высвобождением, и внешнюю фазу, содержащую технологическую добавку, содержание которой составляет от 0,0 до 2,0 мас.% в расчете на общую массу фармацевтической композиции. Более предпочтительно настоящее изобретение относится к фармацевтической композиции, включающей активное ядро, содержащее бриварацетам или селетрацетам, средний размер частиц которого составляет от 500 до 1000 мкм, слой с регулируемым высвобождением, содержание которого в расчете на общую массу фармацевтической композиции составляетот 5,0 до 40%, и содержащий от 60 до 75 мас.% сополимера с контролируемым высвобождением, от 3 до 5 мас.% связующего, от 25 до 35 мас.% агента, уменьшающего липкость, в расчете на общую массу слоя с регулируемым высвобождением, и внешнюю фазу, содержащую технологическую добавку, содержание которой составляет от 0,25 до 1,0 мас.% в расчете на общую массу фармацевтической композиции. В предпочтительном варианте предлагается фармацевтическая композиция, включающая активное ядро, содержащее бриварацетам или селетрацетам, средний размер частиц которого составляет от 75 мкм до 1400 мкм, слой с регулируемым высвобождением, содержание которого в расчете на общую массу фармацевтической композиции составляет от 1,0 до 60%, и содержащий от 30 до 100 мас.% сополимера этилацетата и метилметакрилата, от 1 до 15 мас.% гидроксипропилметилцеллюлозы, от 0 до 50 мас.% талька в расчете на общую массу слоя с регулируемым высвобождением, и внешнюю фазу, содержащую коллоидный безводный диоксид кремния, содержание которого составляет от 0,0 до 3,0 мас.% в расчете на общую массу фармацевтической композиции. В другом предпочтительном варианте предлагается фармацевтическая композиция, включающая активное ядро, содержащее бриварацетам или селетрацетам, средний размер частиц которого составляет от 400 до 1100 мкм, слой с регулируемым высвобождением, содержание которого в расчете на общую массу фармацевтической композиции составляет от 2,0 до 50 мас.%, и содержащий от 40 до 90 мас.% сополимера этилацетата и метилметакрилата, от 1 до 10 мас.% гидроксипропилметилцеллюлозы и от 10 до 45 мас.% талька в расчете на общую массу слоя с регулируемым высвобождением, и внешнюю фазу,содержащую коллоидный безводный диоксид кремния, содержание которого составляет от 0,00 до 2,0 мас.% в расчете на общую массу фармацевтической композиции. Более предпочтительно настоящее изобретение относится к фармацевтической композиции, включающей активное ядро, содержащее бриварацетам или селетрацетам, средний размер частиц которого составляет от 500 до 1000 мкм, слой с регулируемым высвобождением, содержание которого в расчете на общую массу фармацевтической композиции составляет от 5,0 до 40%, и содержащий от 60 до 75 мас.% сополимера этилацетата и метилметакрилата, от 3 до 5 мас.% гидроксипропилметилцеллюлозы, от 25 до 35 мас.% талька в расчете на общую массу слоя с регулируемым высвобождением, и внешнюю фазу, содержащую коллоидный безводный диоксид кремния, содержание которого составляет от 0,25 до 1,0 мас.% в расчете на общую массу фармацевтической композиции. Фармацевтическую композицию по изобретению можно получить любыми способами, известными специалистам в данной области техники, такими как уплотнение, экструзия, влажная и сухая грануляция,смешивание порошков с использованием процессов с распылением, ротационной грануляции или грануляции в псевдоожиженном слое. Необязательно слой с регулируемым высвобождением необходимо отверждать при температуре от 20 до 75 С в течение от 1 ч до 5 сут. Предпочтительно слой с регулируемым высвобождением отверждается при температуре от 30 до 70 С в течение от 2 ч до 3 сут. Более предпочтительно, слой с регулируемым высвобождением отверждается при температуре от 40 до 65 С в течение от 8 ч до 1 сут. В другом предпочтительном варианте предлагается фармацевтическая композиция, содержащая от 0,20 до 70 мас.% бриварацетама в расчете на общую массу фармацевтической композиции. Обычно, в указанном предпочтительном варианте предлагается фармацевтическая композиция, содержащая от 0,40 до 60 мас.% бриварацетама в расчете на общую массу фармацевтической композиции. Предпочтительно, в этом предпочтительном варианте предлагается фармацевтическая композиция,содержащая от 0,60 до 50 мас.% бриварацетама в расчете на общую массу композиции. Фармацевтическую композицию по настоящему изобретению вводят предпочтительно перорально. Фармацевтическую композицию по настоящему изобретению вводят предпочтительно в форме капсулы, пакетика или таблетки. Необязательно фармацевтическая композиция по настоящему изобретению может содержать внешний разбавитель или технологическую добавку, такую как (но не ограничиваясь только ими) крахмал,лактоза, микрокристаллическая целлюлоза, тальк. Необязательно фармацевтическая композиция по настоящему изобретению может содержать подсластитель, такой как сахароза или сахарин, краситель или ароматизатор. Необязательно фармацевтическая композиция по настоящему изобретению может содержать маскирующий вкус агент. В другом предпочтительном варианте предлагается фармацевтическая композиция, содержащая от 0,20 до 70 мас.% селетрацетама в расчете на общую массу композиции. Обычно в этом предпочтительном варианте предлагается фармацевтическая композиция, содержащая от 0,40 до 60 мас.% селетрацетама в расчете на общую массу композиции. Предпочтительно в этом предпочтительном варианте предлагается фармацевтическая композиция,содержащая от 0,60 до 50 мас.% селетрацетама в расчете на общую массу композиции. Фармацевтическую композицию по настоящему изобретению предпочтительно вводят перорально. Фармацевтическую композицию по настоящему изобретению предпочтительно вводят в форме капсулы, пакетика или таблетки. Необязательно фармацевтическая композиция по настоящему изобретению содержит разбавитель или технологическую добавку, такую как (без ограничения перечисленным) крахмал, лактоза, микрокристаллическая целлюлоза, тальк. Необязательно фармацевтическая композиция по настоящему изобретению содержит подсластитель, такой как сахароза или сахарин, краситель или ароматизатор. Необязательно фармацевтическая композиция по настоящему изобретению содержит маскирующий вкус агент. Настоящее изобретение также относится к фармацевтической композиции для лечения заболевания. В другом варианте предлагается фармацевтическая композиция, содержащая активный ингредиент,предназначенный для лечения или профилактики заболевания. Термин "заболевание" обозначает заболевание, выбранное из группы, включающей эпилептогенез,эпилептические припадки, судороги, болезнь Паркинсона, дискинезию, индуцированную заместительной терапией допамином, позднюю дискинезию, индуцированную введением нейролептических лекарственных средств, хорею Гентингтона и другие неврологические нарушения, включающие биполярные нарушения, манию, депрессию, тревогу, синдром дефицита внимания с гиперактивностью (СДВГ), мигрень,невралгию троичного нерва и прочие невралгии, хроническую боль, невропатическую боль, церебральную ишемию, сердечную аритмию, миотонию, злоупотребление кокаином, инсульт, миоклонию, тремор и эссенциальный тремор, простые или сложные тики, синдром Туретта, синдром беспокойных ног и другие нарушения движения, синдром неонатального кровоизлияния в мозг, боковой амиотрофический склероз, мышечную спастичность и дегенеративные заболевания. Термин "лечение", использованный в данном контексте, включает лечебное действие и профилактическое лечение."Лечебный " обозначает эффективность при лечении наблюдаемого симптоматического эпизода нарушения или состояния."Профилактический" обозначает предотвращение развития или рецидива нарушения или состояния. Настоящее изобретение относится также к способу лечения пациента, включая человека, с использованием фармацевтической композиции. Настоящее изобретение также относится к фармацевтической композиции для применения в качестве лекарственного средства, предназначенного для лечения указанного заболевания. Настоящее изобретение также относится к применению фармацевтической композиции для получения лекарственного средства, предназначенного для лечения указанного заболевания. Предпочтительно указанное заболевание выбирают из группы, в основном включающей эпилепсию, болезнь Паркинсона, дискинезию, мигрень, тремор, эссенциальный тремор, биполярные нарушения,хроническую боль, нейропатическую боль. Более предпочтительно указанным заболеванием является эпилепсия. Настоящее изобретение также относится к способу получения лекарственного средства, предназначенного для лечения указанного заболевания, и указанный способ заключается в применении фармацевтической композиции по настоящему изобретению. Дозу можно изменять в широком диапазоне при изменении количества фармацевтической композиции по изобретению и содержания активного ингредиента в лекарственной форме. Можно обеспечивать профиль с немедленным высвобождением (НВ) или с пролонгированным высвобождением (ПВ), так как композиции НВ можно рассматривать как предшественники композиций ПВ. Наконец, профиль растворения можно модулировать простым способом при изменении толщины покрытия ПВ. Более того,формы со множеством частиц пролонгированного высвобождения в основном характеризуются повышенной надежностью и воспроизводимостью в отношении профиля высвобождения активного ингредиента. Фармацевтическая композиция по изобретению обеспечивает высвобождение по крайней мере 50 % активного ингредиента в течение менее 8 ч, при этом наблюдается приемлемая абсорбция лекарственного средства in vivo. Следующие примеры представлены для иллюстрации изобретения и не ограничивают его объем. Пример 1. Композиция селетрацетама с замедленным высвобождением. Пеллеты селетрацетама получали в соответствии с составом, приведенным в табл. 1. Таблица 1. Состав ядра пеллетов селетрацетама Полученное активное ядро характеризуется средним размером частиц 770 мкм. Гидроксипропилметилцеллюлозу, выпускаемую под торговой маркой Pharmacoat 606, использовали в качестве связующего, предпочтительная марка 606. Микрокристаллическую целлюлозу использовали в качестве разбавителя. Тальк использовали в качестве агента, уменьшающего липкость. Сополимер этилакрилата и метилметакрилата выпускается под торговой маркой эудрагит NE 30D. Его использовали в качестве полимера с регулируемым высвобождением. Деметилполисилоксан, выпускаемый под торговым названием симетикон, использовали в качестве пеногасителя. Коллоидный безводный диоксид кремния, выпускаемый под торговым названием аэросил 200,использовали в качестве агента, уменьшающего липкость, и в качестве скользящего вещества. Полученные пеллеты характеризуются профилем замедленного высвобождения селетрацетама, который удовлетворяет требованиям растворимости in vitro. Талица 10. Результаты в % Профили растворимости в воде in vitro определяли, как описано в стандарте USP 711 (прибор n 2,50 об/мин, водная среда 900 мл) в течение 16 ч. Растворение проводили при 37 С в фосфатном буферном растворе рН 6,4. Пример 2. Все эксперименты проводили в соответствии с инструкциями местного этического комитета по экспериментам на животных. Ответные эпилептиформные реакции в гиппокампальных срезах: леветирацетам снижает ответную эпилептиформную реакцию, индуцированную в гиппокампальных срезах крыс при высоких концентрациях K+/низких концентрациях Са 2+ в перфузионнои жидкости и индуцированную бикукуллином. Действие бриварацетама на ответную эпилептиформную реакцию, индуцированную высокими концентрациями K+/низкими концентрациями Са 2+ или бикукуллином, оценивали в поперечных гиппокампальных срезах крыс Sprague-Dawley, полученных по ранее описанным стандартным методикам. Ответную эпилептиформную реакцию индуцировали при замене нормальной перфузии искусственной цереброспинальной жидкостью (ACSF) (K+ 3 мМ, Са 2+ 2,4 мМ) на жидкость с высокой концентрацией K+/низкой концентрацией Са 2+ (HKLCF) (K+ 7,5 мМ, Са 2+ 0,5 мМ) или на жидкость ACSF, содержащую 5 М метиодид бикукуллина (BMI). Полевые внеклеточные потенциалы (ПП) регистрировали в участках СА 3 с использованием стек-7 019583 лянных микроэлектродов, заполненных 2 М NaCl. Индуцированные ПП регистрировали через каждые 10 мин в ответ на фимбриальную стимуляцию прямоугольными импульсами постоянного тока, которая вызывает один популяционный спайк (ПС) с максимальной амплитудой 50-75%, когда срез находится вACSF. В модели HKLCF была также зарегистрирована спонтанная активность в течение 2 мин в середине каждого 10-минутного интервала между регистрациями индуцированных ответных реакций. Бриварацетам либо леветирацетам добавляли в промывную жидкость срезов за 20 мин до замены жидкости на жидкость ACSF или HKLCF или на жидкость ACSF, содержащую 5 М BMI, и выдерживали в перфузионной жидкости в ходе всего эксперимента. Рефлекторный акустикогенный эпилептический припадок у мышей: использовали генетически чувствительных к звуку самцов мышей (16-28 г; n=10 в группе), у которых в ответ на акустикогенную стимуляцию наблюдаются частые, прокурсивные клонические и тонические судороги. Рефлекторный акустикогенный эпилептический припадок индуцировали акустическим стимулом (90 дБ, 10-20 кГц) в течение 30 с. Мышам предварительно вводили солевой раствор, бривацетам (внутрибрюшинно, 30 мин) или леветирацетам (внутрибрюшинно, 60 мин), и число мышей, защищенных от клонических эпилептических судорог, использовали в качестве конечного параметра противосудорожной активности. Химически индуцированные судороги у мышей: пентилентетразол, 83 мг/кг подкожно, использовали для оценки противосудорожных свойств бриварацетама. Дозу выбирали на основании кривых зависимости эффекта от дозы для животных, которым вводили солевой раствор в качестве судорожной дозы,вызывающей клонические судороги во всех четырех конечностях у 97% животных. Сразу после введения хемоконвульсанта мышей размещали каждую отдельно в маленькие пластмассовые клетки (25138 см) и наблюдали наличие клонических судорог во всех четырех конечностях в течение 60 мин. В этот период регистрировали также развитие тонических судорог (вытягивание задней конечности) и смертность. Рассчитывали число мышей, защищенных от клонических конвульсий, его использовали в качестве конечного параметра противосудорожной активности. Результаты Ответная эпилептиформная реакция в гиппокампальных срезах: при замене перфузии гиппокампальных срезов крыс нормальной жидкостью ACSF на жидкость HKLCF наблюдается эпилептиформная ответная реакция: возрастание полевых внеклеточных потенциалов в участках СА 3 в ответ на фимбриальную стимуляцию импульсами постоянного тока. В контрольных срезах при перфузии только жидкостью HKLCF, амплитуда ПС значительно возрастает, достигая плато в течение 20 мин (4.250.77 мВ), почти вдвое выше по сравнению с ПС, регистрируемыми при перфузии жидкостью ACSF (2.180.15 мВ,среднее значение для n=10 срезов). Всплески повторных популяционных спайков (ПС, то есть, ПС 2, ПС 3 и т. д.), индуцированные одним стимулом прямого тока, также возрастают по величине в первые 30 мин перфузии HKLCF от ПС 1 до средней величины ПС 7.62.3 на один популяционный спайк, и продолжают возрастать до средней величины ПС 8.81.6 на один популяционный спайк через 80 мин перфузии жидкостью HKLCF. Бриварацетам и леветирацетам оба снижают указанную эпилептиформную ответную реакцию. Через 15 мин перфузии жидкостью HKLCF наблюдаются спонтанные полевые всплески в 4 из 10 срезов при перфузии только одной жидкостью HKLCF, в то время как через 25 мин и до завершения регистрации во всех контрольных срезах наблюдаются регулярные полевые всплески. Бриварацетам (3,2 М), но не леветирацетам (32 М) снижает степень таких спонтанных всплесков. Испытания in vivo У крыс с полностью раздраженным миндалевидным телом бривацетам вызывает значительное подавление тяжести повторного приступа в дозе 21,2 мг/кг, а леветирацетам оказывает аналогичное действие в дозе 170 мг/кг. Бриварацетам также значительно снижает продолжительность разряда последействия в самой высокой из исследованных дозе (212,3 мг/кг), а леветирацетам не оказывает никакого действия на этот параметр в дозе вплоть до 1700 мг/кг. Чувствительные к звуку мыши, у которых наблюдались судороги в ответ на звуковую стимуляцию,были защищены от клонических судорог при введении бриварацетама и леветирацетама: значения ED50 приведены в таблице 2. Бриварацетам, введенный внутримышечно за 30 мин до индукции судорог у мышей, также защищал от клонических судорог, индуцированных пентиленететразолом, и от тонического вытягивания задней конечности, индуцированного максимальным электрошоком у мышей, хотя и с более высоким значением ED50. Бриварацетам значительно подавлял спонтанные пик-волновые разряды (SWD) у крыс GAERS в дозе 2,1 мг/кг, причем полное подавление наблюдалось в самой высокой исследованной дозе (67,9 мг/кг). С другой стороны, леветирацетам вызвал существенное подавление SWD в дозе 5,4 мг/ кг. Предварительное введение бривацетама мышам в ходе провоцирования припадков при повторной стимуляции роговицы приводило к значительному снижению частоты генерализованных моторных приступов, и аналогичное снижение частоты приступов наблюдалось при введении леветирацетама в более высоких дозах. При непрерывной стимуляции роговицы после завершения лечения наблюдалось устойчивое снижение частоты генерализованных моторных приступов в группе животных, которым вводили самую высокую дозу бривацетама. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция с замедленным высвобождением, включающая гранулят, который содержит активный ингредиент и который покрыт слоем с регулируемым высвобождением, причем активный ингредиент представляет собой производное 2-оксо-1-пирролидина формулы (I) где R1 обозначает н-пропил или 2,2-дифторвинил,R2 обозначает этил,X обозначает -CONH2. 2. Фармацевтическая композиция по п.1, где содержание слоя с регулируемым высвобождением составляет от 1,0 до 60 мас.% в расчете на массу фармацевтической композиции. 3. Фармацевтическая композиция по п.1 или 2, где слой с регулируемым высвобождением содержит, по крайней мере, полимер, выбранный из сополимеров аммониоалкилметакрилата и этилакрилата,или сополимера этилакрилата и метилметакрилата, или этилцеллюлозы, или ацетат целлюлозы, в котором содержание ацетильных групп составляет от 32 до 44%, или их смеси. 4. Фармацевтическая композиция по п.3, где полимер с регулируемым высвобождением выбирается из сополимера аммониоалкилметакрилата и этилакрилата, средняя молекулярная масса которого составляет от 75000 до 200000 Да, а содержание остатков аммониоалкилметакрилата составляет от 6 до 14%,или из сополимера этилакрилата и метилметакрилата в молярном соотношении двух мономеров 2:1,средняя молекулярная масса которого составляет от 500000 до 1000000. 5. Фармацевтическая композиция по п.1, где слой с регулируемым высвобождением содержит, по крайней мере, эксципиент, такой как связующее, агент, уменьшающий липкость, пеногаситель, ароматизатор, пигмент, технологическая добавка, например пластификатор, эмульгатор или стабилизатор. 6. Фармацевтическая композиция по любому из пп.1-5, где гранулятом является активное ядро, которое включает активный ингредиент и по крайней мере один эксципиент. 7. Фармацевтическая композиция по п.6, где активное ядро характеризуется степенью сферичности от 0,5 до 1,0 и средний размер частиц активного ядра составляет от 75 до 1400 мкм. 8. Фармацевтическая композиция по любому из предшествующих пунктов, где гранулят покрыт промежуточным слоем. 9. Фармацевтическая композиция по любому из предшествующих пунктов, где гранулят покрыт слоем с регулируемым высвобождением и дополнительно на него нанесен конечный слой, который включает связующее, агент, уменьшающий липкость, пигменты и/или технологические добавки. 10. Фармацевтическая композиция по любому из предшествующих пунктов, в которую добавлена внешняя фаза, представляющая собой фармацевтически приемлемые эксципиенты.
МПК / Метки
МПК: A61K 31/4015, A61K 9/50
Метки: композиции, высвобождением, пролонгированным, 2-оксо-1-пирролидина, содержащие, производное
Код ссылки
<a href="https://eas.patents.su/10-19583-kompozicii-s-prolongirovannym-vysvobozhdeniem-soderzhashhie-proizvodnoe-2-okso-1-pirrolidina.html" rel="bookmark" title="База патентов Евразийского Союза">Композиции с пролонгированным высвобождением, содержащие производное 2-оксо-1-пирролидина</a>
Предыдущий патент: Гибкие плоские субстраты с абразивной поверхностью
Следующий патент: Холиновые соли янтарной кислоты для лечения депрессий, тревоги, шизофрении, нарушений сна и эпилепсии
Случайный патент: Композиция зипразидона в виде суспензии












