Подкожные имплантаты, высвобождающие активный компонент в течение длительного времени
Формула / Реферат
1. Подкожный имплантат, полученный экструзией, содержащий (1) микрочастицы, включающие активный ингредиент, диспергированный в PLGA-матриксе (сополимер молочной и гликолевой кислот), где все указанные микрочастицы (1) диспергированы в PLGA-матриксе (3), имеющем температуру стеклования ниже, чем температура стеклования PLGA, содержащегося в (1).
2. Подкожный имплантат по п.1, в котором микрочастицы (1) получены измельчением или приданием сферической формы экструдированного PLGA, содержащего диспергированный в нем активный ингредиент.
3. Подкожный имплантат по п.2, в котором указанные микрочастицы (1) получены способом, включающим следующие стадии:
a) сухое смешивание PLGA с активным ингредиентом или а') влажное гранулирование смеси PLGA и активного ингредиента;
b) высушивание влажной гранулированной смеси, полученной на стадии а'), для получения осадка, содержащего минимальное количество жидкого содержимого между 0,1 и 3%;
c) экструдирование смеси, полученной на стадии b), или сухой смеси, полученной на стадии а);
d) измельчение и просеивание экструдированного продукта, полученного на стадии с), в связи с этим получение микрочастиц, имеющих размер, как обусловлено просеиванием, меньше чем 500 мкм.
4. Подкожный имплантат по п.3, в котором на стадии d) экструдированный продукт измельчают до получения микрочастиц, имеющих размер, как обусловлено просеиванием, во фракции [50; 250 мкм].
5. Подкожный имплантат по любому из пп.1-4, дополнительно содержащий, кроме микрочастиц (1), микрочастицы (2), состоящие из того же самого активного ингредиента, содержащегося в (1), или микрочастиц (2'), состоящих из другого активного ингредиента.
6. Подкожный имплантат по п.5, в котором микрочастицы (2') представляют собой активный ингредиент того же самого терапевтического класса, как тот, который содержится в (1).
7. Подкожный имплантат по п.5 или 6, в котором активный ингредиент, содержащийся в (1) и микрочастицах (2) или (2'), выбран из группы, состоящей из пептида, активного ингредиента, способного увеличить плотность кости, аналгезирующего наркотического действующего компонента, стероидного гормона для гормонального лечения во время менопаузы и для контрацепции.
8. Подкожный имплантат по п.7, в котором пептид выбран из группы, состоящей из аворелина, триптолерина, госерелина и лейпрорелина.
9. Подкожный имплантат по п.7, в котором активный ингредиент, способный увеличить плотность кости, выбран из фармацевтически приемлемых бисфосфоновых кислот и их фармацевтически приемлемых солей, витамина Д и половых гормонов.
10. Подкожный имплантат по п.9, в котором эти соли бисфосфоновых кислот выбраны из динатрия этидроната, динатрия алендроната и динатрия памидроната.
11. Подкожный имплантат по п.9, в котором указанные половые гормоны выбраны из группы эстрогенов и андрогенных прогестинов.
12. Подкожный имплантат по п.11, в котором указанные эстрогены выбраны из класса, состоящего из эстрадиола, эстрадиол валерата, эстрадиол ципионата, эстрона, эстрон сульфата или эстрогенов нестероидного типа.
13. Подкожный имплантат по п.11, в котором указанные андрогенные прогестины выбраны из класса, состоящего из норэтиндрона, норэтинодрела, норгестрела, десогестрела, норгестимата.
14. Подкожный имплантат по п.7, в котором активный ингредиент с наркотической аналгетической активностью выбран из группы, состоящей из морфина и морфинанов и агонистов m-рецептора.
15. Подкожный имплантат по п.14, в котором указанные агонисты m-рецептора являются фенилпиперидинами, выбранными из группы, состоящей из меперидина, фентанила и их фармацевтически приемлемых солей и родственных с фентанилом соединений, выбранных из суфентанила, алфентанила, лофентанила, карфентанила, ремифентанила и их фармацевтически приемлемых солей.
16. Подкожный имплантат по любому из пп.11-15, в котором активный ингредиент, содержащийся в (1), микрочастицах (2) или (2'), имеет гомогенное или гетерогенное распределение частиц по размерам.
17. Подкожный имплантат по п.16, в котором активный ингредиент имеет гетерогенное распределение частиц по размерам.
18. Подкожный имплантат по п.17, в котором гетерогенное распределение частиц по размерам находится в пределах от 1 до 63 мкм или от 1 до 100 мкм.
19. Подкожный имплантат по любому из пп.1-18, в котором PLGA, содержащийся в (1), имеет среднюю молекулярную массу в пределах от 50000 до 150000 Да и молярное отношение молочная кислота/гликолевая кислота в пределах от 50/50 до 75/25.
20. Подкожный имплантат по любому из пп.1-19, в котором PLGA (3) имеет среднюю молекулярную массу от 10000 до 40000 Да и молярное отношение молочная кислота/гликолевая кислота в пределах от 50/50 до 60/40.
21. Способ приготовления подкожного имплантата по любому из пп.1-20, включающий следующие стадии:
(А) сухое смешивание частиц (1) с PLGA (3) и необязательно активных микрочастиц (2) или (2') или (А') влажное гранулирование частиц (1) с PLGA (3) и необязательно с (2) или (2');
(B) высушивание влажной гранулированной смеси, полученной на стадии (А');
(C) экструдирование смеси, полученной на стадии (А) или на стадии (В).
Текст
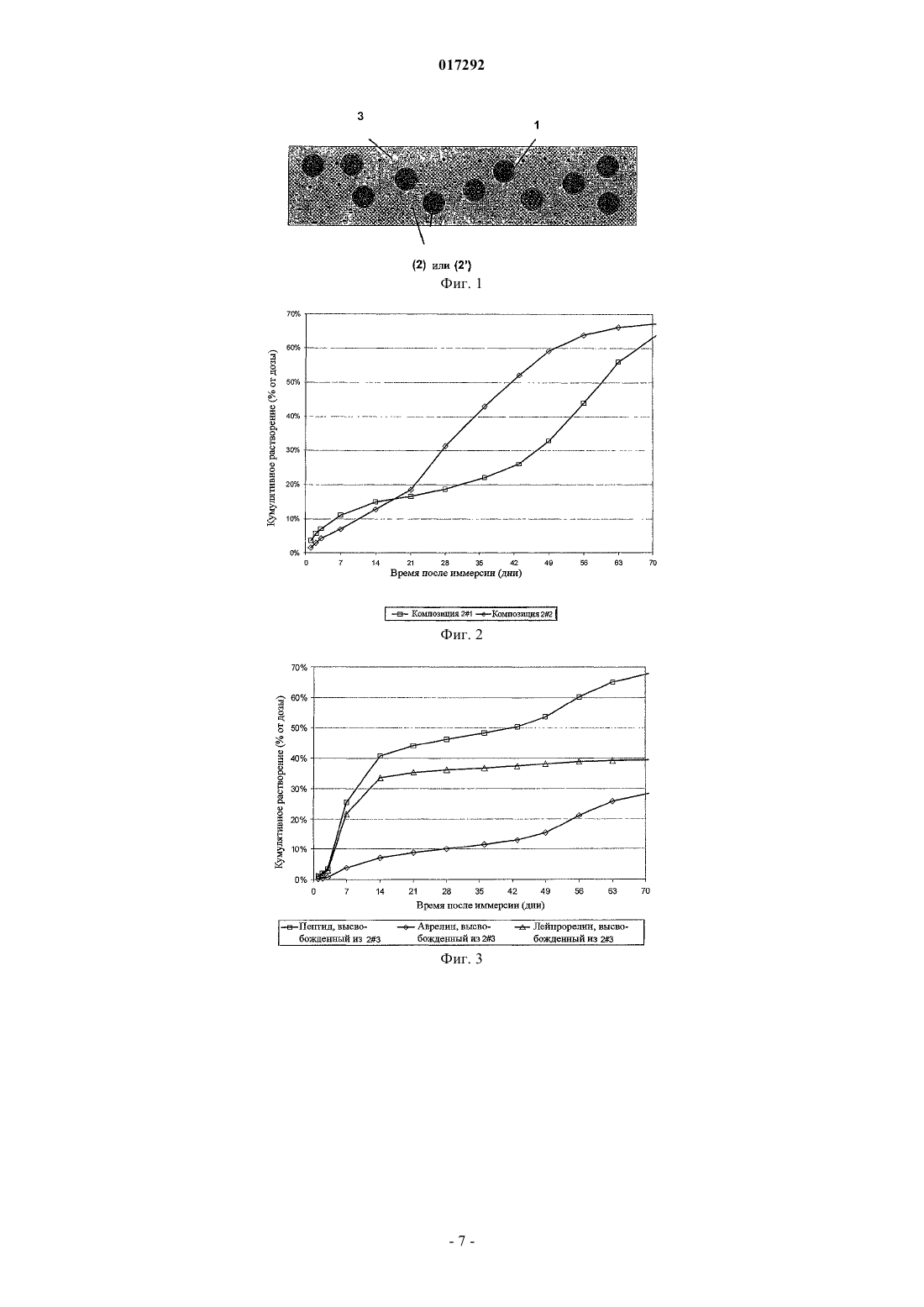
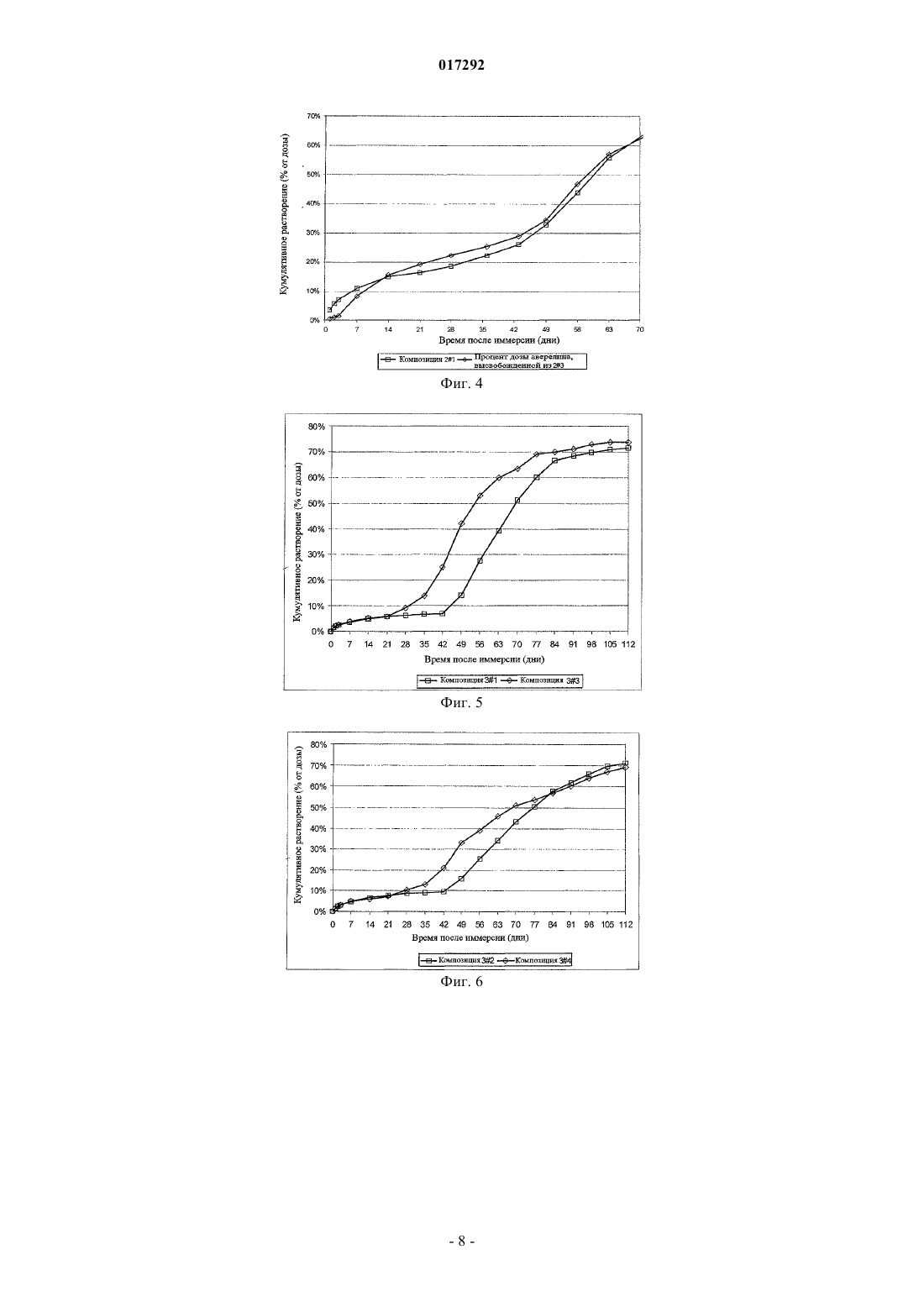
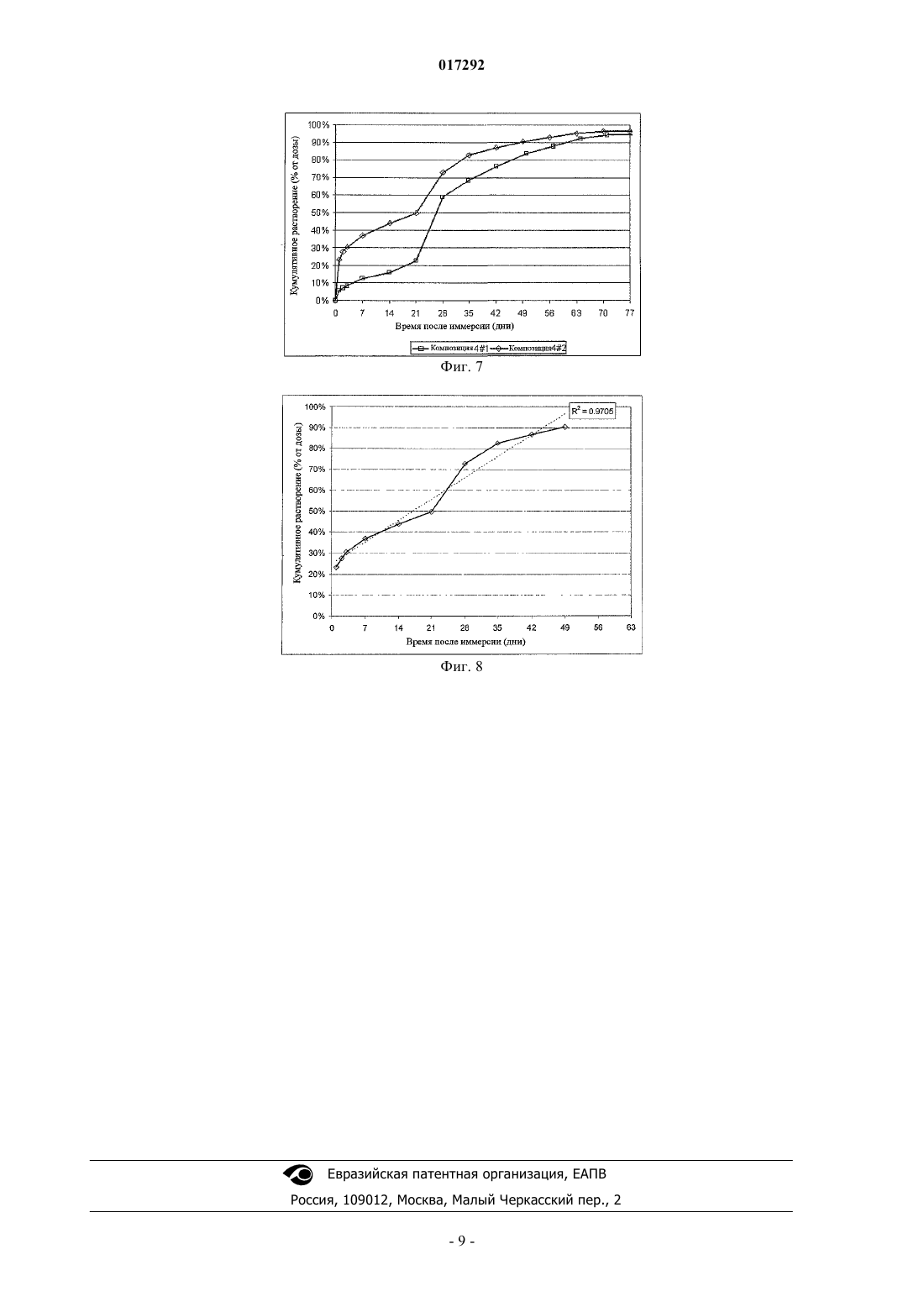
ПОДКОЖНЫЕ ИМПЛАНТАТЫ, ВЫСВОБОЖДАЮЩИЕ АКТИВНЫЙ КОМПОНЕНТ В ТЕЧЕНИЕ ДЛИТЕЛЬНОГО ВРЕМЕНИ В изобретение предложены подкожные имплантаты, полученные экструзией, содержащие (1) микрочастицы, включающие активный ингредиент, диспергированный в PLGA матриксе, и необязательно микрочастицы (2), включающие тот же самый активный ингредиент, или (2') включающие другой активный ингредиент, предпочтительно принадлежащие к той же самой категории, как тот, который содержится в (1); все указанные микрочастицы (1) диспергированы в матриксе из PLGA (3), имеющем температуру стеклования ниже, чем температура стеклования 017292 Область техники, к которой относится изобретение Настоящее изобретение относится к имплантатам для подкожного введения, полученным экструзией, включающим микрочастицы, содержащие активный ингредиент, диспергированный в PLGA (сополимер молочной и гликолевой кислот), и микрочастицы, состоящие из того же самого или другого активного ингредиента, предпочтительно того же самого терапевтического класса, как тот, который содержится в микрочастицах PLGA, все указанные частицы диспергированы в PLGA матриксе, имеющем температуру стеклования ниже, чем температура стеклования PLGA, содержащегося в вышеупомянутых микрочастицах; и соответствующему способу приготовления указанных имплантатов. Предшествующий уровень техники Преимущество применения имплантатов, содержащих вещества с контролируемым высвобождением, хорошо известно в предшествующем уровне техники. Многие активные ингредиенты быстро метаболизируются и уничтожаются организмом человека или млекопитающего, поэтому для поддержания достаточной терапевтической концентрации требуется частое введение препарата. Подкожные имплантаты представляют собой пример имплантатов с контролируемым высвобождением. Среди многочисленных уже известных имплантатов подкожные имплантаты, описанные в WO 00/33809, имеют преимущества по сравнению с ранее известными подкожными имплантатами, содержащими в качестве действующего компонента полипептид, диспергированный в матриксе из полилактикгликолевой кислоты, по той причине, что они способны высвобождать вышеупомянутый действующий компонент в течение 6 месяцев. Подкожные имплантаты, описанные в указанном патенте, отличаются также тем, что они представляют, по существу, трехфазный, а не двухфазный профиль высвобождения, а именно высвобождение чистой диффузией, высвобождение контролируемой набуханием диффузией и высвобождение при деградации полимера. Эта очередность, следовательно, позволяет удлинить время высвобождения. Фактически, когда эти имплантанты вводят в водную среду, вода диффундирует через полимерный матрикс, достигая пептидных частиц, расположенных близко к поверхности, и позже внутренних зон имплантата. Имплантат остается, по существу, неизмененным в течение приблизительно 6 недель и за этот период высвобождает приблизительно 30% пептида. Продолжительность этой стадии чистой диффузии существенным образом определяется уровнем гетерогенности размеров пептида, а скорость, по существу, определяется содержанием частиц в PLGA матриксе. Так как действующий компонент представляет собой разнообразие размеров, достаточное количество пептида остается после первой стадии растворения и может быть высвобождено в последующих упомянутых стадиях, в которых пептид высвобождается при диффузии и набухании, или высвобождается при разрушении полимера. Хотя эти имплантаты представляют собой значительное преимущество, они страдают от следующего недостатка. Будучи описанным, как имеющий тройной профиль высвобождения, случается, что после первой фазы высвобождения препарата и перед тем, как начнется вторая фаза, наблюдается время задержки(длящееся в некоторых случаях много дней), в течение которого препарат высвобождается недостаточно или не высвобождается. В отдельном случае и для некоторых терапевтических протоколов этой задержки в высвобождении препарата следует избегать и может оказаться необходимым более линейный профиль высвобождения. Следовательно, существовала необходимость преодолеть этот недостаток. Раскрытие изобретения В настоящий момент заявитель разработал подкожные имплантаты, которые решают вышеупомянутые проблемы. Данные имплантаты для подкожного введения, которые получены экструзией, содержат микрочастицы, включающие активные ингредиенты, диспергированные в PLGA, и микрочастицы, состоящие из того же самого активного ингредиента, все указанные микрочастицы диспергированы в PLGA матриксе,имеющем температуру стеклования ниже, чем температура стеклования PLGA, содержащегося в вышеупомянутых микрочастицах. Дальнейший предмет настоящего изобретения относится к подкожным имплантатам, включающим вышеупомянутые микрочастицы PLGA, в которых диспергирован действующий компонент и необязательно микрочастицы, состоящие из другого активного ингредиента того же самого терапевтического класса, как тот, который содержится в PLGA частицах. Фактически заявитель обнаружил, что при применении этих подкожных имплантатов, дальнейшего предмета настоящего изобретения, вещество, высвобождающееся из микрочастиц PLGA, является очень похожим на вещество из обыкновенного подкожного имплантата, содержащего два веса того же самого активного ингредиента. Кроме того, с подкожными имплантатами изобретения возможно защитить определенное количество активного вещества для того, чтобы оно высвободилось в конце процесса растворения. Во время пер-1 017292 воначальной фазы высвобождения преимущественно высвобождается активный ингредиент, который диспергируется в PLGA, образующем матрикс имплантата, тогда как активный ингредиент, содержащийся в PLGA частицах, является более защищенным от воды и кислотности внешнего PLGA, и он высвобождается позже. Описание чертежей Фиг. 1 представляет схематический вид участка вдоль оси I-I подкожного имплантата согласно настоящему изобретению; фиг. 2 показывает профиль высвобождения активного ингредиента (по оси ординат % общего высвобожденного количества в зависимости от времени по оси абсцисс) из подкожных имплантатов 21 и 22, изготовленных, как описано в примере 2; фиг. 3 показывает профиль общего высвобождения пептида (по оси ординат % высвобожденного количества в зависимости от времени по оси абсцисс из подкожных имплантатов), высвобождения аворелина и высвобождения лейпрорелина из подкожного имплантата 23, изготовленного, как описано в примере 2; фиг. 4 показывает высвобождение аворелина (по оси ординат % высвобожденного количества в зависимости от времени по оси абсцисс) из обыкновенного подкожного имплантата 21 по сравнению с высвобождением аворелина из подкожного имплантата 23 изобретения, приготовленного, как в примере 2; фиг. 5 показывает высвобождение медроксипрогестерона ацетата (МРА) (по оси ординат % высвобожденного количества в зависимости от времени по оси абсцисс подкожных имплантатов) из обыкновенного подкожного имплантата 31 и подкожного имплантата изобретения 33; фиг. 6 показывает профиль высвобождения медроксипрогестерона ацетата (МРА) (по оси ординат% высвобожденного количества в зависимости от времени по оси абсцисс) из обыкновенного подкожного имплантата 32 и подкожного имплантата изобретения 34; фиг. 7 показывает профиль высвобождения фентанилцитрата (по оси ординат % высвобожденного количества в зависимости от времени по оси абсцисс) из обыкновенных имплантатов 41 и подкожных имплантатов 42; фиг. 8 показывает высвобождение фентанилцитрата (по оси ординат % высвобожденного количества в зависимости от времени по оси абсцисс) из одиночного имплантата изобретения 42. Подробное описание изобретения Предпочтительно в подкожных имплантатах изобретения микрочастицы, содержащие активный ингредиент, диспергированный в PLGA, получены способом, включающим следующие стадии:a) сухое смешение PLGA с активным ингредиентом или а') влажное гранулирование смеси PLGA и активного ингредиента;b) необязательно, высушивание влажной гранулированной смеси, полученной на стадии а'), для получения осадка, содержащего минимальное количество жидкого содержимого между 0,1 и 3%;c) экструдирование смеси, полученной на стадии b), или сухой смеси, полученной на стадии а);d) измельчение и просеивание экструдированного продукта, полученного на стадии с), в связи с этим получение микрочастиц, имеющих размер, как обусловлено просеиванием, меньше чем 500 мкм,более предпочтительно во фракции [50; 250 мкм]. Растворителем, предпочтительно используемым на стадии а'), является, например, этанол или вода. Подкожные имплантаты настоящего изобретения предпочтительно содержат активный ингредиент,выбранный из группы, состоящей из пептида, действующего компонента, способного увеличить плотность кости, аналгезирующего наркотического действующего компонента, стероидного гормона, для гормонального лечения во время менопаузы и для контрацепции. Более предпочтительно указанный пептид является выбранным из аворелина, триптолерина, госерелина и лейпрорелина. Активный ингредиент, способный увеличить плотность кости, является предпочтительно выбранным из фармацевтически приемлемых бисфосфоновых кислот и их солей, витамина Д или его аналогов и половых гормонов. Из этих бисфосфоновых кислот и их фармацевтически приемлемых соответствующих солей мы отметим, например, соединения общей формулы (I): в которой M1, M2, М 3 и М 4 являются моновалентными катионами и/или Н, где указанные моновалентные катионы являются выбранными из щелочных металлов, или катионов алифатических или циклоалифатических аминов, и даже более предпочтительно указанные катионы являются Na+, мы упомя-2 017292 нем, например, такие, в которых R1 и R2 имеют значения, приведенные в следующей таблице: Особенно предпочтительными являются динатрия этидронат, динатрия алендронат и динатрия памидронат. Предпочтительно половые гормоны являются выбранными из группы эстрогенов и прогестинов и среди последних более предпочтительно используются андрогенные прогестины. Эстрогены являются эстрогенами стероидного типа и являются выбранными из класса, состоящего из эстрадиола, эстрадиол валерата, эстрадиол ципионата, эстрона, эстрон сульфата или эстрогенов нестероидного типа, например диэтилстилбестрол, р-р'-DDT, бис-фенил-А. Из числа андрогенных прогестинов предпочтительными являются выбранные из класса, состоящего из норэтиндрона, норэтинодрела, норгестрела, десогестрела, норгестимата. В качестве "веществ с наркотической аналгетической активностью" предпочтительными являются морфин и морфинаны, т.е. соединения, имеющие химическую структуру и активность, подобную активности морфина и агонистоврецептора, а также соединения с морфин-типичной (morphinic-type) активностью, иными словами также агонистырецептора, но с другой химической структурой, такие как те,которые относятся к классу фенилпиперидинов (GoodmanGilman's "The pharmacological basis of therapeutics", Ninth Edition Chapter, 23, pages 521-555). В качестве агонистоврецептора фенилпиперидина мы приводим как предпочтительный по меньшей мере один действующий компонент, выбранный из класса, состоящего из меперидина, фентанила и соответствующих фармацевтически приемлемых солей, родственных с фентанилом соединений, например суфентанила, алфентанила, лофентанила, карфентанила, ремифентанила и их фармацевтически приемлемых солей. Действующий компонент, имеющийся в частицах изобретения, может представлять собой гетерогенные размеры или может иметь более гомогенное распределение частиц по размерам. Предпочтительно в подкожных имплантатах изобретения активный ингредиент, содержащийся вPLGA частицах, и активный ингредиент, диспергированный в PLGA, образующем матрикс имплантата,демонстрирует гетерогенное распределение по размерам в пределах от 1 до 63 мкм или от 1 до 100 мкм.PLGA, содержащийся в микрочастицах в подкожных имплантатах изобретения, предпочтительно имеет среднюю молекулярную массу в пределах от 50000 до 150000 Да и молярное отношение молочная кислота/гликолевая кислота в пределах от 50/50 до 75/25.PLGA, образующий матрикс подкожных имплантатов согласно настоящему изобретению, предпочтительно имеет среднюю молекулярную массу в пределах от 10000 до 40000 Да и молярное отношение молочная кислота/гликолевая кислота в пределах от 50/50 до 60/40. Фиг. 1 предоставляет схематический вид предпочтительного варианта осуществления подкожного имплантата согласно настоящему изобретению, содержащего кроме PLGA частиц (1), в которых диспергирован активный ингредиент согласно настоящему изобретению, также частицы (2) того же самого активного ингредиента или активного ингредиента (2'), отличного от того, который содержится в (1). На данном чертеже (3) указывает PLGA, формирующий каркасную структуру имплантата и имеющий температуру стеклования ниже, чем та температура, которая используется для приготовления (1). Кроме того, настоящее изобретение относится к приготовлению подкожных имплантатов согласно настоящему изобретению способом, включающим следующие стадии:(A) сухое смешение следующих компонентов (1) микрочастиц согласно настоящему изобретению и(2) частиц, состоящих только из того же самого активного ингредиента, который содержится в (1), или(2') частиц, состоящих из другого активного ингредиента, предпочтительно относящегося к тому же самому терапевтическому классу как тот, который содержится в (1), и (3) PLGA, имеющего температуру стеклования ниже, чем температура PLGA, используемая для приготовления (1); или (А') влажное гранулирование в подходящем растворителе, таком как вода или низший спирт, предпочтительно этаноле,смеси, состоящей из компонентов (1), (3), и необязательно (2) или (2');(B) высушивание влажной гранулированной смеси, полученной на стадии (А');(C) экструдирование смеси, полученной на стадии (А) или на стадии (В).-3 017292 Следующие примеры приготовления частиц согласно настоящему изобретению мы сообщаем здесь с иллюстративными, а не с ограничивающими целями. Сведения, подтверждающие возможность осуществления изобретения Пример 1. Приготовление микрочастиц, содержащих аволерин и PLGA. Подкожны имплантаты, содержащие 25% вес./вес. аволерина (имеющий распределение частиц по размерам в пределах от 1 до 63 мкм) и PLGA (L/G молярное отношение 54/46 - средняя молекулярная масса 51000 Да), приготавливали, как описано в WO 00/33809, и измельчали с использованием ротационной мельницы. Это сопровождалось просеиванием микрочастиц для того, чтобы отобрать частицы,включенные в пределы фракции [50; 250 мкм]. Пример 2. Подкожные имплантаты, содержащие пептиды. Композиция 21. Подкожные имплантаты, содержащие 25% вес./вес. аволерина (имеющий распределение частиц по размерам в пределах от 1 до 63 мкм) и PLGA (L/G молярное отношение 50/50 - средняя молекулярная масса 100000 Да), приготовлены, как описано в WO 00/33809. Композиция 22. Подкожные имплантаты, содержащие 39% вес./вес. аволерина (имеющий распределение частиц по размерам в пределах от 1 до 63 мкм) и PLGA (L/G молярное отношение 50/50 - средняя молекулярная масса 100000 Да), приготовлены, как описано в WO 00/33809, и измельчены с использованием ротационной дробилки с ножевым барабаном, как описано в примере 1. Это сопровождалось просеиванием микрочастиц для того, чтобы отобрать частицы, включенные в [50; 250 мкм] интервал. Подкожные имплантаты, содержащие 25% m/m аволерина, приготавливали смешиванием и экструдированием 13% m/m аволерина (имеющий распределение частиц по размерам в пределах от 1 до 63 мкм), 57% m/m PLGA (L/G молярное отношение 50/50 - средняя молекулярная масса 17000 Да) и 30%m/m частиц, полученных, как описано выше. В таких имплантатах (содержащих 25% m/m аволерина) 12% m/m получалось из частиц и 13% m/m из внешнего матрикса. Композиция 23. Подкожные имплантаты, содержащие 26% вес./вес. агониста LHRH, приготовлены смешиванием и экструдированием 14% вес./вес. лейпрорелина (имеющий распределение частиц по размерам в пределах от 1 до 63 мкм), 56% вес./вес. PLGA (L/G молярное отношение 50/50 - средняя молекулярная масса 13000 Да) и 30% вес./вес. частиц, полученных, как описано ранее. В таких имплантатах(содержащих 26% вес./вес. агонистов LHRH), 12% вес./вес. (аворелин) получалось из частиц и 14% вес./вес. (лейпрорелин) из внешнего матрикса. Количество аворелина является одинаковым в этой композиции и в частицах, включенных в композицию имплантатов 22. В этом случае пептид, содержащийся во внешнем матриксе, является очень похожим (лейпрорелин), но не идентичным. Далее, количества растворенного лейпрорелина и аворелина могут быть оценены отдельно в каждой точке на протяжении наблюдения во время проверки на растворение in vitro. Это дает возможность узнать профиль высвобождения аворелина из частиц без какоголибо аналитического вмешательства из высвобождающей пептид формы внешнего матрикса. Фиг. 2 показывает профили высвобождения активного ингредиента (% высвобожденной доли в зависимости от времени после иммерсии) из композиций 21 и 22. Профиль высвобождения, полученный композицией 22 ближе к линейности, чем профиль, полученный с композицией 21. Фиг. 3 показывает профили высвобождения активного ингредиента (% общего высвобожденного количества в зависимости от времени после иммерсии) из подкожного имплантата 23. В этом случае объясняется путь, которым каждый пептид высвобождается или из частиц, или из матрикса. Фиг. 4 показывает профили высвобождения активного ингредиента (% общего высвобожденного количества в зависимости от времени после иммерсии) из композиции 21 и профиль высвобождения аворелина (% высвобожденной доли аволерина в зависимости от времени после иммерсии) из подкожных имплантатов 23. Очень похожий профиль высвобождения аворелина (% высвобожденной доли в зависимости от времени) наблюдается между частицами, содержащимися в композиции 23 и имплантатах Nr 21, несмотря на то, что в подкожных имплантатах изобретения содержание этого активного ингредиента составляет половину от содержащегося в 21. Пример 3. Приготовление подкожного имплантата, содержащего медрокси прогестерон ацетат(МРА). Композиция 31. Подкожные имплантаты, содержащие 30% вес./вес. МРА (имеющий распределение частиц по размерам в пределах от 1 до 63 мкм) и PLGA (L/G молярное отношение 75/25 - средняя молекулярная масса 120000 Да), приготовлены, как описано в WO 00/33809. Композиция 32. Подкожные имплантаты, содержащие 40% вес./вес. МРА (имеющий распределение частиц по размерам в пределах от 1 до 63 мкм) и PLGA (L/G молярное отношение 75/25 - средняя молекулярная масса 120000 Да), приготовлены, как описано в WO 00/33809. Композиция 33. Подкожные имплантаты, содержащие 55% вес./вес. МРА (имеющий распределение частиц по размерам в пределах от 1 до 63 мкм) и PLGA (L/G молярное отношение 75/25 - средняя молекулярная масса 120000 Да), приготовлены, как описано в WO 00/33809 (температура экструзии-4 017292 120 С), и измельчены с использованием ротационной дробилки с ножевым барабаном. Это сопровождалось просеиванием микрочастиц для того, чтобы отобрать частицы, включенные в [50; 250 мкм] интервал. Подкожные имплантаты, содержащие 30% вес./вес. МРА приготовлены смешиванием и экструдированием (температура экструзии 95 С) 21% вес./вес. МРА (имеющий распределение частиц по размерам в пределах от 1 до 63 мкм), 62% вес./вес. PLGA (L/G молярное отношение 60/40 - средняя молекулярная масса 53000 Да) и 17% вес./вес. частиц, полученных, как описано ранее. В этих имплантатах (содержащих 30% вес./вес. МРА) 9% вес./вес. получалось из частиц и 21% вес./вес. из внешнего матрикса. Композиция 34. Подкожные имплантаты, содержащие 25% вес./вес. МРА (имеющий распределение частиц по размерам в пределах от 1 до 63 мкм) и PLGA (L/G молярное отношение 75/25 - средняя молекулярная масса 120000 Да), приготовлены, как описано в WO 00/33809 (температура экструзии 120 С), и измельчены с использованием ротационной дробилки с ножевым барабаном. Это сопровождалось просеиванием микрочастиц для того, чтобы отобрать частицы, включенные в [50; 250 мкм] интервал. Подкожные имплантаты, содержащие 40% вес./вес. МРА приготовлены смешиванием и экструдированием (температура экструзии 95 С) 13% вес./вес. МРА (имеющий распределение частиц по размерам в пределах от 1 до 63 мкм), 37% вес./вес. PLGA (L/G молярное отношение 60/40 - средняя молекулярная масса 53000 Да) и 50% вес./вес. частиц, полученных, как описано ранее. В этих имплантатах (содержащих 40% вес./вес. МРА) 27% вес./вес. получалось из частиц и 13 % вес./вес. из внешнего матрикса. Фиг. 5 представляет сравнение профилей высвобождения активного ингредиента (% общего высвобожденного количества в зависимости от времени после иммерсии) из композиций 31 и 33 (30% вес./вес. нагруженные МРА депо). Фиг. 6 представляет сравнение профилей высвобождения активного ингредиента (% общего высвобожденного количества в зависимости от времени после иммерсии) из композиций 32 и 34 (40% вес./вес. нагруженные МРА депо). В обоих случаях "нагруженные депо частиц" обеспечивают более линейный профиль высвобождения. В основном это было получено укорочением периода плохого растворения, наблюдаемого от 14 до 42 дня при стандартных депо. Пример 4. Приготовление подкожного имплантата, содержащего фентанилцитрат. Композиция 41. Подкожные имплантаты, содержащие 42% вес./вес. фентанилцитрата (имеющий распределение частиц по размерам в пределах от 1 до 63 мкм) и PLGA (L/G молярное отношение 75/25 средняя молекулярная масса 120000 Да), приготовлены, как описано в WO 00/33809. Композиция 42. Подкожные имплантаты, содержащие 36% вес./вес. фентанилцитрата (имеющий распределение частиц по размерам в пределах от 1 до 63 мкм) и PLGA (L/G молярное отношение 75/25 средняя молекулярная масса 120000 Да), приготовлены, как описано в WO 00/33809 (температура экструзии 120 С), и измельчены с использованием ротационной дробилки с ножевым барабаном. Это сопровождалось просеиванием микрочастиц для того, чтобы отобрать частицы, включенные в [50; 250 мкм] интервал. Подкожные имплантаты, содержащие 42% вес./вес. фентанилцитрата, приготовлены смешиванием и экструдированием (температура экструзии 95 С) 22% вес./вес. фентанилцитрата (имеющий распределение частиц по размерам в пределах от 1 до 63 мкм), 22% вес./вес. PLGA (L/G молярное отношение 55/45 - средняя молекулярная масса 51000 Да) и 56% вес./вес. частиц, полученных, как описано ранее. В этих имплантатах (содержащих 42% вес./вес. фентанилцитрата) 20% вес./вес. получалось из частиц и 22% вес./вес. из внешнего матрикса. Фиг. 7 представляет сравнение профилей высвобождения активного ингредиента (% общего высвобожденного количества в зависимости от времени после иммерсии (погружения из композиций 41 и 42. Здесь вновь "нагруженные депо частиц" обеспечивают более линейный профиль высвобождения. В этом случае композиция 42 в действительности приводит к объективно линейному профилю высвобождения (R2 = 0,9705 для % высвобожденного = f(t) от 1 до 7 недели, вычисленный с помощью линейной регрессии - см. фиг. 8). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Подкожный имплантат, полученный экструзией, содержащий (1) микрочастицы, включающие активный ингредиент, диспергированный в PLGA-матриксе (сополимер молочной и гликолевой кислот),где все указанные микрочастицы (1) диспергированы в PLGA-матриксе (3), имеющем температуру стеклования ниже, чем температура стеклования PLGA, содержащегося в (1). 2. Подкожный имплантат по п.1, в котором микрочастицы (1) получены измельчением или приданием сферической формы экструдированного PLGA, содержащего диспергированный в нем активный ингредиент. 3. Подкожный имплантат по п.2, в котором указанные микрочастицы (1) получены способом, включающим следующие стадии:a) сухое смешивание PLGA с активным ингредиентом или а') влажное гранулирование смеси PLGA и активного ингредиента;b) высушивание влажной гранулированной смеси, полученной на стадии а'), для получения осадка,содержащего минимальное количество жидкого содержимого между 0,1 и 3%;c) экструдирование смеси, полученной на стадии b), или сухой смеси, полученной на стадии а);d) измельчение и просеивание экструдированного продукта, полученного на стадии с), в связи с этим получение микрочастиц, имеющих размер, как обусловлено просеиванием, меньше чем 500 мкм. 4. Подкожный имплантат по п.3, в котором на стадии d) экструдированный продукт измельчают до получения микрочастиц, имеющих размер, как обусловлено просеиванием, во фракции [50; 250 мкм]. 5. Подкожный имплантат по любому из пп.1-4, дополнительно содержащий, кроме микрочастиц (1),микрочастицы (2), состоящие из того же самого активного ингредиента, содержащегося в (1), или микрочастиц (2'), состоящих из другого активного ингредиента. 6. Подкожный имплантат по п.5, в котором микрочастицы (2') представляют собой активный ингредиент того же самого терапевтического класса, как тот, который содержится в (1). 7. Подкожный имплантат по п.5 или 6, в котором активный ингредиент, содержащийся в (1) и микрочастицах (2) или (2'), выбран из группы, состоящей из пептида, активного ингредиента, способного увеличить плотность кости, аналгезирующего наркотического действующего компонента, стероидного гормона для гормонального лечения во время менопаузы и для контрацепции. 8. Подкожный имплантат по п.7, в котором пептид выбран из группы, состоящей из аворелина,триптолерина, госерелина и лейпрорелина. 9. Подкожный имплантат по п.7, в котором активный ингредиент, способный увеличить плотность кости, выбран из фармацевтически приемлемых бисфосфоновых кислот и их фармацевтически приемлемых солей, витамина Д и половых гормонов. 10. Подкожный имплантат по п.9, в котором эти соли бисфосфоновых кислот выбраны из динатрия этидроната, динатрия алендроната и динатрия памидроната. 11. Подкожный имплантат по п.9, в котором указанные половые гормоны выбраны из группы эстрогенов и андрогенных прогестинов. 12. Подкожный имплантат по п.11, в котором указанные эстрогены выбраны из класса, состоящего из эстрадиола, эстрадиол валерата, эстрадиол ципионата, эстрона, эстрон сульфата или эстрогенов нестероидного типа. 13. Подкожный имплантат по п.11, в котором указанные андрогенные прогестины выбраны из класса, состоящего из норэтиндрона, норэтинодрела, норгестрела, десогестрела, норгестимата. 14. Подкожный имплантат по п.7, в котором активный ингредиент с наркотической аналгетической активностью выбран из группы, состоящей из морфина и морфинанов и агонистов -рецептора. 15. Подкожный имплантат по п.14, в котором указанные агонисты -рецептора являются фенилпиперидинами, выбранными из группы, состоящей из меперидина, фентанила и их фармацевтически приемлемых солей и родственных с фентанилом соединений, выбранных из суфентанила, алфентанила, лофентанила, карфентанила, ремифентанила и их фармацевтически приемлемых солей. 16. Подкожный имплантат по любому из пп.11-15, в котором активный ингредиент, содержащийся в (1), микрочастицах (2) или (2'), имеет гомогенное или гетерогенное распределение частиц по размерам. 17. Подкожный имплантат по п.16, в котором активный ингредиент имеет гетерогенное распределение частиц по размерам. 18. Подкожный имплантат по п.17, в котором гетерогенное распределение частиц по размерам находится в пределах от 1 до 63 мкм или от 1 до 100 мкм. 19. Подкожный имплантат по любому из пп.1-18, в котором PLGA, содержащийся в (1), имеет среднюю молекулярную массу в пределах от 50000 до 150000 Да и молярное отношение молочная кислота/гликолевая кислота в пределах от 50/50 до 75/25. 20. Подкожный имплантат по любому из пп.1-19, в котором PLGA (3) имеет среднюю молекулярную массу от 10000 до 40000 Да и молярное отношение молочная кислота/гликолевая кислота в пределах от 50/50 до 60/40. 21. Способ приготовления подкожного имплантата по любому из пп.1-20, включающий следующие стадии:(А) сухое смешивание частиц (1) с PLGA (3) и необязательно активных микрочастиц (2) или (2') или(А') влажное гранулирование частиц (1) с PLGA (3) и необязательно с (2) или (2');(B) высушивание влажной гранулированной смеси, полученной на стадии (А');(C) экструдирование смеси, полученной на стадии (А) или на стадии (В).
МПК / Метки
МПК: A61K 9/16
Метки: длительного, компонент, времени, высвобождающие, подкожные, активный, имплантаты, течение
Код ссылки
<a href="https://eas.patents.su/10-17292-podkozhnye-implantaty-vysvobozhdayushhie-aktivnyjj-komponent-v-techenie-dlitelnogo-vremeni.html" rel="bookmark" title="База патентов Евразийского Союза">Подкожные имплантаты, высвобождающие активный компонент в течение длительного времени</a>
Предыдущий патент: Белки слияния на основе rage, их композиции и способы их применения
Следующий патент: Способ очистки данных морской сейсмоприемной косы с нерегулярным расположением приемников от ложных отражений
Случайный патент: Способ приготовления стекольной шихты