Способ получения алмотриптана высокой чистоты
Номер патента: 16759
Опубликовано: 30.07.2012
Авторы: Радль Станислав, Тисовска Люция, Стах Ян, Петрицкова Гана, Ридван Лудек, Вослар Михаль, Затопкова Моника, Груби Петр
Формула / Реферат
1. Способ получения и очистки 3-[2-(диметиламино)этил]-5-(1-пирролидинилсульфонилметил)-1H-индола формулы (I)
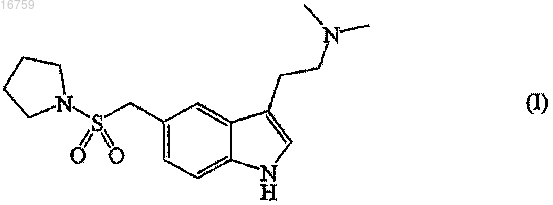
отличающийся тем, что:
(а) 4-(1-пирролидинилсульфонилметил)фенилгидразин путем взаимодействия с щелочной солью функционального производного 4-хлорбутаналя, выбранной из 4-хлор-1-гидроксибутан-1-сульфоната натрия или калия, превращают в соль, являющуюся нерастворимой или плохо растворимой в воде, которую превращают в 3-(2-аминоэтил)-5-(1-пирролидинилсульфонилметил)индол, который далее без выделения превращают в раствор основания алмотриптана, которое образует кристаллическую соль алмотриптана с органической или неорганической кислотой;
(б) соль алмотриптана превращают в основание алмотриптана, которое выделяют из раствора в кристаллической форме;
(в) основание алмотриптана очищают путем кристаллизации из органического растворителя.
2. Способ по п.1, отличающийся тем, что на стадии (а) неочищенное основание алмотриптана получают взаимодействием 4-(1-пирролидинилсульфонилметил)фенилгидразина или его соли с органической кислотой со щелочной солью функционального производного 4-хлорбутаналя, выбранной из 4-хлор-1-гидроксибутан-1-сульфоната натрия или калия, временно образовавшуюся соль гидразония формулы (VI) превращают в 3-(2-аминоэтил)-5-(1-пирролидинилсульфонилметил)индол, который метилируют на последней стадии без предварительного выделения действием раствора формальдегида и NaBH4 с образованием алмотриптана.
3. Способ по п.2, отличающийся тем, что выделяют соль формулы (V)
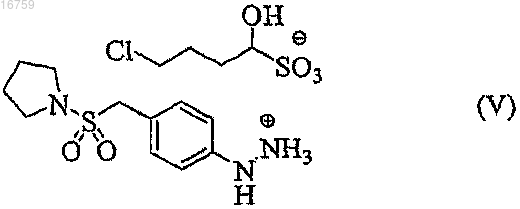
которая образуется при смешивании гидрохлорида 4-(1-пирролидинилсульфонилметил)фенилгидразина и 4-хлор-1-гидроксибутан-1-сульфоната натрия или калия.
4. Способ по п.1, отличающийся тем, что на стадии (а) неочищенное основание алмотриптана превращают действием фумаровой кислоты в его соль в органическом растворителе.
5. Способ по п.4, отличающийся тем, что растворитель выбирают из метанола, этанола, н-бутанола или 2-пропанола.
6. Способ по п.1, отличающийся тем, что на стадии (б) соль алмотриптана по п.1 обрабатывают водным раствором основания, более сильного, чем алмотриптан, после чего основание алмотриптана экстрагируют органическим растворителем.
7. Способ по п.6, отличающийся тем, что основание алмотриптана высвобождают действием водного раствора KOH, NaOH, K2CO3, Na2CO3 или аммиака, а органический растворитель для экстракции вещества (I) представляет собой этилацетат, метилэтилкетон, метилизобутилкетон, толуол или их смеси друг с другом.
8. Способ по п.6 или 7, отличающийся тем, что основание алмотриптана кристаллизуют из органического растворителя.
9. Способ по п.8, отличающийся тем, что кристаллизацию осуществляют путем концентрирования или путем охлаждения раствора или их комбинацией.
10. Способ по п.1, отличающийся тем, что на стадии (б) основание алмотриптана формулы (I) перекристаллизовывают из растворителя, выбранного из ароматических углеводородов, кетонов, спиртов, простых эфиров, сложных эфиров и нитрила уксусной кислоты.
11. Способ по п.10, отличающийся тем, что растворитель для кристаллизации основания алмотриптана формулы (I) выбирают из толуола, ацетона, бутанона, метилизобутилкетона, ацетонитрила, метанола, этанола, 2-пропанола, н-бутанола, тетрагидрофурана, диоксана, а также метилового, этилового или изопропилового эфиров уксусной кислоты.
12. Кристаллический 3-[2-(диметиламино)этил]-5-(1-пирролидинилсульфонилметил)-1H-индол формулы (I).
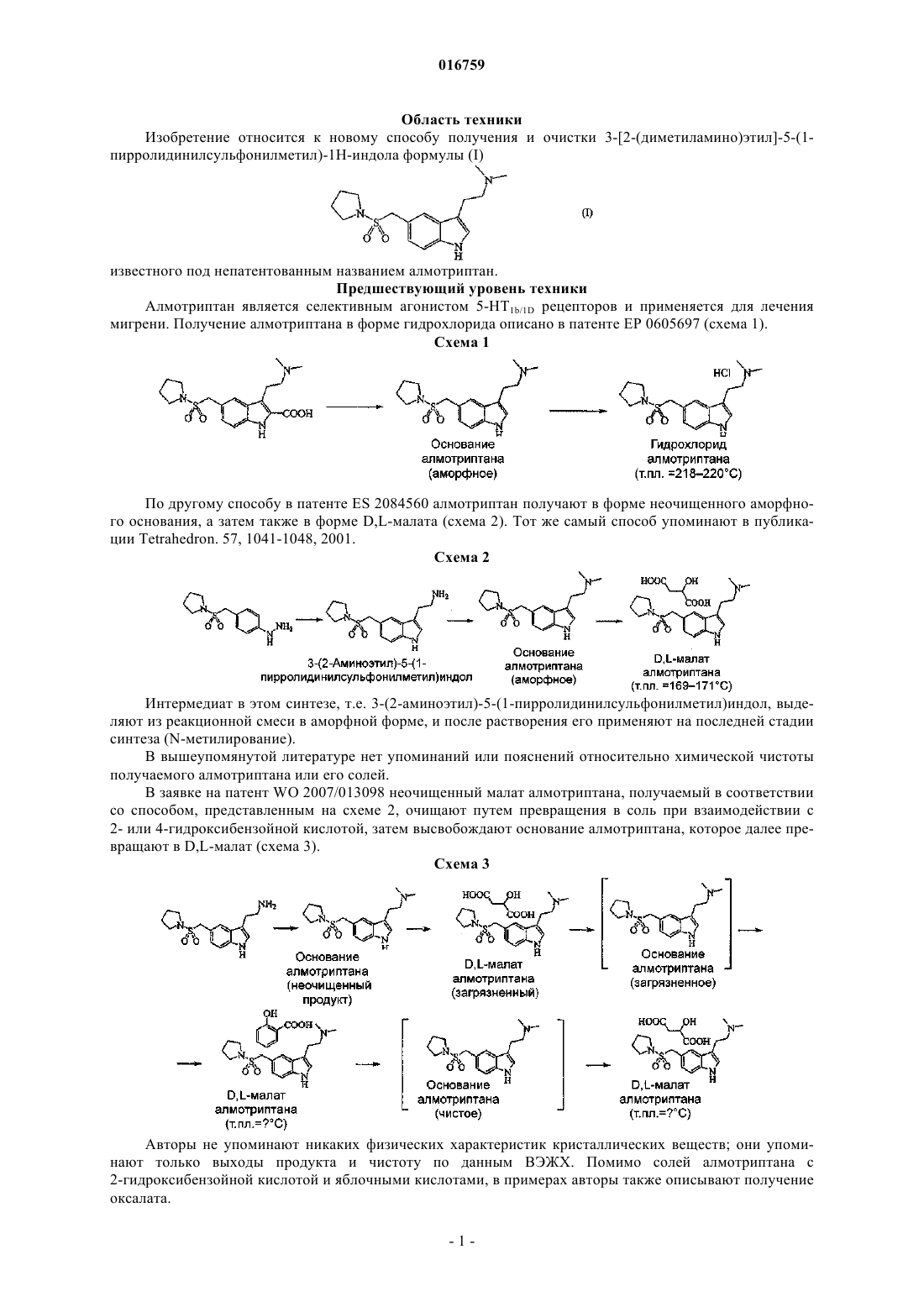
13. Кристаллический 3-[2-(диметиламино)этил]-5-(1-пирролидинилсульфонилметил)-1H-индол формулы (I) по п.12, имеющий следующие значения характеристичных углов дифракции 2θ на дифракционной рентгенограмме: 12,30; 16,38; 17,84; 21,14±0,2° 2θ, т.е. представляющий собой полиморфную форму А.
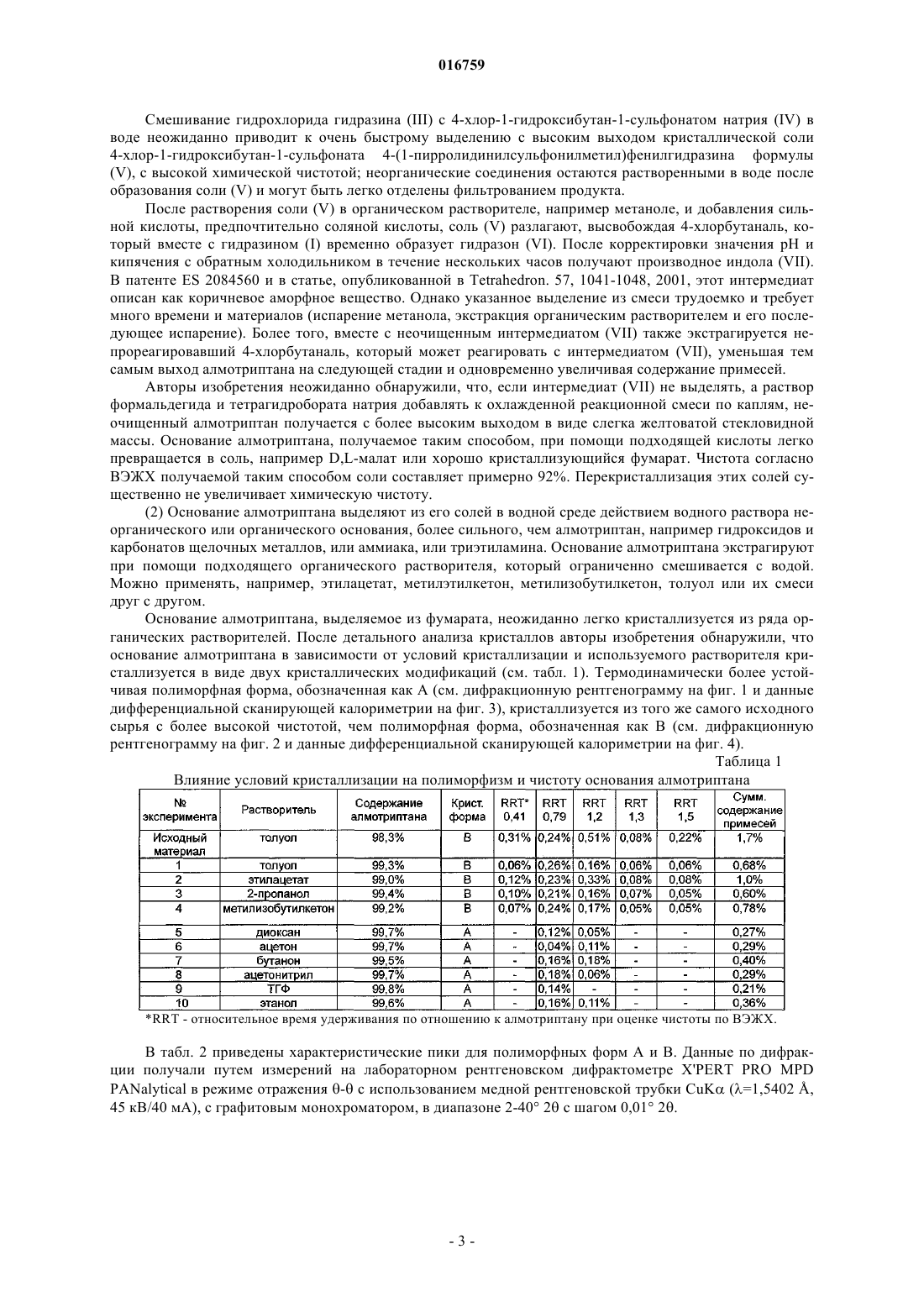
14. Кристаллический 3-[2-(диметиламино)этил]-5-(1-пирролидинилсульфонилметил)-1Н-индол формулы (I) по п.12, имеющий следующие значения характеристичных углов дифракции 2θ на дифракционной рентгенограмме: 7,40; 9,08; 14,19; 20,16; 23,61±0,2° 2θ, т.е. представляющий собой полиморфную форму В.
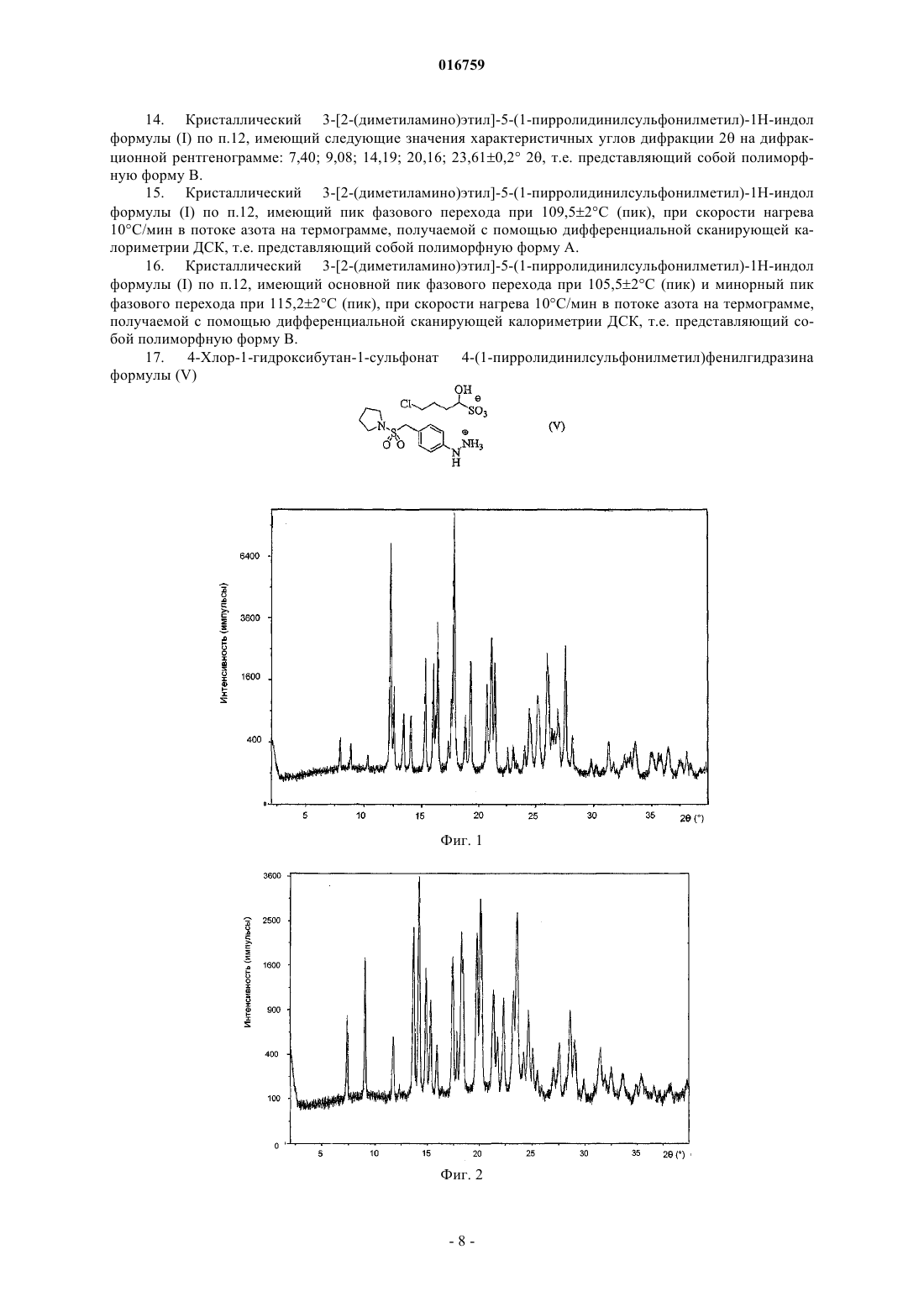
15. Кристаллический 3-[2-(диметиламино)этил]-5-(1-пирролидинилсульфонилметил)-1Н-индол формулы (I) по п.12, имеющий пик фазового перехода при 109,5±2°С (пик), при скорости нагрева 10°С/мин в потоке азота на термограмме, получаемой с помощью дифференциальной сканирующей калориметрии ДСК, т.е. представляющий собой полиморфную форму А.
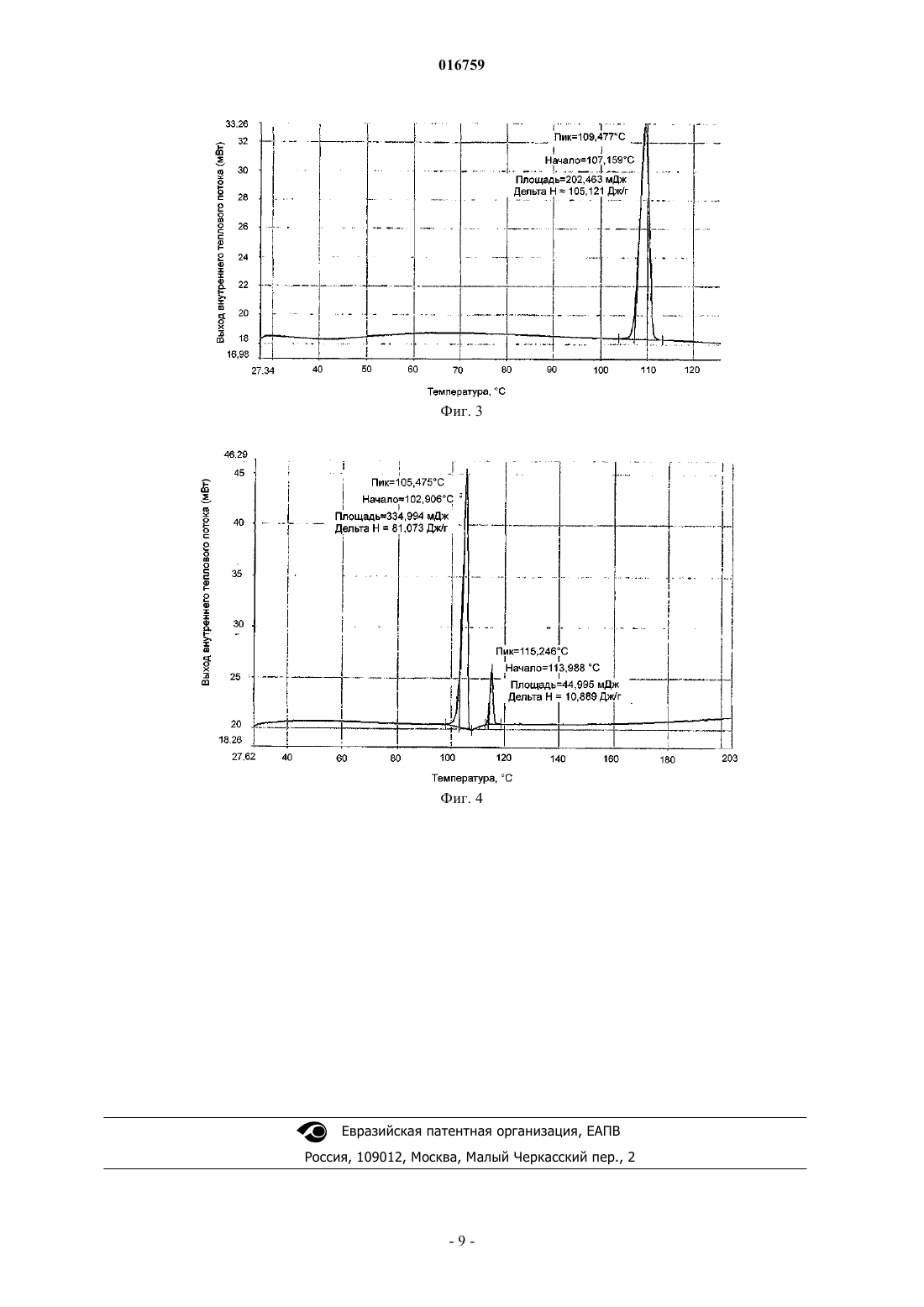
16. Кристаллический 3-[2-(диметиламино)этил]-5-(1-пирролидинилсульфонилметил)-1H-индол формулы (I) по п.12, имеющий основной пик фазового перехода при 105,5±2°С (пик) и минорный пик фазового перехода при 115,2±2°С (пик), при скорости нагрева 10°С/мин в потоке азота на термограмме, получаемой с помощью дифференциальной сканирующей калориметрии ДСК, т.е. представляющий собой полиморфную форму В.
17. 4-Хлор-1-гидроксибутан-1-сульфонат 4-(1-пирролидинилсульфонилметил)фенилгидразина формулы (V)
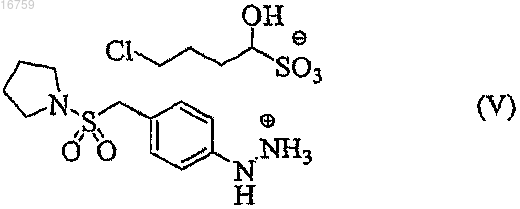
Текст
СПОСОБ ПОЛУЧЕНИЯ АЛМОТРИПТАНА ВЫСОКОЙ ЧИСТОТЫ Изобретение относится к способу получения и очистки вещества формулы (I), т.е. 3-[2-(диметиламино)этил]-5-(1-пирролидинилсульфонилметил)-1H-индола, который включает:(а) превращение 4-(1-пирролидинилсульфонилметил)фенилгидразина формулы (III) путем взаимодействия с щелочной солью функционального производного 4-хлорбутаналя,выбранной из 4-хлор-1-гидроксибутан-1-сульфоната натрия или калия, в соль, являющуюся нерастворимой или плохо растворимой в воде, которую превращают в 3-(2-аминоэтил)-5-(1 пирролидинилсульфонилметил)индол формулы (VII), который далее без выделения превращают в раствор основания алмотриптана, которое с органической или неорганической кислотой образует кристаллическую соль алмотриптана; (б) превращение соли алмотриптана в основание алмотриптана, которое выделяют из раствора в кристаллической форме; (в) очистку основания алмотриптана путем кристаллизации из органического растворителя. 016759 Область техники Изобретение относится к новому способу получения и очистки 3-[2-(диметиламино)этил]-5-(1 пирролидинилсульфонилметил)-1H-индола формулы (I) известного под непатентованным названием алмотриптан. Предшествующий уровень техники Алмотриптан является селективным агонистом 5-HT1b/1D рецепторов и применяется для лечения мигрени. Получение алмотриптана в форме гидрохлорида описано в патенте ЕР 0605697 (схема 1). Схема 1 По другому способу в патенте ES 2084560 алмотриптан получают в форме неочищенного аморфного основания, а затем также в форме D,L-малата (схема 2). Тот же самый способ упоминают в публикации Tetrahedron. 57, 1041-1048, 2001. Схема 2 Интермедиат в этом синтезе, т.е. 3-(2-аминоэтил)-5-(1-пирролидинилсульфонилметил)индол, выделяют из реакционной смеси в аморфной форме, и после растворения его применяют на последней стадии синтеза (N-метилирование). В вышеупомянутой литературе нет упоминаний или пояснений относительно химической чистоты получаемого алмотриптана или его солей. В заявке на патент WO 2007/013098 неочищенный малат алмотриптана, получаемый в соответствии со способом, представленным на схеме 2, очищают путем превращения в соль при взаимодействии с 2- или 4-гидроксибензойной кислотой, затем высвобождают основание алмотриптана, которое далее превращают в D,L-малат (схема 3). Схема 3 Авторы не упоминают никаких физических характеристик кристаллических веществ; они упоминают только выходы продукта и чистоту по данным ВЭЖХ. Помимо солей алмотриптана с 2-гидроксибензойной кислотой и яблочными кислотами, в примерах авторы также описывают получение оксалата.-1 016759 Очевидно, что способ очистки неочищенного алмотриптана очень важен для достижения требуемого качества и выхода продукта. В настоящем изобретении предлагается эффективный способ решения задачи получения алмотриптана высокой чистоты. Описание изобретения Настоящее изобретение относится к новому способу получения и очистки вещества формулы (I),т.е. 3-[2-(диметиламино)этил]-5-(1-пирролидинилсульфонилметил)-1H-индола(а) превращение 4-(1-пирролидинилсульфонилметил)фенилгидразина формулы (III) путем взаимодействия с щелочной солью функционального производного 4-хлорбутаналя, выбранной из 4-хлор-1 гидроксибутан-1-сульфоната натрия или калия, в соль, являющуюся нерастворимой или плохо растворимой в воде, которую превращают в 3-(2-аминоэтил)-5-(1-пирролидинилсульфонилметил)индол формулы(VII), который далее без выделения превращают в раствор основания алмотриптана, которое с органической или неорганической кислотой образует кристаллическую соль алмотриптана;(б) превращение соли алмотриптана в основание алмотриптана, которое выделяют из раствора в кристаллической форме;(в) очистку основания алмотриптана путем кристаллизации из органического растворителя. Схема 4 Изобретение также относится к получению полиморфных форм кристаллического основания алмотриптана. Подробное описание изобретения(1) На первой стадии исходный 4-(1-пирролидинилсульфонилметил)фенилгидразин (III) (схема 4) взаимодействует с 4-хлорбутаналем. С учетом нестабильности 4-хлорбутаналя обычно применяют производное этого вещества с защищенной альдегидной группой, например ацеталь или аддукт с NaHSO3. Арилгидразины обычно получают восстановлением соответствующей соли диазония дихлоридом олова. Известно, что гидрохлориды арилгидразинов, получаемые таким способом, имеют относительно высокое содержание солей олова (см., например, публикацию J. Am. Chem. Soc. 78, 5854-5856, 1956). Гидразин (III), получаемый восстановлением соответствующей соли диазония дихлоридом олова в соответствии со способом, представленным в публикации Tetrahedron. 57, 1041-1048, 2001, содержит от 13 до 16% олова, что соответствует приблизительно 16-22% сульфатной золы. Применение такого загрязненного гидрохлорида гидразина (III) для получения алмотриптана неудобно, поскольку высокое содержание солей олова значительно увеличивает расход Na2HPO4 при корректировке рН до оптимального значения для превращения гидразина (III) в производное индола (VII). Кроме того, соли олова нерастворимы при более высоком значении рН; мелкодисперсную неорганическую суспензию труднее перемешивать и очень трудно фильтровать. Соли олова можно удалить из неочищенного гидрохлорида гидразина (III) путем высвобождения основания гидразина, его экстракцией органическим растворителем и превращением в гидрохлорид. Однако эта операция требует значительного расхода времени и материалов.-2 016759 Смешивание гидрохлорида гидразина (III) с 4-хлор-1-гидроксибутан-1-сульфонатом натрия (IV) в воде неожиданно приводит к очень быстрому выделению с высоким выходом кристаллической соли 4-хлор-1-гидроксибутан-1-сульфоната 4-(1-пирролидинилсульфонилметил)фенилгидразина формулы(V), с высокой химической чистотой; неорганические соединения остаются растворенными в воде после образования соли (V) и могут быть легко отделены фильтрованием продукта. После растворения соли (V) в органическом растворителе, например метаноле, и добавления сильной кислоты, предпочтительно соляной кислоты, соль (V) разлагают, высвобождая 4-хлорбутаналь, который вместе с гидразином (I) временно образует гидразон (VI). После корректировки значения рН и кипячения с обратным холодильником в течение нескольких часов получают производное индола (VII). В патенте ES 2084560 и в статье, опубликованной в Tetrahedron. 57, 1041-1048, 2001, этот интермедиат описан как коричневое аморфное вещество. Однако указанное выделение из смеси трудоемко и требует много времени и материалов (испарение метанола, экстракция органическим растворителем и его последующее испарение). Более того, вместе с неочищенным интермедиатом (VII) также экстрагируется непрореагировавший 4-хлорбутаналь, который может реагировать с интермедиатом (VII), уменьшая тем самым выход алмотриптана на следующей стадии и одновременно увеличивая содержание примесей. Авторы изобретения неожиданно обнаружили, что, если интермедиат (VII) не выделять, а раствор формальдегида и тетрагидробората натрия добавлять к охлажденной реакционной смеси по каплям, неочищенный алмотриптан получается с более высоким выходом в виде слегка желтоватой стекловидной массы. Основание алмотриптана, получаемое таким способом, при помощи подходящей кислоты легко превращается в соль, например D,L-малат или хорошо кристаллизующийся фумарат. Чистота согласно ВЭЖХ получаемой таким способом соли составляет примерно 92%. Перекристаллизация этих солей существенно не увеличивает химическую чистоту.(2) Основание алмотриптана выделяют из его солей в водной среде действием водного раствора неорганического или органического основания, более сильного, чем алмотриптан, например гидроксидов и карбонатов щелочных металлов, или аммиака, или триэтиламина. Основание алмотриптана экстрагируют при помощи подходящего органического растворителя, который ограниченно смешивается с водой. Можно применять, например, этилацетат, метилэтилкетон, метилизобутилкетон, толуол или их смеси друг с другом. Основание алмотриптана, выделяемое из фумарата, неожиданно легко кристаллизуется из ряда органических растворителей. После детального анализа кристаллов авторы изобретения обнаружили, что основание алмотриптана в зависимости от условий кристаллизации и используемого растворителя кристаллизуется в виде двух кристаллических модификаций (см. табл. 1). Термодинамически более устойчивая полиморфная форма, обозначенная как А (см. дифракционную рентгенограмму на фиг. 1 и данные дифференциальной сканирующей калориметрии на фиг. 3), кристаллизуется из того же самого исходного сырья с более высокой чистотой, чем полиморфная форма, обозначенная как В (см. дифракционную рентгенограмму на фиг. 2 и данные дифференциальной сканирующей калориметрии на фиг. 4). Таблица 1 Влияние условий кристаллизации на полиморфизм и чистоту основания алмотриптанаRRT - относительное время удерживания по отношению к алмотриптану при оценке чистоты по ВЭЖХ. В табл. 2 приведены характеристические пики для полиморфных форм А и В. Данные по дифракции получали путем измерений на лабораторном рентгеновском дифрактометре X'PERT PRO MPDPANalytical в режиме отражения - с использованием медной рентгеновской трубки CuK (=1,5402 ,45 кВ/40 мА), с графитовым монохроматором, в диапазоне 2-40 2 с шагом 0,01 2.-3 016759 Таблица 2 Характеристические пики, соответствующие кристаллической форме А и форме В основания алмотриптана Характеристичные данные дифференциальной сканирующей калориметрии, соответствующие формам А и В, представлены на фиг. 3 и 4. Данные дифференциальной сканирующей калориметрии получали путем измерений на приборе Perkin Elmer Pyris 1 DSC при скорости нагрева 10 С/мин в потоке азота. В качестве подходящих растворителей для кристаллизации можно применять, например, ароматические углеводороды (например, толуол), низшие кетоны (например, ацетон, бутанон или метилизобутилкетон), С 1-С 4 низшие спирты (например, этанол или 2-пропанол), эфиры уксусной кислоты (например, метиловый, этиловый или изопропиловый эфиры), циклические эфиры (например, тетрагидрофуран или диоксан) или ацетонитрил, а также их смеси друг с другом. Очищенное основание алмотриптана затем превращают в фармацевтически приемлемую соль,предпочтительно D,L-малат формулы (II) Краткое описание графических материалов На фиг. 1 представлена рентгенограмма, характеристичная для кристаллической формы А основания алмотриптана. На фиг 2 представлена рентгенограмма, характеристичная для кристаллической формы В основания алмотриптана. На фиг. 3 представлены данные дифференциальной сканирующей калориметрии, характеристичные для кристаллической формы А основания алмотриптана. На фиг. 4 представлены данные дифференциальной сканирующей калориметрии, характеристичные для кристаллической формы В основания алмотриптана. Настоящее изобретение описано более подробно на следующих примерах. Примеры Пример 1. Получение 4-хлор-1-гидроксибутан-1-сульфоната 4-(1-пирролидинилсульфонилметил)фенилгидразина (V). Твердый 4-хлор-1-гидроксибутан-1-сульфонат натрия (IV) (21 г) добавляют к раствору 4-(1-пирролидинилсульфонилметил)фенилгидразина (III) (33 г, чистота по ВЭЖХ 89%, содержание олова 13%, сульфатная зола 20%) в воде (80 мл). После перемешивания в течение 15 мин при комнатной температуре смесь охлаждают до 0 С, выделившуюся соль (V) отфильтровывают и промывают ледяной водой. Выход: 31 г (89% в пересчете на чистый гидразин (III), чистота согласно ВЭЖХ 96%, сульфатная зола 4%).-4 016759 Пример 2. Получение фумарата алмотриптана (VIII). Концентрированную соляную кислоту добавляют по каплям к раствору 4-хлор-1-гидроксибутан-1 сульфоната 4-(1-пирролидинилсульфонилметил)фенилгидразина (V) (31 г) в MeOH (300 мл) при температуре 20-25 С, и раствор перемешивают в течение 30 мин. рН корректируют до значения от 4,6 до 4,9 путем добавления раствора Na2HPO4 (30 г в 90 мл воды) и смесь кипятят с обратным холодильником в течение 4 ч. После охлаждения добавляют активированный уголь и смесь фильтруют через диатомит. рН корректируют до значения 7,0-7,5 добавлением 10% водного раствора Na2CO3 (приблизительно 70 мл). К реакционной смеси при температуре 10-15 С в течение 1 ч одновременно добавляют по каплям раствор 35% водного формальдегида (70 мл в 70 мл метанола) и тетрагидробората натрия (10 г в 140 мл воды). Затем смесь перемешивают в течение еще 20-30 мин при температуре 10-15 С. Реакционную смесь подкисляют путем добавления по каплям концентрированной соляной кислоты до значения рН от 5,0 до 5,5. Добавляют 1 г активированного угля, и смесь фильтруют через диатомит в течение 10 мин. Затем корректируют рН раствора до значения 8-9 путем добавления 35% свободного аммиака. После этого MeOH удаляют перегонкой и продукт экстрагируют этилацетатом (3100 мл). Раствор неочищенного алмотриптана концентрируют в вакууме. Остаток после испарения растворяют в 2-пропаноле (20 мл) и добавляют по каплям к раствору фумаровой кислоты (4 г) в 2-пропаноле (100 мл),нагретому до 45-50 С. Смесь охлаждают до 30 С в течение 1 ч и перемешивают при этой температуре в течение 1 ч. Выделившиеся кристаллы отфильтровывают и промывают 2-пропанолом. Выход: 11,5 г (38%), чистота согласно ВЭЖХ 91,8%, температура плавления = 206-210 С. Пример 3. Получение фумарата 1-гидроксиметил-3-[2-(диметиламино)этил]-5-(1 пирролидинилсульфонилметил)-1H-индола (Х) Концентрированную соляную кислоту добавляют по каплям к раствору 4-хлор-1-гидроксибутан-1 сульфоната 4-(1-пирролидинилсульфонилметил)фенилгидразина (V) (31 г) в MeOH (300 мл) при температуре 20-25 С и раствор перемешивают в течение 30 мин. Значение рН корректируют до величины от 4,6 до 4,9 путем добавления раствора Na2HPO4 (30 г в 90 мл воды) и смесь кипятят с обратным холодильником в течение 4 ч. После охлаждения добавляют активированный уголь и смесь фильтруют через диатомит. рН корректируют до значения 7,0-7,5 добавлением 10% водного раствора Na2CO3 (приблизительно 70 мл). К реакционной смеси при температуре 10-15 С в течение 1 ч одновременно добавляют по каплям раствор 35% водного формальдегида (140 мл в 70 мл метанола) и тетрагидробората натрия (10 г в 140 мл воды). Затем смесь перемешивают при температуре 30 С в течение еще 6 ч. Добавляют 1 г активированного угля и через 10 мин смесь фильтруют через диатомит. Затем рН раствора корректируют до значения около 9 путем добавления 10% водного раствора Na2CO3. После этого MeOH удаляют перегонкой и продукт экстрагируют этилацетатом (3100 мл). Раствор неочищенного продукта концентрируют в вакууме. Остаток после испарения растворяют в этаноле (20 мл) и добавляют по каплям к раствору фумаровой кислоты (4 г) в этаноле (80 мл). Смесь перемешивают при комнатной температуре в течение 1 ч. Выделившиеся кристаллы отфильтровывают и промывают этанолом. Выход: 14 г (30%), чистота согласно ВЭЖХ 93,4%, температура плавления = 72-80 С. Перекристаллизация из метанола дает соль с соотношением основание-кислота, равным 2:1, температурой плавления = 186-193 С. Пример 4. Получение фумарата алмотриптана (VIII). Фумарат 1-гидроксиметил-3-[2-(диметиламино)этил]-5-(1-пирролидинилсульфонилметил)-1Hиндола (10 г) перемешивают в 10% водном растворе Na2CO3 (100 мл) и свободное основание экстрагируют этилацетатом. Экстракт сушат и концентрируют в вакууме. Остаток после испарения растворяют в метаноле (60 мл), к раствору добавляют 30% раствор аммиака (20 мл) и смесь перемешивают при комнатной температуре в течение 8 ч. Метанол испаряют; свободное основание алмотриптана экстрагируют этилацетатом. Раствор продукта концентрируют в вакууме. Остаток после испарения растворяют в этаноле (10 мл) и добавляют по каплям к раствору фумаровой кислоты (2,4 г) в этаноле (40 мл). Смесь перемешивают при комнатной температуре в течение 1 ч. Выделяющиеся кристаллы отфильтровывают и промывают этанолом. Выход: 7,4 г (80%), чистота согласно ВЭЖХ 91,7%, температура плавления = 207-211 С. Пример 5. Получение полиморфной формы А кристаллического основания алмотриптана (I). Фумарат алмотриптана (22 г, чистота согласно ВЭЖХ 91,6%) перемешивают в смеси 10% водного раствора Na2CO3 (150 мл) и этилацетата (100 мл). Органическую фазу отделяют, сушат и концентрируют путем испарения растворителя в вакууме. Остаток после испарения растворяют в ацетоне (15 мл). После внесения затравки смесь перемешивают при температуре 10 С в течение 2 ч. Выделяющиеся кристаллы аспирируют и промывают холодным ацетоном.-5 016759 Выход: 10,5 г (66%), чистота согласно ВЭЖХ 99,2%, температура плавления = 109-110 С. Пример 6. Получение полиморфной формы А кристаллического основания алмотриптана (I). Основание алмотриптана (10 г, чистота согласно ВЭЖХ 99,2%) растворяют в бутаноне (20 мл) при температуре 80 С. Раствор охлаждают до температуры 40-50 С, вносят затравку и оставляют медленно охлаждаться до температуры 20 С. Выделяющиеся кристаллы аспирируют и промывают холодным бутаноном. Выход: 7,5 г (75%), чистота согласно ВЭЖХ 99,7%, температура плавления = 109-111 С. Пример 7. Получение полиморфной формы В кристаллического основания алмотриптана (I). Фумарат алмотриптана (22 г, чистота согласно ВЭЖХ 91,6%) перемешивают в смеси 10% водного раствора Na2CO3 (150 мл) и этилацетата (100 мл). Органическую фазу отделяют, сушат и концентрируют путем испарения растворителя в вакууме. Остаток после испарения растворяют в толуоле (30 мл). После внесения затравки смесь перемешивают при температуре 20 С в течение 2 ч. Выделяющиеся кристаллы аспирируют и промывают толуолом. Выход: 13,1 г (81%), чистота согласно ВЭЖХ 97,6%, температура плавления = 104-106 С. Пример 8. Получение полиморфной формы А кристаллического основания алмотриптана (I). Фумарат алмотриптана (22 г, чистота согласно ВЭЖХ 91,6%) перемешивают в смеси 10% водного раствора Na2CO3 (150 мл) и этилацетата (100 мл). Органическую фазу отделяют, сушат и концентрируют путем испарения растворителя в вакууме. Остаток после испарения растворяют в этаноле (20 мл). После внесения затравки смесь перемешивают при температуре 10 С в течение 2 ч. Выделяющиеся кристаллы аспирируют и промывают холодным этанолом. Выход: 11,7 г (72%), чистота согласно ВЭЖХ 99,6%, температура плавления = 110-111 С. Пример 9. Получение D,L-малата алмотриптана (II). Основание алмотриптана (10 г, чистота согласно ВЭЖХ 99,7%) растворяют в MeOH (15 мл) при температуре 40 С и добавляют по каплям к раствору D,L-яблочной кислоты (4 г) в MeOH (30 мл), нагретому до 40 С. Смесь оставляют медленно охлаждаться до 20 С и перемешивают в течение еще 1 ч. Выделяющиеся кристаллы отфильтровывают и промывают с помощью MeOH. Выход: 13 г (93%), чистота согласно ВЭЖХ 99,9%, температура плавления = 169-171 С. Определение химической чистоты. Колонка: Gemini С 18 110 А (1504,6 см, 3 мкм). Температура колонки: 30 С. Подвижная фаза: А: 0,01 М фосфатный буфер (рН 10); В: метанол. Элюирование:(а) 4-(1-пирролидинилсульфонилметил)фенилгидразин путем взаимодействия с щелочной солью функционального производного 4-хлорбутаналя, выбранной из 4-хлор-1-гидроксибутан-1-сульфоната натрия или калия, превращают в соль, являющуюся нерастворимой или плохо растворимой в воде, которую превращают в 3-(2-аминоэтил)-5-(1-пирролидинилсульфонилметил)индол, который далее без выделения превращают в раствор основания алмотриптана, которое образует кристаллическую соль алмотриптана с органической или неорганической кислотой;(б) соль алмотриптана превращают в основание алмотриптана, которое выделяют из раствора в кристаллической форме;(в) основание алмотриптана очищают путем кристаллизации из органического растворителя. 2. Способ по п.1, отличающийся тем, что на стадии (а) неочищенное основание алмотриптана получают взаимодействием 4-(1-пирролидинилсульфонилметил)фенилгидразина или его соли с органической кислотой со щелочной солью функционального производного 4-хлорбутаналя, выбранной из 4-хлор-1-гидроксибутан-1-сульфоната натрия или калия, временно образовавшуюся соль гидразония формулы (VI) превращают в 3-(2-аминоэтил)-5-(1-пирролидинилсульфонилметил)индол, который метилируют на последней стадии без предварительного выделения действием раствора формальдегида иNaBH4 с образованием алмотриптана. 3. Способ по п.2, отличающийся тем, что выделяют соль формулы (V) которая образуется при смешивании гидрохлорида 4-(1-пирролидинилсульфонилметил)фенилгидразина и 4-хлор-1-гидроксибутан-1-сульфоната натрия или калия. 4. Способ по п.1, отличающийся тем, что на стадии (а) неочищенное основание алмотриптана превращают действием фумаровой кислоты в его соль в органическом растворителе. 5. Способ по п.4, отличающийся тем, что растворитель выбирают из метанола, этанола, н-бутанола или 2-пропанола. 6. Способ по п.1, отличающийся тем, что на стадии (б) соль алмотриптана по п.1 обрабатывают водным раствором основания, более сильного, чем алмотриптан, после чего основание алмотриптана экстрагируют органическим растворителем. 7. Способ по п.6, отличающийся тем, что основание алмотриптана высвобождают действием водного раствора KOH, NaOH, K2CO3, Na2CO3 или аммиака, а органический растворитель для экстракции вещества (I) представляет собой этилацетат, метилэтилкетон, метилизобутилкетон, толуол или их смеси друг с другом. 8. Способ по п.6 или 7, отличающийся тем, что основание алмотриптана кристаллизуют из органического растворителя. 9. Способ по п.8, отличающийся тем, что кристаллизацию осуществляют путем концентрирования или путем охлаждения раствора или их комбинацией. 10. Способ по п.1, отличающийся тем, что на стадии (б) основание алмотриптана формулы (I) перекристаллизовывают из растворителя, выбранного из ароматических углеводородов, кетонов, спиртов,простых эфиров, сложных эфиров и нитрила уксусной кислоты. 11. Способ по п.10, отличающийся тем, что растворитель для кристаллизации основания алмотриптана формулы (I) выбирают из толуола, ацетона, бутанона, метилизобутилкетона, ацетонитрила, метанола, этанола, 2-пропанола, н-бутанола, тетрагидрофурана, диоксана, а также метилового, этилового или изопропилового эфиров уксусной кислоты. 12. Кристаллический 3-[2-(диметиламино)этил]-5-(1-пирролидинилсульфонилметил)-1H-индол формулы (I). 13. Кристаллический 3-[2-(диметиламино)этил]-5-(1-пирролидинилсульфонилметил)-1H-индол формулы (I) по п.12, имеющий следующие значения характеристичных углов дифракции 2 на дифракционной рентгенограмме: 12,30; 16,38; 17,84; 21,140,2 2, т.е. представляющий собой полиморфную форму А.-7 016759 14. Кристаллический 3-[2-(диметиламино)этил]-5-(1-пирролидинилсульфонилметил)-1 Н-индол формулы (I) по п.12, имеющий следующие значения характеристичных углов дифракции 2 на дифракционной рентгенограмме: 7,40; 9,08; 14,19; 20,16; 23,610,2 2, т.е. представляющий собой полиморфную форму В. 15. Кристаллический 3-[2-(диметиламино)этил]-5-(1-пирролидинилсульфонилметил)-1 Н-индол формулы (I) по п.12, имеющий пик фазового перехода при 109,52 С (пик), при скорости нагрева 10 С/мин в потоке азота на термограмме, получаемой с помощью дифференциальной сканирующей калориметрии ДСК, т.е. представляющий собой полиморфную форму А. 16. Кристаллический 3-[2-(диметиламино)этил]-5-(1-пирролидинилсульфонилметил)-1H-индол формулы (I) по п.12, имеющий основной пик фазового перехода при 105,52 С (пик) и минорный пик фазового перехода при 115,22 С (пик), при скорости нагрева 10 С/мин в потоке азота на термограмме,получаемой с помощью дифференциальной сканирующей калориметрии ДСК, т.е. представляющий собой полиморфную форму В. 17. 4-Хлор-1-гидроксибутан-1-сульфонат 4-(1-пирролидинилсульфонилметил)фенилгидразина формулы (V)
МПК / Метки
МПК: C07D 401/12
Метки: алмотриптана, способ, чистоты, получения, высокой
Код ссылки
<a href="https://eas.patents.su/10-16759-sposob-polucheniya-almotriptana-vysokojj-chistoty.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения алмотриптана высокой чистоты</a>
Предыдущий патент: Способ очистки углеводородов от меркаптанов
Следующий патент: Антибактериальные производные хинолина
Случайный патент: Способ приготовления суспензии катализатора и устройство