Способ хранения сперматозоидов и продукт для искусственного оплодотворения (варианты)
Номер патента: 8674
Опубликовано: 29.06.2007
Формула / Реферат
1. Способ хранения сперматозоидов, характеризующийся тем, что по меньшей мере один сперматозоид вводят путем инъекции в полую микросферу из агарозного геля, находящуюся в инкубационной среде.
2. Способ по п.1, отличающийся тем, что полая микросфера имеет диаметр от 50 до 200 мкм.
3. Способ по п.1, отличающийся тем, что толщина стенки микросферы составляет от 10 до 25 мкм.
4. Способ по п.1, отличающийся тем, что по меньшей мере одну микросферу по меньшей мере с одним помещенным в нее сперматозоидом помещают в раствор по меньшей мере одного криопротектора, а затем проводят криоконсервацию.
5. Продукт для искусственного оплодотворения in vitro, содержащий по меньшей мере одну полую микросферу из агарозного геля, заполненную инкубационной средой, в которой путем инъекции размещен по меньшей мере один сперматозоид.
6. Продукт по п.5, отличающийся тем, что микросфера или микросферы имеют диаметр от 50 до 200 мкм.
7. Продукт для искусственного оплодотворения, содержащий подвергнутую криоконсервации по меньшей мере одну полую микросферу из агарозного геля, заполненную раствором по меньшей мере одного криопротектора, в которой путем инъекции размещен по меньшей мере один сперматозоид.
8. Продукт по п.7, отличающийся тем, что микросфера или микросферы имеют диаметр от 50 до 130 мкм.
Текст
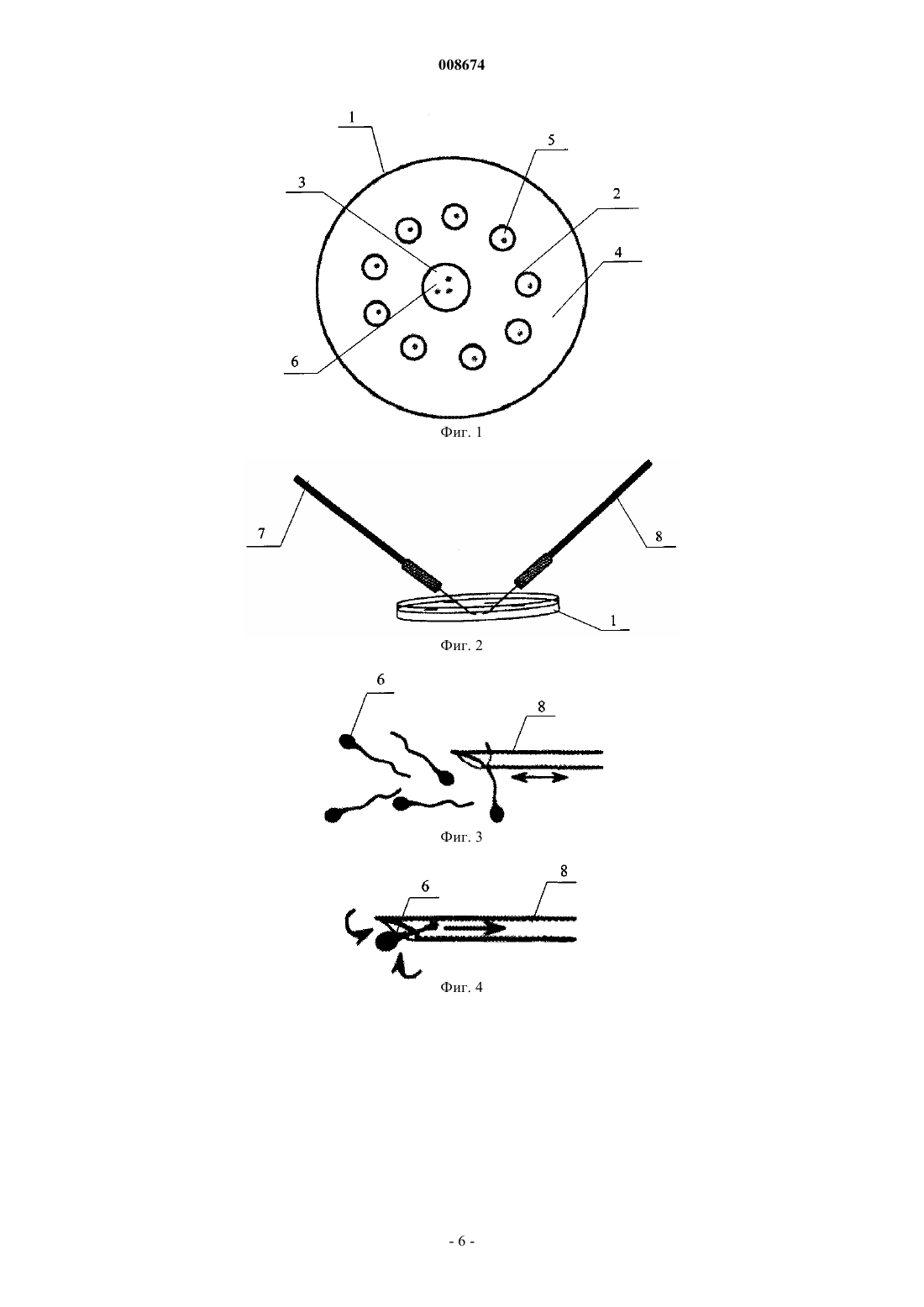
008674 Изобретение относится к медицине и ветеринарии, в частности, к эмбриологии и может быть использовано для хранения микроскопических биологических объектов. К уникальным единичным микроскопическим биологическим объектам могут быть отнесены единичные сперматозоиды, выделенные из спермы пациентов с тяжелой олигозооспермией (незначительное количество или почти полное отсутствие сперматозоидов), а также тканевых образцов, полученных в результате пункции яичка или придатка яичка у пациентов с азооспермией (полное отсутствие сперматозоидов в сперме). Такие сперматозоиды являются уникальным биологическим материалом пациента,стремление которого иметь генетически собственных детей должно быть по возможности удовлетворено. К уникальным микроскопическим биологическим объектам могут быть отнесены и сперматозоиды беспозвоночных и позвоночных животных, в том числе быков, лошадей, а также исчезающих видов животных. В случае высокого риска невозможности получения мужских половых клеток требуется криоконсервация полученных единичных сперматозоидов. Основная проблема состоит в том, что в процессе криоконсервации и подготовки к непосредственному использованию полученные сперматозоиды могут быть утрачены даже в небольших, порядка нескольких микролитров, объемах. Решить эту проблему позволяют микроконтейнеры. Физически локализуя объект в большем объеме, микроконтейнеры значительно упрощают и облегчают манипуляции, связанные с обработкой криопротекторами (веществами, снижающими повреждающие эффекты замораживания), размораживанием и поиском сперматозоидов для оплодотворения методом IСSI (искусственное введение под микроскопом единичного сперматозоида в яйцеклетку при помощи специального стеклянного капилляра-иглы). В настоящее время криоконсервация единичных сперматозоидов в микроконтейнерах не является распространенной практикой в клинической эмбриологии, но являет собой скорее демонстрацию экспериментальных возможностей. Одним из условий успешного внедрения криоконсервации единичных сперматозоидов в клиническую практику является наличие постоянного и легкодоступного источника микроконтейнеров, которые в полной мере отвечали бы своему предназначению. Такие контейнеры должны быть достаточно малы, чтобы обеспечить локализацию отдельного сперматозоида в пределах манипуляционного поля. Идеальный размер контейнера, очевидно, должен быть соизмерим с длиной сперматозоида (не менее 60 мкм), с тем чтобы производить манипуляции под микроскопом с одним объективом (суммарное увеличение 200 х). Размер более 500 мкм затрудняет манипуляции. Наиболее подходящая для манипуляций с использованием техники ICSI форма контейнера сфероидная. Микроконтейнеры должны быть прозрачны, а также иметь упругую стенку, чтобы обеспечить захват их присасывающим капилляром и избежать деформации при помещении или извлечении сперматозоида микроинъекционной иглой. Есть несколько путей получения микроконтейнеров для криоконсервации единичных сперматозоидов. Одним из очевидных способов является использование естественных микросфероидов растительного или животного происхождения. Это могут быть оболочки яиц животных организмов или пыльцы растений, оболочки или покровы каких-либо организменных структур. Сложность поиска адекватных природных микроконтейнеров усугубляется необходимостью их предварительной обработки для удаления содержимого или дезактивации биологически активных веществ и придания требуемых свойств. В настоящее время в качестве микроконтейнеров естественного происхождения успешно используют пустыеzonae pellucidae (прозрачные оболочки яйцеклеток) мыши, хомячка или человека, поскольку эти контейнеры идеально соответствуют указанным выше характеристикам [Cohen J., Garrisi G.J., Congedo-FerraraCryopreservation of a small number of spermatozoa in yolk-filled human zonae pellucidae//Arch. Ital. Urol. Androl. 2003. V. 75. V. 195-198]. Однако описанные микроконтейнеры имеют некоторые существенные недостатки. Использованиеzonae pellucidae животных и человека связано с риском инфицирования, а также с нежелательной в данном случае способностью сперматозоидов связываться с их поверхностью. Кроме того, подготовка таких контейнеров требует микрохирургических манипуляций по удалению содержимого, что значительно усложняет методику. Стерилизация zonae pellucidae и биохимическая обработка с целью избежать связывания со сперматозоидом также создает дополнительные трудности. Известен способ хранения сперматозоидов млекопитающих для искусственного оплодотворения,-1 008674 включающий сбор живых зрелых сперматозоидов или сперматозоидов с нарушенной мембраной, суспензирование их в физиологическую среду, поддерживающую жизнеспособность сперматозоидов, отобранных от выбранного вида млекопитающих с последующим помещением полученной суспензии в контейнер, замораживанием суспензии и высушиванием замороженных сперматозоидов под вакуумом до влажности не менее 1%. Сбор живых зрелых сперматозоидов млекопитающих осуществляют из спермы, которую помещают на дно пробирки, добавляют в нее физиологическую среду и центрифугируют,отделяют сперматозоиды, затем повторно суспенизируют отделенные сперматозоиды в физиологической среде до желаемой концентрации для процесса высушивания вымораживанием. Для получения сперматозоидов с нарушенной мембраной сперматозоиды обрабатывают анионным детергентом или ультразвуком. В качестве контейнеров используют ампулы стеклянные, пластиковые соломки, криотрубочки пластиковые [Патент России 2244525, МПК A61D19/02, A61D19/04, A01N1/02, опубл. 2005 г.]. Получению требуемого технического результата в вышеописанном способе препятствует сложность подготовки сперматозоидов к хранению, необходимость значительного количества спермы и выделение из нее сперматозоидов. Известен способ хранения сперматазоидов, включающий смешивание спермы с нетоксичным гидрофильным полимером, выбранным из группы, состоящей из полиуретана, полиоксиэтилена и полиуретановых полиэстеровых полимеров с последующим микрокапсулированием смеси, охлаждением ее до получения геля и хранение полученных микрокапсул [Патент США 4840891, опубл. 1989, А 01N1/02]. При использовании указанного способа продуктом для искусственного оплодотворения являются микрокапсулы, содержащие сперматозоиды, заключенные в матрицы полимера, размещенные в инкубационной среде. Получению требуемого технического результата в вышеописанном способе препятствуют высокие потери сперматозоидов при использовании вышеописанного способа. Известен способ хранения сперматозоидов, включающий приготовление микрокапсул [Патент США 6596310, опубл. 1989, A01N1/02]. Раствор, состоящий из альгината натрия, агарозы, плавящейся при температуре 37-42 С, и веществ, препятствующих капацитации спермы (фруктозо-6-фосфат), смешивали со спермой, потом полимеризовали эту смесь в микросферы в присутствии ионов кальция, калия и фосфатов, при этом происходила полимеризация альгината с образованием стенки микросферы. Затем смесь немного охлаждали, например до комнатной температуры, что вызывало полимеризацию агарозы и иммобилизацию (обездвиживание) сперматозоидов, а потом растворяли альгинатную твердую стенку в цитрате натрия. В результате происходит образование суспензии иммобилизованных в сферических микроблоках некапацитированных сперматозоидов. С существенными признаками первого объекта заявляемого изобретения совпадают такие признаки прототипа, как использование для хранения микросфер, стенки которых содержат агарозный гель, а также наличие инкубационной среды. С существенными признаками второго объекта заявляемого изобретения совпадают такие признаки прототипа, как наличие полой микросферы, стенка которой содержит агарозный гель, внутри которой находится инкубационная среда и сперматозоиды. С существенными признаками третьего объекта заявляемого изобретения совпадают такие признаки прототипа, как наличие полой микросферы, стенка которой содержит агарозный гель, внутри которой находится среда и сперматозоиды, подвергнутой криоконсервации. Получению требуемого технического результата в вышеописанном способе препятствуют высокие потери сперматозоидов при использовании смешивания сперматозоидов с веществом, образующим капсулу. Задача, на решение которой направлено заявляемое изобретение, - расширение арсенала технических средств для лечения бесплодия, сохранение исчезающих видов животных и размножение уникальных пород животных. Технический результат заключается в реализации расширения арсенала технических средств путем обеспечения возможности сохранения единичных сперматозоидов, повышении сохранения жизнеспособности сперматозоидов и их функции, в повышении нормальной морфологии и сохранения подвижности сперматозоидов после периода хранения, в улучшении стерильности процесса, что предотвращает возможность инфицирования сперматозоидов, за счет использования биологически безопасных микросфер, полученных из биологически инертного агарозного геля. Для достижения вышеуказанного технического результата по первому объекту изобретения в способе хранения сперматозоидов по меньшей мере один сперматозоид вводят путем инъекции в полую микросферу из агарозного геля, находящуюся в инкубационной среде. В частных случаях выполнения изобретения по первому объекту полые микросферы имеют диаметр от 50 до 200 мкм, а толщина стенки микросферы составляет от 10 до 25 мкм. В частном случае выполнения изобретения по первому объекту по меньшей мере одну микросферу по меньшей мере с одним помещенным в нее сперматозоидом помещают в раствор по меньшей мере одного криопротектора, а затем проводят криоконсервацию. Для достижения вышеуказанного технического результата по второму объекту изобретения про-2 008674 дукт для искусственного оплодотворения in vitro содержит по меньшей мере одну полую микросферу из агарозного геля, заполненную инкубационной средой, в которой путем инъекции размещен по меньшей мере один сперматозоид. В частном случае выполнения изобретения по второму объекту микросфера или микросферы имеют диаметр от 50 до 200 мкм. Для достижения вышеуказанного технического результата по третьему объекту изобретения продукт для искусственного оплодотворения содержит подвергнутую криоконсервации по меньшей мере одну полую микросферу из агарозного геля, заполненную раствором по меньшей мере одного криопротектора, в которой путем инъекции размещен по меньшей мере один сперматозоид. В частном случае выполнения изобретения по второму объекту микросфера или микросферы имеют диаметр от 50 до 130 мкм. Объекты изобретения по отношению к прототипу характеризуется такими отличительными признаками, как введение сперматозоида путем инъекции в полую микросферу из агарозного геля. В отличие от описанных в уровне технике способов в заявляемом способе используют микросферы из агарозного геля в качестве микроконтейнеров для хранения и криоконсервации единичных сперматозоидов, что имеет неоспоримые преимущества, т.к. исключает возможность инифицирования или неблагоприятного воздействия на гаметы биологически активных веществ. Введение сперматозоидов путем инъекции позволяет, во-первых, сохранять единичные сперматозоиды, а, во-вторых, положительно сказывается на сохранении их нормальной морфологии. Использование полых микросфер обеспечивает достаточный объем для движения сперматозоида. Использование агарозного геля в качестве материала микросфер обеспечивает возможность прохождения обмена веществ через гелеобразную стенку микросферы, что положительно влияет на сохранение жизнеспособности сперматозоидов. Предварительное помещение единичных сперматозоидов в микросферы из агарозы локализует сперматозоиды в большей области пространства, что делает возможным совершать с ними необходимые для криоконсервации манипуляции с использованием бинокулярной лупы. При разморозке микросфер из агарозного геля с единичными сперматозоидами отсутствует необходимость трудоемких процедур поиска и выделения единичных сперматозоидов из большого объема эякулята. Изобретение поясняется чертежами, где на фиг. 1 схематично представлена операция подготовки к введению единичных сперматозоидов в полые микросферы из агарозного геля, используемое устройство вид сверху,на фиг. 2 схематично представлена операция подготовки к введению единичных сперматозоидов в полые микросферы из агарозного геля, используемые устройства вид сбоку,на фиг. 3 схематично представлена операция введения сперматозоида в полую микросферу, операция подведения иглы к сперматозоиду,на фиг. 4 схематично представлена операция введения сперматозоида в полую микросферу, операция захвата сперматозоида иглой,на фиг. 5 схематично представлена операция введения сперматозоида в полую микросферу, операция прокалывания стенки полой микросферы иглой,на фиг. 6 схематично представлена полая микросфера с введенным в нее единичным сперматозоидом,на фиг. 7 представлена фотография микросферы из агарозного геля,на фиг. 8 представленафотография подведения иглы к полой микросфере,на фиг. 9 представлена фотография полой микросферы с введенным в нее сперматозоидом,на фиг. 10 - увеличенная фотография полой микросферы с введенным в нее сперматозоидом по фиг. 9. Заявляемый способ хранения сперматозоидов характеризуется выполнением следующих операций. В качестве камеры 1 для проведения способа можно использовать крышку от стерильной пластиковой чашки Петри диаметром 40 мм (фиг. 1) или специальные планшеты. По периферии перевернутой крышки делают несколько капель 2 инкубационной среды с буфером, поддерживающим рН 7,2-7,6. В центре крышки делают большую каплю 3 вязкой среды для снижения подвижности сперматозоидов. В качестве инкубационной среды для работы со спермой используют, например, Sperm Preparation Medium(MediCult, Дания). [Trounson A., Gardner D.K. Handbook of in vitro fertilization/CRC Press, 2000. 2-nd ed. 560 p.]. Капли среды заливают минеральным маслом 4. В периферические капли 2 помещают полые микросферы 5 из агарозного геля, а в центральную каплю 3 - сперматозоиды 6. Использование термина "агарозный гель" в заявляемом изобретении эквивалентно понятию "агарозный студень". Для использования отбирают полые микросферы с диаметром от 50 до 200 мкм. Толщины стенки полых микросфер из агарозного геля оставляют от 10 до 25 мкм. Манипуляции с полыми микросферами 5 и сперматозоидами 6 проводят при помощи стеклянных микроинструментов 7, например специальной присасывающей пипетки, и прецизионных манипуляторов 8, например иглой микроинъектора, которую обычно используют для проведения ICSI (intracytoplasmic sperm injection, Trounson A., Gardner D.K. Handbook of in vitro fertilization/CRC Press, 2000. 2-nd ed. 560 p.) (фиг. 2). Сперматозоиды могут быть как подвижными, так и предварительно обездвижены. Сперматозоид 6,выбранный для инъекции, может быть обездвижен путем прижимания жгутика сперматозоида инъекционной иглой 8 к дну чашки 1. Затем сперматозоид 6 набирают в иглу 1 (фиг. 3, 4). Микросферы 5 фикси-3 008674 руют присасывающей микропипеткой 7. Инъекционной иглой 8 прокалывают оболочку (стенку) полой микросферы из агарозного геля и вводят сперматозоид (фиг. 5). Все манипуляции проводят с применением антисептиков. Вышеприведенные операции также отражены на фиг. 7-10. Рекомендуемое количество вводимых сперматозоидов в одну полую микросферу до 10 шт. В результате использования заявляемого способа хранения сперматозоидов получают продукт для искусственного оплодотворения in vitro, содержащий по меньшей мере одну полую микросферу 5 из агарозного геля, заполненную инкубационной средой 2, в которой путем инъекции размещен по меньшей мере один сперматозоид 6. Криоконсервацию микросфер 5 с введенными в них сперматозоидами 6 производят в соответствии со стандартными процедурами, предусмотренными для криоконсервации спермы. Микросферы со сперматозоидами помещают в раствор криопротекторов на 5-10 мин, затем помещают в соломину для криоконсервации объемом 250 мкл. Большинство сред для криоконсервации спермы в качестве основных компонентов содержат глицерин и сывороточный альбумин или его заменители [Mahadevan M., TrounsonA.O. Effect of cryoprotective media and dilution methods on the preservation of human spermatozoa//Andrologia. 1983. V. 15. P. 355-366]. Соломины замораживают в течение 30 мин в парах жидкого азота, после чего погружают непосредственно в жидкий азот на время от 30 мин до 2 суток. Размораживание проводят, помещая соломины под струю холодной проточной воды, микросферы извлекают из соломин и отмывают в среде для обработки сперматозоидов. Жизнеспособность сперматозоидов после размораживания оценивают по сохранению подвижности. Таким способом было заморожено 53 подвижных и 41 предварительно обездвиженных сперматозоидов в 23 агарозных микросферах. Сперматозоиды помещали в микросферы в количестве 1-10 шт. После криоконсервации и последующего размораживания все сперматозоиды сохранили характерную нормальную морфологию, что указывает на отсутствие серьезных механических повреждений, связанных с образованием кристаллов льда. 29 из 53 сперматозоидов (более половины) сохранили подвижность. В результате криоконсервации получают продукт для искусственного оплодотворения, который содержит подвергнутую криоконсервации по меньшей мере одну полую микросферу 5 из агарозного геля,заполненную раствором по меньшей мере одного криопротектора, в которой путем инъекции размещен по меньшей мере один сперматозоид 6. Изобретение иллюстрируется нижеприведенными примерами, которые не охватывают весь объем притязаний, но и не ограничивают его. Пример 1. Подвижные сперматозоиды человека инъецировали в полые микросферы из агарозного геля диаметром 150-200 мкм, в количестве от 1-10 шт. на микросферу, используя базовую технику, оборудование и расходные материалы для инъекции методом ICSI. Микросферы с помещенными в них сперматозоидами под контролем бинокулярной лупы при помощи пластиковой пипетки-капилляра переносили в раствор криопротектора, содержащий 50% среды Sperm Freezing Medium (MediCult, Дания) и 50% средыSperm Preparation Medium (MediCult, Дания), на 5-10 мин. Затем микросферы помещали в пластиковую соломину для криоконсервации объемом 250 мкл. Соломины замораживали в течение 30 мин в парах жидкого азота, после чего погружали непосредственно в жидкий азот на время от 30 мин до 2 суток. Размораживание проводили, помещая соломины под струю холодной проточной воды, микросферы извлекали из соломин и отмывали в 5 каплях среды Sperm Freezing Medium (MediCult, Дания). Жизнеспособность сперматозоидов после размораживания оценивали по сохранению подвижности. Таким способом было заморожено 253 подвижных сперматозоида в 54 микросферах из агарозного геля. После криоконсервации и последующего размораживания все сперматозоиды сохранили характерную нормальную морфологию, что указывает на отсутствие серьезных механических повреждений, связанных с образованием кристаллов льда. Из 253 сперматозоидов 162 (64%) сохранили подвижность. Пример 2. У пациента с диагнозом олигоастенотератозооспермия был получен эякулят, содержащий единичные подвижные сперматозоиды нормальной морфологии. Из эякулята были выделены единичные подвижные сперматозоиды. Инъекция сперматозоидов в полые микросферы из агарозного геля диаметром 150 мкм, с толщиной стенок, равной от 15 до 20 мкм, с использованием техники ICSI и тех же расходных материалов (стеклянные микроинструменты: игла и присасывающая пипетка для ICSI), оборудования техники ICSI. В одну микросферу вводили сперматозоиды в количестве от 1 до 5 шт. Микросферы, содержащие единичные сперматозоиды, были заморожены в жидком азоте в соломинах для криоконсервации спермы, по 1-2 шт. на соломину с использованием среды Sperm Freezing Medium (MediCult, Дания) в соответствии с прилагаемой к среде инструкцией и помещены в криохранилище. Поскольку микросфера со сперматозоидом внутри имеет объем ничтожный по отношению к объему соломинки (250-500 мкл), после инъекции сперматозоида микросфера помещается в смесь препаратаSperm Freezing Medium и специальной среды для обработки спермы, например Sperm Preparation Medium(MediCult, Дания). Микросферы вместе с этой средой (смесью) набирали в соломинки для криоконсервации. Соломинки помещали горизонтально непосредственно над поверхностью жидкого азота на 30 мин,затем помещали в жидкий азот и переносили в криохранилище. Предварительное помещение единичных-4 008674 сперматозоидов в микросферы из агарозы локализует сперматозоиды в большей области пространства,что делает возможным совершать с ними необходимые для криоконсервации манипуляции с использованием бинокулярной лупы. Криоконсервация единичных сперматозоидов в микросферах из агарозы,помещенных в отдельные соломины, позволяет избежать риска отсутствия у пациента нормальных сперматозоидов в эякуляте при осуществлении последующих программ экстракорпорального оплодотворения (ЭКО). При разморозке микросфер из агарозы с единичными сперматозоидами отсутствует необходимость трудоемких процедур поиска и выделения единичных сперматозоидов из большого объема эякулята. Пример 3. Подвижные сперматозоиды крупного рогатого скота (быка) инъецировали в полые микросферы из агарозного геля диаметром 100-150 мкм, в количестве от 5-15 шт. на микросферу, используя базовую технику, оборудование и расходные материалы для инъекции методом ICSI. Микросферы с помещенными в них сперматозоидами под контролем бинокулярной лупы при помощи пластиковой пипеткикапилляра переносили в раствор криопротектора, содержащий 50% среды Sperm Freezing Medium (MediCult, Дания) и 50% среды Sperm Preparation Medium (MediCult, Дания), на 15 мин. Затем микросферы помещали в пластиковую соломину для криоконсервации объемом 250 мкл. Соломины замораживали в течение 30 мин в парах жидкого азота, после чего погружали непосредственно в жидкий азот на одни сутки. Размораживание проводили, помещая соломины под струю холодной проточной воды, микросферы извлекали из соломин и отмывали в среде Sperm Freezing Medium (MediCult, Дания). После криоконсервации и последующего размораживания все сперматозоиды сохранили характерную нормальную морфологию. Было проведено оплодотворение 10 ооцитов путем введения в цитоплазму ооцитов единичных сперматозоидов, предварительно извлеченных из полых. В 7 случаях оплодотворение прошло успешно. Реализация изобретения позволит сохранить уникальные биологические объекты. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ хранения сперматозоидов, характеризующийся тем, что по меньшей мере один сперматозоид вводят путем инъекции в полую микросферу из агарозного геля, находящуюся в инкубационной среде. 2. Способ по п.1, отличающийся тем, что полая микросфера имеет диаметр от 50 до 200 мкм. 3. Способ по п.1, отличающийся тем, что толщина стенки микросферы составляет от 10 до 25 мкм. 4. Способ по п.1, отличающийся тем, что по меньшей мере одну микросферу по меньшей мере с одним помещенным в нее сперматозоидом помещают в раствор по меньшей мере одного криопротектора, а затем проводят криоконсервацию. 5. Продукт для искусственного оплодотворения in vitro, содержащий по меньшей мере одну полую микросферу из агарозного геля, заполненную инкубационной средой, в которой путем инъекции размещен по меньшей мере один сперматозоид. 6. Продукт по п.5, отличающийся тем, что микросфера или микросферы имеют диаметр от 50 до 200 мкм. 7. Продукт для искусственного оплодотворения, содержащий подвергнутую криоконсервации по меньшей мере одну полую микросферу из агарозного геля, заполненную раствором по меньшей мере одного криопротектора, в которой путем инъекции размещен по меньшей мере один сперматозоид. 8. Продукт по п.7, отличающийся тем, что микросфера или микросферы имеют диаметр от 50 до 130 мкм.
МПК / Метки
МПК: A01N 1/02
Метки: хранения, сперматозоидов, продукт, оплодотворения, способ, варианты, искусственного
Код ссылки
<a href="https://eas.patents.su/9-8674-sposob-hraneniya-spermatozoidov-i-produkt-dlya-iskusstvennogo-oplodotvoreniya-varianty.html" rel="bookmark" title="База патентов Евразийского Союза">Способ хранения сперматозоидов и продукт для искусственного оплодотворения (варианты)</a>
Предыдущий патент: Способ защиты от грызунов, тараканов и устройство для его осуществления
Следующий патент: Система и способ поиска, управления, доставки и представления знаний
Случайный патент: Липосомный препарат 6,9-бис[(2-аминоэтил)-амино]бензо[g]изохинолин-5,10-диона дималеата