Лиофилизованная композиция 2-метилтиенобензодиазепина
Номер патента: 6506
Опубликовано: 29.12.2005
Авторы: Декемпер Курт Дуглас, Файтс Алан Ли, Нейл Стивен Л.
Формула / Реферат
1. Стабильная аморфная лиофилизованная композиция для парентерального введения, содержащая оланзапин в качестве активного ингредиента, винную кислоту и лактозу.
2. Композиция по п.1, где оланзапин представлен в виде тартратной соли.
3. Композиция по п.1, где лактоза представлена в виде моногидрата лактозы.
4. Композиция по п.3, содержащая от 1 до 20 мг/мл оланзапина, от 22,5 до 50 мг/мл моногидрата лактозы и от 0,35 до 10 мг/мл винной кислоты.
5. Композиция по п.3, содержащая 5 мг/мл оланзапина, 1,7 мг/мл винной кислоты и 25 мг/мл моногидрата лактозы.
6. Композиция по п.3, где количество оланзапина выбрано из 1, 2,5, 5, 7,5, 10, 15, 20 мг/мл.
7. Композиция по п.3, содержащая 20 мг оланзапина, 7 мг винной кислоты и 100 мг лактозы.
8. Композиция по любому из пп.1-7 для применения при лечении ажитации.
9. Композиция по п.8, где ажитация связана с расстройствами, выбранными из группы, состоящей из психотических расстройств, шизофрении, биполярных расстройств как маниакальных, так и смешанных состояний, слабоумия и связанных нарушений и нейродегенеративных расстройств.
10. Композиция по п.9, где ажитация связана с расстройствами, выбранными из группы, состоящей из делирия, слабоумия и амнезии и других когнитивных расстройств, психических расстройств, вызванных основным медицинским состоянием, нарушений, связанных со злоупотреблением веществами, шизофрении и других психотических расстройств, нарушений настроения, расстройств, связанных с чувством страха, регулируемых расстройств и личностных расстройств.
11. Применение композиции по любому из пп.1-7 для получения лекарственного средства для лечения ажитации.
12. Фармацевтическая композиция по любому из пп.1-7 для применения при лечении ажитации у человека, содержащая оланзапин в качестве активного ингредиента, винную кислоту и лактозу.
13. Промышленное изделие, содержащее упаковочный материал и композицию, содержащую оланзапин, по любому из пп.1-7, где оланзапин используется для лечения ажитации, и указанный упаковочный материал содержит этикетку или рекламный вкладыш, указывающий, что указанная композиция содержит оланзапин и может быть использована для лечения ажитации.
14. Композиция, содержащая от 1 до 20 мг/мл оланзапина, от 22,5 до 50 мг/мл моногидрата лактозы и от 0,35 до 10 мг/мл винной кислоты.
15. Композиция, содержащая от 1 до 20 мг/мл оланзапина, от 20,0 до 50 мг/мл моногидрата лактозы и от 0,35 до 10 мг/мл винной кислоты.
16. Композиция по любому из пп.1-7, 14, 15, где композиция не содержит кристаллических форм оланзапина.
17. Композиция, получаемая способом, который включает лиофилизацию раствора, содержащего оланзапин, винную кислоту и лактозу.
18. Композиция по п.17, где раствор представляет собой водный раствор.
19. Композиция по п.18, где композиция помещена в контейнер в количестве, достаточном для лечения млекопитающего.
20. Композиция по п.19, где количество оланзапина равно от 0,25 до 50 мг.
21. Композиция по п.19, где количество оланзапина равно от 1 до 30 мг.
22. Способ получения композиции, который включает лиофилизацию раствора, содержащего оланзапин, винную кислоту и лактозу.
23. Способ по п.22, где раствор представляет собой водный раствор.
24. Способ по п.23, где композиция помещена в контейнер в количестве, достаточном для лечения одного млекопитающего.
Текст
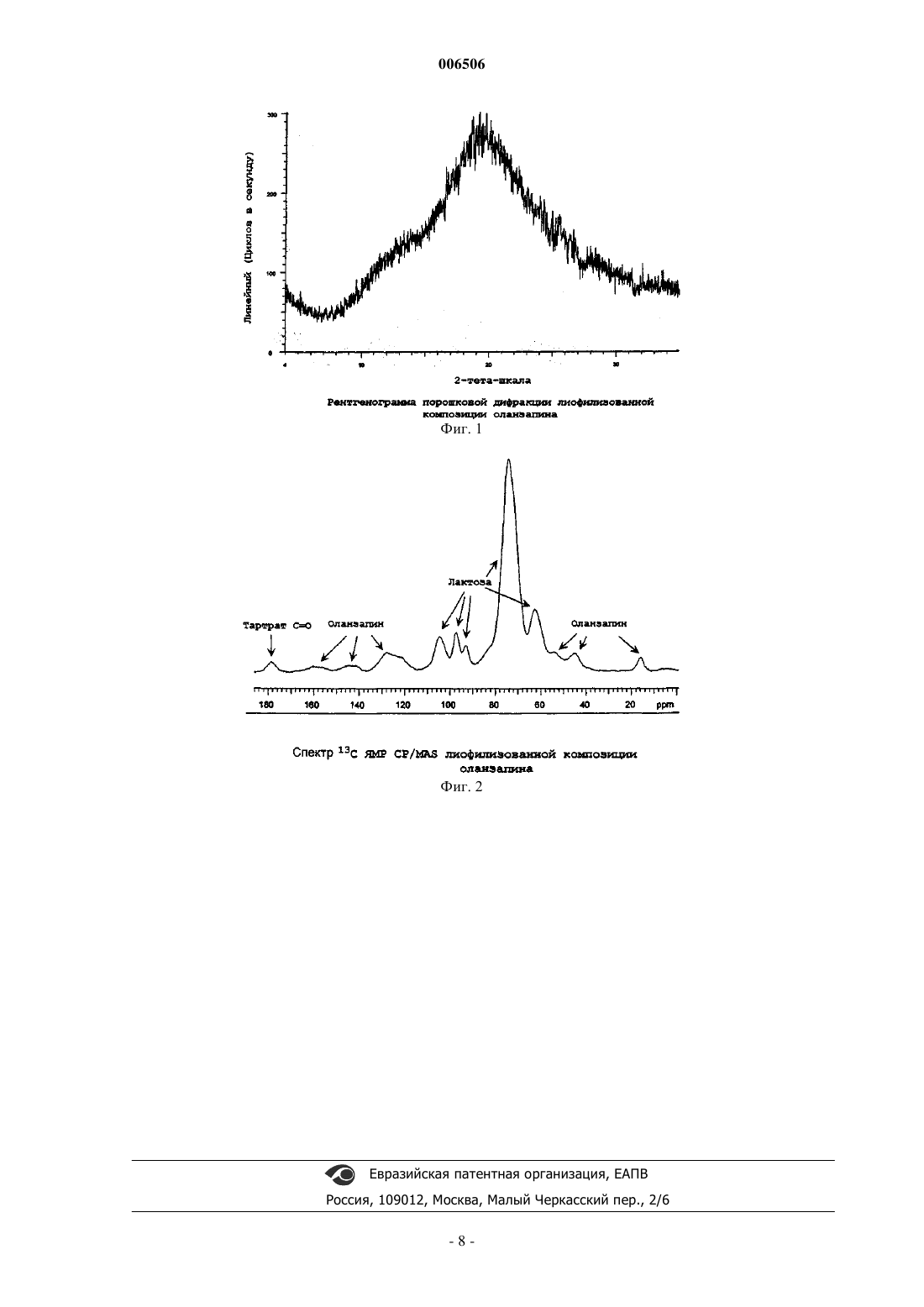
006506 Данное изобретение относится к аморфной лиофилизованной композиции для парентерального введения 2-метил-4-(4-метил-1-пиперазинил)-10 Н-тиено[2,3-b][1,5]бензодиазепина, здесь и далее называемого оланзапин. С оланзапином связывают большие надежды при лечении пациентов, страдающих психическими заболеваниями. Известны конкретные композиции оланзапина, описанные, например, в патентах США 5229382 и 5919485. В ранее заявленных изобретениях описаны аморфные лиофилизованные композиции для парентерального введения, содержащие оланзапин в качестве активного ингредиента, тщательно перемешанный с растворителем и стабилизатором. Оланзапин является мощным тиенобензодиазепиновым атипическим антипсихотическим агентом,обладающим наномолярной рецепторной аффинностью in vitro в отношении серотонина 5-НТ 2 А/2 В/2 С,5-НТ 3, 5-НТ 6, допамина D1/D2/D3/D4/D5, мускариновых холинергических (m1-m5), альфа 1 адренергических и гистаминовых H1 рецепторов. Оланзапин для перорального введения в настоящее время во всем мире используется для лечения пациентов в виде товарного продукта, и к настоящему времени более 5,6 миллионов пациентов лечились оланзапином. Однако в некоторых случаях эти пациенты испытывали затруднения при лечении из-за их клинического состояния на момент лечения, которое может быть возбужденным (сверхактивным, хаотическим и/или отрицательным). Более того, другие лежащие в основе заболеваний состояния, помимо психозов,могут также вызывать у пациентов состояния ажитации, такие как, но без ограничения ими, постхирургический делирий, нарушения поведения, связанные с задержкой умственного развития, эмоциональные расстройства, регулируемые расстройства, личностные расстройства, тревожные нарушения. Парентеральное введение антипсихотических препаратов предпочтительно для подавления ажитации, когда желательно быстрое воздействие или когда больные не соглашаются на прием препаратов перорально. Парентеральная фармакотерапия клинически уместна, когда уровень враждебности, возбуждения, некоммуникабельности или отсутствия импульсного контроля являются такими, что существует возможность нанесения вреда самому больному или окружающим или уничтожения имущества. Доступные в настоящий момент внутримышечные (ВМ) композиции обычных антипсихотических препаратов обладают высокой безопасностью и имеют существенные ограничения, включая острую дистонию (длительное сокращение мышц головы, шеи или верхних конечностей), акатизию (постоянная двигательная дисфория и напряженность мышц), анормальные показатели ЭКГ, такие как удлинениеQTc интервала, чрезмерный седативный эффект и нейролептический злокачественный синдром (ригидность, лихорадка, колеблющийся уровень сознания, нестабильность вегетативной нервной системы и повышенное содержание мышечных ферментов). Оланзапин является высокоэффективным соединением, которое действует в низких дозах. Из-за сильнодействующего характера оланзапина обязательно согласование подходящей дозы. Более того,оланзапин является метастабильным и подвергается гидролизу, в частности, в растворе или во влажных средах при комнатной температуре или даже при охлаждении. Кроме того, оланзапин является относительно нерастворимым в разбавителях, подходящих для парентерального введения инъекцией. Лиофилизованные продукты зачастую сложно получить в виде однородной, твердой лепешки, которая не разрушается, не адгезирует на стенках пузырька и пробке или не оставляет после себя продукта при восстановлении. Нерастворенный продукт является особенно проблематичным, когда взаимодействует с активным веществом, таким как оланзапин, ввиду возможных изменений в дозировании, которые могут происходить, если активный агент не полностью растворен при восстановлении. Таким образом,существует потребность в стабильной, однородной, легко восстанавливаемой быстродействующей композиции оланзапина для инъекции с относительно длительным сроком хранения, пригодной для использования в трудных случаях лечения ажитированных пациентов. Такая композиция, предпочтительно,является изотонической и может быть восстановлена в небольшом объеме инъекции. Была разработана аморфная лиофилизованная композиция для инъекций, объединяющая оланзапин с подходящим растворителем и подходящим стабилизатором, который обеспечивает желаемую физическую и химическую стабильность, легкость восстановления, однородность, продолжительный срок хранения и необходимую быстроту действия для лечения ажитированных пациентов. Было обнаружено, что лиофилизованная аморфная композиция оланзапина для инъекций обеспечивает превосходный результат при лечении ажитированных пациентов. Композиция предпочтительно может быть использована для быстрого подавления ажитированных и тревожных поведений, связанных с ажитацией, относящихся к шизофрении, биполярному маниакальному и смешанному состояниям, слабоумию и сопутствующим расстройствам, и нейродегенеративным расстройствам. Используемый здесь термин "нейродегенеративные расстройства" означает состояния, связанные с ретрогрессивным нейрональным патологическим изменением, приводящим к утрате функции центральной нервной системы. Используемый здесь термин "лечение" включает профилактику указанного состояния, или улучшение, или устранение уже установившегося состояния. Термин "лиофилизованная композиция" означает высушенную замораживанием композицию, полученную известным в данной области способом и включающую в качестве основных ингредиентов оланзапин, растворитель и стабилизатор.-1 006506 Определение "быстродействующий" подразумевает композицию для парентерального введения, которая эффективна для устранения или существенного снижения ажитации у ажитированных пациентов в пределах от около одной минуты до около двенадцати часов после инъекции, предпочтительно от около пяти минут до около десяти часов после инъекции, более предпочтительно от около пятнадцати минут до около двух часов после инъекции. Используемый здесь термин "возбуждение" или "ажитированный больной" означает избыточную моторную или вербальную активность, то есть обычно непроизвольную и повторяющуюся. Ее основные психиатрические симптомы включают враждебность, напряжение, волнение, некоммуникабельность и плохой контроль над побуждениями. Возбуждение может встречаться при многих нарушениях. Оно является обычной составляющей психотических расстройств, шизофрении, биполярного нарушения (как маниакального, так и смешанного состояния), слабоумия и связанных расстройств и нейродегенеративных расстройств. Его феноменология является по существу похожей во всех болезненных состояниях и его клиническое описание хорошо охарактеризовано. В "Diagnostic and Statistical Manual 4th Edition (DSM IV)" психомоторное возбуждение определено как "повышенная моторная активность, то есть обычно непроизвольная и повторяющаяся" (DSM IV,Fourth Edition, Washington DC, American Psychiatric Association, p 763,1994). Примерами моторных проявлений ажитации являются гиперактивность, агрессивность, поступки, направленные на физическое разрушение, и угрозы. Другие авторы описывают вербальные формы ажитации как излишнее словесное или голосовое выражение, которое включает выкрики, угрозы, брань, словесные оскорбления и излишнее угнетающее многословие (Cohen-Mansfiels and Billing, J Am Geriatr Soc 34:711-721,1986; Lanz andMarin, J Geriatr Psychiatry Neurol 9: 107-119,1996; Mintzer and Brawman-Mintzer, J Clin Psychiatry 57 (s): 55-63,1996; Fugate et al., Arch Phys Med Rehabil 78: 917-923, 1996; Lindenmayer, J Clin Psychiatry 61 (suppl 14): 5-10,2000). В настоящем изобретении термин "ажитация" охватывает возбуждение, связанное с любой известной формой психопатологии, предпочтительно возбуждением, связанным с шизофренией, биполярным маниакальным и смешанным состоянием, слабоумием и связанными с ними расстройствами и нейродегенеративными расстройствами. Более конкретно, термин "ажитация" включает возбуждение, связанное с расстройством сознания (делирием), слабоумием и амнезией и другими когнитивными расстройствами(DSM IV рр 123-164), психическими расстройствами вследствие основного медицинского состояния(DSM IV рр 165-174), по существу связанными расстройствами (DSM IV рр 175-272), шизофренией и другими психотическими расстройствами (DSM IV 273316), нарушениями настроения (DSM IV рр 317392), нарушениями, связанными с проявлением страха (DSM IV рр 393674 444), регулируемыми расстройствами (DSM IV рр 623628) или личностными расстройствами (DSM IV рр 629-674). Форма II оланзапина является наиболее стабильной безводной формой известного оланзапина и поэтому важна для коммерческой разработки фармацевтически элегантных композиций. Однако форма II является нестабильной для лиофилизованных композиций, так как она труднорастворима в обычных парентеральных растворителях. В соответствии с данным изобретением неожиданно обнаружено, что аморфный оланзапин, в частности аморфный тартрат оланзапина, является предпочтительным для стабильной, быстродействующей, легковосстанавливаемой лиофилизованной композиции оланзапина с соответствующей воспроизводимой дозой. Настоящее изобретение относится к стабильной аморфной лиофилизованной композиции для парентерального введения, включающей оланзапин в качестве активного ингредиента, винную кислоту в качестве растворителя и лактозу в качестве стабилизатора. Такая композиция, в частности, может быть использована при лечении ажитации. Еще одним вариантом воплощения изобретения является применение композиции для получения лекарственного средства для лечения ажитации. Еще одним предпочтительным вариантом воплощения является фармацевтический препарат для лечения ажитации у человека,содержащий активный ингредиент для лечения ажитации, растворитель и стабилизатор, характеризуемый тем, что указанным активным ингредиентом является оланзапин, растворителем является винная кислота, а стабилизатором является лактоза. Кроме того, настоящее изобретение относится к композиции, вводимой парентерально внутримышечной инъекцией. В другом предпочтительном варианте воплощения изобретения оланзапин находится в аморфном состоянии. Еще более предпочтительной композицией по изобретению является композиция, в которой оланзапин представляет собой тартратную соль. В предпочтительном варианте воплощения лактоза представляет собой моногидрат лактозы. Предпочтительной является композиция, содержащая от около 1 до около 20 мг/мл оланзапина, от около 20 до 50 мг/мл моногидрата лактозы и от около 0,35 до 10 мг/мл винной кислоты. Особенно предпочтительной является композиция, содержащая от около 1 до около 2 0 мг/мл оланзапина, от около 22,5 до 50 мг/мл моногидрата лактозы и от около 0,35 до 10 мг/мл винной кислоты. Кроме того, предпочтительной является композиция, содержащая 5 мг/мл оланзапина, 1,7 мг/мл винной кислоты и 25 мг/мл моногидрата лактозы.-2 006506 В другом предпочтительном варианте воплощения изобретения количество оланзапина в композиции выбрано из 1, 2,5, 5, 7,5, 10, 15, 20 мг/мл. Особенно предпочтительным вариантом воплощения по изобретению является композиция, содержащая 20 мг оланзапина, 7 мг винной кислоты и 100 мг лактозы. В другом варианте воплощения изобретения, как было обнаружено, композиция по изобретению особенно полезна для лечения ажитации, связанной с расстройствами, выбранными из группы, включающей психотические расстройства, шизофрению, биполярное нарушение (как маниакальное, так и смешанное состояния), слабоумие и связанные с ним расстройства, и нейродегенеративные расстройства. Особенно предпочтительным является применение композиции для лечения ажитации, связанной с нарушениями, выбранными из группы, включающей расстройства сознания, слабоумие и амнезию и другие когнитивные расстройства (DSM IV рр 123-164), психические расстройства в результате основного медицинского состояния (DSM IV рр 165-174), нарушения, связанные с злоупотреблением веществами(DSM IV рр 175-272), шизофрению и другие психотические расстройства (DSM IV 273-316), нарушение настроения (DSM IV рр 317-392), расстройства, связанные со страхом (DSM IV рр 393-674 444), регулируемые расстройства (DSM IV рр 623-628) и личностные расстройства (DSM IV рр 629-674). Другим аспектом изобретения является готовый продукт, содержащий упаковочный материал и композицию, включающую оланзапин, где оланзапин используется для лечения ажитации, и указанный упаковочный материал содержит этикетку или рекламный вкладыш, показывающий, что указанная композиция содержит оланзапин и может быть использована для лечения ажитации. Термин "аморфный" означает физическое состояние, не имеющее структуру кристаллической решетки, которое может быть подтверждено данными дифракции рентгеновских лучей, ЯМР твердого состояния (SSNMR) и другими средствами подтверждения, например наблюдением с помощью поляризационного микроскопа и дифференциальной сканирующей калориметрии (DSC). Рентгеновская порошковая дифрактометрия может быть использована для установления того факта,что лиофилизованная композиция находится в аморфном состоянии. Рентгенограммы порошковой дифрактометрии (XRD) лиофилизованной композиции оланзапина получены на рентгеновском порошковом дифрактометре Siemens D5000, оборудованном источником СuK (=1,54056 ) и твердотельном детекторе Kevex, работающем при минимальном напряжении 35 кВ и токе 30 мА. Образец сканировали между 4 и 35 в 2, с максимальной скоростью сканирования 0,05 в 2 в с. Типипичная диаграмма XRD(дифракционный рентгеновский анализ) для аморфной лиофилизованной композиции оланзапина показана на фиг. 1. 13 С ЯМР (SSNMR) кросс-поляризация/вращение магического угла (CP/MAS) может использоваться для определения того, что оланзапин в лиофилизованной композиции является стабилизированным в аморфном состоянии в виде тартратной соли. Спектр 13 С ЯМР (ЯМР твердого состояния или SSNMR) кросс-поляризация/вращение магического угла (CP/MAS) получали, используя 400 МГц ЯМР спектрометр Varian Unity Inova, работающий при углеродной частоте, равной 100,573 МГц и оборудованный полным вспомогательным оборудованием для твердого тела и датчиком либо Varian 5 mm VT CP/MAS,либо Chemagnetics 7,5 mm Т 3. Получены следующие параметры: 90 протон r.f. длительность импульса 5,0 мкс, время контакта 2,0 мс, частота повторения импульсов 10 с, частота MAS 7,0 кГц, ширина спектра 50 кГц, и время поиска 50 мс. Химические сдвиги относятся к метильной группе гексаметилбензола(5=17,3 м.д.) путем замены образца. Идентификация тартрата оланзапина основана на данных сравнения химического сдвига, собранных для изоструктуральных сольватов геми-тартрата оланзапина, с использованием тех же экспериментальных методов, что и для получения данных SSNMR, выше. Типичная картина SSNMR, показывающая, что оланзапин стабилизирован в аморфном состоянии в виде тартратной соли, показана на фигуре II. Более предпочтительно, когда аморфный тартрат оланзапина в композиции свободен от кристаллических форм оланзапина и содержит меньше, чем около 1,5% от общего количества родственных веществ, где к родственным веществам относятся нежелательные химические примеси и продукты деградации оланзапина. В композиции по изобретению стабилизатором является лактоза. Были оценены лиофилизованные композиции, содержащие альтернативные стабилизаторы. Образцы исследовались на эффективность и родственные вещества по прошествии около двух и трех недель хранения при 5 С, 25 С, 40 С/75% относительной влажности и 50 С. Неожиданно оказалось, что композиции, содержащие лактозу, имеют большую эффективность и показывают меньшую деградацию, чем композиции, содержащие другие стабилизаторы. Следовательно, лактоза является неожиданным и важным компонентом стабильной лиофилизованной композиции оланзапина. Моногидрат лактозы является предпочтительным. Подходящие растворители включают органические кислоты, такие как, но не ограничиваются ими,винная кислота, хлористоводородная кислота, лимонная кислота, уксусная кислота, яблочная кислота,фумаровая кислота и фосфорная кислота. Винная кислота является предпочтительной для обеспечения оптимальных характеристик растворимости, диспергируемости, стабильности и сублимационной сушки. Оланзапин эффективен в широком диапазоне доз, фактическая вводимая доза зависит от состояния,-3 006506 подвергаемого лечению. Например, при лечении взрослых могут быть использованы дозировки от около 0,25 до 50 мг, предпочтительно от 1 до 30 мг и более предпочтительно от 1 до 20 мг в день. Конкретная доза вводимого оланзапина по данному изобретению для получения терапевтического действия, конечно, определяется конкретными обстоятельствами заболевания, включая состояние, подвергаемое лечению. Для лечения ажитированных пациентов подходящим является уровень доз от 1 до 20 мг/инъекция,предпочтительно от 2,5 до 12,5 мг/инъекция, более предпочтительно 10 мг/инъекция. Ажитированные пациенты могут получать от одной до трех, предпочтительно одну инъекцию(ии) в день. Следует учесть,что может быть необходимым корректировать дозы в зависимости от возраста и состояния пациента. Лиофилизованная композиция по изобретению представляет собой композицию, содержащую от около 1 до около 20 мг/мл оланзапина в качестве активного ингредиента (предпочтительно, от около 1 до около 10 мг/мл), от около 22,5 до 50 мг/мл моногидрата лактозы и от около 0,35 до 10 мг/мл винной кислоты. Предпочтительная лиофилизованная композиция по изобретению представляет собой композицию,содержащую от около 1 до около 20 мг/мл оланзапина в качестве активного ингредиента (предпочтительно от около 1 до около 10 мг/мл), от около 20 до 50 мг/мл моногидрата лактозы и от около 0,35 до 10 мг/мл винной кислоты. Избыток винной кислоты относительно оланзапина, предпочтительно, в пределах от около 1,67/1 до 0,5/1 мас./мас. оланзапин/винная кислота, необходим для поддержания растворимости оланзапина. Особенно предпочтительной является лиофилизованная композиция, содержащая 5 мг/мл оланзапина в качестве эффективного количества активного ингредиента, 1,7 мг/мл винной кислоты и 25 мг/мл моногидрата лактозы. Более того, такая композиция предпочтительно будет содержать не более чем от около 0,1 до около 1,5% всей массы родственных веществ, более предпочтительно не более чем от около 1,0% всей массы родственных веществ. Кроме того, такие композиции предпочтительно будут содержать не более чем около 4% влаги, более предпочтительно менее чем около 0,1% влаги. Композицию предпочтительно восстанавливают в от около 1,1 до около 2,2 мл разбавителя, предпочтительно в 2 мл, для получения растворов, имеющих концентрации приблизительно 5 и 10 мг/мл, и она может быть растворена в фармацевтически приемлемом носителе, таком как стерильная вода для инъекций (WFI), стерильная вода, необязательно содержащая соль, и/или стерильная вода, содержащая сахара. Например, для внутримышечной инъекции лиофилизованная лепешка может быть растворена в 2 мл WFI. Исследование лиофилизованной композиции, хранившейся в условиях повышенной стабильности в течение почти года, показывает фармацевтически приемлемую эффективность и стабильность. Образцы хранились при 25 С, 40 С и 75% относительной влажности и 50 С и исследовались на эффективность и процентное содержание родственных веществ через 39 дней, 77 дней, 109 дней, 202 дня и 343 дня. Вещества для настоящего изобретения могут быть приобретены или получены различными способами, хорошо известными обычным специалистам в данной области. Оланзапин может быть получен,как описано Chakrabarti в патенте США 5229382('382). Лиофилизованная аморфная композиция по настоящему изобретению может быть получена сублимационной сушкой раствора, содержащего оланзапина технической степени чистоты, лактозу и растворитель, в глубоком вакууме для сублимации воды. Предпочтительно, лиофилизованный раствор получают путем растворения около 3,5 мг/мл винной кислоты (растворитель) и около 50 мг/мл лактозы в подходящем растворителе, предпочтительно воде или воде для инъекции (WFI). Растворитель и лактозу смешивают и перемешивают до тех пор, пока они не растворятся, и раствор предпочтительно охлаждают до температуры от около 2 до около 25 С, предпочтительно около от 6 до около 12 С, перед добавлением оланзапина. Альтернативно, лактоза может быть добавлена после добавления оланзапина. Добавляют от около 1 до около 10 мг/мл оланзапина,предпочтительно около 5 мг/мл. По необходимости проверяют и доводят рН. рН раствора должен быть в пределах от около 5,2 до около 6,0, предпочтительно от 5,5 до 5,7. рН может быть доведен с помощью НСl или NaOH. Затем раствор доводят до соответствующего объема с помощью воды для инъекции. Первоначальный объем WFI должен быть по крайней мере 90% от общего объема для достижения приемлемого растворения оланзапина. Так как гидролиз является основным способом деградации, время выдержки и температура раствора перед лиофилизацией являются критическими. Перед загрузкой рекомендуется, чтобы раствор для лиофилизации был охлажден при от около 2 до 12 С, предпочтительно ниже чем 10 С. Раствор должен быть загружен и лиофилизация начата в течение от около 1 до около 48 ч от времени получения раствора, предпочтительно в течение 24 ч. Вторичный цикл сушки, достаточный для уменьшения влажности в конечном продукте до менее чем 0,6%, является предпочтительным для сведения к минимуму разрушения оланзапина и обеспечения оптимального срока хранения. Лиофилизованная лепешка легко растворяется при восстановлении в фармацевтически приемлемом разбавителе. Если желательно, перед лиофилизацией раствор для лиофилизации может быть подвергнут процессу фильтрации. Процесс фильтрации может включать, например, стерилизующую фильтрацию раствора-4 006506 для лиофилизации с целью удаления микроорганизмов или других загрязняющих веществ. Если желательно, перед лиофилизацией раствор для лиофилизации может быть подвергнут процессу распределения. Процесс распределения включает, например, в случае лиофилизации в пузырьках,процесс распределения подходящего объема раствора для лиофилизации перед лиофилизацией в пузырьки, приведение концентрации оланзапина в соответствие, чтобы продукты в пузырьках содержали желаемое количество оланзапина. Лиофилизованную композицию получают путем последовательных процессов охлаждения и нагревания. Предпочтительно, процесс получения лиофилизованной композиции включает следующие стадии:(a) охлаждение раствора для лиофилизации до температуры ниже -35 С в течение по крайней мере одного часа;(b) нагревание продукта со стадии (а) до температуры по крайней мере -22 С в течение по крайней мере восьми часов при давлении ниже атмосферного с целью удаления воды;(c) нагревание продукта со стадии (b) до температуры по крайней мере 30 С, предпочтительно от около 30 до около 40 С, в течение времени, достаточного для удаления воды из водного растворителя и получения твердого лиофилизованного продукта, предпочтительно, по крайней мере, в течение шести часов при давлении ниже атмосферного. Стадии (b) и (с) проводят при давлении ниже атмосферного,менее чем 125 мТорр, предпочтительно от около 90 до около 115 мТорр. Предпочтительными параметрами процесса лиофилизации являются такие, когда оланзапин замерзает при охлаждении до менее чем -35 С, предпочтительно от около 35 до около -45 С. Данная стадия охлаждения проводится предпочтительно в течение от 1 до 4 ч. Далее здесь данный процесс упоминается как "первичная заморозка". Замороженный раствор, полученный в процессе первичной заморозки, затем нагревают до температуры в пределах от около -15 до около -25 С, предпочтительно при температуре выше или равной-22 С, при давлении ниже атмосферного, предпочтительно в пределах от около 90 до около 115 мТорр. Данную стадию нагревания предпочтительно проводят до завершения в течение от 6 до 40 ч. Далее здесь данный процесс упоминается как "первичная сушка". Композиция, полученная в процессе первичной сушки, сушится в высоком вакууме путем сублимации воды в соответствии со способами, известными обычным специалистам в данной области. Таким образом, получают лиофилизованный препарат по настоящему изобретению. Если желательно, для удаления воды в соответствии со способами, известными специалистам в данной области, могут проводиться две стадии сушки, в которых температура и степень вакуума являются разными. Например, вторая стадия сушки может быть проведена при температурах от около 30 до около 40 С, предпочтительно от около 30 до около 35 С в течение по меньшей мере шести часов. В процессе лиофилизации удаляется большая часть обычно присутствующей воды, но конечная композиция лиофилизованного продукта может содержать остаточную свободную воду, предпочтительно меньше чем 2,5%. Обычно содержание воды может составлять от около 0,1 до около 2,5% по массе. Более типично содержание воды составляет от около 0,2 до около 0,6%. Форма концентрат-доза композиции по изобретению представляет собой герметичный контейнер,содержащий некоторое количество лиофилизованной фармацевтической композиции по изобретению. Форму концентрат-доза получают путем помещения лиофилизованной композиции в контейнер (например, стеклянная или пластиковая бутылки, пузырьки, ампулы, баллончики, шприцы) в количестве, достаточном для лечения по меньшей мере одного млекопитающего. (Используемый здесь термин "млекопитающее" будет относиться к классу молокососущих высших позвоночных. Термин "млекопитающее" включает в себя, но не ограничивается этим, человека, а так же родственный важный ветеринарный класс млекопитающих, домашних четвероногих, таких как обезьяны, собаки, кошки, лошади, овцы, свиньи, козы и коровы.) Контейнер также предпочтительно имеет значительное по размеру свободное пространство для размещения (i) дополнительного водного растворителя плюс (ii) дополнительное пространство, если необходимо, для обеспечения возможности перемешивания и осуществления полного растворения лиофилизованной композиции в добавленном водном растворителе. Контейнер может быть оборудован проницаемым верхом, например резиновой заглушкой, предпочтительно бутилкаучуковой пробкой низкой влажности, для того чтобы можно было добавлять водный растворитель путем протыкания заглушки иглой для подкожных инъекций и потом извлекать концентрат такими же способами. Примером формы концентрат-доза является стеклянный пузырек объемом от около 5 до около 100 мл, содержащий от 1 до 150 мг оланзапина в лиофилизованной фармацевтической композиции. Свободное пространство над твердой композицией имеет достаточный объем для добавления растворителя, такого как стерильная вода для инъекций, плюс пространство для взбалтывания всего содержимого. Добавление водного растворителя к форме концентрат-доза дает жидкий концентрат, который затем можно легко использовать для получения единичных дозированных форм жидкой фармацевтической композиции путем извлечения всего содержимого для непосредственного использования в качестве внутримышечной инъекции или для раствора для внутривенного применения. Для внутривенного применения концентрат добавляют в IV(внутривенный) контейнер, содержащий подходящий водный растворитель. Используемые растворители являются стандартными растворами для инъекции (например, 5% декстроза или стерильная вода для инъекций, и тому подобное). Типичные единичные дозированные резервуары IV представляют собой обычные стеклянные или пластиковые контейнеры, имеющие средства ввода и вывода и имеющие стандартные объемы (например, 250 мл и 500 мл). Концентрированный раствор лиофилизованной фармацевтической композиции добавляют в единичный дозированный резервуар IV в количестве, достаточном для получения общей дозы, от около 1 до около 40 мг оланзапина. Другие фармацевтически приемлемые добавки могут быть добавлены к лиофилизованным композициям по настоящему изобретению. Когда лиофилизованная композиция должна быть использована для инъекции, к ней может быть добавлено изотонирующее вещество, или успокаивающее вещество, или другие добавки. Внутримышечная инъекция является предпочтительным способом доставки подвергаемому лечению млекопитающему, в частности, в критических ситуациях. Конкретным примером является 5 мл стеклянный пузырек с резиновой пробкой с задержкой низкой влажности и низкой скоростью пропускания паров, содержащий лиофилизованную фармацевтическую композицию, включающую 10 мг оланзапина, 3,5 мг винной кислоты и 50 мг моногидрата лактозы. Предпочтительно лиофилизованная фармацевтическая композиция по данному изобретению разбавляется водным растворителем, подходящим для инъекции, и получается жидкая единичная дозированная форма для введения млекопитающему. Скорость всасывания оланзапина больше после парентерального введения, например такого, как внутримышечное, чем после перорального введения такой же дозы. Эффективность лиофилизованной аморфной композиции оланзапина для перорального введения для подавления ажитации оценивается в рандомизированном, двойном контроле, плацебо и активном компаратор-контрольном исследовании ажитированных пациентов, таких как, например, страдающие шизофренией, биполярной манией и слабоумием, связанным с нейродегенеративными расстройствами. Пациенты представлены в диапазоне возрастов от молодого до пожилого и в диапазоне клинических состояний, включающем как психотических, так и непсихотических пациентов со степенью ажитации от умеренной до сильной. Снижение ажитации оценивали путем использования совокупности критериев, включая, но не ограничиваясь ими, среднее отклонение от базовой линии возбужденного компонента по шкале положительных и отрицательных синдромов (PANSS) (Kay et al., Schizophrenia Bulletin, 16, 537-545, 1990). Дополнительные измерения эффективности включают оценочную шкалу ажитация-спокойствие (ACES),шкалу ажитированного поведения Корригана (Corrigan JD Journal of Clinical and Experimental Neuropsychology, 11 (2): 262-77,1989) и кадастр ажитации по Кохону-Мансфельду (Cohen-Mansfield et. Al., JournalMansfield et. Al., Gerontology, 36 (3); 150-8, 1990). Результаты исследований подтверждают эффективность композиции лиофилизованного оланзапина при лечении ажитации в различных группах пациентов. ACES предназначен для дифференциации ажитированного, спокойного и сонного состояний путем использования специально разработанной 9-уровневой шкалы: 1 = явная ажитация; 2 = умеренная ажитация; 3 = слабая ажитация; 4 = нормальное состояние; 5 = слабое спокойствие; 6 = умеренное спокойствие; 7 = явное спокойствие; 8 = глубокий сон; 9 = не возбуждаемое. Показатели могли изменяться от единичного показателя 1 до 9. Начало действия лиофилизованной аморфной композиции оланзапина для парентерального введения исследовали в различные моменты времени в промежутке от 15 мин до 2 ч после первой инъекции. Лиофилизованная композиция оланзапина демонстрирует превосходное снижение ажитации в анализеPANSS возбужденного компонента в наиболее ранний измеренный момент времени (15 мин). Следующие примеры предназначены для иллюстративных целей и не должны истолковываться как ограничивающие объем заявленного изобретения. Пример 1. Оланзапин для инъекции 10 мг Стандартная формула (мг/пузырек) Оланзапин 10 мг Моногидрат лактозы 50 мг Винная кислота 3,5 мг Вода для инъекций q.s. до 2 мл 10% раствор НС 1 и/или 10% раствор NaOH q.s. для доведения рН Получение: 1. Помещение воды для инъекций в производственный контейнер (приблизительно от 75 до 90%q.s. по массе). 2. Добавление винной кислоты в воду и перемешивание до растворения. 3. Добавление моногидрата лактозы в производственный контейнер и перемешивание до растворения. 4. Добавление оланзапина и перемешивание до растворения (5-60 мин). 5. Доведение рН до 5,50-5,70 с помощью 10% NaOH и/или 10% раствора НСl по необходимости. 6. Q.S. до конечного веса с помощью воды для инъекций. 7. Проверка рН; повторное доведение до 5,50-5,70, если необходимо. 8. Фильтрование раствора через удерживающий микробы фильтр с величиной сетки 0,22 мкм. 9. Заполнение до соответствующего объема. 10. Лиофилизация. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Стабильная аморфная лиофилизованная композиция для парентерального введения, содержащая оланзапин в качестве активного ингредиента, винную кислоту и лактозу. 2. Композиция по п.1, где оланзапин представлен в виде тартратной соли. 3. Композиция по п.1, где лактоза представлена в виде моногидрата лактозы. 4. Композиция по п.3, содержащая от 1 до 20 мг/мл оланзапина, от 22,5 до 50 мг/мл моногидрата лактозы и от 0,35 до 10 мг/мл винной кислоты. 5. Композиция по п.3, содержащая 5 мг/мл оланзапина, 1,7 мг/мл винной кислоты и 25 мг/мл моногидрата лактозы. 6. Композиция по п.3, где количество оланзапина выбрано из 1, 2,5, 5, 7,5, 10, 15, 20 мг/мл. 7. Композиция по п.3, содержащая 20 мг оланзапина, 7 мг винной кислоты и 100 мг лактозы. 8. Композиция по любому из пп.1-7 для применения при лечении ажитации. 9. Композиция по п.8, где ажитация связана с расстройствами, выбранными из группы, состоящей из психотических расстройств, шизофрении, биполярных расстройств как маниакальных, так и смешанных состояний, слабоумия и связанных нарушений и нейродегенеративных расстройств. 10. Композиция по п.9, где ажитация связана с расстройствами, выбранными из группы, состоящей из делирия, слабоумия и амнезии и других когнитивных расстройств, психических расстройств, вызванных основным медицинским состоянием, нарушений, связанных со злоупотреблением веществами, шизофрении и других психотических расстройств, нарушений настроения, расстройств, связанных с чувством страха, регулируемых расстройств и личностных расстройств. 11. Применение композиции по любому из пп.1-7 для получения лекарственного средства для лечения ажитации. 12. Фармацевтическая композиция по любому из пп.1-7 для применения при лечении ажитации у человека, содержащая оланзапин в качестве активного ингредиента, винную кислоту и лактозу. 13. Промышленное изделие, содержащее упаковочный материал и композицию, содержащую оланзапин, по любому из пп.1-7, где оланзапин используется для лечения ажитации, и указанный упаковочный материал содержит этикетку или рекламный вкладыш, указывающий, что указанная композиция содержит оланзапин и может быть использована для лечения ажитации. 14. Композиция, содержащая от 1 до 20 мг/мл оланзапина, от 22,5 до 50 мг/мл моногидрата лактозы и от 0,35 до 10 мг/мл винной кислоты. 15. Композиция, содержащая от 1 до 20 мг/мл оланзапина, от 20,0 до 50 мг/мл моногидрата лактозы и от 0,35 до 10 мг/мл винной кислоты. 16. Композиция по любому из пп.1-7, 14, 15, где композиция не содержит кристаллических форм оланзапина. 17. Композиция, получаемая способом, который включает лиофилизацию раствора, содержащего оланзапин, винную кислоту и лактозу. 18. Композиция по п.17, где раствор представляет собой водный раствор. 19. Композиция по п.18, где композиция помещена в контейнер в количестве, достаточном для лечения млекопитающего. 20. Композиция по п.19, где количество оланзапина равно от 0,25 до 50 мг. 21. Композиция по п.19, где количество оланзапина равно от 1 до 30 мг. 22. Способ получения композиции, который включает лиофилизацию раствора, содержащего оланзапин, винную кислоту и лактозу. 23. Способ по п.22, где раствор представляет собой водный раствор. 24. Способ по п.23, где композиция помещена в контейнер в количестве, достаточном для лечения одного млекопитающего.
МПК / Метки
МПК: A61K 31/5513, A61P 25/18
Метки: композиция, лиофилизованная, 2-метилтиенобензодиазепина
Код ссылки
<a href="https://eas.patents.su/9-6506-liofilizovannaya-kompoziciya-2-metiltienobenzodiazepina.html" rel="bookmark" title="База патентов Евразийского Союза">Лиофилизованная композиция 2-метилтиенобензодиазепина</a>
Предыдущий патент: Производные карбамата 1-алкил-1-азониабицикло [2.2.2] октана и их применение в качестве антагонистов мускаринового рецептора
Следующий патент: Новые замещенные 4-фенил-4-[1н-имидазол-2-ил] пиперидиновые производные и их применение в качестве селективных непептидных агонистов дельта-опиоидов
Случайный патент: Антитела против vla-1