Способ получения диорганодиалкоксисиланов
Номер патента: 24457
Опубликовано: 30.09.2016
Авторы: Вималькумар Махендрабхай Патель, Давадра Махеш, Сайнани Джайпракаш Брийлал
Формула / Реферат
1. Способ получения соединения диорганодиалкоксисилана, включающий стадии:
a) реакции соединения тетраалкоксисилана, имеющего общую формулу Si(OR1)4, с первым реактивом Гриньяра общей формулы R2-Mg-X с получением соединения моноорганотриалкоксисилана общей формулы R2-Si(-OR1)3, где молярное соотношение первого соединения Гриньяра и соединения тетраалкоксисилана составляет от 1 до 1,5;
b) реакции соединения моноорганотриалкоксисилана стадии а) с хлорирующим агентом с получением хлорированного соединения моноорганодиалкоксисилана общей формулы
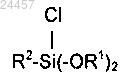
где молярное соотношение между соединением моноорганотриалкоксисилана к хлорирующему агенту составляет от 1 до 1,5;
с) реакции хлорированного соединения моноорганодиалкоксисилана стадии b) со вторым реактивом Гриньяра общей формулы R3-Mg-X с образованием соединения диорганодиалкоксисилана общей формулы
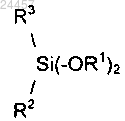
где молярное соотношение второго соединения Гриньяра и хлорированного соединения монозамещенного диалкоксисилана составляет от 1 до 1,5; и где R1, R2 и R3 независимо выбраны из группы, включающей алкильную группу, имеющую от 1 до 20 атомов углерода, и циклоалкильную группу, имеющую от 3 до 20 атомов углерода; а X является йодом, бромом или хлором.
2. Способ по п.1, в котором по меньшей мере один из R1, R2 и R3 является разветвленной алкильной группой, имеющей от 3 до 20 атомов углерода, при этом вторичный или третичный углерод расположен в α и/или β положении к атому кремния.
3. Способ по п.1 или 2, в котором хлорирующий агент выбирают из группы, состоящей из HCl, AlCl3, SOCl2, PCl5, PCl3, ZnCl2, предпочтительно HCl и SOCl2.
4. Способ по любому из пп.1-3, в котором температура реакции в стадии а) поддерживается между 0 и 25°С.
5. Способ по любому из пп.1-4, в котором в стадии а) молярное соотношение соединения первого реактива Гриньяра и соединения тетраалкоксисилана составляет от 1 до 1,2.
6. Способ по любому из пп.1-5, в котором в стадии b) молярное соотношение соединения моноорганотриалкоксисилана и хлорирующего агента составляет от 1 до 1,2, более предпочтительно от 1 до 1,1.
7. Способ по любому из пп.1-6, в котором в стадии с) молярное соотношение второго реактива Гриньяра и хлорированного монозамещенного соединения диалкоксисилана составляет от 1 до 1,2.
8. Способ по любому из пп.1-7, в котором R1 является углеводородной группой, имеющей от одного до десяти атомов углерода, и предпочтительно выбирается из группы, состоящей из метил, этил, n-пропил, изопропил, n-бутил, изобутил, втор-бутил, n-пентил, изопентил, n-гексил, n-гептил, n-октил, n-нонил, n-децил, предпочтительно этил, метил, n-пропил и изопропил.
9. Способ по любому из пп.1-8, в котором R2 является вторичной или третичной углеводородной группой или циклической углеводородной группой, предпочтительно имеющей кольцо от 5 до 20 атомов углерода, при условии, что если R1 является метилом, то циклический углеводород имеет кольцо от 6 до 20 атомов углерода.
10. Способ по п.9, в котором R1 является углеводородной группой, имеющей от 1 до 10 атомов углерода, a R3 может быть такой же или отличаться от R2.
11. Способ по п.9 или 10, в котором R2 выбирают из группы, состоящей из циклических углеводородных групп, имеющих кольцо из 5 или 6 атомов углерода, и третичных углеводородных групп, имеющих от 4 до 10 атомов углерода.
12. Способ по любому из пп.1-11, в котором R3 является алкильной или циклоалкильной группой, имеющей от 3 до 20 атомов углерода.
13. Способ по любому из пп.1-12, в котором R3 выбирают из группы, состоящей из циклических углеводородных групп, имеющих кольцо от 5 до 10 атомов углерода, вторичных углеводородных групп, имеющих от 3 до 10 атомов углерода, и третичных углеводородных групп, имеющих от 4 до 10 атомов углерода.
Текст
Изобретение относится к способу получения диорганодиалкоксисиланов, в частности диорганодиалкоксисиланов, в которых один или оба органических заместителя являются объемными. Способ включает реакцию соединения тетраалкоксисилана с первым реактивом Гриньяра с образованием соединения моноорганотриалкоксисилана, который затем реагирует с хлорирующим агентом с образованием хлорированного моноорганодиалкоксисилана, который затем реагирует со вторым реактивом Гриньяра с образованием соединения диорганодиалкоксисилана.(71)(73) Заявитель и патентовладелец: САУДИ БЕЙСИК ИНДАСТРИЗ КОРПОРЕЙШН (SA) Настоящее изобретение относится к способу получения диорганодиалкоксисиланов, в частности диорганодиалкоксисиланов, в которых один или оба органических заместителя являются объемными. Диорганодиалкоксисиланы, среди прочего, относятся к стереомодификаторам в катализаторах для производства полипропиленов. Чрезвычайно важными для этого применения являются двузамещенные диалкоксиланы, в которых органические заместители являются разветвленными алкильными цепями. Хорошо известно, что диорганодиалкосисиланы могут быть получены алкилированием или армированием тетраалкоксисиланов и только изредка их получают реакцией монозамещенных триалкоксисиланов с реактивами Гриньяра (Houben-Weyl, Methods 25 of Organic Chemistry, XIII/5, 180 p). Однако, как правило, продукты реакции получают в виде смесей диорганодиалкоксисиланов с моноорганотриалкоксисиланами и/или триорганомоноалкоксисиланами, так что выделение искомого диорганодиалкоксисилана требует стадии разделения. Таким образом, в US 4958041 раскрывается, что определенные диорганодиалоксисиланы могут быть легко получены с высоким выходом путем реакции моноорганотриалкоксисиланов или тетраалкоксисиланов с реактивами Гриньяра общей формулы RMgX в соответствующих растворителях. Авторы обнаружили, что этот способ позволяет получить только определенные диорганодиалкоксисиланы. В частности, авторы обнаружили, что если реактив Гриньяра содержит довольно громоздкие органические группы, и в зависимости от типа использованного тетраалкоксисилана предлагаемая в US 4958041 реакция в первую очередь будет давать моноорганотриалкоксисиланы и не давать или давать в малых количествах диорганодиалкоксисиланы. Более того, этот способ позволяет получить только диорганодиалкоксисиланы, в которых две органические группы являются идентичными. Наблюдение авторов поддержано публикацией "Versatile method for introduction of bulky substituentsto alkoxychlorosilanes, Shin Masaoka et al., Journal of Organometallic Chemistry 691 (2006), 182-192", в которой в примере 3.1.21 описана реакция тетра-n-бутоксисилана с изопропилхлоридом магния, для образования изопропил-три(n-бутокси)силана в качестве основного продукта реакции. Задача настоящего изобретения, следовательно, заключается в обеспечении способа получения диорганодиалкоксисиланов, в которых один или предпочтительно оба органических заместителя являются объемными, с использованием легко доступных сырьевых материалов, с помощью относительно простого процесса, при умеренных реакционных условиях и с получением относительно высоких выходов. Дополнительная задача настоящего изобретения заключается в обеспечении способа получения диорганодиалкоксисиланов, в которых органические заместители могут быть различными. Таким образом, авторы нашли способ получения диорганодиалкоксисиланов, включающий стадииa) реакции соединения тетраалкоксисилана, имеющего общую формулу Si(OR1)4 с первым реактивом Гриньяра общей формулы R2-Mg-X, с получением соединения моноорганотриалкоксисилана общей формулы R2-Si(-OR1)3, в котором молярное соотношение первого соединения Гриньяра и соединения тетраалкоксилана составляет от 1 до 1,5;b) реакции соединения моноорганотриалкоксисилана стадии а) с хлорирующим агентом с получением хлорированного соединения моноорганодиалкоксисилана общей формулы где молярное соотношение соединения моноорганотриалкоксисилана к хлорирующему агенту составляет от 1 до 1,5; с) реакции хлорированного соединения моноорганодиалкоксисилана стадии b) с вторым реактивом Гриньяра общей формулы R3-Mg-X с образованием соединения диорганодиалкоксисилана общей формулы где молярное соотношение второго соединения Гриньяра и хлорированного соединения монозамещенного диалкоксисилана составляет от 1 до 1,5; и где R1, R2 и R3 независимо выбраны из группы, включающей алкильную группу, имеющую от 1 до 20 атомов углерода, и циклоалкильную группу, имеющую от 3 до 20 атомов углерода, необязательно содержащую гетероатом; а X является йодом, бромом или хлором. Авторы обнаружили, что для образования преимущественно соединения моноорганотриалкоксисилана в стадии a) R1 и/или R2 должны иметь определенную громоздкость, т.е. они должны привести к определенному эффекту стерического затруднения в ходе реакции. Не желая быть связанным с этим, авторы считают, что данное стерическое затруднение из-за громоздкости в ходе реакции на стадии а) предотвратит или, по меньшей мере, значимо ограничит образование соединений диорганодиалкоксисилана. Термин "преимущественно" при использовании в данном документе следует понимать в том смысле, что выход образования соединения моноорганотриалкоксисилана составляет по меньшей мере 75% от теоретического максимума на основании количества соединения тетраалкоксисилана. Дополнительными факторами, вносящими вклад в образование преимущественно моноорганотриалкоксисилана в стадии а), могут быть молярное соотношение первого реактива Гриньяра и тетраал-1 024457 коксисилана и/или реакционные условия, в частности температура реакции. Специалисту будет понятно,что количество стерического затруднения как результат выбора R1 и R2 будет определять важность этих дополнительных факторов. Например, при выборе молярного соотношения первого реактива Гриньяра и тетраалкоксисилана ниже 1,5, предпочтительно ниже 1,2 будет снижаться возможность образования соединений диорганодиалкоксисилана в случае, когда стерическое затруднение не достаточно сильно, для того чтобы полностью предотвратить образование таких соединений. Однако, это молярное соотношение становится менее важным, если стерическое затруднение само по себе настолько сильное, что не позволяет образование соединений диорганодиалкоксисилана. Предпочтительно R1 и R2 и/или реакционные условия выбирают таким образом, чтобы выход продукта, полученного в стадии а), составлял по меньшей мере 85%. Для получения соединения диорганодиалкоксисилана за стадией а) следует стадия b), в которой одна алкоксигруппа замещается атомом хлора, после которой в стадии с) проводится вторая реакция Гриньяра для замены этого атома хлора на органическую группу R3. Эта органическая группа R3 может быть такой же или отличной от R2, что делает возможным приготовление широкого ряда объемно замещенных диалкоксисиланов, т.е. широкого ряда диорганодиалкоксисиланов. Преимущество настоящего изобретения заключается в том, что оно делает возможным применение легко доступных и недорогих сырьевых материалов, таких как тетраметоксисилан и тетраэтоксисилан. Другие преимущества настоящего изобретения заключаются в том, что выход реакции относительно высокий, и в том, что получение может быть проведено при умеренных реакционных условиях.R1, R2 и R3 независимо выбирают из группы, состоящей из алкильной группы, имеющей от 1 до 20 атомов углерода, и циклоалкильной группы, имеющей от 3 до 20 атомов углерода, необязательно содержащими гетероатом. Предпочтительно по меньшей мере один из R1, R2 и R3 является разветвленной алкильной группой,имеющей от 3 до 20 атомов углерода, при этом вторичный или третичный углерод расположен ви/илиположении к атому кремния. Предпочтительно, если R1, R2 и R3 независимо выбирают из группы, состоящей из алкильной группы, имеющей от 1 до 20 атомов углерода, и циклоалкильной группы, имеющей от 3 до 20 атомов углерода, необязательно содержащими гетероатом, и по меньшей мере один из R1, R2 и R3 является разветвленной алкильной группой, имеющей от 3 до 20 атомов углерода, при этом вторичный или третичный углерод расположен ви/илиположении к атому кремния. Предпочтительно R1 является углеводородной группой, имеющей от 1 до 20 атомов углерода, более предпочтительно от 3 до 10 атомов углерода, а наиболее предпочтительно от 5 до 10 атомов углерода. R1 может быть алкильной группой, предпочтительно имеющей от 1 до 10 атомов углерода, а более предпочтительно выбирают из группы, включающей метил, этил, n-пропил, изопропил, n-бутил, изобутил, вторбутил, n-пентил, изопентил, n-гексил, n-гептил, n-октил, n-нонил, n-децил, предпочтительно этил, метил,n-пропил и изопропил. Более предпочтительно R1 является метилом или этилом. R1 необязательно содержит гетероатом. R1 также может быть циклической углеводородной группой с 3-10 атомами углерода,такой как циклопентильная, циклогексильная или бензильная группа. R1 также может быть алкильной или циклоалкильной группой, состоящей из углеводородного кольца, имеющего от 5 до 8 атомов углерода. Предпочтительно R1 не содержит гетероатом. Предпочтительно R2 является третичной углеводородной группой, или циклической углеводородной группой, предпочтительно имеющей кольцо от 5 до 20 атомов углерода, или алкильной группой,содержащей углеводородное кольцо, имеющее от 5 до 20 атомов углерода, при условии, что если R1 является метилом, циклический углеводород имеет кольцо от 6 до 20 атомов углерода. Авторы обнаружили, что если R1 выбран метилом, стерическое затруднение, полученное циклической R2 группой, имеющей меньше чем 6 атомов углерода, возможно приведет к большему образованию продуктов реакции,отличных от искомого соединения моноорганотриалкоксисилана, т.е. выход образования соединения моноорганотриалкоксисилана меньше чем 75%. Как результат, необходима стадия разделения для получения искомого соединения моноорганотриалкоксисилана. Более предпочтительно, если R2 выбирают из группы, состоящей из циклических углеводородов, имеющих кольцо из 5 или 6 атомов углерода, и третичных углеводородов, имеющих от 3 до 10 атомов углерода. Подходящие примеры R2 группы включают этил, n-пропил, изопропил, n-бутил, изобутил, вторбутил, трет-бутил, n-пентил, изопентил, втор-пентил, трет-пентил, n-гексил, n-гептил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодецил, бензил. Примерами R2 групп, являющихся алкильными группами, содержащими кольцо, являются 1-метил-циклогексил, 1-этил-циклогексил и т.п. Циклические углероводороды также могут содержать разветвления. R2 необязательно содержит гетероатом. Предпочтительно R2 не содержит гетероатом.R1 может быть таким же или отличным от R2 . Предпочтительно R1 является отличным от R2.R3 может быть углеводородным соединением, имеющим от 3 до 20 атомов углерода, необязательно содержащим гетероатом. Предпочтительно, если R3 не содержит гетероатом.R3 предпочтительно выбирают из группы, состоящей из циклических углеводородов, имеющих кольцо от 5 до 10 атомов углерода, вторичные углеводородные группы, имеющие от 3 до 10 атомов углерода, и третичные углеводородные группы, имеющие от 3 до 10 атомов углерода. R3 также может быть алкильной группой, содержащей кольцо (циклической углеводородной группой), или R3 может быть циклическим углеводородным соединением. Примерами R3 являются n-пропил, изопропил, n-бутил, изобутил, втор-бутил, трет-бутил, n-пентил, изопентил, втор-пентил, трет-пентил, n-гексил, n-гептил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодецил, бензил, 1-метилциклогексил, 1-этилциклогексил, циклопентил пропил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодецил, изопропил, втор-бутил, трет-бутил, 1,1-диметилпропил, 1-метил-1 этилпропил, 1,1-диэтилпропил, 1,1,2-триметилпропил.R3 может быть таким же или отличным от R2, предпочтительно R3 отличается от R2. В предпочтительном воплощении R1 является углеводородной группой, предпочтительно алкильной группой, имеющей от 1 до 10 атомов углерода, или циклической углеводородной группой, имеющей от 3 до 10 атомов углерода, R2 является вторичной или более предпочтительно третичной углеводородной группой, или циклической углеводородной группой, предпочтительно имеющей кольцо от 5 до 20 атомов углерода, при условии, что если R является метилом, то циклический углеводород имеет кольцо от 6 до 20 атомов углерода. Хлорирующий агент, используемый в способе настоящего изобретения, может быть любым соединением, способным хлорировать соединение моноорганотриалкоксисилана стадии а). Особенно подходящим для способа настоящего изобретения является неорганический хлорирующий агент, такой какHCl, AlCl3, SOCl2, PCl5, PCl3 и ZnCl2, наиболее предпочтительными являются HCl и SOCl2 в свете их доступности и реакционной способности. Реактивы Гриньяра, используемые в настоящем изобретении, как правило, известны в данной области и могут быть изготовлены любым способом, известным специалисту, например таким, который описан в Grignard Reagents New developments by H.G. Richey 2000 (ISBN 0471999083). Стадия а). Температура стадии а) может поддерживаться между 0 и 25 С, предпочтительно между 5 и 10 С. Реакция может поддерживаться в данном диапазоне до тех пор, пока реакция в стадии а) не закончится(что отслеживается с помощью газовой хроматографии), что означает, что по меньшей мере 85% или предпочтительно 95% соединения тетраалкоксисилана прореагировало. При более низких температурах скорость реакции становится нежелательно низкой; тогда как более высокие температуры могут принести больше побочных продуктов, т.е. понизить выход реакции. Реакционная смесь может поддерживаться при температуре реакции в течение определенного периода времени, например от 1 до 10 ч, предпочтительно от 3 до 8 ч для дальнейшего завершения реакции. Реакция Гриньяра стадии а) может быть проведена в любых хорошо известных растворителях эфирного типа, таких как, например, трет-бутилметиловый эфир и диэтиловый эфир, или в смеси растворителя эфирного типа с апротонным растворителем, таким как гексан, гептан, толуол и ксилол. Реакция в стадии а), как правило, осуществляется в атмосфере инертного газа, например в атмосфере азота или аргона, потому что наличие кислорода в реакционной системе приводит к реакции с реактивом Гриньяра, что, таким образом, приводит к снижению выхода. После окончания реакции стадии а) соответствующее количество насыщенного водного раствора хлорида аммония или разведенной серной кислоты может быть добавлено для растворения соли магния. Количество насыщенного водного раствора хлорида аммония или разведенной серной кислоты зависит от количества тетраалкоксисилана. Например, около 10-15 мл насыщенного раствора хлорида аммония может быть добавлено для 10 г тетраалкоксисилана. Органический слой затем, как правило, отделяют от водного слоя. Органический слой, отделенный таким образом, может быть очищен любым способом,известным в данной области, например фракционной перегонкой при атмосферном или пониженном давлении, на основании чего может быть выделена фракция, состоящая из искомого продукта реакции,которым является моноалкоксиксилан. В зависимости от стерического эффекта, который имеет комбинация выбранных групп R1 и R2, молярное соотношение первого соединения Гриньяра и соединения тетраалкоксисилана может составлять от 1 до 1,5, предпочтительно от 1 до 1,2, а более предпочтительно от 1 до 1,1, с тем, чтобы предотвратить нежелательное образование соединения диорганодиалкоксисилана. В случае, если соотношение ниже 1,тетраалкоксисилан остается непрореагировавшим; тогда как более высокие соотношения приводят к появлению побочных продуктов, т.е. снижению выхода реакции. Материалы, используемые в стадии а), могут быть добавлены в любом порядке и смешаны любым способом, известным в данной области. Тетраалкоксисилан в стадии а) может быть одиночным соединением тетраалкоксисилана или смесью различных соединений тетраалкоксисилана, предпочтительно одиночным соединением тетраалкоксисилана. Аналогично, первый реактив Гриньяра в стадии а) может быть одиночным первым реактивом Гриньяра или смесью различных первых реактивов Гриньяра, предпочтительно одиночным первым реактивом Гриньяра. Стадия b). В течение стадии b) реакционная температура может поддерживаться при умеренных температурах,например температуре в диапазоне от 10 до 50 С, предпочтительно при комнатной температуре, например от между 15 и 30 С. При применении температуры вне этих диапазонов будет уменьшаться выход реакции. Посредством любого способа разделения, известного в данной области, например дистилляцией, в частности вакуумной дистилляцией, может быть получено хлорированное соединение моноорганодиалкоксисилана. Материалы, использованные в стадии b), могут быть добавлены в любом порядке и смешаны любым способом, известным в данной области. Предпочтительно, если хлорирующий агент может быть добавлен постепенно к моноорганотриалкоксисилану в течение определенного периода времени, например в пределах максимум 1 ч. Количество хлорирующего агента предпочтительно эквивалентно количеству соединения моноорганотриалкоксисилана, кроме того, молярное соотношение между соединением моноорганотриалкоксисилана и хлорирующим агентом может находиться в диапазоне от 1 до 1,5, предпочтительно от 1 до 1,2, более предпочтительно от 1 до 1,1. В случае, когда соотношение ниже 1, моноорганотриалкоксилан остается непрореагировавшим; тогда как более высокие соотношения дают на выходе больше побочных продуктов, т.е. снижают выход реакции. Полученный продукт реакции в стадии b) может быть затем очищен любыми средствами, известными в данной области, предпочтительно посредством дистилляции. Хлорирующий агент может быть одиночным хлорирующим агентом или смесью различных хлорирующих агентов. Предпочтительным является одиночный хлорирующий агент. Стадия с). Температура в стадии с) может поддерживаться между 0 и 25 С, предпочтительно между 5 и 10 С. Реакция может поддерживаться в этом диапазоне до окончания реакции стадии с) (что отслеживается газовой хроматографией), что означает, что по меньшей мере 85% или предпочтительно 95% соединения моноорганодиалкоксилана прореагировало. При более низких температурах скорость реакции становится нежелательно низкой; тогда как более высокие температуры могут принести больше побочных продуктов, т.е. понизить выход реакции. Реакционная смесь может выдерживаться при температуре реакции в течение определенного периода времени, например от 1 до 10 ч, предпочтительно от 3 до 8 ч, до окончания реакции. Реакция Гриньяра стадии с) может быть проведена в любых хорошо известных растворителях эфирного типа, таких как, например, трет-бутилметиловый эфир и диэтиловый эфир, или в смеси растворителя эфирного типа с апротонным растворителем, таким как гексан, гептан, толуол и ксилол. Реакция в стадии с), как правило, проводится в инертной атмосфере, например под азотом или аргоном, потому что наличие кислорода в реакционной системе приводит к реакции с реактивом Гриньяра,что таким образом приводит к снижению выхода. После окончания реакции стадии с) соответствующее количество насыщенного водного раствора хлорида аммония или разведенной серной кислоты может быть добавлено к растворенной соли магния. Количество насыщенного водного раствора хлорида аммония или разведенной серной кислоты, как правило, зависит от количества моноорганодиалкоксисилана. Например, около 10-15 мл насыщенного раствора хлорида аммония может быть добавлено к 14 г моноорганодиалкоксилана. Органический слой затем, как правило, отделяют от водного слоя. Органический слой, отделенный таким образом, может быть очищен любым способом, известным в данной области, например фракционной перегонкой при атмосферном или пониженном давлении, на основании чего может быть выделена фракция, состоящая из искомого продукта реакции, которым является соединение диорганодиалкоксилана. Молярное соотношение второго соединения Гриньяра и хлорированного монозамещеного соединения диалкоксисилана составляет от 1 до 1,5, предпочтительно от 1 до 1,2, наиболее предпочтительно от 1 до 1,1. В случае, если соотношение ниже 1, хлорированный монозамещеный диалкоксисилан остается непрореагировавшим; тогда как более высокие соотношения дают на выходе больше побочных продуктов, т.е. снижают выход реакции. Второй реактив Гриньяра в стадии с) может быть одиночным вторым реактивом Гриньяра или смесью различных вторых реактивов Гриньяра; предпочтительно одиночным вторым реактивом Гриньяра. Материалы, использованные в стадии с), могут быть добавлены в любом порядке и смешаны любым способом, известным в данной области. Предпочтительно второй реактив Гриньяра получают отдельно и затем добавляют к хлорированному монозамещенному диалкоксисилану. После этого смесь может храниться при температуре флегмы (как правило определенной по точке кипения растворителя) до окончания реакции в общем между 1 и 6 ч, предпочтительно между 3-6 ч. Способ по настоящему изобретению теперь будет дополнительно объяснен с помощью двух неограничивающих примеров. Пример 1. Получение циклопентилизобутилдиэтоксисилана (е). Общая схема реакции для получения циклопентилизобутилдиэтоксисилана следующая:(a) Получение циклопентилбромид магния (1-й реактив Гриньяра). 1,8 г (0,074 моль) металлического магния и 25 мл трет-бутилметилового эфира загружали в 250 мл колбу, оборудованную обратным холодильником, капельной воронкой и мешалкой, в атмосфере азота. После начала перемешивания кристалл йода и раствор, содержащий 10,0 г циклопентилбромида (0,067 моль) и 0,2 г 1,2-дибромоэтана, разведенных 25 мл трет-бутилэтилового эфира, покапельно добавляли из капельной воронки в течение 6 ч в условиях дефлегмации трет-бутилового эфира. После добавления перемешивание проводили в течение 4 ч с обратным холодильником с получением раствора циклопентилбромида магния.(b) Получение циклопентилтриэтоксисилана. 60 мл сухого трет-бутилметилового эфира и 14,0 г (0,067 моль) тетраэтоксисилана загружали в 250 мл колбу, оборудованную обратным холодильником и мешалкой, в атмосфере азота, медленно добавляли раствор циклопентилбромида магния, полученного выше в (а), при этом поддерживая внутреннюю температуру ниже 10 С. После окончания добавления перемешивание проводили при комнатной температуре в течение 6 ч и температуре флегмы в течение 2 ч. К полученной реакционной массе добавляли покапельно 10-20 мл насыщенного водного раствора хлорида аммония для растворения соли магния. Органический слой отделяли от водного слоя, сушили и выпаривали с получением неочищенного циклопентилтриэтоксисилана. Сырой продукт очищали фракционной перегонкой при пониженном давлении с получением 12 г чистого циклопентилтриэтоксисилана (76% от теоретического максимального выхода на основании количества тетраэтоксисилана).(c) Получение изобутилбромида магния (2-й реактив Гриньяра). 1,8 г (0,074 моль) магния и 25 мл диэтилового эфира загружали в 250 мл колбу, оборудованную обратным холодильником, капельной воронкой и мешалкой, в атмосфере азота. После начала перемешивания кристалл йода и раствор, содержащий изобутилбромид 9,3 г (0,067 моль) и 0,2 г 1,2 дибромоэтана,разведенного 25 мл диэтилового диэфира, покапельно добавляли из капельной воронки в течение 2 ч в условиях дефлегмации диэтилового эфира. После добавления перемешивание проводили в течение 2 ч с обратным холодильником для получения эфирного раствора изобутилбромида магния.(d) Получение хлорциклопентилдиэтоксисилана. 5,4 г тионилхлорида (0,045 моль) покапельно добавляли при 25 С в течение 1 ч в перемешанную смесь 10,5 г (0,045 моль) циклопентилтриэтоксисилана (b) и DMF (0,1 мл). Реакционную массу перемешивали в течение 4 ч при 25 С и перегоняли в вакууме с получением 8,4 г (83,8%) хлорциклопентилдиэтоксисилана (d).(e) Получение циклопентилизобутилдиэтоксисилана. 50 мл сухого диэтилового эфира и 14,0 г (0,063 моль) хлорциклопентилдиэтоксисилана (d) загружали в 250 мл колбу, оборудованную обратным холодильником и мешалкой в атмосфере азота, и полученный выше раствор изобутилбромида магния медленно добавляли при сохранении внутренней температуры ниже 10 С. После окончания добавления перемешивание проводили при комнатной температуре в течение 6 ч и температуре флегмы в течение 2 ч. К полученной реакционной массе добавляли покапельно 10-20 мл насыщенного водного раствора хлорида аммония для растворения соли магния. Органический слой отделяли от водной фазы, сушили и упаривали с получением неочищенного циклопентилизобутилдиэтоксисилана. Этот неочищенный продукт очищали фракционной перегонкой в условиях пониженного давления с получением 12 г (78%) чистого циклопентилизобутилдиэтоксисилана. Пример 2. Получение циклогексилциклопентилдиэтоксисилана (е). Общая схема реакции для получения циклогексилциклопентилдиэтоксисилана следующая:(a) Получение циклогексилхлорида магния (1-й реактив Гриньяра). 2,18 г (0,09 моль) магния и 25 мл диэтилового эфира загружали в 250 мл колбу, оборудованную обратным холодильником, капельной воронкой и мешалкой, в атмосфере азота. После начала перемешивания кристалл йода и раствор, содержащий циклогексилхлорид 9,5 г (0,08 моль) и 0,2 г 1,2-дибромоэтана,разведенных в 25 мл диэтилового эфира, покапельно добавляли из капельной воронки в течение 2 ч в условиях дефлегмации диэтилового эфира. После добавления перемешивание проводили в течение 4 ч с обратным холодильником для получения раствора циклогексилбромида магния.(b) Получение циклогексилтриэтоксисилана. 60 мл сухого диэтилового эфира и 14 г (0,067 моль) тетраэтоксисилана загружали в 250 мл колбу,оборудованную обратным холодильником и мешалкой, в атмосфере азота, и полученный выше раствор циклогексилхлорида магния медленно добавляли при сохранении внутренней температуры ниже 10 С. После окончания добавления перемешивание проводили при комнатной температуре в течение 6 ч и температуре флегмы в течение 2 ч. К полученной реакционной массе добавляли покапельно 10-20 мл насыщенного водного раствора хлорида аммония для растворения соли магния. Органический слой отделяли от водного слоя, сушили и упаривали с получением неочищенного циклогексилтриэтоксисилана. Этот неочищенный продукт очищали фракционной перегонкой при пониженном давлении с получением 14,2 г чистого циклогексилтриэтоксисилана (86% от теоретического максимального выхода на основании количества тетраэтоксисилана).(c) Получение циклопентилхлорида магния (2-й реактив Гриньяра). 1,8 г (0,074 моль) магния и 25 мл диэтилового эфира загружали в 250 мл колбу, оборудованную обратным холодильником, капельной воронкой и мешалкой, в атмосфере азота. После начала перемешивания кристалл йода и раствор, содержащий циклопентилхлорид 7,6 г (0,072 моль) и 0,2 г 1,2 дибромэтана,разведенных в 25 мл диэтилового диэфира, покапельно добавляли из капельной воронки в течение 2 ч в условиях дефлегмации диэтилового эфира. После добавления перемешивание проводили в течение 6 ч с обратным холодильником для получения раствора циклопентилхлорида магния (с).(d) Получение хлорциклогексилдиэтоксисилана. 11,6 г (0,0975 моль) тионилхлорида покапельно добавляли при 25 С в течение 1 ч к перемешиваемой смеси 20 г (0,08 моль) циклогексилтриэтоксисилана (b) и DMF (0,1 мл). Реакционную массу перемешивали в течение 4 ч при 25 С и перегоняли в вакууме с получением хлорциклогексилдиэтоксисилана(e) Получение циклопентилциклогексилдиэтоксисилана. 60 мл сухого диэтилового эфира и 14,0 г (0,063 моль) хлороциклогексилдиэтоксисилана (d) загружали в 250 мл колбу, оборудованную обратным холодильником и мешалкой, в атмосфере азота, и полученный выше раствор циклопентилхлорида магния (2-й реактив Гриньяра) медленно добавляли при поддержании внутренней температуры ниже 10 С. После окончания добавления перемешивание проводили при комнатной температуре в течение 6 ч и при температуре флегмы в течение 5 ч. К полученной реакционной массе добавляли покапельно 10-20 мл насыщенного водного раствора хлорида аммония для растворения соли магния. Органический слой отделяли от водной фазы, сушили и упаривали с получением неочищенного циклопентилизобутилдиэтоксисилана. Этот неочищенный продукт очищали фракционной перегонкой при пониженном давлении с получением 12 г (75%) чистого циклопентилизобутилдиэтоксисилана. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения диорганодиалкоксисилана, включающий стадии:a) реакции соединения тетраалкоксисилана, имеющего общую формулу Si(OR1)4, с первым реактивом Гриньяра общей формулы R2-Mg-X с получением соединения моноорганотриалкоксисилана общей формулы R2-Si(-OR1)3, где молярное соотношение первого соединения Гриньяра и соединения тетраалкоксисилана составляет от 1 до 1,5;b) реакции соединения моноорганотриалкоксисилана стадии а) с хлорирующим агентом с получением хлорированного соединения моноорганодиалкоксисилана общей формулы где молярное соотношение между соединением моноорганотриалкоксисилана к хлорирующему агенту составляет от 1 до 1,5; с) реакции хлорированного соединения моноорганодиалкоксисилана стадии b) со вторым реактивом Гриньяра общей формулы R3-Mg-X с образованием соединения диорганодиалкоксисилана общей формулы где молярное соотношение второго соединения Гриньяра и хлорированного соединения монозамещенного диалкоксисилана составляет от 1 до 1,5; и где R1. R2 и R3 независимо выбраны из группы, включающей алкильную группу, имеющую от 1 до 20 атомов углерода, и циклоалкильную группу, имеющую от 3 до 20 атомов углерода; а X является йодом, бромом или хлором. 2. Способ по п.1, в котором по меньшей мере один из R1, R2 и R3 является разветвленной алкильной группой, имеющей от 3 до 20 атомов углерода, при этом вторичный или третичный углерод расположен ви/илиположении к атому кремния. 3. Способ по п.1 или 2, в котором хлорирующий агент выбирают из группы, состоящей из HCl,AlCl3, SOCl2, PCl5, PCl3, ZnCl2, предпочтительно HCl и SOCl2. 4. Способ по любому из пп.1-3, в котором температура реакции в стадии а) поддерживается между 0 и 25 С. 5. Способ по любому из пп.1-4, в котором в стадии а) молярное соотношение соединения первого реактива Гриньяра и соединения тетраалкоксисилана составляет от 1 до 1,2. 6. Способ по любому из пп.1-5, в котором в стадии b) молярное соотношение соединения моноорганотриалкоксисилана и хлорирующего агента составляет от 1 до 1,2, более предпочтительно от 1 до 1,1. 7. Способ по любому из пп.1-6, в котором в стадии с) молярное соотношение второго реактива Гриньяра и хлорированного монозамещенного соединения диалкоксисилана составляет от 1 до 1,2. 8. Способ по любому из пп.1-7, в котором R1 является углеводородной группой, имеющей от одного до десяти атомов углерода, и предпочтительно выбирается из группы, состоящей из метил, этил, nпропил, изопропил, n-бутил, изобутил, втор-бутил, n-пентил, изопентил, n-гексил, n-гептил, n-октил, nнонил, n-децил, предпочтительно этил, метил, n-пропил и изопропил. 9. Способ по любому из пп.1-8, в котором R2 является вторичной или третичной углеводородной группой или циклической углеводородной группой, предпочтительно имеющей кольцо от 5 до 20 атомов углерода, при условии, что если R1 является метилом, то циклический углеводород имеет кольцо от 6 до 20 атомов углерода. 10. Способ по п.9, в котором R1 является углеводородной группой, имеющей от 1 до 10 атомов углерода, a R3 может быть такой же или отличаться от R2. 11. Способ по п.9 или 10, в котором R2 выбирают из группы, состоящей из циклических углеводородных групп, имеющих кольцо из 5 или 6 атомов углерода, и третичных углеводородных групп, имеющих от 4 до 10 атомов углерода. 12. Способ по любому из пп.1-11, в котором R3 является алкильной или циклоалкильной группой,имеющей от 3 до 20 атомов углерода. 13. Способ по любому из пп.1-12, в котором R3 выбирают из группы, состоящей из циклических углеводородных групп, имеющих кольцо от 5 до 10 атомов углерода, вторичных углеводородных групп,имеющих от 3 до 10 атомов углерода, и третичных углеводородных групп, имеющих от 4 до 10 атомов углерода.
МПК / Метки
МПК: C07F 7/18
Метки: диорганодиалкоксисиланов, способ, получения
Код ссылки
<a href="https://eas.patents.su/8-24457-sposob-polucheniya-diorganodialkoksisilanov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения диорганодиалкоксисиланов</a>
Предыдущий патент: Трубопроводный обратный клапан
Следующий патент: Способ активации целлюлозы
Случайный патент: Рама для двери, окна или иной аналогичной конструкции












