Способ изготовления эндоваскулярного устройства с покрытием
Формула / Реферат
1. Способ изготовления эндоваскулярного устройства с покрытием, который включает в себя
подготовку в основном цилиндрического трубчатого корпуса (2), выполненного из инертного биологически совместимого металла или металлического сплава, выбираемого из группы, состоящей из нержавеющей стали, сплава кобальт-хром CoCr, титана Ti или его сплава, сплава хрома Cr;
покрытие поверхности трубчатого корпуса по меньшей мере одним тонким инертным биологически совместимым слоем (s), причем покрытие изготавливается в соответствии со следующими последовательными этапами:
I. Осаждение первого титанового (Ti) слоя (21);
II. Первая обработка азотом (N) первого титанового (Ti) слоя (21) путем распространения высоких ионных токов по подложке в процессе ионного осаждения при помощи несимметричного магнетронного распылителя с замкнутым полем для преобразования по меньшей мере части первого титанового слоя (21) в первый слой (210) керамического покрытия из нитрида титана (TiN);
III. Осаждение на первый слой керамического покрытия (210) из нитрида титана (TiN) второго титанового (Ti) слоя (22);
VI. Вторая обработка азотом (N) второго титанового (Ti) слоя (22) путем распространения высоких ионных токов по подложке в процессе ионного осаждения при помощи несимметричного магнетронного распылителя с замкнутым полем для преобразования по меньшей мере части второго титанового слоя (22) в первый слой (220) керамического покрытия из нитрида титана (TiN).
2. Способ по п.1, в котором целью первой операции обработки азотом (N) первого титанового (Ti) слоя (21) является преобразование по меньшей мере части указанного титанового слоя (21) в компактное керамическое покрытие (210) из нитрида титана.
3. Способ по п.1 или 2, в котором целью второй операции обработки азотом второго титанового слоя (22), выполняемой путем распространения высоких ионных токов по подложке (ионное осаждение при помощи несимметричного магнетронного распылителя с замкнутым полем), является преобразование всего второго титанового слоя (22) во второй пористый керамический слой (220) из нитрида титана.
4. Способ по п.1 или 2, в котором первый титановый (Ti) слой имеет толщину около 100 нм.
5. Способ по п.1, в котором тонкий инертный биологически совместимый слой (s) на основе нитрида титана, полностью покрывающий поверхность стента, имеет толщину около 1-2 мкм.
6. Способ по п.1, в котором, по меньшей мере, внешняя часть керамического покрытия из нитрида титана (TiN) имеет столбчатую структуру.
7. Способ по п.1, в котором, по меньшей мере, внешняя часть керамического покрытия из нитрида титана (TiN) обладает заданной пористостью.
8. Способ по п.1, в котором операции обработки азотом выполняются при помощи системы ионного осаждения, состоящей по меньшей мере из одного магнетрона.
9. Способ по п.1, отличающийся тем, что он дополнительно включает в себя последующий этап осаждения антирестенозного препарата на внешней пористой поверхности биологически совместимого слоя (s), покрывающего трубчатый корпус.
10. Способ по п.1 или 9, в котором эндоваскулярное устройство является имплантантом для брюшной и грудной аорты и/или подвздошных артерий.
11. Способ по п.1 или 9, в котором эндоваскулярное устройство является коронарным стентом.
12. Способ по п.1 или 9, в котором эндоваскулярное устройство является периферийным стентом.
13. Способ по п.1 или 9, в котором эндоваскулярное устройство является билиарным стентом.
14. Способ по п.1 или 9, в котором эндоваскулярное устройство является ренальным стентом.
15. Способ по п.1 или 9, в котором эндоваскулярное устройство является каротидным и церебральным стентом.
16. Способ по п.1, в котором в эндоваскулярном устройстве в основном цилиндрический корпус (2) выполнен из инертной и биологически совместимой стали 316L.
17. Способ по п.1, в котором в эндоваскулярном устройстве в основном цилиндрический корпус (2) выполнен из различных инертных и биологически совместимых металлических сплавов, в частности сплавов CoCr, таких как L605 (Со-20Cr-15W-10Ni), Co-28Cr-6Mo, Co-35Ni-20Cr-10Mo, Co-20Cr-16Fe-15Ni-7Mo.
18. Способ по п.1, в котором в эндоваскулярном устройстве в основном цилиндрический корпус (2) выполнен из инертного и биологически совместимого титана Ti или его сплава, выбираемого из группы, состоящей из Ti-12Mo-6Zr-2Fe, Ti-15Mo, Ti-3Al-2,5V, Ti-35Nb-7Zr-5Ta, Ti-6Al-4Va, Ti-6Al-7Nb, Ti-13Nb-13Zr.
19. Способ по п.1, в котором в эндоваскулярном устройстве в основном цилиндрический корпус (2) выполнен из никель-титанового сплава (нитинола), обладающего свойством запоминания формы.
20. Способ по п.1, в котором в эндоваскулярном устройстве в основном цилиндрический корпус (2) выполнен из инертного и биологически совместимого сплава хрома Cr, выбираемого из группы, состоящей из Cr-14Ni-2,5Mo, Cr-13Ni-5Mn-2,5Mo, Cr-10Ni-3Mn-2,5Mo.
21. Способ по п.1, который дополнительно включает в себя этап предварительной полировки, целью которого является удаление с трубчатого корпуса, на который будет наноситься покрытие, всех поверхностных загрязнений и дефектов, возникших при лазерной резке, таких как отходы материала, образовавшиеся после термического взрыва.
22. Способ по п.21, в котором этап предварительной полировки выполняется при помощи алюминиевого порошка (Al 203), а в случае если такая обработка не достаточна, может быть проведена химическая обработка способами и устройствами, использующимися в трехмерной литографии.
23. Способ по п.21, в котором этап предварительной полировки может представлять собой химическое, песчаное, электролитическое и/или электрохимическое полирование.
24. Способ по п.1, в котором операции обработки выполняются при помощи по меньшей мере одного магнетрона и которые включают в себя следующие этапы:
помещение трубчатого корпуса (2) в вакуумную камеру;
помещение по меньшей мере одного титанового элемента в вакуумную камеру;
введение инертного газа в вакуумную камеру;
бомбардировку электронами, вырабатываемыми по меньшей мере одним магнетроном, атомов инертного газа для получения ионов инертного газа;
бомбардировку ионами инертного газа указанного титанового элемента для получения ионов титана;
создание разницы потенциалов между трубчатым корпусом (2) и вакуумной камерой для получения осаждения ионов титана на трубчатом корпусе.
25. Способ по п.24, в котором операция дополнительно включает в себя этап введения газообразного водорода в вакуумную камеру для получения нитрида титана.
26. Эндоваскулярное устройство с покрытием, включающее в себя
трубчатый в основном цилиндрический корпус (2), выполненный из инертного и биологически совместимого металла или металлического сплава, выбираемого из группы, состоящей из нержавеющей стали, сплава кобальт-хром CoCr, титана Ti или его сплава, сплава хрома Cr, на внешнюю поверхность в основном цилиндрического корпуса которого нанесен по меньшей мере один тонкий биологически совместимый инертный слой (s) на основе титана, состоящий из
первого керамического слоя, выполненного из слоя (21) на основе титана, находившегося в контакте и связаного с внешней поверхностью устройства, включающий нитрид титана (TiN), полученный путем первой обработки азотом (N) части первого титанового слоя (21) распространением высоких ионных токов по подложке в процессе ионного осаждения при помощи несимметричного магнетронного распылителя с замкнутым полем;
второго слоя на основе титана, имеющего столбчатую структуру и являющегося пористым, связанного непосредственно с первым керамическим слоем из нитрида титана (210), при этом второй слой, по меньшей мере, частично выполнен из второго керамического слоя (220) из нитрида титана, полученного второй обработкой азотом (N) второго титанового (Ti) слоя (22) путем распространения высоких ионных токов по подложке в процессе ионного осаждения при помощи несимметричного магнетронного распылителя с замкнутым полем.
27. Эндоваскулярное устройство с покрытием по п.26, в котором второй слой на основе титана, связываемый непосредственно с указанным первым керамическим слоем (210) из нитрида титана полностью образован из нитрида титана.
28. Эндоваскулярное устройство с покрытием по п.26, в котором толщина первого титанового (Ti) слоя (21) составляла 100 нм.
29. Эндоваскулярное устройство с покрытием по п.26, в котором тонкий инертный биологически совместимый слой (s) покрытия на основе нитрида титана имеет толщину около 1-2 мкм.
30. Эндоваскулярное устройство с покрытием по п.26, в котором в основном цилиндрический корпус (2) выполнен из биологически совместимой стали 316L.
31. Эндоваскулярное устройство с покрытием по п.26, в котором в основном цилиндрический корпус (2) выполнен из инертного и биологически совместимого сплава кобальта с хромом CoCr, выбираемого из группы, состоящей из L605 (Co-20Cr-15W-10Ni), Co-28Cr-6Mo, Co-35Ni-20Cr-10Mo, Co-20Cr-16Fe-15Ni-7Mo.
32. Эндоваскулярное устройство с покрытием по п.26, в котором в основном цилиндрический корпус (2) выполнен из инертного и биологически совместимого титана Ti или его сплава, выбираемого из группы, состоящей из Ti-12Mo-6Zr-2Fe, Ti-15Mo, Ti-3Al-2,5V, Ti-35Nb-7Zr-5Ta, Ti-6Al-4Va, Ti-6Al-7Nb, Ti-13Nb-13Zr.
33. Эндоваскулярное устройство с покрытием по п.26, в котором в основном цилиндрический корпус (2) выполнен из инертного и биологически совместимого никель-титанового сплава (нитинола), обладающего свойством запоминания формы.
34. Эндоваскулярное устройство с покрытием по п.26, в котором в основном цилиндрический корпус (2) выполнен из инертного и биологически совместимого сплава хрома Cr, выбираемого из группы, состоящей из Cr-14Ni-2,5Mo, Cr-13Ni-5Mn-2,5Mo, Cr-10Ni-3Mn-2,5Mo.
35. Эндоваскулярное устройство с покрытием по п.26, дополнительно включающее в себя антиренозный препарат, осажденный на внешней пористой поверхности указанного биологически совместимого слоя (s), который покрывает трубчатый корпус.
36. Эндоваскулярное устройство с покрытием по п.26 или 35, которое является имплантантом для брюшной или грудной аорты и/или подвздошных артерий.
37. Эндоваскулярное устройство с покрытием по п.26 или 35, которое является коронарным стентом.
38. Эндоваскулярное устройство с покрытием по п.26 или 35, которое является периферийным стентом.
39. Эндоваскулярное устройство с покрытием по п.26 или 35, которое является билинарным стентом.
40. Эндоваскулярное устройство с покрытием по п.26 или 35, которое является ренальным стентом.
41. Эндоваскулярное устройство с покрытием по п.26 или 35, которое является каротидным или церебральным стентом.

Текст
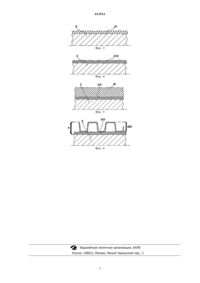
013514 Область техники, к которой относится изобретение Настоящее изобретение относится к способам изготовления эндоваскулярных устройств с покрытием, обладающих свойствами, описанными в п.1 формулы изобретения. Также целью данного изобретения является стент с покрытием, обладающий свойствами, описанными в п.13 формулы изобретения. Настоящее изобретение относится к медицинской области кардиологии, а более конкретно, к реализации медицинского хирургического инструмента для лечения и профилактики ишемического состояния сердца. Уровень техники Ишемическое состояние сердца является наиболее распространенным сердечным заболеванием в западных странах, а также является основной причиной смертей. В последние десятилетия проводились исследования различных устройств, предназначенных для борьбы с этими заболеваниями, и полученные результаты показали, что использование стентов является наиболее эффективным решением. Эта процедура представляет собой простой способ, который позволяет избежать выполнения более сложных хирургических операций типа хирургического восстановления сосудов. Как известно, стент представляет собой имеющий в основном цилиндрическую форму протез с расширяемой открытой структурой, обычно выполненный из стали, предназначенный для использования в медицинских целях, который имплантируется в поврежденный участок артерии (при стенозе или закупорке сосуда). Указанная открытая структура расширяется до требуемых размеров, соответствующих диаметру артерии, при помощи хорошо известного способа надувного баллона, при котором в сосуд вводится и затем надувается баллон с надетым на него стентом. При расширении баллон увеличивает диаметр стента до требуемой величины, затем он сдувается и вытаскивается. Стент остается в том месте, в которое он был помещен, за счет упругого сжатия тканями кровеносного сосуда. Заявители данного патента обратили внимание на то, что при использовании стентов известной технологии возникает ряд проблем, и что они могут быть устранены по ряду аспектов. Наиболее существенной проблемой при реконструкции коронарных сосудов является рестеноз внутри стента. Он определяется несколькими факторами, из которых наиболее важным является внутренняя гиперплазия, проявляющаяся в активации клеток оболочечной среды гладкой мышцы, которая вызывается повреждением, нанесенным, при введении стента. Для устранения этой проблемы обычно используются закрепляемые на поверхности стента препараты, замедляющие рост клеток и тканей. Наиболее распространенным способом является нанесение на поверхность стента полимерного покрытия,которое удерживает препарат и обеспечивает его медленное выделение после имплантации стента. Однако в этих случаях не обеспечивается постепенного и постоянного выделения препарата с поверхности стента, что может снизить эффект от его применения. В частности в случае использования металлического стента без полимерного покрытия было замечено, что возникает дополнительная причина разрастания клеток, заключающаяся в химико-физическом взаимодействии между стенками сосуда и материалом стента (среди элементов сплава которого имеется никель). На самом деле было продемонстрировано, что стенты известной технологии при контакте с органическими жидкостями подвергаются коррозии, при которой выделяется никель, хром и другие вещества,которые, находясь внутри организма, могут спровоцировать аллергические реакции. Кроме того, проблемы кровяной биологической совместимости повышают риск образования тромбов в первые дни после имплантации. По этой причине были разработаны модификации стентов известной технологии, в которых поверхности стентов, находящиеся в контакте с кровью, имеют покрытие,выполненное из не вызывающих аллергических реакций материалов типа обедненного урана, карбида кремния, углерода или полимеров. Однако при использовании металлических стентов с покрытием, не вызывающим аллергических реакций, возникают другие проблемы. На самом деле, использование покрытия, содержащего такие материалы как обедненный уран, являющиеся источниками ионизирующего излучения, может вызвать такое серьезное заболевание как поздний тромбоз. Углерод не является подходящим материалом для покрытия, поскольку под действием большой механической нагрузки при расширении стента во время имплантации он подвергается хрупкому разрушению. Кроме того, карбид кремния также не является часто используемым материалом, поскольку при высоких концентрациях он является цитотоксичным. И, наконец, полимерные покрытия в настоящее время не позволяют получать пленки тоньше 5 мкм. Другой проблемой в известной технологи является то, что при изготовлении стента применяющимися в настоящее время способами невозможно получить идеально гладкую поверхность стента, которая необходима для предотвращения турбулентности потока крови, которая может усугубить повреждения стенок сосуда и повысить вероятность возникновения рестиноза. На имя того же заявителя была подана заявка на патент, зарегистрированная под номером МО 2003 А 000238, в которой предлагается первый вариант решения вышеупомянутых проблем, и которая относится к стентам с покрытием из нитрида титана, которое не выделяет аллергических веществ и не оказывает отрицательного воздействия на организм и, таким образом, обеспечивает коррозионную стой-1 013514 кость, химическую устойчивость и высокую биологическую совместимость. Раскрытие изобретения Задачей настоящего изобретения является усовершенствование результатов, достигнутых в предыдущем изобретении, описанном в патентной заявке МО 2003 А 000238, путем разработки эндоваскулярного устройства с покрытием меньшей толщины, которое не меняет механических свойств и функциональности данного стента. Другой задачей данного изобретения является реализация эндоваскулярного устройства, поверхность которого является настолько гладкой, что позволяет избежать образования турбулентности потока крови и снизить активацию тромбоцитов и, таким образом предотвратить или значительно снизить риск образования тромбов. Кроме того, эндоваскулярное устройство настоящего изобретения позволяет размещать на себе и вводить в организм в заданное время лекарственный препарат. Эти и другие задачи, которые станут понятны из нижеследующего описания, достигаются при помощи эндоваскулярного устройства, обладающего характеристиками, приведенными в п.1 формулы изобретения. Термин "эндоваскулярное устройство" в данном изобретении используется предпочтительно,но не ограничительно, для обозначения устройств одного из следующих типов: имплантанта для брюшной и грудной аорты и/или подвздошных артерий; коронарного стента; периферийного стента; билиарного стента; ренального стента; каротидного и церебрального стента. Другие характеристики и преимущества настоящего изобретения описываются в нижеследующем подробном описании предпочтительного, но не исключительного варианта осуществления эндоваскулярного устройства и способа его изготовления, соответствующего настоящему изобретению. Описание дается со ссылками на прилагаемые чертежи, которые приведены только для иллюстрации и, следовательно, не накладывают ограничений на изобретение. Краткое описание чертежей Фиг. 1 - стент, соответствующий настоящему изобретению; фиг. 2 - участок сечения стента, показанного на фиг. 1, в увеличенном масштабе с выделенными слоями покрытия; фиг. 3, 4, 5, 6 - схематическое изображение того же участка поперечного сечения стенки стента на различных рабочих этапах изготовления покрытия. Подробное описание изобретения Далее термин "стент" будет использоваться в выше определенном расширенном значении. На прилагаемых чертежах позицией 1 обозначен стент, соответствующий настоящему изобретению. Стент 1 имеет трубчатый металлический гибкий и в основном цилиндрический корпус 2, который выполнен, например, из металлической замкнутой сетки. Можно указать, что металлическая сетка может быть изготовлена при помощи лазерной резки из трубки круглого сечения, выполненной из нержавеющей стали. Трубчатый корпус 2, обычно выполняется из технологичного материала с высокой усталостной прочностью, типа нержавеющей стали 316L. Также могут использоваться другие материалы, такие как различные инертные биологически совместимые металлические сплавы, и в частности сплавы кобальта с хромом CoCr, такие как L605 (Co-20Cr-15W-10Ni), Co-28Cr-6 Мо, Co-35Ni-20Cr-10Mo, Co-20Cr16Fe-15Ni-7Mo, в силу их большой эластичности, которая снижает риск образования микротрещин, а также их число на этапах гофрирования и расширения, а также благодаря возможности сохранения этих характеристик при минимальной толщине; различные инертные биологически совместимые металлические сплавы, и в частности чистый титан или его сплавы, такие как Ti-12Mo-6Zr-2Fe, Ti-15Mo, Ti-3Al-2,5V, Ti-35Nb-7Zr-5Ta, Ti-6Al-4Va, Ti6Al-7Nb, Ti-13Nb-13Zr; никель-титановый сплав со свойством запоминания формы (нитинол); различные инертные биологически совместимые металлические сплавы, и в частности сплавы хрома Cr, такие как Cr-14Ni-2,5Mo, Cr-13Ni-5Mn-2,5Mo, Cr-10Ni-3Mn-2,5Mo. Трубчатый корпус 2 полностью покрыт, по меньшей мере, инертным биологически совместимым слоем 's' покрытия, здесь термином "биологически совместимый" обозначен материал, который минимально взаимодействует с тканями стенок сосуда и кровяным потоком и не оказывает отрицательного воздействия на организм человека. Тонкий биологически совместимый инертный слой на основе нитрида титана, который покрывает весь стент, получается после подготовки трубчатого в основном цилиндрического корпуса 2, изготовленного из расширяемой металлической сетки, обычно выполненной из нержавеющей медицинской стали, способом, который включает в себя следующие последовательные операции:-2 013514 осаждение первого титанового слоя (21); первая обработка азотом (N) первого титанового (Ti) слоя (21) путем распространения высоких ионных токов по подложке (ионное осаждение при помощи несимметричного магнетронного распылителя с замкнутым полем) для преобразования по меньшей мере части первого титанового слоя (21) в первый слой (210) керамического покрытия из нитрида титана (TiN); осаждение на первый слой (210) керамического покрытия из нитрида титана (TiN) второго титанового (Ti) слоя (22); вторая обработка азотом (N) второго титанового (Ti) слоя (22) путем распространения высоких ионных токов по подложке (ионное осаждение при помощи несимметричного магнетронного распылителя с замкнутым полем) для преобразования по меньшей мере части второго титанового слоя (22) в первый слой (220) керамического покрытия из нитрида титана (TiN). Первый титановый слой 21 предпочтительно имеет толщину около 100 нм. Первая обработка азотом первого титанового слоя 21 предназначена для преобразования по меньшей мере части первого титанового слоя 21 в компактное керамическое покрытие 210, выполненное из нитрида титана. Вторая обработка азотом второго титанового слоя (22) путем распространения высоких ионных токов по подложке (ионное осаждение при помощи несимметричного магнетронного распылителя с замкнутым полем) предназначена для преобразования всего второго титанового слоя 22 во второй слой 220 керамического покрытия, полностью состоящего из нитрида титана. Первый слой, образованный, по меньшей мере, частично из нитрида титана, обеспечивает безопасность второй обработки, предотвращая непосредственный контакт с внешней поверхностью трубчатого цилиндрического корпуса 2. Вторая обработка выполняется таким образом, что нитрид титана (TiN) обладает строением того же типа, что показано на фиг. 2. В частности, данное строение является характерным для всего керамического покрытия 220, выполненного из пористого нитрида титана. Тонкий инертный и биологически совместимый титановый слой 's' (полностью или почти полностью выполненный из нитрида титана), который покрывает стент, имеет толщину около 1-2 мкм, а предпочтительно 1,5 мкм. Наружная поверхность керамического покрытия, выполненного из нитрида титана (TiN) характеризуется заданной пористостью, целью которой является удержание слоя лекарственного препарата, даже в случае, когда этот слой является мономолекулярным. Более конкретно, операции обработки азотом выполняются при помощи системы ионного осаждения, состоящей по меньшей мере из одного магнетрона. Следующим характерным этапом данного способа нанесения покрытия является осаждение антирестинозного препарата на всей внешней поверхности указанного биологически совместимого материала, которым покрыт трубчатый корпус 2. Перед выполнением этого этапа необходимо проведение предварительной операции по удалению всех загрязнений с трубчатого корпуса 2, на который будет наноситься покрытие. В частности, технологические операции по осаждению титана выполняются при помощи по меньшей мере одного магнетрона и включают в себя следующие этапы: помещение трубчатого корпуса 2 в вакуумную камеру; помещение по меньшей мере одного титанового элемента в вакуумную камеру; введение инертного газа в вакуумную камеру; бомбардировка электронами, вырабатываемыми по меньшей мере одним магнетроном, атомов инертного газа для получения ионов инертного газа; бомбардировка ионами инертного газа титанового элемента для получения ионов титана; создание разницы потенциалов между трубчатым корпусом 2 и вакуумной камерой для получения осаждения ионов титана на трубчатом корпусе. После этого на следующем этапе производится осаждение нитрида титана, когда газообразный азот вводится в вакуумную камеру для получения нитрида титана. Важно отметить, что покрытие стента, выполненное из нитрида титана, обладает меньшей смачиваемостью по отношению к протеинам по сравнению со стальной поверхностью стентов распространенной технологии. Данное покрытие предотвращает выделение токсичных ионов со своей поверхности и из находящейся под ним стали. При помощи вышеописанного способа можно получать покрытия, выполненные из титановых сплавов, с толщинами умеренно малой толщины (около 1,5 мкм) и с очень тонкой гладкой структурой,обеспечивающей высокое сопротивление к механическим нагрузкам, создаваемым при имплантации стента, без изменения эластичности самого стента. На последнем этапе изготовления покрытия на стент наносится тонкий биологически совместимый инертный слой на основе нитрида титана, который включает в себя следующие элементы: первый слой (210) керамического покрытия, выполненного из нитрида титана, который находится в контакте и связан с внешней поверхностью стента;-3 013514 второй слой на основе титана, связываемый непосредственно с первым слоем (210) керамического покрытия, выполненного из нитрида титана, второй слой выполнен, по меньшей мере, частично из второго слоя керамического покрытия из нитрида титана. Первый слой (210) керамического покрытия из нитрида титана является компактным в отличие от непосредственно связываемого с ним второго слоя, который полностью образован нитридом титана и обладает заданной пористостью и столбчатой структурой. Тонкий слой на основе инертного биологически совместимого нитрида титана, покрывающий весь стент, имеет толщину около 1-2 мкм. И, наконец, особый вид кристаллической структуры осажденного нитрида титана обеспечивает размещение лекарственных препаратов на данном покрытии, их введение в организм в заданное время и позволяет использовать тонкий мономолекулярный полимерный активационный слой (например, полимерную мицеллу в качестве липосом). Другим вариантом является помещение на поверхность стента эндотелиального клеточного слоя для содействия более быстрой эндотелиализации кровеносного сосуда и снижения вероятности острого и подострого тромбоза после имплантации и, таким образом снижения риска возникновения рестеноза. В качестве необязательного этапа процедура, являющаяся объектом данного изобретения, включает в себя предварительный этап полировки, целью которого является удаление с трубчатого корпуса, на который будет наноситься покрытие, всех типов поверхностного загрязнения и/или дефектов, возникших при лазерной резке, таких как отходы материала, образовавшиеся после термического взрыва. В дополнение к вышесказанному, этап предварительной полировки может выполняться при помощи алюминиевого порошка (Al 203), а в случае если такая обработка не достаточна, можно провести химическую обработку способами и устройствами, использующимися в трехмерной литографии. Кроме того, этап предварительной полировки может также представлять собой химическое, песчаное, электролитическое и/или электрохимическое полирование. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ изготовления эндоваскулярного устройства с покрытием, который включает в себя подготовку в основном цилиндрического трубчатого корпуса (2), выполненного из инертного биологически совместимого металла или металлического сплава, выбираемого из группы, состоящей из нержавеющей стали, сплава кобальт-хром CoCr, титана Ti или его сплава, сплава хрома Cr; покрытие поверхности трубчатого корпуса по меньшей мере одним тонким инертным биологически совместимым слоем (s), причем покрытие изготавливается в соответствии со следующими последовательными этапами:I. Осаждение первого титанового (Ti) слоя (21);II. Первая обработка азотом (N) первого титанового (Ti) слоя (21) путем распространения высоких ионных токов по подложке в процессе ионного осаждения при помощи несимметричного магнетронного распылителя с замкнутым полем для преобразования по меньшей мере части первого титанового слоя(21) в первый слой (210) керамического покрытия из нитрида титана (TiN);III. Осаждение на первый слой керамического покрытия (210) из нитрида титана (TiN) второго титанового (Ti) слоя (22);VI. Вторая обработка азотом (N) второго титанового (Ti) слоя (22) путем распространения высоких ионных токов по подложке в процессе ионного осаждения при помощи несимметричного магнетронного распылителя с замкнутым полем для преобразования по меньшей мере части второго титанового слоя(22) в первый слой (220) керамического покрытия из нитрида титана (TiN). 2. Способ по п.1, в котором целью первой операции обработки азотом (N) первого титанового (Ti) слоя (21) является преобразование по меньшей мере части указанного титанового слоя (21) в компактное керамическое покрытие (210) из нитрида титана. 3. Способ по п.1 или 2, в котором целью второй операции обработки азотом второго титанового слоя (22), выполняемой путем распространения высоких ионных токов по подложке (ионное осаждение при помощи несимметричного магнетронного распылителя с замкнутым полем), является преобразование всего второго титанового слоя (22) во второй пористый керамический слой (220) из нитрида титана. 4. Способ по п.1 или 2, в котором первый титановый (Ti) слой имеет толщину около 100 нм. 5. Способ по п.1, в котором тонкий инертный биологически совместимый слой (s) на основе нитрида титана, полностью покрывающий поверхность стента, имеет толщину около 1-2 мкм. 6. Способ по п.1, в котором, по меньшей мере, внешняя часть керамического покрытия из нитрида титана (TiN) имеет столбчатую структуру. 7. Способ по п.1, в котором, по меньшей мере, внешняя часть керамического покрытия из нитрида титана (TiN) обладает заданной пористостью. 8. Способ по п.1, в котором операции обработки азотом выполняются при помощи системы ионного осаждения, состоящей по меньшей мере из одного магнетрона. 9. Способ по п.1, отличающийся тем, что он дополнительно включает в себя последующий этап-4 013514 осаждения антирестенозного препарата на внешней пористой поверхности биологически совместимого слоя (s), покрывающего трубчатый корпус. 10. Способ по п.1 или 9, в котором эндоваскулярное устройство является имплантантом для брюшной и грудной аорты и/или подвздошных артерий. 11. Способ по п.1 или 9, в котором эндоваскулярное устройство является коронарным стентом. 12. Способ по п.1 или 9, в котором эндоваскулярное устройство является периферийным стентом. 13. Способ по п.1 или 9, в котором эндоваскулярное устройство является билиарным стентом. 14. Способ по п.1 или 9, в котором эндоваскулярное устройство является ренальным стентом. 15. Способ по п.1 или 9, в котором эндоваскулярное устройство является каротидным и церебральным стентом. 16. Способ по п.1, в котором в эндоваскулярном устройстве в основном цилиндрический корпус (2) выполнен из инертной и биологически совместимой стали 316L. 17. Способ по п.1, в котором в эндоваскулярном устройстве в основном цилиндрический корпус (2) выполнен из различных инертных и биологически совместимых металлических сплавов, в частности сплавов CoCr, таких как L605 (Со-20Cr-15W-10Ni), Co-28Cr-6Mo, Co-35Ni-20Cr-10Mo, Co-20Cr-16Fe15Ni-7Mo. 18. Способ по п.1, в котором в эндоваскулярном устройстве в основном цилиндрический корпус (2) выполнен из инертного и биологически совместимого титана Ti или его сплава, выбираемого из группы,состоящей из Ti-12Mo-6Zr-2Fe, Ti-15Mo, Ti-3Al-2,5V, Ti-35Nb-7Zr-5Ta, Ti-6Al-4Va, Ti-6Al-7Nb, Ti-13Nb13Zr. 19. Способ по п.1, в котором в эндоваскулярном устройстве в основном цилиндрический корпус (2) выполнен из никель-титанового сплава (нитинола), обладающего свойством запоминания формы. 20. Способ по п.1, в котором в эндоваскулярном устройстве в основном цилиндрический корпус (2) выполнен из инертного и биологически совместимого сплава хрома Cr, выбираемого из группы, состоящей из Cr-14Ni-2,5Mo, Cr-13Ni-5Mn-2,5Mo, Cr-10Ni-3Mn-2,5Mo. 21. Способ по п.1, который дополнительно включает в себя этап предварительной полировки, целью которого является удаление с трубчатого корпуса, на который будет наноситься покрытие, всех поверхностных загрязнений и дефектов, возникших при лазерной резке, таких как отходы материала, образовавшиеся после термического взрыва. 22. Способ по п.21, в котором этап предварительной полировки выполняется при помощи алюминиевого порошка (Al 203), а в случае если такая обработка не достаточна, может быть проведена химическая обработка способами и устройствами, использующимися в трехмерной литографии. 23. Способ по п.21, в котором этап предварительной полировки может представлять собой химическое, песчаное, электролитическое и/или электрохимическое полирование. 24. Способ по п.1, в котором операции обработки выполняются при помощи по меньшей мере одного магнетрона и которые включают в себя следующие этапы: помещение трубчатого корпуса (2) в вакуумную камеру; помещение по меньшей мере одного титанового элемента в вакуумную камеру; введение инертного газа в вакуумную камеру; бомбардировку электронами, вырабатываемыми по меньшей мере одним магнетроном, атомов инертного газа для получения ионов инертного газа; бомбардировку ионами инертного газа указанного титанового элемента для получения ионов титана; создание разницы потенциалов между трубчатым корпусом (2) и вакуумной камерой для получения осаждения ионов титана на трубчатом корпусе. 25. Способ по п.24, в котором операция дополнительно включает в себя этап введения газообразного водорода в вакуумную камеру для получения нитрида титана. 26. Эндоваскулярное устройство с покрытием, включающее в себя трубчатый в основном цилиндрический корпус (2), выполненный из инертного и биологически совместимого металла или металлического сплава, выбираемого из группы, состоящей из нержавеющей стали, сплава кобальт-хром CoCr, титана Ti или его сплава, сплава хрома Cr, на внешнюю поверхность в основном цилиндрического корпуса которого нанесен по меньшей мере один тонкий биологически совместимый инертный слой (s) на основе титана, состоящий из первого керамического слоя, выполненного из слоя (21) на основе титана, находившегося в контакте и связаного с внешней поверхностью устройства, включающий нитрид титана (TiN), полученный путем первой обработки азотом (N) части первого титанового слоя (21) распространением высоких ионных токов по подложке в процессе ионного осаждения при помощи несимметричного магнетронного распылителя с замкнутым полем; второго слоя на основе титана, имеющего столбчатую структуру и являющегося пористым, связанного непосредственно с первым керамическим слоем из нитрида титана (210), при этом второй слой,по меньшей мере, частично выполнен из второго керамического слоя (220) из нитрида титана, полученного второй обработкой азотом (N) второго титанового (Ti) слоя (22) путем распространения высоких ионных-5 013514 токов по подложке в процессе ионного осаждения при помощи несимметричного магнетронного распылителя с замкнутым полем. 27. Эндоваскулярное устройство с покрытием по п.26, в котором второй слой на основе титана, связываемый непосредственно с указанным первым керамическим слоем (210) из нитрида титана полностью образован из нитрида титана. 28. Эндоваскулярное устройство с покрытием по п.26, в котором толщина первого титанового (Ti) слоя (21) составляла 100 нм. 29. Эндоваскулярное устройство с покрытием по п.26, в котором тонкий инертный биологически совместимый слой (s) покрытия на основе нитрида титана имеет толщину около 1-2 мкм. 30. Эндоваскулярное устройство с покрытием по п.26, в котором в основном цилиндрический корпус (2) выполнен из биологически совместимой стали 316L. 31. Эндоваскулярное устройство с покрытием по п.26, в котором в основном цилиндрический корпус (2) выполнен из инертного и биологически совместимого сплава кобальта с хромом CoCr, выбираемого из группы, состоящей из L605 (Co-20Cr-15W-10Ni), Co-28Cr-6Mo, Co-35Ni-20Cr-10Mo, Co-20Cr16Fe-15Ni-7Mo. 32. Эндоваскулярное устройство с покрытием по п.26, в котором в основном цилиндрический корпус (2) выполнен из инертного и биологически совместимого титана Ti или его сплава, выбираемого из группы, состоящей из Ti-12Mo-6Zr-2Fe, Ti-15Mo, Ti-3Al-2,5V, Ti-35Nb-7Zr-5Ta, Ti-6Al-4Va, Ti-6Al-7Nb,Ti-13Nb-13Zr. 33. Эндоваскулярное устройство с покрытием по п.26, в котором в основном цилиндрический корпус (2) выполнен из инертного и биологически совместимого никель-титанового сплава (нитинола), обладающего свойством запоминания формы. 34. Эндоваскулярное устройство с покрытием по п.26, в котором в основном цилиндрический корпус (2) выполнен из инертного и биологически совместимого сплава хрома Cr, выбираемого из группы,состоящей из Cr-14Ni-2,5Mo, Cr-13Ni-5Mn-2,5Mo, Cr-10Ni-3Mn-2,5Mo. 35. Эндоваскулярное устройство с покрытием по п.26, дополнительно включающее в себя антиренозный препарат, осажденный на внешней пористой поверхности указанного биологически совместимого слоя (s), который покрывает трубчатый корпус. 36. Эндоваскулярное устройство с покрытием по п.26 или 35, которое является имплантантом для брюшной или грудной аорты и/или подвздошных артерий. 37. Эндоваскулярное устройство с покрытием по п.26 или 35, которое является коронарным стентом. 38. Эндоваскулярное устройство с покрытием по п.26 или 35, которое является периферийным стентом. 39. Эндоваскулярное устройство с покрытием по п.26 или 35, которое является билинарным стентом. 40. Эндоваскулярное устройство с покрытием по п.26 или 35, которое является ренальным стентом. 41. Эндоваскулярное устройство с покрытием по п.26 или 35, которое является каротидным или церебральным стентом.
МПК / Метки
МПК: A61L 31/08
Метки: устройства, покрытием, эндоваскулярного, изготовления, способ
Код ссылки
<a href="https://eas.patents.su/8-13514-sposob-izgotovleniya-endovaskulyarnogo-ustrojjstva-s-pokrytiem.html" rel="bookmark" title="База патентов Евразийского Союза">Способ изготовления эндоваскулярного устройства с покрытием</a>
Предыдущий патент: Способ получения сырых продуктов с подземной термической переработкой in situ
Следующий патент: Контейнер с шарнирной крышкой, имеющий дополнительные интегральные панели
Случайный патент: Погружаемый аппарат и способ его погружения