Медицинское устройство с покрытием для предупреждения рестеноза (варианты) и способ нанесения гемосовместимого покрытия на поверхность медицинского устройства
Номер патента: 9092
Опубликовано: 26.10.2007
Авторы: Фауст Волкер, Хоррес Роланд, Хофман Михель, Линсен Марита Катарина, Хофман Эрика, Ди Биаз Донато
Формула / Реферат
1. Медицинское устройство, контактирующее с кровью, отличающееся тем, что по меньшей мере часть его поверхности покрыта, непосредственно или через посредство по меньшей мере одного промежуточного биостабильного и/или биодеградируемого слоя, гемосовместимым слоем, содержащим по меньшей мере одно соединение формулы 1
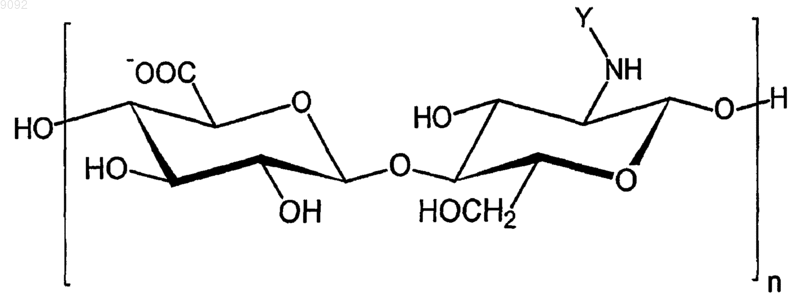
в которой
n представляет собой целое число от 4 до 1050;
Y представляет собой остаток, выбранный из -СНО, -СОСН3, -COC2H5, -СОС3Н7, -СOС4H9, -COC5H11, -СОСН(СН3)2, -СОСН2СН(СН3)2, -СОСН(СН3)С2Н5, -СОС(СН3)3, -СН2СОО-, -C2H4COO-, -C3H6COO-,
-C4H8COO-, а также солей данных соединений,
при этом на, в и/или под гемосовместимым слоем присутствует активный агент паклитаксел.
2. Устройство по п.1, отличающееся тем, что Y представляет собой остаток, выбранный из -СНО,
-СОСН3, -COC2H5, -СОС3Н7, а также солей данных соединений.
3. Устройство по п.2, отличающееся тем, что Y обозначает -СОСН3.
4. Устройство по любому из пп.1-3, отличающееся тем, что гемосовместимый слой расположен непосредственно на его поверхности, причем на указанный гемосовместимый слой нанесен паклитаксел, а также смеси данных активных агентов.
5. Устройство по любому из пп.1-4, отличающееся тем, что под гемосовместимым слоем или между двумя гемосовместимыми слоями расположен по меньшей мере один биостабильный и/или биодеградируемый слой.
6. Устройство по любому из пп.1-5, отличающееся тем, что гемосовместимый слой полностью и/или не полностью покрыт по меньшей мере одним дополнительным биостабильным и/или биодеградируемым слоем.
7. Устройство по любому из пп.1-6, отличающееся тем, что по меньшей мере один слой активного агента паклитаксела расположен между биостабильным и гемосовместимым слоями.
8. Устройство по любому из пп.1-7, отличающееся тем, что паклитаксел ковалентно и/или адгезивно связан в и/или на гемосовместимом слое и/или биостабильном и/или биодеградируемом слое.
9. Устройство по любому из пп.1-8, отличающееся тем, что в качестве биодеградируемых субстанций для биодеградируемого слоя использованы поливалеролактоны, поли-e-декалактоны, полилактоновая кислота, полигликолевая кислота, полилактиды, полигликолиды, сополимеры полилактидов и полигликолидов, поли-e-капролактон, полигидроксибутановая кислота, полигидроксибутираты, полигидроксивалераты, полигидроксибутиратсовалераты, поли(1,4-диоксан-2,3-дионы), поли(1,3-диоксан-2-он), полипарадиоксаноны, полиангидриды, в частности полималеиновые ангидриды, полигидроксиметакрилаты, фибрин, полицианоакрилаты, поликапролактондиметилакрилаты, поли-b-малеиновая кислота, поликапролактонбутилакрилаты, мультиблокполимеры, в частности олигокапролактондиолы и олигодиоксанондиолы, мультиблокполимеры полиэфиров сложных эфиров, в частности ПЭГ и поли(бутилентерефталаты), полипивотолактоны, триметилкарбонаты полигликолевой кислоты, поликапролактонгликолиды, поли(g-этилглутамат), поли(DTH-иминокарбонат), поли(DTE-со-DT-карбонат), поли(бисфенол-А-иминокарбонат), полиортоэфиры, триметилкарбонаты полигликолевой кислоты, политриметилкарбонаты, полииминокарбонаты, поли(N-винил)пирролидон, поливиниловые спирты, полиэфирамиды, гликолированные полиэфиры, полифосфоэфиры, полифосфазены, поли[(р-карбоксифенокси)пропан], полигидроксипентановая кислота, полиангидриды, полиэтиленоксид-пропиленоксид, мягкие полиуретаны, полиуретаны с аминокислотными остатками в скелете, сложные эфиры полиэфиров, в частности полиэтиленоксид, полиалкеноксалаты, полиортоэфиры, а также их сополимеры, липиды, каррагенаны, фибриноген, крахмал, коллаген, полимеры на белковой основе, полиаминокислоты, синтетические полиаминокислоты, зеин, модифицированный зеин, полигидроксиалканоаты, пектиновая кислота, актиновая кислота, модифицированный и немодифицированный фибрин и казеин, карбоксиметилсульфат, альбумин и, кроме того, гиалуроновая кислота, хитозан и его производные, гепарансульфаты и их производные, гепарин, хондроитинсульфат, декстран, b-циклодекстрины, сополимеры с ПЭГ и полипропиленгликолем, гуммиарабик, гуаровая камедь, желатин, коллаген, коллаген-N-гидроксисукцинимид, липиды, фосфолипиды, модификации и сополимеры и/или смеси указанных субстанций.
10. Устройство по любому из пп.1-9, отличающееся тем, что в качестве биостабильных субстанций для биостабильного слоя использованы полиакриловая кислота и полиакрилаты, в частности полиметилметакрилат, полибутилметакрилат, полиакриламид, полиакрилнитрилы, полиамиды, полиэфирамиды, полиэтиленамин, полиимиды, поликарбонаты, поликарбоуретаны, поливинилкетоны, поливинилгалогениды, поливинилиденгалогениды, поливиниловые эфиры, полиизобутилены, поливинилароматические соединения, поливиниловые сложные эфиры, поливинилпирролидоны, полиоксиметилены, политетраметиленоксид, полиэтилен, полипропилен, политетрафторэтилен, полиуретаны, полиэфируретаны, силиконполиуретановые эфиры, силиконполиуретаны, силиконполикарбонатуретаны, полиолефиновые эластомеры, полиизобутилены, сополимеры EPDM, фторсиликоны, карбоксиметилхитозаны, полиарилэфирэфиркетоны, полиэфирэфиркетоны, полиэтилентерфталат, поливалераты, карбоксиметилцеллюлоза, целлюлоза, вискозное волокно, триацетатные волокна, целлюлозонитраты, целлюлозоацетаты, гидроксиэтилцеллюлоза, целлюлозобутираты, целлюлозоацетатбутираты, этилвинилацетатные сополимеры, полисульфоны, эпоксидные смолы, сополимеры ABS, сополимеры EPDM, силиконы, в частности полисилоксаны, полидиметилсилоксаны, поливинилгалогены и сополимеры, целлюлозные эфиры, целлюлозотриацетаты, хитозаны и сополимеры и/или смеси данных субстанций.
11. Медицинское устройство, контактирующее с кровью, отличающееся тем, что по меньшей мере часть его поверхности покрыта, непосредственно или через посредство по меньшей мере одного промежуточного биостабильного и/или биодеградируемого слоя, гемосовместимым слоем, содержащим по меньшей мере одно соединение формулы 1
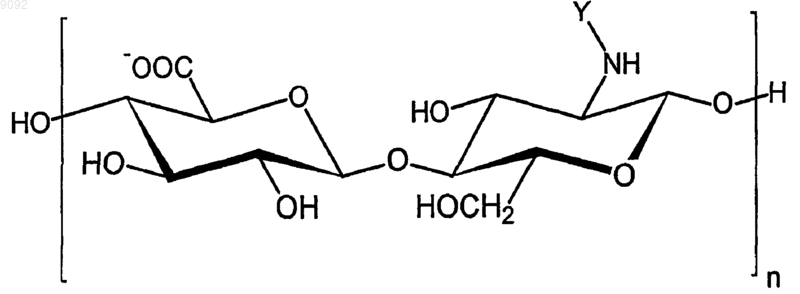
в которой
n представляет собой целое число от 4 до 1050;
Y представляет собой остаток, выбранный из -СНО, -СОСН3, -COC2H5, -СОС3H7, -СOС4Н9, -СОС5Н11, -СОСН(СН3)2, -СОСН2СН(СН3)2, -СОСН(СН3)С2Н5, -СОС(СН3)3, -СН2СОО-, -С2Н4СОО-, -С3Н6СОО-, -С4H8СОО-, а также солей данных соединений,
при этом на, в и/или под гемосовместимым слоем присутствует один из следующих активных агентов: симвастатин, 2-метилтиазолидин-2,4-дикарбоновая кислота и соответствующая натриевая соль, макроциклическая закись (MCS), производные MCS, активированный белок С (аРС), пентаэритритол тетранитрат (PETN), трапидил, b-эстрадиол, а также смеси данных активных агентов или смеси одного из данных активных агентов с паклитакселом.
12. Устройство по любому из пп.1-11, отличающееся тем, что оно выбрано из группы, включающей протезы, органы, сосуды, аорты, сердечные клапаны, трубки, запасные части для органов, имплантаты, волокна, полые волокна, стенты, полые иглы, шприцы, мембраны, консервированные продукты, контейнеры для крови, платы для титрования, электрокардиостимуляторы, поглощающие среды, хроматографические среды, хроматографические колонки, диализаторы, соединительные звенья, датчики, клапаны, камеры для центрифугирования, регенераторы, эндоскопы, фильтры, насосные камеры.
13. Устройсттю по п.12, отличающееся тем, что оно представляет собой стент.
14. Устройство по п.13, отличающееся тем, что оно содержит нанесенный полимер в количестве от 0,01 до 3 мг/слой, предпочтительно от 0,20 до 1 мг/слой и наиболее предпочтительно от 0,2 до 0,5 мг/слой.
15. Устройство по п.13 или 14, отличающееся тем, что активный агент присутствует в фармацевтически активной концентрации от 0,001 до 10 мг/см2 поверхности стента или на слой.
16. Применение медицинского устройства по п.12 в качестве средства, предназначенного для предупреждения или уменьшения рестеноза.
17. Применение медицинского устройства по п.12 в качестве средства, предназначенного для длительного высвобождения паклитаксела, симвастатина, натриевой соли 2-метилтиазолидин-2,4-дикарбоновой кислоты, макроциклической закиси (MCS), производных MCS, активированного белка С (аРС), пентаэритритола тетранитрата (PETN), трапидила и/или b-эстрадиола.
18. Способ нанесения гемосовместимого покрытия на биологическую и/или искусственную поверхность медицинского устройства, контактирующего с кровью, отличающийся тем, что на поверхность медицинского устройства наносят по меньшей мере одно соединение общей формулы 1 по п.1 в качестве гемосовместимого слоя или биостабильный и/или биодеградируемый слой, затем на гемосовместимый слой наносят биостабильный и/или биодеградируемый слой либо гемосовместимый слой наносят на биостабильный или на биодеградируемый слой.
19. Способ по п.18, отличающийся тем, что гемосовместимый слой или биостабильный и/или биодеградируемый слой покрывают посредством погружения или напыления по меньшей мере одним биодеградируемым и/или биостабильным слоем, который содержит ковалентно и/или адгезивно связанный паклитаксел.
20. Способ по п.18 или 19, отличающийся тем, что дополнительно вводят или наносят паклитаксел в и/или на гемосовместимый слой или биостабильный и/или биодеградируемый слой.
21. Способ по п.20, отличающийся тем, что паклитаксел вводят и/или наносят посредством погружения или напыления на и/или в гемосовместимый слой или биостабильный и/или биодеградируемый слой и/или связывают путем ковалентного и/или адгезивного связывания с гемосовместимым слоем или биостабильным и/или биодеградируемым слоем.
22. Способ по любому из пп.18-21, отличающийся тем, что наносят по меньшей мере один биодеградируемый слой и/или по меньшей мере один биостабильный и/или биодеградируемый слой на гемосовместимый слой или слой паклитаксела соответственно; или наносят по меньшей мере одно соединение общей формулы 1 по п.1 в качестве гемосовместимого слоя на биостабильный и/или биодеградируемый слой или слой паклитаксела.
23. Способ по одному из пп.18-22, отличающийся тем, что дополнительно вводят и/или наносят паклитаксел в и/или на по меньшей мере один биодеградируемый и/или биостабильный слой или гемосовместимый слой.
24. Способ по п.23, отличающийся тем, что паклитаксел наносят, и/или вводят посредством погружения или напыления на и/или в по меньшей мере один биодеградируемый и/или биостабильный слой или гемосовместимый слой, и/или связывают путем ковалентного и/или адгезивного связывания по меньшей мере с одним биодеградируемым и/или биостабильным слоем или гемосовместимым слоем.
25. Способ по любому из пп.18-24, отличающийся тем, что биостабильный и/или биодеградируемый слой ковалентно и/или адгезивно связывают на поверхности медицинского устройства, а гемосовместимый слой ковалентно связывают с биостабильным и/или биодеградируемым слоем и полностью или частично покрывают им биостабильный и/или биодеградируемый слой.
26. Способ по любому из пп.18-25, отличающийся тем, что гемосовместимый слой содержит гепарин нативного происхождения, региоселективно синтезированные производные с различными коэффициентами сульфатации и коэффициентами ацилирования в интервале молекулярных масс пентасахарида, который определяет антитромботическую активность, вплоть до стандартной молекулярной массы имеющегося в продаже гепарина молекулярной массы 13 кДа, гепарансульфат и его производные, олиго- и полисахариды эритроцитарного гликокаликса, десульфатированный и N-реацетилированный гепарин, N-карбоксиметилированный и/или частично N-ацетилированный хитозан, а также смеси данных субстанций.
27. Способ по любому из пп.18-26, отличающийся тем, что в качестве биодеградируемых субстанций для биодеградируемого слоя используют поливалеролактоны, поли-e-декалактоны, полилактоновую кислоту, полигликолевую кислоту, полилактиды, полигликолиды, сополимеры полилактидов и полигликолидов, поли-e-капролактон, полигидроксибутановую кислоту, полигидроксибутираты, полигидроксивалераты, полигидроксибутиратсовалераты, поли(1,4-диоксан-2,3-дионы), поли(1,3-диоксан-2-он), полипарадиоксаноны, полиангидриды, в частности полималеиновые ангидриды, полигидроксиметакрилаты, фибрин, полицианоакрилаты, поликапролактондиметилакрилаты, поли-b-малеиновую кислоту, поликапролактонбутилакрилаты, мультиблокполимеры, в частности олигокапролактондиолы и олигодиоксанондиолы, мультиблокполимеры полиэфиров сложных эфиров, в частности ПЭГ и поли(бутилентерефталаты), полипивотолактоны, триметилкарбонаты полигликолевой кислоты, поликапролактонгликолиды, поли(g-этилглутамат), поли(DTH-иминокарбонат), поли(DTE-со-DT-карбонат), поли(бисфенол-А-иминокарбонат), полиортоэфиры, триметилкарбонаты полигликолевой кислоты, политриметилкарбонаты, полииминокарбонаты, поли(N-винил)пирролидон, поливиниловые спирты, полиэфирамиды, гликолированные полиэфиры, полифосфоэфиры, полифосфазены, поли[(р-карбоксифенокси)пропан], полигидроксипентановую кислоту, полиангидриды, полиэтиленоксид-пропиленоксид, мягкие полиуретаны, полиуретаны с аминокислотными остатками в скелете, сложные эфиры полиэфиров, в частности полиэтиленоксид, полиалкеноксалаты, полиортоэфиры, а также их сополимеры, липиды, каррагенаны, фибриноген, крахмал, коллаген, полимеры на белковой основе, полиаминокислоты, синтетические полиаминокислоты, зеин, модифицированный зеин, полигидроксиалканоаты, пектиновую кислоту, актиновую кислоту, модифицированный и немодифицированный фибрин и казеин, карбоксиметилсульфат, альбумин и, кроме того, гиалуроновую кислоту, хитозан и его производные, гепарансульфаты и их производные, гепарин, хондроитинсульфат, декстран, b-циклодекстрины, сополимеры с ПЭГ и полипропиленгликолем, гуммиарабик, гуаровую камедь, желатин, коллаген, коллаген-N-гидроксисукцинимид, липиды, фосфолипиды, модификации и сополимеры и/или смеси указанных субстанций.
28. Способ по любому из пп.18-27, отличающийся тем, что в качестве биостабильных субстанций для биостабильного слоя используют полиакриловую кислоту и полиакрилаты, в частности полиметилметакрилат, полибутилметакрилат, полиакриламид, полиакрилнитрилы, полиамиды, полиэфирамиды, полиэтиленамин, полиимиды, поликарбонаты, поликарбоуретаны, поливинилкетоны, поливинилгалогениды, поливинилиденгалогениды, поливиниловые эфиры, полиизобутилены, поливинилароматические соединения, поливиниловые сложные эфиры, поливинилпирролидоны, полиоксиметилены, политетраметиленоксид, полиэтилен, полипропилен, политетрафторэтилен, полиуретаны, полиэфируретаны, силиконполиуретановые эфиры, силиконполиуретаны, силиконполикарбонатуретаны, полиолефиновые эластомеры, полиизобутилены, сополимеры EPDM, фторсиликоны, карбоксиметилхитозаны, полиарилэфирэфиркетоны, полиэфирэфиркетоны, полиэтилентерфталат, поливалераты, карбоксиметилцеллюлозу, целлюлозу, вискозное волокно, триацетатные волокна, целлюлозонитраты, целлюлозоацетаты, гидроксиэтилцеллюлозу, целлюлозобутираты, целлюлозоацетатбутираты, этилвинилацетатные сополимеры, полисульфоны, эпоксидные смолы, сополимеры ABS, сополимеры EPDM, силиконы, в частности полисилоксаны, полидиметилсилоксаны, поливинилгалогены и сополимеры, целлюлозные эфиры, целлюлозотриацетаты, хитозаны и сополимеры и/или смеси данных субстанций.
29. Способ по любому из пп.18-28, отличающийся тем, что нанесение полисахаридов формулы 1 по п.1 осуществляют посредством гидрофобных взаимодействшщ, вандерваальсовых сил, электростатических взаимодействий, водородных связей, ионных взаимодействий, перекрестных сшивок полисахаридов и/или путем ковалентного связывания.
30. Способ по любому из пп.18-29, отличающийся тем, что дополнительно вводят или наносят в и/или на гемосовместимый слой или биостабильный и/или биодеградируемый слой один из следующих активных агентов: симвастатин, натриевую соль 2-метилтиазолидин-2,4-дикарбоновой кислоты, макроциклическую закись (MCS), производные MCS, активированный белок С (аРС), пентаэритритола тетранитрат (PETN), трапидил, b-эстрадиол, а также смеси данных активных агентов или смеси одного из данных активных агентов с паклитакселом.
31. Медицинское устройство, контактирующее с кровью, отличающееся тем, что оно получено посредством одного из способов по любому из пп.18-30.
Текст
009092 Область техники, к которой относится изобретение Изобретение относится к использованию полисахаридов, содержащих сахарный составляющий блок N-ацилглюкозамин, для получения гемосовместимых поверхностей медицинских устройств, способам нанесения на поверхности гемосовместимого покрытия, содержащего данные полисахариды, а также к медицинским устройствам с данными гемосовместимыми поверхностями. Предшествующий уровень техники В организме человека кровь контактирует с поверхностями, отличными от внутренних поверхностей природных кровеносных сосудов только в случае повреждений. Поэтому система свертывания крови всегда активируется для уменьшения кровотечения и предотвращения угрожающей для жизни потери крови, если кровь начинает контактировать с чужеродными поверхностями. Вследствие того, что имплантат также представляет собой чужеродную поверхность, всех пациентов, которым вживляют имплантат, находящийся в постоянном контакте с кровью, лечат на протяжении данного контакта лекарственными препаратами, так называемыми антикоагулянтами, которые подавляют свертывание крови, поэтому следует принимать во внимание значительные побочные эффекты. Несмотря на применение устройств, поддерживающих сосуды, так называемых стентов, в кровеносных сосудах существует также описанный риск тромбоза как один из факторов риска. В случаях сужения или закупорки сосудов, например, вследствие артериосклеротических изменений, в особенности в коронарных артериях, используют стент для расширения стенок сосудов. Он фиксирует известковые фрагменты в сосудах и улучшает характеристики кровотока в сосуде, поскольку сглаживает поверхность просвета сосуда. Кроме того, стент приводит к возникновению устойчивости к силам восстановления эластичности расширенной части сосуда. Используемый материал, в основном, представлен медицинской нержавеющей сталью. Тромбоз стента происходит менее чем в 1% случаев уже в лаборатории кардиокатетеров как ранний тромбоз или в 2-5% случаев во время восстановительного периода в больнице. Приблизительно в 5% случаев повреждения сосудов вследствие вмешательства обусловлены блокированием артерии, и, кроме того, существует возможность образования псевдоаневризм при расширении сосудов. В дополнение к этому, постоянное применение гепарина как антикоагулянта повышает риск кровотечения. Дополнительным и очень часто встречающимся осложнением является рестеноз, повторное закупоривание сосуда. Хотя стенты снижают до минимума риск возобновления закупорки сосуда, они до настоящего времени не были способны полностью препятствовать развитию рестеноза. Уровень возобновления закупорки (рестеноза) после имплантации стента доходит до 30% и является одной из основных причин повторного обращения пациентов в больницу. В профессиональной литературе отсутствует точное концептуальное описание рестеноза. Обычно используемое морфологическое определение рестеноза состоит в том, что после успешно проведенной ЧТА (чрескожной транслюминальной ангиопластики) рестенозом считают уменьшение диаметра сосуда до меньше чем 50% от нормы. Это эмпирически установленное значение, в котором гемодинамическая обоснованность и ее соответствие клинической симптоматике не имеют серьезного научного обоснования. На практике, ухудшение клинического состояния больного часто рассматривают как признак рестеноза ранее подвергнутого лечению участка сосуда. Повреждения сосудов, возникающие во время имплантации стентов, вызывают воспалительные реакции, которые играют важную роль в процессе лечения в течение первых 7 суток. Указанные одновременно происходящие процессы входят в число других процессов, связанных с высвобождением факторов роста, которые инициируют повышение уровня пролиферации клеток гладкой мускулатуры и приводят при этом к быстрому развитию рестеноза, возобновлению закупорки сосуда вследствие неконтролируемого роста. Даже через 2 недели, когда стент врастает в ткань кровеносного сосуда и становится полностью окруженным клетками гладкой мускулатуры, рубцы могут быть очень выделяющимися (гиперплазия неоинтимы) и приводить не только покрытию поверхности стента, но и к закупорке всего внутреннего пространства стента. Были предприняты безрезультатные попытки решить проблему рестеноза путем покрытия стентов гепарином (см. статью J. Whrle и соавт., European Heart Journal, 22, 1808-1816, (2001. Гепарин как антикоагулянт направлен только на первую упомянутую причину и, более того, способен к проявлению своего основного эффекта только в растворе. Между тем, данную первую проблему практически полностью можно преодолеть посредством медикаментозного лечения с использованием антикоагулянтов. В настоящее время решение следующей проблемы предусматривается посредством локального ингибирования роста клеток гладкой мускулатуры на стенте. Это решение осуществляют, например, при использовании радиоактивных стентов или стентов, которые содержат фармацевтически активные агенты. Следовательно, существует потребность в нетромбогенных гемосовместимых материалах, которые не распознаются как чужеродная поверхность и, в случае контакта с кровью, не активируют систему свертывания крови и не приводят к свертыванию крови. При этом устраняется важный фактор процесса стимуляции рестеноза. Предполагают, что поддержка обеспечивается добавлением активных агентов,которые будут подавлять воспалительные реакции или будут контролировать деление клеток, сопровождающее процесс заживления.-1 009092 В данной области предпринято огромное количество попыток изготовления стента, который может уменьшить рестеноз таким путем или полностью устранить его. В множестве исследований изучены в данном контексте различные возможности осуществления. Наиболее распространенный тип конструкции состоит из стента, который покрыт подходящей матрицей, обычно биостабильным полимером. Матрица включает антипролиферативный или противовоспалительный агент, который высвобождается на контролируемых во времени стадиях и будет подавлять воспалительные реакции и избыточное деление клеток. В патенте US-A-5891108 раскрывают, например, полый литой стент, содержащий внутри фармацевтически активные агенты, которые могут выходить через различное число выходных отверстий в стенте. При этом в заявке ЕР-А-1127582 описан стент, на поверхности которого находятся желобки глубиной 0,1-1 мм и длиной 7-15 мм, пригодные для введения активного агента. Данные резервуары для активного агента выделяют, подобно отверстиям в полом стенте, содержащийся в них фармацевтически активный агент в точной высокой концентрации и в течение относительно длительного периода времени, приводя к тому, что клетки гладкой мускулатуры больше не могут или только с большой задержкой способны закрыть стент. Вследствие этого стент гораздо дольше остается открытым для крови, что снова приводит к повышенному уровню закупорки сосудов в результате тромбоза (см. статью Liistro F., Colombo А.,Поздний острый тромбоз после имплантации стента, выделяющего паклитаксел (Late acute thrombosisafter paclitaxel eluting stent implantation), Heart, 86, 262-4, (2001. Один из подходов к данной проблеме представляет собой фосфорилхолиновое покрытие биосовместимых материалов (WO 0101957), поскольку в данном случае фосфорилхолин, компонент мембраны клеток эритроцитарной линии, будет образовывать нетромбогенную поверхность в качестве ингредиента небиодеградирумого полимерного слоя, покрывающего стент. В зависимости от молекулярной массы активный агент абсорбируется полимерсодержащим фосфорилхолиновым слоем или адсорбируется на поверхности. Задачей данного изобретения является получение медицинских устройств с гемосовместимым покрытием, а также разработка способов нанесения гемосовместимого покрытия и применение медицинских устройств с гемосовместимым покрытием, в особенности стентов, для предупреждения или уменьшения нежелательных реакций, таких как, например, рестеноз. Основной задачей данного изобретения является получение стентов, обеспечивающих непрерывное контролируемое врастание стента, которое осуществляется, с одной стороны, подавлением клеточных реакций в первые дни и недели после имплантации посредством поддержания уровня выбранных агентов и комбинаций агентов и, с другой стороны, путем создания атромбогенной, соответственно, инертной,соответственно, биосовместимой поверхности, обеспечивающей то, что со снижением воздействия агента не будут возникать никакие реакции на существующую чужеродную поверхность, которые также могут привести к осложнениям через длительный срок. Сделано огромное количество попыток создать близкую к совершенству имитацию нативных атромбогенных условий части кровеносного сосуда, расположенной со стороны кровотока. В ЕР-В 0333730 раскрыт способ получения гемосовместимых субстратов путем помещения в углубление, адгезии и/или модификации и прикрепления нетромбогенного поверхностного полисахарида эндотелиальной клетки (HS I). Иммобилизация данного специфического поверхностного протеогепарансульфата HS I эндотелиальной клетки на биологических или искусственных поверхностях приводит к тому, что подобные покрытые поверхности становятся совместимыми с кровью и пригодными к постоянному контакту с кровью. В данном случае недостаток состоит в том, что получение HS I предполагает культивирование эндотелиальных клеток, поэтому экономическая применимость данного процесса сильно ограничена,поскольку культивирование эндотелиальных клеток требует большого количества времени и получение больших количеств культивируемых эндотелиальных клеток сопряжено с очень большими затратами. Сущность изобретения В данном изобретении вышеуказанная задача решена путем создания медицинских устройств, характеризующихся покрытием поверхности определенными полисахаридами и паклитакселом. Вместо или вместе с означенным паклитакселом могут быть использованы другие противовоспалительные агенты, а также противовоспалительные лекарственные препараты, соответственно, комбинации агентов,таких как симвастатин (2-метилтиазолидин-2,4-дикарбоновая кислота и соответствующая натриевая соль), макроциклическая закись (MCS) и ее производные, тирфостины, D24851, тимозин а-1, ингибиторы интерлейкина-1, активированный белок С (аРС), MSH (меланотропин), фумаровая кислота, сложный эфир фумаровой кислоты, PETN (пентаэритритол тетранитрат), PI88, дермицидин, баккатин и его производные, доцетаксел и другие производные паклитаксела, такролимус, пимекролимус, трапидил, - и эстрадиол, сиролимус, колхицин и меланоцитстимулирующий гормон (-MSH). Способы получения данных гемосовместимых поверхностей приведены в пп. формулы 20-31. Предпочтительные варианты осуществления можно найти в зависимых пунктах формулы, примерах, а также на фигурах.-2 009092 Объектом данного изобретения являются медицинские устройства, поверхность которых, по меньшей мере частично, покрыта гемосовместимым слоем, где гемосовместимый слой содержит по меньшей мере одно соединение формулы 1 Формула 1n обозначает целое число между 4 и 1050 иY обозначает остатки -СНО, -СОСН 3, -COC2H5, -СОС 3 Н 7, -СOC4 Н 9, -COC5H11, -СОСН(СН 3)2,-СОСН 2 СH(СН 3)2, -СОСН(СН 3)С 2 Н 5, -СОС(СН 3)3, -СН 2 СОО-, -C2H4COO-, -С 3 Н 6 СОО-, -C4 Н 8 СОO-. Можно также использовать соли соединений формулы 1. Гемосовместимый слой может быть нанесен непосредственно на поверхность предпочтительно негемосовместимого медицинского устройства или расположен на других биостабильных и/или биодеградируемых слоях. Кроме того, дополнительные биостабильные и/или биодеградируемые гемосовместимые слои могут находиться на гемосовместимом слое. В дополнение к этому, активный агент паклитаксел присутствует на, в и/или под гемосовместимым слоем или гемосовместимыми слоями, соответственно. Активный агент (паклитаксел) может в данном случае образовывать свой собственный слой активного агента на или под гемосовместимым слоем и/или может быть введен по меньшей мере в один из биостабильных биодеградируемых и/или гемосовместимых слоев. Предпочтительно, когда используют соединения общей формулы 1, в которых Y обозначает одну из следующих групп: -СНО, -СОСН 3, -СOC2 Н 5 или -СОС 3H7. Кроме того, предпочтительными являются группы -СНО, -СОСН 3, -COC2H5 и особенно предпочтительной - группа -СОСН 3. Соединения общей формулы 1 содержат только небольшое количество свободных аминогрупп. Вследствие того, что при реакции с нингидрином свободные аминогруппы более не определяются по причине чувствительности данного теста, можно предположить, что в виде свободных аминогрупп присутствует меньше 2%, предпочтительно меньше 1% и особенно предпочтительно меньше 0,5% всех групп -NH-Y, т.е. в низком проценте групп -NH-Y Y представляет собой водород. Поскольку полисахариды общей формулы 1 содержат карбоксилатные группы и аминогруппы, общая формула покрывает соли щелочных и щелочно-земельных металлов соответствующих полисахаридов. Можно упомянуть такие соли щелочных металлов, как соль натрия, соль калия, соль лития, или такие соли щелочно-земельных металлов, как соль магния или соль кальция. Кроме того, могут быть образованы соли аммиака, первичных, вторичных, третичных и четвертичных аминов, пиридина и пиридиновых производных, аммония, предпочтительно соли алкиламмония. К основаниям, которые образуют соли с полисахаридами, относятся неорганические и органические основания, например NaOH, KОН,LiOH, СаСО 3, Fе(ОН)3, NH4OH, гидроксид тетраалкиламмония и подобные соединения. Полисахариды, соответствующие формуле 1, имеют молекулярные массы от 2 до 15 кДа, предпочтительно от 4 до 13 кДа, более предпочтительно от 6 до 12 кДа и особенно предпочтительно от 8 до 11 кДа. Переменная величина n представляет собой целое число в интервале 4-1050. Предпочтительно n представляет собой целое число от 9 до 400, более предпочтительно - целое число от 14 до 260 и особенно предпочтительно - целое число между 19 и 210. Общая формула 1 представляет дисахарид, который следует рассматривать как базовый модуль для используемых полисахаридов и который образует полисахарид при n-кратном (множественном) чередовании базового модуля. Данный базовый модуль, который состоит из 2 молекул сахаров, не следует рассматривать таким образом, что общая формула 1 включает только полисахариды с четным числом молекул сахаров. Формула, несомненно, включает также полисахариды с нечетным числом составляющих сахарных звеньев. Концевые группы полисахаридов представлены гидроксильными группами. Особенно предпочтительными являются медицинские устройства, которые непосредственно на поверхности данного медицинского устройства имеют гемосовместимый слой, состоящий из соединений,которые соответствуют формуле 1, и над ним слой паклитаксела. Слой паклитаксела может частично диффундировать в гемосовместимый слой или полностью захватываться гемосовместимым слоем. Кроме того, предпочтительно, когда под гемосовместимым слоем имеется по меньшей мере один биостабильный слой. В дополнение, гемосовместимый слой может быть полностью и/или частично покрыт по меньшей мере еще одним вышележащим биостабильным и/или биодеградируемым слоем. Предпочтительным является наружный биодеградируемый или гемосовместимый слой. Следующий предпочтительный вариант осуществления содержит слой паклитаксела под гемосовместимым слоем или между биостабильным и гемосовместимым слоями, так что паклитаксел медленно выходит через гемосовместимый слой. Паклитаксел может быть ковалентно и/или адгезивно связан в-3 009092 и/или на гемосовместимом слое и/или биостабильном и/или биодеградируемом слое, где адгезивное связывание является предпочтительным. В качестве биодеградируемых субстанций для биодеградируемого слоя(ев) могут быть использованы поливалеролактоны, полидекалактоны, полилактоновая кислота, полигликолевая кислота, полилактиды,полигликолиды, сополимеры полилактидов и полигликолидов, поликапролактон, полигидроксибутановая кислота, полигидроксибутираты, полигидроксивалераты, полигидроксибутират-совалераты, поли(1,4-диоксан-2,3-дионы), поли(1,3-диоксан-2-он), полипарадиоксаноны, полиангидриды, такие как полималеиновые ангидриды, полигидроксиметакрилаты, фибрин, полицианоакрилаты, поликапролактондиметилакрилаты, поли-b-малеиновая кислота, поликапролактонбутилакрилаты, мультиблокполимеры,такие как, например, из олигокапролактондиолов и олигодиоксанондиолов, мультиблокполимеры полиэфиров сложных эфиров, такие как, например, ПЭГ(полиэтиленгликоль) и поли(бутилентерефталаты),полипивотолактоны, триметилкарбонаты полигликолевой кислоты, поликапролактонгликолиды, поли(gэтилглутамат), поли(DТН-иминокарбонат), поли(DТЕ-со-DТ-карбонат), поли(бисфенол-А-иминокарбонат), полиортоэфиры, триметилкарбонаты полигликолевой кислоты, политриметилкарбонаты, полииминокарбонаты, поли(N-винил)пирролидон, поливиниловые спирты, полиэфирамиды, гликолированные полиэфиры, полифосфоэфиры, полифосфазены, поли[(р-карбоксифенокси)пропан], полигидроксипентановая кислота, полиангидриды, полиэтиленоксидпропиленоксид, мягкие полиуретаны, полиуретаны с аминокислотными остатками в скелете, сложные эфиры полиэфиров, такие как полиэтиленоксид, полиалкеноксалаты, полиортоэфиры, а также их сополимеры, липиды, каррагенаны, фибриноген, крахмал,коллаген, полимеры на белковой основе, полиаминокислоты, синтетические полиаминокислоты, зеин,модифицированный зеин, полигидроксиалканоаты, пектиновая кислота, актиновая кислота, модифицированный и немодифицированный фибрин и казеин, карбоксиметилсульфат, альбумин и, кроме того,гиалуроновая кислота, хитозан и его производные, гепарансульфаты и их производные, гепарины, хондроитинсульфат, декстран, b-циклодекстрины, сополимеры с ПЭГ и полипропиленгликолем, гуммиарабик, гуаровая камедь, желатин, коллаген, коллаген-N-гидроксисукцинимид, липиды, фосфолипиды, модификации и сополимеры и/или смеси вышеуказанных субстанций. В качестве биостабильных субстанций для биостабильного слоя(ев) могут быть использованы: полиакриловая кислота и полиакрилаты, такие как полиметилметакрилат, полибутилметакрилат, полиакриламид,полиакрилнитрилы, полиамиды, полиэфирамиды, полиэтиленамин, полиимиды, поликарбонаты, поликарбоуретаны, поливинилкетоны, поливинилгалогениды, поливинилиденгалогениды, поливиниловые эфиры, полиизобутилены, поливинилароматические соединения, поливиниловые сложные эфиры, поливинилпирролидоны, полиоксиметилены, политетраметиленоксид, полиэтилен, полипропилен, политетрафторэтилен, полиуретаны, полиэфируретаны, силиконполиуретановые эфиры, силиконполиуретаны, силиконполикарбонатуретаны, полиолефиновые эластомеры, полиизобутилены, сополимеры EPDM (этилена, пропилена и диенового мономера), фторсиликоны, карбоксиметилхитозаны, полиарилэфирэфиркетоны, полиэфирэфиркетоны, полиэтилентерфталат, поливалераты, карбоксиметилцеллюлоза, целлюлоза,вискозное волокно, триацетатные волокна, целлюлозонитраты, целлюлозоацетаты, гидроксиэтилцеллюлоза, целлюлозобутираты, целлюлозоацетатбутираты, этилвинилацетатные сополимеры, полисульфоны,эпоксидные смолы, сополимеры ABS (акрилонитрила, бутадиена и стирола), сополимеры EPDM, силиконы, такие как полисилоксаны, полидиметилсилоксаны, поливинилгалогены и сополимеры, целлюлозные эфиры, целлюлозотриацетаты, хитозаны и сополимеры и/или смеси данных субстанций. Возможно оснащение любых медицинских устройств описанными в данном контексте гемосовместимыми поверхностями, в особенности такими, которые будут подходить для короткого или длительного контакта с кровью или продуктами крови. Данные медицинские устройства представляют собой, например, протезы, органы, сосуды, аорты, сердечные клапаны, трубки, запасные части для органов, имплантаты, волокна, полые волокна, стенты, полые иглы, шприцы, мембраны, консервированные продукты, контейнеры для крови, платы для титрования, электрокардиостимуляторы, поглощающие среды,хроматографические среды, хроматографические колонки, диализаторы, соединительные звенья, датчики, клапаны, камеры для центрифугирования, регенераторы, эндоскопы, фильтры, насосные камеры. Данное изобретение в особенности относится к стентам. Полисахариды формулы 1 получают из гепарина и/или гепарансульфатов. С точки зрения структуры, данные материалы являются очень близкими соединениями. Гепарансульфаты повсеместно присутствуют на поверхностях клеток млекопитающих. В зависимости от типа клеток они сильно различаются по молекулярной массе, степени ацетилирования и степени сульфатирования. Гепарансульфат из печени,например, имеет коэффициент ацетилирования приблизительно 50%, тогда как гепарансульфат гликокаликса эндотелиальных клеток может демонстрировать коэффициент ацетилирования от приблизительно 90% и выше. Гепарин имеет только очень низкую степень ацетилирования до приблизительно 5%. Коэффициент сульфатирования гепарансульфата из печени и гепарина составляет 2/дисахаридное звено, в случае гепарансульфата из эндотелиальных клеток близок к 0 и в гепарансульфатах из других типов клеток составляет от 0 до 2/дисахаридное звено.-4 009092 Соединения общей формулы 1 характеризуются количеством сульфатных групп/дисахаридное звено менее 0,05. Кроме того, количество свободных аминогрупп в данных соединениях составляет меньше 1%, исходя из всех групп -NH-Y. Ниже представлено тетрасахаридное звено гепарина или гепарансульфата со случайной ориентацией сульфатных групп и коэффициентом сульфатирования 2/дисахаридное звено, что типично для гепарина: Все гепарансульфаты имеют общую последовательность биосинтеза с гепарином. Прежде всего,образуется коровый белок со связывающим участком, содержащим ксилозу. Он включает ксилозу и соединенные с ней два остатка галактозы. К последнему из двух галактозных звеньев поочередно присоединяются глюкуроновая кислота и галактозамин, пока цепь не достигает соответствующей длины. В заключение следует ферментная модификация из нескольких стадий данного общего полисахаридного предшественника всех гепарансульфатов и гепарина с помощью сульфотрансфераз и эпимераз, при которой путем варьирования полноты трансформации образуется широкий спектр различных гепарансульфатов вплоть до гепарина. Гепарин построен из D-глюкозамина и D-глюкуроновой кислоты, чередующихся относительно Lидуроновой кислоты, где количество L-идуроновой кислоты доходит до 75%. D-Глюкозамин и D-глюкуроновая кислота соединены -1,4-гликозидной связью с L-идуроновой кислотой и -1,4-гликозидной связью с дисахаридом, что образует гепариновые субъединицы. Данные субъединицы снова соединены друг с другом -1,4-гликозидной связью и составляют гепарин. Положение сульфонильных групп может быть различным. В среднем, одно тетрасахаридное звено содержит 4-5 групп серной кислоты. Гепарансульфат, называемый также гепаритинсульфатом, содержит, за исключением гепарансульфата из печени,меньше N- и O-связанных сульфонильных групп, чем гепарин, но, вместо этого, содержит больше N-ацетильных групп. Количество L-идуроновой кислоты в нем также меньше по сравнению с гепарином. Как видно из фиг. 1, соединения общей формулы (в качестве примера см. фиг. 1b) по структуре близки природному гепарансульфату эндотелиальных клеток, но в них устранены ранее отмеченные недостатки, связанные с применением гепарансульфатов эндотелиальных клеток. Показано, что с антитромботической активностью связано особое пентасахаридное звено, которое можно обнаружить в коммерческих препаратах гепарина в приблизительно каждой 3-й молекуле. С помощью специальных технологий разделения можно получить препараты гепарина с различной антитромботической активностью. В высокоактивных, например полученных с помощью аффинной хроматографии, препаратах антитромбина III ("высокоаффинный гепарин") данная активная последовательность обнаружена во всех молекулах гепарина, тогда как в "неаффинных" препаратах характерные пентасахаридные последовательности отсутствуют, и, таким образом, не может быть определено никакое активное подавление свертывания. Вследствие взаимодействия с данным пентасахаридом, происходит значительное потенцирование активности антитромбина III, ингибитора ключевого фактора свертывания тромбина(аффинность связывания возрастает до показателя 2 х 103) [см. статью Stiekema J.C.J., Clin. Nephrology, 26,Suppl. No. 1, рр.3-8 (1986)]. Большинство аминогрупп гепарина N-сульфатированы или N-ацетилированы. Наиболее важными положениями O-сульфатирования являются положение С 2 в идуроновой кислоте, а также положения С 6 и C3 в глюкозамине. Показано, что активность пентасахарида в отношении плазматического свертывания, в основном, определяет сульфатная группа на С 6, а также в значительно меньшей степени другие функциональные группы. Поверхности медицинских имплантатов, покрытые гепарином или гепарансульфатами, являются и остаются условно гемосовместимыми благодаря данному покрытию. Гепарин или гепарансульфат, который наносят на искусственную поверхность, в жестких условиях частично теряет свою антитромботическую активность, что связано с ограничением взаимодействия вследствие стерического препятствия указанного пентасахарида с антитробином III. Из-за иммобилизации данных полианионных субстанций во всех случаях наблюдают сильную адсорбцию белка плазмы на гепаринированной поверхности, что, с одной стороны, устраняет эффект подавления свертывания гепарина и, соответственно, гепарансульфатов и, с другой стороны, инициирует процесс специфического свертывания при участии связывающих и,таким образом, изменяющих третичную структуру белков плазмы (например, альбумина, фибриногена,тромбина) и на базе этого адгезионных тромбоцитов. Таким образом, существует корреляция, с одной стороны, между ограниченным взаимодействием пентасахаридных звеньев с антитромбином III и иммобилизацией, с другой стороны, отложений белков-5 009092 плазмы на слое гепарин- и, соответственно, гепарансульфата медицинского имплантата. Это приводит к потере(ям) антитромботических свойств покрытия и может даже привести к обратному результату, поскольку адсорбция белка плазмы, которая происходит в течение нескольких секунд, приводит к утрате противосвертывающей поверхности, и адгезионные белки плазмы изменяют свою третичную структуру,при этом антитромбогенность поверхности изменяется на противоположную, и возникает тромбогенная поверхность. Неожиданно было можно определить, что соединения общей формулы 1, несмотря на структурные различия с гепарином и, соответственно, гепарансульфатом, по-прежнему демонстрируют свойства гемосовместимости гепарина, и, кроме того, после иммобилизации данных соединений не было обнаружено заслуживающих внимания отложений белков плазмы, которые представляют исходную стадию активации каскада свертывания. Свойства гемосовместимости соединений, соответствующих изобретению, по-прежнему сохраняются после их иммобилизации на искусственных поверхностях. Далее, предполагают, что сульфатные группы гепарина и, соответственно, гепарансульфатов необходимы для взаимодействия с антитромбином III и обусловливают, таким образом, противосвертывающий эффект гепарина и, соответственно, гепарансульфата. Соединения, соответствующие изобретению,не являются активными супрессорами свертывания, т.е антикоагулянтами, поскольку, вследствие почти полной десульфатации, происходит удаление сульфатных групп данных соединений до небольшого количества, не превышающего 0,2 сульфатные группы/дисахаридное звено. Соединения, соответствующие изобретению, общей формулы 1 можно получить из гепарина или гепарансульфатов путем изначальной почти полной десульфатации и последующего почти полного Nацилирования. Термин "почти полностью десульфатированный" относится к степени десульфатации более 90%, предпочтительно более 95% и особенно предпочтительно более 98%. Коэффициент десульфатации можно установить согласно так называемому нингидриновому тесту, который служит для определения свободных аминогрупп. В случае использования DMMB (диметилметиленового синего) десульфатацию определяют по отсутствию цветной реакции. Данный цветной тест пригоден для определения сульфатированных полисахаридов, но его предел чувствительности в технической литературе неизвестен. Десульфатацию можно провести, например, с помощью пиролиза соли пиридиния в смеси растворителей. В частности, показана эффективность смеси ДМСО (диметилсульфоксида), 1,4-диоксана и метанола. Гепарансульфаты, как и гепарин, десульфатировали путем общего гидролиза с последующим реацилированием. После этого определяли число сульфатных групп/дисахаридное звено (S/D) с помощью 13 С-ЯМР-спектроскопии. В следующей таблице приведены данные результаты на примере гепарина и десульфатированного реацилированного гепарина (Ас-гепарина). Таблица 1 Распределение функциональных групп/дисахаридное звено на примере гепарина и Ас-гепарина,как определено с помощью 13 С-ЯМР-спектрометрических измеренийNS - сульфатные группы на аминогруппах;N-Ac - ацетильные группы на аминогруппах;S/D - сульфатные группы/дисахаридное звено. Воспроизводимо получено содержание сульфата, составляющее приблизительно 0,03 сульфатные группы/дисахаридное звено (S/D) в случае Ас-гепарина по сравнению с приблизительно 2,5 сульфатными группами/дисахаридное звено в случае гепарина. Как описано выше, различие в содержании сульфата в гепарине и, соответственно, в гепарансульфатах оказывает существенное влияние на активность в отношении антитромбина III и эффектов свертывания данных соединений. Содержание сульфатных групп/сахаридное звено в данных соединениях не превышает 0,2, предпочтительно составляет меньше 0,07, более предпочтительно меньше 0,05 и особенно предпочтительно меньше 0,03 сульфатных групп/дисахаридное звено. Путем удаления сульфатных групп гепарина, с которыми связывают действующий механизм активного подавления свертывания, получают приемлемый гемосовместимый инертный в отношении свертывания олиго-, соответственно, полисахарид с очищенной поверхностью, который, с одной стороны, не играет активной роли в процессе свертывания и который, с другой стороны, не определяется системой свертывания как чужеродная поверхность. В соответствии с этим данной покрытие успешно имитирует природный самый высокий стандарт гемосовметимости и пассивности в отношении активных компонен-6 009092 тов свертывания крови. Примеры 3 и 4 объясняют, что поверхности, которые покрыты соединениями,соответствующими изобретению, в особенности покрытые с использованием ковалентного связывания,дают в результате пассивирующее атромбогенное и гемосовместимое покрытие. Это ясно показано на примере Ас-гепаринов. Термин "в основном, полностью N-ацилированный" относится к степени N-ацилирования 94%,предпочтительно выше 97% и особенно предпочтительно выше 98%. Ацилирование, таким образом, проходит полностью, так что при реакции с нингидрином для определения свободных аминогрупп цветная реакция более не развивается. В качестве ацилирующих агентов предпочтительно используют хлориды,бромиды или ангидриды карбоновых кислот. Например, для синтеза соединений, соответствующих изобретению, подходят ацетангидрид, ангидрид пропионовой кислоты, ангидрид масляной кислоты, хлорид уксусной кислоты, хлорид пропионовой кислоты или хлорид масляной кислоты. В качестве ацилирующих агентов особенно подходящими являются ангидриды карбоновых кислот. В качестве растворителя, в особенности для ангидридов карбоновых кислот, используют деионизированную воду особенно вместе с сорастворителем, который добавляют в количестве от 10 до 30 об.%. Как растворители подходят метанол, этанол, ДМСО (диметилсульфоксид), ДМФ (диметилформамид),ацетон, диоксан, ТГФ (тетрагидрофуран), этилацетат и другие полярные растворители. В случае применения галогенидов карбоновых кислот предпочтительным является использование безводных растворителей, таких как ДМСО. Соединения общей формулы, соответствующие изобретению, содержат в одной половине молекул сахара группу карбоксилата, а в другой половине - N-ацильную группу. В данном изобретении описано применение соединений общей формулы 1, а также солей данных соединений для покрытия, в особенности гемосовместимого покрытия естественных и/или искусственных поверхностей. Под термином "гемосовместимый" подразумевают свойство соединений, соответствующих изобретению, не взаимодействовать с соединениями системы свертывания крови или тромбоцитами и не инициировать каскад свертывания крови. Кроме того, в изобретении раскрывают полисахариды для гемосовместимого покрытия поверхностей. Предпочтительными являются полисахариды, лежащие в пределах вышеуказанных рамок молекулярных масс. Используемые полисахариды характеризуются тем, что они в большом количестве содержат сахарное составляющее звено N-ацилглюкозамин. Это означает, что 40-60% сахарных составляющих звеньев представляют собой N-ацилглюкозамин и каждое из значительной части остальных сахарных составляющих звеньев несет карбоксильную группу. Полисахариды, как правило, состоят из более чем 95%, предпочтительно из более чем 98% только двух сахарных образующих звеньев, при этом одно сахарное составляющее звено несет карбоксильную группу, а другое - N-ацильную группу. Одно сахарное составляющее звено полисахаридов представляет собой N-ацилглюкозамин, предпочтительно N-ацетилглюкозамин, а что касается другого, то оно представлено уроновыми кислотами глюкуроновой кислотой и идуроновой кислотой. Предпочтительными являются полисахариды, которые,главным образом, содержат сахар глюкозамин, при этом, по существу, половина сахарных составляющих звеньев несет N-ацильную группу, предпочтительно N-ацетильную группу, и другая половина глюкозаминовых составляющих звеньев несет одну карбоксильную группу, которая связана непосредственно аминогруппой или одной или более метиленильных групп. В случае, когда данные группы карбоновой кислоты связаны с аминогруппой, считают, что предпочтительными являются карбоксиметильная или карбоксиэтильная группы. Более того, предпочтительны полисахариды, по существу, одна половина из которых содержит N-ацетилглюкозамин и другая половина, в основном, содержит уроновые кислоты глюкуроновую кислоту и идуроновую кислоту. Особенно предпочтительны полисахариды, которые имеют,в основном, чередующуюся последовательность N-ацилглюкозамина и одной из двух уроновых кислот. Неожиданно было показано, что для применения в соответствии с изобретением особенно подходит, главным образом, десульфатированный и, в основном, N-ацилированный гепарин. Для гемосовместимого покрытия особенно подходит N-ацетилированный гепарин. Термин "в основном (по существу)" дает понять, что следует принимать во внимание статические вариации. Выражение "одна в значительной мере чередующаяся последовательность сахарных составляющих звеньев" подразумевает, что, в основном, отсутствует вариант двух одинаковых сахарных составляющих звеньев, связанных друг с другом, но данный дефект соединения полностью не исключен. Соответственно, термин "по существу, половина" означает почти 50%, но допускает маленькие отклонения, поскольку особенно в случае макромолекул, синтезированных биосинтетическим путем, никогда не достигается идеальный вариант, и некоторые отклонения всегда следует принимать во внимание, потому что ферменты работают не идеально и при катализе всегда можно ожидать некоторого уровня ошибок. Несмотря на это, в случае естественного гепарина имеется жестко чередующаяся последовательность звеньев N-ацетилглюкозамина и уроновой кислоты. Кроме того, описаны способы нанесения гемосовместимого покрытия на поверхности, которые предназначены в особенности для непосредственного контакта с кровью. При использовании данных способов получают естественную и/или искусственную поверхность и иммобилизуют на данной поверхности вышеописанные полисахариды.-7 009092 Иммобилизация полисахаридов на данных поверхностях достигается посредством гидрофобных взаимодействий, ван-дер-ваальсовых сил (сил межмолекулярного взаимодействия), электростатических взаимодействий, водородных связей, ионных взаимодействий, перекрестных сшивок полисахаридов и/или путем ковалентного связывания на поверхности. Предпочтительным является ковалентное связывание полисахаридов с помощью боковых цепей, более предпочтительным - ковалентное связывание в одной точке (связывание с помощью боковых цепей) и особенно предпочтительным - ковалентное связывание с концом молекулы (связывание по концу). Ниже описаны способы нанесения покрытия, соответствующие изобретению. С помощью следующего способа могут быть получены биологические и/или искусственные поверхности медицинских устройств с гемосовместимым покрытием:a) получение поверхности медицинского устройства иb) нанесение по меньшей мере одного соединения общей формулы 1, соответствующего пункту формулы 1, в качестве гемосовместимого слоя на данную поверхность и/илиb') нанесение биостабильного и/или биодеградируемого слоя на поверхность медицинского устройства или гемосовместимый слой. Термин "нанесение" будет относиться, по меньшей мере, к частичному покрытию поверхности соответствующими соединениями, причем соединения помещают, и/или иммобилизуют, или иным образом прикрепляют на и/или в расположенной внизу поверхности. Под выражением "значительная часть остальных сахарных составляющих звеньев" следует понимать, что 93% остальных сахарных составляющих звеньев, предпочтительно 96% и особенно предпочтительно 98% остальных 60-40% сахарных составляющих звеньев несут карбоксильную группу. Предпочтительным является получение непокрытой и/или негемосовместимой поверхности. Термин "негемосовместимые" поверхности будет относится к таким поверхностям, которые могут активировать систему свертывания крови и, таким образом, быть более или менее тромбогенными. Альтернативный вариант осуществления предусматривает стадии:a) получение поверхности медицинского устройства иb) нанесение по меньшей мере одного соответствующего изобретению полисахарида согласно формуле 1,b') нанесение биостабильного слоя на поверхность медицинского устройства иd') нанесение дополнительного гемосовместимого слоя по меньшей мере одного соответствующего изобретению полисахарида согласно формуле 1. Последний из упомянутых вариантов осуществления даже в случае, например, механического повреждения полимерного слоя и вместе с ним также внешнего гемосовместимого слоя обеспечивает то,что поверхностное покрытие не теряет своих характеристик гемосовместимости. Под термином "биологическая или искусственная" поверхность следует подразумевать комбинацию искусственного медицинского устройства с искусственной частью, например свиное сердце с искусственным сердечным клапаном. Предпочтительно, когда отдельные слои наносят методами погружения или напыления, при этом паклитаксел может быть также нанесен одновременно с нанесением одного слоя на поверхность медицинского устройства с последующим осуществлением ковалентного и/или адгезивного связывания в соответственном слое. В таком варианте возможно в одно время с нанесением на медицинское устройство гемосовместимого слоя нанести активный агент паклитаксел. Субстанции, входящие в биостабильные или биодеградируемые слои, уже перечислены выше. Затем на данный биостабильный, и/или биодеградируемый, или гемосовместимый слой можно в дополнительной необязательной стадии с) нанести слой агента, представленного паклитакселом. В предпочтительном варианте осуществления паклитаксел ковалентно связывают на нижележащем слое. Кроме того, паклитаксел предпочтительно наносят методами погружения или напыления на и/или в гемосовместимый слой или биостабильный слой. После стадии b) или стадии с) может следовать стадия d), на которой осуществляют нанесение по меньшей мере одного биодеградируемого слоя и/или по меньшей мере одного биостабильного слоя на гемосовместимый слой, соответственно, слой паклитаксела. Согласно альтернативным вариантам осуществления после стадии b') или стадии с) может следовать стадия d'), на которой выполняют нанесение по меньшей мере одного соединения общей формулы 1 в качестве гемосовместимого слоя на биостабильный и/или биодеградируемый слой, соответственно,слой паклитаксела. Предпочтительно, когда стадия d') следует за стадией b'). После стадии d), соответственно, d') может иметь место нанесение паклитаксела в и/или по меньшей мере на один биодеградируемый и/или биостабильный слой или гемосовместимый слой. Отдельные слои, а также паклитаксел предпочтительно наносят и/или выполняют способами погружения или напыления на и/или в нижележащий слой. Согласно предпочтительному варианту осуществления биостабильный слой наносят на поверхность медицинского устройства и полностью или не полностью покрывают гемосовместимым слоем,который (предпочтительно ковалентно) связывают с биостабильным слоем.-8 009092 Предпочтительно, когда гемосовместимый слой содержит гепарин нативной природы или региоселективно синтезированные производные с различными коэффициентами сульфатации (степенями сульфатации) и коэффициентами ацилирования (степенями ацилирования) в интервале молекулярных масс пентасахарида, который определяет антитромботическую активность, вплоть до стандартной молекулярной массы имеющегося в продаже гепарина молекулярной массы 13 кДа, гепарансульфат и его производные, олиго- и полисахариды эритроцитарного гликокаликса, десульфатированный и N-реацилированный гепарин, N-карбоксиметилированный и/или частично N-ацелированный хитозан, а также смеси данных субстанций. Объектом изобретения являются также медицинские устройства, имеющие гемосовместимое покрытие в соответствии с упомянутыми в данном контексте способами. В случае медицинских устройств предпочтительным объектом являются стенты. Обычные стенты, которые могут иметь покрытие согласно способам, соответствующим изобретению,состоят из нержавеющей стали, нитинола и других металлов и сплавов или синтетических полимеров. Стенты, соответствующие изобретению, покрыты предпочтительно ковалентно связанным гемосовместимым слоем, соответствующим общей формуле 1. Второй слой полностью или не полностью покрывает данный первый гемосовместимый слой. Данный второй слой предпочтительно содержит паклитаксел. Гемосовместимое покрытие стента обеспечивает, с одной стороны, необходимую совместимость с кровью и таким образом снижает риск тромбоза, а также сдерживание воспалительных реакций,обусловленных вмешательством и отсутствием неэндогенной поверхности, и паклитаксел, который предпочтительно гомогенно распределен на всей поверхности стента, обеспечивает, чтобы клетки, в особенности клетки гладкой мускулатуры и эндотелиальные клетки, покрывали поверхность стента контролируемым образом. При этом взаимодействие реакций тромбоза и воспалительных реакций, выход факторов роста, пролиферация и миграция клеток в течение процесса восстановления приводят к образованию нового "восстановленного" слоя клеток, который обозначают термином "неоинтима". Таким образом, использование паклитаксела, ковалентно и/или адгезивно связанного с нижележащим слоем и/или ковалентно и/или адгезивно введенного по меньшей мере в один слой, обеспечивает то,что данный активный агент высвобождается непрерывно и в малых дозах, образование популяции клеток на поверхности стента не подавляется, однако, предупреждается образование избыточной популяции и врастание клеток в просвет сосуда. Данная комбинация обоих эффектов обусловливает способность стента, соответствующего изобретению, быстро врастать в стенку сосуда и снижает как риск рестеноза,так и риск тромбоза. Высвобождение паклитаксела происходит приблизительно в течение 1-12 месяцев,предпочтительно в течение 1-3 месяцев после имплантации. Паклитаксел предпочтительно содержится в фармацевтически активной концентрации 0,001-10 мг/см 2 поверхности стента, предпочтительно 0,01-5 мг и особенно предпочтительно 0,1-1,0 мг/см 2 поверхности стента. Дополнительные активные агенты могут содержаться в аналогичной концентрации в том же самом или в гемосовместимом слое. Используемые количества полимера составляют на слой от 0,01 до 3 мг, предпочтительно от 0,20 до 1 мг и особенно предпочтительно от 0,2 до 0,5 мг. Покрытые подобным образом стенты высвобождают активный агент паклитаксел контролируемым образом и непрерывно и, вследствие этого, отлично подходят для предупреждения и уменьшения рестеноза. Такие стенты с гемосовместимым покрытием созданы, поскольку представлены стенты, и на них нанесен предпочтительно ковалентным путем один гемосовместимый слой, соответствующий общей формуле, который постоянно маскирует поверхность имплантата после высвобождения активного агента, а также после прекращения действия активного агента. Предпочтительный вариант осуществления стентов, соответствующих изобретению, демонстрирует покрытие, которое состоит по меньшей мере из двух слоев. Так называемый второй слой представляет собой слой, который нанесен на первый слой. Согласно данной двухслойной конструкции первый слой представляет собой гемосовместимый слой, который практически полностью покрыт вторым слоем, который состоит из паклитаксела, ковалентно и/или адгезивно связанного с первым слоем. Слой паклитаксела медленно растворяется, при этом происходит высвобождение активного агента в соответствии со скоростью процесса растворения. Первый гемосовместимый слой обеспечивает необходимую совместимость стента с кровью в той степени, в которой удаляется активный агент. При высвобождении активного агента адгезия клеток сильно снижается только в течение определенного периода времени, и целевая контролируемая адгезия осуществляется, когда внешний слой уже в значительной степени разрушается. В конечном счете, гемосовместимый слой сохраняется как атромбогенная поверхность и маскирует чужеродную поверхность таким образом, чтобы больше не могла произойти опасная для жизни реакция. Аналогичным образом стенты можно изготовить способом гемосовместимого покрытия на стенты,в основе которого лежат следующие положения: а. получение стента;b. нанесение предпочтительно ковалентно связанного гемосовместимого слоя;-9 009092 с. практически полное покрытие гемосовместимого слоя антипролиферативным активным агентом паклитакселом методом погружения или напыления. Стенты, соответствующие изобретению, решают как проблему острого тромбоза, так и проблему гиперплазии неоинтимы после имплантации стента. Кроме того, стенты, соответствующие изобретению,вследствие их покрытия особенно хорошо подходят для непрерывного высвобождения одного или более антипролиферативных иммунодепрессивных активных агентов. Благодаря данной способности непрерывно высвобождать целевой активный агент в необходимом количестве стенты с покрытием, соответствующим изобретению, почти полностью предупреждают опасность рестеноза. Естественные и/или искусственные поверхности, которые покрыты согласно вышеописанному способу гемосовместимым слоем вышеупомянутых полисахаридов, особенно пригодны для применения в качестве имплантатов, соответственно частей для замены органов, которые находятся в непосредственном контакте с системой кровообращения и кровью, предпочтительно в форме стентов в комбинации с антипролиферативным активным агентом, предпочтительно паклитакселом, для предупреждения рестеноза. Медицинские устройства с покрытиями, соответствующими изобретению, особенно подходят не только для непосредственного и постоянного контакта с кровью, но неожиданно демонстрируют также свойство снижать или даже предупреждать адгезию белков к подобным образом покрытым поверхностям. Адгезия белков плазмы на чужеродных поверхностях, которые находятся в контакте с кровью,представляет собой основную и изначальную стадию дальнейших событий, касающихся распознавания и осуществления действия системы крови. Например, это важно для используемых in vitro диагностических агентов из жидкостей тела. Таким образом, нанесение покрытия, соответствующего изобретению, препятствует или, по меньшей мере,уменьшает, например, неспецифическую адгезию белков на платах для микротитрования или других поддерживающих средах, используемых в методах диагностического определения, которая нарушает, в основном, чувствительные тест-реакции и может привести к искажению результата анализа. Кроме того, использование покрытия, соответствующего изобретению, на адсорбционных средах или хроматографических средах предупреждает или снижает неспецифическую адгезию белков, что позволяет достичь лучшего разделения и получить продукты более высокой чистоты. Перечень фигур, чертежей и иных материалов На фиг. 1 представлено тетрасахаридное звено гепарина или гепарансульфата со статистическим распределением сульфатных групп и коэффициентом сульфатации 2/дисахаридное звено, поскольку это типично для гепарина (см. фиг. 1 а). Для сравнения структурных аналогий на фиг. 1b представлен пример соединения, соответствующего общей формуле, приведенной в описании. На фиг. 2 представлено влияние расширенного PVC-трубкой коронарного стента из нержавеющей стали с модифицированной поверхностью на разрушение тромбоцитов (разрушение PLT). Коронарный стент из нержавеющей стали без покрытия измеряли в качестве эталона. За нулевое значение принимали уровень разрушения тромбоцитов в PVC-трубке без коронарного стента из нержавеющей стали. В данном случае SH1 обозначает стент, покрытый ковалентно связанным гепарином, SH2 - стент, покрытый хондроитинсульфатом, SH3 - стент, покрытый полисахаридами, полученными из гликокаликса эритроцитов, и SH4 - коронарный стент из нержавеющей стали, покрытый ковалентно связанным Ас-гепарином. На фиг. 3 дано схематическое представление скорости рестеноза при использовании стентов, покрытых ковалентно связанным полностью десульфатированным и N-реацетилированным гепарином (Асгепарин), и стентов, покрытых олиго- и полисахаридами гликокаликса эритроцитов (полисах. гликок. эритр.), по сравнению со стентами без покрытия и стентами, покрытыми полиакриловой кислотой (PAS),через 4 недели после имплантации свинье. На фиг. 4 представлены данные количественной коронарной ангиографии: изображения поперечных срезов через стент, содержащие сегмент сосуда со стентом, покрытым Ас-гепарином (а.) и для сравнения сосуда со стентом без покрытия (непокр. или открытый) (b.). Через 4 недели в эксперименте на животном (свинья) можно видеть четкие различия в толщине образованной неоинтимы. На фиг. 5 представлен график элюции паклитаксела из стента (без поддерживающей среды). Сведения, подтверждающие возможность осуществления изобретения Пример 1. Синтез десульфатированного реацилированного гепарина. 100 мл катионообменной смолы амберлит IR-122 вносят в колонку диаметром 2 см с 400 мл 3 М HCl в превращенной Н+-форме и промывают дистиллированной водой, пока элюат не освободится от хлорида и рН не станет нейтральным. 1 г натриевой соли гепарина растворяют в 10 мл воды, наносят на катионообменную колонку и элюируют 400 мл воды. Элюат по каплям добавляют в приемный резервуар, содержащий 0,7 г пиридина, а затем титруют с пиридином до получения рН 6 и подвергают сублимационной сушке. 0,9 г пиридиниевой соли гепарина вносят в круглую колбу с парциальным конденсатором горячего орошения, содержащую 90 мл смеси ДМСО (диметилсульфоксида)/1,4-диоксана/метанола в соотношении 6/3/1 (об./об./об.), и нагревают в течение 24 ч до 90 С. Затем добавляют 823 мг хлорида пиридиния и дополнительно нагревают в течение 70 ч при 90 С. После этого смесь разводят 100 мл воды и титруют разбавленным раствором гидроксида натрия до получения рН 9. Десульфатированный гепарин диализуют против воды и подвергают сублимационной сушке.- 10009092 100 мг десульфатированного гепарина растворяют в 10 мл воды, охлаждают до 0 С и добавляют 1,5 мл метанола при перемешивании. К данному раствору добавляют 4 мл анионообменной смолы dowex 1 х 4 в ОНформе, а затем 150 мкл ацетангидрида и перемешивают в течение 2 ч при 4 С. Затем смолу удаляют фильтрацией, диализуют раствор против воды и подвергают сублимационной сушке. Пример 2. Синтез десульфатированного N-пропионилированного гепарина. 100 мл катионообменной смолы амберлит IR-122 вносят в колонку диаметром 2 см с 400 мл 3 М HCl в превращенной Н+-форме и промывают дистиллированной водой, пока элюат не освободится от хлорида и рН не станет нейтральным. 1 г натриевой соли гепарина растворяют в 10 мл воды, наносят на катионообменную колонку и элюируют 400 мл воды. Элюат по каплям добавляют в приемный резервуар, содержащий 0,7 г пиридина, а затем титруют с пиридином до получения рН 6 и подвергают сублимационной сушке. 0,9 г пиридиниевой соли гепарина вносят в круглую колбу с парциальным конденсатором горячего орошения, содержащую 90 мл смеси ДМСО/1,4-диоксана/метанола в соотношении 6/3/1 (об./об./об.) и нагревают в течение 24 ч до 90 С. Затем добавляют 823 мг хлорида пиридиния и дополнительно нагревают в течение 70 ч при 90 С. После этого смесь разводят 100 мл воды и титруют разбавленным раствором гидроксида натрия до получения рН 9. Десульфатированный гепарин диализуют против воды и подвергают сублимационной сушке. 100 мг десульфатированного гепарина растворяют в 10 мл воды, охлаждают до 0 С и добавляют 1,5 мл метанола при перемешивании. К данному раствору добавляют 4 мл анионообменной смолы dowex 1 х 4 в ОНформе, а затем 192 мкл ангидрида пропионовой кислоты и перемешивают в течение 2 ч при 4 С. Затем смолу удаляют фильтрацией, диализуют раствор против воды и подвергают сублимационной сушке. Пример 3. Измерения гемосовместимости соединений, соответствующих общей формуле 1, с помощью ISO 10933-4 (измерения in vitro). Для измерения гемосовместимости соединений, соответствующих формуле 1, целлюлозные мембраны, силиконовые трубки и стенты из нержавеющей стали покрывают соединением, соответствующим формуле 1, и тестируют относительно гепарина, а также относительно соответствующих используемых в тех же тестах поверхностей из непокрытых материалов. 3.1. Целлюлозные мембраны (купрофан), покрытые десульфатированным реацетилированным гепарином (Ас-гепарином). Для исследования связанных со свертыванием физиологических взаимодействий между обработанной цитратом цельной кровью и покрытых Ас-гепарином, соответственно, гепарином купрофановых мембран используют открытую перфузионную систему типа камеры Baumgartner в модификации Sakariassen(см. статью Sakariassen K.S. и соавт. J. Lab. Clin. Med., 102:522-535, (1983. Камера сделана из четырех составляющих блоков и дополнительно имеет конические соединительные трубки и резьбовые соединения. Она изготовлена из полиметилметакрилата и позволяет проводить параллельное исследование двух модифицированных мембран, так что каждый опыт имеет статистические границы. Конструкция данной камеры обеспечивает квазиламинарные условия перфузии. Через 5 мин перфузии при 37 С мембраны достают и после фиксации прикрепившихся тромбоцитов измеряют их количество. Соответствующие результаты приведены по отношению к высокотромбогенному субэндотелиальному матриксу в качестве отрицательного стандарта со 100% размещением тромбоцитов. Адгезия тромбоцитов происходит после образования слоя белков плазмы на чужеродном материале. Белок плазмы фибриноген действует как кофактор агрегации тромбоцитов. Такая индуцированная активация тромбоцитов приводит к связыванию ряда белков плазмы, ассоциированных со свертыванием, таких как, например, витронектин, фибронектин и фактор фон Виллебранда, на поверхности тромбоцитов. В конечном счете, необратимая агрегация тромбоцитов происходит под их воздействием. Вследствие описанных взаимодействий размещение тромбоцитов представляет собой принятый показатель тромбогенности поверхностей в случае контакта чужеродной поверхности с кровью. Следствием из данного факта является то, что, чем ниже уровень размещения тромбоцитов на перфузируемой поверхности, тем, как считают, выше гемосовместимость исследуемой поверхности. Результаты исследований мембран, покрытых гепарином и мембран, покрытых Ас-гепарином, ясно показывают улучшение гемосовместимости чужеродной поверхности при покрытии Ас-гепарином. Мембраны, покрытые гепарином, демонстрируют размещение тромбоцитов 45-65%, при этом поверхности, покрытые Ас-гепарином, демонстрируют значения 0-5% (относительно субэндотелиального матрикса с размещением тромбоцитов 100%). Адгезия тромбоцитов на Ас-гепаринизированной поверхности значительно ухудшается из-за отсутствия белков плазмы, необходимых для активации тромбоцитов. Напротив, покрытая гепарином поверхность с немедленно начинающейся адсорбцией белков плазмы создает оптимальные предварительные условия для активации, помещения и агрегации тромбоцитов, и, в конечном счете, кровь реагирует при соответствующих механизмах защиты с введенной чужеродной поверхностью. Ас-гепарин значительно лучше, чем гепарин, отвечает требованиям к гемосовместимости чужеродной поверхности. Взаимодействие адсорбции белков плазмы и размещения тромбоцитов, как прямой показатель тромбогенности поверхности, находящийся в зависимости от представляемого для взаимодействия с кровью покрытия, становится особенно хорошо понятным в свете данного теста in vitro. Так, использование- 11009092 ковалентно связанного гепарина в качестве антитромботического компонента поверхности сильно ограничено или совершенно невозможно. Взаимодействия иммобилизованного гепарина с кровью превращает их в нежелательную противоположность - покрытая гепарином поверхность становится тромбогенной. Очевидно, чрезвычайная важность гепарина как антитромботического агента не переносится на ковалентно иммобилизованный гепарин. При системном применении в растворенной форме он может полностью раскрыть свои свойства. Но, если гепарин не иммобилизован ковалентным образом, его антитромботические свойства, при их наличии, являются нестойкими. Отличие Ас-гепарина ("неаффинного" гепарина) состоит в том, что вследствие десульфатации и N-реацетилирования он фактически теряет активные антитромботические свойства исходной молекулы, но взамен приобретает характерные атромбогенные свойства, которые явно обнаруживаются в отсутствие активности в отношении антитромбина III и при потере сродства к процессам инициации свертывания и сохраняются после ковалентного связывания. Вследствие этого Ас-гепарин и, таким образом, соединения общей формулы 1, в целом, оптимально подходят для маскировки чужеродной поверхности, находящейся в контакте с системой свертывания. 3.2. Иммобилизация на силиконе. Через силиконовую трубку длиной 1 м с внутренним диаметром 3 мм прокачивают по кругу 100 мл смеси этанол/вода в соотношении 1/1 (об./об.) в течение 30 мин при 40 С. Затем добавляют 2 мл 3-(триэтоксисилил)пропиламина и дополнительно прокачивают по кругу в течение 15 ч при 40 С. После этого трубку промывают в каждом случае в течение 2 ч 100 мл смеси этанол/вода и 100 мл воды. 3 мг дезацетилированного и реацетилированного гепарина (Ас-гепарина) растворяют при 4 С в 30 мл 0,1 М MES-буфера рН 4,75 и смешивают с 30 мг CME-CDI (N-циклогексил-N'-(2-морфолинэтил)карбодиимидметил-р-толуолсульфата). Данный раствор прокачивают по кругу в течение 15 ч при 4 С через трубку. Затем ее промывают водой и 4 М раствором NaCl и водой (в каждом случае по 2 ч). 3.3. Определение числа тромбоцитов (EN30993-4). В силиконовую трубку длиной 1 м с внутренним диаметром 3 мм помещают две соответствующие по форме стеклянные трубки длиной 2 см. Затем трубку замыкают в кольцо с помощью стягиваемой трубки и наполняют через шприцы с вытеснением воздуха 0,154 М раствором NaCl. В процессе этого один шприц используют для наполнения раствором, а другой шприц используют для удаления воздуха. Раствор заменяют с вытеснением воздуха (без пузырьков) с помощью двух шприцов на обработанную цитратом цельную кровь здорового тест-субъекта. Затем глухие отверстия от шприцов закрывают, помещая над ними стеклянные трубки, и трубку плотно подсоединяют к насосу для диализа. Кровь прокачивают с течение 10 мин при скорости потока 150 мл/мин. Содержание тромбоцитов в крови измеряют до и после перфузии с помощью счетчика coulter. Для силиконовых трубок без покрытия потеря тромбоцитов составляет 10%. В противоположность этому, потеря в силиконовых трубках, которые имеют покрытие в соответствии с примером 5.2, в среднем, составляет 0% (число экспериментов: n=3). Кроме того, в данной динамической тест-системе показано, что на покрытой Ас-гепарином поверхности активация тромбоцитов понижена. Одновременно можно зарегистрировать, что иммобилизация гепарина оказывает отрицательное действие на гемосовместимость используемой поверхности. Напротив, Ас-гепарин в соответствии со своей пассивной природой демонстрирует отсутствие эффектов при контакте с тромбоцитами. 3.4. Эксперименты с цельной кровью на коронарных стентах из нержавеющей стали 16 LVM. В соответствии с экспериментами по биосовместимости стенты из нержавеющей стали 316 LVM длиной 31 мм покрывают Ас-гепарином путем ковалентного связывания. При общей поверхности 2 см 2 и коэффициенте размещения приблизительно 20 пм/см 2 поверхности стента нагрузка данного стента составляет приблизительно 0,35 мкг Ас-гепарина. Для сравнения заметим, что, в отличие от этого, в случае профилактики тромбоза уровень ежедневного введения гепарина составляет 20-30 мг, соответствуя, таким образом, по меньшей мере 60000-кратной величине. Данные эксперименты проводят с разработанной гемодинамической системой петли Chandler [см. статью A. Henseler, В. Oedekoven, С. Andersson, К. Mottaghy, KARDIOTECHNIK, 3, (1999)]. Стенты с покрытием и без покрытия помещают и тестируют в PVC (поливинилхлорид) трубках (PVC медицинского качества) длиной 600 мм и внутренним диаметром 4 мм. Результаты данных экспериментов согласуются с данными, полученными в рассмотренных экспериментах с силиконовыми трубками. Изначальный связанный со стентом уровень разрушения тромбоцитов в перфузате, который составляет 50%, снижается за счет улучшения поверхности стента Ас-гепарином более чем на 80%. Воздействие находящихся в трубке коронарных стентов с модифицированной поверхностью на разрушение тромбоцитов оценивают в последующих тестах Chandler в течение 45-минутной перфузии цельной крови. Для этого сначала анализируют PVC трубку без стента и принимают полученный результат на нулевое значение. Средний уровень потери тромбоцитов в пустой трубке составляет 27,4% относительно донорской крови при стандартном отклонении только 3,6%. Данное базовое значение берут за основу для различных стентов с модифицированными поверхностями, помещенных в PVC трубки, и анализируют в аналогичных условиях в плане вызываемой ими потери тромбоцитов. Это делают также в том случае, когда покрытая поверхность стента, которую принимают только за приблизительно 0,84% от- 12009092 общей тест-поверхности, вызывает значительный и воспроизводимый эффект на содержание тромбоцитов. Относительно пустой трубки (базовое значение) анализ гладкой поверхности стента без химического покрытия дает дополнительное среднее значение потери тромбоцитов 22,7%. Кроме того, по сравнению в пустой PVC трубкой при наличии меньше чем 1% измеряемой чужеродной поверхности это вызывает примерно сравнимую потерю тромбоцитов. Непосредственный результат состоит в том, что медицинская нержавеющая сталь 316 LVM, используемая в качестве материала для изготовления стентов,вызывает приблизительно в 100 раз более сильное повреждение тромбоцитов, чем поверхность PVC медицинского качества, хотя данная тест-поверхность составляет только 0,84% от общей поверхности. Анализ поверхностных покрытий коронарных стентов из нержавеющей стали показывает, что они могут очень существенно уменьшить большие размеры повреждений тромбоцитов, вызываемых стентом (см. фиг. 2). В качестве наиболее эффективного покрытия с результатом 81,5% представлен Ас-гепарин (SH4). При рассмотрении эффектов стентов с покрытием Ас-гепарином в результате получают сравнимые величины. Корреляция потери тромбоцитов в перфузате, соответственно, адгезии тромбоцитов на представленных поверхностях показывает надежность измерений. 3.4.1. Ковалентное гемосовместимое покрытие стентов. Неразвернутые стенты из медицинской нержавеющей стали LVM 316 обезжиривают в ультразвуковой бане в течение 15 мин ацетоном и этанолом и высушивают при 100 С в сушильном шкафу. Затем их погружают на 5 мин в 2% раствор 3-аминопропиотриэтоксисилана с смеси этанол/вода (50/50 (об./об.,потом сушат в течение 5 мин при 100 С. После этого стенты промывают деминерализованной водой в течение ночи. 3 мг десульфатированного и реацетилированного гепарина растворяют при 4 С в 30 мл 0,1 М MESбуфера (2-(N-морфолин)этаносульфоновая кислота), рН 4,75, и смешивают с 30 мг N-циклогексил-N'-(2 морфолинэтил)карбодиимидметил-р-толуолсульфоната. В данном растворе перемешивают 10 стентов в течение 15 ч при 4 С. Затем их промывают водой, 4 М раствором NaCl и водой (в каждом случае по 2 ч). 3.4.2. Определение содержание глюкозамина в стентах с покрытием с помощью ВЭЖХ (высокоэффективной жидкостной хроматографии). Гидролиз: берут стенты с покрытием в маленьких пробирках для гидролиза и добавляют в них 3 мл 3 М HCl точно на 1 мин при комнатной температуре. Металлические зонды удаляют и после запечатывания пробирки инкубируют в течение 16 ч в сушильном шкафу при 100 С. Затем им дают охладиться,трижды выпаривают досуха, помещают в дегазированую и фильтрованную воду и измеряют относительно также гидролизованного стандарта с помощью ВЭЖХ. Пример 4. Исследование in vivo коронарных стентов с покрытием (см. фиг. 5). 4.1. Исследования in vivo коронарных стентов, покрытых Ас-гепарином. На основании данных по гемосовместимости, которые получены для Ас-гепарина в экспериментахin vitro, обсуждают пригодность Ас-гепариновой поверхности как атромбогенного покрытия металлических стентов in vivo (эксперимент на животных). Целью экспериментов является сначала оценить воздействие Ас-гепаринового покрытия на вызываемую стентом реакцию сосудов. Кроме регистрации возможных тромботических событий учитывают соответствующие параметры процессов, связанных с рестенозом, таких как площадь неоинтимы, просвет сосуда и степень стеноза. Для исследований используют домашних свиней в возрасте 6-9 месяцев, в том числе для проверки стентов, установленных в течение длительного времени, и в одобренной модели на животных. Как ожидают, в данных экспериментах ни острые, подострые, ни поздние острые тромботические события не регистрируют, что можно расценить как доказательство атромбогенных свойств Ас-гепарина. Через 4 недели животных умерщвляют (подвергают эвтаназии), выделяют сегменты коронарных артерий со стентами и проводят гистоморфометрический анализ. На протяжении всей экспериментальной фазы показатели возможной острой или субхронической токсичности, реакции аллергизации или невыраженные раздражения как последствия имплантации стентов, покрытых Ас-гепарином, не наблюдают, особенно при гистологическом исследовании. При коронарно-ангиографическом исследовании,проведенном во время имплантации стента, а также по окончании эксперимента получена совокупность результатов, которая допускает интерпретацию, касающуюся реакции сосуда на имплантацию стента. Разница между контрольным стентом без покрытия и стентом, покрытым Ас-гепарином, однозначна. Образование отчетливого слоя неоинтимы очень хорошо заметно в случае контрольного стента без покрытия. Уже через 4 недели эффект стимуляции пролиферации поверхности стента без покрытия на окружающую ткань присутствует в такой степени, что, в конечном счете, создает опасность окклюзии сосуда в области стента. Напротив, в случае стентов, покрытых Ас-гепарином, наблюдают явно более тонкий слой неоинтимы, который свидетельствует о хорошо модулированном врастании стента при сохранении широкого свободного просвета сосуда. Результаты детального гистоморфометрического и коронарно-ангиографического исследования подтверждают данное заключение, поскольку из них сопоставимо видно, что покрытие Ас-гепарином(SH4) подавляет гиперплазию неоинтимы ("рестеноз") приблизительно на 17-20% по сравнению с контрольным стентом без покрытия. Данный результат одновременно является неожиданным и выдающимся. Конечно, не требуется, чтобы в дополнение с наличием характеристик гемосовместимости атромбогенная поверхность влияла также на процессы, которые приводят к гиперплазии неоинтимы, т.е. предупреждала рестеноз. С одной стороны, плотное постоянное покрытие поверхности стента Ас-гепарином препятствует непосредственному контакту клетки с поверхностью металла. Поскольку в технической литературе выход ионов некоторых металлов в ткани, прилежащие к имплантату, рассматривают как одну из возможных причин рестеноза, в основе противорестенозной активности могло бы лежать обусловленное одним из покрытий предупреждение непосредственного контакта с металлом. С другой стороны, данный положительный побочный эффект является правдоподобным, поскольку в отсутствие агрегации тромбоцитов должны также пропадать пролиферативные эффекты высвобождающихся при этом факторов роста в отношении пассивной атромбогенной поверхности стента. Таким образом исключают важный исходящий со стороны просвета сосуда стимул пролиферации неоинтимы. Пример 5. Покрытие стентов таксолом способом напыления. Полученные в примерах 1 и 2 неразвернутые стенты взвешивают и подвешивают горизонтально на тонкий металлический стержень (диаметр=0,2 мм), который прикреплен к оси вращения вращающего и питающего устройства, и вращают со скоростью 28 об./мин. Стенты фиксируют так, чтобы внутренняя часть стента не касалась стрежня. При амплитуде подачи 2,2 см, скорости подачи 4 см/с и расстоянии между стентом и распылительным соплом 6 см стент обрызгивают определенным раствором для напыления. После высушивания при комнатной температуре (в течение приблизительно 15 мин) и последующего выдерживания в вытяжном шкафу в течение ночи стент снова взвешивают. Получение раствора для напыления: 44 мг таксола растворяют в 6 г хлороформа. Пример 6. Определение характера элюции с PBS-буфере.- 14009092 В достаточно маленькую колбу на стент добавляют 2 мл PBS-буфера, закрывают парафильмом и инкубируют в сушильном шкафу при 37 С. По истечении выбранных интервалов времени в каждом случае избыток раствора убирают пипеткой и измеряют поглощение в УФ-спектре при длине волны 306 нм. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Медицинское устройство, контактирующее с кровью, отличающееся тем, что по меньшей мере часть его поверхности покрыта, непосредственно или через посредство по меньшей мере одного промежуточного биостабильного и/или биодеградируемого слоя, гемосовместимым слоем, содержащим по меньшей мере одно соединение формулы 1n представляет собой целое число от 4 до 1050;Y представляет собой остаток, выбранный из -СНО, -СОСН 3, -COC2H5, -СОС 3 Н 7, -СOС 4H9, -COC5H11,-СОСН(СН 3)2, -СОСН 2 СН(СН 3)2, -СОСН(СН 3)С 2 Н 5, -СОС(СН 3)3, -СН 2 СОО-, -C2H4COO-, -C3H6COO-,-C4H8COO-, а также солей данных соединений,при этом на, в и/или под гемосовместимым слоем присутствует активный агент паклитаксел. 2. Устройство по п.1, отличающееся тем, что Y представляет собой остаток, выбранный из -СНО,-СОСН 3, -COC2H5, -СОС 3 Н 7, а также солей данных соединений. 3. Устройство по п.2, отличающееся тем, что Y обозначает -СОСН 3. 4. Устройство по любому из пп.1-3, отличающееся тем, что гемосовместимый слой расположен непосредственно на его поверхности, причем на указанный гемосовместимый слой нанесен паклитаксел, а также смеси данных активных агентов. 5. Устройство по любому из пп.1-4, отличающееся тем, что под гемосовместимым слоем или между двумя гемосовместимыми слоями расположен по меньшей мере один биостабильный и/или биодеградируемый слой. 6. Устройство по любому из пп.1-5, отличающееся тем, что гемосовместимый слой полностью и/или не полностью покрыт по меньшей мере одним дополнительным биостабильным и/или биодеградируемым слоем. 7. Устройство по любому из пп.1-6, отличающееся тем, что по меньшей мере один слой активного агента паклитаксела расположен между биостабильным и гемосовместимым слоями. 8. Устройство по любому из пп.1-7, отличающееся тем, что паклитаксел ковалентно и/или адгезивно связан в и/или на гемосовместимом слое и/или биостабильном и/или биодеградируемом слое. 9. Устройство по любому из пп.1-8, отличающееся тем, что в качестве биодеградируемых субстанций для биодеградируемого слоя использованы поливалеролактоны, полидекалактоны, полилактоновая кислота, полигликолевая кислота, полилактиды, полигликолиды, сополимеры полилактидов и полигликолидов, поликапролактон, полигидроксибутановая кислота, полигидроксибутираты, полигидроксивалераты, полигидроксибутиратсовалераты, поли(1,4-диоксан-2,3-дионы), поли(1,3-диоксан-2-он),полипарадиоксаноны, полиангидриды, в частности полималеиновые ангидриды, полигидроксиметакрилаты, фибрин, полицианоакрилаты, поликапролактондиметилакрилаты, поли-b-малеиновая кислота, поликапролактонбутилакрилаты, мультиблокполимеры, в частности олигокапролактондиолы и олигодиоксанондиолы, мультиблокполимеры полиэфиров сложных эфиров, в частности ПЭГ и поли(бутилентерефталаты), полипивотолактоны, триметилкарбонаты полигликолевой кислоты, поликапролактонгликолиды, поли(g-этилглутамат), поли(DTH-иминокарбонат), поли(DTE-со-DT-карбонат), поли(бисфенол-Аиминокарбонат), полиортоэфиры, триметилкарбонаты полигликолевой кислоты, политриметилкарбонаты, полииминокарбонаты, поли(N-винил)пирролидон, поливиниловые спирты, полиэфирамиды, гликолированные полиэфиры, полифосфоэфиры, полифосфазены, поли[(р-карбоксифенокси)пропан], полигидроксипентановая кислота, полиангидриды, полиэтиленоксид-пропиленоксид, мягкие полиуретаны, полиуретаны с аминокислотными остатками в скелете, сложные эфиры полиэфиров, в частности полиэтиленоксид, полиалкеноксалаты, полиортоэфиры, а также их сополимеры, липиды, каррагенаны, фибриноген,крахмал, коллаген, полимеры на белковой основе, полиаминокислоты, синтетические полиаминокислоты, зеин, модифицированный зеин, полигидроксиалканоаты, пектиновая кислота, актиновая кислота,модифицированный и немодифицированный фибрин и казеин, карбоксиметилсульфат, альбумин и, кроме того, гиалуроновая кислота, хитозан и его производные, гепарансульфаты и их производные, гепарин,хондроитинсульфат, декстран, b-циклодекстрины, сополимеры с ПЭГ и полипропиленгликолем, гуммиа- 15009092 рабик, гуаровая камедь, желатин, коллаген, коллаген-N-гидроксисукцинимид, липиды, фосфолипиды,модификации и сополимеры и/или смеси указанных субстанций. 10. Устройство по любому из пп.1-9, отличающееся тем, что в качестве биостабильных субстанций для биостабильного слоя использованы полиакриловая кислота и полиакрилаты, в частности полиметилметакрилат, полибутилметакрилат, полиакриламид, полиакрилнитрилы, полиамиды, полиэфирамиды,полиэтиленамин, полиимиды, поликарбонаты, поликарбоуретаны, поливинилкетоны, поливинилгалогениды, поливинилиденгалогениды, поливиниловые эфиры, полиизобутилены, поливинилароматические соединения, поливиниловые сложные эфиры, поливинилпирролидоны, полиоксиметилены, политетраметиленоксид, полиэтилен, полипропилен, политетрафторэтилен, полиуретаны, полиэфируретаны, силиконполиуретановые эфиры, силиконполиуретаны, силиконполикарбонатуретаны, полиолефиновые эластомеры, полиизобутилены, сополимеры EPDM, фторсиликоны, карбоксиметилхитозаны, полиарилэфирэфиркетоны, полиэфирэфиркетоны, полиэтилентерфталат, поливалераты, карбоксиметилцеллюлоза,целлюлоза, вискозное волокно, триацетатные волокна, целлюлозонитраты, целлюлозоацетаты, гидроксиэтилцеллюлоза, целлюлозобутираты, целлюлозоацетатбутираты, этилвинилацетатные сополимеры, полисульфоны, эпоксидные смолы, сополимеры ABS, сополимеры EPDM, силиконы, в частности полисилоксаны, полидиметилсилоксаны, поливинилгалогены и сополимеры, целлюлозные эфиры, целлюлозотриацетаты, хитозаны и сополимеры и/или смеси данных субстанций. 11. Медицинское устройство, контактирующее с кровью, отличающееся тем, что по меньшей мере часть его поверхности покрыта, непосредственно или через посредство по меньшей мере одного промежуточного биостабильного и/или биодеградируемого слоя, гемосовместимым слоем, содержащим по меньшей мере одно соединение формулы 1n представляет собой целое число от 4 до 1050;Y представляет собой остаток, выбранный из -СНО, -СОСН 3, -COC2H5, -СОС 3H7, -СOС 4 Н 9, -СОС 5 Н 11,-СОСН(СН 3)2, -СОСН 2 СН(СН 3)2, -СОСН(СН 3)С 2 Н 5, -СОС(СН 3)3, -СН 2 СОО-, -С 2 Н 4 СОО-, -С 3 Н 6 СОО-,-С 4H8 СОО-, а также солей данных соединений,при этом на, в и/или под гемосовместимым слоем присутствует один из следующих активных агентов: симвастатин, 2-метилтиазолидин-2,4-дикарбоновая кислота и соответствующая натриевая соль, макроциклическая закись (MCS), производные MCS, активированный белок С (аРС), пентаэритритол тетранитрат (PETN), трапидил, -эстрадиол, а также смеси данных активных агентов или смеси одного из данных активных агентов с паклитакселом. 12. Устройство по любому из пп.1-11, отличающееся тем, что оно выбрано из группы, включающей протезы, органы, сосуды, аорты, сердечные клапаны, трубки, запасные части для органов, имплантаты,волокна, полые волокна, стенты, полые иглы, шприцы, мембраны, консервированные продукты, контейнеры для крови, платы для титрования, электрокардиостимуляторы, поглощающие среды, хроматографические среды, хроматографические колонки, диализаторы, соединительные звенья, датчики, клапаны,камеры для центрифугирования, регенераторы, эндоскопы, фильтры, насосные камеры. 13. Устройство по п.12, отличающееся тем, что оно представляет собой стент. 14. Устройство по п.13, отличающееся тем, что оно содержит нанесенный полимер в количестве от 0,01 до 3 мг/слой, предпочтительно от 0,20 до 1 мг/слой и наиболее предпочтительно от 0,2 до 0,5 мг/слой. 15. Устройство по п.13 или 14, отличающееся тем, что активный агент присутствует в фармацевтически активной концентрации от 0,001 до 10 мг/см 2 поверхности стента или на слой. 16. Применение медицинского устройства по п.12 в качестве средства, предназначенного для предупреждения или уменьшения рестеноза. 17. Применение медицинского устройства по п.12 в качестве средства, предназначенного для длительного высвобождения паклитаксела, симвастатина, натриевой соли 2-метилтиазолидин-2,4-дикарбоновой кислоты, макроциклической закиси (MCS), производных MCS, активированного белка С (аРС),пентаэритритола тетранитрата (PETN), трапидила и/или -эстрадиола. 18. Способ нанесения гемосовместимого покрытия на биологическую и/или искусственную поверхность медицинского устройства, контактирующего с кровью, отличающийся тем, что на поверхность медицинского устройства наносят по меньшей мере одно соединение общей формулы 1 по п.1 в качестве гемосовместимого слоя или биостабильный и/или биодеградируемый слой, затем на гемосовместимый слой наносят биостабильный и/или биодеградируемый слой либо гемосовместимый слой наносят на биостабильный или на биодеградируемый слой.- 16009092 19. Способ по п.18, отличающийся тем, что гемосовместимый слой или биостабильный и/или биодеградируемый слой покрывают посредством погружения или напыления по меньшей мере одним биодеградируемым и/или биостабильным слоем, который содержит ковалентно и/или адгезивно связанный паклитаксел. 20. Способ по п.18 или 19, отличающийся тем, что дополнительно вводят или наносят паклитаксел в и/или на гемосовместимый слой или биостабильный и/или биодеградируемый слой. 21. Способ по п.20, отличающийся тем, что паклитаксел вводят и/или наносят посредством погружения или напыления на и/или в гемосовместимый слой или биостабильный и/или биодеградируемый слой и/или связывают путем ковалентного и/или адгезивного связывания с гемосовместимым слоем или биостабильным и/или биодеградируемым слоем. 22. Способ по любому из пп.18-21, отличающийся тем, что наносят по меньшей мере один биодеградируемый слой и/или по меньшей мере один биостабильный и/или биодеградируемый слой на гемосовместимый слой или слой паклитаксела соответственно; или наносят по меньшей мере одно соединение общей формулы 1 по п.1 в качестве гемосовместимого слоя на биостабильный и/или биодеградируемый слой или слой паклитаксела. 23. Способ по одному из пп.18-22, отличающийся тем, что дополнительно вводят и/или наносят паклитаксел в и/или на по меньшей мере один биодеградируемый и/или биостабильный слой или гемосовместимый слой. 24. Способ по п.23, отличающийся тем, что паклитаксел наносят, и/или вводят посредством погружения или напыления на и/или в по меньшей мере один биодеградируемый и/или биостабильный слой или гемосовместимый слой, и/или связывают путем ковалентного и/или адгезивного связывания по меньшей мере с одним биодеградируемым и/или биостабильным слоем или гемосовместимым слоем. 25. Способ по любому из пп.18-24, отличающийся тем, что биостабильный и/или биодеградируемый слой ковалентно и/или адгезивно связывают на поверхности медицинского устройства, а гемосовместимый слой ковалентно связывают с биостабильным и/или биодеградируемым слоем и полностью или частично покрывают им биостабильный и/или биодеградируемый слой. 26. Способ по любому из пп.18-25, отличающийся тем, что гемосовместимый слой содержит гепарин нативного происхождения, региоселективно синтезированные производные с различными коэффициентами сульфатации и коэффициентами ацилирования в интервале молекулярных масс пентасахарида,который определяет антитромботическую активность, вплоть до стандартной молекулярной массы имеющегося в продаже гепарина молекулярной массы 13 кДа, гепарансульфат и его производные, олигои полисахариды эритроцитарного гликокаликса, десульфатированный и N-реацетилированный гепарин,N-карбоксиметилированный и/или частично N-ацетилированный хитозан, а также смеси данных субстанций. 27. Способ по любому из пп.18-26, отличающийся тем, что в качестве биодеградируемых субстанций для биодеградируемого слоя используют поливалеролактоны, полидекалактоны, полилактоновую кислоту, полигликолевую кислоту, полилактиды, полигликолиды, сополимеры полилактидов и полигликолидов, поликапролактон, полигидроксибутановую кислоту, полигидроксибутираты, полигидроксивалераты, полигидроксибутиратсовалераты, поли(1,4-диоксан-2,3-дионы), поли(1,3-диоксан-2-он), полипарадиоксаноны, полиангидриды, в частности полималеиновые ангидриды, полигидроксиметакрилаты,фибрин, полицианоакрилаты, поликапролактондиметилакрилаты, поли-b-малеиновую кислоту, поликапролактонбутилакрилаты, мультиблокполимеры, в частности олигокапролактондиолы и олигодиоксанондиолы, мультиблокполимеры полиэфиров сложных эфиров, в частности ПЭГ и поли(бутилентерефталаты), полипивотолактоны, триметилкарбонаты полигликолевой кислоты, поликапролактонгликолиды,поли(g-этилглутамат), поли(DTH-иминокарбонат), поли(DTE-со-DT-карбонат), поли(бисфенол-А-иминокарбонат), полиортоэфиры, триметилкарбонаты полигликолевой кислоты, политриметилкарбонаты, полииминокарбонаты, поли(N-винил)пирролидон, поливиниловые спирты, полиэфирамиды, гликолированные полиэфиры, полифосфоэфиры, полифосфазены, поли[(р-карбоксифенокси)пропан], полигидроксипентановую кислоту, полиангидриды, полиэтиленоксид-пропиленоксид, мягкие полиуретаны, полиуретаны с аминокислотными остатками в скелете, сложные эфиры полиэфиров, в частности полиэтиленоксид, полиалкеноксалаты, полиортоэфиры, а также их сополимеры, липиды, каррагенаны, фибриноген,крахмал, коллаген, полимеры на белковой основе, полиаминокислоты, синтетические полиаминокислоты, зеин, модифицированный зеин, полигидроксиалканоаты, пектиновую кислоту, актиновую кислоту,модифицированный и немодифицированный фибрин и казеин, карбоксиметилсульфат, альбумин и, кроме того, гиалуроновую кислоту, хитозан и его производные, гепарансульфаты и их производные, гепарин, хондроитинсульфат, декстран, -циклодекстрины, сополимеры с ПЭГ и полипропиленгликолем,гуммиарабик, гуаровую камедь, желатин, коллаген, коллаген-N-гидроксисукцинимид, липиды, фосфолипиды, модификации и сополимеры и/или смеси указанных субстанций. 28. Способ по любому из пп.18-27, отличающийся тем, что в качестве биостабильных субстанций для биостабильного слоя используют полиакриловую кислоту и полиакрилаты, в частности полиметилметакрилат, полибутилметакрилат, полиакриламид, полиакрилнитрилы, полиамиды, полиэфирамиды,- 17009092 полиэтиленамин, полиимиды, поликарбонаты, поликарбоуретаны, поливинилкетоны, поливинилгалогениды, поливинилиденгалогениды, поливиниловые эфиры, полиизобутилены, поливинилароматические соединения, поливиниловые сложные эфиры, поливинилпирролидоны, полиоксиметилены, политетраметиленоксид, полиэтилен, полипропилен, политетрафторэтилен, полиуретаны, полиэфируретаны, силиконполиуретановые эфиры, силиконполиуретаны, силиконполикарбонатуретаны, полиолефиновые эластомеры, полиизобутилены, сополимеры EPDM, фторсиликоны, карбоксиметилхитозаны, полиарилэфирэфиркетоны, полиэфирэфиркетоны, полиэтилентерфталат, поливалераты, карбоксиметилцеллюлозу,целлюлозу, вискозное волокно, триацетатные волокна, целлюлозонитраты, целлюлозоацетаты, гидроксиэтилцеллюлозу, целлюлозобутираты, целлюлозоацетатбутираты, этилвинилацетатные сополимеры, полисульфоны, эпоксидные смолы, сополимеры ABS, сополимеры EPDM, силиконы, в частности полисилоксаны, полидиметилсилоксаны, поливинилгалогены и сополимеры, целлюлозные эфиры, целлюлозотриацетаты, хитозаны и сополимеры и/или смеси данных субстанций. 29. Способ по любому из пп.18-28, отличающийся тем, что нанесение полисахаридов формулы 1 по п.1 осуществляют посредством гидрофобных взаимодействий, вандерваальсовых сил, электростатических взаимодействий, водородных связей, ионных взаимодействий, перекрестных сшивок полисахаридов и/или путем ковалентного связывания. 30. Способ по любому из пп.18-29, отличающийся тем, что дополнительно вводят или наносят в и/или на гемосовместимый слой или биостабильный и/или биодеградируемый слой один из следующих активных агентов: симвастатин, натриевую соль 2-метилтиазолидин-2,4-дикарбоновой кислоты, макроциклическую закись (MCS), производные MCS, активированный белок С (аРС), пентаэритритола тетранитрат (PETN), трапидил, -эстрадиол, а также смеси данных активных агентов или смеси одного из данных активных агентов с паклитакселом. 31. Медицинское устройство, контактирующее с кровью, отличающееся тем, что оно получено посредством одного из способов по любому из пп.18-30.
МПК / Метки
МПК: A61L 31/16, A61L 33/08, A61K 31/727
Метки: поверхность, устройства, варианты, способ, покрытием, медицинского, покрытия, гемосовместимого, предупреждения, рестеноза, устройство, нанесения, медицинское
Код ссылки
<a href="https://eas.patents.su/21-9092-medicinskoe-ustrojjstvo-s-pokrytiem-dlya-preduprezhdeniya-restenoza-varianty-i-sposob-naneseniya-gemosovmestimogo-pokrytiya-na-poverhnost-medicinskogo-ustrojjstva.html" rel="bookmark" title="База патентов Евразийского Союза">Медицинское устройство с покрытием для предупреждения рестеноза (варианты) и способ нанесения гемосовместимого покрытия на поверхность медицинского устройства</a>
Предыдущий патент: Способ получения катализатора, катализатор, способ получения неочищенного продукта и неочищенный продукт
Следующий патент: Способ защиты молекулярного сита sapo от потери каталитической активности
Случайный патент: Лечебный и косметический состав для лечения аллергических и иммунологических кожных заболеваний












