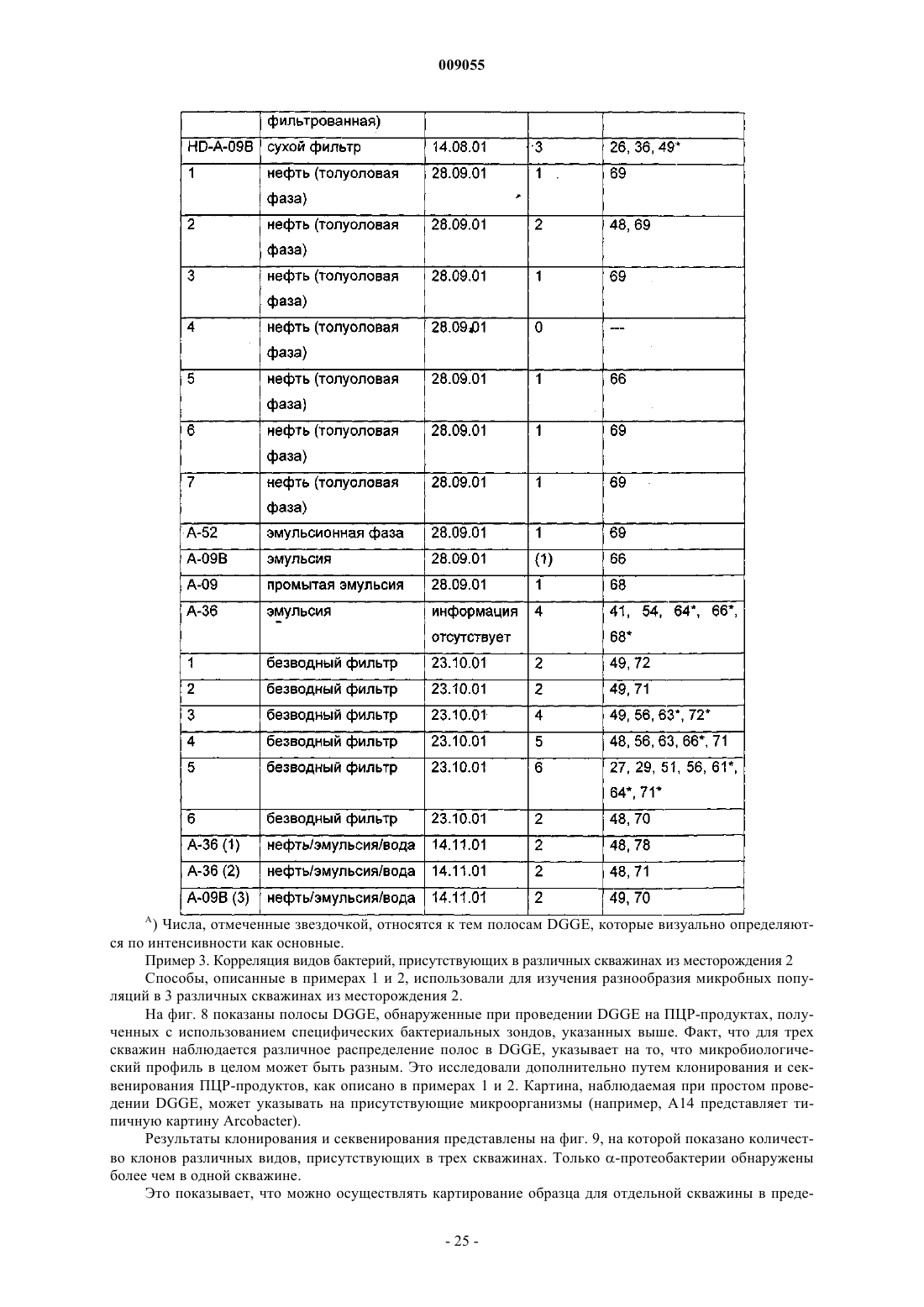
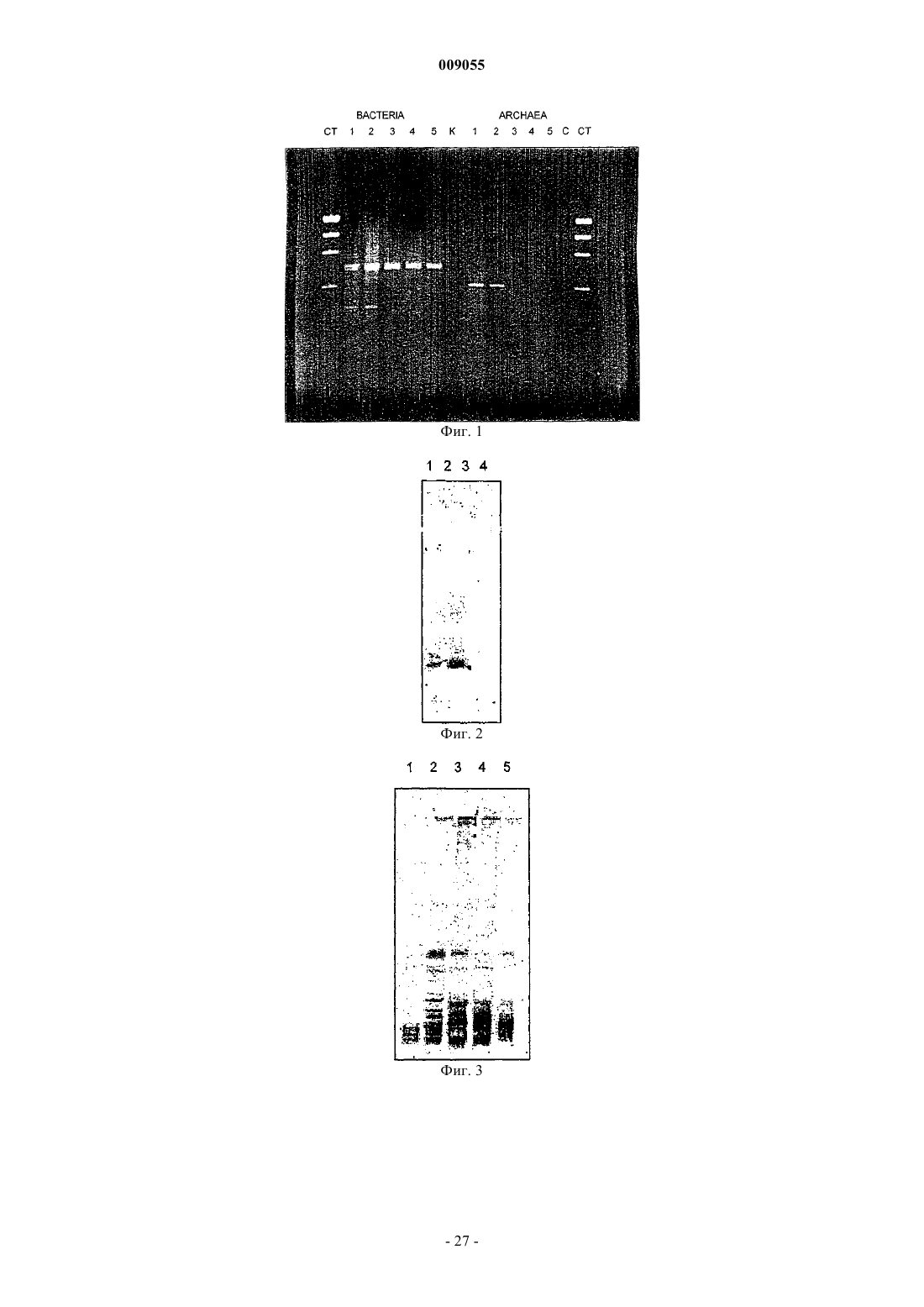
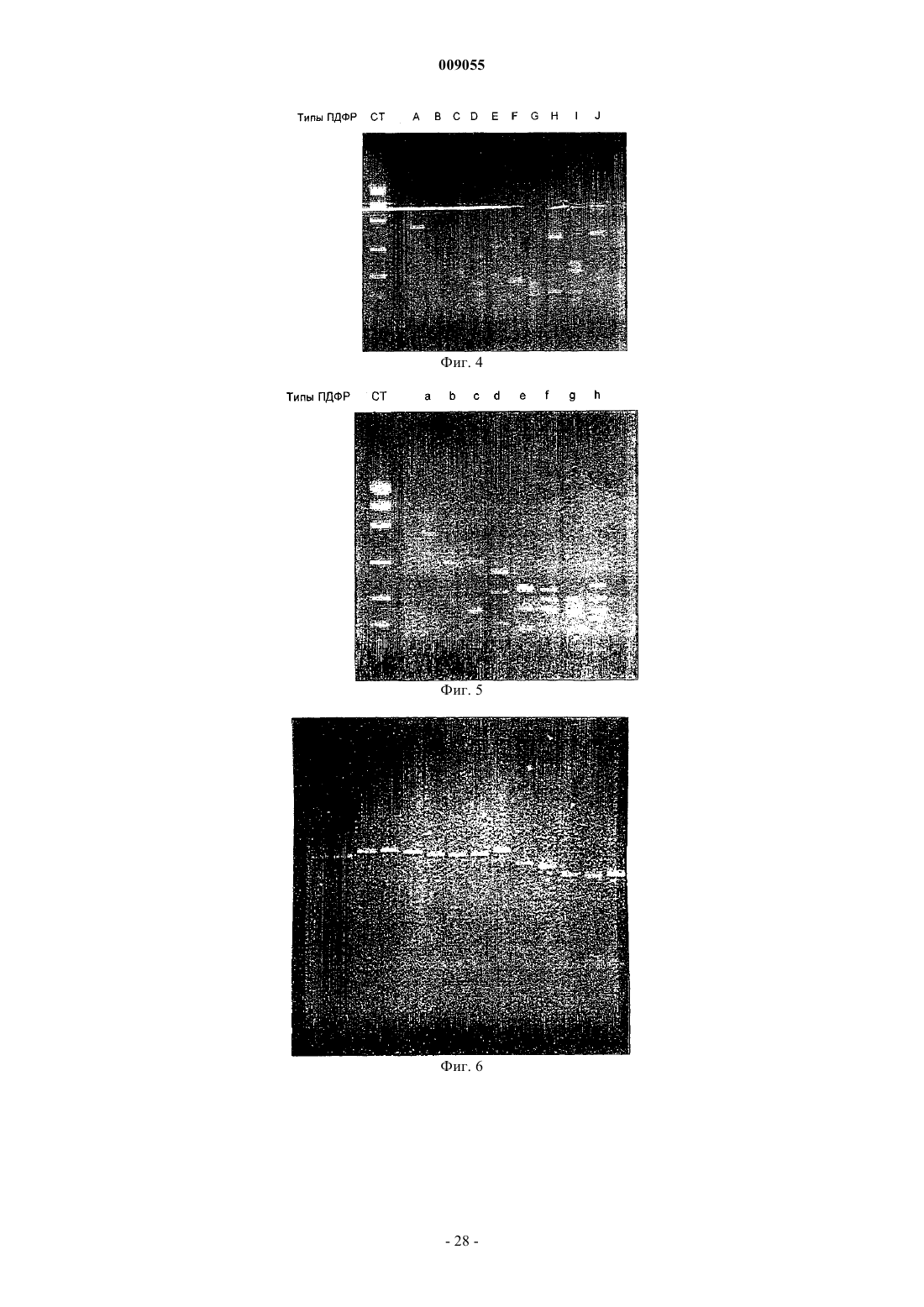
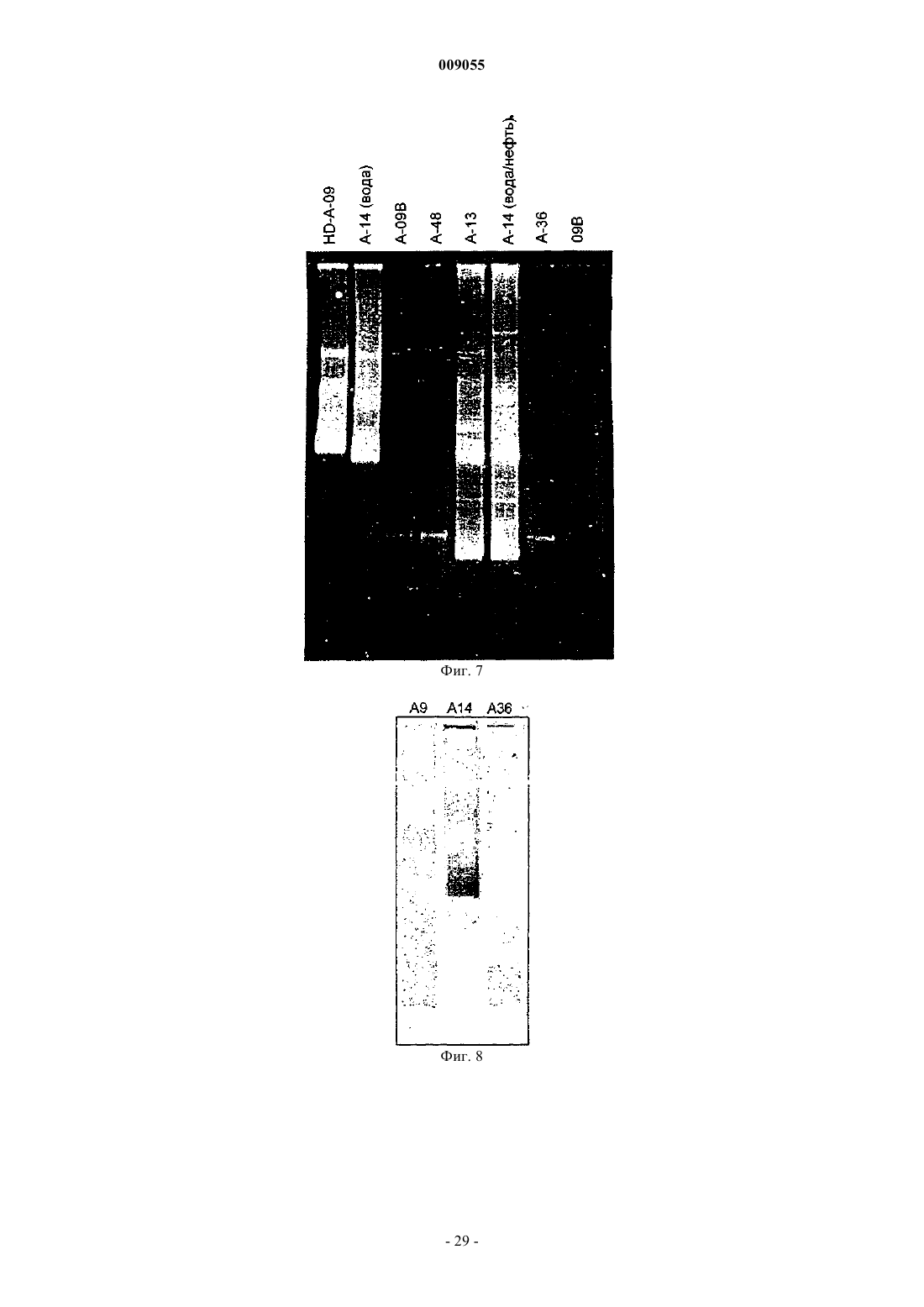
Способы обнаружения, характеристики и мониторинга углеводородных месторождений
Номер патента: 9055
Опубликовано: 26.10.2007
Авторы: Руэслаттен Хакон Гуннар, Котлар Ханс Кристиан, Рамстад Марит Валеур, Бракстад Одд Гуннар
Формула / Реферат
1. Способ обнаружения, характеристики или мониторинга углеводородной зоны, включающий генотипический анализ образца на присутствие одного или более чем одного термофильного или экстремофильного микроорганизма, где указанная характеристика включает в себя корреляцию присутствия одного или более чем одного указанного микроорганизма со свойствами рассматриваемых углеводородов.
2. Способ по п.1, где образец получен из подповерхностной формации.
3. Способ по п.1 или 2, где образец представляет собой нефть, воду или смесь нефть/вода из разведочной или эксплуатационной скважины.
4. Способ по любому из пп.1-3, где образец представляет собой нефть или воду, которая контактировала с нефтью.
5. Способ по любому из пп.1-4, где информацию относительно присутствующих микроорганизмов используют в процессе непрерывной разведки и добычи.
6. Способ по любому из пп.1-5, где обнаруживают множество различных микроорганизмов, получая при этом микробиологический профиль указанного образца.
7. Способ по п.6, где полученный микробиологический профиль сравнивают с одним или более эталонными профилями.
8. Способ по любому из пп.1-7, где образец анализируют на присутствие Archaeglobus, Erythrobacter, Arcobacter, Geothermobacter, Thermodesulforhabdus и Thermotogales.
9. Способ по любому из пп.1-8, не включающий стадию культивирования.
10. Способ по любому из пп.1-9, где образец приводят в контакт с одним или более чем одним другим олигонуклеотидом, сконструированным для гибридизации с областями нуклеиновой кислоты из или происходящих из термофильных, или экстремофильных микроорганизмов.
11. Способ по любому из пп.1-10, где, по меньшей мере, некоторые из нуклеиновых кислот в образце амплифицируют.
12. Способ по любому из пп.1-11, где углеводородную зону характеризуют таким образом, что получают информацию о типе нефти, количестве нефти, качестве нефти, содержании серы в нефти, присутствии газа или соотношении газ/нефть.
13. Способ по любому из пп.1-11, где углеводородную зону характеризуют таким образом, что определяют глубину углеводородной зоны, причем конкретные идентифицированные микроорганизмы указывают на определенную глубину.
14. Способ по любому из пп.1-11, где углеводородную зону характеризуют таким образом, что определяют миграционный путь указанной углеводородной зоны.
15. Способ по п.13 или 14, где углеводородная зона представляет собой нефтяное месторождение.
16. Способ по любому из пп.1-15, где генотипический анализ выполняют с использованием одного или более чем одного зонда из группы, представленной SEQ ID No. 1-SEQ ID No. 19.
17. Олигонуклеотид, как он определен в любой из SEQ ID No. 5-SEQ ID No. 19, или его функционально эквивалентный вариант.
18. Твердый носитель с присоединенным к нему одним или более чем одним олигонуклеотидом по п.17.
19. Твердый носитель по п.18, представляющий собой микрочип.
20. Твердый носитель по п.18 или 19, имеющий по меньшей мере 4 присоединенных к нему олигонуклеотида по п.17.
21. Набор для применения в способе по любому из пп.1-16, включающий один или более чем один олигонуклеотид по п.17.
Текст
009055 Настоящее изобретение относится к области бурения, разведки и добычи нефти, в частности, к новым и улучшенным способам идентификации и мониторинга источников углеводородов (известных как углеводородные зоны) в земной коре (как правило, заключенных в осадочных горных породах). Разведка углеводородов (как правило, нефти, т.е. природного газа или нефти, например сырой нефти) является очень дорогостоящей, и для получения данных, которые используются для точного определения подходящих областей для разведывательного бурения и идентификации геологических формаций, которые могут содержать запасы нефти, применяют множество геофизических и петрофизических способов. Характеристику и идентификацию нефти и пластовой воды, как правило, осуществляют с помощью петрофизических измерений в скважине или с помощью геохимического анализа образцов жидкости, но результаты анализа могут быть трудны для интерпретации с точки зрения полезной информации, касающейся важных аспектов разведки или добычи, таким образом, существует постоянная потребность в улучшенных или альтернативных способах идентификации и характеристики углеводородов в геологических формациях и месторождениях. Настоящее изобретение улучшит интерпретацию благодаря введению новой и независимой совокупности данных, которая также может обеспечить информацию о миграционных путях нефти из материнской породы в месторождение(я) и выступать в качестве специфического индикатора в жидкостях на стадии добычи. Разведочные скважины бурят в районах, представляющих интерес, и желательно использовать эти скважины для получения информации об этом месте, в частности, присутствуют ли в нем углеводороды и на каких глубинах. Образцы керна, полученные из этих скважин, могут быть проанализированы на присутствие углеводородов, и в настоящее время этот анализ обычно осуществляют с помощью петрофизических или геохимических способов. Однако результаты этих анализов часто трудно интерпретировать, поэтому существует постоянная потребность в улучшенных или альтернативных способах идентификации углеводородных зон. Кроме того, известные в настоящее время способы, которые можно было бы использовать для определения того, получен ли данный углеводородный образец из конкретного месторождения, не надежны. Сложно определять местонахождение индикаторов в различных породах-коллекторах, и геохимические способы, основанные, например, на хроматографической характеристике ('fingerprint') нефти в образце могут оказаться не достаточно специфичными, поскольку использование этого способа затрудняет различение похожих образцов нефти, например 2 образцов легкой парафиновой нефти, которые оба обогащены н-алканами. В патенте США 5055397 описан геомикробиологический способ разведки, в котором используют"индикаторные" (pathfinder) соединения для идентификации районов, представляющих потенциальный интерес в отношении разведки нефти. Взаимосвязь этих "индикаторных" соединений, например тяжелых металлов, с присутствием нефти использовали в качестве основы для этого способа. Утверждают, что бактерии, которые демонстрируют устойчивость к тяжелым металлам, представляющим интерес, демонстрируют генетически запрограммированную устойчивость к тяжелым металлам, и поэтому утверждают,что их присутствие указывает на возможное присутствие нефти. Анализируют также устойчивость к углеводородам. Для этого способа необходимы живые образцы, хотя культура не всегда требуется. Этот способ основан на тестировании острой токсичности с использованием стандартного набора бактериальных инокулятов и не связан с тестированием природных микробов для характеристики углеводородного источника. Потребность в живых образцах означает, что тесты не могут быть повторены и, таким образом, проверены после даты тестирования. Согласно описанным здесь новым способам живые образцы не требуются. Кроме того, тесты из уровня техники основаны на присутствии значительных количеств микробов и/или параллельном тестировании образцов относительно ряда различных тяжелых металлов или углеводородов. Кроме того, концентрации токсинов, используемых в анализах, должны быть тщательно выверены,поскольку ионы, органические соединения и рН влияют на токсичность металла. Хотя этот способ является одним из способов идентификации потенциального местоположения нефтяных пластов, очевидно,что имеются значительные недостатки в этом непрямом способе оценки фенотипа бактерий, т.е. их способности преодолевать геохимические препятствия, которые связаны с присутствием нефтехимических соединений. Присутствие бактерий, которые устойчивы к тяжелым металлам, не всегда может быть надежным индикатором наличия тяжелых металлов в этой области, и аналогично, наличие тяжелых металлов не всегда строго коррелирует с наличием углеводородов. Поэтому необходим новый и улучшенный способ более прямой корреляции присутствия микробов с углеводородными зонами. Другие известные способы геомикробиологической разведки основаны на ключевом предположении, что углеводородные месторождения дают течь, и вытекшие углеводороды достигают земной поверхности, которая может представлять собой дно моря. Таким образом, предполагают, что присутствие метанообразующих бактерий на поверхности является индикатором присутствия углеводородных зон (Rawat et al. Proc. Second Seminar on Petroliferous Basins of India Vol. 3 S. K. Biswas etal. (Eds) 1994 Indian Petroleum Publishers). Этот способ основан на способности осуществлять корреляцию присутствия бактерий, использующих метан, с удаленным месторождением. В этой работе, в частности, описывается применение мано-1 009055 метрического способа измерения использования жидкого нефтяного газа и пропана в восходящем газоотводе. Корреляция достоверна только в том случае, когда геология этого района относительно несложна, поскольку в противном случае метан может мигрировать в стороны на значительные расстояния. Таким образом, этот весьма грубый способ должен сочетаться с геологическим, геофизическим и гидрохимическим анализом. Кроме того, этот способ основан исключительно на фенотипических признаках рассматриваемых бактерий, т.е. использовании ими углеводородов, и это до некоторой степени является ограничением. Таким образом, даже если, например, проводить изыскания на присутствие генов, кодирующих белки,относящиеся к утилизации углеводородов, это не обязательно будет свидетельствовать о наличии углеводородов, поскольку гены, отвечающие за утилизацию/деградацию углеводородов, широко встречаются в природе, даже в нетронутых полярных областях и глубоководных морских впадинах. Таким образом,бактерии, использующие метан, могут быть обнаружены в областях, которые не связаны с углеводородными месторождениями. Например, метаногенные бактерии могут быть обнаружены в эвтрофных озерах, в морской воде и биотопах или в естественной среде обитания, которая не связана непосредственно с углеводородными месторождениями. Детектируемые и используемые метаногенные бактерии, как правило, обнаруживаются на клеточной поверхности, и они не способны жить при высоких температурах,т.е. они не являются термофилами или экстремофилами. Таким образом, требуются способы, которые обеспечивают строгое и локализованное указание на наличие углеводородных зон, а также демонстрируют хорошую воспроизводимость и способность осуществлять прямое измерение. В настоящее время предложено использовать взаимосвязь между присутствием определенных видов бактерий и углеводородных зон для получения нового способа идентификации, характеристики и мониторинга углеводородных зон. Определенные микроорганизмы, как правило, бактерии, живут исключительно или преимущественно в углеводородных зонах или вокруг них, и могут использовать компоненты нефти или компоненты газа в качестве источников энергии. Эти бактерии можно использовать в качестве индикаторов наличия углеводородов или для определения некоторых свойств этих углеводородов. Авторы изобретения собрали информацию из двух разных месторождений и разных скважин в пределах этих месторождений для того, чтобы продемонстрировать разнообразие микробиологического профиля этих разных образцов. Хотя бактериальные образцы ранее были выделены из образцов, полученных из этих месторождений, это первое выявление корреляции между определенным микробиологическим профилем и образцом из конкретной скважины. Бактерии, идентифицированные в этих исследованиях, могут жить при высоких температурах и поэтому называются термофилами или экстремофилами. Термофилы определяются как организмы, которые могут переносить высокие температуры и оптимально растут при температурах выше 50 С. Экстремофилы представляют собой организмы, которые оптимально растут в экстремальных условиях, например при экстремальных значениях температуры, давления, рН или солености. Анализируемые микроорганизмы предпочтительно будут местными для углеводородных зон. Таким образом, данное изобретение относится к способу обнаружения, характеристики или мониторинга углеводородной зоны, включающему генотипический анализ образца на наличие одного или более чем одного (целевого) термофильного или экстремофильного микроорганизма. Углеводородный источник, как правило, находится в подповерхностной формации, и поэтому образцы отбирают из этой формации или из естественных выходов нефти, нефтяных пластов или добываемой нефти. Настоящее изобретение широко используется при разведке, когда особый интерес представляет обнаружение и характеристика потенциальных углеводородных зон (источников). Однако оно применимо также в том случае, когда добыча уже началась, поскольку это позволяет осуществлять мониторинг добываемой нефти и области в скважинах и вокруг них, т.е. постоянно или периодически наблюдать за условиями добычи. В некоторых воплощениях анализируемые термофильные или экстремофильные микроорганизмы не будут "целевыми" микроорганизмами в том смысле, что их идентичность известна до применения данного способа, точнее генотипическая информация будет собрана и использована для характеристики микроорганизмов, присутствующих в данном образце. Поэтому в качестве альтернативы в настоящем изобретении предложен способ обнаружения, характеристики или мониторинга углеводородного источника, например мониторинга добычи углеводородов из различных продуктивных зон месторождения,включающий генотипический анализ термофильных или экстремофильных микроорганизмов в образце. Природа образца более подробно обсуждается ниже, но, как правило, представляет собой образец, собранный из добываемых жидкостей (например нефти, воды или смесей нефть/вода) из разведочных и эксплуатационных скважин или выбуривания цилиндрического керна из пород-коллекторов с помощью полой цилиндрической бурильной трубы (даже обломки выбуренной породы могут быть использованы для экстракции типичных образцов нефти и воды), или образец может представлять собой образец, полученный из выходов углеводородов на морском дне или на побережье; в верхнем горизонте почвы или на поверхности почвы."Нефть" или "углеводород" используют в качестве общих терминов для природного газа, конденсатов, сырой нефти, тяжелой сырой нефти или твердого битума, обнаруженного в пористых горных породах. Сырая нефть представляет собой сложную смесь природных углеводородных соединений. Способы по изобретению можно рассматривать в качестве "диагностических". Другими словами,информацию, полученную путем анализа микроорганизмов в образце из места разведки/добычи затем используют при дальнейшей эксплуатации этого участка. Авторы настоящего изобретения показали, что специфичность и качество информации, полученной путем генотипического анализа имеющихся микроорганизмов, таковы, что дают возможность для значимых заключений о достижении углеводородного источника. Таким образом, в предпочтительных воплощениях способов по изобретению информацию,касающуюся присутствующих микроорганизмов, используют в непрерывном способе разведки или добычи. Обнаружение углеводородного источника относится к способу идентификации наличия углеводородного источника в земной коре, т.е. в подповерхностной формации. Он включает в себя способ обнаружения залежей углеводородов, заключенных в пористых горных породах в земной коре; называемых нефтяными месторождениями. Нефтяное месторождение должно быть локализовано с точки зрения долготы, широты и глубины. Попытки обнаружения обычно называют разведкой. Характеристика углеводородной зоны по изобретению, например характеристика нефти в месторождении, может включать в себя корреляцию присутствия одного или более чем одного целевого микроба со свойствами рассматриваемых углеводородов. Характеристика может осуществляться как часть способа обнаружения, или она может осуществляться после того, как будет проведена первоначальная идентификация (предполагаемой) углеводородной зоны. Например, тип нефти, количество нефти, качество нефти, содержание серы в нефти, наличие газа или соотношение газ/нефть представляют собой факторы,по которым требуется информация. Кроме того, может быть определено наличие асфальтенов, смол и фракции NSO (т.е. соединений, несущих азот, серу и кислород). Тот факт, что эти свойства будут влиять на бактериальную флору, означает, что можно идентифицировать взаимосвязь между популяциями микроорганизмов и этими свойствами, поскольку различные микроорганизмы будут развиваться в различных условиях, например доступности серы, которая может утилизироваться некоторыми бактериями. Помимо качественного анализа может быть использован также полуколичественный анализ с использованием микромассивов (микрочипов) и количественный анализ с использованием индексов разнообразия картин пептидного картирования. Глубина углеводородного источника может быть идентифицирована путем анализа микроорганизмов, поскольку различные микроорганизмы живут на различных глубинах. Таким образом, может быть получена картина или пептидная карта углеводородного источника с точки зрения его микробиологической популяции. Полученную картину можно сравнивать с эталонными картинами, полученными из известных, хорошо описанных углеводородных зон. Это может относиться к месторождениям, участкам месторождений или зонам месторождений. Таким образом, стадия сравнения информации, полученной для микроорганизмов, присутствующих в образце, с базой данных о микроорганизмах, обнаруженных в других образцах, представляет предпочтительную дополнительную стадию в способах по настоящему изобретению. Сведения об эталонных образцах могут быть затем использованы для получения заключения о свойствах нового образца. Под "мониторингом" подразумевают, что наблюдение за добычей из нефтяного месторождения или зоны месторождения осуществляется в зависимости от времени. Образцы добываемой нефти (или воды) могут анализироваться с регулярными интервалами, что составляет часть процесса мониторинга, и могут быть обнаружены изменения в их микробной популяции. Эти изменения в популяции микробов могут быть использованы для получения заключения о добыче нефти из различных зон месторождения в смешанной схеме добычи (при условии, что их собственные микробные популяции различаются), а также для получения заключения о способе нагнетания воды из нагнетающей скважины в эксплуатационную скважину. Таким образом можно следить за динамическим поведением месторождения без сложного геохимического анализа или путем использования искусственных индикаторных соединений, которые должны быть введены в месторождение и добыты назад с нефтью или водой. Термофильные и экстремофильные микробы также ассоциируются с рядом проблем, связанных с нефтяным месторождением, таких как коррозия, околоскважинная закупорка и закисление месторождения. Многие из этих проблем связаны с активностью микроорганизмов, утилизирующих серу. Высокое содержание небольших органических кислот во многих месторождениях в сочетании с бескислородными условиями, а также концентрации сульфата и водорода важны для активности строго анаэробных сульфидогенных и метаногенных микробов. Микробные консорции были обнаружены в месторождениях, с которыми не были связаны какие-либо микробные проблемы, без какого-либо проникновения нагнетаемой воды и при температурах выше 80 С. Это указывает на то, что многие горячие нефтяные месторождения населены местной флорой, которая не была привнесена с буровыми растворами или нагнетаемой водой и которая может быть стимулирована в специфических условиях месторождения. В процессе добычи можно наблюдать за изменением этой флоры, для того чтобы избежать усиления нежелательного роста с последующими проблемами в месторождении, как описано выше. Такие способы также можно рассматривать как "мониторинг".-3 009055 Кроме того, высокая чувствительность бактериальных популяций к изменениям условий их роста может представлять собой систему раннего предупреждения об изменениях, которые уже произошли,таких как биообрастание (например, продуцирование H2S или закупорка). Например, Archaeglobus присутствует в высокосернистых месторождениях (т.е. месторождениях, которые содержат свободную серу) и, таким образом, может быть использован в качестве системы раннего предупреждения о наличии продуцирования H2S. Arcobacter также может присутствовать в горячих нефтяных месторождениях. Они окисляют восстановленные соединения серы (например, H2S), и их присутствие, таким образом, также будет указывать на возможное закисление месторождения. Другие бактерии ассоциируются с другими изменениями химических условий в месторождении. В этом случае, месторождение, из которого берут образец, может представлять собой разрабатываемое месторождение, и образец может представлять собой нефть или углеводород, непосредственно взятые из месторождения, или скважинную воду и т.д. Такая информация о поведении углеводородной зоны (например, насыщение флюидом) в зависимости от времени также может быть получена из совокупности данных, относящихся к конкретным видам или типам видов, которые присутствуют в образце. Исследования микробов из горячих месторождений, известные из уровня техники, основаны на культивировании в специфических синтетических обогащенных средах с последующим выделением и характеристикой растущих организмов. Однако, большинство экстремофилов, живущих в таких областях, трудно культивировать. Таким образом, настоящее изобретение, в котором предложен способ, не зависящий от культуры, представляет собой значительное преимущество по сравнению с уровнем техники. Для способов корреляции присутствия микробов с изменениями свойств нефтяного месторождения может быть желательно иметь только один или два вида целевого микроорганизма, например Archaeglobus. Например, на продуцирование H2S может указывать присутствие серувосстанавливающих бактерий(SRB). Это является проблемой при добыче нефти, поскольку SRB могут вызывать закисление месторождения в результате метаболизма сульфата. Закисление месторождения и продуцирование H2S представляет собой проблему при добыче нефти, поскольку H2S должен быть удален из добываемых потоков. Кроме того, углеводород с высоким содержанием сульфида является менее ценным, чем чистый углеводород. Отложения сульфидов железа в месторождении также являются особенностью закисления месторождения (биообрастание). Таким образом, способы обнаружения SRB в разрабатываемых месторождениях обычно обеспечивают хорошее представление с ранним предупреждением о продуцировании H2S и возможностью для раннего вмешательства. Помимо продуцирования H2S, микробиологический профиль разрабатываемых месторождений может быть использован для обзора наличия бактерий, которые, как известно, образуют большие биомассы,обладающие закупоривающим потенциалом. При наличии закупоривания обнаруживаются значительные количества сульфатредуцирующих микроорганизмов. Другие микроорганизмы также могут отвечать за это. Например, в горячих нефтяных месторождениях были идентифицированы Archaeoglobus, Acinetobacter, Desulfotomaculum, Methanobacterium, Methanococcus, Methanoculleus, Nanobacterium, Petrotoga,Pseudomonas, Geothermobacter, Ralstonia, Sphingomonas, Spirochaeta, Thermoanaerobacter, Thermococcus,Therrnotogales, Thermodesulfobacterium, Thermodesulforabdus, Thermodesulforhabdus, Thermotoga, помимо других микроорганизмов, филогенетически родственных Erythrobacter, Arcobacter, Aquabacterium, Peptostreptococcus, Pseudomonoas и Archaeoglobus. С другой стороны, раннее вмешательство предотвратит дорогостоящие процедуры очистки. Помимо обеспечения раннего предупреждения о возможных проблемах с месторождением, способы мониторинга по изобретению могут быть использованы для оценки развития способов, используемых для преодоления ранее идентифицированных проблем. В изобретении может быть использован любой образец, например, из самой углеводородной зоны,которая может включать в себя зону выхода нефти, способную поддерживать микробную популяцию. В частности, образец может быть определен как любой встречающийся в природе образец (например, земля, пыль, сланец или нефть), содержащий жидкий углеводород и/или воду, которая ранее контактировала с углеводородом. Состав микробной популяции, как правило, чувствителен либо к присутствию углеводородов, либо к изменениям свойств углеводородов. Микробная популяция образца может быть только опосредованно чувствительна к присутствию углеводородов. Например, анализ образцов из известных месторождений указывает на то, что горная порода вблизи углеводородного источника или даже горная порода, которая часто, но не всегда, ассоциируется с углеводородным источником, будет содержать определенные популяции микроорганизмов. Образец предпочтительно представляет собой образец керна,полученный из разведочной скважины или скважинной воды. Образец керна можно проанализировать в различных точках, т.е. применительно к различным глубинам в коре. Для того чтобы провести анализ,керновые образцы могут быть измельчены или разрушены и затем смешаны с буферами для обеспечения возможности выделения микробного материала для анализа. Микробный материал может представлять собой, например, сами микроорганизмы, но предпочтительно представляет собой нуклеиновую кислоту,экстрагированную из них. Образцы могут быть для удобства профильтрованы через мембранные фильт-4 009055 ры, улавливающие микроорганизмы на поверхности фильтра. Буфер, используемый на этой стадии, будет зависеть от типа дальнейшего анализа образца и природы образца. Различные способы экстракции,которые могут быть использованы, описаны в примерах. Образец может не являться поверхностным образцом, например, образцом, полученным с поверхности или из верхних 2 м почвы или осадка; причем эта поверхность находится в прямом контакте с воздухом или водой. Образец предпочтительно берут из керна, пересекающего потенциальные углеводородсодержащие формации. Особенно в тех случаях, когда добыча уже начата, образец может состоять из углеводородов или включать в себя углеводороды, например, он может представлять собой образец нефти. Его анализ позволит охарактеризовать сам углеводород. Добыча нефти (как правило, нефти и газа, заключенных в осадочных горных породах в земной коре) является очень дорогой, и множество типов данных (в основном, геофизических и петрофизических данных) используют для идентификации геологических формаций, которые могут содержать залежи нефти. В качестве альтернативы, образец может представлять собой осадочные отложения из зоны выхода нефти на дне моря или, для задач характеристики или мониторинга, образец может представлять собой образец нефти. Если образец представляет собой нефть, то микроорганизмы и нуклеиновые кислоты отделяют от нефти, используя детергент, такой как додецилсульфат натрия, промывая нефть водным буфером или путем экстракции смесью фенол/хлороформ/изоамиловый спирт. Это обычно комбинируют с механическим разрушением, получаемым в результате перемешивания в суспензии небольших пластмассовых гранул, также возможно в присутствии химических соединений для экстракции нуклеиновых кислот, таких как фенол-хлороформ. Такие способы хорошо известны из уровня техники. Для экстракции нуклеиновых кислот также имеются коммерческие наборы. Если образец представляет собой воду,то его фильтруют через фильтры 0,22 мкм перед обработкой. Образец также может представлять собой смесь нефти и воды или любого другого вещества, которое экстрагировано из эксплуатационной скважины. Он может представлять собой также пластовую воду (воду месторождения), воду или осадочные отложения из зон выхода нефти. Анализ образца может быть осуществлен многими путями. Важно, что анализ является генотипическим, а не фенотипическим, поскольку это дает возможность получить более точную картину микробной популяции в образце. Особенно предпочтительными являются способы, которые не зависят от какоголибо культивирования микроорганизмов в образце. Еще одно преимущество настоящего способа заключается в том, что для проведения анализа не обязательно, чтобы образцы содержали живые микроорганизмы. Специфичность взаимодействий нуклеиновая кислота/нуклеиновая кислота или белок/нуклеиновая кислота означает, что достоверные результаты могут быть получены уже на небольшом образце без необходимости культивирования. Кроме того, в бактериальном геноме имеются области,которые являются высококонсервативными между видами бактерий, и другие области, которые являются видоспецифическими. Таким образом, для получения информации об общей популяции бактерий, о классах родственных бактерий или об индивидуальных видах в качестве мишеней могут быть использованы эти области. В настоящем изобретении предпочтительно предложена информация, касающаяся микробиологического профиля образца. "Микробиологический профиль" будет варьировать в зависимости от обстоятельств, и он может быть таким, что определение "микробиологического профиля" будет включать в себя только подтверждение наличия или отсутствия одного целевого микроорганизма или класса микроорганизмов, которые рассматриваются в качестве индикаторов определенной чистоты углеводорода, или, и это может быть более подходящим во время добычи, а не во время разведки, индикатором проблемы со скважиной, такой как быстрое размножение микроорганизмов, продуцирующих H2S. Однако предпочтительно микробиологический профиль будет включать в себя качественную (и,возможно, количественную) информацию о более чем одном виде или классе микроорганизмов. Это означает, что будут проводиться серии отдельных, а, возможно, одновременных тестов на образце, каждый из которых предназначен для выявления определенных видов или класса микроорганизмов. Слово"класс" используют здесь в очень общем смысле для обозначения группы микроорганизмов, которые функционально или таксономически родственны. Поскольку проводимый анализ является генотипическим, то группирование будет осуществляться, как правило, по сходству последовательностей и консервативных областей, например, зонд или праймер может выявлять ряд бактерий посредством гибридизации с последовательностью, которая является консервативной (или по существу консервативной) среди них. Количество проводимых "тестов" будет типично составлять oт 2 до 20, предпочтительно 3 или 4-8. Не обязательно идентифицировать каждый вид, который содержится в образце, поскольку часто можно проводить корреляцию оцениваемого свойства или получать информацию об отличиях месторождения по наличию одного или нескольких видов. Обычно проводят от 2 до 10 тестов, предпочтительно 3 или 4-8, если образцы анализируются одновременно с несколькими зондами. Образец может быть проанализирован на присутствие каждого вида последовательно или одновременно, в зависимости от используемого способа. Если образцы анализируют последовательно, то не существует верхнего предела-5 009055 для количества видов, которые могут быть проанализированы. В предпочтительном воплощении микробиологический профиль образца определяют в одном тесте."Целевые микроорганизмы" могут включать в себя микроорганизмы, которые метаболизируют углеводороды или используют их для роста, однако, предпочтительно, чтобы целевой микроорганизм не был идентифицирован на основе присутствия генов, которые кодируют белки, вовлеченные в метаболизм углеводородов, или по фенотипической способности микроорганизма метаболизировать углеводороды. Эти гены, кодирующие ферменты, вовлеченные в метаболизм углеводородов, широко распространены в природе и не пригодны в качестве точных индикаторов наличия углеводородных зон. Целевые микроорганизмы, как правило, могут включать в себя различные типы бактерий (включая цианобактерии), другие прокариоты и Archaea, включая в себя анаэробные метаногены, анаэробные и аэробные бактерии, метаболизирующие серу, галофильные Archaea и умеренно термофильные Thermoplasmales. Предпочтительные целевые микроорганизмы представляют собой Archaea, микроорганизмы, утилизирующие соединения серы, ферментативные бактерии, редуценты магния и железа, метаногены и ацетогены. Здесь упомянуты специфические микробы, которые могут представлять собой целевые микроорганизмы. Способы по изобретению включают "генотипический анализ" в противоположность фенотипическому анализу, т.е. исследования генетической структуры микроорганизмов посредством прямого анализа нуклеиновой кислоты, а не физической экспрессии генетической информации. Анализируют РНК, но более предпочтительно ДНК. В предпочтительном воплощении изобретения для идентификации и характеристики микроорганизмов используют способы амплификации на основе нуклеиновой кислоты, такие как ПЦР (полимеразная цепная реакция). Применение видоспецифических последовательностей нуклеиновой кислоты представляет очень точный способ типирования микроорганизмов. Например, в бактериальном геноме имеются области, демонстрирующие очень незначительную вариацию от одного вида к другому, и другие области, которые являются высоковариабельными и, по существу, видоспецифическими или даже подтип-специфическими. Для задач идентификации в качестве мишеней могут выступать области генома,которые более или менее вариабельны, в зависимости от того, желательно ли в качестве индикатора присутствия углеводородов использовать один вид микроорганизма или группу микроорганизмов. Аналогично, области генома, которые являются идентичными в группе микроорганизмов, могут быть использованы для идентификации этой группы. Способы работы с нуклеиновой кислотой, такие как ПЦР, также демонстрируют преимущество, заключающееся в том, что нет необходимости осуществлять их непосредственно после выделения образца,в отличие от способов, которые основаны на повторном культивировании или тестировании бактерий,выделенных из образцов. Известно, что культивирование бактерий дает весьма необъективную оценку микробного разнообразия, поскольку трудно верно предсказать условия роста. Определили, что менее 1% всех бактерий было идентифицировано из способов культивирования. Конкретные виды не будут идентифицированы, если используемые культуральные условия не будут оптимальными для их роста. Например, когда для идентификации микроорганизмов из горячих нефтяных месторождений сравнивали способ культивирования и способ с использованием нуклеиновой кислоты, то в способах, которые основаны на выделении и повторном культивировании бактериальных образцов, были идентифицированыArchaeoglobus, Acinetobacter, Desulfotomaculum, Methanobacterium, Methanococcus, Methanoculleus, Nanobacterium, Petrotoga, Pseudomonas, Ralstonia, Sphingomonas, Spirochaeta, Thermoanaerobacter, Thermococcus, Thermodesulfobacterium, Thermodesulforabdus и Thermotoga, тогда как в способах, не зависящих от культивирования, были идентифицированы другие доминантные виды микробов, филогенетически родственных Erythrobacter, Arcobacter, Aquabacterium, Peptostreptococcus, Pseudomonoas и Archaeoglobus. Способы, основанные на культивировании, также требуют много времени, и для их проведения может потребоваться несколько дней или недель. Они также не подходят для анализа на месте, учитывая необходимость специального оборудования для культивирования. В некоторых случаях наиболее исчерпывающая картина микробной флоры может быть получена посредством комбинации независящих и зависящих от культивирования способов. При характеристике путем генотипирования, осуществляемого с использованием ПЦР или других способов, основанных на использовании нуклеиновых кислот, можно хранить образцы, используя способы, которые убивают микробы, не разрушая их ДНК. Примеры таких способов включают в себя замораживание и фиксацию в растворителях, таких как буферы, содержащие этанол, толуол, формальдегид, или сахароза. Таким образом, образцы, содержащие живые или убитые микробы, в равной степени подходят для анализа способами, основанными на использовании нуклеиновых кислот, в противоположность способам, основанном на культивировании, и способу в US 5055397. Таким образом, образцы могут транспортироваться и храниться без потери их полезности. Это также позволяет проводить повторный анализ образцов после периодов хранения, например, для подтверждения результатов или для скрининга микробов, которые могут быть идентифицированы после выделения образца. Таким образом, можно создать более полный профиль, увеличив при этом точность предположений, полученных при использовании этого способа.-6 009055 Образец может содержать лишь небольшое количество индивидуальных микроорганизмов, и может потребоваться значительное количество времени, для того чтобы получить достаточное количество для проведения стандартного микробиологического анализа. В отличие от этого, для способов с использованием нуклеиновых кислот, таких как ПЦР, требуется лишь небольшое количество клеток, и в некоторых случаях результаты могут быть успешно получены путем проведения ПЦР на образцах, содержащих даже единичные клетки. рДНК, или рибосомальная ДНК, присутствует во всех живых организмах и кодирует рибосомальную РНК (рРНК), субъединицы которой связаны с рибосомой. В микробах существует 3 типа рРНК: 5S,16S и 23S. Последовательность этих молекул и, следовательно, кодирующая их ДНК, являются высококонсервативными в эволюции, поскольку рибосомальная РНК имеет одну и ту же функцию в клетках всех жизненных форм. Существуют также области значительной вариабельности. Таким образом, эти последовательности могут быть использованы для определения эволюционной связи между двумя организмами; способ, известный как филогенетический анализ. Наличие целевой последовательности 16S рДНК, специфичной для некоторых видов, может быть обнаружено по присутствию высвобождаемого ПЦР-продукта, который не обнаружен у других видов. Таким образом, видоспецифические различия в последовательности 16S рДНК могут быть использованы в качестве маркеров для идентификации микроорганизмов. Зонды, которые специфически связываются с этими целевыми последовательностями, могут быть использованы в качестве ПЦР-праймеров. В качестве альтернативы, эти зонды могут быть использованы для связывания с ПЦР-продуктами и, таким образом, их специфической идентификации, или для непосредственного обнаружения целевых последовательностей ДНК (например, с использованием FISH (флуоресцентной гибридизации in situ) илиmicrocyte, или на ДНК-чипах). Таким образом, в предпочтительном воплощении изобретения, последовательности 16S рДНК используют в качестве целевых последовательностей для идентификации микроорганизмов. В предпочтительном воплощении зонды не метят, а используют для проведения реакции амплификации, например, с помощью полимеразной цепной реакции (ПЦР). Таким образом, эти зонды могут гибридизоваться с целевыми областями в бактериальном геноме, которые специфичны для конкретных видов или класса бактерий, и приводить к амплификации ДНК только из целевых видов. В качестве альтернативы созданы праймеры для окружения целевой последовательности и, таким образом, амплификации интересующей области для дальнейшего анализа. Проведение реакций амплификации и обнаружение ампликонов представляют собой стандартные способы. Обнаружение посредством использования реакций амплификации, где зонды могут действовать в качестве праймеров для продолжения реакции только в случае гибридизации с целевыми областями, является очень чувствительным; только небольшое количество бактерий, теоретически только одна бактерия, достаточна для получения детектируемого сигнала, если проводится достаточное количество раундов амплификации. Специфичность системы может варьировать в зависимости от жесткости условий,используемых для гибридизации зонда. Таким образом, целевая последовательность ДНК может представлять собой сайт связывания праймера, и, следовательно, зонд может представлять собой ПЦР-праймер. В присутствии специфической анализируемой последовательности будет образовываться ПЦР-продукт желаемого размера, и его можно обнаружить стандартными способами, такими как гель-элетрофорез. За этим могут следовать саузерн-блоттинг или другие способы детекции, в которых может быть использован дополнительный зонд для обнаружения любых характеризующих или специфических последовательностей, которые содержатся в получающемся в результате ПЦР-продукте. Могут быть сконструированы зонды, которые не являются специфическими для отдельных видов. Следовательно, можно обнаруживать более чем один тип микроба с помощью одной пары общих праймеров или используя один зонд для идентификации последовательностей, которые гибридизуются с этой последовательностью, например, в FISH, на микрочипе, или с помощью стандартного способа блоттинга. Например, праймеры, называемые здесь f21ARCH и r958ARCH, и f341Bac/r907Bac, были использованы,соответственно, для идентификации бактерий и Archaea. Продукты амплификации, полученные с использованием этих относительно неспецифических праймеров, могут быть затем дополнительно проанализированы с получением более конкретной информации о популяциях микроорганизмов с помощью ПДРФ (полиморфизма длин рестрикционных фрагментов), DGGE (градиентного гель-электрофореза в денатурирующих условиях), саузерн-блоттинга и т.д., как здесь описано. Под "специфичным к последовательности" понимают, что в условиях, используемых в этом анализе, зонд или праймер связывается только с целевой последовательностью ДНК, а не с какой-либо другой последовательностью ДНК. Целевая последовательность ДНК представляет собой последовательность ДНК, которая используется для характеристики конкретного микроба и может быть уникальной для идентифицируемых видов или общей для группы или класса идентифицируемых видов. Зонд, специфичный к последовательности,может непосредственно распознавать целевую последовательность ДНК или может быть использован для амплификации области, содержащей целевую ДНК, продукт которой затем подвергают дополни-7 009055 тельному анализу, например, с использованием способов гибридизации, для характеристики специфической целевой нуклеотидной последовательности. Как правило, целевая последовательность не является частью гена или не ассоциирована с геном,продукт которого вовлечен в метаболизм углеводородов. Если зонд, специфичный к последовательности, представляет собой праймер, который распознает целевую последовательность ДНК, то присутствие амплифицированного продукта подходящего размера при использовании стандартного гель-электрофореза будет указывать на то, что в образце присутствует микроб, в нуклеиновой кислоте которого (например, в рДНК) содержится целевая последовательность. Это может быть дополнительно подтверждено тем, что амплифицированный продукт подвергают способам гибридизации, таким как саузерн-блоттинг. Эти способы хорошо известны в данной области техники. Если зонд, специфичный к последовательности, сконструирован таким образом, что амплифицируется область ДНК, которая может содержать целевую последовательность, то присутствие "амплифицированного продукта не является достаточным для идентификации присутствия целевого микроба. Требуется дополнительный анализ амплифицированного продукта для определения того, действительно ли присутствует целевая последовательность. Это может быть осуществлено с помощью саузерн-блоттинга с использованием меченных, например радиоактивно меченных зондов, специфичных к последовательности. Эти зонды будут специфически связываться с целевыми последовательностями ДНК, но не с другими последовательностями ДНК. Положительная идентификация целевой последовательности, таким образом, будет являться результатом амплификации области 16S рДНК, которая содержит правильную целевую последовательность. Такие зонды могут быть также использованы непосредственно для образца ДНК без первоначальной амплификации. Градиентный гель-электрофорез в денатурирующих условиях (DGGE) также может быть использован для анализа ПЦР-продуктов. Этот способ используют для разделения молекул нуклеиновой кислоты,демонстрирующих различные условия плавления благодаря вариациям в их последовательностях. Фрагменты, являющиеся в этом случае ПЦР-продуктами, наносят на денатурирующий акриламидный гель с градиентом от низкого к высокому, в котором они разделяются сначала на основе молекулярной массы. В более жестких денатурирующих условиях начинается специфическое для последовательности ДНК плавление, которое влияет на подвижность фрагментов. Сдвиг подвижности различается для разных последовательностей, и даже различие в 1 п.о. может вызвать сдвиг подвижности. Таким образом, в целевых микроорганизмах могут быть обнаружены видоспецифические различия в амплифицированных фрагментах 16S pДHK. ПЦР-продукты могут быть также проанализированы с использованием полиморфизма длин рестрикционных фрагментов (ПДРФ). Он представляют собой изменения в последовательности ДНК, которые приводят к изменению одного или более чем одного сайта для рестрикционного фермента. Таким образом, если видоспецифическое изменение в последовательности 16S рДНК вызывает появление или исчезновение сайта для рестрикционного фермента, то путем расщепления амплифицированного ПЦРпродукта этим ферментом и последующего стандартного анализа с помощью гель-электрофореза для определения молекулярных масс продуктов данного расщепления могут быть идентифицированы целевые виды. Если предстоит использовать ПДРФ-анализ, то ПЦР-праймеры будут сконструированы для амплификации целевой области ДНК, содержащей сайт ПДРФ. Для идентификации конкретных видов микробов могут быть использованы уникальные ПДРФ. В качестве альтернативы может быть использован любой другой стандартный способ обнаружения специфических известных нуклеотидных последовательностей в ПЦР-продуктах, известный в данной области техники. Амплифицированные продукты могут быть секвенированы непосредственно, и, как описано в настоящих примерах, полученную в результате информацию о последовательности подвергают BLAST-анализу. Предпочтительно анализ проводят с использованием множества зондов или праймеров последовательно или одновременно, для того чтобы получить информацию относительно микробиологического профиля образца. В наиболее предпочтительном воплощении анализ проводят одновременно, используя различные зонды или праймеры, т.е. набор зондов или праймеров. Набор зондов или праймеров будут специфически конструировать в зависимости от природы информации, которая требуется, т.е. диапазона и типов микроорганизмов, которые желательно обнаружить. Для идентификации бактерий, присутствующих в образце, могут быть использованы также другие способы с применением нуклеиновых кислот, кроме ПЦР или вместо нее. Такие способы включают в себя способы, при которых зонд связывается непосредственно с нуклеиновой кислотой микроба без предварительной амплификации целевой последовательности. В этом случае зонды, которые связываются с целевой последовательностью нуклеиновой кислоты, метят, для того чтобы обеспечить их обнаружение после гибридизации. Соответственно, еще один аспект изобретения относится к способам идентификации углеводородного источника путем анализа образца на присутствие в нем одной или более чем одной специфической целевой последовательности нуклеиновой кислоты или маркера, где анализ осуществляют с помощью FISH, microcyte илииспользуя ДНК-микрочип.FISH (флуоресцентная гибридизация in situ) представляет собой хорошо охарактеризованный способ, который используют для обнаружения целевых последовательностей нуклеиновой кислоты в отдельных интактных клетках посредством системы связанных антител и флуорохромов. Синтезируют специфические зонды нуклеиновой кислоты, имеющие длину примерно 20 нуклеотидов, включая меченные нуклеотиды. Нуклеиновые кислоты могут быть помечены путем конъюгации или добавления флуоресцентных молекул, таких как FITC, Су 5, Су 3, TRITC, техасский красный. В качестве альтернативы,зонды могут быть помечены иммуногенной молекулой, такой как дигоксигенин, в этом случае на стадии обнаружения используют антитела к иммуногенной молекуле. Антитела могут быть флуоресцентно помечены или могут быть обнаружены с помощью других флуоресцентно меченных антител. Биотин также может быть использован для мечения зондов, и его обнаруживают, используя его высокоаффинный связывающий партнер авидин. Зонды могут выявлять ДНК, предпочтительно рДНК. Гибридзацию осуществляют путем смешивания меченных зондов с образцом, в котором нуклеиновая кислота была денатурирована, таким образом, обеспечивая доступ зонда к целевой ДНК. Зонды детектируют непосредственно, используя флуоресцентную микроскопию, или опосредованно, добавляя затем флуоресцентно меченные антитела, которые специфически связываются с меченным зондом, или с другими немеченными антителами, которые специфически связываются с меченным зондом. Можно одновременно детектировать более чем один тип флуоресценции, используя подходящие фильтры. Таким образом, одновременно можно осуществлять детекцию присутствия более чем одного маркера. Если будут использовать FISH, то зонды будут сконструированы для специфической гибридизации с идентифицированными целевыми последовательностями для каждого вида микробов или группы видов.FISH можно комбинировать с другими красителями, такими как бромистый этидий и DAPI. Это позволит рассчитать количество микрооорганизмов, содержащих целевую последовательность, относительно общего количества присутствующих микроорганизмов. Для обнаружения или анализа присутствия специфических групп видов бактерий можно использовать также microcyte проточную цитометрию. Microcyte проточная цитометрия представляет собой способ проточной цитометрии, который специально адатирован для микробиологи и имеет преимущество, состоящее в том, что он может быть использован с очень маленькими количествами клеток. Клетки окрашивают, используя флуоресцентно меченные зонды рРНК. Таким образом могут быть идентифицированы и количественно определены клетки, содержащие специфические последовательности. Нанесение зондов на микрочип и обеспечение условий для гибридизации образца нуклеиновой кислоты представляет собой еще один путь идентификации последовательностей, гомологичных этим зондам (или достаточно гомологичных для связывания с этими зондами). Зонды, с которыми гибридизуется образец ДНК, могут быть легко идентифицированы, если образец нуклеиновой кислоты был помечен. Зонды присоединяются к чипу в известных положениях, и положение сигнала указывает на то, с каким зондом была связана нуклеиновая кислота. Образец нуклеиновой кислоты, например, может представлять собой геномную ДНК, тотальную РНК, мРНК, кРНК, кДНК, ПЦР-продукт, и каждая из этих или любая другая нуклеиновая кислота может быть помечена перед приведением в контакт с чипом согласно стандартным способам. Из всех вышеприведенных обсуждений очевидно, что способы по изобретению типично включают в себя стадию, на которой олигонуклеотид связывается с областью нуклеиновой кислоты, находящейся в или происходящей из нуклеиновой кислоты целевых микроорганизмов. Таким образом, "генотипический анализ" предпочтительно включает в себя контактирование образца с одним или более видами олигонуклеотида, причем указанные олигонуклеотиды сконструированы для гибридизации с характеризующими последовательностями или соседними с ними последовательностями в пределах нуклеиновой кислоты целевых микроорганизмов. Термин олигонуклеотид охватывает зонды (например, меченные зонды) и праймеры для амплификации или способов с чередованием секвенирования и синтеза (sequencing-bysynthesis). Если не следует иначе из контекста, то термины зонды и праймеры могут быть использованы здесь взаимозаменяемо. "Характеризующие последовательности" представляют собой описанные выше целевые последовательности, которые могут быть видоспецифическими или классоспецифическими. Как описано выше, при проведении реакции амплификации праймеры могут гибридизоваться рядом с характеризующей последовательностью (т.е. по одному с каждой стороны). Это обеспечивает также возможность для двух уровней специфичности, если выбирают селективные праймеры и затем осуществляют также дополнительную реакцию гибридизации для анализа амплифицированной последовательности. В качестве предпочтительных вариантов всех вышеприведенных способов может быть одновременно использовано множество различных зондов или праймеров, которые гибридизуются с целевыми последовательностями различных видов бактерий, что даст картину бактериальной флоры, присутствующей в образце, т.е. микробиологический профиль образца. Эта картина может быть визуализирована после гель-электрофореза в том случае, если она получена с помощью ПЦР. В качестве альтернативы,как упомянуто выше, могут быть использованы FISH, микроцитные или другие технологии, основанные на использовании нуклеиновой кислоты, которые позволяют визуализировать множественные зонды в-9 009055 одном образце. Такая система, которая обеспечивает более подробную информацию о присутствующих видах бактерий, может давать хорошее представление об условиях среды, из которой отбирают образец. Полученную картину можно сравнивать с эталонными картинами, полученными из образцов, отобранных из известных углеводородных зон. Таким образом, анализ (предпочтительно одновременный анализ) множества видов для получения микробиологического профиля представляет собой предпочтительное воплощение по данному изобретению. В предпочтительных воплощениях способы по настоящему изобретению (более конкретно способы разведки по изобретению) дают в результате микробиологический профиль данного образца. Качественная информация о присутствии или отсутствии 2 или более чем 2 типов (т.е. видов или групп/классов),предпочтительно 3 или 4 или большего числа, например, 3 или 4-8 различных типов. Это дает в результате картину, которую можно сравнить, вручную или с помощью компьютерного анализа, с эталонными образцами, для того чтобы получить хорошее представление об углеводородном потенциале данного образца. Таким образом, в предпочтительном воплощении настоящего изобретения предложен способ оценки образца (например, полученного из подповерхностной формации, образца из выхода нефти или образца из нефтяного месторождения) путем генотипической детекции множества различных целевых термофильных или экстремофильных микроорганизмов, получения микробиологического профиля для указанного образца и, возможно, сравнения указанного профиля с одним или более чем одним эталонным профилем. Оценку можно производить для определения углеводородного потенциала зоны или области,из которых был взят образец, или типа нефти, которая может находиться в этой зоне или области, или она может представлять собой часть анализа или программы мониторинга, осуществляемой на известном месторождении или скважине на месторождении, например, образца на стадии добычи. Термин "подповерхностная формация" представляет собой термин, обычно используемый для области земной коры, в которой расположены углеводороды. С другой стороны, эта оценка может предоставлять информацию относительно миграционных путей, наполнения/разлива и глубин месторождения. Еще один аспект изобретения относится к мониторингу и анализу нефти из различных формаций при смешанной продукции на стадии добычи, т.е., когда добываемую нефть получают из двух или более чем двух месторождений. Это будет иметь место в том случае, если существует равномерность месторождения. В качестве альтернативы, смешение нефти из разных месторождений может иметь место также при повреждениях трубопроводов. Этот способ можно использовать также для определения того, получены ли два образца нефти, добытые из разных скважин, фактически из одного непрерывного месторождения или из разных месторождений. На стадии добычи эту оценку можно использовать для идентификации продуктивных зон при смешанной схеме добычи и мониторинге способа нагнетания воды в эксплуатационную скважину. Для эксплуатации месторождения важно, чтобы структура пород-коллекторов была понятна. Понятно, что как только для двух или более месторождений или продуктивных зон будут установлены индивидуальные профили микроорганизмов, то в процессе добычи будет несложно определить путем анализа содержащихся в нем микроорганизмов, является ли нефтяной продукт на самом деле смешанным продуктом из двух месторождений. Например, если виды А, В и D обнаружены в одном месторождении или продуктивной зоне, а виды В, С и Е обнаружены во второй продуктивной зоне, то только присутствие видов А, В и D указывает на то, что нефть получена из первого месторождения или продуктивной зоны, и могут быть предприняты действия по закрытию или модификации добычи из второй (содержащей В, С и Е) зоны. Количественный анализ может указать на относительный вклад одной или более чем одной продуктивной зоны в объединенный углеводород. В области техники смешивание нефти оценивали путем тестирования и картирования давления или путем введения в разные месторождения индикаторов, таких как радиоактивные индикаторы или органические флуоресцентные вещества. Тестирование давления с помощью подходящих индикаторов может быть очень дорогостоящим и также не всегда возможно. Введение индикаторов в пласт-коллектор представляет собой очень сложную процедуру и также не всегда возможно. Можно оценивать имеющиеся природные компоненты в нефти или воде, которые могут быть специфичными для конкретного месторождения, для определения источника смешанных продуктов, однако такие специфичные для месторождения компоненты не всегда могут присутствовать. Поэтому требуется способ, который можно использовать для любого месторождения и который не требует остановки добычи и который может быть использован для непрерывного мониторинга. Анализируя микробиологический профиль добываемой нефти или воды можно будет осуществить корреляцию либо наличия определенных микробов, либо общей картины микробов с источником нефти. Аналогично, на стадии добычи могут быть исследованы миграционные пути путем сравнения микробиологических профилей образцов, собранных в различных местах. Таким образом можно также оценивать наполнение/разлив нефти. Если, например, нефть из одного месторождения перетекла во второе месторождение, то присутствие новых видов микроорганизмов в- 10009055 другом месторождении может указывать на происхождение затекшей нефти. Микроорганизмы, которые могут быть идентифицированы, и чье присутствие коррелирует с характеристиками и присутствием углеводородов, включают в себя представителей бактерий и Archaea. В месторождениях были идентифицированы Archaeoglobus, Acinetobacter, Bajacaliformiensis, Desulfotomaculum, Methanobacterium, Methanococcus, Methanoculleus, Nanobacterium, Petrotoga, Pseudomonas, Ralstonia,Sphingomonas, Spirochaeta, Thermoanaerobacter, Thermococcus, Thermodesulfobacterium, Thermodesulforabdus, Thermotoga, Acidoaminococcus, Aminobacterium, Halomonas, Desulfomicrobium и Methylobacterium, и поэтому они могут быть целевыми микроорганизмами. Способность многих Archaea выживать в условиях, обнаруженных в эксплуатационных и разведочных скважинах, делает их особенно подходящими в качестве целевых микроорганизмов. Как правило,Archaea можно идентифицировать по их клеточной стенке, которая лишена пептидогликанового скелета,и по их цитоплазматической мембране, которая вместо глицериновых эфиров жирных кислот содержит глицериновые эфиры с С 20 (фитанил) и С 40 (бифитанил) алкилизопреноидами. Кроме того, ДНКзависимые РНК-полимеразы Archaea отличаются от полимераз Bacteria тем, что они состоят из более чем четырех субъединиц и устойчивы к антибиотикам рифампицину и стрептолидигину. Эти и другие микробы специально приспособлены для жизни в условиях, обнаруженных в нефтяных скважинах. Например, они являются термофилами или экстремофилами. Они также могут быть метаногенами, использующими серу, или способными жить на больших глубинах. Еще одно применение описанных здесь способов оценки и характеристики заключается в оценке глубин месторождения. Существует прямая корреляция между температурой и глубиной. Существует также прямая корреляция между температурой и способностью микроорганизмов расти, и поэтому присутствие определенных микроорганизмов дает информацию непосредственно о температуре образца и опосредованно о глубине, с которой был получен образец. Поскольку не обязательно, чтобы образец содержал живые микроорганизмы, то можно получить информацию также относительно прошлых свойств нефти до тех пор, пока нуклеиновая кислота микроорганизма(ов), которая обеспечивает эту информацию, сохраняется в этом образце. Поскольку свойства нефти могут изменяться из-за присутствия одного или более чем одного микроорганизма вследствие изменения и/или метаболизма компонентов нефти (деградации нефти), полезно знать, являются ли настоящие свойства образца нефти присущими ему свойствами или же они обусловлены деградацией нефти. Присутствие определенных микроорганизмов, которые, как известно, вызывают биодеградацию, можно применять для диагностики биодеградации и для обеспечения раннего вмешательства с помощью подходящих биоцидов. Данное изобретение также относится к зондам или праймерам для применения в способе анализа. Например, ПЦР-праймеры, которые распознают видоспецифические последовательности 16S рДНК и поэтому образуют видоспецифические или классоспецифические продукты амплификации, образуют часть данного изобретения. Как упомянуто выше, могут быть сконструированы также ПЦР-праймеры для специфической амплификации последовательностей ДНК, содержащих целевые области 16S рДНК,которые содержат видоспецифическую последовательность, которая может быть затем идентифицирована с помощью анализа ПДРФ или методов гибридизационного анализа, которые известны из уровня техники. В качестве альтернативы могут быть использованы зонды для непосредственного связывания с нуклеиновой кислотой, полученной из или присутствующей в образце, без предварительной амплификации. Здесь описаны различные новые зонды, которые подходят для идентификации индивидуальных видов или групп видов. Такие зонды сами по себе составляют еще один аспект настоящего изобретения. Зонды или праймеры могут распознавать один вид или класс родственных видов. Например, существуют праймеры/зонды, которые будут идентифицирать бактерии; f341Bac и 907 Вас, 341fBac: 5'-CCTACG-GGA-GGC-AGC-AG-3' (SEQ ID NO:1) (прямой праймер), 907rВас: 5'-CCC-CGT-CAA-TTC-CTTTGA-GTT-3' (SEQ ID NO:2) (обратный праймер), которые дают ожидаемый ПЦР-продукт длиной 567 п.о. Также существуют праймеры/зонды, которые идентифицируют Archaea, f21ARCH и r958ARCH 21fARCH: 5'-TTC-CGG-TTG-ATC-CCG-CCG-GA-3' (SEQ ID NO:3) (прямой праймер), 958rARCH: 5'CCC-GGC-GTT-GAA-TTC-AAT-T-3' (SEQ ID NO:4) (обратный праймер), которые дают ожидаемый ПЦР-продукт длиной 938 п.о. (Teske et al. 1996 Appl. Environ. Microbiol. 62: 1405-1415, DeLong et al. 1992, PNAS USA 89(1): 5685-9). Также существуют праймеры, которые распознают группы сероредуцирующих бактерий (Desulphovibrio), например, f341Bac и r687SRB (r687SRB:TACGGATTCACTCCT)(SEQ ID NO:5). Зонды/праймеры, которые распознают Desulfovibrio и Desulfobulbus (f385SRB: 5'-CGGCGT-CGC-TGC-GTC-AGG-3' (SEQ ID NO:6) и r907 ВАС), и зонды/праймеры, которые распознают Desulfobacter и Desulfobacterium (f341Bac и r804SRB: 5'-CAA-CGT-TTA-CTG-GGT-GGA-3') (SEQ ID NO:7). Они могут быть использованы для ПЦР или для способов прямой гибридизации. Зонды, которые подходят для применения в FISH, для применения на микрочипах или для других способов гибридизации, включают в себя EUB338: 5'-GCTGCCTCCCGTAGGAGT-3' (SEQ ID NO:8)Archaea в целом); NON338: 5'-ACTCCTACGGGAGGCAGC-3' (SEQ ID NO:10) (отрицательный в отношении всех бактерий и Archaea); ARGL0605: 5'-GCCTCTCCCGGTCCCTAG-3' (SEQ ID NO:11) (против всех зарегистрированных Archaeoglobus); THERSI672: 5'-CCCTACACCAGCAGTTCC-3' (SEQ ID NO:12) (против всех зарегистрированных Thermotogales). Ery368: 5'-CCAGTATTCTAGCCATCC-3' (SEQ ID NO:13)(SEQ ID NO:17) представляют собой три дополнительных зонда, которые могут быть использованы. 554 ARCHI 5'-TTA-GGC-CCA-ATA-ATC-MTC-CT-3', (SEQ ID NO:18) представляет собой зонд, который использовали для саузерн-блоттинга и который может быть использован в любом прямом способе гибридизации для распознавания Crenarchaeota (группа I Archaea). 544 ARCHII 5'-TTA-GGC-CCA-ATA-AAA-KCG-AC-3', (SEQ ID NO:19) представляет собой еще один зонд, который использовали для саузерн-блоттинга и который может быть использован в любом прямом способе гибридизации для распознавания Euryarchaeota (группа II Archaea). Таким образом, новые зонды, описанные выше, или комплементарные им последовательности представляют собой еще один аспект данного изобретения. В этом аспекте изобретения также рассматриваются функционально эквивалентные варианты этих новых зондов, т.е. зонды с эквивалентной специфичностью, но различной длины, или с модифицированными последовательностями. Как правило, эти варианты зондов будут не менее чем на 6 нуклеотидов короче, предпочтительно не менее чем на 3 нуклеотида короче, но не более чем на 10 нуклеотидов, предпочтительно не более чем на 5 нуклеотидов длиннее, чем указанные зонды, перечисленные выше. Варианты зондов/олигонуклеотидов будут, как правило, иметь по меньшей мере 80%, предпочтительно по меньшей мере 90%, например по меньшей мере 95% идентичности последовательности со специфическими зондами, перечисленными выше. Зонды могут быть сконструированы для связывания непосредственно с характеризующей последовательностью, например, для применения в FISH или для прямой гибридизации, например, на чипах с использованием обычных способов блоттинга. Зонд может быть помечен или маркирован флуоресцентным маркером, радиоактивным маркером или антигенной меткой. Зонды, специфичные к последовательности, могут идентифицировать последовательности, которые специфичны для микробов, которые ассоциированы с конкретной зоной нефтяного месторождения. В способе по данному изобретению могут быть использованы комбинации зондов или праймеров. Смеси зондов, включающие в себя зонды для одновременной идентификации более чем одного микроорганизма, или для получения микробиологического профиля, таким образом, образуют еще один аспект данного изобретения. Для обеспечения различных уровней специфичности могут быть использованы также условия, при которых осуществляют анализ. Например, композиция буфера, в котором гибридизуют зонд, специфичный к последовательности, может быть модифицирована для изменения жесткости условий. Аналогично может быть модифицирована температура, при которой осуществляют стадию отжига в ПЦР. Такие модификации хорошо известны в данной области техники. В объеме данного изобретения также указаны наборы для осуществления способов по изобретению. Такие наборы включают в себя один или более чем один олигонуклеотид, сконструированный для гибридизации с или соседние с характеризующими последовательностями, и могут включать в себя пары праймеров для осуществления амплификации и/или единичные зонды, направленные против микроорганизмов, причем эти единичные зонды могут быть мечены. Выбор праймеров осуществляют таким образом, чтобы получить микробиологический профиль образца, который может быть использован при оценке образца относительно индикаторов углеводородного источника, на присутствие маркеров, определяющих проблемы с добычей и т.д. В предпочтительном наборе зонды присоединены к твердому носителю, например микрочипу. В этом случае, будут сконструированы зонды для гибридизации с характеризующими последовательностями, а не для участия в реакции амплификации. Наборы, так же как олигонуклеотиды, как правило, включают в себя подходящие буферы для применения в тестировании, например лизирующий буфер и другие буферы и компоненты для применения в реакции амплификации, например ДНК-полимеразу (в частности, Taq ДНК-полимеразу) и нуклеотиды для включения в амплифицированные продукты. Чипы для проведения гибридизационного анализа составляют еще один аспект данного изобретения. Чипы предпочтительно содержат зонды, описанные выше. Более предпочтительно присоединены зонд, специфичный к бактериям (например, SEQ ID NO:8), плюс зонд, специфичный к археям (например,с SEQ ID NO:9), плюс один или более чем один зонд, выбранный из группы, включающей в себя SEQ IDNO:8-17 или функционально эквивалентные варианты этих зондов. Предпочтительно, чип содержит 2 или более чем 2, 4 или более чем 4, 6 или более чем 6 олигонуклеотидных зондов. Изобретение будет теперь дополнительно описано со ссылкой на следующие, не ограничивающие его объем примеры и фигуры, где на фиг. 1 показаны результаты электрофореза в агарозном геле ПЦР-продуктов, амплифицирован- 12009055 ных с наборами праймеров, определяющими соответственно Bacteria и Archaea. Образцы представляют собой скважину 1 из месторождения 1 (1), скважину 2 из месторождения 1 (2), скважину 1 из месторождения 2 (3), скважину 2 из месторождения 2 (4), промытую интерфазу скважины 2 из месторождения 2(5); на фиг. 2 представлен саузерн-блот-анализ ПЦР-продуктов образцов из месторождений после гибридизации ДНК с биотинилированным зондом 385SRB, определяющим бактерии подтипа . Образцы представляют собой скважину 1 из месторождения 1 (1), скважину 2 из месторождения 1 (2), скважину 1 из месторождения 2 (3), скважину 2 из месторождения 2 (4); на фиг. 3 продемонстрированы результаты DGGE ПЦР-продуктов, амплифицированных с наборами праймеров, определяющими Bacteria. Образцы представляют собой скважину 1 из месторождения 1 (1),скважину 2 из месторождения 1 (2), скважину 1 из месторождения 2 (3), скважину 2 из месторождения 2(4), промытую интерфазу из скважины 2 месторождения 2 (5); на фиг. 4 представлены Наеlll типы ПДРФ клонированных ПЦР-продуктов из ДНК, экстрагированной из двух месторождений; на фиг. 5 представлены Rsal типы ПДРФ клонированных ПЦР-продуктов из ДНК, экстрагированной из двух месторождений; на фиг. 6 показаны различия в миграции полос в клонах, охарактеризованных как тип А Наеlll ПДРФ; на фиг. 7 представлены результаты DGGE мелких фракций (fines), полученных 17.8.01, амплифицированных с помощью праймеров, определяющих бактерии. на фиг. 8 продемонстрированы результаты DGGE образцов, взятых из месторождения 2, амплифицированных с помощью праймеров, определяющих бактерии. на фиг. 9 представлены количества клонов различных бактериальных типов, обнаруженных в 3 скважинах на месторождении 2. на фиг. 10 представлен ПДРФ-анализ образцов Archaea. Пример 1. Идентификация Archae и Bacteria, являющихся местными для месторождений. 1. Материалы и способы 1.1 Сбор и обработка образцов 1.1.1 Отбор проб Стерилизованные стеклянные колбы на 5 л для образцов (Schott) с 5 мл 0,1% (мас./об.) восстанавливающего агента резазурина (Sigma Chemical Co., St. Louis, MA, USA) на колбу отправляли на морские месторождения. Образцы собирали в виде сырой добываемой жидкости (нефть/вода) из эксплуатационного трубопровода перед отделением попутной воды. Колбы полностью заполняли. Верхний нефтяной слой изолировал воду от атмосферы, исключая оксигенацию водных фаз. Образцы отправляли на сушу в закрытых алюминиевых контейнерах (период транспортировки 1-2 недели). Во время транспортировки контейнеры хранили при температуре окружающей среды. Никаких следов кислорода не было обнаружено в водных фазах при поступлении образцов на сушу. 1.1.2 Фильтрация водных образцов После поступления в лабораторию нефтяную и водную фазы образцов пластовой жидкости немедленно нагревали (70 С; 20 мин), и горячие фазы разделяли в делительных воронках на 2 л (2 л). Микробную биомассу из 1-2 л воды собирали фильтрацией через фильтры 0,22 мкм Sterivex GV (Millipore Corp.,Bedford, Ma, USA), соединенные с предварительными фильтрами Millex АР (Millipore). После фильтрации каждый фильтр Sterivex заполняли 2 мкл лизирующего буфера (50 мМ Tris-HCl, pH 8,0; 40 мМ ЭДТА; 750 мМ сахароза) и хранили при -20 С до экстракции ДНК. Один из образцов был сильно эмульгирован, что дало в результате лишь небольшое количество водной фазы. Эту эмульсионную фазу промывали стерильным буферным раствором, фазы разделяли и фильтровали, как описано выше (примерно 1 л буферной фазы). 1.2 Подсчет микроорганизмов Количество клеток в водных фазах добываемых жидкостей подсчитывали сразу после поступления в лабораторию с помощью эпифлуоресцентной микроскопии. Образцы предварительно фильтровали(Millex АР, Millipore) и 100 мл фильтратов центрифугировали (6000 х g; 10 мин для удаления крупных частиц и остаточных капель нефти. К супернатантам (10 мл) добавляли флуорохром 4'6-диамино-2 фенилиндол (DAPI; 0,6 г/мл), и образцы инкубировали при комнатной температуре (10 мин) с последующей фильтрацией через черные поликарбонатные фильтры 0,22 мкм (Millipore). Фильтры помещали в флуоресцентный микроскоп (Leitz Dialux с флуоресцентным блоком Ploemopak и УФ фильтром и оборудованным цифровой камерой Leica DC 100) с иммерсионным маслом. Флуоресцентные клетки подсчитывали при увеличении 1250 раз. 1.3 Амплификация образцов из месторождений с помощью полимеразной цепной реакции (ПЦР) 1.3.1 Экстракция и количественная оценка нуклеиновых кислот Замороженные фильтры Sterivex с микробными сообществами оттаивали и лизировали непосредственно на фильтрах. Лизис осуществляли путем инкубации каждого фильтра с 2 мкг лизоцима (Sigma; из исходного раствора 20 мг/мл; 37 С в течение 30 мин). Смеси затем инкубировали при 55 С в течение 2 ч- 13009055 с 1 мкг протеиназы К (Sigma; из исходного раствора 20 мг/мл) и 1% (мас./об.) додецилсульфатом натрия(55 С; 10 мин), и лизаты с каждого фильтра объединяли. Лизаты экстрагировали горячей смесью фенолхлороформ-изоамиловый спирт (25:24:1) в соответствии со стандартными способами (Sambrook and Russel, 2001). Кратко, каждый лизат (3 мл) смешивали с 6 мл горячей (60 С) забуференной Tris-HCl смеси фенол-хлороформ-изоамиловый спирт (рН 8,0), тщательно перемешивали, выдерживали в течение 5 мин,затем охлаждали на льду с последующим разделением фаз путем центрифугирования (4000 х g; 5 мин при 4 С; Jouan Model 1812, Saint Nazaire, France). В каждую водную фазу добавляли ацетат натрия (0,2 объема 10 М растворов) и повторно экстрагировали 5 мл забуференной Tris-HCl смеси фенол-хлороформизоамиловый спирт с последующим центрифугированием. Водные фазы затем экстрагировали 5 мл горячей (60 С) смеси хлороформ-изоамиловый спирт (24:1) и центрифугировали, как описано выше. Экстрагированные водные фазы осаждали 2,5 объемами 96% этанола (-20 С; 3 ч), осадки осаждали центрифугированием (4000 х g), и эти осадки после центрифугирования промывали 75% этанолом. Осадки сушили(N2) после повторного центрифугирования и растворяли в 100 мкл стерильной ультрачистой воды (Biochrom AG, Berlin, Germany). Экстракты нуклеиновой кислоты замораживали (-20 С). Экстрагированные нуклеиновые кислоты полуколичественно оценивали с помощью бромистого этидия (Sambrook and Russel, 2001). Нуклеиновые кислоты (2 мкл) наносили в виде пятен на столик УФтрансиллюминатора (BioRad), покрытый пластиковой пленкой ("GladPak"), и к каждому пятну добавляли 2 мкл бромистого этидия (10 мг/мл в буфере ТЕ, рН 8,0). Пятна фотографировали при УФ-освещении, и концентрации определяли путем сравнения интенсивности со стандартными сериями ДНК лосося(Sigma) в диапазоне 100-500 нг ДНК на пятно. 1.3.2 Олигонуклеотиды и реагенты для ПЦР 1.3.2.1 Олигонуклеотиды для ПЦР-амплификации Получали олигонуклеотидные праймеры, специфические в отношении Bacteria и Archaea (Teske etArchaea 21fARCH: 5'-TTC-CGG-TTG-ATC-CCG-CCG-GA-3' (прямой праймер SEQ ID NO:3) 958rARCH: 5'-CCC-GGC-GTT-GAA-TTC-AAT-T-3' (обратный праймер SEQ ID NO:4) Ожидаемый ПЦР-продукт: 938 п.о. Праймеры синтезировали в EuroGentec, Seraing, Belgium. Праймеры разбавляли в стерильной воде при концентрациях 50 мкМ, распределяли по 50 мкл аликвотам и хранили при -20 С. 1.3.2.2 Биотинилированные олигонуклеотиды Для саузерн-блот-анализа ПЦР-продуктов было получено множество биотинилированных олигонуклеотидов ДНК (5'-и 3'-меченых) (Teske et. al., 1996; Massana et. al., 1997): подгруппа /грамположительные бактерии (включающие в себя Desulfovibrio и Desulfobulbus) 385 SRB: Биотин-5'-CGG-CGT-CGC-TGC-GTC-AGG-3'-Биотин Температура гибридизации: 50C (SEQ ID NO:6) Desulfobacter и Desulfobacterium 804 SRB: Биотин-5'-CAA-CGT-TTA-CTG-CGT-GGA-3'-Биотин Температура гибридизации: 40C (SEQ ID NO:7) Crenarchaeota (Группа I Archaea) 554ARCH-I: Биотин-5'-ТТА-GGС-ССА-АТА-АТС-МТС-СТ-3'-Биотин Температура гибридизации: 40 С (SEQ ID NO:18) Euryarchaeota (Группа II Archaea) 554 ARCH-II: Биотин-5'-TTA-GGC-CCA-ATA-AAA-KCG-AC-3'-Биотин Температура гибридизации: 40 С (SEQ ID NO:19) Все биотинилированные праймеры были синтезированы с помощью EuroGentec, Seraing, Belgium. Праймеры разбавляли в стерильной воде в концентрациях 50 мкМ, распределяли по аликвотам 50 мкл и хранили при -20 С. 1.3.2.3 Дезоксинуклеотиды Концентрированные растворы дезоксинуклеотидов (d'NTP) готовили путем разбавления 100 мМd'NTP 2'-дезоксиаденозин 5'-трифосфата (d'ATP),2'-дезокситимидин 5'-тpифocфaтa(d'TTP),2'-дезоксигуанозин 5'-трифосфата (d'GTP) и 2'-дезоксицитидин 5'-трифосфата (d'CTP) (Amersham Pharmacia Biotech, Piscataway, NJ, USA). Каждый d'NTP (100 мкл) разбавляли в стерильной воде (600 мкл), получая в результате конечные концентрации 10 мМ каждого d'NTP. Растворы распределяли по аликвотам 50 мкл и хранили при -20 С. 1.3.3 "Touchdown" ПЦР Экстрагированную ДНК (см. выше) или суспензии лизированных микробных клеток использовали- 14009055 в качестве ДНК-матрицы для ПЦР-амплификации. При использовании суспензии лизированных клеток культуральные бульоны разбавляли стерильной водой (10-2), или колонии с агаровых чашек суспендировали в стерильной воде с последующим нагреванием (100 С) в течение 10 мин. 100 мкл ПЦР-смеси состояла из 20 мкл d'NTP (10 мМ), 10 мкл прямого праймера (50 мкМ), 10 мкл обратного праймера (50 мкМ), 55 мкл стерильной воды и 5 мкл AmpliTaq ДНК-полимеразы (Perkin ElmerRoche Molecular Systems, Branchburg, NJ, USA). ДНК-матрицу (1-10 мкл) разбавляли в 10 мкл [10 х] буфера для ПЦР с 15 мкМ MgCl2 (Perkin ElmerRoche) и стерильной водой до конечного объема 90 мкл. Смесь нагревали (95 С) в течение 5-10 мин в нагревающем блоке. Когда образцы находились в нагревающем блоке (95 С), в каждый образец добавляли по 10 мкл ПЦР-смеси, и образцы немедленно переносили в термоциклер для ДНК (iCycler, BioRad). ПЦР проводили в виде "touchdown" способа для уменьшения образования ложных побочных продуктов и со следующей последовательностью циклов. Денатурация: 95 С в течение 1 мин; Отжиг праймера: 65-55 С в течение 1 мин; Синтез ДНК (удлинение праймера): 72 С в течение 3 мин; Количество циклов: 35. В течение первых 10 циклов температуру отжига постепенно уменьшали с 65 до 55 С с 1 С на каждый цикл, затем 25 циклов с температурой отжига 55 С. Раунды ПЦР прерывали с помощью 72 С в течение 15 мин перед охлаждением до 4 С. 1.3.4 Электрофорез в агарозном геле 1.3.4.1 Аналитический электрофорез ПЦР-продукты анализировали с помощью горизонтального электрофореза в агарозном геле. Образцы (27 мкл) смешивали с [10 х] буфером ТВЕ для нанесения на гель (3 мкл) (0,9 М Tris, 0,9 М борат, 20 мМ ЭДТА, рН 8,3, 50% (об./об.) глицерин, 0,25% (мас./об.) бромфеноловый синий). В качестве стандарта использовали низкомолекулярную ДНК-"лестницу" (Gibco BRL, Paisley, UK), 12 мкл стандарта в 3 мкл[10 х] буфера ТВЕ для нанесения на гель. Гели приготавливали путем нагревания агарозы (2,0 г; Sigma) в 160 мл [0,5 х] ТВЕ (0,045 М Tris,0,045 М борат, 1 мМ ЭДТА, рН 8,3) в микроволновой печи (4 мин) с последующим охлаждением до 50 С в водяной бане. К агарозе добавляли бромистый этидий (10 мкл) из исходного раствора (10 мг/л бромистого этидия в стерильной воде), и расплавленный гель заливали горизонтально в пластиковый поддон(открытые края поддона запаяны) с гребенкой на 15 или 20 лунок в аппарате для электрофореза (BioRad). Гель держали при комнатной температуре в течение 20 мин, погружали в [0,5 х] буфер ТВЕ и гребенку и уплотнительные прокладки осторожно удаляли. Приготовленные образцы и стандарт (см. выше) наносили в погруженные лунки геля (20 мкл образца и 10 мкл стандарта), и электрофорез проводили при постоянном напряжении (150 В) в течение 1,52 ч при комнатной температуре. Визуализацию геля, осуществляли на столике УФ-трансиллюминатора(BioRad). Гели фотографировали на черно-белую пленку Polaroid (время экспозиции 0,1-0,5) или на цифровую камеру (GelDoc, 2000, BioRad). 1.3.4.2 Препаративный электрофорез Препаративный электрофорез в агарозном геле проводили в основном, как описано выше для аналитического подхода, за исключением того, что использовали легкоплавкую агарозу (Sigma). Агарозу(1,3 г) плавили в 160 мл [0,5 х] буфера ТВЕ или [1 х] буфера ТАЕ (0,04 М Tris-ацетат, рН 8,0; 1 мМ ЭДТА),раствор геля охлаждали до 35-50 С, добавляли бромистый этидий и заливали горизонтальный гель, как описано выше, за исключением того, что установленная температура составляла 4-5 С. Образцы наносили, как описано выше, и электрофорез проводили при постоянном напряжении 100 В в течение 1,5-2 ч. После электрофореза гели фотографировали, и выбранные полосы ДНК вырезали из агарозы с помощью стерильного скальпеля и переносили в микроцентрифужные пробирки. Перед последующей обработкой агарозные кусочки осаждали путем быстрого центрифугирования и расплавляли при 65 С в течение 15 мин. Образцы поддерживали в расплавленном состоянии при 35-37 С. 1.3.5 Саузерн-блоттинг и гибридизация 1.3.5.1 Блоттинг Электрофорез в агарозном геле продуктов ПЦР с саузерн-блоттингом осуществляли, как описано выше (аналитический подход), за исключением того, что в гель не добавляли бромистый этидий. ДНК переносили из геля на мембраны Hybond N+ (Amersham Pharmacia) путем диффузионного блоттинга (diffusion blotting). После электрофореза гель погружали в 10 объемов денатурирующего раствора (0,5 М NaOH, 1,5 МNaCl) в течение 2 х 20 мин (медленное перемешивание) с последующей нейтрализацией (1 М ацетат аммония) в течение 2 х 15 мин. Гель затем обрезали и помещали на стеклянную пластину с хроматографической бумагой (3 мм Chr, Whatman, Maidstone, UK), смоченной в 1M ацетате аммония. Концы хроматографической бумаги помещали в ванночку с буфером для переноса (0,2 М ацетат аммония). Гель окружали тонкой пластмассовой пленкой ("GladPak") для предотвращения испарения буфера для переноса. Мембрану Hybond N+ для переноса смачивали в 0,2 М ацетате аммония и помещали плотно на поверх- 15009055 ность геля. На поверхность мембраны помещали несколько слоев хроматографической бумаги (смоченной в 0,2 М ацетате аммония), и на поверхность хроматографической бумаги помещали стопку бумажных салфеток (5-8 см). Поверх бумажных салфеток помещали стеклянную пластину массой 300-400 г. Перенос ДНК проводили в течение ночи (8-12 ч) при комнатной температуре и бумажные салфетки меняли, когда они становились влажными. Качество блоттинга контролировали путем окрашивания геля в ванночке бромистым этидием (0,5 мкг/мл в воде) в течение 45 мин. После блоттинга ДНК фиксировали на мембране Hybond под УФ-светом в течение 40 с. Мембраны гибридизовали сразу или обертывали в пластик и хранили (в темноте) при 4 С. 1.3.5.2. Гибридизация Перед гибридизацией фиксированные мембраны предварительно гибридизовали в растворе (10 мл) 3 х SSC, 0,1% ДСН и 1,0% блокирующего агента (Roche Molecular Biochemicals) в течение 2 ч при выбранной температуре гибридизации для различных зондов ДНК (смотри выше) в аппарате для гибридизации Roller-Blot HB-3D (Techne, Cambridge, UK). Биотинилированные зонды ДНК затем наносили во вращающиеся колбы в аппарате для гибридизации и инкубировали в течение 16-20 ч при температурах,описанных для различных ДНК-зондов (см. выше). После гибридизации мембраны промывали в течение 10 мин в 50 мл 2 х SSC - 0,1% ДСН, 10 мин в 50 мл 0,1 х SSC -.0,1% ДСН и 10 мин в PBS-T (фосфатно-солевом буфером с детергентом Tween) (все промывки проводили при комнатной температуре). Мембраны инкубировали с ЭкстравидинПероксидазой (Sigma Chemical Co., St. Louis, МО), разбавленной 1:2000 в PBS-T, в течение 30 мин при комнатной температуре (перемешивание), промывали 2 х 10 мин в PBS-T, 10 мин в PBS (комнатная температура) и проявляли (10-20 мин) в 30 мл PBS с использованием 2 таблеток диаминобензидина (DAB;Sigma) и 24 мл 30% безводной Н 2 О 2. После проявления мембраны ополаскивали в водопроводной воде и фотографировали. 1.4 Градиентный гель-электрофорез в денатурирующих условиях (DGGE) 1.4.1 Аналитический DGGE Используя DGGE получали ПЦР-продукты с помощью общих праймеров, определяющих BacteriaDGGE проводили с использованием 6% (мас./об.) полиакриламидных (ПАА) гелей в [0,5 х] буфере ТАЕ (20 мМ Tris-ацетат, рН 7,4; 10 мМ ацетат; 0,5 мМ ЭДТА) с 20-70% градиентом денатурирующих агентов мочевины и формамида (100% денатурирующие агенты соответствовали 7 М мочевине и 40%(об./об.) деионизированного формамида) в универсальной системе обнаружения мутаций DCode (BioRad). Концентрированные растворы ПАА/бис-акриламида (Бис) (40%), состоящие из 38,93 г акриламида и 1,07 г Бис, растворяли в деионизированной воде до 100 мл, тогда как концентрированные растворы[50 х] буфера ТАЕ готовили путем смешивания 242 г Tris, 57,1 г уксусной кислоты и 100 мл 0,5 М ЭДТА до общего объема 1000 мл с деонизированной водой. Гели с линейным градиентом (толщина 1 мм) готовили путем смешивания ПАА и Бис с денатурирующими агентами для получения линейного градиента от 20 до 70% в системе для создания градиента (BioRad, модель 475). Растворы с 20 или 70% денатурирующих агентов описаны в табл. 1, представленной ниже: Таблица 1. Композиция 20% и 70% денатурирующих растворов, используемых в DGGE Для приготовления одного геля 18 мл каждого раствора смешивали с 200 мл персульфата аммония(10% (мас./об.) в деионизированной воде) и 20 мкл N,N,N',N'-тетраэтилендиамина (TEMED) (BioRad), и смеси немедленно переносили в каждый из двух 30 мл шприцев, которые затем закрепляли в системе для создания градиента. Гель заливали в виде параллельного градиентного геля (16 х 16 см) толщиной 1 мм и давали возможность полимеризоваться в течение примерно 1 ч с 15-луночными гребенками. Емкость для проведения электрофореза заполняли [1 х] буфером ТАЕ, который нагревали до 60 С внутри емкости и 12 полимеризованных геля вертикально помещали в емкость для электрофореза. Каждый образец ПЦР-продукта (10 мкл) смешивали с 10 мкл буфера для образцов (0,05% бромфеноловый синий, 0,05% ксилолцианол, 70% глицерин, разбавленный в деионизированной воде), и полный- 16009055 объем (20 мкл) наносили в каждую лунку. Вертикальный электрофорез осуществляли при постоянной температуре (60 С) и напряжении (150 В) до тех пор, пока оба маркера не мигрировали к нижней части геля (примерно 4,5 ч). После электрофореза гели окрашивали SYBR Gold (Molecular Probes, Leiden, The Netherlands), разбавленным 1:10000 в [1 х] ТАЕ в течение 20-30 мин. Гели затем фотографировали с помощью системыGelDoc (BioRad). Картины полос гелей сравнивали на сходство, и коэффициенты сходства получали с помощьюQuantity One варианта программы GelDoc. Использовали способ с коэффициентом сходства на основе следующей формулы сходства: где S и Т - векторы, представляющие собой две линии в одном и том же наборе сравниваемых полос. 1.4.2 Препаративный DGGE Осуществляли препаративный DGGE, как описано для аналитического DGGE, за исключением того, что вместо Бис при приготовлении геля использовали N,N'-бис-акрилилцистеин (ВАС; Sigma). ВАС представляет собой раствор для геля после электрофореза (Muyzer et al., 1996). ПЦР-образцы (300 мкл) осаждали 30 мкл 5 М NaCl и 750 мкл этанола при -80 С в течение 1 ч, центрифугировали (20000 х g, 2 мин) в микроцентрифуге (Eppendorf Model 5417 С, Eppendorf, Hamburg,Germany). Осадок промывали 70% этанолом, сушили в нагревающем блоке (35 С, 20 мин) и растворяли в 30 мкл стерильной воды. Гель заливали, наносили образцы и проводили электрофорез, как описано выше. После электрофореза гель окрашивали SYBR Gold (смотри выше), и выбранные полосы вырезали стерильными скальпелями под УФ-освещением. Каждый кусочек геля переносили в микроцентрифужную пробирку, промывали 2 х 10 мин 100 мкл стерильной воды, и воду удаляли. Добавляли (3 меркаптоэтанол (100 мкл; BioRad), и пробирки инкубировали в течение 16-20 ч при 37 С. В каждую пробирку добавляли деионизированную воду (100 мкл), 0,1 объем 5 М NaCl и 2,5 объема этанола, охлажденного на льду. Пробирки инкубировали при -80 С в течение 2 ч, центрифугировали (10000 х g, 20 мин) в микроцентрифуге, и супернатант осторожно удаляли. Пробирки сушили (35 С, 20 мин) и осадок растворяли в 100 мкл стерильной воды. Содержание ПЦР-продукта в образцах проверяли в ПЦР с помощью праймеров, определяющихBacteria, но без GC-clamp (фиксатора). ПЦР-продукты затем очищали с помощью препаративного электрофореза в агарозном геле с легкоплавкой агарозой (см. выше). 1.5 Клонирование 1.5.1 Клонирование ТОРО ТА Клонирование осуществляли с использованием набора для клонирования ТОРО ТА (Invitrogen,Carlsbad, СА, USA) с плазмидным вектором pCR 2.1-ТОРО и химически компетентными клетками Escherichia coli One Shot ТОР 10. ДНК амплифицировали в ПЦР с использованием праймеров 341fBAC и 907rВАС, определяющихBacteria. ПЦР осуществляли, как описано выше, за исключением того, что конечная терминация при 72 С продолжалась в течение 10 мин для получения 3'-аденилированных липких концов. ПЦР-продукты очищали с помощью препаративного электрофореза в агарозном геле с легкоплавкой агарозой, как описано выше. Кусочки гелей с ПЦР-продуктами плавили, как описано (65 С, 15 мин), и поддерживали в расплавленном состоянии при 37 С до лигирования в вектор. Расплавленные кусочки агарозы (4 мкл) осторожно смешивали с 1 мкл солевого раствора (1,2 МNaCl, 0,06 М MgCl2) и 1 мкл вектора ТОРО pCR 2.1. Лигирование проводили в течение 10 мин при 37 С. Пробирки помещали на лед, и трансформацию вектора (4 мкл) в химически компетентные клетки ТОР 10(50 мкл) осуществляли на льду (15 мин) с последующим тепловым шоком (42 С, 30 с), и немедленно переносили на лед (10 мин). Реакционную смесь для трансформации разбавляли в 250 мкл среды SOC (2% триптон, 0,5% дрожжевой экстракт, 10 мМ NaCl, 2,5 мМ KCl, 10 мМ MgCl2, 10 мМ MgSO4, 20 мМ глюкоза) и реакцию проводили в инкубаторе при 37 С в течение 1 ч при горизонтальном перемешивании 200 об./мин. Суспензии распределяли на чашки с агаровой средой Луриа-Бертани (LB) (1,5% агар, 1,0% триптон,0,5% дрожжевой экстракт, 1,0% NaCl, pH 7,0; Sigma), дополненной 50 мкг/мл антибиотиков ампициллина или канамицина. Перед инокуляцией на чашки наносили X-gal (5-бром-4-хлор-3-индолил-бета-Dгалактопиранозид; Sigma), 40 мкл 40 мг/мл X-gal в диметилформамиде. Суспензии (20 и 50 мкл) трансформантов наносили на чашки с агаром LB (20 мкл суспензии разбавляли 20 мкл среды SOC перед распределением на чашки для обеспечения равномерного распределе- 17009055 ния). Чашки инкубировали в течение 20-24 ч при 37 С. Только трансформанты со встроенной плазмидой росли на среде благодаря гену устойчивости этой плазмиды. Колонии с ПЦР-продуктами, лигированые в вектор, визуализировали в виде белых колоний в противоположность светло- или темно-синим колониям с векторами без встроенного ПЦР-продукта. Отдельные белые колонии выделяли в жидкой среде LB,дополненной ампициллином или канамицином (50 мкг/мл). Среду распределяли в 24-луночные стерильные планшеты для тканевых культур (Corning Inc., Corning, NY, USA) с 2 мл среды/лунку. Колонии инкубировали в течение 20-24 ч в среде LB и плазмиды очищали. 1.5.2 Выделение плазмид Плазмиды выделяли с помощью набора GenElute Plasmid Miniprep (Sigma) в соответствии с инструкциями производителя. Клоны трансформантов (2 мл) собирали путем центрифугирования в микроцентрифуге (Eppendorf) при 14000 х g в течение 2 мин. Осадки ресуспендировали в ресуспендирующем растворе (200 мкл) путем интенсивного вихревого перемешивания. Добавляли лизирующий раствор (200 мкл), смесь осторожно переворачивали до тех пор, пока она не становилась светлее (8-10 раз), и лизис нейтрализовали в течение 3-5 мин 350 мкл нейтрализующего/связывающего буфера. Клеточный дебрис осаждали центрифугированием (14000 х g в течение 10 мин). Супернатанты переносили в связывающие колонки GenElute Miniprep, укомплектованные в микроцентрифужные пробирки, центрифугировали(14000 х g в течение 2 мин) и прошедшую через колонки жидкость отбрасывали. Связывающие колонки затем промывали 750 мкл промывающего раствора и центрифугировали (14000 х g в течение 2 мин),проскок удаляли, и колонки снова центрифугировали (14000 х g в течение 2 мин) для удаления любых дополнительных растворов. Связывающие колонки затем переносили в новые микроцентрифужные пробирки, добавляли 100 мкл стерильной воды, и пробирки центрифугировали (14000 х g в течение 2 мин). Выделенные растворы плазмиды хранили при -20 С. 1.5.3 Контроль положительной ПЦР-вставки Положительные ПЦР-вставки в трансформирующий вектор контролировали с помощью ПЦР с использованием праймеров М 13, определяющих векторные последовательности, фланкирующие встроенную последовательность. Праймерные последовательности представляли собой: Прямой праймер М 13 (-20): 5'-GTA-AAA-CGA-CGG-CCA-G-3' (SEQ ID NO:21) Обратный праймер М 13: 5'-CAG-GAA-ACA-GCT-ATG-AC-3' (SEQ ID NO:22) Праймерные участки соответствовали основаниям 391-406 (М 13 прямой -20) и 205-221 (М 13 обратный) фрагмента вектора LacZa. Плазмида без положительной вставки ПЦР-продукта дает в результате ПЦР-продукт М 13 длиной 202 п.о., тогда как положительный ПЦР-продукт дает в результате ПЦРпродукт длиной 769 п.о. ПЦР-смесь готовили, как описано выше (см. раздел 3.4.3) с набором праймеров М 13 (50 мкМ концентрированные растворы). Плазмидную ДНК-матрицу (2 мкл) разбавляли в буфере для ПЦР и стерильной воде до конечного объема 90 мкл, как описано выше, смешанной с ПЦР-смесью. ПЦР проводили в соответствии со следующей последовательностью циклов: Начальная денатурация: 94 С в течение 2 мин; Денатурация: 95 С в течение 1 мин; Отжиг праймеров: 55 С в течение 1 мин; Синтез ДНК (удлинение праймера): 72 С в течение 1 мин; Количество циклов: 30. ПЦР останавливали при 72 С (7 мин) и охлаждали при 4 С. 1.5.4 Полиморфизм длин рестрикционных фрагментов (ПДРФ) ПЦР-продукты М 13 с положительной вставкой ПЦР-продукта анализировали с использованием рестрикционных эндонуклеаз EcoRI (Sigma), НаеIII (Sigma) и RsaI (Sigma). Рестрикционные ферменты и соответствующие ферменты (доступные от производителя; Sigma) описаны в табл. 2. Таблица 2. Характеристики рестрикционных эндонуклеаз и буферов- 18009055 А) Одна единица каждого фермента расщепляет 1 мг ДНК в течение 1 ч при 37 С. Плазмидную ДНК, амплифицированную с помощью ПЦР М 13 (1,5 или 10 мкл), смешивали с рестрикционными ферментами: 1,0 мкл EcoRI (40 Е), 2,0 мкл НаеIII (20 Е) или 2,0 мкл RsaI (20 Е). Каждую смесь разбавляли до общего объема 50 мкл соответствующей концентрацией ферментативных буферов[1 х] (см. табл. 2). Реакционные смеси инкубировали при 37 С в течение 2,5 ч и помещали на лед для остановки реакции. Ферментативное расщепление анализировали в виде полиморфизма длин рестрикционных фрагментов (ПДРФ) после аналитического электрофореза в агарозном геле. 1.6 Секвенирование плазмидной ДНК Для секвенирования очищенные плазмиды амплифицировали в ПЦР с помощью набора праймеров М 13. ДНК оценивали способом с использованием бромистого этидия и осаждали 60% этанолом и 0,1 МNa-ацетатным буфером (рН 4,6). Осажденные ПЦР-продукты подвергали секвенироваиию ДНК (MedProbe). Последовательности плазмид анализировали в Национальном центре биотехнологической информации (NCBI), используя программу BLAST базы данных NCBI (Altschul et al., 1997). Филогенетические древа и дистанционные матрицы определяли с использованием Phylip interphase программы Ribosomal Database Project (RDP; Maidak et al., 1997). 1.7 Обнаружение Bacteria и Archaea Присутствие Bacteria определяли путем проведения ПЦР с использованием праймеров 341 Вас и 907rВас. После гель-электрофореза присутствие полосы размером 567 п.о. указывает на присутствие в образце бактерий (фиг. 1). ПЦР-продукты переносили на мембрану Hybond N+ путем саузерн-блоттинга и подвергали гибридизации с различными меченными зондами, например, для подтипа 5 бактерий,включающих в себя роды SRB Desulphovibrio и Desulfobulbus (385-SRB). Оба образца из одного месторождения содержали такие бактерии, тогда как образцы из другого месторождения не содержали этих бактерий (фиг. 2). Зонд, определяющий Desulfovibrio, не обнаружил в образце ни одного из этих видов (не показано). 1.8 Гетерогенность ДНК 1.8.1 DGGE Генетическую гетерогенность ПЦР-продуктов, полученных выше, исследовали с помощью DGGEанализа. ПЦР-продукты, определяющие Bacteria, концентрировали в 10 раз и осуществляли электрофорез с непрерывным градиентом 20-70% денатурирующих агентов. Результаты, представленные на фиг. 3,демонстрируют, что ДНК-профили продуктов из образца значительно варьируют. Для скважины 1 из месторождения 1 было обнаружено 6 полос, располагающихся в нижней зоне геля DGGE, тогда как в другом образце из этого месторождения было обнаружено 15 полос, распределенных на большой площади. Два образца из 2-го месторождения показали более однородные результаты, в общей сложности 7-9 полос, обнаруживаемых в амплифицированной ДНК, экстрагированной из водных образцов или эмульсионной фазы. Для двух образцов из 2-го месторождения были продемонстрированы более однородные результаты, в общей сложности 7-9 полос, обнаруживаемых амплифицированной ДНК, экстрагированной из водных образцов или эмульсионной фазы. Установили, что различные полосы определяют условия плавления в DGGE геле. Полученный линейный градиент в геле находился в диапазоне 20-70% денатурирующего агента. Разнообразие картин DGGE анализировали способом с использованием коэффициента сходства. Сходство между образцами из одного и того же месторождения составляло более 50%, варьируя от 53,4 до 64,7% (в среднем 58,6%). Сходство между образцами из разных месторождений составляло менее 50% (диапазон 22,2-33,5%, в среднем 27,5%). Различия в сходстве между образцами из одинаковых и разных месторождений были значительными (Р 0,05). 1.8.2 Клонирование Для дифференцирования генетических вариаций в образцах из месторождений использовали стратегию клонирования. Бактериальные ПЦР-продукты встраивали в вектор pCR 2.1 и трансформировали в компетентные клетки Е. соli ТОР 10. После 3 отдельных клонирований был проанализирован 101 клон с возможным вставками бактериального ПЦР-продукта. Очищенные плазмиды из клонов анализировали с помощью ПЦР М 13, используя праймеры, определяющие плазмидные последовательности, фланкирующие встроенные ПЦР-продукты. Эти праймеры были выбраны, потому что они специфичны в отношении плазмидных последовательностей, фланкирующих встроенные ПЦР-продукты, или отжигаются с ними. Таким образом, можно избежать амплификации геномной 16S рДНК Е. coli. После ПЦР М 13 продукты визуализировали электрофорезом в агарозном геле. Продукты с положительными вставками бактериальных ПЦР-продуктов обнаруживали в виде полосы примерно 800 п.о., тогда как "пустой" продукт(вектор без какого-либо встроенного ПЦР-продукта) визуализировали в виде полосы примерно 240 п.о.(данные не показаны). Результаты показали, что большая часть анализируемых клонов содержала положительную вставку бактериального ПЦР-продукта (n=7/1), тогда как небольшое количество не показало вставку (n=21) и было исключено из дальнейшего анализа. Однако несколько клонов показали оба продукта (n=9). Это может быть результатом трансформации более чем одной плазмиды в отдельные клоны, включая копии- 19009055 вставки ПЦР-продукта и "пустых" плазмид. Кроме того, анализировали плазмиды из 80 клонов (клонов, содержащих вставки ПЦР-продуктов) с использованием рестрикционных эндонуклеаз НаеIII и RsaI для анализа путем полиморфизма длин рестрикционных фрагментов (ПДРФ). Плазмидные последовательности, содержащие вставки, амплифицировали (ПЦР М 13), и продукты подвергали ПДРФ-анализу. После расщепления рестрикционными ферментами картины визуализировали, используя электрофорез в агарозном геле. ПДРФ-анализ выявил значительную вариацию между клонами. Не было обнаружено существенных различий между клонами, имеющими только положительные вставки ПЦР-продуктов, и клонами,имеющими положительные и отрицательные вставки, что указывает на то, что рестрикционные фрагменты были рестрицированы для вставок ПЦР-продуктов. При использовании НаеIII было определено в общей сложности 10 различных генотипов (A-J), продемонстрированных на фиг. 4, тогда как рестрикционный анализ с использованием RsaI выявил в общей сложности 8 генотипов (а-h), как показано на фиг. 5. Распределения пар оснований расщепленных ПЦР-продуктов продемонстрировано в табл. 3 и 4. Таблица 3. Размеры отдельных полос (п.о.) на фиг. 4 (НаеIII ПДРФ), определенные путем сравнения с известными размерами стандартной ДНК (п.о.) Таблица 4. Размеры отдельных полос (п.о.) на фиг. 5 (RsaI ПДРФ), определенные путем сравнения с известными размерами стандартной ДНК (п.о.) Основные генотипические картины продемонстрировали минимальные или умеренные различия в отношении подвижности отдельных полос. Пример этого представлен для типа А НаеIII ПДРФ на фиг. 6. Соответствующие вариации были обнаружены также для нескольких других генотипов, которые содержали несколько клонов. Сравнение основных типов НаеIII и RsaI ПДРФ показало взаимосвязь между картинами, полученными с помощью двух рестрикционных ферментов. Клоны, демонстрирующие гомологичную картину с НаеIII, часто демонстрировали гомологичную картину с RsaI. Было определено 22 уникальных типа на основе объединенных результатов, полученных с использованием двух рестрикционных ферментов, и среди этих 7 картин количественно доминировали картины с количеством клонов не менее 5. Взаимосвязь между картинами ПДРФ и происхождением месторождения представлена в табл. 5. Эти результаты показали, что большинство картин ПДРФ было ограничено одним или другим месторождением, и что образцы из отдельных скважин из каждого месторождения содержали общие типы ПДРФ. Таким образом, было показано присутствие микробной флоры, специфической для месторождения, а не для скважины. В обоих месторождениях также было обнаружено несколько типов ПДРФ (табл. 5). Однако, более тщательная проверка с использованием различий подтипов с высоким разрешением также выявила специфичность месторождения для этих типов ПДРФ с единственным исключением (табл. 6). НаеIII тип АВ и RsaI тип а-а обнаруживался и в образцах из скважины 1 месторождения 1 (1 клон), и в образцах из скважины 2 месторождения 2 (2 клона). На основе связи между типами НаеII и RsaI была создана система типов ПДРФ, которая использует преимущество объединенных картин ПДРФ, полученных с помощью обоих рестрикционных ферментов.- 20009055 Таблица 5. Взамосвязь между типами ПДРФ и происхождением месторождения- 21009055 Таблица 7. Дальнейший анализ типов ПДРФ, основанный на объединенных картинах рестрикционного анализа с помощью НаеII и RsaI.- 22009055 Все клоны помимо клона 13 специфичны в отношении либо месторождения 1, либо месторождения 2. Месторождение 1 имеет разрабатываемые нефтеносные зоны в интервале 68-75 С, тогда как месторождение 2 имеет разрабатываемые нефтеносные зоны в интервале 82-90 С. Очевидно, что в месторождении с меньшей температурой существует большее биоразнообразие. 1.9 Секвенирование Выбранные клоны, представляющие собой уникальные типы ПДРФ, секвенировали с помощью имеющегося в продаже набора Primer Walking Service (MedProbe). Сиквенс осуществляли на бактериальных ПЦР-продуктах, генерирующих плазмиды, содержащие вставки ПЦР-продукта 16S рДНК, с набором праймеров М 13, который включал в себя плазмидные области, фланкирующие встроенные продукты.Primer Walking Service включал в себя секвенирование одноцепочечной последовательности обеих М 13 амплифицированных цепей от 5'-стартового нуклеотида каждой цепи. Ряд последовательностей анализировали с помощью программы BLAST, используя базу данныхNCBl, или с помощью программы Ribosomal Database Project. Для клонов с полными идентифицированными последовательностями использовали полноразмерный 16S рДНК продукт (позиции 341-907 гена) для BLAST анализов, тогда как только часть продукта использовали для клонов с неполными последовательностями. Таким образом, было идентифицировано множество различных микроорганизмов. Пример 2. Материалы образцов Образцы "мелких фракций" были получены из Statoil несколькими партиями. Образцы представляли собой следующие типы: вода, вода/нефть, безводная фильтрованная нефть(толуоловая фаза), эмульсионная фаза, промытая эмульсия, волокна в толуоле, волокна в воде. Экстракция нуклеиновых кислот Для экстракции нуклеиновых кислот использовали различные подходы. Экстракция смесью фенол-хлороформ-изоамиловый спирт Некоторые образцы экстрагировали согласно следующему способу. Полученные образцы немедленно фильтровали через фильтры Durapore (предел эксклюзии 0,22 мкм), и фильтры хранили в 2 мл лизирующего буфера (50 мМ Tris-HCl, pH 8,0; 40 мМ ЭДТА; 750 мМ сахароза) при -20 С до экстракции ДНК. Экстракцию замороженных фильтров осуществляли следующим образом. Вещества "мелких фракций" оттаивали и лизировали непосредственно на фильтрах. Лизис осуществляли путем инкубации каждого фильтра с 2 мкг лизоцима (из исходного раствора 20 мг/мл; при 37 С в течение 30 мин) с последующей инкубацией с 1 мкг протеиназы К (из исходного раствора 20 мг/мл) и 1% (мас./об.) додецилсульфата натрия (ДСН; из 20% исходного раствора) при 55 С в течение 2 ч. Лизаты обрабатывали и анализировали как в примере 1. Экстракция имеющимся в продаже набором для экстракции ДНК Нуклеиновые кислоты из других образцов экстрагировали упрощенным способом с использованием имеющегося в продаже набора "Genomic Prep DNA Isolation Kit" (Pharmacia Biotech, Uppsala, Sverige). Некоторые образцы фильтровали через фильтры Durapore, и эти фильтры помещали в 1 мл "реагента для лизиса клеток" из набора для получения геномной ДНК. Сухие образцы на фильтрах разрушали и инкубировали в 1 мл "реагента для лизиса клеток". Оставшиеся образцы центрифугировали (16000 х g; 5 мин), супернатант отбрасывали и осадок суспендировали в 0,6 мл "реагента для лизиса клеток". Суспензии инкубировали при 80 С в течение 10 мин для лизиса клеток, охлаждали до комнатной температуры,добавляли 3 мкл "раствора рибонуклеазы А" и образец инкубировали при 37 С в течение 30 мин. Добавляли "раствор для осаждения белков" (200 мкл), содержимое пробирок тщательно перемешивали (20 с) для осаждения белков и центрифугировали (15000 х g; 5 мин). Супернатанты (600 мкл) затем смешивали со 100% изопропанолом (600 мкл), смешивали, центрифугировали (15000 х g; 3 мин), осадок промывали 600 мкл этанола (70 об.%) и центрифугировали (15000 х g; 3 мин). Осадки растворяли в 100 мкл "раствора для гибридизации ДНК" и инкубировали при комнатной температуре в течение ночи. Растворы экстрагированных нуклеиновых кислот хранили при -20 С. Амплификация с помощью полимеразной цепной реакции (ПЦР) Олигонуклеотиды и дезоксинуклеотиды такие, как описано в примере 1, и "Touchdown" ПЦР проводили, как также описано в примере 1. Затем проводили аналитический электрофорез в агарозном геле или DGGE, как описано в примере 1. Результаты и обсуждение Обнаружение Bacteria и Archaea путем ПЦР Выбранный экстрагированный материал подвергали ПЦР-амплификации с набором праймеров, определяющих Bacteria или Archaea. Большинство описанных образцов тестировали с помощью ПЦР с использованием набора обоих праймеров. Результаты тестирования могут быть разделены на три группы: а) вода/мелкие фракции" эмульсионной фазы, б) "мелкие фракции" нефтяной фазы (толуоловые экстракты), и в) результаты, полученные с сухих фильтров. Результаты ПЦР с набором бактериальных праймеров из водной или эмульсионной фаз были положительными для 14 из 20 протестированных образцов (70%), для нефтяной фазы для 9 из 11(82%), и для сухих фильтров все 7 протестированных образцов были строго положительными. Все положительные ПЦР-продукты продемонстрировали полосу одноцепочечной ДНК ожидаемого размера длиной примерно 570 п.о. Результаты ПЦР с археальными праймерами продемонстрировали многочисленные полосы слабой или умеренной интенсивности для 8 из 35 протестированных образцов. Ни одна из этих полос не имела ожидаемого размера 930 п.о. Таким образом, авторы изобретения предположили,что археальные полосы представляли собой ложноотрицательные результаты, полученные благодаря отчасти случайному связыванию праймеров. Некоторые ПЦР-продукты продемонстрировали очень интенсивные полосы при электрофорезе в агарозном геле. Они были ограничены образцами воды или образцами, полученными с сухих фильтров. До настоящего времени не было сообщений об обнаружении положительных ПЦР-продуктов в"мелких фракциях", выделенных из нефтяной фазы толуоловой экстракцией. Можно предположить, что"мелкие фракции" демонстрируют амфипатические характеристики. Бактерии могут "прятаться" в содержащем воду защитном полимерном "кэпе", который может проникать в нефтяную фазу. В нефтяной фазе наружная поверхность "мелких фракций" может иметь в основном гидрофобный характер, тогда как внутренняя часть является гидрофильной, захватывая воду и защищая микробы. Поэтому возникают вопросы, могут ли микробы жить и размножаться в полимерных "кэпах" в нефтяных фазах, лишенных воды. Таким образом, микробы могут выживать просто в содержащих воду полимерных "кэпах". ПЦР-продукты с бактериальными праймерами демонстрировали изменчивые результаты, связанные с отдельными сериями. Большинство образцов экстрагировали способом простой экстракции ДНК (с использованием имеющегося в продаже набора для получения геномной ДНК), который продемонстрировал изменчивые результаты ПЦР. После экстракции ДНК с помощью имеющегося в продаже набора,остатки нефти могут быть визуализированы в нескольких экстрактах, как в смеси вода/нефть, так и в толуоловых препаратах, но не в экстрактах с сухих фильтров. Однако первые серии образцов были экстрагированы способом с использованием смеси фенол-хлороформ-изоамиловый спирт. При использовании этого способа ПЦР-продукты продемонстрировали превосходную интенсивность полос при электрофорезе в агарозном геле, и не было обнаружено никаких следов нефти в экстрактах ДНК. Таким образом, результаты ПЦР могут быть связаны с ингибирующими нефтяными соединениями, остающимися в нефти после экстракции. Основная причина, по которой способ с фенолхлороформ-изоамиловым спиртом не используют для всех образцов, заключалась в трудоемкости этого способа. Таким образом, эти результаты придают особое значение требованиям оптимизации способов экстракции ДНК. Модифицированный способ с фенол-хлороформ-изоамиловым спиртом дает возможность экстрагировать большие количества образцов. В заключение, бактерии были обнаружены в образцах, полученных из большинства тестируемых образцов, включая воду/эмульсии/нефтяные фазы, нефтяные фазы (полученные в толуоле) и безводные фильтры. Особый интерес представляло обнаружение бактериальной ДНК в образцах нефтяной фазы. Используемые здесь способы, не зависящие от культуры, давали возможность осуществлять микробный анализ, несмотря на разрушающую предварительную обработку образца, что приводило в результате к гибели микробов, присутствующих в образцах.DGGE-анализы выбранных образцов осуществляли с использованием ПЦР-продуктов, амплифицированных с помощью набора бактериальных праймеров. Результаты визуализированы на фиг. 7 и собраны в табл. 7. Таблица 8. Обобщение результатов DGGE, представленных на фиг. 7) Числа, отмеченные звездочкой, относятся к тем полосам DGGE, которые визуально определяются по интенсивности как основные. Пример 3. Корреляция видов бактерий, присутствующих в различных скважинах из месторождения 2 Способы, описанные в примерах 1 и 2, использовали для изучения разнообразия микробных популяций в 3 различных скважинах из месторождения 2. На фиг. 8 показаны полосы DGGE, обнаруженные при проведении DGGE на ПЦР-продуктах, полученных с использованием специфических бактериальных зондов, указанных выше. Факт, что для трех скважин наблюдается различное распределение полос в DGGE, указывает на то, что микробиологический профиль в целом может быть разным. Это исследовали дополнительно путем клонирования и секвенирования ПЦР-продуктов, как описано в примерах 1 и 2. Картина, наблюдаемая при простом проведении DGGE, может указывать на присутствующие микроорганизмы (например, А 14 представляет типичную картину Arcobacter). Результаты клонирования и секвенирования представлены на фиг. 9, на которой показано количество клонов различных видов, присутствующих в трех скважинах. Только -протеобактерии обнаружены более чем в одной скважине. Это показывает, что можно осуществлять картирование образца для отдельной скважины в преде- 25009055 лах месторождения. Кроме того, это может быть связано также с конкретными зонами месторождения или с конкретным минералогическим типом нефти. Скважина может быть обследована также в отношении ее производительности, и/или данные могут быть связаны с температурным диапазоном конкретной зоны месторождения. Пример 4. Тип ПДРФ для Archaea исследовали в образцах, взятых из трех различных выходов нефти в Северном море. Эти способы осуществляли, как описано выше, и результаты дополнительно подтверждали тот факт, что различные микробиологические профили могут коррелировать с образцами, взятыми из разных выходов. Например, тип I ПДРФ обнаружен во всех трех выходах, тогда как каждый из типов 3, 6 и 7 ПДРФ был обнаружен только в одном выходе нефти (фиг. 10). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ обнаружения, характеристики или мониторинга углеводородной зоны, включающий генотипический анализ образца на присутствие одного или более чем одного термофильного или экстремофильного микроорганизма, где указанная характеристика включает в себя корреляцию присутствия одного или более чем одного указанного микроорганизма со свойствами рассматриваемых углеводородов. 2. Способ по п.1, где образец получен из подповерхностной формации. 3. Способ по п.1 или 2, где образец представляет собой нефть, воду или смесь нефть/вода из разведочной или эксплуатационной скважины. 4. Способ по любому из пп.1-3, где образец представляет собой нефть или воду, которая контактировала с нефтью. 5. Способ по любому из пп.1-4, где информацию относительно присутствующих микроорганизмов используют в процессе непрерывной разведки и добычи. 6. Способ по любому из пп.1-5, где обнаруживают множество различных микроорганизмов, получая при этом микробиологический профиль указанного образца. 7. Способ по п.6, где полученный микробиологический профиль сравнивают с одним или более эталонными профилями. 8. Способ по любому из пп.1-7, где образец анализируют на присутствие Archaeglobus, Erythrobacter, Arcobacter, Geothermobacter, Thermodesulforhabdus и Thermotogales. 9. Способ по любому из пп.1-8, не включающий стадию культивирования. 10. Способ по любому из пп.1-9, где образец приводят в контакт с одним или более чем одним другим олигонуклеотидом, сконструированным для гибридизации с областями нуклеиновой кислоты из или происходящих из термофильных, или экстремофильных микроорганизмов. 11. Способ по любому из пп.1-10, где, по меньшей мере, некоторые из нуклеиновых кислот в образце амплифицируют. 12. Способ по любому из пп.1-11, где углеводородную зону характеризуют таким образом, что получают информацию о типе нефти, количестве нефти, качестве нефти, содержании серы в нефти, присутствии газа или соотношении газ/нефть. 13. Способ по любому из пп.1-11, где углеводородную зону характеризуют таким образом, что определяют глубину углеводородной зоны, причем конкретные идентифицированные микроорганизмы указывают на определенную глубину. 14. Способ по любому из пп.1-11, где углеводородную зону характеризуют таким образом, что определяют миграционный путь указанной углеводородной зоны. 15. Способ по п.13 или 14, где углеводородная зона представляет собой нефтяное месторождение. 16. Способ по любому из пп.1-15, где генотипический анализ выполняют с использованием одного или более чем одного зонда из группы, представленной SEQ ID No. 1-SEQ ID No. 19. 17. Олигонуклеотид, как он определен в любой из SEQ ID No. 5-SEQ ID No. 19, или его функционально эквивалентный вариант. 18. Твердый носитель с присоединенным к нему одним или более чем одним олигонуклеотидом по п.17. 19. Твердый носитель по п.18, представляющий собой микрочип. 20. Твердый носитель по п.18 или 19, имеющий по меньшей мере 4 присоединенных к нему олигонуклеотида по п.17. 21. Набор для применения в способе по любому из пп.1-16, включающий один или более чем один олигонуклеотид по п.17.
МПК / Метки
МПК: C12Q 1/68
Метки: месторождений, углеводородных, обнаружения, характеристики, мониторинга, способы
Код ссылки
<a href="https://eas.patents.su/30-9055-sposoby-obnaruzheniya-harakteristiki-i-monitoringa-uglevodorodnyh-mestorozhdenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Способы обнаружения, характеристики и мониторинга углеводородных месторождений</a>
Предыдущий патент: Система выплаты призовых денег, устройство выдачи призовых билетов и устройство учета призовых билетов
Следующий патент: Связывающие агенты, ингибирующие миостатин
Случайный патент: Тонкостенный контейнер для продукта