Кристаллический полуторогидрат азитромицина, содержащая его фармацевтическая композиция и способ лечения на его основе
Формула / Реферат
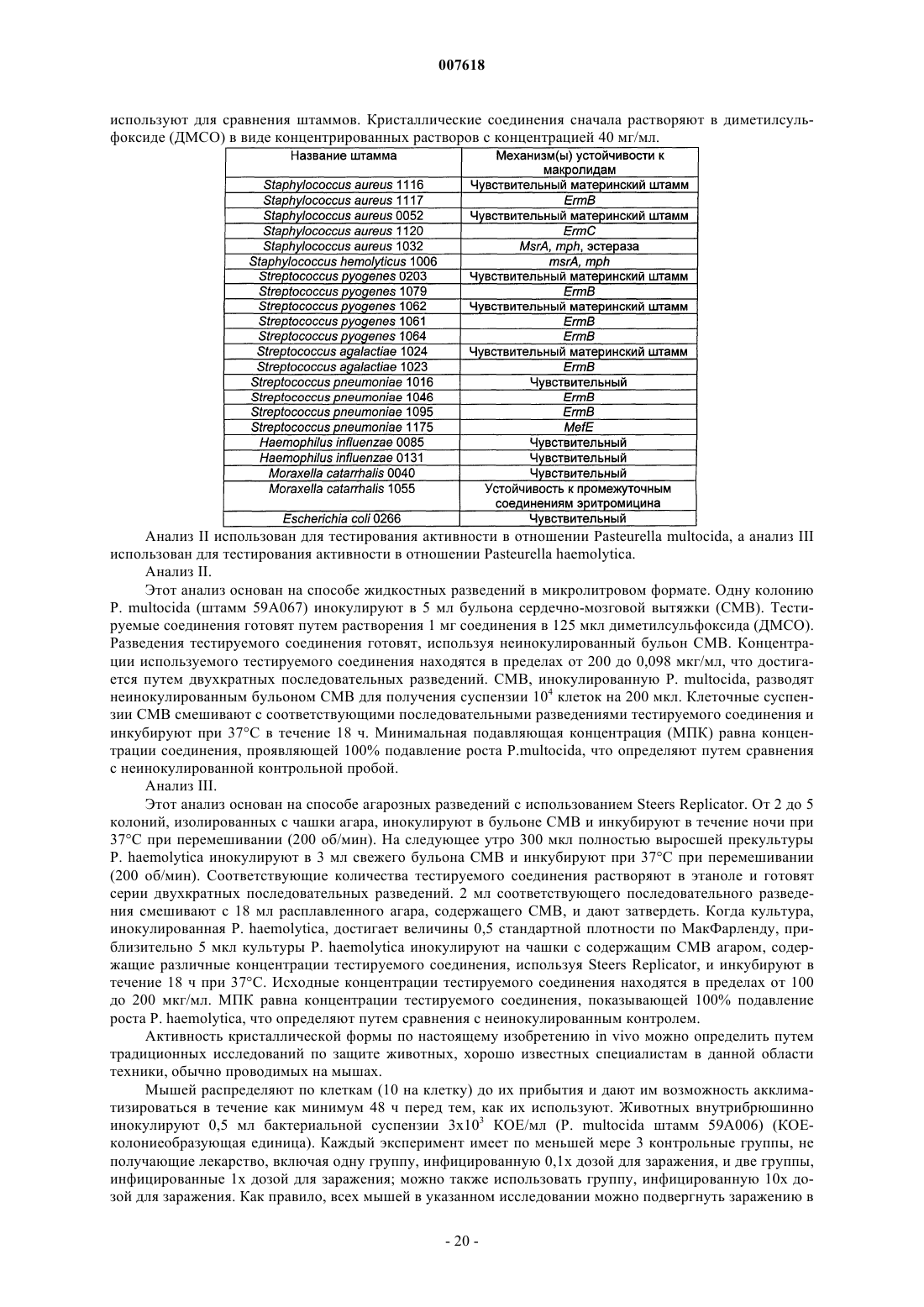
1. Кристаллический полуторогидрат азитромицина, характеризующийся спектром 13С твердотельного ЯМР, содержащим совокупность пиков с химическими сдвигами 179,5 м.д., являющимся одним пиком с расщеплением между 0 м.д. и 0,3 м.д.; 10,4 м.д.; 9,9 м.д.; 9,3 м.д.; 7,6 м.д.; 6,5 м.д.; где указанные пики могут проявлять изменение в химическом сдвиге в пределах +0,2 м.д.
2. Кристаллический полуторогидрат азитромицина по п.1, по существу, в чистой форме.
3. Кристаллическая форма азитромицина по п.1 или 2, где указанная форма характеризуется тем, что содержит 2,5-6% воды и менее 1% органического растворителя по массе в порошковом образце.
4. Кристаллическая форма азитромицина по п.2, где указанный азитромицин включает в себя 90% по массе или более полуторогидрата азитромицина.
5. Кристаллическая форма азитромицина по п.2, где указанный азитромицин включает в себя 95% по массе или более полуторогидрата азитромицина.
6. Фармацевтическая композиция, содержащая кристаллическую форму азитромицина по любому из пп.1-5 и фармацевтически приемлемый эксципиент.
7. Способ лечения бактериальной инфекции или протозойной инфекции у млекопитающего, рыбы или птицы, при котором указанному млекопитающему, рыбе или птице вводят терапевтически эффективное количество кристаллической формы азитромицина по любому из пп.1-5.
Текст
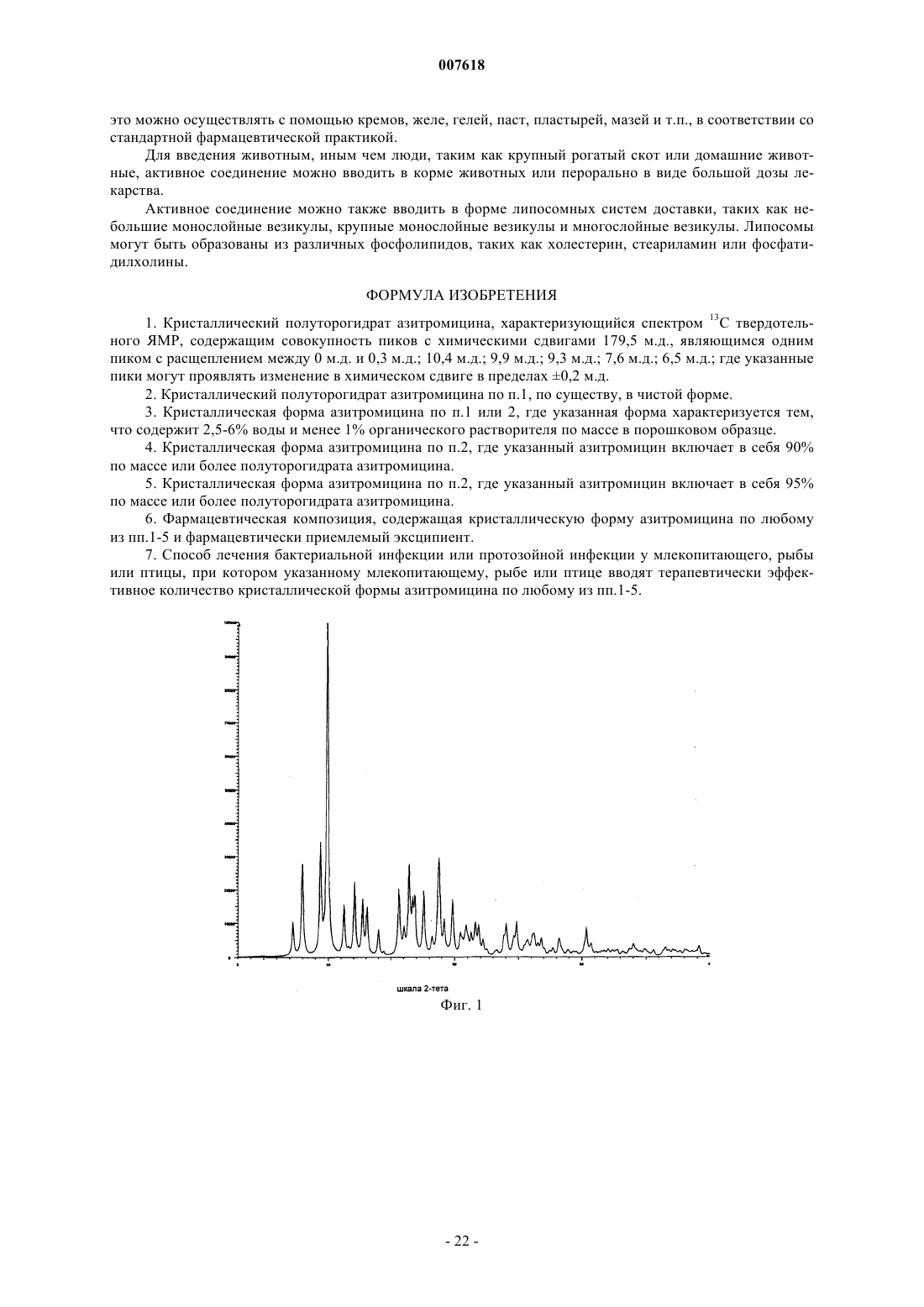
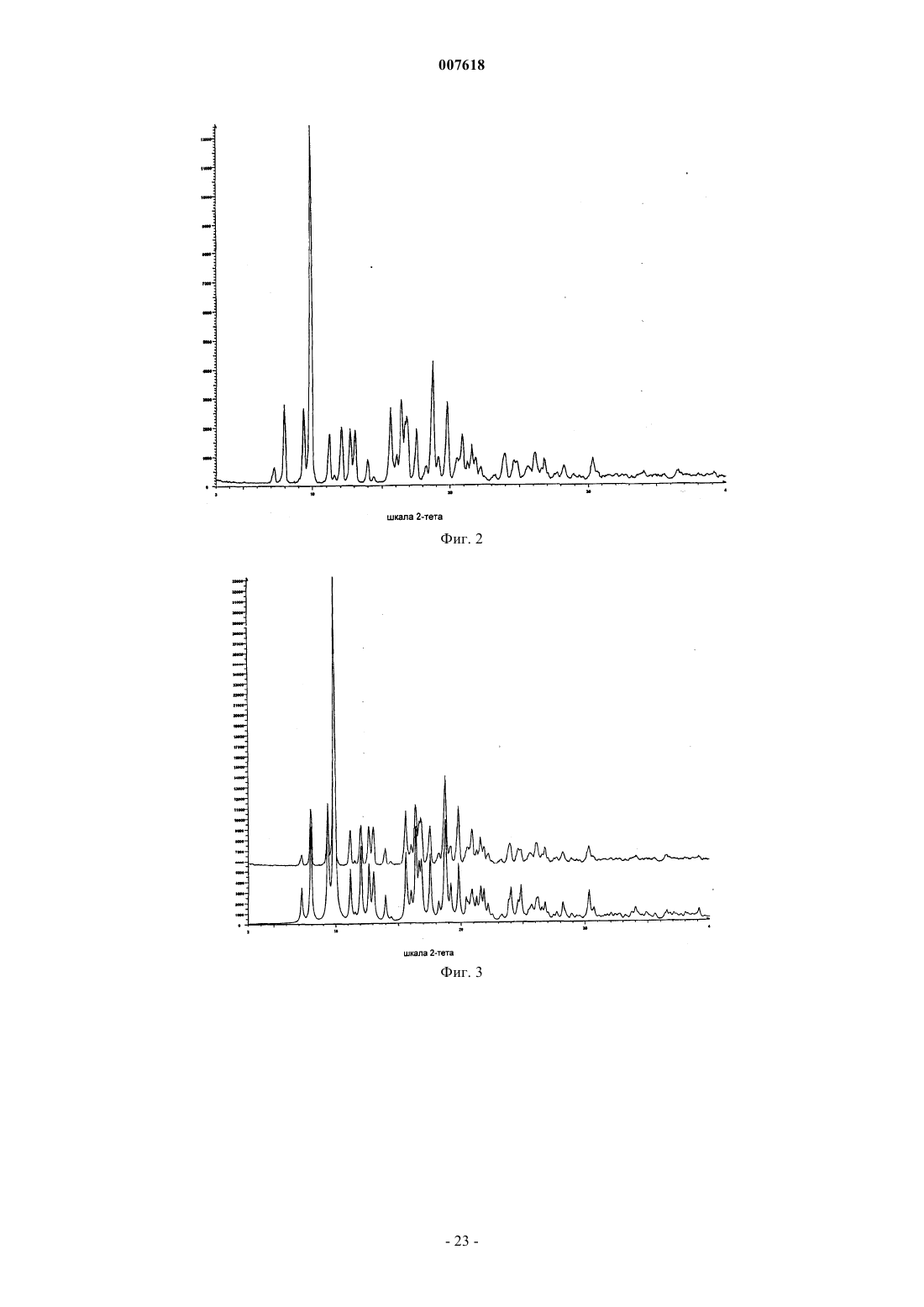
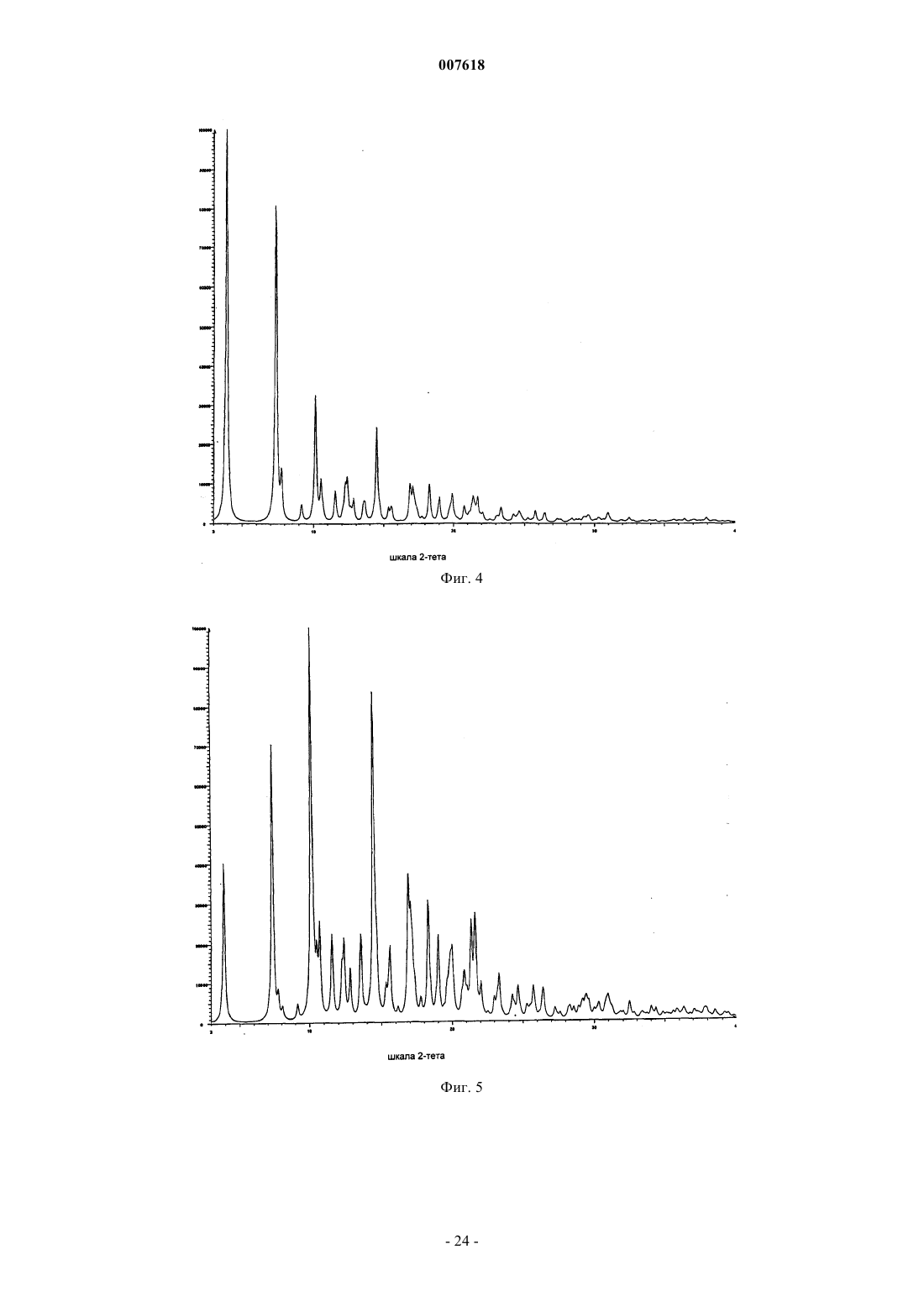
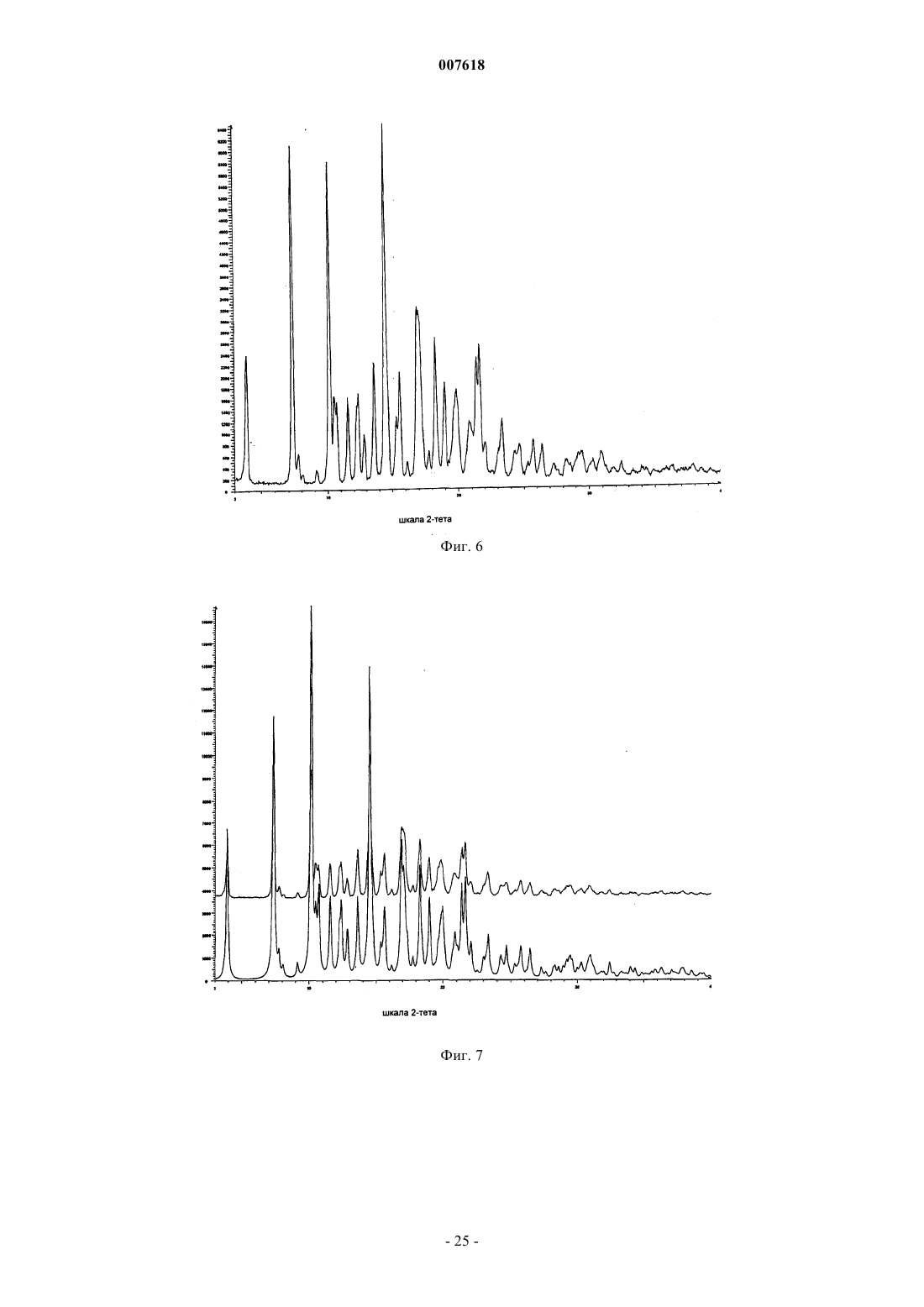
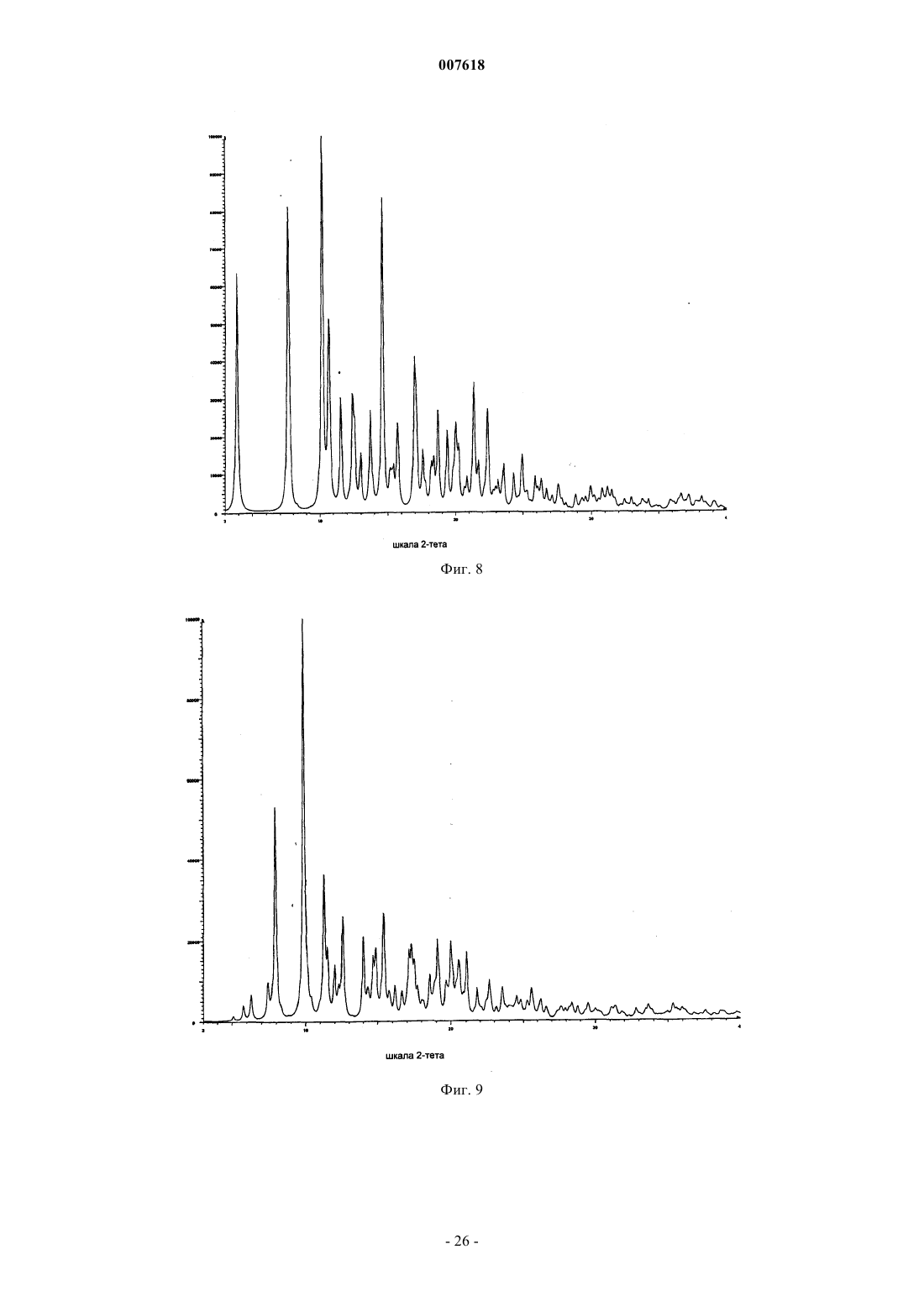
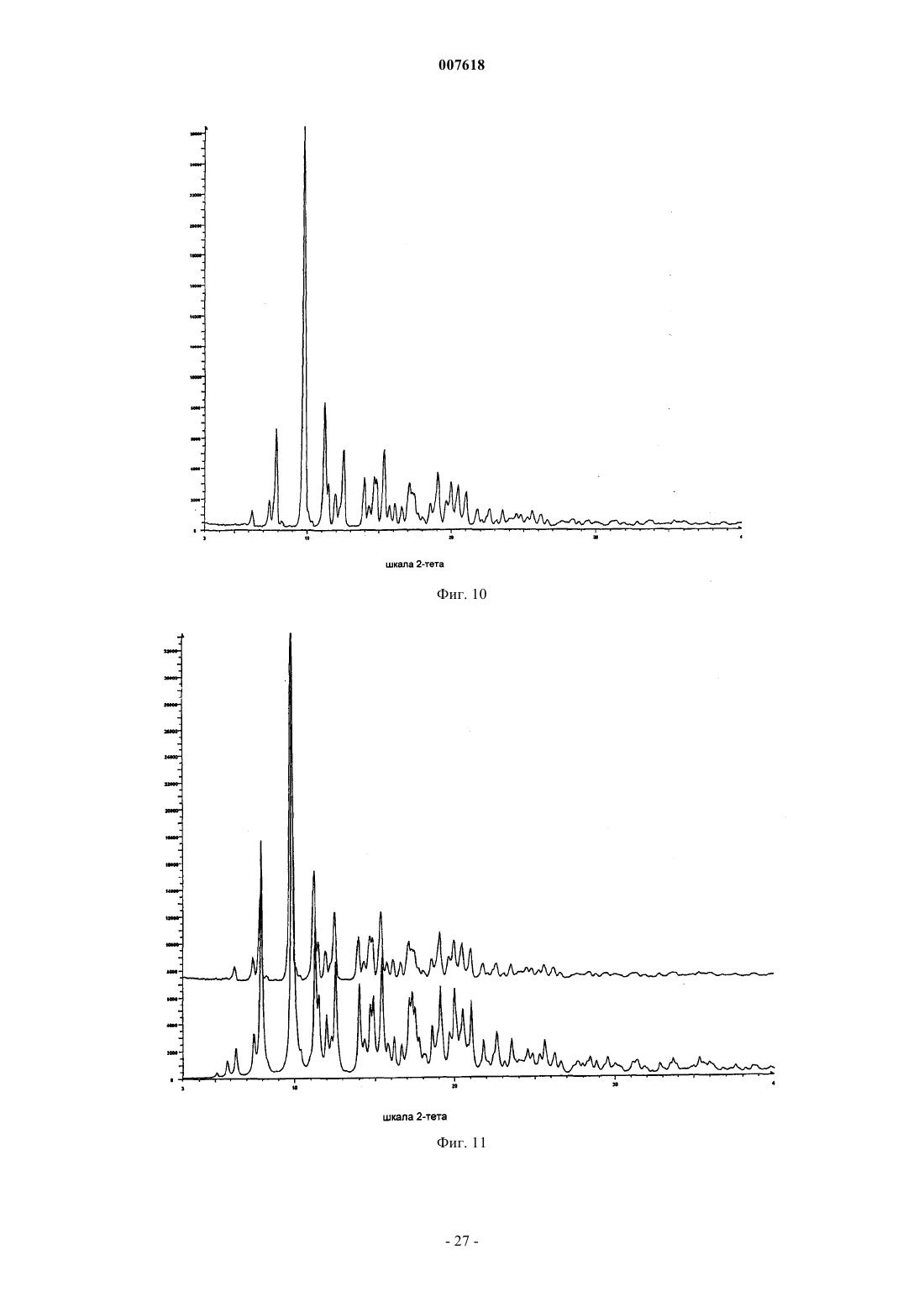
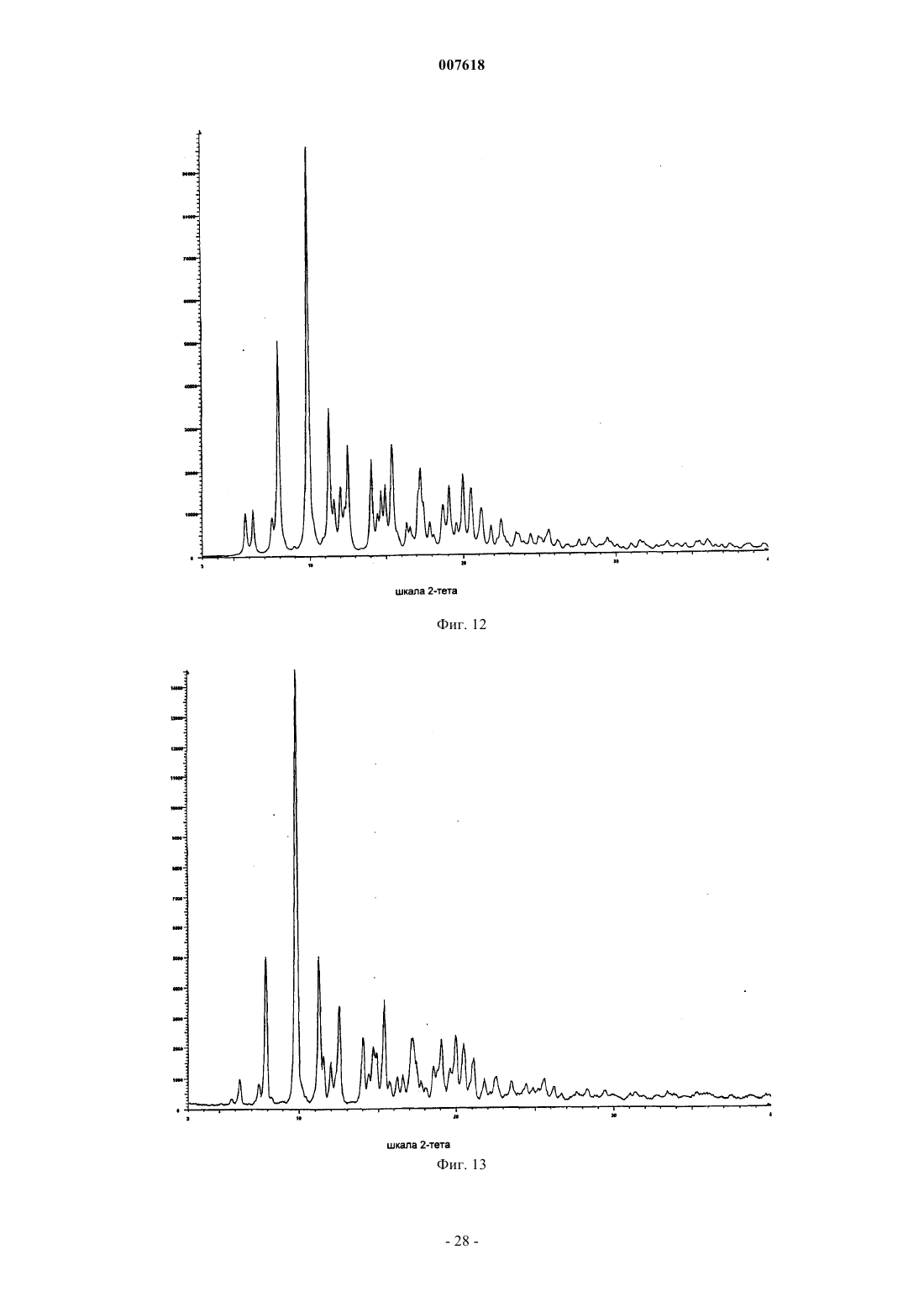
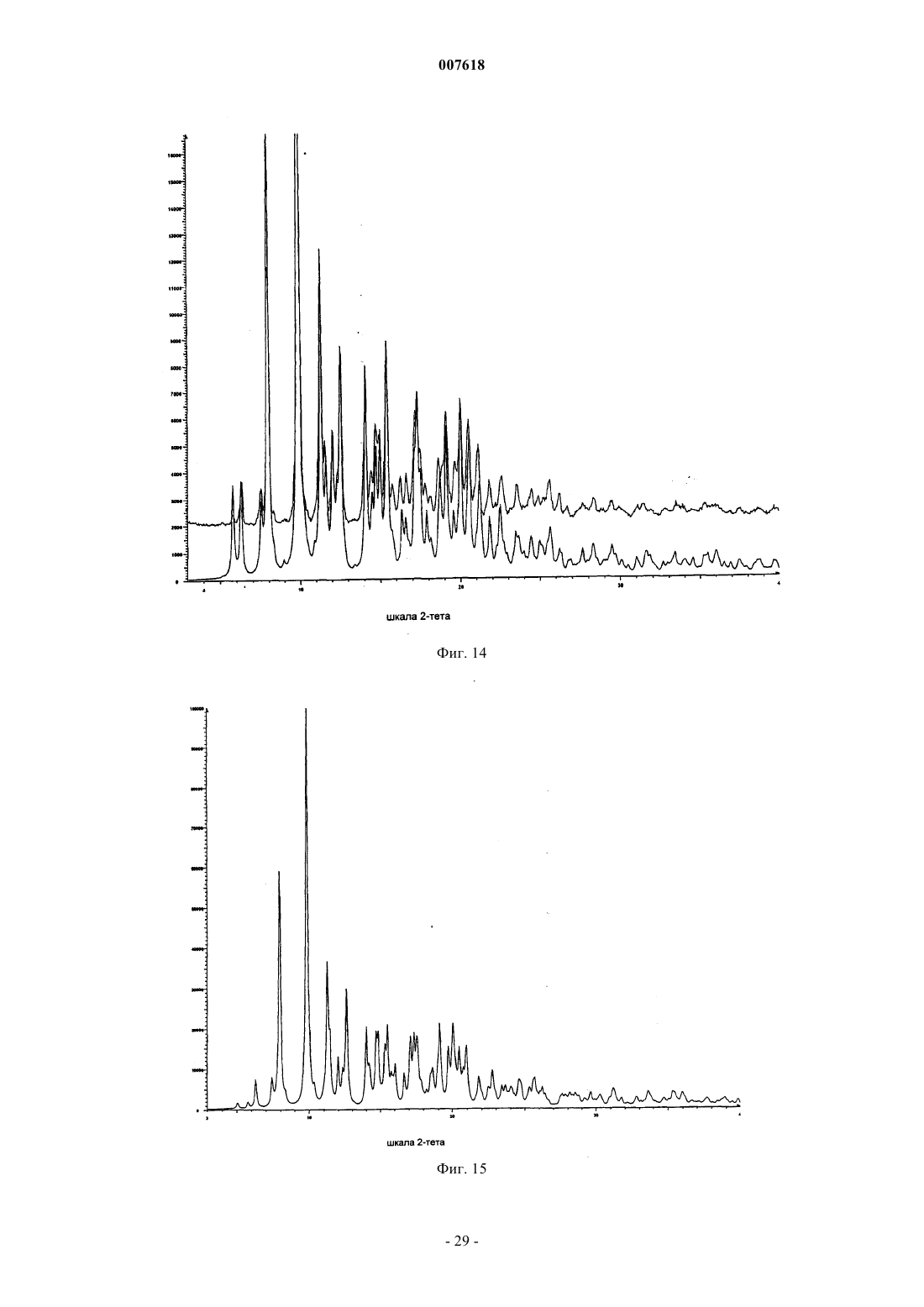
007618 Предшествующий уровень техники Данное изобретение относится к кристаллическим формам азитромицина, а именно к полуторогидрату азитромицина (форме G). Азитромицин имеется в продаже и представляет собой эффективный антибиотик при лечении широкого спектра бактериальных инфекций. Кристаллическая форма по данному изобретению также полезна в качестве антибиотического агента у млекопитающих, включая человека, а также у рыб и птиц. Азитромицин имеет следующую структурную формулу: Азитромицин описан в патентах США 4517359 и 4474768. Он также известен под названием 9 дезоксо-9 а-аза-9 а-метил-9 а-гомоэритромицин А. Другие патенты или заявки на патент, которые прямо или косвенно относятся к азитромицину,включают в себя: ЕР 298650, в которой заявлен дигидрат азитромицина; патент США 4963531, который относится к способу лечения от штамма вида Toxoplasma gondii; патент США 5633006, который относится к фармацевтической композиции в виде жевательной таблетки или жидкой суспензии с пониженной горечью; патент США 5686587, который относится к промежуточному соединению, полезному при получении азитромицина; патент США 5605889, который относится к лекарственной форме для перорального применения, которая уменьшает "пищевой эффект", связанный с приемом азитромицина; патент США 6068859, который относится к контролируемой лекарственной форме, содержащей азитромицин; патент США 5498699, который относится к композиции, содержащей азитромицин в комбинации с бивалентными или тривалентными металлами; ЕР 925789, в которой заявлен способ лечения глазных инфекций; заявка на патент Китая CN 1123279 А, которая относится к водорастворимым солям азитромицина; заявка на патент Китая CN 1046945C, которая относится к двойным натриеводигидрофосфатным солям азитромицина; заявка на патент Китая CN 1114960A, которая относится к кристаллам азитромицина; заявка на патент Китая CN 1161971 А, которая относится к кристаллам азитромицина; заявка на патент Китая CN 1205338A, которая относится к способу получения водорастворимых солей азитромицина; международная публикация WO 00/32203, которая относится к этаноляту азитромицина; и заявка на Европейский патент ЕР 984020, которая относится к изопропаноловому клатрату моногидрата азитромицина. Сущность изобретения Согласно настоящему изобретению предложен кристаллический полуторогидрат азитромицина (формаG), характеризующийся спектром 13C твердотельного ЯМР, содержащим совокупность пиков с химическими сдвигами 179,5 м.д., являющимся одним пиком с расщеплением между 0 и 0,3 м.д.; 10,4 м.д.; 9,9 м.д.; 9,3 м.д.; 7,6 м.д.; 6,5 м.д.; где указанные пики могут проявлять изменение в химическом сдвиге в пределах 0,2 м.д., предпочтительно в по существу чистой форме. Кристаллическая форма азитромицина по изобретению характеризуется тем, что содержит 2,5-6% воды и менее 1% органического растворителя по массе в порошковом образце. Предпочтительной является кристаллическая форма азитромицина по изобретению, где указанный азитромицин включает в себя 90% по массе или более полуторогидрата азитромицина, еще более предпочтительной является кристаллическая форма, где указанный азитромицин включает в себя 95% по массе или более полуторогидрата азитромицина. Согласно изобретению предложена также фармацевтическая композиция, содержащая кристаллическую форму азитромицина по изобретению и фармацевтически приемлемый эксципиент. Изобретение также относится к способу лечения бактериальной инфекции или протозойной инфекции у млекопитающего, рыбы или птицы, при котором указанному млекопитающему, рыбе или птице вводят терапевтически эффективное количество кристаллической формы азитромицина по изобретению. В настоящем описании с иллюстративными целями раскрыты также кристаллические формы азитромицина, выбранные из форм C, D, E, F, G, H, J, М, N, О, P, Q и R, где указанные формы являются такими как здесь определено. Формы F, G, H, J, M, N, О и Р относятся к семейству I азитромицина и относятся к моноклинной пространственной группе P21 с размерами ячейки a=16,30,3 , b=16,20,3 , c=18,40,3 и бета=1092. Формы C, D, Е и R относятся к семейству II азитромицина и относятся к орторомбиче-1 007618 ской пространственной группе P212121 с размерами ячейки a=8,90,4 , b=12,30,5 и c=45,80,5 . Форма Q отличается от семейств I и II. Форма F азитромицина имеет формулу C38H72N2O12H2O0,5C2H5OH в структуре монокристалла, являясь полуэтанольным сольватом моногидрата азитромицина. Форма F, кроме того, отличается тем, что содержит 2-5% воды и 1-4% этанола по массе в порошковых образцах и имеет пики 20 рентгеновской дифракции на порошке, такие как определенные в табл. 9. Спектр 13C ттЯМР (твердотельного ядерного магнитного резонанса) формы F имеет два пика с химическим сдвигом приблизительно 1791 м.д., а именно 179,50,2 м.д. и 178,6 0,2 м.д., набор из пяти пиков между 6,4 и 11,0 м.д., и этанольные пики 58,00,5 м.д. и 17,20,5 м.д. Пики растворителя могут быть широкими и относительно слабыми по интенсивности. Описана также по существу чистая форма F азитромицина, форма F азитромицина, по существу свободная от формы G азитромицина, и форма F азитромицина, по существу свободная от дигидрата азитромицина. Описаны также способы получения формы F азитромицина, при которых азитромицин обрабатывают этанолом до полного растворения при 40-70 С и охлаждают с уменьшением объема этанола или добавлением воды для того, чтобы осуществить кристаллизацию. Также описаны способы получения по существу чистой формы F азитромицина, формы F азитромицина, по существу свободной от формы G азитромицина, и формы F азитромицина, по существу свободной от дигидрата азитромицина. Форма G азитромицина имеет формулу C38H72N2O121,5H2O в структуре монокристалла, являясь полуторогидратом азитромицина. Форма G, кроме того, отличается тем, что содержит 2,5-6% воды и 1% органического растворителя(лей) по массе в порошковых образцах и имеет пики 20 рентгеновской дифракции на порошке, такие как определенные в табл. 9. 13C ттЯМР формы G имеет один пик с химическим сдвигом приблизительно 1791 м.д., а именно 179,50,2 м.д. (может присутствовать расщепление 0,3 м.д.) и набор из пяти пиков между 6,3 и 11,0 м.д. Данное изобретение также относится по существу к чистой форме G азитромицина и форме G азитромицина по существу свободной от дигидрата азитромицина. Данное изобретение также относится к способам получения по существу чистой формы G азитромицина и формы G по существу свободной от дигидрата азитромицина, при которых азитромицин обрабатывают смесью метанола и воды или ацетона и воды до полного растворения при 40-60 С и охлаждают для того, чтобы осуществить кристаллизацию. Форма Н азитромицина имеет формулу C38H72N2O12H2OC3H8O2, являясь полу-1,2-пропандиоловым сольватом моногидрата азитромицина. Форма J азитромицина имеет формулу C38H72N2O12H2O0,5C3H7OH в структуре монокристалла, являясь полу-н-пропаноловым сольватом моногидрата азитромицина. Форма J, кроме того, отличается тем,что содержит 2-5% воды и 1-5% 1-пропанола по массе в порошковых образцах и имеет пики 20 рентгеновской дифракции на порошке, такие как определенные в табл. 9. Спектр 13C ттЯМР формы J имеет два пика с химическим сдвигом приблизительно 179 1 м.д., а именно 179,60,2 м.д. и 178,40,2 м.д., набор из пяти пиков между 6,6 и 11,7 м.д., и н-пропаноловый пик 25,20,4 м.д. Пики растворителя могут быть широкими и относительно слабыми по интенсивности. В данном описании раскрыты также способы получения формы J, при которых азитромицин обрабатывают н-пропанолом до полного растворения при 25-55 С и охлаждают с добавлением воды для того,чтобы осуществить кристаллизацию. Форма М азитромицина имеет формулу C38H72N2O12H2O0,5C3H7OH, являясь полуизопропаноловым сольватом моногидрата азитромицина. Форма М, кроме того, отличается тем, что содержит 2-5% воды и 1-4% 2-пропанола по массе в порошковых образцах и имеет пики 2 рентгеновской дифракции на порошке, такие как определенные в табл. 9. Спектр 13 С ттЯМР формы М имеет один пик с химическим сдвигом приблизительно 1791 м.д., а именно 179,60,2 м.д., пик 41,90,2 м.д., набор из шести пиков между 6,9 и 16,4 м.д., и изопропаноловый пик 26,00,4 м.д. Пик растворителя может быть широким и относительно слабым по интенсивности. Описаны также по существу чистая форма М азитромицина, форма М азитромицина, по существу свободная от формы G азитромицина, и форма М азитромицина, по существу свободная от дигидрата азитромицина. В данном описании также раскрыты способы получения по существу чистой формы М азитромицина, формы М азитромицина, по существу свободной от формы G азитромицина, и формы М азитромицина, по существу свободной от дигидрата азитромицина, при которых азитромицин обрабатывают изопропанолом до полного растворения при 40-60 С и восстанавливают изопропанол с последующим охлаждением или охлаждают с последующим добавлением воды для того, чтобы осуществить кристаллизацию. Форма N азитромицина представляет собой смесь изоморфов семейства I. Смесь может содержать различные процентные концентрации изоморфов F, G, H, J, M и других, и различные количества воды и органических растворителей, таких как этанол, изопропанол, н-пропанол, пропиленгликоль, ацетон, аце-2 007618 тонитрил, бутанол, пентанол и др. Массовая процентная концентрация воды может составлять от 1 до 5% и общая массовая процентная концентрация органических растворителей может составлять 2-5% при содержании каждого растворителя от 0,5 до 4%. Образцы формы N демонстрируют все характеристические пики представителей семейства I в различных пропорциях. Форма N может быть охарактеризована как "смешанные кристаллы" или "кристаллические твердые растворы" изоморфов семейства I. Форма N демонстрирует химические сдвиги в виде комбинации изоморфов семейства I. Пики могут различаться по химическому сдвигу в м.д. в пределах 0,2 м.д. и по относительным интенсивностям и ширине вследствие смешивания в различных пропорциях изоморфов, содержащихся в кристаллическом твердом растворе формы N. Форма Р азитромицина имеет формулу C38H72N2O12H2O0,5C5H12O, являясь полу-н-пентаноловым сольватом моногидрата азитромицина. Форма Q азитромицина имеет формулу C38H72N2O12H2O0,5C4H8O, являясь полутетрагидрофурановым сольватом моногидрата азитромицина. Форма R азитромицина имеет формулу C38H72N2O12H2OC5H12O, являясь моногидратом моносольвата азитромицина с метила mpem-бутиловым эфиром. Форма D азитромицина имеет формулу C38H72N2O12H2OC6H12 в структуре своего монокристалла,являясь моноциклогексановым сольватом моногидрата азитромицина. Форма D, кроме того, отличается тем, что содержит 2-6% воды и 3-12% циклогексана по массе в порошковых образцах и имеет репрезентативные пики 2 рентгеновской дифракции на порошке, такие как определенные в табл. 9. Спектр 13 С ттЯМР формы D имеет один пик с химическим сдвигом приблизительно 1791 м.д., а именно 178,10,2 м.д., и пики 103,90,2 м.д., 95,10,2 м.д., 84,20,2 м.д., и набор из трех пиков между 8,4 и 11 м.д. В данном описании также раскрыт способ получения формы D, при котором дигидрат азитромицина суспендируют с циклогексаном. Форма Е азитромицина имеет формулу C38H72N2O12H2OC4H8O, являясь монотетрагидрофурановым сольватом моногидрата азитромицина. Описаны также азитромицин в аморфном состоянии и способ получения аморфного азитромицина,при котором удаляют воду и/или растворители из кристаллической решетки азитромицина. Рентгеновская порошковая дифрактограмма для аморфного азитромицина демонстрирует отсутствие острых пиков 2, но имеет два широких закругленных пика. Первый пик возникает между 4 и 13. Второй пик возникает между 13 и 25. Описаны также способы получения кристаллической формы G азитромицина, при которых суспендируют азитромицин в подходящем растворителе или растворяют азитромицин в нагретом органическом растворителе или растворе органический растворитель/вода и осаждают кристаллический азитромицин путем охлаждения раствора с уменьшением объема растворителя, или путем растворения азитромицина в растворителе или смеси растворителей и осаждения кристаллического азитромицина путем добавления воды к раствору. Азитромицин в аморфном состоянии получают путем нагревания кристаллического азитромицина в вакууме. Используемый здесь термин "лечение", если не оговорено особо, обозначает лечение или предотвращение бактериальной инфекции или протозойной инфекции в соответствии с тем как было предложено в способе по настоящему изобретению, включая выздоровление, уменьшение симптомов или замедление прогрессирования указанного заболевания. Термин "по существу свободная от", когда относится к указанной кристаллической форме азитромицина, обозначает, что присутствует менее 20% (по массе) указанной кристаллической формы (форм),более предпочтительно, присутствует менее 10% (по массе) указанной кристаллической формы (форм),более предпочтительно, присутствует менее 5% (по массе) указанной кристаллической формы (форм), и наиболее предпочтительно, присутствует менее 1% (по массе) указанной кристаллической формы(форм). Например, форма G азитромицина, по существу свободная от дигидрата азитромицина, обозначает форму G с 20% или менее 20% (по массе) дигидрата азитромицина, более предпочтительно 10% или менее 10% (по массе) дигидрата азитромицина, наиболее предпочтительно 1% (по массе) дигидрата азитромицина. Термин "по существу чистая", когда относится к указанной кристаллической форме азитромицина,означает, что указанная кристаллическая форма содержит менее 20% (по массе) остаточных компонентов, таких как альтернативная полиморфная или изоморфная кристаллическая форма(мы) азитромицина. Предпочтительно, чтобы по существу чистая форма азитромицина содержала менее 10% (по массе) альтернативных полиморфных или изоморфных кристаллических форм азитромицина, более предпочтительно, менее 5% (по массе) альтернативных полиморфных или изоморфных кристаллических форм азитромицина, и наиболее предпочтительно, менее 1% (по массе) альтернативных полиморфных или изоморфных кристаллических форм азитромицина. Термин "по существу в отсутствие дигидрата азитромицина", когда относится к массе кристаллического азитромицина или композиции, содержащей кристаллический азитромицин, означает, что кристаллический азитромицин содержит менее чем приблизительно 5% (по массе) дигидрата азитромицина, бо-3 007618 лее предпочтительно, менее чем приблизительно 3% (по массе) дигидрата азитромицина, и наиболее предпочтительно, менее чем 1% (по массе) дигидрата азитромицина. Используемый здесь термин "бактериальная(ые) инфекция(и)" или "протозойная инфекция", если не оговорено особо, включает в себя бактериальные инфекции и протозойные инфекции и заболевания,вызываемые такими инфекциями, которые встречаются у млекопитающих, рыб и птиц, а также расстройства, связанные с бактериальными инфекциями и протозойными инфекциями, которые можно лечить или предупреждать путем введения антибиотиков, таких как соединение по настоящему изобретению. Такие бактериальные инфекции и протозойные инфекции и связаные с такими инфекциями расстройства включают в себя следующие: пневмония, средний отит, синусит, бронхит, тонзилит и мастоидит, связаные с заражением Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis,Staphylococcus aureus или Peptostreptococcus spp.; фарингит, ревматическая лихорадка и гломерулонефрит, связанные с заражением Streptococcus pyogenes, стрептококками групп С и G, Clostridium diphtheriae или Actinobacillus haemolyticum; инфекции дыхательных путей, связанные с заражением Mycoplasmapneumoniae; не давшие осложнений инфекции кожи и мягких тканей, абсцессы и остеомиелит, и родильная горячка, связанные заражением Staphylococcus aureus, коагулаза-положительными стафилококкамиminutissium, Clostridium spp. или Bartonella henselae; не давшие осложнений острые инфекции мочевыводящих путей, связаные с заражением Staphylococcus saprophytics или Enterococcus spp.; уретрит и цервицит; и болезни, передаваемые половым путем, связанные с заражением Chlamydia trachomatis, Haemophilus ducreyi, Treponema pallidum, Ureaplasma urealyticum или Neiserria gonorrheae; вызванные токсином заболевания, связанные с заражением S. aureus (пищевое отравление и синдром токсического шока) или стрептококками Групп А, В и С; язвы, связанные с заражением Helicobacter pylori; системные лихорадочные синдромы, связанные с заражением Borrelia recurrentis; болезнь Лима, связанная с заражениемBorrelia burgdorferi; конъюнктивит, кератит и дакроцистит, связанные с заражением Chlamydia trachomatis, Neisseria gonorrhoeae, S. aureus, S. pneumoniae, S. pyogenes, H. Influenzae или Listeria spp.; диссеминированный комплекс Mycobacterium avium (МАК), связанный с заражением Mycobacterium avium или Mycobacterium intracellular; гастроэнтерит, связанный с заражением Campylobacter jejuni; поражение кишечного тракта простейшими, связанное с заражением Cryptosporidium spp.; одонтогенная инфекция, связанная с заражением зеленящими стрептококками; стойкий кашель, связанный заражением Bordetella pertussis; газовая гангрена, связанная с заражением Clostridium perfringens или Bacteroides spp.; и атеросклероз,связанный с заражением Helicobacter pylori или Chlamydia pneumoniae. Атеросклероз и малярия также включены. Бактериальные инфекции и протозойные инфекции и связанные с такими инфекциями расстройства, которые можно лечить или предупреждать у животных, включают в себя следующие: респираторное заболевание у жвачных животных, связанное с заражением P.haemolytica., P.multocida, Mycoplasma bovis или Bordetella spp.; кишечное заболевание у коров, связанное с заражением E.coli или простейшими (например coccidia, Cryptosporidia, и.т.д); мастит у молочных коров, связанный с заражением S. aureus, Strep. uberis, Streptococcus agalactiae, Streptococcus dysgalactiae, Klebsiella spp., Corynebacterium или Enterococcus spp., респираторное заболевание у свиней, связанное с заражением A.pleuro,P.multocida или Mycoplasma spp.; кишечное заболевание у свиней, связанное с заражением E.coli, Lawsonia intracellularis, Salmonella или Serpulina hyodyisinteriae; копытная гниль у коров, связанная с заражением Fusobacterium spp.; метрит у коров, связанный с заражением E.coli; волосатые бородавки у коров,связанные с заражением Fusobacterium necrophorum или Bacteroides nodosus; розовоглазость у коров, связанная с заражением Moraxella bovis; преждевременный аборт у коров, связанный с заражением простейшими (например neosporium); инфекции мочевыводящих путей у собак и кошек, связанные с заражением E.coli; инфекции кожи и мягких тканей у собак и кошек, связанные с заражением S. epidermidis,S. intermedius, коагулаза-отриц. Staphylococcus или P.multocida; и инфекции зубов или рта у собак и кошек, связанные с заражением Alcaligenes spp., Bacteroides spp., Clostridium spp., Enterobacter spp., Eubacterium, Peptostreptococcus, Porphyromonas или Prevotella. Другие бактериальные инфекции или протозойные инфекции и связанные с такими инфекциями расстройства, которые можно лечить или предупреждать в соответствии со способом по настоящему изобретению, описаны в J. P. Sanford et al., "The SanfordGuide To Antimicrobial Therapy", 26th Edition (Antimicrobial Therapy, Inc., 1996). Настоящее изобретение также включает в себя изотопно-меченные соединения, в которых один или более чем один атом замещены атомом, имеющим атомную массу или массовое число, отличное от атомных масс или массовых чисел, обычно встречающихся в природе. Примеры изотопов, которые могут быть включены в соединения по данному изобретению, включают в себя изотопы водорода, углерода,азота, кислорода, фосфора, серы, фтора и хлора, такие как 2 Н, 3 Н, 13 С, 14 С, 15N, 18O и 17O. Такие меченные радиоактивной меткой и меченые стабильным изотопом соединения полезны в качестве исследовательских и диагностических средств.-4 007618 Краткое описание графических материалов Фиг. 1 представляет собой рассчитанную порошковую рентгеновскую дифрактограмму формы A азитромицина. Шкала абсциссы представляет собой градусы 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах. Фиг. 2 представляет собой экспериментальную порошковую рентгеновскую дифрактограмму формы А азитромицина. Шкала абсциссы представляет собой градусы 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах. Фиг. 3 представляет собой наложение фиг. 1 и 2, где рассчитанная дифрактограмма формы A азитромицина (фиг. 1) находится внизу и экспериментальная дифрактограмма формы А азитромицина (фиг. 2) находится наверху. Шкала абсциссы измеряется в градусах 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах. Фиг. 4 представляет собой рассчитанную порошковую рентгеновскую дифрактограмму формы C азитромицина. Шкала абсциссы измеряется в градусах 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах. Фиг. 5 представляет собой рассчитанную порошковую рентгеновскую дифрактограмму формы D азитромицина. Шкала абсциссы измеряется в градусах 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах. Фиг. 6 представляет собой экспериментальную порошковую рентгеновскую дифрактограмму формы D азитромицина. Шкала абсциссы измеряется в градусах 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах. Фиг. 7 представляет собой наложение фиг. 5 и 6, где рассчитанная дифрактограмма формы D азитромицина (фиг. 5) находится внизу и экспериментальная дифрактограмма формы D азитромицина (фиг. 6) - наверху. Шкала абсциссы измеряется в градусах 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах. Фиг. 8 представляет собой рассчитанную порошковую рентгеновскую дифрактограмму формы Е азитромицина. Шкала абсциссы измеряется в градусах 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах. Фиг. 9 представляет собой рассчитанную порошковую рентгеновскую дифрактограмму формы F азитромицина. Шкала абсциссы измеряется в градусах 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах. Фиг. 10 представляет собой экспериментальную порошковую рентгеновскую дифрактограмму формы F азитромицина. Шкала абсциссы измеряется в градусах 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах. Фиг. 11 представляет собой наложение фиг. 9 и 10, где рассчитанная дифрактограмма формы F азитромицина (фиг. 9) находится внизу и экспериментальная дифрактограмма формы F азитромицина(фиг. 10) - наверху. Шкала абсциссы измеряется в градусах 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах. Фиг. 12 представляет собой рассчитанную порошковую рентгеновскую дифрактограмму формы G азитромицина. Шкала абсциссы измеряется в градусах 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах. Фиг. 13 представляет собой экспериментальную порошковую рентгеновскую дифрактограмму формы G азитромицина. Шкала абсциссы измеряется в градусах 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах. Фиг. 14 представляет собой наложение фиг. 12 и 13, где рассчитанная дифрактограмма формы G азитромицина (фиг. 12) находится внизу и экспериментальная дифракторамма формы G азитромицина(фиг. 13) - наверху. Шкала абсциссы измеряется в градусах 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах. Фиг. 15 представляет собой рассчитанную порошковую рентгеновскую дифрактограмму формы J азитромицина. Шкала абсциссы измеряется в градусах 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах. Фиг. 16 представляет собой экспериментальную порошковую рентгеновскую дифрактограмму формы J азитромицина. Шкала абсциссы измеряется в градусах 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах. Фиг. 17 представляет собой наложение фиг. 15 и 16, где рассчитанная дифрактограмма формы J азитромицина (фиг. 15) находится внизу и экспериментальная дифрактограмма формы G азитромицина(фиг. 16) - наверху. Шкала абсциссы измеряется в градусах 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах. Фиг. 18 представляет собой экспериментальную порошковую рентгеновскую дифрактограмму формы М азитромицина. Шкала абсциссы измеряется в градусах 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах.-5 007618 Фиг. 19 представляет собой экспериментальную порошковую рентгеновскую дифрактограмму формы N азитромицина. Шкала абсциссы измеряется в градусах 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах. Фиг. 20 представляет собой экспериментальную порошковую рентгеновскую дифрактограмму аморфного азитромицина. Шкала абсциссы измеряется в градусах 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах. Фиг. 21 представляет собой спектр 13 С твердотельного ЯМР формы А азитромицина. Фиг. 22 представляет собой спектр 13 С твердотельного ЯМР формы D азитромицина. Фиг. 23 представляет собой спектр 13 С твердотельного ЯМР формы F азитромицина. Фиг. 24 представляет собой спектр 13 С твердотельного ЯМР формы G азитромицина. Фиг. 25 представляет собой спектр 13 С твердотельного ЯМР формы J азитромицина. Фиг. 26 представляет собой спектр 13 С твердотельного ЯМР формы М азитромицина. Фиг. 27 представляет собой спектр 13 С твердотельного ЯМР формы N азитромицина. Фиг. 28 представляет собой спектр 13 С твердотельного ЯМР аморфного азитромицина. Фиг. 29 представляет собой спектр 13 С твердотельного ЯМР формы фармацевтической таблетки,содержащей форму G азитромицина. Фиг. 30 представляет собой экспериментальную порошковую рентгеновскую дифрактограмму формы Q азитромицина. Шкала абсциссы измеряется в градусах 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах. Фиг. 31 представляет собой экспериментальную порошковую рентгеновскую дифрактограмму формы R азитромицина. Шкала абсциссы измеряется в градусах 2-тета (2-). Ордината представляет собой интенсивность, выраженную в импульсах. Фиг. 32 представляет собой спектр 13 С твердотельного ЯМР формы Н азитромицина. Фиг. 33 представляет собой спектр 13 С твердотельного ЯМР формы R азитромицина. Подробное описание изобретения Было обнаружено, что азитромицин существует в различных кристаллических формах. Дигидрат,форма А, и нестехиометрический гидрат, форма В, описаны в заявке на Европейский патент ЕР 298650 и патенте США 4512359, соответственно. Были описаны шестнадцать других форм, а именно, формы С, D,E, F, G, H, I, J, K, L, M, N, О, Р, Q и R. Эти формы представляют собой или гидраты или смеси гидрат/сольват свободного основания азитромицина. Формы L и K представляют собой метастабильные низкогидратные формы А, обнаруженные при высокой температуре. Были выяснены кристаллические структуры форм А, С, D, E, F, G, H, J и О. Структурные данные этих кристаллических форм приведены ниже. Таблица 1. Кристаллографические данные формы А азитромицина.-6 007618 Таблица 2. Кристаллографические данные формы С азитромицина. Таблица 3. Кристаллографические данные формы D азитромицина. Таблица 4. Кристаллографические данные формы Е азитромицина.-7 007618 Таблица 5. Кристаллографические данные формы F азитромицина. Таблица 6. Кристаллографические данные формы G азитромицина. Таблица 7. Кристаллографические данные формы Н азитромицина.-8 007618 Таблица 8. Кристаллографические данные формы J азитромицина. Таблица 8 А. Кристаллографические данные формы О азитромицина. Среди этих 16 кристаллических форм были идентифицированы два изоморфных семейства. Семейство I включает в себя формы F, G, H, J, M, N, О и Р. Семейство II включает в себя формы C, D, Е и R. Форма Q отличается от семейств I и II. Формы внутри семейства представляют собой изоморфы, которые кристаллизуются в одной и той же пространственной группе с незначительным варьированием параметров ячейки, и включают в себя химически близкие структуры, но различный элементарный состав. В этом случае, варьирование химического состава между изоморфами возникает вследствие включения различных молекул вода/растворитель. Следовательно, изоморфы демонстрируют похожие, но не идентичные рентгеновские дифрактограммы и спектры твердотельного ЯМР (ттЯМР, ssNMR). Другие способы, такие как спектроскопия в инфракрасной ближней зоне (БИК, NIR), дифференциальная сканирующая калориметрия (ДСК, DSC), газовая хроматография (ГХ, GC), термогравиметрический анализ (ТГА, TGA) или термогравиметрический анализ/анализ путем инфракрасной спектроскопии (ТГА-ИК, TG-IR), водный анализ Карла Фишера (КФ, KF) и молекулярное моделирование/визуализация предоставляют данные для утвердительной идентификации изоморфов. Температуры дегидратации/десольватации определяли путем ДСК со скоростью нагревания 5 С/мин. Форма С: Эта кристаллическая форма была идентифицирована по структуре монокристалла (табл. 2) как моногидрат азитромицина. Она имеет пространственную группу P212121 и параметры ячейки, похожие на параметры форм D и Е; поэтому она относится к семейству II изоморфов. Ее рассчитанная дифрактограмма похожа на дифрактограмму форм D и Е. Форма D: Форма D кристаллизуется из циклогексана. Структура монокристалла формы D демонстрирует стехиометрию моногидрат/моноциклогексановый сольват азитромицина (табл. 3). Молекулы циклогексана, как было обнаружено, разупорядочиваются в кристаллической решетке. По данным монокристалла рассчитанное содержание воды и циклогексана в форме D составляет соответственно 2,1 и 9,9%. Как экспериментальная порошкограмма, так и рассчитанная порошкограмма формы D похожи на порошкограммы форм C и E. Порошковые образцы формы D демонстрируют эндотерму десольватации/дегидратации с начальной температурой, составляющей приблизительно 87 С и широкой эндотермой между 200 и 280 С (разложение) в анализе ДСК при 5 С/мин от 30 до 300 С. Форму D получают путем суспендирования азитромицина в циклогексане в течение 2-4 суток. Твердую форму азитромицина собирают путем фильтрации и сушат.-9 007618 Форма Е: Форма Е была получена как монокристалл, собираемый в среде тетрагидрофуран(ТГФ)/вода. Она представляет собой моногидрат и моно-ТГФ сольват в соответствии с анализом монокристалла (табл. 4). По своей структуре монокристалла, рассчитанная порошковая рентгеновская дифрактограмма (ПРД, PXRD) похожа на дифрактограмму формы С и формы D, делая их семейством II изоморфов. Форму Е получают путем растворения азитромицина в тетрагидрофуране (ТГФ). Диффузия водяного пара в насыщенный ТГФ раствор азитромицина со временем позволяет получить кристаллы формы Е. Форма F: Монокристалл формы F кристаллизуется в моноклинной пространственной группе P21 с асимметрической ячейкой, содержащей две молекулы азитромицина, две молекулы воды и одну молекулу этанола, в виде моногидрат/полуэтанолят (табл. 5). Она изоморфна с формами всего семейства I кристаллических форм азитромицина. Рассчитанная ПРД этой формы похожа на дифрактограмму другого семейства I изоморфов. Теоретическое содержание воды и этанола составляет соответственно 2,3 и 2,9%. Порошковые образцы демонстрируют эндотерму дегидратации/десольватации при начальной температуре 110-125 С. Форму F получают путем растворения азитромицина в этаноле (1-3 объема по массе) при температуре приблизительно 50-70 С. После полного растворения раствор охлаждают до температуры ниже температуры окружающей среды для того, чтобы вызвать осаждение. Объем этанола может быть уменьшен путем вакуумной перегонки при перемешивании в течение 1-2 ч для увеличения выхода. В качестве альтернативы, могут быть добавлены приблизительно 0,1-2 объема воды (возможно охлажденной до 0-20 С) со сбором твердого вещества в течение 30 мин после добавления воды. Охлаждение этанолового раствора азитромицина перед добавлением воды до температуры ниже 20 С, предпочтительно ниже 15 С, более предпочтительно ниже 10 и наиболее предпочтительно 5 С приводит в результате к по существу чистой форме F азитромицина. Твердую форму F азитромицина собирают путем фильтрации и сушат. Форма G: Структура монокристалла формы G состоит из двух молекул азитромицина и трех молекул воды на асимметрическую ячейку (табл. 6). Это соответствует полуторогидрату с теоретическим содержанием воды 3,5%. Содержание воды в порошковых образцах формы G находится от 2,5 до приблизительно 6%. Общий остаточный органический растворитель составляет менее 1% от соответствующего растворителя, используемого для кристаллизации, и находится значительно ниже стехиометрических количеств сольвата. Эта форма дегидратируется с начальной температурой, составляющей приблизительно 110-120 С. Форма G может быть получена путем добавления азитромицина в предварительно смешанную смесь органический растворитель/вода (1/1 по объему), где органический растворитель может представлять собой метанол, ацетон, ацетонитрил, этанол или изопропанол. Смесь перемешивают и нагревают до повышенной температуры, например 45-55 С в течение 4-6 ч для того, чтобы вызвать растворение. Осаждение происходит во время охлаждения до температуры окружающей среды. Твердую форму G азитромицина собирают путем фильтрации и сушат. Форма Н: Эта кристаллическая форма представляет собой моногидрат/полу-пропиленгликолевый сольват свободного основания азитромицина (табл.7). Ее выделяют из раствора препарата, содержащего пропиленгликоль. Кристаллическая структура формы Н изоморфна кристаллическим формам семейства I. Форму Н азитромицина получают путем растворения дигидрата азитромицина в 6 объемах пропиленгликоля. К получающемуся в результате пропиленгликолевому раствору азитромицина добавляют 2 объема воды и происходит осаждение. Суспензию перемешивают в течение 24 ч и твердые вещества фильтруют и сушат на воздухе при температуре окружающей среды с получением кристаллической формы Н. Форма J: Форма J представляет собой моногидрат/полу-н-пропанольный сольват (табл. 8). Рассчитанное содержание растворителя составляет приблизительно 3,8% н-пропанола и приблизительно 2,3% воды. Экспериментальные данные демонстрируют для порошковых образцов содержание н-пропанола приблизительно от 2,5 до 4,0 % и воды приблизительно от 2,5 до 3%. Ее картина ПРД очень похожа на картину ее изоморфов F, G, Н, М и N. Подобно F и G порошковые образцы имеют эндотерму дегидратации/десольватации при 115-125 С. Форму J получают путем растворения азитромицина в 4 объемах н-пропанола при температуре приблизительно 25-55 С. При комнатной температуре добавляют воду, приблизительно 6-7 объемов, и суспензию постоянно перемешивают в течение 0,5-2 ч. Твердую форму J азитромицина собирают путем фильтрации и сушат. Форма K: Картина ПРД формы К была обнаружена в смеси формы А азитромицина и микрокристаллического воска после отжига при 95 С в течение 3 ч. Она представляет собой низкогидратированную форму А и является метастабильной при высокой температуре формой. Форма L: Эта форма, обнаруженная только при нагревании дигидрата формы А. В экспериментах по рентгеновской дифракции на порошке при переменной температуре (ПРД-ПТ, VT-PXRD), когда форму А нагревали до приблизительно 90 С, появилась новая порошковая рентгеновская дифрактограмма. Новая форма, обозначенная как форма L, представляет собой низкогидратную форму формы А, поскольку форма А теряет приблизительно 2,5% массы при 90 С в соответствии с ТГА, таким образом соответ- 10007618 ствуя превращению в моногидрат. При охлаждении до температуры окружающей среды форма L быстро превращается в форму А. Форма М: Выделенная из суспензии изопропанол/вода, форма М включает в себя как воду, так и изопропанол. Ее картина ПРД и спектр тт-ЯМР очень похожи на картину и спектр изоморфов СемействаI, что указывает на то, что она относится к Семейству I. По аналогии с известными кристаллическими структурами изоморфов Семейства I структура монокристалла формы М может представлять собой моногидрат/полуизопропанолят. Температура дегидратации/десольватации формы М составляет приблизительно 115-125 С. Форма М может быть получена путем растворения азитромицина в 2-3 объемах изопроапнола (ИП) при 40-50 С. Раствор охлаждают до температуры ниже 15 С, предпочтительно ниже 10 С, более предпочтительно, приблизительно 5 С, и 2-4 объема холодной воды с температурой приблизительно 5 С добавляют для того, чтобы осуществить осаждение. Затравки кристаллов формы М могут быть добавлены в начале кристаллизации. Суспензию перемешивают менее чем приблизительно 5 ч, предпочтительно, менее чем приблизительно 3 ч, более предпочтительно, менее чем приблизительно 1 ч, и наиболее предпочтительно, приблизительно 30 мин или меньше, и твердые вещества собирают путем фильтрации. Твердые вещества могут быть ресуспендированы в изопропаноле. Способ обеспечивает форму М по существу в отсутствии дигидрата азитромицина. Форма N: Выделенные из суспензии формы А в смеси вода/этанол/изопропанол кристаллы формыN могут содержать различные количества кристаллизационных растворителей и воду. Содержание воды в ней варьирует приблизительно от 3,4 до приблизительно 5,3 массовых процентных концентраций. Анализ путем ГХ Headspace выявил различное содержание этанола и изопропанола. Общее содержание растворителя образцов формы N обычно ниже чем приблизительно 5% в зависимости от условий получения и сушки. Картина ПРД формы N похожа на картину форм F, G, H, J и М изоморфов семейства I. Эндотерма(мы) дегидратации/десольватации образцов формы N могут быть шире и могут варьировать между 110-130 С. Форма N азитромицина может быть получена путем перекристаллизации азитромицина из смеси воды и органических растворителей, инкорпорирующих в кристаллическую решетку азитромицина, таких как этанол, изопропанол, н-пропанол, ацетон, ацетонитрил и т.п. Смесь растворителей нагревают до 45-60 С и в нагретую смесь растворителей добавляют азитромицин в общем до приблизительно 4 объемов. После растворения добавляют 1-3 объема воды и продолжают перемешивание при 45-60 С. ФормаN азитромицина осаждается в виде белого твердого вещества. Суспензии дают возможность охладиться до температуры окружающей среды при перемешивании. Твердую форму N азитромицина выделяют путем фильтрации и сушат. Форма O: Эта кристаллическая форма представляет собой полугидрат полу-н-бутаноловый сольват свободного основания азитромицина в соответствии со структурными данными кристалла (табл. 8 А). Она была выделена из н-бутанолового раствора азитромицина при диффузии противорастворителя. Кристаллическая структура формы О изоморфна структурам кристаллических форм семейства I. Азитромицин полностью растворяется в н-бутаноле. Добавление противорастворителя, такого как гексан, вода, изопропиловый эфир (ИПЭ) или другого не растворителя, путем диффузии приводит в результате к осаждению формы О. Форма P: Представляет собой предполагаемую кристаллическую форму, являющуюся полугидратом полу-н-пентаноловым сольватом свободного основания азитромицина. Она может быть выделена из н-пентанолового раствора азитромицина при диффузии противорастворителя. Кристаллическая структура формы Р изоморфна структурам кристаллических форм семейства I. Форма Р азитромицина может быть получена следующим образом: азитромицин полностью растворяется в н-пентаноле; добавление противорастворителя, такого как гексан, вода, изопропиловый эфир(ИПЭ) или другого не растворителя, путем диффузии приводит в результате к осаждению формы P. Форма Q: Кристаллическая форма Q демонстрирует уникальную порошковую рентгеновскую дифрактограмму. Она содержит приблизительно 4% воды и приблизительно 4,5% ТГФ, являясь гидратом полу-ТГФ сольватом. Основная температура дегидратации/десольватации составляет приблизительно от 80 до 110 С. Дигидрат азитромицина растворяют в 6 объемах ТГФ и добавляют 2 объема воды. Раствору дают возможность выпариться досуха в условиях окружающей среды с получением кристаллической формы Q. Форма R: Эту кристаллическую форму получают путем добавления аморфного азитромицина к 2,5 объемам трет-бутил метилового эфира (ТБМЭ). Получающуюся в результате густую белую суспензию перемешивают в течение 3 суток в условиях окружающей среды. Твердые вещества собирают путем вакуумной фильтрации и сушат на воздухе. Получающаяся в результате масса формы R азитромицина имеет теоретическое содержание воды 2,1% по массе и теоретическое содержание метил трет-бутилового эфира 10,3% по массе. Вследствие похожести структур изоморфы имеют склонность образовывать смесь форм внутри семейства, иногда называемую "смешанные кристаллы" или "кристаллический твердый раствор". Форма N представляет собой такой твердый кристаллический раствор и, как было обнаружено, представляет со- 11007618 бой смесь изоморфов семейства I по составу растворителей и данным твердофазового ЯМР. Изоморфы как семейства I, так и семейства II представляют собой гидраты и/или сольваты азитромицина. Молекулы растворителя в полостях имеют тенденцию обмениваться между растворителем и водой в специфических условиях. Поэтому содержание растворитель/вода изоморфов может в некоторой степени варьировать. Кристаллические формы изоморфного семейства I при нагревании более устойчивы, чем форма А. Формы F, G, H, J, M и N демонстрируют более высокие начальные температуры дегидратации при 110125 С, чем температуры дегидратации формы А, имеющей начальную температуру дегидратации приблизительно от 90 до 110 С и одновременный переход в твердую фазу с образованием формы L приблизительно при 90 С. Аморфный азитромицин: Все кристаллические формы азитромицина содержат воду или растворитель(ли) или и воду и раствориель(ли). Когда воду и растворитель(ли) удаляют из кристаллических твердых тел, азитромицин становится аморфным. Аморфные твердые вещества имеют преимущество, заключающееся в высоких начальных скоростях растворения. Исходное вещество для синтеза различных кристаллических форм, описанного ниже, представляет собой, если не оговорено особо, дигидрат азитромицина. Могут быть использованы другие формы азитромицина, такие как аморфный азитромицин или другие не дигидратные кристаллические формы азитромицина. Примеры Пример 1. Получение формы G Реакционный сосуд заполняют формой А азитромицина. В отдельном сосуде смешивают 1,5 объема метанола и 1,5 объема воды. В реакционный сосуд, содержащий форму А азитромицина, добавляют смесь растворителя. Суспензию перемешивают при нагревании до 50 С в течение приблизительно 5 ч. Нагревание прекращают и суспензии дают возможность охладиться при перемешивании до температуры окружающей среды. Форму G азитромицина собирают путем фильтрации и дают ей возможность сохнуть на воздухе в течение приблизительно 30 мин. Собранную форму G азитромицина дополнительно сушат в вакуумной печи при 45 С. Способ позволяет получать, по существу, чистую форму G азитромицина и форму G азитромицина, по существу, свободную от дигидрата азитромицина. Получение следующих кристаллических форм азитромицина, а также данные ПРД и ЯМР приведены только в иллюстративных целях. Получение формы D Форму D получают путем суспендирования дигидрата азитромицина в циклогексане в течение 2-4 суток при повышенной температуре, например 25-50 С. Кристаллические твердые вещества формы D собирают путем фильтрации и сушат. Получение формы F 2 А: Дигидрат азитромицина медленно добавляют к одному объему теплого этанола, приблизительно 70 С, и перемешивают до завершения растворения при 65-70 С. Для облегчения кристаллизации могут быть введены затравки формы F 1-2 мас.%. Раствору дают возможность постепенно охладиться до 25 С и добавляют один объем охлажденной воды. Кристаллические твердые вещества быстро собирают(предпочтительно менее чем за 30 мин) после добавления воды путем вакуумной фильтрации. 2 Б: Дигидрат азитромицина медленно добавляют к одному объему теплого этанола, приблизительно 70 С, и перемешивают до завершения растворения при 65-70 С. Для облегчения кристаллизации могут быть введены затравки формы F 1-2 мас.%. Раствору дают возможность постепенно охладиться до 25 С и объем этанола может быть уменьшен путем вакуумной перегонки. После перемешивания в течение промежутка времени до 2 ч кристаллические твердые вещества собирают вакуумной фильтрацией. Выделение кристаллов позволяет получить, по существу, чистую форму F азитромицина, форму F азитромицина, по существу, свободную от формы G азитромицина, и форму F азитромицина, по существу, свободную от дигидрата азитромицина. Получение формы J Форму J получают путем растворения азитромицина в 4 объемах н-пропанола при температуре приблизительно 25 С. Добавляют воду (6,7 объемов) и суспензию постоянно перемешивают в течение 1 ч с последующим охлаждением приблизительно до 0 С. Твердую форму J азитромицина собирают путем фильтрации и сушат. Получение формы М по существу в отсутствие дигидрата азитромицина 5 А: Дигидрат азитромицина полностью растворяют в 2 объемах теплого изопропанола 40-50 С. Затравки формы М при желании могут быть введены для облегчения кристаллизации. Раствор затем охлаждают до 0-5 С и добавляют 4 объема охлажденной воды в качестве противорастворителя и твердые вещества собирают вакуумной фильтрацией. Твердые вещества ресуспендируют в 1 объеме изопропанола в течение 3-5 ч при 40-50 С и затем охлаждают до 0-5 С. Кристаллические твердые вещества быстро собирают (приблизительно в течение 15 мин) после добавления воды путем вакуумной фильтрации. Твердые вещества ресуспендируют в 0,5-1 объеме изопропанола при 25-40 С и охлаждают приблизительно до 5 С с последующей фильтрацией для того, чтобы собрать твердые частицы формы М.(45 С). Получающийся в результате прозрачный раствор фильтруют через перфорированный фильтр 0,2 мкм в чистую колбу. Температуру поддерживают при 45 С и в раствор вводят затравку кристаллов формы М. В течение 8 мин добавляют 7,8 л охлажденной воды. Раствор охлаждают до 5 С и отмечают образование густой суспензии. Твердые вещества выделяют путем вакуумной фильтрации и переносят в чистую колбу. Кристаллический азитромицин суспендируют в 1 объеме изопропилового спирта при нагревании до 35 С. Суспензию затем охлаждают до 5 С в течение 30 мин и твердое кристаллическое вещество отфильтровывают. Эти способы позволяют получать по существу чистую форму М азитромицина, форму М азитромицина, по существу, свободную от формы G азитромицина и форму М азитромицина, по существу, свободную от дигидрата азитромицина. Получение формы N Два объема этанола и 2 объема изопропанола добавляют в реакционный сосуд и нагревают до 50 С. При перемешивании в нагретую смесь этанол/изопропанол добавляют форму А азитромицина с получением прозрачного раствора. Реакционный сосуд заполняют 2 объемами дистиллированной воды (температура окружающей среды). Перемешивание продолжают при 50 С и твердая форма N азитромицина осаждается приблизительно через 1 ч. Нагревание прекращают через 5 ч после добавления воды. Суспензии дают возможность охладиться до температуры окружающей среды. Осажденную форму N азитромицина собирают путем фильтрации и сушат в течение 4 ч в вакуумной печи при 45 С. Получение аморфного азитромицина Кристаллическую форму А азитромицина нагревают до 110-120 С в печи в течение ночи в вакууме. Аморфные твердые вещества собирают и хранят с осушителем в соответствии с тем как необходимо. Получение формы Н Дигидрат азитромицина или другие кристаллические формы растворяют в 6 объемах пропиленгликоля. К полученному в результате пропиленгликолевому раствору азитромицина добавляют 2 объема воды и осуществляется осаждение. Суспензию перемешивают в течение 24 ч и твердые вещества фильтруют и сушат на воздухе при температуре окружающей среды с получением кристаллической формы Н. Получение формы Q Кристаллический порошок получают путем растворения 500 мг формы А азитромицина в 2 мл ТГФ. К прозрачному бесцветному раствору при комнатной температуре добавляют 1 мл воды. Когда раствор станет мутным, добавляют еще 1 мл ТГФ для полного растворения азитромицина, и раствор перемешивают при температуре окружающей среды. Растворителю дают возможность выпариваться в течение 7 суток, после чего твердые вещества собирают и характеризуют. Пример 2: Порошковая рентгеновская дифрактометрия Порошкограммы получали, используя дифрактометр Bruker D5000 (Madison, Wisconsin), оборудованный медным излучателем, фиксированными щелями (1,0, 1,0, 0,6 мм) и твердотельным детекторомKevex. Данные получали с 3,0-40,0 2-тета, используя величину шага 0,04 и время шага 1,0 с. Результаты суммированы в табл. 9, которая также включает данные для других кристаллических форм азитромицина, представленные с иллюстративными целями. Экспериментальная ПРД формы G азитромицина приведена на фиг. 13. Также с иллюстративными целями представлены ПРД следующих кристаллических форм азитромицина. Экспериментальная ПРД формы А азитромицина приведена на фиг. 2. Экспериментальная ПРД формы D азитромицина приведена на фиг. 6. Экспериментальная ПРД формы F азитромицина приведена на фиг. 10. Экспериментальная ПРД формы J азитромицина приведена на фиг. 16. Экспериментальная ПРД формы М азитромицина приведена на фиг. 18. Экспериментальная ПРД формы N азитромицина приведена на фиг. 19. Экспериментальная ПРД аморфного азитромицина приведена на фиг. 20. Экспериментальная ПРД формы Q азитромицина приведена на фиг. 30. Экспериментальная ПРД формы R азитромицина приведена на фиг. 31. Экспериментальная вариабельность от образца к образцу составляет приблизительно 0,2 угла 2-тета,а те же самые отклонения наблюдаются между рассчитанной порошкограммой структуры монокристалла и экспериментальными данными. Подробный анализ демонстрирует, что изоморфы семейства I можно различить путем использования ПРД с наборами характеристических пиков, приведенных в табл. 9.- 13007618 Таблица 9. Пики рентгеновской дифракции на порошке азитромицина, выраженные в углах 2-тета 0,2 Подчеркнутые пики представляют собой характеристические пики для форм А, D, семейства I и Q. Пики, набранные курсивом и подчеркнутые, представляют собой наборы пиков, которые являются характеристическими среди изоморфов семейства I. Изоморфы семейства I имеют следующие общие характеристики: дифракционные пики при 6,2,11,2, 21,00,1 и 22,50,1 2-тета. Каждый изоморф демонстрирует репрезентативный набор дифракционных пиков, приведенный далее, и каждый набор имеет характеристическое расстояние между пиками. Приведенные положения дифракционных пиков являются точными до 0,2 2-тета. Репрезентативная картина ПРД формы А показана на фиг. 2. Форма А демонстрирует пики при 9,3,13,0 и 18,7 2-тета. Репрезентативная картина ПРД формы D показана на фиг. 6. Форма D демонстрирует пики при 3,9,10,1, 10,6 и 21,4 2-тета. Репрезентативная картина ПРД формы F показана на фиг. 10. Форма F демонстрирует характеристические пики семейства I и три набора пиков, набор 1 при 2-тета из 11,2 и 11,5; набор 2 при 2-тета из 13,9, 14,3, 14,7 и 14,8; набор 3 при 2-тета из 16,2, 16,6, 17,1, 17,2 и 17,7. Репрезентативная картина ПРД формы G показана на фиг. 13. Форма G демонстрирует характеристические пики семейства I и три набора пиков, набор 1 при 2-тета из 11,2 и 11,6; набор 2 при 2-тета из 14,0, 14,4, 14,6 и 14,9; набор 3 при 2-тета из 16,3, 16,6, 17,2, 17,4 и 17,8. Репрезентативная картина ПРД формы J показана на фиг. 16. Форма J демонстрирует характеристические пики семейства I и три набора пиков, набор 1 при 2-тета из 11,2 и 11,4; набор 2 при 2-тета из 13,9,14,2 и 14,6; набор 3 при 2-тета из 16,0, 16,6, 17,0, 17,2 и 17,5. Репрезентативная картина ПРД формы М показана на фиг. 18. Форма М демонстрирует характеристические пики семейства I и три набора пиков, набор 1 при 2-тета из 11,2; набор 2 при 2-тета из 14,0 и 14,6; набор 3 при 2-тета из 15,9, 16,6, 17,1 и 17,5.- 14007618 Репрезентативная картина ПРД формы N показана на фиг. 10. Форма N демонстрирует характеристические пики семейства I. Набор пиков формы N похож на набор форм F, G, J и М, набор 1 при 2-тета из 11,2 до 11,6; набор 2 при 2-тета из 13,9 до 15,0; и набор 3 при 2-тета из 15,9 до 17,9, причем пики могут слегка варьировать по положению, интенсивности и ширине, вследствие смешивания в различном соотношении изоморфов семейства I. Репрезентативная картина ПРД формы Q показана на фиг. 30. Форма Q демонстрирует пики при 6,8, 8,4 и 20,2 2-тета. Репрезентативная картина ПРД формы R показана на фиг. 31. Пример 3. Рентгеновский анализ монокристалла Данные были получены при комнатной температуре, используя рентгеновский дифрактометрBruker, оборудованный медным излучателем и графитовыми монохроматорами. Структуры распознавали, используя прямые способы. Компьютерная библиотека SHELXTL, поставляемая Bruker AXS, Inc,облегчала все необходимые кристаллографические расчеты и молекулярные представления (SHELXTLReference Manual, Version 5.1, Bruker AXS, Madison, Wisconsin, USA (1997. Пример 4. Расчет картины ПРД, исходя из данных по монокристаллам Для сравнения результатов между монокристаллами и порошковым образцом расчетная порошкограмма может быть получена, исходя из результатов по монокристаллам. Компьютерные программыXFOG и XPOW, поставляемые как часть компьютерной библиотеки SHELXTL, использовали для осуществления расчетов. Сравнение расчетной порошкограммы с экспериментальной подтверждает, соответствует ли порошковый образец установленной структуре монокристалла (табл. 9 А). С иллюстративными целями способ был также осуществлен на кристаллических формах азитромицина A, D, F и J. Расчетная ПРД формы G азитромицина приведена на фиг. 12. Расчетная ПРД формы А азитромицина приведена на фиг. 1. Расчетная ПРД формы D азитромицина приведена на фиг. 5. Расчетная ПРД формы F азитромицина приведена на фиг. 9. Расчетная ПРД формы J азитромицина приведена на фиг. 15. Результаты отображены на расположенных одна под другой порошковых рентгеновских дифрактограммах форм A, D, F, G и J на фиг. 3, 7, 11, 14 и 17 соответственно. Снизу расположена расчетная порошковая рентгеновская дифрактограмма (из результатов по монокристаллу), а сверху - репрезентативная экспериментальная порошкограмма. Сходство между двумя такими дифрактограммами указывает на согласие между образцом для рентгеновской дифракции на порошке и соответствующей структурой монокристалла. Таблица 9 А. Рассчитанные и экспериментальные пики ПРД изоморфов семейства I Пример 5. Анализ путем твердотельного ЯМР Все спектры 13 С твердотельного ЯМР были получены на спектрометре 11,75 Т (Bruker Biospin, Inc.,Billerica, MA), на частоте 13 С 125 МГц. Спектры получали, используя кросс-поляризацию и вращение под магическим углом (CPMAS) при температуре и давлении окружающей среды. В зависимости от количества анализируемых образцов использовали датчики Bruker 7 мм BL или 4 мм BL, вмещающие 300 и 75 мг образца, при максимальных скоростях 7 и 15 кГц, соответственно. Данные были обработаны с использованием экспоненциальной расширяющей функции 5,0 Гц. В 7- и 4-мм датчиках соответственно использовали протонную развязку 65 и 100 кГц. Достаточное количество выборок усреднялось для получения адекватных соотношений сигнал/шум для всех пиков. Как правило, получали 600 сканов с задержкой обновления 3,0 с, что соответствует приблизительно 30 мин общего времени выборки. Магический угол доводили, используя порошок KBr в соответствии со стандартной практикой продавцов ЯМР. В качестве эталона использовали либо метилового резонанс гексаметилбензола (ГМБ) при 17,3 м.д., или сдвинутый наверх резонанс адамантана (АДМ) при 29,5 м.д. Спектры с эталоном ГМБ дают химические сдвиги при всех пиках, сдвинутые вниз на 0,08 м.д. по сравнению с теми же самыми спектрами с АДМ в качестве эталона. Спектральное окно минимально включает область спектра от 190 до 0 м.д. Результаты суммированы в табл.10. Эталоном тт-ЯМР спектров для форм М, Н и R являлся АДМ. Эталоном тт-ЯМР спектров для форм A, D, G, F, J и N являлся ГМБ. Формы Н и R вращали со скоростью 15 кГц. Химические сдвиги, помеченные жирным и подчеркнутые, представляют собой пики или наборы пиков, репрезентативные для каждой формы. Химические сдвиги, помеченные курсивом, представляют собой пики растворителя, которые могут быть широкими и изменчивыми (0,4 м.д.). Химические сдвиги, помеченные одной звездочкой, могут проявлять расщепление 0,3 м.д. Химические сдвиги, помеченые двойными звездочками, могут проявлять изменение в пределах 0,3 м.д. Приведенные химические сдвиги являются точными до 0,2 м.д., если не оговорено особо. Репрезентативный спектр 13 С тт-ЯМР формы G приведен на фиг. 24. Форма G демонстрирует пик с самым высоким химическим сдвигом 179,5 м.д., являющийся одним пиком с возможным расщеплением 0,3 м.д. и набор из 5 пиков 10,4, 9,9, 9,3, 7,6 и 6,5 м.д. С иллюстративными целями представлены также спектры 13 С тт-ЯМР для других кристаллических азитромицина. Репрезентативный спектр 13 С тт-ЯМР формы А приведен на фиг. 21. Форма А демонстрирует пик 178,1 м.д. и пики 104,1, 98,4, 84,6, 26,9, 13,2, 11,3 и 7,2 м.д. Репрезентативный спектр 13 С тт-ЯМР формы D приведен на фиг. 22. Форма В демонстрирует пик с самым высоким химическим сдвигом 178,1 м.д., и пики с химическими сдвигами 103,9, 95,1, 84,2, 10,6,9,0 и 8,6 м.д. Репрезентативный спектр 13 С тт-ЯМР формы F приведен на фиг. 23. Форма F имеет два пика с химическим сдвигом приблизительно 179,12 м.д., а именно 179,5 и 178,6 м.д., и набор из пяти пиков 10,1,9,8, 9,3, 7,9 и 6,6 м.д. и этаноловые пики 58,00,5 м.д. и 17,20,5 м.д. Пики растворителя могут быть широкими и относительно слабыми по интенсивности. Репрезентативный спектр 13 С тт-ЯМР формы J приведен на фиг. 25. Форма J имеет два пика с химическим сдвигом приблизительно 179,12 м.д., а именно 179,6 и 178,4 м.д., набор из 4 пиков 10,0, 9,3,8,1 и 6,8 м.д. и н-пропаноловые пики 11,50,5 м.д. и 25,20,5 м.д. Пики растворителя могут быть широкими и относительно слабыми по интенсивности. Репрезентативный спектр 13 С тт-ЯМР формы М приведен на фиг. 26. Форма М имеет один пик с химическим сдвигом 1791 м.д., а именно 179,6 м.д., пики 41,9 и 16,3 м.д., набор из пяти пиков 10,3, 9,6,9,3, 7,7 и 7,1 м.д. и изопропаноловый пик 26,00,5 м.д. Пики растворителя могут быть широкими и относительно слабыми по интенсивности. Репрезентативный спектр 13 С тт-ЯМР формы N приведен на фиг. 27. Форма N демонстрирует химические сдвиги в виде комбинации изоморфов в семействе I. Пики могут варьировать по химическому сдвигу и относительным интенсивностям и ширине вследствие смешивания в изменяющейся пропорции изоморфов, содержащихся в форме N кристаллического твердого раствора. Репрезентативный спектр 13 С тт-ЯМР аморфной формы приведен на фиг. 28. Аморфный азитромицин демонстрирует широкие химические сдвиги. Характеристические химические сдвиги имеют положения пиков 179 и 110,5 м.д.- 18007618 Резюме обнаруженных тт-ЯМР пиков для форм азитромицина A, D, F, G, Н, J, M, N и R приведено в табл. 10. Пример 6. Анализ лекарственной формы, содержащей форму G азитромицина, путем ЯМР Для того, чтобы продемонстрировать способность 13 С тт-ЯМР идентифицировать форму азитромицина, содержащегося в фармацевтической лекарственной форме, приготовили покрытые таблетки азитромицина, содержащие форму G азитромицина, и проанализировали их путем 13 С тт-ЯМР. Таблетки были подвергнуты влажному гранулированию и таблетированию на F-Press (Manesty, Liverpool, UK), используя оборудование 0,262"х 0,531" (0,6655 х 1,3381 см). Таблетки были приготовлены и таблетированы с использованием прописи, приведенной ниже, таким образом, что содержали 250 мг формы G азитромицина при общей массе таблетки 450 мг. Таблетки единообразно покрывали pink Opadry II (смесь моногидрата лактозы, гидроксипропилметилцеллюлозы, диоксида титана, DrugCosmetic red30, и триацетина) (Colorcon, west Point, PA) Покрытую таблетку осторожно разрушали и измельченный образец с помощью упаковочных средств упаковывали в твердотельном роторе, не содержащем фон 13 С. Анализ образца осуществляли в условиях, описанных в примере 13. Репрезентативный спектр 13 С тт-ЯМР таблетки, содержащей форму G азитромицина, приведен на фиг. 29. Пример 7. Антимикробная активность Активность кристаллических форм по настоящему изобретению в отношении бактериальных и протозойных патогенов продемонстрирована по способности соединений подавлять рост определенных штаммов патогенов человека (анализ I) или животного (анализы II и III). Анализ I. В анализе I, описанном ниже, использованы стандартная методика и критерии интерпретации, и данный анализ разработан, чтобы дать направление для химических модификаций, которые могут привести к соединениям, которые обходят определенные механизмы устойчивости к макролидам. В анализеI подбирают набор бактериальных штаммов, включающий множество целевых патогенных видов, в том числе представителей, обладающих механизмами устойчивости к макролидам, которые были описаны. Использование этого набора позволяет определить взаимосвязь химической структуры и активности в отношении силы, спектра действия и структурных элементов или модификаций, которые могут быть необходимы для избежания действия механизмов устойчивости. Бактериальные патогены, которые составляют набор для скрининга, показаны в таблице ниже. Во многих случаях как материнский штамм, чувствительный к макролидам, так и устойчивый к макролидам штамм, полученный из него, пригодны для того, чтобы обеспечить более точную оценку способности соединений обходить механизм устойчивости. Штаммы, которые содержат ген, обозначенный как ermA/ermB/ermC, являются устойчивыми к макролидам, линкозамидам и стрептограмину В благодаря модификациям (метилированию) молекул 23S рРНК метилазой Erm, посредством чего, как правило, предотвращая связывание всех трех структурных классов. Были описаны два типа утечки макролидов: msrA кодирует компонент системы утечки у стафиллококков, который препятствует проникновению макролидов и стрептограминов, тогда как mefA/E кодирует трансмембранный белок, который, по-видимому, обеспечивает утечку только макролидов. Может наступить инактивация макролидных антибиотиков, и она может быть опосредована либо путем фосфорилирования 2'-гидроксила (mph), либо путем расщепления макроциклического лактона (эстераза). Штаммы можно охарактеризовать, используя стандартную технологию полимеразной цепной реакции(ПЦР) и/или путем секвенирования детерминанты устойчивости. Использование технологии ПЦР в этом приложении описано в J. Sutcliffe et al, "Detection Of Erythromycin-Resistant Determinants By PCR, Antimicrobial Agents and Chemotherapy, 40(11), 2562-2566 (1996). Антибактериальный анализ осуществляют в микротитрационных планшетах и интерпретируют в соответствии с Performance Standards for Antimicrobial Disk Susceptibility Tests - Sixth Edition; Approved Standard, опубликованном в соответствии с указаниями The National Committee for Clinical Laboratory Standards (NCCLS) (Национального комитета по клиническим лабораторным стандартам (НККЛС; минимальную подавляющую концентрацию (МПК)- 19007618 используют для сравнения штаммов. Кристаллические соединения сначала растворяют в диметилсульфоксиде (ДМСО) в виде концентрированных растворов с концентрацией 40 мг/мл. Анализ II использован для тестирования активности в отношении Pasteurella multocida, а анализ III использован для тестирования активности в отношении Pasteurella haemolytica. Анализ II. Этот анализ основан на способе жидкостных разведений в микролитровом формате. Одну колониюP. multocida (штамм 59 А 067) инокулируют в 5 мл бульона сердечно-мозговой вытяжки (СМВ). Тестируемые соединения готовят путем растворения 1 мг соединения в 125 мкл диметилсульфоксида (ДМСО). Разведения тестируемого соединения готовят, используя неинокулированный бульон СМВ. Концентрации используемого тестируемого соединения находятся в пределах от 200 до 0,098 мкг/мл, что достигается путем двухкратных последовательных разведений. СМВ, инокулированную P. multocida, разводят неинокулированным бульоном СМВ для получения суспензии 104 клеток на 200 мкл. Клеточные суспензии СМВ смешивают с соответствующими последовательными разведениями тестируемого соединения и инкубируют при 37 С в течение 18 ч. Минимальная подавляющая концентрация (МПК) равна концентрации соединения, проявляющей 100% подавление роста P.multocida, что определяют путем сравнения с неинокулированной контрольной пробой. Анализ III. Этот анализ основан на способе агарозных разведений с использованием Steers Replicator. От 2 до 5 колоний, изолированных с чашки агара, инокулируют в бульоне СМВ и инкубируют в течение ночи при 37 С при перемешивании (200 об/мин). На следующее утро 300 мкл полностью выросшей прекультурыP. haemolytica инокулируют в 3 мл свежего бульона СМВ и инкубируют при 37 С при перемешивании(200 об/мин). Соответствующие количества тестируемого соединения растворяют в этаноле и готовят серии двухкратных последовательных разведений. 2 мл соответствующего последовательного разведения смешивают с 18 мл расплавленного агара, содержащего СМВ, и дают затвердеть. Когда культура,инокулированная P. haemolytica, достигает величины 0,5 стандартной плотности по МакФарленду, приблизительно 5 мкл культуры P. haemolytica инокулируют на чашки с содержащим СМВ агаром, содержащие различные концентрации тестируемого соединения, используя Steers Replicator, и инкубируют в течение 18 ч при 37 С. Исходные концентрации тестируемого соединения находятся в пределах от 100 до 200 мкг/мл. МПК равна концентрации тестируемого соединения, показывающей 100% подавление роста P. haemolytica, что определяют путем сравнения с неинокулированным контролем. Активность кристаллической формы по настоящему изобретению in vivo можно определить путем традиционных исследований по защите животных, хорошо известных специалистам в данной области техники, обычно проводимых на мышах. Мышей распределяют по клеткам (10 на клетку) до их прибытия и дают им возможность акклиматизироваться в течение как минимум 48 ч перед тем, как их используют. Животных внутрибрюшинно инокулируют 0,5 мл бактериальной суспензии 3 х 103 КОЕ/мл (P. multocida штамм 59 А 006) (КОЕколониеобразующая единица). Каждый эксперимент имеет по меньшей мере 3 контрольные группы, не получающие лекарство, включая одну группу, инфицированную 0,1 х дозой для заражения, и две группы,инфицированные 1 х дозой для заражения; можно также использовать группу, инфицированную 10 х дозой для заражения. Как правило, всех мышей в указанном исследовании можно подвергнуть заражению в- 20007618 течение 30-90 мин, особенно если для введения дозы для заражения используют многоразовый шприц(такой как шприц Cornwall). По прошествии тридцати минут после начала заражения, дают первое соединение. Может быть необходимо, чтобы второй человек начал введение соединения, если все животные не были подвергнуты заражению к концу 30 мин. Пути введения представляют собой введение подкожных или пероральных доз. Подкожные дозы вводят в открытую кожу в задней части шеи, тогда как пероральные дозы вводят посредством питающей иглы. В обоих случаях, используют объем 0,2 мл на мышь. Соединения вводят через 30 мин, 4 и 24 ч после заражения. В каждый тест включают контрольное соединение с известной эффективностью, вводимое тем же самым путем. За животными наблюдают ежедневно и записывают количество выживших животных в каждой группе. Мониторинг модели P. multocida продолжают в течение 96 ч (четырех дней) после заражения. Защитная доза препарата (3 Д 50) представляет собой расчетную дозу, при которой тестируемое соединение защищает 50% группы мышей от смерти вследствие бактериальной инфекции, которая могла бы иметь летальный исход в отсутствии лечения лекарством. Кристаллическую форму G азитромицина по настоящему изобретению (далее "активное соединение") можно вводить пероральным, парентеральным, местным или ректальным путем при лечении бактериальных инфекций или протозойных инфекций. В общем, активные соединения наиболее желательно вводить в дозах в пределах от приблизительно 0,2 мг на кг массы тела в сутки (мг/кг/сутки) до приблизительно 200 мг/кг/сутки в виде разовых или разделенных доз (т.е от 1 до 4 доз в сутки), хотя непременно появятся вариации в зависимости от вида, массы и состояния субъекта, которого лечат, и конкретного выбранного пути введения. Однако наиболее желательно использовать уровень дозировки, который находится в пределах от приблизительно 2 до приблизительно 50 мг/кг/сутки. Тем не менее, могут возникать вариации в зависимости от вида млекопитающего, рыбы или птицы, которых лечат, и их индивидуальной реакции на указанное лекарство, а также от типа выбранного фармацевтического препарата и периода времени и интервала, с которым проводят такое введение. В некоторых случаях уровни доз ниже нижнего предела вышеуказанного диапазона могут быть более чем адекватными, а в других случаях могут быть использованы дозы больше верхнего предела, не вызывая каких-либо побочных эффектов, при условии, что такие более высокие дозы сначала разделены на несколько небольших доз для введения в течение суток. Активное соединение можно вводить сами по себе или в сочетании с фармацевтически приемлемыми носителями или разбавителями указанными ранее путями, и такое введение можно осуществлять в виде разовых или разделенных доз. Более конкретно, активное соединение можно вводить в виде широкого разнообразия различных лекарственных форм, т.е. его можно объединять с различными фармацевтически приемлемыми инертными носителями в форме таблеток, капсул, лепешек, драже, леденцов, порошков, аэрозолей, кремов, бальзамов, суппозиториев, желе, гелей, паст, лосьонов, мазей, саше, порошков для пероральных суспензий, водных суспензий, инъецируемых растворов, эликсиров, сиропов и т.п. Такие носители включают в себя твердые разбавители или наполнители, стерильную водную среду и различные нетоксичные органические растворители и.т.п. Более того, фармацевтические композиции для перорального введения можно подходящим образом подсластить или ароматизировать. Как правило,активное соединение присутствует в таких лекарственных формах при уровнях концентрации в пределах от приблизительно 1,0 до приблизительно 70% по массе. Для перорального введения можно использовать таблетки, содержащие различные эксципиенты,такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, гидрофосфат кальция и глицин, наряду с различными разрыхлителями, такими как крахмал (и предпочтительно кукурузный,картофельный крахмал или крахмал тапиоки), альгиновая кислота и некоторые комплексные силикаты,вместе с гранулирующими связывающими веществами, такими как поливинилпирролидон, сахароза,желатин и аравийская камедь. Дополнительно, смазывающие вещества, такие как стеарат магния, лаурилсульфат натрия и тальк, очень часто являются полезными в целях таблетирования. В качестве наполнителей в желатиновых капсулах можно также использовать твердые композиции подобного типа; в этой связи предпочтительные вещества также включают в себя лактозу или молочный сахар, а также высокомолекулярные полиэтиленгликоли. Когда для перорального ведения желательны водные суспензии и/или эликсиры, активное соединение можно объединять с различными подсластителями или корригентами,природными красящими веществами или красителями, и, если желательно, эмульгаторами и/или суспендирующими агентами, а также вместе с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и разными их сочетаниями. Для парентерального введения можно использовать растворы активного соединения либо в кунжутном, либо в арахисовом масле, либо в водном пропиленгликоле. Водные растворы, если необходимо,должны быть соответствующим образом забуферены (предпочтительно рН больше 8), а жидкий разбавитель сначала должен быть сделан изотоническим. Эти водные растворы подходят для внутривенной инъекции. Масляные растворы подходят для внутрисуставной, внутримышечной и подкожной инъекции. Приготовление всех этих растворов в стерильных условиях легко осуществить стандартными фармацевтическими способами, хорошо известными специалистам в данной области техники. Кроме того, также возможно вводить активное соединение по настоящему изобретению местно, и- 21007618 это можно осуществлять с помощью кремов, желе, гелей, паст, пластырей, мазей и т.п., в соответствии со стандартной фармацевтической практикой. Для введения животным, иным чем люди, таким как крупный рогатый скот или домашние животные, активное соединение можно вводить в корме животных или перорально в виде большой дозы лекарства. Активное соединение можно также вводить в форме липосомных систем доставки, таких как небольшие монослойные везикулы, крупные монослойные везикулы и многослойные везикулы. Липосомы могут быть образованы из различных фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолины. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллический полуторогидрат азитромицина, характеризующийся спектром 13 С твердотельного ЯМР, содержащим совокупность пиков с химическими сдвигами 179,5 м.д., являющимся одним пиком с расщеплением между 0 м.д. и 0,3 м.д.; 10,4 м.д.; 9,9 м.д.; 9,3 м.д.; 7,6 м.д.; 6,5 м.д.; где указанные пики могут проявлять изменение в химическом сдвиге в пределах 0,2 м.д. 2. Кристаллический полуторогидрат азитромицина по п.1, по существу, в чистой форме. 3. Кристаллическая форма азитромицина по п.1 или 2, где указанная форма характеризуется тем,что содержит 2,5-6% воды и менее 1% органического растворителя по массе в порошковом образце. 4. Кристаллическая форма азитромицина по п.2, где указанный азитромицин включает в себя 90% по массе или более полуторогидрата азитромицина. 5. Кристаллическая форма азитромицина по п.2, где указанный азитромицин включает в себя 95% по массе или более полуторогидрата азитромицина. 6. Фармацевтическая композиция, содержащая кристаллическую форму азитромицина по любому из пп.1-5 и фармацевтически приемлемый эксципиент. 7. Способ лечения бактериальной инфекции или протозойной инфекции у млекопитающего, рыбы или птицы, при котором указанному млекопитающему, рыбе или птице вводят терапевтически эффективное количество кристаллической формы азитромицина по любому из пп.1-5.
МПК / Метки
МПК: A61P 31/04, C07H 17/08
Метки: лечения, азитромицина, способ, композиция, содержащая, полуторогидрат, кристаллический, фармацевтическая, основе
Код ссылки
<a href="https://eas.patents.su/30-7618-kristallicheskijj-polutorogidrat-azitromicina-soderzhashhaya-ego-farmacevticheskaya-kompoziciya-i-sposob-lecheniya-na-ego-osnove.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллический полуторогидрат азитромицина, содержащая его фармацевтическая композиция и способ лечения на его основе</a>
Предыдущий патент: Моноклональное антитело к двойному интегриновому белку и его фрагмент, фармацевтическая композиция и способ лечения
Следующий патент: Пленочное покрытие для таблеток и каплет
Случайный патент: Получение сжиженного природного газа