Выявление индуцибельных генов в микроорганизмах
Формула / Реферат
1. Способ выявления наличия микроорганизма в тестируемом образце, предусматривающий воздействие на тестируемый образец индуктором, который способен индуцировать экспрессию по меньшей мере одного гена в микроорганизме, и тестирование наличия мРНК, транскрибированной с гена, который индуцирован посредством воздействия указанным индуктором.
2. Способ по п.1, где микроорганизмом является медленно растущая бактерия.
3. Способ по п.2, где медленно растущая бактерия выбрана из группы, состоящей из Borreliae, Pediococcus, Mycoplasma и рода Mycobacterium.
4. Способ по любому из пп.1-3, где стадия тестирования наличия мРНК, транскрибированной с гена, который индуцирован посредством воздействия указанным индуктором, предусматривает осуществление реакции амплификации, чтобы амплифицировать всю или часть мРНК, и регистрацию специфичных продуктов реакции амплификации.
5. Способ по п.4, где реакцией амплификации является RT-PCR или амплификация, основанная на последовательности нуклеиновой кислоты.
6. Способ по любому из пп.3-5, где индуктором является кислород или пероксид водорода, а ген, который индуцируют посредством воздействия индуктором, представляет собой ген, кодирующий супероксиддисмутазу.
7. Способ по п.6, где стадия тестирования наличия мРНК, транскрибированной с гена, кодирующего супероксиддисмутазу, предусматривает:
(a) составление реакционной смеси, содержащей пару праймеров NASBA P1 и NASBA P2, подходящую для применения при амплификации области указанной мРНК по методу NASBA, РНК-зависимую ДНК-полимеразу, рибонуклеазу, которая гидролизует нить РНК гибрида РНК-ДНК, не гидролизуя однонитевые или двунитевые РНК или ДНК, РНК-полимеразу, которая узнает последовательность промотора, присутствующую в праймере NASBA P1, и рибонуклеозид- и дезоксирибонуклеозидтрифосфаты;
(b) инкубирование указанной реакционной среды с препаратом нуклеиновой кислоты, выделенной из тестируемого образца, который предположительно содержит микроорганизм, в условиях реакции, которые обеспечивают реакцию амплификации NASBA; и
(c) выявление и/или количественное измерение какого-либо специфичного продукта реакции амплификации NASBA.
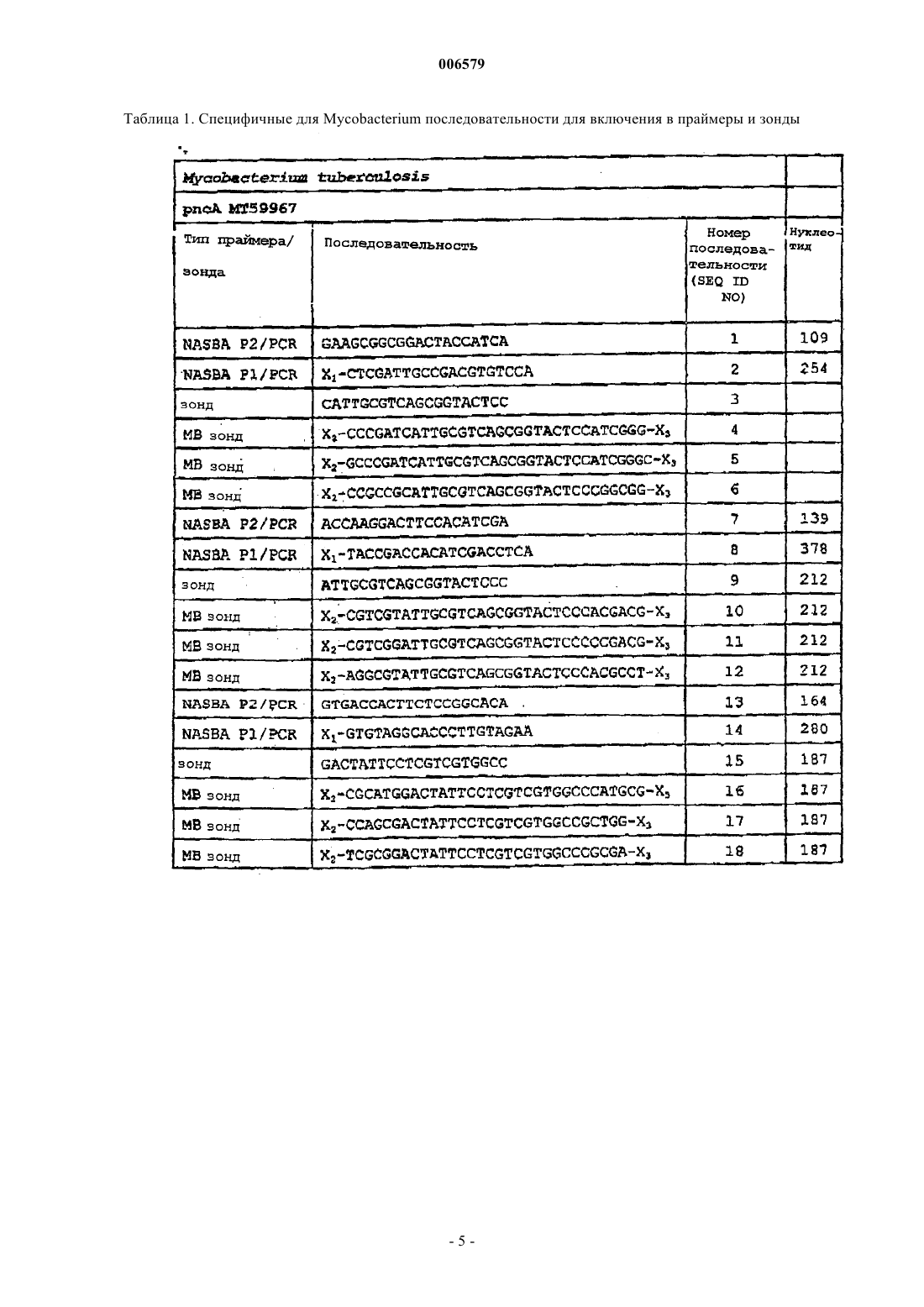
8. Способ по п.7 для применения при выявлении видов Mycobacterium, где пара праймеров NASBA P1 и NASBA P2 является одной из следующих пар:
праймер NASBA P1, содержащий SEQ ID NO: 20, и праймер NASBA P2, содержащий SEQ ID NO: 19;
праймер NASBA P1, содержащий SEQ ID NO: 26, и праймер NASBA P2, содержащий SEQ ID NO: 25;
праймер NASBA P1, содержащий SEQ ID NO: 32, и праймер NASBA P2, содержащий SEQ ID NO: 31;
праймер NASBA P1, содержащий SEQ ID NO: 38, и праймер NASBA P2, содержащий SEQ ID NO: 37;
праймер NASBA P1, содержащий SEQ ID NO: 61, и праймер NASBA P2, содержащий SEQ ID NO: 62;
праймер NASBA P1, содержащий SEQ ID NO: 64, и праймер NASBA P2, содержащий SEQ ID NO: 65;
праймер NASBA P1 4-86 и праймер NASBA P2, содержащий SEQ ID NO: 61, предпочтительно праймер 4-85;
праймер 4-92 и праймер NASBA P2, содержащий SEQ ID NO: 64, предпочтительно праймер 4-91;
праймер 4-104 и праймер NASBA P2, содержащий SEQ ID NO: 19, предпочтительно праймер 4-103; или
праймер 4-122 и праймер NASBA P2, содержащий SEQ ID NO: 31, предпочтительно праймер 4-115.
9. Способ по п.6, где стадия тестирования наличия мРНК, транскрибированной с гена, кодирующего супероксиддисмутазу, включает в себя амплификацию части мРНК по методу RT-PCR.
10. Способ по п.9 для применения при выявлении видов Mycobacterium, где амплификацию части мРНК по методу RT-PCR осуществляют с использованием одной из следующих пар праймеров:
праймер PCR, содержащий SEQ ID NO: 20, и праймер PCR, содержащий SEQ ID NO: 19;
праймер PCR, содержащий SEQ ID NO: 26, и праймер PCR, содержащий SEQ ID NO: 25;
праймер PCR, содержащий SEQ ID NO: 32, и праймер PCR, содержащий SEQ ID NO: 31;
праймер PCR, содержащий SEQ ID NO: 38, и праймер PCR, содержащий SEQ ID NO: 37;
праймер PCR, содержащий SEQ ID NO: 61, и праймер PCR, содержащий SEQ ID NO: 62; или
праймер PCR, содержащий SEQ ID NO: 64, и праймер PCR, содержащий SEQ ID NO: 65.
11. Способ по любому из пп.3-5, где индуктором является изопропил-b-D-тиогалактопиранозид или пиразинамид, а ген, который индуцируют посредством воздействия индуктором, представляет собой ген pncA.
12. Способ по п.11, где стадия тестирования наличия мРНК, транскрибированной с гена pncA, предусматривает
(a) составление реакционной смеси, содержащей пару праймеров NASBA P1 и NASBA P2, подходящую для применения при амплификации области указанной мРНК по методу NASBA, РНК-зависимую ДНК-полимеразу, рибонуклеазу, которая гидролизует нить РНК гибрида РНК-ДНК, не гидролизуя однонитевые или двунитевые РНК или ДНК, РНК-полимеразу, которая узнает последовательность промотора, присутствующую в праймере NASBA P1, и рибонуклеозид- и дезоксирибонуклеозидтрифосфаты;
(b) инкубирование указанной реакционной среды с препаратом нуклеиновой кислоты, выделенной из тестируемого образца, который предположительно содержит микроорганизм, в условиях реакции, которые обеспечивают реакцию амплификации NASBA; и
(c) выявление и/или количественное измерение какого-либо специфичного продукта реакции амплификации NASBA.
13. Способ по п.12 для применения при выявлении Mycobacterium tuberculosis, где пара праймеров NASBA P1 и NASBA P2 является одной из следующих пар:
праймер NASBA P1, содержащий SEQ ID NO: 2, и праймер NASBA P2, содержащий SEQ ID NO: 1;
праймер NASBA P1, содержащий SEQ ID NO: 8, и праймер NASBA P2, содержащий SEQ ID NO: 7;
праймер NASBA P1, содержащий SEQ ID NO: 14, и праймер NASBA P2, содержащий SEQ ID NO: 13;
праймер 4-2 и праймер NASBA P2, содержащий SEQ ID NO: 1, предпочтительно праймер 4-1;
праймер 4-8 и праймер NASBA P2, содержащий SEQ ID NO: 7, предпочтительно праймер 4-7; или
праймер 4-14 и праймер NASBA P2, содержащий SEQ ID NO: 13, предпочтительно праймер 4-15.
14. Способ по п.11, где стадия тестирования наличия мРНК, транскрибированной с гена pncA, включает в себя амплификацию части мРНК по методу RT-PCR.
15. Способ по п.14, используемый для выявления Mycobacterium tuberculosis, где амплификацию части мРНК по методу RT-PCR осуществляют с использованием одной из следующих пар праймеров:
праймер PCR, содержащий SEQ ID NO: 2, и праймер PCR, содержащий SEQ ID NO: 1;
праймер PCR, содержащий SEQ ID NO: 8, и праймер PCR, содержащий SEQ ID NO: 7; или
праймер PCR, содержащий SEQ ID NO: 14, и праймер PCR, содержащий SEQ ID NO: 13.
16. Олигонуклеотидный праймер, используемый для регистрации мРНК, экспрессированной у вида Mycobacterium, мРНК которого транскрибирована с индуцируемого гена, при этом олигонуклеотидный праймер выбран из
(i) праймера NASBA P1, содержащего одну из SEQ ID NO: 2, 8, 14, 20, 26, 32, 38, 62, 65, 68, 75, 78, 81, 84, 87, 90, 93 или 96;
(ii) праймера NASBA P1, который является праймером номер 4-2, 4-8, 4-14, 4-86, 4-98, 4-104, 4-110, 4-116 или 4-122;
(iii) праймера NASBA P2, содержащего одну из SEQ ID NO: 1, 7, 13, 19, 25, 31, 37, 61, 64, 67, 74, 77, 80, 83, 86, 89, 92 или 95;
(iv) праймера NASBA P2, который является праймером номер 4-1, 4-7, 4-13, 4-85, 4-97, 4-103, 4-109, 4-115 или 4-121;
(v) праймера PCR, содержащего одну из SEQ ID NO: 1, 2, 7, 8, 13, 14, 19, 20, 25, 26, 31, 32, 37, 38, 61, 62, 64, 65, 67, 68, 74, 75, 77, 78, 80, 81, 83, 84, 87, 88, 89, 90, 92, 93, 95 или 96.
17. Олигонуклеотидный зонд, используемый для регистрации мРНК, экспрессированной у вида Mycobacterium, мРНК которого транскрибирована с индуцируемого гена, при этом молекула олигонуклеотида выбрана из
(i) олигонуклеотидного зонда, содержащего одну из SEQ ID NO: 3, 9, 15, 21, 27, 33, 39, 63, 66, 69, 76, 79, 82, 85, 88, 91, 94, 97;
(ii) олигонуклеотидного зонда с молекулярными маячками, который является SEQ ID NO: 4, 5, 6, 10, 11, 12, 16, 17, 18, 22, 23, 24, 28, 29, 30, 34, 35, 36, 40, 41 или 42.
18. НасюЁ праймер/зонд для регистрации методом NASBA мРНК, экспрессированной у вида Mycobacterium, мРНК которого транскрибирована с индуцируемого гена, при этом набор праймер/зонд выбран из следующих наборов:
праймер NASBA P1, содержащий SEQ ID NO: 2, праймер NASBA P2, содержащий SEQ ID NO: 1 и либо зонд, содержащий SEQ ID NO: 3, либо по меньшей мере один зонд с молекулярными маячками, выбранный из SEQ ID NO: 4, 5 и 6;
праймер NASBA P1, содержащий SEQ ID NO: 8, праймер NASBA P2, содержащий SEQ ID NO: 7, и либо зонд, содержащий SEQ ID NO: 9, либо по меньшей мере один зонд с молекулярными маячками, выбранный из SEQ ID NO: 10, 11 и 12;
праймер NASBA P1, содержащий SEQ ID NO: 14, праймер NASBA P2, содержащий SEQ ID NO: 13, и либо зонд, содержащий SEQ ID NO: 15, либо по меньшей мере один зонд с молекулярными маячками, выбранный из SEQ ID NO: 16, 17 и 18;
праймер 4-2, праймер NASBA P2, содержащий SEQ ID NO: 1, предпочтительно праймер 4-1, и либо зонд, содержащий SEQ ID NO: 3, либо по меньшей мере один зонд с молекулярными маячками, выбранный из SEQ ID NO: 4, 5 и 6;
праймер 4-8, праймер NASBA P2, содержащий SEQ ID NO: 7, предпочтительно праймер 4-7, и либо зонд, содержащий SEQ ID NO: 9, либо по меньшей мере один зонд с молекулярными маячками, выбранный из SEQ ID NO: 10, 11 и 12;
праймер 4-14, праймер NASBA P2, содержащий SEQ ID NO: 13, предпочтительно праймер 4-15, и либо зонд, содержащий SEQ ID NO: 15, либо по меньшей мере один зонд с молекулярными маячками, выбранный из SEQ ID NO: 16, 17 и 18;
праймер NASBA P1, содержащий SEQ ID NO: 20, праймер NASBA P2, содержащий SEQ ID NO: 19, и либо зонд, содержащий SEQ ID NO: 21, либо по меньшей мере один зонд с молекулярными маячками, выбранный из SEQ ID NO: 22, 23 и 24;
праймер NASBA P1, содержащий SEQ ID NO: 26, праймер NASBA P2, содержащий SEQ ID NO: 25, и либо зонд, содержащий SEQ ID NO: 27, либо, по меньшей мере, один зонд с молекулярными маячками, выбранный из SEQ ID NO: 28, 29 и 30;
праймер NASBA P1, содержащий SEQ ID N0: 32, праймер NASBA P2, содержащий SEQ ID NO: 31, и либо зонд, содержащий SEQ ID NO: 33, либо по меньшей мере один зонд с молекулярными маячками, выбранный из SEQ ID NO: 34, 35 и 36; или
праймер NASBA P1, содержащий SEQ ID NO: 38, праймер NASBA P2, содержащий SEQ ID NO: 37, и либо зонд, содержащий SEQ ID NO: 39, либо по меньшей мере один зонд с молекулярными маячками, выбранный из SEQ ID NO: 40, 41 и 42.
праймер NASBA P1 4-86 и праймер NASBA P2, содержащий SEQ ID NO: 61, предпочтительно праймер 4-85;
праймер 4-104 и праймер NASBA P2, содержащий SEQ ID NO: 19, предпочтительно праймер 4-103.
19. Набор праймеров для регистрации методом RT-PCR мРНК, экспрессированной у вида Mycobacterium, мРНК которого транскрибирована с индуцируемого гена, при этом набор праймер/зонд выбран из следующих наборов:
праймер PCR, содержащий SEQ ID NO: 2, и праймер PCR, содержащий SEQ ID NO: 1;
праймер PCR, содержащий SEQ ID NO: 8, и праймер PCR, содержащий SEQ ID NO: 7;
праймер PCR, содержащий SEQ ID NO: 14, и праймер PCR, содержащий SEQ ID NO: 13;
праймер PCR, содержащий SEQ ID NO: 20, и праймер PCR, содержащий SEQ ID NO: 19;
праймер PCR, содержащий SEQ ID NO: 26, и праймер PCR, содержащий SEQ ID NO: 25;
праймер PCR, содержащий SEQ ID NO: 32, и праймер PCR, содержащий SEQ ID NO: 31; или
праймер PCR, содержащий SEQ ID NO: 38, и праймер PCR, содержащий SEQ ID NO: 37.
20. Набор праймер/зонд для регистрации методом RT-PCR мРНК, экспрессированной у вида Mycobacterium, мРНК которого транскрибирована с индуцируемого гена, при этом набор праймер/зонд выбран из следующих наборов:
праймер PCR, содержащий SEQ ID NO: 2, праймер PCR, содержащий SEQ ID NO: 1, и зонд, содержащий SEQ ID NO:3;
праймер PCR, содержащий SEQ ID NO: 8, праймер PCR, содержащий SEQ ID NO: 7, и зонд, содержащий SEQ ID NO:9;
праймер PCR, содержащий SEQ ID NO: 14, праймер PCR, содержащий SEQ ID NO: 13, и зонд, содержащий SEQ ID NO: 15;
праймер PCR, содержащий SEQ ID NO: 20, праймер PCR, содержащий SEQ ID NO: 19, и зонд, содержащий SEQ ID NO: 21;
праймер PCR, содержащий SEQ ID NO: 26, праймер PCR, содержащий SEQ ID NO: 25, и зонд, содержащий SEQ ID NO: 27;
праймер PCR, содержащий SEQ ID NO: 32, праймер PCR, содержащий SEQ ID NO: 31, и зонд, содержащий SEQ ID NO: 33; или
праймер PCR, содержащий SEQ ID NO: 38, праймер PCR, содержащий SEQ ID NO: 37, и зонд, содержащий SEQ ID NO: 39.
Текст
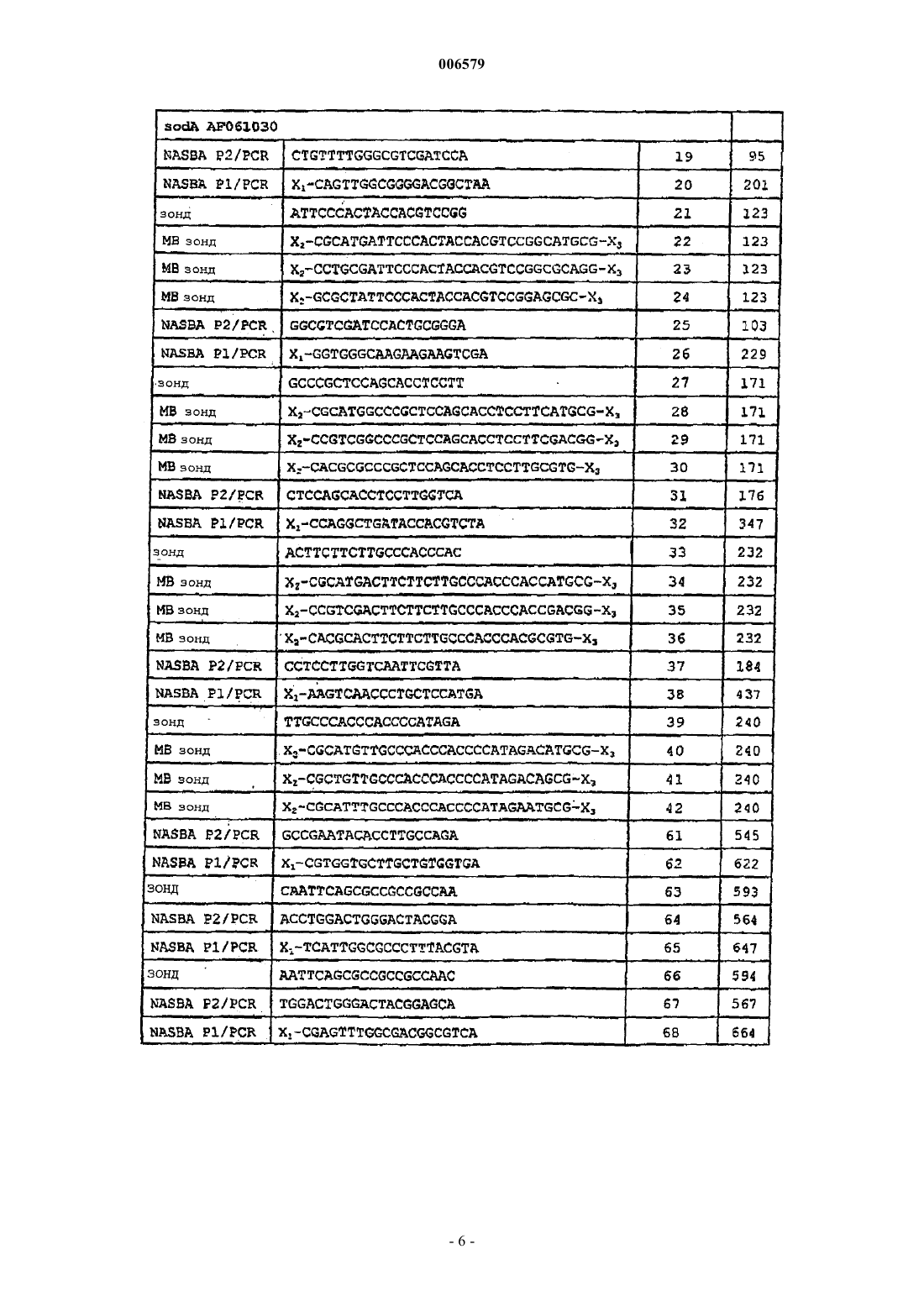
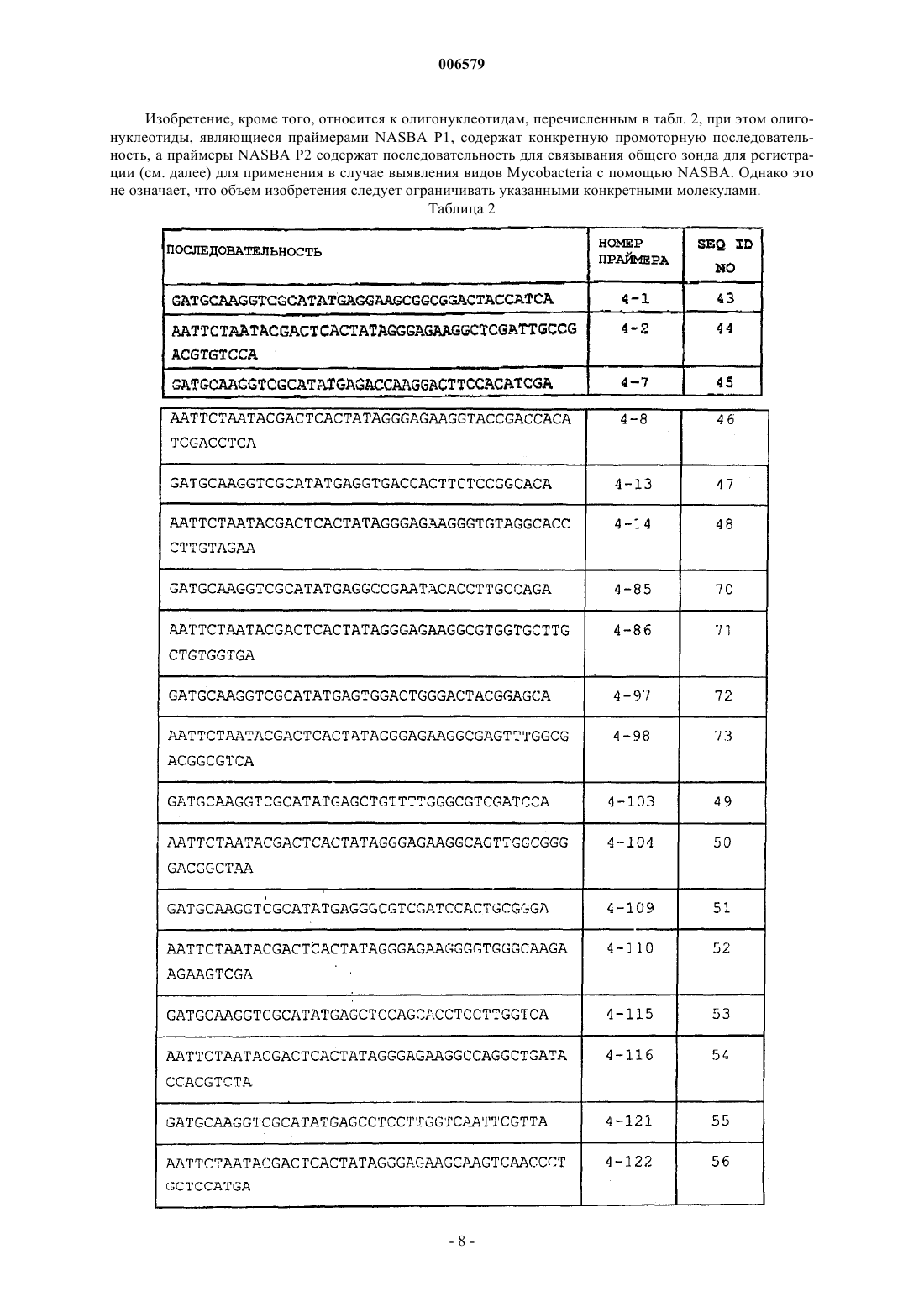
006579 Данное изобретение относится к способам выявления наличия микроорганизмов, в частности, медленно растущих бактерий рода Mycobacterium, путем индукции экспрессии мРНК и регистрации индуцированной мРНК. Предпосылка изобретения Несмотря на эффективную антимикробную терапию, во всем мире туберкулез остается основным источником заболеваемости и смертности и все шире распространяется во всем мире. Ранняя диагностика и немедленное начало лечения туберкулезного менингита улучшает исход заболевания, но выявлениеMycobacterium tuberculosis в спинномозговой жидкости (СМЖ) обычными способами остается сложной проблемой. Проблема диагностики микобактерии состоит в том, что небольшое количество организмов М. tuberculosis и их медленный рост ограничивают выявление кислотоустойчивых штаммов и способы культивирования (Molavi A. and J.L. LeFrock., Med. Clin. North. Am. 69: 315-331, 1985). Несколькими группами исследователей описаны PCR-анализы для чувствительного и специфичного выявления Mycobacterium tuberculosis в клинических образцах. Прямая идентификация микобатерий в клинических образцах с помощью PCR-амплификации специфичной последовательности нуклеиновой кислоты-мишени обеспечивает возможность диагностики инфекции в день обращения. Способы PCR применяли на реальных клинических образцах, но они ограничены небольшим размером образцов, которые можно тестировать, и небольшим количеством организмов, присутствующих в клинических образцах, ложно-позитивными результатами вследствие загрязнения и присутствием ингибиторов PCR (Кох etal., J. Clin Micro 32: 672-678, 1994). Прогностическая ценность выявления в значительной степени зависит от доли М. tuberculosisпозитивных образцов среди исследуемых клинических образцов. Согласно рекомендациям Grosset иMouton PCR не следует использовать для рутинной диагностики туберкулеза до тех пор, пока методика не устоится и не появятся способы внутреннего и внешнего контроля качества (Grosset J. and Y. Mouton.,Tubercle Lung dis. 76: 183-184, 1995). При совместном международном контрольном исследовании качества из 30 лабораторий только пять лабораторий безошибочно идентифицировали наличие или отсутствие микобактериальной ДНК во всех 20 образцах (Noordhoek G. Т. J. Clin. Microbiology 34: 2522-2525,1996). Это исследование также показало, что отсутствие специфичности было большей проблемой, чем отсутствие чувствительности. Пока способы выявления на основе амплификации не заменили традиционные способы диагностики (Piersimoni et al., 36: 3601-3604, 1998. J. Clin Microbiology; смотри такжеMycobacterium paratuberculosis является хроническим кишечным патогеном, который может поражать много различных видов животных, включая приматов (Chiodini et al., Cornell Vet. 74: 218-262,1984). Впервые организм идентифицировали 100 лет назад в качестве причины хронического воспаления кишечника у коров немецкой породы. Классификация болезни Джона, или паратуберкулеза животных,характеризуется наличием в пораженном кишечнике миллионов кислотоустойчивых микобактерий в бациллярной форме с макрофагами, но с небольшим дополнительным воспалительным клеточным инфильтратом. М. paratuberculosis редко культивируют в бациллярной форме из указанных животных. Указанный клинико-патологический спектр мультибациллярного-паусимикробного паратуберкулеза у животных напоминает критические состояния, представленные лепроматозной и туберкулоидной формами лепры у человека. Прогресс в нашем понимании М. tuberculosis и вызываемого им заболевания на протяжении ряда лет в значительной степени задерживался иногда в результате огромных трудностей, связанных с идентификацией данного агента с помощью обычного культивирования в лаборатории (Chiodini et al., Clin. Microbiol. Rev. 2: 90-117, 1989). В Великобритании может существовать высокий риск,особенно в часы пик, что остаточные М. tuberculosis будут присутствовать в продаваемом в розницу пастеризованном коровьем молоке. Таким образом, остается необходимость в чувствительных, специфичных способах выявления Microbacterium spp., в частности М. tuberculosis. Сущность изобретения Согласно первому аспекту изобретения представлен способ выявления наличия микроорганизма в тестируемом образце, который включает в себя воздействие на тестируемый образец индуктором, который способен индуцировать экспрессию по меньшей мере одного гена в микроорганизме, и тестирование в отношении наличия мРНК, транскрибированной с гена, который индуцирован в результате воздействия указанного индуктора. В предпочтительном варианте микроорганизмом может быть медленно растущая бактерия. Предпочтительные медленно растущие бактерии включают, например, Borreliae, Pediococcus, Mycoplasma и штаммы Mycobacteria. Способ наиболее предпочтителен для выявления Mycobacteria Spp., в частности Mycobacterium tuberculosis, Mycobacterium paratuberculosis (например, М. avium subsp. paratuberculosis) и Mycobacteriumbovis. Тестируемый образец, который предположительно содержит микроорганизм, главным образом,будет переставлять собой клинический образец, взятый у субъекта, которого необходимо тестировать в отношении присутствия микроорганизма.-1 006579 Тестирование в отношении наличия специфичных последовательностей мРНК предпочтительно будет осуществляться на препарате нуклеиновой кислоты, выделенной из тестируемого образца. Указанный препарат нуклеиновой кислоты должен содержать мРНК, однако он не обязательно является препаратом очищенной поли А+-мРНК, также подходящими в качестве исходного материала являются препараты суммарной РНК или даже препараты суммарных нуклеиновых кислот, содержащие как РНК, так и геномную ДНК, в зависимости от природы способа, используемого для тестирования наличия специфичной мРНК. По существу для того чтобы выделить нуклеиновую кислоту из тестируемого образца можно использовать любой способ, известный в данной области для выделения препарата нуклеиновой кислоты, содержащего мРНК. Предпочтительным способом является способ выделения по Буму, описанный в патентах US-A5234809 и ЕР-В-0389063. Указанный способ, который можно использовать для выделения препарата нуклеиновой кислоты, содержащего как РНК, так и ДНК, основан на свойствах частиц диоксида кремния связывать нуклеиновые кислоты в присутствии разобщающего агента тиоцианата гуанидина (GuSCN). В предпочтительном варианте стадия тестирования в отношении наличия мРНК, транскрибированной с гена, который индуцирован в результате воздействия индуктора, включает в себя осуществление реакции амплификации, чтобы амплифицировать всю или часть мРНК, и регистрацию специфичных продуктов реакции амплификации. Наиболее предпочтительно реакцией амплификации является обратная транскрипция-полимеразная цепная реакция (RT-PCR) или амплификация, основанная на последовательности нуклеиновой кислоты (NASBA).RT-PCR хорошо известна в данной области для регистрации специфичных последовательностей мРНК. Протоколы выполнения RT-PCR и регистрации специфичных продуктов реакций RT-PCR можно найти в стандартных руководствах, например, таких как PCR Protocols: A Guide to Methods and Applications, Eds Innis et al., Academic Press, San Diego, CA, 1990; PCR in Bioanalysis: Methods in Molecular Biology, Vol. 92, S. J. Smeltzer, Ed., Humana Press, Totowa, NJ. , 1998. NASBA является относительно новым способом амплификации РНК (смотри Compton, Nature. 350: 91-92 (1991) ) . NASBA хорошо известна специалистам в данной области и описана, например, в US-A-5409818. NASBA является эффективным способом образования больших количеств последовательности РНК-мишени in vitro, позволяющим регистрировать последовательности РНК-мишени, которые присутствуют в очень низких концентрациях в исходном тестируемом образце. Способ NASBA основан на применении наборов праймеров, подобных наборам, используемым дляPCR, но один праймер модифицирован последовательностью промотора, например промотора Т 7. Показано, что чувствительность и специфичность амплификации NASBA является такой же, как в случаеPCR, и лучше, чем в случае большинства протоколов RT-PCR. Так как способ NASBA является изотермальным анализом и зависит от РНКазы Н, он не может амплифицировать ДНК.NASBA предпочтительно осуществляют согласно следующему способу:(a) составление реакционной смеси, содержащей пару праймеров NASBA PI и NASBA P2, подходящих для применения при амплификации области мРНК-мишени микроорганизма с помощью NASBA(смотри ниже), РНК-направленную ДНК-полимеразу, рибонуклеазу, которая гидролизует нить РНК гибрида РНК-ДНК, не гидролизуя однонитевые или двунитевые РНК или ДНК, РНК-полимеразу, которая узнает последовательность промотора, присутствующую в праймере NASBA P1, и рибонуклеозид- и дезоксирибонуклеозидтрифосфаты;(b) инкубирование реакционной среды с препаратом нуклеиновой кислоты, выделенной из тестируемого образца, который предположительно содержит микроорганизм, в условиях реакции, которые обеспечивают реакцию амплификации NASBA; и(c) выявление и/или количественное измерение какого-либо специфичного для микроорганизма продукта реакции амплификации NASBA. Выявление специфичного продукта(тов) реакции NASBA (т.е. смысловых и/или антисмысловых копий РНК-мишени) можно осуществлять с помощью ряда различных способов. В одном из способов продукт(ты) NASBA можно обнаружить с использованием специфичного для мишени зонда для гибридизации, способного к специфичному отжигу с продуктом NASBA. Гибридизационный зонд может быть связан с регистрируемой меткой, например флуоресцентным, люминесцентным, радиоактивным или хемилюминесцентным соединением или ферментной меткой или меткой любого другого типа, известной специалистам в данной области. Определенная природа метки не имеет решающего значения, но она должна быть способной давать сигнал, регистрируемый внешними способами, либо посредством самой метки, либо вместе с одним или несколькими дополнительными веществами (например, субстратом для фермента). Также в объем изобретения входит так называемая NASBA в режиме реального времени, которая позволяет осуществлять непрерывный мониторинг образования продукта реакции NASBA в ходе реакции. Этого можно достичь с использованием зонда с молекулярными маячками, содержащего специфичную по отношению к мишени последовательность, способную к отжигу с продуктом NASBA, олигонуклеотидную последовательность, образующую шпильку, и пару компонентов люминофор/гаситель,которые описаны в WO 95/13399. Методика молекулярных маячков более полно описана ниже. Если-2 006579 зонд с молекулярными маячками добавляют к реакционной смеси до амплификации, то можно осуществлять мониторинг образования продукта NASBA в режиме реального времени (смотри Leone et al., Nucleic Acids Research, 1998, Vol. 26, 2150-2155). В следующем способе молекулярные маячки можно включить в один из олигонуклеотидных праймеров, используемых при амплификации NASBA, как описано ниже, для того чтобы облегчить мониторинг реакции NASBA в режиме реального времени, не нуждаясь в отдельном зонде для гибридизации. В еще одном способе продукты реакции NASBA можно контролировать с использованием общего меченого зонда для регистрации, который гибридизуется с нуклеотидной последовательностью на 5'конце праймера 2. Это эквивалентно системе регистрации NucliSens, поставляемой Organon Teknika. В указанной системе специфичность в отношении продуктов NASBA, полученных на основе мРНКмишени, можно придать благодаря использованию специфичных для последовательности иммобилизованных зондов, содержащих олигонуклеотидные зонды, которые приведены в данном описании, прикрепленные к твердому носителю, такому как магнитные микрошарики. Наиболее предпочтительно общий меченый зонд для регистрации является зондом для регистрации ECL, поставляемый Organon Teknika. Ампликоны NASBA гибридизуют с HPV-специфичными иммобилизованными зондами и общим ECLзондом (посредством комплементарной последовательности в праймере 2). После гибридизации можно осуществить захват комплекса шарик/ампликон/ЕСL-зонд магнитным электродом автоматического считывающего устройства для ECL (например, считывающего устройства NucliSens, поставляемого Organon Teknika). Затем импульс напряжения запускает реакцию ECL. Индуцированным геном или геном(ами) может быть любой ген(ны), который можно индуцировать внешним стимулом, например, таким как химический агент или изменение окружающей среды. Индукция экспрессии одного или нескольких генов с последующей специфичной регистрацией транскриптов по меньшей мере одного индуцированного гена обеспечивает дополнительный уровень амплификации и таким образом повышает чувствительность по сравнению со способами, которые основаны на регистрации экспрессии мРНК без стадии индукции. Индуктором может быть по существу все, что угодно, что способно индуцировать экспрессию одного или нескольких генов в выбранном в качестве мишени виде микроорганизма. Индуктором может быть химическое вещество или стимул в окружающей среде, например, такой как воздействие света конкретной длины волны. Исследуемый образец, который необходимо тестировать в отношении наличия микроорганизма,подвергают воздействию индуктора в течение периода времени, достаточного для получения требуемой индукции экспрессии гена. Точное необходимое время воздействия будет варьировать в зависимости от природы индуктора и гена-мишени, который необходимо индуцировать. Для любой данной комбинации индуктор/ген подходящее время воздействия можно определить эмпирически с помощью стандартного эксперимента. После воздействия индуктором нуклеиновую кислоту можно выделить из тестируемого образца, как описано выше. В одном варианте изобретение относится к способу выявления микроорганизмов, который основан на индукции экспрессии гена, кодирующего фермент супероксиддисмутазу, посредством воздействия на тестируемый образец кислородом или пероксидом водорода, с последующим тестированием наличия транскриптов мРНК, соответствующих данному гену. Указанный способ предпочтителен для выявления микобактерий, наиболее предпочтительно М. tuberculosis или М. paratuberculosis, но он может быть адаптирован для выявления любого микроорганизма, имеющего ген супероксиддисмутазы, в котором экспрессию данного гена индуцируют воздействием кислорода или пероксида водорода. У М. tuberculosis ген, кодирующий супероксиддисмутазу, обозначают sodA (инвентарный номер в GenBank AF061030;SEQ ID NO: 57 и 58) . У М. avium subsp. paratuberculosis ген, кодирующий супероксиддисмутазу, обозначают sod (инвентарный номер в GenBank AF180816; SEQ ID NO: 59 и 60). Гомологи SodA/sod у других видов микроорганизмов можно идентифицировать, используя способы, хорошо известные специалистам в данной области, например, путем поиска в общедоступных базах данных последовательностей и/или непосредственно путем скрининга геномной ДНК. Стадию тестирования в отношении наличия транскриптов мРНК, соответствующих гену супероксиддисмутазы, можно проводить с помощью амплификации целой или части мРНК в RT-PCR илиNASBA и регистрации специфичных в отношении супероксиддисмутазы продуктов амплификации. Подходящие наборы праймеров для использования в амплификации мРНК sodA с помощью RTPCR или NASBA приведены ниже. Указанные наборы праймеров можно использовать при выявлении всех видов Mycobaterium, но особенно они подходят для выявления М. tuberculosis и М. bovis. Наборы праймеров для регистрации с помощью NASBA: праймер NASBA P1, содержащий SEQ ID NO: 20, и праймер NASBA P2, содержащий SEQ ID NO: 19; праймер NASBA P1, содержащий SEQ ID NO: 26, и праймер NASBA P2, содержащий SEQ ID NO: 25; праймер NASBA P1, содержащий SEQ ID NO: 32, и праймер NASBA P2, содержащий SEQ ID NO: 31;-3 006579 праймер NASBA P1, содержащий SEQ ID NO: 38, и праймер NASBA P2, содержащий SEQ ID NO: 37; праймер NASBA P1, содержащий SEQ ID NO: 61, и праймер NASBA P2, содержащий SEQ ID NO: 62; праймер NASBA P1, содержащий SEQ ID NO: 64, и праймер NASBA P2, содержащий SEQ ID NO: 65; праймер NASBA P1 4-86 и праймер NASBA P2, содержащий SEQ ID NO: 61, предпочтительно праймер 4-85; праймер 4-92 и праймер NASBA Р 2, содержащий SEQ ID NO: 64, предпочтительно праймер 4-91; праймер 4-104 и праймер NASBA P2, содержащий SEQ ID NO: 19, предпочтительно праймер 4-103; праймер 4-122 и праймер NASBA P2, содержащий SEQ ID NO: 31, предпочтительно праймер 4-115. Наборы праймеров для регистрации с помощью RT-PCR: праймер PCR, содержащий SEQ ID NO: 20, и праймер PCR, содержащий SEQ ID NO: 19; праймер PCR, содержащий SEQ ID NO: 26, и праймер PCR, содержащий SEQ ID NO: 25; праймер PCR, содержащий SEQ ID NO: 32, и праймер PCR, содержащий SEQ ID NO: 31; праймер PCR, содержащий SEQ ID NO: 38, и праймер PCR, содержащий SEQ ID NO: 37; праймер PCR, содержащий SEQ ID NO: 61, и праймер PCR, содержащий SEQ ID NO: 62; или праймер PCR, содержащий SEQ ID NO: 64, и праймер PCR, содержащий SEQ ID NO: 65. В каждом случае SEQ ID NO: относится к последовательностям, указанным в табл. 1, а номера праймеров - к праймерам, перечисленным в табл. 2. Олигонуклеотидные зонды, подходящие для применения при регистрации продуктов реакцийNASBA и RT-PCR, выполняемых с использованием указанных наборов специфичных праймеров, также относятся к данному изобретению, как обсуждается ниже. В следующем варианте изобретение относится к способу выявления микроорганизмов, который основан на индукции экспрессии гена рnсА путем воздействия на тестируемый образец химическим индуктором, который может представлять собой изопропил-В-D-тиогалактопиранозид или пиразинамид, с последующим тестированием наличия транскриптов мРНК, соответствующих гену рnсА. Указанный способ также предпочтителен для выявления видов Mycobacteria. Полная последовательность кДНК рnсА М. tuberculosis имеется в GenBank с инвентарным номером U59967 (смотри также SEQ ID NO: 98 и 99). Гомологи рnсА у других видов микроорганизмов можно идентифицировать с использованием способов,хорошо известных специалистам в данной области. И опять-таки стадию тестирования в отношении наличия транскриптов мРНК, соответствующих гену рnсА, можно проводить с помощью амплификации целой или части мРНК в RT-PCR или NASBA и регистрации pncA-специфичных продуктов амплификации. Подходящие наборы праймеров конкретно для использования при амплификации мРНК рnсА изMycobacterium tuberculosis с помощью RT-PCR или NASBA приведены ниже. Наборы праймеров для регистрации с помощью NASBA: праймер NASBA P1, содержащий SEQ ID NO: 2, и праймер NASBA Р 2, содержащий SEQ ID NO: 1; праймер NASBA P1, содержащий SEQ ID NO: 8, и праймер NASBA P2, содержащий SEQ ID NO: 7; праймер NASBA P1, содержащий SEQ ID NO: 14, и праймер NASBA P2, содержащий SEQ ID NO: 13; праймер 4-2 и праймер NASBA P2, содержащий SEQ ID NO: 1, предпочтительно праймер 4-1; праймер 4-8 и праймер NASBA P2, содержащий SEQ ID NO: 7, предпочтительно праймер 4-7; или праймер 4-14 и праймер NASBA P2, содержащий SEQ ID NO: 13, предпочтительно праймер 4-15. Наборы праймеров для регистрации с помощью RT-PCR: праймер PCR, содержащий SEQ ID NO: 2, и праймер PCR, содержащий SEQ ID NO: 1; праймер PCR, содержащий SEQ ID NO: 8, и праймер PCR, содержащий SEQ ID NO: 7; или праймер PCR, содержащий SEQ ID NO: 14, и праймер PCR, содержащий SEQ ID NO: 13. Изобретение, кроме того, относится к специфичным по отношению к мишени праймерам и олигонуклеотидным зондам для применения при выявлении видов Mycobacterium, в частности, для применения при выявлении видов Mycobacterium с помощью RT-PCR или NASBA. В частности изобретение относится к олигонуклеотидным праймерам и зондам, содержащим последовательности, представленные SEQ ID NO: 1-42, 61-69 и 74-97 в табл. 1:-4 006579 Таблица 1. Специфичные для Mycobacterium последовательности для включения в праймеры и зонды Пояснение: Х 1 означает нуклеотидную последовательность, содержащую промотор. Олигонуклеотиды, приспособленные для применения в качестве праймеров NASBA P1, имеют общую структуру X1-SEQ, где Х 1 означает нуклеотидную последовательность, содержащую промотор, a SEQ означает специфичную по отношению к мишени последовательность (SEQ ID NO), которая приведена в прилагаемом списке последовательностей. Включение промоторной последовательности важно в случае праймеровNASBA P1, но не обязательно в случае праймеров PCR, которые обсуждаются ниже. В предпочтительном варианте X1 может являться последовательностью, содержащей промотор Т 7, наиболее предпочтительно последовательностью ААТ ТСТ ААТ ACG ACT САС ТАТ AGG GAG AAGG.x2 и х 3 означают флуоресцирующий компонент и компонент-гаситель, способный в значительной степени или полностью гасить флуоресценцию от флуоресцирующего компонента в том случае, когда они оба удерживаются вместе близко друг к другу. Нуклеотид указывает положение в соответствующей последовательности кДНК.-7 006579 Изобретение, кроме того, относится к олигонуклеотидам, перечисленным в табл. 2, при этом олигонуклеотиды, являющиеся праймерами NASBA P1, содержат конкретную промоторную последовательность, а праймеры NASBA P2 содержат последовательность для связывания общего зонда для регистрации (см. далее) для применения в случае выявления видов Mycobacteria с помощью NASBA. Однако это не означает, что объем изобретения следует ограничивать указанными конкретными молекулами. Таблица 2-8 006579 Олигонуклеотидные праймеры и зонды, представленные в изобретении, могут быть сгруппированы в несколько типов. К первому типу олигонуклеотидов относятся праймеры NASBA P1, которые являются олигонуклеотидами обычно длиной примерно 50 оснований, содержащими в среднем примерно 20 оснований на 3'-конце, которые комплементарны области мРНК-мишени. Олигонуклеотиды, подходящие для применения в качестве праймеров NASBA P1, обозначены в табл. 1 NASBA P1/PCR. 5'-концы олигонуклеотидных праймеров Р 1 (обозначенные в данном описании в общем виде как X1) содержат промоторную последовательность, которая узнается специфичной РНКполимеразой. Промоторы бактериофагов, например, промоторы Т 7, Т 3 и SP6, являются предпочтительными для применения в олигонуклеотидах согласно изобретению, так как они обеспечивают преимущества транскрипции на высоком уровне, которая зависит только от связывания соответствующей РНКполимеразы. В предпочтительном варианте 5'-концевая последовательность олигонуклеотидных праймеров Р 1 может содержать последовательность AATTCTAATACGACTCACTATAGGG. Указанная последовательность содержит промотор Т 7, включая сайт инициации транскрипции для РНК-полимеразы Т 7. Специфичные для Mycobacterium последовательности, обозначенные в табл. 1 как NASBA P1/PCR подходят для применения как в качестве праймеров NASBA P1, так и в качестве стандартных праймеровPCR. В том случае, когда указанные последовательности используют в качестве основы праймеровNASBA P1, они имеют общую структуру X1-SEQ, где Х 1 означает последовательность, содержащую промотор, a SEQ означает специфичную по отношению к мишени последовательность. Последовательность промотора X1 необходима в праймере NASBA P1. Однако в том случае, когда те же самые последовательности используют в качестве основы стандартных праймеров PCR, не обязательно включать Х 1. Фразу номер последовательности, которую используют в формуле изобретения, необходимо интерпретировать соответствующим образом. Во избежание неясности, фразу праймер NASBA P1, содержащий SEQ ID NO: 1 необходимо интерпретировать как требование наличия последовательности X1 с 5'-стороны специфичной по отношению к Mycobacterium последовательности, указанной в списке как SEQ ID NO: 1, тогда как фраза праймер PCR содержащий SEQ ID NO: 1 относится к любому подходящему праймеру PCR, содержащему специфичную по отношению к Mycobacterium последовательность, при этом X1 не является необходимым признаком праймера PCR. Ко второму типу олигонуклеотидов, представленных в изобретении, относятся олигонуклеотиды праймера 2 NASBA, которые обычно содержат последовательность примерно из 20 оснований, в значительной степени идентичную области мРНК-мишени. Олигонуклеотидные последовательности, обозначенные в табл. 1 как NASBA P2/PCR, подходят для применения как в качестве праймеров NASBA P1,так и в качестве стандартных праймеров PCR. Олигонуклеотиды, предназначенные для применения в качестве праймеров NASBA Р 2, могут в конкретном, но не ограничивающем варианте, кроме того, содержать последовательность нуклеотидов на 5' -конце, которая не родственна мРНК-мишени, но которая способна гибридизоваться с общим зондом для регистрации. Зонд для регистрации предпочтительно будет меченым, например, флуоресцентной, люминесцентной или ферментной меткой. В одном варианте зонд для регистрации метят меткой, которая позволяет проводить регистрацию с использованием методики ECL, хотя будет понятно, что изобретение никоим образом не ограничено указанным конкретным способом регистрации. В предпочтительном варианте 5'-конец олигонуклеотидных праймеров 2 может содержать последовательность GATGCAAGGTCGCATATGAG. Указанная последовательность способна гибридизоваться с общим зондом ECL, коммерчески доступным из Organon Teknika, имеющим следующую структуру: Ru(bpy)32+ -GAT GCA AGG TCG CAT ATG AG-3'. В другом варианте получение олигонуклеотидного праймера 2 может включать в себя технологию молекулярных маячков, которая известна в данной области и описана, например, в WO 95/13399 Tyagiand Kramer, Nature Biotechnology, 14: 303-308, 1996, чтобы обеспечить мониторинг реакции NASBA в режиме реального времени. К третьему типу олигонуклеотидных молекул, представленных в изобретении, относятся специфичные по отношению к мишени олигонуклеотидные зонды (обозначенные зонд в таблице 1). Олигонуклеотидные зонды, как правило, содержат последовательность примерно из 20-25 оснований, в значительной степени идентичную области мРНК-мишени. Олигонуклеотидные зонды можно использовать в качестве специфичных для мишени гибридизационных зондов для регистрации продуктов реакцииNASBA или PCR. В этой связи олигонуклеотидные зонды могут быть связаны с твердым носителем, таким как парамагнитные шарики, чтобы получить иммобилизованный зонд (смотри ниже). В предпочтительном варианте 5'-конец олигонуклеотидного зонда можно метить биотином. Добавление биотиновой метки облегчает связывание зонда с твердым носителем с помощью связи биотин/стрептавидин или биотин/авидин. К четвертому типу олигонуклеотидных молекул, представленных в изобретении (обозначенных МВ-зонд в табл. 1), относятся специфичные для мишени зонды, полученные на основе технологии включения молекулярных маячков, которая известна в данной области и описана, например Tyagi and-9 006579 маячков позволяет проводить мониторинг в режиме реального времени реакций амплификации, таких как реакции NASBA или RT-PCR. Зонды с молекулярными маячками обычно содержат кроме специфичной для мишени последовательности дополнительные основания, которые позволяют формировать структуру петли в виде шпильки, флуоресцирующий компонент и компонент-гаситель, при этом флуоресцирующий компонент и компонент-гаситель обозначены в данном описании Х 2 и Х 3. Как будет понятно специалисту флуоресцирующий компонент и компонент-гаситель выбирают так, чтобы компонент-гаситель был способен в значительной степени или полностью гасить флуоресценцию от флуоресцирующего компонента в том случае, если оба компонента находятся в непосредственной близости, например, когда зонд находится в замкнутой конформации в виде шпильки в отсутствии последовательности-мишени. Зонды с молекулярными маячками, показанные в табл. 1, содержат комплементарные фланкирующие последовательности на 5'- и 3'-концах, фланкирующие последовательности, специфичные для микобактерий, которые способны гибридизоваться с образованием дуплекса в виде ствола. Точная нуклеотидная последовательность указанных фланкирующих последовательностей не является предметом изобретения за исключением требования, что они должны обладать способностью образовывать дуплекс в виде ствола в том случае, когда зонд не связан с последовательностью-мишенью HPV. Таким образом, специалисту будет понятно, что указанные последовательности в большой степени могут варьировать, не оказывая влияния на функцию зондов с молекулярными маячками. Любую из последовательностей, обозначенных зонд в таблице 1, можно использовать в качестве основы зонда с молекулярными маячками, добавляя подходящие комплементарные фланкирующие последовательности и гасящий и флуоресцирующий компоненты. В данной области известно большое количество примеров подходящих пар гаситель/флуоресцирующий компонент, которые можно использовать в зондах с молекулярными маячками(смотри WO 95/13399, Tyagi and Kramer, там же). Можно использовать широкий круг флуорофоров разных цветов, включая, например, 5-(2'-аминоэтил)аминонафталин-1-сульфоновую кислоту (EDANS),флуоресцеин, FAM и техасский красный (смотри Tyagi, Bratu and Kramer, 1998, Nature Biotechnology, 16,49-53). Применение зондов, меченых флуорофорами разных цветов, дает возможность для множественной регистрации двух или более различных зондов в одном реакционном сосуде. Предпочтительным гасителем является 4-(4'-диметиламинофенилазо)бензойная кислота (DABCYL), нефлуоресцентный хромофор, который служит в качестве универсального гасителя для широкого круга флуорофоров. Флуоресцирующий и гасящий компоненты могут быть ковалентно связаны с зондом в любой ориентации, либо с флуоресцирующим агентом на 5'-конце или вблизи 5'-конца и гасителем на 3'-конце или вблизи 3'конца, либо наоборот. Протоколы синтеза зондов с молекулярными маячками известны в данной области. Подробный протокол синтеза представлен в работе, озаглавленной Molecular Beacons: HybridizationGenetics, Public Health Research Institute, 455 First Avenue, New York, NY 10016, USA, которая находится в оперативном доступе на веб-сайте PHRI (www.phri.nyu.edu или www.molecularbeacons.org). Подходящие комбинации олигонуклеотидных молекул праймера 1 и праймера 2 можно использовать для регистрации мРНК-мишени с помощью NASBA. Для того чтобы направлять реакцию амплификации NASBA олигонуклеотиды праймера 1 и праймера 2 должны быть способными праймировать синтез двунитевой ДНК с области мРНК-мишени. Чтобы это происходило олигонуклеотидные праймеры 1 и праймера 2 должны содержать специфичные для мишени последовательности, которые комплементарны областям смысловой и антисмысловой нити мРНК-мишени, соответственно. В первой фазе цикла амплификации NASBA, так называемой нециклической фазе, олигонуклеотидный праймер 1 отжигается с комплементарной последовательностью в мРНК-мишени и его 3'-конец удлиняется в результате действия РНК-зависимой ДНК-полимеразы (например, обратной транскриптазы) при этом происходит синтез первой нити кДНК. Затем РНК-нить полученного в результате гибрида РНК:ДНК расщепляют, например, за счет действия РНКазы Н, чтобы оставить однонитевую ДНК. Олигонуклеотидный праймер 2 отжигается с последовательностью, комплементарной по отношению к 3'концу полученной однонитевой ДНК, и его 3'-конец удлиняется (за счет действия обратной транскриптазы) с образованием двунитевой ДНК. После этого РНК-полимераза способна транскрибировать множественные копии РНК с новой транскрипционно активной промоторной последовательности в двунитевой ДНК. Полученный РНК-транскрипт, который является антисмысловым по отношению к исходной мРНК-мишени, может действовать в качестве матрицы для следующего раунда реакций NASBA с праймером 2, который отжигается с РНК и праймирует синтез первой нити кДНК, и праймером 1, который праймирует синтез второй нити кДНК. Общие принципы реакции NASBA хорошо известны в данной области (смотри Compton, J. Nature, 350: 91-92). Специфичные по отношению к мишени олигонуклеотидные зонды, приведенные в данном описании, также можно связать с твердым носителем, таким как магнитные микрошарики, и использовать в качестве иммобилизованных зондов, чтобы иммобилизовать продукт реакции амплификации NASBA(однонитевую РНК). Специфичные по отношению к мишени зонды с молекулярными маячками, приведенные в данном описании, можно использовать для мониторинга реакции NASBA в режиме реального времени.- 10006579 Кроме того, изобретение будет понятно при обращении к следующим экспериментальным примерам со ссылками на сопровождающие фигуры, где на фиг. 1 показана временная кривая амплификации мРНК sodA M. tuberculosis и М. bovis с использованием амплификации NASBA в режиме реального времени с применением зондов с молекулярными маячками. X - ось флуоресценции (относительные единицы), у - ось времени (секунды). Пример 1. Индукция экспрессии бактериального гена. 1) Обработка кислородом. Образец, содержащий медленно растущие микобактерии, инокулируют в жидкую среду. Бактерии подвергают воздействию газообразного кислорода (барботирование) в течение 10 и 60 мин. Образцы. Из-за варьирующего количества собранных бактерий образцы разводят в жидкой среде, используемой для культивирования, перед тем как их переносят в лизирующий буфер. Разведения - 1:1 и 1:100. 2) Инокуляция в ростовые среды. Бактериальный образец помещают в среду, оптимальную для роста рассматриваемой бактерии, на ночь при 37 С. Даже если бактерии не размножаются в значительной степени, этого будет достаточно для индукции генов для начала реакции амплификации NASBA. Лизис бактерий. Лизирующий буфер (0,9 мл с низким значением рН) хранят при 2-8 С. Перед использованием буфер должен быть нагрет до 37 С в течение 30 мин, так чтобы растворились все кристаллы. 100 мл бактериальной культуры добавляют к 0,9 мл буфера. Тщательно перемешивают. Лизирующий буфер с бактериями инкубируют при 37 С в течение 10 мин. Лизированные бактерии хранят при -70 С или сразу же экстрагируют нуклеиновые кислоты. 3) Экстракция ДНК/РНК из образца индуцированных бактерий. Следующую процедуру выполняли согласно руководству Nuclisens, Organon Teknika:- к каждому образцу добавляют 50 мкл частиц диоксида кремния и инкубируют в течение 10 мин при комнатной температуре. Содержимое пробирок перемешивают каждые 2 мин. Весь материал переносят из образца в картридж, используемый в экстракторе Nuclisens. Следуют руководству для способа: Экстракция 1 мл плазмы. Тестирование праймеров для регистрации супероксиддисмутазы видов Mycobacterium. 2 X гранулы реагентов 2 X 80 мкл растворителя тщательно перемешивают, затем добавляют 28 мкл воды NASBA 32 мкл KCl(Все реагенты из системы Nuclisens, поставляемой Organon Teknika). Распределяют в 8 пробирок по 27,5 мкл в каждую пробирку. Праймеры добавляют следующим образом. (Номера праймеров соответствуют праймерам, перечисленным в табл. 2).пробирки Праймеры 1 1,25 мкл 4-85 (SEQ ID NO:70) 1,25 мкл 4-86 (SEQ ID NO:71) 2 1,25 мкл 4-85 (SEQ ID NO:70) 1,25 мкл 4-98 (SEQ ID NO:73) 3 1,25 мкл 4-97 (SEQ ID NO:72) 1,25 мкл 4-86 (SEQ ID NO:71) 4 1,25 мкл 4-97 (SEQ ID NO:72) 1,25 мкл 4-98 (SEQ ID NO:73) 5 1,25 мкл 4-115 (SEQ ID NO:53) 1,25 мкл 4-116 (SEQ ID NO:54) 6 1,25 мкл 4-115 (SEQ ID NO:53) 1,25 мкл 4-122 (SEQ ID NO:56) 7 1,25 мкл 4-121 (SEQ ID NO:55) 1,25 мкл 4-116 (SEQ ID NO:54) 8 1,25 мкл 4-121 (SEQ ID NO:55) 1,25 мкл 4-122 (SEQ ID NO:56) Образцы: М. tuberculosis и М. bovis. Амплификацию выполняли при 41 С в течение 2,5 ч. Продукты регистрировали на биоанализатореAgilent. Результаты: Праймеры выявляли как М. tuberculosis, так и М. bovis, как и ожидалось на основании их последовательности. Пример 3. Амплификация Mycobacterium tuberculosis из образца пациента. Образцы. 1) Штамм бактерии АТТС, выращенный в культуре (контроль).- 11006579 2) Образец от пациента. Основная смесь: 2 гранулы реагентов 2 X 80 мкл растворителя гранул реагентов Перемешивают в одной пробирке, добавляют 23 мкл воды NASBA 10 мкл праймера 1 (4-122; SEQ ID NO: 56) 10 мкл праймера 2 (4-115; SEQ ID NO: 53) 5 мкл молекулярных маячков (4-125; SEQ ID NO: 41) 32 мкл KCl Прогон образцов: Пример 4. Амплификация NASBA с молекулярными маячками Mycobacterium tuberculosis. 2 X гранулы реагентов 2 X 80 мкл растворителя 1) добавляют к 11,5 мкл воды 5 мкл праймера 4-115 (SEQ ID NO: 53) 5 мкл праймера 4-122 (SEQ ID NO: 56) 16 мкл KCl 2) и также добавляют к 11,5 мкл воды 5 мкл праймера 4-121 (SEQ ID NO: 55) 5 мкл праймера 4-116 (SEQ ID NO: 54) 16 мкл KCl Две смеси праймеров разделяют в 4 пробирки (всего 8), по 29,5 мкл в каждую пробирку. Добавляют молекулярные маячки; по 0,63 мкл в каждую пробирку: 1 а) 4-118 (SEQ ID NO:34) 1b) 4-119 (SEQ ID NO:35) 1 с) 4-124 (SEQ ID NO:40) 1d) 4-125 (SEQ ID NO:41) 2a) 4-118 (SEQ ID NO:34) 2b) 4-119 (SEQ ID NO:35) 2c) 4-124 (SEQ ID NO:40) 2d) 4-125 (SEQ ID NO:41) 2 X фермент разбавляют в 2 X 55 мкл разбавителя. Реагенты из NucliSens, Organon Teknika. Образцы. Образец 2 и 24 являются М. tuberculosis. Образец 7 является М. bovis.- 12006579 Амплификацию и регистрацию в считывающем устройстве проводят при 41 С при положении таймера 2,5. Результаты, кратность увеличения сигнала. Увеличение в 1,5 раза считается позитивным. Амплификацию регистрировали во всех образцах - наилучшие результаты зарегистрированы для основной смеси 1d. Оптимальные результаты получены для следующей комбинации праймеров и молекулярных маячков: праймер 2: 4-115 (SEQ ID NO: 53) праймер 1: 4-122 (SEQ ID NO: 56) молекулярный маячок: 4-125 (SEQ ID NO: 41) Графическое изображение амплификации показано на фиг. 1. Пример 5. Специфичность праймеров Mycobacterium tuberculosis в отношении sodA. Образцы: Основная смесь: 2 гранулы реагентов 2 гранулы ферментов 2 X 80 мкл растворителя гранул реагентов 2 X 55 мкл растворителя ферментов Смешивают в одной пробирке, затем добавляют 23 мкл воды NASBA 10 мкл праймера 1 (4-122; SEQ ID NO: 56) 10 мкл праймера 2 (4-115 SEQ ID NO: 53) 5 мкл молекулярных маячков (4-125; SEQ ID NO: 41) 32 мкл KCl. Прогон образцов- 13006579 Результаты Кратность увеличения сигнала (позитивный сигнал: выше 1,5). Заключение: праймеры специфичны в отношении М. tuberculosis или М. bovis и не будут реагировать с другими микобактериями или родственными бактериями, подобными Micrococcus luteus. Список последовательностейSEQ ID NO: 57. Нуклеотидная последовательность для sodA M. tuberculosis.SEQ ID NO: 58. Аминокислотная последовательность для sodA М. tuberculosis.SEQ ID NO: 59. Нуклеотидная последовательность для sod M. avium subsp. paratuberculosis.SEQ ID NO: 60. Аминокислотная последовательность для sod M. avium subsp. paratuberculosis.SEQ ID NO: 98. Нуклеотидная последовательность для pncA M. tuberculosis.SEQ ID NO: 99. Аминокислотная последовательность для pncA M. tuberculosis. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ выявления наличия микроорганизма в тестируемом образце, предусматривающий воздействие на тестируемый образец индуктором, который способен индуцировать экспрессию по меньшей мере одного гена в микроорганизме, и тестирование наличия мРНК, транскрибированной с гена, который индуцирован посредством воздействия указанным индуктором. 2. Способ по п.1, где микроорганизмом является медленно растущая бактерия. 3. Способ по п.2, где медленно растущая бактерия выбрана из группы, состоящей из Borreliae, Pediococcus, Mycoplasma и рода Mycobacterium. 4. Способ по любому из пп.1-3, где стадия тестирования наличия мРНК, транскрибированной с гена, который индуцирован посредством воздействия указанным индуктором, предусматривает осуществление реакции амплификации, чтобы амплифицировать всю или часть мРНК, и регистрацию специфичных продуктов реакции амплификации. 5. Способ по п.4, где реакцией амплификации является RT-PCR или амплификация, основанная на последовательности нуклеиновой кислоты. 6. Способ по любому из пп.3-5, где индуктором является кислород или пероксид водорода, а ген,который индуцируют посредством воздействия индуктором, представляет собой ген, кодирующий супероксиддисмутазу. 7. Способ по п.6, где стадия тестирования наличия мРНК, транскрибированной с гена, кодирующего супероксиддисмутазу, предусматривает:(а) составление реакционной смеси, содержащей пару праймеров NASBA P1 и NASBA P2, подходящую для применения при амплификации области указанной мРНК по методу NASBA, РНК-зависимую ДНК-полимеразу, рибонуклеазу, которая гидролизует нить РНК гибрида РНК-ДНК, не гидролизуя однонитевые или двунитевые РНК или ДНК, РНК-полимеразу, которая узнает последовательность промотора, присутствующую в праймере NASBA P1, и рибонуклеозид- и дезоксирибонуклеозидтрифосфаты;(b) инкубирование указанной реакционной среды с препаратом нуклеиновой кислоты, выделенной из тестируемого образца, который предположительно содержит микроорганизм, в условиях реакции,которые обеспечивают реакцию амплификации NASBA; и(c) выявление и/или количественное измерение какого-либо специфичного продукта реакции амплификации NASBA. 8. Способ по п.7 для применения при выявлении видов Mycobacterium, где пара праймеров NASBAP1 и NASBA P2 является одной из следующих пар: праймер NASBA P1, содержащий SEQ ID NO: 20, и праймер NASBA Р 2, содержащий SEQ ID NO: 19; праймер NASBA P1, содержащий SEQ ID NO: 26, и праймер NASBA Р 2, содержащий SEQ ID NO: 25; праймер NASBA P1, содержащий SEQ ID NO: 32, и праймер NASBA Р 2, содержащий SEQ ID NO: 31;- 14006579 праймер NASBA P1, содержащий SEQ ID NO: 38, и праймер NASBA Р 2, содержащий SEQ ID NO: 37; праймер NASBA P1, содержащий SEQ ID NO: 61, и праймер NASBA P2, содержащий SEQ ID NO: 62; праймер NASBA P1, содержащий SEQ ID NO: 64, и праймер NASBA P2, содержащий SEQ ID NO: 65; праймер NASBA P1 4-86 и праймер NASBA P2, содержащий SEQ ID NO: 61, предпочтительно праймер 4-85; праймер 4-92 и праймер NASBA P2, содержащий SEQ ID NO: 64, предпочтительно праймер 4-91; праймер 4-104 и праймер NASBA P2, содержащий SEQ ID NO: 19, предпочтительно праймер 4-103; или праймер 4-122 и праймер NASBA P2, содержащий SEQ ID NO: 31, предпочтительно праймер 4-115. 9. Способ по п.6, где стадия тестирования наличия мРНК, транскрибированной с гена, кодирующего супероксиддисмутазу, включает в себя амплификацию части мРНК по методу RT-PCR. 10. Способ по п.9 для применения при выявлении видов Mycobacterium, где амплификацию части мРНК по методу RT-PCR осуществляют с использованием одной из следующих пар праймеров: праймер PCR, содержащий SEQ ID NO: 20, и праймер PCR, содержащий SEQ ID NO: 19; праймер PCR, содержащий SEQ ID NO: 26, и праймер PCR, содержащий SEQ ID NO: 25; праймер PCR, содержащий SEQ ID NO: 32, и праймер PCR, содержащий SEQ ID NO: 31; праймер PCR, содержащий SEQ ID NO: 38, и праймер PCR, содержащий SEQ ID NO: 37; праймер PCR, содержащий SEQ ID NO: 61, и праймер PCR, содержащий SEQ ID NO: 62; или праймер PCR, содержащий SEQ ID NO: 64, и праймер PCR, содержащий SEQ ID NO: 65. 11. Способ по любому из пп.3-5, где индуктором является изопропилD-тиогалактопиранозид или пиразинамид, а ген, который индуцируют посредством воздействия индуктором, представляет собой ген рnсА. 12. Способ по п.11, где стадия тестирования наличия мРНК, транскрибированной с гена рnсА, предусматривает(a) составление реакционной смеси, содержащей пару праймеров NASBA P1 и NASBA P2, подходящую для применения при амплификации области указанной мРНК по методу NASBA, РНК-зависимую ДНК-полимеразу, рибонуклеазу, которая гидролизует нить РНК гибрида РНК-ДНК, не гидролизуя однонитевые или двунитевые РНК или ДНК, РНК-полимеразу, которая узнает последовательность промотора, присутствующую в праймере NASBA P1, и рибонуклеозид- и дезоксирибонуклеозидтрифосфаты;(b) инкубирование указанной реакционной среды с препаратом нуклеиновой кислоты, выделенной из тестируемого образца, который предположительно содержит микроорганизм, в условиях реакции,которые обеспечивают реакцию амплификации NASBA; и(c) выявление и/или количественное измерение какого-либо специфичного продукта реакции амплификации NASBA. 13. Способ по п.12 для применения при выявлении Mycobacterium tuberculosis, где пара праймеровNASBA P1 и NASBA Р 2 является одной из следующих пар: праймер NASBA P1, содержащий SEQ ID NO: 2, и праймер NASBA Р 2, содержащий SEQ ID NO: 1; праймер NASBA P1, содержащий SEQ ID NO: 8, и праймер NASBA P2, содержащий SEQ ID NO: 7; праймер NASBA P1, содержащий SEQ ID NO: 14, и праймер NASBA P2, содержащий SEQ ID NO: 13; праймер 4-2 и праймер NASBA P2, содержащий SEQ ID NO: 1, предпочтительно праймер 4-1; праймер 4-8 и праймер NASBA P2, содержащий SEQ ID NO: 7, предпочтительно праймер 4-7; или праймер 4-14 и праймер NASBA P2, содержащий SEQ ID NO: 13, предпочтительно праймер 4-15. 14. Способ по п.11, где стадия тестирования наличия мРНК, транскрибированной с гена рпсА,включает в себя амплификацию части мРНК по методу RT-PCR. 15. Способ по п.14, используемый для выявления Mycobacterium tuberculosis, где амплификацию части мРНК по методу RT-PCR осуществляют с использованием одной из следующих пар праймеров: праймер PCR, содержащий SEQ ID NO: 2, и праймер PCR, содержащий SEQ ID NO: 1; праймер PCR, содержащий SEQ ID NO: 8, и праймер PCR, содержащий SEQ ID NO: 7; или праймер PCR, содержащий SEQ ID NO: 14, и праймер PCR, содержащий SEQ ID NO: 13. 16. Олигонуклеотидный праймер, используемый для регистрации мРНК, экспрессированной у видаMycobacterium, мРНК которого транскрибирована с индуцируемого гена, при этом олигонуклеотидный праймер выбран из(i) праймера NASBA P1, содержащего одну из SEQ ID NO: 2, 8, 14, 20, 26, 32, 38, 62, 65, 68, 75, 78,81, 84, 87, 90, 93 или 96;(ii) праймера NASBA P1, который является праймером номер 4-2, 4-8, 4-14, 4-86, 4-98, 4-104, 4-110,4-116 или 4-122;(iii) праймера NASBA P2, содержащего одну из SEQ ID NO: 1, 7, 13, 19, 25, 31, 37, 61, 64, 67, 74, 77,80, 83, 86, 89, 92 или 95;(iv) праймера NASBA P2, который является праймером номер 4-1, 4-7, 4-13, 4-85, 4-97, 4-103, 4-109,4-115 или 4-121;(v) праймера PCR, содержащего одну из SEQ ID NO: 1, 2, 7, 8, 13, 14, 19, 20, 25, 26, 31, 32, 37, 38,61, 62, 64, 65, 67, 68, 74, 75, 77, 78, 80, 81, 83, 84, 87, 88, 89, 90, 92, 93, 95 или 96. 17. Олигонуклеотидный зонд, используемый для регистрации мРНК, экспрессированной у видаMycobacterium, мРНК которого транскрибирована с индуцируемого гена, при этом молекула олигонуклеотида выбрана из(i) олигонуклеотидного зонда, содержащего одну из SEQ ID NO: 3, 9, 15, 21, 27, 33, 39, 63, 66, 69,76, 79, 82, 85, 88, 91, 94, 97;(ii) олигонуклеотидного зонда с молекулярными маячками, который является SEQ ID NO: 4, 5, 6,10, 11, 12, 16, 17, 18, 22, 23, 24, 28, 29, 30, 34, 35, 36, 40, 41 или 42. 18. Набор праймер/зонд для регистрации методом NASBA мРНК, экспрессированной у вида Mycobacterium, мРНК которого транскрибирована с индуцируемого гена, при этом набор праймер/зонд выбран из следующих наборов: праймер NASBA P1, содержащий SEQ ID NO: 2, праймер NASBA Р 2, содержащий SEQ ID NO: 1 и либо зонд, содержащий SEQ ID NO: 3, либо по меньшей мере один зонд с молекулярными маячками,выбранный из SEQ ID NO: 4, 5 и 6; праймер NASBA P1, содержащий SEQ ID NO: 8, праймер NASBA P2, содержащий SEQ ID NO: 7, и либо зонд, содержащий SEQ ID NO: 9, либо по меньшей мере один зонд с молекулярными маячками,выбранный из SEQ ID NO: 10, 11 и 12; праймер NASBA P1, содержащий SEQ ID NO: 14, праймер NASBA P2, содержащий SEQ ID NO: 13,и либо зонд, содержащий SEQ ID NO: 15, либо по меньшей мере один зонд с молекулярными маячками,выбранный из SEQ ID NO: 16, 17 и 18; праймер 4-2, праймер NASBA P2, содержащий SEQ ID NO: 1, предпочтительно праймер 4-1, и либо зонд, содержащий SEQ ID NO: 3, либо по меньшей мере один зонд с молекулярными маячками, выбранный из SEQ ID NO: 4, 5 и 6; праймер 4-8, праймер NASBA P2, содержащий SEQ ID NO: 7, предпочтительно праймер 4-7, и либо зонд, содержащий SEQ ID NO: 9, либо по меньшей мере один зонд с молекулярными маячками, выбранный из SEQ ID NO: 10, 11 и 12; праймер 4-14, праймер NASBA P2, содержащий SEQ ID NO: 13, предпочтительно праймер 4-15, и либо зонд, содержащий SEQ ID NO: 15, либо по меньшей мере один зонд с молекулярными маячками,выбранный из SEQ ID NO: 16, 17 и 18; праймер NASBA P1, содержащий SEQ ID NO: 20, праймер NASBA Р 2, содержащий SEQ ID NO: 19,и либо зонд, содержащий SEQ ID NO: 21, либо по меньшей мере один зонд с молекулярными маячками,выбранный из SEQ ID NO: 22, 23 и 24; праймер NASBA P1, содержащий SEQ ID NO: 26, праймер NASBA Р 2, содержащий SEQ ID NO: 25,и либо зонд, содержащий SEQ ID NO: 27, либо по меньшей мере один зонд с молекулярными маячками,выбранный из SEQ ID NO: 28, 29 и 30; праймер NASBA P1, содержащий SEQ ID N0: 32, праймер NASBA Р 2, содержащий SEQ ID NO: 31,и либо зонд, содержащий SEQ ID NO: 33, либо по меньшей мере один зонд с молекулярными маячками,выбранный из SEQ ID NO: 34, 35 и 36; или праймер NASBA P1, содержащий SEQ ID NO: 38, праймер NASBA P2, содержащий SEQ ID NO: 37,и либо зонд, содержащий SEQ ID NO: 39, либо по меньшей мере один зонд с молекулярными маячками,выбранный из SEQ ID NO: 40, 41 и 42. праймер NASBA P1 4-86 и праймер NASBA P2, содержащий SEQ ID NO: 61, предпочтительно праймер 4-85; праймер 4-104 и праймер NASBA P2, содержащий SEQ ID NO: 19, предпочтительно праймер 4-103. 19. Набор праймеров для регистрации методом RT-PCR мРНК, экспрессированной у вида Mycobacterium, мРНК которого транскрибирована с индуцируемого гена, при этом набор праймер/зонд выбран из следующих наборов: праймер PCR, содержащий SEQ ID NO: 2, и праймер PCR, содержащий SEQ ID NO: 1; праймер PCR, содержащий SEQ ID NO: 8, и праймер PCR, содержащий SEQ ID NO: 7; праймер PCR, содержащий SEQ ID NO: 14, и праймер PCR, содержащий SEQ ID NO: 13; праймер PCR, содержащий SEQ ID NO: 20, и праймер PCR, содержащий SEQ ID NO: 19; праймер PCR, содержащий SEQ ID NO: 26, и праймер PCR, содержащий SEQ ID NO: 25; праймер PCR, содержащий SEQ ID NO: 32, и праймер PCR, содержащий SEQ ID NO: 31; или праймер PCR, содержащий SEQ ID NO: 38, и праймер PCR, содержащий SEQ ID NO: 37. 20. Набор праймер/зонд для регистрации методом RT-PCR мРНК, экспрессированной у вида Mycobacterium, мРНК которого транскрибирована с индуцируемого гена, при этом набор праймер/зонд выбран из следующих наборов: праймер PCR, содержащий SEQ ID NO: 2, праймер PCR, содержащий SEQ ID NO: 1, и зонд, содержащий SEQ ID NO:3;
МПК / Метки
МПК: C12Q 1/68
Метки: микроорганизмах, выявление, индуцибельных, генов
Код ссылки
<a href="https://eas.patents.su/30-6579-vyyavlenie-inducibelnyh-genov-v-mikroorganizmah.html" rel="bookmark" title="База патентов Евразийского Союза">Выявление индуцибельных генов в микроорганизмах</a>
Предыдущий патент: Гидрофобные агонисты допамина, введенные в дерму
Следующий патент: Новые соединения, являющиеся сильнодействующими ингибиторами механизма обмена ионов na+/ca2+ при лечении аритмии
Случайный патент: Способ построения трехмерной модели земли