1,2-диарилбензимидазолы для лечения заболеваний, связанных с активацией микроглии
Номер патента: 6302
Опубликовано: 27.10.2005
Авторы: Кунке Йоахим, Мённинг Урсула, Хальфбродт Вольфганг
Формула / Реферат
1. Соединения общей формулы
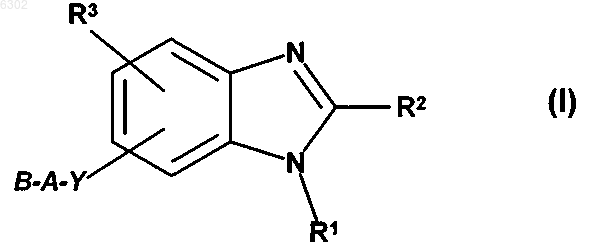
в которой R1 означает моно- либо бициклическую C6-12арильную группу или моно- либо бициклическую 5-10-членную гетероарильную группу с 1-4 гетероатомами, выбранными из группы, включающей N, S и O, при этом указанная арильная или гетероарильная группа может содержать до трех заместителей, независимо друг от друга выбранных из F, Cl, Br, I, C(NH)NH2, C(NH)NHR4, C(NH)NR4R4', C(NR4)NH2, C(NR4)NHR4', C(NR4)NR4R4', XOH, XOR4, XOCOR4, XOCONHR4, XOCOOR4, XCOR4, XC(NOH)R4, XC(NOR4)R4', XC(NO(COR4))R4', XCN, XCOOH, XCOOR4, XCONH2, XCONR4R4', XCONHR4, XCONHOH, XCONHOR4, XCOSR4, XSR4, XSOR4, XSO2R4, SO2NH2, SO2NHR4, SO2NR4R4', NO2, XNH2, XNHR4, XNR4R4', XNHSO2R4, XN(SO2R4)SO2R4', XNR4SO2R4', XNHCOR4, XNHCOOR4, XNHCONHR4, тетрагидро-2,5-диоксопиррол-1-ила, 2,5-дигидро-2,5-диоксопиррол-1-ила, 2,7-дигидро-2,7-диоксоизоиндол-1-ила и R4, причем два заместителя у R1, если они находятся в орто-положении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2-диилбисоксигруппу, пропан-1,3-диил или бутан-1,4-диил,
R2 означает моно- либо бициклическую C6-10арильную группу или моно- либо бициклическую 5-10-членную гетероарильную группу с 1-4 гетероатомами, выбранными из группы, включающей N, S и O, при этом указанная арильная или гетероарильная группа может содержать до трех заместителей, независимо друг от друга выбранных из F, Cl, Br, I, XOH, XOR4, XOCOR4, XOCONHR4, XOCOOR4, XCOR4, XC(NOH)R4, XC(NOR4)R4', XC(NO(COR4))R4', XCOOH, XCOOR4, XCONH2, XCONHR4, XCONR4R4', XCONHOH, XCONHOR4, XCOSR4, XSR4, XSOR4, XSO2R4, SO2NH2, SO2NHR4, SO2NR4R4', NO2, XNHSO2R4, XN(SO2R4)SO2R4', XNR4 SO2R4' , тетрагидро-2,5-диоксопиррол-1-ила, 2,5-дигидро-2,5-диоксопиррол-1-ила, 2,7-дигидро-2,7-диоксоизоиндол-1-ила и R4 , причем два заместителя у R2 , если они находятся в орто-положении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2-диилбисоксигруппу, пропан-1,3-диил или бутан-1,4-диил, R3 означает один или два заместителя, которыми независимо друг от друга могут являться водород, F, Cl, Br, I, XOH, XOR4, XOCOR4, XOCONHR4, XOCOOR4, XCOR4, XC(NOH)R4, XC(NOR4)R4', XC(NO(COR4))R4', XCN, XCOOH, XCOOR4, XCONH2, XCONHR4, XCONR4R4', XCONHOH, XCONHOR4, XCOSR4, XSR4, XSOR4, XSO2R4, SO2NH2, SO2NHR4, SO2NR4R4', NO2, XNH2, XNHR4, XNR4R4', XNHSO2R4, XNR4SO2R4', XN(SO2R4)(SO2R4'), XNHCOR4, XNHCOOR4, XNHCONHR4, тетрагидро-2,5-диоксопиррол-1-ил, 2,5-дигидро-2,5-диоксопиррол-1-ил, 2,7-дигидро-2,7-диоксоизоиндол-1-ил или R4, при этом два заместителя R3, если они находятся в орто-положении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2-диилбисоксигруппу, пропан-1,3-диил или бутан-1,4-диил,
R4 и R4' независимо друг от друга означают C1-4перфторалкил, C1-6алкил, C2-6алкенил, C2-6алкинил, C3-7циклоалкил, (C1-3алкил-C3-7циклоалкил), C1-3алкил-C6-10арил, C1-3алкил-(5-10-членный гетероарил с 1-4 N-, S- или O-атомами), C6-10арил или 5-10-членный гетероарил с 1-4 N-, S- или O-атомами, при этом арильные и гетероарильные группы могут быть замещены одним или двумя заместителями из группы, включающей F, Cl, Br, CH3, C2H5, NO2, OCH3, OC2H5, CF3, C2F5, или могут также нести аннелированную метандиилбисокси-, этан-1,2-диилбисоксигруппу и, кроме того, в 5-членном циклоалкильном кольце одним его членом может являться N или O, а в 6- или 7-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или O, причем атомы азота кольца необязательно могут быть замещены C1-3алкилом или C1-3алканоилом,
R5 и R5' независимо друг от друга означают C1-6алкил, C2-6алкенил, C2-6алкинил, при этом один атом углерода может быть заменен на O, S, SO, SO2, NH, N-C1-3алкил или N-C1-3алканоил, или означают C3-7циклоалкил-C0-3алкил, при этом в 5-членном циклоалкильном кольце одним его членом может являться N или O, а в 6- или 7-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или O, причем атомы азота кольца необязательно могут быть замещены C1-3алкилом или C1-3алканоилом, C6-10арил или 5-10-членный гетероарил с 1-4 гетероатомами из группы, включающей N, S и O, причем указанные алкильные, алкенильные и алкинильные цепи могут быть замещены одной из вышеуказанных циклоалкильных, арильных или гетероарильных групп и, кроме того, все вышеуказанные алкильные и циклоалкильные остатки могут содержать до двух таких заместителей, как CF3, C2F5, OH, O-C1-3алкил, NH2, NH-C1-3алкил, NH-C1-3алканоил, N(C1-3алкил)2, N(C1-3алкил)(C1-3алканоил), COOH, CONH2, COO-C1-3алкил, а все вышеуказанные арильные и гетероарильные группы могут быть замещены одним или двумя заместителями из группы, включающей F, Cl, Br, CH3, C2H5, NO2, OCH3, OC2H5, CF3, C2F5, или могут также нести аннелированную метандиилбисоксигруппу или этан-1,2-диилбисоксигруппу, или
R5 и R5' вместе с атомом азота образуют 5-7-членный гетероцикл, который может содержать еще один атом кислорода, азота или серы и который может быть замещен C1-4алкилом, C1-4алкокси-C0-2алкилом, C1-4алкоксикарбонилом, аминокарбонилом или фенилом,
A означает C1-10алкандиил, C2-10алкендиил, C2-10алкиндиил или (C0-5алкандиил-C3-7циклоалкандиил-C0-5алкандиил), при этом в 5-членном циклоалкильном кольце одним его членом может являться N или O, а в 6- или 7-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или O, причем атомы азота кольца необязательно могут быть замещены C1-3алкилом или C1-3алканоилом, и, кроме того, т вышеуказанных алифатических цепях один или два атома углерода могут быть заменены на O, NH, N-C1-3алкил, N-C1-3алканоил, а алкильные или циклоалкильные группы могут содержать до двух таких заместителей, как =O, OH, O-C1-3алкил, NH2, NH-C1-3алкил, NH-C1-3алканоил, N(C1-3алкил)2, N(C1-3алкил)(C1-3алканоил),
B означает COOH, COOR5, CONH2, CONHNH2, CONHR5, CONR5R5', CONHOH, CONHOR5, SO3H, SO2NH2, SO2NHR5, SO2NR5R5', PO3H, PO(OH)(OR5), PO(OR5)(OR5'), PO(OH)(NHR5), PO(NHR5)(NHR5') или тетразолил, при этом каждый из указанных остатков связан с атомом углерода группы A,
или вся группа Y-A-B представляет собой N(SO2R4)(SO2R4') или NHSO2R4,
X означает связь, CH2, (CH2)2, CH(CH3), (CH2)3, CH(CH2CH3), CH(CH3)CH2 или CH2CH(CH3) и
Y означает O, NH, NR4, NCOR4 или NSO2R4,
при условии, что если Y представляет собой NH, NR4 , NCOR4 или NSO2R4 и
а) заместитель R2 содержит азотсодержащий насыщенный гетероцикл, то такой гетероцикл не замещен у иминового азота атомом H, метилом, этилом, пропилом или изопропилом, или
б) в необязательно присутствующих группах XNHR4 или XNR4R4' заместителя R2 заместители R4 и /или R4' не означают C1-4алкил, а также при условии, что одновременно B не означает COOH, SO3H, PO3H2 или тетразолил и R1 и R2 независимо друг от друга не означают C5-6гетероарил или фенил, когда они независимо друг от друга незамещены, однозамещены C1-6алкилом, C1-4перфторалкилом, O-C1-6алкилом, O-C1-4перфторалкилом, группой COOH, COO-C1-6алкилом, CO-C1-6алкилом, группой CONH2, группой CONHR4, группой NO2, группой NH2, группой NHCOR4, группой NHSO2R4 или замещены 1 или 2 атомами галогена из группы, включающей F, Cl, Br, J, и за исключением следующих соединений:
метиловый эфир [(1,2-дифенил-1H-бензимидазол-6-ил)окси]уксусной кислоты,
метиловый эфир 5-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]пентановой кислоты,
этиловый эфир 4-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]масляной кислоты,
метиловый эфир 5-[[1-(4-нитрофенил)-2-фенил-1H-бензимидазол-6-ил]окси]пентановой кислоты,
метиловый эфир 6-[[1-(4-нитрофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 5-[[1-(4-аминофенил)-2-фенил-1H-бензимидазол-6-ил]окси]пентановой кислоты,
метиловый эфир 5-[[1-[4-[[(4-хлорфенил)сульфонил]амино]фенил]-2-фенил-1H-бензимидазол-6-ил]окси]пентановой кислоты,
метиловый эфир 5-[[1-[4-[(ацетил)амино]фенил]-2-фенил-1H-бензимидазол-6-ил]окси]пентановой кислоты,
метиловый эфир 5-[[1-(3-нитрофенил)-2-фенил-1H-бензимидазол-6-ил]окси]пентановой кислоты,
метиловый эфир 6-[[1-(3-нитрофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 5-[[1-(3-аминофенил)-2-фенил-1H-бензимидазол-6-ил]окси]пентановой кислоты,
метиловый эфир 5-[[1-[3-[[(4-хлорфенил)сульфонил]амино]фенил]-2-фенил-1H-бензимидазол-6-ил]окси]пентановой кислоты,
метиловый эфир 5-[[1-[3-[(ацетил)амино]фенил]-2-фенил-1H-бензимидазол-6-ил]окси]пентановой кислоты.
2. Бензимидазолы по п.1, отличающиеся тем, что R1 означает моно- либо бициклическую C6-12арильную группу или моно- либо бициклическую 5-10-членную гетероарильную группу с 1-2 гетероатомами, выбранными из группы, включающей N, S и O, при этом указанная арильная или гетероарильная группа может содержать до трех заместителей, независимо друг от друга выбранных из F, Cl, Br, XOH, XOR4, XOCOR4, XOCONHR4, XOCOOR4, XCOR4, XCN, XCOOH, XCOOR4, XCONH2, XCONR4R4', XCONHR4, XCONHOH, XCONHOR4, XCOSR4, XSR, NO2, XNHR, XNR4R4' и R4, причем два заместителя у R1, если они находятся в орто-положении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2-диилбисоксигруппу, пропан-1,3-диил или бутан-1,4-диил.
3. Бензимидазолы по п.1 или 2, отличающиеся тем, что R2 означает моно- либо бициклическую C6-10арильную группу или моно- либо бициклическую 5-10-членную гетероарильную группу с 1-2 гетероатомами, выбранными из группы, включающей N, S и O, при этом указанная арильная или гетероарильная группа может содержать до трех заместителей, независимо друг от друга выбранных из F, Cl, Br, XOH, XOR4, XOCOR4, XOCONHR4, XOCOOR4, XCOR4, XC(NOH)R4, XC(NOR4)R4', XC(NO(COR4))R4', XCOOH, XCOOR4, XCONH2, XCONHR4, XCONR4R4', XCONHOH, XCONHOR4, XCOSR4, XSR4, XSOR4, XSO2R4, SO2NH2, SO2NHR4, SO2NR4R4', NO2, XNHSO2R4, XN(SO2R4)SO2R4', XNR4 SO2R4' и R4, причем два заместителя у R2, если они находятся в орто-положении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2-диилбисоксигруппу, пропан-1,3-диил или бутан-1,4-диил.
4. Бензимидазолы по любому из пп.1-3, отличающиеся тем, что R3 означает один или два заместителя, которыми независимо друг от друга могут являться водород, F, Cl, Br, XOH, XOR4, XOCOR4, XOCONHR4, XOCOOR4, XCOR4, XC(NOH)R4, XC(NOR4)R4', XC(NO(COR4))R4', XCN, XSR4, XSOR4, XSO2R4, SO2NH2, SO2NHR4, SO2NR4R4', NO2, XNH2, XNHR4, XNR4N4', XNHSO2R4, XNR4SO2R4', XN(SO2R4)SO2R4', XNHCOR4, XNHCOOR4, XNHCONHR4 или R4, при этом два заместителя R3, если они находятся в орто-положении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2-диилбисоксигруппу, пропан-1,3-диил или бутан-1,4-диил.
5. Бензимидазолы по любому из пп.1-4, отличающиеся тем, что R4 и R4' независимо друг от друга означают CF3, C2F5, C1-4алкил, C2-4алкенил, C2-4алкинил, C3-6циклоалкил, (C1-3алкил-C3-6циклоалкил), фенил или 5-6-членный гетероарил с 1-2 N-, S- или O-атомами, при этом фенильные и гетероарильные группы могут быть замещены одним или двумя заместителями из группы, включающей F, Cl, Br, CH3, C2H5, OCH3, OC2H5, CF3, C2F5, и, кроме того, в 5-членном циклоалкильном кольце одним его членом может являться N или O, а в 6-членном циклоалкильэюь кольце одним или двумя его членами могут являться N и/или O, причем атомы азота кольца необязательно могут быть замещены C1-3алкилом или C1-3алканоилом.
6. Бензимидазолы по любому из пп.1-5, отличающиеся тем, что R5 и R5' независимо друг от друга означают C1-6алкил, при этом один атом углерода может быть заменен на O, NH, N-C1-3алкил, N-C1-3алканоил, или означают C3-7циклоалкил-C0-3алкил, при этом в 5-членном циклоалкильном кольце одним его членом может являться N или O, а в 6- или 7-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или O, причем атомы азота кольца необязательно могут быть замещены C1-3алкилом или C1-3алканоилом, при этом указанные C1-6алкильные фрагменты могут быть замещены одной из вышеуказанных циклоалкильных групп или же 5-6-членной гетероароматической группой с 1-2 гетероатомами, выбранными из N, S и O, и, кроме того, все вышеуказанные алкильные и циклоалкильные фрагменты могут содержать до двух таких заместителей, как CF3, OH, O-C1-3алкил, а вышеуказанные гетероарильные группы могут быть замещены одним или двумя такими заместителями, как F, Cl, CF3, CH3, C2H5, OCH3, OC2H5, или R5 и R5' вместе с атомом азота образуют 5-7-членный гетероцикл, который может содержать еще один атом кислорода, азота или серы и может быть замещен C1-4алкилом, C1-4алкокси-C0-2алкилом, C1-4алкоксикарбонилом, аминокарбонилом или фенилом.
7. Бензимидазолы по любому из пп.1-6, отличающиеся тем, что A означает C1-10алкандиил, C2-10алкендиил, C2-10алкиндиил или (C0-5алкандиил-C3-7циклоалкандиил-C0-5алкандиил), при этом в 5-членном циклоалкильном кольце одним его членом может являться N или O, а в 6- или 7-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или O, причем атомы азота кольца необязательно могут быть замещены C1-3алкилом или C1-3алканоилом, и в вышеуказанных алифатических цепях один или два атома углерода могут быть заменены на O, NH, N-C1-3алкил, N-C1-3алканоил.
8. Бензимидазолы по любому из пп.1-7, отличающиеся тем, что B означает COOH, COOR5, CONH2, CONHR5, CONR5R5', CONHOH, CONHOR5 или тетразолил, при этом каждый из указанных остатков связан с атомом углерода группы A.
9. Бензимидазолы по любому из пп.1-8, отличающиеся тем, что X означает связь или метилен.
10. Бензимидазолы по любому из пп.1-9, отличающиеся тем, что Y означает O.
11. Соединения из группы, включающей:
изопропиловый эфир [(1,2-дифенил-1H-бензимидазол-6-ил)окси]уксусной кислоты,
метиловый эфир 3-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]пропионовой кислоты,
метиловый эфир 2-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]пропионовой кислоты,
изопропиловый эфир 4-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]масляной кислоты,
изопропиловый эфир 5-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]пентановой кислоты,
метиловый эфир 6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексановой кислоты,
изопропиловый эфир 6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексановой кислоты,
6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,
N-метокси-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,
N-(фенилметокси)-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,
N-гидрокси-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,
метиловый эфир 7-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гептановой кислоты,
изопропиловый эфир 6-[[1-(3-нитрофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[2-фенил-1-[3-(трифторметил)фенил]-1H-бензимидазол-6-ил]окси]гексановой кислоты,
изопропиловый эфир 6-[[2-фенил-1-[3-(трифторметил)фенил]-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-(3-цианофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
изопропиловый эфир 6-[[1-(3-цианофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
6-[[1-(3-цианофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота,
метиловый эфир 6-[[1-(4-цианофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
изопропиловый эфир 6-[[1-(4-цианофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-(3-хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
изопропиловый эфир 6-[[1-(3-хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-(4-хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
изопропиловый эфир 6-[[1-(4-хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-(3-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
изопропиловый эфир 6-[[1-(3-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
изопропиловый эфир 6-[[1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-(3,5-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
изопропиловый эфир 6-[[1-(3,5-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-(3-метоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-(4-метоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-(3,4-диметоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-[3,4-(метилендиокси)фенил]-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
6-[[1-[3,4-(метилендиокси)фенил] -2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота,
метиловый эфир 6-[[2-фенил-1-(3,4,5-триметоксифенил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,
6-[[2-фенил-1-(3,4,5-триметоксифенил)-1H-бензимидазол-6-ил]окси]гексановая кислота,
изопропиловый эфир 6-[[2-фенил-1-(3,4,5-триметоксифенил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-[4-(N,N-диметиламино)фенил]-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
6-[[1-[4-(N,N-диметиламино)фенил]-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота,
изопропиловый эфир 6-[[1-фенил-2-[3-(трифторметил)фенил]-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[2-(3-хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
изопропиловый эфир 6-[[2-(3-хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[2-(4-хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
изопропиловый эфир 6-[[2-(4-хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[2-(4-метилфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
изопропиловый эфир 6-[[2-(4-метилфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-фенил-2-(4-пиридинил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[(1,2-дифенил-5-нитро-1H-бензимидазол-6-ил)окси]гексановой кислоты,
изопропиловый эфир 6-[(1,2-дифенил-5-нитро-1H-бензимидазол-6-ил)окси]гексановой кислоты,
изопропиловый эфир 6-[[5-[[(4-бромфенил)сульфонил]амино]-1,2-дифенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[5-[[(4-хлорфенил)сульфонил]амино]-1,2-дифенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
изопропиловый эфир 6-[[5-[[(4-хлорфенил)сульфонил]амино]-1,2-дифенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
изопропиловый эфир 6-[[1,2-дифенил-5-[[(3-метилфенил)сульфонил]амино]-1H-бензимидазол-6-ил]окси]гексановой кислоты,
изопропиловый эфир 6-[[1,2-дифенил-5-[[(4-метилфенил)сульфонил]амино]-1H-бензимидазол-6-ил]окси]гексановой кислоты,
изопропиловый эфир 6-[[1,2-дифенил-5-[[(4-метоксифенил)сульфонил]амино]-1H-бензимидазол-6-ил]окси]гексановой кислоты,
изопропиловый эфир 6-[[1,2-дифенил-5-[[[(4-трифторметил)фенил]сульфонил]амино]-1H-бензимидазол-6-ил]окси]гексановой кислоты,
изопропиловый эфир 6-[[5-[[[4-(ацетиламино)фенил]сульфонил]амино]-1,2-дифенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
изопропиловый эфир 6-[[5-[[бис(3-хлорфенил)сульфонил]амино]-1,2-дифенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
изопропиловый эфир 6-[[1,2-дифенил-5-[(пропилсульфонил)амино]-1H-бензимидазол-6-ил]окси]гексановой кислоты,
изопропиловый эфир 6-[[5-[(бензилсульфонил)амино]-1,2-дифенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 2-[2-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]этокси]уксусной кислоты,
метиловый эфир 3-[2-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]этокси]пропионовой кислоты,
этиловый эфир 6-[[1-(3-нитрофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[4-ацетил-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-(4-метилфенил)-2-фенил-1H-бензимидазол-5-ил]окси]гексановой кислоты,
метиловый эфир 6-[[2-фенил-1-[4-(тиометил)фенил]-1H-бензимидазол-5-ил]окси]гексановой кислоты,
метиловый эфир 6-[[2-фенил-1-[(4-тиометил)фенил]-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[2-фенил-1-(3-тиенил)-1H-бензимидазол-5-ил]окси]гексановой кислоты,
метиловый эфир 6-[[2-фенил-1-(3-тиенил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 4-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]масляной кислоты,
N-(фенилметокси)-6-[[2-фенил-1-(3,4,5-триметоксифенил)-1H-бензимидазол-6-ил]окси]гексанамид,
N,N-диметил-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,
N-изопропил-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,
6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]-1-пирролидин-1-илгексан-1-он,
метиловый эфир 5-[[5-[[(4-хлорфенил)сульфонил]амино]-1,2-дифенил-1H-бензимидазол-6-ил]окси]пентановой кислоты,
метиловый эфир 6-[[5-[[(4-хлорфенил)сульфонил]амино]-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[5-[[(4-хлорфенил)сульфонил]амино]-1-(4-метоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[4-(ацетилокси)-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[4-гидрокси-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
6-[[4-гидрокси-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота,
метиловый эфир 6-[[7-метил-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты.
12. Соединения из группы, включающей
метиловый эфир 6-[[2-фенил-1-(3-пиридил)-1H-бензимидазол-5-ил]окси]гексановой кислоты,
метиловый эфир 6-[[2-фенил-1-(3-пиридил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[2-фенил-1-(4-пиридил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[2-(4-фторфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[2-(4-метоксифенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[2-(4-бромфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[2-[4-(трифторметил)фенил]-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-фенил-2-(бензотиен-2-ил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,
6-[[1-фенил-2-(бензотиен-2-ил)-1H-бензимидазол-6-ил]окси]гексановая кислота,
изопропиловый эфир 6-[[5-гидрокси-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
6-[[5-гидрокси-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота,
изопропиловый эфир 6-[[5-метокси-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[5-гидрокси-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[5-метокси-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[5-[[(4-хлорфенил)сульфонил]амино]-1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[5-[[(4-хлорфенил)сульфонил]амино]-2-(4-фторфенил)-1-(4-метоксифенил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[5-[[(4-хлорфенил)сульфонил]амино]-1-(4-метоксифенил)-2-(4-метоксифенил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 4-[[5-[[(4-хлорфенил)сульфонил]амино]-1-(4-метоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]масляной кислоты,
метиловый эфир 5-[[5-[[(4-хлорфенил)сульфонил]амино]-1-(4-метоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]пентановой кислоты,
метиловый эфир 5-[[5-[[(4-хлорфенил)сульфонил]амино]-1,2-дифенил-1H-бензимидазол-6-ил]окси]пентановой кислоты,
метиловый эфир 6-[[5-[[(4-(трифторметил)фенил)сульфонил]амино]-1-(4-метоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[5-[[(4-хлорфенил)сульфонил]метиламино]-1-(4-метоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-(индан-5-ил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
6-[[1-(индан-5-ил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота,
метиловый эфир 6-[[1-(3-фторфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[2-(4-нитрофенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-фенил-2-(3-пиридинил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,
N-(циклопропилметокси)-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,
N-изобутокси-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,
N-(циклопропилметокси)-6-[2-фенил-1-(3,4,5-триметоксифенил-1H-бензимидазол-6-ил)окси]гексанамид,
N-изобутокси-6-[2-фенил-1-(3,4,5-триметоксифенил-1H-бензимидазол-6-ил)окси]гексанамид,
N-(2-метоксиэтил)-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,
N-(3-метоксипропил)-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,
N-изобутил-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,
6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]-1-морфолин-1-илгексан-1-он,
N,N-ди(2-метоксиэтил)-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,
N-изопентил-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,
N-(пиридин-2-ил)-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,
N-(пиридин-3-ил)-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,
N-изопропил-6-[[1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексанамид,
N,N-диметил-6-[[1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексанамид,
N,N-диэтил-6-[[1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексанамид,
N-изобутил-6-[[1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексанамид,
N-циклопропил-6-[[1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексанамид,
N-циклобутил-6-[[1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексанамид,
N-трет-бутил-6-[[1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексанамид,
(R)-6-[[1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]-1-(2-метоксиметил)пирролидин-1-илгексан-1-он,
N-(3-имидазол-1-ил-пропил)-6-[[1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексанамид,
N-(2-пиридин-2-илэтил)-6-[[1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексанамид,
N-(3-метоксипропил)-6-[[1-(индан-5-ил)-2-фенил-1H-бензимидазол-6-ил] окси]гептанамид,
метиловый эфир 6-[[1-(4-метилфенил)-2-(3-пиридил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфшЁ 6-[[1-(4-метилфенил)-2-(4-пиридил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-(4-метилфенил)-2-(2-тиенил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-(4-метилфенил)-2-(3-тиенил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[2-(3-индолил)-1-(4-метилфенил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-(4-метилфенил)-2-(2-фурил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-(4-метилфенил)-2-(3-фурил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-(4-метилфенил)-2-(5-метил-2-тиенил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,
метиловый эфир 6-[[1-(4-метилфенил)-2-(3-метил-2-тиенил)-1H-бензимидазол-6-ил]окси]гексановой кислоты.
13. Применение соединения по любому из пп.1-12 для получения лекарственного средства, предназначенного для лечения или предупреждения заболеваний, связанных с активацией микроглии.
14. Фармацевтическое средство, отличающееся тем, что оно содержит одно или несколько соединений по любому из пп.1-12 и один или несколько носителей.
15. Применение бензимидазола общей формулы II
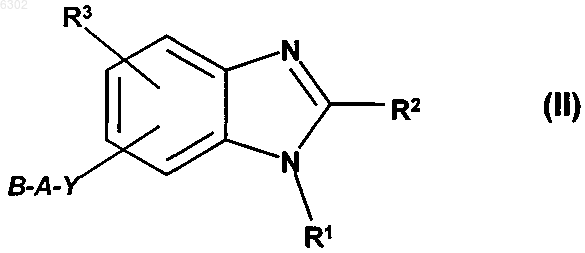
в которой R1 означает моно- либо бициклическую C6-12арильную группу или моно- либо бициклическую 5-10-членную гетероарильную группу с 1-4 гетероатомами, выбранными из группы, включающей N, S и O, при этом указанная арильная или гетероарильная группа может независимо содержать до трех заместителей, независимо друг от друга выбранных из F, Cl, Br, I, C(NH)NH2, C(NH)NHR4, C(NH)NR4R4', C(NR4)NH2, C(NR4)NHR4', C(NR4)NR4R4', XOH, XOR4, XOCOR4, XOCONHR4, XOCOOR4, XCOR4, XC(NOH)R4, XC(NOR4)R4', XC(NO(COR4))R4', XCN, XCOOH, XCOOR4, XCONH2, XCONR4R4', XCONHR4, XCONHOH, XCONHOR4, XCOSR4, XSR4, XSOR4, XSO2R4, SO2NH2, SO2NHR4, SO2NR4R4', NO2, XNH2, XNHR4, XNR4R4', XNHSO2R4, XN(SO2R4)(SO2R4'), XNR4SO2R4', XNHCOR4, XNHCOOR4, XNHCONHR4, тетрагидро-2,5-диоксопиррол-1-ила, 2,5-дигидро-2,5-диоксопиррол-1-ила, 2,7-дигидро-2,7-диоксоизоиндол-1-ила и R4, причем два заместителя у R1, если они находятся в орто-положении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2-диилбисоксигруппу, пропан-1,3-диил или бутан-1,4-диил,
R2 означает моно- либо бициклическую C6-10арильную группу или моно- либо бициклическую 5-10-членную гетероарильную группу с 1-4 гетероатомами, выбранными из группы, включающей N, S и O, при этом указанная арильная или гетероарильная группа может содержать до трех заместителей, независимо друг от друга выбранных из F, Cl, Br, I, C(NH)NH2, C(NH)NHR4, C(NH)NR4R4', C(NR4)NH2, C(NR4)NHR4', C(NR4)NR4R4', XOH, XOR4, XOCOR4, XOCONHR4, XOCOOR4, XCOR4, XC(NOH)R4, XC(NOR4)R4', XC(NO(COR4))R4', XCN, XCOOH, XCOOR4, XCONH2, XCONR4R4', XCONHR4, XCONHOH, XCONHOR4, XCOSR4, XSR4, XSOR4, XSO2R4, SO2NH2, SO2NHR4, SO2NR4R4', NO2, XNH2, XNHR4, XNR4R4', XNHSO2R4, XN(SO2R4)(SO2R4'), XNR4SO2R4', XNHCOR4, XNHCOOR4, XNHCONHR4, тетрагидро-2,5-диоксопиррол-1-ила, 2,5-дигидро-2,5-диоксопиррол-1-ила, 2,7-дигидро-2,7-диоксоизоиндол-1-ила и R4, причем два заместителя у R2, если они находятся в орто-положении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2-диилбисоксигруппу, пропан-1,3-диил или бутан-1,4-диил,
R3 означает один или два заместителя, которыми независимо друг от друга могут являться водород, F, Cl, Br, I, XOH, XOR4, XOCOR4, XOCONHR4, XOCOOR4, XCOR4, XC(NOH)R4, XC(NOR4)R4', XC(NO(COR4))R4', XCN, XCOOH, XCOOR4, XCONH2, XCONHR4, XCONR4R4', XCONHOH, XCONHOR4, XCOSR4, XSR4, XSOR4, XSO2R4, SO2NH2, SO2NHR4, SO2NR4R4', NO2, XNH2, XNHR4, XNR4R4', XNHSO2R4, XNR4SO2R4', XN(SO2R4)(SO2R4'), XNHCOR4, XNHCOOR4, XNHCONHR4, тетрагидро-2,5-диоксопиррол-1-ил, 2,5-дигидро-2,5-диоксопиррол-1-ил, 2,7-дигидро-2,7-диоксоизоиндол-1-ил и R4, при этом два заместителя R3, если они находятся в орто-положении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2-диилбисоксигруппу, пропан-1,3-диил или бутан- 1,4-диил,
R4 и R4' независимо друг от друга означают C1-4перфторалкил, C1-6алкил, C2-6алкенил, C2-6алкинил, C3-7циклоалкил, (C1-3алкил-C3-7циклоалкил), C1-3алкил-C6-10арил, C1-3алкил-(5-10-членный гетероарил с 1-4 N-, S- или O-атомами), C6-10арил или 5-10-членный гетероарил с 1-4 N-, S- или O-атомами, при этом C6-10арильные и гетероарильные группы могут быть замещены одним или двумя заместителями из группы, включающей F, Cl, Br, CH3, C2H5, NO2, OCH3, OC2H5, CF3, C2F5, или могут также нести аннелированную метандиилбисокси- или этан-1,2-диилбисоксигруппу, в 5-членном циклоалкильном кольце одним из его членов может являться N или O, а в 6- или 7-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или O, при этом атомы азота кольца необязательно могут быть замещены C1-3алкилом или C1-3алканоилом,
R5 и R5' независимо друг от друга означают водород, C1-6алкил, C2-6алкенил, C2-6алкинил, при этом атом углерода может быть заменен на O, S, SO, SO2, NH, N-C1-3алкил или N-C1-3алканоил, или означают C3-7циклоалкил-C0-3алкил, при этом в 5-членном циклоалкильном кольце одним его членом может являться N или O, а в 6- или 7-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или O, причем атомы азота кольца необязательно могут быть замещены C1-3алкилом или C1-3алканоилом, C6-10арил или 5-10-членный гетероарил с 1-4 гетероатомами из группы, включающей N, S и O, при этом указанные алкильные, алкенильные и алкинильные цепи могут быть замещены одной из вышеуказанных циклоалкильных, арильных или гетероарильных групп и, кроме того, все вышеуказанные алкильные и циклоалкильэых остатки могут содержать до двух таких заместителей, как CF3, C2F5, OH, O-C1-3алкил, NH2, NH-C1-3алкил, NH-C1-3алканоил, N(C1-3алкил)2, N(C1-3алкил)(C1-3алканоил), COOH, CONH2, COOC1-3алкил, а все вышеуказанные арильные и гетероарильные группы могут быть замещены одним или двумя заместителями из группы, включающей F, Cl, Br, CH3, C2H5, NO2, OCH3, OC2H5, CF3, C2F5, или могут также нести аннелированную метандиилбисокси-, этан-1,2-диилбисоксигруппу, или
R5 и R5' вместе с атомом азота образуют 5-7-членный гетероцикл, который может содержать еще один атом кислорода, азота или серы и может быть замещен C1-4алкилом, C1-4алкокси-C0-2алкилом, C1-4алкоксикарбонилом, аминокарбонилом или фенилом,
A означает C1-10алкандиил, C2-10алкендиил, C2-10алкиндиил, (C0-5алкандиил-C3-7циклоалкандиил-C0-5алкандиил), (C0-5алкандииларилен-C0-5алкандиил) или (C0-5алкандиилгетероарилен-C0-5алкандиил), при этом арильные и гетероарильные группы могут быть замещены одним или двумя заместителями из группы, включающей F, Cl, Br, CH3, C2H5, NO2, OCH3, OC2H5, CF3, C2F5, в 5-членном циклоалкильном кольце одним его членом может являться N или O, а в 6- или 7-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или O, причем атомы азота кольца необязательно могут быть замещены C1-3алкилом или C1-3алканоилом, в указанных алифатических цепях один или два атома углерода могут быть заменены на O, NH, NR4, NCOR4, NSO2R4 и, кроме того, алкильные или циклоалкильные группы могут содержать до двух таких заместителей, как F, OH, OR4, OCOR4, =O, NH2, NR4R4', NHCOR4, NHCOOR4, NHCONHR4, NHSO2R4, SH, SR4,
B означает водород, OH, OCOR5, OCONHR5, OCOOR5, COR5, C(NOH)R5, C(NOR5)R5', C(NO(COR5))R5', COOH, COOR5, CONH2, CONHNH2, CONHR5, CONR5R5', CONHOH, CONHOR5, SO3H, SO2NH2, SO2NHR5, SO2NR5R5', PO3H, PO(OH)(OR5), PO(OR5)(OR5'), PO(OH)(NHR5), PO(NHR5)(NHR5') или тетразолил, при этом каждый из указанных остатков связан с атомом углерода группы A,
или вся группа Y-A-B представляет собой N(SO2R4 XSO2R4') или NHSO2R4 ,
X означает связь, CH2, (CH2)2, CH(CH3), (CH2)3, CH(CH2CH3), CH(CH3)CH2 или CH2CH(CH3) и
Y означает связь, O, S, SO, SO2, NH, NR4, NCOR4 или NSO2R4,
для получения лекарственного средства, предназначенного для лечения или предупреждения заболеваний, связанных с активацией микроглии.
16. Применение по п.15, при котором в общей формуле II R1 означает моно- либо бициклическую арильную группу или моно- либо бициклическую 5-10-членную гетероарильную группу с 1-2 гетероатомами, выбранными из группы, включающей N, S и O, при этом указанная арильная или гетероарильная группа может независимо содержать до трех заместителей, независимо друг от друга выбранных из F, Cl, Br, XOH, XOR4, XOCOR4, XOCONHR4, XOCOOR4, XCOR4, XCN, XCOOH, XCOOR4, XCONH2, XCONR4R4', XCONHR4, XCONHOH, XCONHOR4, XCOSR4, XSR4, NO2, XNHR4, XNR4R4' и R4, причем два заместителя у R1, если они находятся в орто-положении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2-диилбисоксигруппу, пропан-1,3-диил или бутан-1,4-диил.
17. Применение по п.15 или 16, при котором в общей формуле II R2 означает моно- либо бициклическую арильную группу или моно- либо бициклическую 5-10-членную гетероарильную группу с 1-2 гетероатомами, выбранными из группы, включающей N, S и O, при этом указанная арильная или гетероарильная группа может независимо содержать до трех заместителей, независимо друг от друга выбранных из F, Cl, Br, XOH, XOR4 , XOCOR4 , XOCONHR4, XOCOOR4, XCOR4, C(NOH)R4, XC(NOR4)R4', XC(NO(COR4))R4', XCN, XCOOH, XCOOR4, XCONH2, XCONR4R4', XCONHR4, XCONHOH, XCONHOR4, XCOSR4, XSR4, XSOR4, XSO2R4, SO2NH2, SO2NHR4, SO2NR4R4', NO2, XNH2, XNHR4, XNR4R4', XNHSO2R4, XN(SO2R4)(SO2R4'), XNR4SO2R4', XNHCOR4, XNHCOOR4, XNHCONHR4 и R4, причем два заместителя у R2, если они находятся в орто-положении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2-диилбисоксигруппу, пропан-1,3-диил или бутан-1,4-диил.
18. Применение по любому из пп.15-17, при котором в общей формуле II R3 означает один или два заместителя, которыми независимо друг от друга могут являться водород, F, Cl, Br, XOH, XOR4, XOCOR4, XOCONHR4, XOCOOR4, XCOR4, XC(NOH)R4, XC(NOR4)R4', XC(NO(COR4))R4', XCN, XSR4, XSOR4, XSO2R4, SO2NH2, SO2NHR4, SO2NR4R4', NO2, XNH2, XNHR4, XNR4R4', XNHSO2R4, XNR4SO2R4', XN(SO2R4)(SO2R4'), XNHCOR4, XNHCOOR4, XNHCONHR4 или R4 , при этом два заместителя R3, если они находятся в орто-положении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2-диилбисоксигруппу, пропан-1,3-диил или бутан-1,4-диил.
19. Применение по любому из пп.15-18, при котором в общей формуле II R4 и R4' независимо друг от друга означают CF3, C2F5, C1-4алкил, C2-4алкенил, C2-4алкинил, C3-6циклоалкил, (C1-3алкил-C3-6циклоалкил), C1-3алкиларил, C1-3алкилгетероарил, моноциклический арил или 5-6-членный гетероарил с 1-2 N-, S- или O-атомами, при этом арильные и гетероарильные группы могут быть замещены одним или двумя заместителями из группы, включающей F, Cl, Br, CH3, C2H5, NO2, OCH3, OC2H5, CF3, C2F5, или могут также нести аннелированную метандиилбисокси- или этан-1,2-диилбисоксигруппу и, кроме того, в 5-членэюь циклоалкильном кольце одним его членом может являться N или O, а в 6-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или O, причем атомы азота кольца необязательно могут быть замещены C1-3алкилом или C1-3алканоилом.
20. Применение по любому из пп.15-19, при котором в общей формуле II R5 и R5' независимо друг от друга означают C1-6алкил, при этом один атом углерода может быть заменен на O, NH, N-C1-3алкил, N-C1-3алканоил, или означают C3-7циклоалкил-C0-3алкил, при этом в 5-членном циклоалкильном кольце одним его членом может являться N или O, а в 6- или 7-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или O, причем атомы азота кольца необязательно могут быть замещены C1-3алкилом или C1-3алканоилом, указанный C1-6алкильный фрагмент может быть замещен одной из вышеуказанных циклоалкильных групп или же 5-6-членной гетероароматической группой с 1-2 гетероатомами, выбранными из группы, включающей N, S и O, и, кроме того, все вышеуказанные алкильные и циклоалкильные фрагменты могут содержать до двух таких заместителей, как CF3, OH, O-C1-3алкил, а вышеуказанные гетероарильные группы могут быть замещены одним или двумя заместителями из группы, включающей F, Cl, CF3, CH3, C2H5, OCH3, OC2H5, или R5 и R5' вместе с атомом азота образуют 5-7-членный гетероцикл, который может содержать еще один атом кислорода, азота или серы и может быть замещен C1-4алкилом, C1-4алкокси-C0-2алкилом, C1-4алкоксикарбонилом, аминокарбонилом или фенилом.
21. Применение по любому из пп.15-20, при котором в общей формуле II A означает C1-10алкандиил, C2-10алкендиил, C2-10алкиндиил, (C0-5алкандиил-C3-7циклоалкандиил-C0-5алкандиил) или (C0-5алкандиилгетероарилен-C0-5алкандиил), при этом присутствующая при определенных условиях гетероарильная группа может быть замещена одним или двумя заместителями из группы, включающей F, Cl, Br, CH3, C2H5, NO2, OCH3, OC2H5, CF3, C2F5, и, кроме того, в 5-членном циклоалкильном кольце одним его членом может являться N или O, а в 6- или 7-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или O, причем атомы азота кольца необязательно могут быть замещены C1-3алкилом или C1-3алканоилом, в алифатической цепи один или два атома углерода могут быть заменены на O, NH, N-C1-3алкил, N-C1-3алканоил, NSO2-C1-3алкил и алкильные или циклоалкильные фрагменты могут содержать в качестве заместителей до двух атомов F или могут быть замещены одним из таких заместителей, как OH, O-C1-3алкил, O-C1-3алканоил, =O, NH2, NH-C1-3алкил, N(C1-3алкил)2, NH-C1-3алканоил, N(C1-3алкил)(C1-3алканоил), NHCOO-C1-3алкил, NHCONH-C1-3алкил, NHSO2-C1-3алкил, SH, S-C1-3алкил.
22. Применение по любому из пп.15-21, при котором в общей формуле II B означает водород, OH, OCOR5, OCONHR5, OCOOR5, COOH, COOR5, CONH2, CONHR5, CONR5R5, CONHOH, CONHOR5 или тетразолил, при этом каждый из указанных остатков связан с атомом углерода группы A.
23. Применение по любому из пп.15-22, при котором в общей формуле II X означает связь или CH2.
24. Применение по любому из пп.15-23, при котором в общей формуле II Y означает связь, O, S, NH, NR4, NCOR4 или NSO2R4.
Текст
006302 Настоящее изобретение относится к новым бензимидазольным производным и к применению таких бензимидазольных производных для получения лекарственных средств, предназначенных для лечения и профилактики заболеваний, связанных с активацией микроглии. Практически все дегенеративные заболевания центральной нервной системы связаны с хроническим воспалением. Ключевой фазой воспалительного процесса является активация одноядерных фагоцитов - глиальных макрофагов - или микроглии. Подобная активация обусловлена, например, при болезни Альцгеймера старческими бляшками, при болезни Крейтцфельда-Якоба - прион-протеином, а при ишемической апоплексии - отмершими клетками. Глиальные макрофаги в течение длительного периода времени могут оставаться в активированном состоянии, в котором они продуцируют и секретируют различные воспалительные факторы, например реакционноспособные кислород-/азотсодержащие промежуточные продукты, протеазы, цитокины, факторы комплемента и нейротоксины. Такие факторы в свою очередь приводят к дисфункции и перерождению нервных клеток. Один из возможных описанных в литературе подходов по терапии воспалительных заболеваний нервной системы состоит в настоящее время в применении нестероидных подавляющих воспалительный процесс ингибиторов (ингибиторов СОХ II) (McGeer P.L., Roger, Neurology 42, 447-449 (1992); Rogers J.,Kirby L.C., Hempleman S.R., Berry D.L., McGeer P.L., Kaszniak A.W., Zalinski J., Cofield M, Mansukhani L.,Wilson P., Kogan F., Neurology 43, 1609-1611 (1993); Andersen K., Launer L.J., Ott A., Hoes A.W., BretelerG.Z, J. Cerebral Blood Flow and Metabolism 19, 819-834 (1999 и ингибиторов пути активации комплемента (Chen. S., Frederickson R.C.A. и Brunden K.R., Neurobiol. Aging (1996); McGeer E.G., McGeer P.L., Drugs 55: 739-746 (1998. Подобные соединения ингибируют синтез или действие отдельных воспалительных факторов. Однако представляется более целесообразным получить соединения, которые позволяли бы ингибировать воспалительный процесс на более ранней стадии и тем самым препятствовали бы образованию многих воспалительных факторов или проявлению ими их действия. Указанную проблему позволяют решить предлагаемые в изобретении бензимидазольные производные общей формулы I, их таутомерные или изомерные формы или солиR1 означает моно- либо бициклическую С 6-12 арильную группу или моно- либо бициклическую 5-10 членную гетероарильную группу с 1-4 гетероатомами, выбранными из группы, включающей N, S и О,при этом указанная арильная или гетероарильная группа может содержать до трех заместителей, независимо друг от друга выбранных из F, Cl, Вr, I, C(NH)NH2, C(NH)NHR4, C(NH)NR4R4', C(NR4)NH2,C(NR4)NHR4', C(NR4)NR4R4', XOH, XOR4, XOCOR4, XOCONHR4, XOCOOR4, XCOR4, XC(NOH)R4,XC(NOR4)R4', XC(NO(COR4R4', XCN, XCOOH, XCOOR4, XCONH2, XCONR4R4', XCONHR4,XCONHOH, XCONHOR4, XCOSR4, XSR4, XSOR4, XSO2R4, SO2NH2, SO2NHR4, SO2NR4R4', NO2, XNH2,XNHR4, XNR4R4', XNHSO2R4, XN(SO2R4)SO2R4', XNR4SO2R4', XNHCOR4, XNHCOOR4, XNHCONHR4,тетрагидро-2,5-диоксопиррол-1-ила, 2,5-дигидро-2,5-диоксопиррол-1-ила, 2,7-дигидро-2,7-диоксоизоиндол-1-ила иR4 , причем два заместителя у R1, если они находятся в орто-положении друг относительно друга,могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2-диилбисоксигруппу, пропан-1,3-диил или бутан-1,4-диил,R2 означает моно- либо бициклическую С 6-10 арильную группу или моно- либо бициклическую 5-10 членную гетероарильную группу с 1-4 гетероатомами, выбранными из группы, включающей N, S и О,при этом указанная арильная или гетероарильная группа может содержать до трех заместителей, независимо друг от друга выбранных из F, Cl, Br, I, XOH, XOR4, XOCOR4, XOCONHR4, XOCOOR4, XCOR4,XC(NOH)R4, XC(NOR4)R4', XC(NO(COR4R4', XCOOH, XCOOR4, XCONH2, XCONHR4, XCONR4R4',XCONHOH, XCONHOR4, XCOSR4, XSR4, XSOR4, XSO2R4, SO2NH2, SO2NHR4, SO2NR4R4', NO2,XNHSO2R4, XN(SO2R4)SO2R4', XNR4SO2R4', тетрагидро-2,5-диоксопиррол-1-ила, 2,5-дигидро-2,5 диоксопиррол-1-ила, 2,7-дигидро-2,7-диоксоизоиндол-1-ила и R4, причем два заместителя у R2, если они находятся в орто-положении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2-диилбисоксигруппу, пропан-1,3 диил или бутан- 1,4-диил,R3 означает один или два заместителя, которыми независимо друг от друга могут являться водород,F, Cl, Вr, I, ХОН, XOR4, XOCOR4, XOCONHR4, XOCOOR4, XCOR4, XC(NOH)R4, XC(NOR4)R4',-1 006302XC(NO(COR4R4', XCN, XCOOH, XCOOR4, XCONH2, XCONHR4, XCONR4R4', XCONHOH, XCONHOR4,XCOSR4, XSR4, XSOR4, XSO2R4, SO2NH2, SO2NHR4, SO2NR4R4', NO2, XNH2, XNHR4, XNR4R4',XNHSO2R4, XNR4SO2R4', XN(SO2R4)(SO2R4), XNHCOR4, XNHCOOR4, XNHCONHR4, тетрагидро-2,5 диоксопиррол-1-ил, 2,5-дигидро-2,5-диоксопиррол-1-ил, 2,7-дигидро-2,7-диоксоизоиндол-1-ил и R4, при этом два заместителя R3, если они находятся в opтo-положении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2 диилбисоксигруппу, пропан-1,3-диил или бутан-1,4-диил,R4 и R4' независимо друг от друга означают С 1-4 перфторалкил, С 1-6 алкил, С 2-6 алкенил, С 2-6 алкинил,С 3-7 циклоалкил, (С 1-3 алкил-С 3-7 циклоалкил), С 1-3 алкил-С 6-10 арил, С 1-3 алкил-(5-10-членный гетероарил с 14 N-, S- или О-атомами), С 6-10 арил или 5-10-членный гетероарил с 1-4 N-, S- или О-атомами, при этом арильные и гетероарильные группы могут быть замещены одним или двумя заместителями из группы,включающей F, Cl, Вr, СН 3, С 2 Н 5, NO2, OCH3, ОС 2 Н 5, CF3, C2F5, или могут также нести аннелированную метандиилбисокси- или этан-1,2-диилбисоксигруппу и, кроме того, в 5-членном циклоалкильном кольце одним его членом может являться N или О, а в 6- или 7-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или О, причем атомы азота кольца необязательно могут быть замещены С 1-3 алкилом или С 1-3 алканоилом,R5 и R5' независимо друг от друга означают С 1-6 алкил, С 2-6 алкенил, С 2-6 алкинил, при этом один атом углерода может быть заменен на О, S, SO, SO2, NH, N-С 1-3 алкил или N-С 1-3 алканоил, или означают С 3-7 циклоалкил-С 0-3 алкил, при этом в 5-членном циклоалкильном кольце одним его членом может являться N или О, а в 6- или 7-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или О, причем атомы азота кольца необязательно могут быть замещены С 1-3 алкилом или С 13 алканоилом, С 6-10 арил или 5-10-членный гетероарил с 1-4 гетероатомами из группы, включающей N, S и О, причем указанные алкильные, алкенильные и алкинильные цепи могут быть замещены одной из вышеуказанных циклоалкильных, арильных или гетероарильных групп и, кроме того, все вышеуказанные алкильные и циклоалкильные остатки могут содержать до двух таких заместителей, как CF3, C2F5, ОН, ОС 1-3 алкил, NH2, NН-С 1-3 алкил, NН-С 1-3 алканоил, N(С 1-3 алкил)2, N(С 1-3 алкил)(С 1-3 алканоил), СООН,CONH2 и СОО-С 1-3 алкил, а все вышеуказанные арильные и гетероарильные группы могут быть замещены одним или двумя заместителями из группы, включающей F, Cl, Вr, CH3, C2H5, NO2, ОСН 3, OC2H5,CF3, C2F5, или могут также нести аннелированную метандиилбисоксигруппу, этан-1,2-диилбисоксигруппу, илиR5 и R5' вместе с атомом азота образуют 5-7-членный гетероцикл, который может содержать еще один атом кислорода, азота или серы и который может быть замещен С 1-4 алкилом, С 1-4 алкокси-С 0-2 алкилом, С 1-4 алкоксикарбонилом, аминокарбонилом или фенилом,А означает С 1-10 алкандиил, С 2-10 алкендиил, С 2-10 алкиндиил, (С 0-5 алкандиил-С 3-7 циклоалкандиил-С 0 алкандиил), при этом в 5-членном циклоалкильном кольце одним его членом может являться N или О, а 5 в 6- или 7-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или О,причем атомы азота кольца необязательно могут быть замещены С 1-3 алкилом или С 1-3 алканоилом и, кроме того, в вышеуказанных алифатических цепях один или два атома углерода могут быть заменены на О,NH, N-C1-3 алкил, N-С 1-3 алканоил, а алкильные или циклоалкильные группы могут содержать до двух таких заместителей, как =O, ОН, О-С 1-3 алкил, NH2, NH-С 1-3 алкил, NH-C1-3 алканоил, N(С 1-3 алкил)2 и N(С 13 алкил)(С 1-3 алканоил),В означает СООН, COOR5, CONH2, CONHNH2, CONHR5, CONR5R5', CONHOH, CONHOR5, SO3H,SO2NH2, SO2NHR5, SO2NR5R5', PO3H, PO(OH)(OR5), PO(OR5)(OR5'), PO(OH)(NHR5), PO(NHR5)(NHR5') или тетразолил, при этом каждый из указанных остатков связан с атомом углерода группы А, или вся группа Y-A-B представляет собой N(SO2R4)(SO2R4') или NHSO2R4,X означает связь, СН 2, (СН 2)2, СН(CH3), (СН 2)3, СН(СН 2 СН 3), СН(CH3)СН 2 или СН 2 СН(CH3) иY означает О, NH, NR4, NCOR4 или NSO2R4, при условии, что если Y представляет собой NH, NR4,NCOR4 или NSO2R4 и а) заместитель R2 содержит азотсодержащий насыщенный гетероцикл, то такой гетероцикл не замещен у иминового азота атомом Н, метилом, этилом, пропилом или изопропилом, или б) в необязательно присутствующих группах XNHR4 или XNR4R4' заместителя R2 заместители R4 и/или R4' не означают С 1-4 алкил, а также при условии, что одновременно В не означает СООН, SO3H,РО 3 Н 2 или тетразолил и R1 и R2 независимо друг от друга не означают С 5-6 гетероарил или фенил, когда они независимо друг от друга не замещены, однозамещены С 1-6 алкилом, С 1-4 перфторалкилом, О-С 1-6 алкилом, О-С 1-4 перфторалкилом, группой СООН, СОО-С 1-6 алкилом, CO-С 1-6 алкилом, группой CONH2,группой CONHR4, группой NO2, группой NH2, группой NHCOR4, группой NHSO2R4 или замещены 1 или 2 атомами галогена из группы, включающей F, Cl, Br, J, и за исключением следующих соединений: метиловый эфир [(1,2-дифенил-1H-бензимидазол-6-ил)окси]уксусной кислоты,метиловый эфир 5-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]пентановой кислоты,этиловый эфир 4-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]масляной кислоты,метиловый эфир 5-1-(4-нитрофенил)-2-фенил-1H-бензимидазол-6-ил]окси]пентановой кислоты,метиловый эфир 6-1-(4-нитрофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,-2 006302 метиловый эфир 5-1-(4-аминофенил)-2-фенил-1H-бензимидазол-6-ил]окси]пентановой кислоты,метиловый эфир 5-1-[4-(4-хлорфенил)сульфонил]амино]фенил]-2-фенил-1H-бензимидазол-6-ил] окси]пентановой кислоты,метиловый эфир 5-1-[4-[(ацетил)амино]фенил]-2-фенил-1H-бензимидазол-6-ил]окси]пентановой кислоты,метиловый эфир 5-1-(3-нитрофенил)-2-фенил-1H-бензимидазол-6-ил]окси]пентановой кислоты,метиловый эфир 6-1-(3-нитрофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 5-1-(3-аминофенил)-2-фенил-1H-бензимидазол-6-ил]окси]пентановой кислоты,метиловый эфир 5-1-[3-(4-хлорфенил)сульфонил]амино]фенил]-2-фенил-1H-бензимидазол-6-ил] окси]пентановой кислоты,метиловый эфир 5-1-[3-[(ацетил)амино]фенил]-2-фенил-1H-бензимидазол-6-ил]окси]пентановой кислоты. Для образования физиологически приемлемых солей пригодны неорганические и органические кислоты, такие, например, как щавелевая кислота, молочная кислота, лимонная кислота, фумаровая кислота, уксусная кислота, малеиновая кислота, винная кислота, фосфорная кислота, НСl, НВr, серная кислота,n-толуолсульфоновая кислота, метансульфоновая кислота. Для образования солей пригодны также неорганические или органические основания, которые известны по их применению для образования физиологически приемлемых солей, такие как гидроксиды щелочных металлов, например гидроксид натрия или калия, гидроксиды щелочноземельных металлов, например гидроксид кальция, аммиак, а также амины,например этаноламин, диэтаноламин, триэтаноламин, N-метилглюкамин, трис-(гидроксиметил)метиламин. Под "арильной группой" понимается прежде всего необязательно замещенная фенильная группа либо дифенил, нафтил, индан или флуоренил. Гетероарильная группа состоит из 5-10 скелетных атомов и может содержать 1-4 гетероатома. Такими гетероатомами являются кислород (О), азот (N) и сера (S). В качестве примеров моноциклической гетероарильной группы можно назвать пирролил, тиенил, фуранил, имидазолил, тиазолил, изотиазолил,оксазолил, изоксазолил, пиразолил, фуразанил, пиридил, пиримидинил, пиразинил и пиридазинил. Примерами бициклической гетероарильной группы являются тиеноимидазолил, индолил, изоиндолил, бензотиофенил, бензофуранил, бензимидазолил, индазолил, имидазопиридинил, пуринил, хинолил, изохинолил, фталазинил, хиназолинил, хиноксалинил, циннолинил, нафтиридинил и птеридинил. Когда арильные или гетероарильные группы образуют часть R1, связь с атомом N бензимидазола осуществляется через атом углерода. Алкильные группы могут иметь прямую или разветвленную цепь. В качестве примера таких групп можно назвать метил, этил, пропил, изопропил, н-бутил, втop-бутил, трет-бутил, н-пентил, втор-пентил,трет-пентил, неопентил, н-гексил, втор-гексил, гептил, октил, нонил и гексил. Перфторированными алкилами являются предпочтительно CF3 и C2F5, a алканоилами - предпочтительно формил, ацетил, пропионил. Алкенильные группы могут иметь прямую или разветвленную цепь. В качестве примера таких групп можно назвать следующие остатки: винил, 2-пропенил, 1-пропенил, 2-бутенил, 1-бутенил, 1 метил-1-пропенил, 2-метил-2-пропенил, 3-метил-2-пропенил. Алкинильные группы могут иметь прямую или разветвленную цепь. В качестве примера таких групп можно назвать этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил. Под циклоалкильными группами в каждом случае понимаются циклопропил, циклобутил, циклопентил, циклогексил или циклогептил. В качестве примеров насыщенного гетероцикла, соответственно в качестве примеров циклоалкила с одним или несколькими гетероатомами следует назвать пиперидин, пирролидин, тетрагидрофуран, морфолин, пиперазин, гексагидроазепин, а также 2,6-диметилморфолин, N-фенилпиперазин, метоксиметилпирролидин, при этом связь со смежным с кольцом атомом углерода может осуществляться через присутствующие при определенных условиях атомы азота кольца. Примерами алканов, алкенов и алкинов в качестве значений радикала А являются алкилы с прямой или разветвленной цепью, содержащие 1-8 С-атомов, такие как метилен, этилен, пропилен, бутилен, пентилен и т.д., 1-метилэтилен, 1-этилэтилен, 1-метилпропилен, 2-метилпропилен, 1-метилбутилен, 2 метилбутилен, 1-этилбутилен, 2-этилбутилен, 1-метилпентилен, 2-метилпентилен, 3-метилпентилен и т.д. Алкениленами и алкиниленами с прямой или разветвленной цепью, содержащими 2-8 С-атомов,являются алкениленовые, соответственно алкиниленовые группы с двойными и тройными связями во всех возможных положениях, а также со всеми возможными метильными или этильными замещениями. В каждом из таких остатков один или два С-атома могут быть заменены на О, NH, NС 1-3 алкил или N-C1-3 алканоил, при этом замененная группа отделена от Y по меньшей мере двумя С-атомами. Когда два остатка находятся в орто-положении, они могут образовывать со смежными ароматическими группами общее кольцо. При этом из объема изобретения исключены соединения, в которых либоN-, О- или S-атомы связаны с этиленовыми или ацетиленовыми кратными связями, либо несколько N-,-3 006302 О-, S-атомов или атомов галогена связаны с одним и тем же алифатическим атомом углерода, либо N-,О- или S-атомы непосредственно связаны друг с другом, если такие связи не указаны в явном виде, например в указанных в формуле изобретения функциональных группах или в гетероароматических группах. Предпочтительны бензимидазолы, в которых R1 означает моно- либо бициклическую С 6-12 арильную группу или моно- либо бициклическую 5-10-членную гетероарильную группу с 1-2 гетероатомами, выбранными из группы, включающей N, S и О, при этом указанная арильная или гетероарильная группа может содержать до трех заместителей, независимо друг от друга выбранных из F, С 1, Вr, ХОН, XOR4,XOCOR4, XOCONHR4, XOCOOR4, XCOR4, XCN, ХСООН, XCOOR4, XCONH2, XCONR4R4', XCONHR4,XCONHOH, XCONHOR4, XCOSR4, XSR4, NO2, XNHR4, XNR4R4' и R4, причем два заместителя у R1, если они находятся в opтo-положении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2-диилбисоксигруппу, пропан 1,3-диил или бутан-1,4-диил. Предпочтительны также бензимидазолы, в которых R2 означает моно- либо бициклическую С 6-10 арильную группу или моно- либо бициклическую 5-10-членную гетероарильную группу с 1-2 гетероатомами, выбранными из группы, включающей N, S и О, при этом указанная арильная или гетероарильная группа может содержать до трех заместителей, независимо друг от друга выбранных из F, Cl, Вr, ХОН,XOR4, XOCOR4, XOCONHR4, XOCOOR4, XCOR4, XC(NOH)R4, XC(NOR4)R4', XC(NO(COR4R4',XCOOH, XCOOR4, XCONH2, XCONHR4, XCONR4R4', XCONHOH, XCONHOR4, XCOSR4, XSR4, XSOR4,XSO2R4, SO2NH2, SO2NHR4, SO2NR4R4', NO2, XNHSO2R4, XN(SO2R4)SO2R4', XNR4SO2R4' и R4, причем два заместителя у R2, если они находятся в орто-положении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2 диилбисоксигруппу, пропан-1,3-диил или бутан-1,4-диил. Равным образом предпочтительны бензимидазолы общей формулы I, в которых R означает один или два заместителя, которыми независимо друг от друга могут являться водород, F, Cl, Вr, ХОН, XOR4,XOCOR4, XOCONHR4, XOCOOR4, XCOR4, XC(NOH)R4, XC(NOR4)R4', XC(NO(COR4R4', XCN, XSR4,XSOR4, XSO2R4, SO2NH2, SO2NHR4, SO2NR4R4', NO2, XNH2, XNHR4, XNR4N4', XNHSO2R4, XNR4SO2R4',XN(SO2R4)SO2R4', XNHCOR4, XNHCOOR4, XNHCONHR4 и R4, при этом два заместителя R3, если они находятся в орто-положении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2-диилбисоксигруппу, пропан-1,3 диил или бутан-1,4-диил. Предпочтительны также бензимидазолы общей формулы I, в которых R и R4' независимо друг от друга означают CF3, C2F5, С 1-4 алкил, С 2-4 алкенил, С 2-4 алкинил, С 3-6 циклоалкил, (С 1-3 алкил-С 3-6 циклоалкил), фенил или 5-6-членный гетероарил с 1-2 N-, S- или О-атомами, при этом фенильные и гетероарильные группы могут быть замещены одним или двумя заместителями из группы, включающей F, Сl,Вr, CH3, C2H5, ОСН 3, OC2H5, CF3, C2F5, и, кроме того, в 5-членном циклоалкильном кольце одним его членом может являться N или О, а в 6-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или О, причем атомы азота кольца необязательно могут быть замещены С 1-3 алкилом или С 1-3 алканоилом. Равным образом предпочтительны бензимидазолы общей формулы I, в которых R5 и R5' независимо друг от друга означают С 1-6 алкил, при этом один атом углерода может быть заменен на О, NH, N-C1-3 алкил, N-C1-3 алканоил, или означают С 3-7 циклоалкил-С 0-3 алкил, при этом в 5-членном циклоалкильном кольце одним его членом может являться N или О, а в 6- или 7-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или О, причем атомы азота кольца необязательно могут быть замещены C1-3 алкилом или С 1-3 алканоилом, при этом указанные С 1-6 алкильные фрагменты могут быть замещены одной из вышеуказанных циклоалкильных групп или же 5-6-членной гетероароматической группой с 1-2 гетероатомами, выбранными из N, S и О, и, кроме того, все вышеуказанные алкильные и циклоалкильные фрагменты могут содержать до двух таких заместителей, как CF3, ОН, О 1-3, а вышеуказанные гетероарильные группы могут быть замещены одним или двумя такими заместителями, как F, Cl,CF3, CH3, C2H5, OCH3, OC2H5, или R5 и R5' вместе с атомом азота образуют 5-7-членный гетероцикл, который может содержать еще один атом кислорода, азота или серы и может быть замещен С 1-4 алкилом,С 1-4 алкокси-С 0-2 алкилом, С 1-4 алкоксикарбонилом, аминокарбонилом или фенилом. Предпочтительны также бензимидазолы общей формулы I, в которых А означает С 1-10 алкандиил,С 2-10 алкиндиил, С 2-10 алкиндиил или (С 0-5 алкандиил-С 3-7 циклоалкандиил-С 0-5 алкандиил), при этом в 5 членном циклоалкильном кольце одним его членом может являться N или О, а в 6- или 7-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или О, причем атомы азота кольца необязательно могут быть замещены C1-3 алкилом или С 1-3 алканоилом и в вышеуказанных алифатических цепях один или два атома углерода могут быть заменены на О, NH, N-С 1-3 алкил, N-С 1-3 алканоил. Помимо этого предпочтительны также бензимидазолы общей формулы I, в которых В означает СООН, COOR5, CONH2, CONHR5, CONR5R5', CONHOH, CONHOR5 или тетразолил, при этом каждый из указанных остатков связан с атомом углерода группы А. Наиболее предпочтительными значениями В являются COOR5, CONH2, CONHR5 или CONR5R5'. Предпочтительны также бензимидазолы общей формулы I, в которых X означает связь или мети-4 006302 лен. Предпочтительны, кроме того, бензимидазолы общей формулы I, в которых Y означает О. Более предпочтительно R1 и R2 независимо друг от друга означают фенил или 5-6-членный гетероарил с 1-2 гетероатомами, такими как N-, О- или S-атомы, которые могут быть замещены F, Cl, Вr, цианогруппой, С 1-4 алкилом, С 1-4 алкоксигруппой, метилендиоксигруппой, С 1-4 алкилтиогруппой, NO2, CF3,NH2,NН(С 1-3 алкилом) или N(С 1-3 алкилом)2. Более предпочтительно R3 означает Н, F, Cl, ОН, С 1-4 алкоксигруппу, С 1-4 алкил, NO2, NH2, NН-С 1-4 алканоил, NH-SO2-бензил или NH-SO2-фенил, при этом фенильный остаток может быть замещен F, Cl,Вr, С 1-4 алкилом, С 1-4 алкоксигруппой, CF3 или ацетиламиногруппой. Особо предпочтительны следующие бензимидазолы: изопропиловый эфир [(1,2-дифенил-1H-бензимидазол-6-ил)окси]уксусной кислоты,метиловый эфир 3-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]пропионовой кислоты,метиловый эфир 2-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]пропионовой кислоты,изопропиловый эфир 4-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]масляной кислоты,изопропиловый эфир 5-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]пентановой кислоты,метиловый эфир 6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексановой кислоты,изопропиловый эфир 6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексановой кислоты,6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,N-метокси-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,N-(фенилметокси)-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,N-гидрокси-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,метиловый эфир 7-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гептановой кислоты,изопропиловый эфир 6-1-(3-нитрофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-2-фенил-1-[3-(трифторметил)фенил]-1H-бензимидазол-6-ил]окси]гексановой кислоты,изопропиловый эфир 6-2-фенил-1-[3-(трифторметил)фенил]-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-(3-цианофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,изопропиловый эфир 6-1-(3-цианофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,6-1-(3-цианофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота,метиловый эфир 6-1-(4-цианофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,изопропиловый эфир 6-1-(4-цианофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-(3-хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,изопропиловый эфир 6-1-(3-хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-(4-хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,изопропиловый эфир 6-1-(4-хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-(3-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,изопропиловый эфир 6-1-(3-метилфенил)-2-фенил-1 H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,изопропиловый эфир 6-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-(3,5-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,изопропиловый эфир 6-1-(3,5-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-(3-метоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-(4-метоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-(3,4-диметоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-[3,4-(метилендиокси)фенил]-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,6-1-[3,4-(метилепдиокси)фенил]-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота,метиловый эфир 6-2-фенил-1-(3,4,5-триметоксифенил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,6-2-фенил-1-(3,4,5-триметоксифенил)-1H-бензимидазол-6-ил]окси]гексановая кислота,изопропиловый эфир 6-2-фенил-1-(3,4,5-триметоксифенил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-[4-(N,N-диметиламино)фенил]-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,6-1-[4-(N,N-диметиламино)фенил]-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота,изопропиловый эфир 6-1-фенил-2-[3-(трифторметил)фенил]-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-2-(3-хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,-5 006302 изопропиловый эфир 6-2-(3-хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-2-(4-хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,изопропиловый эфир 6-2-(4-хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-2-(4-метилфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,изопропиловый эфир 6-2-(4-метилфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-фенил-2-(4-пиридинил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-[(1,2-дифенил-5-нитро-1H-бензимидазол-6-ил)окси]гексановой кислоты,изопропиловый эфир 6-[(1,2-дифенил-5-нитро-1H-бензимидазол-6-ил)окси]гексановой кислоты,изопропиловый эфир 6-5-(4-бромфенил)сульфонил]амино]-1,2-дифенил-1H-бензимидазол-6 ил]окси]гексановой кислоты,метиловый эфир 6-5-(4-хлорфенил)сульфонил]амино]-1,2-дифенил-1H-бензимидазол-6-ил]окси] гексановой кислоты,изопропиловый эфир 6-5-(4-хлорфенил)сульфонил]амино]-1,2-дифенил-1H-бензимидазол-6-ил] окси]гексановой кислоты,изопропиловый эфир 6-1,2-дифенил-5-(3-метилфенил)сульфонил]амино]-1H-бензимидазол-6-ил] окси]гексановой кислоты,изопропиловый эфир 6-1,2-дифенил-5-(4-метилфенил)сульфонил]амино]-1H-бензимидазол-6-ил] окси]гексановой кислоты,изопропиловый эфир 6-1,2-дифенил-5-(4-метоксифенил)сульфонил]амино]-1H-бензимидазол-6-ил] окси]гексановой кислоты,изопропиловый эфир 6-1,2-дифенил-5-(4-трифторметил)фенил]сульфонил]амино]-1H-бензимидазол-6-ил]окси]гексановой кислоты,изопропиловый эфир 6-5-4-(ацетиламино)фенил]сульфонил]амино]-1,2-дифенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,изопропиловый эфир 6-5-бис(3-хлорфенил)сульфонил]амино]-1,2-дифенил-1H-бензимидазол-6 ил]окси]гексановой кислоты,изопропиловый эфир 6-1,2-дифенил-5-[(пропилсульфонил)амино]-1H-бензимидазол-6-ил]окси] гексановой кислоты,изопропиловый эфир 6-5-[(бензилсульфонил)амино]-1,2-дифенил-1H-бензимидазол-6-ил]окси] гексановой кислоты,метиловый эфир 2-[2-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]этокси]уксусной кислоты,метиловый эфир 3-[2-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]этокси]пропионовой кислоты,этиловый эфир 6-1-(3-нитрофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-4-ацетил-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-(4-метилфенил)-2-фенил-1H-бензимидазол-5-ил]окси]гексановой кислоты,метиловый эфир 6-2-фенил-1-[4-(тиометил)фенил]-1H-бензимидазол-5-ил]окси]гексановой кислоты,метиловый эфир 6-2-фенил-1-[(4-тиометил)фенил]-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-2-фенил-1-(3-тиенил)-1H-бензимидазол-5-ил] окси] гексановой кислоты,метиловый эфир 6-2-фенил-1-(3-тиенил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 4-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]масляной кислоты,N-(фенилметокси)-6-2-фенил-1-(3,4,5-триметоксифенил)-1H-бензимидазол-6-ил]окси]гексанамид,N,N-диметил-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,N-изопропил-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]-1-пирролидин-1-илгексан-1-он,метиловый эфир 5-5-(4-хлорфенил)сульфонил]амино]-1,2-дифенил-1H-бензимидазол-6-ил]окси] пентановой кислоты,метиловый эфир 6-5-(4-хлорфенил)сульфонил]амино]-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-5-(4-хлорфенил)сульфонил]амино]-1-(4-метоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-4-(ацетилокси)-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-4-гидрокси-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,6-4-гидрокси-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота,метиловый эфир 6-7-метил-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-2-фенил-1-(3-пиридил)-1H-бензимидазол-5-ил]окси]гексановой кислоты,метиловый эфир 6-2-фенил-1-(3-пиридил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-2-фенил-1-(4-пиридил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,-6 006302 метиловый эфир 6-2-(4-фторфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-2-(4-метоксифенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-2-(4-бромфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-2-[4-(трифторметил)фенил]-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-фенил-2-(бензотиен-2-ил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,6-1-фенил-2-(бензотиен-2-ил)-1H-бензимидазол-6-ил]окси]гексановая кислота,изопропиловый эфир 6-5-гидрокси-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,6-5-гидрокси-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота,изопропиловый эфир 6-5-метокси-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-5-гидрокси-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-5-метокси-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-5-(4-хлорфенил)сульфонил]амино]-1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-5-(4-хлорфенил)сульфонил]амино]-2-(4-фторфенил)-1-(4-метоксифенил)-1Hбензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-5-(4-хлорфенил)сульфонил]амино]-1-(4-метоксифенил)-2-(4-метоксифенил)1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 4-5-(4-хлорфенил)сульфонил]амино]-1-(4-метоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]масляной кислоты,метиловый эфир 5-5-(4-хлорфенил)сульфонил]амино]-1-(4-метоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]пентановой кислоты,метиловый эфир 5-5-(4-хлорфенил)сульфонил]амино]-1,2-дифенил-1H-бензимидазол-6-ил]окси] пентановой кислоты,метиловый эфир 6-5-(4-(трифторметил)фенил)сульфонил]амино]-1-(4-метоксифенил)-2-фенил 1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-5-(4-хлорфенил)сульфонил]метиламино]-1-(4-метоксифенил)-2-фенил-1Hбензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-(индан-5-ил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,6-1-(индан-5-ил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота,метиловый эфир 6-1-(3-фторфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-2-(4-нитрофенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-фенил-2-(3-пиридинил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,N-(циклопропилметокси)-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,N-изобутокси-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,N-(циклопропилметокси)-6-[2-фенил-1-(3,4,5-триметоксифенил)-1 Н-бензимидазол-6-ил)окси]гексанамид,N-изобутокси-6-[2-фенил-1-(3,4,5-триметоксифенил)-1 Н -бензимидазол-6-ил)окси]гексанамид,N-(2-метоксиэтил)-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,N-(3-метоксипропил)-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,N-изобутил-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]-1-морфолин-1-илгексан-1-он,N,N-ди(-2-метоксиэтил)-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,N-изопентил-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,N-(пиридин-2-ил)-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,N-(пиридин-3-ил)-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид,N-изопропил-6-1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексанамид,N,N-диметил-6-1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексанамид,N,N-диэтил-6-1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексанамид,N-изобутил-6-1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексанамид,N-циклопропил-6-1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексанамид,N-циклобутил-6-1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексанамид,N-трет-бутил-6-1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексанамид,(R)-6-1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]-1-(2-метоксиметил)пирролидин-1-илгексан-1-он,N-(3-имидазол-1-ил-пропил)-6-1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексанамид,N-(2-пиридин-2-илэтил)-6-1-(3,4-диметилфенил)-2-фенил-1 Н-бензимидазол-6-ил]окси]гексанамид,-7 006302N-(3-метоксипропил)-6-1-(индан-5-ил)-2-фенил-1H-бензимидазол-6-ил] окси] гептанамид,метиловый эфир 6-1-(4-метилфенил)-2-(3-пиридил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-(4-метилфенил)-2-(4-пиридил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-(4-метилфенил)-2-(2-тиенил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-(4-метилфенил)-2-(3-тиенил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-2-(3-индолил)-1-(4-метилфенил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-(4-метилфенил)-2-(2-фурил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-(4-метилфенил)-2-(3-фурил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-(4-метилфенил)-2-(5-метил-2-тиенил)-1H-бензимидазол-6-ил]окси]гексановой кислоты,метиловый эфир 6-1-(4-метилфенил)-2-(3-метил-2-тиенил)-1H-бензимидазол-6-ил]окси]гексановой кислоты. Предлагаемые в изобретении бензимидазольные производные ингибируют активацию микроглии и поэтому могут использоваться для получения лекарственного средства, предназначенного для лечения или предупреждения заболеваний, связанных с микроглией. Под микроглией в данном случае понимаются макрофаги головного мозга. Подобное действие является неожиданным, поскольку до настоящего времени бензимидазольные производные применялись согласно литературным источникам только для лечения тромбозов и артериосклероза (ЕР 0531883, WO 95/07263, ЕР 0104727, WO 97/12613), цистита (WO 97/33873) и заболеваний,связанных с -амилоидным пептидом (US 5552426) и повышенной активацией кальциевых каналов (ЕР 520200), однако их влияние на микроглию не было известно. Настоящее изобретение относится также к применению бензимидазола общей формулы IIR1 означает моно- либо бициклическую С 6-12 арильную группу или моно- либо бициклическую 5-10 членную гетероарильную группу с 1-4 гетероатомами, выбранными из группы, включающей N, S и О,при этом указанная арильная или гетероарильная группа может независимо содержать до трех заместителей, независимо друг от друга выбранных из F, Cl, Вr, I, C(NH)NH2, C(NH)NHR4, C(NH)NR4R4',C(NR4)NH2, C(NR4)NHR4', C(NR4)NR4R4', XOH, XOR4, XOCOR4, XOCONHR4, XOCOOR4, XCOR4,XC(NOH)R4, XC(NOR4)R4', XC(NO(COR4R4', XCN, XCOOH, XCOOR4, XCONH2, XCONR4R4',XCONHR4, XCONHOH, XCONHOR4, XCOSR4, XSR4, XSOR4, XSO2R4, SO2NH2, SO2NHR4, SO2NR4R4',NO2, XNH2, XNHR4, XNR4R4', XNHSO2R4, XN(SO2R4)(SO2R4'), XNR4SO2R4', XNHCOR4, XNHCOOR4,XNHCONHR4, тетрагидро-2,5-диоксопиррол-1-ила, 2,5-дигидро-2,5-диоксопиррол-1-ила, 2,7-дигидро 2,7-диоксоизоиндол-1-ила иR4, причем два заместителя у R1, если они находятся в ортоположении друг относительно друга,могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2-диилбисоксигруппу, пропан-1,3-диил или бутан-1,4-диил,R2 означает моно- либо бициклическую С 6-10 арильную группу или моно- либо бициклическую 5-10 членную гетероарильную группу с 1-4 гетероатомами, выбранными из группы, включающей N, S и О,при этом указанная арильная или гетероарильная группа может независимо содержать до трех заместителей, независимо друг от друга выбранных из F, Cl, Вr, I, C(NH)NH2, C(NH)NHR4, C(NH)NR4R4',C(NR4)NH2, C(NR4)NHR4', C(NR4)NR4R4', XOH, XOR4, XOCOR4, XOCONHR4, XOCOOR4, XCOR4,XC(NOH)R4, XC(NOR4)R4', XC(NO(COR4R4', XCN, XCOOH, XCOOR4, XCONH2, XCONR4R4',XCONHR4, XCONHOH, XCONHOR4, XCOSR4, XSR4, XSOR4, XSO2R4, SO2NH2, SO2NHR4, SO2NR4R4',NO2, XNH2, XNHR4, XNR4R4', XNHSO2R4, XN(SO2R4)(SO2R4'), XNR4SO2R4', XNHCOR4, XNHCOOR4,XNHCONHR4, тетрагидро-2,5-диоксопиррол-1-ила, 2,5-дигидро-2,5-диоксопиррол-1-ила, 2,7-дигидро 2,7-диоксоизоиндол-1-ила и R4, причем два заместителя у R2, если они находятся в ортоположении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2-диилбисоксигруппу, пропан- 1,3-диил или бутан-1,4-диил,R3 означает один или два заместителя, которыми независимо друг от друга могут являться водород,F, Cl, Br, I, XOH, XOR4, XOCOR4, XOCONHR4, XOCOOR4, XCOR4, XC(NOH)R4, XC(NOR4)R4',XC(NO(COR4R4', XCN, XCOOH, XCOOR4, XCONH2, XCONHR4, XCONR4R4', XCONHOH, XCONHOR4,XCOSR4, XSR4, XSOR4, XSO2R4, SO2NH2, SO2NHR4, SO2NR4R4', NO2, XNH2, XNHR4, XNR4R4',XNHSO2R4, XNR4SO2R4', XN(SO2R4)(SO2R4'), XNHCOR4, XNHCOOR4, XNHCONHR4, тетрагидро-2,5 диоксопиррол-1-ил, 2,5-дигидро-2,5-диоксопиррол-1-ил, 2,7-дигидро-2,7-диоксоизоиндол-1-ил и R4, при-8 006302 этом два заместителя R3, если они находятся в орто-положении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2 диилбисоксигруппу, пропан-1,3-диил или бутан-1,4-диил,R4 и R 4' независимо друг от друга означают С 1-4 перфторалкил, С 1-6 алкил, С 2-6 алкенил, С 2-6 алкинил,С 3-7 циклоалкил, (С 1-3 алкил-С 3-7 циклоалкил), С 1-3 алкил-С 6-10 арил, С 1-3 алкил-(5-10-членный гетероарил с 14 N-, S- или О-атомами), С 6-10 арил или 5-10-членный гетероарил с 1-4 N-, S- или О-атомами, при этом С 6-10 арильные и гетероарильные группы могут быть замещены одним или двумя заместителями из группы, включающей F, Cl, Вr, CH3, C2H5, NO2, OCH3, OC2H5, CF3, C2F5, или могут также нести аннелированную метандиилбисокси- или этан-1,2-диилбисоксигруппу, в 5-членном циклоалкильном кольце одним из его членов может являться N или О, а в 6- или 7-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или О, при этом атомы азота кольца необязательно могут быть замещены С 1-3 алкилом или С 1-3 алканоилом,R5 и R 5' независимо друг от друга означают водород, С 1-6 алкил, С 2-6 алкенил, С 2-6 алкинил, при этом атом углерода может быть заменен на О, S, SO, SO2, NH, N-C1-3 алкил или N-C1-3 алканоил, или означают С 3-7 циклоалкил-С 0-3 алкил, при этом в 5-членном циклоалкильном кольце одним его членом может являться N или О, а в 6- или 7-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или О, причем атомы азота кольца необязательно могут быть замещены С 1-3 алкилом или С 1-3 алканоилом, С 6-10 арил или 5-10-членный гетероарил с 1-4 гетероатомами из группы, включающей N, S и О, при этом указанные алкильные, алкенильные и алкинильные цепи могут быть замещены одной из вышеуказанных циклоалкильных, арильных или гетероарильных групп и, кроме того, все вышеуказанные алкильные и циклоалкильные остатки могут содержать до двух таких заместителей, как CF3, C2F5,ОН, O-C1-3 алкил, NH2, NН-С 1-3 алкил, NН-С 1-3 алканоил, N(С 1-3 алкил)2, N(С 1-3 алкил)(С 1-3 алканоил), СООН,CONH2 и COOC1-3 алкил, а все вышеуказанные арильные и гетероарильные группы могут быть замещены одним или двумя заместителями из группы, включающей F, Cl, Вr, CH3, C2H5, NO2, OCH3, OC2H5, CF3,C2F5, или могут также нести аннелированную метандиилбисокси- или этан-1,2-диилбисоксигруппу, илиR5 и R5' вместе с атомом азота образуют 5-7-членный гетероцикл, который может содержать еще один атом кислорода, азота или серы и может быть замещен С 1-4 алкилом, С 1-4 алкокси-С 0-2 алкилом, С 1-4 алкоксикарбонилом, аминокарбонилом или фенилом,А означает С 1-10 алкандиил, С 2-10 алкендиил, С 2-10 алкиндиил, (С 0-5 алкандиил-С 3-7 циклоалкандиил-С 05 алкандиил), (С 0-5 алкандииларилен-С 0-5 алкандиил) или (С 0-5 алкандиилгетероарилен-С 0-5 алкандиил), при этом арильные и гетероарильные группы могут быть замещены одним или двумя заместителями из группы, включающей F, Cl, Вr, CH3, C2H5, NO2, OCH3, OC2H5, CF3, C2F5, в 5-членном циклоалкильном кольце одним его членом может являться N или О, а в 6- или 7-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или О, причем атомы азота кольца необязательно могут быть замещены С 1-3 алкилом или С 1-3 алканоилом, в указанных алифатических цепях один или два атома углерода могут быть заменены на О, NH, NR4, NCOR4, NSO2R4 и, кроме того, алкильные или циклоалкильные группы могут содержать до двух таких заместителей, как F, ОН, OR4, OCOR4, =O, NH2, NR4R4', NHCOR4,NHCOOR4, NHCONHR4, NHSO2R4, SH, SR4,В означает водород, OH, OCOR5, OCONHR5, OCOOR5, COR5, C(NOH)R5, C(NOR5)R5',C(NO(COR5R5', COOH, COOR5, CONH2, CONHNH2, CONHR5, CONR5R5', CONHOH, CONHOR5, SO3H,SO2NH2, SO2NHR5, SO2NR5R5', PO3H, PO(OH)(OR5), PO(OR5) (OR5'), PO(OH)(NHR5), PO(NHR5)(NHR5') или тетразолил, при этом каждый из указанных остатков связан с атомом углерода группы А, или вся группа Y-A-B представляет собой N(SO2R4)(SO2R4') или NHSO2R4,X означает связь, СН 2, (СН 2)2, СН(CH3), (СН 2)3, СН(СН 2 СН 3), СН(CH3)СН 2 или СН 2 СН(CH3) иY означает связь, О, S, SO, SO2, NH, NR4, NCOR4, NSO2R4 для получения лекарственного средства,предназначенного для лечения или предупреждения заболеваний, связанных с активацией микроглии. Под общую формулу II наряду с новыми соединениями общей формулы I подпадают также известные соединения (ЕР 0531883, DE 4330959). Предлагаемые в изобретении соединения общей формулы II ингибируют активацию микроглии. Подобное действие, в том числе и для известных соединений, является новым. Предпочтительно применение соединений общей формулы II, в которой R1 означает моно- либо бициклическую арильную группу или моно- либо бициклическую 5-10-членную гетероарильную группу с 1-2 гетероатомами, выбранными из группы, включающей N, S и О, при этом указанная арильная или гетероарильная группа может независимо содержать до трех заместителей, независимо друг от друга выбранных из F, Сl, Вr, ХОН, XOR4 , XOCOR4 , XOCONHR4, XOCOOR4, XCOR4, XCN, XCOOH, XCOOR4,XCONH2, XCONR4R4', XCONHR4, XCONHOH, XCONHOR4, XCOSR4, XSR4, NO2, XNHR4, XNR4R4' и R4,причем два заместителя у R1, если они находятся в орто-положении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2 диилбисоксигруппу, пропан- 1,3-диил или бутан-1,4-диил. Равным образом предпочтительно применение соединений общей формулы II, в которой R2 означает моно- либо бициклическую арильную группу или моно-либо бициклическую 5-10-членную гетероарильную группу с 1-2 гетероатомами, выбранными из группы, включающей N, S и О, при этом указанная-9 006302 арильная или гетероарильная группа может содержать до трех заместителей, независимо друг от друга выбранных из F, Cl, Вr, ХОН, XOR4, XOCOR4, XOCONHR4, XOCOOR4, XCOR4, C(NOH)R4,XC(NOR4)R4', XC(NO(COR4R4', XCN, XCOOH, XCOOR4, XCONH2, XCONR4R4', XCONHR4,XCONHOH, XCONHOR4, XCOSR4, XSR4, XSOR4, XSO2R4, SO2NH2, SO2NHR4, SO2NR4R4', NO2, XNH2,XNHR4, XNR4R4', XNHSO2R4, XN(SO2R4)(SO2R4'), XNR4SO2R4', XNHCOR4, XNHCOOR4, XNHCONHR4 иR4, причем два заместителя у R2, если они находятся в орто-положении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу,этан-1,2-диилбисоксигруппу, пропан-1,3-диил или бутан-1,4-диил. Кроме того, предпочтительно применение соединений общей формулы II, в которой R3 означает один или два заместителя, которыми независимо друг от друга могут являться водород, F, Cl, Вr, ХОН,XOR4, XOCOR4, XOCONHR4, XOCOOR4, XCOR4, XC(NOH)R4, XC(NOR4)R4', XC(NO(COR4R4', XCN,XSR4, XSOR4, XSO2R4, SO2NH2, SO2NHR4, SO2NR4R4', NO2, XNH2, XNHR4, XNR4R4', XNHSO2R4,XNR4SO2R4', XN(SO2R4)(SO2R4'), XNHCOR4, XNHCOOR4, XNHCONHR4 и R4, при этом два заместителяR3, если они находятся в орто-положении друг относительно друга, могут быть соединены между собой таким образом, что они совместно образуют метандиилбисоксигруппу, этан-1,2-диилбисоксигруппу,пропан-1,3-диил или бутан-1,4-диил. Помимо этого предпочтительно применение соединений общей формулы II, в которой R4 и R4' независимо друг от друга означают CF3, C2F5, С 1-4 алкил, С 2-4 алкенил, С 2-4 алкинил, С 3-6 циклоалкил, (С 1-3 алкилС 3-6 циклоалкил), C1-3 алкиларил, С 1-3 алкилгетероарил, моноциклический арил или 5-6-членный гетероарил с 1-2 N-, S- или О-атомами, при этом арильные и гетероарильные группы могут быть замещены одним или двумя заместителями из группы, включающей F, Сl, Вr, CH3, C2H5, NO2, OCH3, OC2H5, CF3, C2F5,или могут также нести аннелированную метандиилбисокси- или этан-1,2-диилбисоксигруппу и, кроме того, в 5-членном циклоалкильном кольце одним его членом может являться N или О, а в 6-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или О, причем атомы азота кольца необязательно могут быть замещены С 1-3 алкилом или С 1-3 алканоилом. Равным образом предпочтительно применение соединений общей формулы II, в которой R5 и R5' независимо друг от друга означают С 1-6 алкил, при этом один атом углерода может быть заменен на О, NH, N-С 1-3 алкил, N-С 1-3 алканоил, или означают С 3-7 циклоалкил-С 0-3 алкил, при этом в 5-членном циклоалкильном кольце одним его членом может являться N или О, а в 6- или 7-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или О, причем атомы азота кольца необязательно могут быть замещены С 1-3 алкилом или C1-3 алканоилом, указанный С 1-6 алкильный фрагмент может быть замещен одной из вышеуказанных циклоалкильных групп или же 5-6-членной гетероароматической группой с 1-2 гетероатомами, выбранными из группы, включающей N, S и О, и, кроме того, все вышеуказанные алкильные и циклоалкильные фрагменты могут содержать до двух таких заместителей, как CF3, ОН и О 1-3 а вышеуказанные гетероарильные группы могут быть замещены одним или двумя заместителями из группы, включающей F, Cl, CF3, CH3, C2H5, ОСН 3, OC2H5, или R5 и R5' вместе с атомом азота образуют 5-7-членный гетероцикл, который может содержать еще один атом кислорода, азота или серы и может быть замещен С 1-4 алкилом, С 1-4 алкокси-С 0-2 алкилом, С 1-4 алкоксикарбонилом, аминокарбонилом или фенилом. Равным образом предпочтительно применение соединений общей формулы II, в которой А означает С 1-10 алкандиил, С 2-10 алкендиил, С 2-10 алкиндиил, (С 0-5 алкандиил-С 3-7 Циклоалкандиил-С 0-5 алкандиил) или(С 0-5 алкандиилгетероарилен-С 0-5 алкандиил), при этом присутствующая при определенных условиях гетероарильная группа может быть замещена одним или двумя заместителями из группы, включающей F, Cl,Вr, CH3, C2H5, NO2, ОСН 3, OC2H5, CF3, C2F5, и, кроме того, в 5-членном циклоалкильном кольце одним его членом может являться N или О, а в 6- или 7-членном циклоалкильном кольце одним или двумя его членами могут являться N и/или О, причем атомы азота кольца необязательно могут быть замещены С 1-3 алкилом или С 1-3 алканоилом, в алифатической цепи один или два атома углерода могут быть заменены на О, NH, N-C1-3 алкил, N-С 1-3 алканоил, NSO2-С 1-3 алкил и алкильные или циклоалкильные фрагменты могут содержать в качестве заместителей до двух атомов F или могут быть замещены одним из таких заместителей, как ОН, О-С 1-3 алкил, О-С 1-3 алканоил, =O, NH2, NH-C1-3 алкил, NС 1-3 алкил)2, NH-С 1-3 алканоил, N(С 1-3 алкил)(С 1-3 алканоил), NHCOO-C1-3 алкил, NHCONH-С 1-3 алкил, NHSO21-3 SH, S-С 1-3 алкил. Равным образом предпочтительно применение соединений общей формулы II, в которой В означает водород, ОН, OCOR5, OCONHR5, OCOOR5, СООН, COOR5, CONH2, CONHR5, CONR5R5', CONHOH,CONHOR5 или тетразолил, при этом каждый из указанных остатков связан с атомом углерода группы А. Равным образом предпочтительно применение соединений общей формулы II, в которой X означает связь или СН 2. Равным образом предпочтительно применение соединений общей формулы II, в которой Y означает связь, О, S, NH, NR4, NCOR4 или NSO2R4. В примере 307 описана методика, в соответствии с которой можно оценить ингибирование активации микроглии. При этом для активации микроглии можно использовать различные стимулы, например А-петид (-амилоид, Araujo D.M. и Cotman СМ., Brain Res. 569: 141-145 (1992, прион-протеин, цитокины или клеточные фрагменты (Combs C.K. и др., J. Neurosci. 19: 928-939 (1999), Wood P.L., Neuroinflammation: Mechanisms and Management, изд-во Humana Press, 1998). Так, например, определяемая по- 10006302 показателю IC50 ингибирующая концентрация соединения из примера 49, а именно, изопропилового эфира 6-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты, составляет 0,75 мкМ. Стимуляция с помощью А-пептида соответствует патофизиологической ситуации при болезни Альцгеймера. В этом исследовании при стимуляции с помощью А-пептида предлагаемые в изобретении соединения проявляют ингибирующее действие на активацию микроглии. Ингибирующее действие предлагаемых в изобретении соединений на активацию микроглии проявляется в значительном снижении продуцирования и секреции цитокинов, например интерлейкина 1 (Il 1) и фактора- некроза опухоли (TNF) (по результатам твердофазного иммуноферментного анализа (ELISA) и анализа экспрессии мРНК), и к пониженной секреции реакционноспособных кислород-/азотсодержащих промежуточных продуктов. Таким образом, обеспечивается одновременное ингибирование нескольких воспалительных факторов. Активность предлагаемых в изобретении соединений in vivo определяли с помощью МСАО-модели на крысах. Подобная модель позволяет сымитировать состояние, соответствующее апоплексии. Предлагаемые в изобретении соединения снижают активацию микроглии, наступающую при острых патологических изменениях в головном мозге животных. Настоящее изобретение относится также к применению предлагаемых в нем соединений общей формулы I и общей формулы II для получения лекарственного средства, предназначенного для лечения или предупреждения заболеваний, связанных с активацией микроглии. В качестве примера таких заболеваний можно назвать СПИД-деменцию, боковой амиотрофический склероз, болезнь КрейтцфельдаЯкоба (спастический псевдосклероз), болезнь Дауна, болезнь диффузных телец Леви, болезнь Хантингтона, лейкодистрофию, рассеянный склероз, болезнь Паркинсона, болезнь Пика, болезнь Альцгеймера,апоплексию, эпилепсию височной доли и различные опухоли. Настоящее изобретение относится, кроме того, к фармацевтическим средствам, содержащим одно или несколько предлагаемых в изобретении соединений общей формулы I и один или несколько носителей. Такие фармацевтические средства или составы по изобретению получают в зависимости от предполагаемого пути их введения в необходимой дозировке по известным методам с использованием обычных твердых или жидких носителей или разбавителей, а также обычных фармацевтических и технологических вспомогательных веществ. Предпочтительные композиции представлены в лекарственной форме,пригодной для перорального, энтерального или парентерального введения. Примерами подобных лекарственных форм служат таблетки, филм-таблетки, драже, пилюли, капсулы, порошки или депо-формы, а также суппозитории. Соответствующие таблетки можно изготавливать, например, смешением действующего вещества с известными вспомогательными веществами, например с инертными разбавителями,такими как декстроза, сахар, сорбит, маннит, поливинилпирролидон, разрыхлителями, такими как кукурузный крахмал или альгиновая кислота, связующими, такими как крахмал или желатин, смазывающими веществами, такими как карбоксиполиметилен, карбоксиметилцеллюлоза, фталат ацетилцеллюлозы или поливинилацетат. Таблетки могут иметь также многослойную структуру. Соответствующим образом можно также получать драже, нанося на изготовленные аналогично таблеткам ядра покрытия из обычно применяемых в качестве оболочек драже средств, таких, например,как поливинилпирролидон или шеллак, гуммиарабик, тальк, оксид титана или сахар. При этом оболочка драже также может иметь многослойную структуру, для получения которой можно использовать вспомогательные вещества, указанные выше для таблеток. Содержащие действующее вещество капсулы можно изготавливать, например, смешением действующего вещества с инертным носителем, таким как лактоза или сорбит, и расфасовыванием полученной смеси в желатиновые капсулы. Предлагаемые в изобретении соединения можно также применять в виде соответствующих растворов, например в виде физиологического раствора поваренной соли, в качестве растворов для инфузии или инъекций. Для парентерального введения пригодны прежде всего масляные растворы, например растворы в кунжутном масле, касторовом масле и хлопковом масле. Для повышения растворимости можно добавлять гидротропные солюбилизаторы, такие, например, как бензилбензоат или бензиловый спирт. Предлагаемые в изобретении соединения можно также внедрять в соответствующий материал с получением трансдермальной системы и темсамым вводить их чрескожно. Назначаемая пациенту доза предлагаемых в изобретении соединений общей формулы I и общей формулы II определяется лечащим врачом и зависит, среди прочего, от конкретно вводимого соединения, от пути введения, от подвергаемого лечению заболевания и от степени его тяжести. Суточная доза не превышает 1000 мг, предпочтительно не превышает 100 мг, при этом такая доза может вводиться однократно в виде разовой дозы либо может быть разделена на несколько меньших доз из расчета на два или более приемов в день. Соединения формулы I могут быть представлены в виде таутомеров, стереоизомеров или геометрических изомеров. Поэтому в объем изобретения включены также все возможные изомеры, такие как Е- иZ-изомеры, S- и R-энантиомеры, диастереомеры, рацематы и их смеси, в том числе и таутомерных со- 11006302 единений. Смеси изомеров можно по обычным методам, таким, например, как кристаллизация, хроматография или солеобразование, разделять на энантиомеры, соответственно на E/Z-изомеры. Предлагаемые в изобретении соединения получают аналогично известным методам, описанным,например, в ЕР 531883. Если в последующем способ получения тех или иных исходных соединений не описан, то подразумевается, что такие исходные соединения либо являются известными и имеются в продаже, либо их получают аналогично представленным в настоящем описании методам. В приведенных ниже примерах описано получение некоторых соединений-предшественников, промежуточных продуктов и конечных продуктов. Предлагаемые в изобретении соединения получают, например, следующими методами. Общая методика 1. Восстановление нитрогрупп, гидрирование олефиновых двойных связей и гидрогенолиз простых бензиловых эфиров. Восстанавливаемое соединение растворяют в этилацетате, тетрагидрофуране, метаноле или этаноле либо в смеси указанных растворителей и гидрируют в присутствии 2-5% (в пересчете на нитросоединение) палладия на угле (10%-ного) при нормальном давлении. По завершении процесса поглощения водорода смесь подвергают вакуум-фильтрации, остаток промывают этилацетатом, метанолом или этанолом и фильтрат концентрируют в вакууме. Полученной сырой продукт, как правило, используют в последующей реакции без дополнительной очистки. Общая методика 2. Восстановление нитрогрупп. 9,2 г сульфата железа (Н) помещают в 30 мл воды и 9 мл раствора аммиака. К этой смеси по каплям добавляют раствор из 3,6 ммоля нитросоединения в 100 мл этанола и полученную суспензию интенсивно перемешивают в течение 1 ч при 70 С. После этого реакционной смеси дают отстояться, отфильтровывают твердое вещество, фильтрат концентрируют практически досуха, смешивают с водой и трижды экстрагируют этилацетатом. Объединенные экстракты сушат над сульфатом натрия и концентрируют в вакууме. Полученное аминосоединение используют в последующем процессе в виде сырого продукта. Общая методика 3. Циклизация до бензимидазолов с помощью ортоэфиров. 10 ммолей 1,2-диаминобензольного производного растворяют в 25 мл этанола. К этом раствору по каплям добавляют 47 мл 0,8-молярного раствора НСl в простом эфире, перемешивают в течение 30 мин и затем досуха концентрируют в вакууме. Остаток растворяют в 230 мл метанола и смешивают с 6 мл триметилортобензоата или с соответствующим количеством другого ортоэфира. Далее смесь в течение 2-8 ч кипятят с обратным холодильником, после охлаждения сливают в насыщенный раствор гидрокарбоната натрия, трижды экстрагируют этилацетатом, объединенные экстракты сушат над сульфатом натрия и концентрируют в вакууме. Остаток очищают кристаллизацией или колоночной хроматографией на силикагеле. Общая методика 4. Циклизация до бензимидазолов с помощью гидрохлоридов иминоэфиров. 1,2 ммоля 1,2-диаминобензольного производного растворяют в 5 мл тетрагидрофурана, смешивают с 1,5 ммоля гидрохлорида бензимидата и смесь перемешивают в течение 15 ч. Далее смесь смешивают с насыщенным раствором гидрокарбоната натрия, разбавляют водой и трижды экстрагируют этилацетатом. Объединенные органические фазы трижды промывают 1 н. водной соляной кислотой и однократно насыщенным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют через фритту с силикагелем и раствор концентрируют досуха. Продукт кристаллизуют из диизопропилового эфира. Общая методика 5. Циклизация до бензимидазолов через промежуточные анилиды карбоновой кислоты. 4,7 ммоль 1,2-диаминобензольного производного растворяют в 20 мл дихлорметана, смешивают с 14 ммолями триэтиламина, а затем медленно с 6 ммолями хлорангидрида карбоновой кислоты и смесь перемешивают в течение 15 ч. Далее смесь смешивают с насыщенным раствором гидрокарбоната натрия,разбавляют водой и дважды экстрагируют дихлорметаном. Объединенные органические фазы промывают водой и насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют в вакууме. Остаток в виде сырого анилида карбоновой кислоты растворяют в смеси из метанола и конц. соляной кислоты (в соотношении 9:1) и в течение 1 ч кипятят с обратным холодильником. После охлаждения реакционную смесь медленно добавляют к насыщенному раствору гидрокарбоната натрия, разбавляют водой и трижды экстрагируют дихлорметаном. Объединенные органические фазы промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют в вакууме. Остаток при необходимости очищают кристаллизацией или колоночной хроматографией на силикагеле. Общая методика 6. Отщепление эфира с помощью бромистоводородной кислоты. 5 г арилметилового эфира смешивают с 160 мл 48%-ной водной НВr и в течение 1-5 ч кипятят с обратным холодильником. После охлаждения смесь фильтруют. Остаток растворяют в этилацетате и трижды экстрагируют насыщенным раствором гидрокарбоната натрия. После сушки над сульфатом натрия концентрируют в вакууме. Остаток при необходимости очищают кристаллизацией или колоночной хроматографией на силикагеле. Общая методика 7. Отщепление эфира с помощью трибромида бора. 1,86 ммоль арилметилового эфира растворяют в 18 мл дихлорметана и при -35 С медленно смешивают с 7,4 мл 1-молярного раствора трибромида бора в дихлорметане. После этого смесь выдерживают в- 12006302 течение 12-15 ч при -30 С, а затем смешивают с насыщенным раствором гидрокарбоната натрия, трижды экстрагируют дихлорметаном, объединенные экстракты сушат над сульфатом натрия и концентрируют в вакууме. Остаток при необходимости очищают колоночной хроматографией на силикагеле. Общая методика 8. Алкилирование гидроксибензимидазольных производных и фенольных производных алкилгалогенидами. Раствор 1,85 ммоль гидроксибензимидазольного производного в 12 мл N,N-диметилформамида смешивают с 1,85 ммоль карбоната цезия и 2,24 ммолями алкилбромида или алкилйодида. При использовании алкилбромида необязательно добавляют 1,85 ммоль йодида натрия. Смесь перемешивают в течение 12-96 ч, после чего сливают в воду, растворяют в этилацетате, органическую фазу четырежды промывают водой, сушат над сульфатом натрия и концентрируют в вакууме. Альтернативно такой водной переработке реакционную смесь можно смешивать с дихлорметаном, отделять фильтрацией выпавшие в осадок соли и концентрировать фильтрат в вакууме. Вне зависимости от выбранного метода переработки остаток очищают кристаллизацией или колоночной хроматографией на силикагеле. Общая методика 9. Омыление алкиловых эфиров карбоновой кислоты. 0,77 ммоль алкилового эфира карбоновой кислоты растворяют в 5 мл метанола и 5 мл тетрагидрофурана и смешивают с 5 мл 0,5 н. водного раствора гидроксида лития или натрия. После перемешивания в течение 2-12 ч смесь практически досуха концентрируют в вакууме, нейтрализуют добавлением водной соляной кислоты и экстрагируют этилацетатом. Далее сушат над сульфатом натрия и концентрируют в вакууме. Остаток при необходимости очищают колоночной хроматографией на силикагеле. Общая методика 10. Этерификация карбоновых кислот. 0,2 ммоль карбоновой кислоты растворяют в 1 мл первичного или вторичного спирта, смешивают с двумя каплями конц. серной кислоты и в течение 12 ч перемешивают при 60 С. Затем смесь смешивают с насыщенным раствором гидрокарбоната калия, разбавляют водой и трижды экстрагируют этилацетатом. После промывки объединенных экстрактов насыщенным раствором хлорида натрия и сушки над сульфатом натрия концентрируют в вакууме и остаток кристаллизуют из диизопропилового эфира. Общая методика 11. Восстановление алкиловых эфиров карбоновой кислоты с помощью алюмогидрида лития. 0,15 ммоль эфира карбоновой кислоты растворяют в тетрагидрофуране и смешивают с 0,09 ммоля алюмогидрида лития. После этого перемешивают в течение 1-48 ч, смешивают с водой и трижды экстрагируют дихлорметаном. После сушки объединенных органических фаз над сульфатом натрия концентрируют в вакууме. Остаток при необходимости очищают кристаллизацией или колоночной хроматографией на силикагеле. Общая методика 12. Взаимодействие бензимидазолкарбальдегидов с бромидами (-карбоксиалкил) трифенилфосфония по реакции Виттига и этерификация метанолом. 2 ммоль бромида (-карбоксиалкил)трифенилфосфония при 0 С смешивают в 2,5 мл диметилсульфоксида и 2,5 мл тетрагидрофурана с 4 ммолями трет-бутилата калия и в течение 30 мин перемешивают при температуре выше 10 С. Затем добавляют раствор из 0,67 ммоль альдегида в 2 мл тетрагидрофурана и в течение 3 ч перемешивают при 20 С. После этого смесь смешивают с насыщенным раствором хлорида аммония, разбавляют водой и трижды экстрагируют этилацетатом. После сушки объединенных органических фаз над сульфатом натрия концентрируют в вакууме. Остаток растворяют в 15 мл метанола,смешивают с двумя каплями конц. серной кислоты и оставляют стоять в течение 48-72 ч. После концентрирования в вакууме остаток очищают колоночной хроматографией на силикагеле. Общая методика 13. Взаимодействие аминобензимидазолов с галогенангидридами алкил- и арилсульфоновых кислот. 47 мкмолей аминобензимидазольного производного растворяют в 0,5 мл дихлорметана, смешивают с 51 мкмолями триэтиламина и 51 мкмолями галогенангидрида алкил- или арилсульфоновой кислоты и реакционную смесь перемешивают в течение 2-15 ч. Для переработки добавляют насыщенный раствор гидрокарбоната натрия, трижды экстрагируют дихлорметаном, объединенные органические фазы промывают водой, сушат над сульфатом натрия и концентрируют в вакууме. Остаток очищают кристаллизацией или колоночной хроматографией на силикагеле. Общая методика 14. О- или N-арилирование бензимидазолов с использованием меди. 5 ммоль незамещенного у атома N бензимидазольного производного или замещенного у атома N арилом гидроксибензимидазольного производного растворяют в 20 мл дихлорметана. Далее добавляют 10 ммоль арилбороновой кислоты, 5 ммоль безводного ацетата меди(II), 10 ммоль пиридина или триэтиламина и примерно 2,5 г молекулярных сит (4 А), перемешивают в течение 48-72 ч без доступа влаги,затем добавляют силикагель, досуха концентрируют в вакууме и порошковый остаток очищают хроматографией на силикагеле. При необходимости региоизомерные продукты N-арилирования разделяют с помощью ЖХВР. Общая методика 15. N-Замещение бензимидазолов с использованием основного катализатора. 5 ммоль незамещенного у атома N бензимидазольного производного растворяют в 20 мл диметилацетамида. Далее добавляют 25 ммоль гидрида натрия и 20 ммоль обедненного электронами арил- или- 13006302 гетероарилгалогенида и в течение 48-72 ч кипятят с обратным холодильником без доступа влаги, после чего добавляют силикагель, досуха концентрируют в вакууме и порошковый остаток очищают хроматографией на силикагеле. При необходимости региоизомерные продукты N-арилирования разделяют с помощью ЖХВР. Общая методика 16. Циклизация до бензимидазолов с помощью альдегидов. 1 ммоль 1,2-диаминобензольного производного растворяют в 3 мл нитробензола. К этому раствору добавляют 1 ммоль арил-, соответственно гетероарилальдегида. Далее нагревают до 150 С, выдерживая при этой температуре в течение 2-6 ч, а затем смеси дают охладиться. Остаток без дополнительной переработки непосредственно очищают колоночной хроматографией на силикагеле. Общая методика 17. Перевод карбоновых кислот в их амиды. 0,25 ммоль карбоновой кислоты растворяют в 3 мл N,N-диметилформамида, смешивают с 0,38 ммоль первичного или вторичного амина, 0,5 ммоль триэтиламина и 0,25 ммоль дифенилфосфорилазида и смесь перемешивают в течение 2 дней. Для переработки добавляют воду, трижды экстрагируют этилацетатом, объединенные органические фазы промывают водой, сушат над сульфатом натрия и концентрируют в вакууме. Остаток очищают колоночной хроматографией на силикагеле. Общая методика 18. Перевод эфиров карбоновых кислот в амиды карбоновых кислот. 0,36 ммоль амина растворяют в 3 мл толуола и при охлаждении на ледяной бане по каплям смешивают с 0,18 мл 2-молярного раствора триметилалюминия в толуоле. Далее смешивают с раствором из 0,33 ммолей метилового эфира карбоновой кислоты в 3 мл толуола и перемешивают в течение 2-8 ч при 95 С. Для переработки после охлаждения добавляют воду, трижды экстрагируют этилацетатом, объединенные органические фазы промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют в вакууме. Остаток очищают колоночной хроматографией на силикагеле. Пример 1. Изопропиловый эфир [(1,2-дифенил-1H-бензимидазол-6-ил)окси]уксусной кислоты. Указанное соединение получают взаимодействием 1,2-дифенил-6-гидрокси-1H-бензимидазола (Benincori Т., Sannicolo F., J. Heterocycl. Chem. 25: 1029-1033 (1988 с изопропиловым эфиром бромуксусной кислоты в соответствии с общей методикой 8, tпл. 137-138C. Пример 2. [(1,2-Дифенил-1H-бензимидазол-6-ил)окси]этан-1-ол. Указанное соединение получают путем химического превращения метилового эфира [(1,2-дифенил 1H-бензимидазол-6-ил)окси]уксусной кислоты (DE 4330959) в соответствии с общей методикой 11, 1 НЯМР (D6-ДМСО):в част./млн = 3,72 t (J = 7,5 Гц, 2 Н); 4,02 t (J = 7,5 Гц, 2 Н); 6,72 d (J = 2 Гц, 1 Н); 7,10dd (J = 8, 2 Гц, 1 Н); 7,38-7,68 m (10 Н); 7,76 d (J = 8 Гц, 1H). Пример 3. 3-[(1,2-Дифенил-1H-бензимидазол-6-ил)окси]пропан-1-ол. 0,5 г 1,2-дифенил-6-гидрокси-1H-бензимидазола в соответствии с общей методикой 8 подвергают взаимодействию с 3-(бромпропокси)-трет-бутилдиметилсиланом. После хроматографии на силикагеле продукт растворяют в 2,5 мл метанола, добавляют 0,4 мл конц. соляной кислоты и перемешивают в течение 2 ч при 20 С. Далее смесь сливают в насыщенный водный раствор гидрокарбоната натрия, трижды экстрагируют этилацетатом, объединенные экстракты промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют в вакууме, tпл 191-193C. Пример 4. 3-[(1,2-Дифенил-1H-бензимидазол-6-ил)окси]пропионовая кислота. 100 мг 3-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]пропан-1-ола помещают в 2,5 мл ацетона и при-15 С смешивают с 0,15 мл раствора реагента Джонса (полученного из 0,27 г оксида хрома(VI), 1 мл воды и 0,23 мл конц. серной кислоты). После перемешивания в течение 3,5 ч при -15 С реакцию прекращают добавлением изопропанола. Далее разбавляют водой, трижды экстрагируют дихлорметаном, объединенные органические фазы сушат над сульфатом натрия и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле. 1 Н-ЯМР (D6-ДМСО):в част./млн = 2,60 t (J = 7,5 Гц, 2 Н); 4,15 t (J = 7,5 Гц, 2 Н); 6,64 d (J = 2 Гц,1 Н); 6,95 dd (J = 8, 2 Гц, 1 Н); 7,30-7,61 m (10 Н); 7,69 d (J = 8 Гц, 1 Н). Пример 5. Метиловый эфир 3-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]пропионовой кислоты. 45 мг 3-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]пропионовой кислоты растворяют в 0,5 мл N,Nдиметилформамида и смешивают с 41 мг карбоната цезия и 10 мкл метилйодида. Далее перемешивают в течение 2 дней, разбавляют дихлорметаном, фильтруют, фильтрат концентрируют в вакууме и остаток хроматографируют на силикагеле, tпл 120-121 С. Пример 6. Метиловый эфир 2-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]пропионовой кислоты. Указанное соединение получают взаимодействием 1,2-дифенил-6-гидрокси-1H-бензимидазола с метиловым эфиром 2-бромпропионовой кислоты в соответствии с общей методикой 8. tпл 132-135C. Пример 7. Изопропиловый эфир 4-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]масляной кислоты. Указанное соединение получают взаимодействием 1,2-дифенил-6-гидрокси-1H-бензимидазола с изопропиловым эфиром 4-броммасляной кислоты в соответствии с общей методикой 8, tпл 89-91C. Пример 8. 4-[(1,2-Дифенил-1H-бензимидазол-6-ил)окси]бутан-1-ол. Указанное соединение получают химическим превращением метилового эфира 4-[(1,2-дифенил-1Hбензимидазол-6-ил)окси]масляной кислоты в соответствии с общей методикой 11, tпл 159-160C.- 14006302 Пример 9. [4-[(1,2-Дифенил-1H-бензимидазол-6-ил)окси]бут-1-иловый]эфир уксусной кислоты. 50 мг 4-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]бутан-1-ола растворяют в 1 мл дихлорметана,смешивают с 0,34 мл пиридина и 20 мкл ацетилхлорида и перемешивают в течение 15 ч. Далее смешивают с насыщенным раствором гидрокарбоната натрия, разбавляют водой, дважды экстрагируют дихлорметаном, объединенные органические фазы промывают насыщенным раствором хлорида натрия,сушат над сульфатом натрия и концентрируют в вакууме. Остаток очищают толстослойной хроматографией, tпл 68-69C. Пример 10. [4-[(1,2-Дифенил-1H-бензимидазол-6-ил)окси]бут-1-иловый]эфир пивалиновой кислоты. Указанное соединение получают аналогично примеру 9 из 50 мг 4-[(1,2-дифенил-1H-бензимидазол 6-ил)окси]бутан-1-ола, 0,34 мл пиридина и 22 мкл хлорангидрида триметилуксусной кислоты, tпл 104106 С. Пример 11. 4-[(1,2-Дифенил-1H-бензимидазол-6-ил)окси]бутил-N-метилкарбамат. 100 мг 4-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]бутан-1-ола растворяют в 4 мл дихлорметана,смешивают с 0,1 мл триэтиламина и 20 мг метилизоцианата и перемешивают в течение 15 ч. Далее дополнительно добавляют 0,1 мл триэтиламина и 20 мг метилизоцианата, перемешивают в течение 20 ч и затем концентрируют в вакууме. Остаток очищают хроматографией на силикагеле, tпл 124-126 С. Пример 12. Изопропиловый эфир 5-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]пентановой кислоты. Указанное соединение получают взаимодействием 1,2-дифенил-6-гидрокси-1H-бензимидазола с изопропиловым эфиром 5-бромпентановой кислоты в соответствии с общей методикой 8, tпл 91-92 С. Пример 13. Метиловый эфир 6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексановой кислоты. Указанное соединение получают взаимодействием 1,2-дифенил-6-гидрокси-1H-бензимидазола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8. 1 Н-ЯМР (CDCl3):= 1,44-1,56 m (2H); 1,64-1,85 m (4H); 2,33 t (J = 7,5 Гц, 2 Н); 3,66 s (3 Н); 3,93 t (J = 7,5 Гц, 2 Н); 6,70 d (J = 2 Гц, 1 Н); 6,96 dd (J = 8, 2 Гц, 1 Н); 7,22-7,38 m (5 Н); 7,43-7,58 m (5 Н); 7,76 d (J = 8 Гц, 1 Н). Пример 14. Изопропиловый эфир 6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексановой кислоты. Указанное соединение получают взаимодействием 1,2-дифенил-6-гидрокси-1H-бензимидазола с изопропиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8. 1 Н-ЯМР (CDC13):в част./млн = 1,22 d (J = 7,5 Гц, 6 Н); 1,43-1,56 m (2H); 1,62-1,87 m (4 Н); 2,30 t (J= 7,5 Гц, 2 Н); 3,93 t (J = 7,5 Гц, 2 Н); 5,01 sp (J = 7,5 Гц, 1H); 6,69 d (J = 2 Гц, 1 Н); 6,96 dd (J = 8, 2 Гц, 1 Н); 7,25-7,38 m (5H); 7,43-7,55 m (5 Н); 7,75 d (J = 8 Гц, 1 Н). Пример 15. 6-[(1,2-Дифенил-1H-бензимидазол-6-ил)окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-[(1,2-дифенил-1Hбензимидазол-6-ил)окси]гексановой кислоты в соответствии с общей методикой 9. 1 Н-ЯМР (D6-ДМСО):в част./млн = 1,35-1,49 m (2H); 1,50-1,63 m (2H); 1,65-1,77 m (2 Н); 2,23 t (J = 7,5 Гц, 2 Н); 3,92 t (J = 7,5 Гц, 2 Н); 6,62 d (J = 2 Гц, 1 Н); 6,95 dd (J = 10, 2 Гц, 1 Н); 7,30-7,62 m (10 Н); 7,68 d(J = 10 Гц, 1 Н). Пример 16. 6-[(1,2-Дифенил-1H-бензимидазол-6-ил)окси]гексан-1-ол. Указанное соединение получают химическим превращением метилового эфира 6-[(1,2-дифенил-1Hбензимидазол-6-ил)окси]гексановой кислоты в соответствии с общей методикой 11. 1d (J = 2 Гц, 1 Н); 6,98 dd (J = 8, 2 Гц, 1 Н); 7,24-7,38 m (5H); 7,45-7,58 m (5H); 7,75 d (J = 8 Гц, 1 Н). Пример 17. 6-[(1,2-Дифенил-1H-бензимидазол-6-ил)окси]гексанамид. а) 6-[(1,2-Дифенил-1H-бензимидазол-6-ил)окси]гексаннитрил. Указанное соединение получают взаимодействием 1,2-дифенил-6-гидрокси-1H-бензимидазола с 6 бромгексаннитрилом в соответствии с общей методикой 8. tпл 108-112 С. б) 6[(1,2-Дифенил-1H-бензимидазол-6-ил)окси]гексанамид. К раствору 50 мг 6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексаннитрила в 1 мл метанола добавляют 18 мг карбоната калия и 40 мкл 30%-ного раствора пероксида водорода и перемешивают в течение 24 ч. Далее примешивают охлажденный на льду водный раствор тиосульфата натрия и трижды экстрагируют этилацетатом. После сушки над сульфатом натрия концентрируют в вакууме и остаток хроматографируют на силикагеле. 1H-ЯМР (CDCl3):в част./млн = 1,48-1,60 m (2H); 1,65-1,87 m (4H); 2,25 t (J = 7,5 Гц, 2 Н); 3,94 t (J = 7,5 Гц, 2 Н); 5,30-5,53 шир. сигнал (2 Н); 6,68 d (J = 2 Гц, 1 Н); 6,95 dd (J = 8, 2 Гц, 1 Н); 7,23-7,38 m (5H); 7,42-7,58 m (5H); 7,75 d (J = 8 Гц, 1 Н). Пример 18. N-Метокси-6-[(1,2-дифенил-1H-бензимидазол-6-ил)oкси]гексанамид. 100 мг 6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексановой кислоты растворяют в 2 мл тетрагидрофурана, смешивают с 39 мг карбонилдиимидазола, перемешивают в течение 30 мин при 20 С и затем в течение 30 мин кипятят с обратным холодильником. После этого при 20 С добавляют 21 мг гидрохлорида О-метилгидроксиламина и перемешивают в течение 18 ч. Далее реакционную смесь разбавляют этилацетатом и промывают 2 н. водной соляной кислотой и насыщенным раствором гидрокарбоната- 15006302 калия. После сушки над сульфатом натрия концентрируют в вакууме и остаток хроматографируют на силикагеле, tпл 144-145C. Пример 19. N-(Фенилметокси)-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид. Указанное соединение получают взаимодействием 6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси] гексановой кислоты с гидрохлоридом О-бензилгидроксиламина аналогично примеру 18, tпл 144C. Пример 20. N-Гидрокси-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамид. 23 мг N-(фенилметокси)-6-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гексанамида растворяют в 4 мл этанола, смешивают с 15 мг палладия на угле (10%-ного) и в течение 3 ч перемешивают в атмосфере водорода. После отделения катализатора смесь концентрируют в вакууме и остаток кристаллизуют из диэтилового эфира, tпл 83-85C. Пример 21. Метиловый эфир 7-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гептановой кислоты. Указанное соединение получают взаимодействием 1,2-дифенил-6-гидрокси-1H-бензимидазола с метиловым эфиром 7-бромгептановой кислоты в соответствии с общей методикой 8, tnл 77-80C. Пример 22. 7-[(1,2-Дифенил-1H-бензимидазол-6-ил)окси]гептановая кислота. Указанное соединение получают химическим превращением метилового эфира 7-[(1,2-дифенил-1Hбензимидазол-6-ил)окси]гептановой кислоты в соответствии с общей методикой 9, tnл 142-145 С. Пример 23. Изопропиловый эфир 7-[(1,2-дифенил-1H-бензимидазол-6-ил)окси]гептановой кислоты. Указанное соединение получают взаимодействием 7-[(1,2-дифенил-1H-бензимидазол-6-ил)окси] гептановой кислоты с изопропанолом в соответствии с общей методикой 10, tnл 98-100C. Пример 24. Изопропиловый эфир 6-1 -(3-нитрофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 6-гидрокси-1-(3-нитрофенил)-2-фенил-1Hбензимидазола (DE 4330959) с изопропиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tnл 111-113C. Пример 25. Метиловый эфир 6-2-фенил-1-[3-(трифторметил)фенил]-1H-бензимидазол-6-ил]окси] гексановой кислоты. а) (5-Метокси-2-нитрофенил)[(3-трифторметил)фенил]амин. 2 г 3-фтор-4-нитроанизола и 16 мл 3-(трифторметил)анилина перемешивают в течение 72 ч при 140 С. Далее смесь разбавляют этилацетатом, десятикратно промывают 4 н. водной соляной кислотой и однократно насыщенным раствором хлорида натрия, сушат над сульфатом натрия, концентрируют в вакууме и остаток хроматографируют на силикагеле. 1m (4 Н); 8,22 d (J = 8 Гц, 1 Н); 9,78 s (шир. сигнал) (1 Н). б) 6-Метокси-2-фенил-1-[(3-трифторметил)фенил]-1H-бензимидазол. Указанное соединение получают гидрированием (5-метокси-2-нитрофенил)[(3-трифторметил)фенил]амина в соответствии с общей методикой 1 и последующей циклизацией с помощью триэтилортобензоата в соответствии с общей методикой 3, tnл 135-137C. в) 6-Гидрокси-2-фенил-1-[(3-трифторметил)фенил]-1H-бензимидазол. Указанное соединение получают химическим превращением 6-метокси-2-фенил-1-[(3-трифторметил)фенил]-1H-бензимидазола в соответствии с общей методикой 6. 1H-ЯМР (D6-ДMCO):в част./млн = 6,56 d (J = 2 Гц, 1 Н); 6,82 dd (J = 8, 2 Гц, 1 Н); 7,32-7,50 m (5 Н); 7,60 d (J = 8 Гц, 1 Н); 7,70-7,95 m (4H); 9,48 s (шир. сигнал) (1 Н). г) Метиловый эфир 6-2-фенил-1-[3-(трифторметил)фенил]-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 6-гидрокси-2-фенил-1-[(3-трифторметил)фенил]1H-бензимидазола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8,tпл 106-108 С. Пример 26. Изопропиловый эфир 6-2-фенил-1-[3-(трифторметил)фенил]-1H-бензимидазол-6-ил] окси]гексановой кислоты. Указанное соединение получают взаимодействием 6-гидрокси-2-фенил-1-[(3-трифторметил)фенил]1H-бензимидазола с изопропиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 113-115 С. Пример 27. 6-2-Фенил-1-[3-(трифторметил)фенил]-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-2-фенил-1-[3(трифторметил)фенил]-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9, tnл 156-158C. Пример 28. 6-2-Фенил-1-[3-(трифторметил)фенил 1-1H-бензимидазол-6-ил]окси]гексан-1-ол. Указанное соединение получают химическим превращением метилового эфира 6-2-фенил-1-[3(трифторметил)фенил]-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 11, tпл 143-145C.- 16006302 Пример 29. Метиловый эфир 6-1-(3-цианофенил)-2-фенил-1H-бензимидазол-6-ил]окси] гексановой кислоты. а) 3-(5-Метокси-2-нитрофенил)аминобензонитрил. 2 г 3-фтор-4-нитроанизола и 15 мл 3-аминобензонитрила перемешивают в течение 65 ч при 140 С. После этого смесь разбавляют этилацетатом, трижды промывают водой и однократно насыщенным раствором хлорида натрия, сушат над сульфатом натрия, концентрируют в вакууме и остаток хроматографируют на силикагеле, tпл 157-158C. б) 6-Метокси-1-(3-цианофенил)-2-фенил-1H-бензимидазол. Указанное соединение получают гидрированием 3-(5-метокси-2-нитрофенил)аминобензонитрила в соответствии с общей методикой 1 и последующей циклизацией с помощью триэтилортобензоата в соответствии с общей методикой 3. При циклизации в отличие от этой общей методики используют тетрагидрофуран в качестве растворителя, tпл 185-191C (разлож.). в) 6-Гидрокси-1-(3-цианофенил)-2-фенил-1H-бензимидазол. Указанное соединение получают химическим превращением 6-метокси-1-(3-цианофенил)-2-фенил 1H-бензимидазола в соответствии с общей методикой 7, tпл 216-218C. г) Метиловый эфир 6-1-(3-цианофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 6-гидрокси-1-(3-цианофенил)-2-фенил-1Hбензимидазола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 115-118C. Пример 30. Изопропиловый эфир 6-1-(3-цианофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 6-гидрокси-1-(3-цианофенил)-2-фенил-1Hбензимидазола с изопропиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 101-102 С. Пример 31. 6-1-(3-Цианофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-1-(3 цианофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9, tпл 99-101 С. Пример 32. Метиловый эфир 6-1-(4-цианофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. а) 4-(5-метокси-2-нитрофенил)аминобензонитрил. 2 г 3-фтор-4-нитроанизола и 15 мл 4-аминобензонитрила перемешивают в течение 22 ч при 140 С. После этого смесь разбавляют этилацетатом, трижды промывают 2 н. водной соляной кислотой, трижды водой и однократно насыщенным раствором хлорида натрия, сушат над сульфатом натрия, концентрируют в вакууме и остаток хроматографируют на силикагеле. 1= 8 Гц, 2 Н); 7,54 d (J = 8 Гц, 2 Н); 8,08 d (J = 8 Гц, 1H); 9,60 s (шир. сигнал) (1 Н). б) 6-Метокси-1-(4-цианофенил)-2-фенил-1H-бензимидазол. Указанное соединение получают гидрированием 4-(5-метокси-2-нитрофенил)аминобензонитрила в соответствии с общей методикой 1 и последующей циклизацией с помощью триэтилортобензоата в соответствии с общей методикой 3. При циклизации в отличие от этой общей методики используют тетрагидрофуран в качестве растворителя. 1 Н-ЯМР (CDC13):в част./млн = 3,82 s (3 Н); 6,72 d (J = 2 Гц, 1 Н); 7,00 dd (J = 8, 2 Гц, 1 Н); 7,30-7,49m (7 Н); 7,78 d (J = 8 Гц, 1 Н); 7,81 d (J = 8 Гц, 2 Н). в) 6-Гидрокси-1-(4-цианофенил)-2-фенил-1H-бензимидазол. Указанное соединение получают химическим превращением 6-метокси-1-(4-цианофенил)-2-фенил 1H-бензимидазола в соответствии с общей методикой 7, tпл 266-268C. г) Метиловый эфир 6-1-(4-цианофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 6-гидрокси-1-(4-цианофенил)-2-фенил-1Hбензимидазола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 145-148C. Пример 33. Изопропиловый эфир 6-1-(4-цианофенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 6-гидрокси-1-(4-цианофенил)-2-фенил-1Hбензимидазола с изопропиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 102-103 С. Пример 34. Метиловый эфир 6-1-(3-хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. а) 1-(3-Хлорфенил)-6-метокси-2-фенил-1H-бензимидазол. Указанное соединение получают восстановлением (3-хлорфенил)-(5-метокси-2-нитрофенил)амина(Belton, McInerney, Proc. R. Ir. Acad. Sect. В; 69: 21, 27 (1970 в соответствии с общей методикой 2 и по- 17006302 следующей циклизацией с помощью триэтилортобензоата в соответствии с общей методикой 3, tпл 140143 С. б) 1-(3-Хлорфенил)-6-гидрокси-2-фенил-1H-бензимидазол. Указанное соединение получают химическим превращением 6-метокси-1-(3-хлорфенил)-2-фенил 1H-бензимидазола в соответствии с общей методикой 6, tпл 210-214C. в) Метиловый эфир 6-1-(3-хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 1-(3-хлорфенил)-6-гидрокси-2-фенил-1Hбензимидазола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 101-105 С. Пример 35. Изопропиловый эфир 6-1-(3-хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 1-(3-хлорфенил)-6-гидрокси-2-фенил-1Hбензимидазола с изопропиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 107-112 С. Пример 36. 6-1-(3-Хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-1-(3-хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9. 1H-ЯМР (D6-ДМСО):в част./млн = 1,36-1,78 m (6H); 2,24 t (J = 7,5 Гц, 2 Н); 3,96 t (J = 7,5 Гц, 2 Н); 6,68 d (J = 2 Гц, Ш); 6,97 dd (J = 8, 2 Гц, 1 Н); 7,32-7,65 m (9 Н); 7,69 d (J = 8 Гц, 1 Н). Пример 37. 6-1-(3-Хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексан-1-ол. Указанное соединение получают химическим превращением метилового эфира 6-1-(3-хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 11. 1d (J = 2 Гц, 1 Н); 6,97 dd (J = 8, 2 Гц, 1 Н); 7,18 ddd (J = 8, 2, 2 Гц, 1 Н); 7,25-7,55 m (8 Н); 7,76 d (J = 8 Гц,1 Н). Пример 38. Метиловый эфир 6-1-(4-хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. а) 1-(4-Хлорфенил)-6-метокси-2-фенил-1H-бензимидазол. Указанное соединение получают восстановлением (4-хлорфенил)-(5-метокси-2-нитрофенил)аминаm (5H); 7,46-7,55 m (4H); 7,77 d (J - 8 Гц, 1 Н). б) 1-(4-Хлорфенил)-6-гидрокси-2-фенил-1H-бензимидазол. Указанное соединение получают химическим превращением 6-метокси-1-(4-хлорфенил)-2-фенил 1H-бензимидазола в соответствии с общей методикой 6. 1H-ЯМР (D6-ДМСО):в част./млн = 6,60 d (J = 2 Гц, 1H); 6,87 dd (J = 8, 2 Гц, 1H); 7,40-7,56 m (7 Н); 7,64 d (J = 8 Гц, 1 Н); 7,70 d (J = 8 Гц, 2 Н); 9,50 s (шир. сигнал) (1H). в) Метиловый эфир 6-1-(4-хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 1-(4-хлорфенил)-6-гидрокси-2-фенил-1Hбензимидазола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8,tпл 100-104 С. Пример 39. Изопропиловый эфир 6-1-(4-хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 1-(4-хлорфенил)-6-гидрокси-2-фенил-1Hбензимидазола с изопропиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 83-88C. Пример 40. 6-1-(4-Хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-1-(4-хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9. 1H-ЯМР (D6-ДМСО)в част./млн = 1,35-1,78 m (6H); 2,25 t (J = 7,5 Гц, 2 Н); 3,94 t (J = 7,5 Гц, 2 Н); 6,68 d (J = 2 Гц, 1 Н); 6,95 dd (J = 8, 2 Гц, 1 Н); 7,33-7,54 m (7 Н); 7,63 d (J = 8 Гц, 2 Н); 7,69 d (J = 8 Гц, 1 Н). Пример 41. 6-1-(4-Хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексан-1-ол. Указанное соединение получают химическим превращением метилового эфира 6-1-(4-хлорфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 11, tпл 115-120 С. Пример 42. Метиловый эфир 6-1-(2-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. а) 5-Хлор-2-нитрофенил-о-толиламин. К раствору 10 г 1-хлор-3,4-динитробензола в 50 мл этанола добавляют 81 мл о-толуидина и в течение 72 ч кипятят с обратным холодильником. Далее концентрируют в вакууме и остаток растворяют в- 18006302 этилацетате и 2 н. водной соляной кислоте. Органическую фазу еще трижды экстрагируют 2 н. водной соляной кислотой, сушат над сульфатом натрия и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле. 1 Н-ЯМР (CDCl3):в част./млн = 2,28 s (3 Н); 6,70 dd (J = 10, 2 Гц, 1 Н); 6,80 d (J = 2 Гц, 1 Н); 7,22-7,40m (4 Н); 8,18 d (J = 10 Гц, 1 Н); 9,40 s (шир. сигнал) (1H). б) 5-Метокси-2-нитрофенил-о-толиламин. К раствору 1 г натрия в 20 мл метанола добавляют 1 г 5-хлор-2-нитрофенил-о-толиламина и в течение 72 ч кипятят с обратным холодильником. Затем охлаждают до 0 С и кристаллический продукт отделяют вакуум-фильтрацией. 1H-ЯМР (CDCl3):в част./млн = 2,30 s (3 Н); 3,72 s (3 Н); 6,19 d (J = 2 Гц, 1H); 6,32 dd (J = 10, 2 Гц,1 Н); 7,20-7,40 m (4 Н); 8,20 d (J = 10 Гц, 1H); 9,62 s (шир. сигнал) (1 Н). в) 6-Метокси-1-(2-метилфенил)-2-фенил-1H-бензимидазол. Указанное соединение получают химическим превращением 5-метокси-2-нитрофенил-о-толиламина в соответствии с общей методикой 1 и последующей циклизацией с помощью триэтилортобензоата в соответствии с общей методикой 3. 1H-ЯМР (CDCl3):в част./млн = 1,93 s (3 Н); 3,78 s (3 Н); 6,42 d (J = 2 Гц, 1H); 6,97 dd (J = 8, 2 Гц,1H); 7,22-7,48 m (7H); 7,57 dd (J = 8, 1 Гц, 2 Н); 7,78 d (J = 8 Гц, 1 Н). г) Метиловый эфир 6-1-(2-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. 6-Метокси-1-(2-метилфенил)-2-фенил-1H-бензимидазол подвергают химическому превращению в соответствии с общей методикой 6. Сырой продукт подвергают взаимодействию с метиловым эфиром 6 бромгексановой кислоты в соответствии с общей методикой 8. 1H-ЯМР (CDCl3):в част./млн = 1,43-1,58 m (2H); 1,62-1,84 m (4H); 1,93 s (3 Н); 2,34 t (J = 7,5 Гц,2 Н); 3,68 s (3 Н); 3,90 t (J = 7,5 Гц, 2 Н); 6,42 d (J = 2 Гц, 1 Н); 6,96 dd (J = 8, 2 Гц, 1 Н); 7,22-7,48 m (7 Н); 7,56 dd (J = 8, 1,5 Гц, 2 Н); 7,76 d (J= 8 Гц, 1H). Пример 43. 6-1-(2-Метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-1-(2-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9, Tпл 198-200 С. Пример 44. Метиловый эфир 6-1-(3-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. а) 5-Хлор-2-нитрофенил-м-толиламин. К раствору 50 г 1-хлор-3,4-динитробензола в 250 мл этанола добавляют 81 мл м-толуидина и раствор оставляют стоять в течение 72 ч. Далее реакционную смесь фильтруют и кристаллизат промывают холодным этанолом и 2 н. водной соляной кислотой. Продукт очищают хроматографией на силикагеле. 1H-ЯМР (CDCl3):в част./млн = 2,40 s (3 Н); 6,72 dd (J = 10, 2 Гц, 1 Н); 7,04-7,13 m (3 Н); 7,14 d (J = 2 Гц, 1 Н); 7,32 t (J = 10 Гц, 1 Н); 8,18 d (J = 10 Гц, 1 Н); 9,52 s (шир. сигнал) (1 Н). б) 5-Метокси-2-нитрофенил-м-толиламин. К раствору 9 г натрия в 670 мл метанола добавляют 39 г 5-хлор-2-нитрофенил-м-толиламина и в течение 72 ч кипятят с обратным холодильником. Затем смесь охлаждают до 0 С и кристаллический продукт отделяют вакуум-фильтрацией. 1H-ЯМР (CDCl3):в част./млн = 2,40 s (3 Н); 3,73 s (3 Н); 6,33 dd (J = 10, 2 Гц, 1H); 6,58 d (J = 2 Гц,1 Н); 7,03-7,15 m (3 Н); 7,31 t (J = 10 Гц, 1H); 8,19 d (J = 10 Гц, 1 Н); 9,72 s (шир. сигнал) (1 Н). в) 6-Метокси-1-(3-метилфенил)-2-фенил-1H-бензимидазол. Указанное соединение получают химическим превращением 5-метокси-2-нитрофенил-м-толиламина в соответствии с общей методикой 1 и последующей циклизацией с помощью триэтилортобензоата в соответствии с общей методикой 3. 1H-ЯМР (CDCl3):в част./млн = 2,42 s (3 Н); 3,81 s (3 Н); 6,69 d (J = 2 Гц, 1 Н); 7,03 dd (J = 8, 2 Гц,1 Н); 7,10-7,18 m (2H); 7,30-7,48 m (5H); 7,62 dd (J = 8, 1 Гц, 2 Н); 7,89 d (J = 8 Гц, 1 Н). г) 6-Гидрокси-1-(3-метилфенил)-2-фенил-1H-бензимидазол. Указанное соединение получают химическим превращением 6-метокси-1-(3-метилфенил)-2-фенил 1H-бензимидазола в соответствии с общей методикой 6. 1(J = 8 Гц, 1 Н); 7,28 s (шир. сигнал) (Ш); 7,32-7,55 m (7 Н); 7,59 d (J = 8 Гц, 1 Н); 9,37 s (шир. сигнал) (1 Н). д) Метиловый эфир 6-1-(3-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 6-гидрокси-1-(3-метилфенил)-2-фенил-1Hбензимидазола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8. 1- 19006302 Указанное соединение получают взаимодействием 6-гидрокси-1-(3-метилфенил)-2-фенил-1Hбензимидазола с изопропиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8. 1dd (J = 8, 2 Гц, 1H); 7,10 d (J = 8 Гц, 1H); 7,14 s (шир. сигнал) (Ш); 7,25-7,41 m (4H); 7,54 dd (J = 8, 1 Гц,2 Н); 7,75 d (J = 8 Гц, 1 Н). Пример 46. 6-1-(3-Метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-1-(3-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9. 1(J = 2 Гц, 1 Н); 6,87 d (шир. сигнал) (J = 8 Гц, 1 Н); 7,15 d (J = 8 Гц, 2 Н); 7,20-7,32 m (4H); 7,42-7,50 m (2H); 7,59 d (J = 8 Гц, 1H); 7,77d(J = 8 Гц, 1H). Пример 47. 6-1-(3-Метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексан-1-ол. Указанное соединение получают химическим превращением метилового эфира 6-1-(3 метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 11. 1H-ЯМР (CDCl3):в част./млн = 1,40-1,85 m (8H); 2,40 s (3 Н); 3,68 t (J = 7,5 Гц, 2 Н); 3,96 t (J = 7,5 Гц, 2 Н); 6,69 d (J = 1,5 Гц, 1 Н); 6,96 dd (J = 8, 1,5 Гц, 1 Н); 7,10 d (J = 8 Гц, 1 Н); 7,13 s (шир. сигнал) (1H); 7,25-7,42 m (5H); 7,54 dd (J = 8, 1 Гц, 2 Н); 7,76 d (J = 8 Гц, 1 Н). Пример 48. Метиловый эфир 6-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. а) 5-Хлор-2-нитрофенил-n-толиламин. Указанное соединение получают аналогично 5-хлор-2-нитрофенил-м-толиламину из 1-хлор-3,4 динитробензола и n-толуидина. Продукт очищают кристаллизацией. 1= 10 Гц, 2 Н); 7,28 d (J = 10 Гц, 2 Н); 8,18 d (J = 10 Гц, 1 Н); 9,50 s (шир. сигнал) (1 Н). б) 5-Метокси-2-нитрофенил-n-толиламин. Указанное соединение получают аналогично 5-метокси-2-нитрофенил-м-толиламину из 5-хлор-2 нитрофенил-n-толиламина и этанолята натрия. 1H-ЯМР (CDCl3):в част./млн = 2,39 s (3 Н); 3,72 s (3 Н); 6,31 dd (J = 10, 2 Гц, 1 Н); 6,50 d (J = 2 Гц,1 Н); 7,19 d (J = 10 Гц, 2 Н); 7,25 d (J = 10 Гц, 2 Н); 8,19 d (J = 10 Гц, 1 Н); 9,70 s (шир. сигнал) (1 Н). в) 6-Метокси-1-(4-метилфенил)-2-фенил-1H-бензимидазол. Указанное соединение получают химическим превращением 5-метокси-2-нитрофенил-n-толиламина в соответствии с общей методикой 1 и последующей циклизацией с помощью триэтилортобензоата в соответствии с общей методикой 3. 1H-ЯМР (CDC13):в част./млн = 2,49 s (3 Н); 3,80 s (3 Н); 6,69 d (J = 2 Гц, 1 Н); 6,97 dd (J = 8, 2 Гц,1 Н); 7,20 d (шир. сигнал) (J = 8 Гц, 2 Н); 7,25-7,36 m (5 Н); 7,53 dd (J = 8, 1 Гц, 2 Н); 7,76 d (J = 8 Гц, 1 Н). г) 6-Гидрокси-1-(4-метилфенил)-2-фенил-1 H-бензимидазол. Указанное соединение получают химическим превращением 6-метокси-1-(4-метилфенил)-2-фенил 1H-бензимидазола в соответствии с общей методикой 6. 1(J = 8 Гц, 2 Н); 7,32-7,43 m ( 5 Н); 7,46-7,52 m (2H); 7,56 d (J = 8 Гц, 1 Н); 9,28 s (шир. сигнал) (1 Н). д) Метиловый эфир 6-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 6-гидрокси-1-(4-метилфенил)-2-фенил-1Hбензимидазола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8. 1(3 Н); 3,68 s (3 Н); 3,94 t (J = 7,5 Гц, 2 Н); 6,69 d (J = 2 Гц, 1 Н); 6,96 dd (J = 8, 2 Гц, 1 Н); 7,19 d (J = 8 Гц, 2 Н); 7,28-7,38 m (5H); 7,55 dd (J = 8, 1 Гц, 2 Н); 7,75 d (J = 8 Гц, 1 Н). Пример 49. Изопропиловый эфир 6-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 6-гидрокси-1-(4-метилфенил)-2-фенил-1Hбензимидазола с изопропиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8. 1 Н-ЯМР (CDCl3):в част./млн = 1,22 d (J = 7,5 Гц, 6 Н); 1,44-1,56 m (2H); 1,62-1,85 m (4 Н); 2,30 t (J = 7,5 Гц, 2 Н); 2,47 s (3 Н); 3,93 t (J = 7,5 Гц, 2 Н); 5,01 sp (J = 7,5 Гц, 1 Н); 6,68 d (J = 2 Гц, 1 Н); 6,96 dd (J = 8,2 Гц, 1 Н); 7,20 d (J = 8 Гц, 2 Н); 7,26-7,36 m (5 Н); 7,55 dd (J = 8, 1 Гц, 2 Н); 7,75 d (J = 8 Гц, 1 Н). Пример 50. 6-1-(4-Метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-1-(4 метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9, tпл 186-190 С. Пример 51. 6-1-(4-метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексан-1-ол.- 20006302 Указанное соединение получают химическим превращением метилового эфира 6-1-(4 метилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 11. 1a) 3-(3,4-Диметилфенил)амино-4-нитрофенол. 3 г 3-фтор-4-нитрофенола смешивают с 6,9 г 3,4-диметиланилина и перемешивают в течение 2 ч при 150 С. После охлаждения растворяют в дихлорметане и шестикратно экстрагируют 1 н. водной соляной кислотой. Органическую фазу отбрасывают, а объединенные водные фазы трижды экстрагируют хлороформом. Объединенные экстракты сушат над сульфатом натрия, концентрируют в вакууме и остаток хроматографируют на силикагеле. 1H-ЯМР (CDCl3/D6MCO):в част./млн = 2,18 s (6H); 6,13 dd (J = 8, 2 Гц, 1 Н); 6,36 d (J = 2 Гц, 1H); 6,90-7,00 m (2 Н); 7,09 d (J = 8 Гц, 1 Н); 7,93 d (J = 8 Гц, 1 Н); 9,50 s (шир. сигнал) (1 Н); 10,19 s (шир. сигнал) (1 Н). б) Метиловый эфир 6-[3-(3,4-диметилфенил)амино-4-нитрофенил]оксигексановой кислоты. Указанное соединение получают взаимодействием 3-(3,4-диметилфенил)амино-4-нитрофенола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8. 1H-ЯМР (CDCl3):в част./млн = 1,38-1,52 m (2H); 1,59-1,80 m (4H); 2,30 s (6 Н); 2,33 t (J = 7,5 Гц,2 Н); 3,68 s (3 Н); 3,87 t (J = 7,5 Гц, 2 Н); 6,28 dd (J = 8, 2 Гц, 1 Н); 6,48 d (J = 2 Гц, 1 Н); 7,04 d (J = 8 Гц, 1 Н); 7,06 s (шир. сигнал) (1 Н); 7,18 d (J = 8 Гц, 1H); 8,17 d (J = 8 Гц, 1 Н); 9,71 s (шир. сигнал) (1 Н). в) Метиловый эфир 6-1-(3,4-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают химическим превращением метилового эфира 6-[3-(3,4 диметилфенил)амино-4-нитрофенил]оксигексановой кислоты в соответствии с общей методикой 1 и последующей циклизацией с помощью триэтилортобензоата в соответствии с общей методикой 3. 1= 8, 1,5 Гц, 1 Н); 7,09 s (шир. сигнал) (1H); 7,22-7,35 m (4H); 7,57 dd (J = 8, 1,5 Гц, 2H); 7,76 d (J = 8 Гц,1 Н). Пример 53. 6-1-(3,4-Диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-1-(3,4 диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9, tпл 158-161C. Пример 54. Метиловый эфир 6-1-(3,5-диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. а) 3-(3,5-диметилфенил)амино-4-нитрофенол. 5,4 г 3-фтор-4-нитрофенола смешивают с 4,3 мл 3,5-диметиланилина и перемешивают в течение 6 ч при 120 С. После охлаждения растворяют в этилацетате и воде и трижды экстрагируют 1 н. водной соляной кислотой. Объединенные водные фазы трижды экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия, концентрируют в вакууме и остаток кристаллизуют. 1 Н-ЯМР (D6-ДМСО):в част./млн = 2,30 s (6 Н); 6,28 dd (J = 8, 2 Гц, 1 Н); 6,49 d (J = 2 Гц, 1 Н); 6,52 d(J = 2 Гц, 1 Н); 6,90 s (шир. сигнал) (1 Н); 6,98 s (шир. сигнал) (2 Н); 8,04 d (J = 8 Гц, 1 Н); 9,51 s (шир. сигнал) (1 Н). б) Метиловый эфир 6-[3-(3,5-диметилфенил)амино-4-нитрофенил] оксигексановой кислоты. Указанное соединение получают взаимодействием 3-(3,5-диметилфенил)амино-4-нитрофенола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8. 1(1 Н); 6,91 s (шир. сигнал) (2 Н); 8,17 d (J = 8 Гц, 1H); 9,69 s (шир. сигнал) (1H). в) Метиловый эфир 6-[3-(3,5-диметилфенил)амино-4-нитрофенил]оксигексановой кислоты. Указанное соединение получают химическим превращением метилового эфира 6-[3-(3,5-диметилфенил)амино-4-нитрофенил]оксигексановой кислоты в соответствии с общей методикой 1 и последующей циклизацией с помощью триэтилортобензоата в соответствии с общей методикой 3, tпл 124-126 С. Пример 55. 6-1-(3,5-Диметилфенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-[3-(3,5 диметилфенил)амино-4-нитрофенил]оксигексановой кислоты в соответствии с общей методикой 9.- 21006302 гексановой кислоты. Указанное соединение получают взаимодействием 6-[3-(3,5-диметилфенил)амино-4-нитрофенил] оксигексановой кислоты с изопропанолом в соответствии с общей методикой 10, tпл 98-101C. Пример 57. Метиловый эфир 6-1-(3-метоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. а) 3-(3-Метоксифенил)амино-4-нитрофенол. 4 г 3-фтор-4-нитрофенола смешивают с 9,4 г м-анизидина и перемешивают в течение 2,5 ч при 150 С. После охлаждения растворяют в дихлорметане и трижды экстрагируют 1 н. водной соляной кислотой. Органическую фазу сушат над сульфатом натрия, концентрируют в вакууме и остаток хроматографируют на силикагеле. 1m (2 Н); 6,89 d (шир. сигнал) (J = 10 Гц, 1 Н); 7,32 t (J = 10 Гц, 1 Н); 8,19 d (J = 10 Гц, 1 Н); 9,68 s (шир. сигнал) (Ш); 9,69 s (шир. сигнал). б) Метиловый эфир 6-[3-(3-метоксифенил)амино-4-нитрофенил]оксигексановой кислоты. Указанное соединение получают взаимодействием 3-(3-метоксифенил)амино-4-нитрофенола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8. 1(3 Н); 3,80 s (3 Н); 4,03 t (J = 7,5 Гц, 2 Н); 6,32 dd (J = 10, 2 Гц, 1 Н); 6,59 d (J = 2 Гц, 1H); 6,68-6,84 m (2H); 6,90 d (шир. сигнал) (J = 8 Гц, 1H); 7,32 t (J = 8 Гц, 1 Н); 8,19 d (J = 10 Гц, 1 Н); 9,70 s (шир. сигнал) (1 Н). в) Метиловый эфир 6-1-(3-метоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают химическим превращением метилового эфира 6-[3-(3 метоксифенил)амино-4-нитрофенил]оксигексановой кислоты в соответствии с общей методикой 1 и последующей циклизацией с помощью триэтилортобензоата в соответствии с общей методикой 3. 1(3 Н); 3,78 s (3 Н); 3,95 t (J = 7,5 Гц, 2 Н); 6,71 d (J = 1,5 Гц, 1H); 6,83 dd (J = 1,5, 1,5 Гц, 1 Н); 6,90 dd (J = 8,1,5 Гц, 1 Н); 6,94 dd (J = 8, 1,5 Гц, 1H); 7,01 dd (J = 8, 1,5 Гц, 1 Н); 7,27-7,36 m (3 Н); 7,40 t (J = 8 Гц, 1 Н); 7,56 dd (J = 8, 2 Гц, 2 Н); 7,74 d (J = 8 Гц, 1 Н). Пример 58. 6-1-(3-Метоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-1-(3 метоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9, tпл 149-152 С. Пример 59. Метиловый эфир 6-1-(4-метоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. а) 3-(4-Метоксифенил)амино-4-нитрофенол. 0,16 г 3-фтор-4-нитрофенола смешивают с 0,37 г n-анизидина и перемешивают в течение 1,5 ч при 150 С. После охлаждения растворяют в дихлорметане, дважды экстрагируют 1 н. водной соляной кислотой и однократно насыщенным раствором хлорида натрия. Органическую фазу сушат над сульфатом натрия и концентрируют в вакууме. 1(шир. сигнал). б) Метиловый эфир 6-[3-(4-метоксифенил)амино-4-нитрофенил]оксигексановой кислоты. Указанное соединение получают взаимодействием 3-(4-метоксифенил)амино-4-нитрофенола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8. 1(3 Н); 3,85 t (J = 7,5 Гц, 2 Н); 3,88 s (3 Н); 6,29 dd (J = 10, 1,5 Гц, 1 Н); 6,30 d (J = 1,5 Гц, 1H); 6,98 d (J = 10 Гц, 2 Н); 7,20 d (J = 10 Гц, 2 Н); 8,18 d (J = 10 Гц, 1 Н); 9,63 s (шир. сигнал) (1 Н). в) Метиловый эфир 6-1-(4-метоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают химическим превращением метилового эфира 6-[3-(4-метоксифенил)амино-4-нитрофенил]оксигексановой кислоты в соответствии с общей методикой 1 и последующей циклизацией с помощью триэтилортобензоата в соответствии с общей методикой 3, tпл 98-102 С. Пример 60. 6-1-(4-метоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-1-(4-метоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9, tпл 160-165 С. Пример 61. Метиловый эфир 6-1-(3,4-диметоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. а) 3-(3,4-Диметоксифенил)амино-4-нитрофенол. 3 г 3-фтор-4-нитрофенола смешивают с 8,8 г 3,4-диметоксианилина и перемешивают в течение 2 ч- 22006302 при 150 С. После охлаждения растворяют в дихлорметане и дважды экстрагируют 1 н. водной соляной кислотой. Водную фазу дважды экстрагируют хлороформом и объединенные хлороформные экстракты сушат над сульфатом натрия и концентрируют в вакууме. 1s (шир. сигнал) (1 Н); 10,72 s (шир. сигнал). б) Метиловый эфир 6-[3-(3,4-диметоксифенил)амино-4-нитрофенил]оксигексановой кислоты. Указанное соединение получают взаимодействием 3-(3,4-диметоксифенил)амино-4-нитрофенола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8. 1 Н-ЯМР (CDCl3):в част./млн = 1,40-1,52 m (2H); 1,60-1,80 m (4H); 2,32 t (J = 7,5 Гц, 2 Н); 3,68 sd (J = 1,5 Гц, 1H); 6,87 dd (J = 10, 1,5 Гц, 1H); 6,92 d (J = 10 Гц, 1 Н); 8,18 d (J = 10 Гц, 1 Н); 9,68 s (шир. сигнал) (1 Н). в) Метиловый эфир 6-1-(3,4-диметоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают химическим превращением метилового эфира 6-[3-(3,4 диметоксифенил)амино-4-нитрофенил]оксигексановой кислоты в соответствии с общей методикой 1 и последующей циклизацией с помощью триэтилортобензоата в соответствии с общей методикой 3, tпл 116-118 С. Пример 62. 6-1-(3,4-Диметоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-1-(3,4 диметоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9, tпл 158-161oС. Пример 63. Метиловый эфир 6-1-[3,4-(метилендиокси)фенил]-2-фенил-1H-бензимидазол-6-ил] окси]гексановой кислоты. а) 3-(3,4-Метилендиоксифенил)амино-4-нитрофенол. 0,86 г 3-фтор-4-нитрофенола смешивают с 2,25 г 3,4-метилендиоксианилина и перемешивают в течение 5 ч при 120 С. Сырую смесь хроматографируют на силикагеле. 1dd (J = 8, 1,5 Гц, 1H); 6,87 d (J = 1,5 Гц, 1 Н); 7,05 d (J = 10 Гц, 1H); 8,18 d (J = 10 Гц, 1H); 9,52 s (шир. сигнал) (1 Н). б) Метиловый эфир 6-[3-(3,4-метилендиоксифенил)амино-4-нитрофенил]оксигексановой кислоты. Указанное соединение получают взаимодействием 3-(3,4-метилендиоксифенил)амино-4 нитрофенола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 108-111 С. в) Метиловый эфир 6-1-(3,4-метилендиоксифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают химическим превращением метилового эфира 6-[3-(3,4 метилендиоксифенил)амино-4-нитрофенил]оксигексановой кислоты в соответствии с общей методикой 1 и последующей циклизацией с помощью триэтилортобензоата в соответствии с общей методикой 3. 1 Н-ЯМР (CDC13):в част./млн = 1,43-1,55 m (2H); 1,65-1,82 m (4H); 2,35 t (J = 7,5 Гц, 2 Н); 3,68 s(3 Н); 3,95 t (J = 7,5 Гц, 2 Н); 6,10 s (2H); 6,65 d (J = 1,5 Гц, 1H); 6,72-6,83 m (2 Н); 6,90 d (J = 10 Гц, 1H); 6,93 dd (J = 10, 1,5 Гц, 1 Н); 7,29-7,38 m (3 Н); 7,52-7,62 m (2 Н); 7,72 d (J = 10 Гц, 1 Н). Пример 64. 6-1-[3,4-(метилендиокси)фенил]-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-1-(3,4 метилендиоксифенил)-2-фенил-1 H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9, tпл 130 С. Пример 65. Метиловый эфир 6-2-фенил-1-(3,4,5-триметоксифенил)-1H-бензимидазол-6-ил]окси] гексановой кислоты. а) 3-(3,4,5-Триметоксифенил)амино-4-нитрофенол. 3,7 г 3-фтор-4-нитрофенола смешивают с 4,76 г 3,4,5-триметоксианилина и перемешивают в течение 10 ч при 100 С. После охлаждения растворяют в этилацетате и воде и трижды экстрагируют этилацетатом. Объединенные органические фазы трижды экстрагируют 1 н. водной соляной кислотой и однократно насыщенным раствором хлорида натрия, сушат над сульфатом натрия и практически досуха концентрируют в вакууме. Продукт дигерируют диизопропиловым эфиром. 1 Н-ЯМР (D6-ДМСО):в част./млн = 3,70 s (3 Н); 3,80 s (6H); 6,28 dd (J = 10, 2 Гц, 1 Н); 6,53 d (J = 2 Гц, 1 Н); 6,70 s (2 Н); 8,05 d (J = 10 Гц, 1H); 9,50 s (шир. сигнал) (1 Н); 10,71 s (шир. сигнал). б) Метиловый эфир 6-[4-нитро-3-[(3,4,5-триметоксифенил)амино]фенил]оксигексановой кислоты. Указанное соединение получают взаимодействием 4-нитро-3-[(3,4,5-триметоксифенил)амино]фенола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8.s (2 Н); 8,18 d (J = 10 Гц, 1 Н); 9,68 s (шир. сигнал) (1 Н). в) Метиловый эфир 6-2-фенил-1-(3,4,5-триметоксифенил)-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают химическим превращением метилового эфира 6-[4-нитро-3-[(3,4,5 триметоксифенил)амино]фенил]оксигексановой кислоты в соответствии с общей методикой 1 и последующей циклизацией с помощью триэтилортобензоата в соответствии с общей методикой 3, tпл. 128130 С. Пример 66. 6-2-фенил-1-(3,4,5-триметоксифенил)-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-2-фенил-1(3,4,5-триметоксифенил)-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9, tпл 198-201C. Пример 67. Изопропиловый эфир 6-2-фенил-1-(3,4,5-триметоксифенил)-1H-бензимидазол-6-ил] окси]гексановой кислоты. Указанное соединение получают взаимодействием 6-2-фенил-1-(3,4,5-триметоксифенил)-1Hбензимидазол-6-ил]окси]гексановой кислоты с изопропанолом в соответствии с общей методикой 10,tпл 98-101C. Пример 68. Метиловый эфир 6-1-[4-(N,N-диметиламино)фенил]-2-фенил-1H-бензимидазол-6-ил] окси]гексановой кислоты. а) N,N-диметил-N'-(5-хлор-2-нитрофенил)бензол-1,4-диамин Указанное соединение получают аналогично 5-хлор-2-нитрофенил-м-толиламину из 1-хлор-3,4-динитробензола и N,N-диметил-n-фенилендиамина. 1H-ЯМР (CDCl3):в част./млн = 3,01 s (6 Н); 6,63 dd (J = 10, 2 Гц, 1 Н); 6,80 d (шир. сигнал) (J = 10 Гц, 2 Н); 6,97 d (J = 2 Гц, 1 Н); 7,14 d (J = 10 Гц, 2 Н); 8,14 d (J = 10 Гц, 1H); 9,42 s (шир. сигнал) (1 Н). б) N,N-Диметил-N'-(5-метокси-2-нитрофенил)бензол-1,4-диамин. 24,9 г N,N-диметил-N'-(5-хлор-2-нитрофенил)бензол-1,4-диамина добавляют к раствору из 8 г натрия в 200 мл метанола и смесь нагревают в автоклаве до 120 С и выдерживают при этой температуре в течение 9 ч. После охлаждения кристаллический продукт отделяют вакуум-фильтрацией. 1H-ЯМР (CDCl3):в част./млн = 3,00 s (6H); 3,70 s (3 Н); 6,25 dd (J = 10, 2 Гц, 1 Н); 6,34 d (J = 2 Гц,1 Н); 6,78 d (J = 10 Гц, 2 Н); 7,14 d (J = 10 Гц, 2 Н); 8,16 d (J = 10 Гц, 1 Н); 9,67 s (шир. сигнал) (1 Н). в) 6-Метокси-1-[4-(N,N-диметиламино)фенил]-2-фенил-1H-бензимидазол. Указанное соединение получают химическим превращением N,N-диметил-N'-(5-метокси-2 нитрофенил)бензол-1,4-диамина в соответствии с общей методикой 1, затем взаимодействием сырого диамина с триметилортобензоатом в соответствии с общей методикой 3 и последующим кипячением с обратным холодильником сырого продукта с 6 н. водной соляной кислотой в течение 1 ч. После подщелачивания реакционной смеси водным раствором едкого натра экстрагируют этилацетатом, сушат над сульфатом натрия и концентрируют в вакууме. 1 Н-ЯМР (CDCl3):в част./млн = 3,04 s (6H); 3,80 s (3 Н); 6,68 d (J = 2 Гц, 1H); 6,78 d (J = 10 Гц, 2 Н); 6,95 dd (J = 10, 2 Гц, 1 Н); 7,17 d (J = 10 Гц, 2 Н); 7,25-7,33 m (3 Н); 7,56-7,64 m (2H); 7,74 d (J = 10 Гц, 1 Н). г) 6-Гидрокси-1-[4-N,N-диметиламино)фенил]-2-фенил-1H-бензимидазол. Указанное соединение получают химическим превращением 6-метокси-1-[4-(N,N-диметиламино) фенил]-2-фенил-1H-бензимидазола в соответствии с общей методикой 6. 1 Н-ЯМР (D6-ДМСО):в част./млн = 2,98 s (6 Н); 6,48 d (J = 2 Гц, 1 Н); 6,78 dd (J = 10, 2 Гц, 1 Н); 6,83d (J = 10 Гц, 2 Н); 7,17 d (J = 10 Гц, 2 Н); 7,30-7,38 m ( 3 Н); 7,50-7,57 m (3 Н); 9,32 s (шир. сигнал) (1 Н). д) Метиловый эфир 6-1-[4-(N,N-диметиламино)фенил]-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 6-гидрокси-1-[4-(N,N-диметиламино)фенил]-2 фенил-1H-бензимидазола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8. 1(6 Н); 3,67 s (3 Н); 3,93 t (J = 7,5 Гц, 2 Н); 6,65 d (J = 2 Гц, 1H); 6,76 d (J = 10 Гц, 2 Н); 6,93 dd (J = 10, 2 Гц,1 Н); 7,14 d (J = 10 Гц, 2 Н); 7,23-7,27 m (3 Н); 7,62 dd (J = 10, 1,5 Гц, 2 Н); 7,74 d (J = 10 Гц, 1 Н). Пример 69. 6-1-[4-(N,N-диметиламино)фенил]-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-1-[4-(N,Nдиметиламино)фенил]-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9, tпл 210-213C. Пример 70. Метиловый эфир 6-1-(4-дифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. а) 5-Хлор-2-нитрофенил-4-дифениламин.- 24006302 Указанное соединение получают аналогично 5-хлор-2-нитрофенил-м-толиламину из 1-хлор-3,4 динитробензола и 4-дифениламина. Продукт очищают хроматографией на силикагеле. 1H-ЯМР (CDCl3):в част./млн = 6,76 dd (J = 10, 2 Гц, 1 Н); 7,26 d (J = 2 Гц, 1H); 7,35 d (J = 8 Гц, 1 Н); 7,32-7,52 m (4H); 7,60-7,72 m (4H); 8,19 d (J = 10 Гц, 1 Н); 9,60 s (шир. сигнал) (1 Н). б) 5-Метокси-2-нитрофенил-4-дифениламин. Указанное соединение получают аналогично 5-метокси-2-нитрофенил-м-толиламину из 5-хлор-2 нитрофенил-4-дифениламина и метанолята натрия, tпл 150-154 С. в) 1-(4-Дифенил)-6-метокси-2-фенил-1H-бензимидазол. Указанное соединение получают химическим превращением 5-метокси-2-нитрофенил-4-дифениламина в соответствии с общей методикой 1 и последующей циклизацией с помощью триэтилортобензоата в соответствии с общей методикой 3, tпл 140-144 С. г) 1-(4-Дифенил)-6-гидрокси-2-фенил-1H-бензимидазол. Указанное соединение получают химическим превращением 1-(4-дифенил)-6-метокси-2-фенил-1Hбензимидазола в соответствии с общей методикой 6, tпл 312 С. д) Метиловый эфир 6-1-(4-дифенил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 1-(4-дифенил)-6-гидрокси-2-фенил-1H-бензимидазола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 106108 С. Пример 71. 6-1-(4-Дифенил]-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-1-(4-дифенил)-2 фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9. 1(J = 10 Гц, 2 Н). Пример 72. Метиловый эфир 6-1-(2-нафтил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. а) 3-(2-Нафтиламино)-4-нитрофенол. 3 г 3-фтор-4-нитрофенола смешивают с 8,2 г 2-нафтиламина и перемешивают в течение 8 ч при 180 С. Далее сырую смесь растворяют в хлороформе и промывают 2 н. водной соляной кислотой. Органическую фазу сушат над сульфатом натрия и концентрируют в вакууме. Остаток хроматографируют на силикагеле. 1dd (J = 8, 1,5 Гц, 1 Н); 6,87 d (J = 1,5 Гц, 1 Н); 7,05 d (J = 10 Гц, 1 Н); 8,18 d (J = 10 Гц, 1 Н); 9,52 s (шир. сигнал) (1H). б) Метиловый эфир 6-[3-(2-нафтил)амино-4-нитрофенил]оксигексановой кислоты. Указанное соединение получают взаимодействием 3-(2-нафтиламино)-4-нитрофенола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8. 1H-ЯМР (CDCl3):в част./млн = 1,35-1,49 m (2H); 1,60-1,80 m (4H); 2,30 t (J = 7,5 Гц, 2 Н); 3,64 s(шир. сигнал) (1 Н). в) Метиловый эфир 6-1-(2-нафтил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают химическим превращением метилового эфира 6-[3-(2-нафтиламино)-4-нитрофенил]оксигексановой кислоты в соответствии с общей методикой 1 и последующей циклизацией с помощью триэтилортобензоата в соответствии с общей методикой 3, tпл 111-114C. Пример 73. 6-1-(2-Нафтил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-1-(2-нафтил)-2 фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9, tпл 170175 С. Пример 74. Метиловый эфир 6-1-(2-флуоренил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. а) 3-(2-Флуорениламино)-4-нитрофенол. 2,17 г 3-фтор-4-нитрофенола смешивают с 5 г 2-аминофлуорена и перемешивают в течение 9 ч при 140 С. Сырую смесь растворяют в этилацетате и воде и промывают 1 н. водной соляной кислотой. Водную фазу экстрагируют этилацетатом и объединенные органические фазы трижды промывают 2 н. водной соляной кислотой и однократно насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют в вакууме. Остаток хроматографируют на силикагеле. 1- 25006302 Указанное соединение получают взаимодействием 3-(2-флуорениламино)-4-нитрофенола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8. 1(J = 10 Гц, 1 Н); 9,87 s (шир. сигнал) (1 Н). в) Метиловый эфир 6-1-(2-флуоренил)-2-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают химическим превращением метилового эфира 6-[3-(2-флуоренил) амино)-4-нитрофенил]оксигексановой кислоты в соответствии с общей методикой 1 и последующей циклизацией с помощью триэтилортобензоата в соответствии с общей методикой 3, tпл 125-128C. Пример 75. Метиловый эфир 6-1-фенил-2-[3-(трифторметил)фенил]-1H-бензимидазол-6-ил]окси] гексановой кислоты. а) Гидрохлорид этил-(3-трифторметил)бензимидата. 9,7 мл 3-(трифторметил)бензонитрила растворяют в 12 мл этанола и этот раствор при охлаждении на ледяной бане барботируют до насыщения газообразным НС 1. Через 72 ч выпавший в осадок продукт отделяют вакуум-фильтрацией. Затем продукт промывают диэтиловым эфиром, tпл 131-133C (разлож.). б) 5-Метокси-2-нитрофенилдифениламин. Раствор 2 г 3-фтор-4-нитроанизола в 16 мл анилина перемешивают в течение 24 ч при 140 С. После охлаждения растворяют в этилацетате и экстрагируют 2 н. водной соляной кислотой. Органическую фазу сушат над сульфатом натрия и концентрируют в вакууме. Остаток хроматографируют на силикагеле. 1m (3 Н); 7,44 dd (J = 8, 8 Гц, 2 Н); 8,18 d (J = 10 Гц, 1 Н); 9,78 s (шир. сигнал) (1 Н). в) 4-Метокси-N2-фенил-о-фенилендиамин. Указанное соединение получают химическим превращением 5-метокси-2-нитрофенилдифениламина в соответствии с общей методикой 1. 1H-ЯМР (CDCl3):в част./млн = 3,42 s (шир. сигнал) (2 Н); 3,72 s (3 Н); 5,33 s (шир. сигнал) (1 Н); 6,56 dd (J = 10, 2 Гц, 1H); 6,76 d (J = 10 Гц, 1 Н); 6,79 d (J = 2 Гц, 1 Н); 6,82-6,90 m (3 Н); 7,25 dd (J = 8, 8 Гц,2 Н). г) 6-Метокси-1-фенил-2-[3-(трифторметил)фенил]-1 H-бензимидазол Указанное соединение получают взаимодействием 4-метокси-N2-фенил-о-фенилендиамина с гидрохлоридом этил-(3-трифторметил) бензимидата в соответствии с общей методикой 4, tпл 138-140 С. д) 6-Гидрокси-1-фенил-2-[3-(трифторметил)фенил]-1H-бензимидазол. Указанное соединение получают химическим превращением 6-метокси-1-фенил-2-[3-(трифторметил)фенил]-1H-бензимидазола в соответствии с общей методикой 7. 1(10 Н). е) Метиловый эфир 6-1-фенил-2-[3-(трифторметил)фенил]-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 6-гидрокси-1-фенил-2-[3-(трифторметил)фенил]1H-бензимидазола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8,tпл 68-70C. Пример 76. Изопропиловый эфир 6-1-фенил-2-[3-(трифторметил)фенил]-1H-бензимидазол-6-ил] окси]гексановой кислоты. Указанное соединение получают взаимодействием 6-гидрокси-1-фенил-2-[3-(трифторметил)фенил]1H-бензимидазола с изопропиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 96-98C. Пример 77. 6-1-Фенил-2-[3-(трифторметил)фенил]-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-1-фенил-2-[3(трифторметил)фенил]-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9. 1H-ЯМР (D6-ДМСО):в част./млн = 1,38-1,80 m (6H); 2,27 t (J = 7,5 Гц, 2 Н); 3,98 t (J = 7,5 Гц, 2 Н); 6,70 d (J = 2 Гц, 1 Н); 7,02 dd (J - 10, 2 Гц, 1 Н); 7,48-7,88 m (9 Н); 7,77 d (J = 10 Гц, 1 Н); 11,94 s (шир. сигнал) (1 Н). Пример 78. 6-1-Фенил-2-[3-(трифторметил)фенил]-1H-бензимидазол-6-ил]окси]гексан-1-ол. Указанное соединение получают химическим превращением метилового эфира 6-1-фенил-2-[3(трифторметил)фенил]-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 11. 1 Н-ЯМР (CDCl3):в част./млн = 1,38-1,68 m (6H); 1,75-1,87 m (2H); 3,60-3,72 m (2 Н); 3,94 t (J = 7,5 Гц, 2 Н); 6,69 d (J = 2 Гц, 1 Н); 6,99 dd (J = 10, 2 Гц, 1 Н); 7,25-7,35 m (2 Н); 7,40 dd (J = 8,8 Гц; 1 Н); 7,50-7,61- 26006302 Пример 79. Метиловый эфир 6-2-(3-хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. а) 2-(3-Хлорфенил)-6-метокси-1-фенил-1H-бензимидазол. Указанное соединение получают взаимодействием 4-метокси-N2-фенил-о-фенилендиамина с гидрохлоридом этил-3-хлорбензимидата (полученного по методу, описанному у DeWolfe и Augustine в J. Org.Chem., 30: 699) в соответствии с общей методикой 4, tпл 149-151C. б) 2-(3-хлорфенил)-6-гидрокси-1-фенил-1H-бензимидазол. Указанное соединение получают химическим превращением 2-(3-хлорфенил)-6-метокси-1-фенил 1H-бензимидазола в соответствии с общей методикой 7, tпл 199-202C. в) Метиловый эфир 6-2-(3-хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 2-(3-хлорфенил)-6-гидрокси-1-фенил-1Hбензимидазола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 69-72 С. Пример 80. Изопропиловый эфир 6-2-(3-хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 2-(3-хлорфенил)-6-гидрокси-1-фенил-1Hбензимидазола с изопропиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 98-100 С. Пример 81. 6-2-(3-Хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-2-(3-хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9,tпл 137-140 С. Пример 82. 6-2-(3-Хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексан-1-ол. Указанное соединение получают химическим превращением метилового эфира 6-2-(3-хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 11. 1H-ЯМР (CDCl3):в част./млн = 1,40-1,70 m (6H); 1,75-1,86 m (2H); 3,67 t (J= 7,5 Гц, 2 Н); 3,93 t (J = 7,5 Гц, 2 Н); 6,69 d (J = 2 Гц, 1H); 6,99 dd (J = 10, 2 Гц, 1H); 7,20 dd (J = 8,8 Гц; 1H); 7,26-7,38 m (4H); 7,477,58 m (3H); 7,60 dd (J = 2, 2 Гц, lH);7,76d(J=10 Гц, 1H). Пример 83. Метиловый эфир 6-2-(4-хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. а) Гидрохлорид этил-4-хлорбензимидата. 10 г 4-хлорбензонитрила суспендируют в 12 мл этанола и растворяют добавлением диэтилового эфира. При охлаждении на ледяной бане барботируют до насыщения газообразным НСl. Через 72 ч выпавший в осадок продукт отделяют вакуум-фильтрацией. Затем продукт промывают диэтиловым эфиром, tпл 173-174C (разлож.). б) 2-(4-Хлорфенил)-6-метокси-1-фенил-1H-бензимидазол. Указанное соединение получают взаимодействием 4-метокси-N2-фенил-о-фенилендиамина с гидрохлоридом этил-4-хлорбензимидата в соответствии с общей методикой 4, tпл 162-164 С. в) 2-(4-Хлорфенил)-6-гидрокси-1-фенил-1H-бензимидазол. Указанное соединение получают химическим превращением 2-(4-хлорфенил)-6-метокси-1-фенил 1H-бензимидазола в соответствии с общей методикой 7, tпл 246-250C. г) Метиловый эфир 6-2-(4-хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 2-(4-хлорфенил)-6-гидрокси-1-фенил-1Hбензимидазола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 86-87C. Пример 84. Изопропиловый эфир 6-2-(4-хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 2-(4-хлорфенил)-6-гидрокси-1-фенил-1Hбензимидазола с изопропиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 124-126 С. Пример 85. 6-2-(4-Хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-2-(4-хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9. 1 Н-ЯМР (D6-ДМСО)в част./млн = 1,35-1,48 m (2H); 1,50-1,62 m (2H); 1,64-1,77 m (2 Н); 2,23 t (J = 7,5 Гц, 2 Н); 3,91 t (J = 7,5 Гц, 2 Н); 6,64 d (J = 2 Гц, 1 Н); 6,96 dd (J = 10, 2 Гц, 1 Н); 7,38-7,50 m (6H); 7,527,65 m (3 Н); 7,70 d (J = 10 Гц, 1 Н). Пример 86. 6-2-(4-Хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексан-1-ол. Указанное соединение получают химическим превращением метилового эфира 6-2-(4 хлорфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 11. 1H-ЯМР (CDCl3):в част./млн = 1,38-1,68 m (6H); 1,74-1,85 m (2H); 3,67 t (шир. сигнал) (J = 7,5 Гц,- 27006302 2 Н); 3,94 t (J = 7,5 Гц, 2 Н); 6,68 d (J = 2 Гц, 1 Н); 6,98 dd (J = 10, 2 Гц, 1H); 7,22-7,35 m (5 Н); 7,47 d (J = 8 Гц; 2 Н); 7,49-7,59 m (2H); 7,73 d (7=10 Гц, 1 Н). Пример 87. Метиловый эфир 6-2-(3-метилфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. а) 6-Метокси-2-(3-метилфенил)-1-фенил-1H-бензимидазол. Указанное соединение получают взаимодействием 4-метокси-N2-фенил-о-фенилендиамина с гидрохлоридом этил-3-метилбензимидата (полученным по методу, описанному у DeWolfe и Augustine в J. Org.Chem., 30: 699) в соответствии с общей методикой 4, tпл 156-158C. б) 6-Гидрокси-2-(3-метилфенил)-1-фенил-1H-бензимидазол. Указанное соединение получают химическим превращением 6-метокси-2-(3-метилфенил)-1-фенил 1H-бензимидазола в соответствии с общей методикой 7. 1s (шир. сигнал) (3 Н); 7,35-7,52 m (3H); 7,50-7,63 m (4 Н); 9,28 s (шир. сигнал) (1 Н). в) Метиловый эфир 6-2-(3-метилфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 6-гидрокси-2-(3-метилфенил)-1-фенил-1Hбензимидазола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 82-84C. Пример 88. Изопропиловый эфир 6-2-(3-метилфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 6-гидрокси-2-(3-метилфенил)-1-фенил-1Hбензимидазола с изопропиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8. 1 Н-ЯМР (CDC13):в част./млн = 1,22 d (J = 7,5 Гц, 6 Н); 1,38-1,56 m (2H); 1,62-1,85 m (4 Н); 2,30 t (J= 7,5 Гц, 2 Н); 2,30 s (3 Н); 3,93 t (J = 7,5 Гц, 2 Н); 5,00 sp (J = 7,5 Гц, 1 Н); 6,68 d (J = 2 Гц, 1 Н); 6,95 dd (J = 10, 2 Гц, 1 Н); 7,13 s (шир. сигнал) (3 Н); 7,31 dd (J = 8, 2 Гц, 2 Н); 7,42-7,57 m (4 Н); 7,76 d (J = 10 Гц, 1 Н). Пример 89. 6-2-(3-Метилфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-2-(3 метилфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9. 1H-ЯМР (D6-ДМСО):в част./млн = 1,35-1,49 m (2H); 1,50-1,63 m (2H); 1,64-1,78 m (2 Н); 2,22 t (J = 7,5 Гц, 2 Н); 2,24 s (3 Н); 3,92 t (J = 7,5 Гц, 2 Н); 6,62 d (J = 2 Гц, 1 Н); 6,95 dd (J = 10, 2 Гц, 1 Н); 7,18 s (шир. сигнал) (3 Н); 7,37-7,42 m (3 Н); 7,51-7,65 m (3 Н); 7,67 d (J = 10 Гц, 1H); 11,90 s (шир. сигнал) (1 Н). Пример 90. 6-2-(3-Метилфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексан-1-ол. Указанное соединение получают химическим превращением метилового эфира 6-2-(3 метилфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9, tпл 92-94 С. Пример 91. Метиловый эфир 6-2-(4-метилфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. а) 6-Метокси-2-(4-метилфенил)-1-фенил-1H-бензимидазол. Указанное соединение получают взаимодействием 4-метокси-N2-фенил-о-фенилендиамина с гидрохлоридом этил-4-метилбензимидата (полученным по методу, описанному у DeWolfe и Augustine в J. Org.Chem., 30: 699) в соответствии с общей методикой 4, tпл 150-152 С. б) 6-Гидрокси-2-(4-метилфенил)-1-фенил-1H-бензимидазол. Указанное соединение получают химическим превращением 6-метокси-2-(4-метилфенил)-1-фенил-1H-бензимидазола в соответствии с общей методикой 7, tпл 257-264C. в) Метиловый эфир 6-2-(4-метилфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 6-гидрокси-2-(4-метилфенил)-1-фенил-1Hбензимидазола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 99-102 С. Пример 92. Изопропиловый эфир 6-2-(4-метилфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием 6-гидрокси-2-(4-метилфенил)-1-фенил-1Hбензимидазола с изопропиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 107-109C. Пример 93. 6-2-(4-Метилфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-2-(4-метилфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9. 1- 28006302 Указанное соединение получают химическим превращением метилового эфира 6-2-(4 метилфенил)-1-фенил-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 11, tпл 150-152 С. Пример 95. Метиловый эфир 6-1-фенил-2-(4-пиридинил)-1H-бензимидазол-6-ил]окси]гексановой кислоты. а) 6-Метокси-1-фенил-2-(4-пиридинил)-1H-бензимидазол. 0,4 г 4-метокси-N-фенил-о-фенилендиамина растворяют в 8 мл N,N-диметилформамида и полученный раствор смешивают с 0,7 г этил-2-этокси-1,2-дигидрохинолин-1-карбоксилата и 0,34 г изоникотиновой кислоты. Далее смесь перемешивают в течение 16 ч при 100 С, после охлаждения смешивают с водой, трижды экстрагируют этилацетатом, объединенные органические фазы промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют в вакууме. После хроматографической очистки на силикагеле амид растворяют в 5 мл 6 н. водной соляной кислоты и в течение 3 ч кипятят с обратным холодильником. После охлаждения примешивают к насыщенному раствору гидрокарбоната натрия, трижды экстрагируют этилацетатом, объединенные экстракты промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют в вакууме. 1m (2H); 7,42 dd (J = 8, 1,5 Гц, 2H); 7,54-7,62 m (3H); 7,79 d (J = 10 Гц, 1H); 8,53 d (шир. сигнал) (J = 6 Гц,2 Н). б) 6-Гидрокси-1-фенил-2-(4-пиридинил)-1H-бензимидазол. Указанное соединение получают химическим превращением 6-метокси-1-фенил-2-(4-пиридинил)1H-бензимидазола в соответствии с общей методикой 7. 1H-ЯМР (CD3OD):в част./млн = 6,52 d (J = 2 Гц, 1 Н); 6,82 dd (J = 10, 2 Гц, 1 Н); 7,28-7,33 m (2 Н); 7,39 dd (J = 8, 1,5 Гц, 2 Н); 7,49-7,57 m (4H); 8,40 d (шир. сигнал) (J = 6 Гц, 2 Н). в) Метиловый эфир 6-1-фенил-2-(4-пиридинил)-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают химическим превращением 6-гидрокси-1-фенил-2-(4-пиридинил)1H-бензимидазола в соответствии с общей методикой 8, tпл 100-103 С. Пример 96. 6-1-фенил-2-(4-пиридинил)-1H-бензимидазол-6-ил]окси]гексановая кислота. Указанное соединение получают химическим превращением метилового эфира 6-1-фенил-2-(4 пиридинил)-1H-бензимидазол-6-ил]окси]гексановой кислоты в соответствии с общей методикой 9, tпл 160-162 С. Пример 97. Метиловый эфир 6-[(1,2-дифенил-5-нитро-1H-бензимидазол-6-ил)окси]гексановой кислоты. а) 1,2-Дифенил-6-гидрокси-5-нитро-1H-бензимидазол. б) 1,2-Дифенил-6-гидрокси-7-нитро-1H-бензимидазол. в) 1,2-Дифенил-6-гидрокси-5,7-динитро-1H-бензимидазол. 5 г 1,2-дифенил-6-гидрокси-1H-бензимидазола растворяют в 45 мл ледяной уксусной кислоты и при 10-15 С смешивают, добавляя по каплям, с раствором 1,67 г нитрита натрия в 15 мл воды. Далее в течение 2 ч выдерживают на ледяной бане, а затем перемешивают в течение 2 ч при 20 С, после чего реакционную смесь концентрируют в вакууме и очищают хроматографией на силикагеле. а) 1H-ЯМР (CDCl3):в част./млн = 6,83 s (1H); 7,25-7,44 m (5H); 7,52-7,60 m (5H); 8,66 s (1H); 10,78s (1H). б) 1H-ЯМР (D6-ДМСО):в част./млн = 7,05 d (J = 10 Гц, 1 Н); 7,30-7,53 m (10 Н); 7,82 d (J - 10 Гц, 1 Н); 10,83 s (1H). в) 1H-ЯМР (D6-ДMCO):в част./млн = 7,32-7,58 m (10 Н); 8,67 s (1H). г) Метиловый эфир 6-[(1,2-дифенил-5-нитро-1H-бензимидазол-6-ил)окси]гексановой кислоты. Указанное соединение получают взаимодействием 1,2-дифенил-6-гидрокси-5-нитро-1Hбензимидазола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 123 С. Пример 98. Изопропиловый эфир 6-[(1,2-дифенил-5-нитро-1H-бензимидазол-6-ил)окси]гексановой кислоты. Указанное соединение получают взаимодействием 1,2-дифенил-6-гидрокси-5-нитро-1Hбензимидазола с изопропиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 115-117 С. Пример 99. Метиловый эфир 6-[(1,2-Дифенил-7-нитро-1H-бензимидазол-6-ил)окси]гексановой кислоты. Указанное соединение получают взаимодействием 1,2-дифенил-6-гидрокси-7-нитро-1H-бензимидазола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 110112 С. Пример 100. Изопропиловый эфир 6-[(1,2-дифенил-7-нитро-1H-бензимидазол-6-ил)окси]гексановой кислоты. Указанное соединение получают взаимодействием 1,2-дифенил-6-гидрокси-5-нитро-1H- 29006302 бензимидазола с изопропиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 88oC. Пример 101. Метиловый эфир 6-[(7-амино-1,2-дифенил-1H-бензимидазол-6-ил)окси]гексановой кислоты. 340 мг метилового эфира 6-[(1,2-дифенил-7-нитро-1H-бензимидазол-6-ил)окси]гексановой кислоты при 50 С и при нормальном давлении гидрируют в этаноле в присутствии никеля Ренея в автоклаве. По завершении процесса поглощения водорода катализатор отфильтровывают и продукт концентрируют в вакууме, tпл 113-115 С. Пример 102. Изопропиловый эфир 6-[(7-амино-1,2-дифенил-1H-бензимидазол-6-ил)окси]гексановой кислоты. Указанное соединение получают аналогично примеру 101 химическим превращением изопропилового эфира 6-[(1,2-дифенил-7-нитро-1H-бензимидазол-6-ил)окси]гексановой кислоты. 1(J = 7,5 Гц, 2 Н); 5,00 sp (J = 7,5 Гц, 1 Н); 6,97 d (J = 7,5 Гц, 1 Н); 7,20-7,33 m (4H); 7,42-7,53m (7H). Пример 103. Метиловый эфир 6-[(5,7-динитро-1,2-дифенил-1H-бензимидазол-6-ил)окси]гексановой кислоты. Указанное соединение получают взаимодействием 5,7-динитро-1,2-дифенил-6-гидрокси-1Hбензимидазола с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 88-91C. Пример 104. Изопропиловый эфир 6-[(5,7-динитро-1,2-дифенил-1H-бензимидазол-6-ил)окси]гексановой кислоты. Указанное соединение получают взаимодействием 5,7-динитро-1,2-дифенил-6-гидрокси-1Hбензимидазола с изопропиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 92-93C. Пример 105. Метиловый эфир 6-5-(ацетиламино)-1,2-дифенил-1H-бензимидазол-6-ил]окси] гексановой кислоты. а) 5-Фтор-2,4-динитрофенол. 0,41 г 1,3-дифтор-4,6-динитробензола растворяют в 8 мл 0,5 н. водного раствора едкого натра и в течение 2 ч кипятят с обратным холодильником. После охлаждения разбавляют водой и трижды экстрагируют диэтиловым эфиром. Величину рН водной фазы добавлением 1 н. соляной кислоты устанавливают на кислое значение и экстрагируют диэтиловым эфиром. Органическую фазу сушат над сульфатом натрия и концентрируют в вакууме. 1H-ЯМР (CDCl3):в част./млн = 7,10 d (J = 12 Гц, 1 Н); 9,03 d (J = 8 Гц, 1 Н); 11,10 s(1H). б) 2,4-Динитро-5-гидроксидифениламин. К суспензии 50 мг 5-фтор-2,4-динитрофенола в 0,5 мл этанола добавляют 100 мкл анилина, перемешивают в течение 30 мин и затем оставляют стоять в течение 15 ч. Затем твердое вещество отделяют вакуум-фильтрацией, промывают 1 н. водной соляной кислотой и сушат в вакууме. 1dd (J = 10,10 Гц, 2 Н); 9,20 s (1H); 9,90 s (шир. сигнал) (1 Н); 10,97 s (шир. сигнал) (1 Н). в) (2,4-Динитро-5-фениламино)фениловый эфир уксусной кислоты. К 275 мг 2,4-динитро-5-гидроксидифениламина в 1 мл пиридина добавляют 0,11 мл ангидрида уксусной кислоты, после чего перемешивают в течение 30 мин на ледяной бане, а затем еще в течение 1 ч при 20 С. После разбавления этилацетатом трижды промывают охлажденной льдом 1 н. водной соляной кислотой, однократно насыщенным раствором гидрокарбоната калия и однократно насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют в вакууме. 1H-ЯМР (CDCl3):в част./млн = 2,34 s (3 Н); 6,80 s (1H); 7,32 d (J = 10 Гц, 2 Н); 7,40 dd (J = 10, 10 Гц,1 Н); 7,52 dd (J = 10,10 Гц, 2 Н); 9,21 s (1H); 9,95 s (шир. сигнал) (1 Н). г) (1,2-дифенил-6-гидрокси-1H-бензимидазол-5-ил)амид уксусной кислоты. Указанное соединение получают химическим превращением (2,4-динитро-5-фениламино) фенилового эфира уксусной кислоты в соответствии с общей методикой 1 и последующим взаимодействием с триметилортобензоатом в соответствии с общей методикой 3. 1(1 Н); 8,43 s (шир. сигнал) (1 Н). д) Метиловый эфир 6-5-(ацетиламино)-1,2-дифенил-1H-бензимидазол-6-ил]окси]гексановой кислоты. Указанное соединение получают взаимодействием (1,2-дифенил-6-гидрокси-1H-бензимидазол-5 ил)амида уксусной кислоты с метиловым эфиром 6-бромгексановой кислоты в соответствии с общей методикой 8, tпл 128-130C. Пример 106. Изопропиловый эфир 6-[(5-амино-1,2-дифенил-1H-бензимидазол-6-ил)окси]гексановой кислоты. Указанное соединение получают химическим превращением изопропилового эфира 6-[(1,2- 30
МПК / Метки
МПК: A61K 31/415, A61P 25/28, C07D 235/18
Метки: заболеваний, связанных, микроглии, активацией, 1,2-диарилбензимидазолы, лечения
Код ссылки
<a href="https://eas.patents.su/30-6302-12-diarilbenzimidazoly-dlya-lecheniya-zabolevanijj-svyazannyh-s-aktivaciejj-mikroglii.html" rel="bookmark" title="База патентов Евразийского Союза">1,2-диарилбензимидазолы для лечения заболеваний, связанных с активацией микроглии</a>
Предыдущий патент: Ацильные производные, используемые для лечения опосредованных vla-4 расстройств
Следующий патент: Повышение эффективности сверхзвуковой сепарации текучей среды за счет инжекции распыляемого материала
Случайный патент: Игровой автомат












