Способ получения вируса или вирусного белка для получения вакцины
Номер патента: 6136
Опубликовано: 27.10.2005
Авторы: Схаутен Говерт Йохан, Ийтдехаг Альфонсус Герардус Корнелис Мария, Пау Мария Грация
Формула / Реферат
1. Способ получения вируса или вирусных белков, отличных от аденовируса или аденовирусных белков, для применения в качестве вакцины, включающий в себя введение в клетку последовательности, кодирующей по меньшей мере один продукт гена E1 аденовируса или его функциональное производное, и нуклеиновой кислоты, кодирующей вирус и/или вирусные белки, культивирование указанной клетки в подходящей среде, обеспечение возможности экспрессии вируса и/или вирусных белков и сбор указанного вируса и/или вирусных белков из культуральной среды и/или клетки.
2. Способ по п.1, где указанной клеткой является первичная клетка человека.
3. Способ по п.1 или 2, где указанная первичная клетка иммортализована продуктом гена E1.
4. Способ по любому из пп.1-3, где указанную клетку получают из ретинобласта эмбриона человека.
5. Способ по любому из пп.1-4, где указанная последовательность, кодирующая по меньшей мере один продукт гена E1, присутствует в геноме указанной клетки человека.
6. Способ по любому из пп.1-5, где указанная клетка не продуцирует структурные белки аденовируса.
7. Способ по любому из пп.1-6, где указанная клетка, дополнительно, содержит последовательность, кодирующую продукт гена E2A аденовируса, или его функциональное производное, аналог или фрагмент.
8. Способ по п.7, где указанная последовательность, кодирующая продукт гена E2A аденовируса, или его функциональное производное, аналог или фрагмент, присутствует в геноме указанной клетки человека.
9. Способ по любому из пп.7 или 8, где продукт гена E2A аденовируса является температурочувствительным.
10. Способ по любому из пп.1-9, где клетка не содержит других аденовирусных последовательностей.
11. Способ по любому из пп.1-10, где указанная клетка способна расти в суспензии.
12. Способ по любому из пп.1-11, где указанную клетку можно культивировать в отсутствие сыворотки.
13. Способ по любому из пп.1-12, где указанной клеткой человека является клетка PER.C6 ECACC 96022940 или производная от нее.
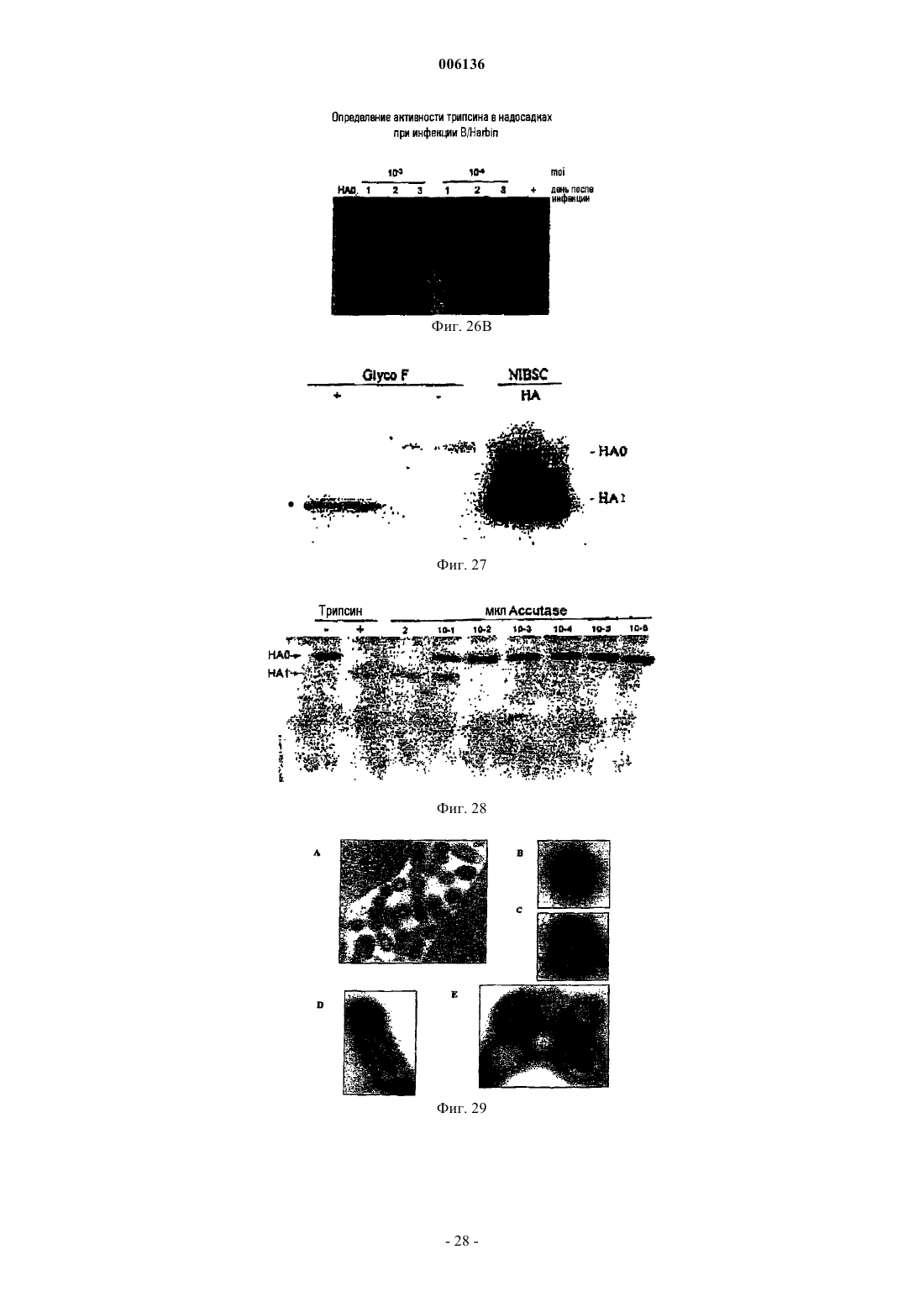
14. Способ по любому из пп.1-13, где указанные вирусные белки как сами по себе, так и в составе вируса, подвергаются посттрансляционным и/или перитрансляционным модификациям.
15. Способ по п.14, где указанные модификации включают в себя гликозилирование.
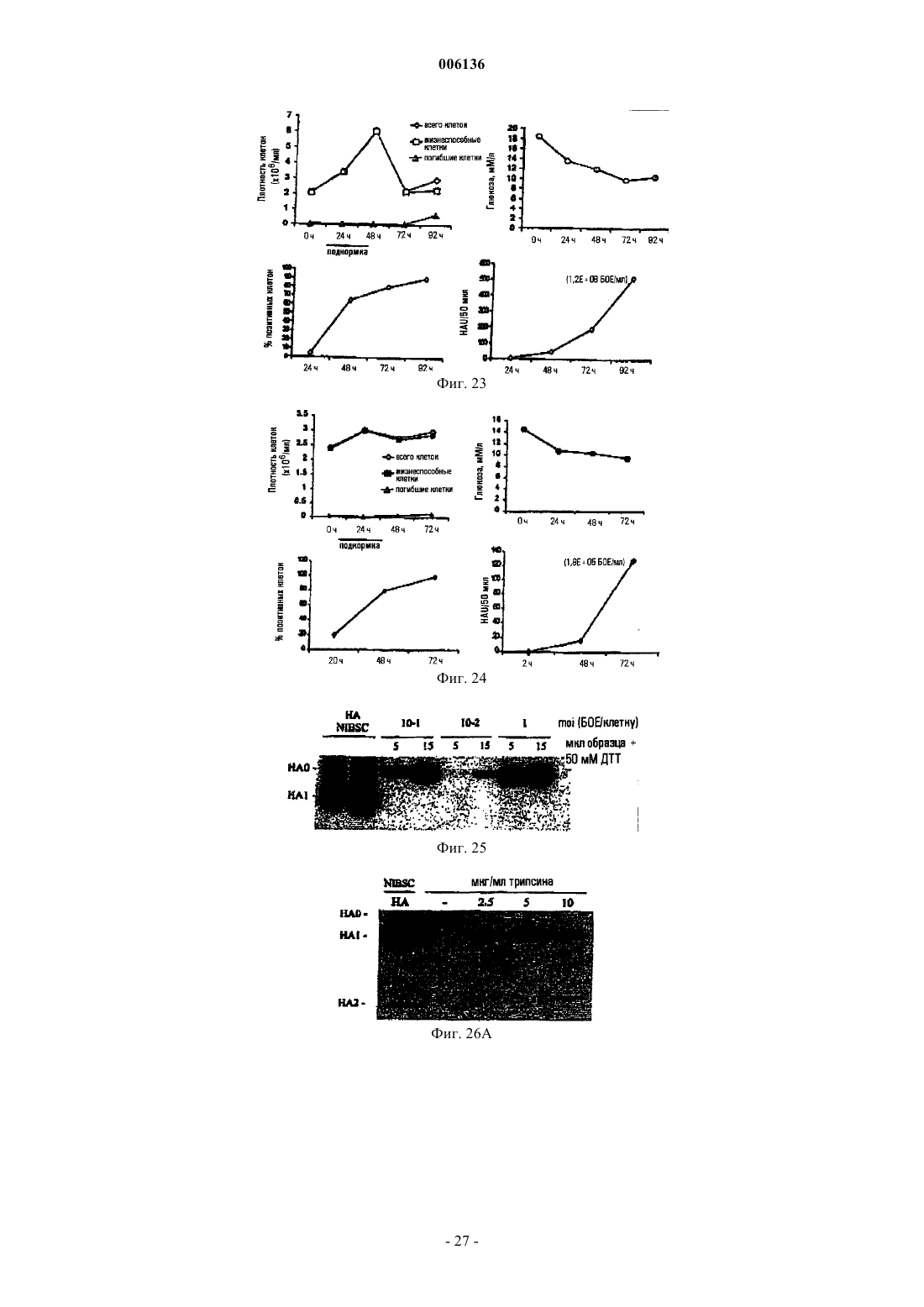
16. Способ по любому из пп.1-15, где по крайней мере одним из указанных вирусных белков является нейраминидаза и/или гемагглютинин вируса гриппа.
17. Способ по любому из пп.1-16, где указанный вирус является энтеровирусом, таким как риновирус, афтовирус или вирус полиомиелита.
18. Способ по любому из пп.1-16, где указанный вирус является вирусом герпеса, таким как вирус простого герпеса, вирус псевдобешенства или вирус коровьего бешенства.
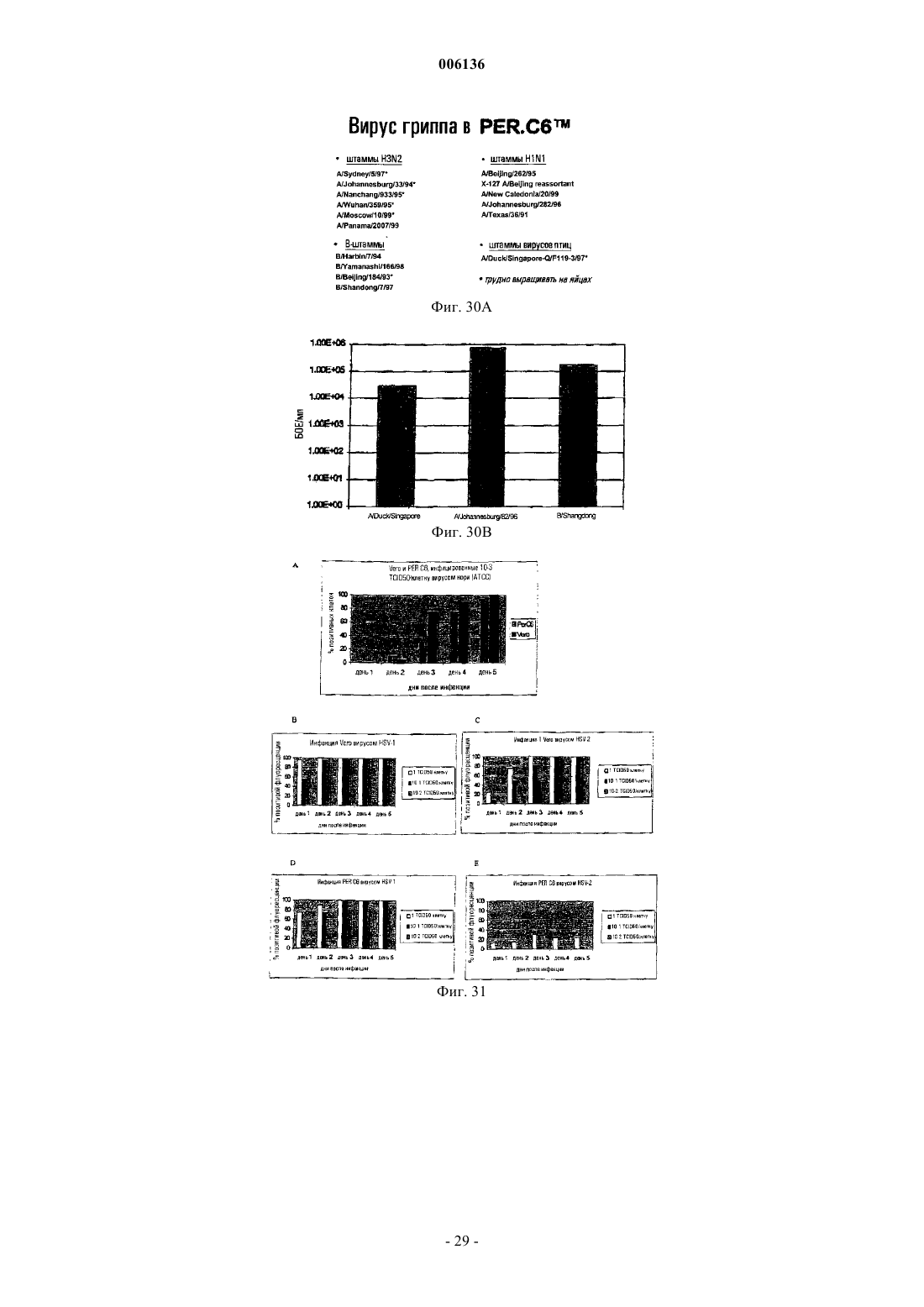
19. Способ по любому из пп.1-16, где указанный вирус является ортомиксовирусом, таким как вирус гриппа, или парамиксовирусом, таким как вирус ньюкаслской болезни, респираторно-синцитиальный вирус, вирус эпидемического паротита или вирус кори.
20. Способ по любому из пп.1-16, где указанный вирус является ретровирусом, таким как вирус иммунодефицита человека, или где указанный вирус является парвовирусом или паповавирусом.
21. Способ по любому из пп.1-16, где указанный вирус является ротавирусом или коронавирусом, таким как вирус инфекционного гастроэнтерита, или флавивирусом, таким как вирус клещевого энцефалита или вирус желтой лихорадки.
22. Способ по любому из пп.1-16, где указанный вирус является тогавирусом, таким как вирус краснухи или вирус восточного, западного или венесуэльского энцефаломиелита лошадей.
23. Способ по любому из пп.1-16, где указанный вирус является вирусом, вызывающим гепатит, таким как вирус гепатита A или гепатита B.
24. Способ по любому из пп.1-16, где указанный вирус является пестивирусом, таким как вирус холеры свиней, или рабдовирусом, таким как вирус бешенства.
25. Способ по любому из пп.1-16, где указанный вирус является буньявирусом, таким как хантавирус.
26. Применение клетки человека, содержащей в своем геноме последовательность, кодирующую по меньшей мере один продукт гена E1 аденовируса или его функциональное производное, причем указанная клетка не продуцирует структурных белков аденовируса, для получения вируса или вирусных белков, отличных от аденовируса или аденовирусных белков, для применения в качестве вакцины.
27. Применение по п.26, где указанную клетку человека получают из первичной клетки.
28. Применение по п.26 или 27, где указанная клетка является клеткой PER.C6 или производной от нее.
29. Применение по пп.26-28, где указанная клетка дополнительно содержит в своем геноме последовательность, кодирующую продукт гена E2A аденовируса, или его функциональное производное, аналог или фрагмент.
30. Применение по п.29, где продукт гена E2A аденовируса является температурочувствительным.
31. Клетка человека, содержащая в своем геноме последовательность, кодирующую по меньшей мере один продукт гена E1 аденовируса или его функциональное производное, причем указанная клетка не продуцирует структурных белков аденовируса и содержит нуклеиновую кислоту, кодирующую вирус, или по меньшей мере один белок вируса, не являющегося аденовирусом, где указанная клетка предназначена для получения вируса или вирусных белков, отличных от аденовируса или аденовирусных белков, для применения в качестве вакцины.
32. Клетка человека по п.31, которую получают из клетки PER.C6 ECACC 96022940.
33. Клетка человека по п.31 или 32, которая дополнительно содержит в своем геноме последовательность, кодирующую продукт гена E2A аденовируса или его функциональное производное, аналог или фрагмент.
34. Клетка человека по п.33, где продукт гена E2A является температурочувствительным.
Текст
006136 Область изобретения Данное изобретение относится к разработке и производству вакцин. В частности, изобретение относится к области получения вирусных белков и/или вирусов, более конкретно к применению клетки млекопитающих, предпочтительно клетки человека, для получения вирусов, растущих в эукариотических клетках, предпочтительно клетках млекопитающих, и, в частности, клетках человека. Изобретение особенно пригодно для получения вакцин с целью защиты от вирусных патогенов позвоночных, в частности млекопитающих, и особенно человека. В изобретении раскрыты средства и способы для получения вирусов и/или вирусного белка в клетке (человека), предпочтительно с использованием определенной синтетической среды, и для очистки вирусов и/или их компонентов от клетки и/или культуральной среды. Представлены фармацевтические композиции, содержащие вирус или его компоненты, и способы производства и их выделения и/или очистки. Предпосылка Вакцинация является одним из наиболее важных путей борьбы с вирусными инфекциями. Хотя имеется ряд антивирусных средств, обычно указанные средства обладают ограниченной эффективностью. Введение антител против вируса может быть хорошим средством борьбы с вирусными инфекциями в том случае, если человек инфицирован (пассивная иммунизация), и обычно человеческие или гуманизированные антитела кажутся перспективными для борьбы с рядом вирусных инфекций, но наиболее эффективным и безопасным способом борьбы с вирусной инфекцией является, и вероятно будет являться, профилактика посредством активных иммунизаций. Активную иммунизацию обычно называют вакцинацией, и вакцины содержат по меньшей мере одну антигенную детерминанту, обычно вируса, предпочтительно ряд различных антигенных детерминант по меньшей мере одного вируса или другого патогена, например, посредством включения в вакцину по меньшей мере одного (вирусного) полипептида или белка, полученного из вируса (субъединичные вакцины). Как правило, упоминаемые до настоящего времени формы содержат адъюванты для того, чтобы усилить иммунный ответ. Это также возможно для вакцин, основанных на целом вирусе (патогене), например, в инактивированной форме. Другая возможность заключается в применении живых, но аттенуированных форм патогенного вируса. Следующая возможность состоит в применении вируса дикого типа, например, в тех случаях, когда взрослым людям инфекция не угрожает, но для детей существует опасность инфекции, и их можно защитить с помощью материнских антител, и тому подобное. Получение вакцин не всегда является легкой процедурой. В некоторых случаях вирусный материал получают на основе яиц, что ведет к трудностям при очистке материала и широким мерам безопасности в отношении загрязнения и т.д. Получение на бактериях и/или дрожжах, которые иногда, но не всегда являются альтернативой яйцам, также требует много стадий очистки и обеспечения безопасности. Альтернативой может быть получение на основе клеток млекопитающих, но все используемые до настоящего времени клетки млекопитающих требуют для роста, например,присутствия сыворотки и/или адгезии на твердом носителе. В первом случае проблемой снова становится очистка и безопасность и, например, потребность в протеазе для поддержания репликации некоторых вирусов. Во втором случае дополнительно проблематичными являются высокие выходы и простота получения. Данное изобретение преодолевает, по меньшей мере, ряд проблем, встречающихся в случае продуцирующих систем для получения вирусов и/или вирусных белков в целях создания вакцин, характерных для систем предшествующего уровня техники. Подробное описание Данное изобретение относится к новой линии иммортализованных клеток человека, предназначенной для размножения и сбора вируса, для получения указанного вируса. Клетки PER.C6 (WO 97/00326) созданы посредством трансфекции первичных эмбриональных клеток сетчатки глаза человека с использованием плазмиды, которая содержала последовательности, кодирующие Е 1 А и Е 1 В Ad серотипа 5(Ad5) (нуклеотиды Ad5 459-3510) под контролем промотора фосфоглицераткиназы (PGK) человека. Следующие характеристики делают PER.C6 или ее производные особенно пригодными в качестве хозяина для получения вирусов: указанная линия является полностью охарактеризованной линией клеток человека, она разработана в соответствии с GLP, ее можно выращивать в суспензионных культурах в определенной бессывороточной среде, не содержащей никаких белков сыворотки человека или животных; она растет в роллерных флаконах, встряхиваемых колбах, вращающихся флаконах и биореакторах,со временем удвоения, примерно равным 35 ч. Эпидемиология гриппа Вирусы гриппа, представители семейства Orthomyxoviridae, являются возбудителями ежегодных эпидемий острого респираторного заболевания. Только в одних США 50 миллионов американцев ежегодно заболевают гриппом. Оцененное число случаев со смертельным исходом во всем мире (1972-1992) составляет 60000 (статистика CDC). Имели место 3 основных случая вспышки пандемии гриппа, а именно в 1918 г ("испанка", по оценкам 40 миллионов случаев со смертельным исходом), в 1957 г. (азиатский грипп, по оценкам 1 миллион случаев со смертельным исходом) и в 1968 г. (Гонконгский грипп, по оценкам 700000 случаев со смертельным исходом). Инфекции, вызванные вирусами гриппа, связаны с широким спектром заболеваний и осложнений, результатом которых является значительная доля заболе-1 006136 ваемости и смертности в мире, особенно среди пожилых людей и пациентов с хроническими заболеваниями. Вакцинация против гриппа наиболее эффективна для предотвращения зачастую смертельных осложнений, связанных с данной инфекцией (Murphy, B.R. and R.G. Webster 1996). Сообщалось о получении вируса гриппа на диплоидной линии клеток человека MRC-5 (Herrero-Euribe L. et al., 1983). Однако титры вируса гриппа недопустимо малы. Штаммы вируса гриппа В настоящее время вакцины против гриппа содержат очищенный гемагглютинин и нейраминидазу вируса гриппа А и В. Важными с эпидемиологической точки зрения штаммами являются 3 вируса гриппа A (H1N1), гриппа A (H3N2) и гриппа В. Разделение на типы А и В основано на антигенных различиях их нуклеопротеидов (NP) и антигенов белков матрикса (М). Вирусы гриппа А, кроме того, подразделяются на подтипы на основании антигенного состава (последовательности) молекул гемагглютинина (Н 1-Н 15) и нейраминидазы (N1-N9). Представителей каждого их указанных подтипов выделили из водоплавающих птиц, которые вероятно являются исходным источником всех вирусов гриппа видов птиц и млекопитающих. Выявлена передача между свиньями и человеком и недавно (H5N1) между птицами и людьми. Вакцины против гриппа В настоящее время в мире используют три типа инактивированной вакцины против гриппа: вакцины на основе целого вируса, продукта расщепления и поверхностного антигена или субъединицы. Все указанные вакцины содержат поверхностные гликопротеиды, гемагглютинин (НА) и нейраминидазу(NA) штаммов вируса гриппа, которые предположительно циркулируют в популяции человека в наступающем сезоне. Указанные штаммы, которые включают в состав вакцины, выращивают в эмбрионах куриных яиц и затем вирусные частицы очищают перед дальнейшей обработкой. Необходимость в ежегодной корректировке вакцин гриппа является следствием вариациями антигенов, вызванных процессами, известными как "антигенный дрейф" и "антигенный сдвиг"."Антигенный дрейф" происходит при накоплении серии точечных мутаций либо в Н-, либо в Nбелке вируса, приводящих к аминокислотным заменам. Указанные замены предотвращают связывание нейтрализующих антител, индуцированных предыдущей инфекцией, и новый вариант может инфицировать хозяина."Антигенный сдвиг" представляет собой появление нового подтипа в результате перераспределения генетического материала между вирусами гриппа А животных и человека. Пандемичные штаммы 1957(H2N2) и 1968 гг. (H3N2) являются примерами перераспределения материала вирусов, при котором гены Н или N птиц были интродуцированы в циркулирующие вирусы человека, которые впоследствии смогли распространиться в популяции человека. На основании эпидемиологических исследований более чем сотни национальных центров гриппа во всем мире Всемирная организация здравоохранения (ВОЗ) ежегодно рекомендует состав вакцины против гриппа, обычно в феврале для северного полушария и в сентябре для южного полушария. Данная практика ограничивает промежуток времени для получения и стандартизации вакцины максимально до 9 мес. В случае срочной потребности большого количества доз вакцины, например в том случае, когда возникает новый подтип вируса гриппа А в результате антигенного сдвига или антигенного дрейфа, наличие ограниченного количества яиц- может препятствовать быстрому получению вакцины. Дополнительным недостатком данной продуцирующей системы является отсутствие гибкости, риск наличия токсинов и риск наличия случайных вирусов, особенно ретровирусов, и проблемы со стерильностью. Это представляет серьезную проблему в современной практике производства вакцины против гриппа на эмбрионах куриных яиц. Вследствие этого применение системы культуры клеток для получения вакцины против гриппа было бы привлекательной альтернативой. Вирусы гриппа можно выращивать на ряде первичных клеток,включая клетки почки обезьян, почки теленка, почки хомячка и почки цыпленка. До сих пор применение этих клеток для производства вакцин не практиковалось из-за необходимости заново восстанавливать культуры из первичных клеток для каждого получения вакцины. Поэтому применение постоянных иммортализованных линий клеток для получения вакцины против гриппа является привлекательной альтернативой. Применению систем на основе культур способствовало выяснение того, что для инфекционности вируса гриппа требуется протеолитическое расщепление НА на две его субъединицы (НА 1 и НА 2), которого можно достичь при добавлении трипсина. Добавление трипсина дает возможность для репликации и образования бляшек в клетках почки собаки Madin-Darby (MDCK) (Tobita et al., 1975). Недавно показано, что линия клеток MDCK поддерживает рост вируса гриппа при получении вакцины (Brand et al., 1996 и 1997, Palache et al. 1997). Применение трипсина требует выращивания клетокMDCK в среде для культуры ткани без сыворотки (MDCK-SF1). Однако в настоящее время клеткиMDCK не одобрены в качестве субстрата для получения вируса гриппа. Важно, что любой системе, основанной не на клетках человека, для получения вакцин против гриппа свойственен недостаток, известный как "адаптация". Оба вируса гриппа А и В несут мутации в НА вследствие адаптации в эмбрионах куриных яиц. Указанные мутации приводят к измененной антигенно-2 006136 сти (Newman et al. 1993, Williams and Robertson 1993, Robertson et al. 1994, Gubareva et al. 1994, Schild etal. 1993, Robertson et al. 1987, Kodihalli et al. 1995). Иммунизация вакцинами, содержащими и несущими в НА мутацию в результате адаптации в яйцах, индуцирует у людей меньше нейтрализующих антител к вирусу, который содержит не адаптированный к яйцам НА (Newman et al. 1993). Вирусы гриппа человека, размноженные в клетках собак, таких как клетки MDCK, также проявляют адаптацию, хотя и в меньшей степени. Такие вирусы больше похожи на природные изоляты у человека, чем вирусы, полученные из яиц (Robertson et al. 1990). Кроме того, существует доказательство того, что специфичные для хозяина изменения в NA и специфичный для хозяина характер фосфорилирования NA могут влиять на репликацию вирусов гриппа(Schulman and Palese 1977; Sugiara and Ueda 1980; Kistner et al 1976). Вследствие этого очевидно, что предпочтительным было бы избежать адаптации или других индуцированных в хозяина изменений вируса гриппа. Это может привести к более гомогенной популяции вирусов и сделать конечную вакцину более эффективной. Поэтому объектом данного изобретения являются клетки человека в качестве субстрата для получения высоких титров вируса гриппа, подходящих для разработки вакцин. Ротавирус и ротавакцины Ротавирусы являются наиболее важной причиной тяжелых дегидратирующих гастроэнтеритов у маленьких детей во всем мире. В развивающихся странах инфекции ротавирусами ежегодно приводят к более 800000 случаям со смертельным исходом. В Соединенных Штатах по оценкам расходы здравоохранения из-за ротавирусных инфекций превышают 1 миллиард долларов США в год. Ротавирусы, члены семейства Reoviridae, представляют собой двунитевые РНК-вирусы, состоящие из 11 фрагментов РНК, каждый из которых кодирует структурный или неструктурный вирусный белок(VP). Внутреннее ядро вируса содержит четыре VP: VP1, 2, 3 и 6. VP определяют три основных антигенных свойства: HRV-группу, подгруппу и серотип. Идентифицировано семь отличающихся по антигенам групп (A-G), которые кодируются VP6. Инфекция ротавирусом человека (HRV) главным образом вызвана ротавирусами группы А с серотипами 1-4, являющимися причиной 95% клинических случаев заболевания. Естественная защита от заболевания специфична для серотипа. Группу А, кроме того, делят на подгруппы I и II. Двойной слой наружной оболочки, образующей капсид вируса, состоит из двух вирусных белков,VP4 и VP7, которые являются нейтрализуемыми антигенами, вовлеченными в защитный иммунитет, и которые определяют серотип, хотя VP4 играет меньшую роль в определении серотипа. Во время совместной инфекции разными серотипами сегментированные геномы легко подвергаются генетической пересортировке, свойство, которое использовали для создания вакцины (Marsha et al. 1999). В связи с широкой распространенностью во всем мире связанной с ротавирусами детской заболеваемости и смертности наиболее эффективным способом борьбы с указанным вирусом считается крупномасштабная вакцинация против ретровируса. Целью вакцинации было бы не предотвращение заболевания, а снижение его тяжести и осложнений, особенно в первые годы жизни. Единственной эффективной вакциной, доступной в настоящее время, является вводимая перорально живая аттенуированная вакцина, основанная на пересортировке фрагментов РНК ротавирусов человека, кодирующих VP7 серотипов 1, 2 и 4 в ротавирусе резус, обеспечивающем аттенуированный фон, сVP7 серотипа 3. Вакцинация указанной тетравалентной вакциной на основе пересортировки генов вирусов человека и макак-резус (RRV-TV), хотя и является высоко эффективной в предотвращении тяжелых гастроэнтеритов, связана с инвагинацией, болезнью непроходимости кишечника. По этой причине указанную вакцину уже больше не используют. Сущность изобретения Изобретение относится к способу получения вируса и/или вирусных белков, отличных от аденовируса или аденовирусных белков, для применения в качестве вакцины, включающему в себя введение в клетку, по меньшей мере, последовательности, кодирующей по меньшей мере один продукт гена Е 1 аденовируса или его функциональное производное, и нуклеиновой кислоты, кодирующей вирус или вирусные белки, культивирование указанной клетки в подходящей среде и обеспечение возможности размножения вируса или экспрессии вирусных белков и сбор указанного вируса и/или указанных вирусных белков из культуральной среды и/или клетки. До настоящего изобретения существовало немного, если и существовали, клеток (человека), которые считались подходящими для получения вирусов и/или вирусных белков для применения в качестве вакцин каким-либо воспроизводимым и масштабным способом и/или с достаточно высоким выходом,и/или легко поддающихся очистке. Авторы изобретения обнаружили, что клетки, которые содержат последовательности Е 1 аденовируса предпочтительно в их геноме, способны поддерживать размножение вирусов в значительных количествах. Предпочтительно клетку согласно изобретению получают из первичной клетки человека, предпочтительно клетки, которая иммортализована генным продуктом указанного гена Е 1. Для того, чтобы иметь возможность выращивать первичную клетку, ее, конечно, необходимо подвергнуть иммортализации. Хорошим примером такой клетки является клетка, полученная из ретинобласта эмбриона человека.-3 006136 Важно, чтобы в клетках согласно изобретению последовательности гена Е 1 не терялись в ходе клеточного цикла. Поэтому предпочтительно, чтобы указанная последовательность, кодирующая по меньшей мере один генный продукт гена Е 1, присутствовала в геноме указанной клетки (человека). По соображениям безопасности лучше позаботиться о том, чтобы избежать присутствия лишних аденовирусных последовательностей в клетках согласно изобретению. Таким образом, другим вариантом данного изобретения является подготовка клеток, которые не продуцируют структурных аденовирусных белков. Однако для того чтобы добиться крупномасштабного (непрерывного) получения вируса с помощью культуры клеток, предпочтительно иметь клетки, способные расти без необходимости в прикреплении. Клетки согласно данному изобретению обладают такой способностью. Для того чтобы получить чистую безопасную продуцирующую систему, из которой легко выделить и, при необходимости, очистить вирус,предпочтительно владеть способом согласно изобретению, при использовании которого указанная клетка не содержит других аденовирусных последовательностей. Наиболее предпочтительной клеткой для способов и применений изобретения является PER.C6, которая депонирована под 96022940 в ЕСАСС,или производные от нее. Таким образом, изобретение относится к способу, в котором используется клетка согласно изобретению, при этом указанная клетка, кроме того, содержит последовательность, кодирующую Е 2 А или его функциональное производное, аналог или фрагмент, предпочтительно клетка, в которой указанная последовательность, кодирующая Е 2 А или его функциональное производное, аналог или фрагмент, присутствует в геноме указанной клетки человека, и наиболее предпочтительно клетка, в которой указанная последовательность, кодирующая Е 2 А, кодирует чувствительный к температуре мутант Е 2 А. Кроме того, как указано, изобретение также относится к способу согласно изобретению, при котором указанная клетка (человека) способна расти в суспензии. Изобретение также относится к способу, при котором указанную клетку человека можно культивировать в отсутствие сыворотки. Клетки согласно изобретению, в частности PER.C6, обладают дополнительным преимуществом, состоящим в том, что их можно культивировать в отсутствие сыворотки или компонентов сыворотки. Таким образом, выделение является простым, достигается безопасность и система облает хорошей надежностью (синтетические среды являются наилучшими для размножения). Клетки человека согласно изобретению и, в частности, клетки, основанные на первичных клетках, и особенно клетки, основанные на клетках HER, способны осуществлять нормальные пост- и перитрансляционные модификации и сборку. Это означает, что они очень подходят для получения вирусных белков и вирусов для применения в вакцинах. Таким образом, изобретение относится к способу согласно изобретению, при котором указанный вирус и/или указанные вирусные белки содержат белок, который подвергается посттрансляционной и/или перитрансляционной модификации, особенно при котором указанные модификации включают в себя гликозилирование. Хорошим примером вирусной вакцины, которую было трудно получить какимлибо надежным способом, является вакцина против гриппа. Изобретение относится к способу согласно изобретению, при котором указанные вирусные белки включают в себя по меньшей мере один из белков- нейраминидазу и/или гемагглютинин вируса гриппа. Другие вирусные белки (субъединицы) и вирусы(дикого типа, которые необходимо инактивировать) или аттенуированные вирусы, которые можно получить способами согласно изобретению, включают энтеровирус, такой как риновирус, афтовирус или вирус полиомиелита, вирус герпеса, такой как вирус простого герпеса, вирус псевдобешенства или вирус герпеса коров, ортомиксовирус, такой как вирус гриппа, парамиксовирус, такой как вирус ньюкаслской болезни, вирус дыхательного синцития, вирус эпидемического паротита или вирус кори, ретровирус,такой как вирус иммунодефицита человека или парвовирус или паповавирус, ротавирус или коронавирус, такой как вирус инфекционного гастроэнтерита, или флавивирус, такой как вирус клещевого энцефалита или вирус желтой лихорадки, тогавирус, такой как вирус краснухи или вирус восточного, западного или венесуэльского энцефаломиелита лошадей, вирус, вызывающий гепатит, такой как вирус гепатита А или гепатита В, пестивирус, такой как вирус холеры свиней, или рабдовирус, такой как вирус бешенства, буньявирус, такой как хантавирус. В одном варианте клетка согласно изобретению пригодна для размножения штамма вируса гриппа,который не растет очень эффективно на эмбрионах яиц. Изобретение также относится к применению клетки человека, содержащей в своем геноме последовательность, кодирующую по меньшей мере один белок Е 1 аденовируса или его функциональное производное, гомолог или фрагмент, и при этом клетка не продуцирует структурные аденовирусные белки для получения вируса или по меньшей мере одного вирусного белка для использования в вакцине. Конечно,для такого применения также предпочтительны клетки, которые предпочтительны в способах согласно изобретению. Изобретение также относится к продуктам, получаемым способами и в результате применений согласно изобретению, особенно вирусным белкам и вирусам, получаемым согласно таким применениям и/или способам, особенно в том случае, когда они поставляются в фармацевтической композиции, содержащей подходящие наполнители и в некоторых формах (инактивированные вирусы, субъединицы) адъюванты. Дозирование и пути введения можно выяснить посредством обычного клинического тестирования, поскольку они еще не известны по уже разрешенным к выпуску вакцинам.-4 006136 Таким образом, изобретение также относится к вирусу или вирусному белку для применения в вакцине, получаемым способом или посредством применения согласно изобретению, при этом указанный вирус или указанный вирусный белок не содержит какого-либо белкового материала млекопитающего,такого как человек, и к фармацевтической композиции, содержащей такой вирус и/или вирусный белок. Изобретение, кроме того, относится к клетке человека, содержащей в своем геноме последовательность, кодирующую по меньшей мере один белок Е 1 аденовируса, или его функциональное производное,гомолог или фрагмент, и при этом клетка не продуцирует структурные аденовирусные белки, и содержащей нуклеиновую кислоту, кодирующую вирус или по меньшей мере один вирусный белок не аденовируса. Такую клетку можно использовать в способе согласно изобретению. Предпочтительный вариант изобретения относится к вирусу гриппа, получаемому способом согласно изобретению, или в результате применения согласно изобретению. Другой вариант изобретения относится к вакцинам против гриппа, получаемым способом согласно изобретению или в результате применения согласно изобретению. Для иллюстрации изобретения представлены следующие примеры, не предназначенные для того,чтобы ограничить рамки изобретения. Пример 1. Материалы и способы Культура клеток PER.С 6 и MDCK Клетки почки собаки Madin Darby (MDCK) культивировали в среде Игла, модифицированной по Дульбекко (DMEM, Life Technologies Breda, The Netherlands), содержащей 10% инактивированной нагреванием фетальной телячьей сыворотки (FCS) и 1 х L-глутамин (Gibco-BRL), при 37 С и 10% СО 2. Суспензионные культуры PER.C6 культивировали в ExCell 525 (JRH Biosciences) с добавлением 1 х Lглутамина при 37 С и 10% СО 2 в виде стационарных культур в 6-луночных чашках (Greiner) или в роллерных флаконах для культуры ткани объемом 490 см 3 (Corning Costar Corporation) при непрерывном вращении со скоростью 1 об/мин. Иммунофлуоресцентный тест Анализы прямой иммунофлуоресценции для выявления инфекции вирусом гриппа выполняли, используя набор для выявления вирусов гриппа А и В IMAGEN (Dako), следуя стандартному протоколу поставщика. Образцы оценивали с помощью микроскопа, используя эпифлуоресцентное освещение. Инфицированные клетки характеризовали на основе яркой флуоресценции цвета зеленого яблока. Окрашивание йодидом пропидия Осадки клеток ресуспендировали в 300 мкл холодного PBS/0,5% BSA + 5 мкл йодида пропидия(концентрация 50 мкг/мл) в растворе PBS/FCS/азида, известном специалистам в данной области. Живые и мертвые клетки затем выявляли с помощью проточного цитофлуорометрического анализа. Анализ гемагглютинации В общем, анализы гемагглютинации для определения титров вируса гриппа выполняли в соответствии со способами, известными специалистам в данной области. В данном случае 50 мкл двукратного разведенного раствора вируса в PBS добавляли к 25 мкл PBS и 25 мкл 1% суспензии индюшачьих эритроцитов (Biotrading Benelux B.V.) в PBS и инкубировали в 96-луночных планшетах для микротитрования при 4 С в течение 1 ч. Изучали и оценивали характер гемагглютинации и выражали в виде единиц гемагглютинации (HAU). Число HAU соответствовало обратной величине наибольшего разведения вируса, при котором наблюдалась полная гемагглютинация. Вестерн-блот-анализ белка НА вируса гриппа В общем, полученные вирусы гриппа разрушали в буфере Лэммли согласно способам, известным специалистам в данной области, и разные объемы полученных смесей белков разделяли, используя 10%DCH/ПААГ-гели. Коротко, блоты блокировали в течение 30 мин при комнатной температуре блокирующим раствором (5% порошок обезжиренного сухого молока (Biorad) в TBST с добавлением 1% сыворотки кролика (Rockland с последующими 3 промывками TBST. Затем блоты инкубировали с антисывороткой против НА А/Сидней/5/97 (NIBSC 98/768), разведенной 1/500 в 1% BSA/TBST с 5% сыворотки кролика (Rockland) O/N при комнатной температуре. Блоты снова 8 раз промывали TBST. Наконец блоты инкубировали с кроличьей антисывороткой против иммуноглобулина овцы (меченой HRP, Rockland),разведенной 1/6000 в блокирующем растворе, в течение 1 ч при комнатной температуре. После 8 промывок TBST комплекс конъюгированных белков выявляли с помощью ECL (Amersham Pharmacia Biotech),и экспонировали пленки (Hyperfilm, Amersham Life Science). Антисыворотку получали из NIBSC (UK) и использовали в разведениях, рекомендуемых NIBSC. Анализ одномерной радиальной иммунодиффузии (SRID) Концентрацию гемагглютинина в надосадках, полученных из клеток PER.C6, инфицированных вирусом гриппа, определяли посредством анализа одномерной радиальной иммунодиффузии (SRID), как описано ранее (Wood et al. 1977). Анализ выполняли, используя стандартные антигены NIBSC (UK) и реагенты антисыворотки.-5 006136 Анализ бляшек Всего 1 мл 10-кратно серийно разведенных вирусных надосадков высевали на клетки MDCK, которые выращивали до 95% слияния в 6-луночных планшетах. После 1 ч при 35 С клетки дважды промывали PBS и покрывали 3 мл агарозной смеси (1,2 мл 2,5% агарозы, 1,5 мл 2 х MEM, 30 мкл 200 мМ Lглутамина, 24 мкл трипсина-EDTA, 250 мкл PBS). Затем клетки инкубировали во влажной атмосфере,содержащей 10% СО 2, при 35 С примерно в течение 3 дней, и вирусные бляшки подсчитывали визуально. Анализ инфекционности вируса (TCID50) Титрование инфекционного вируса выполняли на клетках MDCK. Коротко, клетки высевали в 96 луночные планшеты при плотности 4 х 104 клеток/лунку в DMEM с добавлением 2 мМ L-глутамина. Через двадцать четыре часа клетки инфицировали 100 мкл десятикратно серийно разведенными надосадками культуры в четырех повторах в среде, содержащей трипсин-EDTA в концентрации 4 мкг/мл. Спустя два часа монослой инфицированных клеток два раза промывали в PBS и инкубировали в среде, содержащей трипсин, в течение 7 дней при 35 С. Затем надосадки указанных культур тестировали в анализе НА. Титры TCID50 рассчитывали согласно способу Karber (1931). Инактивация вируса гриппа -пропиолактоном Для инактивации вирусов с целью получения целого инактивированного вируса для создания вакцин, полученных из PER.C6, протокол создания мутации, известный специалистам в данной области,выполняли, используя -пропиолактон. -пропиолактон является очень эффективным агентом, широко используемым для инактивации вирусов и хорошо известным в данной области вследствие его мутагенных эффектов. Он модифицирует основания нуклеиновых кислот в вирусном геноме и геноме клеткихозяина, вследствие чего блокирует репликацию. Следуя широко известному протоколу, используемому для получения целого инактивированного вируса гриппа, получаемого на эмбрионах яиц, инактивировали количество вируса, соответствующее примерно 400 мкг НА на штамм, и использовали для составления конечной вакцины. Коротко, один объем 0,3 М натрий-фосфатного буфера добавляли к 9 объемам препарата вируса гриппа. Инактивацию вируса выполняли, добавляя один объем 10% -пропиолактона(Newall Design, UK) к 100 объемам вирусного препарата, забуференного фосфатом, и инкубировали при 20 С в течение 24 ч. Инактивацию вирусов проверяли анализом бляшек и ни в одной из инактивированных партий не выявляли бляшек (данные не показаны). Пример 2 А. Создание банка клеток PER.C6 и предварительное культивирование. Использовали линию клеток PER.C6 (депонирована под 96022940 в Европейской коллекции культур клеток животных в Center for Applied Microbiology and Research) или производные от нее (описанные в WO 97/00326). Банки линий клеток создавали посредством двухъярусной системы банков клеток. Банк выбранной линии клеток готовили в виде основного банка клеток для исследований (rМСВ),который хранили в разных местах. Из указанного rМСВ рабочие банки клеток для исследований (rWCB) готовили следующим образом: размораживали ампулу rМСВ и размножали клетки до тех пор, пока количество клеток становилось достаточным для замораживания клеток с использованием сухого льда. До 500 ампул, содержащих 1 мл (1-2 х 106 клеток/мл) rWCB, хранили в паровой фазе низкотемпературной камеры с жидким N2. Одну ампулу, содержащую 5 х 106 клеток PER.C6 WCB, размораживали в водяной бане при 37 С. Клетки быстро переносили в пробирки объемом 50 мл и ресуспендировали при добавлении 9 мл суспензионной среды ExCell 525 (JRH Biosciences) с добавлением 1 х L-глутамина. После 3 мин центрифугирования при 1000 об/мин в настольной центрифуге с верхней загрузкой клетки ресуспендировали в конечной концентрации 3 х 105 клеток/мл и культивировали во флаконах для культуры ткани Т 80 при 37 С, 10% СO2. Спустя 2-3 дня клетки высевали в роллерные флаконы для культуры ткани объемом 490 см 3 (Corning Costar Corporation) при плотности 3 х 105 в мл и культивировали при непрерывном вращении со скоростью 1 об/мин. Пример 2 В. Клетки PER.С 6 в качестве пермиссивной линии клеток для вируса гриппа АPER.C6 как клетка человека не была известна по своей способности поддерживать инфекцию и репликацию вируса гриппа. Поэтому проверяли, являются ли клетки PER.C6 пермиссивными в отношении инфекции вирусом гриппа по сравнению с линией собачьих клеток почки собак Madin Darby (MDCK),которые служили в качестве позитивного контроля. За день до инфекции высевали 2 х 105 клеток MDCK на лунку в 6-луночные планшеты. Спустя двадцать четыре часа 4 х 105 высеянных клеток PER.C6 и MDCK на лунку инфицировали H1N1-штаммом А/ПуэртоРико/8/34 (титр 3,6 х 107 БОЕ/мл) (полученным от Dr. E. Claas, Leiden University Medical Center, The Netherlands). Инфицирование осуществляли при разной множественности инфицирования (moi) в пределах от 0,1 до 10 БОЕ/клетку. После 2 ч инкубации при 37 С инокулят удаляли и заменяли свежей средой. Прямой иммунофлуоресцентный анализ для выявления инфекции вирусом гриппа проводили через 24 и 48 ч после инфицирования. Эксперимент продемонстрировал пермиссивность PER.C6 для инфекции гриппом, при этом процент позитивных клеток зависел от moi и был сравним с MDCK (фиг. 1).-6 006136 Пример 3. PER.C6, используемые для размножения вируса гриппа А Проверяли, могут ли PER.C6 поддерживать репликацию и размножение вируса гриппа. В день инфицирования клетки PER.C6 высевали в роллерные флаконы для культуры ткани объемом 490 см при плотности 2 х 105 клеток/мл в конечном объеме 40 мл в присутствии 5 мкг/мл трипсина-EDTA (GibcoBRL). Клетки либо подвергали ложной инокуляции, либо инфицировали Н 3N2-штаммомA/Shenzhen/227/95 (титр 1,5 х 106 БОЕ/мл) (полученным от Dr. E. Claas, Leiden University Medical Center,The Netherlands). Инфицирование осуществляли при moi 10-4 и 10-3 БОЕ/клетку. После 1 ч инкубации при 37 С инокулят удаляли посредством осаждения клеток центрифугированием при 1500 об/мин и ресуспендированием клеток в свежей культуральной среде + 5 мкг/мл трипсина-EDTA. Сбор 1,3 мл суспензии клеток проводили каждый день с 1 по 6 день после инфицирования. Надосадки хранили при -80 С и использовали для анализов гемагглютинации. Осадки клеток использовали для прямых иммунофлуоресцентных анализов и для окрашивания йодидом пропидия. Пример 4. Пермиссивность PER.C6 для разных штаммов гриппа Для дальнейшего исследования пермиссивности PER.C6 для размножения разных штаммов гриппа проводили инфекцию с использованием вакцинного штамма H1N1 A/Beijing/262/95 и его пересортированного варианта Х-127, полученного из National Institute for Biological Standards and Control (NIBSC,UK). В день инфицирования клетки PER.C6 высевали в роллерные флаконы для культуры ткани объемом 490 см 3 при плотности примерно 1 х 106 клеток/мл в конечном объеме 50 мл. Проводили инокуляцию клеток 5 мкл (разведение 10-4) и 50 мкл (разведение 10-3) вируса в присутствии 5 мкг/мл трипсина-EDTA. Для того чтобы установить, действительно ли необходим трипсин, проводили еще одну инфекцию посредством инокуляции 5 мкл штамма A/Beijing/262/95 в отсутствии протеазы. Примерно после 1 ч инкубации при 37 С инокулят удаляли посредством осаждения клеток центрифугированием при 1500 об/мин и ресуспендированием их в свежей культуральной среде 5 мкг/мл трипсина-EDTA. На 2 и 4 день после инфицирования к образцам еще добавляли трипсин. Сбор 1,3 мл суспензии клеток проводили каждый день с 1 по 6 день после инфицирования. Надосадки хранили при -80 С и использовали для анализов гемагглютинации и дальнейших инфицирований; осадки клеток использовали для прямых иммунофлуоресцентных анализов. Результаты, полученные с использованием упомянутых выше анализов иммунофлуоресценции и гемагглютинации, показаны на фиг. 4 и 5, соответственно, иллюстрирующих эффективную репликацию и высвобождение вирусов. Пример 5. Инфекционность вируса, размноженного на PER.С 6 Проверяли, являются ли вирусы, выращенные в PER.C6, инфекционными, и может ли адаптация к линии клеток увеличивать выходы вируса. Использовали надосадки вирусов, полученные из PER.C6,инфицированных штаммом A/Beijing/262/95 и его пересортированным вариантом Х-127 (разведение 10-3) и собранных на 6 день после инфицирования. В день инфицирования PER.C6 высевали в роллерные флаконы для культуры ткани объемом 490 см 3 при плотности примерно 1 х 106 клеток/мл в конечном объеме 50 мл. Проводили инокуляцию клеток 100 мкл и 1 мл надосадка вирусов в присутствии 5 мкг/мл трипсина-EDTA. Для того чтобы установить, требуется ли еще трипсин, проводили еще одно инфицирование посредством инокуляции 100 мкл штамма A/Beijing/262/95 в отсутствие протеазы. Примерно после 1 ч инкубации при 37 С инокулят удаляли посредством осаждения клеток центрифугированием при 1500 об/мин и ресуспендированием их в свежей культуральной среде 5 мкг/мл трипсина-EDTA. На 2 и 4 день после инфицирования к образцам еще добавляли трипсин. Сбор 1,3 мл суспензии клеток проводили с 1 по 6 день после инфицирования. Надосадки хранили при -80 С и использовали для анализов гемагглютинации и дальнейших инфицирований; осадки клеток использовали для прямых иммунофлуоресцентных анализов. Результаты, полученные с использованием упомянутых выше анализов иммунофлуоресценции и гемагглютинации, показаны на фиг. 6 и 7. Данные, полученные с помощью описанного эксперимента, показали инфекционность вирусов, выращенных в PER.C6, а также увеличение выходов вируса. Пример 6. Наличие поверхностных клеточных рецепторов для вируса гриппа на PER.C6. Размножение штаммов гриппа А и В человека в эмбрионах куриных яиц всегда приводит к селекции связывающих рецепторы вариантов, которые несут аминокислотные замены в дистальной части глобулярной головки НА в открытых и функционально важных районах молекулы. Вследствие указанных мутаций адаптированные к яйцам штаммы могут отличаться от исходных вирусов человека по своей антигенной и иммуногенной активности, а также по их вирулентности. В вирусах гриппа человека, выделенных из клеток MDCK, обычно присутствует белок НА, который идентичен белку НА, присутствующему на вирусе исходного клинического образца. В недавнем исследовании (Govorkova 1999) выяснена молекулярная основа селекции вариантов в куриных яйцах и отсутствия указанного явления селекции вариантов в клетках MDCK. Обнаружено, что все штаммы вируса гриппа А и В человека, выделенные из клеток MDCK, связываются с высоким сродством и специфичностью по отношению к мостикам альфа 2,6-сиаловая кислота-галактоза, присутствующим в олигосахаридах, находящихся в поверхностных клеточных рецепторах, тогда как их эквиваленты, выросшие в яйцах, проявляют повышенное сродство к мостикам альфа-2,3-сиаловая кислота-галактоза в поверхностных клеточных рецепторах, несущих оли-7 006136 госахариды (Sia2-3Gal). С использованием специфичных лектинов было показано, что на поверхности эмбриональных клеток цыплят присутствовали только рецепторы, содержащие Sia2-3Gal, тогда как клетки MDCK экспрессировали как Sia2-6Gal, так и Sia2-3Gal. Экспрессию компонентов Sia2-3Gal и Sia26Gal на поверхности клеток PER.C6 исследовали FACS-анализом, используя два разных меченых дигоксигенином (DIG) лектина: агглютинин Sambuca nigra (SNA), который специфично узнает мостики Sia26Gal, и агглютинин Maackia amurensis (MAA), который специфично узнает мостики Sia2-3Gal. На фиг. 8 А показано распознавание лектинами SNA и MAA и их связывание с сайтами гликозилирования. Кроме того, на фиг. 8 А схематично показано взаимодействие между ФИТЦ-меченым анти-DIG-антителом иDIG-меченым лектином, который узнает специфичную связь с сиалилом в основной цепи гликозилирования рецептора, присутствующего на поверхности клеток. Оба лектина брали из набора для дифференциации гликанов (Boehringer-La Roche). Эксперимент проводили на клетках PER.C6 в суспензии и прикрепленных клетках MDCK и СНО. Клетки MDCK и СНО освобождали от твердого носителя с использованием трипсина-EDTA (GibcoBRL). Затем суспензии клеток один раз промывали Mem-5% FBS и инкубировали в указанной среде в течение 1 ч при 37 С. После промывки PBS (Gibco-BRL) клетки ресуспендировали до концентрации примерно 106 клеток/мл в среде для связывания (физиологический раствор, забуференный трисом, рН 7,5, 0,5% BSA и 1 мМ каждой из солей MgCl2, MnCl2 и CaCl2). Аликвоты клеток инкубировали в течение 1 ч при комнатной температуре с DIG-мечеными лектинами SNA и MAA. Через 1 ч обработанные лектинами клетки промывали PBS и инкубировали еще час при комнатной температуре с ФИТЦ-меченым анти-DIG-антителом (Boehringer-Mannheim). Наконец, клетки промывали PBS и анализировали посредством флуоресцентно-активируемой сортировки клеток, используя аппаратуру для FAC-сортировки (Becton Dickinson). Результаты, представленные на фиг. 8 В, показывают, что клетки PER.C6 были окрашены обоими лектинами, что свидетельствует о наличии как Sia2-6Gal-рецепторов, так и Sia2-3Gal-рецепторов. В таком же эксперименте клетки MDCK использовали в качестве позитивного контроля в отношении обоих сиалированных рецепторов, в то время как клетки СНО вследствие отсутствия гликозилирующего фермента альфа-2-6-сиалилтрансферазы в данных клетках хомячка, представляли собой негативный контроль в отношении Sia2-6Gal-компонента. На верхних панелях показаны результаты, полученные с лектином SNA, и на нижних панелях показаны результаты, полученные с лектином МАА. На основании указанных результатов можно сделать вывод, что PER.C6 экспрессирует белки клеточной поверхности, которые имеют как Sia2-3Gal, так и Sia2-6Gal-мостики в своих олигосахаридных цепях. Пример 7. Влияние разных концентраций трипсина-EDTA на жизнеспособность клеток PER.C6, на продукцию вируса гриппа в клетках PER.C6 и на полученный из них белок НА. Из-за абсолютной потребности в трипсине для размножения вирусов гриппа в культурах клеток исследовали влияние разных концентраций трипсина-EDTA на жизнеспособность клеток PER.C6 и репликацию вируса в клетках PER.C6 после инфицирования, используя несколько штаммов вируса гриппа. Инфекция штаммом вируса гриппа А/Сидней/5/97 в присутствии низких концентраций трипсина В день инфицирования клетки PER.C6 высевали в роллерные флаконы для культуры ткани объемом 490 см 3 при плотности 1 х 106 клеток/мл в присутствии трипсина-EDTA в конечных концентрациях 0,5,1, 2, 3 и 5 мкг/мл. Указанные концентрации трипсина не влияли на характеристики роста клеток и их жизнеспособность (данные не показаны). Клетки либо подвергали ложной инфекции, либо инфицировали выращенном на PER.C6 вирусом гриппа А/Сидней/5/97 при moi 10-4 БОЕ/клетку. Продукцию вируса контролировали посредством анализов прямой иммунофлуоресценции (данные не показаны), гемагглютинации, одномерной радиальной иммунодиффузии (SRID), указанных выше, и анализом бляшек, все способы, как описано выше. Результаты данного эксперимента изображены на фиг. 9, и они показывают, что содержание НА по измерениям посредством SRID, а также биологическая активность вируса, выраженная вHAU, были наибольшими в случае использования концентрации трипсина, равной 1 мкг/мл. На фиг. 9 также показано, что при использовании анализа бляшек наибольшее количество бляшкообразующих единиц (БОЕ) в мл наблюдалось в образце, соответствующем клеткам, выращенным в среде, содержащей 2 мкг/мл трипсина. Инфекция штаммом вируса гриппа B/Harbin/7/94 В день инфицирования клетки PER.C6 высевали в роллерные флаконы для культуры ткани объемом 490 см 3 при плотности 1 х 106 клеток/мл в присутствии разных концентраций трипсина-EDTA в пределах от 1 до 5 мкг/мл. Клетки инфицировали выращенным на PER.C6 вирусом гриппа B/Harbin/7/94 при moi 10-3 БОЕ/клетку. Продукцию вируса контролировали посредством анализов прямой иммунофлуоресценции, гемагглютинации и анализом бляшек, как показано на фиг. 10. Инфицируемость PER.C6 на 2 день возрастала с увеличением концентрации трипсина. Однако на 3 день не наблюдалось значительных различий в проценте инфицированных клеток в тех случаях, когда присутствовало 1, 2,5 или 5 мкг/мл трипсина. В отсутствие трипсина (0 мкг/мл) не выявлено инфекции вирусом гриппа. В день последнего сбора(4 день после инфицирования) биологическая активность вируса по измерениям в анализе гемагглютинации существенно не отличалась. Интересно, что анализ инфекционности, выполненный в образцах,которые были взяты на 3 и 4 день после инфицирования, показал различие в продукции вируса. Наи-8 006136 большие титры получали на 3 день и 4 день в том случае, когда использовали концентрацию трипсина от 2,5 до 5 (3 день) и 1 мкг/мл (4 день). Инфекция "пересортированным" вирусом гриппа Х-127 В день инфицирования клетки PER.C6 высевали в роллерные флаконы для культуры ткани Т 25 при плотности 1 х 106 клеток/мл в присутствии разных концентраций трипсина-EDTA в пределах от 0 до 7,5 мкг/мл. Клетки инфицировали выращенным на PER.C6 вирусом Х-127 (пересортированный в яйцах штамм A/Beijing/262/95) при moi 10-4 и 10-3 БОЕ/клетку. Рост вируса контролировали посредством анализов прямой иммунофлуоресценции, гемагглютинации и анализом бляшек. Как показано на фиг. 11 и 12,титры HAU в образцах были идентичными, независимыми от концентрации трипсина и исходного значения moi, которые использовали. Кроме того, не наблюдали значимых различий в титрах инфекционности, измеренных посредством анализа бляшек. Инфекция PER.C6 штаммом вируса гриппа А/Сидней/5/97 в присутствии высоких концентраций трипсина Для того чтобы исследовать влияние возрастающих концентраций трипсина на жизнеспособность клеток и репликацию вируса, клетки PER.C6 высевали в роллерные флаконы при плотности 1 х 106 клеток/мл в присутствии разных концентраций трипсина-EDTA в пределах от 0 до 12,5 мкг/мл. Клетки либо ложно инфицировали, либо инфицировали выращенным на PER.C6 вирусом гриппа А/Сидней/5/97 приmoi 4 х 10-5 БОЕ/клетку. HAU в полученных партиях определяли, как описано. Важно, что данные, изображенные на фиг. 13, четко показывают, что концентрации трипсина вплоть до 10 мкг/мл не влияют на жизнеспособность клеток. Кроме того, биологическая активность вируса, полученного на 4 день после инфицирования, на основании измерений HAU была выше, чем при использовании концентрации трипсина от 2,5 до 5 мкг/мл. Кроме того, измеряли TCID50 (фиг. 14 А) и выполняли анализ бляшек (данные не показаны). Не обнаружено значимых различий при указанных анализах бляшек в титрах инфекционности (TCID50), в расщеплении и количестве НА (примерно 10 мкг/мл), что определяли с помощью вестернблот-анализов, показанных на фиг. 14 В. Пример 8. Продукция вируса гриппа на клетках PER.C6 в системе перфузируемого биореактора на основе полых волокон Масштабируемость продукции вируса гриппа в растущих в суспензии клетках PER.C6 изучали, используя биореакторы объемом 3 л (общий объем), содержащие 2-литровый объем суспензии клеток в бессывороточной среде, которая также не содержала белков животного происхождения или белков человека (ExCell 525, JRH Biosciences). Инфицирование вирусом гриппа выполняли при плотности клеток примерно 3 х 106 клеток/мл. В клетки инокулировали выращенный на PER.C6 вирус А/Сидней/5/97 при moi 10-4 БОЕ/клетку. Каждый день брали образцы суспензий клеток объемом от 5 до 10 мл, чтобы выполнить подсчет общего количества клеток, чтобы определить жизнеспособность клеток, для измерения концентрации глюкозы, для анализов прямой иммунофлуоресценции, гемагглютинации и инфекционности. Результаты данных экспериментов показаны на фиг. 15. Чтобы исследовать наличие и состояние белка НА, использовали вестерн-блоты с применением двух разных анти-НА-антител, полученных из NIBSC. Также выполняли анализы SRID, как описано выше. Результаты, изображенные на двух вестерн-блотах на фиг. 16, показывают, что партия вируса гриппа, полученная в данном биореакторе, давала содержание НА с определенной концентрацией, равной 15 мкг/мл, которая была подтверждена в анализах SRID. Полученный НА сравним с эталонным НА NIBSC по субъединичному составу и иммунной реактивности с эталонной антисывороткой, специфичной для подтипа. Пример 9. Инфекция PER.C6 вирусом А/Сидней/5/97 в биореакторе объемом 15 л с последующей специфичной процедурой в нисходящем потоке (DSP) Растущие в суспензии клетки PER.C6 инкубировали при 37 С в перфузируемой системе биореактора объемом 15 л на основе полых волокон при объеме клеточной суспензии, равной 10 л, в бессывороточной среде ExCell 525 (JRH Biosciences). Инфицирование вирусом осуществляли при 35 С при плотности клеток, примерно равной 3,3 х 106 клеток/мл, в среде, содержащей 5 мкг/мл трипсина-EDTA (LifeTechnologies). В клетки инокулировали выращенный на PER.C6 вирус А/Сидней/5/97 (пассаж номер 3) при moi 10-4 БОЕ/клетку. Перфузию бессывороточной средой ExCell 525, содержащей трипсин-EDTA,продолжали в течение первых 24 ч инфекции. Через два дня после инфицирования клетки подкармливали питательным раствором, содержащим глюкозу, незаменимые аминокислоты и дополнительный глутамин: 82 мл на литр суспензии, содержащей 50 мас./об.% глюкозы (NPBI-The Netherlands), 50x незаменимых аминокислот без Gln (Gibco-BRL-Life Technologies) и 200 мМ глютамина (Gibco-BRL-Life Technologies). Каждый день брали образцы суспензии клеток объемом 10 мл для того, чтобы выполнить стандартные подсчеты количества клеток (результаты показаны на фиг. 17, левый график), для измерений концентрации глюкозы (результаты показаны на фиг. 17, правый график), для анализов прямой иммунофлуоресценции (фиг. 18), гемагглютинации (фиг. 19) и инфекционности (данные не показаны). Кроме того, исследовали белок НА с помощью вестерн-блот-анализов и сравнивали со стандартным контролем НА NIBSC (фиг. 20). В день последнего сбора всей суспензии клеток (92 ч после инфицирования) очист-9 006136 ку от обломков клеток выполняли в непрерывном потоке при 20000 g, используя сепарирующую системуPowerfuge (Carr, JM Separations) в соответствии с протоколами, предоставляемыми производителем. Затем очищенный надосадок двадцатикратно концентрировали, используя мембранный картридж на основе полых волокон с отсечкой 500 кД (A/G Technology, JM Separations). Результаты, изображенные на фиг. 21, показывают, что количественное получение живого вируса гриппа после концентрирования на полых волокнах по измерениям с помощью анализов гемагглютинации и инфекционности является очень значительным. Пример 10. Иммуногенность выращенных на PER.С 6 вирусов гриппа и полученных на их основе вакцин Чтобы определить иммуногенность выращенных на PER.С 6 вирусов гриппа, разработали исследование in vivo и модель контрольного заражения хорьков. Использовали две партии тривалентной вакцины на основе целых инактивированных вирусов гриппа (состоящей из А/Сидней/5/97, A/Beijing/262/95 иB/Harbin/7/94), содержащей 15 мкг НА каждого из трех штаммов. Первую партию получали из оплодотворенных куриных яиц, а вторую получали из клеток PER.C6. Получение, очистку, инактивацию и приготовление состава тривалентных вакцин на основе целых инактивированных полученных из клетокPER.C6 вирусов гриппа выполняли, как описано ниже. Рост штаммов вируса гриппа А/ Сидней/5/97, A/Beijing/262/95 и B/Harbin/7/94 на PER.С 6 Получение всех трех партий вируса гриппа осуществляли в трех отдельных системах биореакторов с подпиткой при помощи полых волокон объемом 3 л при объемах суспензии клеток, равной 2 л. Подпитку осуществляли путем добавления следующего раствора: один раз добавляли раствор, содержащий в общем объеме 96 мл 50 маc./об.% глюкозы (NPBI), 50 х незаменимых аминокислот без Gln (Gibco-BRLLife Technologies), 200 мМ глутамина (Gibco-BRL-Life Technologies) и 7,5 маc./об.% NаНСО 3 (Merck). Инфицирование вирусом гриппа выполняли при плотности клеток в пределах от 1,8 х 106 до 2,6 х 106 живых клеток/мл в бессывороточной среде ExCell 525, содержащей 5 мкг/мл трипсина-EDTA. На клеткиPER.С 6 высевали выращенные на PER.С 6 партии вируса А/Сидней/5/97, A/Beijing/262/95 и B/Harbin/7/94 при разных значениях moi: 10-4 (А/Сидней/5/97) или 10-3 (A/Beijing/262/95 и B/Harbin/7/94) БОЕ/клетку. Во время периода продуцирования вируса каждый день отбирали образцы объемом 10 мл для того, чтобы выполнить стандартные подсчеты клеток и жизнеспособности, для измерений концентрации глюкозы, анализов прямой иммунофлуоресценции и гемагглютинации. На фиг. 22 (результаты для клетокPER.C6, инфицированных А/Сидней/5/97) показано общее количество клеток и количество жизнеспособных клеток после инфицирования вирусом (верхняя левая панель), потребление глюкозы (верхняя правая панель), процент позитивных клеток при определении прямой иммунофлуоресценции (нижняя левая панель) и HAU (нижняя правая панель). На фиг. 23 (результаты для клеток PER.C6, инфицированных A/Beijing/262/95) показано общее количество клеток и количество жизнеспособных клеток после инфицирования вирусом (верхняя левая панель), потребление глюкозы (верхняя правая панель), процент позитивных клеток при определении прямой иммунофлуоресценции (нижняя левая панель) и HAU(нижняя правая панель). На фиг. 24 (результаты для клеток PER.C6, инфицированных B/Harbin/7/94) показано общее количество клеток и количество жизнеспособных клеток после инфицирования вирусом(верхняя левая панель), потребление глюкозы (верхняя правая панель), процент позитивных клеток при определении прямой иммунофлуоресценции (нижняя левая панель) и HAU (нижняя правая панель). Концентраты, содержащие вирус, хранили при -80 С до DSP. Во всех трех случаях потребление глюкозы и жизнеспособность и общее количество клеток для клеток PER.C6 были сравнимы. Уровни продукции трех вирусов на основании измерений прямой иммунофлуоресценции также были сходными. Хотя по HAU и титрам инфекционности разные штаммы отличались, PER.C6 поддерживали репликацию всех тестированных в данной работе вирусов гриппа. В день сбора партий целиком (либо на 3, либо на 4 день после инфицирования) надосадки вирусов очищали центрифугированием при 2000 об/мин в настольной центрифуге с верхней загрузкой и десятикратно концентрировали посредством ультрафильтрации с использованием мембранного картриджа на основе полых волокон с отсечкой 750 кД (A/G Technology, JM Separations), следуя протоколам, предоставляемым производителем. Вирусы гриппа очищали из концентрированных надосадков с помощью двух последовательных стадий центрифугирования в градиенте плотности: 25-70% ступенчатый градиент сахарозы (1,5 ч при 27 К) с последующим непрерывным градиентом сахарозы 25-70% (4 ч при 23 К). Полосы, соответствующие вирусам, разбавляли примерно 50 мл фосфатного буфера и, наконец, осаждали при 24000 об/мин в ультрацентрифуге. Вирусные осадки разводили в фосфатном буфере в объеме от 1,5 до 2,3 мл, разделяли на аликвоты и замораживали при -80 С. Композиция инактивированных вирусных вакцин основана на количестве (в микрограммах) "иммунологически активного" белка НА, измеренного посредством анализа SRID (Wood et al. 1977). Выполняли тестирование, для того чтобы охарактеризовать содержание НА в партиях. В то же время измеряли количество белков, используя основанный на методе Лоури набор для анализа DC-белков (Biorad), следуя процедурам, предлагаемым производителем. Обнаружено, что НА составляет примерно от 20 от 30% общего содержания белка в препаратах вируса.PER.С 6. Хорьки и мыши представляют собой две хорошо разработанные животные модели для исследования инфекции гриппа, и их использовали для того, чтобы определить эффективность и иммуногенность вакцин гриппа. Используя мышиную модельную тест-систему, сравнивали иммуногенность тривалентных вакцин, содержащих А/Сидней/5/97, A/Beijing/262/95 и B/Harbin/7/94, полученных на PER.C6 и яйцах, анализируя сыворотки вакцинированных животных при анализе ингибирования гемагглютинации. Используя модель инфекции хорьков после иммунизации, проводили контрольное заражение А/Сидней/5/97. Выход вируса на клетках MDCK и анализ ингибирования гемагглютинации, выполненный на сыворотке, использовали для того, чтобы сравнить иммуногенность и эффективность двух вакцин. Исследование in vivo на мышах Девяносто самок мышей Balb/C делили на девять групп по десять мышей. В день 0 собирали до 100 мкл крови. Отделяли сыворотку и хранили при -20 С. Затем каждую мышь вакцинировали соответствующей вакциной согласно схеме, указанной в таблице 1. На 28 день брали еще 100 мкл крови. Сыворотку хранили при -20 С. Каждую мышь снова вакцинировали согласно режиму, указанному в таблице 1. На 42 день отбирали 100 мкл крови и всех мышей забивали. Отделяли сыворотку и замораживали при -20 С. Анализы ингибирования гемагглютинации (HI) проводили на образцах сыворотки, отобранных на 0, 28 и 42 день. Все указанные анализы проводили в параллели для каждого дня для вирусов, выращенных как в яйцах, так и клетках. Таблица 1. Тестирование иммуногенности у мышей Исследование in vivo на хорьках Восемнадцать взрослых самок хорьков (альбиносы или черные) делили на три группы по шесть,разделенных следующим образом: группа 1 внутримышечно (в/м) получала тестируемую вакцину, полученную из яиц, животных контрольно заражали А/Сидней/5/97. Группа 2 в/м получала тестируемую вакцину, полученную на клетках PER.C6, животных контрольно заражали А/Сидней/5/97. Группа 3 получала только разбавитель тестируемой вакцины и животных контрольно заражали А/Сидней/5/97. Тестируемые вакцины вводили на 0 и 28 день. На 56 день всех хорьков инфицировали интраназально 0,5 мл вируса для контрольного заражения А/Сидней/5/97 при TCID50, равной 103. Выполняли назальные промывки и один раз в день с 57 по 63 день проверяли количество воспалительных клеток, температуру и массы хорьков. Всех животных забивали на 63 день. Отделяли сыворотку и хранили при -20 С. Образцы назальных промывок хранили на льду и подсчет выхода клеток в назальных промывках проводили, используя анализ исключения при окрашивании трипановым синим. Титр вируса, полученного из образцов назальных промывок, определяли измерением выхода вируса на клетках MDCK. Использовали метод расчета по Spearman and Karber (1931), чтобы вычислить значения TCID50. Анализы ингибирования гемагглютинации проводили на образцах сыворотки, отобранных- 11006136 на 0, 28, 56 и 63 день. На основе данного эксперимента сделан вывод, что полученная на клетках PER.C6 тестируемая вакцина была эффективной. Пример 12. Характеристика белка НА, полученного из вируса гриппа, продуцируемого клетками PER.C6. Для того чтобы исследовать гликозилирование НА в клетках PER.C6, получили партию нерасщепленного НА (НА 0). Клетки PER.C6 инфицировали вирусом А/Сидней/5/97 (пассаж номер 5 на PER.C6) при moi 1; 0,1 и 0,01 БОЕ/клетку в среде ExCell 525, содержащей трипсин-EDTA в конечной концентрации 5 мкг/мл. После 1 ч инкубации при 35 С клетки дважды промывали PBS, чтобы удалить трипсин, и инкубировали в течение ночи при 35 С и 10% CO2 в отсутствии трипсина. Спустя день собирали суспензии клеток и центрифугировали (500 g), и осадки клеток дважды промывали средой. Вирусные надосадки замораживали при -80 С и их образцы использовали в вестерн-блот-анализах, как описано, чтобы исследовать наличие или отсутствие нерасщепленного белка НА. Нерасщепленный белок НА (НА 0) состоит из двух субъединиц: НА 1 и НА 2, которые связаны посредством дисульфидной связи. Поскольку указанную дисульфидную связь можно нарушить при восстановлении с помощью ДТТ, НА 1 и НА 2 можно разделить и визуализировать в восстанавливающем геле с последующими вестерн-блотами с использованием антисыворотки, которая узнает субъединицы. Если белок НА состоит только из НА 0, будет видна одна полоса, которая мигрирует медленнее в DCH/ПААГгеле по сравнению с субъединицей НА 1 и самой быстро мигрирующей субъединицей НА 2. Результаты,показанные на фиг. 25, свидетельствуют о наличии, главным образом, нерасщепленного НА 0, полученного при инфекциях PER.C6, по сравнению с полученным из яиц позитивным контролем, который приобретали в NIBSC (UK). Чтобы подтвердить, что выявленная полоса действительно представляла собой нерасщепленный гемагглютинин, образец НА 0 расщепляли трипсином в разных концентрациях в пределах от 2,5 до 10 мкг/мл в среде в течение ночи при 37 С. Расщепленные белки наносили при восстанавливающих условиях на DCH/ПААГ-гель с последующим вестерн-блот-анализом с использованием такой же антисыворотки, как описано для фиг. 14. Как показано на фиг. 26 А, можно добиться расщепления НА 0, что подтверждает образование нерасщепленного белка НА в PER.C6. На основании указанных результатов разработали анализ для определения активности трипсина в культуральной среде с использованием НА 0 вируса гриппа в качестве субстрата. Анализ активности трипсина Чтобы определить, активен ли еще трипсин, присутствующий в среде культивирования в период продуцирования вируса гриппа, разработали анализ активности трипсина. Указанный анализ основан на измерении ферментативной активности трипсина по расщеплению субстрата, который наиболее важен для продукции вакцины гриппа: НА 0. Определяли сохраняет ли трипсин активность в культуре PER.C6, зараженной вирусом гриппаB/Harbin/7/94 (moi 10-3/10-4 БОЕ/клетку), в течение полного периода продуцирования. С этой целью 10 мкл надосадка, отобранного на 1, 2 или 3 день после инфицирования, использовали, чтобы расщепить 68 нг субстрата, который состоял из НА 0 вируса гриппа А/Сидней/5/97, в течение ночи при 37 С. После расщепления добавляли ингибиторы протеазы до конечной концентрации 1 х (полная смесь ингибиторов протеаз, Boehringer Mannheim) в 3 х буфере Лэмли с 150 мМ ДТТ (Fluka). Образцы наносили наDCH/ПААГ-гель в 10% трис-HCl (Biorad) и разгоняли. Вестерн-блот выполняли, как описано. Результаты показаны на фиг. 26 В и демонстрируют, что в культурах PER.C6, зараженных вирусом гриппаB/Harbin, трипсин сохраняет активность в течение всего периода продуцирования, так как надосадки культуры обладали способностью полностью расщеплять НА 0. Пример 13. Расщепление НА 0 N-гликозидазой F Белок НА вируса гриппа представляет собой гликопротеид, который содержит от 3 до 9 Nсвязанных сайтов гликозилирования олигосахаридами. Количество сайтов зависит от штамма вируса. Положение указанных сайтов определяют по нуклеотидной последовательности гена НА, и поскольку вирусный геном вируса гриппа реплицируется склонной к ошибкам РНК-полимеразой, с высокой частотой происходят мутации, которые вызывают добавление или удаление сайтов гликозилирования. Затем определяют состав и структуру олигосахаридных цепей, присутствующих на НА, с помощью ряда биосинтетических и корректирующих гликозилирование ферментов, предоставляемых клеткой-хозяином. Поскольку гликозилирование НА играет важную роль в вирулентности и эффективности вакцины, изучали свойства НА, полученного на инфицированных вирусом гриппа PER.C6. Расщепление нерасщепленного белка НА 0 вируса А/Сидней/5/97 ферментом N-гликозидазой F выполняли, используя протокол,предоставленный производителем, для того чтобы удалить семь олигосахаридов, предположительно присутствующих на полипептиде НА вируса А/Сидней/5/97. Вирус гриппа А/Сидней/5/97 лизировали 1% тритоном Х-100 (Merck). Ингибитор протеазы добавляли к аликвоте данного лизированного вируса, соответствующей 68 нг НА, до конечной концентрации 1 х (полная смесь ингибиторов протеаз BoehringerMannheim). Полученный образец инкубировали в присутствии 100 мМ NaPO4, рН 7, 10 мМ EDTA (J.T.Baker), 1% DCH (J.T. Baker) и 1% -меркаптоэтанола (Merck). Все это инкубировали в течение 10 мин при комнатной температуре. Образец разбавляли в пять раз в 100 MM NaPO4, pH 7, 10 MM EDTA (J.T.Barker), 0,625% NP-40 и 1% -меркаптоэтаноле (Merck). Из полученной смеси 40 мкл использовали для- 12006136 глико-F-расщепления. Для этого добавляли 2 мкл раствора глико-F с концентрацией 1 U/мкл (Nгликозидаза F, Boehringer) и инкубировали в течение периода времени, равного как минимум 16 ч, при 37 С. Затем добавляли 3 х буфер Лэммли с 150 мМ ДТТ (Fluka) до конечной концентрации 1 х. Образцы разгоняли в 7,5% DCH/ПААГ-геле. DCH-ПААГ и вестерн-блот выполняли следующим образом. Коротко, блот блокировали в течение 30 мин при комнатной температуре блокирующим раствором (5% сухой порошок обезжиренного молока, Biorad, в TBST с добавлением 1% сыворотки кролика (Rockland), после чего 3 раза промывали TBST. Затем блот инкубировали с антисывороткой против А/Сидней/5/97 (98/768NIBSC) в разведении 1/500 в 1% BSA/TBST с 5% сыворотки кролика (Rockland) в течение ночи при комнатной температуре. Блот снова 8 раз промывали TBST. Наконец блот инкубировали с меченой HRP кроличьей антисывороткой против иммуноглобулина овцы (Rockland), разведенной 1/6000 в блокирующем растворе, в течение 1 ч при комнатной температуре. После 8 промывок TBST комплекс конъюгированных белков выявляли с помощью ECL (Amersham Pharmacia Biotech) и экспонировали с пленками(Hyperfilm, Amersham Life Sciences). Как показано на фиг. 27, обработка ферментом гликозидазой F отчетливо снижала размер белка примерно на 28-30 кД, при предполагаемой потере примерно 4 кД на олигосахарид. Полоса белка, указанная звездочкой , представляет собой дегликозилированный НА 0, который мигрирует подобно продукту в виде субъединицы НА 1, полученной после расщепления НА 0 на субъединицы НА 1 и НА 2 (правые дорожки). Пример 14. Расщепление HА 0 с помощью Accutase Исследовали возможность замены полученного из млекопитающих трипсина-EDTA белками не млекопитающих или рекомбинантными белками. Недавно для обычной культуры клеток появилась смесь протеолитических и коллагенолитических ферментов (Accutase, РАА) из беспозвоночного. Вследствие своего происхождения не из организма млекопитающих Accutase не содержит прионов, парвовирусов и других компонентов, которые потенциально могут загрязнять растворы трипсина-EDTA. До настоящего времени нет возможности получить информацию относительно типа протеаз, присутствующих в Accutase. Расщепление НА 0 исследовали, используя вестер-блот-анализ. Постоянное количество белка НА 0, полученного посредством PER.C6, инфицированных А/Сидней/5/97 при moi 1 БОЕ на клетку без трипсина, расщепляли с помощью нескольких серийных разведений Accutase в течение ночи при 37 С. В качестве позитивного контроля использовали такое же количество НА 0, расщепленного 100 нг трипсина-EDTA. Затем расщепленные белки наносили на 10% DCH-ПААГ-гель в восстанавливающих условиях для вестерн-блот-анализа. Как показано на фиг. 28, расщепление с помощью обработки 2 мклAccutase приводила к полному расщеплению НА 0; частичное расщепление наблюдали при использовании 0,2 мкл. Полученные результаты свидетельствуют о том, что обработка Accutase во время репликации и продукции вируса гриппа может заменять трипсин-EDTA во время инфекций на PER.C6. Пример 15. Электронно-микроскопический анализ вирусов гриппа в клетках PER.C6 Исследования методом трансмиссионной электронной микроскопии выполняли на клетках PER.C6,которые инфицировали штаммом гриппа А/Сидней/5/97, а также на надосадках, содержащих вирусы, и материале, очищенном в сахарозе, для того чтобы определить фенотип указанного вируса гриппа, продуцируемого в клетках PER.C6. Все использованные способы хорошо известны специалистам в данной области. На фиг. 29 показано, что последние стадии жизненного цикла вируса представлены активной репликацией и высвобождением покрытых оболочкой вирионов из цитоплазматической мембраны. Выявлены выступы, соответствующие вирусным белкам НА и NA, обрамляющие периферию вирионных частиц. На фигуре также показан характерный плейоморфизм вирусов гриппа. Пример 16. Инфекция PER.С 6 множеством штаммов вирусов гриппа А и В Применение PER.C6 в качестве основной технологии получения вакцины гриппа требует, чтобыPER.C6 поддерживали рост широкого ряда штаммов разных подтипов вируса гриппа. Стационарные суспензионные культуры клеток PER.C6, которые выращивали во флаконах Т 25 и/или в 6-луночных планшетах в среде ExCell 525, инфицировали при плотности клеток 106 клеток/мл 16 разными штаммами вирусов гриппа, показанными на фиг. 30 А. Указанные штаммы включали в себя несколько штаммов H3N2, H1N1, В-типа и птичьи штаммы. Инфекции осуществляли в присутствии 5 мкг/мл трипсина. Вирусы получали из NIBSC (UK) в виде пассируемых на яйцах штаммов дикого типа или пересортированных штаммов, и они отмечены. Инфекции выполняли разведениями вирусов, рекомендованными NIBSC в технологических картах, которые предоставлены с разными штаммами. Все тестируемые вирусы были способны размножаться в PER.C6, что определяли по иммунофлуоресценции(данные не показаны) и титрованию надосадочных жидкостей в анализе БОЕ (фиг. 30 В). Полученные результаты показывают, что даже штаммы вируса гриппа (обозначенные звездочками),такие как A/Johannesburg/33/94, B/Beijing/184/93 и A/Duck/Syngapore-Q/F119-3/97, которые обычно очень трудно получать на эмбрионах яиц, могут реплицироваться и могут быть получены на клетках PER.C6 человека.- 13006136 Пример 17. Получение вируса простого герпеса типа 1 (HSV-1), вируса простого герпеса типа 2(HSV-2) и вируса кори на PER.C6 Проверяли, могут ли на PER.C6 также реплицироваться другие вирусы, отличные от вируса гриппа и аденовируса, такие как вирус простого герпеса типа 1 и 2 и вирус кори. На основе выращенных на PER.C6 партиях вирусов созданы вакцины, которые получены из указанных выращенных на PER.C6 вирусах, и которые индуцируют нейтрализующее действие у человека для защиты от инфекций дикого типа. Штаммы, которые получали из АТСС и использовали для инфекции клеток PER.C6, указаны в табл. 2. Таблица 2. Штаммы вируса простого герпеса и кори, которые получали из АТСС и которые использовали для инфекции клеток PER.C6 Для того чтобы тестировать, могут ли вирусы HSV-1 и HSV-2 и кори, полученные из АТСС, реплицироваться и продуцироваться в PER.C6, клетки пассажа номер 46 высевали в камеры Labtek, покрытые поли-L-лизином с использованием способов, известных специалистам в данной области, при плотности 105 клеток/лунку. Клетки Vero от обезьян (полученные из АТСС) культивировали в пассаже номер 137 и использовали в качестве позитивных контролей, и высевали при плотности 2,5 х 104 клеток/лунку. В день 0, когда в лунках клетки PER.C6 сливались на 60% и клетки Vero на 80%, клетки инфицировали при разных значениях moi (10-3, 10-2, 10-1 и 1 TCID50 на клетку). С промежутками в один день при инфекции клетки фиксировали и анализировали по иммунофлуоресценции с использованием специфичных моноклональных антител, конъюгированного с ФИТЦ типа, используя набор (для вируса простого герпеса(HSV) типа 1 и 2 Imagen, (Dako и ФИТЦ-конъютированные антитела против НА и белка матрикса вируса кори (набор IFA для кори, Light diagnostics), следуя процедурам, предлагаемым производителем. Антисыворотка направлена против антигенов HSV-1 и HSV-2 и вируса кори. Результаты, суммированные на фиг. 31, показывают, что PER.C6 является пермиссивной для инфекций HSV-1 (фиг. 31D), HSV-2 (фиг. 31 Е) и вирусом кори (фиг. 31 А). Кроме того, кинетика свидетельствует о том, что указанные вирусы реплицируются на PER.C6 зависимым от moi образом. Затем исследовали, могут ли HSV-1, HSV-2 и вирус кори размножаться на PER.C6. С этой целью клетки инфицировали при moi 0,01; 0,1 и 1 TCID50/клетку для HSV-1 (фиг. 32 С) и HSV-2 (фиг. 32 А) и при moi 0,001 TCID50/клетку для вируса кори (фиг. 32 В) (пассаж номер 1). При проявлении почти полного ЦПД собирали клетки и надосадки, быстро замораживали в жидком N2 и размораживали. После этого осветленные надосадки вслепую пассировали, используя примерно 100 мкл, на PER.C6 (пассаж номер 2). И снова после достижения почти полного ЦПД сходным образом проводили третий пассаж (пассаж номер 3). Значения moi пассажа номер 2 и 3 определяли ретроспективно по анализам TCID50. Результаты проведенных экспериментов показывают, что вирус простого герпеса типа 1 и 2 и вирус кори могут реплицироваться в PER.C6, и что репликация и размножение могут даже происходить уже при использовании значении moi 10-7. Пример 18. Скрининг ротавируса в отношении репликации на PER.C6 Чтобы проверить, могут ли PER.C6 поддерживать репликацию ротавируса, клетки PER.C6 инфицировали ротавирусом резус (MMU 18006; ATCCVR-954; штамм S:USA:79:2; партия 2181153). КлеткиPER.C6 (пассаж номер 41) культивировали при плотности 1 х 105 в мл и клетки Vero от обезьян (получены из АТСС, пассаж номер 139) культивировали при плотности 2,5 х 104 в мл и затем высевали в камерыLabtek, которые были предварительно покрыты поли-L-лизином с применением способов, известных специалистам в данной области. Клетки инфицировали при moi 1 TCID50/клетку ротавирусов резус в- 14006136 присутствии и отсутствии 2 мкг/мл трипсина-EDTA. После 90 мин инфекции клетки промывали средойExCell 525 и далее инкубировали при 37 С при 10% CO2 во влажной атмосфере. В 5 последующих дней после инфицирования собирали образцы надосадков, очищали от клеток и клеточных остатков центрифугированием при 2000 об/мин в настольной центрифуге с верхней загрузкой и анализировали способомELISA, специфичным в отношении ротавируса (IDEIA Rotavirus, Dako). Результаты, изображенные на фиг. 33, четко показывают, что ротавирус резус реплицируется на PER.С 6. Подписи к фигурам Фиг. 1. Процент инфицированных клеток (позитивные клетки), видимых под микроскопом после анализа иммунофлуоресценции, против процента погибших клеток, измеренных с помощью FACS после окрашивания йодидом пропидия, при moi 10-3 и 10-4. Низкая жизнеспособность клеток в образцах, полученных для инфекции при moi 10-3, не давала возможности получить надежные данные. Фиг. 2. Процент инфицированных клеток, видимых под микроскопом после анализа иммунофлуоресценции. Образцы, полученные при инфицировании с moi 10 и 1 через 48 ч после инфицирования, не показаны из-за полного ЦПД. Фиг. 3. Кинетика размножения вируса, измеренная в единицах гемагглютинации (HAU) с 1 по 6 день после инфицирования. Фиг. 4. Процент инфицированных клеток (позитивные клетки), видимых под микроскопом после анализа иммунофлуоресценции. Фиг. 5. Кинетика размножения вируса, измеренная в единицах гемагглютинации (HAU) с 1 по 6 день после инфицирования. Фиг. 6. Процент инфицированных клеток (позитивные клетки), видимых под микроскопом после анализа иммунофлуоресценции. Фиг. 7. Кинетика размножения вируса, измеренная в единицах гемагглютинации (HAU) со 2 по 6 день после инфицирования. Фиг. 8. Экспрессия мостиков Sia2-3Gal и Sia2-6Gal на рецепторах клеточной поверхности, присутствующих на клетках яичника китайского хомячка (СНО), клетках PER.C6 и клетках MDCK. (А) Схематичное представление взаимодействия агглютинина Sambuca nigra (SNA), лектина, который специфично узнает мостики Sia2-6Gal, и агглютинина Maackia amurensis (MAA), лектина, который специфично узнает мостики Sia2-3Gal. Также схематично изображено взаимодействие с ФИТЦ-меченым антителом против DIG и DIG-меченым лектином, связанным с олигосахаридной цепью на белке клеточной поверхности. (В) FACS-анализ клеток, инкубированных с DIG-мечеными лектинами. Лектины, связанные с клетками, выявляли с помощью ФИТЦ-меченого анти-DIG-антитела, используя способы, известные специалистам в данной области. Подсчитанное количество клеток наносили против интенсивности флуоресценции окрашенных лектином клеток (серые) по сравнению с клетками, которые инкубировали только с ФИТЦ-анти-DIG-антителом (не закрашены). На верхних панелях показан сдвиг при анализе FACS, полученный при использовании лектина SNA, а на нижних панелях показан сдвиг при анализе FACS, полученный при использовании лектина MAA. Фиг. 9. Инфекция А/Сидней/5/97 в PER.C6. (А) Влияние трипсина-EDTA на титры HAU. (В) Концентрация НА в мкг/мл и (С) титры инфекционности вируса в БОЕ/мл, которые измеряли в неочищенных вирусных надосадках через 96 ч после инфицирования. Фиг. 10. Инфекция B/Harbin/7/94 в PER.C6. (А) Влияние разных концентраций трипсина-EDTA,присутствующего во время и после вирусной инфекции, на кинетику роста. (В) Титры HAU на 50 мкл и(С) титры инфекционности вируса в БОЕ/мл. Фиг. 11. Инфекция Х-127 в PER.C6 при moi 10-3. (А) Влияние трипсина-EDTA на HAU, приведенное вHAU/50 мкл, и (В) титры инфекционности вируса в БОЕ/мл в течение 5 дней после инфицирования. Фиг. 12. Инфекция Х-127 в PER.C6 при moi 10-4. (А) Влияние трипсина-EDTA на HAU, приведенное вHAU/50 мкл, и (В) титры инфекционности вируса в БОЕ/мл в течение 5 дней после инфицирования. Фиг. 13. Влияние трипсина-EDTA на (А) жизнеспособность клеток PER.C6 и (В) биологическую активность вируса. Жизнеспособность клеток измеряли после окрашивания трипановым синим. ТитрыHAU измеряли, как описано, и приводили в HAU на 50 мкл. Фиг. 14. Влияние трипсина-EDTA на титры инфекционности вируса и содержание белка НА после инфицирования гриппом клеток PER.C6 с использованием А/Сидней/5/97. (А) Анализ инфекционности выполняли посредством инокуляции в четырех повторах клеток MDCK общим объемом 100 мкл 10 кратно серийно разведенных надосадков, содержащих вирусы, в бессывороточной среде с трипсиномEDTA (4 мкг/мл). Через семь дней надосадок указанных культур тестировали в отношении активности НА. Титры инфекционного вируса рассчитывали согласно способу Spearman-Karber (1931). (В) Вестернблот-анализ НА-белка А/Сидней/5/97. Сбор вирусных белков выполняли путем разрушения и денатурации белков, используя лизирующий буфер, содержащий DCH. Электрофорез выполняли в 10%DCH/ПААГ-геле в восстанавливающих условиях. Разделенные белки исследовали с помощью специфичной антисыворотки против А/Сидней-НА. Наносили возрастающие количества А/Сидней-НА- 15006136 антигена позитивного контроля (4 левых дорожки) и 10 мкл надосадков образцов клеток PER.C6, инкубированных с указанным количеством трипсина (5 правых дорожек). Фиг. 15. Жизнеспособность клеток PER.C6, концентрация глюкозы и кинетика роста А/Сидней/5/97 в перфузируемой системе на основе полых волокон. Фиг. 16. Характеристика и количественный анализ вируса гриппа А/Сидней/5/97, размножаемого вPER.C6 в перфузируемой системе на основе полых волокон. DCH-ПААГ и вестерн-блоты выполняли,как описано в подписи к фиг. 14, для анти-А/Сидней-НА-антитела. Моноклональное антитело анти-НАметка (НА-зонд (F7), мышиное моноклональное, (Santa Cruz) использовали в разведении 1:1000. В качестве второго антитела использовали конъюгированное с HRP антимышиное антитело козы (Biorad) в разведении 1:7500. Фиг. 17. Жизнеспособность клеток PER.C6 (левая панель) и концентрация глюкозы (правая панель) в биореакторе объемом 12 л вплоть до 92 ч после инфицирования вирусом А/Сидней/5/97. Фиг. 18. Инфекция PER.C6 вирусом А/Сидней/5/97 в 10 л суспензии клеток в биореакторе объемом 12 л. Кинетика репликации вируса, измеренная при анализе иммунофлуоресценции, приведена в процентах позитивно окрашенных клеток. Фиг. 19. Инфекция PER.C6 вирусом А/Сидней/5/97 в 10 литрах суспензии клеток в биореакторе объемом 12 л. Кинетика репликации вируса, измеренная при анализе гемагглютинации, приведена вHAU в течение нескольких дней после вирусной инфекции. Столбик, обозначенный звездочкой, представляет количество HAU, полученное после очистки в Powerfuge, как описано в тексте. Фиг. 20. Вестерн-блот после инфицирования PER.C6 вирусом А/Сидней/5/97 в 10 л суспензии клеток в биореакторе объемом 12 л. Показана характеристика и количественный анализ полипептида НА вируса гриппа А/Сидней/5/97. DCH/ПААГ и вестерн-блот выполняли, как описано в подписи к фиг. 14. Разные субъединицы (НА 1 и НА 2) и нерасщепленные белки HA0 показаны острием стрелок. В качестве позитивного контроля служил НА, полученный из NIBSC. Фиг. 21. Определение HAU и БОЕ/мл после инфицирования PER.C6 вирусом А/Сидней/5/97 в 10 л суспензии клеток в биореакторе объемом 12 л. После инфицирования следовала обработка нисходящим потоком (DSP). Также показан выход при сборе вирусов после ультрафильтрации на полых волокнах (20 кратное концентрирование). Фиг. 22. Инфекция PER.C6 вирусом А/Сидней/5/97 в 2 л суспензии клеток в биореакторе объемом 3 л. Приведены жизнеспособность клеток PER.C6 (вверху слева), концентрация глюкозы (вверху справа) и кинетика роста вирусов в процентах позитивно окрашенных клеток (внизу слева) и HAU (внизу справа). Фиг. 23. Инфекция PER.C6 вирусом A/Beijing/262/95 в 2 л суспензии клеток в биореакторе объемом 3 л. Приведены жизнеспособность клеток PER.C6 (вверху слева), концентрация глюкозы (вверху справа) и кинетика роста вирусов в процентах позитивно окрашенных клеток (внизу слева) и HAU (внизу справа). Фиг. 24. Инфекция PER.C6 вирусом B/Harbin/7/94 в 2 л суспензии клеток в биореакторе объемом 3 л. Приведены жизнеспособность клеток PER.C6 (вверху слева), концентрация глюкозы (вверху справа) и кинетика роста вирусов в процентах позитивно окрашенных клеток (внизу слева) и HAU (внизу справа). Фиг. 25. Вестерн-блот-анализ нерасщепленного белка HA0 вируса А/Сидней/5/97. Позитивно окрашенные белки выявляли после инкубации со специфичной антисывороткой против А/Сидней, полученной из NIBSC, и как описано в подписи к фиг. 14 и в тексте. Фиг. 26. (А) Вестерн-блот-анализ полученного из вируса А/Сидней/5/97 белка HA0, расщепленного трипсином. Белки выявляли после инкубации со специфичной антисывороткой против А/Сидней. Слева стандартный расщепленный НА А/Сидней, справа - HA0, обработанный возрастающими количествами трипсина. (В) Определение активности трипсина в надосадке культуры в ходе получения вируса гриппаB/Harbin с использованием в качестве субстрата HA0 вируса гриппа А/Сидней/5/97. Вестерн-блот-анализ продуктов расщепления HA0, НА 1 и НА 2, которые визуализировали с помощью специфичной антисыворотки против НА вируса гриппа А/Сидней/5/97, указанной в подписи к фиг. 14. Фиг. 27. Вестерн-блот-анализ HA0 А/Сидней, расщепленного N-гликозидазой F. Белки выявляли после инкубации со специфичной антисывороткой против А/Сидней. Полоса белка, отмеченная звездочкой, соответствует дегликозилированному продукту. Фиг. 28. Вестерн-блот-анализ НА А/Сидней/5/97 после расщепления Accutase. Белки выявляли после инкубации со специфичной поликлональной антисывороткой против НА А/Сидней. Слева - HA0 перед и после обработки трипсином, справа - HA0, расщепленный уменьшающимися количествами Accutase. Фиг. 29. Электронная микрофотография вируса гриппа А/Сидней/5/97. (А) Клетки PER.C6 через 72 ч после инфицирования. (В и С) Негативное окрашивание на вирус, полученный из инфицированныхPER.C6. (D и Е) Негативное окрашивание материала, очищенного в сахарозе. Фиг. 30. (А) Тестированные на клетках PER.C6 разные штаммы вируса гриппа А и В. (В) Титры инфекционности трех указанных вирусов гриппа А- и В-типа, полученных из инфицированных клеток- 16006136 Фиг. 31. Иммунофлуоресценция клеток PER.C6 и Vero, инфицированных другими вирусами, отличными от вирусов гриппа. (А) Позитивно окрашиваемые клетки при инфекции вирусом кори. (В) Позитивно окрашиваемые клетки при инфекции клеток Vero вирусом HSV-1. (С) Позитивно окрашиваемые клетки при инфекции клеток Vero вирусом HSV-2. (D) Позитивно окрашиваемые клетки при инфекции клеток PER.C6 вирусом HSV-1. (Е) Позитивно окрашиваемые клетки при инфекции клеток PER.C6 вирусом HSV-2. Фиг. 32. Титры инфекционности, определенные после размножения вируса кори (средняя панель),HSV-1 (нижняя панель) и HSV-2 (верхняя панель) на клетках PER.C6. Фиг. 33. Репликация ротавируса после инфицирования клеток PER.C6 (верхняя панель) и Vero(нижняя панель) при разных значениях moi, измеренная с помощью ELISA в неочищенных надосадках. Ссылкиvaccines. Dev. Biol. Stand. 1977 13; 39: 193-20. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения вируса или вирусных белков, отличных от аденовируса или аденовирусных белков, для применения в качестве вакцины, включающий в себя введение в клетку последовательности,кодирующей по меньшей мере один продукт гена Е 1 аденовируса или его функциональное производное,и нуклеиновой кислоты, кодирующей вирус и/или вирусные белки, культивирование указанной клетки в подходящей среде, обеспечение возможности экспрессии вируса и/или вирусных белков и сбор указанного вируса и/или вирусных белков из культуральной среды и/или клетки. 2. Способ по п.1, где указанной клеткой является первичная клетка человека. 3. Способ по п.1 или 2, где указанная первичная клетка иммортализована продуктом гена Е 1. 4. Способ по любому из пп.1-3, где указанную клетку получают из ретинобласта эмбриона человека. 5. Способ по любому из пп.1-4, где указанная последовательность, кодирующая по меньшей мере один продукт гена Е 1, присутствует в геноме указанной клетки человека. 6. Способ по любому из пп.1-5, где указанная клетка не продуцирует структурные белки аденовируса. 7. Способ по любому из пп.1-6, где указанная клетка дополнительно, содержит последовательность,кодирующую продукт гена Е 2 А аденовируса или его функциональное производное, аналог или фрагмент. 8. Способ по п.7, где указанная последовательность, кодирующая продукт гена Е 2 А аденовируса или его функциональное производное, аналог или фрагмент, присутствует в геноме указанной клетки человека. 9. Способ по любому из пп.7 или 8, где продукт гена Е 2 А аденовируса является температурочувствительным. 10. Способ по любому из пп.1-9, где клетка не содержит других аденовирусных последовательностей. 11. Способ по любому из пп.1-10, где указанная клетка способна расти в суспензии. 12. Способ по любому из пп.1-11, где указанную клетку можно культивировать в отсутствие сыворотки. 13. Способ по любому из пп.1-12, где указанной клеткой человека является клетка PER.C6 ЕСАСС 96022940 или производная от нее. 14. Способ по любому из пп.1-13, где указанные вирусные белки как сами по себе, так и в составе вируса, подвергаются посттрансляционным и/или перитрансляционным модификациям. 15. Способ по п.14, где указанные модификации включают в себя гликозилирование. 16. Способ по любому из пп.1-15, где по крайней мере одним из указанных вирусных белков является нейраминидаза и/или гемагглютинин вируса гриппа. 17. Способ по любому из пп.1-16, где указанный вирус является энтеровирусом, таким как риновирус, афтовирус или вирус полиомиелита. 18. Способ по любому из пп.1-16, где указанный вирус является вирусом герпеса, таким как вирус простого герпеса, вирус псевдобешенства или вирус коровьего бешенства. 19. Способ по любому из пп.1-16, где указанный вирус является ортомиксовирусом, таким как вирус гриппа, или парамиксовирусом, таким как вирус ньюкаслской болезни, респираторно-синцитиальный вирус, вирус эпидемического паротита или вирус кори. 20. Способ по любому из пп.1-16, где указанный вирус является ретровирусом, таким как вирус иммунодефицита человека, или где указанный вирус является парвовирусом или паповавирусом. 21. Способ по любому из пп.1-16, где указанный вирус является ротавирусом или коронавирусом,таким как вирус инфекционного гастроэнтерита, или флавивирусом, таким как вирус клещевого энцефалита или вирус желтой лихорадки. 22. Способ по любому из пп.1-16, где указанный вирус является тогавирусом, таким как вирус краснухи или вирус восточного, западного или венесуэльского энцефаломиелита лошадей. 23. Способ по любому из пп.1-16, где указанный вирус является вирусом, вызывающим гепатит, таким как вирус гепатита А или гепатита В. 24. Способ по любому из пп.1-16, где указанный вирус является пестивирусом, таким как вирус холеры свиней, или рабдовирусом, таким как вирус бешенства.- 18006136 25. Способ по любому из пп.1-16, где указанный вирус является буньявирусом, таким как хантавирус. 26. Применение клетки человека, содержащей в своем геноме последовательность, кодирующую по меньшей мере один продукт гена Е 1 аденовируса или его функциональное производное, причем указанная клетка не продуцирует структурных белков аденовируса для получения вируса или вирусных белков,отличных от аденовируса или аденовирусных белков, для применения в качестве вакцины. 27. Применение по п.26, где указанную клетку человека получают из первичной клетки. 28. Применение по п.26 или 27, где указанная клетка является клеткой PER.C6 или производной от нее. 29. Применение по пп.26-28, где указанная клетка дополнительно содержит в своем геноме последовательность, кодирующую продукт гена Е 2 А аденовируса или его функциональное производное, аналог или фрагмент. 30. Применение по п.29, где продукт гена Е 2 А аденовируса является температурочувствительным. 31. Клетка человека, содержащая в своем геноме последовательность, кодирующую по меньшей мере один продукт гена Е 1 аденовируса или его функциональное производное, причем указанная клетка не продуцирует структурных белков аденовируса и содержит нуклеиновую кислоту, кодирующую вирус,или по меньшей мере один белок вируса, не являющегося аденовирусом, где указанная клетка предназначена для получения вируса или вирусных белков, отличных от аденовируса или аденовирусных белков, для применения в качестве вакцины. 32. Клетка человека по п.31, которую получают из клетки PER.C6 ЕСАСС 96022940. 33. Клетка человека по п.31 или 32, которая дополнительно содержит в своем геноме последовательность, кодирующую продукт гена Е 2 А аденовируса или его функциональное производное, аналог или фрагмент. 34. Клетка человека по п.33, где продукт гена Е 2 А является температурочувствительным.
МПК / Метки
МПК: C12N 15/34, A61P 31/12, C07K 14/11, A61K 39/145
Метки: вирусного, способ, вакцины, белка, вируса, получения
Код ссылки
<a href="https://eas.patents.su/30-6136-sposob-polucheniya-virusa-ili-virusnogo-belka-dlya-polucheniya-vakciny.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения вируса или вирусного белка для получения вакцины</a>
Предыдущий патент: Замещенные тиоацетамиды
Следующий патент: Мутантный хемокин rantes человека и применение мутантных хемокинов для лечения рассеянного склероза
Случайный патент: Способ переработки оксидных побочных продуктов, содержащих мышьяк