Монофторалкилпроизводные
Номер патента: 4299
Опубликовано: 26.02.2004
Авторы: Митчелл Дэвид, Зарринмайех Хамидех, Саймон Ричард Ли, Зиммерман Деннис Майкл, Миллер Вилльям Дэвид, Кантрелл Бадди Юджен, Фрэй Эндрю Хендли, Бендер Дэвид Майкл, Джоунс Винтон Деннис
Формула / Реферат
1. Соединение формулы
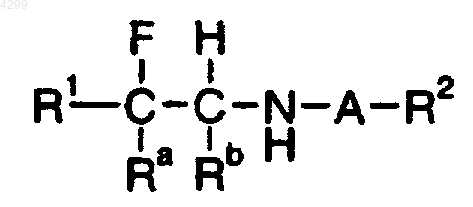
где A означает SO2;
Ra означает (1-6C)алкил;
Rb означает H;
R1 означает группу нафтил или группу фенил, фурил, тиенил или пиридил, которая является незамещенной или замещена одним или двумя заместителями, выбранными независимо из групп галоген; нитро; циано; гидроксиимино; (1-10C)алкил; (2-10C)алкенил; (2-10C)алкинил; (3-8C)циклоалкил; гидрокси(3-8C)циклоалкил; оксо(3-8C)циклоалкил; галоген(1-10C)алкил; (CH2)yX1R9, где y означает 0 или целое число от 1 до 4, X1 означает O, S, NR10, CO, COO, OCO, CONR11, NR12CO, NR12COCOO или OCONR13, R9 означает водород, (1-10C)алкил, (3-10C)алкенил, (3-10C)алкинил, пирролидинил, тетрагидрофурил, морфолино или (3-8C)циклоалкил, а R10, R11, R12 и R13, каждый независимо, означают водород или (1-10C) алкил или R9 и R10, R11, R12 или R13 вместе с атомом азота, к которому они присоединены, образуют группу азетидинил, пирролидинил, пиперидинил или морфолино; N-(1-4C)алкилпиперазинил; N-фенил(1-4C)алкилпиперазинил; тиенил; фурил; оксазолил; изоксазолил; пиразолил; имидазолил; тиазолил; пиридил; пиридазинил; пиримидинил; дигидротиенил; дигидрофурил; дигидротиопиранил; дигидропиранил; дигидротиазолил; (1-4C)алкоксикарбонилдигидротиазолил; (1-4C)алкоксикарбонилдиметилдигидротиазолил; тетрагидротиенил; тетрагидрофурил; тетрагидротиопиранил; тетрагидропиранил; индолил; бензофурил; бензотиенил; бензимидазолил; и группы формулы R14-(La)n-X2- (Lb)m, где X2 представляет связь O, NH, S, SO, SO2, CO, CH(OH), CONH, NHCO, NHCONH, NHCOO, COCONH, OCH2CONH или CH=CH, La и Lb каждый обозначают (1-4C)алкилен, одно из n и m равно 0 или 1, а другое равно 0 и R14 означает группу фенил или гетероароматическую группу, любая из которых является незамещенной или замещена одним или двумя заместителями из галогена; нитро; циано; гидроксиимино, (1-10C)алкила; (2-10C)алкенила; (2-10C)алкинила; (3-8C)циклоалкила; 4-(1,1-диоксотетрагидро-1,2-тиазинила); галоген(1-10C)алкила; циано(2-10C)алкенила; фенила; и (CH2)zX3R15, где z равно 0 или целому числу от 1 до 4, X3 означает O, S, NR16, CO, CH(OH), COO, OCO, CONR17, NR18CO, NHSO2, SO2NH, NHSO2NR17, NHCONH, OCONR19 или NR19COO, R15 означает водород, (1-10C)алкил, фенил(1-4C)алкил, галоген(1-10C)алкил, (1-4C)алкоксикарбонил(1-4C)алкил, (1-4C)алкилсульфониламино(1-4C)алкил, N-(1-4C)алкоксикарбонил(1-4C)алкилсульфониламино(1-4C)алкил, (3-10C)алкенил, (3-10C)алкинил, (3-8C)циклоалкил, камфорил или ароматическую либо гетероароматическую группу, которая является незамещенной или замещена одним или двумя заместителями, выбранными из галогена, (1-4C)алкила, галоген(1-4C)алкила, ди(1-4C)алкиламино и (1-4C)алкокси, и R16, R17, R18 и R19, каждый независимо, означают водород или (1-10C)алкил или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединены, образуют азетидинил, пирролидинил, пиперидинил или морфолиногруппу;
R2 означает (1-6C)алкил;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R2 представляет метил, этил, изопропил или трет-бутил.
3. Соединение по п.2, где R3 представляет метил, этил, пропил, н-бутил, втор-бутил, трет-бутил, пентил или гексил.
4. Соединение по п.3, где Ra представляет метил.
5. Соединение по п.4, где R2 представляет изопропил.
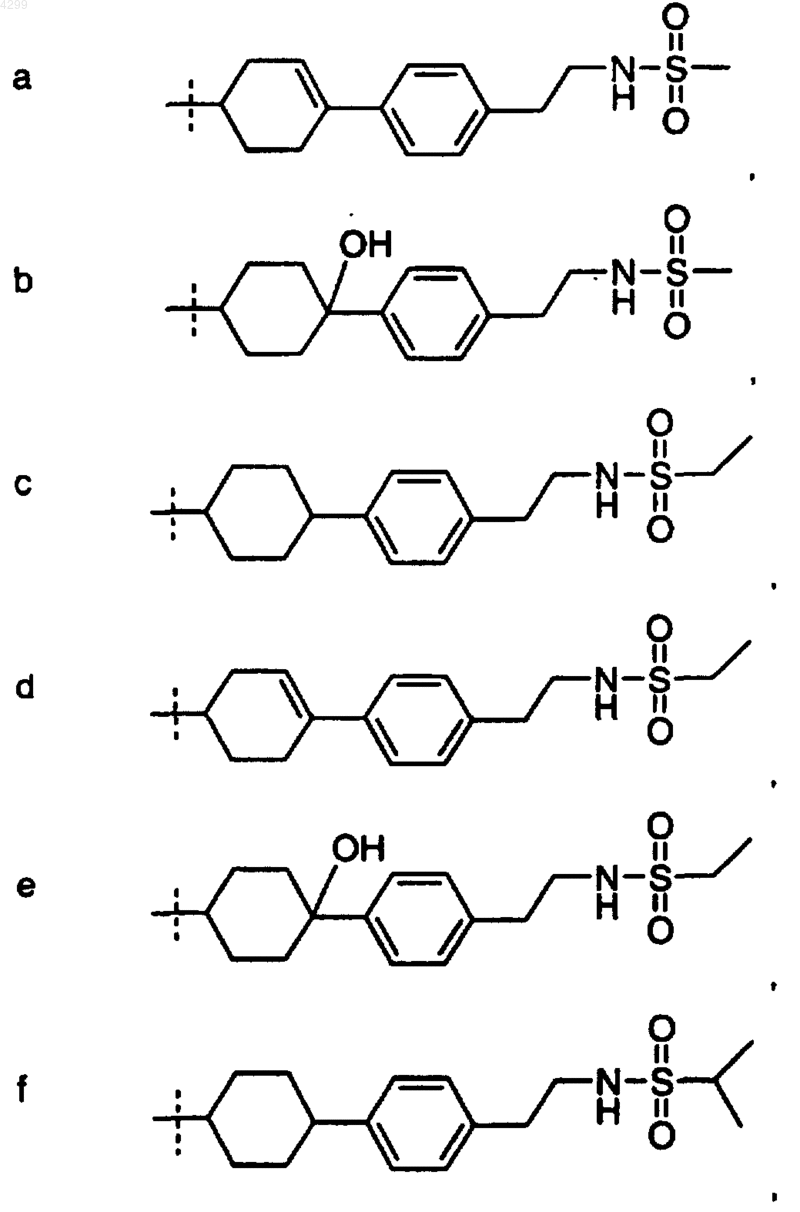
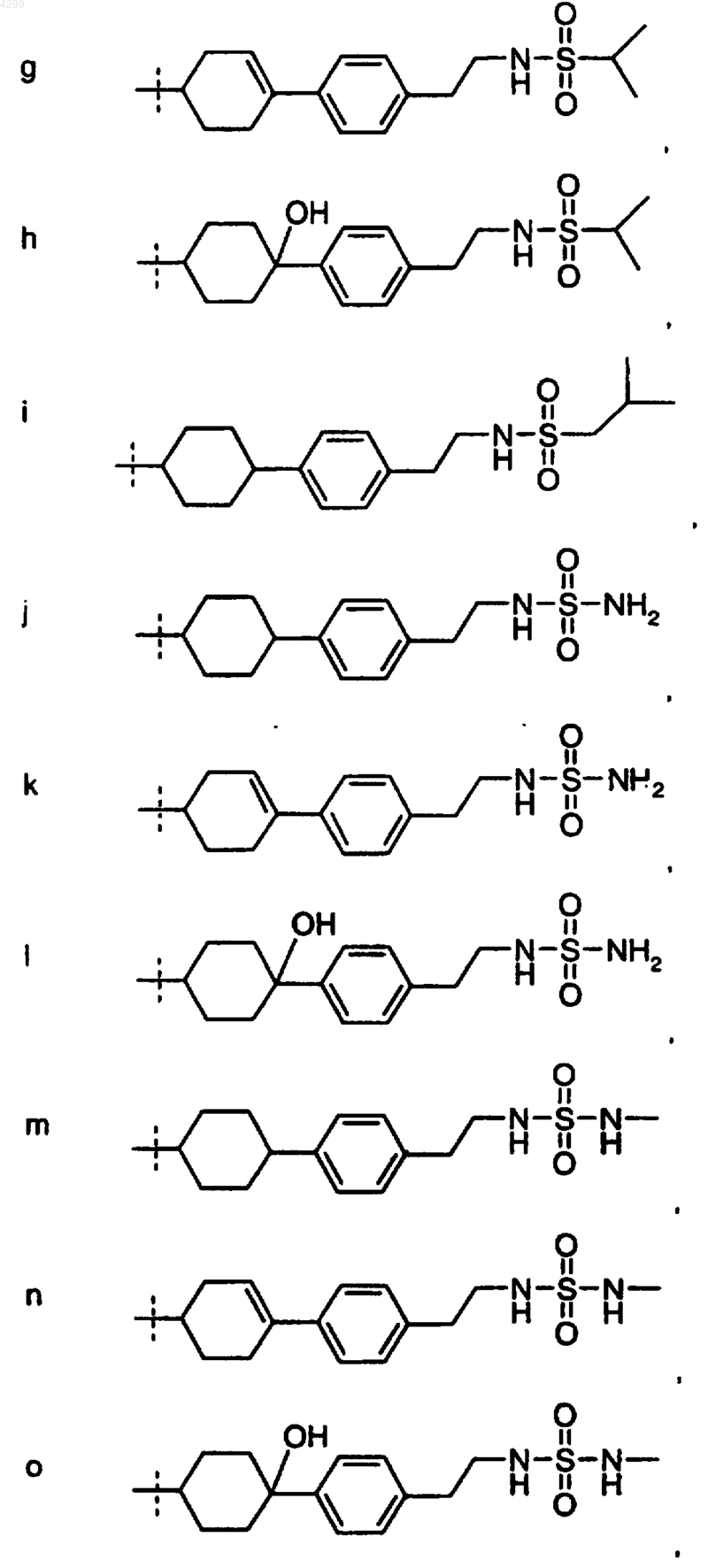
6. Соединение по любому из пп.1-5, где R1 выбран из группы, состоящей из
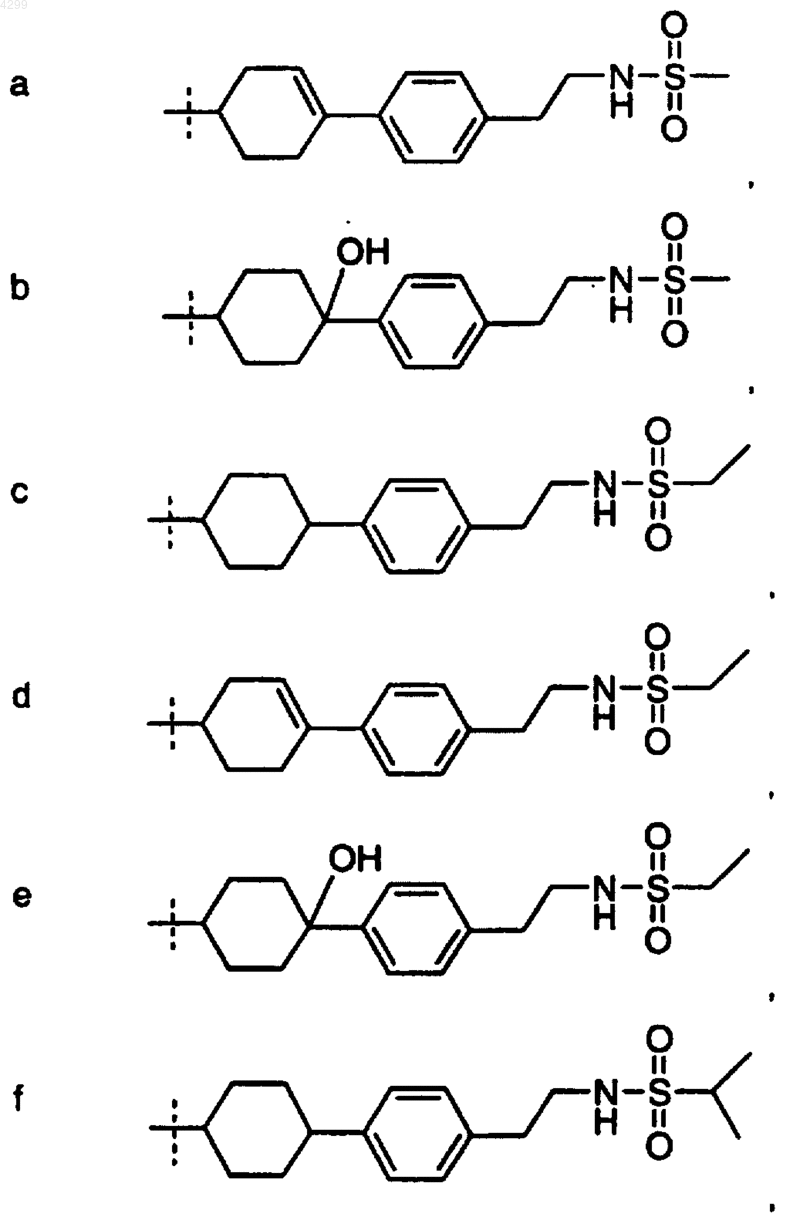
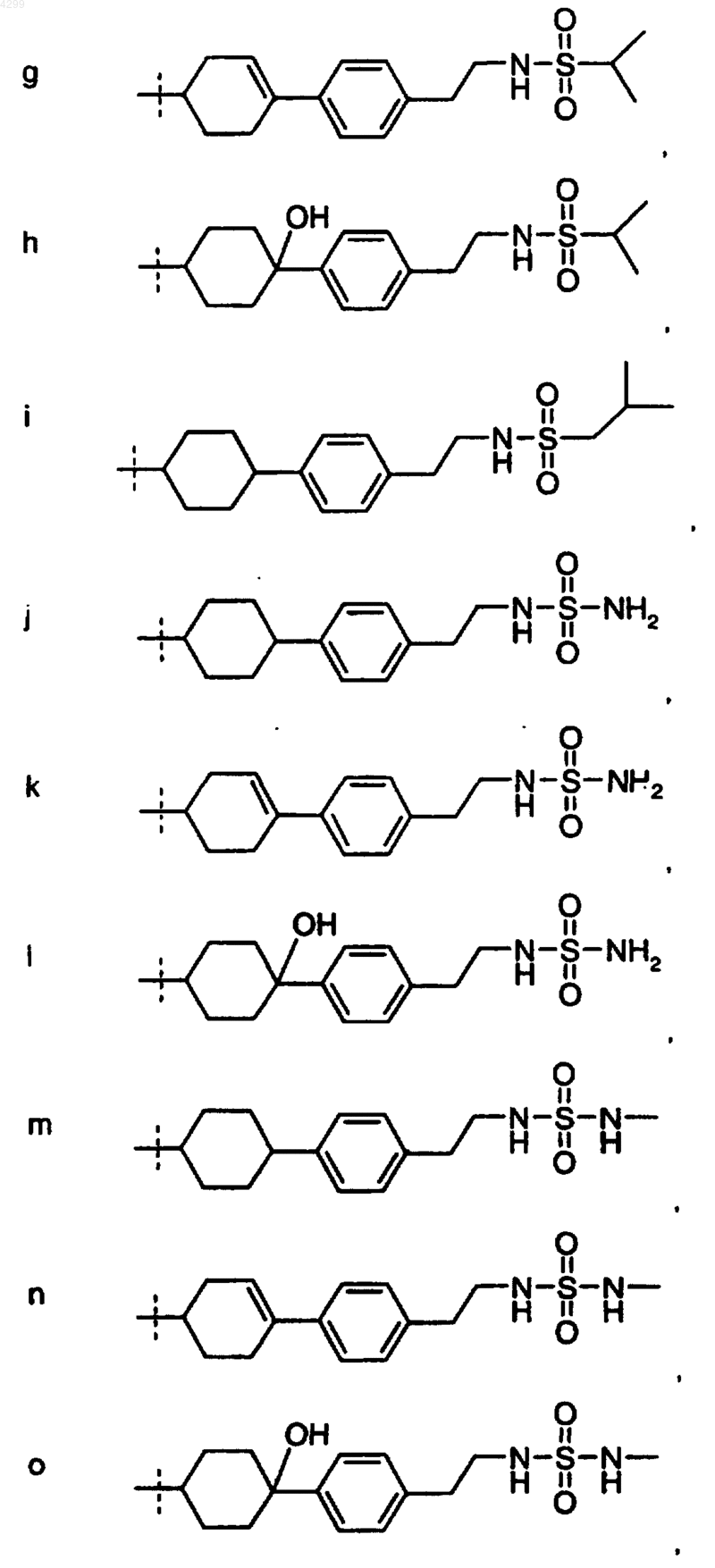
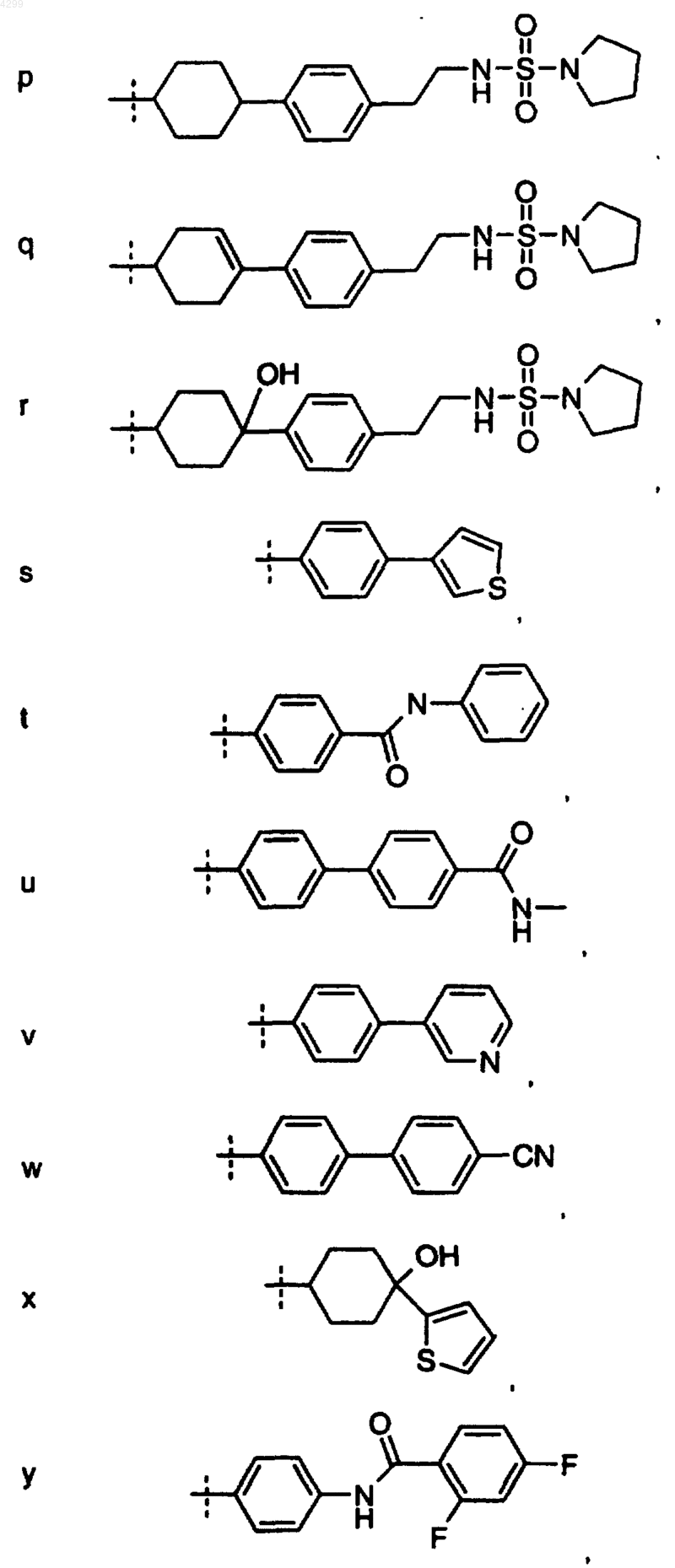
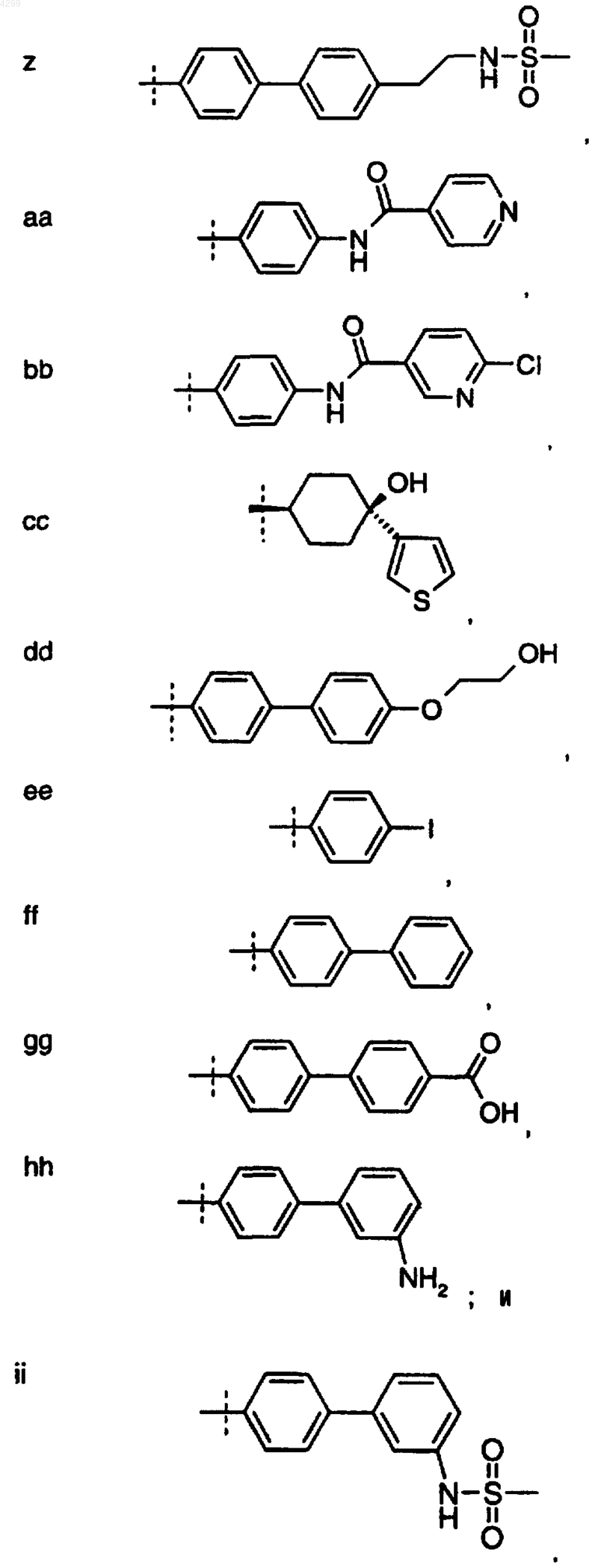
7. Соединение, выбранное из группы, включающей в себя
[2-фтор-2-(4-иодфенил)пропил][(метилэтил)сульфонил]амин;
[2-фтор-2-(4-фенилфенил)пропил][(метилэтил)сульфонил]амин;
4-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]бензолкарбонитрил;
4-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]бензойную кислоту;
{2-[4-(3-аминофенил)фенил]-2-фторпропил}[(метилэтил)сульфонил]амин;
[2-фтор-2-(4-{3-[(метилсульфонил)амино]фенил}фенил)пропил][(метилэтил)сульфонил]амин;
[2-фтор-2-(4-(3-тиенил)фенил)пропил][(метилэтил)сульфонил]амин;
[2-фтор-2-(4-(3-пиридил)фенил)пропил][(метилэтил)сульфонил]амин;
2-{4-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]фенил}этаннитрил;
4-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]бензальдегид;
{4-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]фенил}-N-метилкарбоксамид;
{4-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]фенил}-N,N-диметилкарбоксамид;
N-этил-{4-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]фенил}карбоксамид;
4-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]фенилпирролидинилкетон;
N-{3-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]фенил}ацетамид;
N-{3-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]фенил}пропанамид;
N-{3-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]фенил}бутанамид;
амино-N-{3-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]фенил}амид;
N-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]бензамид;
(3-цианофенил)-N-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]карбоксамид;
N-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]-4-пиридилкарбоксамид;
N-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]{4-[2-(метоксикарбониламино)этил]фенил}карбоксамид;
(2-{4-[(3,5-дифторфенил)метокси]фенил}-2-фторфенил)[(метилэтил)сульфонил]амин;
{2-фтор-2-[4-(4-{2-[(метилсульфонил)амино]этил}фенил)фенил]пропил}[(метилэтил)сульфонил]амин;
(4-хлорфенил)-N-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]карбоксамид;
(6-хлор-(3-пиридил))-N-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]карбоксамид;
(4-цианофенил)-N-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]карбоксамид;
этокси-N-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]карбоксамид;
N-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]изоксазол-5-илкарбоксамид;
4-(диметиламино)-N-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]бутанамид;
N-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]-3-тиенилкарбоксамид;
{2-фтор-2-[4-(фенилметокси)фенил]пропил}[(метилэтил)сульфонил]амин;
2-{[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенокси]метил}бензолкарбонитрил;
[2-фтор-2-(4-метоксифенил)пропил][(метилэтил)сульфонил]амин;
{2-[4-(3,5-дифторфенил)фенил]-2-фторпропил}[(метилэтил)сульфонил]амин;
[(диметиламино)сульфонил][2-фтор-2-(4-иодфенил)пропил]амин;
4-[4-(2-{[(диметиламино)сульфонил]амино}-1-фторизопропил)фенил]бензолкарбонитрил;
[(диметиламино)сульфонил][2-фтор-2-(4-{3-[(метилсульфонил)амино]фенил}фенил)пропил]амин;
[(диметиламино)сульфонил]{2-фтор-2-[4-(3-{[(метилэтил)сульфонил]амино}фенил)фенил]пропил}амин;
4-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]бензолсульфонамид;
N-(2-{3-фтор-4'-[1-фтор-1-метил-2-(пропан-2-сульфониламино)этил]бифенил-4-ил}этил)изобутирамид;
N-(2-{3-фтор-4'-[1-фтор-1-метил-2-(пропан-2-сульфониламино)этил]бифенил-4-ил}этил)ацетамид;
N-{2-(2-фтор-2-[3'-фтор-4'-(2-метансульфониламино)этил]бифенил-4-ил)пропил}-2-пропансульфонамид;
N-{2-(2-фтор-2-[3'-фтор-4'-(2-(пропан-2-сульфониламино)этил)]бифенил-4-ил)пропил}-2-пропансульфонамид;
N-(2-{3'-фтор-4'-[2-(пропан-2-сульфониламино)этил]бифенил-4-ил}-2-гидроксипропил)-2-пропансульфонамид;
N-{2-фтор-2-[4-(2-оксо-2,3-дигидро-1H-индол-6-ил)фенил]пропил}-2-пропансульфонамид;
(+)-[2-фтор-2-(4-иодфенил)пропил][(метилэтил)сульфонил]амин;
(-)-[2-фтор-2-(4-иодфенил)пропил][(метилэтил)сульфонил]амин;
[2-фтор-2-(4-{3-[(метилсульфонил)амино]фенил}фенил)пропил]-[(метилэтил)сульфонил]амин (энантиомер 1);
[2-фтор-2-(4-{3-[(метилсульфонил)амино]фенил}фенил)пропил]-[(метилэтил)сульфонил]амин (энантиомер 2);
{4-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]фенил}-N-метилкарбоксамид (энантиомер 1) и
{4-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]фенил}-N-метилкарбоксамид (энантиомер 2)
и их фармацевтически приемлемые соли.
8. Соединение по п.5, где замещенный фенил замещен группой, выбранной из групп галоген; нитро; циано; гидроксиимино; (1-10C)алкил; (2-10C)алкенил; (2-10C)алкинил; (3-8C)циклоалкил; гидрокси(3-8C)циклоалкил; оксо(3-8C)циклоалкил; галоген (1-10C) алкил; (CH2)yX1R9, где y означает 0 или целое число от 1 до 4, X1 означает O, S, NR10, CO, COO, OCO, CONR11, NR12CO, NR12COCOO, OCONR13, R9 обозначает водород, (1-10C)алкил, (3-10C)алкенил, (3-10C)алкинил, пирролидинил, тетрагидрофурил, морфолино или (3-8C)циклоалкил, а R10, R11, R12 и R13, каждый независимо, означают водород или (1-10C)алкил или R9 и R10, R11, R12 или R13 вместе с атомом азота, к которому они присоединены, образуют группу азетидинил, пирролидинил, пиперидинил или морфолино; N-(1-4C)алкилпиперазинил; N-фенил(1-4C)алкилпиперазинил; тиенил; фурил; оксазолил; изоксазолил; пиразолил; имидазолил; тиазолил; пиридил; пиридазинил; пиримидинил; дигидротиенил; дигидрофурил; дигидротиопиранил; дигидропиранил; дигидротиазолил; (1-4C)алкоксикарбонилдигидротиазолил; (1-4C)алкоксикарбонилдиметилдигидротиазолил; тетрагидротиенил; тетрагидрофурил; тетрагидротиопиранил; тетрагидропиранил; индолил; бензофурил; бензотиенил; бензимидазолил; и группы формулы R14-(La)n-X2-(Lb)m, где X2 представляет связь, O, NH, S, SO, SO2, CO, CH(OH), CONH, NHCO, NHCONH, NHCOO, COCONH, OCH2CONH или CH=CH, La и Lb каждый означают (1-4C)алкилен, одно из n и m равно 0 или 1, а другое равно 0 и R14 означает группу фенил или гетероароматическую группу, любая из которых является незамещенной или замещена одним или двумя заместителями, выбранными из галогена; нитро; циано; (1-10C)алкила; (2-10C)алкенила; (2-10C)алкинила; (3-8C)циклоалкила; 4-(1,1-диоксотетрагидро-1,2-тиазинила); галоген(1-10C)алкила; циано(2-10C)алкенила; фенила; и (CH2)zX3R15, где z равно 0 или целому числу от 1 до 4, X3 означает O, S, NR16, CO, CH(OH), COO, OCO, CONR17, NR18CO, NHSO2, SO2NH, NHSO2NR17, OCONR19 или NR19COO, R15 означает водород, (1-10C)алкил, фенил(1-4C)алкил, галоген(1-10C)алкил, (1-4C)алкоксикарбонил(1-4C)алкил, (1-4C)алкилсульфониламино(1-4C)алкил, N-(1-4C)алкоксикарбонил(1-4C)алкилсульфониламино(1-4C)алкил, (3-10C)алкенил, (3-10C)алкинил, (3-8C)циклоалкил, камфорил или ароматическую или гетероароматическую группу, которая является незамещенной или замещена одним или двумя заместителями из галогена, (1-4C)алкила, галоген(1-4C)алкила, ди(1-4C)алкиламино и (1-4C)алкокси, и R16, R17, R18 и R19, каждый независимо, означают водород или (1-10C)алкил или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединены, образуют группу азетидинил, пирролидинил, пиперидинил или морфолино.
9. Соединение по п.8, где замещенный фенил замещен группой формулы R14-(La)n-X2-(Lb)m, где X2 представляет связь, O, NH, S, SO, SO2, CO, CH(OH), CONH, NHCO, NHCONH, NHCOO, COCONH, OCH2CONH или CH=CH, La и Lb каждый означают (1-4C)алкилен, одно из n и m равно 0 или 1, а другое равно 0 и R14 означает группу фенил или гетероароматическую группу, любая из которых является незамещенной или замещена одним или двумя заместителями, выбранными из галогена; нитро; циано; (1-10C)алкила; (2-10C)алкенила; (2-10C)алкинила; (3-8C)циклоалкила; 4-(1,1-диоксотетрагидро-1,2-тиазинила); галоген(1-10C)алкила; циано(2-10C)алкенила; фенила; и (CH2)zX3R15, где z равно 0 или целому числу от 1 до 4, X3 означает O, S, NR16, CO, CH(OH), COO, OCO, CONR17, NR18CO, NHSO2, SO2NH, NHSO2NR17, OCONR19 или NR19COO, R15 означает водород, (1-10C)алкил, фенил(1-4C)алкил, галоген(1-10C)алкил, (1-4C)алкоксикарбонил(1-4C)алкил, (1-4C)алкилсульфониламино(1-4C)алкил, N-(1-4C)алкоксикарбонил(1-4C)алкилсульфониламино(1-4C)алкил, (3-10C)алкенил, (3-10C)алкинил, (3-8C)циклоалкил, камфорил или ароматическую или гетероароматическую группу, которая является незамещенной или замещена одним или двумя заместителями, выбранными из галогена, (1-4C)алкила, галоген(1-4C)алкила, ди(1-4C)алкиламино и (1-4C)алкокси, и R16, R17, R18 и R19, каждый независимо, означают водород или (1-10C) алкил или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединены, образуют группу азетидинил, пирролидинил, пиперидинил или морфолино.
10. Соединение по п.9, где (La)n-X2- (Lb)m представляет связь, CONH или CH2O.
11. Соединение по п.10, где R14 представляет фенил, который является незамещенным или замещен одним или двумя заместителями, выбранными из галогена; нитро; циано; (1-10C)алкила; (2-10C)алкенила; (2-10C)алкинила; (3-8C)циклоалкила; 4-(1,1-диоксотетрагидро-1,2-тиазинила); галоген(1-10C)алкила; циано (2-10C)алкенила; фенила и (CH2)zX3R15, где z равно 0 или целому числу от 1 до 4, X3 означает O, S, NR16, CO, CH(OH), COO, OCO, CONR17, NR18CO, NHSO2, SO2NH, NHSO2NR17, OCONR19 или NR19COO, R15 представляет водород, (1-10C)алкил, фенил(1-4C)алкил, галоген(1-10C)алкил, (1-4C)алкоксикарбонил(1-4C)алкил, (1-4C)алкилсульфониламино(1-4C)алкил, N-(1-4C)алкоксикарбонил(1-4C)алкилсульфониламино(1-4C)алкил, (3-10C)алкенил, (3-10C)алкинил, (3-8C)циклоалкил, камфорил или ароматическую или гетероароматическую группу, которая является незамещенной или замещена одним или двумя заместителями, выбранными из галогена, (1-4C)алкила, галоген(1-4C)алкила, ди(1-4C)алкиламино и (1-4C)алкокси, и R16, R17, R18 и R19, каждый независимо, означают водород или (1-10C) алкил или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединены, образуют азетидинил, пирролидинил, пиперидинил или морфолиногруппу.
12. Соединение по п.11, где фенил замещен одним или двумя заместителями, выбранными из галогена; нитро; циано; (1-10C)алкиыр; галоген(1-10C)алкила и (CH2)zX3R15, где z равно 0, 1 или 2, X3 означает O, NR16, CO, COO, CONR17, NR18CO, NHSO2, SO2NH, NHSO2NR17, OCONR19 или NR19COO, R15 означает водород, (1-10C)алкил, фенил(1-4C)алкил, галоген(1-10C)алкил или (3-10C)алкенил и R16, R17, R18 и R19, каждый независимо, означают водород или (1-10C)алкил.
13. Соединение по п.10, где фенил замещен одним или двумя заместителями, выбранными из фтора; хлора; циано; (1-4C)алкила; трифторметила и (CH2)zX3R15, где z равно 0 или 2, X3 означает NR16, CO, COO, CONR17, NR18CO, NHSO2, R15 представляет водород, (1-4C)алкил, фенил(1-4C)алкил или галоген(1-4C)алкил и R16, R17, R18 и R19, каждый независимо, означают водород или (1-4C)алкил.
14. Соединение по п.10, где фенил замещен одним заместителем, выбранным из фтора; хлора; циано; (1-4C)алкила; трифторметила и (CH2)zX3R15, где z равно 0 или 2, X3 означает NR16, CO, COO, CONR17, NR18CO, NHSO2, R15 представляет водород, (1-4C)алкил, фенил(1-4C)алкил или галоген(1-4C)алкил и R16, R17, R18 и R19, каждый независимо, означают водород или (1-4C)алкил.
15. Соединение формулы

где R1 означает замещенный фенил, где указанный замещенный фенил замещен группой, выбираемой из групп галоген; нитро; циано; гидроксиимино; (1-10C)алкил; (2-10C)алкенил; (2-10C)алкинил; (3-8C)циклоалкил; гидрокси(3-8C)циклоалкил; оксо(3-8C)циклоалкил; галоген (1-10C)алкил; (CH2)yX1R9, где y означает 0 или целое число от 1 до 4, X1 означает O, S, NR10, CO, COO, OCO, CONR11, NR12CO, NR12COCOO, OCONR13, R9 обозначает водород, (1-10C)алкил, (3-10C)алкенил, (3-10C)алкинил, пирролидинил, тетрагидрофурил, морфолино или (3-8C) циклоалкил, a R10, R11, R12 и R13, каждый независимо, означают водород или (1-10C)алкил или R9 и R10, R11, R12 или R13 вместе с атомом азота, к которому они присоединены, образуют группу азетидинил, пирролидинил, пиперидинил или морфолино; N-(1-4C)алкилпиперазинил; N-фенил(1-4C)алкилпиперазинил; тиенил; фурил; оксазолил; изоксазолил; пиразолил; имидазолил; тиазолил; пиридил; пиридазинил; пиримидинил; дигидротиенил; дигидрофурил; дигидротиопиранил; дигидропиранил; дигидротиазолил; (1-4C)алкоксикарбонилдигидротиазолил; (1-4C)алкоксикарбонилдиметилдигидротиазолил; тетрагидротиенил; тетрагидрофурил; тетрагидротиопиранил; тетрагидропиранил; индолил; бензофурил; бензотиенил; бензимидазолил; и группа формулы R14-(La)n-X2-(Lb)m, где X2 представляет связь, O, NH, S, SO, SO2, CO, CH(OH), CONH, NHCO, NHCONH, NHCOO, COCONH, OCH2CONH или CH=CH, La и Lb каждый означают (1-4C)алкилен, одно из n и m равно 0 или 1, а другое равно 0 и R14 означает группу фенил или гетероароматическую группу, любая из которых является незамещенной или замещена одним или двумя заместителями, выбранными из галогена; нитро; циано; (1-10C)алкила; (2-10C)алкенила; (2-10C)алкинила; (3-8C)циклоалкила; 4-(1,1-диоксотетрагидро-1,2-тиазинила); галоген(1-10C)алкила; циано(2-10C)алкенила; фенила; и (CH2)zX3R15, где z равно 0 или целому числу от 1 до 4, X3 означает O, S, NR16, CO, CH(OH), COO, OCO, CONR17, NR18CO, NHSO2, SO2NH, NHSO2NR17, OCONR19 или NR19COO, R15 означает водород, (1-10C)алкил, фенил(1-4C)алкил, галоген(1-10C)алкил, (1-4C)алкоксикарбонил(1-4C)алкил, (1-4C)алкилсульфониламино(1-4C)алкил, N-(1-4C)алкоксикарбонил(1-4C)алкилсульфониламино(1-4C)алкил, (3-10C)алкенил, (3-10C)алкинил, (3-8C)циклоалкил, камфорил или ароматическую или гетероароматическую группу, которая является незамещенной или замещена одним или двумя заместителями, выбранными из галогена, (1-4C)алкила, галоген(1-4C)алкила, ди(1-4C)алкиламино и (1-4C)алкокси, и R16, R17, R18 и R19, каждый независимо, означают водород или (1-10C)алкил, или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединены, образуют группу азетидинил, пирролидинил, пиперидинил или морфолино.
16. Соединение по п.15, где замещенный фенил замещен группой формулы R14-(La)n-X2-(Lb)m, где X2 представляет связь, O, NH, S, SO, SO2, CO, CH(OH), CONH, NHCO, NHCONH, NHCOO, COCONH, OCH2CONH илиCH=CH, La и Lb каждый означают (1-4C)алкилен, одно из n и m равно 0 или 1, а другое равно 0 и R14 означает группу фенил или гетероароматическую группу, любая из которых является незамещенной или замещенной одним или двумя заместителями, выбранными из галогена; нитро; циано; (1-10C)алкила; (2-10C)алкенила; (2-10C)алкинила; (3-8C)циклоалкила; 4-(1,1-диоксотетрагидро-1,2-тиазинила); галоген(1-10C)алкила; циано (2-10C)алкенила; фенила; и (CH2)zX3R15, где z равно 0 или целому числу от 1 до 4, X3 означает O, S, NR16, CO, CH(OH), COO, OCO, CONR17, NR18CO, NHSO2, SO2NH, NHSO2NR17, OCONR19 или NR19COO, R15 означает водород, (1-10C)алкил, фенил(1-4C)алкил, галоген(1-10C)алкил, (1-4C)алкоксикарбонил(1-4C)алкил, (1-4C)алкилсульфониламино(1-4C)алкил, N-(1-4Cалкоксикарбонил)(1-4C)алкилсульфониламино(1-4C)алкил, (3-10C)алкенил, (3-10C)алкинил, (3-8C)циклоалкил, камфорил или ароматическую или гетероароматическую группу, которая является незамещенной или замещена одним или двумя заместителями, выбранными из галогена, (1-4C)алкила, галоген(1-4C)алкила, ди(1-4C)алкиламино и (1-4C)алкокси, и R16, R17, R18 и R19, каждый независимо, означают водород или (1-10C)алкил или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединены, образуют группу азетидинил, пирролидинил, пиперидинил или морфолино.
17. Соединение по п.16, где (La)n-X2- (Lb)m представляет связь, CONH или CH2O.
18. Соединение по п.17, где R14 представляет фенил, который является незамещенным или замещен одним или двумя заместителями, выбранными из галогена; нитро; циано; (1-10C)алкила; (2-10C)алкенила; (2-10C)алкинила; (3-8C)циклоалкила; 4-(1,1-диоксотетрагидро-1,2-тиазинила); галоген(1-10C)алкила; циано (2-10C)алкенила; фенила; и (CH2)zX3R15, где z равно 0 или целому числу от 1 до 4, X3 означает O, S, NR16, CO, CH(OH), COO, OCO, CONR17, NR18CO, NHSO2, SO2NH, NHSO2NR17, OCONR19 или NR19COO, R15 представляет водород, (1-10C)алкил, фенил(1-4C)алкил, галоген(1-10C)алкил, (1-4C)алкоксикарбонил(1-4C)алкил, (1-4C)алкилсульфониламино(1-4C)алкил, N-(1-4C)алкоксикарбонил(1-4C)алкилсульфониламино(1-4C)алкил, (3-10C)алкенил, (3-10C)алкинил, (3-8C)циклоалкил, камфорил или ароматическую или гетероароматическую группу, которая является незамещенной или замещена одним или двумя заместителями, выбранными из галогена, (1-4C)алкиыр, галоген(1-4C)алкила, ди(1-4C)алкиламино и (1-4C)алкокси, и R16, R17, R18 и R19, каждый независимо, означают водород или (1-10C)алкил или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединены, образуют группу азетидинил, пирролидинил, пиперидинил или морфолино.
19. Соединение по п.17, где фенил замещен одним или двумя заместителями, выбранными из галогена; нитро; циано; (1-10C) алкила; галоген(1-10C)алкила и (CH2)zX3R15, где z равно 0, 1 или 2, X3 означает O, NR16, CO, COO, CONR17, NR18CO, NHSO2, SO2NH, NHSO2NR17, OCONR19 или NR19COO, R15 означает водород, (1-10C)алкил, фенил(1-4C)алкил, галоген(1-10C)алкил или (3-10C)алкенил и R16, R17, R18 и R19, каждый независимо, означают водород или (1-10C)алкил.
20. Соединение по п.17, где фенил замещен одним или двумя заместителями, выбранными из фтора; хлора; циано; (1-4C)алкила; трифторметила и (CH2)zX3R15, где z равно 0 или 2, X3 означает NR16, CO, COO, CONR17, NR18CO, NHSO2, R15 представляет водород, (1-4C)алкил, фенил(1-4C)алкил или галоген(1-4C)алкил и R16, R17, R18 и R19, каждый независимо, представляют водород или (1-4C)алкил.
21. Соединение по п.17, где фенил замещен одним заместителем, выбранным из фтора; хлора; циано; (1-4C)алкила; трифторметила и (CH2)zX3R15, где z равно 0 или 2, X3 означает NR16, CO, COO, CONR17, NR18CO, NHSO2, R15 представляет водород, (1-4C)алкил, фенил(1-4C)алкил или галоген(1-4C)алкил и R16, R17, R18 и R19, каждый независимо, означают водород или (1-4C)алкил.
22. Соединение по п.15, где R1 выбран из группы, состоящей из
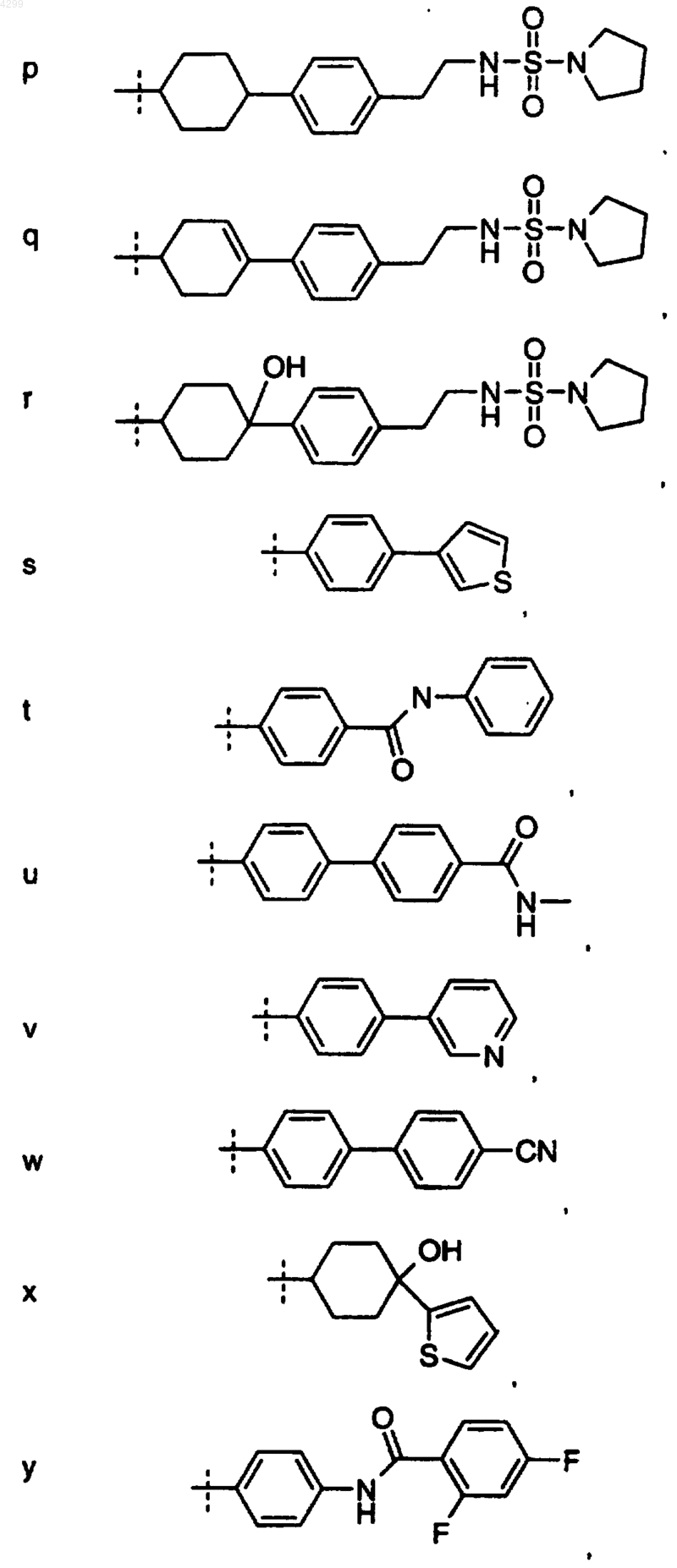
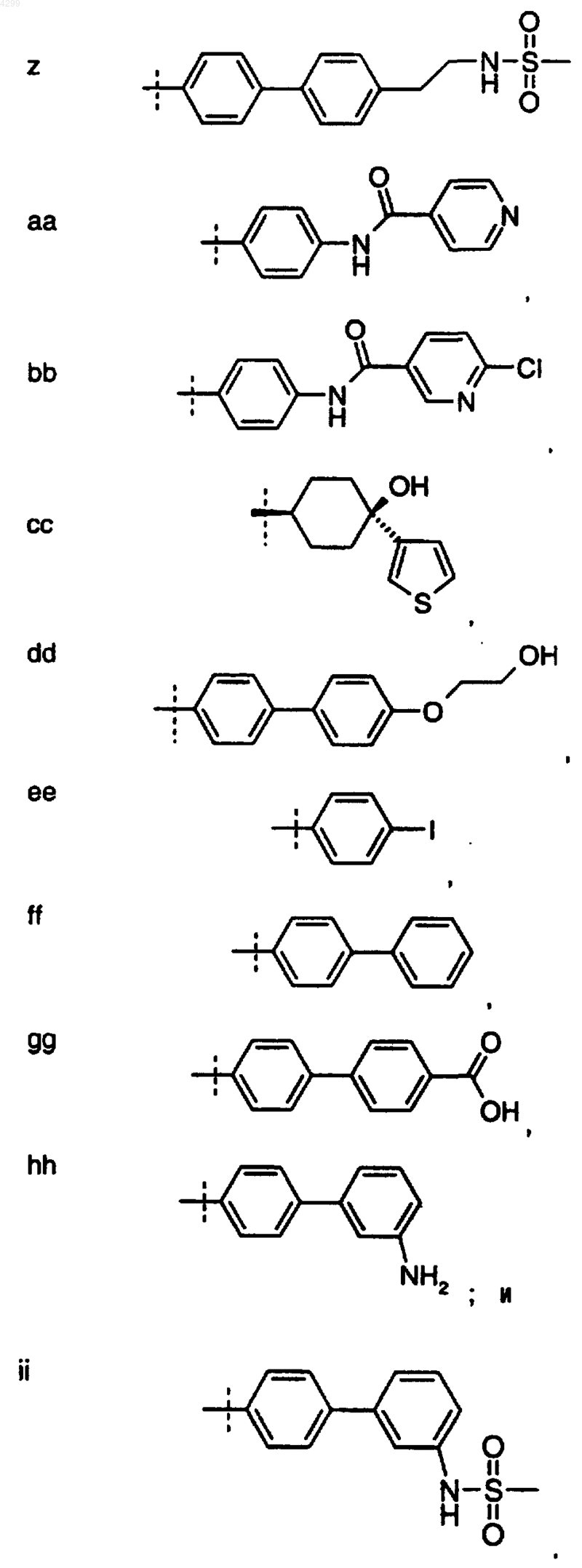
23. Фармацевтическая композиция, которая содержит соединение по п.1 и фармацевтически приемлемый разбавитель или носитель.
24. Способ потенциирования функции рецепторов глутамата у пациента, предусматривающий введение указанному пациенту эффективного количества соединения формулы
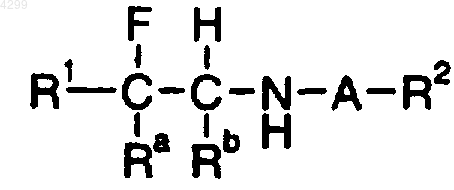
где A означает SO2;
Ra означает (1-6C)алкил;
Rb означает H;
R1 означает группу нафтил или группу фенил, фурил, тиенил или пиридил, которая является незамещенной или замещена одним или двумя заместителями, выбранными независимо из групп галоген; нитро; циано; гидроксиимино; (1-10C)алкил; (2-10C)алкенил; (2-10C)алкинил; (3-8C)циклоалкил; гидрокси(3-8C)циклоалкил; оксо(3-8C)циклоалкил; галоген(1-10C)алкил; (CH2)yX1R9, где y означает 0 или целое число от 1 до 4, X1 означает O, S, NR10, CO, COO, OCO, CONR11, NR12CO, NR12COCOO или OCONR13, R9 означает водород, (1-10C)алкил, (3-10C)алкенил, (3-10C)алкинил, пирролидинил, тетрагидрофурил, морфолино или (3-8C)циклоалкил, а R10, R11, R12 и R13, каждый независимо, означают водород или (1-10C) алкил или R9 и R10, R11, R12 или R13 вместе с атомом азота, к которому они присоединены, образуют группу азетидинил, пирролидинил, пиперидинил или морфолино; N-(1-4C)алкилпиперазинил; N-фенил(1-4C)алкилпиперазинил; тиенил; фурил; оксазолил; изоксазолил; пиразолил; имидазолил; тиазолил; пиридил; пиридазинил; пиримидинил; дигидротиенил; дигидрофурил; дигидротиопиранил; дигидропиранил; дигидротиазолил; (1-4C)алкоксикарбонилдигидротиазолил; (1-4C)алкоксикарбонилдиметилдигидротиазолил; тетрагидротиенил; тетрагидрофурил; тетрагидротиопиранил; тетрагидропиранил; индолил; бензофурил; бензотиенил; бензимидазолил и группы формулы R14-(La)n-X2-(Lb)m, где X2 представляет связь, O, NH, S, SO, SO2, CO, CH(OH), CONH, NHCO, NHCONH, NHCOO, COCONH, OCH2CONH или CH=CH, La и Lb каждый означают (1-4C)алкилен, одно из n и m равно 0 или 1, а другое равно 0 и R14 означает группу фенил или гетероароматическую группу, любая из которых является незамещенной или замещена одним или двумя заместителями из галогена; нитро; циано; гидроксиимино, (1-10C)алкила; (2-10C)алкенила; (2-10C)алкинила; (3-8C)-циклоалкила; 4-(1,1-диоксотетрагидро-1,2-тиазинила); галоген(1-10C)алкила; циано(2-10C)алкенила; фенила и (CH2)zX3R15, где z равно 0 или целому числу от 1 до 4, X3 означает O, S, NR16, CO, CH(OH), COO, OCO, CONR17, NR18CO, NHSO2, SO2NH, NHSO2NR17, NHCONH, OCONR19 или NR19COO, R15 означает водород, (1-10C)алкил, фенил(1-4C)алкил, галоген(1-10C)алкил, (1-4C)алкоксикарбонил(1-4C)алкил, (1-4C)алкилсульфониламино(1-4C)алкил, N-(1-4Cалкоксикарбонил)(1-4C)алкилсульфониламино(1-4C)алкил, (3-10C)алкенил, (3-10C)алкинил, (3-8C)циклоалкил, камфорил или ароматическую либо гетероароматическую группу, которая является незамещенной или замещена одним или двумя заместителями, выбранными из галогена, (1-4C)алкила, галоген(1-4C)алкила, ди(1-4C)алкиламино и (1-4C)алкокси, и R16, R17, R18 и R19, каждый независимо, означают водород или (1-10C)алкил или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединены, образуют группу азетидинил, пирролидинил, пиперидинил или морфолино;
R2 означает (1-6C)алкил;
или его фармацевтически приемлемой соли.
25. Способ лечения расстройства познавательной способности; нейродегенеративного нарушения; связанной с возрастом деменции; индуцируемого возрастом ослабления памяти; моторного нарушения; реверсирования индуцированных лекарственными средствами состояний; депрессии; нарушения с дефицитом внимания; нарушения гиперактивности с дефицитом внимания; психоза; нарушений познавательной способности, связанных с психозом, или индуцированного лекарственными средствами психоза, включающий введение пациенту, нуждающемуся в лечении, эффективного количества соединения формулы
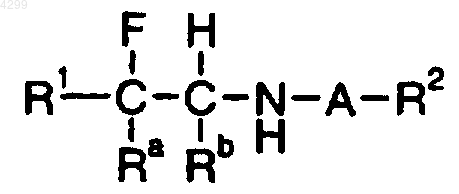
где A означает SO2;
Ra означает (1-6C)алкил;
Rb означает H;
R1 означает группу нафтил или группу фенил, фурил, тиенил или пиридил, которая является незамещенной или замещена одним или двумя заместителями, выбранными независимо из групп галоген; нитро; циано; гидроксиимино; (1-10C)алкил; (2-10C)алкенил; (2-10C)алкинил; (3-8C)циклоалкил; гидрокси(3-8C)циклоалкил; оксо(3-8C)циклоалкил; галоген(1-10C)алкил; (CH2)yX1R9, где y означает 0 или целое число от 1 до 4, X1 означает O, S, NR10, CO, COO, OCO, CONR11, NR12CO, NR12COCOO или OCONR13, R9 означает водород, (1-10C)алкил, (3-10C)алкенил, (3-10C)алкинил, пирролидинил, тетрагидрофурил, морфолино или (3-8C)циклоалкил, а R10, R11, R12 и R13, каждый независимо, означают водород или (1-10C)алкил или R9 и R10, R11, R12 шыш R13 вместе с атомом азота, к которому они присоединены, образуют группу азетидинил, пирролидинил, пиперидинил или морфолино; N-(1-4C)алкилпиперазинил; N-фенил(1-4C)алкилпиперазинил; тиенил; фурил; оксазолил; изоксазолил; пиразолил; имидазолил; тиазолил; пиридил; пиридазинил; пиримидинил; дигидротиенил; дигидрофурил; дигидротиопиранил; дигидропиранил; дигидротиазолил; (1-4С)алкоксикарбонилдигидротиазолил; (1-4C)алкоксикарбонилдиметилдигидротиазолил; тетрагидротиенил; тетрагидрофурил; тетрагидротиопиранил; тетрагидропиранил; индолил; бензофурил; бензотиенил; бензимидазолил и группы формулы R14-(La)n-X2-(Lb)m, где X2 представляет связь, O, NH, S, SO, SO2, CO, CH(OH), CONH, NHCO, NHCONH, NHCOO, COCONH, OCH2CONH или CH=CH, La и Lb каждый означают (1-4C)алкилен, одно из n и m равно 0 или 1, а другое равно 0 и R14 означает группу фенил или гетероароматическую группу, любая из которых является незамещенной или замещена одним или двумя заместителями из галогена; нитро; циано; гидроксиимино, (1-10C)алкила; (2-10C)алкенила; (2-10C)алкинила; (3-8C)циклоалкила; 4-(1,1-диоксотетрагидро-1,2-тиазинила); галоген(1-10C)алкила; циано(2-10C)алкенила; фенила и (CH2)zX3R15, где z равно 0 или целому числу от 1 до 4, X3 означает O, S, NR16, CO, CH(OH), COO, OCO, CONR17, NR18CO, NHSO2, SO2NH, NHSO2NR17, NHCONH, OCONR19 или NR19COO, R15 означает водород, (1-10C)алкил, фенил(1-4C)алкил, галоген (1-10C)алкил, (1-4C)алкоксикарбонил(1-4C)алкил, (1-4C)алкилсульфониламино(1-4C)алкил, N-(1-4C)алкоксикарбонил(1-4C)алкилсульфониламино(1-4C)алкил, (3-10C)алкенил, (3-10C)алкинил, (3-8C)циклоалкил, камфорил или ароматическую либо гетероароматическую группу, которая является незамещенной или замещена одним или двумя заместителями, выбранными из галогена, (1-4C)алкила, галоген(1-4C)алкила, ди(1-4C)алкиламино и (1-4C)алкокси, и R16, R17, R18 и R19, каждый независимо, означают водород или (1-10C)алкил или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединены, образуют группу азетидинил, пирролидинил, пиперидинил или морфолино;
R2 означает (1-6C)алкил;
или его фармацевтически приемлемой соли.
26. Способ улучшения памяти или способности к научению у пациента, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения формулы
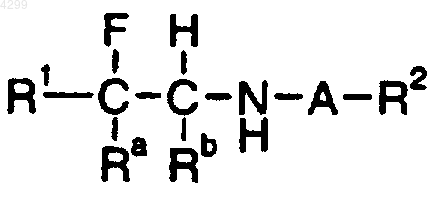
где A означает SO2;
Ra означает (1-6C)алкил;
Rb означает H;
R1 означает группу нафтил или группу фенил, фурил, тиенил или пиридил, которая является незамещенной или замещена одним или двумя заместителями, выбранными независимо из групп галоген; нитро; циано; гидроксиимино; (1-10C)алкил; (2-10C)алкенил; (2-10C)алкинил; (3-8C)циклоалкил; гидрокси(3-8C)циклоалкил; оксо(3-8C)циклоалкил; галоген(1-10C)алкил; (CH2)yX1R9, где y означает 0 или целое число от 1 до 4, X1 означает O, S, NR10, CO, COO, OCO, CONR11, NR12CO, NR12COCOO или OCONR13, R9 означает водород, (1-10C)алкил, (3-10C)алкенил, (3-10C)алкинил, пирролидинил, тетрагидрофурил, морфолино или (3-8C)циклоалкил, а R10, R11, R12 и R13, каждый независимо, означают водород или (1-10C)алкил или R9 и R10, R11, R12 или R13 вместе с атомом азота, к которому они присоединены, образуют группу азетидинил, пирролидинил, пиперидинил или морфолино; N-(1-4C)алкилпиперазинил; N-фенил(1-4C)алкилпиперазинил; тиенил; фурил; оксазолил; изоксазолил; пиразолил; имидазолил; тиазолил; пиридил; пиридазинил; пиримидинил; дигидротиенил; дигидрофурил; дигидротиопиранил; дигидропиранил; дигидротиазолил; (1-4C)алкоксикарбонилдигидротиазолил; (1-4C)алкоксикарбонилдиметилдигидротиазолил; тетрагидротиенил; тетрагидрофурил; тетрагидротиопиранил; тетрагидропиранил; индолил; бензофурил; бензотиенил; бензимидазолил; и группы формулы R14- (La)n-X2- (Lb)m, где X2 представляет связь, O, NH, S, SO, SO2, CO, CH(OH), CONH, NHCO, NHCONH, NHCOO, COCONH, OCH2CONH или CH=CH, La и Lb каждый означают (1-4C)алкилен, одно из n и m равно 0 или 1, а другое равно 0 и R14 означает группу фенил или гетероароматическую группу, любая из которых является незамещенной или замещена одним или двумя заместителями из галогена; нитро; циано; гидроксиимино, (1-10C)алкила; (2-10C)алкенила; (2-10C)алкинила; (3-8C)циклоалкила; 4-(1,1-диоксотетрагидро-1,2-тиазинила); галоген(1-10C)алкила; циано(2-10C)алкенила; фенила; и (CH2)zX3R15, где z равно 0 или целому числу от 1 до 4, X3 означает O, S, NR16, CO, CH(OH), COO, OCO, CONR17, NR18CO, NHSO2, SO2NH, NHSO2NR17, NHCONH, OCONR19 или NR19COO, R15 означает водород, (1-10C)алкил, фенил(1-4C)алкил, галоген(1-10C)алкил, (1-4C)алкоксикарбонил(1-4C)алкил, (1-4C)алкилсульфониламино(1-4C)алкил, N-(1-4C)алкоксикарбонил(1-4C)алкилсульфониламино(1-4C)алкил, (3-10C)алкенил, (3-10C)алкинил, (3-8C)циклоалкил, камфорил или ароматическую либо гетероароматическую группу, которая является незамещенной или замещена одним или двумя заместителями, выбранными из галогена, (1-4C)алкила, галоген(1-4C)алкила, ди(1-4C)алкиламино и (1-4C)алкокси, и R16, R17, R18 и R19, каждый независимо, означают водород или (1-10C)алкил или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединены, образуют группу азетидинил, пирролидинил, пиперидинил или морфолино;
R2 означает (1-6C)алкил;
или его фармацевтически приемлемой соли.
27. Применение соединения по любому из пп.1-14 или его фармацевтически приемлемой соли в качестве фармацевтического средства.
28. Применение соединения по любому из пп.1-14 или его фармацевтически приемлемой соли для приготовления лекарственного средства для потенциирования функции рецепторов глутамата.
29. Применение соединения по любому из пп.1-14 или его фармацевтически приемлемой соли для приготовления лекарственного средства для лечения расстройства познавательной способности; нейродегенеративного нарушения; связанной с возрастом деменции; индуцируемого возрастом ослабления памяти; моторного нарушения; реверсирования индуцированных лекарственными средствами состояний; депрессии; нарушения с дефицитом внимания; нарушения гиперактивности с дефицитом внимания; психоза; нарушений познавательной способности, связанных с психозом, или индуцированного лекарственными средствами психоза у пациента.
30. Соединение по п.1, представляющее собой {4-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]фенил}-N-метилкарбоксамид, и его фармацевтически приемлемая соль.
31. Соединение по п.1, представляющее собой {4-[4-(1-фтор-1-метил-2-{[(метилэтил)сульфонил]амино}этил)фенил]фенил}-N-метилкарбоксамид (энантиомер 1).
Текст
1 Данное изобретение относится к потенциированию функции рецепторов глутамата с использованием некоторых монофторалкилпроизводных. Оно относится также к новым монофторалкилпроизводным, к способам их получения и к содержащим их фармацевтическим композициям. В центральной нервной системе (ЦНС) млекопитающих передача нервных импульсов регулируется взаимодействием между нейротрансмиттером (нейромедиатором), который высвобождается посылающим нейроном, и поверхностным рецептором на принимающем нейроне, что вызывает возбуждение принимающего нейрона. L-глутамат, который является наиболее обильным нейротрансмиттером в ЦНС, опосредует основной путь возбуждения у млекопитающих и называется возбуждающей аминокислотой (ЕАА). Рецепторы, которые отвечают на глутамат, называются рецепторами возбуждающей аминокислоты (ЕАА-рецепторами). См. WatkinsEvans, Ann. Rev. Pharmacol.Cotman, Ann. Rev. Pharmacol. Toxicol., 29,365(1989); Watkins, Krogsgaard-Larsen and Honore, Trans, Pharm. Sci., 11, 25 (1990). Возбуждающие аминокислоты имеют большое физиологическое значение, играя роль в разнообразных физиологических процессах, таких как долгосрочное потенциирование (обучение и память), развитие синаптической пластичности(гибкости), моторная регуляция, дыхание, сердечно-сосудистая регуляция и сенсорное восприятие. Рецепторы возбуждающих аминокислот классифицируются на два основных типа. Рецепторы, которые прямо связаны с открыванием катионных каналов в клеточной мембране нейронов, называются ионотропными. Этот тип рецепторов был подразделен по меньшей мере на три подтипа, которые определяются деполяризующими действиями селективных агонистовN-метил-D-аспартата (НМДА), альфа-амино-3 гидрокси-5-метилизоксазол-4-пропионовой кислоты (АМПК) и каиновой кислоты (КК). Второй основной типа рецептора представляет собой G-белок или рецептор связанной с вторичным мессенджером метаботропной возбуждающей аминокислоты. Этот второй тип связан с многочисленными системами вторичных мессенджеров, которые приводят к усиленному гидролизу фосфоинозитида, активации фосфолипазы D, увеличениям или уменьшениям в образовании цАМФ и изменениям функции ионных каналов. Schoepp and Conn, Trends in Pharmacol. Sci., 14, 13 (1993). Оба типа рецепторов,по-видимому, не только медиируют нормальную синаптическую передачу импульсов в путях возбуждения, но также участвуют в модификации синаптических связей во время развития и в процессе всей жизни. Schoepp, BockaertReviews, 15, 41 (1990). АМПК-рецепторы собраны из четырех белковых субъединиц, известных как GluR1 GluR4, тогда как рецепторы каиновой кислоты собраны из субъединиц GluR5 - GluR7 и КК-1 и КК-2. Wong and Mayer, Molecular Pharmacology 44:505-510, 1993. Пока еще неизвестно, как эти субъединицы комбинируются в природном состоянии. Однако были выяснены структуры некоторых вариантов человека для каждой субъединицы, и клеточные линии, экспрессирующие индивидуальные варианты субъединиц были клонированы и включены в тест-системы, сконструированные для идентификации соединений,которые связываются с ними или взаимодействуют с ними и которые, следовательно, модулируют их функцию. Так, В Европейской патентной заявке с номером публикации ЕР-А 20574257 описаны варианты субъединиц человека GluR1B, GluR2B, GluR3A и GluR3B. В Европейской патентной заявке с номером публикации ЕР-А 1-0583917 описан вариант субъединицы человека GluR4B. Одним отличительным свойством АМПКрецепторов и рецепторов каиновой кислоты является их быстрая дезактивация и десенсибилизация в отношении глутамата. Yamada and Tang,The Journal of Neuroscience, September 1993,13(9): 3904-3915 и Kathrin M. Partin, J. Neuroscience, November 1, 1996, 16(21): 6634-6647. Физиологический смысл быстрой десенсибилизации и дезактивации, если они имеются, до конца не выяснены. Известно, что быстрая десенсибилизация и дезактивация АМПК-рецепторов и/или рецепторов каиновой кислоты в отношении глутамата могут ингибироваться с использованием определенных соединений. Это действие таких соединений часто называют альтернативно "потенциированием" этих рецепторов. Одним таким соединением, которое селективно потенциирует функцию АМПК-рецепторов, является циклотиазид. Partin et al., Neuron. Vol. 11, 10691082, 1993. Соединения, которые потенциируют АМПК-рецепторы, подобно циклотиазиду, часто называют ампакинами. Международная патентная заявка с номером публикации WO 9625926 описывает группу фенилтиоалкилсульфонамидов, S-оксидов и гомологов, которые, как указывается, потенциируют мембранные токи, индуцируемые каиновой кислотой и АМПК. В описании патента Соединенных Штатов с номером 3 143 549 описаны некоторые фенилалкилсульфамиды, в том числе 1-метил-2 фенилэтилдиметилсульфамид. Утверждается,что эти соединения обладают активностью в отношении центральной нервной системы, в частности, обладают успокаивающими (против тревоги) и транквилизирующими свойствами. 3 В описании патента Соединенных Штатов с номером 3 267 139 описаны N'-триметилацетил-N-фенилалкилсульфамиды и -фенилциклопропилсульфамиды, обладающие активностью по отношению к центральной нервной системе и противосудорожной активностью. Сообщается,что эти соединения вызывают Паркинсонподобные симптомы у экспериментальных животных. В описании патента Соединенных Штатов с номером 3 860 723 описан способ увеличения приема пищи для здоровых животных с использованием некоторых фенилалкилсульфамидов.Foye et al., J. Pharm. Sci. (1971), 60(7),1095-6 описывают некоторые фенилалкилметилсульфонамиды, в том числе N-1-метил-2 фенилэтилметансульфонамид, имеющие гипотензивную активность. Описание к патенту Великобритании с номером 1 059 360 раскрывает некоторые фенилалкилсульфамиды, обладающие активностью в качестве седативных, наркотических и противосудорожных агентов, в том числе 1-(1-метил-2 фенилэтиламиносульфонил)пиперидин. В описании патента США с номером 4 210 749 описывает N-1-метил-2-фенил-3-метоксиэтилбутансульфонамид.Gualtieri et al., J. Pharm. Sci., (1973), 62(5),8490851 описывают N-1-метил-2-фенилэтилбутансульфонамид и его оценку в качестве репеллента для комаров (москитов).Foye and Sane, J. Pharm. Sci. (1977), 66(7),923-6 описывают N-метансульфонил- и Nтрифторметансульфонилпроизводные амфетаминов и некоторые их 4-замещенные аналоги и их оценку в отношении центральной нервной системы и анорексических эффектов. Европейская патентная заявка с номером публикации ЕР-А 1-0657442 описывает некоторые производные нафтилоксиуксусной кислоты в качестве агонистов и антагонистов PEG2. N(2,2-дифенилэтил)метансульфонамид описан в качестве промежуточного продукта на странице 53, строчке 38. Патент США с номером описания 3 629 332 описывает некоторые N-арил- и N-гетероарилалкилфторалкансульфонамиды в качестве модификаторов роста растений, в том числе N(альфа-метилфенилэтил)трифторметансульфонамид, дифторметансульфонамид и фторметансульфонамид. Сообщается также, что некоторые из этих соединений обладают другой биологической активностью, в том числе инсектицидной, акарицидной, нематоцидной, аналгетической и противовоспалительной активностью. Было показано, что ампакины улучшают память в различных тестах на животных. Staubliof Pharmacology and Experimental Therapeutics,278: 627-638, 1996. Кроме того, некоторые сульфонамидные производные, которые потенциируют функцию рецепторов глутамата у млекопитающего, были описаны в публикации Международной патентной заявки WO 98/33596, опубликованной 6 августа 1998 года и публикации Международной патентной заявки WO 99/43285, опубликованной 2 сентября 1999 года. В настоящем изобретении предлагаются соединения формулы IRb обозначает Н, (1-6 С)алкил, (2-6 С) алкенил, -(1-4 С)алкил(3-8 С)циклоалкил или -(1-4 С) алкилароматический радикал; или Ra и Rb вместе с атомами углерода, к которым они присоединены, образуют (3-8 С)-насыщенное карбоциклическое кольцо, (3-8 С)-насыщенное карбоциклическое кольцо, содержащее гетероатом,выбранный из группы, состоящей из серы и кислорода, или (5-8 С)-карбоциклическое кольцо,содержащее одну двойную связь;R1 обозначает незамещенную или замещенную ароматическую группу, незамещенную или замещенную гетероароматическую группу или незамещенную или замещенную (5-8 С)циклоалкильную группу;R2 обозначает (1-6 С)алкил, (3-6 С)циклоалкил, (1-6 С)фторалкил, (1-6 С)хлоралкил, (26 С)алкенил, (1-4 С)алкокси(1-4 С)алкил, фенил,который является незамещенным или замещен галогеном, (1-4 С)алкилом или (1-4 С)алкокси,или, когда А обозначает SO2, группу формулыR3R4N, в которой R3 и R4, каждый независимо,обозначают (1-4 С)алкил или, вместе с атомом азота, к которому они присоединены, образуют азетидинильную, пирролидинильную, пиперидинильную, морфолино-, пиперазинильную,гексагидроазепинильную или октагидроазоцинильную группу; или их фармацевтически приемлемую соль. В настоящем изобретении предлагается,кроме того, способ потенциирования функции рецептора глутамата у пациента, который предусматривает введение указанному пациенту эффективного количества соединения формулы I. В настоящем изобретении предлагается способ лечения расстройств познавательной способности у пациента, который предусматривает введение указанному пациенту эффективного количества соединения формулы I. Кроме того, в настоящем изобретении предлагается, далее, способ лечения нарушений 5 познавательной способности у пациента, связанных с психозом, который предусматривает введение указанному пациенту эффективного количества соединения формулы I. Согласно другому аспекту, в настоящем изобретении предлагается применение соединения формулы I или его фармацевтически приемлемой соли для приготовления лекарственного средства для потенциирования функции рецепторов глутамата. Кроме того, в настоящем изобретении предлагается применение соединения формулыI или его фармацевтически приемлемой соли для потенциирования функции рецепторов глутамата. Далее, в настоящем изобретении предлагаются фармацевтические композиции, содержащие соединение формулы I и фармацевтически приемлемые разбавитель или носитель. Настоящее изобретение, кроме того, включает соединения формулыRb обозначает Н, (1-6 С)алкил, (2-6 С)алкенил, -(1-4 С)алкил(3-8 С)циклоалкил или -(1-4 С) алкилароматический радикал; или Ra и Rb вместе с атомами углерода, к которым они присоединены, образуют (3-8 С)-насыщенное карбоциклическое кольцо, (3-8 С)-насыщенное карбоциклическое кольцо, содержащее гетероатом,выбранный из группы, состоящей из серы и кислорода, или (5-8 С)-карбоциклическое кольцо,содержащее одну двойную связь;R1 обозначает незамещенную или замещенную ароматическую группу, незамещенную или замещенную гетероароматическую группу либо незамещенную или замещенную (5-8 С)циклоалкильную группу; или их фармацевтически приемлемую соль; при условии, что, когда Ra обозначает метил, тогда R1 является иным, чем 4-бромфенил. Данное изобретение охватывает также новые промежуточные продукты и способы синтеза соединений формулы I. В настоящем описании термин потенциирование функции рецепторов глутамата относится к любой увеличенной отвечаемости рецепторов глутамата, например, АМПК-рецепторов, на глутамат или агонист и включает в себя, но не ограничивается ими, ингибирование быстрой десенсибилизации или дезактивации АМПК-рецепторов в отношении глутамата. Большое число состояний может лечиться или предупреждаться с помощью соединений формулы I и их фармацевтически приемлемыми солями посредством их действия в качестве по 004299 6 тенциаторов функции рецепторов глутамата. Такие состояния включают в себя состояния,связанные с гипофункцией глутамата, такие как психиатрические и неврологические нарушения,например, расстройства познавательной способности; нейродегенеративные нарушения,такие как болезнь Альцгеймера; связанные с возрастом деменции; вызванное возрастом ухудшение памяти; моторные нарушения, такие как поздняя лицевая дискинезия, хорея Хантингтона, миоклонус и болезнь Паркинсона; реверсирование индуцированных лекарственными средствами состояний (таких как индуцированные кокаином, амфетаминами, алкоголем состояния); депрессию; нарушение с дефицитом внимания; нарушение гиперактивности с дефицитом внимания; психоз; нарушения познавательной способности, связанные с психозом,индуцированный лекарственными средствами психоз и сексуальную дисфункцию. Соединения формулы I могут быть также применимы для улучшения памяти (как кратковременного, так и долгосрочного) и способности к научению. В настоящем изобретении предлагается применение соединений формулы I для лечения каждого из этих состояний. Должно быть понятно, что соединения формул Ia', Ib', Ic' и In': где R1 обозначает незамещенную или замещенную ароматическую группу, незамещенную или замещенную гетероароматическую группу или незамещенную или замещенную (5-8 С)-циклоалкильную группу; или их фармацевтически приемлемая соль,включены в объем формулы I. Данное изобретение включает фармацевтически приемлемые соли соединений, определенных формулой I. Соединение данного изобретения может иметь достаточно кислую группу, достаточно основную группу или обе эти функциональные группы, и, соответственно,взаимодействовать с любыми из множества органических и неорганических оснований и неорганических и органических кислот с образованием фармацевтически приемлемой соли. Термин фармацевтически приемлемая соль, как 7 он здесь применяется, относится к солям соединений приведенной выше формулы, которые являются по существу нетоксичными для живых организмов. Типичные фармацевтически приемлемые соли включают в себя соли, полученные реакцией соединений данного изобретения с фармацевтически приемлемыми минеральной или органической кислотой или органическим или неорганическим основанием. Подобные соли известны как кислотно-аддитивные и основно-аддитивные соли. Такие соли включают в себя фармацевтически приемлемые соли, перечисленные в Journal of Pharmaceutical Science,66, 2-19 (1977), которые известны квалифицированному в данной области специалисту. Кислоты, обычно используемые для образования кислотно-аддитивных солей, представляют собой неорганические кислоты, такие как хлористо-водородная кислота, бромисто-водородная кислота, иодисто-водородная кислота,серная кислота, фосфорная кислота и т.п., и органические кислоты, такие как п-толуолсульфоновая кислота, метансульфоновая кислота,бензолсульфоновая кислота, щавелевая кислота,п-бромфенолсульфоновая кислота, угольная кислота, янтарная кислота, лимонная кислота,бензойная кислота, уксусная кислота и т.п. Примерами таких фармацевтически приемлемых солей являются сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, бромид, иодид, ацетат, пропионат, деканоат, капрат, каприлат, акрилат, формиат,гидрохлорид, дигидрохлорид, изобутират, капроат, гептаноат, пропиолат, пропионат, фенилпропионат, салицилат, оксалат, малонат, сукцинат, суберат, себацат, фумарат, малат, малеат,гидроксималеат, манделат, никотинат, изоникотинат, циннамат, гиппурат, нитрат, фталат, терефталат, бутин-1,4-диоат, бутин-1,4-дикарбоксилат, гексин-1,4-дикарбоксилат, гексин-1,6 диоат, бензоат, хлорбензоат, метилбензоат, гидроксибензоат, метоксибензоат, динитробен-зоат,о-ацетоксибензоат, нафталин-2-бензоат, фталат,п-толуолсульфонат,п-бромбензолсульфонат, п-хлорбензолсульфонат, ксилолсульфонат, фенилацетат, трифторацетат, фенилпропионат, фенилбутират, цитрат, лактат, -гидроксибутират, гликолят, тартрат, бензолсульфонат,метансульфонат, этансульфонат, пропансульфонат, гидроксиэтансульфонат, 1-нафталинсульфонат, 2-нафталинсульфонат, 1,5-нафталиндисульфонат, манделат, тартрат и т.п. Предпочтительными фармацевтически приемлемыми кислотно-аддитивными солями являются соли,образованные с такими минеральными кислотами, как хлористо-водородная кислота и бромисто-водородная кислота, и соли, образованные с такими органическими кислотами, как малеиновая кислота, щавелевая кислота и метансульфоновая кислота. 8 Основно-аддитивные соли включают в себя соли, полученные из неорганических оснований, таких как гидроксиды аммония или щелочных или щелочно-земельных металлов, карбонаты, бикарбонаты и т.п. Таким образом, такие основания, применимые в получении солей данного изобретения, включают в себя гидроксид натрия, гидроксид калия, гидроксид аммония,карбонат аммония, карбонат натрия, бикарбонат натрия, бикарбонат калия, гидроксид кальция,карбонат кальция и т.п. Формы солей калия и натрия являются особенно предпочтительными. Должно быть понятно, что конкретный противоион, образующий часть любой соли данного изобретения, обычно не имеет решающего характера до тех пор, пока эта соль в целом является фармацевтически приемлемой и пока этот противоион не способствует нежелательным качествам этой соли в целом. Далее,должно быть понятно, что приведенные выше соли могут образовывать гидраты или существовать в практически безводной форме. Как он применяется здесь, термин стереомер относится к соединению, образованному из тех же самых атомов, связанных теми же самыми связями, но имеющему отличающиеся трехмерные структуры, которые не являются взаимозаменяемыми. Эти трехмерные структуры называют конфигурациями. Как он применяется здесь, термин энантиомер относится к двум стереоизомерам, молекулы которых являются неналагаемыми зеркальными отображениями друг друга. Термин хиральный центр относится к атому углерода, к которому присоединены четыре различные группы. Как он применяется здесь, термин диастереомеры относится к стереоизомерам, которые не являются энантиомерами. Кроме того, два диастереомера,которые имеют различную конфигурацию только при одном хиральном центре, называются здесь эпимерами. Термин рацемат, рацемическая смесь или рацемическая модификация относится к смеси равных частей энантиомеров. Термин энантиомерное обогащение, как он применяется здесь, относится к увеличению количества одного энантиомера в сравнении с другим. Удобным способом выражения достигаемого энантимерного обогащения, является концепция энантиомерного избытка, или ЭИ,который можно найти с использованием следующего уравнения: где Е 1 обозначает количество первого энантиомера, а Е 2 обозначает количество второго энантиомера. Таким образом, если исходное отношение этих двух энантиомеров равно 50:50, такое, которое присутствует в рацемической смеси, и достигается энантиомерное обогащение,достаточное для обеспечения конечного отно 9 шения 50:30, то ЭИ в отношении первого энантиомер равно 25%. Однако если конечное обогащение равно 90:10, то ЭИ в отношении первого энантиомера равно 80%. Предпочтительным является ЭИ более 90%, ЭИ более 95% является наиболее предпочтительным и особенно предпочтительным является ЭИ более 99%. Энантиомерное обогащение может быть легко определено средним специалистом в данной области с использованием стандартных способов и процедур, таких как газовая или высокоэффективная жидкостная хроматография с хиральной колонкой. Выбор подходящей хиральной колонки, элюента и условий, необходимых для выполнения разделения конкретной энантиомерной пары находятся в пределах знаний специалиста с обычной квалификацией в данной области. Кроме того, конкретные стереоизомеры и энантиомеры соединений формулы I могут быть получены специалистом с обычной квалификацией в данной области с использованием хорошо известных способов и процессов, таких как описанные J. Jacques, et al., "Enantiomers,Racemates and Resolutions", John Wiley and Sons,Inc., 1981, и E.L. Eliel and S.H. Wilen, "Stereochemistry of Organic Compounds", (WileyInterscience 1994) и в Европейской патентной заявке с номером ЕР-А-838448, опубликованной 29 апреля 1998 года. Примеры разделений включают в себя способы перекристаллизации или хиральную хроматографию. Некоторые из соединений данного изобретения имеют один или несколько хиральных центров и могут существовать во множестве стереоизомерных конфигураций. Как следствие этих хиральных центров, соединения данного изобретения встречаются в виде рацематов,смесей энантиомеров и в виде индивидуальных энантиомеров, а также в виде диастереомеров и смесей диастереомеров. Все подобные рацематы, энантиомеры и диастереомеры входят в объем данного изобретения. Термины "R" и "S" используются здесь,как они обычно и используются в органической химии, для обозначения специфической конфигурации хирального центра. Термин "R" (rectus,правый, лат.) относится к конфигурации хирального центра, при которой приоритеты групп упорядочены по часовой стрелке (наивысшийвторой наинизший),если смотреть вдоль связи в направлении группы самого низкого приоритета. Термин "S"(sinister, левый, лат.) относится к конфигурации хирального центра, при которой приоритеты групп упорядочены против часовой стрелки(наивысшийвторой наинизший), если смотреть вдоль связи в направлении группы самого низкого приоритета. Приоритет групп основывается на их порядковом (атомном) номере (в порядке уменьшения атомного номера). Частичный список приоритетов и обсуждение стерео 004299Principles and Practice", (J.H. Fletcher, et al.,eds., 1974) на страницах 103-120. Как он применяется здесь, термин ароматическая группа обозначает то же самое, что арил и включает в себя фенил и полициклическое ароматическое карбоциклическое кольцо,такое как 1- или 2-нафтил, 1,2-дигидронафтил,1,2,3,4-тетрагидронафтил и т.п. Термин гетероароматическая группа включает в себя ароматическое 5-6-членное кольцо, содержащее от одного до четырех гетероатомов, выбранных из кислорода, серы и азота, и бициклическую группу, состоящую из 5-6 членного кольца, содержащего от одного до четырех гетероатомов, выбранных из кислорода, серы и азота, конденсированного с бензольным кольцом или другим 5-6-членным кольцом,содержащим один-четыре атома, выбранных из кислорода, серы и азота. Примерами гетероароматических групп являются тиенил, фурил, оксазолил, изоксазолил, оксадиазолил, пиразолил,тиазолил, тиадиазолил, изотиазолил, имидазолил, триазолил, тетразолил, пиридил, пиридазинил, пиримидил, бензофурил, бензотиенил, бензимидазолил, бензоксазолил, бензотиазолил, индолил и хинолил. Термин заместитель, как он используется здесь, в термине замещенная ароматическая или гетероароматическая группа, означает, что могут присутствовать один или несколько (например, один или два) заместителя, причем указанные заместители выбраны из атомов и групп,которые, при их присутствии в соединении формулы I, не препятствуют функционированию соединения формулы I в качестве потенциатора функции рецепторов глутамата. Должно быть понятно, что, когда R1 представляет незамещенную или замещенную (58 С)-циклоалкильную группу, результатом могут быть смеси цис- и транс-изомеров, которые могут быть разделены на индивидуальные цис- и транс-изомеры специалистом с обычной квалификацией в данной области с использованием стандартных способов и процедур, таких как высокоэффективная жидкостная хроматография с обращенной или нормальной фазой или флешхроматография, с подходящей стационарной(неподвижной) фазой и подходящим элюентом. Примерами подходящих стационарных фаз являются силикагель, оксид алюминия и т.п. Примерами подходящих растворителей являются смеси этилацетат/гексан, этилацетат/толуол,метанол/дихлорметан и т.п. Такие индивидуальные цис- и транс-изомеры включены в объем данного изобретения. Примерами заместителей, которые могут присутствовать в замещенной ароматической,гетероароматической группе или (5-8 С)-циклоалкильной группе, являются галоген; нитро; циано; гидроксиимино; (1-10 С)алкил; (2-10 С) 11 алкенил; (2-10 С)алкинил; (3-8 С)циклоалкил; гидрокси(3-8 С)циклоалкил; оксо(3-8 С)циклоалкил; галоген(1-10 С)алкил; (CH2)yX1R9, где у обозначает 0 или целое число от 1 до 4, X1 обозначает О, S, NR10, CO, COO, OCO, CONR11,NR12CO, NR12COCOO, OCONR13, R9 обозначает водород, (1-10 С)алкил, (3-10 С)-алкенил, (3-10 С) алкинил, пирролидинил, тетрагидрофурил,морфолино или (3-8 С) циклоалкил, a R10, R11,R12 и R13, каждый независимо, обозначают водород или (1-10 С) алкил, или R9 и R10, R11,R12 или R13 вместе с атомом азота, к которому они присоединены, образуют азетидинил,пирролидинил, пиперидинил или морфолиногруппу; N-(1-4C)алкилпиперазинил; N-фенил(1-4C)алкоксикарбонилдигидротиазолил; (1-4C) алкоксикарбонилдиметилдигидротиазолил; тетрагидротиенил; тетрагидрофурил; тетрагидротиопиранил; тетрагидропиранил; индолил; бензофурил; бензотиенил; бензимидазолил; и группу формулы R14-(La)n-X2-(Lb)m, где X2 представляет связь, О, NH, S, SO, SO2, СО, СН(ОН),CONH, NHCO, NHCONH, NHCOO, COCONH,OCH2CONH или СН=СН, La и Lb, каждый, обозначают (1-4C) алкилен, одно из n и m равно 0 или 1, а другое равно 0 и R14 обозначает фенил или гетероароматическую группу, которая является незамещенной или замещена одним или двумя заместителями, выбранными из галогена; нитро; циано; (1-10 С)алкила; (2-10 С)алкенила;(1-10 С)алкила; циано (2-10 С) алкенила; фенила; и (CH2)zX3R15, где z равно 0 или целому числу от 1 до 4, X3 обозначает О, S, NR16, СО,СН(ОН), COO, OCO, CONR17, NR18CO, NHSO2,SO2NH, NHSO2NR17, OCONR19 или NR19COO,R15 обозначает водород, (1-10 С)алкил, фенил(1-4C)алкилсульфониламино(1-4C)алкил, (3-10 С) алкенил, (3-10 С)алкинил, (3-8 С)циклоалкил,камфорил или ароматическую или гетероароматическую группу, которая является незамещенной или замещена одним или двумя заместителями, выбранными из галогена, (1-4 С)алкила,галоген(1-4C)алкила, ди(1-4C)алкиламино и (14 С)алкокси, и R16, R17, R18 и R19, каждый независимо, обозначают водород или (1-10 С)алкил,или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединены, образуют азетидинил, пирролидинил, пиперидинил или морфолиногруппу. Термин (1-10 С)алкил включает в себя(1-8 С)алкил, (1-6 С)алкил и (1-4C)алкил. Конкретными значениями являются метил, этил, 004299(2-4 С)алкенил. Конкретными значениями являются винил и проп-2-енил. Термин (2-10 С)алкинил включает в себя(3-4 С)алкинил. Конкретным значением является проп-2-инил. Термин C1-C6 алкокси обозначает прямую или разветвленную алкильную цепь,имеющую от одного до шести атомов углерода,присоединенную к атому кислорода. ТипичныеC1-C6 алкоксигруппы включают в себя метокси,этокси, пропокси, изопропокси, бутокси, третбутокси, пентокси и т.п. Термин C1-C6 алкокси включает в его определение термин C1-C4 алкокси. Термин (3-8 С)циклоалкил, как таковой или в термине (3-8 С)циклоалкилокси, включает в себя моноциклические и полициклические группы. Конкретными значениями являются циклопропил, циклобутил, циклопентил,циклогексил и бицикло[2.2.2]октан. Этот термин включает в себя (3-6 С)циклоалкил: циклопропил, циклобутил, циклопентил и циклогексил. Как он применяется здесь, термины целое число от 1 до 4 или целое число от 1 до 3 включают в себя целые числа 1, 2, 3 и 4, или целые числа 1, 2 и 3, соответственно. Термин (5-8 С)циклоалкил включает в себя циклопентил, циклогексил, циклогептил и циклооктил. Термин гидрокси(3-8 С)циклоалкил включает в себя гидроксициклопентил, такой как 3-гидроксициклопентил. Термин оксо(3-8 С)циклоалкил включает в себя оксициклопентил, такой как 3-оксоциклопентил. Термин галоген, Hal или галогенид включают в себя фтор, хлор, бром и иод, если нет других указаний. Термин галоген(1-10 С)алкил включает в себя фтор(1-10 С)алкил, такой как трифторметил и 2,2,2-трифторэтил, и хлор(1-10 С)алкил, такой как хлорметил. Термин циано(2-10 С)алкенил включает в себя 2-цианоэтенил. Термин (2-4 С)алкилен включает в себя этилен, пропилен и бутилен. Предпочтительным значением является этилен. Термин тиенил включает в себя тиен-2 ил и тиен-3-ил. Термин фурил включает в себя фур-2-ил и фур-3-ил. Термин оксазолил включает в себя оксазол-2-ил, оксазол-4-ил и оксазол-5-ил. Термин изоксазолил включает в себя изоксазол-3-ил, изоксазол-4-ил и изоксазол-5-ил. 13 Термин оксадиазолил включает в себя[1,2,4]оксадиазол-3-ил и [1,2,4]оксадиазол-5-ил. Термин пиразолил включает в себя пиразол-3-ил, пиразол-4-ил и пиразол-5-ил. Термин тиазолил включает в себя тиазол-2-ил, тиазол-4-ил и тиазол-5-ил. Термин тиадиазолил включает в себя[1,2,4]тиадиазол-3-ил и [1,2,4]тиадиазол-5-ил. Термин изотиазолил включает в себя изотиазол-3-ил, изотиазол-4-ил и изотиазол-5-ил. Термин имидазолил включает в себя имидазол-2-ил, имидазолил-4-ил и имидазолил 5-ил. Термин триазолил включает в себя[1,2,4] триазол-3-ил и [1,2,4]триазол-5-ил. Термин тетразолил включает в себя тетразол-5-ил. Термин пиридил включает в себя пирид 2-ил, пирид-3-ил и пирид-4-ил. Термин пиридазинил включает в себя пиридазин-3-ил, пиридазин-4-ил, пиридазин-5 ил и пиридазин-6-ил. Термин пиримидинил включает в себя пиримидин-2-ил, пиримидин-4-ил, пиримидин 5-ил и пиримидин-6-ил. Термин бензофурил включает в себя бензофур-2-ил и бензофур-3-ил. Термин бензотиенил включает в себя бензотиен-2-ил и бензотиен-3-ил. Термин бензимидазолил включает в себя бензимидазол-2-ил. Термин бензоксазолил включает в себя бензоксазол-2-ил. Термин бензотиазолил включает в себя бензотиазол-2-ил. Термин индолил включает в себя индол 2-ил и индол-3-ил. Термин хинолил включает в себя хинол 2-ил. Термин дигидротиазолил включает в себя 4,5-дигидротиазол-2-ил, а термин (1-4 С) алкоксикарбонилдигидротиазолил включает в себя 4-метоксикарбонил-4,5-дигидротиазол-2-ил. Термин -(1-4 С)алкил(3-8 С)циклоалкил включает в себя следующее: Предпочтительно Ra представляет собой метил, этил, пропил, н-бутил, втор-бутил, пентил и гексил, причем метил является наиболее предпочтительным. 14 Предпочтительно Rb представляет собой водород, метил, этил, пропил, н-бутил, вторбутил, пентил и гексил, причем водород является наиболее предпочтительным. Предпочтительно R3 и R4 каждый обозначают метил. Примерами значений для R2 являются метил, этил, пропил, 2-пропил, бутил, 2-метилпропил, циклогексил, трифторметил, 2,2,2 трифторэтил, хлорметил, этенил, проп-2-енил,метоксиэтил, фенил, 4-фторфенил или диметиламино. Предпочтительно R2 представляет собой этил, 2-пропил или диметиламино. Примерами значений для R9 являются водород, метил, этил, пропил, изопропил, третбутил, этенил, циклопропил, циклобутил, циклопентил, циклогексил, 2-пирролидинил, морфолино или 2-тетрагидрофурил.(1-4 С)алкил, (2-4 С)алкенил, (3-6 С)циклоалкил,пирролидинил, морфолино или тетрагидрофурил. Примерами значений для R15 являются водород, метил, этил, пропил, изопропил, третбутил, бензил, 2,2,2-трифторэтил, 2-метоксикарбонилэтил, циклогексил, 10-камфорил, фенил, 2-фторфенил, 3-фторфенил, 2-трифторметилфенил, 4-трифторметилфенил, 2-метоксифенил, 3-метоксифенил, 4-метоксифенил, 1-(5 диметиламино)нафтил и 2-тиенил.z равно предпочтительно 0. Конкретные значения для групп(CH2)yX1R9 и (CH2)zX3R15 включают в себя (110 С)алкокси, в том числе (1-6 С)алкокси и (14 С)алкокси, например, метокси, этокси, пропокси, изопропокси и изобутокси; (3-10 С)алкенилокси, в том числе (3-6 С)алкенилокси, например, проп-2-енилокси; (3-10 С)алкинилокси,в том числе (3-6 С)алкинилокси, например,проп-2-инилокси; и (1-6 С)алканоил, например,формил и этаноил. Примерами конкретных значений для у являются 0 и 1. Примерами конкретных значений для z являются 0, 1, 2 и 3. La и Lb предпочтительно, каждый независимо, обозначают CH2. X2 предпочтительно обозначает связь, О, NH, СО,СН(ОН), CONH, NHCONH или OCH2CONH, причем связь, О и CONH являются особенно предпочтительными. Предпочтительно группа (CH2)yX1R9 обозначает СНО; СОСН 3; ОСН 3; ОСН(СН 3)2;NHCOR9, где R9 представляет метил, этил, изопропил, трет-бутил, этенил, циклопропил, циклобутил, циклопентил, циклогексил, 2-пирролидинил или морфолино; CONHR9, где R9 представляет циклопропил или циклопентил;(CH2)2NHCOR15, где R15 представляет СН 3,СН(СН 3)2, СН 2 СН(СН 3)2, фенил, 3-фторфенил,4-фторфенил, бензил, 2-метоксифенил, 4 метоксифенил, 2-тиенил, СН=СН, CH-CHCN,ОСН 3 или O(СН 2)3 СН 3. Примерами конкретных значений дляR14 предпочтительно обозначает группу незамещенный или замещенный фенил, нафтил,фурил, тиенил, изоксазолил, тиазолил, тетразолил, пиридил, пиримидил, бензотиенил или бензотиазолил. Примерами конкретных значений для R14 являются фенил, 2-фторфенил, 3-фторфенил, 4 фторфенил, 2-хлорфенил, 3-хлорфенил, 4-хлорфенил, 2-бромфенил, 3-бромфенил, 4-бромфенил, 4-иодфенил, 2,3-дифторфенил, 2,4-дифторфенил, 3,5-дифторфенил, 3,4-дихлорфенил,3,5-дихлорфенил, 4-цианофенил, 3-нитрофенил,4-гидроксииминофенил, 2-метилфенил, 4-метилфенил, 4-этилфенил, 3-пропилфенил, 4-третбутилфенил, 2-проп-2-енилфенил, 4-(4-(1,1 диоксотетрагидро-1,2-тиазинил)фенил, 2-трифторметилфенил, 3-трифторметилфенил, 4-трифторметилфенил, 2-бромметилфенил, 2-фтор-4 трифторметилфенил, 4-(2-цианоэтенил)фенил,4-фенил, 2-формилфенил, 3-формилфенил, 4 формилфенил, 2-ацетилфенил, 3-ацетилфенил,4-ацетилфенил, 2-пропаноилфенил, 2-(2-метилпропаноил)фенил, 2-метоксифенил, 3-метоксифенил, 4-метоксифенил, 4-бутоксифенил, 2 гидроксиметилфенил, 4-гидроксиметилфенил,2-(1-гидроксиэтил)фенил,3-(1-гидроксиэтил) фенил, 4-(1-гидроксиэтил)фенил, 2-(1-гидроксипропил)фенил, 4-(1-гидроксипропил)фенил, 2(1-гидрокси-2,2-диметилпропил)фенил, 4-трифторметоксифенил, 2-аминофенил, 4-аминофенил, 4-N,N-диэтиламинофенил, 4-аминометилфенил, 4-(2-аминоэтил)фенил, 4-(3-аминопропил)фенил, 4-карбоксифенил, 4-карбамоилфенил, 4-N-метилкарбамоилфенил, 4-N,N-диметилкарбамоилфенил, 2-изопропиламинометилфенил, 4-трет-бутоксикарбониламинометилфенил,4-(2-изопропоксикарбоксамидо)этилфе 004299 17 Примерами незамещенной или замещенной ароматической или гетероароматической группы, представленной R1, являются незамещенный или замещенный фенил, фурил, тиенил(например, 3-тиенил) и пиридил (например, 3 пиридил). Примерами незамещенной или замещенной (5-8 С)циклоалкильной группы, представленной R1, являются незамещенный или замещенный циклопентил, циклогексил, циклогептил и циклооктил, причем предпочтительным является циклогексил. Более предпочтительно, R1 представляет 2 нафтил или группу формулы(3-8 С)циклоалкил; оксо(3-8 С)циклоалкил; галоген(1-10 С)алкил; (CH2)yX1R9, где у равно 0 или представляет целое число от 1 до 4, X1 представляет О, S, NR10, CO, COO, OCO, CONR11,NR12CO, NR12COCOO, OCONH13, R9 представляет водород, (1-10C)алкил, (3-10 С)алкенил, (310 С)алкинил, пирролидинил, тетрагидрофурил,морфолино или (3-8 С)циклоалкил, a R10, R11, R12 и R13, каждый независимо, обозначают водород или (1-10 С)алкил, или R9 и R10, R11, R12 или R13 вместе с атомом азота, к которому они присоединены, образуют азетидинил, пирролидинил,пиперидинил или морфолиногруппу; N-(1-4C) алкилпиперазинил; N-фенил(1-4C)-алкилпиперазинил; тиенил; фурил; оксазолил; изоксазолил; пиразолил; имидазолил; тиазолил; тетразолил; пиридил; пиридазинил; пиримидинил; дигидротиенил; дигидрофурил; дигидротиопиранил; дигидропиранил; дигидротиазолил; (1-4C) алкоксикарбонилдигидротиазолил; (1-4C)алкоксикарбонилдиметилдигидротиазолил; тетрагидротиенил; тетрагидрофурил; тетрагидротиопиранил; тетрагидропиранил; индолил; бензофурил; бензотиенил; бензимидазолил; и группу формулы R14-(La)n-X2-(Lb)m, где 2X представляет связь, О, NH, S, SO, SO2, CO,CH(OH), CONH, NHCONH, NHCOO, COCONH,OCH2CONH или СН=СН, NHCO, La и Lb, каждый, представляют (1-4 С)алкилен, одно из n и m равно 0 или 1, а другое равно 0, а R14 представляет фенил или гетероароматическую группу,которая является незамещенной или замещена одним или двумя из галогена; нитро; циано; (110 С)алкила; (2-10 С)алкенила; (2-10 С)алкинила;(3-8 С)-циклоалкила; 4-(1,1-диоксотетрагидро 1,2-тиазинила); галоген(1-10 С)алкила; циано (210 С)алкенила; фенила; (CH2)2X3R15, где z равно 0 или целому числу от 1 до 4, X3 обозначает О,S, NR16, CO, CH(OH), COO, OCO, CONR17, 004299NR18CO, NHSO2, NHSO2NR17, NHCONH,OCONR19 или NR19COO, R15 обозначает водород, (1-10 С)алкил, фенил(1-4C)алкил, галоген(110 С)алкил, (1-4 С)алкоксикарбонил(1-4C)алкил,(1-4C)алкилсульфониламино(1-4 С)алкил, (N-(14C)алкоксикарбонил 1-4 С)алкилсульфониламино(1-4C)алкил, (3-10 С)алкенил, (3-10 С)алкинил, (3-8 С)циклоалкил, камфорил или ароматическую или гетероароматическую группу,которая является незамещенной или замещена одним или двумя из галогена, (1-4C)алкила, галоген(1-4 С)алкила, ди (1-4C)алкиламино и (14C) алкокси, и R16, R17, R18 и R19, каждый независимо, представляют водород или (1-10 С)алкил или R15 и R16, R17, R18 или R19 вместе с атомом азота, к которому они присоединены, образуют группу азетидинил, пирролидинил, пиперидинил или морфолино; иR21 представляет атом водорода, атом галогена, группу (1-4 С)алкил или группу (1-4 С) алкокси. Примерами конкретных значений для R20 являются фтор, хлор, бром, циано, гидроксиимино, метил, этил, пропил, 2-пропил, бутил, 2 метилпропил, 1,1-диметилэтил, циклопентил,циклогексил, 3-гидроксициклопентил, 3-оксоциклопентил, метокси, этокси, пропокси, 2 пропокси, ацетил, ацетиламино, этилкарбоксамидо, пропилкарбоксамидо, 1-бутаноиламидо,1-бутилкарбоксамидо, акриломламидо, 2-пирролидинилкарбоксамидо, 2-тетрагидрофурилметокси, морфолинокарбоксамидо, метилоксалиламидо, циклопропилкарбоксамидо, циклобутилкарбоксамидо, циклопентилкарбоксамидо,циклогексилкарбоксамидо, циклопропилкарбамоил, циклопентилкарбамоил, пирролидин-1-ил,морфолино,пиперидин-1-ил,N-метилпиперазинил, N-бензилпиперазинил, 2-тиенил,3-тиенил, 2-фурил, 3-фурил, изоксазол-3-ил,тиазол-2-ил, тетразол-5-ил, пирид-2-ил, пирид 3-ил, пирид-4-ил, пиримидин-5-ил, 4,5-дигидротиазол-2-ил,4,5-дигидро-4-метоксикарбонилтиазол-2-ил,4,5-дигидро-4-метоксикарбонил 5,5-диметилтиазол-2-ил, бензотиен-2-ил, бензотиазол-2-ил, фенил, 2-фторфенил, 3-фторфенил,2,3-дифторфенил, 4-хлорфенил, 3,4-дихлорфенил, 3,5-дихлорфенил, 3-нитрофенил, 4 цианофенил, 2-метилфенил, 4-метилфенил, 4-(4(1,1-диоксотетрагидро-1,2-тиазинил)фенил, 3 трифторметилфенил, 4-трифторметилфенил, 4(2-цианоэтенил)фенил, 2-формилфенил, 3-формилфенил, 4-формилфенил, 3-ацетилфенил, 4 ацетилфенил, 4-карбоксифенил, 2-метоксифенил, 4-метоксифенил, 2-гидроксиметилфенил,4-гидроксиметилфенил, 3-(1-гидроксиэтил)фенил, 4-(1-гидроксиэтил)фенил, 4-(1-гидроксипропил)фенил, 2-аминофенил, 4-аминофенил, 4N,N-диэтилaминoфeнил, 4-аминометилфенил, 4(2-аминоэтил)фенил, 4-(3-аминопропил)фенил,4-(2-ацетиламиноэтил)фенил, 4-трет-бутоксикарбоксиламиноэтил)фенил, 4-(2-трет-бутоксикарбоксиламиноэтил)фенил, бензилсульфонил 19 амино, 4-изопропилсульфониламинофенил, 4(2-метансульфониламиноэтил)фенил, 4-(2-этилсульфониламиноэтил)фенил, 4-(2-пропилсульфониламиноэтил)фенил, 4-(2-бутилсульфониламиноэтил)фенил,4-(2-изопропилсульфониламиноэтил)фенил, 4-(1-гидрокси-2-метансульфониламиноэтил)фенил,4-(2-диметиламиносульфониламиноэтил)фенил, 4-(1-(2-(2-пропил) сульфониламинопропил)фенил, 4-(2-(2,2,2-трифторэтил)сульфониламиноэтил)фенил, 4-(2-циклогексилсульфониламиноэтил)фенил, 4-(2-фенилсульфониламиноэтил)фенил, 4-(2-(2-фторфенил)сульфониламиноэтил)фенил,4-(2-(4 фторфенил)сульфониламиноэтил)фенил, 4-(2-(2 трифторметилфенил)сульфониламиноэтил)фенил, 4-(2-(4-трифторметилфенил)сульфониламиноэтил)фенил, 4-(2-(4-метоксифенил)сульфониламиноэтил, 4-(2-(1-(5-диметиламино)нафталинсульфониламино)этил)фенил,4-(2-(2-тиенил)сульфониламино)этил)фенил,4-(2-бензамидоэтил)фенил, 4-(2-(4-фторбензамидо)этил) фенил, 4-(2-(3-метоксибензамидо)этил)фенил, 4(2-(3-фторбензамидо)этил)фенил, 4-(2-(4-метоксибензамидо)этил)фенил, 4-(2-(2-метоксибензамидо)этил)фенил, 4-(2-(2-тиенилкарбоксамидо)этил)фенил, 4-карбамоилфенил, 4-метилкарбамоилфенил, 4-диметилкарбамоилфенил, 4-(2(2-метилпропанамидо)этил)фенил, 4-(2-(3-метилбутанамидо)этил)фенил, бензоилметил, бензамидо, 2-фторбензамидо, 3-фторбензамидо, 4 фторбензамидо, 2,4-дифторбензамидо, 3-хлорбензамидо, 4-хлорбензамидо, 4-бромбензамидо,4-иодбензамидо, 4-цианобензамидо, 3-метилбензамидо, 4-метилбензамидо, 4-этилбензамидо,4-пропилбензамидо, 4-третбутилбензамидо, 4 винилбензамидо, 2-трифторметилбензамидо, 3 трифторметилбензамидо, 4-трифторметилбензамидо, 2-фтор-4-трифторметилбензамидо, 2 метоксибензамидо, 3-метоксибензамидо, 4 метоксибензамидо, 4-бутоксибензамидо, 4 фенилфенилкарбоксамидо, 4-бензилкарбоксамидо, 4-феноксиметилкарбоксамидо, 2-фторбензиламино, бензилокси, 2-фторбензилокси, 2 гидрокси-2-фенилэтил, 2-фторфенилкарбамоил,4-(1-(2-(2-метоксикарбонилэтансульфониламино)этил)фенил, 4-(1-(2-(10-камфорсульфониламино)этил)фенил, 4-(1-(2-(бензилсульфониламино)этил)фенил, 4-(2-фенилацетамидо)этил)фенил, 4-(метансульфониламиноэтаноил)фенил,4-(N-трет-бутоксикарбонил)метансульфониламиноэтаноил)фенил, 2-тиенилкарбоксамидо, 2 фурилкарбоксамидо,3-(5-метилизоксазолил) карбоксамидо, 5-изоксазолилкарбоксамидо, 2 бензотиенилкарбоксамидо, 4-(5-метил-3-фенилизоксазолил)карбоксамидо, 4-пиридилкарбоксамидо, 2-(5-нитрофурил)карбоксамидо, 2 пиридилкарбоксамидо,6-хлор-2-пиридилкарбоксамидо, 2-тиенилсульфонамидо, 2-тиенилметиламино, 3-тиенилметиламино, 2-фурилметиламино, 3-фурилметиламино, 3-ацетилуреидо и 2-(2-тиенил)этилуреидо. 20 Примерами конкретных значений для R21 являются водород и хлор. R21 находится предпочтительно орто относительно R20. Примерами конкретных значений для R1 являются 2-нафтил, 4-бромфенил, 4-цианофенил, 4-бензамидофенил, 4-метилфенил, 4 изопропилфенил, 4-изобутилфенил, 4-третбутилфенил, 4-метоксифенил, 4-изопропоксифенил, 4-циклопентилфенил, 4-циклогексилфенил, 4-(2-гидроксиметилфенил)фенил, 4-(4 гидроксиметилфенил)фенил, 4-(2-фурил)фенил,4-(3-фурил)фенил, 4-(2-тиенил)фенил, 4-(3 тиенил)фенил, 4-(пирролидин-1-ил)фенил, 4(пиперидин-1-ил)фенил, 3-хлор-4-пиперидин-1 илфенил, 4-бензилоксифенил, 4-(2-фторфенил) фенил, 4-(3-фторфенил)фенил, 4-(2-формилфенил)фенил, 4-(3-формилфенил)фенил, 4-(4 формилфенил)фенил, 4-(4-метилфенил)фенил и 4-(2-метоксифенил)фенил. Соединения формулы I могут быть получены согласно различным процедурам, приведенным ниже. Реагенты и исходные материалы являются легко доступными для специалиста с обычной квалификацией в данной области. Все заместители, если нет других указаний, являются такими, как описанные выше. Схема 1(1) объединяют с соединением структуры (2) при условиях, хорошо известных в данной области, что дает соединения структуры (3). Более конкретно, например, соединение (1) растворяют в подходящем органическом растворителе. Примеры подходящих органических растворителей включают в себя дихлорметан, тетрагидрофуран и т.п. Этот раствор обрабатывают небольшим избытком подходящего основания и затем охлаждают до температуры от приблизительно -78 С до приблизительно 0 С. Примеры подходящих оснований включают в себя триэтиламин, пиридин, 1,8-диазабицикло[5.4.0] ундец-7-ен (DBU) и т.п. К перемешиваемому раствору добавляют один эквивалент соединения (2). Термин "Lg", как он здесь применяется,обозначает подходящую уходящую группу. Примеры подходящих уходящих групп включают в себя Сl, Вr, метансульфонилокси, трифторметансульфонилокси, бензолсульфонилокси,п-толуолсульфонилокси и т.п. Сl является предпочтительной уходящей группой. Реакционную 21 смесь перемешивают при температуре от приблизительно 0 С до приблизительно 50 С в течение приблизительно от 0,5 ч до приблизительно 16 ч. Затем соединение (3) выделяют и очищают способами, хорошо известными в данной области, такими как способы экстракции и хроматография. Например, смесь промывают 10% бисульфатом натрия, слои разделяют и водный слой экстрагируют несколько раз подходящим органическим растворителем, таким как дихлорметан. Органические экстракты объединяют, сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме. Затем остаток очищают флеш-хроматографией на силикагеле с подходящим элюентом, таким как смесь этилацетат/гексан, с получением соединения (3). В стадии В схемы 1 соединение структуры(3) фторируют при условиях, хорошо известных в данной области, с получением соединения формулы Iа. Например, соединение (3) растворяют в подходящем органическом растворителе,таком как дихлорметан, и раствор охлаждают до приблизительно -78 С в инертной атмосфере,такой как азот. К этому раствору медленно добавляют около одного эквивалента (диэтиламиносера)трифторида (DAST), растворенного в подходящем органическом растворителе, таком как дихлорметан, при перемешивании. Затем реакционной смеси дают нагреться до комнатной температуры (около 22 С) и затем соединение формулы Iа выделяют и очищают с использованием способов и методик, хорошо известных в данной области, таких как способы экстракции и хроматография. Например, реакцию разбавляют водой и дихлорметаном. Слои разделяют и органический слой промывают водой,сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме с получением неочищенного соединения формулы Iа. Этот неочищенный материал может быть затем очищен стандартными способами, такими как перекристаллизация из подходящего элюента или флэш-хроматография или радиальная хроматография (радиальную хроматографию проводят с использованием Chromatotron, Harrison ResearchInc., 840 Moana Court, Palo Alto CA 94306) на силика-геле с подходящим элюентом, таким как смесь гексан/этилацетат, с получением очищенного соединения формулы Iа. Альтернативно, в стадии В' схемы I соединение (1) фторируют способом, аналогичным процедуре, описанной в стадии В выше, с использованием DAST с получением соединения структуры (4). В стадии А' схемы I соединение В стадии А схемы II соединение (1) превращают в карбамат (6) в стандартных условиях образования карбамата, хорошо известных специалисту с обычной квалификацией в данной области. Например, стандартные условия образования карбамата описаны в J. March, "Advanced Organic Chemistry: Reactions, MechanismsSons, Inc. (1981) pages 223-248. Более конкретно, например, соединение (1) растворяют в подходящем органическом растворителе, таком как тетрагидрофуран или дихлорметан, и обрабатывают эквивалентом соединения (5), где "Lg" представляет подходящую уходящую группу. Примерами подходящих уходящих групп являются Сl, Вr, I и т.п. Реакцию можно проводить при температуре от около -10 С до около 50 С, предпочтительно при температуре от около 0 С до около 25 С. Через приблизительно 2 ч - приблизительно 12 ч, карбамат (6) выделяют и очищают способами,хорошо известными в данной области, такими как способы экстракции и хроматография. Например, реакционную смесь разбавляют в подходящем органическом растворителе, таком как дихлорметан, промывают насыщенным раствором бикарбоната натрия, солевым раствором,сушат над безводным сульфатом магния,фильтруют и концентрируют в вакууме. Затем неочищенный продукт может быть очищен флеш-хроматографией на силикагеле с подходящим элюентом, таким как смесь этилацетат/гексаны, с получением очищенного карбамата (6). В стадии В схемы II карбамат (6) превращают в соединение формулы Ib способом, аналогичным методике, представленной в стадии В схемы I. Альтернативно, в стадии В' схемы II соединение (1) фторируют способом, аналогичным методике, описанной в стадии В выше, с использованием DAST с получением соединения структуры (7). В стадии А' схемы II соединение (7) превращают в соединение формулы Ib способом, аналогичным методике, описанной в стадии А выше. Схема III В стадии А схемы III мочевину (9) получают из соединения (1) в стандартных условиях образования мочевины, хорошо известных специалисту с обычной квалификацией в данной области. Например, стандартные условия образования мочевины описаны в J. March, "Advanced Organic Chemistry: Reactions, MechanismsSons, Inc. (1981) pages 248-249. Более конкретно, например, соединение (1) растворяют в подходящем органическом растворителе, таком как дихлорметан, и этот раствор обрабатывают приблизительно 1,1 эквивалента изоцианата (8). Реакцию можно проводить при температуре от около -10 С до около 50 С в течение от приблизительно 2 ч до приблизительно 12 ч с получением мочевины (9). Мочевина (9) может быть выделена и очищена способами, хорошо известными в данной области,такими как способы экстракции и хроматография. Например, реакционную смесь разбавляют в подходящем органическом растворителе, таком как дихлорметан, промывают водой, солевым раствором, сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме. Затем неочищенный продукт может быть очищен флеш-хроматографией на силикагеле с подходящим элюентом, таким как смесь этилацетат/гексаны, с получением очищенной мочевины (9). В стадии В схемы III мочевину (9) превращают в соединение формулы Iс способом,аналогичным процедуре, представленной в стадии В схемы I. Альтернативно, в стадии В' схемы III соединение (1) фторируют способом, аналогичным методике, описанной в стадии В выше, с использованием DAST с получением соединения структуры (10). В стадии А' схемы III соединение (10) превращают в соединение формулы Iс способом, аналогичным методике, описанной в стадии А выше. Соединения формулы I, в которых R1 представляет 4-бромфенильную группу, 4-иодфенильную группу или 4-(трифлат)фенильную группу, могут быть легко превращены в другие соединения формулы I, в которых R представляет другую 4-замещенную фенильную группу,при условиях, хорошо известных в данной области, например, реакцией с подходящим про 004299 24 изводным бороновой кислоты, например, производным бензолбороновой кислоты. См., например, Международную публикацию с номером WO 98/33496, опубликованную 6 августа 1998 года, описание которой включено здесь в качестве ссылки. Более конкретно, реакцию удобным образом проводят в присутствии катализатора тетра-кис(трифенилфосфин)палладия(0), такого как тетра-кис(трифенилфосфин)палладий(0), и основания, например, карбоната калия. Подходящие растворители для этой реакции включают в себя ароматические углеводороды, такие как толуол. Температура, при которой проводят эту реакцию, находится в диапазоне от 0 до 150 С, предпочтительно 75-120 С. Бис-ароматические промежуточные продукты,применимые в получении соединений формулыI, могут быть получены реакцией бромароматического или бромгетероароматического соединения с ароматической или гетероароматической бороновой кислотой аналогичным образом. Альтернативно, эта реакция сочетания может проводиться с использованием диацетата палладия с подходящим органическим растворителем, таким как н-пропанол или ацетон. См.,например, Organic Synthesis 1998, 75, 61; Goodson, F.E.; Wallow, T.I.; Novak, B.M. и OrganicMitchell, D.; Staszak, M.A., где используют аналогичные условия сочетания. Производное бороновой кислоты, используемое в качестве исходного материала, может быть получено реакцией триалкилбората, такого как триизопропилборат, с подходящим литийорганическим соединением при пониженной температуре. Например, 2-фторбензолбороновая кислота может быть получена реакций 2 фторбромбензола с бутиллитием в тетрагидрофуране при приблизительно -78 С с получением 2-фторфениллития и затем реакцией этого литийорганического соединения с триизопропилборатом. Затем следует гидролиз водной НСl. Альтернативно, соединения формулы I, в которых R1 представляет 4-бромфенильную группу, могут быть превращены в соединения с 4-(триметилстаннил)фенильной или 4-(три-нбутилстаннил)фенильной группой обработкой соответствующим бромидом с палладиевым(0) катализатором, таким как тетра-кис(трифенилфосфин)палладий(0), и гексаалкилдистаннаном,где алкильной группой является метил или нбутил, в апротонном растворителе, таком как толуол, в присутствии основания третичного амина, такого как триэтиламин, при температурах в диапазоне от 80 до 140 С, предпочтительно от 90 до 110 С. Соединения формулы I, в которых R1 представляет 4-(три-н-бутилстаннил)фенильную группу, могут затем взаимодействовать с арилили гетероарилбромидом, таким как 2-бромтиофен-5-карбоксальдегид, или арил- или гетероарилиодидом или арил- или гетероарилтриф 25 латом, в присутствии палладиевого(0) катализатора, такого как тетракис(трифенилфосфин) палладий(0), или палладиевого(II) катализатора,такого как бис(трифенилфосфин)палладий(II) дихлорид, в апротонном растворителе, таком как диоксан, при температурах в диапазоне от 80 до 140 С, предпочтительно от 90 до 110 С, с получением соответствующего 4-(арил)фенилили 4-(гетероарил)фенилзамещенного соединения. Соединения формулы I, в которых R1 представляет 4-бромфенильную группу, могут быть превращены в другие соединения формулы I, в которых R1 представляет 4-замещенную алкил- или циклоалкилфенильную группу, такую как 4-циклопентилфенил, обработкой соответствующего бромида подходящим алкил- или циклоалкил-реактивом Гриньяра, таким как циклопентилмагнийбромид, в присутствии катализатора палладия(II), такого как [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II)(PdCl2(dppf, в апротонном растворителе, таком как диэтиловый эфир, при температурах в диапазоне от -78 С до 25 С. Соединения формулы I, в которых R1 представляет 4-бромфенильную группу, могут быть превращены в соединения с 4-замещенной группой карбоксиальдегидфенил(формилфенил) реакцией соответствующего бромида с газообразным моноксидом углерода, который барботируют в реакционную смесь при атмосферном давлении, в присутствии катализатора палладия(II)дихлорид, и формиата натрия в апротонном растворителе, таком как диметилформамид, при температурах в диапазоне от 70 до 110 С, предпочтительно при 90 С. Соединения формулы I, в которых R1 представляет 4-гидроксифенильную группу,могут быть превращены в другие соединения формулы I, в которых R1 представляет алкоксигруппу, обработкой соответствующей гидроксифенильной группы подходящим алкилгалогенидом, таким как бензилбромид, в присутствии гидрида натрия в апротонном растворителе, таком как диметилформамид, при температурах в диапазоне от 25 до 100 С, предпочтительно от 50 до 90 С. Соединения структуры (1 а) могут быть получены по методике, описанной в схеме IV. Реагенты и исходные материалы являются легко доступными для специалиста с обычной квалификацией в данной области. Все заместители,если нет других указаний, являются такими, как описанные ранее. Схема IVGreenlee and Hangauer, Tetrahedron Lett., 24(42),4559 (1983). Например, соединение (11) растворяют в подходящем органическом растворителе,таком как сухой тетрагидрофуран, содержащий избыток 18-кроун-6 и избыток цианида калия. К этой смеси при комнатной температуре добавляют по каплям около 1,2 эквивалента цианотриметилсилана. Реакционной смеси дают перемешиваться в течение приблизительно 1-4 ч с получением соединения (12). Затем соединение(12) переводят сразу же в стадию В без выделения. Альтернативно, в стадии А схемы IV, например, соединение (11) объединяют с каталитическим количеством иодида цинка с последующим медленным добавлением избытка триметилсилилцианида с генерированием тепла. Полученный раствор перемешивают при комнатной температуре в атмосфере азота в течение около 8-16 ч. Затем смесь разбавляют подходящим органическим растворителем, таким как хлороформ, промывают насыщенным бикарбонатом натрия, водой, солевым раствором, сушат над безводным сульфатом магния, фильтруют и концентрируют в вакууме с получением соединения (12). В стадии В схемы IV соединение (12) превращают в соединение структуры (1a). Например, соединение (11), полученное, как описано выше, все еще находящееся в растворе, обрабатывают раствором приблизительно 1,4 эквивалента борана в диметилсульфиде. Затем реакционную смесь нагревают до кипения с обратным холодильником в течение приблизительно 16 ч и затем охлаждают до комнатной температуры. Затем реакционную смесь осторожно обрабатывают безводной НСl в метаноле и дают перемешиваться в течение приблизительно 1 ч. Затем продукт (1 а) выделяют и очищают стандартными способами и методиками. Например, растворитель удаляют в вакууме и остаток растирают с подходящим органическим растворителем, таким как метил-трет-бутиловый эфир, и твердое вещество собирают фильтрованием. Затем твердое вещество суспендируют в смеси дихлорметан/тетрагидрофуран (1:2,4) и обрабатывают 1 н.NaOH до достижения рН 12,3. Фазы разделяют и органическую фазу промывают солевым раствором. Затем органическую фазу концентрируют в вакууме и остаток растирают с диэтиловым эфиром с получением очищенного соединения (1a). Затем соединение (1 а) используют в схемах I, II и III аналогично процедурам, описанным для соединения (1). Более конкретно, соединения структурыV. Реагенты и исходные материалы являются легко доступными для специалиста с обычной квалификацией в данной области. Все замести 27 тели, если нет других указаний, являются такими, как описанные ранее. Схема V(12 а) превращают в соединение структуры (1 а') аналогично процедуре, описанной в стадии В схемы IV. Затем соединение (1 а') превращают в сульфонамид, карбамат или мочевину способом,аналогичным процедурам, описанным в схемахI, II и III выше. Полученные сульфонамид, карбамат или мочевина могут быть затем фторированы с использованием DAST способом, аналогичным методикам, представленным выше в схемах I, II и III. Полученный фторированный продукт, имеющий нитрозаместитель на фенильной группе, может быть затем гидрирован при стандартных условиях, хорошо известных специалисту с обычной квалификацией в данной области, с получением соответствующего амино-замещенного соединения. Например, см.J. March, "Advanced Organic Chemistry: Reactions, Mechanisms and Structure," 2nd Edition,McGraw Hill Inc., (1977) pages 1125-1126. Кроме того, соединения структуры (1 а") могут быть получены, как описано в схеме Va. Реагенты и исходные материалы являются легко доступными для специалиста с обычной квалификацией в данной области. Все заместители,если нет других указаний, являются такими, как описанные ранее. Схема Va(1 а") аналогично процедуре, описанной в стадии В схемы IV. Затем соединение (1 а") превращают в сульфонамид, карбамат или мочевину способом, аналогичным методикам, описанным в схемах I, II и III выше. Полученные сульфонамид, карбамат или мочевина могут быть затем фторированы с использованием DAST спосо 004299 28 бом, аналогичным методикам, представленным выше в схемах I, II и III. Соединения формулы Id и формулы Iе могут быть получены согласно методике, описанной в схеме VI. Реагенты и исходные материалы являются легко доступными для специалиста с обычной квалификацией в данной области. Все заместители, если нет других указаний, являются такими, как описанные ранее. Схема VI(14) при стандартных условиях с получением соединения структуры (15). Например, соединение (13) объединяют с приблизительно 1,5 экв. соединения (14), приблизительно 1,5 экв. карбоната калия и приблизительно 0,06 экв. тетракис(трифенилфосфин)палладия(0) в подходящем растворителе или смеси растворителей,такой как диоксан/вода (3:1). Затем эту смесь нагревают при приблизительно 100 С в течение приблизительно 18 ч. Затем реакцию охлаждают и соединение (15) выделяют и очищают с использованием стандартных способов и методик,таких как способы экстракции и хроматография. Например, реакционную смесь экстрагируют в подходящем органическом растворителе, таком как этилацетат, органические экстракты объединяют, промывают водой, сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме. Затем этот неочищенный материал очищают хроматографией на силикагеле с подходящим элюентом, таким как смесь гексан/этилацетат, с получением очищенного соединения (15). В стадии В схемы VI соединение (15) фторируют при стандартных условиях с получением соединения формулы Iе. Например, соединение (15) растворяют в подходящем органическом растворителе, таком как дихлорметан, добавляют к приблизительно одному эквивалентуDAST при приблизительно -78 С при перемешивании в атмосфере азота. Реакционной смеси дают нагреться до комнатной температуры и соединение формулы Iе выделяют и очищают с использованием стандартных способов, таких как способы экстракции и хроматография. Например, реакционную смесь разбавляют водой и подходящим органическим растворителем, таким как дихлорметан. Слои разделяют и органический слой промывают водой, сушат над 29 безводным сульфатом натрия, фильтруют и концентрируют в вакууме. Затем неочищенный материал очищают хроматографией на силикагеле с подходящим элюентом, таким как смесь гексан/этилацетат, с получением очищенного соединения формулы Iе. Альтернативно в стадии В' схемы VI соединение (13) фторируют с получением соединения формулы Id способом, аналогичным методике, описанной в стадии В. Кроме того, в стадии А' схемы VI соединение формулы Id превращают в соединение формулы Iе способом, аналогичным методике, описанной выше в стадии А. Более конкретно, соединения формулы Ig и формулы Ih могут быть получены, как показано в схеме VII. Реагенты и исходные материалы являются легко доступными для специалиста с обычной квалификацией в данной области, например, см. Международную патентную заявку с номером PCT/US 99/03449, опубликованную 2 сентября 1999 г. Все заместители, если нет других указаний, являются такими, как описанные ранее. Схема VIIRp связь, Rp представляет водород, гидрокси,или вместе с Rc связь, q равно целому числу 1, 2,3 или 4, R30 представляет (1-6 С)алкил, (3-6 С) циклоалкил, фтор(1-6 С)алкил, хлор(1-6 С)алкил,(2-6 С)алкенил, (1-4 С)алкокси(1-4 С)алкил, фенил, котоый является незамещенным или замещен галогеном, (1-4 С)алкилом или (1-4 С)алкокси), (1-4 С)алкилфенил, где фенильная группа является незамещенной или замещена галогеном, (1-4 С)алкилом или (1-4 С)алкокси), а остальные заместители имеют определенные выше значения, превращают в амин формулы Ig при условиях, хорошо известных в данной области. Например, соединение If растворяют в 30 подходящем органическом растворителе, таком как тетрагидрофуран, и нагревают с обратным холодильником до кипения. К кипящему с обратным холодильником раствору добавляют приблизительно 1,1 экв. боранового реагента,такого как комплекс боран-диметилсульфид. Затем реакционную смесь нагревают с обратным холодильником до кипения в течение приблизительно 1-2 ч, охлаждают до комнатной температуры и затем обрабатывают 6 н. НСl. Реакцию опять нагревают с обратным холодильником при дефлегмации в течение приблизительно 1 ч, охлаждают и рН доводят до приблизительно рН 10 водным раствором гидроксида натрия. Затем продукт соединение Ig выделяют и очищают стандартными способами,такими как экстракция и хроматография. Например, реакционную смесь разбавляют водой и экстрагируют подходящим органическим растворителем, таким как дихлорметан. Органические экстракты объединяют, сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме с получением соединения формулы Ig. В стадии В схемы VII соединение формулы Ig сульфонилируют с получением соединения формулы Ih при условиях, хорошо известных в данной области. Например, соединение Ig растворяют в подходящем органическом растворителе, таком как дихлорметан, с последующим добавлением приблизительно 1,05 экв. триэтиламина. Раствор охлаждают до приблизительно 0 С и обрабатывают приблизительно 1,05 экв. подходящего сульфонилхлорида формулы R30SO2Cl, такого как метансульфонилхлорид. Затем реакционной смеси дают нагреваться до комнатной температуры на протяжении 2 ч при перемешивании. Затем продукт, соединениеIh, выделяют и очищают с использованием способов, хорошо известных специалисту с обычной квалификацией в данной области, таких как экстракция и хроматография. Например, затем реакционную смесь разбавляют подходящим органическим растворителем, таким как дихлорметан и 10% водный бисульфат натрия. Органический слой отделяют и водный слой экстрагируют дихлорметаном. Затем органический слой и экстракты объединяют, сушат над безводным сульфатом натрия,фильтруют и концентрируют в вакууме с получением соединения Ih. Затем соединение Ih может быть очищено флеш-хроматографией на силикагеле с подходящим элюентом, таким как смесь этилацетат/гексан с получением очищенного соединения Ih. Более конкретно, соединения формулы Ij и формулы Ik могут быть получены, как показано в схеме VIII. Реагенты и исходные материалы являются легко доступными для специалиста с обычной квалификацией в данной области. Все заместители, если нет других указаний, являются такими, как описанные ранее. В стадии А схемы VIII соединение формулы If может быть гидролизовано при стандартных условиях с получением соединения формулы Ij. Например, соединение If растворяют в подходящем органическом растворителе, таком как диоксан, и обрабатывают подходящим основанием, таким как гидроксид натрия. Затем реакционную смесь нагревают при приблизительно 100 С в течение приблизительно 24 ч. Затем реакционную смесь охлаждают до комнатной температуры и подкисляют 10% бисульфатом натрия. Затем соединение Ij выделяют и очищают способами, хорошо известными в данной области, такими как экстракция и хроматография. Например, реакционную смесь экстрагируют подходящим органическим растворителем,таким как этилацетат, органические экстракты объединяют, сушат над безводным сульфатом магния, фильтруют и концентрируют в вакууме с получением соединения Ij. Соединение Ij может быть очищено флеш-хроматографией на силикагеле с подходящим элюентом,таким как смесь метанол/хлороформ. В стадии В схемы VIII соединение формулы Ij может быть эстерифицировано при условиях, хорошо известных в данной области, с получением соединения формулы Ik. Например,соединение Ij растворяют в подходящем органическом растворителе формулы R40OH, где R40 представляет (1-6 С)алкил, (3-6 С)циклоалкил,фтор(1-6 С)алкил, хлор(1-6 С)алкил, (2-6 С) алкенил, (1-4 С)алкокси(1-4 С)алкил, фенил, который является незамещенным или замещен галогеном, (1-4 С)алкилом или (1-4 С)алкокси, (1-4 С) алкилфенил, где фенильная группа является незамещенной или замещена галогеном, (1-4 С) алкилом или (1-4 С)алкокси, таком как этанол, и газообразный НСl барботируют через этот раствор до насыщения смеси. Затем реакционную смесь нагревают при 60 С в течение приблизительно 24 ч, затем охлаждают до комнатной температуры и концентрируют в вакууме. К остатку добавляют дополнительно этанол и смесь опять концентрируют в вакууме с полу 004299 32 чением этилового эфира соединения Ik. Затем соединение Ik может быть очищено флешхроматографией на силикагеле с подходящим элюентом, таким как смесь этилацетат/гексан. Более конкретно, соединения формулы Im могут быть получены, как показано в схеме IX. Реагенты и исходные материалы являются легко доступными для специалиста с обычной квалификацией в данной области. Все заместители,если нет других указаний, являются такими, как описанные ранее. Схема IX В стадии А схемы IX соединение Ij легко превращают в амид формулы Im при условиях,хорошо известных в данной области. Например,соединение Ij растворяют в подходящем органическом растворителе, таком как тетрагидрофуран, и обрабатывают избытком тионилхлорида. Реакционную смесь перемешивают при комнатной температуре в течение приблизительно 16 ч и затем концентрируют в вакууме. Затем остаток растворяют в подходящем органическом растворителе, таком как дихлорметан. Раствор добавляют к раствору одного эквивалента подходящего амина формулы R31R32NH, где R31 и R32 независимо представляют (1-4 С)алкил или вместе с атомом азота, к которому они присоединены, образуют группу азе-тидинил, пирролидинил, пиперидинил, морфолино, пиперазинил, гексагидроазепинил или октагидроазоцинил, такого как диметиламин, в дихлорметане при перемешивании. Эту смесь перемешивают в течение приблизительно 2 ч при приблизительно 0 С и затем добавляют 10% водный бисульфат натрия. Затем соединение Im выделяют и очищают способами, хорошо известными в данной области, такими как экстракция и флешхроматография. Например, реакционную смесь затем экстрагируют подходящим органическим растворителем, таким как дихлорметан, органические экстракты объединяют, сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме с получением соединения Im. Затем оно может быть очищено флеш-хроматографией на силикагеле с подходящим элюентом, таким как смесь этилацетат/гексан, с получением очищенного соединения Im. Соединения формулы In могут быть получены, как показано на схеме X. Реагенты и исходные материалы являются легко доступными для специалиста с обычной квалификацией в данной области. Все заместители, если нет дру 33 гих указаний, являются такими, как описанные ранее. Схема ХClSO2NR3R4 при стандартных условиях с получением соединения структуры (16). Например,соединение (1) растворяют в подходящем органическом растворителе, таком как тетрагидрофуран, и обрабатывают приблизительно одним эквивалентом подходящего основания, такого как DBU, при приблизительно 0 С. Затем раствор обрабатывают приблизительно одним эквивалентом соединения формулы ClSO2NR3R4. Затем реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение приблизительно 4-16 ч. Затем реакционную смесь концентрируют в вакууме с получением неочищенного продукта (16), который затем очищают хроматографией на силикагеле с подходящим элюентом, таким как смесь этилацетат/гексан. В стадии В схемы Х соединение (16) превращают в соединение формулы In способом,аналогичным методике, представленной в стадии В схемы I. Альтернативно, в стадии В' схемы Х соединение (1) фторируют способом, аналогичным методике, описанной в стадии В схемы I, с использованием DAST с получением соединения формулы In способом, аналогичным методике, описанной выше в стадии А. Соединения формулы Iр могут быть получены, как показано в схеме XI. Реагенты и исходные материалы являются легко доступными для специалиста с обычной квалификацией в данной области. Все заместители, если нет других указаний, являются такими, как описанные ранее. Схема XI В стадии А схемы XI фенол структуры (18) алкилируют подходящим алкилирующим агентом структуры Ralk-Hal при стандартных усло 004299 34 виях, где Hal обозначает Br или Cl, a Ralk обозначает незамещенную или замещенную ароматическую группу, незамещенную или замещенную гетероароматическую группу, незамещенную или замещенную группу (5-8 С)циклоалкил,(1-10 С)алкил; (2-10 С)алкенил; или (2-10 С)алкинил, с получением соединения структуры(19). Например, соединение (18) добавляют к приблизительно одному эквиваленту подходящего основания, такого как гидрид натрия, в подходящем органическом растворителе, таком как диметилформамид. Реакционную смесь перемешивают в течение приблизительно 30 мин при комнатной температуре и обрабатывают приблизительно одним эквивалентом подходящего алкилирующего агента Ralk-Hal с последующим добавлением иодида натрия. Реакционную смесь нагревают при приблизительно 100 С в течение приблизительно 2 ч и затем охлаждают. Реакционную смесь разбавляют водой, экстрагируют подходящим органическим растворителем, таким как этилацетат, органические экстракты объединяют, промывают водой,сушат над безводным сульфатом натрия, фильтруют и концентрируют с получением неочищенного соединения (19). Неочищенный материал может быть очищен хроматографией на силикагеле с подходящим растворителем, таким как смесь этилацетат/гексан. В стадии В схемы XI соединение (19) фторируют способом, аналогичным методике, описанной в стадии В схемы I, с использованиемDAST с получением соединения формулы Iр. Соединения формулы Iq могут быть получены, как показано на схеме XII. Реагенты и исходные материалы являются легко доступными для специалиста с обычной квалификацией в данной области. Все заместители, если нет других указаний, являются такими, как описанные ранее. Схема XII В стадии А схемы XII соединение структуры (20) превращают в амид структуры (21) при стандартных условиях сочетания амидов, хорошо известных в данной области. Например, соединение (20) растворяют в подходящем органическом растворителе, таком как дихлорметан,и обрабатывают каталитическим количеством ди-метиламинопиридина (DMAP), около 1,6 экв. 1-[3-(диметиламино)пропил]-3-этилкарбодиимида, и приблизительно одним эквивалентом подходящей кислоты формулы RalkCO2H.Ralk обозначает незамещенную или замещенную 35 ароматическую группу, незамещенную или замещенную гетероароматическую группу, незамещенную или замещенную группу (5-8 С)циклоалкил, (1-10 С)алкил; (2-10 С)алкенил; или (210 С)алкинил. Реакционную смесь перемешивают при комнатной температуре в течение приблизительно от 4 до 64 ч и выливают в воду. Затем эту погашенную реакционную смесь экстрагируют подходящим органическим растворителем, таким как этилацетат, объединенные органические экстракты промывают водой, сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме с получением неочищенного (21). Неочищенный материал может быть очищен хроматографией на силикагеле с подходящим элюентом, таким как смесь этилацетат/гексан. Альтернативно, на стадии А соединение 20 растворяют в подходящем органическом растворителе, таком как тетрагидрофуран, с добавлением около 1,2 экв. триэтиламина. Затем раствор обрабатывают по каплям приблизительно одним эквивалентом хлорангидри-да кислоты формулы RalkCOCl. Ralk обозначает незамещенную или замещенную ароматическую группу,незамещенную или замещенную гетероароматическую группу, незамещенную или замещенную группу (5-8 С)циклоалкил, (1-10 С)алкил; (210 С)алкенил; или (2-10 С)алкинил. Реакционную смесь перемешивают при комнатной температуре в течение приблизительно от 4 до 64 час и выливают в воду. Затем эту погашенную реакционную смесь экстрагируют подходящим органическим растворителем, таким как этилацетат, объединенные органические экстракты промывают водой, сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме с получением неочищенного (21). Неочищенный материал может быть очищен хроматографией на силикагеле с подходящим элюентом, таким как смесь этилацетат/гексан. В стадии В схемы XII соединение (21) фторируют способом, аналогичным методике,описанной в стадии В схемы I, с использованием DAST с получением соединения формулы Iq. Способность соединений формулы I потенциировать опосредованную рецептором глутамата ответную реакцию, может быть определена с использованием флуоресцентных красителей (Molecular Probes, Eugene, Oregon, Fluo-3),являющихся индикаторами кальция, измерением индуцируемого глутаматом оттока кальция вGluR4-трансфицированные клетки НЕК 293, как описано более подробно ниже. В одном тесте готовят 96-луночные планшеты, содержащие конфлюэнтные монослои клеток НЕК 293, стабильно экспрессирующихGluR4B человека (полученных, как описано в публикации Европейской патентной заявки с номером ЕР-А 1-583917). Затем среду для культуры ткани в этих лунках выбрасывают и лунки(каждую) промывают один раз 200 мкл буфера(глюкоза, 10 мМ, хлорид натрия, 138 мМ, хлорид магния, 1 мМ, хлорид калия, 5 мМ, хлорид кальция, 5 мМ, N-[2-гидроксиэтил]пиперазинN-[2-этансульфоновая кислота], 10 мМ, до рН 7,1-7,3). Затем планшеты инкубируют в течение 60 мин в темноте с 20 мкМ красителем Fluo3AM (полученным от Molecular Probes Inc.,Eugene, Oregon) в буфере в каждой лунке. После инкубирования каждую лунку промывают один раз 100 мкл буфера, добавляют 200 мкл буфера и планшеты инкубируют в течение 30 мин. Растворы для применения в этом тесте готовят также следующим образом. Разведения 30 мкМ, 10 мкМ, 3 мкМ и 1 мкМ испытуемого соединения готовят с использованием буфера из 10 мМ раствора испытуемого соединения в ДМСО. 100 мкМ раствор циклотиа-зида готовят добавлением 3 мкл 100 мМ циклотиазида к 3 мл буфера. Контрольный буферный раствор готовят добавлением 1,5 мкл ДМСО к 498,5 мкл буфера. Затем каждый тест проводят следующим образом. 200 мкл контрольного буфера в каждой лунке выбрасывают и заменяют 45 мкл контрольного буферного раствора. Измерение флуоресцентного фона считывают с использованием флуориметра FLUOROSKAN II (полученного от Labsystems, Needham Heights, MA,USA, a Division of Life Sciences International Plc). Затем буфер удаляют и заменяют 45 мкл буфера и 45 мкл испытуемого соединения в буфере в соответствующих лунках. Второе флуоресцентное считывание данных выполняют через 5 мин инкубации. Затем 15 мкл 400 мкМ раствора глутамата добавляют в каждую лунку (конечная концентрация глутамата 100 мкМ) и выполняют третье считывание. Активности испытуемых соединений и растворов циклотиазида определяют вычитанием данных второго из данных третьего считывания (флуоресценция, вызываемая добавлением глутамата в присутствии или в отсутствие испытуемого соединения или циклотиазида) и выражают относительно усиления флуоресцении, производимого 100 мкМ циклотиазидом. В другом тесте клетки НЕК 293, стабильно экспрессирующие GluR4 человека (полученные,как описано в публикации Европейской патентной заявки с номером ЕР-А 1-583917), используют в определении электрофизиологических свойств потенциаторов АМПК-рецепторов. Раствор для внеклеточного считывания данных содержит (в мМ): 140 NaCl, 5 KCl, 10 HEPES, 1MgCl2, 2 CaCl2, 10 глюкозу, рН = 7,4 с NaOH,295 мОсм/кг. Раствор для внутриклеточного считывания данных содержит (в мМ): 140 CsCl,1 MgCl2, 10 HEPES N-[2-гидроксиэтил] пиперазин-N-[2-этансульфоновая кислота, 10 ЭГТА (этилен-бис(оксиэтиленнитрило)тетрауксусная кислота), рН = 7,2 с CsOH, 295 мОсм/кг. С этими растворами регистрирующие пипетки имеют сопротивление 2-3 МОм. С использова 37 нием способа фиксации напряжения во всей клетке (способа вольт-клампа) (Hamil et al.(1981) Pflugers Arch., 391: 85-100) к клеткам применяют фиксацию напряжением (вольткламп) при -60 мВ и вызывают контрольные отклики тока на 1 мМ глутамат. Затем отклики на 1 мМ глутамат определяют в присутствии испытуемого соединения. Соединения считают активными в данном тесте, если при концентрации в тесте 10 мкМ или менее они производят более, чем 10% увеличение в величине тока,вызываемого 1 мМ глутаматом. Для определения силы испытуемых соединений концентрацию испытуемого соединения,как в промывочном растворе, так и при введении с глутаматом, увеличивают в полулогарифмических единицах до тех пор, пока не наблюдается максимальное действие. Данные, полученные таким образом, используют в уравнении Хилла, получая величину EC50, являющуюся показателем силы данного испытуемого соединения. Обратимость активности испытуемого соединения определяют оценкой контрольных ответных реакций на 1 мМ глутамат. Как только контрольные ответные реакции на действие глутамата повторно устанавливаются, определяют потенциирование этих ответных реакций 100 мкМ циклотиазидом посредством его включения как в промывочный раствор, так и в глутаматсодержащий раствор. Таким образом может быть определена эффективность испытуемого соединения относительно циклотиазида. В соответствии с другим аспектом, в данном изобретении предлагается фармацевтическая композиция, которая содержит соединение формулы I или его фармацевтически приемлемую соль и фармацевтически приемлемый разбавитель или носитель. Фармацевтические композиции готовят по известным методикам с использованием хорошо известных и легко доступных ингредиентов. При приготовлении композиций данного изобретения активный ингредиент обычно смешивают с носителем, или разбавляют носителем,или заключают в носитель, и композиции могут быть в форме капсулы, саше, бумажного или иного контейнера. Когда носитель служит в качестве разбавителя, он может быть твердым,полутвердым или жидким материалом, который действует как носитель, наполнитель или среда для активного ингредиента. Композиции могут быть в форме таблеток, пилюль, порошков, пастилок, саше, крахмальных облаток, эликсиров,суспензий, эмульсий, растворов, сиропов, аэрозолей, мазей, содержащих, например, до 10% по весу активного соединения, мягких и твердых желатиновых капсул, суппозиториев, стерильных инъекционных растворов и стерильных упакованных порошков. Некоторые примеры подходящих носителей, наполнителей и разбавителей включают лактозу, декстрозу, сахарозу, сорбит, маннит, 004299 38 крахмалы, камедь, аравийскую камедь, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическую целлюлозу,поливинилпирролидон, целлюлозу, водный сироп, метилцеллюлозу, метил- и пропилгидроксибензоаты, тальк, стеарат магния и минеральное масло. Эти композиции могут дополнительно содержать смазывающие агенты, увлажняющие агенты, эмульгирующие и суспендирующие агенты, консерванты, подсластители или корригенты. Композиции данного изобретения могут быть приготовлены таким образом, чтобы они обеспечивали быстрое, длительное или задержанное высвобождение активного ингредиента после введения пациенту, с использованием процедур, хорошо известных в данной области. Композиции готовят предпочтительно в форме унифицированной (стандартной) лекарственной формы, содержащей от приблизительно 1 мг до приблизительно 500 мг, более предпочтительно от приблизительно 5 мг до приблизительно 300 мг (например, 25 мг) активного ингредиента. Термин унифицированная лекарственная форма относится к физически дискретной единице, пригодной в качестве единичной дозы для субъектов-людей и других млекопитающих, причем каждая единица содержит заранее заданное количество активного материала, рассчитанное для получения желаемого терапевтического эффекта, в сочетании с подходящим фармацевтическим носителем, разбавителем или наполнителем. Следующие примеры композиций являются только иллюстративными и не предназначены для ограничения каким-либо образом объема данного изобретения. Композиция 1. Твердые желатиновые капсулы готовят с использованием следующих ингредиентов: Количество(мг/капсула) Активный ингредиент 250 Крахмал, высушенный 200 Стеарат магния 10 Всего 460 Указанные выше ингредиенты смешивают и заполняют ими твердые желатиновые капсулы в количествах по 460 мг. Композиция 2. Таблетки, каждая из которых содержит 60 мг активного ингредиента,готовят следующим образом: Количество Активный ингредиент, крахмал и целлюлозу пропускают через сито США с отверстиями 45 меш и тщательно смешивают. Раствор поливинилпирролидона смешивают с полученными порошками и затем пропускают через сито США с отверстиями 14 меш. Полученные таким образом гранулы сушат при 50 С и пропускают через сито США с отверстиями 18 меш. Натрий-карбоксиметилкрахмал, стеарат магния и тальк, предварительно пропущенные через сита США с отверстиями 60 меш, добавляют затем к этим гранулам, которые, после смешивания, прессуют на таблетировочной машине с получением таблеток, каждая из которых имеет вес 150 мг. Как он здесь применяется, термин пациент относится к млекопитающему, такому как мышь, морская свинка, крыса, собака или человек. Понятно, что предпочтительным пациентом является человек. Как они здесь применяются, термины лечение или лечить обозначает каждый ослабление симптомов, элиминацию причины заболевания либо на временной основе, либо на постоянной основе, или предупреждение либо замедление появления симптомов указанного нарушения. Как таковые, способы данного изобретения включают в себя как терапевтическое,так и профилактическое введение. Как он здесь применяется, термин эффективное количество относится к количеству соединения формулы I, которое является эффективным, при введении одной дозы или при введении многочисленных доз пациенту, в лечении пациента, страдающего от указанного нарушения. Эффективное количество может быть легко определено лечащим диагностом, а также лицом, квалифицированным в данной области,путем применения известных способов и наблюдения результатов, полученных при аналогичных обстоятельствах. В определении эффективного количества или дозы ряд факторов учитываются лечащим диагностом, в том числе, но не ограничиваясь только ими, вид млекопитающего, его размер, возраст и общее здоровье; конкретное вовлеченное в патологический процесс заболевание или нарушение; степень или вовлечение в патологический процесс или тяжесть данного заболевания или нарушения; реакция конкретного индивидуального пациента; конкретное вводимое соединение; способ введения; характеристики биодоступности вводимого препарата; выбранная схема введения препарата; применение сопутствующего лекарственного средства и другие относящиеся к лечению обстоятельства. Соединения могут вводиться различными путями, в том числе пероральным, ректальным,чрескожным, подкожным, внутривенным, внутримышечным, щечным или интраназальным 40 путями. Альтернативно, соединение может вводиться непрерывной инфузией. Типичная суточная доза содержит от приблизительно 0,01 мг/кг до приблизительно 100 мг/кг активного соединения данного изобретения. Предпочтительно суточные дозы будут составлять от около 0,05 мг/кг до около 50 мг/кг, более предпочтительно от около 0,1 мг/кг до около 25 мг/кг. Следующие примеры и получения представляют типичные синтезы соединений формулы I, описанные в общем виде выше. Эти примеры являются лишь иллюстративными и не предназначены для ограничения каким-либо образом данного изобретения. Реагенты и исходные материалы являются легко доступными специалисту с обычной квалификацией в данной области. Как они здесь используются, следующие термины имеют указанные значения:"фунт/кв. дюйм" обозначает фунты на квадратный дюйм; "мин" обозначает минуты; "ч" обозначает часы; "С" обозначает градусы Цельсия;"ТСХ" обозначает тонкослойную хроматографию; "ВЖХ" обозначает жидкостную хроматографию высокого разрешения (высокоэффективную жидкостную хроматографию); "Rf" обозначает коэффициент удерживания; "Rt" обозначает время удерживания;обозначает миллионные доли в направлении вниз в поле от тетраметилсилана; ТГФ обозначает тетрагидрофуран; ДМФА обозначает"aq"обозначает водный; "iPrOAc" обозначает изопропилацетат; метил DAST обозначает диметиламиносератрифторид; "DAST" обозначает диэтиламиносератрифторид; " DBU" обозначает 1,8-диазабицикло[5.4.0]ундец-7-ен и КТ обозначает комнатная температура. Пример 1. Получение [2-фтор-2-(4-иодфенил)пропил][(метилэтил)сульфонил]амина 1-амино-2-(4-иодфенил)про Схема IV, стадия А. Триметилсилилзащищенное цианогидриновое производное 4 иодацетофенона получали in situ в основном согласно способу, описанному Greenlee andHangauer, Tetrahedron Lett., 24(42), 4559 (1983). Таким образом, цианотриметилсилан (21,4 г,0,216 моль) добавляли по каплям на протяжении 5 мин к сухому, имеющему комнатную темпе 41 ратуру раствору, содержащему 4-иодацетофенон (44,3 г, 0,180 моль), 18-краун-6 (1,6 г, 6,1 ммоль) и KCN (1,17 г, 0,018 ммоль) в ТГФ (100 мл). Полученному раствору давали перемешиваться в течение 2,5 ч. ТСХ-анализ (3:7EtOAc/гексаны) показал израсходование исходного ацетофенона. Схема IV, стадия В: ЮМ раствор борана в диметилсульфиде (25 мл, 0,25 ммоль) быстро добавляли к реакционному раствору и полученную смесь нагревали с обратным холодильником при кипении в течение 16 ч. Смесь охлаждали до комнатной температуры и безводный 10% (по весу) НСl в метаноле медленно добавляли на протяжении 1 ч (выделение газа). Раствору давали перемешиваться в течение еще одного часа и концентрировали при пониженном давлении с получением неочищенного указанного в заголовке соединения в виде белого твердого вещества и в виде гидрохлоридной соли. Эту соль растирали с метил-третбутиловым простым эфиром и фильтровали. Свободное основание получали добавлением 1 н.NaOH к суспензии HCl-соли в CH2Cl2 (150 мл) и ТГФ (350 мл) до получения рН 12,3. Фазы разделяли и органическую фазу промывали солевым раствором (25 мл). Органическую фазу,содержащую свободный амин, концентрировали при пониженном давлении и полученные твердые вещества растирали с диэтиловым эфиром(30 мл) с получением промежуточного указанного в заголовке соединения (35,6 г, 71,3%) в виде порошка нестандартно белого цвета после сушки в вакууме. 1H ЯМР, (СD3OD, 300 МГц):7,68 (д, 2 Н, J=8,4), 7,24 (д, 2 Н, J=8,7), 2,78 (м,2 Н), 1,46 (с, 3H). Получение(1,60 г, 0,011 моль) к 1-амино-2-(4-иодфенил) пропан-2-олу (2,77 г, 0,01 моль) в 125 мл CH2Cl2 при перемешивании при 0 С в атмосфере азота. Затем реакционной смеси давали нагреваться до комнатной температуры и перемешивали в течение ночи при этой температуре. Утром смесь выливали в Н 2 О и слои разделяли. Органический слой промывали один раз Н 2O, сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении. Полученное полутвердое вещество очищали хроматографией на силикагеле с использованием Prep.LC-2000 и элюированием смесью гексан/ EtOAc 3:1 с получением промежуточного указанного в заголовке соединения (744 мг, 19%) в виде твердого вещества. FDMS 382 (М).N 3,55. Альтернативное получение указанного в заголовке соединения. Схема I, стадия А: В 3-горлую колбу на 250 мл, снабженную мешалкой и термометром,добавляли по каплям 2,10 г 2-пропансульфонилхлорида к 2,77 г 1-амино-2-(4-иодфенил)пропан 2-ола и 2,30 г DBU в СН 2 Сl2 (150 мл) при перемешивании при 0 С в атмосфере азота. Реакционной смеси давали нагреваться до комнатной температуры и перемешивали в течение ночи при этой температуре. Утром реакционную смесь разбавляли CH2Cl2 (100 мл) и органический слой промывали два раза H2O, сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением вязкого масла. Этот материал очищали хроматографией на силикагеле с использованием Chromatotron с ротором 4000 мкм и элюированием смесью дихлорметан/метанол 19:1 с получением промежуточного указанного в заголовке соединения (1,0 г, 31%) в виде вязкого масла. МС с распылением ионов 382 (М-1). Получение конечного указанного в заголовке соединения. Схема I, стадия В: В одногорлую колбу на 10 мл добавляли медленно шприцом раствор [2 гидрокси-2-(4-иодфенил)пропил]-[(метилэтил) сульфонил]амина (158 мг, 0,41 ммоль) в 1,7 млCH2Cl2 к раствору DAST (66 мг, 0,41 ммоль) в 0,3 мл CH2Cl2 при перемешивании при -78 С в атмосфере азота. Реакционной смеси давали нагреваться до комнатной температуры и смесь разбавляли H2O и CH2Cl2. Слои разделяли и органический слой промывали дважды Н 2 О, сушили над безводным Nа 2SO4, фильтровали и концентрировали при пониженном давлении с получением конечного указанного в заголовке соединения (113 мг) в виде твердого вещества. МС с распылением ионов 384 (М-1). Дополнительное получение конечного указанного в заголовке соединения. Схема I, стадия В: В 3-горлую колбу на 100 мл, снабженную мешалкой и термометром,добавляли по каплям 1,0 г [2-гидрокси-2-(4 иодфенил)пропил][(метилэтил)сульфонил]амина в CH2Cl2 (15 мл) к 0,3 мл DAST в СН 2 Сl2 (10 мл) при перемешивании при -78 С в атмосфере азота. Реакционной смеси давали нагреваться до комнатной температуры и разбавляли CH2Cl2(50 мл). Органический слой промывали H2O,сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением масла. Этот материал очищали хроматографией на силикагеле с использованием Chromatotron с ротором 4000 мкм и элюированием градиентным растворителем гексан/этилацетат 9:1 - гексан/этилацетат 3:1 с получением конечного указанного в заголовке 43 соединения (0,906 г) в виде белого твердого вещества. МС с распылением ионов 384 (М-1). Анализ для C12H17NO2SFI: Вычислено: С 37,42; Н 4,44; N 3,64. Найдено: С 37,27; Н 4,33;[Как он применяется здесь, термин 3 А этанол обозначает этанол, содержащий 5% метанола]. Смесь перемешивали посредством ультразвука с получением прозрачного бесцветного раствора. Этот объем раствора наносили на препаративную хроматографическую колонку 8 х 28 смChiralpak AD, которая была предварительно уравновешена смесью 60% 3 А этанол/40% гептан. Поток элюента составлял 300 мл/мин и длина волны детектирования была 240 нм. Первым элюирующимся веществом был (+)-[2 фтор-2-(4-иодфенил)пропил]метилэтил) сульфонил]амин, []D = +18,5 (с=1,08, МеОН), а следующим элюирующимся веществом был (-)-[2 фтор-2-(4-иодфенил)пропил][(метилэтил)сульфонил]амин, []D = -23,5 (с=1,02, МеОН). Описанную выше процедуру повторяли дважды аналогичным образом с [2-фтор-2-(4-иодфенил) пропил][(метилэтил)сульфонил]амином (второй прогон, 3,0 г, растворенные в 50 мл смеси 3A этанол/гептан, 3:2, и третий прогон, 2,0 г, растворенные в 0,8 г, растворенных в 40 мл смеси 3A этанол/гептан, 3:2). Таким образом, в трех прогонах в целом 5,8 г [2-фтор-2-(4-иодфенил) пропил][(метилэтил)сульфонил]амина разделяли на составляющие энантиомеры со следующими выходами фракций после концентрирования: Схема VI, Стадия А'. В одногорлую колбу на 10 мл помещали [2-фтор-2-(4-иодфенил) пропил][(метилэтил)сульфонил]амин (113 мг,0,29 ммоль, полученный в примере 1), фенилборную кислоту (54 мг, 0,44 ммоль), карбонат калия (61 мг, 0,44 ммоль) и тетракис(трифенилфосфин)Pd(0) (17 мг, 0,02 ммоль) в смеси диоксан/вода (3:1, 7 мл). Затем смесь нагревали при 100 С при перемешивании в течение 18 ч. Затем реакционную смесь охлаждали до комнатной температуры и выливали в Н 2 О. Смесь экстрагировали EtOAc и органический слой промывали дважды Н 2O, сушили над безводнымNa2SO4, фильтровали и концентрировали в вакууме. Полученное полутвердое вещество очищали радиальной хроматографией (Chromatotron, Harrison Research Inc., 840 Moana Court,Palo Alto CA 94306) с использованием ротора 2000 мкм (силикагель) и элюированием растворителем в виде смеси гексан/EtOAc 4:1 с получением указанного в заголовке соединения (33 мг, 34%) в виде медленно кристаллизующегося рыжевато-коричневого масла. МС с распылением ионов 335 (М+1). Анализ для С 12 Н 18NO3S: Вычислено: С 64,45; Н 6,61; N 4,18. Найдено: С 65,50; Н 6,46; Раствор 4-бромбензонитрила (91,7, 0,50 моль) в ТГФ (1,1 л) сушили в присутствии активированных молекулярных сит 3 при комнатной температуре. Этот раствор фильтровали и охлаждали до -100 С. 1,6 М раствор н 45 бутиллития в гексанах (355 мл, 0,567 моль) добавляли к этому холодному раствору на протяжении 15 мин при поддержании внутренней температуры между -105 С и -93 С. К полученной оранжевой реакционной смеси добавляли триметилборат (81 г, 0,78 моль) на протяжении 3 мин, с кратковременным увеличением температуры реакции до -72 С. Реакционную смесь повторно охлаждали до -100 С на протяжении 5 мин и затем давали ей медленно нагреваться до комнатной температуры на протяжении 2,3 ч. Реакционную смесь подкисляли 4 н. НСl до рН 2,2 и разбавляли CH2Cl2 (200 мл). Водный слой отделяли и органический слой промывали солевым раствором (2 х 200 мл), сушили над безводным МgSO4, фильтровали и растворитель удаляли при пониженном давлении с получением бледножелтого твердого вещества. Это твердое вещество дополнительно очищали растворением в 1 н. NaOH и экстракцией в смесь СН 2 Сl2/ТГФ(1:1, 2 х 200 мл). Водную фазу подкисляли 4 н. НСl до рН 2,2 и экстригировали в смесь СН 2 Сl2/ТГФ (1:1, 500 мл). Объединенные органические экстракты концентрировали до неочищенного твердого вещества (64,6 г), которое растирали с диэтиловым эфиром (160 мл) и сушили в вакууме с получением промежуточного указанного в заголовке соединения (44,0 г,59,9%) в виде белого порошка. 1 Схема VI, стадия А: В одногорлую колбу на 50 мл помещали [2-гидрокси-2-(4-иодфенил) пропил][(метилэтил)сульфонил]амин (350 мг,0,90 ммоль), промежуточное соединение, полученное в примере 1), 4-цианобензолбороновую кислоту (206 мг, 1,40 ммоль), карбонат калия(193 мг, 1,40 ммоль) и тетракис(трифенилфосфин)палладий(0) (52 мг, 0,045 ммоль) в смеси диоксан/вода (3:1, 25 мл) и смесь нагревали при 100 С при перемешивании в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры и выливали в Н 2 О. Реакционную смесь экстрагировали EtOAc и органический слой отделяли и промывали дважды Н 2 О, сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении. Полученное полутвердое вещество очищали радиальной хроматографией (Chromatotron) с использованием ротора 4000 мкм (силикагель) и элюированием растворителем в виде смеси гексан/EtOAc 3:1 с получением промежуточного указанного в заголовке соединения (265 мг, 004299N 7,67. Получение конечного указанного в заголовке соединения. Схема VI, стадия В: В одногорлую колбу на 25 мл раствор 4-[4-(1-гидрокси-1-метил-2[(метилэтил)сульфонил]аминоэтил]фенил] бензолкарбонитрила (253 мг, 0,70 ммоль) в 8 млCH2Cl2 медленно добавляли шприцом к раствору DAST (114 мг, 0,71 ммоль) в 2 мл СН 2 Сl2 при перемешивании при -78 С в атмосфере азота. Затем реакционной смеси давали нагреваться до комнатной температуры и смесь разбавляли H2O и CH2Cl2. Слои разделяли и органический слой промывали дважды Н 2 О, сушили над безводнымNa2SO4, фильтровали и концентрировали при пониженном давлении с получением неочищенного указанного в заголовке соединения в виде твердого вещества. Этот неочищенный материал затем очищали радиальной хроматографией с использованием Chromatotron с применением ротора 2000 мкм (силикагель) и элюированием растворителем в виде смеси гексан/EtOAc 3:1 с получением указанного в заголовке соединения(174 мг, 69%) в виде белого твердого вещества. Т.пл. 123-125 С. МС с распылением ионов 359(0) (52 мг, 0,05 ммоль) объединяли в смеси диоксан/вода (30 мл, 3:1) в одногорлой колбе на 50 мл. Смесь нагревали при 100 С при перемешивании в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры и выливали в Н 2 О. Желаемый продукт экстрагировали этилацетатом и органический слой отделяли, промывали дважды H2O, сушили над К 2 СО 3 и концентрировали при пониженном давлении с получением неочищенного материала (350 мг) в виде рыжевато-коричневого твердого вещества. Неочищенный материал очищали хроматографией на силикагеле с применением Chromatotron с использованием ротора 4000 мкм при 47 элюировании растворителем в виде смеси дихлорметан/метанол 9:1 с получением указанного в заголовке соединения (91 мг, 31%) в виде белого твердого вещества. МС с распылением ионов 378 (М-1). Пример 4 а. Получение 4-[4-(1-фтор-1 метил-2-[(метилэтил)сульфонил]аминоэтил] фенил]бензойной кислоты (энантиомера 1).(+)-[2-фтор-2-(4-иодфенил)пропил][(метилэтил)сульфонил]амин (1,00 г, 2,6 ммоль),полученный в примере 1 а), 4-карбоксибензолбороновую кислоту (627 мг, 3,8 ммоль), карбонат калия (520 мг, 3,8 ммоль), тетракис(трифенилфосфин)палладий(0) (206 мг, 0,2 ммоль) и смесь диоксан/вода (112 мл, 3:1) смешивали вместе в одногорлой колбе на 250 мл и перемешивали при 80 С в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры и выливали в 1 н. НСl и желаемый продукт экстрагировали этилацетатом. Органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении с получением 1,43 г в виде темного масла. Этот материал очищали хроматографией на си-ликагеле с применением хроматотрона и с использованием ротора 4000 мкм при элюировании растворителем в виде смеси дихлорметан/метанол 9:1 с получением указанного в заголовке соединения(-)-[2-фтор-2-(4-иодфенил)пропил][(метилэтил)сульфонил]амин (1,00 г, 2,6 ммоль), полученный в примере 1 а), 4-карбоксибензолбороновую кислоту (485 мг, 2,9 ммоль),Na2CO3/H2O (4,4 мл, избыток), тетракис (трифенилфосфин)палладий(0) (206 мг, 0,2 ммоль) и диоксан (20 мл) смешивали вместе в одногорлой колбе на 50 мл и перемешивали при 80 С в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры и выливали в 1 н. НСl и желаемый продукт экстрагировали этилацетатом. Органический слой сушили над MgSO4,фильтровали и концентрировали при пониженном давлении с получением 871 мг в виде пенообразного продукта. Этот материал очищали хроматографией на силикагеле с применением хроматотрона и с использованием ротора 4000 мкм при элюировании растворителем в виде смеси дихлорметан/метанол 9:1 с получением указанного в заголовке соединения (500 мг,51%) в виде рыжевато-коричневого твердого вещества. МС с распылением ионов 378,3 (М 1). Рассчитано для: C19H22NO4SFH2O: Теоретически: С 57,41; Н 6,09; N 3,52. Найдено: С 57,20; Н 5,82; N 3,52. Получение схема VI, стадия А'. В одногорлую колбу на 50 мл [2-фтор-2-(4 иодфенил)пропил][(метилэтил)сульфонил]амин(20 мл, 3:1). Смесь нагревали при 100 С при перемешивании в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры и выливали в H2O. Желаемый продукт экстрагировали этилацетатом и органический слой отделяли, промывали дважды H2O, сушили надK2 СО 3 и концентрировали при пониженном давлении с получением неочищенного материала (276 мг) в виде темного масла. Полученное масло очищали хроматографией на силикагеле с применением хроматотрона с использованием ротора 4000 мкм при элюировании растворителем в виде смеси гексан/этилацетат 1:1 с получением указанного в заголовке соединения (164 мг, 905) в виде вязкого масла. МС с распылением ионов 351,4 (М 1). Анализ для C18H23N2O2SF: Вычислено: С 61,69; Н 6,62; N 7,99. Найдено: С 61,53; Н 6,55;[(метилэтил)сульфонил]амином (140 мг, 0,44 ммоль, полученным в примере 5) и дихлорметаном (10 мл) в атмосфере азота и охлаждали до 0 С. К этому перемешиваемому раствору добавляли по каплям хлорметансульфонилхлорид (69 мг, 1,5 экв.). Реакционной смеси давали нагреваться до комнатной температуры и перемешивали в течение ночи при этой температуре. Утром смесь выливали в Н 2 О и слои разделяли. Органический слой промывали один раз H2O,сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением неочищенного материала (192 мг) в виде желтого масла. Этот неочищенный материал очищали хроматографией на силикагеле с использованием хроматотрона с применением ротора 4000 мкм при элюировании растворителем в виде смеси дихлорметан/этилацетат 9:1 с получением указанного в заголовке соединения продукт экстрагировали этилацетатом. Органический слой промывали один раз Н 2O, сушили над K2 СО 3, фильтровали и концентрировали при пониженном давлении с получением 571 мг в виде пенообразного вещества. Этот материал очищали хроматографией на силикагеле с применением хроматотрона и с использованием ротора 4000 мкм при элюировании растворителем в виде смеси гексан/этилацетат 1:1 с получением указанного в заголовке соединения (294 мг, 56%) в виде коричневого твердого вещества. МС с распылением ионов 427,3 (М-1). Вычислено для C19H25N2O4S2FH2O. Теоретически: С 51,08; Н 6,09; N 6,27. Найдено: С 51,29; Н 5,63; N 6,29. Пример 7. Получение [2-фтор-2-(4-(3-тиенил)фенил)пропил][(метилэтил)сульфонил] амина(0) (75 мг, 0,06 ммоль) и смесь диоксан/вода (36 мл, 3:1) смешивали вместе в одногорлой колбе на 100 мл и перемешивали при 80 С в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры и выливали в Н 2O и желаемый продукт экстрагировали этилацетатом. Органический слой промывали один раз Н 2O, сушили над K2 СО 3, фильтровали и концентрировали при пониженном давлении с получением 191 мг в виде вязкого масла. Этот материал очищали хроматографией на силикагеле с применением хроматотрона и с использованием ротора 2000 мкм при элюировании растворителем в виде смеси гексан/этилацетат 1:1 с получением указанного в заголовке соединения (86 мг, 26%) в виде белого твердого вещества. МС с распылением ионов 427,1 (М-1). Вычислено для C19H25N2O4S2FH2O: Теоретически: С 51,08, Н 6,09, N, 6,27. Найдено: С 51,29 Н 5,63 N 6,29. Пример 6b. Получение [2-фтор-2-(4-3[(метилсульфонил)амино]фенилфенил)пропил] Схема VI, Стадия А': В одногорлую колбу на 50 мл [2-фтор-2-(4-иодфенил)пропил][(метилэтил)сульфонил]амин (150 мг, 0,39 ммоль,полученный в примере 1 а), тиофен-3-бензолбороновую кислоту (74 мг, 0,56 ммоль), карбонат калия (80 мг, 0,56 ммоль) и тетракис(трифенилфосфин)палладий(0) (31 мг, 0,027 ммоль) объединяли в смеси диоксан/вода (15 мл, 3:1). Смесь нагревали при 100 С при перемешивании в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры и выливали в Н 2O. Желаемый продукт экстрагировали этилацетатом и органический слой отделяли и промывали дважды Н 2O, сушили над К 2 СО 3 и концентрировали при пониженном давлении с получением неочищенного материала (236 мг) в виде темного масла. Полученное масло очищали хроматографией на силикагеле с применением хроматотрона с использованием ротора 4000 мкм при элюировании растворителем в виде смеси гексан/этилацетат 7:3 с получением указанного в заголовке соединения (107 мг, 81%) в виде белого твердого вещества. МС с распылением ионов 340,0 (М-1). Анализ для C16H20N2O2S2F: Вычислено: С 56,28; Н 5,90; N 4,10. Найдено: С 56,24; Н 5,86;(385 мг, 1,30 экв.), 2,0 М Na2CO3/H2O (2,2 мл, избыток), тетракис(трифенилфосфин)палладий(0) (100 мг, 0,09 ммоль) и диоксан (15 мл) смешивали вместе в одногорлой колбе на 50 мл и перемешивали при 80 С в течение ночи. Утром реакционную смесь охлаждали до комнатной температуры и выливали в Н 2O и желаемый Схема VI, Стадия А': [2-фтор-2-(4-иодфенил)пропил]-[(метилэтил)сульфонил]амин (200 мг, 0,52 ммоль, полученный в примере 1), пиридилбороновую кислоту (93 мг, 0,76 ммоль), кар 51 бонат калия (104 мг, 0,76 ммоль) и тетракис(трифенилфосфин)палладий(0) (41 мг, 0,036 ммоль) и смесь диоксан/вода (20 мл, 3:1) смешивали вместе в одногорлой колбе на 100 мл и перемешивали при 90 С в течение ночи. Утром реакционную смесь охлаждали до комнатной температуры и выливали в Н 2O и желаемый продукт экстрагировали этилацетатом. Органический слой промывали один раз Н 2O, сушили над K2 СО 3, фильтровали и концентрировали при пониженном давлении с получением 235 мг вязкого масла. Этот материал очищали хроматографией на силикагеле с применением хроматотрона с использованием ротора 4000 мкм при элюировании растворителем в виде смеси дихлорметан/этилацетат 1:1 с получением указанного в заголовке соединения (126 мг, 72%) в виде полутвердого вещества. МС с распылением ионов 337,2 (М+1). Вычислено для C17H21N2O2SF: Теоретически: С 60,69; Н 6,29; N 8,33. Найдено: С 60,86; Н 6,17; N 7,99. Пример 9. Получение 2-4-[4-(1-фтор-1 метил-2-[(метилэтил)сульфонил]аминоэтил) фенил]фенилэтаннитрила.(500 мг, 1,3 ммоль, полученный в примере 1), 4 фенилацетонитрилбороновую кислоту (193 мг,1,4 ммоль), карбонат калия (193 мг, 1,4 ммоль),тетракис(трифенилфосфин)палладий(0) (75 мг,0,65 ммоль) и смесь диоксан/вода (30 мл, 3:1) смешивали вместе в одногорлой колбе на 100 мл и перемешивали при 90 С в течение ночи. Утром реакционную смесь охлаждали до комнатной температуры и выливали в Н 2 О и желаемый продукт экстрагировали этилацетатом. Органический слой промывали один раз H2O, сушили над К 2 СО 3, фильтровали и концентрировали при пониженном давлении с получением вязкого масла. Этот материал очищали хроматографией на силикагеле с применением хроматотрона с использованием ротора 2000 мкм при элюировании растворителем в виде смеси гексан/этилацетат 7:3 с получением указанного в заголовке соединения (143 мг, 30%) в виде желтого твердого вещества. Материал перекристаллизовывали из смеси этилацетат/гексан 1:1. Т. пл. 155-157 С. МС с распылением ионов 373(1,05 г, 2,7 ммоль, полученный в примере 1 а), 4 формилфенилбороновую кислоту (564 мг, 3,5 ммоль), карбонат калия (483 мг, 3,5 ммоль), тетракис(трифенилфосфин)палладий(0) (162 мг, 1,4 ммоль) и смесь диоксан/вода (60 мл, 3:1) смешивали вместе в одногорлой колбе на 250 мл и перемешивали при 90 С в течение ночи. Утром реакционную смесь охлаждали до комнатной температуры и выливали в Н 2 О и желаемый продукт экстрагировали этилацетатом. Органический слой промывали один раз Н 2 О, сушили над K2 СО 3, фильтровали и концентрировали при пониженном давлении с получением вязкого масла. Этот материал очищали хроматографией на силикагеле с применением хроматотрона с использованием ротора 2000 мкм при элюировании растворителем в виде смеси гексан/этилацетат 1:1 с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества. Материал перекристаллизовывали из смеси этилацетат/гексан 1:1 с получением промежуточного указанного в заголовке соединения (519 мг) в виде твердого вещества. МС с распылением ионов 360 (М-1). Вычислено для C19H23NO4S: Теоретически: С 63,13; Н 6,41; N 3,87. Найдено: С 62,94; Н 6,29; N 3,82. Получение конечного указанного в заголовке соединения. Схема VI, стадия В: В 3-горлую колбу,снабженную мешалкой и термометром, 4-[4-(1 гидрокси-1-метил-2-[(метилэтил)сульфонил] аминоэтил)фенил]бензальдегид (519 мг) вCH2Cl2 (25 мл) добавляли по каплям к 0,19 мл-78 С в атмосфере азота. Реакционной смеси давали нагреться до комнатной температуры и разбавляли CH2Cl2 (75 мл). Этот органический слой промывали Н 2 О, сушили над безводнымNa2SO4, фильтровали и концентрировали при пониженном давлении с получением масла. Этот дающий два пятна материал очищали хроматографией на силикагеле с применением хроматотрона с использованием ротора 2000 мкм при элюировании растворителем в виде смеси гексан/этилацетат 3:1 с получением конечного 53 указанного в заголовке соединения (0,337 г,66%, нижнее пятно) в виде белого твердого вещества. МС с распылением ионов 362 (М-1). Вычислено для C19H22NO3SF: Теоретически: С 62,79, Н 6,10, N 3,85. Найдено: С 65,22, Н 6,13, 3,21. Пример 11. Получение 4-[4-(1-фтор-1 метил-2-[(метилэтил)сульфонил]аминоэтил) фенил]фенил-N-метилкарбоксамида В одногорлую колбу на 50 мл добавляли шприцом 1 мл оксалилхлорида к 4- [4-(1-фтор 1-метил-2-[(метилэтил)сульфонил]амино этил)фенил]бензойной кислоте (150 мг, 0,40 ммоль, полученной в примере 4) в CH2Cl2 (10 мл) при перемешивании в атмосфере азота при комнатной температуре. Сразу же добавляли пипеткой 1 каплю ДМФА с инициацией пенообразования смеси. Реакционную смесь перемешивали в течение одного часа при этой температуре и затем концентрировали при пониженном давлении с получением белого полутвердого вещества. Этот материал помещали в ТГФ (10 мл) и добавляли по каплям к перемешиваемому раствору 40% метиламина в воде (5 мл) при комнатной температуре и смесь перемешивали в течение ночи. Утром раствор концентрировали при пониженном давлении и полученное масло помещали в СН 2 Сl2 и органический слой промывали один раз Н 2 О, сушили надK2 СО 3 и концентрировали при пониженном давлении с получением 159 мг полутвердого вещества. Этот материал очищали хроматографией на силикагеле с применением хроматотрона с использованием ротора 2000 мкм при элюировании растворителем в виде смеси дихлорметан/этилацетат 1:1 с получением указанного в заголовке соединения (51 мг, 32%) в виде белого твердого вещества. МС с распылением ионов 362 (М-1). Вычислено для С 20 Н 25N2O3SF: Теоретически: С 61,21; Н 6,42; N 7,14. Найдено: С 59,92; Н 5,86, 6,84. Пример 11 а. Получение 4-[4-(1-фтор-1 метил-2-[(метилэтил)сульфонил]аминоэтил) фенил]фенил-N-метилкарбоксамида (энантиомера 1). В одногорлую колбу на 50 мл добавляли шприцом 1 мл оксалилхлорида к (+)-4-[4-(1 фтор-1-метил-2-[(метилэтил)сульфонил] аминоэтил)фенил]бензойной кислоте (300 мг, 0,79 ммоль, полученной в примере 1 а) в CH2Cl2 (20 мл) при перемешивании в атмосфере азота при комнатной температуре. Сразу же добавляли пипеткой 1 каплю ДМФА с инициацией пенообразования смеси. Реакционную смесь перемешивали в течение одного часа при этой тем 004299 54 пературе и затем концентрировали при пониженном давлении с получением белого полутвердого вещества. Этот материал помещали в диоксан (20 мл) и добавляли по каплям к перемешиваемому раствору 40% метиламина в воде(5 мл) при комнатной температуре и смесь перемешивали в течение ночи. Утром раствор концентрировали при пониженном давлении и полученное масло помещали в дихлорметан и органический слой промывали один раз Н 2 О,сушили над K2 СО 3 и концентрировали при пониженном давлении с получением 271 мг полутвердого вещества. Этот материал очищали хроматографией на силикагеле с применением хроматотрона с использованием ротора 2000 мкм при элюировании растворителем в виде смеси дихлорметан/этилацетат 1:1 с получением указанного в заголовке соединения (100 мг,32%) в виде белого твердого вещества. МС с распылением ионов 391,2 (М-1). Вычислено для С 20 Н 25N2O3SF1/2 Н 2O: Теоретически: С 59,82, Н 6,52, N 6,98. Найдено: С 59,69, Н 6,29, 6,81. Пример 11b. Получение 4-[4-(1-фтор-1 метил-2-[(метилэтил)сульфонил]аминоэтил) фенил]фенил-N-метилкарбоксамида (энантиомера 2). В одногорлую колбу на 50 мл добавляли шприцом 1 мл окса-лилхлорида к (-)-4-[4-(1 фтор-1-метил-2-[(метилэтил)сульфонил]аминоэтил)фенил]бензойной кислоте (300 мг, 0,79 ммоль, полученной в примере 1 а) в дихлорметане (15 мл) при перемешивании в атмосфере азота при комнатной температуре. Сразу же добавляли пипеткой 1 каплю ДМФА с инициацией пенообразования смеси. Реакционную смесь перемешивали в течение одного часа при этой температуре и затем концентрировали при пониженном давлении с получением белого полутвердого вещества. Этот материал помещали в диоксан (20 мл) и добавляли по каплям к перемешиваемому раствору 40% метиламина в воде(5 мл) при комнатной температуре и смесь перемешивали в течение ночи. Утром раствор концентрировали при пониженном давлении и полученное масло помещали в дихлорметан и органический слой промывали один раз H2O,сушили над K2 СО 3 и концентрировали при пониженном давлении с получением 391 мг полутвердого вещества. Этот материал очищали перекристаллизацией из смеси гексан/этилацетат 1:1 с получением указанного в заголовке соединения (231 мг, 49%) в виде белого твердого вещества. МС с распылением ионов 391,4 (М-1). Вычислено для С 20 Н 25N2O3SF1/2 H2O: Теоретически: С 59,82, Н 6,52, N 6,98. Найдено: С 59,78, Н 6,53, 6,89. Пример 12. Получение 4-[4-(1-фтор-1 метил-2-[(метилэтил)сульфонил]аминоэтил) фенил]фенил-N,N-диметилкарбоксамида В одногорлую колбу на 50 мл добавляли шприцом 1 мл оксалилхлорида к 4-[4-(1-фтор-1 метил-2-[(метилэтил)сульфонил]аминоэтил) фенил]бензойной кислоте (150 мг, 0,40 ммоль,полученной в примере 4) в CH2Cl2 (10 мл) при перемешивании в атмосфере азота при комнатной температуре. Сразу же добавляли пипеткой 1 каплю ДМФА с инициацией пенообразования смеси. Реакционную смесь перемешивали в течение одного часа при этой температуре и затем концентрировали при пониженном давлении с получением белого полутвердого вещества. Этот материал помещали в ТГФ (10 мл) и добавляли по каплям к перемешиваемому раствору 40% диметиламина в воде (5 мл) при комнатной температуре и смесь перемешивали в течение ночи. Утром раствор концентрировали при пониженном давлении и полученное масло помещали в CH2Cl2 и органический слой промывали один раз H2O, сушили над K2 СО 3 и концентрировали при пониженном давлении с получением 167 мг в виде масла. Этот материал очищали хроматографией на силикагеле с применением хроматотрона с использованием ротора 2000 мкм при элюировании растворителем в виде смеси дихлорметан/этилацетат 1:1 с получением указанного в заголовке соединения (97 мг, 60%) в виде вязкого масла. МС с распылением ионов 407,4 (М+1). Вычислено для C21H27N2O3SF: Теоретически: С 62,05; Н 6,70; N 6,89. Найдено: С 61,32; Н 6,69; N 6,85. Пример 13. Получение N-этил-4-[4-(1 фтор-1-метил-2-[(метилэтил)сульфонил]аминоэтил)фенил]фенилкарбоксамида В одногорлую колбу на 50 мл добавляли шприцом 1 мл оксалилхлорида к 4-[4-(1-фтор-1 метил-2-[(метилэтил)сульфонил]аминоэтил) фенил]бензойной кислоте (140 мг, 0,37 ммоль,полученной в примере 4) в СН 2 Сl2 (10 мл) при перемешивании в атмосфере азота при комнатной температуре. Сразу же добавляли пипеткой 1 каплю ДМФА с инициацией пенообразования смеси. Реакционную смесь перемешивали в течение 1 ч при этой температуре и затем концентрировали при пониженном давлении с получением белого полутвердого вещества. Этот материал помещали в ТГФ (10 мл) и добавляли по каплям к перемешиваемому раствору 2,0 М этиламина в ТГФ (0,5 мл) при комнатной температуре и смесь перемешивали в течение ночи. Ут 004299 56 ром раствор концентрировали при пониженном давлении и полученное масло помещали вCH2Cl2 и органический слой промывали один раз Н 2 О, сушили над K2 СО 3 и концентрировали при пониженном давлении с получением 151 мг масла. Этот материал очищали хроматографией на силикагеле с применением хроматотрона с использованием ротора 2000 мкм при элюировании растворителем в виде смеси дихлорметан/этилацетат 1:1 с получением указанного в заголовке соединения (127 мг, 85%) в виде вязкого масла. МС с распылением ионов 407,4 В одногорлую колбу на 50 мл добавляли шприцом 1 мл оксалилхлорида к 4-[4-(1-фтор-1 метил-2-[(метилэтил)сульфонил]аминоэтил) фенил]бензойной кислоте (200 мг, 0,53 ммоль,полученной в примере 4) в CH2Cl2 (15 мл) при перемешивании в атмосфере азота при комнатной температуре. Сразу же добавляли пипеткой 1 каплю ДМФА с инициацией пенообразования смеси. Реакционную смесь перемешивали в течение одного часа при этой температуре и затем концентрировали при пониженном давлении с получением белого полутвердого вещества. Этот материал помещали в ТГФ (10 мл) и добавляли по каплям к перемешиваемому раствору 94 мг пирролина в ТГФ (10 мл) при комнатной температуре и смесь перемешивали в течение ночи. Утром раствор концентрировали при пониженном давлении и полученное масло помещали в CH2Cl2 и органический слой промывали один раз H2O, сушили над K2 СО 3 и концентрировали при пониженном давлении с получением 271 мг масла. Этот материал очищали хроматографией на силикагеле с применением хроматотрона с использованием ротора 4000 мкм при элюировании растворителем в виде смеси гексан/этилацетат 7:3 с получением указанного в заголовке соединения (141 мг, 62%) в виде вязкого масла. МС с распылением ионов 433,3 (М+1). Вычислено для С 23 Н 29N2O3SF: Теоретически: С 63,86; Н 6,76; N 6,48. Найдено: С 62,93; Н 6,40; N 5,95. Пример 15. Получение N-3-[4-(1-фтор-1 метил-2-[(метилэтил)сульфонил]аминоэтил) фенил]фенилацетамида 57 В одногорлую колбу на 100 мл добавляли по каплям 49 мг ацетилхлорида к 200 мг 2-[4(3-аминофенил)фенил]-2-фторпропил[(метилэтил)сульфонил]амина (полученного в примере 5) и 63 мг триэтиламина в ТГФ (25 мл) при перемешивании в атмосфере азота при комнатной температуре. Реакционной смеси давали перемешиваться при этой температуре в течение 2 ч. Затем смесь выливали в H2O и желаемый продукт экстрагировали в этилацетат. Органический слой промывали один раз Н 2 О, сушили надK2 СО 3 и концентрировали при пониженном давлении с получением 193 мг в виде пенообразного вещества. Этот материал очищали хроматографией на силикагеле с применением хроматотрона с использованием ротора 4000 мкм при элюировании растворителем в виде смеси гексан/этилацетат 1:1 с получением указанного в заголовке соединения (121 мг, 54%) в виде белого пенообразного вещества. МС с распылением ионов 391,2 (М-1). Вычислено для C20H25N2O3SF: Теоретически: С 61,20, Н 6,42, N 7,13. Найдено: С 60,28, Н 6,40, N 6,76. Пример 16. Получение N-3-[4-(1-фтор-1 метил-2-[(метилэтил)сульфонил]аминоэтил) фенил]фенилпропанамида В одногорлую колбу на 100 мл добавляли по каплям 58 мг пропинилхлорида к 200 мг 2[4-(3-аминофенил)фенил]-2-фторпропил[(метилэтил)сульфонил]амина (полученного в примере 5) и 63 мг триэтиламина в ТГФ (25 мл) при перемешивании в атмосфере азота при комнатной температуре. Реакционной смеси давали перемешиваться при этой температуре в течение 2 ч. Затем смесь выливали в H2O и желаемый продукт экстрагировали в этилацетат. Органический слой промывали один раз Н 2 О, сушили над K2 СО 3 и концентрировали при пониженном давлении с получением 256 мг в виде пенообразного вещества. Этот материал очищали хроматографией на силикагеле с применением хроматотрона с использованием ротора 4000 мкн при элюировании растворителем в виде смеси гексан/этилацетат 1:1 с получением указанного в заголовке соединения (130 мг, 56%) в виде белого пенообразного вещества. МС с распылением ионов 405,5 (М-1). Вычислено для В одногорлую колбу на 100 мл добавляли по каплям 71 мг бутирилхлорида к 200 мг 2-[4(3-аминофенил)фенил]-2-фторпропил[(метилэтил)сульфонил]амина (полученного в примере 5) и 63 мг триэтиламина в ТГФ (25 мл) при перемешивании в атмосфере азота при комнатной температуре. Реакционной смеси давали перемешиваться при этой температуре в течение 2 ч. Затем смесь выливали в Н 2O и желаемый продукт экстрагировали в этилацетат. Органический слой промывали один раз H2O, сушили надK2 СО 3 и концентрировали при пониженном давлении с получением 211 мг в виде масла. Этот материал очищали хроматографией на силикагеле с применением хроматотрона с использованием ротора 4000 мкм при элюировании растворителем в виде смеси гексан/этилацетат 1:1 с получением указанного в заголовке соединения (130 мг, 54%) в виде белого пенообразного вещества. МС с распылением ионов 419,2 (М-1). Вычислено для C22H29N2O3SF: Теоретически: С 62,83: Н 6,95; N 6,66. Найдено: С 62,49; Н 6,84; N 6,60. Пример 18. Получение N-3-[4-(1-фтор-1 метил-2-[(метилэтил)сульфонил]аминоэтил) фенил]фениламида В одногорлую колбу на 100 мл добавляли по каплям 0,1 мл ТФУ в толуоле (5 мл) к 200 мг 2-[4-(3-аминофенил)фенил]-2-фторпропил[(метилэтил)сульфонил]амина (полученного в примере 5) и 56 мг цианата натрия в толуоле (15 мл) при перемешивании в атмосфере азота при 40-50 С. Затем реакционную смесь нагревали до 80 С в течение 1 ч. Раствор охлаждали до комнатной температуры и концентрировали при пониженном давлении с получением твердого вещества. Эту соль ТФУК выделяли с помощью 1 н. NaOH и желаемый продукт экстрагировали в дихлорметан. Органический слой промывали один раз Н 2 О, сушили над K2 СО 3 и концентрировали при пониженном давлении с получением 168 мг в виде пенообразного вещества. Этот материал очищали хроматографией на силикагеле с применением хроматотрона с использованием ротора 4000 мкм при элюировании растворителем в виде смеси гексан/этилацетат 1:9 с получением указанного в заголовке соединения(77 мг, 34%) в виде желтого пенообразного вещества. МС с распылением ионов 392,2 (М-1). Вычислено для C19H24N3O3SFH2O: Теоретически: С 55,45; Н 6,37; N 10,21. Найдено: С 55,82; Н 6,02; N 9,91. Пример 19. Получение N-[4-(1-фтор-1 метил-2-[(метилэтил)сульфонил]аминоэтил) фенил]бензамида В 3-горлую колбу на 500 мл, снабженную мешалкой и термометром, 2,98 г пропансульфонилхлорида добавляли по каплям к 3,92 г 2 гидрокси-2-(4-нитрофенил)пропиламина и 3,19 гDBU в CH2Cl2 (200 мл) при перемешивании при 0 С в атмосфере азота. Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение ночи при этой температуре. Утром реакцию разбавляли CH2Cl2 (100 мл) и органический слой промывали два разаH2O, сушили над Na2SO4 и концентрировали при пониженном давлении с получением вязкого масла. Этот материал очищали хроматографией на силикагеле с использованиемWater's Prep 2000 при элюировании растворителем в виде смеси гексан/этилацетат 1:1 с получением промежуточного указанного в заголовке соединения (940 мг, 16%) в виде вязкого масла. МС с распылением ионов 302,1 (М-1). Получение [2-(4-аминофенил)-2-гидроксипропил]-[(метилэтил)сульфонил]амина 900 мг [2-гидрокси-2-(4-нитрофенил)пропил][(метилэтил)сульфонил] амина и 1,2 экв. 10% Pd/C в этилацетате (50 мл) подвергали действия атмосферы водорода при встряхивании при давлении 60 фунт/кв. дюйм (414 кПа) в течение 3 ч. Раствор фильтровали через подушкуCelite и полученный фильтрат концентрировали при пониженном давлении с получением 720 мг в виде масла. Этот материал очищали хроматографией на силикагеле с применением хроматотрона с использованием ротора 4000 мкм при элюировании растворителем в виде смеси гексан/этилацетат 1:1 с получением промежуточного указанного в заголовке соединения (340 мг,42%) в виде рыжевато-коричневого твердого вещества. МС с распылением ионов 271,4 (М 1). Вычислено для C12H20N2O3S: Теоретически: С 52,92; Н 7,40; N 10,29. Найдено: С 53,26; Н 7,40; N 10,11. Схема XII, стадия А. В одногорлую колбу на 100 мл добавляли по каплям 77 мг бензоилхлорида к 135 мг [2-(4-аминофенил)-2-гидроксипропил][(метилэтил)сульфонил]амина и 56 мг триэтиламина в ТГФ (20 мл) при перемешивании в атмосфере азота при комнатной температуре. Реакционной смеси давали перемешиваться при этой температуре в течение 2 ч. Затем смесь выливали в H2O и желаемый продукт экстрагировали в этилацетат. Органический слой промывали один раз H2O, сушили надK2 СО 3 и концентрировали при пониженном давлении с получением 233 мг в виде твердого вещества. Этот материал очищали хроматографией на силикагеле с применением хроматотрона с использованием ротора 2000 мкм при элюировании растворителем этилацетатом с получением промежуточного указанного в заголовке соединения (151 мг, 80%) в виде белого твердого вещества. МС с распылением ионов 375,2 (М-1). Получение конечного указанного в заголовке соединения. Схема XII, стадия В. В 3-горлую колбу на 500 мл, снабженную мешалкой и термометром,добавляли по каплям 130 мг N-[4-(1-гидрокси-1 метил-2-[(метилэтил)сульфонил]аминоэтил) фенил]бензамида в дихлорметане (5 мл) к 62 мгDAST в дихлорметане (5 мл) при перемешивании при -78 С в атмосфере азота. Реакционной смеси давали нагреться до комнатной температуры и разбавляли дихлорметаном (25 мл). Этот органический слой промывали H2O, сушили надNa2SO4 и концентрировали при пониженном давлении с получением 136 мг в виде белого пенообразного вещества. Этот материал очищали хроматографией на силикагеле с применением хроматотрона с использованием ротора 2000 мкм при элюировании растворителем в виде смеси гексан/этилацетат 1:1 с получением конечного указанного в заголовке соединения (79 мг, 60%) в виде белого твердого вещества. Выход = 60%. МС с распылением ионов 377,4 (М-1). Вычислено для C19H23N2O3SF: Теоретически: С 60,30; Н 6,13; N 7,31. Найдено: С 60,20; Н 6,05; N 7,30. Пример 20. Получение (3-цианофенил)-N[4-(1-фтор-1-метил-2-[(метилэтил)сульфонил] аминоэтил)фенил]карбоксамида
МПК / Метки
МПК: C07D 333/20, C07C 311/03, A61K 31/18
Метки: монофторалкилпроизводные
Код ссылки
<a href="https://eas.patents.su/30-4299-monoftoralkilproizvodnye.html" rel="bookmark" title="База патентов Евразийского Союза">Монофторалкилпроизводные</a>
Предыдущий патент: Гидроиодид 5-[4-[2-(n-метил-n-(2-пиридил)амино)этокси]бензил] тиазолидин-2,4 – диона в качестве фармацевтического препарата
Следующий патент: Клеточная везикула, называемая “текзосома”, ее получение и применение для стимуляции иммунного ответа
Случайный патент: Сульфонамиды, предназначенные для лечения респираторных нарушений







