Конъюгированная система доставки и композиция для направленной доставки малых интерферирующих рнк (мирнк) и способ получения композиции
Номер патента: 24534
Опубликовано: 30.09.2016
Авторы: Китас Эрик А., Розема Дэвид Б., Хоффманн Торстен, Тюер Вилма, Хадвиджер Филипп, Вэйкфилд Даррен Х., Мор Петер, Льюис Дэвид Л., Валис Линда Кристин
Формула / Реферат
1. Конъюгированная система доставки для доставки полинуклеотида РНК-интерференции в клетки печени in vivo, включающая
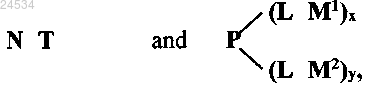
где Р представляет собой обладающий активностью по отношению к мембране амфипатический полиамин, содержащий первичные амины и способный лизировать эритроциты,
-L-M1 имеет структуру, представленную -СО C(R)=C(M1) COO- или СО C(M1)=C(R) COO-, где М1 электрически нейтрален и содержит производное галактозы, обладающее равным или более высоким сродством к асиалогликопротеиновому рецептору, чем галактоза, и R представляет собой алкильную группу;
-L-M2 имеет структуру, представленную СО C(R)=C(M2) COO- или СО C(M2)=C(R) COO-, где М2 электрически нейтрален и содержит полиэтиленгликоль, и R представляет собой алкильную группу;
х представляет собой целое число, большее или равное 1,
у представляет собой целое число, равное или большее 0,
значение х + у больше 50% числа первичных аминов на Р, и числа L М1 и L М2, связанных с Р, достаточно для ингибирования активности Р по отношению к мембране, и отщепление L М1 и L М2 от Р приводит к восстановлению активности Р,
N представляет собой полинуклеотид РНК-интерференции, и
Т представляет собой тример галактозы или гидрофобную группу, содержащую по меньшей мере 20 атомов углерода.
2. Система по п.1, отличающаяся тем, что полинуклеотид РНК-интерференции включает ДНК, РНК, дцРНК, мРНКи и микроРНК.
3. Система по п.1, отличающаяся тем, что обладающий активностью по отношению к мембране полимер содержит два или более различных мономеров.
4. Система по п.1, отличающаяся тем, что обратимо маскированный обладающий активностью по отношению к мембране полиамин растворим в воде.
5. Система по п.1, отличающаяся тем, что обладающий активностью по отношению к мембране полиамин представляет собой нерегулярный сополимер.
6. Система по п.1, отличающаяся тем, что значение х+у больше 70% числа первичных аминов на Р.
7. Система по п.6, отличающаяся тем, что значение х+у больше 80% числа первичных аминов на Р.
8. Система по п.1, отличающаяся тем, что зета-потенциал обратимо модифицированного обладающего активностью в отношении мембраны амфипатического полиамина составляет от 0 до -20 мВ при рН 8.
9. Система по п.1, отличающаяся тем, что система представлена в фармацевтически приемлемом носителе или разбавителе.
10. Система по п.1, отличающаяся тем, что N связан с Т чувствительной к физиологическим условиям связью.
11. Система по п.1, отличающаяся тем, что Т представляет собой гидрофобную группу, содержащую 20 и более атомов углерода.
12. Система по п.1, отличающаяся тем, что Т представляет собой тример галактозы.
13. Система по п.1, отличающаяся тем, что соотношение производного галактозы и ПЭГ-групп, связанных с полимером, составляет от 1 до 0,5-2.
14. Система по п.1, отличающаяся тем, что производное галактозы состоит из N-ацетилгалактозамина.
15. Система по п.12, отличающаяся тем, что тример галактозы состоит из тримера N-ацетилгалактозамина.
16. Композиция для доставки олигонуклеотида в клетки печени in vivo, включающая:
а) олигонуклеотид, ковалентно связанный с гидрофобной группой, содержащей не менее 20 атомов углерода, и
б) обратимо маскированный и нацеленный, обладающий активностью в отношении мембраны амфипатический полиамин, причем указанный полиамин представляет собой терполимер, синтезированный из мономеров, содержащих первичные амины, мономеров, содержащих низшие гидрофобные группы, где низшие гидрофобные группы содержат 2-6 атомов углерода, и мономеров, содержащих высшие гидрофобные группы, где высшие гидрофобные группы содержат 12 или более атомов углерода, и при этом более 50% мономеров, содержащих первичные амины, по отдельности присоединено к производным галактозы или ПЭГ-группам рН-лабильными двузамещенными малеаматными связями, причем расщепление указанных рН-чувствительных двузамещенных малеаматных связей приводит к образованию аминогрупп, что обеспечивает образование обладающего активностью по отношению к мембране полиамина, способного лизировать эритроциты.
17. Способ изготовления композиции для направленной доставки олигонуклеотида РБК, включающий:
а) формирование обладающего активностью по отношению к мембране амфипатического полиамина, содержащего некоторое количество первичных аминов и способного лизировать эритроциты;
б) формирование первого маскирующего агента, который включает электрически нейтральный двузамещенный малеиновый ангидрид, содержащий производное галактозы;
в) формирование второго маскирующего агента, который содержит электрически нейтральный двузамещенный малеиновый ангидрид, содержащий полиэтиленгликоль;
г) обратимое ингибирование активности в отношении мембраны обладающего активностью по отношению к мембране амфипатического полиамина, причем ингибирование заключается в модификации 50% или более аминов на обладающем активностью в отношении мембраны амфипатическом полиамине в результате реакции обладающего активностью в отношении мембраны амфипатического полиамина с первым и вторым маскирующими агентами с присоединением производного галактозы и полиэтиленгликоля к обладающему активностью по отношению к мембране полимеру чувствительными к физиологическому рН двузамещенными малеаматными связями,
д) присоединение полинуклеотида РНК-интерференции к тримеру галактозы или гидрофобной группе, содержащей по меньшей мере 20 атомов углерода, с образованием конъюгата полинуклеотид РНК - нацеливающий полинуклеотид остаток; и
е) объединение конъюгата полинуклеотид РНК-интерференции - нацеливающий полинуклеотид остаток, полученного на этапе д), и обратимо ингибированного обладающего активностью по отношению к мембране амфипатического полиамина в растворе, пригодном для введения in vivo.
Текст
КОНЪЮГИРОВАННАЯ СИСТЕМА ДОСТАВКИ И КОМПОЗИЦИЯ ДЛЯ НАПРАВЛЕННОЙ ДОСТАВКИ МАЛЫХ ИНТЕРФЕРИРУЮЩИХ РНК (миРНК) И СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ Настоящее изобретение относится к системам и композициям для направленной доставки нуклеотидов иРНК (РНКи) в гепатоциты in vivo. Нуклеотиды интерференции РНК для направленной доставки вводятся совместно с полимерами для доставки. Полимеры обеспечивают проникновение через клеточную мембрану нуклеотидов иРНК снаружи клетки внутрь. Обратимая модификация обеспечивает полимеру для доставки чувствительность к физиологическим условиям.(CH), Розема Дэвид Б. (US), Тюер Вилма, Валис Линда Кристин (DE),Вэйкфилд Даррен Х. (US) Нилова М.И. (RU) Доставка полинуклеотидных и других, по существу, не проникающих через клеточную мембрану соединений в живую клетку сильно ограничивается сложной системой мембран клетки. Лекарственные препараты, которые применяют для антисмысловой, РНК-интерферирующей и генной терапии, представляют собой сравнительно высшие гидрофильные полимеры и часто имеют сильный отрицательный заряд. Обе эти физические характеристики исключают их прямую диффузию через клеточную мембрану. По этой причине, основным препятствием для доставки полинуклеотидов является их перенос через цитоплазматическую клеточную мембрану в цитоплазму клетки или в ядро. Один из способов, который был использован для доставки небольшой нуклеиновой кислоты in vivo,заключался в присоединении нуклеиновой кислоты к небольшой направляющей молекуле, липиду или стеролу. Несмотря на то, что эти конъюгаты в некоторой степени проникали через мембрану и обладали некоторой биологической активностью в клетке, концентрация нуклеиновой кислоты, необходимая для этих способов, была чрезмерно высокой. Были разработаны многочисленные реагенты для трансфекции, которые позволяли достичь достаточно эффективной доставки полинуклеотидов в клетки in vitro. Тем не менее, доставка полинуклеотидов in vivo с помощью этих же реагентов для трансфекции осложняется и теряет эффективность вследствие их in vivo токсичности, взаимодействий с компонентами сыворотки, а также низкой направленности доставки. Трансфицирующие реагенты, которые хорошо работают in vitro, катионные полимеры и липиды, как правило, образуют большие электростатические частицы и дестабилизируют клеточные мембраны. Положительный заряд реагентов для трансфекции in vitro облегчает связывание с нуклеиновой кислотой благодаря взаимодействию точечных зарядов (электростатическому), формируя тем самым комплекс нуклеиновая кислота/трансфицирующий реагент. Положительный заряд способствует неспецифическому связыванию носителя с клеткой, а также слиянию, дестабилизации или разрушению мембран. Дестабилизация мембран облегчает доставку почти непроникающих полинуклеотидов через клеточную мембрану. Несмотря на то, что эти свойства способствуют доставке нуклеиновой кислоты in vitro, они вызывают токсические явления и снижают эффективность направленной доставки in vivo. Катионный заряд приводит к возникновению взаимодействия с компонентами сыворотки, что вызывает дестабилизацию комплекса полинуклеотида и реагента для трансфекции, снижает биодоступность и эффективность направленной доставки. Мембранная активность реагентов для трансфекции, которые могут быть эффективны in vitro, зачастую приводит к возникновению токсичности in vivo. Для доставки in vivo носитель (нуклеиновая кислота и связанный с ней агент для доставки) должен быть небольшим, меньше 100 нм в диаметре, и предпочтительно менее 50 нм. Более эффективными могут быть комплексы еще меньшего размера, менее 20 нм или даже менее 10 нм. Носители для доставки крупнее 100 нм обладают очень незначительной способностью проникать в клетки, отличные от клеток кровеносных сосудов, in vivo. Комплексы, образующиеся в результате электростатических взаимодействий, как правило, агрегируют или распадаются под воздействием физиологических концентраций солей или компонентов сыворотки. Кроме того, катионный заряд на носителях для доставки in vivo приводит к возникновению нежелательных взаимодействий с компонентами сыворотки и, следовательно, низкой биодоступности. Интересно отметить, что сильный отрицательный заряд может также ингибировать доставку in vivo, препятствуя взаимодействиям, которые необходимы для направленной доставки. Таким образом, для распределения in vivo и направленной доставки необходимы почти нейтральные носители. При отсутствии тщательного контроля разрушение мембраны или дестабилизирующая активность являются токсичными, если используются in vivo. Баланса между этой активностью и эффективностью введения нуклеиновых кислот легче достигать in vitro, чем in vivo.Rozema et al. в публикации патента США 20040162260 продемонстрировали средство обратимой регуляции способности обладающих активностью по отношению к мембране полиаминов разрушать мембрану. Обладающие активностью по отношению к мембране полиамины представляют собой средство для разрушения клеточных мембран. Метод рН-зависимой обратимой регуляции позволяет ограничить активность эндосом клеток-мишеней, ограничивая тем самым токсичность полиаминов. Предложенный этими авторами способ относится к модификации аминогрупп на полиамине с использованием 2-пропионо-3-метилмалеинового ангидрида. Это модификация преобразует поликатион в полианион через перегруппировку первичных аминов с образованием пары карбоксильных групп ( икарбоксильной) и обратимо ингибирует мембранную активность полиамина. Rozema et al. (Bioconjugate Chem. 2003, 14, 51-57) сообщил, что -карбоксильная группа не обладала полным кажущимся отрицательным зарядом и сама по себе не могла ингибировать мембранную активность. Было установлено, что для эффективного ингибирования мембранной активности необходимо добавление -карбоксильной группы. Для того чтобы обеспечить совместную доставку нуклеиновой кислоты и носителя, нуклеиновая кислота была ковалентно связана с полимером для доставки. Используя биологически лабильную конъюгированную систему доставки, авторы смогли продемонстрировать доставку полинуклеотидов в клетки in vitro. Однако эта система не была эффективной для доставки in vivo, поскольку помимо носителя, имевшего сильный отрицательный заряд, нуклеиновая кислота и модифицированный полимер также имели высокую плотность отрицательного заряда. Отрицательный заряд, вероятно, ингибировал направленную доставку к клеткам-мишеням и повышал неспецифическое поглощение клетками ретикулоэндотелиальной системы (РЭС). Кроме того, используя полимеры, модифицированные 2-пропионо-3-метилмалеиновым ангидридом, Rozema et al. было показано образование небольших тройных электростатических комплексов нуклеиновых кислот, поликатионов и полимеров, модифицированных 2-пропионо-3-метилмалеиновым ангидридом.Rozema et al. в публикации патента США 20080152661 улучшили способ, раскрытый в публикации патента США 20040162260, суть улучшения заключалась в устранении высокой плотности отрицательного заряда на модифицированном обладающем активностью по отношению к мембране полимере. Путем замены у-карбоксильной группы 2-пропионо-3-метилмалеинового ангидрида на нейтральные гидрофильные группы для направленной доставки (галактоза) и стабилизаторы стерической конфигурации(ПЭГ) Rozema et al. смогли сохранить общую растворимость в воде и обратимое ингибирование мембранной активности, при этом обеспечив эффективную направленную доставку к гепатоцитам in vivo. Как и прежде, полинуклеотид был ковалентно связан с трансфицирующим полимером. Для того чтобы обеспечить совместную доставку полинуклеотида и трансфицирующего полимера к клетке-мишени во время введения in vivo, ковалентное связывание полинуклеотида и трансфицирующего полимера поддерживалось путем ингибирования диссоциации полинуклеотида от трансфицирующего полимера. Совместная доставка полинуклеотида и трансфицирующего полимера была необходима, поскольку трансфицирующий полимер обеспечивал транспорт полинуклеотида через клеточную мембрану в цитоплазму клетки, как из внеклеточного пространства, так и из эндосом. В публикации патента США 20080152661 была продемонстрирована высокоэффективная доставка полинуклеотидов, в частности олигонуклеотидов иРНК, к клеткам печени in vivo с помощью этого нового улучшенного поликонъюгата, чувствительного к физиологическим условиям. Тем не менее, ковалентное связывание нуклеиновой кислоты с полиамином вносит внутренние ограничения. Модификация трансфицирующих полимеров с целью присоединения нуклеиновой кислоты и маскирующих веществ осложняется взаимодействиями зарядов. Присоединение отрицательно заряженной нуклеиновой кислоты к положительно заряженному полимеру повышает вероятность агрегации и тем самым ограничивает концентрацию смеси. Агрегации можно избежать при наличии избытка поликатиона или полианиона. Тем не менее, этот раствор ограничивает соотношение, с которым может быть приготовлена композиция нуклеиновой кислоты и полимера. Кроме того, присоединение отрицательно заряженной нуклеиновой кислоты на немодифицированный катионный полимер вызывает конденсацию и агрегацию комплекса и ингибирует модификацию полимера. Модификация полимера, приводящая к образованию отрицательного полимера, ухудшает присоединение нуклеиновой кислоты. Краткое изложение сущности изобретения В предпочтительном варианте реализации изобретения предложена конъюгированная система доставки для доставки полинуклеотида РНК-интерференции в клетки печени in vivo, включающая: где Р представляет собой обладающий активностью по отношению к мембране амфипатический полиамин, содержащий первичные амины и способный лизировать эритроциты,-L-M1 имеет структуру, представленную -СО C(R)=C(M1) COO- или СО C(M1)=C(R) COO-, где М 1 электрически нейтрален и содержит производное галактозы, обладающее равным или более высоким сродством к асиалогликопротеиновому рецептору, чем галактоза, и R представляет собой алкильную группу;-L-M2 имеет структуру, представленную СО C(R)=C(M2) COO- или СО C(M2)=C(R) COO-, где М 2 электрически нейтрален и содержит полиэтиленгликоль, и R представляет собой алкильную группу; х представляет собой целое число, большее или равное 1,у представляет собой целое число, равное или большее 0,значение х + у больше 50% числа первичных аминов на Р, и число L М 1 и L М 2, связанных с Р, достаточно для ингибирования активности Р по отношению к мембране, и отщепление L М 1 и L М 2 от Р приводит к восстановлению активности Р,N представляет собой полинуклеотид РНК-интерференции, и Т представляет собой тример галактозы или гидрофобную группу, содержащую по меньшей мере 20 атомов углерода. В предпочтительном варианте реализации изобретения предложена композиция для направленной доставки полинуклеотида иРНК в клетки печени in vivo, которая включает обратимо замаскированный полиамин, обладающий активностью по отношению к мембране и направленный на асиалогликопротеиновый рецептор (ASGPr) (полимер для доставки), а также полинуклеотид иРНК, конъюгированный с трехвалентным галактозамином (РНК-конъюгат). Полимер для доставки и миРНК-конъюгат синтезируются отдельно и могут поставляться в отдельных контейнерах или в одном контейнере. Полинуклеотид иРНК не конъюгируется с полимером. В одном из вариантов реализации изобретения обладающий активностью по отношению к мембране полимер включает: амфипатический полимер, образованный посредством нерегулярной полимеризации амин-содержащих мономеров и мономеров, содержащих низшие гидрофобные группы. Аминсодержащие мономеры содержат боковые аминогруппы, которые могут представлять собой первичный и вторичный амин. Низшие гидрофобные мономеры содержат боковые гидрофобные группы, содержащие от 1 до 6 атомов углерода. Соотношение аминогрупп и гидрофобных групп подбирают таким образом,чтобы обеспечить образование водорастворимого полимера, способного разрушать мембрану, предпочтительно 1 аминового мономера на один гидрофобный мономер. В одном из вариантов реализации изобретения полимер будет иметь 60-80% аминовых мономеров. Гидрофобные группы могут быть выбраны из группы, состоящей из: алкил, алкенил, алкинил, арил, аралкил аралкенил, аралкинил групп, каждая из которых может быть линейной, разветвленной или циклической. Гидрофобные группы предпочтительно представляют собой углеводороды, содержащие только атомы углерода и водорода. Тем не менее, допускаются замены или гетероатомы, которые поддерживают гидрофобность и включают, например,фтор. Особенно предпочтительны обладающие активностью по отношению к мембране полиамины, которые включают нерегулярные сополимеры поливинилового эфира или нерегулярные сополимеры полиакрилового эфира. В одном из вариантов реализации изобретения обладающий активностью по отношению к мембране полиамин включает: амфипатический полимер, образованный посредством нерегулярной полимеризации амин-содержащих мономеров, низших гидрофобных мономеров и крупных гидрофобных мономеров. Амин-содержащие мономеры содержат боковые аминогруппы, которые могут представлять собой первичный и вторичный амин. Низшие гидрофобные мономеры содержат боковые гидрофобные группы,содержащие от 1 до 6 атомов углерода. Высшие гидрофобные мономеры содержат боковые гидрофобные группы с 12-36 или более атомами углерода. Соотношение аминогрупп и гидрофобных групп выбирается для образования водорастворимого полимера, способного разрушать мембрану, предпочтительно 1 аминового мономера на один гидрофобный мономер. В одном из вариантов реализации изобретения полимер будет иметь 60-80% аминовых мономеров. Гидрофобные группы могут быть выбраны из группы,состоящей из: алкил, алкенил, алкинил, арил, аралкил аралкенил, аралкинил групп, каждая из которых может быть линейной, разветвленной или циклической, стерольной, стероидной, и стероидным производным. Гидрофобные группы предпочтительно представляют собой углеводороды, содержащие только атомы углерода и водорода. Тем не менее, допускаются замены или гетероатомы, которые поддерживают гидрофобность и включают, например, фтор. Особенно предпочтительными являются обладающие активностью по отношению к мембране полиамины, которые включают нерегулярные тройные сополимеры простого поливинилового эфира или нерегулярные тройные сополимеры простого полиакрилового эфира. В предпочтительном варианте реализации изобретения обратимо замаскированный, обладающий активностью по отношению к мембране полиамин включает обладающий активностью по отношению к мембране полиамин согласно изобретению, обратимо модифицированный реакцией аминогрупп полимера с маскирующими веществами. Амин является обратимо модифицированным, если отщепление модифицирующей группы приводит к восстановлению амина. Обратимая модификация обладающего активностью по отношению к мембране полиамина обратимо ингибирует его мембранную активность. Предпочтительно, маскирующий агент также обеспечивает направляющую функцию и/или предотвращает взаимодействие с компонентами сыворотки. Модификация полимерного амина при помощи маскирующего агента также предпочтительно нейтрализует заряд амина. Предпочтительный маскирующий агент включает галактозамин или производное галактозамина или полиэтиленгликоль, содержащий двузамещенную амин-реактивную группу малеинового ангидрида. При реакции с ангидридом амин обратимо модифицируется, образуя малеамат или малеамовую кислоту. В маскированном состоянии, обратимо маскированный обладающий активностью по отношению к мембране полиамин не проявляет активности, направленной на разрушение мембраны. Для того чтобы обеспечить направленную доставку в клетку-мишень и ингибировать активность по отношению к мембране,может потребоваться обратимая модификация более чем 50%, более чем 55%, более чем 60%, более чем 65%, более чем 70%, более чем 75% или более чем 80% аминогрупп в полиамине с помощью маскирующего агента, т.е. образование обратимо замаскированного полимера, обладающего активностью по отношению к мембране. Чтобы обеспечить ингибирование активности по отношению к мембране и/или направленную доставку in vivo описанного полиамина, обладающего активностью по отношению к мембране, требуется модификация 50% аминогрупп полимера. Предпочтительный маскирующий агент включает нейтральный гидрофильный замещенный алкил-3 024534 отличающийся тем, что R1 включает направляющий остаток или стабилизатор стерической конфигурации. Примером замещенного алкилмалеинового ангидрида может быть производное 2-пропионово 3-алкилмалеиминового ангидрида. Нейтральное производное гидрофильного 2-пропионово-3-алкилмалеиминового ангидрида образуется путем присоединения нейтральной гидрофильной группы к 2 пропионово-3-алкилмалеиновому ангидриду через -карбоксильную группу 2-пропионово-3-алкилмалеинового ангидрида. В одном из вариантов реализации изобретения алкильная группа представляет собой метальную группу. Предпочтительный маскирующий агент обеспечивает функцию направленной доставки за счет сродства к поверхностным рецепторам клетки, то есть маскирующий агент содержит лиганд для рецепторов, расположенных на клеточной поверхности. Предпочтительные маскирующие агенты содержат сахара, имеющие сродство к ASGPr, включая, следующие соединения но не ограничиваясь ими: галактоза, N-ацетил-галактозамин и производные галактозы. Производные галактоза, имеющие сродство к ASGPr, хорошо известны в данной области техники. Существенной особенностью обратимо модифицированного обладающего активностью по отношению к мембране полиамина является то, что, по меньшей мере, некоторые, или почти все, присоединенные к полимеру маскирующие агенты обеспечивают функцию направленной доставки к клетке-мишени. Другой предпочтительный маскирующий агент обеспечивает улучшенное биораспределение как за счет ингибирования неспецифических взаимодействий между обратимо модифицированным полимером и компонентами сыворотки или клетками, не являющимися мишенями, так и путем уменьшения агрегации полимера. Предпочтительные маскирующие агенты, выполняющие функцию стабилизаторов стерической конфигурации, включают полиэтиленгликоли, но не ограничиваются этими соединениями. В одном из вариантов реализации изобретения используется комбинация маскирующих агентов, обеспечивающих направленную доставку и стабилизацию стерической конфигурации. Конъюгат полинуклеотида иРНК и полимера для доставки вводят млекопитающим в фармацевтически приемлемых носителях или растворителях. В одном из вариантов реализации изобретения перед введением млекопитающему полимер для доставки и конъюгат полинуклеотида иРНК могут быть объединены в растворе. В другом варианте реализации изобретения полимер для доставки и конъюгат полинуклеотида иРНК могут быть сочетано введены млекопитающему в виде отдельных растворов. В еще одном варианте реализации изобретения полимер для доставки и конъюгат полинуклеотида иРНК могут быть введены млекопитающему последовательно. В случае последовательного введения полимер для доставки может быть введен перед применением конъюгата полинуклеотида иРНК. Также при последовательном введении возможен вариант применения сначала конъюгата полинуклеотида иРНК, а затем полимера для доставки. Другие цели, функции и преимущества настоящего изобретения будут очевидны из следующего подробного описания при использовании с сопутствующими чертежами. Фиг. 1. Схема реакции полимеризации амфипатического поливинилового эфира с образованием нерегулярных тройных сополимеров. Фиг. 2. График, иллюстрирующий влияние концентрации конъюгата миРНК-холестерин на суппресию активности гена. Фиг. 3. График, иллюстрирующий влияние размера гидрофобного фрагмента конъюгата миРНКгидрофобный фрагмент, который обеспечивает направленную доставку в печень. Фиг. 4. График, иллюстрирующий влияние концентрации конъюгата миРНК-гидрофобный фрагмент на суппресию активности гена для нескольких гидрофобных групп. Фиг. 5. График, иллюстрирующий влияние концентрации полимера для доставки на эффективность доставки конъюгата миРНК-гидрофобный фрагмент в печень. Фиг. 6. Связывание кластера N-ацетилгалактозамина с РНК. В настоящем изобретении предложен усовершенствованный способ доставки полинуклеотидов иРНК (RNAi) в клетки печени млекопитающих in vivo. Настоящий способ также предоставляет усовершенствованный метод производства носителей для доставки полинуклеотидов иРНК. Ранее, доставка полинуклеотидов in vivo требовала физического связывания полинуклеотида с носителем для доставки. Полинуклеотид был электростатически связан с носителем для доставки, например, как в комплексах поликатион/нуклеиновая кислота, которые инкапсулируются носителем для доставки, как в липосомах и стабильных частицах нуклеиновая кислота/липид (SNALPs), либо ковалентно связан с носителем для доставки, как в динамических поликонъюгатах (Rozema et al., 2007). К своему удивлению мы обнаружили, что при использовании соответствующих молекул конъюгата полинуклеотида иРНК и полимеров для доставки, направленных к соответствующей мишени, полинуклеотид иРНК может быть отделен от по-4 024534 лимеров для доставки, при этом эффективная доставка полинуклеотида к гепатоцитам сохраняется. Возможность отделения полинуклеотида от полимера для доставки обеспечивает преимущества для приготовления лекарственных форм, синтеза и производства. а) При устранении необходимости связывания полинуклеотида и полимера посредством ковалентной связи или взаимодействий заряд-заряд, концентрация полимера и полинуклеотидов, а также соотношение между ними, ограничивается только растворимостью компонентов, а не растворимостью комплекса связанных компонентов или возможностью производства указанного комплекса. Повышенная растворимость позволяет повысить концентрации полинуклеотида или полимера для доставки и, как следствие, увеличить дозу. б) Полинуклеотид и полимер для доставки могут быть смешаны в любое время перед введением или могут быть введены индивидуально. Таким образом, разделение позволяет хранить компоненты отдельно, как в растворе, так и в сухом виде. в) Возможно создание меньших и более стабильных лекарственных форм по сравнению с большими, внутренне нестабильными, нековалентными системами доставки. г) Изготовление маскированного полимера для доставки облегчается при отсутствии ковалентно связанного отрицательно заряженного полинуклеотида или необходимости ковалентно присоединять отрицательно заряженный полинуклеотид. д) Изготовление упрощается и требует меньше производственных стадий при отсутствии физического присоединения полинуклеотида к полимеру для доставки. е) Наблюдается улучшение направленной доставки миРНК и полимера. Изобретение включает конъюгированную систему доставки для доставки полинуклеотида РНКинтерференции в клетки печени in vivo, включающую где Р представляет собой обладающий активностью по отношению к мембране амфипатический полиамин, содержащий первичные амины и способный лизировать эритроциты,-L-M1 имеет структуру, представленную СО C(R)=C(M1) COO- или СО C(M1)=C(R) COO-, где М 1 электрически нейтрален и содержит производное галактозы, обладающее равным или более высоким сродством к асиалогликопротеиновому рецептору, чем галактоза, и R представляет собой алкильную группу;-L-M2 имеет структуру, представленную СО C(R)=C(M2) COO- или СО C(M2)=C(R) COO-, где М 2 электрически нейтрален и содержит полиэтиленгликоль, и R представляет собой алкильную группу; х представляет собой целое число, большее или равное 1,у представляет собой целое число, равное или большее 0,значение х + у больше 50% числа первичных аминов на Р, и число L М 1 и L М 2, связанных с Р, достаточно для ингибирования активности Р по отношению к мембране, и отщепление L М 1 и L М 2 от Р приводит к восстановлению активности Р,N представляет собой полинуклеотид РНК-интерференции, и Т представляет собой тример галактозы или гидрофобную группу, содержащую по меньшей мере 20 атомов углерода. Для доставки полинуклеотида в печень in vivo не требуется электростатическое или гидрофобное связывание полинуклеотида или полинуклеотид-конъюгата с маскированным или немаскированным полимером. Маскированный полимер и полинуклеотид-конъюгат могут поставляться в одном и том же контейнере или в отдельных контейнерах. Они могут быть объединены перед введением, либо вводиться сочетано или последовательно. Полимер Полимеры согласно настоящему изобретению представляют собой амфипатические полиамины,обладающие активностью по отношению к мембране. Полимер представляет собой молекулу, построенную из связанных повторяющихся меньших единиц, называемых мономерами. Полимер может быть гомополимером, в котором используется один мономер, сополимером или гетерополимером, в котором используются два или более различных мономера. Основная цепь полимера состоит из атомов, связи которых необходимы для удлинения полимера. Боковая цепь полимера состоит из атомов, связи которых не являются обязательными для удлинения полимера. В частности, полимеры согласно настоящему изобретению представляют собой амфипатические нерегулярные сополимеры, обладающие активностью по отношению к мембране. Мономеры в нерегулярных сополимерах не имеют определенного порядка или расположения в любой конкретной цепи и записываются, например, как -Ах-Ву- или -Ах-By-Cz. Общие составы таких полимеров отражают соотношение входящих в них (загруженных) мономеров. Однако точное соотношение количества одного мономера и другого мономера может варьировать в разных цепях. Распределение мономеров также может быть различным в одном полимере. Кроме того, химические свойства мономера могут влиять на уровень его включения в нерегулярный сополимер и на его распределение в полимере. Таким образом, хотя соот-5 024534 ношение мономеров в нерегулярном полимере зависит от соотношения загруженных мономеров, степень загрузки может не соответствовать точно соотношению включенных мономеров. Амфипатический полимер Амфипатические или амфифильные полимеры хорошо известны и признаны в данной области техники. Они имеют как гидрофильные (полярные, растворимые в воде), так и гидрофобные (неполярные,липофильные, нерастворимые в воде) группы или их части. Гидрофильными группами в качественном смысле являются химические фрагменты, которые "отдают предпочтение" воде. Как правило, такие химические группы растворимы в воде и являются донорами или акцепторами водородной связи с молекулами воды. Гидрофильная группа может не иметь заряда или быть заряженной. Заряженные группы могут быть положительно заряженными (анионные),отрицательно заряженными (катионные) или иметь оба заряда (цвиттерионные). Примеры гидрофильных групп включают остатки следующих химических веществ: углеводов, полиоксиэтилена, некоторых пептидов, олигонуклеотидов, аминов, амидов, алкокси амидов карбоновых кислот, сульфо и гидрокси группы. Гидрофобными группами в качественном смысле являются химические фрагменты, которые "избегают" воды. Как правило, такие химические группы не растворяется в воде и, как правило, не образуют водородные связи. Липофильные группы растворяются в жирах, маслах, липидах и неполярных растворителях и практически не способны образовывать водородные связи. Некоторыми примерами гидрофобных групп и соединений являются углеводороды, содержащие два (2) или более атомов углерода, некоторые замещенные углеводороды, холестерин и производные холестерина. В контексте настоящего изобретения для амфипатических полимеров часть определяется как молекула, полученная при разрыве одной ковалентной связи и замене ее водородом. Например, разрыв связи между углеродом и азотом в молекуле бутиламина с последующей заменой на водород приводит к образованию аммиака (гидрофильный) и бутана (гидрофобный). Если в молекуле 1,4-диаминобутан расщепляется связь азот и углерода с последующей заменой на атомы водорода, то в результате образуется молекулы аммиака (2 молекулы) и бутана. Тем не менее, 1,4-диаминобутан не считается амфипатическим соединением, так как образование гидрофобных частей требует разрыва двух связей. В контексте настоящего изобретения поверхностно-активный полимер снижает поверхностное натяжение воды и/или поверхностное натяжение на межфазной границе и, как следствие, положительно адсорбируется на жидкости/парах. Наличие поверхностной активности, как правило, обусловлено амфипатическими или амфифильными свойствами молекул этого вещества. Полимеры, обладающие активностью по отношению к мембране В контексте настоящего изобретения полимеры, обладающие активностью по отношению к мембране, представляют собой поверхностно-активные, амфипатические полимеры, которые способны индуцировать один или несколько из следующих эффектов в биологических мембранах: изменение или разрушение мембраны, что позволяет непроникающим молекулам пересечь клеточную мембрану и проникнуть в клетку, формирование пор в мембране, сегментацию, разрушение или растворение мембраны. В контексте настоящего изобретения мембрана или клеточная мембрана представляет собой липидный бислой. Изменение или разрушение мембраны может быть определено функционально по активности полимера при помощи по меньшей мере одного из следующих количественных анализов: лизис эритроцитов (гемолиз), текучесть липосом, слияние липосом, слияние клеток, лизис клеток и высвобождение веществ из эндосом. Обладающие активностью по отношению к мембранам полимеры, которые могут вызвать лизис клеточных мембран, также называются мембранолитические полимеры. Полимеры, которые преимущественно вызывают разрушение эндосом или лизосом за плазматической мембраной, считаются эндосомолитическими. Эффект обладающих активностью по отношению к мембранам полимеров на клеточную мембрану может быть кратковременным. Обладающие активностью по отношении к мембранам полимеры обладают сродством к мембране и вызывают денатурацию или деформацию структуры липидного бислоя. Обладающие активностью по отношению к мембране полимеры могут быть синтетическими или неестественными амфипатическими полимерами. В контексте настоящего изобретения обладающие активностью по отношению к мембране полимеры отличаются от класса полимеров, названных как проникающие в клетку пептиды, или полимеров,представителями которых являются такие соединения как богатый аргинином пептид, полученный из ТАТ-белка ВИЧ, пептид антенапедия, VP22-пептид, транспортан, богатые аргинином искусственные пептиды, низшие богатые гуанидием искусственные полимеры или т.п. Хотя проникающие в клетку соединения, вероятно, транспортируют некоторые молекулы через мембрану с одной стороны липидного бислоя на другую сторону липидного бислоя, по-видимому, без необходимости в эндоцитозе и без разрушения целостности мембраны, их механизм действия пока не известен. Доставка полинуклеотида в клетку происходит за счет разрушения или дестабилизации плазматической мембраны или мембраны внутренних везикул (таких как эндосома или лизосома), индуцированных обладающим активностью по отношению к мембране полимером, включая образование пор в мембране или разрушение эндосомальных или лизосомальных везикул, что способствует высвобождению содержимого везикул в цитоплазму клетки. Эндосомолитические полимеры Эндосомолитические полимеры представляют собой полимеры, которые в ответ на изменение значения рН могут вызывать разрушение или лизис эндосомы или служат для выхода в норме не обладающего способностью проникать через мембрану соединения, такого как полинуклеотид или белок, из заключенной во внутреннюю клеточную мембрану везикулы, такой как эндосома или лизосома. В эндосомолитическпх полимерах происходит сдвиг их физико-химических свойств при физиологически приемлемых значениях рН (как правило, рН 5,5-8). Вследствие изменения заряда, гидрофобности или гидрофильности этот сдвиг может приводить к изменению растворимости полимера, его способности взаимодействовать с другими соединениями или мембранами. Репрезентативные эндосомолитические полимеры могут нести рН-чувствительные группы или связи. Таким образом, обратимо замаскированный обладающий активностью по отношению к мембране полимер, где маскирующие агенты присоединены к полимеру через рН-чувствительные связи, можно рассматривать как эндосомолитический полимер. Обладающие активностью по отношению к мембране амфипатические нерегулярные полимеры. Обладающие активностью по отношению к мембране амфипатические полиамины согласно настоящему изобретению включают: обладающие активностью по отношению к мембране амфипатические полиамины (нерегулярные гетерополимеры). В контексте настоящего изобретения сополимер содержит два или более вида мономеров, включающих, по меньшей мере: мономер, содержащий первичную или вторичную концевую аминогруппу, и мономер, содержащий концевую гидрофобную боковую группу. В более предпочтительном варианте реализации изобретения два вида мономеров включают, по меньшей мере: мономер, первичную или вторичную концевую аминогруппу, и мономер, содержащий низшую концевую гидрофобную боковую группу. В контексте настоящего изобретения концевая группа это группа, состоящая из связанных с полимером атомов, связи которых не участвуют в удлинении полимера, т. е. атомов и связи концевой группы не являются частью основной цепи или основы полимера, к которому присоединена группа. Обладающие активностью по отношению к мембране амфипатические полиамины согласно настоящему изобретению является продуктом сополимеризации двух или более видов мономеров. В одном варианте реализации обладающие активностью по отношению к мембране амфипатические гетерополимеры согласно настоящему изобретению имеют общую структуру отличающуюся тем, что А содержит боковую первичную или вторичную функциональную аминогруппу и В содержит низшую гидрофобную концевую группу (содержащую от 2 до 6 атомов углерода). Параметры а и b - это целые числа 0. Для облегчения синтеза в процессе полимеризации могут использоваться мономеры, содержащие защищенные амины, такие как фталимидо-защищенные или ВОС защищенные мономеры аминов. Для получения аминов защитные группы удаляются после полимеризации. Допускается включение мономеров, до 10%, содержащих низшие и средние концевые гидрофобные группы (7 или более атомов углерода). Также допускается включение небольших количеств дополнительных мономеров (5%). Например, полимеры могут также иметь дополнительные мономеры, содержащие реактивные группы. Содержащие реактивные группы мономеры могут использоваться для присоединения компонентов к полимеру после его синтеза. Мономер может иметь реактивную группу, которая не участвует в реакции полимеризации. Мономер также может иметь защищенную реактивную группу. В процессе полимеризации защитная группа препятствует вступлению реактивной группы в реакцию. После полимеризации защитная группа удаляется. В другом варианте реализации изобретения тройной сополимер, т.е. полимер, содержащий по меньшей мере три различных вида мономеров, используется в качестве полимера для доставки. В контексте настоящего изобретения тройные полимеры содержат мономеры, включающие, по меньшей мере: мономер, содержащий первичную или вторичную концевую аминогруппу, мономер, содержащий первую концевую гидрофобную группу, а также мономер, содержащий вторую концевую гидрофобную группу,где первая и вторая боковые гидрофобные группы отличаются друг от друга. В более предпочтительном варианте реализации изобретения три или более мономеров включают по меньшей мере: один мономер,содержащий первичную или вторичную аминогруппу, мономер, содержащий концевую низшую гидрофобную группу, и мономера, содержащего среднюю или высшую гидрофобную группу. В одном варианте реализации обладающие активностью по отношению к мембране амфипатические терполимеры согласно настоящему изобретению имеют общую структуру отличающуюся тем, что А содержит боковую первичную или вторичную функциональную аминогруппу, В содержит низшую гидрофобную концевую группу (содержащую от 2 до 6 атомов углерода) и С содержит концевую высшую гидрофобную группу (содержащую 12 и более атомов углерода). Параметры a, b и с - это целые числа 0. Для облегчения синтеза в процессе полимеризации могут использоваться мономеры, содержащие защищенные амины, такие как фталимидо-защищенные или ВОС защищенные мономеры аминов. Для получения аминов защитные группы удаляются после полимеризации. Допускается включение небольших количеств дополнительных мономеров (5%). Например, полимеры могут также содержать дополнительные гидрофобные мономеры или мономеры, содержащие реактивные группы. Содержащие реактивные группы мономеры могут использоваться для присоединения компонентов к полимеру после его синтеза. Мономер может иметь реактивную группу, которая не участвует в реакции полимеризации. Мономер также может иметь защищенную реактивную группу. В процессе полимеризации защитная группа препятствует вступлению реактивной группы в реакцию. После полимеризации защитная группа удаляется. Гидрофобные группы предпочтительно являются углеводородами, содержащими только атомы углерода и водорода. Тем не менее, допускается использование неполярных заместителей или неполярных гетероатомов, которые поддерживают гидрофобность, и включают, например, фтор. Этот термин включает алифатические группы, ароматические группы, ацильные группы, алкильные группы, алкенильные группы, алкинильные группы, арильные группы, аралкильные группы, аралкенильные группы и аралкинильные группы, каждая из которых может быть линейной, разветвленной или циклической. Термин гидрофобная группа также включает: стерины, стероиды, холестерин и производные стероидов и холестерина. В контексте настоящего изобретения низший гидрофобный мономер или группа включают гидрофобные группы, содержащие от двух (2) до шести (6) атомов углерода. В контексте настоящего изобретения средние гидрофобные мономеры или группы включают гидрофобные группы, содержащие от семи (7) до одиннадцати (11) атомов углерода. В контексте настоящего изобретения высшие гидрофобные мономеры или группы включают гидрофобные группы, содержащие от двенадцати (12) до тридцати шести (36) или более атомов углерода. Биофизические свойства амфипатических полимеров определяются классом участвующих в полимеризации мономеров соотношением, в котором они включены в полимер, а также размером полимера. Различные полимеры можно получать, изменяя степень загрузки мономеров в реакции полимеризации или меняя группы, которые использовались для модификации основной цепи полимера. Хотя соотношение включенных мономеров в полимер может быть таким же, что и степень загрузки мономеров, соотношения могут быть различными. Вне зависимости от того, соответствует ли включение мономеров степени загрузки или соответствует другому соотношению, можно изменять степень загрузки мономеров для достижения требуемого соотношения включения мономеров. Соотношение аминогрупп и гидрофобных групп выбрано с целью образования водорастворимых полимеров, обладающих разрушающей способностью по отношению к мембране. Предпочтительные обладающие активностью по отношению к мембране полимеры согласно настоящему изобретению являются водорастворимыми в концентрациях 1 мг/мл, 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл, 25 мг/мл и 30 мг/мл. Предпочтительные обладающие активностью по отношению к мембране полимеры согласно настоящему изобретению являются поверхностно-активными. Обладающие активностью по отношению к мембране полимеры согласно настоящему изобретению предпочтительно имеют размер,варьирующий от 3 до 300 кДа. Поскольку полимеры проявляют амфипатические свойства, в водных растворах они образуют мицеллы с критической концентрацией ассоциации 1 мг/мл. В одном из вариантов реализации изобретения соотношение включения мономеров для обладающего активностью по отношению к мембране полиамина составляет около 4-8 аминовых мономеров к 3-5 низшим гидрофобным мономерам. В другом варианте реализации изобретения соотношение включения мономеров для обладающего активностью по отношению к мембране полиамина составляет около 5,47,5 аминовых мономеров к 3-5 низшим гидрофобным мономерам. В другом варианте реализации изобретения соотношение включения мономеров для обладающего активностью по отношению к мембране полиамина составляет около 2 аминовых мономеров к 1 низшему гидрофобному мономеру. В одном варианте реализации изобретения гидрофобные группы гидрофобных мономеров включают алкильные группы. В одном из вариантов реализации изобретения соотношение включения мономеров для обладающего активностью по отношению к мембране полиаминового терполимера составляет около 4-8 аминовых мономеров к 3-5 низшим гидрофобным мономерам и к 1 высшему гидрофобному мономеру. В другом варианте реализации изобретения соотношение включения мономеров для обладающего активностью по отношению к мембране полиамина составляет около 5,4-7,5 аминовых мономеров к 3-3,5 низшим гидрофобным мономерам и к 1 высшему гидрофобному мономеру. В другом варианте реализации изобретения соотношение включения мономеров для обладающего активностью по отношению к мембране полиамина составляет около 6 аминовых мономеров к 3 низшим гидрофобным мономерам и к 1 высшему гидрофобному мономеру. В одном варианте реализации изобретения гидрофобные группы гидрофобных мономеров включают алкильные группы. В одном варианте реализации изобретения кополимеры, содержащие аминогруппы и низшие гидрофобные группы, синтезируются с использованием соотношения загрузки мономеров примерно 4-8 аминовых мономеров к 3-5 низшим алкил-содержащим мономерам. В другом варианте реализации изобретения кополимеры, содержащие аминогруппы/низшие гидрофобные группы, могут быть синтезированы с использованием соотношения загрузки мономеров примерно 15 аминовых мономеров к 4 низшим гидрофобным мономерам. В одном варианте реализации изобретения тройные полимеры, содержащие аминогруппы/низшие/высшие гидрофобные группы, синтезируются с использованием соотношения загрузки мономеров примерно 4-8 аминовых мономеров к примерно 3-5 низшим алкил-содержащим мономерам и к 1 высшему алкил-содержащему мономеру. В другом варианте реализации изобретения тройные полимеры, содержащие аминогруппы/низшие/высшие гидрофобные группы, может быть синтезированы с использованием соотношения загрузки мономеров примерно 15 аминовых мономеров к примерно 4 низшим гидрофобным мономерам и к 1 высшему гидрофобному мономеру. В одном из вариантов реализации изобретения особенно предпочтительные обладающие активностью по отношению к мембране полиамины включают сополимеры, содержащие аминсодержащие мономеры, бутилсодержащие мономеры и мономеры, содержащие высшие гидрофобные группы с 12-18 атомами углерода. Особенно приемлемые обладающие активностью по отношению к мембране полиамины включают нерегулярные тройные полимеры поливинилового эфира или нерегулярные тройные полимеры полиакрилового эфира. В другом варианте реализации изобретения особенно предпочтительные обладающие активностью по отношению к мембране полиамины включают сополимеры, содержащие аминсодержащие мономеры,низшие мономеры, содержащие гидрофобные группы. Особенно приемлемые обладающие активностью по отношению к мембране полиамины включают нерегулярные тройные полимеры поливинилового эфира или нерегулярные тройные полимеры полиакрилового эфира. Особенно приемлемые обладающие активностью по отношению к мембране полиамины включают сополимеры, содержащие аминсодержащие мономеры, бутилсодержащие мономеры. Особенно приемлемые обладающие активностью по отношению к мембране полиамины включают нерегулярные тройные полимеры поливинилового эфира или нерегулярные тройные полимеры полиакрилового эфира. Биоразлагаемые полимеры Полимер может иметь одну или несколько расщепляемых связей. Если расщепляемые связи разрушаются в нормальных физиологических условиях или физиологических условиях клетки, полимер является биоразлагаемым. Биоразлагаемые связи могут быть локализованы в основной цепи или в боковой цепи. Если происходит расщепление связи в основной цепи, то разрыв связей приводит к уменьшению длины полимера и образованию двух молекул. Если происходит расщепление связи в боковой цепи, то разрыв связей приводит к потере атомов боковой цепи из полимера. Для обладающих активностью по отношению к мембране полимеров биодеградация приведет к снижению мембранной активности полимера. В контексте настоящего изобретения термин биоразлагаемый означает, что в организме полимер будет разрушаться с течением времени под действием ферментов, из-за гидролитической активности и/или других аналогичных механизмов. Биоразлагаемые связи - это связи, которые расщепляются при биологических процессах и включают, но не ограничиваются: эфирные связи, фосфодиэфирные связи,некоторые пептидные связи и их комбинации. Эфиры подвергаются гидролизу, а также каталитическому расщеплению эстеразами. Фосфодиэфирные связи расщепляются нуклеазами. Пептидные связи расщепляются пептидазами. В частности, основная цепь полимера разрушается или расщепляется, либо боковые цепи (боковые группы) разрушаются или отщепляются от полимера. Биоразлагаемые связи в биоразлагаемом полимере могут быть расщеплены в физиологических условиях с периодом полураспада менее 45 мин, более 45 мин, более 2 ч, более 8 ч, более 24 ч или более 48 ч. Хотя биоразлагаемые полимеры являются полезными для доставки in vivo, полимер должен быть достаточно стабильным для того чтобы сформировать в водном растворе полимер достаточного размера. Кроме того, скорость расщепления биоразлагаемой связи должна быть меньше, чем лабильной связи, использованной для присоединения маскирующего агента к полимеру. В предпочтительном варианте реализации изобретения деградация биоразлагаемых полимеров происходит с меньшей скоростью, чем расщепление маскирующих агентов. Маскирующий агент Полимеры для доставки согласно настоящему изобретению включают обратимо модифицированные амфипатические полиамины, обладающие активностью по отношению к мембране, в которых обратимая модификация ингибирует мембранную активность, нейтрализует полиамин для уменьшения положительного заряда и образования почти нейтрального полимера, обеспечивает специфичную доставку к определенному типу клеток, а также препятствует неспецифическим взаимодействиям полимера. Полиамин обратимо модифицируется посредством обратимого изменения аминогрупп на полиамине. Обладающие активностью по отношению к мембране полиамины согласно настоящему изобретению способны разрушать плазматическую мембрану или мембраны лизосом или эндосом. Это действие на мембрану является важным элементом для доставки полинуклеотида в клетку. Мембранная активность, однако, приводит к интоксикации, когда полимер вводят in vivo. Полиамины также быстро взаимодействуют с большим количеством анионных компонентов in vivo, что приводит к нежелательному биораспределению. Таким образом, обратимая маскировка активности полиамина по отношению к мембране необходима для его использования in vivo. Эта маскировка осуществляется через обратимое присоединение маскирующего агента к активному по отношению к мембране полиамину с образованием обратимо замаскированного активного по отношению к мембране полиамина, т.е. полимера для доставки. Помимо ингибирования активности по отношению к мембране, маскирующие агенты защищают по-9 024534 лимер от неспецифических взаимодействий, уменьшают взаимодействия с компонентами сыворотки,увеличивают время циркуляции и обеспечивают специфические клеточные взаимодействия, т.е. направленность. Существенной особенностью маскирующего агента, когда он находится в форме агрегата, является ингибирование мембранной активности полимера, защита полимера от неспецифических взаимодействий (снижение взаимодействия с компонентами сыворотки, увеличение времени циркуляции), а также обеспечение направленной доставки к гепатоцитам in vivo. Обладающие активностью по отношению к мембране полиамины проявляют мембранную активность в немодифицированном состоянии (немаскированном) и не имеют мембранной активности (инактивированы) в модифицированном состоянии (замаскированном). Достаточное количество маскирующих агентов связывается с полимером для достижения желаемого уровня инактивации. Желаемый уровень модификации полимера, который достигается присоединением маскирующего агента(ов), легко определяется с помощью соответствующих методов количественного анализа активности полимера. Например, если по результатам данного анализа полимер обладает активностью по отношению к мембране, достаточный уровень маскирующего агента связывается с полимером для достижения желаемого уровня ингибирования мембранной активности в этом анализе. Маскировка требует модификации 50%, 60%, 70% или 80% аминогрупп на полимере, исходя из количества аминов на полимере, определенного в отсутствие маскирующих агентов. Предпочтительной характеристикой маскирующих агентов является снижение положительного заряда полимера, так как при их присоединении к полимеру образуется более нейтральный полимер для доставки. Желательно, чтобы маскированный полимер сохранял растворимость в воде. В контексте настоящего изобретения обладающий активностью по отношению к мембране полиамин маскируется, если модифицированный полимер не проявляет мембранной активности и демонстрирует направленную доставку к специфичным клеткам (например, гепатоцитам) in vivo. Обладающий активностью по отношению к мембране полиамин обратимо маскируется, если расщепление связей соединяющих маскирующий агент с полимером приводит к восстановлению аминов на полимере,восстанавливая тем самым активность по отношению к мембране. Еще одной существенной особенностью маскирующих агентов является их ковалентная связь с обладающим активностью по отношению к мембране полиамином посредством физиологически обратимых связей. Используя физиологически обратимые мостики или связи, маскирующие агенты могут быть отщеплены от полимера in vivo, тем самым снимая маскировку полимера и восстанавливая активность незамаскированного полимера. Выбирая соответствующие обратимые связи можно сформировать конъюгат, который восстанавливает активность обладающего активностью по отношению к мембране полимера после того как он был перенесен или нацелен на нужный тип клеток или внутриклеточный компартмент. Обратимость образования мостиков обеспечивает избирательную активацию обладающего активностью по отношению к мембране полимера. Обратимые ковалентные мостики содержат обратимые или лабильные (чувствительные) связи, которые могут быть выбраны из группы, включающей: физиологически лабильные связи, клеточные физиологически лабильные связи в клеточных условиях, рНчувствительные связи, очень рН-чувствительных связей и крайне рН-чувствительных связей. В контексте настоящего изобретения маскирующий агент включает соединение, содержащие нацеливающий на ASGPr остаток или стабилизатор стерической конфигурации и амино-реактивную группу,в котором реакция амино-реактивной группы с амином на полимере приводит к связыванию направляющего на ASGPr остатка или стабилизатора стерической конфигурации с полимером посредством физиологически лабильной ковалентной связи. Обеспечивающий направленную доставку к ASGPr остаток представляет собой группу, как правило, сахарид, имеющую сродство к асиалогликопротеиновому рецептору. Предпочтительным стабилизатором стерической конфигурации является полиэтиленгликоль(ПЭГ). Предпочтительные маскирующие агенты изобретения могут модифицировать полимер (образовывать обратимую связь с полимером) в водном растворе. Предпочтительная амино-реактивная группа включает двузамещенный малеиновый ангидрид. Предпочтительный маскирующий агент имеет следующую структуру: отличающуюся тем, что R1 представляет собой алкильную группу, такую как метил (-СН 3), этил(-СН 2 СН 3), или пропил (-СН 2 СН 2 СН 3) (для образования замещенного алкилмалеинового ангидрида) и R2 включает направляющий на асиалогликопротеиновый рецепторов (ASGPr) остаток или стабилизатор стерической конфигурации. Обладающий активностью по отношению к мембране полиамин может быть конъюгирован с маскирующими агентами в присутствии избытка маскирующих агентов. Избыток маскирующего агента может быть удален из конъюгированного полимера для доставки до его введения. Стабилизатор стерической конфигурации В контексте настоящего изобретения стабилизатор стерической конфигурации представляет собой неионный гидрофильный полимер (природный, синтетический или искусственный), который предотвращает или ингибирует внутримолекулярные и межмолекулярные взаимодействия полимера, к которому он присоединен, по сравнению с полимером, не содержащим стерического стабилизатора. Стабилизатор стерической конфигурации препятствует участию полимера, к которому он присоединен, в электростатических взаимодействиях. Электростатические взаимодействия представляют собой нековалентную ассоциацию двух или нескольких веществ, обусловленную силами притяжения между положительными и отрицательными зарядами. Стабилизаторы стерической конфигурации могут ингибировать взаимодействие с компонентами крови и, следовательно, препятствовать опсонизации, фагоцитозу и поглощению клетками ретикулоэндотелиальной системы. Стабилизаторы стерической конфигурации могут таким образом увеличивать время циркуляции молекул, к которым они присоединены. Стерические стабилизаторы могут также ингибировать агрегацию полимера. Предпочтительным стабилизатором стерической конфигурации является полиэтиленгликоль (ПЭГ) или производное ПЭГ. В контексте настоящего изобретения предпочтительный ПЭГ может иметь примерно 1-500 мономеров этиленгликоля, 2-20 мономеров этиленгликоля, 5-15 мономеров этиленгликоля или примерно 10 мономеров этиленгликоля. В контексте настоящего изобретения предпочтительный ПЭГ может иметь средний молекулярный вес примерно 85-20000 дальтон (Да), примерно 200-1000 Да, примерно 200-750 Да или примерно 550 Да. В контексте настоящего изобретения стабилизатор стерической конфигурации предотвращает или ингибирует в водном растворе внутримолекулярные или межмолекулярные взаимодействия полимера, к которому он присоединен, по сравнению с полимером, не содержащим стабилизатора стерической конфигурации. Фрагмент, обеспечивающий направленную доставку к ASGPr Фрагменты или группы, обеспечивающие направленную доставку, повышают фармакокинетические свойства или биораспределение конъюгата, к которому они присоединены с целью улучшения специфичного клеточного распределения и специфичного поглощения конъюгата клетками. Для направленной доставки молекул к гепатоцитам in vivo была использована галактоза и производные галактозы, которые связываются с асиалогликопротеиновым рецептором (ASGPr), экспрессирующимся на поверхности гепатоцитов. В контексте настоящего изобретения фрагмент, обеспечивающий направленную доставку к ASGPr, состоит из галактозы и производного галактозы, имеющего сопоставимое или большее сродство к ASGPr, чем галактоза. Связывание галактозного остатка, обеспечивающего направленную доставку, с асиалогликопротеиновым рецептором(ами) облегчает специфичный клеточный направленную доставку полимера к гепатоцитам и эндоцитоз полимера для доставки в гепатоциты. Фрагмент, обеспечивающий направленную доставку к ASGPr, может быть выбран из группы,включающей: лактозу, галактозу, N-ацетилгалактозамин (GalNAc), галактозамин, N-формилгалактозамин, N-ацетилгалактозамин, N-пропионилгалактозамин, N-n-бутаноилгалактозамин и N-изо-бутаноилгалактозамин (Iobst, S.T. и Drickamer, K. J.B.C. 1996, 271, 6686). Фрагменты, обеспечивающие направленную доставку к ASGPr, могут быть мономерными (например, содержащими только один галактозамин) или мультимерными (например, содержащими несколько галактозаминов). В некоторых вариантах реализации изобретения содержащий галактозу направляющий фрагмент связан с обладающей активностью по отношению к аминам группой через ПЭГ линкер, как это показано на структуре отличающейся тем, что n - это целое число от 1 до 19. В одном из вариантов реализации изобретения обладающий активностью по отношению к мембране полиамин обратимо маскируется присоединением направляющего на ASGPr маскирующего остатка к 50%, 60%, 70% или 80% аминов на полиамине. В другом варианте реализации изобретения обладающий активностью по отношению к мембране полиамин обратимо маскируется присоединением направляющего на ASGPr остатка и маскирующего агента ПЭГ к 50%, 60%, 70% или 80% аминов на полиамине. В другом варианте реализации изобретения направляющий на ASGPr маскирующий остаток включает направляющий на ASGPr остаток, связанный с обладающей активностью по отношению к аминам группой через ПЭГ линкер. Для маскировки обладающего активностью по отношению к мембране полиамина с помощью как направляющего на ASGPr маскирующего остатка, так и маскирующего агента ПЭГ, соотношение ПЭГ:ASGPr остаток составляет примерно 0-4:1, более предпочтительно примерно 0,5-2:1. В другом варианте реализации изобретения используется соотношение маскирующий агент ПЭГ маскирующее производное галактозы примерно равное 1.3-2:1. Поверхностный заряд Зета-потенциал является физическим свойством, которым обладает любая частица в суспензии, этот показатель близок к поверхностному заряду. В водных средах значение рН образца является одним из наиболее важных факторов, влияющих на зета-потенциал. Когда заряд основан на протонировании/депротонировании оснований/кислот, то заряд зависит от значения рН. Таким образом, значение зета-потенциала должно отражать условия раствора, прежде всего основную роль имеет значение рН. Для обычных частиц величина зета-потенциала свидетельствует о возможной стабильности коллоидной системы. Если все частицы в суспензии имеют большой отрицательный или положительный зетапотенциал, то они должны иметь тенденцию отталкивать друг друга, и в результате частицы не имеют тенденцию к объединению. Однако если частицы имеют низкое значение зета-потенциала, то не существует силы, предотвращающей их объединение и хлопьеобразование. Основная разделяющая линия между стабильными и нестабильными суспензиями для обычных частиц проходит на уровне либо +30, либо 30 мВ. Частицы, имеющие положительный зета-потенцнал, превышающий +30 мВ, или отрицательный потенциал, более низкий чем -30 мВ, как правило, считаются стабильными. Полимеры для доставки согласно настоящему изобретению демонстрируют зета-потенциал от 20 мВ до -20 мВ при физиологической концентрации соли и рН 8, но в водном растворе коллоидная система стабильна и не образует хлопьев. Положительный заряд или зета-потенциал обладающего активностью по отношению к мембране полиамина снижают путем модификации или присоединения маскирующих агентов. Заряд полимера,прежде всего положительный заряд, может приводить к нежелательным взаимодействиям с компонентами сыворотки или клетками, не являющимися мишенями. Положительный поверхностный заряд также играет важную роль в мембранной активности за счет усиления взаимодействия полимера с отрицательно заряженными клеточными мембранами. Таким образом, полимер для доставки с почти нейтральным суммарным зарядом или зета-потенциалом является предпочтительным для доставки полинуклеотидов invivo. Полимер для доставки согласно настоящему изобретению обладающие активностью по отношению к мембране полиамины замаскированные путем обратимого присоединения направляющего на ASGPr маскирующего остатка и маскирующие стабилизаторы стерической конфигурации имеют близкий к нейтральному кажущийся поверхностный заряд и стабильны в сыворотке. В частности, предлагаемые в изобретении полимеры для доставки имеют зета-потенциал, измеренный при рН 8, в диапазоне от +30 до -30 мВ, в диапазоне от +20 до -20 мВ, в диапазоне от +10 до -10 мВ, или в диапазоне от +5 до -5 мВ. Ожидается, что суммарный заряд конъюгата при рН 7 будет более положительным, чем при рН 8. Суммарный или поверхностный заряд является важным фактором для применения in vivo. Лабильные связи Связь или линкер представляет собой соединяющий элемент между двумя атомами, который соединяет одну представляющую интерес химическую группу или сегмент с другой представляющей интерес химической группой или сегментом посредством одного или нескольких ковалентных мостиков. Например, связь может соединять полинуклеотид или маскирующий агент с полимером. При формировании связи может происходить соединение двух отдельных молекул с образованием одной молекулы, или она может соединять два атома одной и той же молекулы. Связь может быть нейтральной или может нести положительный или отрицательный заряд. Обратимая или лабильная связь содержит обратимый или лабильный мостик. Связь необязательно может включать спейсер, который увеличивает расстояние между двумя объединяемыми атомами. Спейсер может придавать дополнительную гибкость и/или увеличивать длину связи. Спейсеры могут включать, но не ограничиваются: алкильные группы, алкенильные группы, алкинильные группы, арильные группы, аралкильные группы, аралкенильные группы, аралкинильные группы, каждая из которых может содержать один или несколько гетероатомов, гетероциклы,аминокислоты, нуклеотиды и сахариды. Спейсерные группы хорошо известны в данной области и перечисленный выше ряд не следует рассматривать, как ограничивающий объем изобретения. Обратимая или лабильная связь представляет собой ковалентную связь, отличную от ковалентной связи с атомом водорода, которую можно избирательно разрушать или расщеплять в условиях, при которых не разрушаются или расщепляются другие ковалентные связи в этой же молекуле. Более конкретно,обратимая или лабильная связь представляет собой ковалентную связь, которая является менее стабильной (термодинамически) или быстрее расщепляется (кинетически) в соответствующих условиях, чем другие нелабильные ковалентные связи в этой же молекуле. Расщепление лабильной связи в молекуле может приводить к образованию двух или большего количества молекул. Специалисты в данной области способность к расщеплению или лабильность связи, как правило, выражают в понятиях времени полужизни (t1/2) касательно расщепления связи или времени, которое необходимо для расщепления половины связей. Таким образом, обратимые или лабильные связи охватывают связи, которые могут избирательно расщепляется быстрее других связей молекулы. Соответствующие условия определяются типом лабильной связи и хорошо известны в органической химии. Лабильная связь может быть чувствительной к значению рН, окислительным или восстановительным условиям или агентам, температуре, концентрации солей, присутствию фермента (например,эстераз, включая нуклеазы и протеазы) или присутствию дополнительного агента. В другом примере по- 12024534 вышенные или пониженные значения рН могут являются соответствующими условиями для рНчувствительной связи. Скорость трансформации лабильной группы можно контролировать, изменяя химические составляющие молекулы, содержащей лабильную группу. Например, добавление конкретных химических фрагментов (например, акцепторов или доноров электронов) вблизи лабильной группы может влиять на конкретные состояния (например, значение рН), в которых может иметь место химическая трансформация. В контексте настоящего изобретения подразумевается, что физиологически лабильная связь представляет собой лабильную связь, которая может расщепляться в условиях, которые, как правило, встречаются или аналогичны встречающимся в организме млекопитающего. Физиологически лабильные группы связей выбирают из связей, которые подвергаются химической трансформации (например, расщеплению), когда находятся в физиологических условиях. В контексте настоящего описания подразумевается, что клеточная физиологически лабильная связь представляет собой связь, которая может расщепляться во внутриклеточной среде млекопитающих. Внутриклеточные среды млекопитающих включают химические условия, такие как значение рН, температура, окислительные или восстановительные условия или агенты и концентрация соли, обнаруженные или аналогичные встречающимся в клетках млекопитающих. Внутриклеточные среды млекопитающих включают также наличие ферментативной активности, которая в норме характерна для клетки млекопитающего, например, связанной с протеолитическими или гидролитическими ферментами. Клеточная физиологически лабильная связь может расщеплять также в ответ на введение фармацевтически приемлемого экзогенного агента. Физиологически лабильные связи, расщепление которых характеризуется временем полужизни, составляющим менее 45 мин, считаются очень лабильными. Физиологически лабильные связи, расщепление которых характеризуется временем полужизни, составляющим менее 15 мин,считаются чрезвычайно лабильными Химическую трансформацию (расщепление лабильной связи) можно инициировать, добавляя фармацевтически приемлемый агент в клетку, или она может происходить спонтанно, когда молекула, содержащая лабильную связь, достигает соответствующего внутри- и/или внеклеточного окружения. Например, рН-чувствительная связь может расщепляться, когда молекула проникает в кислую среду эндосомы. Так, рН-чувствительную связь можно рассматривать как расщепляемую в эндосоме связь. Ферментативно расщепляемые связи могут расщеплять при контакте с ферментами, которые присутствуют в эндосоме или лизосоме, или в цитоплазме. Дисульфидный мостик может расщепляться, когда молекула проникает в обладающую более высокой восстанавливающей способностью среду клеточной цитоплазмы. Таким образом, дисульфид можно рассматривать как расщепляемую в цитоплазме связь. В контексте настоящего описания подразумевается, что рН-чувствительные связи представляют собой лабильные связи, которые избирательно разрушаются в кислых условиях (рН 7). Такие связи можно обозначать также как лабильные в условиях эндосомы связи, поскольку значение рН в эндосомах и лизосомах менее 7. Под понятие "рН-чувствительные связи" подпадают рН-чувствительные связи, очень лабильные при определенных значениях рН связи и чрезвычайно лабильные при определенных значениях рН связи. Взаимодействие ангидрида с амином приводит к образованию амида и кислоты. Для многих ангидридов обратная реакция (образование ангидрида и амина) протекает очень медленно и энергетически невыгодна. Однако если ангидрид является циклическим ангидридом, реакция с амином дает амид кислоты, т.е. молекулу, в которой амидная и кислотная группы находятся в одной молекуле. Наличие обеих реактивных групп (амидной и карбоксильной) в одной и той же молекуле ускоряет обратную реакцию. В частности, продукт реакции первичных аминов с малеиновым ангидридом и производными малеинового ангидрида, малеамовыми кислотами, ревертирует до амина и ангидрида в 1109 - 11013 раз быстрее, чем его нециклические аналоги (Kirby, 1980). Реакция амина с ангидридом с образованием амида и кислоты Расщепление амида кислоты с образованием амина и ангидрида зависит от рН и значительно ускоряется при кислых рН. Эта рН зависимая реакционная способность может быть использована для формирования обратимых рН-чувствительных связей и линкеров. В качестве такой рН-чувствительной линкер- 13024534 ной молекулы использовалась цис-аконитовая кислота. Сначала с первой молекулой связывается карбоксилат. На втором этапе, - или -карбоксилат связывается со второй молекулой с образованием рН-чувствительной связи между двумя молекулами. Полупериод расщепления этого линкера при рН 5 составляет от 8 до 24 ч. Структуры цис-аконитового ангидрида и малеинового ангидрида малеиновый ангидрид Значение pH, при котором происходит расщепление, контролируется добавлением химических компонентов к лабильному остатку. Скорость превращения малеамовых кислот в амины и малеиновые ангидриды сильно зависит от заместителя (R2 и R3) в системе малеинового ангидрида. Когда R2 представляет собой метил, скорость превращения в 50 раз выше, чем в случае, когла R2 и R3 представляют водород. Наличие алькильных заместителей в R2 и R3 (например, 2,3-диметилмалеиновый ангидрид) чрезвычайно сильно повышает скорость преобразования: в 10000 раз быстрее по сравнению с незамещенным малеиновым ангидридом. Малеаматная связь, образовавшаяся в результате модификации амина 2,3-диметилмалеиновым ангидридом, расщепляется с восстановлением ангидрида и амина, время полужизни которых составляет от 4 до 10 мин при pH 5. Это позволяет предполагать, что если R2 и R3 представляют собой группы более крупные, чем водород, то скорость превращения амида кислоты в амин и ангидрид должна быть быстрее, чем в случае, когда R2 и R3 обозначают водород. Существенно рН-чувствительные связи: полупериод расщепления очень рН-чувствительной связи при рН 5 менее 45 мин. Конструкция очень рН-чувствительных связей хорошо известна в химии. Чрезвычайно рН-чувствительные связи: полупериод расщепления чрезвычайно рН-чувствительной связи при рН 5 менее 15 мин. Конструкция чрезвычайно рН-чувствительных связей хорошо известна в химии. Двузамещенные циклические ангидриды особенно полезны для присоединения маскирующих агентов к обладающим активностью по отношению к мембране полиаминам согласно настоящему изобретению. Они обеспечивают чувствительные к физиологическому рН связи, легко модифицируют амины и восстанавливают эти амины при расщеплении в условиях низких значений рН, обнаруженных в эндосомах и лизосомах. Во-вторых, - или -карбоксильные группы, образовавшиеся при реакции с амином,возможно обуславливают только 1/20 от ожидаемого отрицательного заряда на полимере (Rozema et al.Bioconjugate Chemistry, 2003). Таким образом, более вероятно, что модификация полиаминов при помощи двузамещенных малеиновых ангидридов эффективно нейтрализует положительный заряд полиаминов, создавая тем самым полимер с высоким отрицательным зарядом. Почти нейтральные полимеры являются предпочтительными для доставки in vivo. Ступенчатая полимеризация При ступенчатой полимеризации полимеризацию осуществляют постадийно. Для удлинения полимера используют реакцию между мономерами, олигомерами и полимерами. При этом не требуется никакой инициации, так как одна и та же реакция имеет место на всем протяжении и не имеет стадии обрыва цепи, поскольку концевые группы еще являются реактивными. Скорость полимеризации снижается в зависимости от поглощения функциональных групп. Полимер можно создавать с помощью ступенчатой полимеризации, используя мономеры, которые имеют две реактивные группы (А и В) в одном и том же мономере (гетеробифункциональный), при этом А содержит реактивную группу и В содержит реактивную в отношении А группу (реактивная группа,которая образует ковалентную связь с А). Полимеризация А-В позволяет получать -[А-В]n-. Реактивные группы А и В можно соединять ковалентной связью или множеством ковалентных связей, получая состоящий из мономеров полимер. Полимер можно создавать также путем ступенчатой полимеризации,используя гомобифункциональные мономеры, такие как А-А+В-В, получая -[А-А-В-В]n-. Как правило,эти реакции могут включать ацилирование и алкилирование. Две реактивные группы мономера можно соединять одной ковалентной связью или множеством ковалентных связей. Если реактивная группа А представляет собой амин, то В представляет собой обладающую реактивностью в отношении амина группу, которую можно выбирать из группы, включающей: изотиоцианат,изоцианат, ацилазид, N-гидроксисукцинимид, сульфонилхлорид, альдегид (включая формальдегид и глутаровый альдегид), кетон, эпоксид, карбонат, сложный имидоэфир, карбоксилат, активированный карбодиимидом, алкилфосфат, галоидарилы (дифтординитробензол), ангидрид, галогенангидрид, сложный пара-нитрофениловый эфир, сложный ортонитрофениловый эфир, сложный пентахлорфениловый эфир, сложный пентафторфениловый эфир, карбонилимидазол, карбонилпиридиний и карборилдиметиламинопиридиний. Другими словами, если реактивная группа А представляет собой амин, то В может представлять собой ацилирующий или алкилирующий агент или агент для аминирования. Если реактивная группа А представляет собой сульфгидрил (тиол), то В представляет собой обладающую реактивностью в отношении тиола группу, которую можно выбирать из группы, включающей: йодацетильное производное, малеимид, азиридиновое производное, акрилоильное производное, фторбензольное производное и дисульфидное производное (такое как пиридилдисульфид или производные 5 тио-2-нитробензойной кислоты (TNB. Если реактивная группа А представляет собой карбоксилат, то реактивная группа В представляет собой обладающую реактивностью в отношении карбоксилата группу, которую можно выбирать из группы, включающей: диазоацетат и амин, в качестве которого используют карбодиимид. Можно применять другие добавки, такие как карбонилимидазол, диметиламинопиридин (ДМАП), N-гидроксисукцинимид или спирт, в случае применения карбодиимида и ДМАП. Если реактивная группа А представляет собой гидроксил, то реактивная группа В представляет собой обладающую реактивностью в отношении гидроксила группу, которую можно выбирать из группы,включающей: эпоксид, оксиран, активированный карбамат, активированный сложный эфир и галоидалкил. Если реактивная группа А представляет собой альдегид или кетон, то реактивная группа В представляет собой обладающую реактивностью в отношении альдегида или кетона группу, которую можно выбирать из группы, включающей: гидразин, производное гидразида, амин (для получения основания Шиффа, которое можно не восстанавливать или восстанавливать с помощью восстановителя, такого какNaCNBH3) и гидроксилсодержащее соединение. Полимер можно создавать с помощью ступенчатой полимеризации, используя бифункциональные мономеры и другие агенты, такие, например, как А-А плюс другой агент, с получением -[А-А]n-. Если реактивная группа А представляет собой сульфгидрильную (тиол) группу, то ее затем можно превращать в дисульфидные мостики с помощью окислителей, таких как йод (I2), перйодат натрия(NaIO4) или кислород (O2). Если реактивная группа А представляет собой амии, то ее можно превращать в тиол путем взаимодействия с 2-иминотиолатом (реагент Траута), который затем подвергают окислению и образованию дисульфида. Для катализа формирования дисульфидного мостика можно применять также дисульфидные производные (такие как пиридилдисульфид или производные TNB). Реактивные группы А или В в любом из приведенных выше примеров могут представлять собой также фотореактивную группу, такую как арилазид (включая галогенированный арилазид), диазогруппу,бензофенон, алкин или диазириновое производное. Реакции с участием амина, гидроксила, сульфгидрила или карбоксилата позволяют получать химические связи, которые описаны как амиды, амидины, дисульфиды, простые эфиры, сложные эфиры, енамипы, имины, мочевины, изотиомочевины, изомочевины, сульфонамиды, карбаматы, алкиламинные связи (вторичные амины) и простые связи типа углерод-азот, в которых углерод содержит гидроксильную группу, простой тиоэфир, диол, гидразон, диазогруппу или сульфон. Цепная полимеризация При цепной реакции полимеризации рост полимера происходит в результате последовательного добавления мономерных звеньев к ограниченному количеству растущих цепей. Механизмы инициации и роста являются различными и, как правило, включают стадию обрыва цепи. Цепные реакции полимеризации могут быть радикальными, анионными или катионными. Мономеры для цепной полимеризации можно выбирать из таких групп, как: винил, виниловый эфир, акрилатные, метакрилатные, акриламидные и метакриламидные группы. Цепную полимеризацию можно осуществлять также посредством циклической полимеризации или полимеризации с раскрытием кольца. Можно применять также несколько различных типов ингибиторов свободных радикалов, включая, но не ограничиваясь только ими, пероксиды, гидроксипероксиды и азосоединения, такие как дигидрохлорид 2,2-азобис(амидинопропана)(ААР). Встречающийся в естественных условиях полимер представляет собой полимер, который можно обнаружить в природе. Их примерами являются полинуклеотиды, белки, коллаген и полисахариды(крахмалы, целлюлоза, гликозамингликаны, хитин, агар, агароза). Встречающийся в естественных условиях полимер можно выделять из биологического источника, или он может быть синтетическим. Синтетический полимер можно составлять или получать путем химического процесса, осуществляемого человеком, и не создавать с помощью биологических процессов, встречающихся в естественных условиях. Не встречающийся в естественных условиях полимер представляет собой синтетический полимер, который не создан из встречающихся в естественных условиях материалов (животного или растительного происхождения) или мономеров (таких как аминокислоты, нуклеотиды и сахариды). Полимер может быть полностью или частично природным, синтетическим или неприродным. Конъюгат полинуклеотида иРНК (РНКи) Мы обнаружили, что конъюгация полинуклеотида иРНК с остатком, обеспечивающим направленную доставку полинуклеотида, гидрофобной группой или галактозным кластером, и одновременное введение конъюгата полинуклеотида иРНК с полимером для доставки, описанным выше, обеспечивает эффективный, функциональную доставку полинуклеотида иРНК в клетки печени, в частности, гепатоциты,in vivo. Функциональная доставка означает, что полинуклеотид иРНК доставляется в клетки и имеет ожидаемую биологическую активность, а также осуществляет ингибирование экспрессии генов, специфичное к определенной нуклеотидной последовательности. Многие вводимые в сосудистое русло млекопитающих молекулы, в том числе полинуклеотиды, как правило, выводится из организма печенью. Печеночный клиренс полинуклеотида, при котором полинуклеотид разрушается или подвергается другой трансформации для выведения из организма, и при котором полинуклеотид не осуществляет ингибирование экспрессии генов, специфичное к определенной нуклеотидной последовательности, не рассматривается как функциональная доставка. Конъюгат полинуклеотида иРНК образуется посредством ковалентного присоединения полинуклеотида иРНК к полинуклеотидному фрагменту, обеспечивающему направленную доставку. Полинуклеотид синтезируется или модифицируется таким образом, что включает реактивную группу А. Обеспечивающий направленную доставку остаток также синтезируется или модифицируется таким образом,что включает реактивную группу В. Реактивные группы А и В выбираются таким образом, что они могут быть связаны с помощью ковалентной связи с использованием способов хорошо известных в данной области. Обеспечивающий направленную доставку остаток может быть связан с 3' или 5' концом полинуклеотида иРНК. Для миРНК полинуклеотидов обеспечивающий направленную доставку остаток может быть связан либо со смысловой нитью, либо с антисмысловой нитью, хотя связь со смысловой нитью является предпочтительной. В одном варианте реализации изобретения обеспечивающий направленную доставку полинуклеотида остаток состоит из гидрофобной группы. В частности, обеспечивающий направленную доставку полинуклеотида остаток состоит из гидрофобных групп, содержащих не менее 20 атомов углерода. Гидрофобные группы, используемые в качестве остатка, обеспечивающего направленную доставку полинуклеотида, в настоящем описании назеваются гидрофобные остатки, обеспечивающие направленную доставку. Пример подходящей гидрофобной группы может быть выбран из группы, включающей: холестерол, дихолестерол, токоферол, дитокоферол, дидецил, дидодецил, диоктадецил, дидодецил, диоктадецил, изопреноид и холеамид. Гидрофобные группы, содержащие 6 или меньше атомов углерода, не являются эффективными обеспечивающими направленную доставку полинуклеотида остатками, в то время как гидрофобные группы, содержащие от 8 до 18 атомов углерода, обеспечивают повышение эффективности доставки полинуклеотида с увеличением размера гидрофобной группы (т.е. увеличения числа атомов углерода). Присоединение гидрофобного остатка, обеспечивающего направленную доставку, к полинуклеотидов иРНК не обеспечивает эффективную функциональную доставку полинуклеотида иРНК с обладающей активностью по отношению к аминам группой в отсутствие одновременного введения полимера для доставки. Хотя в некоторых работах было показано, что конъюгаты миРНК-холестерин способны доставлять миРНК (миРНК-холестерин) в клетки печени обладающей активностью по отношению к аминам группой при отсутствии какой-либо дополнительной системы доставки, для доставки требуются высокие концентрации миРНК и эффективность доставки очень низкая. Эффективность доставки значительно повышается при использовании комбинации с полимером для доставки согласно настоящему изобретению. Эффективность доставки миРНК-холестерина увеличивается примерно в 100 раз при совместном использовании конъюгата миРНК-холестерин вместе с полимером для доставки согласно настоящему изобретению. Гидрофобные группы, которые могут быть полезны в качестве обеспечивающего направленную доставку полинуклеотида остатка, могут быть выбраны из группы, состоящей из: алкил, алкенил, алкинил,арил, аралкил, аралкенил, аралкинил группы, каждая из которых может быть линейной, разветвленной или циклической, холестерина, производных холестерина, стирола, стероидов и стероидных производных. Гидрофобные обеспечивающие направленную доставку остатки предпочтительно представляют собой углеводороды, содержащие только атомы углерода и водорода. Тем не менее, допускается использование заместителей или гетероатомов, которые поддерживают гидрофобность, например, фтора. Гидрофобный обеспечивающий направленную доставку остаток может быть присоединен к 3' или 5' концу полинуклеотида иРНК с использованием методов, известных в данной области. Для полинуклеотидов иРНК, включающих 2 нити, таких как миРНК, гидрофобная группа может быть присоединена к одной цепи. В другом варианте реализации изобретения обеспечивающий направленную доставку полинуклеотида остаток состоит из галактозного кластера (галактозный кластер, обеспечивающий направленную доставку). В контексте настоящего изобретения галактозный кластер включает молекулу, содержащую 24 концевых производных галактозы. В контексте настоящего изобретения термин производные галактозы включает как галактозу, так и производные галактозы, имеющие сопоставимое или более высокое сродство к асиалогликопротеиновому рецептору, чем у галактозы. Концевые производные галактозы присоединяются к молекуле через их С 1-углерод. Асиалогликопротеиновый рецептор (ASGPr) является уникальным для гепатоцитов и способен связывать разветвленные гликопротеины с концевыми остатками галактозы. Предпочтительный кластер галактозы имеет три концевых галактозамина или производных галактозамина, каждый из которых имеет сродство к асиалогликопротеиновому рецептору. Более предпочтительный кластер галактозы имеет три концевых N-ацетилгалактозамина. Другие термины, широко распространенные в этой области техники, включают три-антенари галактозу, трехвалентную галактозу и тример галактозы. Известно, что кластеры, состоящие из три-антенари галактозных производных, связываются с ASGPr с большим сродством, чем би-антенари или моно-антенари структуры производных галактозы (Baenziger and Fiete, 1980, Cell, 22, 611-620; Connolly et al., 1982, J. Biol. Chem., 257,939-945). Для достижения сродства с константой близкой к нМ диапазону необходима мультивалентность. Присоединение одного производного галактозы, имеющего сродство к асиалогликопротеиновому рецептору, не обеспечивает функциональную доставку полинуклеотида иРНК в гепатоциты обладающей активностью по отношению к аминам группой при одновременном применении с полимером для доставки. Кластер галактозы состоит из трех производных галактозы, каждый из которых связан с центральной точкой ветвления. Производные галактозы присоединены к центральной точке ветвления через С 1 углерод сахаридов. Производные галактозы предпочтительно связаны с точкой ветвления через линкеры или спейсеры. Предпочтительный спейсер представляет собой гибкий гидрофильный спейсер (патент США 5885968, Biessen et al. J. Med. Chem. 1995. Vol. 39, p. 1538-1546). Предпочтительный гибкий гидрофильный спейсер представляет собой ПЭГ. Предпочтительный ПЭГ спейсер представляет собой ПЭГ 3 спейсер. Точкой ветвления может быть любая маленькая молекула, которая позволяет присоединение трех производных галактозы и дополнительно позволяет присоединение точки ветвления к полинуклеотидов иРНК. Примером группы для точки ветвления является дилизин. Молекула дилизина содержит три аминогруппы, через которые могут быть присоединены три производных галактозы, и реактивную карбоксильную группу, через которую к дилизину может быть присоединен полинуклеотид иРНК. Присоединение точки ветвления к полинуклеотидов иРНК может проходить через линкер или спейсер. Предпочтительный спейсер представляет собой гибкий гидрофильный спейсер. Предпочтительный гибкий гидрофильный спейсер это ПЭГ спейсер. Предпочтительный ПЭГ спейсер представляет собой ПЭГ 3 спейсер (три субединицы этилена). Кластер галактозы может быть присоединен к 3' или 5' концу полинуклеотида иРНК при помощи хорошо известных в данной области методов. Для полинуклеотидов иРНК, включающих 2 нити, таких как миРНК, кластер галактозы может быть присоединен к одной цепи. Предпочтительным производным галактозы является N-ацетилгалактозамин (GalNAc). Другие сахара, имеющие сродство к асиалогликопротеиновому рецептору, могут быть выбраны из списка, включающего: галактозу, галактозамин, N-формилгалактозамин, N-ацетилгалактозамин, N-пропионилгалактозамин, N-n-бутаноилгалактозамин и N-изо-бутаноилгалактозамин. Были исследованы величины аффинности многочисленных производных галактозы к асиалогликопротеиновому рецептору (см., например, Iobst, S.T. and Drickamer, K. J. B.C. 1996, 271, 6686), они могут быть легко определены, используя хорошо известные в этой области методы. Один из вариантов кластера галактозы кластер галактозы с ПЭГ спейсером между точкой ветвления и нуклеиновой кислотой. Понятие полинуклеотид или нуклеиновая кислота, или полинуклеиновая кислота в данной области относится к полимеру, содержащему по меньшей мере два нуклеотида. Нуклеотиды представляют собой мономерные звенья полинуклеотидных полимеров. Полинуклеотиды, содержащие менее 120 мономерных звеньев, часто называют олигонуклеотидами. Встречающиеся в естественных условиях нуклеиновые кислоты имеют дезоксирибозо- или рибозофосфатный каркас. Не встречающийся в естественных условиях или синтетический полинуклеотид представляет собой полинуклеотид, который полимеризован invitro или в бесклеточной системе и содержит такие же или сходные основания, но может иметь тип каркаса, отличный от встречающегося в естественных условиях рибозо- или дезоксирибозофосфатного каркаса. Полинуклеотиды можно синтезировать с помощью любых известных в данной области методов. Полинуклеотидные каркасы, известные в данной области, включают: ПНК (пептидные нуклеиновые кислоты), фосфоротиоаты, фосфородиамидаты, морфолины и другие варианты фосфатного каркаса нативных нуклеиновых кислот. Основания представляют собой пурины и пиримидины, которые в свою очередь включают встречающиеся в естественных условиях соединения, такие как аденин, тимин, гуанин,цитозин, урацил, инозин, и аналоги встречающихся в естественных условиях оснований. Синтетические производные пуринов и пиримидинов включают, но не ограничиваясь только ими, модификации, которые приводят к появлению новых реактивных групп в нуклеотиде, таких как, но не ограничиваясь только ими, амины, спирты, тиолы, карбоксилаты и галоидалкилы. Под это понятие подпадают также все известные аналоги ДНК и РНК. Понятие полинуклеотид включает дезоксирибонуклеиновую кислоту(ДНК) и рибонуклеиновую кислоту (РНК) и комбинации ДНК, РНК и других встречающихся в естественных условиях и синтетических нуклеотидов. Полинуклеотиды могут быть полимеризованы in vitro,они могут быть рекомбинантными, содержать химерные последовательности или производные этих групп. Полинуклеотид может включать концевой кэп на 5' конце, 3' конце или как на 5', так и на 3' конце. Кэп может включать, но не ограничивается, инвертированный остаток рибозы в молекуле ДНК, лишенной азотистого основания, инвертированный дезокситимидиновый остаток, тимидиновый остаток или 3 глицерильную модификацию. Полинуклеотид, принимающий участие в интерференции РНК (иРНК) (полинуклеотид иРНК),представляет собой молекулу, которая может индуцировать РНК-интерференцию путем воздействия на механизм пути РНК-интерференции в клетках млекопитающих, в результате чего происходит нарушение или ингибирование трансляции транскриптов матричной РНК (мРНК) трансгена специфическим для последовательности образом. Два основных РНКи-полинуклеотида представляют собой малые (или короткие) интерферирующие РНК (миРНК) и микроРНК. РНКи-полинуклеотиды можно выбирать из группы,включающей: миРНК, микроРНК, двухцепочечную РНК (dsPHK), короткую РНК-шпильку (shPHK) и кассеты экспрессии, кодирующие РНК, если они обладают способностью индуцировать РНКинтерференцию. миРНК содержит двухцепочечную структуру, как правило, состоящую из 15-50 пар оснований и предпочтительно из 21-25 пар оснований, и имеющую нуклеотидную последовательность,которая идентична (полностью комплементарна) или практически идентична (частично комплементарна) кодирующей последовательности в экспрессируемом гене-мишени или РНК внутри клетки. миРНК может иметь состоящие из двух нуклеотидов 3-выступающие концы. миРНК может состоять из двух ренатурированных полинуклеотидов или одного полинуклеотида, который образует структуру типа шпильки. Молекула миРНК, предлагаемая в изобретении, содержит смысловую область и антисмысловую область. В одном из вариантов реализации изобретения миРНК, входящие в конъюгат, состоят из двух олигонуклеотидных фрагментов, при этом один фрагмент содержит нуклеотидную последовательность антисмысловой цепи молекулы миРНК, а второй фрагмент содержит нуклеотидную последовательность смысловой области молекулы миРНК. В другом варианте реализации изобретения смысловую цепь соединяют с антисмысловой цепью через линкерную молекулу, такую как полинуклеотидный линкер или ненуклеотидный линкер. МикроРНК (миРНК) представляют собой генные продукты в виде малых некодирующих РНК, состоящих примерно из 22 нуклеотидов, которые вызывают деструкцию или подавление трансляции их мРНК-мишеней. Если комплементарность между миРНК и мРНК-мишенью является частичной,- 18024534 то трансляция мРНК-мишени подавляется, а если комплементарность является более полной, то мРНКмишень расщепляется. В случае миРНК комплекс связывается с сайтами-мишенями, обычно локализованными в 3'UTR области мРНК, которая, как правило, имеет лишь частичную гомологию с миРНК."Область затравки", т.е. участок, состоящий примерно из 7 последовательных нуклеотидов на 5'конце миРНК, который осуществляет точное спаривание оснований с ее мишенью, играет основную роль в специфичности миРНК. Связывание комплекса RISC (РНК-индуцируемый комплекс выключения гена)/миРНК с мРНК может приводить либо к подавлению трансляции белка, либо к расщеплению и деградации мРНК. Согласно современным данным расщепление мРНК главным образом происходит, если существует точная гомология по всей длине миРНК и ее мишени, а не только в важной для спаривания оснований ее области затравки (Pillai et al. 2007). Кассеты экспрессии полинуклеотида РНКи могут транскрибироваться в клетке с образованием малых РНК шпилек, которые могут функционировать в качестве миРНК, индивидуальных смысловых и антисмысловых миРНК с линейными цепями или линейных РНК, которые могут функционировать в качестве антисмысловой РНК. Транскрибируемые при участии РНК-полимеразы III ДНК содержат промоторы, выбранные из ряда, включающего: U6-промоторы, H1-промоторы и tPHK-промоторы. Промоторы РНК-полимеразы II включают промоторы U1, U2, U4 и U5, промоторы мяРНК промоторы микроРНК и промоторы мРНК. Перечень известных последовательностей миРНК можно почерпнуть из баз данных, поддерживаемых среди прочего такими исследовательскими организациями, как Wellcome Trust Sanger Institute, PennCenter for Bioinformatics, Memorial Sloan Kettering Cancer Center и European Molecule Biology Laboratory. Данные об эффективности последовательностей миРНК и местах связывания конъюгатов также подробно описаны в соответствующей литературе. РНКи-молекулы легко можно создавать и получать с помощью методик, известных в данной области. Кроме того, существуют компьютерные средства для повышения шанса обнаружения эффективных и специфических участков последовательностей (Pei et al. 2006,Reynolds et al. 2004, Khvorova et al. 2003, Schwarz et al. 2003, Ui-Tei et al. 2004, Heale et al. 2005, Chalk etal. 2004, Amarzguioui et al. 2004). Полинуклеотиды согласно настоящему изобретению можно химически модифицировать. Примерами таких химических модификаций являются, но не ограничиваясь только ими: фосфоротиоатные межнуклеотидные связи, 2'-О-метилрибонуклеотиды, 2'-дезокси-2'-фторрибонуклеотиды, 2'-дезоксирибонуклеотиды, состоящие из "универсальных оснований" нуклеотиды, 5-С-метилнуклеотиды и включение инвертированного остатка рибозы в молекулу ДНК, лишенную азотистого основания. Установлено, что эти химические модификации при их применении в различных полинуклеотидных конструкциях сохраняют активность полинуклеотида в клетках, в то же время повышая стабильность в сыворотке этих соединений. Химически модифицированная миРНК может также снижать до минимально возможного уровня возможность активации интерферонов в организме человека. В одном из вариантов реализации химически модифицированный РНКи-полинуклеотид согласно настоящему изобретению содержит дуплекс, который имеет две цепи, при этом одна или обе цепи могут быть модифицированы, где каждая цепь содержит от примерно 19 до примерно 29 нуклеотидов. В одном из вариантов реализации изобретения РНКи-полинуклеотид согласно настоящему изобретению содержит один или несколько модифицированных нуклеотидов, сохраняя способность опосредовать процесс РНК интерференции внутри клетки или реконструированной системе in vitro. РНКи-полинуклеотид можно модифицировать, при этом химическая модификация затрагивает один или несколько (например, примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более) нуклеотидов. РНКи-полинуклеотид согласно настоящему изобретению может содержать определенный процент модифицированных нуклеотидов относительно общего количества нуклеотидов, присутствующих РНКи-полинуклеотиде. Сам по себе РНКиполинуклеотид согласно настоящему изобретению может в целом содержать модифицированные нуклеотиды примерно в 5-100% нуклеотидных положений (например, в 5%, 10%, 15%, 20%, 25%, 30%,35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% нуклеотидных положений). Фактический процент модифицированных нуклеотидов, присутствующих в данном РНКиполинуклеотиде, зависит от общего количества нуклеотидов, присутствующих в РНКи-полинуклеотиде. Если РНКи-полинуклеотид является одноцепочечным, то процентное содержание модифицированных нуклеотидов можно определять в зависимости от общего количества нуклеотидов, присутствующих в одноцепочечном РНКи-полинуклеотиде. Аналогично этому, если РНКи-полинуклеотид является двухцепочечным, то процентное содержание модифицированных нуклеотидов можно определять в зависимости от общего количества нуклеотидов, присутствующих в смысловой цепи, антисмысловой цепи или и в смысловой, и в антисмысловой цепях. Кроме того, фактический процент модифицированных нуклеотидов, присутствующих в данном РНКи-полинуклеотиде, может зависеть также от общего количества пуриновых и пиримидиновых нуклеотидов, присутствующих в РНКиполинуклеотиде. Например, при этом все пиримидиновые нуклеотиды и/или все пуриновые нуклеотиды,присутствующие в РНКи-полинуклеотиде, могут быть модифицированными. РНКи-полинуклеотид модулирует экспрессию РНК, кодируемую геном. Поскольку множество генов могут иметь определенный уровень гомологии их последовательностей, то РНКи-полинуклеотид можно создавать таким образом, чтобы его мишенью был класс генов, обладающих достаточной гомологией последовательностей. Так, РНКи-полинуклеотид может содержать последовательность, комплементарную последовательностям, которые характерны для различных генов-мишеней, или являются уникальными для специфического гена-мишени. Таким образом, можно создавать РНКи-полинуклеотид,мишенью которого будут консервативные области последовательности РНК, которые имеют гомологию с несколькими генами, тем самым оказывая направленное воздействие на несколько генов в семействах генов (например, различные изоформы гена, полученные в результате сплайсинга варианты, мутантные гены и т.д.). В другом варианте осуществления изобретения РНКи-полинуклеотид можно создавать так,чтобы его мишенью являлась последовательность, которая является уникальной для специфической последовательности РНК индивидуального гена. Понятие комплементарность относится к способности полинуклеотида образовывать водородную(ые) связь(и) с другой полинуклеотидной последовательностью либо согласно традиционному предложенному Уотсоном-Криком типу или согласно другому нетрадиционному типу. Касательно полинуклеотидных молекул, предлагаемых в настоящем изобретении, свободная энергия связывания полинуклеотидной молекулы с ее мишенью (эффекторный сайт связывания) или комплементарнной последовательностью, является достаточной для того, чтобы происходил процессинг соответствующей функции полинуклеотида, например, ферментативное расщепление мРНК или ингибирование трансляции. Определение свободной энергии связывания для молекул нуклеиновых кислот хорошо известно в данной области (Frier и др., 1986, Turner и др., 1987). Процент комплементарности свидетельствует о проценте оснований в состоящей из смежных нуклеотидов цепи в первой полинуклеотидной молекуле, которые могут образовывать водородные связи (например, спаривание оснований согласно модели Уотсона-Крика),со второй полинуклеотидной последовательностью (например, 5, 6, 7, 8, 9, 10 из 10 соответствуют 50%,60%, 70%, 80%, 90% и 100% комплементарности). Полная комплементарность означает, что все основания в состоящей из смежных нуклеотидов цепи полинуклеотидной последовательности связаны с помощью водородной связи с таким же количеством смежных оснований во второй полинуклеотидной последовательности. Под ингибированием, понижающей регуляцией или "выключением" экспрессии гена подразумевают, что экспрессия гена, оцененная по уровню РНК, транскрибированной с гена, или уровню полипептида, белка или субъединицы белка, транслируемого с РНК, понижена по сравнению с тем, когда содержащие блокирующий полинуклеотид конъюгаты согласно настоящему изобретению отсутствуют. Ингибирование, понижающая регуляция или "выключение" экспрессии гена с помощью полинуклеотида, введенного с использованием композиций, предлагаемых в изобретении, предпочтительно являются более низкими по сравнению с уровнем, обнаруженным в присутствии контрольной инактивирующей нуклеиновой кислоты с реорганизованной (скремблированной) последовательностью или инактивирующими ошибочными спариваниями, или в отсутствии конъюгации полинуклеотида с маскирующим полимером. Введение обладающей активностью по отношению к аминам группы В фармакологии и токсикологии способ введения - это путь, по которому лекарственный препарат,жидкость, яд или другое вещество вступает в контакт с телом. В целом, методы введения лекарственных средств и нуклеиновых кислот для лечения млекопитающих хорошо известны и могут быть применены для введения композиции изобретения. Соединения согласно настоящему изобретению могут быть введены с помощью любого подходящего способа, наиболее предпочтительно парентерального, в виде препарата, подготовленного надлежащим образом для этого метода введения. Таким образом, соединения согласно настоящему изобретению могут быть введены путем инъекции, например, внутривенно, внутримышечно, внутрикожно, подкожно или внутрибрюшинно. Соответственно, настоящее изобретение также относится к фармацевтическим композициям, содержащим фармацевтически приемлемый носитель или вспомогательное вещество. Парентеральные пути введения включают внутрисосудистые (внутривенные, внутриартериальные),внутримышечные, внутрипаренхимные, внутрикожные, субдермальные, подкожные, внутриопухолевые,внутрибрюшинные, внутритрахеальные, субдуральные, эпидуральные и внутрилимфатические инъекции, для которых используют шприц и иглы или катетеры. В контексте настоящего описания понятие"внутрисосудистый" означает "находящийся внутри трубчатой структуры, которую называют сосудом,соединенной с тканью или органом в организме". Внутрь полости трубчатой структуры общая жидкая среда организма втекает или вытекает в организм. Примерами общей жидкой среды организма являются кровь, спинномозговая жидкость (СМЖ), лимфатическая жидкость или желчь. Примерами сосудов являются артерии, артериолы, капилляры, венулы, синусоидные капилляры, вены, лимфатические, желчные протоки и протоки слюнных или других экзокринных желез. Внутрисосудистый путь включает введение через кровеносные сосуды, такие как артерия или вена. Кровеносная система обеспечивает системное распространение фармацевтических агентов. Описанные композиции вводятся в фармацевтически приемлемом носителе в виде раствора. Фармацевтически приемлемые относится к тем свойствам и/или субстратам, которые являются приемлемыми для млекопитающих с фармакологической/токсикологической точки зрения. Понятие "фармацевтически приемлемый" относится к свойствам и/или субстанциям, приемлемым для млекопитающего с фарма- 20024534 кологической/токсикологической точки зрения. Фраза "фармацевтически приемлемый" относится к молекулярным субстанциям, композициям и свойствам, которые являются физиологически переносимыми и, как правило, не вызывают аллергическую или другую нежелательную реакцию при введении млекопитающему. Предпочтительно в контексте настоящего описания понятие "фармацевтически приемлемый" относится к субстанции, утвержденной регулирующим агентством Федерального или государственного управления или разрешенной Фармакопеей США или другой принятой фармакопеей для применения на животных и более конкретно на человеке. Конъюгат РНКи полинуклеотида и направляющего фрагмента вводиться совместно с полимером для доставки. Понятие "совместное ведение" означает, что полинуклеотид РНКи и полимер для доставки вводят млекопитающим, при этом они оба находятся в организме млекопитающего в одно и то же время. Конъюгат РНКи полинуклеотида и направляющего фрагмента и полимер для доставки можно вводить одновременно либо они могут доставляться последовательно. При одновременном введении они могут быть смешаны перед введением. При последовательном введении первым может вводиться как конъюгат РНКи полинуклеотида и направляющего фрагмента, так и полимер для доставки. Для конъюгатов РНКи полинуклеотида и гидрофобного направляющего фрагмента, конъюгат РНКи полинуклеотида может вводиться за 30 мин до введения полимера для доставки. Кроме того, для конъюгатов РНКи полинуклеотида и гидрофобного направляющего фрагмента, полимер для доставки может быть введен за два часа до введения конъюгата РНКи полинуклеотида. Для конъюгатов РНКи полинуклеотида и представленного кластером галактозы направляющего фрагмента, конъюгат РНКи может быть введен за 15 мин до введения полимера для доставки. Кроме того, для конъюгатов РНКи полинуклеотида и представленного кластером галактозы направляющего фрагмента, полимер для доставки можно вводить за 15 мин до введения конъюгата РНКи. Терапевтическое действие РНКи полинуклеотиды могут быть доставлены для научных целей или для получения изменения в клетке, которое является терапевтическим, обладающей активностью по отношению к аминам группой доставка полинуклеотидов иРНК является полезным для исследовательских реагентов и для использования в различных целях, включая терапевтические, диагностические цели, подтверждение адресной доставки, исследования генома, в генной инженерии и фармакогеномике. В изобретении предложено введение полинуклеотида, приводящее к ингибированию экспрессии эндогенных генов в гепатоцитах. Уровни экспрессии репортерных (маркерных) генов, определенные после введения полинуклеотида, свидетельствуют о том, что можно ожидать таких же уровней генной экспрессии, которые наблюдаются при введении других полинуклеотидов. Показатель лечения, который обычный специалист в данной области рассматривает, как благоприятный, отличается от заболевания к заболеванию, например, гемофилия А и В связана с дефицитом Х-сцепленных факторов свертывания VIII и IX, соответственно. На их клиническую картину главным образом влияет процентное содержание, относительно уровней в сыворотке здоровых людей, фактора VIII или IX: 2%, серьезная; 2-5%, умеренная; и 5-30%, слабая. Таким образом,повышение содержания фактора с 1% до 2% относительно уровня в кровотоке здорового человека у страдающих серьезной формой гемофилии следует рассматривать как благоприятное воздействие. Уровни, превышающие 6%, предупреждают спонтанное кровотечение, но не те кровотечения, которые являются вторичными, связанными с хирургическим вмешательством или повреждением. Аналогично этому,ингибирование гена не обязательно должно быть 100% для проявления благоприятного действия. Обычный специалист в области генной инженерии может с уверенностью определить благоприятные уровни экспрессии гена, специфического для заболевания, на основании данных о достаточных уровнях маркерного гена. Например, в случае гемофилии, если в результате экспрессии маркерных генов уровень образовавшего белка, сопоставим с 2 об.% относительно уровней фактора VIII у здорового человека, то можно с большой долей уверенности ожидать, что ген, кодирующий фактор VIII, должен экспрессироваться с подобными же уровнями. Таким образом, репортерные или маркерные гены служат в качестве ценных примеров, характеризующих экспрессию внутриклеточных белков в целом. Печень является одним из наиболее важных органов-мишеней для генной терапии, поскольку она играет основную роль в метаболизме (например, метаболизм липопротеинов при различных гиперхолестеринемиях) и секреции белков кровотока (например, факторы свертывающей системы крови при гемофилии). Кроме того, приобретенные нарушения, такие как хронический гепатит и цирроз, являются широко распространенными и их также можно лечить с помощью направленных на печень терапий, основанных на применении полинуклеотидов. Ряд заболеваний или состояний, которые влияют на функции печени или зависят от функционирования печени, потенциально могут лечиться при помощи понижающей регуляции экспрессии гена. Такие заболевания печени и состояния могут быть выбраны из списка включающего: рак печени (включая гепатоцеллюлярную карциному), вирусные инфекции (включая гепатит), метаболические расстройства (включая гиперлипидемию и диабет), фиброз и острое поражение печени. Количество (доза) полимера для доставки и конъюгата РНКи полинуклеотида, который будет вводиться, может быть определено эмпирически. Мы показали, эффективную понижающую регуляцию экспрессии, используя 0,1-10 мг/кг массы тела животного миРНК-конъюгата и 5-60 мг/кг массы тела живот- 21024534 ного полимера для доставки. Предпочтительное количество при использовании у мышей составляет 0,252,5 мг/кг миРНК-конъюгата и 10-40 мг/кг полимера для доставки. Более предпочтительно, вводится примерно 12,5-20 мг/кг полимера для доставки. Количество конъюгата РНКи полинуклеотида легко увеличивается, поскольку он практически нетоксичен в больших дозах. В контексте настоящего изобретения понятие обладающей активностью по отношению к аминам группой относится к процессу, осуществляемому внутри организма, и более конкретно к процессу, осуществляемому в живой ткани целого живого многоклеточного организма (животного), такого как млекопитающее, в отличие от части организма или мертвого организма. Примеры Синтез полимера Пример 1. Нерегулярный сополимер простого поливинилового эфира. А. Мономеры винилового эфира для включения аминсодержащих мономеров. 2-Винилоксиэтилфталимид получали взаимодействием простого 2-хлорэтилвинилового эфира (25 г,0,24 моль, CAS 110-75-8) и фталимида калия (25 г, 0,135 моль, CAS 1074-82-4) при 100 С в ДМФ (75 мл), используя бромид тетра-н-бутиламмония (0,5 г, CAS 1643-19-2) в качестве межфазного катализатора. Этот раствор нагревали в течение 6 ч и затем сливали в воду и фильтровали. Указанный твердый продукт затем перекристаллизовывали дважды из метанола, получая кристаллы белого цвета. Б. Синтез водорастворимых, амфипатических, обладающих активностью по отношению к мембране тройных сополимеров винилового эфира-полиамина.X мол.% несущего защищенный амин винилового эфира (например, 2-винилоксиэтилфталимид) добавляли в высушенную в печи круглодонную колбу в защитном слое азота в безводном дихлорметане. К этому раствору добавляли Y мол.% винилового эфира с низшей гидрофобной группой (например, пропил- или бутил-), а затем необязательно Z мол.% винилового эфира с высшей гидрофобной группой (додецил-, октадецил-) (рисунок 1). Раствор доводили до температуры от -50 до -78 С в бане до выпадения осадка 2-винилоксиэтилфталимида. К этому раствору добавляли 10 мол.% BF3 (ОСН 2 СН 3)2 и давали протекать реакции в течение 2-3 ч при температуре от -50 до -78 С. Реакцию полимеризации прекращали с помощью метанольного раствора гидроксида аммония. Полимер высушивали досуха при пониженном давлении и затем вносили в смесь 1,4-диоксан/метанол (2/1). Добавляли 20 мол. эквивалентов гидразина на фталимид для удаления защитной группы амина. Раствор кипятили с обратным холодильником в течение 3 ч, затем сушили досуха при пониженном давлении. Твердый продукт вносили в 0,5 М HCl, кипятили с обратным холодильником в течение 15 мин для образования хлоридов полимера, затем разводили дистиллированной водой и кипятили с обратным холодильником в течение еще 1 ч. Затем раствор нейтрализовали NaOH, охлаждали до комнатной температуры, переносили в целлюлозное трубчатое устройство для диализа, подвергали диализу в противотоке дистиллированной воды и сушили вымораживанием. Полимер может быть дополнительно очищен при помощи гель-фильтрации или других видов хроматографии. Молекулярную массу полимеров определяли с помощью аналитических колонок для гельфильтрации согласно стандартным процедурам, включая аналитическую гель-фильтрацию и эксклюзионную хроматографии с непрерывным измерением многолучевого рассеяния и показателя преломления(SEC/MALS). В. Синтез DW1360 Тройной сополимер амин/бутил/октадецилполивинилового эфира синтезировали из мономеров 2 винилоксиэтилфталимида (5 г, 23,02 ммоль), бутилвинилового эфира (0,665 г, 6,58 ммоль) и октадецилвинилового эфира (0,488 г, 1,64 ммоль). 2-винилоксиэтилфталимид добавляли в 200 мл высушенную в печи круглодонную колбу, содержащую магнитную мешалку, в защитном слое аргона в 36 мл безводном дихлорметане. Бутилвиниловый эфир и n-октадецилвиниловый эфир были добавлены к этому раствору. Мономеры полностью растворялись при комнатной температуре для получения прозрачного гомогенного раствора. Реакционный сосуд, содержащий прозрачный раствор был помещен в баню при температуре-50 С, которая создавалась добавлением сухого льда к смеси денатурированного спирта ACS класса и этиленгликоля в соотношении 1:1, реакция продолжалась до образования видимого преципитата мономера фталимида. После охлаждения в течение 15 мин для инициации реакции полимеризации был добавлен BF3(OCH2CH3)2 (0,058 г, 0,411 ммоль). Мономер фталимида растворяется после начала полимеризации. Реакцию проводили в течение 3 ч при температуре -50 С. Полимеризации была остановлена путем добавления 5 мл 1% гидроксида аммония в метаноле. Растворитель удаляется на роторном испарителе. После чего полимер растворяли в 30 мл смеси 1,4-диоксан/метанол (2/1). К этому раствору добавляли гидразин (0,44 г, 138 ммоль) и смесь нагревали до температуры дефлегмации в течение 3 ч. Затем растворители удаляли с помощью роторного испарителя, образовавшееся твердое вещество вносили в 20 мл 0,5 М HCl и кипятили с обратным холодильником в течение 15 мин, разводили 20 мл дистиллированной воды и кипятили с обратным холодильником в течение еще 1 ч. Затем этот раствор нейтрализовали с помощью NaOH, охлаждали до КТ, переносили в целлюлозное трубчатое устройство для диализа, отсекающее соединения с молекулярной массой 3500, подвергали диализу в течение 24 ч (220 л) в противотоке дистиллированной воды и лиофилизировали. Несмотря на то, что описаны полимеры, содержащие указанные мономеры винилового эфира, изобретение не ограничивается этими конкретными мономерами. Г. Синтез водорастворимых, амфипатических, обладающих активностью по отношению к мембране тройных сополимеров полиакрилового эфира-полиамина Поли(акриловые) и поли(метилакриловые) гетерополимеры могут быть синтезированы с использованием общей схемы свободно-радикальной реакции (использованный в настоящем описании поли(метакрил)полиамин является представителем семейства поли(акрил)полиаминов) где R представляет независимо водород или метальную группу и X представляет собой концевые группы желаемого мономера, присутствующие в полимере в нужном соотношении. Мономеры, пригодные для синтеза полимеров, включают, но не ограничиваются: ВОСзащищенные аминсодержащие мономеры (М): где n = 1-4 и удаление защитной группы ВОС дает первичный амин. Мономеры с низшей гидрофобной группой (N) где n = 1-5 и один или более атомов углерода могут содержать ненасыщенные связи. Мономеры с высшей гидрофобной группой (О) где n = 8-24 и один или более атомов углерода могут содержать ненасыщенные связи. Используя приведенные выше мономеры, могут быть синтезированы обладающие активностью по отношению к мембране гетерополимеры со следующими композициями: М может быть 50-90 мол.%, N может быть 10-50 мол.%, О может быть 0-10 мол.%. Д. Синтез водорастворимых, амфипатических, обладающих активностью по отношению к мембране тройных сополимеров полиакрилового эфира-полиамина.a, b, d целые числа, выбранные так, что полимер обладает требуемым соотношением мономеров,как описано выше.X мол.% акрилового мономера с защищенными аминогруппами, Y мол.% акрилового мономера с низшей гидрофобной группой, и необязательно Z мол.% акрилового мономера с высшей гидрофобной группой добавляют в реакционную пробирку с мешалкой. Вносится подходящий растворитель (например, ацетонитрил или диоксан), а затем соответствующий катализатор (например, AIBN), реакционную смесь продувают N2. Реакционную пробирку закрывают крышкой, переносят в масляную ванну и нагревают (например, 60 С) в течение времени достаточного для полимеризации (например, 3 ч). Сырой полимер может быть очищен с помощью соответствующих методов, включая, но не ограничиваясь ими,диализ, хроматографию на колонке и преципитацию, до удаления защитных ВОС-групп. Защитные ВОСгруппы удаляют посредством реакции с 2 М HCl в ледяной уксусной кислоте. Удаление защитных ВОСгрупп дает полимерные первичные амины и растворимые в воде обладающие активностью по отношению к мембране поли(акриловые)полиамины. Полимер затем может быть очищен с помощью соответствующих методов, включая диализ, хроматографию на колонке и преципитацию. Синтез (Ant 40911-3 23-28, Ant 40911-35-2). 2,2'-азобис(2-Метилпропионитрил) (ATBN, ДАК, радикальный инициатор), ацетонитрил и диоксан были приобретены у Sigma Aldrich. Акриловые и метакриловые мономеры фильтровали для удаления ингибиторов. 3-(ВОС-амино)1-пропанол (TCI) вступал в реакцию с акрилоилхлоридом (CAS 814-68-6) для производства ВОС-аминопропил акрилата (ВАРА) 2-(2-Аминоэтокси)этанол (21,1 г, 202,9 ммоль) растворяют в 350 мл дихлорметана в 2-л круглодонной колбе, оснащенной мешалкой. В отдельной 1-л колбе ВОС ангидрид (36,6 г, 169,1 ммоль) растворяли в 660 мл дихлорметана. Круглодонная колба объемом 2 л была оснащена капельной воронкой, после чего в колбу добавляли раствор ВОС ангидрида в течение 6 ч. Реакцию оставляли перемешиваться в течение ночи. Продукт промывали, заливая в 2 л делительную воронку по 300 мл таких растворов как 10% лимонная кислота, 10% K2CO3, насыщ. NaHCO3 и насыщ. NaCl. Продукт ВОС-защищенный 2-(2 аминоэтокси)этиловый спирт сушили над Na2SO4, фильтровали и выпаривали DCM с помощью роторного испарителя в высоком вакууме. В 500-мл круглодонную колбу, снабженную мешалкой и продутую аргоном, вносили ВОСзащищенный 2-(2-аминоэтокси)этанол (27,836 г, 135,8 ммоль), после чего добавляли 240 мл безводного дихлорметана. Вносили диизопропилэтиламин (35,5 мл, 203,7 ммоль), и систему помещали в ванну со смесью сухой лед/ацетон. Акрилоилхлорид (12,1 мл, 149,4 ммоль) разбавляли с помощью 10 мл дихлорметана, и добавили по каплям к продутой аргоном системе. Систему оставили в атмосфере аргона охлаждаться до комнатной температуры при постоянном перемешивании в течение ночи. Продукт промывали объемами по 100 мл таких растворов, как dH2O, 10% лимонная кислота, 10% K2CO3, насыщ. NaHCO3 и насыщ. NaCl. Продукт ВОС-аминоэтилэтокси акрилат (ВАЕЕА) сушили над Na2SO4, фильтровали и выпаривали DCM с помощью роторного испарителя. Продукт очищали посредством колоночной хроматографии на 29 см оксида кремния, используя колонку с диаметром 7,5 см. В качестве растворителя использовали 30% этилацетат в гексане. Rf: 0,30. Фракции были собраны и растворитель удаляли с помощью роторного испарителя в высоком вакууме. Выход ВАЕЕА составил 74%. ВАЕЕА хранился в морозильной камере. Полимер 40911-3 23-28: 70% ВАРА 25% бутилметакрилата (CAS 97-88-1), 5% октадецил метакрилата (CAS 4813-57-4), (3% ДАК катализатор) молярное соотношение загрузки (всего 0,0139 моль). ВАРА(9,739 ммоль) (А), бутилметакрилат (3,478 ммоль) (В), и октадецил метакрилат (0,6957 ммоль) (D) добавили в 20-и мл реакционную пробирку оснащенную мешалкой. Внесли ацетонитрил (16 мл), а затем ДАК(0,4174 ммоль). Указанные выше шаги повторялись для того, чтобы иметь две параллельные реакции. Реакционную смесь продували N2 в течение 30 мин. Реакционную пробирку затем закрыли крышкой и перенесли в масляную ванну, где прогревали при 60 С в течение 3 ч. Пробирки удаляли и содержимое объединили. Сырой полимер осаждали в деионизированной воде, после чего он взаимодействовал с чистой трифторуксусной кислотой (40 мл) в течение 1,5 ч для удаления защитных ВОС-групп и производства первичных аминов и растворимых в воде активных по отношению к мембране поли(акрил)полиаминов. К реакции добавляли 200 мл деионизированной H2O (dH2O), раствор переносили в целлюлозное трубчатое устройство для диализа, отсекающее соединения с молекулярной массой 3500,подвергали диализу в противотоке высоких концентраций солей в течение 24 ч, затем в противотоке шенный полимер растворяли в 50% МеОН/100 мМ формата аммония/0.2% муравьиной кислоты до концентрации 25 мг/мл. Три инъекции сырого раствора полимера (250 мг, 10 мл) очищали на S-200 сефакриле, используя колонку ХК 50/30, скорость потока 5,0 мл/мин. Колона была заполнена и использовалась в соответствии с инструкцией производителя (GE Healthcare, инструкции 56-1130-82 А 1, 52-2086-00 АК). Элюирование полимера определяли с помощью рефрактометрического детектора Shimadzu RID- 1 OA. Фракции с 23 мин до 28 мин были собраны и объединены для каждого эксперимента. Растворитель выпаривали и очищенный полимер дважды лиофилизировали. Полимер Ant 40911-35-2: 80% BAEEA, 15% бутилметакрилата, 5% октадецил акрилата, (3% ДАК катализатора) молярное соотношение загрузки (всего 0,013913 моль). ВАЕЕА (А) (11,13 ммоль), бутилметакрилат (В) (2,086 ммоль) и октадецил акрилат (D) (0,6957 ммоль) внесли в 20-и мл реакционную пробирку оснащенную мешалкой. Внесли диоксан (16 мл), а затем ДАК (0,4174 ммоль). Указанные выше шаги повторялись для получения двух протекающих параллельно реакций. Реакционную смесь продували N2 в течение 30 мин. Реакционную пробирку затем закрыли крышкой и перенесли в масляную ванну,где прогревали при 60 С в течение 3 ч. Пробирки удаляли и содержимое объединили. Диоксан выпаривали с помощью роторного испарителя в высоком вакууме, сырой полимер растворяли в растворе 89,8% дихлорметан/10% тетрагидрофуран/0,2% триэтиламин до концентрации 70 мг/мл. Три инъекции сырого раствора полимера (700 мг, 10 мл) очищали с использованием геля дивинилбензола марки Jordin Gel на колонках 104 Ангстрем (внутренний диаметр 22 мм, длина: 500 мм) при скорости потока 5,0 мл/мин. Элюирование полимера определяли с помощью рефрактометрического детектора Shimadzu RID- 1 ОА. Фракции с 15,07 мин до 17,13 мин были собраны и объединены. Растворитель выпаривали при помощи роторного испарителя. Примерно 10 мг полимера растворили в 0,5 мл 89,8% дихлорметана, 10% тетрагидрофурана, 0,2% триэтиламина. Молекулярная масса и полидисперсность (PDI) измерялась с помощью MLSD марки Wyatt Helos II, подключенного к Prominence Shimadzu ВЭЖХ с помощью колонок Jordi 5 7.8300 MixedBed LS DVB. Молекулярный вес составил 172000, PDI=1,26. Очищенный ВОС-защищенный полимер взаимодействовал с чистой трифторуксусной кислотой (7 мл) в течение 1,5 ч (или 2 М HCl в ледяной уксусной кислоте в течение 0,5 ч) для удаления защитных ВОС-групп и производства аминов. К реакции добавляли 40 мл деионизированной H2O (dH2O), раствор переносили в целлюлозное трубчатое устройство для диализа, отсекающее соединения с молекулярной массой 3500, подвергали диализу в противотоке высоких концентраций солей в течение 24 ч, затем в противотоке dH2O течение 18 ч. Содержимое выпаривали досуха, растворяли в 20-30 мл dH2O и дважды лиофилизировали. Раствор полимера хранился при температуре 2-8 С. Число атомов углерода, связывающих амин с основанием полимера, и разветвленность линкера влияют на pKa аминов и стерические эффекты возле аминогруппы. Например, для указанных выше полимеров, pKa этиламина около 8,1, pKa пропиламина около 9,3 и pKa пентиламина около 10,2. pKa амина или стерические эффекты возле аминогруппы влияют на подвижность маскирующих групп, присоединенных к амину. В случае обратимого присоединения малеинового ангидрида к амину более высокое значение pKa амина даст в результате более медленное высвобождение ангидрида из аминов. Кроме того, повышение пространственного затруднения возле амина, например с помощью изопропилового линкера, может увеличить pK амина. Полимер Lau 41305-38-17-19: 80% ВАРА, 20% этилметакрилат (CAS 97-63-2), (3% ДАК катализатор) молярное соотношение загрузки (всего 0,0105 моль). ВАРА (А) (8,40 ммоль) и этилметакрилат (В)(2,10 ммоль) вносят в реакционную пробирку объемом 15 мл и оснащенную мешалкой. Вносят ацетонитрил (11,5 мл) с последующим добавлением ДАК (0,315 ммоль). Указанные выше шаги повторялись для получения двух протекающих параллельно реакций. Реакционную смесь продували N2 в течение 30 мин. Реакционную пробирку затем закрыли крышкой и перенесли в масляную ванну, где прогревали при 60 С в течение 3 ч. Пробирки были удалены и содержимое объединили. Ацетонитрил выпаривали на роторном испарителе в высоком вакууме, затем сырой полимер растворяли в растворе, содержащем 74,8% дихлорметана/25% тетрагидрофурана/0.2% триэтиламина до концентрации 50 мг/мл. Три инъекции раствора сырого полимера (500 мг, 10 мл) очищали на гелевых колонках 104 А марки Jordi, заполненных фторированным дивинилбензолом (внутренний диаметр 22 мм, длина: 500 мм) при скорости потока 5,0 мл/мин. Элюцию полимера определяли с помощью рефрактометрического детектора ShimadzuRID- 1 ОА. Фракции с 17,16 мин до 19,18 мин были собраны и объединены. Растворитель выпаривали при помощи роторного испарителя. Очищенный ВОС-защищенный полимер реагировал с 2 М HCl в ледяной уксусной кислоте (7 мл) в течение 1,5 ч для удаления защитных ВОС-групп и получения аминов. К реакции добавили 40 мл dH2O, раствор переносили в целлюлозное трубчатое устройство для диализа,отсекающее соединения с молекулярной массой 3500, подвергали диализу в противотоке высоких концентраций солей в течение 24 ч, затем в противотоке dH2O течение 18 ч. Содержимое выпаривали досуха, растворяли в 30 мл dH2O и дважды лиофилизировали. Е. Как ожидается, аналогичные полимеры, синтезированные из (защищенных) аминовых мономеров, мономеров с низшими гидрофобными группами и высшими гидрофобными октадециловыми группами, также будут эффективным в практике описанного изобретения. Характеристика полимеров Пример 2. Характеристика DW1360.(ех=350 нм; em=452 нм) повышалась в гидрофобной среде. Этот флуорофор применяли для анализа полимера DW1360. 0,5 мкМ (конечная концентрация) DPH добавляли к 10 мкг DW1360 в 0,5 мл 50 мМHEPES-буфера, рН 8,0. Затем в растворе оценивали накопление DPH в гидрофобной среде путем определения флуоресценции DPH. Повышение флуоресценции DPH в присутствии конъюгатов свидетельствует об образовании гидрофобной среды с помощью полимера. Б. Молекулярная масса. Молекулярный вес (массу) полимера DW1360 определяли серийно с помощью жидкостного хроматографа с детектором по светорассеянию (Wyatt Technology DAWN HELEOS II(MALS)/OptiLab rEX). Полимер растворяли в соответствующем растворителе для получения серии концентраций, которые загружали в систему Wyatt. При помощи программного обеспечения Astra рассчитывали изменение показателя светорассеяния в зависимости от концентрации (DN/DC), на основании рассчитанных значений была построена диаграмма Цимма для определения молекулярного веса. Средний молекулярный вес очищенного DW1360 составлял 4000-6000 Да. Средний молекулярный вес очищенных полимеров акрилата составлял примерно 100-120 кДа.B. Определение размера частиц и зета-потенциала. Зета-потенциал полимеров измеряли с помощью устройства Malvern Zetasizer nano series (Nano ZS). Зета-потенциал CDM-маскированных полимеров изменяется в диапазоне от 0 до -30 мВ и более преимущественно в диапазоне от 0 до -20 мВ. Зета потенциал измеряется в растворе изотонической глюкозы, забуферной до рН 8 остаточными количествамиHEPES. Можно ожидать, что при рН 7 конъюгаты приобретут определенный положительный заряд в результате протонирования части аминов. Г. Определение количества аминогрупп в конъюгате после модификации CDM-реагентом. DW1360 полимер был синтезирован как описано выше, с последующей обработкой 14 эквивалентов массы(мас.экв.) основания HEPES и 7 мас.экв. смеси CDM-NAG и CDM-PEG в весовом соотношении 2:1 (в среднем 11 единиц). Через час содержание аминов в полимере, обработанном производным малеинового ангидрида, определяли при помощи обработки тринитробензоловой кислотой (TNBS) в 100 мМ NaHCO3. Было установлено, что количество модифицированных аминов составляет примерно 75% от общего числа групп конъюгата по сравнению с конъюгатом, который не подвергался малеаматной модификации. Степень модификации может изменяться путем добавления другого количества малеинового ангидрида или изменения условий проведения реакции. Д. Лизис липосом. 10 мг фосфатидилхолина куриного яйца гидрировали с помощью 1 мл буфера,содержащего 100 мМ карбоксифлуоресцеина (CF) и 10 мМ HEPES, рН 7,5. Затем липосомы экструдировали через поликарбонатные фильтры с размером пор 100 нм (фирма Nucleopore, Плезантон, шт. Калифорния) Несвязанный CF удаляли с помощью гель-фильтрации на сефарозе 4 В-200, осуществляя элюцию 10 мМ HEPES, рН 8, 0,1 М NaCl. Аликвоты по 200 мкл загруженных CF липосом добавляли в 1,8 мл изотоничного буфера. Флуоресценцию (ex=488, em=540) определяли через 30 мин после добавления 0,25 мкг полимеров в суспензии везикул. В конце каждого эксперимента везикулы разрушали, добавляя 40 мкл 1%-ного раствора Тритон Х-100 для определения максимального лизиса. Маскирующие полимер агенты Пример 3. Маскирующие агенты. А. Синтез предшественника маскирующего агента 2-пропионово-3-метилмалеинового ангидридаCDM). К суспензии гидрида натрия (0,58 г, 25 ммоль) в 50 мл безводного тетрагидрофурана добавляли триэтил-2-фосфорнопропионат (7,1 г, 30 ммоль). После прекращения выделения газообразного водорода добавляли диметил-2-оксоглутарат (3,5 г, 20 ммоль) в 10 мл безводного тетрагидрофурана и перемешивали в течение 30 мин. Затем добавляли 10 мл воды и тетрагидрофуран удаляли с помощью роторного испарителя. Образовавшуюся смесь твердого вещества и воды экстрагировали 350 мл этилового эфира. Эфирные экстракты объединяли, сушили над сульфатом магния и концентрировали, получая масло светло желтого цвета. Масло очищали гель-фильтрацией на силикагеле, используя для элюции смесь 2:1 простой эфир: гексан, в результате чего получали 4 г (выход 82%) чистого сложного триэфира. Затем получали 2-пропионово-3-метилмалеиновый ангидрид в результате растворения этого сложного триэфира в 50 мл смеси 50/50 воды и этанола, содержащей 4,5 г (5 экв.) гидроксида калия. Этот раствор нагревали до температуры дефлегмации в течение 1 ч. Затем этанол удаляли с помощью роторного испарителя и рас- 26024534 твор подкисляли до рН 2 с помощью соляной кислоты. Этот водный раствор затем экстрагировали 200 мл этилацетата, выделяли, сушили над сульфатом магния и концентрировали с получением твердого вещества белого цвета. Затем это твердое вещество перекристаллизовывали из дихлорметана и гексана,получая 2 г (выход 80%) 2-пропионово-3-метилмалеинового ангидрида. Тиоэфиры, эфиры и амиды можно синтезировать на основе CDM путем превращения CDM в хлорангидрид с помощью оксалилхлорида с последующим добавлением тиола, эфира или амина и пиридина.CDM и его производные можно легко модифицировать с помощью стандартных методов, известных в данной области, добавляя обеспечивающие направленную доставку лиганды, стабилизаторы стерической конфигурации, заряженные группы и другие реактивные группы. Образовавшиеся молекулы можно применять для обратимой модификации аминов. Маскирующие агенты были синтезированы путем модификации CDM для получения предпочтительно заряженных нейтральных агентов где R1 представляет собой лиганд, обеспечивающий направленную доставку к ASGPr, или стабилизатор стерической конфигурации (например, ПЭГ). Б. Маскирующий агент, содержащий группу, обеспечивающую направленную доставку к ASGPr. Наиболее хорошо изученные группы, которые обеспечивают направленную доставку к гепатоцитам, содержат остаток галактозы, которая связывается с экспрессированным на поверхности гепатоцитов асиалогликопротеиновым рецептором. Было показано, что присоединение галактозы или производного галактозы облегчает направленную доставку к гепатоцитам нескольких хорошо растворимых в воде незаряженных полимеров, включая: олигосахарид хитозан, производное полистирола и полиакриламид НРМА. Группы, обеспечивающие направленную доставку к ASGPr, легко получают с использованием лактозы, дисахарид галактоза-глюкоза, через модификацию остатка глюкозы. Лактобионовая кислота(LBA, производное лактозы, в котором глюкоза окислена до глюконовой кислоты) легко встраивается в производное малеинового ангидрида с использованием стандартных методов амидного связывания. В. Синтез стабилизатора стерической конфигурации CDM-ПЭГ и обеспечивающей направленную доставку группы CDM-NAG (N-ацетилгалактозамин). К раствору CDM (300 мг, 0,16 ммоль) в 50 мл метиленхлорида добавляли оксалилхлорид (2 г, 10 мас. экв.) и диметилформамид (5 мкл). Реакции давали протекать в течение ночи, после чего избыток оксалилхлорида и метиленхлорида удаляли с помощью роторного испарителя, получая хлорангидридCDM. Хлорангидрид растворяли в 1 мл метиленхлорида. К этому раствору добавляли 1,1 молярного эквивалента монометилового эфира полиэтиленгликоля (средний молекулярный вес 450) для CDM-ПЭГ или (аминоэтокси)этокси-2-(ацетиламино)-2-дезоксиD-глюкопиранозида (т.е. аминобисэтоксилэтилNAG) для CDM-NAG, и пиридин (200 мкл, 1,5 экв.) в 10 мл метиленхлорида. Затем раствор перемешивали в течение 1,5 ч. Затем растворитель удаляли, образовавшееся твердое вещество растворяли в 5 мл воды и очищали с помощью ВЭЖХ с обращенной фазой, используя градиент 0,1% ТФК в смеси вода/ацетонитрил. Предпочтительно содержащий от 5 до 20 этиленовых мономеров ПЭГ присоединяется к двузамещенному малеиновому ангидриду. Более предпочтительно содержащий 10-14 этиленовых мономеров ПЭГ присоединяется к двузамещенному малеиновому ангидриду. ПЭГ может быть переменной длины и иметь среднюю длину 5-20 или 10-14 этиленовых мономеров. Кроме того, ПЭГ может быть монодисперсным, однородным или дискретным, и содержать, например, ровно 11 или 13 этиленовых мономеров. Как показано выше, ПЭГ-спейсер может быть расположен между ангидридом и группой, обеспечивающей направленную доставку к ASGPr. Предпочтительный ПЭГ-спейсер содержит 1-10 этиленовых мономеров. Обратимая модификация полимера Пример 4. Обратимая модификация/маскировка обладающего активностью по отношению к мембране полиамина, то есть модификация обладающего активностью по отношению к мембране полиамина с помощью CDM-NAG или смеси CDM-NAG плюс CDM-ПЭГ. К раствору х мг обладающего активностью по отношению к мембране полиамина (например, описанного выше DW1360) в изотоническом растворе глюкозы добавили 14 мг свободного основания HEPES с последующим внесением 7 мг CDMNAG или смеси 2,3 мгCDM-NAG + 4,6 мг CDM-ПЭГ, в общей сложности 7 двузамещенный маскирующий малеиновый ангидрид. Перед введением животному раствор выдерживали в течение не менее 30 мин при комнатной температуре. Реакция CDM-NAG или CDM-ПЭГ с полиамином приводит к образованию где R представляет собой полимер, R1 представляет собой фрагмент, обеспечивающий направленную доставку к ASGPr, или стабилизатор стерической конфигурации. Карбоксил ангидрида, образовавшийся в результате реакции между ангидридом и полиамином, несет 1/20 от предполагаемого поверхностного заряда (Rozema et al. Bioconjugate Chemistry 2003). Таким образом, происходит скорее эффективная нейтрализация обладающего активностью по отношению к мембране полимера, чем превращение в полианион, несущий большой отрицательный заряд. миРНК-конъюгат Пример 5. Конъюгат полинуклеотид иРНК-обеспечивающий направленную доставку фрагмент. А. Конъюгат миРНК-гидрофобный фрагмент. Различные гидрофобные группы ковалентно связывались с 3 'или 5' концом молекул миРНК с использованием стандартных методов в этой области. Б. Конъюгат миРНК-N-ацетилгалактозаминовый кластер. N-ацетилгалактозаминовый кластер синтезировался путем присоединения трех групп N-ацетилгалактозами-ПЭГ 3 к аминам на точке ветвления,содержащей 2 лизиновых остатка. Карбоксильная группа на дилизине затем становится доступной для ковалентного присоединения к полинуклеотидов иРНК, такому как миРНК. Направленная доставка миРНК in vivo Пример 6. Введение полинуклеотидов иРНК in vivo, а также направленная доставка в гепатоциты. Создавали конъюгат полинуклеотида иРНК и маскированного полимера согласно описанному выше методу. Мыши в возрасте от шести до восьми недель (линия C57BL/6 или ICR, -18-20 г каждое животное) были получены от Harlan Sprague Dawley (штат Индианаполис, США). Мыши были получены и размещены по меньшей мере за 2 дня до инъекции. Животные имели неограниченный доступ к корму HarlanTeklad Rodent Diet (Харлан, Мэдисон, штат Висконсин, США). Конъюгаты полинуклеотидов иРНК и маскированные полимеры были синтезированы согласно описанному выше методу. Мышам вводили 0,2 мл раствора полимера для доставки и 0,2 мл конъюгата миРНК в хвостовую вену. Для одновременного введения полимера и миРНК, миРНК-конъюгат был добавлен к модифицированному полимеру перед инъекцией, после чего мышам вводили общий объем 0,4 мл. Композиция была растворимой и не образовывала агрегатов в физиологических условиях. Для инъекций, в которых полимер и миРНК вводят отдельно, полимер вводили в 0,2 мл раствора для приготовления композиции, миРНК вводили в 0,2 мл изотонического раствора глюкозы. Растворы вводили путем инфузии в хвостовую вену. Инъекции в другие сосуды, например ретроорбитальная инъекция, были одинаково эффективны. Определение сывороточных уровней ароВ. Мыши не получали пищи в течение 4 ч (16 ч для крыс) перед отбором проб сыворотки из подчелюстных сосудов. Сывороточные уровни ароВ белка определялись при помощи стандартного метода сэндвич-ELISA. Вкратце, поликлональные козьи антитела к мышиным антителам против ароВ и кроличьи антитела к мышиным антителам против ароВ (Biodesign International) были использованы для захвата и обнаружения антител мышей соответственно. Затем для связывания комплекса ароВ/антитело были добавлены HRP-конъюгированные антитела козы к IgG кролика (Sigma). Поглощение хромогена тетраметилбензидина (ТМВ, Sigma) измеряли колориметрическим методом при помощи планшетного ридера Tecan Safire2 (Австрия, Европа) при длине волны 450 нм. Измерение активности плазменного фактора VII (F7). Образцы плазмы мышей были подготовлены путем сбора крови (9 объемов) из подчелюстных сосудов в микроцентрифужные пробирки, содержащие 0,109 моль/л антикоагулянта цитрата натрия (1 объем) в соответствии со стандартными методиками. Активность F7 в плазме крови измеряется хромогенным методом с помощью набора для количественного определения BIOPHEN VII (Hyphen BioMed/Aniara, Мейсон, штат Огайо, США) в соответствии с рекомендациями производителя. Поглощение окрашенного комплекса измеряется колориметрическим методом при помощи планшетного ридера Tecan Safire2 (Австрия, Европа) при длине волны 450 нм. Пример 7. Направленную доставку миРНК в гепатоциты in vivo при помощи одновременного введения конъюгата миРНК-гидрофобный фрагмент с замаскированным полимером для доставки DW1360. миРНК и полимер для доставки были синтезированы и введены согласно описанным выше методам с использованием указанных доз миРНК и полимера. А. Направленную доставку полинуклеотида РНКи в гепатоциты in vivo. Одновременное введение конъюгата миРНК-холестерин и маскированного полимера для доставки DW1360 привело к снижению сывороточных уровней белка ароВ, что указывает на направленную доставку миРНК в гепатоциты и ингибирование экспрессии гена ароВ. Для эффективной направленной доставки полимер для доставки и холестерин должны быть конъюгированы с полинуклеотидом иРНК (табл. 1, рис. 2). При использовании 5 мг/кг неконъюгированной миРНК не наблюдалось значительного ингибирования экспрессии гена. Кроме того, гидрофобная группа может быть присоединена к 5' или 3' концу миРНК. Таблица 1. Ингибирование экспрессии представляющего интерес гена in vivo после введения конъюгата миРНК-гидрофобный фрагмент плюс полимер для доставки DW1360, эффект дозы миРНК-конъюгата Процент ингибирования гена по отношению к контрольной группе (n=3), которой вводили изотонический раствор глюкозы. В. Влияние размера гидрофобной группы на доставку полинуклеотида иРНК в гепатоциты. Для эффективной доставки миРНК в гепатоциты при совместном введении с полимером для дос- 29
МПК / Метки
МПК: A61K 48/00, C12N 15/11, C12N 15/87, A61K 47/18, A61K 31/713
Метки: получения, композиции, система, мирнк, интерферирующих, малых, направленной, композиция, доставки, конъюгированная, рнк, способ
Код ссылки
<a href="https://eas.patents.su/30-24534-konyugirovannaya-sistema-dostavki-i-kompoziciya-dlya-napravlennojj-dostavki-malyh-interferiruyushhih-rnk-mirnk-i-sposob-polucheniya-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Конъюгированная система доставки и композиция для направленной доставки малых интерферирующих рнк (мирнк) и способ получения композиции</a>
Предыдущий патент: Формы солей кислот конъюгатов полимер-лекарственное средство
Следующий патент: Устройство и способ для определения оседания в текучих средах












