Вектор гена
Номер патента: 23938
Опубликовано: 29.07.2016
Авторы: Нальдини Луиджи, Биффи Алессандра, Гентнер Бернхард Рудольф
Формула / Реферат
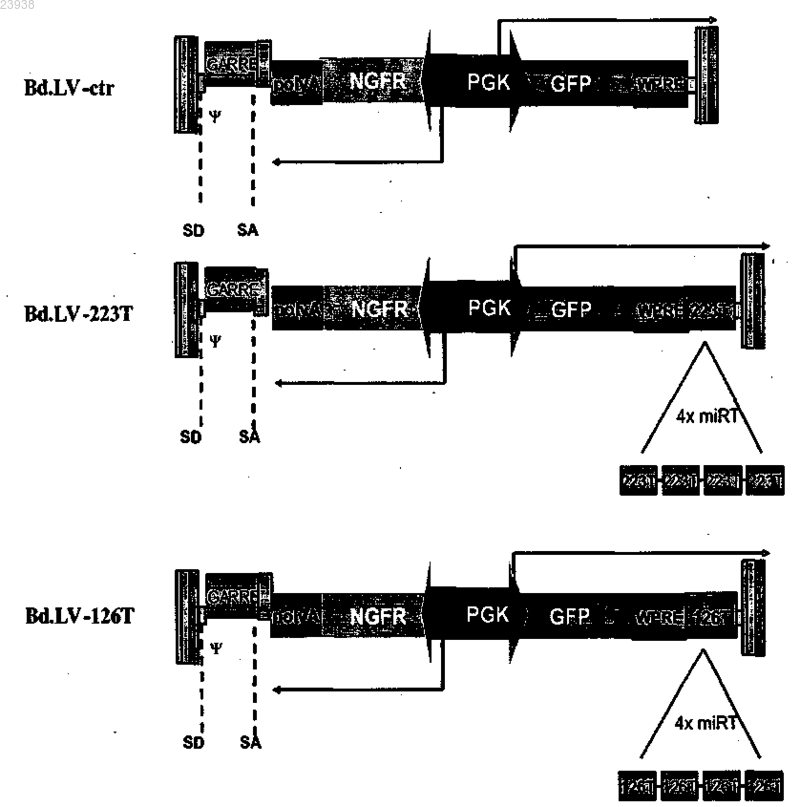
1. Вектор гена, пригодный для использования в генной терапии и содержащий по меньшей мере одну последовательность мишени микроРНК, функционально связанную с нуклеотидной последовательностью, причем последовательность мишени микроРНК является наводимой микроРНК, выбранной из группы, включающей miR-130a и miR-126.
2. Вектор по п.1, содержащий по меньшей мере одну последовательность мишени микроРНК, наводимую miR-130a, и по меньшей мере одну последовательность мишени, наводимую miR-126.
3. Вектор по п.2, где число копий последовательности мишени микроРНК, наводимой miR-130a, составляет двойное число копий последовательности мишени микроРНК, наводимой miR-126.
4. Вектор по любому из предшествующих пунктов, где нуклеотидная последовательность контролирует экспрессию вектора.
5. Вектор по п.1 или 2, где нуклеотидная последовательность представляет собой трансген.
6. Вектор по любому из предшествующих пунктов, где вектор является вирусным вектором.
7. Вектор по любому из предшествующих пунктов, где вектор получается из лентивирусов.
8. Вектор по любому из предшествующих пунктов, где вектор содержит тканеспецифический промотор.
9. Вектор по п.8, где тканеспецифический промотор выбирают из группы, включающей CD11b, c-Fes и CYBB и TEK.
10. Вектор по п.9, где тканеспецифический промотор является миелоидным специфическим промотором, таким как TEK.
11. Вектор по любому из предшествующих пунктов, где трансген кодирует фермент.
12. Вектор по п.11, где фермент выбирают из группы, включающей лизосомальные ферменты галактоцереброзидазы, gp91 phox и интерферон-альфа.
13. Набор ДНК-конструктов, пригодный для получения частицы вирусного вектора, содержащий ДНК-конструкт, кодирующий геном вирусного вектора, включающий по меньшей мере одну последовательность мишени микроРНК, как определено в любом из пп.1-4, и, при необходимости, трансген.
14. Способ получения частицы вирусного вектора, включающий введение набора ДНК-конструктов по п.13 в клетку-хозяин и получение частицы вирусного вектора.
15. Способ по п.14, в котором клетка-хозяин содержит микроРНК, которая наводима на последовательность мишени микроРНК, как определено в любом из пп.1-4.
16. Частица вирусного вектора, полученная способом по п.14 или 15.
17. Фармацевтическая композиция, содержащая вектор по любому из пп.1-12 или частицу по п.16.
18. Клетка, инфицированная или трансдуцированная вектором по любому из пп.1-12 или частицей по п.16.
19. Клетка по п.18, которая представляет собой гематопоэтическую стволовую клетку или гематопоэтическую клетку-предшественник.
20. Набор по меньшей мере из двух различных последовательностей мишени микроРНК, причем последовательности мишени микроРНК являются наводимыми микроРНК, выбранными из группы, включающей miR-130a и miR-126.
21. Набор по п.20, в котором последовательности мишени микроРНК предназначены для одновременного, раздельного или последовательного применения.
22. Вектор по любому из пп.1-12, пригодный для предотвращения или уменьшения экспрессии трансгена в гематопоэтической стволовой клетке или гематопоэтической клетке-предшественнике.
23. Частица по п.16, пригодная для предотвращения или уменьшения экспрессии трансгена в гематопоэтической стволовой клетке или гематопоэтической клетке-предшественнике.
24. Клетка по п.18 или 19, пригодная для предотвращения или уменьшения экспрессии трансгена в гематопоэтической стволовой клетке или гематопоэтической клетке-предшественнике.
25. Набор по п.20 или 21, пригодный для предотвращения или уменьшения экспрессии трансгена в гематопоэтической стволовой клетке или гематопоэтической клетке-предшественнике.
26. Вектор по любому из пп.1-12, пригодный для лечения заболевания, выбранного из глобоидной клеточной лейкодистрофии, хронической гранулематозной болезни, тяжелого комбинированного иммунодефицита (ТКИН) и солидных опухолей.
27. Частица по п.16, пригодная для лечения заболевания, выбранного из глобоидной клеточной лейкодистрофии, хронической гранулематозной болезни, тяжелого комбинированного иммунодефицита (ТКИН) и солидных опухолей.
28. Клетка по п.18 или 19, пригодная для лечения заболевания, выбранного из глобоидной клеточной лейкодистрофии, хронической гранулематозной болезни, тяжелого комбинированного иммунодефицита (ТКИН) и солидных опухолей.
29. Набор по п.20 или 21, пригодный для лечения заболевания, выбранного из глобоидной клеточной лейкодистрофии, хронической гранулематозной болезни, тяжелого комбинированного иммунодефицита (ТКИН) и солидных опухолей.
30. Вектор по любому из пп.1-12, пригодный для увеличения шансов на выживание гематопоэтической стволовой клетки или гематопоэтической клетки-предшественника относительно генной терапии.
31. Частица по п.16, пригодная для увеличения шансов на выживание гематопоэтической стволовой клетки или гематопоэтической клетки-предшественника относительно генной терапии.
32. Клетка по п.18 или 19, пригодная для увеличения шансов на выживание гематопоэтической стволовой клетки или гематопоэтической клетки-предшественника относительно генной терапии.
33. Набор по п.20 или 21, пригодный для увеличения шансов на выживание гематопоэтической стволовой клетки или гематопоэтической клетки-предшественника относительно генной терапии.
34. Вектор по любому из пп.1-12, пригодный для повышения безопасности и/или эффективности генной терапии.
35. Частица по п.16, пригодная для повышения безопасности и/или эффективности генной терапии.
36. Клетка по п.18 или 19, пригодная для повышения безопасности и/или эффективности генной терапии.
37. Набор по п.20 или 21, пригодный для повышения безопасности и/или эффективности генной терапии.
38. Вектор по любому из пп.1-12, пригодный для предотвращения апоптоза гематопоэтической стволовой клетки или гематопоэтической клетки-предшественника, при этом апоптоз вызван экспрессией трансгена.
39. Частица по п.16, пригодная для предотвращения апоптоза гематопоэтической стволовой клетки или гематопоэтической клетки-предшественника, при этом апоптоз вызван экспрессией трансгена.
40. Клетка по п.18 или 19, пригодная для предотвращения апоптоза гематопоэтической стволовой клетки или гематопоэтической клетки-предшественника, при этом апоптоз вызван экспрессией трансгена.
41. Набор по п.20 или 21, пригодный для предотвращения апоптоза гематопоэтической стволовой клетки или гематопоэтической клетки-предшественника, при этом апоптоз вызван экспрессией трансгена.
42. Вектор по любому из пп.1-12, пригодный для мониторинга стадии дифференциации гематопоэтической стволовой клетки или гематопоэтической клетки-предшественника.
43. Частица по п.16, пригодная для мониторинга стадии дифференциации гематопоэтической стволовой клетки или гематопоэтической клетки-предшественника.
44. Клетка по п.18 или 19, пригодная для мониторинга стадии дифференциации гематопоэтической стволовой клетки или гематопоэтической клетки-предшественника.
45. Набор по п.20 или 21, пригодный для мониторинга стадии дифференциации гематопоэтической стволовой клетки или гематопоэтической клетки-предшественника.
46. Применение вектора по любому из пп.22, 26, 30, 34, 38 или 42 в гематопоэтической стволовой клеточной терапии.
47. Применение последовательности мишени микроРНК, причем последовательность мишени микроРНК является наводимой микроРНК, выбранной из группы miR-130a и miR-126, для производства лекарственного средства для использования в генной терапии.
48. Применение последовательности мишени микроРНК, причем последовательность мишени микроРНК является наводимой микроРНК, выбранной из группы miR-130a и miR-126, в генной терапии.
49. Способ определения степени дифференциации гематопоэтической стволовой клетки или гематопоэтической клетки-предшественника, включая определение уровня экспрессии микроРНК в клетке, причем микроРНК наводима на последовательность мишени микроРНК, функционально связанную с последовательностью нуклеотидов, причем микроРНК предотвращает или уменьшает экспрессию нуклеотидной последовательности в гематопоэтической клетке-предшественнике или гематопоэтической стволовой клетке, но не в дифференцированной клетке.
50. Способ определения степени дифференциации гематопоэтической стволовой клетки или гематопоэтической клетки-предшественника, включая определение уровня экспрессии по меньшей мере двух различных микроРНК в клетке, причем микроРНК наводимы на последовательности мишени микроРНК, функционально связанные с последовательностями нуклеотидов, причем микроРНК предотвращают или уменьшают экспрессию нуклеотидных последовательностей в гематопоэтической клетке-предшественнике или гематопоэтической стволовой клетке, но не в дифференцированной клетке, и сравнение уровня экспрессии различных микроРНК.
51. Способ определения степени дифференциации гематопоэтической стволовой клетки или гематопоэтической клетки-предшественника, включая определение уровня экспрессии трансгена в указанных гематопоэтической стволовой клетке или гематопоэтической клетке-предшественнике, причем трансген функционально связан с последовательностью мишени микроРНК, причем микроРНК наводима на последовательность мишени микроРНК и предотвращает или уменьшает выраженность трансгена в гематопоэтической клетке-предшественнике (ГКП) или гематопоэтической стволовой клетке (ГСК), но не дифференцированной клетке.
52. Способ по одному из пп.50, 51, в котором микроРНК выбирают из группы, включающей miR-130a и miR-126.
Текст
Изобретение относится к вектору гена для использования в генной терапии, содержащему по меньшей мере одну мишень последовательности микроРНК, функционально связанную с нуклеотидной последовательностью, имеющей соответствующую микроРНК в гематопоэтической клетке-предшественнике (ГКП) или гематопоэтической стволовой клетке (ГСК), которые предотвращают или уменьшают экспрессию нуклеотидной последовательности в URG или ГСК,но не в дифференцированной клетке.(71)(73) Заявитель и патентовладелец: ОСПЕДАЛЕ САН РАФАЭЛЛЕ С.Р.Л.; ФОНДАЦИОНЕ ТЕЛЕТОН (IT) Область изобретения Настоящее изобретение касается векторов гена, используемых при переносе генов и терапевтических применениях, а также способов их получения и их применения. Предпосылки создания изобретения Трансплантация гематопоэтических клеток (ТГК) от здоровых доноров представляет собой лечебную терапию для некоторых наследственных и приобретенных заболеваний. Тем не менее, пересадка ограничена недостаточным наличием соответствующих доноров и смертностью, связанной с аллогенной процедурой (в основном связанной с реакцией "трансплантант против хозяина" - РТПХ). ТГК имеет очень низкую эффективность в некоторых расстройствах, таких как лизосомальные болезни накопления(ЛБН). В целях повышения безопасности и эффективности аллогенной трансплантации и определения альтернативных протоколов для пациентов, не имеющих подходящего донора, подход генной терапии основан на пересадке исправленного гена, требуется собственная гематопоэтическая стволовая клетка(ГСК). В качестве альтернативы аллогенной трансплантации гематопоэтических клеток наследственный генетический дефект может быть исправлен в собственных гематопоэтических клетках пациента путем генной терапии. Тем не менее, доставка функциональной копии соответствующего гена во все пораженные клетки тела очень затруднительна. Концепция генной терапии стволовых клеток основана на генетической модификации относительно небольшого количества стволовых клеток, которые остаются долго в организме в результате процесса самообновления, а также генерирования огромного количества генетически исправленного потомства, тем самым обеспечивая непрерывную поставку исправленных клеток для остальной жизни пациента. Гематопоэтические стволовые клетки представляют собой отличную мишень-популяцию для генной терапии, поскольку они могут быть легко и безопасно получены из костного мозга (КМ) либо мобилизованной периферической крови. Изолированная ГСК может быть генетически модифицирована и возвращена пациенту в качестве собственного трансплантата. Долгосрочная польза требует пересадки достаточно большого количества генномодифицированных ГСК, которые могут населить условный костный мозг, что приводит к увеличению роста клеток крови всех кроветворных линий. Собственные аллогенные ГСК делают процедуру пересадки доступной всем пациентам и позволяют избежать иммунологических проблем с совместимостью, ведущих к РТПХ. Кроме того, некоторые болезни, такие как первичные признаки иммунодефицита, требуют коррекции части кроветворных стволовых клеток и их потомства. Интенсивность режима кондиционирования (так называемого "немиелоаблативного" или "мини" режима кондиционирования) уменьшается, что приводит к лучшей переносимости и меньшим количествам побочных эффектов для пациентов. Сниженный режим кондиционирования менее совместим со стандартной аллогенной трансплантацией, потому что смешанный химеризм доноров, как правило, неустойчив в аллогенной настройке из-за иммунологического противоборства с принимающими иммунными клетками реципиента. Эффективная долгосрочная генная модификация ГСК и их потомства требует технологии, которая позволяет стабильную интеграцию корректирующей ДНК в геном, не затрагивая функции ГСК. Наиболее эффективной системой доставки являются векторы вируса. Например, перенос генов и экспрессия в гематопоэтическую клетку-предшественник (ГКП) из лизосомального фермента галактоцереброзидазы (при отсутствии глобоидной лейкодистрофии - ГЛД - или болезни Краббе) вызывает апоптоз и функциональные нарушения трансдуцированных клеток, предотвращая развитие ГКП, основанных на подходах генной терапии для лечения расстройств (см. ниже). Таким образом, будущие кассеты экспрессии, используемые в генной терапии должны напоминать физиологические модели экспрессии и избегать внематочной и/или нефизиологической экспрессии трансгена,что может привести к токсичности, удалению или даже злокачественной трансформации трансдуцированных клеток. Это особенно важно для стволовых клеток, ключевая клетка-мишень гарантирует долгосрочную эффективность генной терапии, биология которой не должна быть нарушена генетическим вмешательством. Подводя итог, текущие гематопоэтические стратегии генной терапии требуют трансдукции ГСК,чтобы гарантировать долгосрочную коррекцию кроветворной системы, но они могут принести значительную пользу от регулируемой экспрессии трансгенных кассет, которые не выражают эктопически трансгенные продукты в ГСК, но "включают" только в дифференцированное потомство, которые является целью для генетических заболеваний, например, лимфоцитов в ТКИН (тяжлой комбинированной иммунной недостаточности), гранулоцитов в ХГБ (хроническая гранулематозная болезнь) и моноцитов/макрофагов в ГЛД. Одним из способов достижения этого является использование линии конкретных транскрипционных контрольных элементов, например эндогенных промоторов локуса, которые приводят к экспрессии терапевтического гена в векторе. Однако промоторы часто распространяются через большие расстояния ДНК и слабо изучены, следовательно, не могут быть легко восстановлены в полном объеме в конструкции вектора. Кроме того, уровни экспрессии от тканеспецифических промоторов, воссозданных в передаче векторов гена, часто недостаточны для достижения фенотипической коррекции, скорее всего, из-за несовершенного восстановления и/или вредного влияния хроматина в полупроизвольной векторной ин-1 023938теграции участка гена. Таким образом, крайне необходимы дополнительные стратегии для регулирования трансгена. Изложение сущности изобретения В соответствии с одним из аспектов настоящего изобретения представленный вектор гена, используемый в генной терапии, содержащий по меньшей мере одну последовательность микроРНК, функционально связан с мишенью нуклеотидной последовательности, имеющей соответствующую микроРНК в гематопоэтической клетке-предшественнике (ГКП), которая предотвращает или уменьшает экспрессию нуклеотидной последовательности в ГКП, но не в дифференцированной клетке. В соответствии с другим аспектом настоящего изобретения представленный вектор гена, используемый в генной терапии, содержащий по меньшей мере одну мишень последовательности микроРНК функционально связан с нуклеотидной последовательностью, имеющей соответствующую микроРНК в гематопоэтической стволовой клетке (ГСК), которая предотвращает или уменьшает экспрессию нуклеотидной последовательности в ГСК, но не в дифференцированной клетке. Другими словами, настоящее изобретение предлагает вектор гена, подходящий для использования в гематопоэтической генной терапии, содержащий по меньшей мере одну мишень последовательности микроРНК для микроРНК, которая присутствует в достаточном количестве в гематопоэтической клеткепредшественнике или гематопоэтической стволовой клетке и, возможно, трансгене. Под эффективным количеством подразумеваем, что концентрация эндогенного микроРНК достаточна, чтобы уменьшить или предотвратить экспрессию трансгена, который функционально связан с соответствующей мишенью микроРНК последовательности. Таким образом, настоящее изобретение применяет использование микроРНК, сильно экспрессированных в клетках, таких как ГКП и ГСК, но не в дифференцированном потомстве, например миелоидного и лимфоидного происхождения, предотвращая или сокращая экспрессию потенциально токсичного трансгена в группе уязвимых стволовых клеток, в то же время поддерживая экспрессию и терапевтическую эффективность в больном потомстве. МикроРНК "функционально связана" с трансгеном. Термин "функционально связана" означает, что описанные компоненты находятся в отношениях, позволяющих им функционировать необходимым образом. Стволовая клетка способна дифференцироваться во многие типы клеток. Клетка, способная дифференцироваться во все типы клеток, известна как тотипотентная. У млекопитающих только зиготы и ранние эмбриональные клетки тотипотентны. Стволовые клетки представляют собой клетки, которые есть в большинстве, если не во всех, многоклеточных организмах. Для них характерна способность обновляться посредством митотического деления клеток и дифференцироваться в разнообразные специализированные типы клеток. Два широких типа стволовых клеток млекопитающих: эмбриональные стволовые клетки, которые выделяют из внутренней клеточной массы бластоцист, и взрослые стволовые клетки,которые находятся в тканях взрослого организма. В развивающемся эмбрионе стволовые клетки могут дифференцироваться во все специализированные эмбриональные ткани. У взрослых организмов стволовые клетки и клетки-предшественники выступают в качестве возобновляющей системы для тела, пополняющей специализированные клетки, а также поддерживающей нормальное обновление регенеративных органов, например, крови, кожи или кишечных тканей. Гематопоэтические стволовые клетки (ГСК) являются мультипотентными стволовыми клетками,которые дают начало всем типам клеток крови, включая миелоидные (моноциты и макрофаги, нейтрофилы, базофилы, эозинофилы, эритроциты, мегакариоциты/тромбоциты, дендритные клетки), и лимфоидные линии (Т-клетки, В-клетки, NK-клетки). Клетки-предшественники имеют способность к дифференциации в определенный тип клеток. В отличие от стволовых клеток, однако, они уже гораздо более конкретны: они вынуждены дифференцироваться в свою клетку "мишень". Самое важное различие между стволовыми клетками и клеткамипредшественниками в том, что стволовые клетки могут воспроизводиться до бесконечности, в то время как клетки-предшественники могут только делиться ограниченное количество раз. ГКП может быть строго дифференцированна от ГСК только функциональностью в естественных условиях анализа, т.е. трансплантации, а также демонстрации того, что они могут дать начало всем линиям крови в течение длительных периодов времени. Обнаружение поверхностных клеточных маркеров, таких как C-Kit(CD117), Sca-1, и отсутствие/низкой экспрессии панели линии маркеров, в сочетании с недавно описанным набором молекул, принадлежащих к семейству рецепторов SLAM (CD150 и CD48), может обогатить субпопуляции ГСК и ГКП, достигая чистоты 50% при испытании стандартными функциональными тестами (Киль и др.). Дифференцированной клеткой является клетка, которая стала более специализированной, по сравнению со стволовой клеткой или клеткой-предшественником. Дифференциация происходит во время развития многоклеточного организма, так как организм изменяется из одной зиготы в сложную систему тканей и типов клеток. Дифференциация представляет собой также общий процесс у взрослых: взрослые стволовые клетки делятся и создают полностью дифференцированные дочерние клетки во время восстановления тканей и во время нормального обновления клеток. Дифференциация в корне меняет размер ячейки, форму, мембранный потенциал, метаболическую активность и способности реагировать на сиг-2 023938 налы. Эти изменения происходят в значительной степени из-за высококонтролируемых изменений в экспрессии генов. Другими словами, дифференцированной клеткой является та клетка, которая содержит конкретные структуры и выполняет определенные функции в связи с развитием процесса, который включает в себя активацию и деактивацию конкретных генов. Таким образом, дифференцированная клетка включает в себя дифференцированные клетки линии кроветворения, такие как моноциты, макрофаги, нейтрофилы, базофилы, эозинофилы, эритроциты, мегакариоциты/тромбоциты, дендритные клетки, Т-клетки, В-клетки и NK-клетки. Например, дифференцированные клетки гематопоэтической линии можно отличить от ГСК и ГКП при обнаружении на поверхности клеточных молекул, которых нет или они менее выражены на недифференцированных клетках. Примерами подходящей линии маркеров являются такие, как CD11b, Gr1, CD19, Ter119 и CD3. В соответствии с другим аспектом данного изобретения предложен вектор гена для использования в генной терапии, содержащий по меньшей мере одну мишень последовательности микроРНК, соответствующую микроРНК, выбранной из группы, включающей miR-130a, miR-126 и miR-223, функционально связанные с нуклеотидной последовательностью. Мишень miR-126 блокирует экспрессию наиболее эффективно в более примитивных ГКП и (у людей) в эритроидной линии, miR-126 будет, в частности, пригодна для применения в генной терапии, опираясь на надежную экспрессию трансгена в миелоидной и лимфоидной линиях. Мишень miR-130a блокирует экспрессию наиболее эффективно в более примитивных ГКП (также как и miR-126), miR-130a будет, в частности, пригодна для применения в генной терапии, опираясь на надежную экспрессию трансгена в миелоидной, лимфоидной и эритроидной линиях.miR-126 может быть сильнее, чем miR-130a в человеческих CD34 клетках, но может также иметь неспецифическую активность в дифференцированном потомстве. Комбинация мишени, включающаяmiR-130aT последовательности (предпочтительно 2-4 копии) и "половину" miR-126T (желательно в двух копиях) максимизирует рабочее окно, определяемое отношением репрессии в ГКП и экспрессии в миелоидном потомстве. Кроме того, при использовании комбинации мишени снижение экспрессии трансгена в ГКП обеспечивается за счет двух независимых miRNAs, и риск вмешательства в эндогенную регуляцию микроРНК снижается, повышая тем самым безопасность и эффективность целевой последовательности. Мишень miR-223 блокирует экспрессию наиболее эффективно в миелоидных коммитированных клетках-предшественниках и, по меньшей мере частично, в более примитивных ГКП. В противоположность miR-126 и miR-130a, мишень miR-223 полностью и решительно блокирует экспрессию в дифференцированных миелоидных клетках, включая гранулоциты, моноциты, макрофаги, миелоидные дендрические клетки. Мишень miR-223 особенно бы подходила для применения в генной терапии, опираясь на надежную экспрессию трансгена в лимфоидных или эритроидных линиях. Мишень miR-223 может блокировать экспрессию также очень эффективно в человеческих ГСК. Предпочтительно, чтобы микроРНК мишени последовательности соответствовали miR-130a и miR126. В одном из вариантов осуществления вектор гена содержит нуклеотидные последовательности, которая управляет экспрессией вектора. Другими словами, эндогенная микроРНК предотвращает экспрессию или распространение вирусов в определенных типах клеток (ГСК и ГКП), но допускает экспрессию или распространение в другие типы клеток. Например, miR-126, miR-130 и miR-223 предотвращают экспрессию вектора гена или онколитического вируса в гематопоэтических стволовых клетках или клеткахпредшественниках. В одном из вариантов осуществления вектор гена содержит нуклеотидную последовательность, которая является трансгеном. В другом варианте осуществления вектор переноса генов находится в форме невирусного вектора переноса генов. В этом варианте осуществления вектор переноса генов может включать в себя или быть в форме вектора экспрессии или плазмиды, которая включает в себя мишень последовательности микроРНК, функционально связанную с нуклеотидной последовательностью. Векторы экспрессии, как описано здесь, содержат участки нуклеиновой кислоты, содержащие последовательности, которые могут быть транскрибированы. Таким образом, последовательности, кодирующие мРНК, тРНК и рРНК, включены в это определение. Вектор гена или вектор переноса гена настоящего изобретения могут быть использованы для доставки трансгена в сайт или клетку, представляющую интерес. Вектор настоящего изобретения может быть доставлен к целевому сайту вирусным или невирусным вектором. Вектор является инструментом, который позволяет или способствует передаче объекта из одной среды в другую. Как пример некоторые векторы, используемые в рекомбинантной ДНК, позволяют элементам, таким как сегмент ДНК (например, гетерологичный сегмент ДНК, такой как гетерологичный сегмент кДНК), быть переданными в клетку-мишень. При желании, один раз в клетке-мишени вектор может служить для поддержания гетерологичной ДНК в клетке или может выступить в качестве единицы репликации ДНК. Примеры векторов, используемых в рекомбинантной ДНК, включают плазмиды,хромосомы, искусственные хромосомы или вирусы.-3 023938 Невирусные системы доставки включают, но они не ограничиваются методами трансфекции ДНК. Так, трансфекция включает в себя процесс с использованием невирусного вектора для доставки генов в целевую клетку млекопитающих. Типичные методы трансфекции включают электропорацию, баллистическую трансфекцию ДНК,липидно-опосредованную трансфекцию, уплотненную ДНК-опосредованную трансфекцию, липосомы,иммунолипосомы, липофектин, катионный опосредованный агент, катионные лицевые амфифилы(CFAS) (Nature Biotechnology, 1996, 14; 556) и их комбинации. В одном варианте осуществления вектор гена представляет собой вектор вируса. Вирусная система доставки включают, но не ограничивается ими, вектор аденовируса, аденоассоциированный вирусный (ААВ) вектор, герпесный вирусный вектор, ретровирусный вектор, вектор лентивирусов, бакуловиральный вектор. Другие примеры векторов включают векторы бывших естественных систем доставки, которые включают, но не ограничиваются ими, методы трансфекции ДНК, такие как электропорация, баллистическая трансфекция ДНК, липидно-опосредованная трансфекция, уплотненная ДНК-опосредованная трансфекция. Термин "векторная частица" относится к упакованному ретровирусному вектору, т.е. предпочтительно способному к соединению с и проникновению в клетки-мишени. Компоненты частиц, как уже обсуждалось в случае вектора, могут быть изменены по отношению к дикому типу ретровируса. Например, Env белки в белковом слое частиц могут быть генетически изменены для того, чтобы изменить их специфику ориентации или достичь другие нужные функции. Предпочтительно вектор вируса преимущественно преобразовывает определенные виды клеток или виды клеток. Более предпочтительно вектор вируса представляет собой целевой вектор, т.е. он имеет доступ к тканям, которые изменяются по сравнению с природным вирусом, так что вектор направлен на определенные клетки. В предпочтительном варианте вектор гена получают из лентивирусов. В одном из вариантов осуществления вектор гена содержит тканеспецифический промотор. Предпочтительно тканеспецифический промотор выбран из группы, включающей CD11b и c-Fes, и промоторы, полученные из цитохрома b-245 тяжелой цепи (CYBB, gp91 phox) локуса и TEK (Tie2). TEK (Tie2) промотор может быть объединен с мишенью miR-126 последовательности, данная комбинация позволит специфическую экспрессию трансгена в множество опухолепроникающих миелоидных клеток. В одном из вариантов осуществления вектор гена содержит трансген, кодирующий энзим. Предпочтительно энзим выбран из группы лизосомального фермента галактоцереброзидазы и gp91 phox. В соответствии с этим настоящее изобретение может быть использовано для доставки иммуномодулирующих молекул, таких как интерферон-альфа. Предпочтительно, чтобы эти векторы доставляли иммуномодулирующие молекулы в опухолевые клетки при трансплантации костного мозга. Предпочтительно, чтобы эти векторы содержали Tie2 промотор плюс miR-126T последовательность. Важно отметить, что Tie2 промотор обладает активностью в гематопоэтических стволовых клетках,и иммуномодулирующие молекулы, таких как интерферон-альфа, как известно, являются токсичными для гематопоэтической стволовой клетки. Таким образом, использование конкретных гематопоэтических стволовых клеток miRTs, как описано в данном документе, становится обязательным, а не вариантом для того, чтобы специально получить биологически активные молекулы с помощью Tie2 экспрессии, проникающих в опухоль макрофагов, не вмешиваясь в функции гематопоэтической стволовой клетки. Учитывая, что промотор Tie2 слабее в ГСК, чем промотор PGK, который был использован в исследованиях,авторы ожидают, что 126 Т/130 аТ последовательности полностью предотвратят токсичность трансгенов,выраженных Tie2 промотором в ГСК. В соответствии с другим аспектом изобретения предложен набор ДНК-конструктов для производства вирусных векторных частиц, содержащих ДНК-конструкты, кодирующие вирусный векторный геном, содержащий по меньшей мере одну последовательность микроРНК в соответствии с данным изобретением и, при необходимости, трансген. Под упакованным векторным геномом подразумеваем, что вектор генома находится в среде, где он может быть упакован в вирусную векторную частицу. Как правило, это требует наличия Gag-Pol и Env. В соответствии с другим аспектом изобретения предложен способ получения вирусных векторных частиц, включающий введение набора ДНК-конструктов данного изобретения в клетку-хозяина и получение вирусной векторной частицы. В одном из вариантов осуществления клетка-хозяин содержит соответствующую микроРНК. В соответствии с другим аспектом изобретения предложена вирусная векторная частица, полученная способом настоящего изобретения. В соответствии с другим аспектом изобретения предложена фармацевтическая композиция, содержащая вектор гена или частицу в соответствии с настоящим изобретением вместе с фармацевтически приемлемым разбавителем, наполнителем или носителем. В соответствии с другим аспектом изобретения предложена клетка, инфицированная или трансдуцированная вектором гена или частицей в соответствии с настоящим изобретением. Клетка может быть-4 023938 трансдуцирована или инфицирована в организме или в искусственных условиях. Клетки могут быть получены из или являться частью животного, предпочтительно млекопитающего, такого как человек или мышь. Таким образом, будет понятно, что настоящее изобретение полезно в обеспечении трансгенных животных, например, для использования в качестве моделей болезни. В одном варианте осуществления млекопитающее является нечеловеческим млекопитающим. В одном варианте осуществления клетка является гематопоэтической стволовой клеткой или гематопоэтической клеткой-предшественником. В соответствии с другим аспектом изобретения предложена комбинация по меньшей мере двух различных мишеней последовательностей микроРНК, соответствующих микроРНК, выбранным из группы,включающей miR-130a, miR-126, miR-223. В одном из вариантов осуществления мишени микроРНК последовательности направлены на одновременное, раздельное или последовательное применение. В соответствии с другим аспектом изобретения предложены вектор гена в соответствии с настоящим изобретением, частица в соответствии с настоящим изобретением, фармацевтическая композиция в соответствии с настоящим изобретением, клетка в соответствии с формулой настоящего изобретения или комбинация в соответствии с настоящим изобретением для предотвращения или уменьшения экспрессии трансгена в гематопоэтических стволовых клетках или гематопоэтических клетках-предшественниках. В соответствии с другим аспектом изобретения предложены вектор гена в соответствии с настоящим изобретением, частица в соответствии с настоящим изобретением, фармацевтическая композиция в соответствии с настоящим изобретением, клетка в соответствии с формулой настоящего изобретения или комбинация в соответствии с настоящим изобретением для лечения заболевания, выбранного из глобоидной лейкодистрофии клетки, хронической гранулематозной болезни и тяжлой комбинированной иммунной недостаточности (ТКИН). В соответствии с другим аспектом изобретения предложены вектор гена в соответствии с настоящим изобретением, частица в соответствии с настоящим изобретением, фармацевтическая композиция в соответствии с настоящим изобретением, клетка в соответствии с формулой настоящего изобретения или комбинация в соответствии с настоящим изобретением для увеличения шансов на выживание гематопоэтических стволовых клеток или гематопэтических клеток-предшественников по отношению к генной терапии. Шансы на выживание ГСК или ГКП могут быть увеличены специальной ненацеливающей экспрессией генов этих клеток. В частности, ненацеливание экспрессии трансгенов, которые являются токсичными для ГСК или ГКП, могли бы оказаться полезными для выживания этих клеток. Кроме того, ненацеливание экспрессии трансгенов, которые могут вызвать нежелательную иммунную реакцию в реципиенте, может привести к увеличению шансов на выживание клетки. В соответствии с другим аспектом изобретения предложены вектор гена в соответствии с настоящим изобретением, частица в соответствии с настоящим изобретением, фармацевтическая композиция в соответствии с настоящим изобретением, клетка в соответствии с формулой настоящего изобретения или комбинация в соответствии с настоящим изобретением для повышения безопасности и/или эффективности генной терапии. Увеличение безопасности генной терапии включает в себя предотвращение или сокращение нежелательной экспрессии трансгенов или экспрессии вектора в определенные типы клеток, такие как ГСК и ГКП. Ненацеливание экспрессии трансгена или вектора из специфических типов клеток может уменьшить нежелательные реакции и побочные эффекты, которые могут сопровождать генную терапию. Увеличение эффективности генной терапии включает в себя то, что трансгены более эффективно выражаются в нужные типы клеток, таких как дифференцированные гематопоэтические клетки, так как эти клетки более эффективно генерируются из генно-модифицированных недифференцированных клеток, которые были защищены от трансгенной токсичности и нежелательных иммунных реакций с помощью мишеней последовательности микроРНК. В частности, генная терапия, связанная с трансплантацией ГСК или ГКП, может быть более безопасной и эффективной, если экспрессию трансгена можно было бы избежать, пока клетки дифференцировались. В соответствии с другим аспектом изобретения предложены вектор гена в соответствии с настоящим изобретением, частица в соответствии с настоящим изобретением, фармацевтическая композиция в соответствии с настоящим изобретением, клетка в соответствии с формулой настоящего изобретения или комбинация в соответствии с настоящим изобретением для предотвращения апоптоза гематопоэтических стволовых клеток или гематопоэтических клеток-предшественников, в результате чего апоптоз вызван экспрессией трансгена. В соответствии с другим аспектом изобретения предложены вектор гена в соответствии с настоящим изобретением, частица в соответствии с настоящим изобретением, фармацевтическая композиция в соответствии с настоящим изобретением, клетка в соответствии с формулой настоящего изобретения или комбинация в соответствии с настоящим изобретением для мониторинга стадии дифференциации в гематопоэтических стволовых клетках или гематопоэтических клетках-предшественниках.-5 023938 Наличие miR-126, miR-223 и miR-130a является показателем ГСК или ГКП. Более конкретно, miR126 является показателем примитивной ГКП, в людях, а также клетках эритроидной линии. miR-130 а является показателем более примитивной ГКП. miR-130 а является показателем миелоидных совершенных клеток-предшественников и более примитивных ГКП. miR-223 также является показателем дифференцированных миелоидных клеток, включая гранулоциты, моноциты, макрофаги и миелоидные дентритичные клетки. В одном варианте осуществления вектор гена применим в гематопоэтической клеточной терапии. Гематопоэтическая клеточная терапия включает гематопоэтическую стволовую клеточную трансплантацию. В соответствии с другим аспектом данного изобретения предложена мишень микроРНК последовательности, соответствующая микроРНК, выбранной из группы miR-130a, miR-126, miR-223 для использования в генной терапии. В соответствии с другим аспектом изобретения предложен способ определения степени дифференциации гематопоэтической стволовой клетки или гематопоэтической клетки-предшественника, включая определение уровня экспрессии микроРНК в клетке, в которой микроРНК соответствует микроРНК целевой последовательности, функционально связанной с последовательностью нуклеотидов, в которой микроРНК предотвращает или уменьшает экспрессию нуклеотидной последовательности в гематопоэтической клетке-предшественнике (ГКП) или гематопоэтической стволовой клетке (ГСК), но не в дифференцированной клетке. Например, экспрессия miR-130a и miR-126 указывает на то, что клетка является ГКП или ГСК, в то время как экспрессия микроРНК-223 указывает на принадлежность к миелоидной линии, т.е. гранулоцитам и моноцитам, в том числе их предшественников и дериватов. В соответствии с другим аспектом изобретения предложен способ определения степени дифференциации гематопоэтической стволовой клетки или гематопоэтической клетки-предшественника, включая определение уровня экспрессии по меньшей мере двух микроРНК в клетке, в которой микроРНК соответствует мишени микроРНК последовательности, функционально связанной с последовательностью нуклеотидов, в которой микроРНК предотвращает или уменьшает экспрессию нуклеотидной последовательности в гематопоэтической клетке-предшественнике (ГКП) или гематопоэтической стволовой клетке(ГСК), но не в дифференцированной клетке и сравнения уровня экспрессии различных микроРНК. Более того, экспрессия двух микроРНК может быть проанализирована одновременно и независимо друг от друга, используя двунаправленный вектор, который выражает два маркерных гена, каждый из которых содержит различные мишени микроРНК последовательности. Например, различные микроРНК, могут быть связаны с различными маркерами, такими как флуоресцентные маркеры. Различные цвета могут означать различные смеси экспрессии микроРНК, которые представляют различные стадии дифференциации (например, зеленый маркер + микроРНК-126 Т, красный маркер + микроРНК-223 Т. Если клетки красного или черного цвета: -ГКП, если клетки желтые: - лимфоциты,если клетки зеленого цвета: дифференцированные клетки миелоидной линии). В соответствии с другим аспектом изобретения предложен способ определения степени дифференциации гематопоэтической стволовой клетки или гематопоэтической клетки-предшественника, включая определение уровня экспрессии трансгена в указанной гематопоэтической стволовой клетке или гематопоэтической клетке-предшественнике, в которой трансген функционально связан с мишенью последовательности микроРНК, в результате чего соответствующая микроРНК предотвращает или уменьшает выраженность трансгена в гематопоэтической клетке-предшественнике (ГКП) или гематопоэтической стволовой клетке (ГСК), но не дифференцированной клетке. Кроме того, репортер векторов для микроРНК, выбранный из группы, содержащей микроРНК-126,miR-130a и микроРНК-223, может применяться для определения гематопоэтических стволовых клеток и/или их непосредственных предшественников в культуре системы с целью получения линии гематопоэтических клеток из индуцированных плюрипотентных клеток (IPS) или эмбриональных стволовых клеток (ES). В одном варианте осуществления настоящего изобретения микроРНК, используемые в способах настоящего изобретения, включают микроРНК выбранные из группы, включающей miR-130a, miR-126 иmiR-223. Некоторые дальнейшие ключевые преимущества изобретения Изобретение учит, как векторы гена, подходящие для генной терапии, могут быть спроектированы для регулирования эндогенных микроРНК для ГСК и ГКП для управления экспрессией трансгенов для достижения конкретных профилей экспрессии вектора. Изобретение обеспечивает широкое применение этих векторов, так как они помогают предотвратить токсичность трансгена в ГСК и ГКП и, тем самым,содействовать развитию стратегий генной терапии для лечения различных заболеваний. Векторы являются особенно подходящими для генной терапии, которая включает экспрессию трансгена, который является токсичным для ГСК или ГКП. Изобретатели предлагают новый способ профилирования деятельности отдельных микроРНК нескольких гематопоэтических множеств клеток, включая редкие ГКП, тем самым добавляя новое измерение в обычную экспрессию микроРНК, профилируя подходы, которые являются широкими, но ограни-6 023938 ченными ранее очищенными массовыми совокупностями. Этот метод основывается на трансдукции ГКП с микроРНК лентивирусными репортерными векторами, которые служат в качестве живого генетического индикатора активности микроРНК, легко поддаются количественной оценке на одном уровне клеток и на разных уровнях клеточных популяций параллельно с помощью проточной цитометрии. Используя этот подход, учные определили две микроРНК, которые высокофункциональны в мышиных и человеческих ГКП, в том числе множествах, обогащенных для самых примитивных стволовых клеток. По дифференциации, одна микроРНК регулируется стремительно вниз на раннем уровне клетокпредшественников, а другая - в дальнейшем индуцирована во время гранулоцитопоэза и моноцитопоэза,но регулируется резко вниз в лимфоцитах и в течение дифференциации мегакариоцитов/эритроцитов. Кроме того, учные применяли одну из двух микроРНК, сильно выраженную в ГКП для преодоления важного вопроса, предотвращающего эффективное лечение глобоидной лейкодистрофии (ГЛД) (лизосомальные расстройства хранения из-за дефектов активности лизосомальных ферментов галактоцереброзидазы - GALC) в мышиной модели лентивирусных векторов, основанных на стволовой клеточной генной терапии. В отличие от других лизосомальных ферментов, GALC перенос генов и экспрессия в ГКП приводят к апоптозу и функциональному нарушению трансдуцированных клеток из-за дисбаланса внутриклеточного содержания в биологически активных сфинголипидах, следующим за экспрессией энзима. Дифференцированные клетки миелоидной и лимфоидной линий не зависят от GALC экспрессии,предлагая уникальную чувствительность ГКП к токсичности энзима. Проблематика последовательностей микроРНК, используемая для репортерного вектора, позволила регулировать профиль экспрессии генов в терапевтически соответствующем GALC трансгене, ненацеливании экспрессии трансгена из клеток,где родственные микроРНК выражаются (ГКП), при этом обеспечивается возможность полной терапевтической экспрессии в дифференцированное потомство, которое не зависит от экспрессии токсичностиGALC. ГКП, трансдуцированные с микроРНК-регулируемыми GALC векторами лентивирусов, были защищены от фермента токсичности и сохранили свои функции как в искусственных условиях, так и в организме. Предварительные результаты показывают терапевтическую эффективность данного подхода в коррекции проявлений болезни в мышиной модели. Предпочтительно следующие мишени микроРНК последовательности используют для достижения регулируемой экспрессии трансгена в человеческой гематопоэтической системе: генная терапия приложений, которые требуют экспрессии в миелоидную линию (например, хроническое гранулематозное заболевание, лизосомальные нарушения хранения данных, такие как болезнь Краббе, метахроматическая лейкодистрофия, адренолейкодистрофия и т.д.): 126 Т/130 аТ (2+2 мишени последовательности) - оптимизированы для максимальных репрессий в ГКП; 126 Т (2 целевая последовательность) - оптимизирована для минимальной фоновой активности в миелоидном потомстве. Методы генной терапии, которые требуют экспрессии в эритроидную линию (например, талассемия, недостаточность глюкоза-6-фосфат-дегидрогеназы, серповидно-клеточная анемия, ): 130 аТ (4 мишени последовательности) или 223 Т (2 или 4 мишени последовательности). Последняя мишень может проявлять некоторую активность (5 раз) в более примитивных BFU-E и CFU-E. Методы генной терапии, которые требуют экспрессии в лимфоидную линию (например,RAG1/RAG2 недостаточность, ВТК недостаточность, X-SCID, ADA-SCID): 223T (2 или 4 мишени последовательности), возможно, в комбинации с 126 Т/130 аТ (2+2 мишени последовательности) или 126 Т (2 мишени последовательности). Векторы, такие как вирусные векторы лентивирусов, в том числе для экспрессии трансгена для переноса генов и терапии, могут быть сконструированы с мишенью микроРНК последовательности, чтобы быть признанными эндогенными клетками эндогенных микроРНК к ГСК и ГКП, регулируя тем самым экспрессию трансгена во множестве клеток. Кроме того, комбинации мишеней микроРНК последовательности могут быть использованы для получения векторов с высокой определенной клеточной экспрессией шаблонов. Практика настоящего изобретения будет работать, если не указано иное, в обычных методах химии,молекулярной биологии, микробиологии, рекомбинантной ДНК и иммунологии, которые находятся в пределах возможностей среднего специалиста в данной области техники. Такие методы описаны в литературе. См., например, J. Sambrook, E.F. Fritsch, and T. Maniatis, 1989, Molecular Cloning: A LaboratoryJ.E. Dahlberg, 1992, Methods of Enzymology: Структура ДНК часть A: Synthesis and Physical Analysis ofDNA Methods in Enzymology, Academic Press; Using Antibodies: Лабораторный справочник: Portable Protocol No. I by Edward Harlow, David Lane, Ed. Harlow (1999, Cold Spring Harbor Laboratory Press, ISBN 0-87969-544-7); Antibodies: Лабораторный справочник под ред. Ed Harlow (Editor), David Lane (Editor)-7 023938 0-8247-0562-9) и Lab Ref: Справочник рецептов, реагентов и других средств для использования at theBench, Edited Jane Roskams and Linda Rodgers, 2002, Cold Spring Harbor Laboratory, ISBN 0-87969-630-3. Каждый из этих общих текстов включен в настоящий документ посредством ссылки. Описание чертежей Настоящее изобретение будет описано далее, только в качестве примеров, со ссылкой на предпочтительные варианты его осуществления, как показано на прилагаемых чертежах. Фиг. 1. Схематическое изображение двунаправленной микроРНК, регулируемой репортерными векторами лентивирусов. Здесь показаны представители структуры микроРНК, регулируемой двунаправленными векторами(Bd.LVs), содержащие зеленый флуоресцентный белок (GFP) в качестве репортера микроРНК и усеченной форме человеческого сходства фактора роста нервных рецепторов (NGFR), как конститутивно выраженного нормализатора. Хотя Bd.LV-ctr не содержит мишени микроРНК последовательности (мирт),Bd.LV-223T и 126T-Bd.LV были построены с добавлением 4 тандемных повторов, содержащих 21 bp,полностью дополняющих микроРНК-223 или микроРНК-126 соответственно. Фиг. 2. Оценка микроРНК репортеров Bd.LVs в клеточных линиях.HEK293T, U937 и HEK293T клетках, которые эктопически экспрессируют микроРНК-126 с помощью трансдукции с LV содержащими PRI-miR-126 под управлением вездесущего промотораb - Репрезентативный FACS анализ HEK293 Т, U937, HUVEC и HEK293T.LV. miR-126 клеток, трансдуцированных Bd.LVs, регулируемыми указанными микроРНК. Клетки были проанализированы на GFP"микроРНК репортер" и NGFR "нормализатор" экспрессии. с - Формула для расчета микроРНК-опосредованной репрессии гена репортера на уровне белка и на уровне РНК. Гистограммы показывают микроРНК-223 и микроРНК-126 активность в клеточных линиях,рассчитываемых как GFP FR значения на белковом уровне. Алмазы представляют GFP FR на уровне РНК. Фиг. 3. Оценка микроРНК репортера BdLVs в организме. Линия-/low костный мозг (КМ) гематопоэтических стволовых и клеток-предшественников (ГКП) были трансдуцированы с двунаправленным микроРНК репортером векторов лентивирусов (BdLVs) дляmiR-223 и miR-126 и трансплантированы в реципиентов мышей. Клетки периферической крови мышей,регулярно привитых клетками, несущих микроРНК репортер, были проанализированы посредствомa - Селекционная стратегия при применении для идентификации основной популяции лейкоцитов из мышиной периферической крови: гранулоциты (CD11b+, SSChigh), моноциты (CD11b+, SSClow), Влимфоциты (CD19+) и Т-клетки (CD11b-CD19b-).b - Представитель FACS анализа GFP и NGFR экспрессии в мышиной периферической крови подмножеств. с - GFP FR значения (среднееSD) в периферической крови субпопуляций от мышей, трансплантированных - ГКП, трансдуцированных либо Bd.LV-ctr (n=5), Bd.LV-223T (n=6), либо Bd.LV-126T(n=4). Фиг. 4.a - Линии-/low костного мозга (КМ) гематопоэтических стволовых и клеток-предшественников (ГКП) были трансдуцированны с двунаправленным микроРНК репортером векторов лентивирусов (BdLVs) и трансплантированы в смертельно облученных мышей. BdLVs совместно выражают дестабилизированный GFP (d4GFP) репортер, реагирующий на специфическую микроРНК 4 тандемными повторами, полностью коплементарной мишени микроРНК (miRT) последовательности и усеченный ген NGFR маркера(NGFR). Мыши были подвергнуты эвтаназии через 8-12 недель после трансплантации, и многие субпопуляции ГКП костного мозга были проспективно определены иммунофенотипированием, как показаноb - Представители FACS схемы показывают экспрессию Control-BdLV (miRT или 133 аТ, мускульно-специфичные miRT) и репортер BdLVs для miR-126 (126T), miR-130a (130aT), miR-196b (196bT), miR10a (10 аТ), miR-223 (223T), miR-19a (19aT), miR-93 (93T), miR-17-5p (17T) и let-7a (Let7aT) в ГКП субпопуляциях, недавно изолированных из костного мозга трансплантированным мышам, как описано в (а). Каждая строка показывает образцовую модель экспрессии репортера для указанных BdLV в ГКП вышеупомянутых этапов дифференциации. Гистограммы справа от каждой строки показывают небольшуюсвернутую репрессию (FR) рассчитываемого РЭМ из репортера, означающего интенсивности флуоресценции (контроль: n=9; 126 Т: n=10; 130 аТ: n=4; 196bT: n=4; 10 аТ: n=4, кроме ГСК и МРР 1, где n=1, хотя статистика n/a; 223T: n=6, из которых 5 с eGFP репортером 19 аТ: n=3; 93T: n=2; 17 Т: n=3; let7aT: n=1 депо крови из 3 мышей). Статистические сравнения микроРНК активности между ГКП субпопуляциями были сделаны односторонней Anova и Bonferroni послетестовой коррекцией, используя EPs каждойa - Гематопоэтическая активность 8 микроРНК, измеряемой небольшой свернутой репрессией (FR),указанным BdLVs репортером на нескольких клеточных популяциях, изолированных от трансплантированных мышей. Линия- подмножества КМ: как это описано на фиг. 4; Линия+ подмножества KM: Pro В:(130 а/126 Т; n=4 мыши), были сравнены либо с 4 копиями miR-126T (126T; n=10 мышей), либо 4 копиямиmiR-130aT (130aT; n=4 мыши). Столбики показывают свернутую репрессию РЭМ, полученными этимиmiRT последовательностями в линейном маркере отрицательных популяций костного мозга (обозначения как на схеме 4) и лейкоцитов периферической крови. Обратите внимание, что 130 а/126 Т достигает лучших репрессий в ГСК, чем 126 Т один, в то время как фоновая репрессия в лейкоцитах РВ снижается. Фиг. 6. Регулирование экспрессии гена самоубийства мишенями микроРНК последовательностями.a - miRT последовательность полностью дополняют miR-142, miR-223, miR-126 или miR-130a, которые были добавлены к транскрипции дестабилизированной тимидинкиназы (dTK). Однонаправленные векторы самоубийства лентивирусов (правая половина каждой векторной графики), которые были использованы для (b), а двунаправленные векторы самоубийства, связывающие GFP маркер с микроРНК регулируемыми ТК, или маркер NGFR с контроль-ТК при применении в (с).b - Линейно-/low ГКП были трансдуцированны с указанными векторами лентивирусов, с покрытиемганцикловир (GCV) в среде полутвердых (LV-GFP: n=2; CTRL-TK: n=8; TK-142T: n=4; TK-223T: n=6;TK-126T: n=4; TK-130 аТ: n=2). После 10d количество миелоидных (CFU-GM, CFU-G, CFU-GM) и эритроидных (BFU-E, CFU-E) колоний было подсчитано. Диаграммы боксов и контактов показывают количество колоний в культурах, содержащих GCV, разделенное на количество колоний в соответствующих контрольных культурах без GCV (10-90-й процентиль). Данные "no GCV" точки показывают покрытие изменчивости (количество колоний каждого не-GCV рассматриваемой культуры, поделенное на среднее количество колоний всех не GCV обработанных культур; n=26). Статистические сравнения были сделаны против GCV обработанных, LV-GFP групп; не существенно не отличается; : 0,001 р 0,01, : р 0,001.c - Линия-/low ГКП от CD45.1+ мышей были трансдуцированны либо с TK вектором контроля(NGFR-отмеченным) или микроРНК-регулируемым TK вектором (GFP-отмеченным; опыт 1: TK.126 Т; опыт 2: TK.142 Т). LV.NGFR/Контрольные TK и LV.GFP/TK-miRT-трансдуцированные клетки были смешаны в соотношении 1:1 и трансплантированы в CD45.2 конгенных мышей, получавших GCV (опыт 1: n=6 мышей; опыт 2: n=5 мышей) для 7-14, начиная с 3 дня после трансплантации или оставленных без лечения (опыт 1: n=4; опыт 2: n=3). Репрезентативные диаграммы FACS показываютGFP/NGFR химеризм в CD45.1+ клетках донора. Графики показывают фракцию GFP-экспрессирующих клеток в трансдуцированных, полученных донорских клетках в крови для обработанных GCV (рыжих) и необработанных (черных) мышей, для каждого типа клеток крови в течение периода 7-8 месяцев. Обратите внимание, что весьма большое количество клеток - это GFP+ в GCV группе (: р 0,001, в двухфакторном дисперсионном анализе), указывающие на защиту от самоубийства и селективное преимущество ГСК, трансдуцированных с помощью GFP/TK.126T или GFP/TK.142T. Таким образом, miR-126T последовательность, добавленная к трансгену, преодолевает токсичность ГКП, связанную с высокотоксичными трансгенами даже при экспрессии от убиквитарных промоторов, неся значительный потенциал для повышения безопасности и эффективности ГКП-основанной генной терапии. Кроме того, эти результаты официально доказывают, что miR-126 принимает активное участие в долгоживущих привитых гематопоэтических стволовых клетках, как показывает анализ функционального вторичного заселения. Фиг. 7.a - Для решения безопасности эксплуатации miR-126 регулирования генной терапии трансгенная линия мышей, содержащая miR-126 репортер (Tg.126T), была создана путем микроинъекции, иллюстрированной LV, в перивителлиновое пространство зигот. Анализ FACS костного мозга молодых, взрослых трансгенных мышей показал, что GFP экспрессия была самой низкой в Kit+Sca+Линейных- (KSL) клетках маркера (синий график в гистограмме участка), в то время как GFP экспрессия включена в Kit+Sca-Linпредшественников (черный и красный график в гистограмме участка). GFP MFI Tg.126T мышей и контрольных GFP трансгенных мышей был измерен для расчета FR miR-126 репортера в указанных субпопуляциях ГКП (средняяРЭМ, n=10 Tg.126T мышей; : р 0,001; : 0,01 р 0,001 по сравнению с ЕР).b - В то время как мыши с двумя мощными аллелями для miR-126 проявляют значительную эмбриональную смертность из-за дефектов кровеносных сосудов, разведение Tg.126T колонии привело к нормальному размеру помета и ожидаемому числу копий (VCN) распределения вектора в потомстве,отражающем одно из родительских поколений, предполагая, что умеренная экспрессия miR-126T последовательностей из промотора PGK не мешала регулированию естественных miR-126 мишеней в процессеc - Клетки KM CD45.2+ Tg126T мышей и CD45.1+ мышей дикого типа (WT), обогащенных для ГКП положительной селекцией для CD117 и успешно трансплантированными (соотношение 1:1) в смертельно облученных CD45.2+ реципиентов (n=4). Трансплантированные мыши истекали кровью через регулярные промежутки времени, и CD45.1/CD45.2 химеризм был определен в различных периферийных линиях клеток крови (Granu: CD11b+ side scatterhi; Mono: CD11b+ side scatterlow; В-клетки: CD19+; T-клетки:CD3+). Эти данные показывают, что существует удобное терапевтическое окно для безопасного использования miR-126 регулирования. Фиг. 8.a - CD34+ГКП очищали от человеческой пуповинной крови (ПК) и трансдуцированных с контрольно-BdLV (контроль) или miR-126 репортером BdLVs для miR-126 (126T), miR-130a (130aT) или miR-223(223T) (n=3 биологических репликаций в группе). Клетки находились в жидкой среде при условиях поддержки краткосрочного поддержания ГКП и BdLV маркеров, экспрессию измеряли через 2 дня после трансдукции в CD34+CD38-ГКП и CD34+D38+ предшественников (первые 2 столбца слева). Затем клетки были дифференцированы либо в жидкой среде в течение 6 дней (CD34-CD38+ клеток, средняя колонка),либо в полужидкой среде в течение 16 дней (CD13+ миелоидных клеток, CD235+ эритроидных клеток). Репрезентативные диаграммы FACS представлены. Количественные гистограммы снизу показываютb - Клетки пуповинной крови CD34+ были трансдуцированны с контрольной или miRNA, регулируемыми двунаправленными векторами самоубийства, содержащими мишени последовательностиmiRNA для miR-223 (TK-223T) или miR-126 (TK-126T, см. также схему 2) и показанными в CFC анализах в четырех экземплярах либо в присутствии или в отсутствие пролекарства GCV. Число GFP+ эритроидных (CFU-Е, BFU-E) или миелоидных (CFU-G, CFU-M, CFU-GM) колоний было подсчитано через 14 дней после покрытия, а нормализовано к количеству, исчисляемому "не-GCV" культурой. Диаграммы боксов и контактов показывают 10-90-й процентили. GCV полностью предотвратил рост CTR-TK трансдуцированных колоний.c - Комбинации miR-126T и miR-130aT последовательностей (4+4 и 2+2 и тандемные повторы, соответственно), а также 2 тандемных повтора miR-126T были только сравнены со стандартным проецированием miRT, утилизируя 4 тандемных повтора miR-126T или miR-130aT соответственно. Человеческие клетки пуповинной крови были трансдуцированы с соответствующими BdLVs репортерами и кратная репрессия репортера была определена в примитивных стволовых/предшествующих отсеках (CD34+CD38) и предшествующем отсеке (CD34+CD38-) в течение 2 дней после трансдукции, а также в миелоидном потомстве (CD13+) и эритроидном потомстве (CD235+) в течение 10-14 дней после трансдукции. 126 Т(4 мишени), 126 Т/130 аТ (4+4 мишени) и 126 Т/130 аТ (2+2 мишени) подавляют одинаково хорошо в стволовом/предшествующем отсеке. Тем не менее, 126 Т/130 аТ (4+4 мишени) имеет более высокий фон подавляющей активности в миелоидном потомстве.d - Подавляющая активность 126 Т (4 мишени), 126 Т/130 аТ (2+2 мишени) и 126 Т (2 мишени) в примитивном отсеке (как в С) и в конце миелоидных этапов дифференциации (миелоциты: CD11b+/CD16-; метамиелоциты: CD11b+/CD16+/SSClow; гранулоциты: CD11b+/CD16+/SSChigh) по G-CSF, индуцированной дифференциации in vitro. Этапы дифференциации были проверены на May-Grnwald/Giemsa окрашенных образцах цитоспина от культуры. Регулирование индекса (правый график) рассчитывается путем деления кратной репрессии соответствующих miRT в CD34+/CD38- стволовом/мультипотентном отсеке, кратной репрессии в метамиелоцитах. Лучшее "освобождение" экспрессии трансгена в миелоидном потомстве получается от 126 Т (2 мишени), в то время как подавление в стволовом/предшествующем отсеке подобно на 130 аТ (4 мишени) - чуть меньше по сравнению с 126 Т (4 мишени) и 126 Т/130 аТ (2+2 мишени). Что касается последних 2 мишеней последовательностей, 126 Т/130 аТ (2+2 мишени) предпочтительнее 126 Т (4 мишени), так как она предлагает большое регулирование индекса. Кроме того, снижение экспрессии трансгена обеспечивается за счет двух независимых микроРНК, и риск вмешательства в эндогенную регуляции микроРНК еще больше снижается, что повышает безопасность и эффективностьmiRT. Фиг. 9. Лизосомный энзим гиперэкспрессии в ГКП. Энзим уровня экспрессии, нормированный к дикому типу, в мГКП (a) и чГКП (b) на LV трансдукции. GALC экспрессия была значительно ниже по сравнению с ARSA и IDUA. Фиг. 10. Нарушение функции мышиных ГКП на LV-опосредованной GALC экспрессии.a - CFC анализ на мГКП трансдуцированных с GALC и контролем LV. Числоколоний/пластин(левая ось Y, колонки) было рассчитано, и число комплексных LV копий/клеток (VCN) (правая ось Y,точки) было измерено. GALC.LV трансдуцированные -/- мГКП (n=12 независимых экспериментов) производятся значительно меньше, число колоний по сравнению с GFP.LV (n=10) и ARSA.LV (n=8) трансдуцированными клетками. Это нарушение не было обнаружено, когда мГКП были трансдуцированны сmiR-142T GALC.LV (n=6). : р 0,001 в однофакторном дисперсионном анализе для обоих количеств колоний/пластин и VCN. Средние величиныSD показаны. Аналогичные результаты были получены с -/- 10023938 и +/+ мГКП.b - GALC активность измеряется на трансдуцированных мГКП. После GALC.LV трансдукцииGALC -/- (на этом -/-) (n=5) и GALC +/+ (на этом +/+) (n=5) мГКП показал 2-кратное увеличение GALC активности над дикими типами уровней (+/+ мГКП трансдуцированных с GFP.LV, n=5). Отсутствие увеличения активности было обнаружено в мГКП, трансдуцированных с miR-142, регулируемой GALC.LV(miR-142T) (n=3). Фиг. 11. Нарушение функции человеческой ГКП на LV-опосредованной GALC экспрессии.(левая ось Y, колонки) было рассчитано, и число комплексных LV копий/клеток (VCN) (правая ось Y,точки) было измерено. GALC.LV трансдуцированные n.d. (n=4) и GLD чГКП (n=4) показали значительное ухудшение в образовании колоний по сравнению с контрольными клетками (n=5), которых не наблюдалось в следующей miR-142T GALC.LV трансдукции (n=4). Колонии, полученные из GALC.LV трансдуцированных чГКП, показали значительно низший вектор содержания, по сравнению сGFP/ARSA/GALCmiR 142T.LV контрольными группами. : p0,001 в однофакторном дисперсионном анализе для обоих количеств колоний/пластин и VCN. Средние величиныSD показаны.b - GALC активность измеряется на трансдуцированных чГКП. GALC.LV трансдукция позволила воссоздание GALC активности в n.d. уровнях в GLD чГКП (n=3), в то время как трансдукция n.d. чГКП(n=4 для СВ и n=3 для КМ) привела к гиперэкспрессии энзима выше GFP.LV трансдуцированных уровней (n=3). Отсутствие увеличения активности было обнаружено в чГКП, трансдуцированных с miR-142,регулируемой GALC.LV (miR-142T) (n=3). Фиг. 12. Выживание twi мышей после ГСКТ.b - Средняя продолжительность жизни twi мышей, получивших ГСКТ. Twi мыши трансплантировали с общим КМ (ТВМ) (n=12), или с GFP.LV трансдуцированными +/+ мГКП и нетрансдуцированнымиSca1-предшественниками (GFP.LV +/+ Lin-+/+ Sca1-, n=7), или с GFP.LV трансдуцированными +/+ чГКП и GFP.LV трансдуцированными Sca1-предшественниками (GFP.LV +/+ Lin-GFP.LV +/+ Sca1-,n=5) достигли более долгого выживания по сравнению с необработанными контрольными группами(n=7), показали значительно более высокую продолжительность жизни по отношению к ТВМ илиGFP.LV трансдуцированными +/+ Sca1-предшественниками (n=8). : р 0,01 на тесте однофакторного дисперсионного анализа.Sca1-предшественниками. Фиг. 13. Нарушенная в организме функция мГКП в FVB/twi мышах. Среднее выживание мышей,получивших мГКП трансплантацию, как указано -/- мыши с трансплантированной с GFP.LV трансдуцированных +/+ мГКП (n=11), достигли дольшего выживания по сравнению с необработанными контрольными группами (UT), а наоборот, -/- (n=9) и +/-(n=5) мыши, трансплантированные с GALC.LV трансдуцированными -/- мГКП, не выжили после смертельного облучения. Табл. 2: Среднее VCN SD, обнаруженных в костном мозге -/- или +/+ мышей, трансплантированных с перечисленными мГКП (трансдуцированных GALC.LV или GFP.LV) на 20 и 120 день после трансплантата (n=3 точка времени).+/- хозяин.Аналогичные результаты были получены с помощью +/+ мГКП. Фиг. 14. Апоптоз GALC экспрессии мышиных и человеческих ГКП.a, b - TUNEL анализ на -/- мГКП (слева) и чГКП (справа) (из n.d CB и GLD КМ) на 2 и 5 день после переноса генов. TUNEL+ядро от общего количества ядерных клеток заявлены. 8 полей и 100 клеток были подсчитаны в таком состоянии. Аналогичные результаты были получены с +/+ чГКП.a - Большинство GALC.LV трансдуцированных м- и чГКП были TUNEL положительным как на 2,так и на 5 день после трансдукции.b - TUNEL анализ (красный) и ToPro (TPIII, синий) для окрашивания ядер на м- и чГКП на 2 и(чГКП) день после трансдукции с указанными LV: репрезентативные изображения (изображения были получены с помощью тройного лазерного конфокального микроскопа - Сияние 2100, BioRad; флуоресцентные сигналы от одиночных оптических секций были последовательно получены и проанализированы программным обеспечением Adobe Photoshop CS, увеличение 100).c - Цитофлурометрический анализ окрашивания Annexin V на м- (верхние панели) (от -/- мышей доноров) и чГКП (нижние панели) (из n.d. CB). Часть апоптотических клеток выше среди GALC.LV трансдуцированных мГКП и чГКП по сравнению с GFP-трансдуцированными контрольными группами. СМТ = обработанная камптотецином положительная контрольная группа. Получение было выполнено сFACS Calibur 2, Beckton Dickinson. По меньшей мере 10000 случаев были оценены, и данные были обработаны FlowJo 8.5.3 программным обеспечением. Данные -/- мГКП и n.d. CB (GLD и ВМ для TUNEL)- 11023938 показаны, но аналогичные результаты были получены следующей GALC трансдукцией +/+ мГКП по сравнению с -/- клеток и в n.d. KM (TUNEL и Annexin V) и GLD BM (Annexin V) чГКП по сравнению с СВ клетками. Фиг. 15. IGF1 лечение препятствует апоптозу GALC экспрессии ГКП.a - CFC анализ на GALC.LV и ARSA.LV трансдуцированных мГКП, обработанных или нет IGF 1. Числоколоний/пластин (левая ось Y, пластины) было рассчитано, и число комплексных копий/клеток векторов лентивирусов (VCN) (правая ось Y, точки) было измерено. IGF1 лечение индуцированного роста высшего количества колоний, по сравнению с GALC.LV трансдуцированными необработанными клетками (n=4 независимых эксперимента). По антиапоптотическому лечению, VCN из GALC.LV трансдуцированных клеток показало, что из ARSA.LV трансдуцированных контрольных клеток (и для CFC количества, и для VCN однофакторного дисперсионного анализа: : р 0,001 по сравнению с обработанными GALC трансдуцированных мГКП с необработанной GALC.LV трансдуцированных клеток; р 0,05 для сравнения с обработанными GALC.LV трансдуцированными мГКП с ARSA.LV трансдуцированными клетками).b - Колонии, выросшие из обработанных мГКП, также показали увеличение в размерах (фото справа, увеличение 5).c - TUNEL анализ на GALC.LV и ARSA.LV-трансдуцированных мГКП, обработанных или нет сIGF1. 8 полей и 100 клеток были подсчитаны в таком состоянии. Подавляющее большинство обработанных клеток были отрицательными для TUNEL (однофакторный дисперсионный анализ: р 0,001 по сравнению с необработанной GALC.LV трансдуцированными клетками; р 0,05 по сравнению с ARSA.LV трансдуцированными клетками).d - GALC активность измеряется на трансдуцированных мГКП от -/- или +/+ мышей. IGF1 лечение не оказывает существенного влияния GALC уровни экспрессии (n=3) по сравнению с трансдуцированными необработанными контрольными группами (n=6). Показаны средние величиныSD. Фиг. 16. Анализ катепсина D активации в трансдуцированных клетках. Вестерн-блот анализ катепсина D на GFP.LV или GALC.LV трансдуцированных мГКП и U937 клетках через различные промежутки времени после переноса генов, как было указано. Активированная форма соответствует 30 кДа мембраносвязанной изоформе, как показано стрелкой. Никаких существенных накоплений активной формы катепсина D не наблюдалось в GALC.LV трансдуцированных клетках после переноса генов, по сравнению с GFP.LV трансдуцированными клетками. Предшественник (48 кДа,стрелка) накопился в GFP-трансдуцированных клетках после 7 дней культуры (GFP 7d), а его накопление было менее выражено в присутствии GALC (GALC 5d), кульминацией которого было исчезновение и предшественника, и зрелых форм после 7 дней. Антиактин был использован в качестве контроля для белковой нагрузки. Фиг. 17. Базальная GALC активность в различных типах клеток. Базальная GALC активность, нормированная на уровне мГКП дикого типа. Оба первичных олигодендроцита дикого типа (n=4) и микроглии (n=4) показали более высокую GALC активность по сравнению с мГКП. Фиг. 18. Чувствительность к новой GALC экспрессии в миелоидных клетках. Результаты TUNEL анализа (% TUNEL+ клеток от общего числа ядерных клеток, на левой оси Y,пластины), определения GALC активности (по правой оси Y, точки) и, по возможности, предназначенной для окрашивания, выполненного на (a) человеческих моноцитах (b) моноцитарной линии клеток человека U (c) мышиных макрофагах и (d) мышиных микроглиях через 5 дней после трансдукции. Во всех протестированных условиях TUNEL окрашивание продемонстрировало возникновение незначительного/отсутствие апоптоза (6 полей и 250 клеток были подсчитаны в состоянии), несмотря на это, эффективная трансдукция (оценивается по анти-НА окрашивания на макрофагах в (c и устойчивая GALC экспрессия выше базальных уровней и во всех других образцах (ARSA.LV или GFP.LVтрансдуцированных клетках), были получены. Средние величиныSD показаны.c и d - Репрезентативные изображения TUNEL анализа на GALC/GALC-HA.LV или GFP.LV трансдуцированных макрофагах (c) и микроглиях (d). Изображения были получены трхлазерным конфокальным микроскопом (Radiance 2100, BioRad). Флуоресцентные сигналы от одиночных оптических секций были последовательно получены и проанализированы программным обеспечением Adobe Photoshop CS. Увеличение: 80 в С, 100 в D. Фиг. 19. Чувствительность к новой GALC экспрессии в лимфоцитах. Результаты TUNEL анализа (% TUNEL+ клетки от общего числа ядерных клеток, на левой оси Y,пластины), определения GALC активности (по правой оси Y, точки), выполненной на Т- и В-лимфоцитах через 5 дней после трансдукции.TUNEL окрашивание продемонстрировало возникновение незначительного/отсутствие апоптоза(6 полей и 250 клеток были подсчитаны в состоянии), несмотря на эффективную трансдукцию (см. устойчивая GALC экспрессия выше базальных уровней). Средние величиныSD показаны. Фиг. 20. Чувствительность к новой GALC экспрессии в олигодендроцитах.a - TUNEL анализ (% TUNEL+ клетки от общего числа ядерных клеток, на левой оси Y, пластины),определения GALC активности (по правой оси Y, точки), выполненной через 5 дней после трансдукции.TUNEL окрашивание продемонстрировало возникновение незначительного/отсутствие апоптоза (6 полей и 250 клеток были подсчитаны в состоянии), несмотря на эффективную трансдукцию (см. устойчивая GALC экспрессия выше базальных уровней). Средние величиныSD показаны.b - Репрезентативные изображения TUNEL анализа на GALC.LV или GFP.LV трансдуцированных олигодендроцитах. Чистота подготовки олигодендроцитов была проверена NG2 и Gal-Cer окрашиванием на нетрансдуцированных клетках (UT), в то время как микроглии окрашивали F4/80 на GALC.LVтрансдуцированных клетках; ToPro (TPIII) был использован для окрашивания ядер. Изображения были получены трхлазерным конфокальным микроскопом (Radiance 2100, BioRad). Флуоресцентные сигналы от одиночных оптических секций были последовательно получены и проанализированы программным обеспечением Adobe Photoshop CS. Увеличение: 40. Фиг. 21. Регулирование GALC экспрессии с помощью микроРНК 126.b, c - GALC анализ активности и CFC анализ производится на I-мГКП, трансдуцированных сb - Активность была нормализована до +/+ уровней (первая колонка). Клетки, трансдуцированные сGALC.микроРНК 126Tag.LV GALC гиперэкспрессией на супрафизиологических уровнях.c - Числоколоний/пластин (левая ось Y, пластины) было рассчитано, и число комплексных копий/клеток векторов лентивирусов (VCN) (правая ось Y, точки) было измерено. Репрессия GALC экспрессии микроРНК 126 привела к росту высшего количества колоний, по сравнению с GALC.LV трансдуцированными необработанными клетками (n=4 независимых эксперимента). : р 0,01 тестом однофакторного дисперсионного анализа. Фиг. 22. микроРНК 126 регулирование GALC экспрессии предотвращает апоптоз мГКП.a - TUNEL анализ на GALC.микроРНК 126Tag.LV или GALC.LV и GFP.микроРНК 126Tag.LVтрансдуцированных мГКП. 8 полей и 100 клеток были подсчитаны в состоянии. Подавляющее большинство GALC.miRNA126Tag.LV трансдуцированных клеток были отрицательными для TUNIEL.b - TUNEL анализ (красный) и ToPro (TPIII, синий) для окрашивания ядер или GALC.LVGALC.микроРНК 126Tag.LV или GALC.LV трансдуцированных мГПК -/- через 5 дней после трансдукции: репрезентативные изображения (изображения были получены с помощью тройного лазерного конфокального микроскопа - Radiance 2100, BioRad; флуоресцентные сигналы от одиночных оптических секций были последовательно получены и проанализированы программным обеспечением AdobePhotoshop CS, увеличение 40). Фиг. 23. Токсичность новой GALC экспрессии в ГКП и спасение с помощью miR-126 регулирования. Указанные LVs (a) были использованы для трансдукции мышиных и человеческих ГКП, полученных из Galc-/- (-/-) и (+/+) мышей дикого типа, а также пуповинной крови (ПК) и костного мозга (КМ) от нормальных доноров соответственно. GALC активность (b) и вектор количества копий (VCN) (c) были измерены в искусственных условиях потомства культуры, трансдуцированных мышиных (верхние панели) и человеческих (нижние панели) ГКП (объединенные данные -/- и +/+ ГКП показаны в верхней панели С).d - количествоколоний, полученных из клоногенных анализов (CFC), выполненных в конце трансдукции с указанными LV на мышиных -/- (верхняя панель) и человеческих (нижняя панель) ГКП,сообщено.e - TUNEL анализ проводился через два дня после трансдукции с указанными LV на мышиных -/ГКП (верхняя панель) и CD34+ клетках ПК и КМ здоровых доноров (нижняя панель). Частота апоптоза среди трансдуцированных клеток была оценена (% TUNEL+ клетки). Каждая точка представляет собой отдельный образец (b-e).b, e - 8 полей и 100 клеток были подсчитаны для каждого образца. : р 0,05;р 0,01;f - Репрезентативный TUNEL окрашивания на GFP LV-и GALC LV-трансдуцированных ГКП показан. Увеличение 100. Фиг. 24. Улучшение выживания мышей после GLD генной терапии ГСК.Gale-/- или +/+ мышиные ГКП были трансдуцированы с указанными векторами и внутривенно трансплантировании в Trs мышей по экспериментальной схеме (a). Средние выживаниеSD и среднее приживление трансдуцированных клеток измеряется в % отGFP+ клеток или VCN, обнаруженных в костном мозге трансплантированных мышей ( SD) на 120 день или в момент смерти, показаны (n=4-26 на группу).Аналогичные результаты были получены, используя +/+ мГПК. Выживание необработанных GLD мышей показано в первой строке ( = необлученные;b - Человеческие первичные моноциты, В- и Т-лимфоциты и мышиные микроглии были трансдуцированы с указанными векторами. GALC активность (выражена кратно к нетрансдуцированным клеткам UT) измеряли на культивируемых клетках 5 дней посттрансдукции (центральная панель) и TUNEL анализ (выраженный в качестве % TUNEL+ клеток) был выполнен через 2 дня посттрансдукции (правая панель). Данные GALC-трансдуцированных мышиных и человеческих ГКП (из схемы 5) и % TUNEL+ клеток в GFP-трансдуцированных микроглиях приводятся для сравнения. Каждая точка представляет собой отдельный образец, в котором 6 полей и 250 клеток были подсчитаны.c - Репрезентативные изображения TUNEL окрашивания на клетках микроглии, трансдуцированных с GALC LV или GFP LV, как указывалось, окрашивают маркер микроглии F4/80 (GALC трансдуцированных клеток) или GFP. Ядра были обозначены ToproIII (TPIII). Увеличение 100.d - Кривые выживания Kaplan-Meier Trs мышей, трансплантированных либо с Gale -/- ГКП, трансдуцированных с GALC-126T LV (n=26) или Galc/ГКП, трансдуцированных GFP LV (n=10) и необработанных пострадавших контрольных групп (UT) (n=15). GALC-126T по сравнению с GFP при входе ранговые критерии попарного сравнения: р=0,002; GALC-126 по сравнению с UT: p0,0001.e - GALC-126T трансплантированные мыши были разделены на две группы в зависимости от VCN,измеренным от общих КМ клеток на момент смерти. Выживание показано для животных, несущих меньше (среднееSD = 6713 дней) или более (среднееSD = 11743 дней), чем 5 LV копий в клетки,будучи 5 средним VCN, измеряемым в КМ целой популяции обработанных мышей.f - GALC активность (светло-голубая) была качественно оценена в отделах мозга GALC-126T трансплантированных и контрольных мышей. Репрезентативные отделы из гиппокампа (f, g) и варолиева моста (h, i) из GALC-126T трансплантированных мышей, по сравнению с WT и необработанными Trs мышами представлены. GALC анализ был связан с микроглиями/макрофагагами Ibal маркера (f, g) и гематопоэтическим маркером CD45 (h, i). Отмеченное проникновение активированных гематопоэтических клеток присутствует в необработанных и GALC-126T трансплатированных Trs мышах, последний показатель GALC активности и внутри трансдуцированных ГКП гематопоэтического потомства (стрелка в g и i, показывающие совместное окрашивание GALC [в синем] и Ibal [g] и CD45 [i] в коричневом) и в Ibal-,CD45-негематопоэтических клеток. Увеличение 20 в (f, h) и 40 в (g, i). Микро-РНК (miRNA). Центральной догмой биологии с давних пор является то, что генетическая информация идет от ДНК к РНК к белку. Другими словами, было сделано предположение, что гены кодируют белки, а белки выполняют все клеточные функции, в том числе регулирование программ экспрессии генов. Однако лишь меньшинство РНК-транскриптов (2-3%) кодируют белки у высших эукариот, ставя под сомнение центральную догму, что белки являются только эффекторами функционирования клетки (Mercer et al.,2009). На самом деле, в настоящее время есть новые доказательства того, что класс некодирующих малых РНК, называемых "микроРНК", выполняют важную роль в регуляции экспрессии генов. МикроРНК являются (Biffi et al., 2004; Sadelain M., 2006; Sadelain et al., 2005; Газиев et al., 2005; Yesilipek M., 2006;Abonour et al., 2000) нуклеотидными длинными некодирующими РНК, негативно регулирующими экспрессию генов на посттранскрипционном уровне, запуская процесс так называемой РНК-интерференции(РНК-интерференции, см. ниже) (Bartel D.P., 2004). МикроРНК была впервые обнаружена в Caenorhabditis elegans в виде lin-4 и let-7, и они были представлены для регулирования сроков развития личинок. (Leeet al., 1993, Рейнхарт et al., 2000). Это открытие привело к поиску аналогичных некодирующих РНК, контролирующих экспрессии генов у высших эукариот. Открытие, что все организмы выражают микроРНК,многие из которых являются филогенетически и сохраняются у разных видов, было задумано как революция в области биологии. Согласно базе данных микроРНК ссылка (http://microrna.sanger.ac.uk/). 695 различных микроРНК были выявлены у людей на момент написания статьи. МикроРНК были вовлечены почти во всех биологических процессах, включая разработку, дифференциацию, пролиферацию и апоптоз (Xiao и Rajewsky, 2009). Они также играют важную роль при таких заболеваниях, как рак, сердечная недостаточность и нарушения обмена веществ (Xiao et al., 2009; Divaka et al., 2008, Krutzfeldt et al., 2006). МикроРНК гены разбросаны во всех хромосомах человека, за исключением хромосомы Y. Они могут быть расположены в некодирующих областях генома или в пределах интроно, генов, кодирующих белки. Около 50% микроРНК появляются в сочетаниях, которые транскрибируются как полицистроновые первичные транскрипты (Lagos-Quintana et ak., 2003). Как и в генах, кодирующих белки, микроРНК,как правило, расшифрованы с полимеразы-II промоторов, создавая так называемую первичную транскрипцию микроРНК (PRI-микроРНК). Эта PRI-микроРНК затем обрабатывается с помощью ряда эндонуклеотичных шагов расщепления, в исполнении двух энзимов, принадлежащих к типу РНКазы III,Drosha и Dicer. С PRI-микроРНК, стволовой цикл около 60 нуклеотидов в длину, называется мирна предшественником (пре-мирна), выделяется по конкретному ядерному комплексу, состоящему из Drosha и DiGeorge синдрома критической области гена (DGCR8), который культивирует обе цепи у основания первого контура стебля и листьев 5' фосфат и 2 б.п. в длину, 3' в высоту. Пре-мирна затем активно транспортируются из ядра в цитоплазму по RAN-GTP и Exportin-(Yi et al., 2003, Лунд et al., 2004). Затем Dicer выполняет двойную нить, выделенную в конце контура стебля, не определенную надрезом Drosha, гене- 14023938 рируя 19-24 б.п. дуплексов, которые состоят из зрелых микроРНК и противоположной нити дуплекса,называемой микроРНК(Bartel D.P., 2004). В соответствии с правилом термодинамической асимметрии,только одной нить дуплекса, выборочно загруженая в РНК-индуцированный приглушнный комплекс(RISC), накапливается в зрелом микроРНК. Это нить, как правило, такая нить, 5'-конец которой менее тесно сопряжена с е дополнением, как это было продемонстрировано при помощи однонуклеотидных несоответствий, представленных в 5'-конец каждой нити микроРНК дуплексов (Томари и соавт., 2005). Однако есть некоторые микроРНК, которые поддерживают накопление двух дуплексных нитей в аналогичной степени (Шварц et al., 2003). МикроРНК вызвает RNAi, очень похожие на малые интерферирующие РНК (siRNA), которые широко используются для экспериментальных разрушений гена. Основное различие между miRNA и siRNA является их биогенез. После загрузки в RISC, главная нить небольшой молекулы РНК взаимодействует с мРНК целевой последовательностью, преимущественно находящейся в 3'-нетранслируемой области(3'UTR) генов, некодирующих белки. Было показано, что нуклеотиды 2-8, отсчитываемые от 5'-конца микроРНК, так называемой семенной последовательности, необходимы для запуска РНК-интерференции(Brennecke et al., 2005). Если вся последовательность главной нити полностью дополняет мРНК цель, как это обычно бывает для siRNAs и растительного микро РНК, мРНК эндонуклиотически расщепляется,при участии Argonaute (Ago) белка, называемый также "срезом" малого дуплекса индуцированного РНК комплекса сайленсинга (RISC). DGRC (DiGeorge синдром критической области гена 8) и TRBP (TAR(ВИЧ), РНК-связывающий белок 2) двухцепочечные РНК-связывающие белки, которые способствуют развитию биогенеза зрелых миРНК с помощью энзимов Drosha и Dicer РНКазы III соответственно. Главная нить дуплекса микроРНК включена в эффекторный комплекс RISC, в котором принимает конкретные задачи с помощью несовершенного соединения оснований и вызывает посттранскрипционное приглушение генов. Несколько механизмов были предложены для этого режима регулирования: miPHK могут вызывать подавление инициации трансляции, отмечая целевую мРНК деградации с помощью деаденуляции или секвестре цели в цитоплазму ic Р-тела. С другой стороны, при условии, что семя полностью дополняет целевой мРНК, но оставшиеся базы показывают неполное соединение, RNAi действует через несколько механизмов, ведущих к поступательной репрессии (Bartel D.P., 2004; Pillai R.S., 2005; Bartel DP., 2009). Эукариотические деградации мРНК происходят главным образом через сокращение окончания polyA на 3'-конце мРНК, и потерей покрытия в 5'-конце, за которым следует 5'-3' экзонуклеазное пищеварение и накопление миРНК в дискретных цитоплазматических областях, так называемых Р-тел, обогащенных компонентами путей распадаmRNA (Луи и соавт., 2005). МикроРНК, которые полезны в данном изобретении, являются микроРНК, которые выражаются в гематопоэтических стволовых и/или клетках-предшественниках, но которые не выражены широко в дифференцированных клетках. Предпочтительные примеры включают miR-130a, miR-126 и miR-223. Другие подходящие микроРНК включают микроРНК, выраженные в эмбриональных стволовых клетках и так называемых плюрипотентных клетках. Например, микроРНК-302 А, микроРНК-373 и микроРНК 292 специально выражаются в плюрипотентных клетках (ES, IPS), но не у взрослых типа стволовых клеток или дифференцированных клеток. Let-7 семьи микроРНК выражены во всех клетках, за исключением плюрипотентных (ES, IPS). miR-124a специфично выражается в нейронах. Векторы гена. МикроРНК могут быть использованы с подходящим вектором гена, т.е. вектором, подходящим для доставки генов (трансгенов), представляющих интерес, таких как вирусный вектор. Вирусные векторы,подходящие для генной терапии, хорошо известны в данной области. Примеры вирусных векторов полезны для настоящего изобретения, описаны в WO 2007/000668. Вирусы из разных семей были изменены, чтобы генерировать вирусные векторы для доставки генов. Вирусы, которые могут быть использованы в настоящем изобретении, включают ретровирусы, лентивирусы, аденовирусы, аденоассоциированные вирусы, вирусы простого герпеса, пикорнавирусы и альфа-вирусы. Настоящее изобретение предпочтительно работает с ретровирусами, в том числе лентивирусами. Настоящее изобретение может быть использовано для управления экспрессией трансгена, включенного в вектор. Изобретение может быть использовано для управления экспрессией вектора. Например, вектор, который может управляться mir-РНК настоящего изобретения, является онколитическим вирусом. Трансплантация гематопоэтических стволовых клеток. Трансплантация гематопоэтических стволовых клеток является ГСКТ-трансплантацией стволовых клеток крови, полученных из костного мозга (в данном случае известного как пересадка костного мозга) или крови. Трансплантация стволовых клеток является медицинской процедурой в области гематологии и онкологии, чаще всего проводится для людей с заболеваниями крови, костного мозга или некоторых видов рака.- 15023938 При наличии стволовых клеток факторы роста, GM-CSF и G-CSF, большинство процедур трансплантации гематопоэтических стволовых клеток в настоящее время осуществляются с использованием стволовых клеток, собранных из периферической крови, а не из костного мозга. Сбор стволовых клеток периферической крови обеспечивает большее количество трансплантата, не требует, чтобы донор подвергался общему наркозу при сборе трансплантата, результаты видны за более короткое время приживления, а может снизить степень долгосрочных рецидивов. Трансплантация гематопоэтических стволовых клеток остается рискованной процедурой со многими возможными осложнениями, она традиционно зарезервирована для пациентов с угрожающими жизни заболеваниями. Хотя иногда используется экспериментально при доброкачественных и негематологических показаниях, таких как тяжелое инвалидизирующее аутоиммунное заболевание и сердечнососудистые заболевания, риск смертельных осложнений является слишком высоким, чтобы получить более широкое признание. Многие реципиенты ГСКТ являются пациентами множественной миеломы или лейкемии, которые не получили бы пользу от длительного лечения, или уже устойчивы к химиотерапии. Кандидаты на ГСКТ включают педиатрические случаи, когда пациент имеет врожденный дефект, такие как тяжелый комбинированный иммунодефицит или врожденная нейтропения с дефектными стволовыми клетками, а также детей и взрослых с апластической анемией, которые потеряли свои стволовые клетки после рождения. Другие условия, при которых лечение производится трансплантацией стволовых клеток, включают серповидно-клеточную анемию, МДС, нейробластому, лимфому, саркому Юинга, вызывающие развитие фиброзной ткани маленькие круглые опухоли и болезнь Ходжкина. Совсем недавно немиелоаблативные или так называемые "мини-трансплантатные" процедуры были разработаны, которые требуют меньших доз препаративной химиотерапии и радиации. Это позволило ГСК быть привитыми пожилым и другим пациентам, которые иначе считаются слишком слабыми, чтобы противостоять обычной процедуре лечения. Настоящее изобретение направлено на расширение терапевтического применения такого лечения за счет повышения их безопасности и/или эффективности. Заболевания. Настоящее изобретение особенно полезно в генной терапии, в частности тех методов лечения, которые связаны с выражением потенциально токсичного трансгена. Заболевания, которые могут быть обработаны в соответствии с настоящим изобретением, включают лизосомальные нарушения хранения данных (LSD), такие как глобоидная лейкодистрофия клетки (ГЛД). Другим примером болезни, излечимой настоящим изобретением, является хроническая гранулематозная болезнь (ХГБ). Глобоидная лейкодистрофия клетки (GLD), или болезнь Краббе, вызывается мутациями в генеGALC, что вызывает дефицит фермента, называемого галактозилцерамидаза. Накопление неусвоенных липидов влияет на рост защитной оболочки нерва миелина (покрытие, которое изолирует много нервов) и вызывает серьезные дегенерации двигательных навыков. В рамках группы заболеваний, известных как лейкодистрофия, результаты болезни Краббе появляются от несовершенного роста и развития миелина. Лечения генной терапии GLD предполагает вырабатывание GALC гена в организм пациента. Например,GALC может быть вживлен в ГКП или ГСК, которую затем трансплантируют в организм пациента. Авторы настоящего изобретения обнаружили токсичность и в искусственных условиях, и в организме функциональных нарушений мышиных и человеческих ГКП после LV-опосредованного переноса генаGALC и его экспрессии. Эта токсичность может быть преодолена с помощью векторов гена данного изобретения. Доставка одного или более терапевтических генов векторной системой в соответствии с настоящим изобретением может быть использована отдельно или в комбинации с другими методами лечения или компонентами лечения. Например, вектор настоящего изобретения может быть использован для доставки одного или нескольких трансгенов, полезных при лечении расстройств, перечисленных в WO-A-98/05635. Для удобства, часть этого списка теперь предоставляется: рак, воспаление или воспалительные заболевания, кожные расстройства, лихорадка, сердечно-сосудистые эффекты, кровотечение, коагуляция и острая фаза обострения, кахексия, потеря аппетита, острая инфекция, ВИЧ-инфекция, шоковые состояния, отторжение трансплантата, аутоиммунные заболевания, реперфузионное повреждение, менингит, мигрень и аспиринозависимый антитромбоз; рост опухоли, инвазия и распространение ангиогенеза, метастазы, злокачественные асциты и злокачественная плевральная жидкость; ишемия головного мозга, ишемическая болезнь сердца, остеоартрит, ревматоидный артрит, остеопороз, бронхиальная астма, рассеянный склероз, нейродегенеративные заболевания, болезнь Альцгеймера, атеросклероз, инсульт, васкулит, болезнь Крона и неспецифический язвенный колит; пародонтит, гингивит, псориаз, атопический дерматит, хроническая язва, буллезный эпидермолиз; роговичная язвенная ретинопатия и лечение с хирургическим вмешательством; ринит, аллергический конъюнктивит, экзема, анафилаксия; рестеноза, застойная сердечная недостаточность, эндометриоз, атеросклероз или эндосклероз. Кроме того или в качестве альтернативы, вектор настоящего изобретения может быть использован для доставки одного или нескольких трансгенов, полезных в лечении заболеваний, перечисленных вWO-A-98/07859. Для удобства, часть этого списка теперь предоставляется: цитокин и пролиферация кле- 16023938 ток/дифференциация деятельности; иммунодепрессанты или иммуностимулирующее деятельность (например, для лечения иммунной недостаточностью, в том числе инфицирование вирусом иммунодефицита человека; регулирование лимфоцитов роста, лечения рака и многих аутоиммунных заболеваний, и для предотвращения отторжения трансплантата или для развития противоопухолевого иммунитета); регулирование кроветворения, например лечения миелоидных или лимфоидных заболеваний; способствующих росту костей, хрящей, сухожилий, связок и нервных тканей, например, для заживления ран, лечения ожогов, язв и заболеваний пародонта и нейродегенерации, торможение или активация фолликулостимулирующего гормона (модуляция фертильности); хемотаксичная/хемокинестичная деятельность (например, для мобилизации специфических типов клеток на участки травм или инфекций); кровоостанавливающая и тромболитическая активность (например, для лечения гемофилии и инсульта); противовоспалительная активность (например, для лечения септического шока или болезни Крона), в качестве противомикробных препаратов, модуляторы, например, метаболизма или поведения; анальгетики, лечение специфических расстройств дефицита, лечение, например, псориаза, в человеческой и ветеринарной медицине. Кроме того или в качестве альтернативы, ретровирусный вектор настоящего изобретения может быть использован для доставки одного или нескольких трансгенов, полезных в лечении заболеваний,перечисленных в WO-А-98/09985. Для удобства, часть этого списка теперь предоставляется: тормозные макрофаги и/или Т-клетки, ингибирующие активность и, таким образом, противовоспалительную активность; антииммунная активность, т.е. тормозящее действие на клеточном и/или гуморальном иммунном ответе, в том числе ответе, не связанном с воспалением, подавлять способность макрофагов и Т-клеток придерживаться компонентов внеклеточного матрикса и фибронектина, а также до-регулируемых fas рецепторов экспрессии в Т-клетках, подавлять нежелательные иммунные реакции и воспаления, включая артрит, включая ревматоидный артрит, воспаление, связанное с повышенной чувствительностью, аллергические реакции, бронхиальная астма, системная красная волчанка, коллагеновые болезни и другие аутоиммунные заболевания, воспаления, связанные с атеросклерозом, атеросклероз, атеросклеротическая болезнь сердца, реперфузионное повреждение, остановка сердца, инфаркт миокарда, сосудистые воспалительные заболевания, респираторный дистресс-синдром или другие сердечные заболевания, воспаление, связанное с язвенной болезнью, язвенный колит и другие заболевания желудочно-кишечного тракта,фиброз печени, цирроз печени и другие заболевания печени, тиреоидит или другие железистые заболевания, гломерулонефрит или другие почечные и урологические заболевания, отит или другие оториноларингологические заболевания, дерматит или другие кожные заболевания, заболевания пародонта или другие стоматологические заболевания, орхит или эпидидимо-орхит, бесплодие, тестикулярные травмы или другие иммунные, связанные с яичками заболевания, дисфункции плаценты, плацентарная недостаточность, привычный аборт, эклампсия, преэклампсия и другие иммунные и/или связанные с воспалением гинекологические заболевания, задний увеит, промежуточный увеит, передний увеит, конъюнктивит,хориоретинит, увеоретинит, неврит зрительного нерва, внутриглазное воспаление, например, ретинит или цистоидный отек макулы, симпатическая офтальмия, склерит, пигментный ретинит, иммунные и воспалительные компоненты дегенеративных болезней, воспалительные компоненты глазной травмы,глазные воспаления, вызванные инфекцией, пролиферативная витреоретинопатия, острая ишемическая невропатия зрительного нерва, чрезмерное рубцевание, например, следующая фильтрация операция глаукомы, иммунная и/или воспалительная реакция против глазных имплантатов и других иммунных и воспалительных реакций, связанных с глазными заболеваниями, воспаления, связанные с аутоиммунными заболеваниями или условиями или расстройствами, где как в центральной нервной системе (ЦНС) или в любом другом органе, иммунном и/или подавление воспаления было бы выгодно, болезнь Паркинсона,осложнения и/или побочные эффекты от лечения болезни Паркинсона, связанные со СПИДом деменции комплекса, связанные с ВИЧ энцефалопатиии, болезнь Девича, хорея Сиденгама, болезнь Альцгеймера и другиедегенеративные заболевания, условия или расстройства центральной нервной системы, воспалительные компоненты Стокса, синдром постполиомиелита, иммунные и воспалительные компоненты психических расстройств, миелит, энцефалит, подострый склерозирующий панэнцефалит, энцефаломиелит, острая нейропатия, подострая нейропатия, хроническая нейропатия, Guillaim-Барре, Sydenham хоры,миастения, псевдоопухоль мозга, синдром Дауна, болезнь Хантингтона, боковой амиотрофический склероз, воспалительные компоненты ЦНС, сжатие, или травмы ЦНС, или инфекции центральной нервной системы, воспалительные компоненты, мышечная атрофия и дистрофия, и иммунные и воспалительные заболевания, условия или заболевания центральной и периферической нервной системы, посттравматические воспаления, септический шок, инфекционные заболевания, воспалительные осложнения или побочные эффекты хирургии, трансплантация костного мозга и другие осложнения трансплантации и/или побочных эффектов, воспалительные и/или иммунные, и побочные эффекты генной терапии, например,из-за инфекции с вирусными переносчиком, или воспаление, связанное со СПИДом, чтобы подавлять или тормозить гуморальный и/или клеточный иммунный ответ для лечения или смягчения моноцитов или лейкоцитов пролиферативных заболеваний, например лейкемия, за счет сокращения количества моноцитов и лимфоцитов, в целях предотвращения и/или лечения отторжения трансплантата в случаях трансплантации натуральных или искусственных клеток, тканей и органов, таких как роговица, костный- 17023938 мозг, органы, линзы, кардиостимуляторы естественного или искусственного покрова кожной ткани. Настоящее изобретение также относится к фармацевтической композиции для лечения людей путем генной терапии, где композиция содержит терапевтически эффективное количество вектора настоящего изобретения в составе одного или нескольких получаемых терапевтических и/или диагностических трансгенов и/или вирусной частицы, производимой или полученной таким же образом. Фармацевтическая композиция может быть использована для человека или животного. Как правило, терапевт будет определять фактические дозы, которые будут наиболее эффективны для индивидуального субъекта, и они будут меняться в зависимости от возраста, массы тела и реакции конкретного человека. Композиция может необязательно содержать фармацевтически приемлемый носитель, разбавитель,наполнитель или вспомогательное лекарственное вещество. Выбор фармацевтического носителя, наполнителя или разбавителя может быть определн с учетом предполагаемого пути введения и стандартной фармацевтической практики. Фармацевтические композиции могут включать в себя, как или в дополнение, носитель, наполнитель или разбавитель любого подходящего связующего вещества(в), смазки(ок),временного возбудителя(ей), наружного возбудителя(ей), солюбилизирующего возбудителя(ей) и других носителей возбудителей, которые могут помочь или увеличить вирусное проникновение в целевой участок (как, например, система доставки липидов). Где это уместно, фармацевтической композицией можно управлять каким-либо одним или несколькими способами: ингаляцией, в виде суппозитория или пессария, наружно в виде лосьона, раствора, крема, мази или присыпки с использованием на участках кожи, при приме внутрь в форме или в виде таблеток, содержащих наполнители, такие как крахмал или лактоза, или в капсулах или яйцеклетках либо самостоятельно, либо в смеси с наполнителями, или в виде эликсиров, растворов или суспензий, содержащих ароматические или красящие вещества, или они могут быть введены парентерально, например через носовую полость, внутривенно, внутримышечно или подкожно. Для парентерального введения композиции могут быть лучше всего использованы в виде стерильного водного раствора, который может содержать другие вещества, например достаточно соли или моносахаридов, чтобы сделать раствор изотоническим с кровью. При трансбуккальном или подъязычном введении композиции могут быть в виде таблеток или пастилок, которые могут быть сформированы обычным образом. Поставка одного или более терапевтических генов векторной системой в соответствии с настоящим изобретением может быть использована отдельно или в комбинации с другими методами лечения или компонентами лечения. Болезни, которые можно лечить, включают, но не ограничиваются только ими,рак, неврологические заболевания, наследственные заболевания, болезни сердца, инсульт, артрит, вирусные инфекции и заболевания иммунной системы. Подходящие терапевтические гены включают кодирование для опухолевых супрессорных белков, наркотических активирующих ферментов, иммуномодулирующих молекул, антител, сложных молекул иммуноглобулинов, гибридных белков, гормонов, мембранных белков, вазоактивных белков или пептидов, цитокинов, хемокинов, антивирусных белков, антисмысловых РНК и рибозим. Пример 1. Строительство и проверка лентивирусных векторов репортеров микроРНК. Для того чтобы определить активность микроРНК в гемеопатических клетках, в том числе редких и слабоизученных в популяциях, как ГСК, авторы воспользовались собственным предварительным наблюдением, что трансгены, выраженные из лентивирусных векторов, могут быть подавлены при эндогенных микроРНК, для которых искусственные участки связывания (мирт, микроРНК целевые участки) будут добавлены в трансген кассеты (Brown B.D., 2006). Таким образом, была поставлена цель построить лентивирусную микроРНК репортерных векторов, учитывая микроРНК активность в реальном времени и на одной резолюции клетки. Двунаправленные лентивирусные векторы (Bd.LV) позволяют координировать выражение двух генов репортеров, обусловленных конститутивным промотором с двунаправленной деятельностью, состоящей из человеческого фосфоглицерата киназы (PGK) промотора, слитого с ТАТАполем в виде минимального цитомегаловируса (CMV) промотора в противоположной ориентации(Amendola M., 2005). Так как эта конструкция позволяет репортерам быть выраженными как две независимые транскрипции, одна из которых может быть выполнена с реагированием на микроРНК активность,добавив miRT к 3'-UTR ("микроРНК репортер"), в то время как другая, не обеспеченная miRT, не повлияет на микроРНК и будет служить в качестве внутреннего контроля ("нормализатора"). Был создан- 19023938 клон таких двунаправленных векторов (Bd.LVs), содержащих зеленый флуоресцентный белок (GFP) в качестве репортера микроРНК и усеченной формы человеческого небольшого сходства фактора роста нервных рецепторов (NGFR), как конститутивно выраженного нормализатора. Были выбраны для исследования две микроРНК, которые должны быть выражены в гематопоэтической ткани, микроРНК-223 и микроРНК-126-3 р. МикроРНК-223, как сообщалось, высоко и конкретно выражается в дифференцированных миелоидных клетках, но отсутствует в лимфоцитах (Fazi F., 2005),что позволяет проверить работу Bd.LVs репортеров в хорошо изученных линиях. Более того, авторы хотели исследовать, как микроРНК-223 была выражена в гематопоэтических стволовых клетках и клеткахпредшественниках ГКП. С точки зрения генной терапии, было бы весьма актуальным для идентификации микроРНК, которая сильно выражена в ГКП, но не в дифференцированном потомстве, для того, чтобы предотвратить вне целевой экспрессию трансгена в чувствительных популяциях стволовых клеток при полном сохранении терапевтической коррекции больного потомства. Крупномасштабное клонирование микроРНК позволило предположить, что микроРНК-126 может выполнить эти критерии, как это было специально обнаружено в человеческих CD34+ HSPC, но не в других гематопоэтических популяциях клеток (Ландграф и соавт., 2007). Авторы изобретения выпустили репортер Bd.LVs для микроРНК-223 и микроРНК-126-3 Р (Bd.LV223T и 126T-Bd.LV соответственно), а также контроль Bd.LV, не содержащий miRT (схема 1). Эти векторы были тогда оценены по панели различных типов клеток (схема 2). HEK293 Т эмбриональных почечных клеток, U937 моноцитов клеток и эндотелиальные клетки пупочной вены человека (HUVECs) были трансдуцированы с согласованными дозами Bd.LV-CTR, Bd.LV-223 Т и 126T-Bd.LV и проанализирована ярепортера методом проточной цитометрии (FACS) через несколько дней после трансдукции. HEK293 Т клетки выражают от низкого до неопределнного уровня микроРНК-223 или микроРНК-126, в то время как U937 клетки сильно выражают микроРНК-223, но не микроРНК-126 (схема 2) и HUVECs выражают микроРНК-126, но не микроРНК-223 (Kuehbacher et al., 2007). В качестве дополнительного контроля авторы спроектировали HEK293 Т клетки, чтобы эктопически выразить микроРНК-126 (схема 2 а) с помощью трансдукции с LV, содержащие pri-miR-126 под управлением вездесущего промотора (в настоящее время называют HEK293T.LV.miR-126, в отличие от неконтролируемого типа клетки HEK293 Т). В HEK293 Т клетках GFP означает интенсивность флуоресценции (MFI) из NGFR экспрессии трансдуцированных клеток, одинаковый для всех трех Bd.LVs (схема 2 б в левой колонке), подтверждающий, что ни микроРНК-223, ни микроРНК-126-3 р не были выражены в этих клетках. В резком контрасте, U937 клетки, трансдуцированные с Bd.LV.223T, показали существенное сокращение GFP МФО по сравнению с Bd.LV.126T или Bd.LV.ctrl, указывая, что микроРНК-223, но не микроРНК-126, была биологически активна в U937 клетках. Напротив, HUVECs показали репрессию GFP специально дляBd.LV-126T по сравнению с векторным контролем. Точно так же HEK293T.LV.miR-126 клетки, трансдуцированные с Bd.LV126T репортером, сильно регулируется GFP экспрессией по сравнению с неконтролируемым типомHEK293 Т клеток (сравните последний и первый участок в третьем ряду схема 2 б). Для описания микроРНК активности в более количественном выражении, мы вычислили значение"Protein Fold Repression" (FR), основанное на нормированном значении интенсивности флуоресценции(MFI) из микроРНК репортера Bd.LV по управлению Bd.LV (схема 2 с). Для учета различных уровней переноса генов между векторными группами, мы использовали внутренний нормализатор, NGFR, который транскрибируется в стехиометрические суммы с микроРНК репортером, GFP. Таким образом, мы завершили FACS анализ NGFR положительных клеток, и рассчитали "соотношение трансгена" (TGR),деля NGFR MFI по GFP MFI для каждого Bd.LV. TGR, полученные для микроРНК репортерных векторов (Bd.LV.223T или Bd.LV.126T, соответственно) были затем разделены с помощью TGR контроляBd.LV. Это фактор, который мы называем "кратная репрессия" с сегодняшнего дня, не зависит от дозы вектора и уровня трансдукции (по меньшей мере, в пределах линейного участка векторной кривой дозыреакции) и обеспечивает количественный отсчет для микроРНК активности в анализируемых клетках(схема 2 с). miRT были разработаны для того, чтобы идеально дополнять родственные микроРНК. Таким образом, ожидается, что транскрипции, признанные микроРНК, были деградированы. Чтобы доказать это, измерили NGFR и транскрипции GFP мРНК при помощи RT-QPCR в U937 и HEK293T.LV.miR-126 клетки и рассчитанной "RNA кратной репрессией", как указано на схеме 2 с. В самом деле, GFP транскрипции были снижены по сравнению с NGFR транскрипциями U937.Bd.LV.223T клеток, а также вHEK293T.LV.miR-126.Bd.LV.126T клетках, как показано расчтами значения RNA кратной репрессии 7 и 14 соответственно (схема 2 с, алмазы).- 20023938 Взятые вместе, эти результаты показывают, что рассматриваемая микроРНК, регулируемая Bd.LVs,на самом деле подтверждает микроРНК активность в клеточных линиях в соответствии с нашими собственными и ранее опубликованными данными микроРНК экспрессии. В дополнение к традиционным методам профилирования микроРНК, рассматриваемые векторы подтверждают не только наличие микроРНК, но и е биологическую активность. FACS анализ клеток, имеющие рассматриваемый Bd.LV репортер, позволяет оценить микроРНК активность на одном уровне клеток и, таким образом,подходит для анализа гетерогенных смесей клетки, которые могут быть далее разделены иммунофенотипированием. Характеристика микроРНК-223 и микроРНК-126 активности в мышиной гематопоэтической системе. Продемонстрировав надежность репортеров Bd.LVs в измерении активности микроРНК в клеточных линиях, перейдем к исследованию активности вышеупомянутых микроРНК в начальных гематопоэтических клетках. С этой целью воспользуемся мышиным образцом, потому что он широко доступен,легко управляем в экспериментальных условиях и хорошо описан. На самом деле, когда авторы стремились определить микроРНК активность в редких популяциях ГКП, мышиная гематопоэтическая система,хорошо характеризуемая поверхностными маркерами, представляет большое преимущество. Экспериментальный подход был направлен на обогащение мышиной ГКП из костного мозга, разделяя линии положительных клеток, для их трансдукции с векторными лентивирусными репортерами микроРНК и трансплантации этих клеток в смертельно облученных конгенных мышей-реципиентов. МикроРНК активность была тогда контролирована в лейкоцитах периферической крови в течение долгого времени,чтобы определить е активность в дифференцированных клетках. После достижения стабильного приживления мыши были подвергнуты эвтаназии, и микроРНК активность определяли в нескольких популяциях костного мозга, определяя поверхностным иммунофенотипированием. Таким образом, авторы хотели оценить, насколько эти микроРНК были выражены в будущих определенных ГКП. В частности,авторы хотели определить, присутствует ли микроРНК-126 в самых примитивных ГСК участках. Первая группа мышей была трансплантирована с ГКП, трансдуцированных описанным ранее репортеромBd.LV-126T, n=4 мыши). Периферическая кровь (ПК) была собрана через 8 недель после трансплантации, и лейкоциты были отсортированы в соответствии с физическими параметрами и поверхностными маркерами в гранулоцитах (CD11b+ участок scatterhi SSChi), моноцитах (CD11b+ SSClo), В-клетках (CD19+) и Т-клетках (CD11bCD19-) (схема 3 а). GFP репортер микроРНК и NGFR нормализатор экспрессии был подсчитан в этих лейкоцитов с помощью FACS (схема 3b). Хотя GFP был также выражен во всех лейкоцитах, полученных из Bd.LV-CTR и Bd.LV-126 Т-трансдуцированных HSPC, отметим глубокую понижающую регуляциюGFP, в частности, в ПК миелоидных клетках, но не в лимфоцитах Bd.LV-223 Т группы. Количественная оценка микроРНК-223 активности указывала на 30- и 17-кратную репрессию в гранулоцитах и моноцитах соответственно, в то время как микроРНК-126 не была активна в лейкоцитах ПК (схема 3 с). Для того чтобы охарактеризовать микроРНК-223 и микроРНК-126 профиль в отличие от ГКП подмножества, пожертвовали Bd.LV репортерными мышами и подвергали их костный мозг многоцветному анализу иммунофенотипирования с целью выявления в будущем различных популяций клеток-предшественников и стволовых клеток. Было проверено как на мышах, как описано выше, так и в последующем эксперименте на мышах, трансплантированных с ГКП, выраженную более чувствительным микроРНК репортером,основанным на дестабилизированном GFP варианте. Этот репортер содержит пролин-глутамат-серинтреонин- (PEST) последовательность, соединенную с С-окончанием GFP. PEST мотив опосредует быструю протеасомную деградацию и быстрый оборот белка, сокращение полураспада GFP примерно с 26 до 4 ч (Kitsera et al., 2007). Этот короткий полураспад dGFP позволил более точно выявить изменения в микроРНК экспрессии, которые, возможно, происходят во время транзита ГСК по отношению к совершенным предшественникам. Для того чтобы достоверно определить сигнал dGFP, который ниже, чем у стандартного GFP, аутофлуоресценция в каждой отдельной подгруппе была выделена из GFP MFI путем включения группы мышей, несущих Bd.LV-NGFR вектор, который не содержал ген GFP. FACS участки в следующей схеме 4 были получены от КМ мышей с транспортируемыми, более чувствительными векторами Bd.dGFP. Тем не менее, определение микроРНК активности в мышах, несущих стандартный репортер GFP, дало очень близкие результаты, так что кратная репрессия на схеме 3 с может быть рассчитана на объединенных данных двух независимых экспериментов (Bd-CTR, n=10; Bd -223 Т, n=9; Bd-126T,n=13 мышей). Футпринтинг микроРНК активности в мышиной ГКП и их потомстве. Затем были подсчитаны BdLV репортерные белковые уровни в нескольких, перспективно определенных гематопоэтических субпопуляциях, изолированных от восстановленных мышей. Участок HSPC был определен как костный мозг (ВМ) клеток, имеющих c-Kit hi линию маркеров с низким иммунофенотипом, а в дальнейшем был подразделен на части с различной способностью к самообновлению и дифференцирующим потенциалом, основанным на выражении ССС-1, CD150, CD48 и CD45. Следует отметить, что 3 из 5 клеток с иммунофенотипом c-Kit +Sca-1+ Lin- (KSL) CD150hi CD48- предрасположены- 21023938 иметь долгосрочный, мультилинейный потенциал обновления при одной клеточной трансплантации и,таким образом, представляют собой настоящие ГСК (Киль М. Дж., 2005). Более того, основываясь на литературе (Pronk C.J., 2007) и собственных выводах, авторы разделили Kit+Sca-Линии- клеток подмножества, обогащенные гранулоцитами/моноцитами предшественниками (GMP) против предшественников мегакариоцитов и эритроцитов (ЕР) и получившие оценку микроРНК экспрессии. Интересно, что микроРНК-126, miR-130 а и микроРНК-196b показали самую высокую активность на участках, обогащенных самыми примитивными ГСК, и эта активность была потеряна во время ранних стадий дифференциации(схема 4). Важно отметить, что микроРНК-126, miR-130a и микроРНК-196b в значительной степени неактивны в дифференцированных клетках лимфоидной и миелоидной линий, за исключением терминально дифференцированных гранулоцитов, которые, кажется, могут восстановить некоторую степень микроРНК-126 активности. МикроРНК-223 была выражена в большинстве KSL клеток и во всех миелоидных предшественниках (GMP), но при этом был резко снижен уровень в EPs. Как и ожидалось, микроРНК-223 была постепенно увеличена в миелоидной дифференциации, в то время как В- и Тлимфоциты были лишены е (схема 5 а). Кроме того, члены микроРНК-17 92 сочетаний (микроРНК-19,микроРНК-93 а, микроРНК-17-5 р) показали высокую экспрессию в ГКП. Однако их подавляющая активность была сохранена в течение дальнейшей дифференциации, и снизилась в некоторой степени только в терминально дифференцированных В-клетках и гранулоцитах (схема 5 а). Наконец, let-7a сохранила существенную подавляющую активность во всех типах гематопоэтических клеток, в том числе настоящих ГСК, в соответствии с ее вездесущей экспрессией. Защита ГСК от условного самоубийства микроРНК-126. Вышеупомянутые следы активности микроРНК были основаны на перспективе изоляции гематопоэтических клеточных популяций по иммунофенотипу. Для того чтобы окончательно определить активность выбранных микроРНК в функционально определенных подмножествах клеток, была разработана система условного самоубийства на основе лентивирусных векторов, выражающих вирус простого герпеса тимидин киназы (ТК) гена, регулируемого разными последовательностями miRT (схема 6 а). Поскольку ТК является очень стабильной с периодом полураспада около 35 ч, то дестабилизировали белок ТК (сейчас он называется дТК) путем слияния PEST области d4GFP с С-точкой ТК. ГКП были трансдуцированы с одним из указанных векторов самоубийства или вектором GFP контроля и были помещены в полужидкую среду либо в присутствии, либо в отсутствие GCV (схема 6 б). ГКП, трансдуцированные с вектором ТК контроля, не вызывали рост колонии в присутствии GCV. Добавление микроРНК-142 Т последовательности в транскрипцию dTK полностью спасло образование колоний, в соответствии с пангематопоэтической экспрессией этой микроРНК (Brown BD., 2006). Вместо этого, miR-223T, по меньшей мере частично, восстановил рост миелоидных колоний, в то время как число эритроидной колонии было значительно снижено (р 0,001) и не отличалось от контрольных статистически ТК-трансдуцированных клеток. Частичное спасение миелоидных колоний было также достигнуто с помощью микроРНК-126 Т,хотя и на более низком уровне, чем полученное с помощью микроРНК-223 Т. GCV полностью предотвратило рост как миелоидных, так и эритроидных колоний в микроРНК-130 аТ группах в соответствии с резкой понижающей регуляцией miR-130a на ранних стадиях дифференциации. Затем авторы разработали в организме анализ самоубийства, чтобы продемонстрировать активность микроРНК в функционально определенной ГСК.TK/GCV самоубийственная система требует деления клетки, чтобы стать токсичной. Пробные эксперименты совместно с пересадкой ТК-трансдуцированных клеток с нетрансдуцированными КМ опорными клетками показали, что 1-недельный курс GCV в течение первых 2 недель после приживления эффективно устраняет ТК-трансдуцированные долгосрочные размножающиеся ГСК (данные не представлены). Затем трансдуцировали ГКП либо с микроРНК-регулируемым двунаправленным вектором самоубийства, выраженным dTK-126T или dTK-142T и GFP, или контрольным двунаправленным вектором самоубийства, выраженным dTK и ANGFR. Клетки, трансдуцированные с контрольным или одним из микроРНК регулируемым вектором самоубийства, были тогда трансплантированы в конгенных мышей,которые получали или не получали GCV во время фазы приживления (схема 6). Долгосрочный анализ периферической крови химеризма показал, что большинство из NGFR+ клеток были эффективно устранены в GCV-обработанных мышах, в то время GFP клетки сохраняются в + относительно повышенном числе. Это наблюдалось в нескольких линиях (гранулоциты, моноциты, В- и Т-лимфоциты) и 7 месячного срока как для dTK-126T, так и для 142 Т-dTK-трансдуцированных клеток. Эти данные определяют, что как микроРНК-126, так и микроРНК-142 выражаются в долгосрочном размножении ГСК на достаточном уровне, чтобы предотвратить ТК экспрессию белка и гибели клеток, индуцированных GCV. Безопасность эксплуатации микроРНК-126 регулирования для генной терапии. Затем авторы вывели линию трансгенных мышей (Tg.126T мыши), которая собирает зародышевую линию интеграции лентивирусного вектора, выражающего d4GFP.126T транскрипцию из того же промотора, используемую в BdLV исследовании, которая описана выше. FACS анализ Lin- KM клеток молодых мышей, Tg.126T взрослых мышей показал аналогичную картину из микроРНК-126 активности, как это наблюдается в мышах с трансплантацией (схема 7 а). Это подтверждает, что микроРНК-126 физиологически выражается в ГСК. МикроРНК-126, как известно, выражается в эндотелиальных клетках, а с поте- 22023938 рей функции в процессе развития привела к гибели плода из-за дефектов ангиогенеза (Fish JE., 2008). Явные фенотипические аномалии не присутствуют в Tg.126T мышах. Когда Tg.126 мыши были скрещены, пометы нормальных размеров, которые сохранили среднее количество векторных компонентов их родителей, были получены (схема 7b). Эти данные показывают, что экспрессия микроРНК-126 Т последовательностей из фосфоглицераткиназы 1 (PGK) промотора не мешала мышиному развитию, и выступают против гипотезы, что микроРНК-126 Т экспрессия может вмешиваться в регулирование естественных целевых микроРНК-126 в эндотелиальных клетках в этих условиях. Для дальнейшего исключения этого последнего вопроса в гематопоэтических клетках, был проведен конкурентоспособный размножающийся эксперимент. CD45.1+ HSPC были совместно введены равным количеством CD45.2+ HSPC отTg.126T мышей в смертельно облученных CD45.1+ реципиентов. Химеризма периферийной крови была стабильной и сохранялась не менее 1 года (последний момент анализа) на уровне около 40-50% CD45.2+ клеток (n=4) для всех основных линий крови (схема 7 с). В совокупности эти данные свидетельствуют о том, что микроРНК-126 экспрессирует в примитивные ГСК и биосенсорный подход обеспечивает мощные, нетоксичные средства для выявления гематопоэтических клеток на одном уровне клетки на основе микроРНК экспрессии. Характеристика кандидата микроРНК активности в гематопоэтических клетках человека. Характеристика микроРНК-223, miR-130a и микроРНК-126 активности в мышиной гематопоэтической системе позволила предположить эти микроРНК как перспективные эндогенные регуляторы для ограничения токсичности трансгена в ГКП, позволяя при этом терапевтическую экспрессию в дифференцированных миелоидных и лимфоидных клетках. Затем авторы стремились исследовать активность этих микроРНК в человеческих гематопоэтических клетках, которые являются фактическими целями для генной терапии. Авторы трансдуцировали человеческие СВ CD34+ клетки с репортером Bd.LVs дляmiR-126, miR-130a, miR-223 (схема 8 А). Клетки культивировали в искусственных условиях, которые обеспечивают поддержку для краткосрочного сохранения ГКП, и субпопуляции, основанные наCD34/CD38 экспрессии были определены с помощью проточной цитометрии. Миелоидная (CD13+) и эритроидная (CD235+) дифференциация оценивалась с использованием анализа метилцеллюлозы.miR-126, miR-130a и miR-223 полностью подавили их соответствующие репортерные транскрипты вCD34+ ГКП популяции. По дифференциации, микроРНК-223 сохранила активность в миелоидной линии,в то время как она снизилась в процессе эритроидной дифференциации. Напротив, микроРНК-126 потеряла свою активность в течение миелоидной дифференциации, но сохранила е в эритроидном потомстве. Эти модели экспрессии были функционально проверены условным анализом самоуничтожения (схема 8b). miR-130 а потеряли свою активность в обеих миелоидной и эритроидной линиях. Количественная оценка микроРНК активности в соответствующих популяциях (схема 8 А) показала, что среди протестированных микроРНК, микроРНК-126 был самым мощным в микроРНК CD34+CD38- СВ, обогащенным примитивными ГКП. Схема 8c/d показывает дальнейшую оптимизацию miRT последовательности путем объединения miR-126T и микроРНК-130 аТ последовательностей. Пример 2. Вынужденная экспрессия GALC в ГКП. Для того чтобы оценить возможность чрезмерной экспрессии GALC в мышиной ГКП (мГПК), выделили Lin-клетки из FVB/TWI (GALC -/-) мышей. мГПК были трансдуцированы в MOI 100 с GALC.LV в присутствии оптимизированного сочетания цитокинов (Biffi et al., 2004). После трансдукции клетки культивировали 10-14 дней в искусственных условиях для оценки энзимной активности и числа копий вектора (VCN) по Q-PCR. Сравнили уровень экспрессии GALC с гиперэкспрессией других лизосомальных ферментов, арилсульфатазы A (ARSA) и идуронидазы (IDUA), полученных методом трансдуции мГПК с контролем векторов ARSA.LV и IDUA.LV. Все векторы выразили трансген из той же экспрессионной кассеты, содержащей человеческие промоторы PGK. Так как цель заключалась в сравнении гиперэкспрессии энзима в трансдуцированных -/-ГКП по отношению к физиологическим уровням фермента дикого типа ГКП, мГПК, полученной из ARSA КО мышей и от IDUA КО мышей, была использована для трансдукции ARSA.LV и IDUA.LV соответственно. Трансдукция мГПК восстанавливает лизосомальную активность энзима в -/- клетках и ведет к гиперэкспрессии энзима по отношению к неконтролируемым уровням в культивированном потомстве, трансдуцированном -/- мГПК (фиг. 9 А). Тем не менее, увеличение GALC экспрессии (2 раза выше неконтролируемого типа) было значительно ниже по сравнению с увеличением IDUA и ARSA, полученным из IDUA.LV и ARSA.LV контролров (320 и 5,6 кратно по сравнению с неконтролируемым типом соответственно), несмотря на схожие VCN. Аналогичный эксперимент был проведен на человеческих ГКП (чГКП), изолированных черезCD34+, выделенных из СВ, полученных от здоровых доноров (n.d.). чГКП были трансдуцированы в MOI 100 с GALC.LV, ARSA.LV и IDUA.LV, используя ранее оптимизированные протоколы трансдукции 105. Как и в мГПК, авторы оценили энзимную активность восстановления и VCN в искусственных условиях трансдуцированных клеток. GALC.LV трансдукция ГКП из n.d. ПК (n=4) привела к ограниченной гиперэкспрессии энзима в культивированных клетках потомства по сравнению с IDUA.LV (n=3) и ARSA.LV- 23023938 Нарушенные в искусственных условиях функции GALC, выраженных ГКП в LV-опосредованнойGALC экспрессии. Эффекты трансдукции и энзимной экспрессии в потенциальных клоногенных мГПК оценивалисьCFC анализом. Равное число GALC/GFP/ARSA.LV трансдуцированных мГПК были посеяны для анализа колониеобразования. ARSA был выбран в качестве контроля лизосомального энзима, как ранее было показано, не влияющего на ГКП функции (Capontondo et al., 2007). В 12 независимых экспериментахGALC.LV трансдуцированные -/-и +/+ мГПК дали развитие значительно меньшему количеству колоний по сравнению с GFP.LV и ARSA.LV трансдуцированными клетками (фиг. 10 А для GALC -/- клеток). Колонии из GALC.LV трансдуцированных мГПК были заметно уменьшены в размере по сравнению с контрольной группой (фиг. 24 В). Эти результаты показали, что гиперэкспрессия GALC на LV трансдукции ухудшила клоногенный потенциал мГПК. Относительная доля эритроидных и миелоидных колоний при трансдукции GALC.LV была похожа на контрольную (не показано), предполагая, что экспрессия энзима ухудшила различные гематопоэтические линии в той же степени. Сниженный потенциал клоногенных GALC.LV трансдуцированных мГПК может привести к смерти высокотрансдуцированных GALC гематопоэтических предшественников с чрезмерной экспрессией. Для того чтобы исследовать возможности появления отрицательного отбора высокотрансдуцированных мГПК, подсчитали VCN колонии с помощью Q-PCR. Q-PCR проводили на ДНК, извлеченной из каждого пула 4 колоний (пулы были сделаны для того, чтобы иметь достаточное количество материала для анализа). Колонии, полученные из GALC.LV трансдуцированных мГПК, показали значительно низший вектор содержания по сравнению с контрольными (фиг. 10 А), что свидетельствует о появлении отрицательной селекции высокотрансдуцированных предшественников. По этим данным авторы не могли определить, были ли функциональное нарушение и селекция в искусственных условиях из-за токсического действия трансдукции или наличия вредных веществ, выпущенных вектором-производителем клеток и совместно очищенных вектором. Следует отметить, что во время производства GALC.LV, 293T клетки отделяются от пластинки, предполагая, что GALC экспрессия является токсичной для этих клеток. По этой причине включение токсичных молекул, полученных из мертвых 293 Т клеток в векторе подготовки, не может быть исключено. Для решения этой проблемы было получено векторное управление, регулируемое гематопоэтическими специфическими microRNA,GALCmiR-142T.LV 56. Четыре мишени последовательности для микроРНК 142 включены ниже трансгена, позволяя подавить экспрессию в мГПК и в их потомстве без ущерба GALC экспрессии в негематопоэтических клетках, таких как 293 Т LV-продуцирующих клетках. Эта технология основана на микроРНК посттранскрипционной регуляции: микроРНК 142, выраженная только гематопоэтическими клетками,признает е целевую последовательность ниже трансгена и замедляет преобразование транскрипции и экспрессию трансгена. Как и ожидалось, трансдукция мГПК с GALCmiR-142T.LV не была связана с повышением активности GALC (фиг. 10 В). Более того, мГПК, трансдуцированные с GALCmiR-142T.LV(n=6) показали незатронутый клоногенный потенциал и аналогичный вектор содержания по сравнению с контрольной группой, тем самым подтвердив ранее наблюдаемое ухудшение, которое зависит от GALC экспрессии (фиг. 10 А). Было исследовано влияние GALC гиперэкспрессии также и на человеческие ГКП. чГКП были изолированы от n.d. ПК и КМ и из собранных КМ GLD пациента, который должен был быть отвергнутым. Равное количество чГКП были трансдуцированы с GALC.LV или ARSA.LV или GFP.LV векторами контроля и посажены для CFC анализа для того, чтобы оценить клоногенный потенциал трансдуцированных чГКП. Как и в случае с мышиными клетками, GALC.LV, трансдуцированные n.d. и GLD чГКП, показали нарушение клоногенного потенциала (фиг. 11 А). Колонии из GALC.LV трансдуцированных чГКП показали значительно низший вектор содержания, по сравнению с контрольной группой, уменьшенный размер и сохраннную эритроидно-миелоидную пропорцию, снова предлагая отрицательную селекцию высокотрансдуцированных предшественников (фиг. 11 А). Также в этом случае вектор контроля GALCmiR142T.LV был использован, чтобы исключить неспецифический токсичный эффект трансдукции. Как и в случае мышиных клеток, GALCmiR-142T.LV, трансдуцированные чГКП (n=4), показали GALC активность и клоногенный потенциал, аналогичный тому, который наблюдался в контрольных клетках (фиг. 11a и 11b). В целом эти данные показывают, что вынужденная GALC новая экспрессия на трансдукции LV оказывает отрицательный эффект как на мышиных, так и человеческих ГКП, что приводит к отрицательной селекции GALC слишком экспрессирующих клеток и функциональному нарушению. Нарушенная в организме функция ГКП на LV-опосредованной GALC экспрессии. Были проведены в естественных условиях эксперименты с целью оценки потенциала репопуляции м- и чГКП на трансдукции GALC.LV и GALC новой экспрессии. В организме исследования проводились на twi и FVB/twi мышах для чГКП и на Rag2c мышах для чГКП. Первоначальные эксперименты проводились на twi мышах, тяжелых моделях GLD, как описано в разделе "Методы". Первая серия экспериментов была направлена на определение условия ТГК у twi мышей. Общая трансплантация КМ из дикого типа доноров была выполнена у этих мышей, что привело к значительному увеличению продолжительности их жизни до 100 дней, как сообщалось ранее 115. Эти- 24023938 предварительные эксперименты позволили определить оптимальную дозу облучения. Использование донорских ГСК, содержащих CD45.1 аллели, позволило оценить приживление донорских клеток, так какtwi мыши имеют CD45.2 аллеля. Поскольку целью было преобразование twi ГСК, авторы старались создать трансплантацию Lin-ГСК для того, чтобы уменьшить количество клеток, которые будут трансдуцированы и трансплантированы по сравнению с использованием общих клеток КМ. ГКП из дикого типа(+/+) мышей были трансдуцированы в MOI 100 с PGK GFP.LV (GFP.LV) в присутствии оптимизированного сочетания цитокинов (Biffi et al., 2004) (фиг. 12 А). После трансдукции клетки были трансплантированы в смертельно облученных 8 дневных twi мышей или +/- контрольные группы. Контрольные группы включали также twi мышей с трансплантированным диким типом КМ или Lin-клеток. Удивительно, но и в отличие от контрольных животных, ГКП-трансплантированные -/- twi мыши не выжили после смертельного кондиционирования, тем самым предполагая, что Lin-клетки сами по себе не могут вновь заселить twi мышей (фиг. 12b). Таким образом, решено было поддержать GFP.LV трансдуцированное приживление ГКП путем совместной трансплантации нетрансдуцированных КМ-производных гематопоэтических коммитированных клеток-предшественников, обедненных ГКП. Эти клетки были получены магнитным истощениемSca1+ клеток от общего КМ +/+ мышей. Интересно, что twi мыши, трансплантированные с GFP.LV трансдуцированными +/+ Lin-клетками и нетрансдуцированными +/+ Sca1- клетками, достигли выживания,подобного полученному с +/+ общей трансплантации КМ (фиг. 12c). Приживление GFP.LV трансдуцированных ГКП было оценено с помощью проточной цитометрии на периферической крови. Пять-шесть недель после трансплантации цитофлуориметрический анализ показал высокое приживление GFP+ ГКП полученных клеток (фиг. 12d). Таким образом, совместная трансплантация +/+ Sca1-предшественников спасла дефектное приживление очищенных ГКП и позволила продлить жизнь и улучшить фенотип twi мышей, подобно полученному из общего числа +/+ трансплантации КМ (Йегер и др., 1993; Wu et al.,2000). Так как процедуры трансплантации были оптимизированы с +/+ ГКП и GFP.LV, twi мыши были трансплантированы с GALC.LV трансдуцированными -/-ГКП и с или +/+ или GALC.LV трансдуцированными -/- Sca1-клетками. Twi мыши, получившие GALC.LV трансдуцированные -/- ГКП и +/+ нетрансдуцированные клетки, живут значительно дольше, чем мыши, трансплантированные с +/+ общим КМ или с +/+ ГКП и Sca1-предшественниками, и показали улучшение их фенотипа и медленное прогрессирование заболевание (фиг. 12c). Эти данные позволяют предположить, что GALC ГКП гиперэкспрессирующая трансплантация предоставляет уникальное терапевтическое преимущество по сравнению с обычными ГСК. Однако, когда оценивали присутствие GALC.LV трансдуцированных клеток в костном мозге этих мышей с помощью Q-PCR, обнаружили небольшое количество копий вектора (VCN), от 0,8 до 1, что свидетельствует о том, что только GALC.LV трансдуцированные клетки с низким VCN удалось привить. Тем не менее, twi мыши, получившие -/- Lin- и Sca1-клетки, обе трансдуцированные с GALC.LV,умерли после смертельного кондиционирования или имели продолжительность жизни, похожую на необработанных мышей. Эти результаты показали, что GALC.LV трансдуцированные предшественники не в состоянии поддержать ГКП приживление в результате отказа приживления и аутологичного восстановления гематопоэза. Авторы решили использовать FVB/twi мышей вместо обычной twi модели GLD, чтобы воспользоваться преимуществом из чуть менее тяжелой модели: предыдущие эксперименты показали, что успешная трансплантация Lin-клеток без необходимости Sca1-поддерживающих клеток была возможна в этой модели. Более того, FVB/twi мыши имеют большие пометы, что позволяет иметь большее число -/- мышей, чтобы изолировать мГПК. Трансдуцированные мГПК были пересажены в смертельно облученных 8 дневных FVB/twi -/- и гетерозиготных (+/-) реципиентов (схема 13). В целях снижения биологической изменчивости трансплантировали -/- и +/- однопомтных мышей. Мыши контрольной группы были трансплантированы с GFP.LV трансдуцированными +/+ клетками. Для этой контрольной группы эффективность трансдукции была оценена цитофлуориметрией через 7 дней после трансдукции на культуре в искусственных условиях, а приживление трансдуцированных клеток оценивали по цитофлуориметрии в периферической крови через 6 недель после ГСКТ. Эффективность трансдукции была очень высокой, в пределах между 75 и 93%GFP+ клеток. Все GFP-трансплантированные животные показали высокое приживление трансплантированных клеток (между 63 и 85%), и все облученные контрольные группы (смертельно облученные мыши,которые не получили ГСК) умерли в течение 3 недель после кондиционирования, подтвердив тем самым правильные настройки ГСК условий. -/- мыши, получавшие GFP.LV трансдуцированные +/+ мГПК, достигли длительной выживаемости после смертельного кондиционирования (до 150 дней), по сравнению с нетрансплантированными контрольными мышами. Выживание необработанных иGFPтрансплантированных FVB/twi мышей было больше по отношению к наблюдаемому в соответствующих группах twi мышей, подтвердив тем самым влияние генетического фона на тяжесть фенотипа. Приживление трансдуцированных мГПК также было оценено с помощью Q-PCR на ДНК, извлеченной из КМ трансплантированных мышей, пожертвовав ими. Значительное приживление GFP.LV трансдуцирован- 25023938 ных мГПК, измеряемых как VCN на геном, наблюдалось (табл. 2). Поразительно, обе -/- и +/- мыши,трансплантированные с GALC.LV трансдуцированными -/- или +/+ мГПК, не дожили до смертельного облучения (смерть в течение 21 дней, подобно той в контрольных группах) (фиг. 13 и данные не представлены). Q-PCR оказался очень низким до неопределяемого VCN в своих КМ (табл. 2). Эти результаты показали функциональные нарушения GALC-трансдуцированных мГПК, которые были не в состоянии населить смертельно условного хозяина. Апоптоз GALC экспрессии мышиных и человеческих ГКП. Обнаружив функциональные нарушения GALC.LV трансдуцированных ГКП, авторы оценили, могло ли это произойти из-за апоптоза трансдуцированных клеток в посредничестве с новой GALC экспрессией. Возникновение апоптоза было оценено в двух различных точках времени, 2 и 5 дней после трансдукции, когда экспрессия трансгена предположительно достигает стабильного состояния (см. GFP экспрессия на фиг. 14b) с помощью Annexin V окрашивания и TUNEL анализа. Первый метод категоризирует ранний апоптоз клеток, а второй - поздний апоптоз клеток, м- и чГКП были трансдуцированы сGALC.LV и контрольными GFP/ARSA.LV. После трансдукции и абсорбции клетки были помещены на матригель-покрытые поверхности для анализа TUNEL или культивированы в обычных пластинах и окрашены для Annexin V и TUNEL. В конфокальной микроскопии большинство GALC.LV трансдуцированных мГПК были TUNEL положительные и показывали увеличенные ядра с конденсированным хроматином, что свидетельствует о широком распространении апоптоза в обеих временных точках(фиг. 14a, 14b). Напротив, ARSA/GFP.LV трансдуцированные клетки были в основном TUNEL отрицательными. Annexin V окрашивание подтвердило появление апоптоза, показывая больший процент апоптотических клеток среди GALC-трансдуцированных м- и чГКП, по сравнению с контрольной группой(фиг. 14c). Чувствительность к GALC экспрессии токсичности зависит от дифференциации и клеточной линии. Макрофаги и микроглии представляют ГКП эффекторное потомство, воссоздающее активность фермента в пораженных тканях, в том числе нервной системе, в подходах ГКП генной терапии для LSD. Авторы оценили, могут ли прототипичная клеточная линия моноцитов (U937), первичные человеческие моноциты, первичные мышиные макрофаги и микроглии наблюдаться в GALC экспрессии токсичности на LV опосредованном переносе генов. Более того, для дальнейшего анализа специфики GALCиндуцированного апоптоза вместе с гематопоэтической дифференциацией протестировали Т- и В-лимфоциты. Чтобы разрешить GALC иммунодетекцию и эффективность оценки трансдукции, в некоторых экспериментах использовали С-неизлечимо помеченный трансген, в котором ген сливается в рамке с последовательностью, кодирующей НА пептид из белка гемагглютинина вируса гриппа человека. НА-помеченный энзим имел специфическую активность, сравнимую с активностью немодифицированного энзима, и был тщательно сортирован по лизосомальным ячейкам (данные не представлены). После трансдукции оценили в разные моменты времени возникновение апоптоза TUNEL анализа и GALC активности. Как и ожидалось, все проанализированные типы клеток показали различные уровни базальнойGALC активности (фиг. 17). Макрофаги мышей были получены как присоединнная часть перитонеальной совокупности клетки. Первичные культуры микроглии были выделены из мозга +/+ и -/- FVB/twi мышей установленными протоколами (Armstrong R.C., 1998; et al., Gritti et al. 1996). Кроме того, протестировали оба первичных моноцита и U937 клеточную линию моноцитов. Человеческие моноциты были изолированы от РВМС положительной селекцией CD14 моноцитарного маркера. Условия трансдукции были созданы, используяGFP.LV и анализ эффективности трансдукции с помощью цитофлуориметрии (когда это возможно) либо с помощью конфокальной микроскопии. После трансдукции протокол был оптимизирован, микроглии и макрофаги эффективно трансдуцированы с GALC.LV/GALC-HA.LV и векторами контроля в MOI 50 и 200 соответственно и выраженных GALC выше базальных уровней (фиг. 18). Даже тогда, когда высокие уровни экспрессии (до 40 раз до wt уровня) были достигнуты, TUNEL анализ показал низкую частоту или отсутствие апоптоза следующей GALC.LV трансдукции и GALC гиперэкспрессию во всех клетках(фиг. 18). Никаких различий не наблюдалось между +/+ и -/- микроглией (фиг. 18 и другие данные не приводятся). Эти результаты показывают, что эффекторные клетки ГСК генной терапии не чувствительны к токсичности GALC, тем самым предполагая, что с целью развития ГСК стратегии генной терапии для GLD, GALC экспрессии следует избегать в ГКП, тогда как она должна быть повышена в дифференцированных миелоидных гематопоэтических клетках, способных нацелеванию энзима на пораженные ткани. Человеческие Т- и В лимфоциты были получены при РНА-стимуляции и EBV трансформации общего числа РВМС соответственно. Как и в экспериментах с моноцитами и макрофагами, трансдукция была оптимизирована с помощью GFP.LV и проточной цитометрии. В-лимфоциты были эффективно трансдуцированы с GALC.LV/GALC-HA.LV и векторами контроля в MOI 100, пока две дозы в MOI 100 были использованы для Т-лимфоцитов. Несмотря на устойчивый рост на GALC активность при трансдукции, не апоптоз был обнаружен на всех рассматриваемых временных точках (фиг. 19), тем самым еще больше поддерживая понятие, что дифференцированные гематопоэтические клетки не чувствительны к- 26023938 В искусственных условиях регуляция GALC экспрессии с помощью miRNA126. Для того чтобы оценить влияние miRNA126 регулируемой GALC экспрессии в ГКП, авторы трансдуцировали мГПК с GALC.miR-126T.LV, или с GFP.miR-126T.LV, или GALC.LV в MOI 100. После абсорбции клетки были посеяны для CFC анализа или культивированы в искусственных условиях в течение двух недель для GALC анализа активности и Q-PCR анализа. Трансдукция с GALC.miR-126T.LV разрешает реконструкцию GALC активности на супрафизиологических уровнях в дифференцированном мГПК потомстве до 2 раз, по сравнению с диким типом уровней. Важно отметить, что число колоний,полученных из мГПК трансдуцированных с GALC.miR-126T.LV, было подобно контрольным группам и было почти 2-кратно по отношению к GALC.LV колониям (схема 21c), тем самым предполагая, что регулирование GALC экспрессии miRNA126 позволило сохранить клоногенный потенциал трансдуцированных мГПК. Эти обнадеживающие результаты побудили оценить, должен ли непораженный клоногенный потенциал спасти от апоптоза GALC.miR-126T.LV трансдуцированных мГПК. После трансдукции мГПК были посеяны на matrigel-покрытую поверхность, и TUNEL анализ был выполнен после 2 и 5 дней культивирования. Уровень апоптоза был оценен с помощью конфокальной микроскопии. TUNEL анализ на GALC.miR-126T.LV трансдуцированных клетках показал незначительный или вообще отсутствие апоптоза как на временных точках (1% 1 и 3% 2 на 2 и 5 дней соответственно), подобно тому как это наблюдалось в клетках, трансдуцированных с контролем LV. (фиг. 22a, 22b). Эти данные показали, что подавление GALC экспрессии miRNA126 смогло спасти мГПК от GALC-индуцированного апоптоза. Регуляция GALC экспрессии с помощью miRNA126 в организме. Влияние miRNA126 регулируемой GALC экспрессии в мГПК потенциале репопуляции было оценено в +/- FVB/twi мышах. Смертельно облученные 8-дневные мыши были трансплантированы сGALC.miR-126T.LV трансдуцированных -/- мГПК или с PGK GALC.LV трансдуцированными клетками и выживаемость была оценена в кратко- и долгосрочной перспективе. Подобно тому, как наблюдалось сCD11bGALC.LV, +/- FVB/TWI мыши, трансплантированные с GALC.miR-126T.LV трансдуцированными мГПК, были спасены от летальности и пережили длительный срок (более 3 месяцев после ТГСК), в отличие от PGKGALC.LV-трансплантированных мышей, которые не выжили после смертельного кондиционирования. Когда мышам трансплантировали с GALC.miR-126T.LV, трансдуцированные мГПК были подвергнуты эвтаназии в возрасте 80 дней, и Q-ПЦР-анализ был проведен на КМ, авторы обнаружили среднее VCN из 5, подтвердив тем самым наличие трансдуцированных клеток в КМ долго после ТГК. В целом, эти результаты вместе с теми, которые наблюдаются с CD11bGALC.LV трансдуцированными клетками, показали успешное спасение GALC дефицита и защиты от новой GALC экспрессии в ГКП улучшенной регулируемой стратегии генной терапии. Принудительная GALC экспрессия является токсичной для ГКП, но не дифференцирует гематопоэтические клетки. Чтобы разработать модель генной терапии, трансдуцировали ГКП от дикого типа и GLD мышей,несущих точечную мутацию, приводящую к 5% остаточной активности энзима (TRS)45, с GALC илиGFP-экспрессирующими векторами лентивирусов (фиг. 23 а). Трансдукция с вектором GALC восстановила GALC активность в культивируемом потомстве GLD клеток, ведущих к 2-кратной гиперэкспрессии по сравнению с GFP-трансдуцированными клетками дикого типа (фиг. 23 в). Аналогичные уровни экспрессии наблюдались при трансдукции дикого типа мышиных ГКП, а также человеческих CD34+ ГКП от нормальных СВ или КМ (фиг. 23 в). Неожиданно, принудительная GALC экспрессия нарушила клоногенную активность как человеческой, так и мышиной ГКП по сравнению с GFP-трансдуцированных клетками (фиг. 23d и данные не представлены). TUNEL анализ, проведнный через два дня после трансдукции, показал, что большинство GALC-, но не GFP-трансдуцированных ГКП были TUNEL положительные и показали увеличение ядер с конденсированным хроматином (фиг. 23 е и 23f). Эти результаты показывают, что клоногенное нарушение из GALC-трансдуцированных ГКП было связано с индукцией апоптоза, а также подтвержднным annexin V окрашиванием (не показано). Функциональные нарушение ГКП непосредственно вызвано принудительной/новой GALC экспрессией, а не токсичностью, связанной с вектором подготовки, так как ГКП, трансдуцированные с микроРНК-142-регулируемым, GALC кодирующим вектором лентивирусов, показали нормальную клоногенную активность и отсутствие апоптоза. В самом деле, 142 Т последовательность подавляется GALC экспрессией энзима в гематопоэтических клетках, но не в LV производных клетках 33 (фиг. 23b). Принудительная/новая GALC экспрессия была также токсична для долгосрочных привитых клеток, а GALC-трансдуцированным мышиным ГКП не удалось спасти Trs мышей от смертельного облучения (фиг. 24 а). После трансплантации ГСК макрофаги и микроглии являются эффекторным потомством, ответственным за воссоздание GALC активности в пораженных тканях. Чтобы проверить, влияет ли токсичность принудительной/новой GALC экспрессии на дифференцированные клетки, трансдуцировали человеческие первичные моноциты, Т- и В-лимфоциты, а также мышиные клетки микроглии с GALC- или контрольными векторами (фиг. 24b). Хотя эффективная трансдукция и GALC гиперэкспрессия были достигнуты во всех типах клеток, TUNEL анализ показал низкий или нулевой апоптоз в культурах(фиг. 24b и 24c). Таким образом, чувствительность к GALC экспрессии является уникальной особенно- 27023938 стью ГКП, которая не наблюдалось в зрелых гематопоэтических клетках.miR-126 регулирование спасает ГКП от GALC экспрессии токсичности и дает возможность генной терапии GLD. Селективная токсичность новой GALC экспрессии в ГКП подчеркивает необходимость жесткого регулирования экспрессии трансгена в ГКП для успешной генной терапии GLD. Таким образом, протестировали эффективность новой miR-126, основанной на системе регулирования и сравнимой с е транскрипционной стратегией, основанной на миелоидно-специфичных CD11b промоторах к целевой GALC экспрессии дифференцированного ГКП потомства. Обе стратегии спасли трансдуцированные ГКП отGALC- вызванной токсичности (см. фиг. 23b-23e). Тем не менее, восстановленная GALC активность была значительно выше (в 2 раза, чем у уровня дикого типа) в потомстве клеток, трансдуцированных сGALC-126T лентивектором (в котором GALC экспрессия становится активной с помощью PGK промотора), чем в CD11b-GALC трансдуцированных клетках, даже если сравнить культуры, трансдуцированные с аналогичным количеством копий вектора (фиг. 23b и 23c). Авторы также убедились, чтоGALC.126T вектор лентивирусов эффективно защитил человеческую ГКП от GALC токсичности (схема 23c и 23d). Учитывая вероятное преимущество от сверхфизиологической активности энзима в зрелых гематопоэтических клетках, выбрали микроРНК-регулируемый вектор для исследования GLD терапии в организме. ГКП от Trs мышей были трансдуцированы с GALC-126T вектором лентивирусов и трансплантированы в новорожденных Trs мышей. Трансплантированные мыши были успешно привиты (фиг. 24 а) и показали значительно более долгое выживание не только по отношению к необработанным Trs мышам(р 0,0001), но и к мышам, трансплантированным с диким типом GFP-трансдуцированных ГКП (р=0,002; фиг. 24a и 24d). Более того, когда стратифицировали генную терапию мышей по количеству копий вектора, измеряемого в КМ, животные с высоким содержанием вектора показали значительно более долгое выживание (фиг. 6 е), уверенно предполагая, что суперфизиологическая экспрессия энзима в гематопоэтических клетках увеличивает терапевтическую эффективность ГСК трансплантации. Действительно,эффективная доставка функционального GALC энзима в поврежднный мозг и восстановление дефектной активности наблюдались в мозге Trs мышей, лечимых генной терапией (фиг. 24f-24i). В центральной нервной системе мышей GALC активность была обнаружена как в Iba1+, CD45+ проникающих гематопоэтических клетках, а также и в Iba1-, CD45- негематопоэтических клетках (фиг. 24f-24i), демонстрирующих перекрстную коррекцию клеток резидентов, вероятно из-за секреции энзима потомством, трансплантированных и трансдуцированных ГКП. Важно отметить, что восстановление активности энзима и увеличение выживаемости были связаны с улучшением фенотипа обработанных мышей, по сравнению с необработанными пораженными контрольными группами, с сохраненными способностями к ходьбе и снижением судорожного сокращения (GLD-связанные интенционные дрожания). Обсуждение. Глубокое профилирование экспрессии микроРНК в гематопоэтической системе. МикроРНК репортерные векторы, используемые в этой работе, дают возможность измерять микроРНК биологическую активность, а не полагаться только на уровни экспрессии микроРНК, обеспечивая тем самым биологически значимое, количественное считывание функции микроРНК. Brown et al. предположили, что пороговый уровень экспрессии микроРНК должен быть достигнут для значительной подавляющей активности в отношении появления микроРНК целей, которые могут быть результатом предельной RNAi структуры, доступной в клетке (Brown et al., 2007). Если малые РНК конкурируют за ограниченные RNAi эффекторные комплексы, достаточно высокий уровень экспрессии может быть необходим для обеспечения включения микроРНК в активную RISC. Таким образом, те виды микроРНК, которые выражаются до очень низких уровней, могут иметь небольшую или отсутствие активности, потому что они не являются частью функционирования RISC. Исследования микроРНК профилирования часто рассматриваются только в относительных различиях в экспрессии микроРНК и, таким образом, показывают статистически значимые различия, которые, тем не менее, могут и не иметь никакого отношения к регуляции генов. Сочетание широты геномозначимого анализа экспрессии микроРНК (например, с помощью микроматриц или глубоко секвенирования) с микроРНК репортерным Bd.LV подходом добавляет новый аспект в изучение микроРНК. Это позволяет строго проверить биологическую значимость дифференциальной экспрессии микроРНК и может быть использовано для продольного изучения экспрессии выбранного микроРНК по нескольким клеточным популяциям, с одним клеточным расщеплением и в живых клетках. Авторы использовали этот подход для изучения экспрессии выбранной микроРНК в редких и труднодоступных клеточных популяциях, таких как ГСК. Проведенные исследования микроРНК репортерного вектора не только подтвердили данные о miR-223 и miR-126 экспрессии профилей,описанных в литературе, но добавили дополнительную информацию об активности этих микроРНК в высокочистых ГКП субпопуляциях и их потомстве. miR-223 ранее уже была описана, в изобилии выраженная в миелоидной линии мышей и людей (Chen et al., 2004; Fazi et al., 2005, Rosa et al., 2007). Действительно, данные репортерного вектора обнаружили высокую активность miR-223 в гранулоцитах. Более того, активность miR-223 также была найдена в моноцитах и в иерархии ГКП, в частности в предшественниках, стремящихся к гранулоцито-моноцитной линии. Данные позволяют предположить, что, по- 28023938 меньшей мере, некоторые плюрипотентные гематопоэтические клетки выражают miR-223 как в мышах,так и в людях. Одна возможность заключается в том, что эти клетки нацелены на гранулоцитомоноцитный метаболический путь. Двунаправленные репортерные векторы позволяют фракционирование этих ГКП популяций по miR-223 экспрессии и исследовании их потенциала дифференциации. Эти исследования могут обеспечить новый способ перспективного выявления миелоидных предшественников, опираясь не только на поверхностные маркеры, и, возможно, исследовать самые ранние шаги линии дифференциации. Экспрессия miR-126 в гематопоэтической системе до сих пор была слабо изучена. Широкое, основанное на глубоком секвенировании исследование микроРНК профилирования широко присваивается к его CD34+ ГКП. Теперь покажем, что miR-126 работает в мышиных и человеческих ГКП, в частности в рамках подмножеств, обогащенных самыми примитивными ГСК. На ранних стадиях дифференциации активность miR-126 постепенно уменьшается. Ассоциация miR-126 для человеческих ГСК еще более подтверждается анализом BdLV.126 Т-трансдуцированных СВ ГКП, недавно изолированы от NOD/SCID мышей, выполненным сотрудником на UHN, Торонто (Lechman et al., 2008, ASH, аннотация). Данные подтверждают стволовую/раннюю предшествующе специфическую экспрессию шаблона для miR-126, с сайленсингом в большинстве нижних линий. Интересно, что подгруппа острого миелобластного лейкоза (ОМЛ), характеризуемая мутациями в"ядро-связующем факторе" (CBF), выражает высокие уровни miR-126 121. Авторы определили полоподобные киназы (PLK-2 А проверенная цель miR-126. PLK-2 была признана в качестве регулятора клеточного цикла и может действовать как опухолевый супрессор гена в гематологических заболеваниях. С учетом жесткой ассоциации miR-126 с ГСК авторы изобретения изучают в сотрудничестве с группой Джона Дика на UHN, Торонто, активность miR-126 в лейкозных стволовых клетках (LSC), редкие субпопуляции которых стоят на вершине развития иерархии AML, которая, как полагают, отвечают за стойкость к химиотерапии и рецидив (Barabe et al., 2007, Kennedy et al., 2007). Предварительные результаты показывают, что AML образцы, в частности, принадлежащие к другим подгруппам, чем CBF-AML, проявляют градиент экспрессии miR-126, будучи самым высоким в LSC-обогащенной CD34+38- фракции и низким в непривитой фракции. Эта модель активности miR-126 сохранена в трансплантации LSC в иммунодефицитных NOD/SCID мышах. Таким образом, активность miR-126, визуализированная репортером Bd.LV лентивирусов, может служить новым биомаркером и потенциально терапевтической мишенью для лейкозных AML стволовых клеток (Lechman et al., 2008, ASH, аннотация). За пределами гематопоэтической системы miR-126 была тщательно описана как положительный регулятор ангиогенезной индукции в эндотелиальных клетках. Ангиогенез описывает формирование новых кровеносных сосудов за счет роста уже существующих судов. Сигналы, содействующие ангиогенезу,включают фактор роста эндотелия сосудов (VEGF) и основной фактор роста фибробластов (bFGF), которые активируют митоген-активированную протеинкиназу (МАРК) и фосфоинозитидную 3-киназу(PI3K), каскады, регулирующие моторику и пролиферацию эндотелиальных клеток, и последующее прорастание сосудов. miR-126 имеет две оцененные мишени, участвующие в процессе ангиогенеза, прорастающе-связующий EVH1 домен, содержащей белок (Spred1) и регуляторную субъединицу PI3K, оба отрицательных регулятора VEFG/FGF индукции. Эндотелиальные клетки с недостатком miR-126 не реагируют на сигналы ангиогенеза. Разрушение miR-126 в полосатом данио привело к потере сосудистой целостности и кровотечения во время эмбрионального развития (Fish et al., 2008), в то время как удалениеmiR-126 у мышей является причиной протекания сосудов, кровотечения и частичной эмбриональной смертности в связи с потерей сосудистой целостности и дефектов в пролиферации эндотелиальных клеток, миграции и ангиогенезе (Wang et al., 2008). Таким образом, miR-126 выражается в биологически соответствующих уровнях в ангиогенных эндотелиальных клетках, а также гематопоэтических стволовых клетках и их ближайшем потомстве. Интересно, что экспрессия miR-126 является еще одним фактором, который является общим для эндотелиальных клеток и ГСК. На самом деле, во время эмбрионального развития одновременное появление эндотелиальных и гемопоэтических клеток (эритроцитов) в желточном мешке и последовательное появление ГСК и эндотелиальных клеток в aorta-gonado-mesonephros области (AGM) подчеркивают общее происхождение этих 2 линий, возникающих с так называемого "гемангиобласт" клеточной популяции. Не удивительно, что растущий список генов, изначально предполагая, что он выражен исключительно в эндотелии сосудов, которые оказались в ГСК, факторах транскрипции и мембранных рецепторах, таких какTie2 рецепторы, ССС-1, VEGFR-(Flt-1), VEGFR-(Flk-1) и CD31. С учетом функциональной и анатомической связи между микроциркуляторной частью и ГСК в процессе развития и во взрослом костном мозге miR-126 может способствовать гомеостазу гемопоэтической ниши и регулированию пролиферации двух е эндотелиальных и ГСК компонентов. Вмешательство микроРНК-регулируемой LV с микроРНК функцией. Одним вопросом по поводу использования микроРНК регулирования является возможность вмешиваться в регулирование природных микроРНК целей с помощью гиперэкспрессивной транскрипции,содержащей последовательности miRNA цели. Для того чтобы понять биологию и безопасность микроРНК-регулируемой LV, авторы подсчитали требуемую дозу для насыщения активности микроРНК
МПК / Метки
МПК: C12N 15/85, C12N 15/63, C12N 15/113, A61K 48/00
Код ссылки
<a href="https://eas.patents.su/30-23938-vektor-gena.html" rel="bookmark" title="База патентов Евразийского Союза">Вектор гена</a>


































