Способ лечения пациента, страдающего i или ii стадией системной красной волчанки
Номер патента: 22911
Опубликовано: 31.03.2016
Авторы: Гросс Джейн А., Визич Дженифер, Несторов Иван, Басби Шарон Дж., Мунафо Ален, Папасоулиотис Орестис, Пена-Росси Клаудиа
Формула / Реферат
1. Способ лечения пациента, страдающего I или II стадией системной красной волчанки, включающий еженедельное введение в дозе приблизительно от 1 до приблизительно 10 мг/кг в течение приблизительно от 2 до приблизительно 52 недель слитой молекулы, которая включает:
(i) TACI внеклеточный домен или его фрагмент, который связывается с BlyS;
(ii) константный домен иммуноглобулина человека.
2. Способ по п.1, где указанный TACI внеклеточный домен имеет последовательность, включающую SEQ ID NO: 1.
3. Способ по п.1, где указанный TACI внеклеточный домен является по крайней мере на 50% идентичным SEQ ID NO: 1.
4. Способ по п.1, где указанный TACI внеклеточный домен имеет последовательность, включающую аминокислоты 30-110 SEQ ID NO: 1.
5. Способ по п.1, где указанный константный домен иммуноглобулина человека имеет последовательность, включающую SEQ ID NO: 2.
6. Способ по п.1, где указанная слитая молекула представляет собой атацицепт.
7. Способ по п.1, где указанная композиция вводится в количестве приблизительно от 1 до приблизительно 9 мг/кг.
8. Способ по п.1, где этот способ предусматривает дополнительное введение пациенту второго лекарственного средства, которое выбрано из группы, состоящей из NSAID, противомалярийных средств, кортикостероидов, иммуносупрессивных агентов, IVIg, DHEA и талидомида.
9. Способ по п.8, где указанная слитая молекула представляет собой атацицепт.
10. Способ по п.1, где указанная слитая молекула вводится подкожно, перорально или внутривенно.
11. Способ по п.1, где пациент представляет собой человека.
Текст
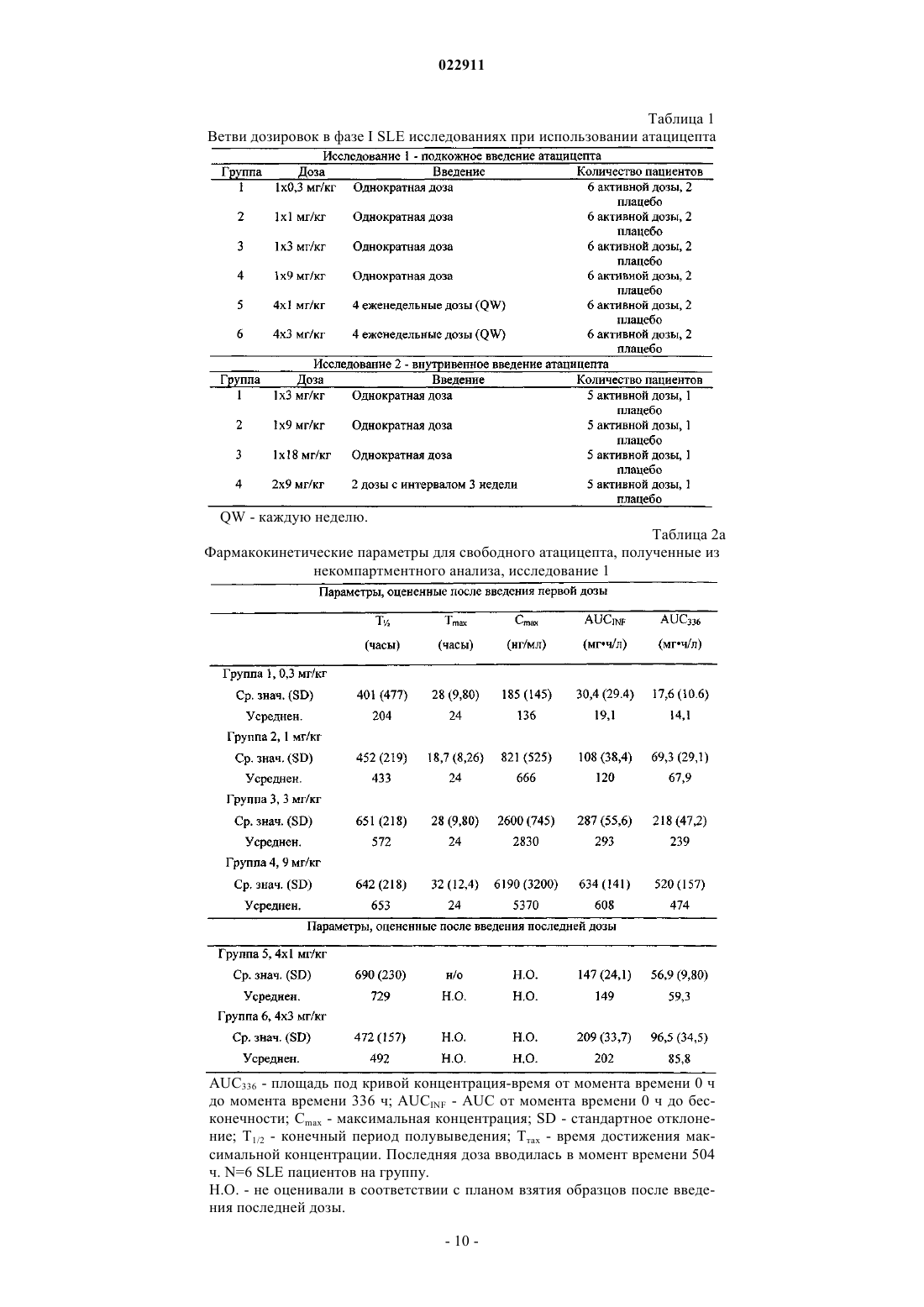
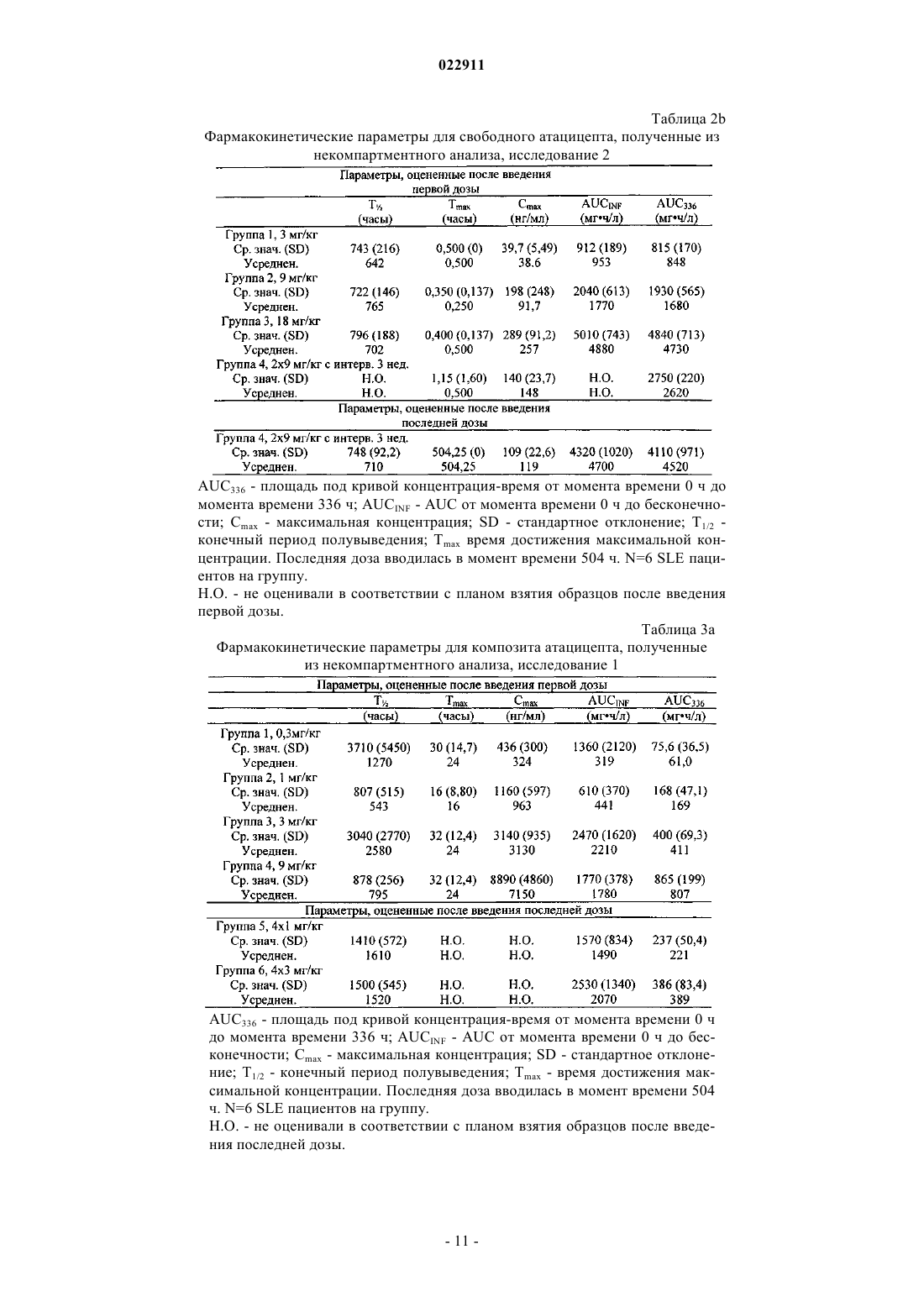
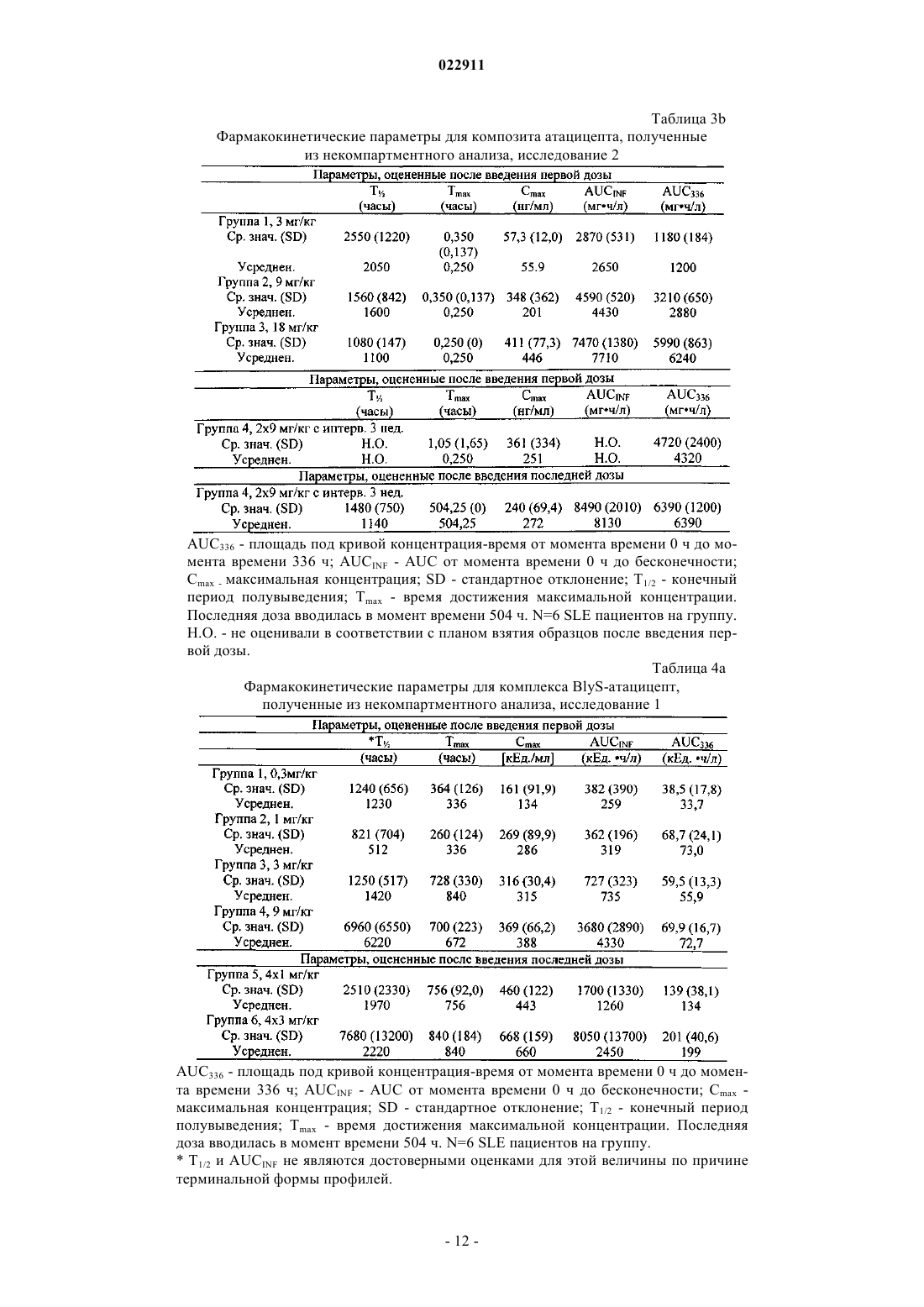
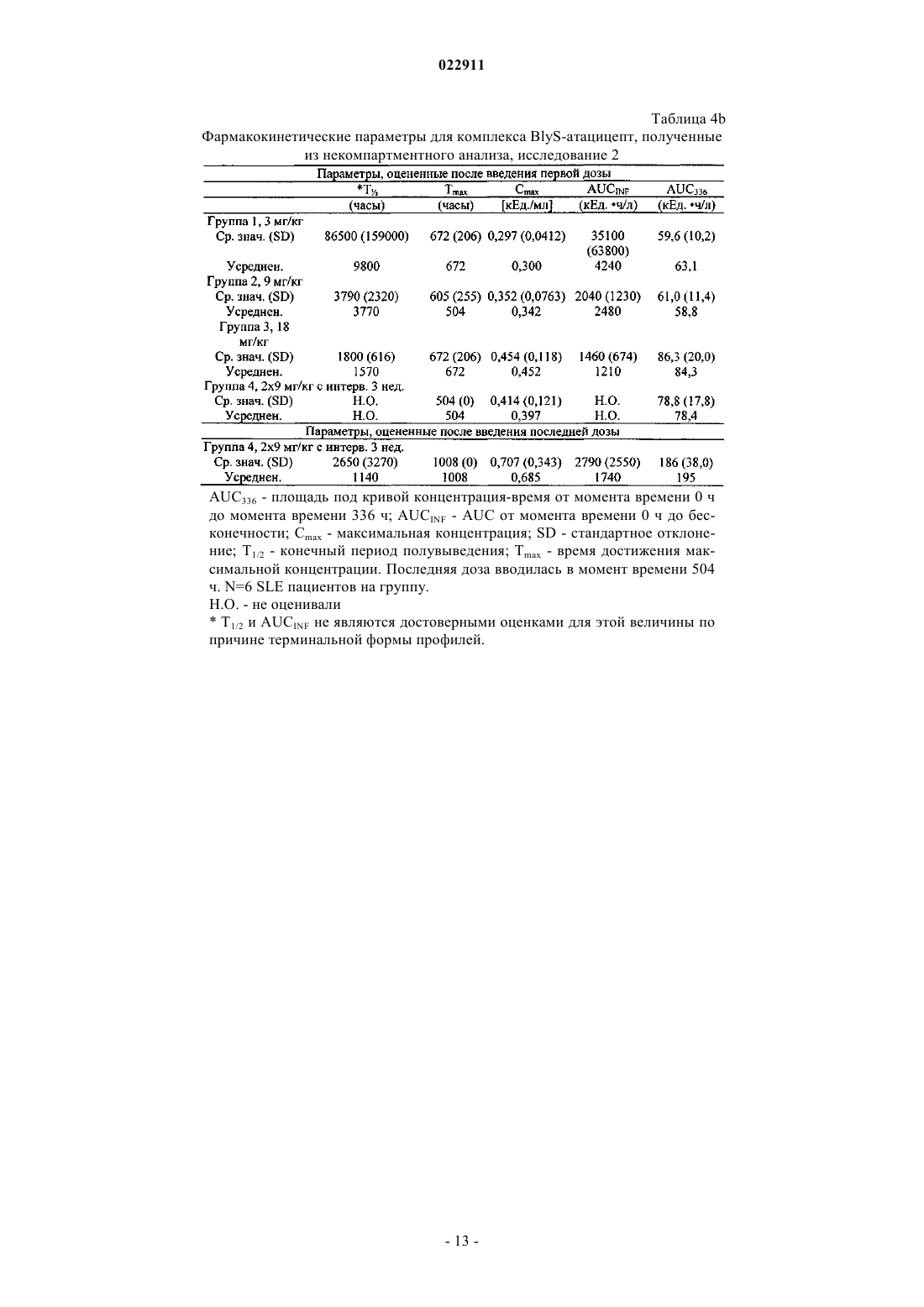
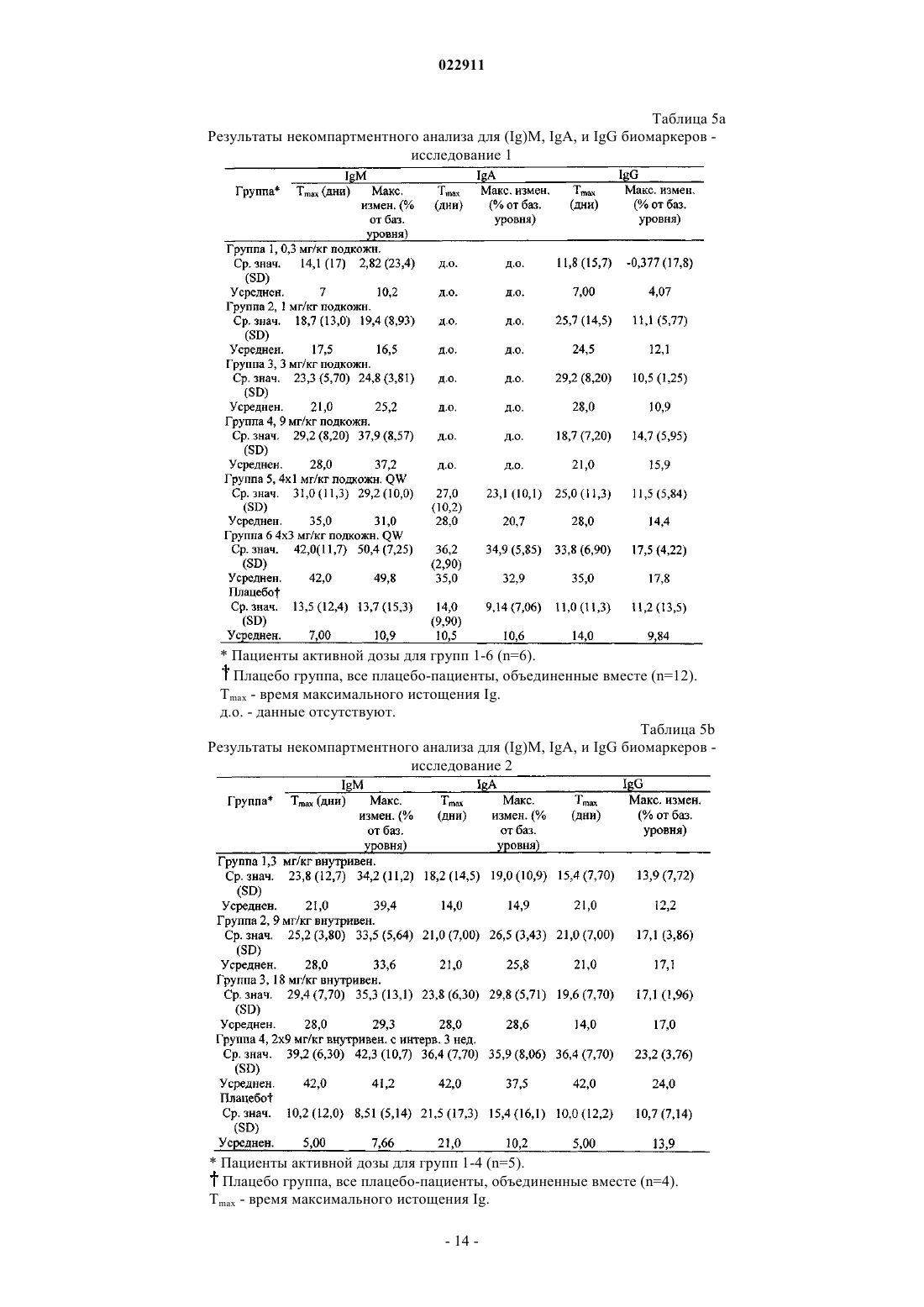
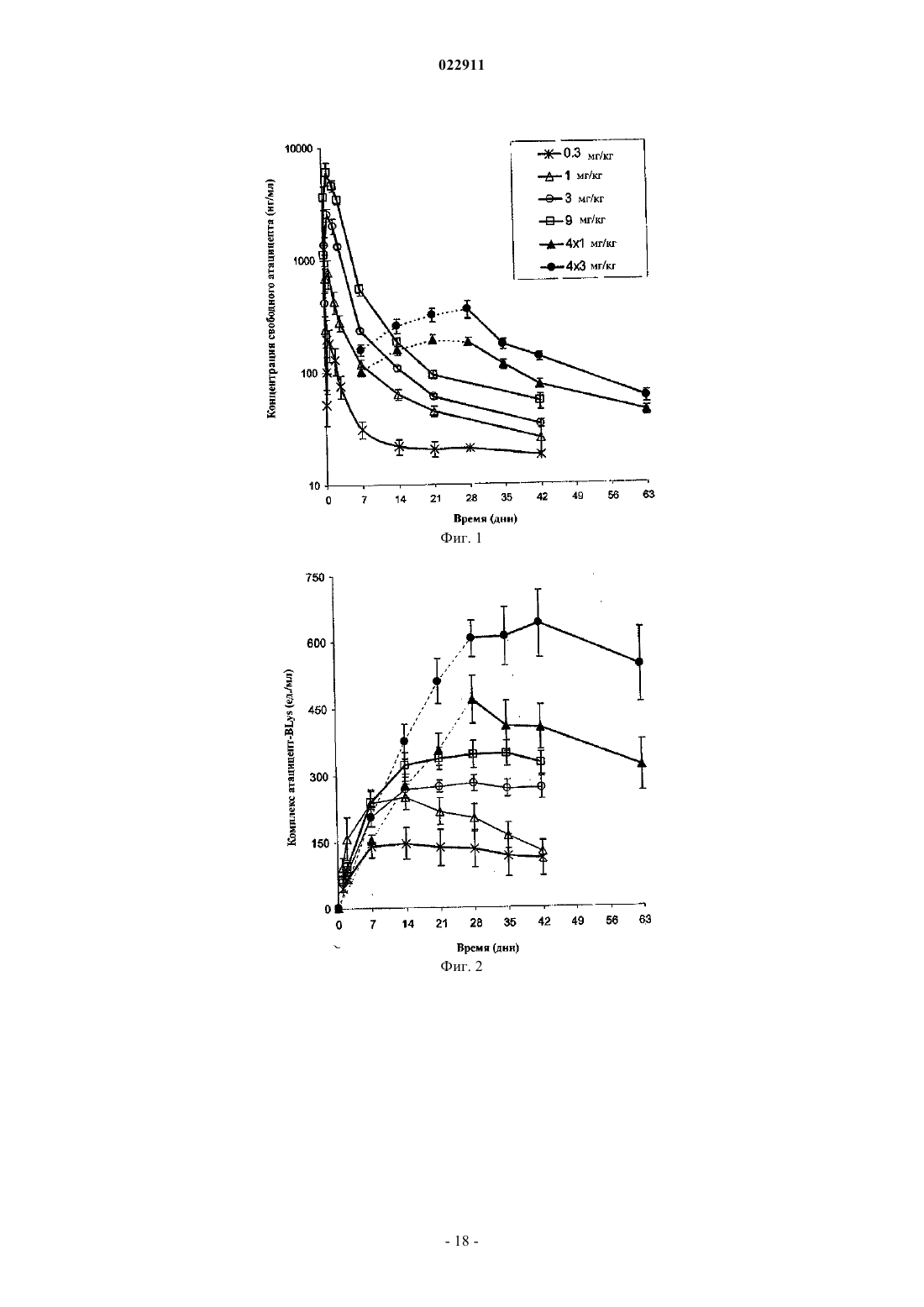
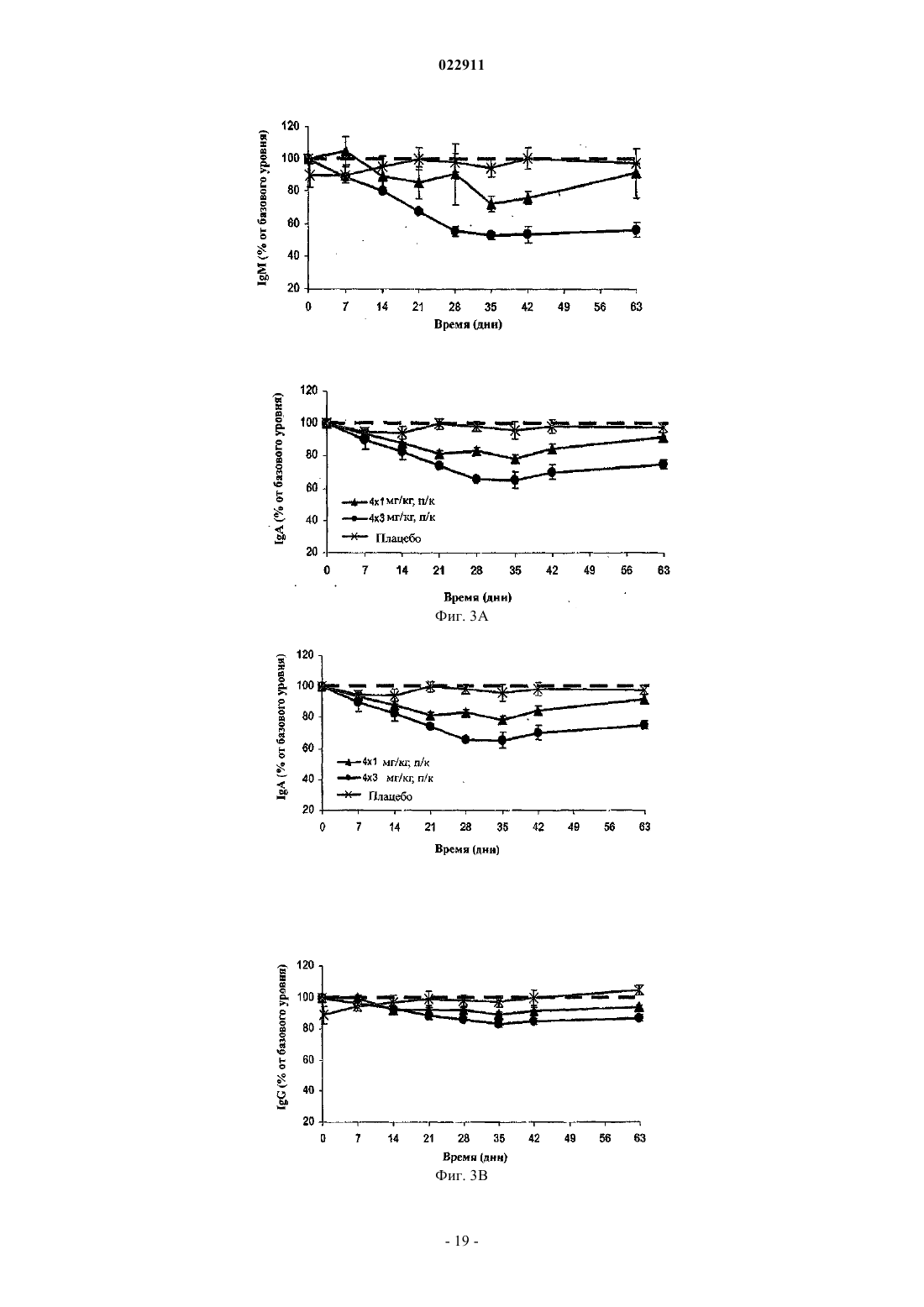
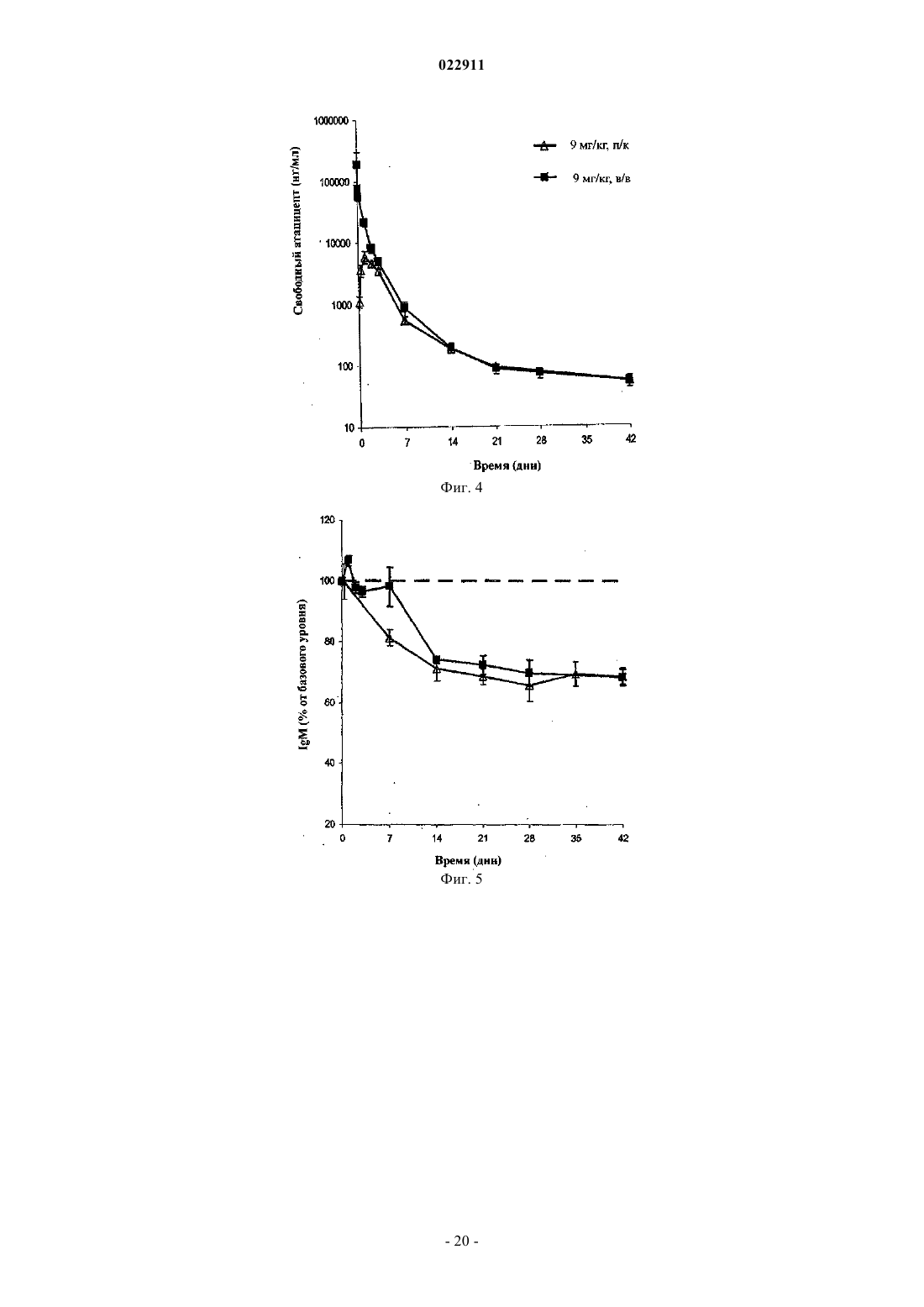
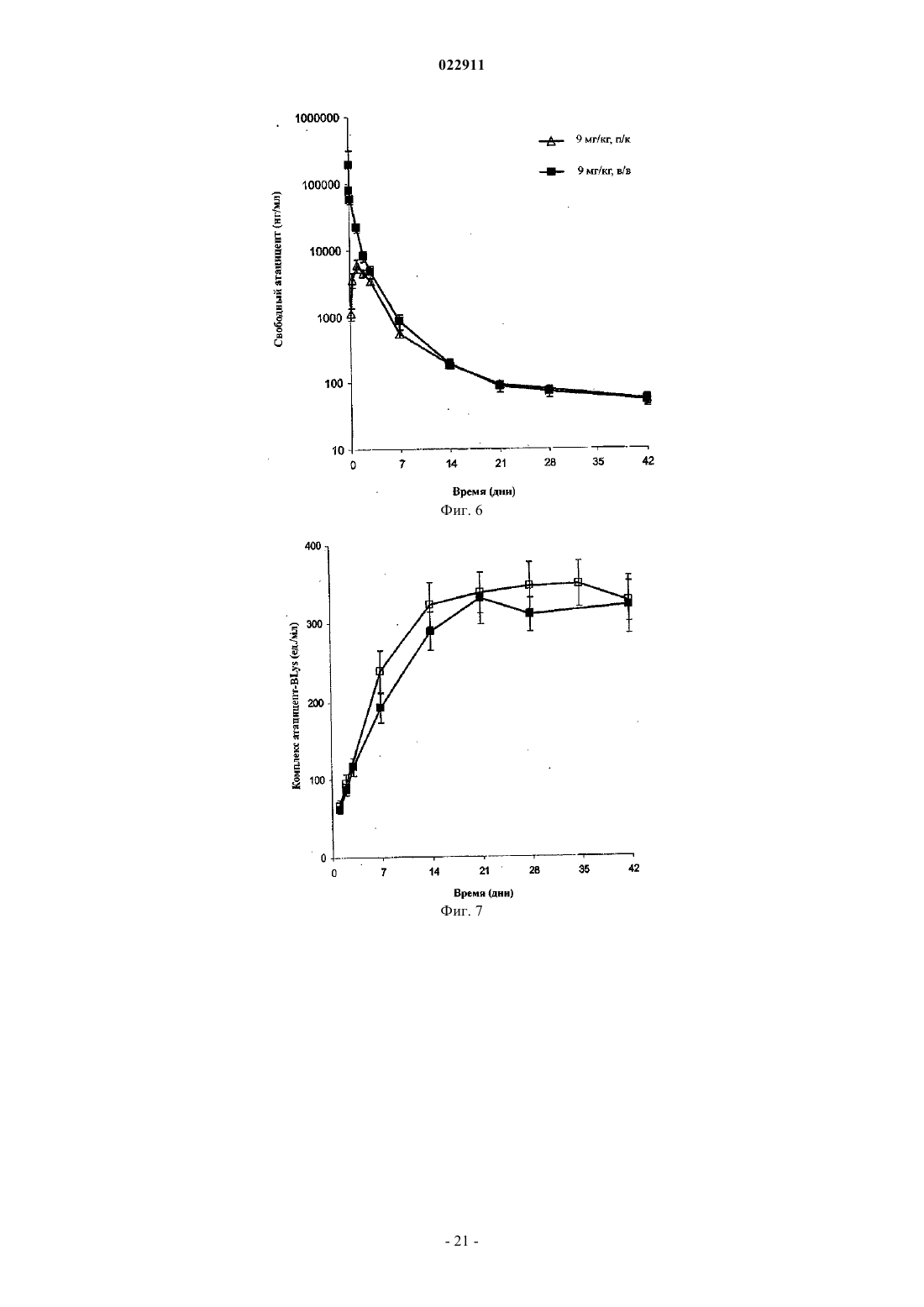
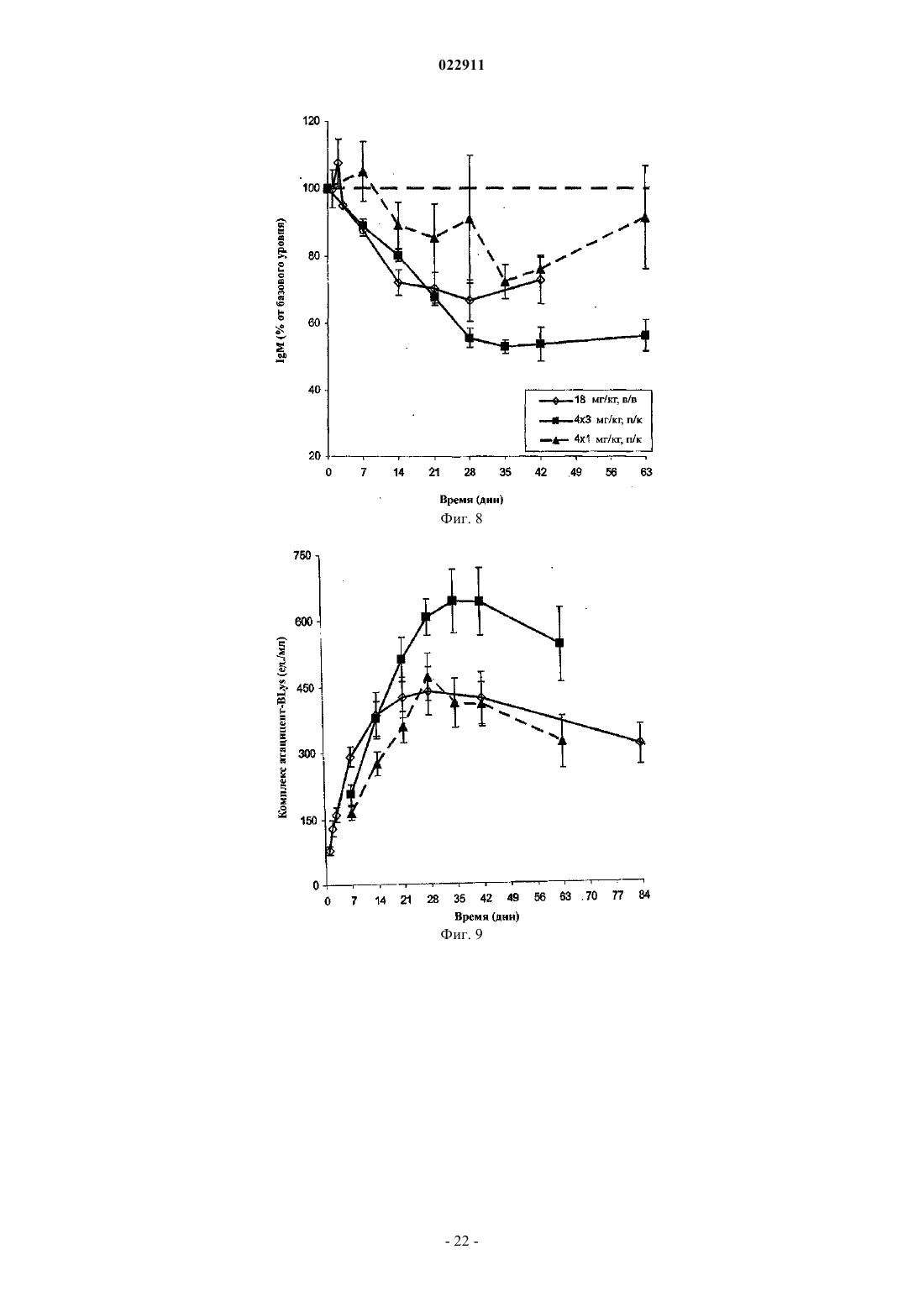
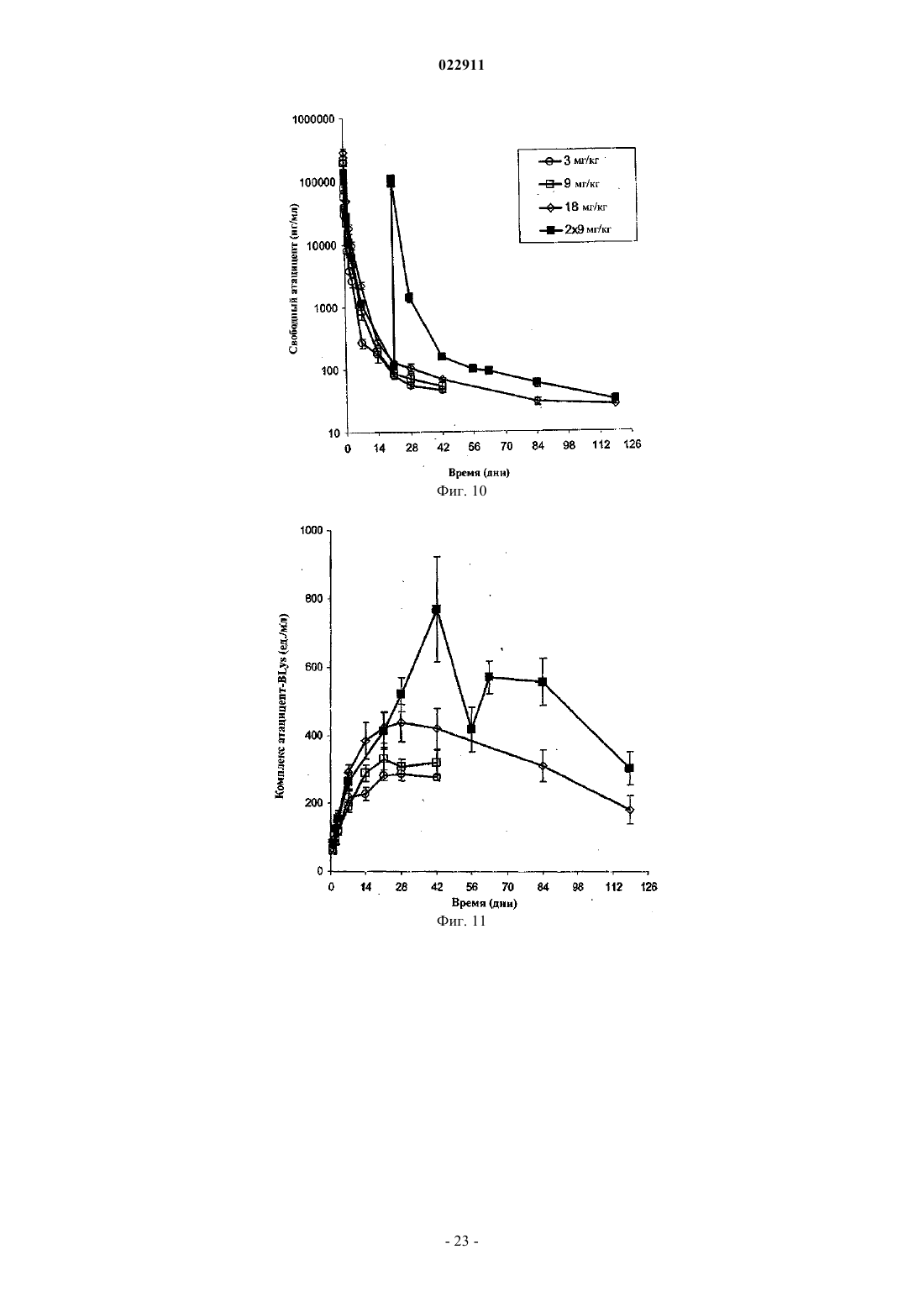
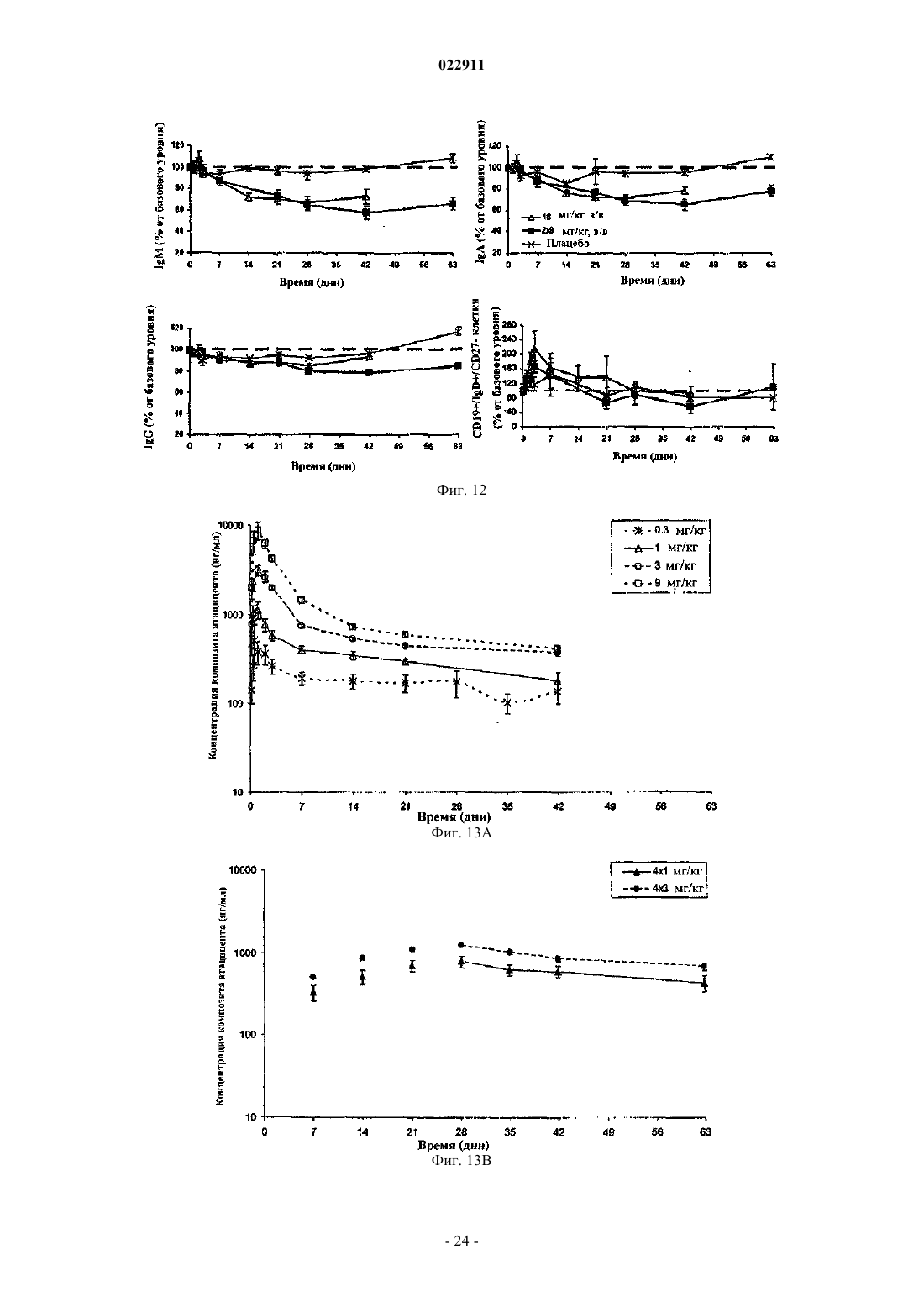
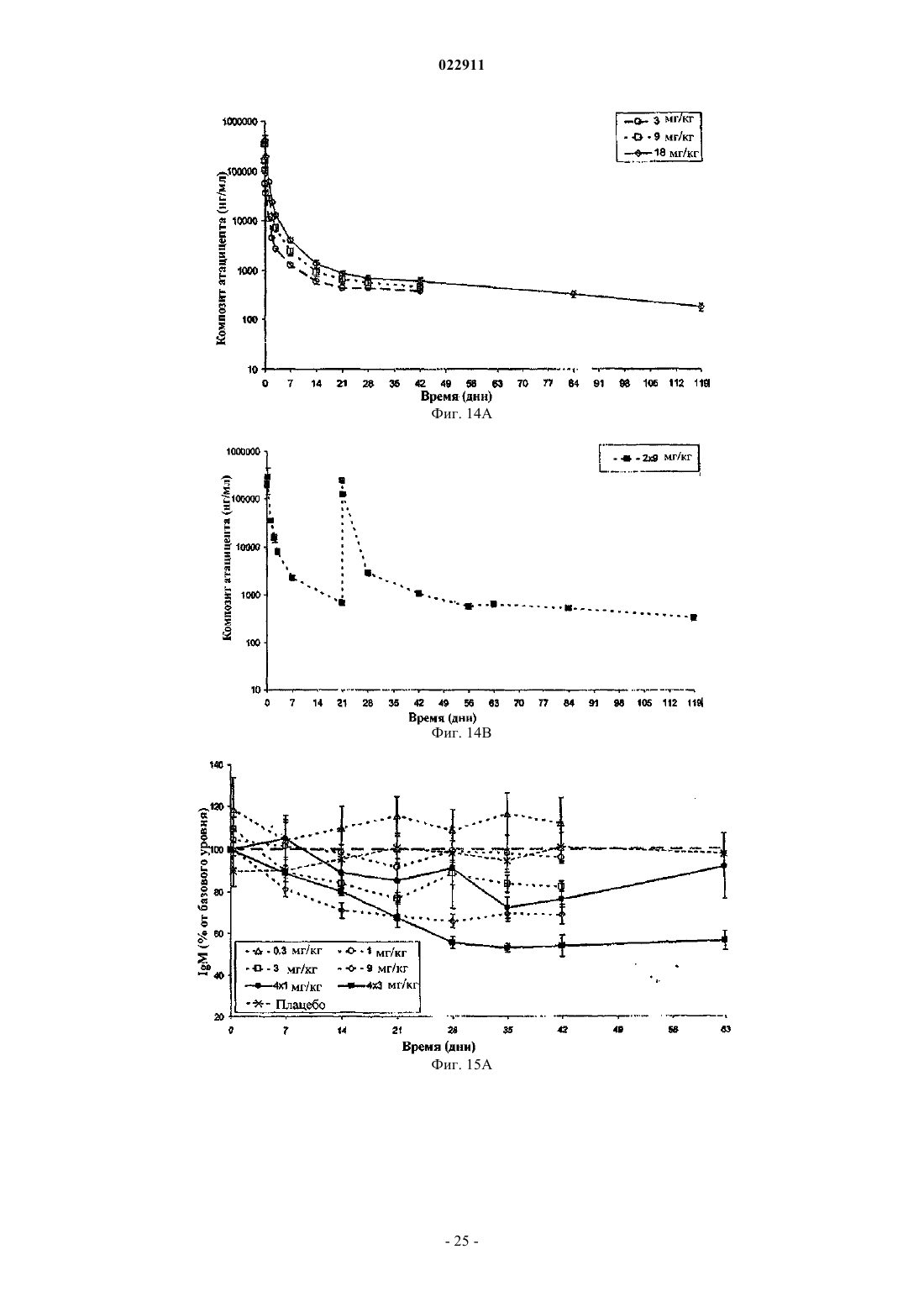
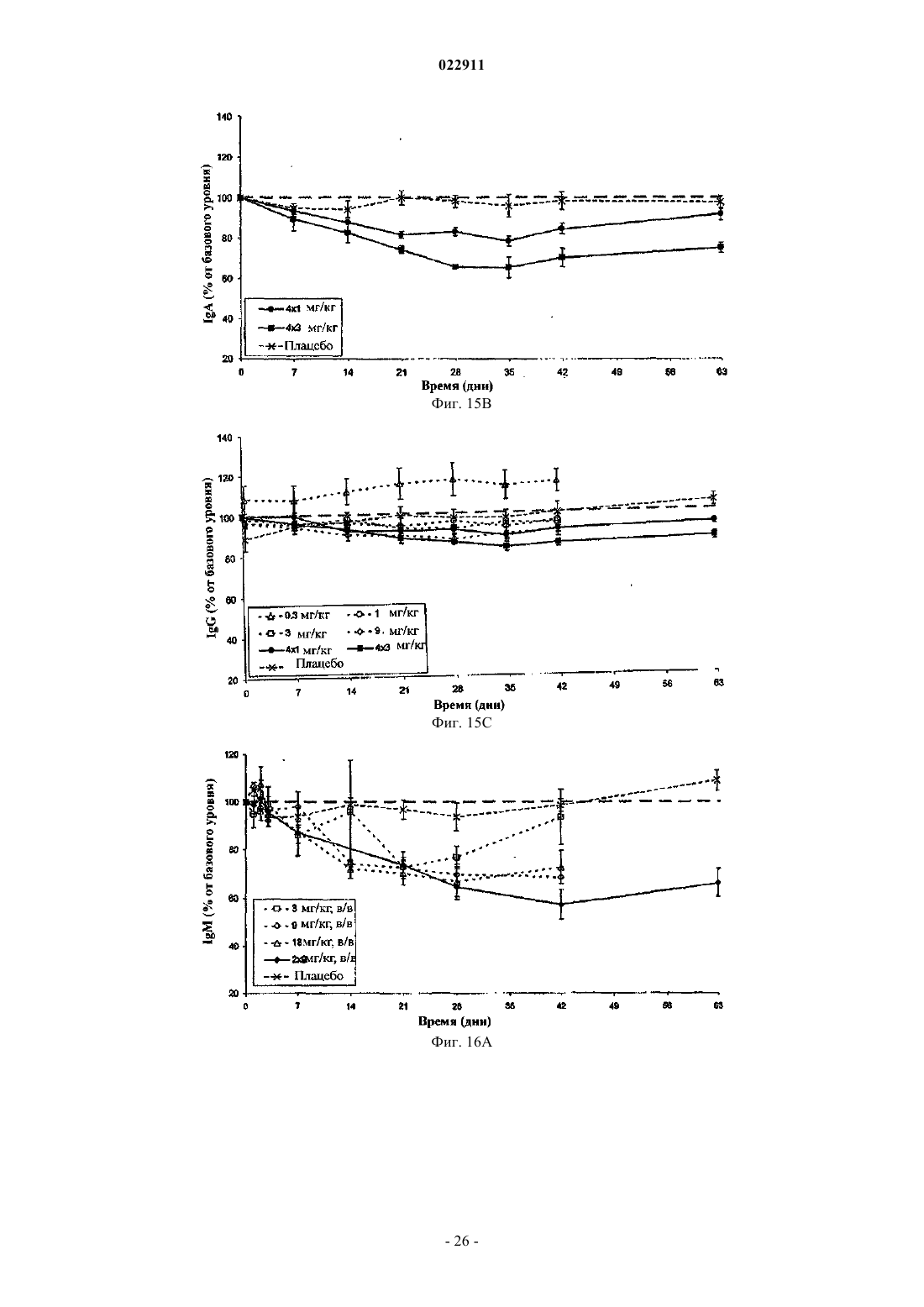
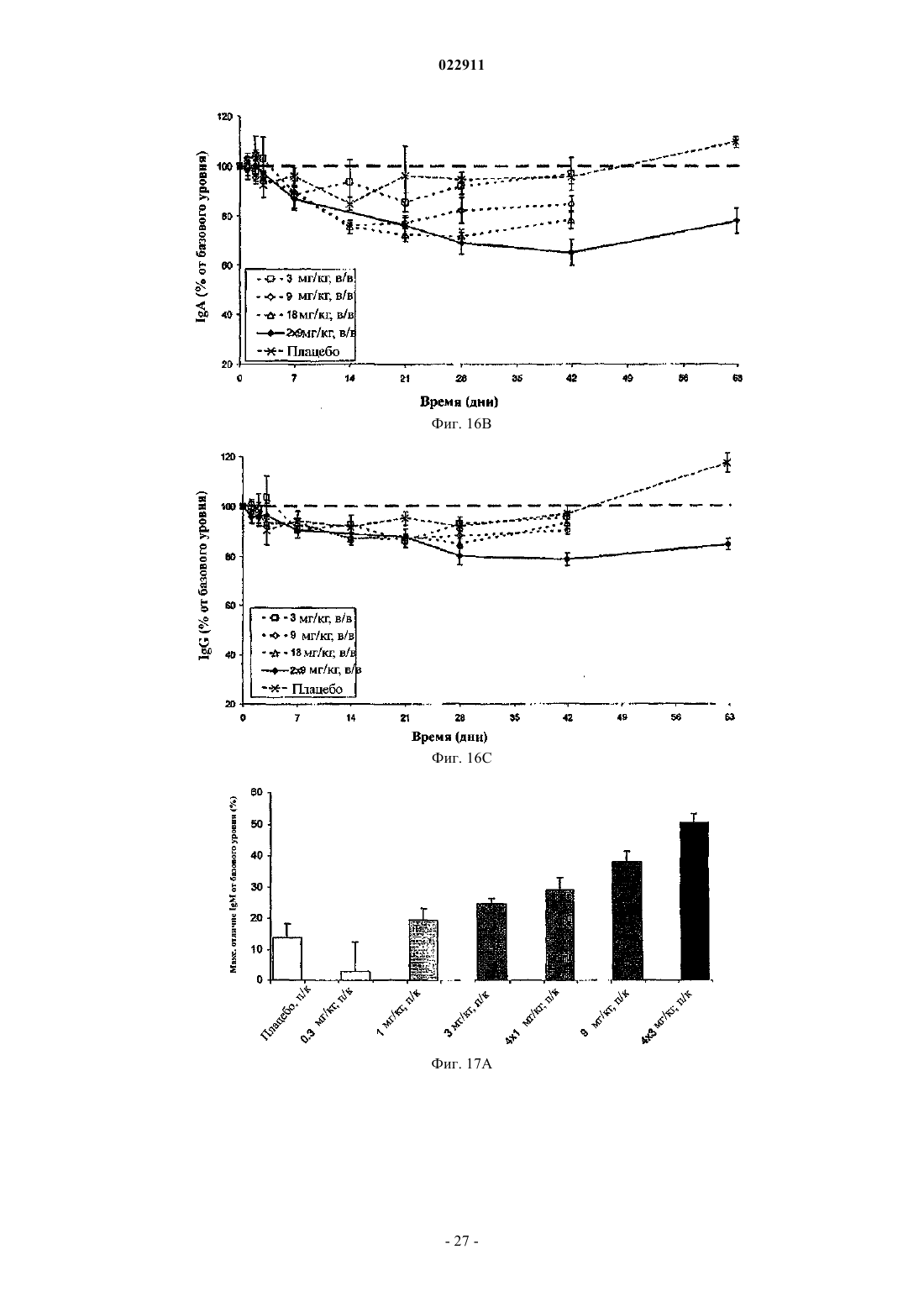
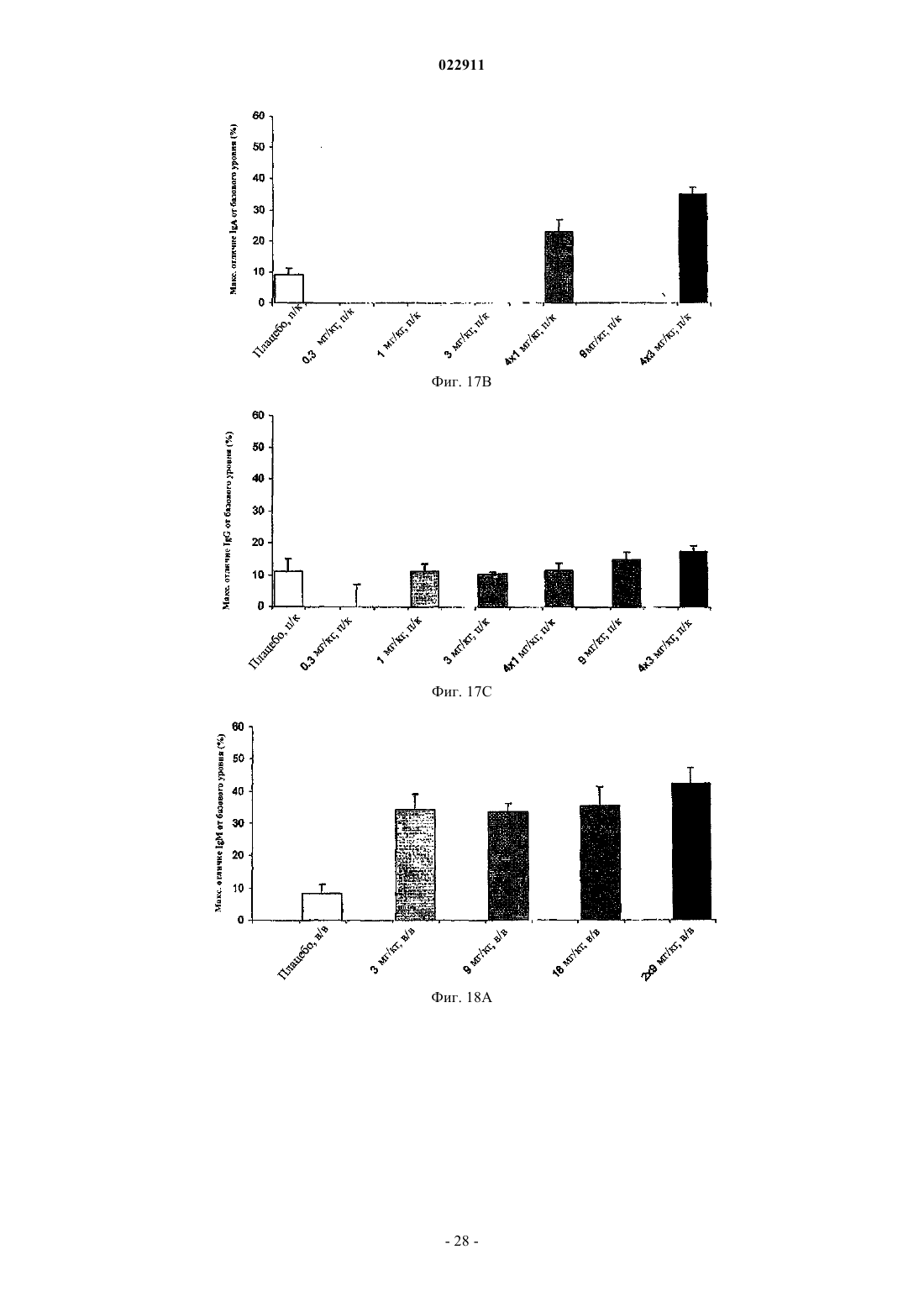
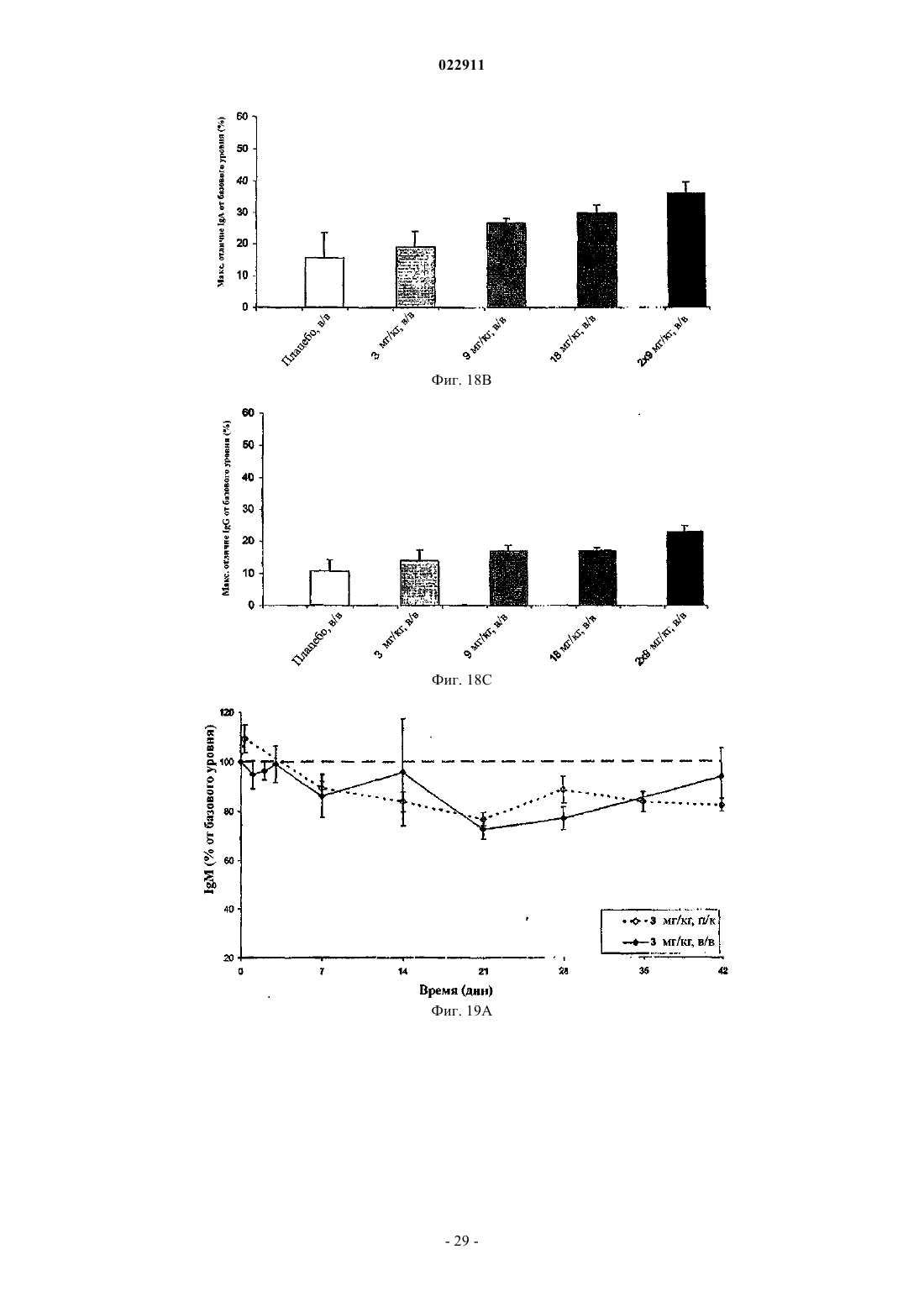
СПОСОБ ЛЕЧЕНИЯ ПАЦИЕНТА, СТРАДАЮЩЕГО I ИЛИ II СТАДИЕЙ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКИ В различных воплощениях настоящее изобретение относится к способу лечения пациента,страдающего I или II стадией системной красной волчанки, включающему еженедельное введение в дозе приблизительно от 1 до приблизительно 10 мг/кг в течение приблизительно от 2 до приблизительно 52 недель слитой молекулы, которая включает TACI внеклеточный домен или его фрагмент, который связывается с BlyS, и константный домен иммуноглобулина человека. Область техники, к которой относится изобретение В различных воплощениях настоящее изобретение относится к способам и композициям для лечения аутоиммунных заболеваний или расстройств иммунной системы, а именно системной красной волчанки, включающим введение TACI-Ig слитого белка такого, как атацицепт при использовании особого режима ведения доз, который максимизирует блокирование функций лигандов семейства TNF. Предпосылки создания изобретения Лиганд BlyS/Семейство рецепторов. Три рецептора, TACI (трансмембранный активатор или трансмембранный активатор и партнр кальциевого модулятора и лиганда циклофилина), ВСМА (антиген созревания В-клеток) и BAFF-R (рецептор для фактора, активирующего В-клетки, принадлежащего к семейству TNF), были идентифицированы как такие, которые обладают уникальными связывающими аффинностями для двух факторов ростаBiol 2000; 10 (13): 785-788; Thompson et al. Science 2001; 293: 2108-2111). TACI и ВСМА связываются как с BlyS, так и с APRIL, в то время как BAFF-R был определен как такой, который связывается с BlyS с высокой аффинностью (Marsters et al. Curr Biol 2000; 10(13): 785-788; Thompson et al. Science 2001; 293:21 08-2111). В результате этого BlyS является способным передавать сигнал через три рецептора, в то время как APRIL способен предавать сигнал только через TACI и ВСМА. Кроме того, циркулирующие гетеротримерные комплексы BlyS и APRIL (группировки, состоящие из трех белков, содержащие одну или две копии каждого из BlyS и APRIL) были идентифицированы в образцах сыворотки, взятой от пациентов с системными иммунными ревматическими заболеваниями, и были продемонстрированы как такие,которые индуцируют пролиферацию В-клеток in vitro (Roschke et al. J. Immunol 2002; 169: 4314-4321). Среди Ig-слитых белков для всех трех рецепторов, только TACI-Fc5, такой, как атацицепт, является способным блокировать биологическую активность гетеротримерных комплексов (Roche et al. J. Immunol 2002; 169:4314-4321).BlyS и APRIL представляют собой мощные стимуляторы созревания, пролиферации и выживания В-клеток (Gross et al. Nature 2000; 404: 995-999, Gross et al. Immunity 2001; 15(2): 289-302, Groom et al. J.Clin Invest 2002; 109(1): 59-68). BlyS и APRIL могут быть необходимыми для персистенции аутоиммунных заболеваний, в частности, тех, которые вовлекают в свое развитие В-клетки. Трансгенные мыши,созданные для экспрессии высоких уровней BlyS, демонстрируют расстройства клеток иммунной системы, а также симптомы, подобные тем, которые наблюдаются у пациентов с системной эритематозной волчанкой (SLE) (Cheson et al. Revised guidelines for diagnosis and treatment. Blood 1996; 87: 4990-4997,Cheema et al. Arthritis Rheum 2001; 44(6): 1313-1319). Подобно этому, повышенные уровни BlyS и APRIL были измерены в образцах сыворотки, взятой от SLE пациентов и других пациентов с различными аутоиммунными заболеваниями, подобными ревматоидному артриту (Roschke et al. J. Immunol 2002; 169: 4314-4321; Mariette X., Ann Rheum Dis 2003; 62(2): 168-171; Hahne et al. J. Exp Med 1998; 188(6): 11851190), что расширило ассоциацию BlyS и/или APRIL с заболеваниями, которые опосредуются Вклетками, от животных моделей до человека. Системная эритематозная волчанка (SLE) представляет собой аутоиммунное заболевание, которое клинически характеризуется возрастающим и угасающим течением и вовлечением многочисленных органов, включая кожу, почки и центральную нервную систему (Kammer G.M. и Tsokos G.С. ред. (1999),Lupus: Molecular and Cellular Pathogenesis 1-е изд., Human Press, N.J.; Lahita R.G. ред. (1999), SystemicLupus Erythromatosus, 3-е изд., Academic Press, Amsterdam). Общее распространение SLE составляет 1 из 2000, и приблизительно 1 из 700 белых женщин развивает SLE в течение периода своей жизни (LahitaR.G. (1999), Curr. Opin. Rheumatol. Sep; 11(5): 352-6). Только в США более полумиллиона людей имеютSLE, и большинство из них представляет собой женщин в репродуктивном возрасте (Hardin J.А. (2003), J.Exp. Med. 185: 1101-1111). Не существует единого критерия для диагностики SLE. Американский ревматологический колледж разработал 11 критериев для диагностики SLE, которые охватывают клинический спектр SLE в отношении кожных, системных и лабораторных анализов. Такие критерии включают высыпания на щеках, дискоидные высыпания, чувствительность к солнечному свету, язвы в ротовой полости, артрит, воспаление серозных оболочек, воспаления почек и центральной нервной системы, изменения в составе крови, и присутствие антинуклеарных антител. Пациент должен соответствовать четырем из этих критериев для того, чтобы быть диагностированным в качестве SLE пациента. (Tan et al. (1982), Arthritis Rheumatol. 25: 1271-1277). SLE обычно подтверждают анализами, которые включают, но без ограничения, анализы крови для определения антинуклеарных антител; анализы крови и мочи для оценки функции почек; анализы при использовании комплемента для определения присутствия низких уровней комплемента, что часто ассоциируется с SLE; скорость седиментации (ESR) или наличие С-реактивного белка для измерения уровней воспаления (CRP); рентгенографию для оценки повреждения легких и ЭКГ для оценки повреждения сердца. Стандартная терапия для SLE представляет собой введения стероидного глюкокортикоида, общего ингибитора иммунной системы. Она может использоваться для облегчения симптомов; однако в настоящее время не является доступным никакое лечение для SLE. Обычно назначается низкая пероральная доза преднизона при уровнях ниже чем 0,5 мг/кг/сутки. К сожалению, эта терапия является недостаточной для того, чтобы удержать пациентов в состоянии ремиссии, и часто случаются заболевания. Обострения могут подвергаться контролю при использовании высоких доз глюкокортикоида посредством внутривенных введений при дозе 30 мг метилпреднизолона/кг/сутки в течение трех последовательных дней. Однако лечение с помощью стероидных средств при высоких дозах может давать тяжелые побочные эффекты для пациентов. Такие стандартные лечения в общем случае являются неспецифическими, часто ассоциируются с тяжелыми побочными эффектами и существенно не влияют на развитие заболевания или вызывают переход к осложнениям функции почек, которые угрожают жизни (волчаночный нефрит или LN). Следовательно, существует давно ощущаемая потребность уровня техники в развитии новых способов для лечения SLE. Краткое изложение сущности изобретения Данное изобретение относится к способу лечения пациента, страдающего I или II стадией системной красной волчанки, который включает еженедельное введение в дозе приблизительно от 1 до приблизительно 10 мг/кг в течение приблизительно от 2 до приблизительно 52 недель слитой молекулы, содержащей TACI внеклеточный домен или его фрагмент, который связывается с BlyS и константный домен иммуноглобулина человека. Краткое описание фигур Фиг. 1 графически представляет концентрацию свободного атацицепта, построенную против времени, выраженного в днях, для подкожного введения, основное фармакинетическое измерение. Каждая линия на графике представляет собой дозу, как представлено в пояснениях. Фиг. 2 графически представляет концентрацию комплекса атацицепта и BlyS, построенную против времени, выраженного в днях, для подкожного введения, основное фармакинетическое измерение. Каждая линия на графике представляет собой дозу, как представлено в пояснениях фиг. 1. Фиг. 3 А и 3 В графически представляют биологические эффекты подкожного введения на уровни различных иммуноглобулинов и уровни В-клеток. Фиг. 4 показывает различие в биодоступности, как показано с помощью измерений свободного атацицепта для подкожного и внутривенного введения атацицепта. Фиг. 5 графически представляет относительную подобность биологической активности, которую наблюдали при использовании двух методов введения, как представлено с помощью концентрации IgM против времени. См. пояснения на фиг. 4. Фиг. 6 графически показывает подобие способа подкожного и внутривенного введения, как представлено с помощью уровня свободного атацицепта против времени. Фиг. 7 показывает относительно подобие кривых целевого связывания, которые наблюдали при использовании двух методов введения, как представлено с помощью уровня комплекса атацицепт-BlyS против времени. См. пояснения на фиг. 4. Фиг. 8 графически показывает, что множественные дозы обеспечивают получение более высокой биологической активности, как представлено с помощью концентрации IgM против времени. Фиг. 9 графически показывает, что целевое связывание является более высоким при использовании множественных доз, как представлено с помощью уровня комплекса атацицепт-BlyS против времени. См. пояснения на фиг. 8. Фиг. 10 графически представляет концентрацию свободного атацицепта, построенную против времени, выраженного в днях, для внутривенного введения, основное фармакинетическое измерение. Каждая линия на графике представляет собой дозу, как представлено в пояснениях. Фиг. 11 графически представляет концентрацию комплекса атацицепт-BlyS, построенную против времени, выраженного в днях, для внутривенного введения, основное фармакинетическое измерение. Каждая линия на графике представляет собой дозу, как представлено в пояснениях фиг. 10. Фиг. 12 является графическим представлением биомаркерного измерения при использовании внутривенного введения, в частности, представлены уровни иммуноглобулинов и уровни В-клеток. Фиг. 13 А и 13 В являются графическими представлениями концентрации смеси (композита) атацицепта (определяется как свободный атацицепт + атацицепт-BlyS комплекс) против времени для подкожного введения (исследование 1). (А) группы введения однократной дозы; (В) группы введения множественных доз. Представлены средние значениязначения стандартной ошибки. Множественные дозы вводили в дни 0, 7, 14 и 21. Точки времени введения дозы не являются связанными с указанными пиками концентрации, которые не регистрировались между дозами. Фиг. 14 А и 14 В представляют собой графическое представление концентрации композита атацицепта (определяется как свободный атацицепт + атацицепт-BlyS комплекс) против времени для внутривенного введения (исследование 2). (А) группы введения однократной дозы; (В) группы введения множественных доз. Представлены средние значениязначения стандартной ошибки. Множественные дозы вводили в дни 0 и 21. Фиг. 15 А-15 С представляют собой суммарные профили иммуноглобулинов в исследовании 1 (под-2 022911 кожное введение), которые демонстрируются группой (% от базового значения, среднее значениестандартная ошибка). (A) IgM; (В) IgA, (С) IgG. Эти фигуры расширяют данные, представленные на фиг. 3 А и 3 В. Фиг. 16 А-16 С представляют собой профили суммарного иммуноглобулина в исследовании 2 (внутривенное введение), которые демонстрируются группой (% от базового уровня, среднее значениезначение стандартной ошибки). (A) IgM; (В) IgA, (С) IgG. Эти фигуры расширяют данные, представленные на фиг. 12. Фиг. 17 А-17 С графически представляют взаимоотношение между подкожной дозой атацицепта (исследование 1) и наблюдаемым максимумом иммуноглобулинового ответа (в % снижения от базового уровня). Столбцы представляют среднее значениестандартная ошибка. (A) IgM; (В) IgA, (С) IgG. Фиг. 18 А-18 С графически представляют взаимоотношение между внутривенной дозой атацицепта(исследование 2) и наблюдаемым максимумом иммуноглобулинового ответа (в % снижения от базового уровня). Столбцы представляют среднее значениестандартная ошибка. (A) IgM; (В) IgA, (С) IgG. Фиг. 19 А и 19 В показывают профили IgM (среднее значениестандартная ошибка) в группах введения той же однократной дозы исследований при подкожном и внутривенном введении. (А) 3 мг/кг; (В) 9 мг/кг. Фиг. 20 А и 20 В показывают профили комплекса атацицепт-BlyS (среднее значениестандартная ошибка) в группах той же однократной дозы исследований при подкожном и внутривенном введении.(А) 3 мг/кг; (В) 9 мг/кг. Подробное описание изобретения Данное изобретение относится к способу лечения пациента, страдающего I или II стадией системной красной волчанки, который включает еженедельное введение в дозе приблизительно от 1 до приблизительно 10 мг/кг в течение приблизительно от 2 до приблизительно 52 недель слитой молекулы, содержащей TACI внеклеточный домен или его фрагмент, который связывается с BlyS и константный домен иммуноглобулина человека. В предпочтительном варианте осуществления заявленного изобретения указанный TACI внеклеточный домен имеет последовательность, включающую SEQ ID NO: 1 или же указанный TACI внеклеточный домен является по крайней мере на 50% идентичным SEQ ID NO: 1. Он может также иметь последовательность, включающую только аминокислоты 30-110 SEQ ID NO: 1. Указанный константный домен иммуноглобулина человека в предпочтительном варианте осуществления имеет последовательность, включающую SEQ ID NO: 2. В наиболее предпочтительном варианте осуществления способа указанная слитая молекула представляет собой атацицепт. Слитая молекула может вводиться пациенту в количестве приблизительно от 1 до приблизительно 9 мг/кг. Способ в соответствии с изобретением предусматривает дополнительное введение пациенту второго лекарственного средства, которое выбрано из группы, состоящей из NSAID, противомалярийных средств, кортикостероидов, иммуносупрессивных агентов, IVIg, DHE и талидомида. Предпочтительные варианты осуществления изобретения предполагают любой приемлемый способ введения, включая подкожный, пероральный или внутривенный. В предпочтительном варианте осуществления изобретения пациент представляет собой человека. В-клетки, как считается в настоящее время, играют важную роль в патогенезе SLE с помощью зависимых от антитела и независимых от антитела механизмов. В дополнение к выработке антител, В-клетки секретируют множество цитокинов, действуют в качестве антигенпрезентирующих клеток и выполняют разнообразные эффекторные функции. Таким образом, В-клетки выступают в качестве рациональных мишеней для разработки лекарственных средств для SLE (Browning J.L., Nat Rev Drug Discov 2006; 5: 564-76). Были предложены некоторые направленные на В-клетки стратегии в качестве возможных терапий для SLE. Некоторые из этих стратегий предназначены для устранения В-клеток посредством использования моноклональных антител (mAb) (Leandro M.J., Edwards J.C., Cambridge G.I. Ehrenstein M.R., lsenbergD.M., Burmester G.R., Arthritis Res Ther 2006, 8: R74). В это же время другие препятствуют стимуляции В-клеток (Baker K.P., Edwards B.M., Main S.H., Choi G.H., Wager R.E., Halpern W.G., et al. Arthritis Rheum 2003; 48: 3253-65; Wallace D.J., Lisse J., Stohl W., McKay J., Boling El Merrill J.T., et al., American College 2004; 24: 579-90; Mauermann N., Sthoeger Z., Zinger H., Mozes E., Clin Exp Immunol 2004; 137: 513-20). Попытки ингибировать стимуляцию В-клеток были сфокусированы, в первую очередь, на взаимодействиях рецептор-лиганд, которые вовлекают молекулы, которые называются стимулятором Влимфоцитов (BlyS) и лигандом, стимулирующим пролиферацию (APRIL). BlyS и APRIL представляют собой членов семейства цитокинов фактора некроза опухоли (TNF), которые являются важными для выживания В-клеток и их развития после выхода из костного мозга. BlyS и APRIL связываются с одинаковыми и различными рецепторами. Обе молекулы связываются с трансмембранным активатором и партнром (TACI) кальциевого модулятора и лиганда циклофилина (CAML) и антигеном созревания Вклеток (ВСМА), в то время как BlyS также связывается с фактором, активирующим В-клетки, который относится к рецептору семейства TNF (BAFF-R), a APRIL взаимодействует с протеогликанами. Полученные подтверждения на животных моделях и на людях поддерживают важную роль BlyS иI., Xia X.Z., McCabe S., Miner K., Solovyev I., et al., Proc Natl Acad Sci 2000; 97: 3370-5). Некоторые из этих мышей развивают фенотип, подобный волчанке, состоящий из антител, направленных против двухцепочечной ДНК (дцДНК), депонирование иммуноглобулина в почках и ускоренное развитие гломерулярного заболевания, уровни BlyS также являются повышенными у предрасположенных к волчанкеNZBINZW F1 (BIW) и MRL-lpr/lpr мышей (Stohl W., Xu D., Kim K.S., Koss M.N., Jorgensen T.N., Deocharan В., et al., Arthritis Rheum 2005; 52: 2080-91). Исследования, проведенные на людях, также предполагают роль BlyS и APRIL в системных аутоиммунных заболеваниях. Пациенты с SLE имели повышенные уровни BlyS в сыворотке крови, что позитивно коррелирует с уровнями анти-дцДНК антител (Zhang J.,Roschke V., Baker K., Wang Z., Alarcon G.S., Fessler B.J., et al., J. Immunol 2001, 166: 6-10; Cheema G.S.,Roschke V., Hilbert D.M., Stohl W., Arthritis Rheum 2001; 44: 1313-19; Stohl W., Metyas S., Tan S.M., Cheema G.S., Oamar B., Xu D., et al., Arthritis Rheum 2003; 48: 3475-86). Сывороточные уровни APRIL являются повышенными у пациентов с SLE по сравнению со здоровыми индивидуумами и у пациентов с ревматоидным артритом (Koyama T., Tsukamoto H., Miyagi Y., Himeji D., Otsuka J., Miyagawa H., et al. AnnRheum Dis 2005; 64: 1065-7). Сывороточные уровни BlyS и APRIL были определены в синовиальной жидкости пациентов с воспалительным артритом (Tan S.M., Xu D., Roschke V., Perry J.W., Arkfeld D.G.,Ehresmann G.R., et al., Arthritis Rheum 2003; 48: 982-92). Такие убедительные наблюдения у мышей и у людей привели в разработке нескольких BlyS антагонистов. Один из таких агентов является рекомбинантным слитым белком, включающим внеклеточный домен TACI рецептора, связанный с человеческимIgGI Fc доменом (атацицепт, ранее обозначался как TACI-Ig). Атацицепт блокирует стимуляцию Вклеток с помощью как BlyS, так и APRIL. Несколько линий исследований обеспечивают поддержку предположения о том, что атацицепт будет обладать мощными эффектами in vivo. В первую очередь,трансгенные мыши, которые экспрессируют атацицепт, имеют незначительное количество В-клеток и сниженные концентрации иммуноглобулина, а лечение их с помощью атацицепта замедляет начало и снижает тяжесть артрита в мышиной модели индуцированного коллагеном артрита. Выработка антител против коллагена также является супрессированной (Gross J.A., Dillon S.R., Mudri S., Johnston J., LittauA., Roque R., et al., выше). В третьих, обработка предрасположенных к волчанке самок BIW мышей с помощью атацицепта замедляет развитие протеиноурии и повышает выживание (Gross J.A., Johnston J.,Mudri S., Enselman R., Dillon S., Madden K., et al., выше). В заключение, при прямом сравнении эффективности мышиного атацицепта и BAFF-R-Ig (ингибитор только BlyS) у предрасположенных к волчанке самок BIW мышей, только атацицепт снижает сывороточные уровни IgM, снижает частоту встречаемости антителообразующих клеток в селезенке, и ингибирует IgM ответ на антиген, зависимый от Т-клеток,что дает возможность предположить роль APRIL в этих процессах (Ramanujam M., Wang X., Huang W.,Liu Z., Schiffer L., Tao H., et al., J. Clin Invest. 2006; 116: 724-34). В свете этих обнадеживающих предклинических данных изобретатели в соответствии с данной заявкой проверили биологические эффекты,фармакокинетики, фармакодинамики и безопасность атацицепта в клинических опытах у пациентов сSLE. В обоих фаза I исследованиях, описанных в примерах 1 и 2, представленных ниже, атацицепт был хорошо переносимым местно и системно у пациентов с SLE. Наблюдали явные признаки биологической активности атацицепта при этих перспективных показаниях, в значительной степени в соответствии с его механизмом действия (МоА). В соответствии с современными концепциями в отношении механизмов действия (МоА) для атацицепта и не связывая это с теорией, можно сказать, что ингибирование BlyS и APRIL приводит к воздействию на В-клетки, включая секрецию неспецифических и специфических антител, что главным образом влияет на связанные с SLE биомаркеры и маркеры клинической эффективности. Как это является типичным для исследований фазы I, внимание в настоящем анализе фокусировалось на ранних этапах МоА каскада и, в частности, на ответах, начиная с ранних биомаркеров BlyS и APRIL ингибирования (таких,как комплекс атацицепт-BlyS) и биологических эффектах (таких, как уровни Ig). Атацицепт демонстрирует мультифазную нелинейную PK, характеризующуюся более чем пропорциональным дозе увеличением воздействия свободного лекарственного средства, и сверхпологим повышением воздействия комплекса атацицепт-BlyS. Такое поведение не было неожиданным и было показано у RA пациентов. Это поддерживает гипотезу о том, что PK атацицепта опосредуется его лигандами. Общее значение PK атацицепта, хотя и есть линейным, является предсказуемым для совокупности доз,между однократной и множественными дозами. Три PK маркера атацицепта имели сходное поведение уRA и SLE пациентов, что свидетельствует о том, что тип аутоиммунного заболевания не является основной детерминантой PK атацицепта. Длительная аккумуляция комплекса атацицепт-BlyS при множественном введении доз (вплоть до четырех еженедельных доз групп 5 и 6, исследование 1), совместно с минимальной аккумуляцией свободного атацицепта, обеспечивает подтверждение присутствия значительной начальной загрузки свободных BlyS и APRIL, как системной, так и периферической. Повышенные базовые уровни BlyS, измеренные в трех исследованиях (по сравнению с нормальными субъектами, данные для которых были взяты из литературы), говорят в пользу этой гипотезы. Также является вероятным, что если существующее перед введением дозы равновесие между растворимыми лигандами и их рецепторами нарушается путем введения атацицепта, то инициируются сложные кинетические процессы перераспределения системой циркуляции крови, лимфатической системой и периферическими компартментами. Такое перераспределение вовлекает как лекарственное средство, так и его лиганды, и с учетом размера вовлеченной молекулы занимает, по крайней мере, несколько недель до установления нового равновесия. С другой стороны, длительная аккумуляция комплекса может предполагать эндогенную генерацию свободных лигандов (опять-таки, как в системе циркуляции крови, так и в периферических тканях). Опубликованные данные в отношении скорости повышения уровня сывороточного BlyS после введения ретуксимаба (Cambridge et al., Arthritis Rheum 2006; 54: 723-732) обеспечивают дополнительное подтверждение того факта, что эндогенное образование BlyS играет важную роль в BlyS ингибировании и должно учитываться. Длительный период достижения стабильного состояния (в течение одного месяца еженедельного введения дозы) поддерживает эти гипотезы. Насыщаемые кинетики атацицепта впервые наблюдали, и о них было сообщено при использовании однократных доз атацицепта, применяемых к здоровым волонтерам и RA пациентам в предыдущих фазаI исследованиях, они показали, что BlyS (и APRIL) ингибирование является насыщаемым, то есть повышение воздействия атацицепта в пределах точки насыщения будет приводить к снижающемуся эффекту в отношении связывания BlyS (и в конечном итоге, APRIL). Это явление должно учитываться и использоваться при выборе терапевтических режимов введения доз. Следует подчеркнуть, что приемлемое насыщение ингибирования BlyS (и APRIL) требует поддержания в течение определенного времени и будет достигаться с помощью приемлемой модели воздействия атацицепта во времени. Последнее будет необходимым для динамического баланса между сложными и, главным образом, не охарактеризованными процессами образования и перераспределения эндогенныхBlyS и APRIL, и образовавшимся кинетическим профилем атацицепта. Такой баланс может быть достигнут только с помощью приемлемой модели дозирующего режима в отношении не только уровня дозы, а также и частоты введения доз. Хорошо определенные взаимоотношения между кумулятивной дозой атацицепта и ответом Ig антитела были установлены с помощью способов неизолированного размещения; такое взаимоотношение сначала определяли с помощью однократных доз атацицепта у здоровых волонтеров и с помощью однократных и множественных доз атацицепта у пациентов с RA. В настоящих исследованиях все три Ig маркера, используемые для мониторинга, показали быстрое снижение после введения первой дозы атацицепта. После четырех недель введения дозы все три биомаркера антителогенеза постепенно, последовательно и систематически снижались по направлению к стабильному состоянию, по-видимому, при отсутствии достижения его во время периода введения доз. Обнаружение того факта, что частота введения дозы оказывается такой, которая играет, по крайней мере, важную роль в качестве уровня дозы в ответе всех трех биомаркеров, сначала сделанное при исследовании RA, подтверждается с помощью SLE данных, полученных после подкожного введения (исследование 1). В общем случае, биомаркеры имеют весьма подобное поведение при подобных уровнях дозы как в популяции SLE, так и RA, что подчеркивает наличие общих корней в МоА при обоих показаниях, основываясь на ингибировании BlyA (и APRIL). Другие интересные факты были выявлены из сравнения PK и результатов биологической активности между двумя исследованиями. Несмотря на то что ни один из них не был предназначен для обращения к вопросу пригодности подкожного способа введения, сравнения частичных и общих площадей под кривыми концентрация - время (AUC) свободного атацицепта и композита атацицепта после введения подобных подкожных и внутривенных доз (группа 3, исследование 1 против группы 1 исследования 2, и группа 4, исследование 1 протип группы 2, исследование 2) позволяет дифференцировать грубую оценку"среднего значения" биодоступности. Из табл. 2ab и 3ab эти оценки составляют приблизительно 35-40% как для свободного, так и для композитного лекарственного средства - число, которое не выходит за пре-5 022911 делы диапазона фигур для молекул с высокими молекулярными весами (Porter и Charman, J. Pharm Sci 2000; 89: 297-310). Однако наблюдение за маркерами биологической активности выявило, что подобные дозы обеспечивают подобную биологическую активность вне зависимости от способа введения, как проиллюстрировано для IgM на фиг. 19. На первый взгляд, наблюдение, что 2,5-3-кратная разница в системном воздействии лекарственного средства может приводить к подобным биологическим эффектам противоречит установленной системе понятий; однако в случае же атацицепта это явление может быть хорошо обосновано. Современное понимание абсорбции больших белковых молекул после подкожного введения констатирует, что происходит отток белков из сайта инъекции, как в периферическую лимфатическую систему, так и в капилляры крови, и поглощение лимфатической системой повышается с повышением молекулярного размера. Для лекарственных средств с молекулярным весом, сопоставимым с таковым атацицепта, можно ожидать, что вплоть до 70-80% подкожной дозы может предполагаемо сначала поступить в периферическую лимфатическую систему. Однако система циркуляции крови и лимфатическая система являются тесно сплетенными и связанными так, что массовый обмен между компартментами крови и лимфы будет весьма оперативным и беспрепятственным даже для больших молекул. Последнее было подтверждено в случае атацицепта с помощью относительно (для молекулярного веса 73,4 кДа) быстрого уравновешивания PK профилей для внутривенного и подкожного введений. Эти рассуждения приводят по крайней мере к двум возможным, взаимосвязанным и, следовательно,никоим образом не взаимоисключающим объяснениям наблюдаемого явления. "Кинетическое" объяснение предполагает, что даже при подкожном введении достаточное количество лекарственного средства переносится в систему циркуляции крови для обеспечения адекватного ингибирования BlyS и, таким образом, для начала МоА каскада в центральном компартменте. Является хорошо известным, что многие биологические эффекты замедляются в отношении лежащих в их основе кинетики лекарственного средства. Несмотря на то что в случае атацицепта PD lag не является избыточной (о чем свидетельствует быстрое снижение уровня Ig маркеров после введения первой дозы), это оказывается достаточным для обеспечения PK lag, вызванной почти несоответствующей абсорбцией. Эта гипотеза поддерживается почти идентичными профилями комплекса атацицепт-BlyS в группах одинаковой однократной дозы при подкожном и внутривенном введении (фиг. 20), где подобие, в частности, отмечается в первые 7 дней после введения."Фармакодинамическое" объяснение заключается в том, что как система циркуляции крови, так и лимфатическая система представляют собой "сайты воздействия" для ингибирования BlyS (и APRIL) и как таковые представляют собой мишени для атацицепта. При внутривенном способе введения лекарственное средство сначала инъецируется в кровяное русло и оттуда оно распределяется к лимфе и другим(целевым и нецелевым) периферическим тканям. При подкожном пути введения лекарственное средство сначала подвергается оттоку в лимфатический компартмент и в русло крови параллельно и из последнего распределяется к другим (целевым и нецелевым) периферическим тканям. В обоих случаях проникновение лекарственного средства в оба сайта действия является незамедлительным и быстрым и приводит к подобным профилям биологической активности в каждом из них. Этот интересный факт подтверждает гипотезу о том, что механистическое применение системы знаний, которая предписывает, что оценка воздействия введенных подкожным путем белковых лекарственных средств, которая должна быть осуществлена при использовании параметра системной или "сывороточной" биодоступности, может быть неприемлемой или, в лучшем случае, неполной. Правило "чем выше системная доступность, тем больше эффект" может иметь важные исключения в этом классе лекарственных средств. Последнее имеет важное практическое применение, связанное с разработкой терапевтического режима при использовании атацицепта. Становится понятным, что внутривенный путь может представлять собой только средство для доставки более высоких доз лекарственного средства пациенту, если это является необходимым, при условии, что величина подкожной дозы может быть ограничена объемом инъекции и концентрацией раствора, содержащего дозу лекарственного средства. Хорошая переносимость, выраженная биологическая активность лечения с помощью атацицепта на ряду с его МоА и другие позитивные закономерности, наблюдаемые в двух фаза I исследованиях SLE,обеспечивают разумное объяснение для дальнейших исследовательских работ в отношении лекарственного средства для лечения пациентов с SLE. В соответствии с современной системой воззрений на разработку лекарственного средства на каждом этапе вновь полученная информация должна прилагаться к уже существующим сведениям, в то время как банк знаний в отношении лекарственного средства обновляется, расширяется и совершенствуется для последующего применения с целью создания основанной на имеющейся информации модели следующего этапа в типичном цикле "изучать и подтверждать". В соответствии с такой системой понятий авторы изобретения предпочли наблюдать и анализировать множество воздействий (свободный и композитный атацицепт), специфическое связывание (комплекс атацицептBlyS), биологическую активность (Ig и количество клеток иммунной системы) и определенные маркеры,связанные с заболеванием (анти-дцДНК антитела) в двух ранних исследованиях при использовании очень сложной модели (последовательной, с увеличением дозы). Анализируя ценность данных, полученных научным путем, и извлекая информацию, которую они содержат, для авторов представилась возможность определить интервалы доз и режимы для проведения дальнейших исследований, которые понадобятся для того, чтобы охарактеризовать профиль безопасности атацицепта, и для того, чтобы улучшить понимание его МоА, подтвердить изначальные данные клинической эффективности и определить оптимальное клиническое применение. Пример 1. Подкожное введение атацицепта. Это фаза Ib, двойное слепое, плацебо-контролируемое исследование с увеличением дозы включало шесть групп (n=8 каждая, за исключением для группы 5, в которой n=7) пациентов, которых подвергали лечению с помощью атацицепта или плацебо в соотношении 3:1. Группы 1-4 получали однократную подкожную дозу плацебо, или 0,3, 1, 3, или 9 мг/кг атацицепта. Группы 5 и 6 получали четыре еженедельные дозы плацебо или 1 или 3 мг/кг атацицепта (см. табл. 1). Пациентов подвергали наблюдению в течение 6 (группы 1-4) или 9 (группы 5 и 6) недель. Результаты измерений включали: (i) системную и местную переносимость атацицепта; (ii) частоту возникновения побочных эффектов (АЕ); (iii) фармакокинетику и фармакодинамику атацицепта, включая влияния на субпопуляции лимфоцитов и уровни Ig; и(iv) измерения активности SLE заболевания. Пациентов с SLE от слабой до умеренной степени вносили в список. Биологическая активность атацицепта была продемонстрирована с помощью зависимых от дозы снижений уровней иммуноглобулина и количества зрелых В-клеток и общего количества В-клеток. Этот эффект был наиболее сильным в группах повторной дозы и не затухал в течение всего последующего периода. Не наблюдали никаких изменений в количестве Т-клеток, клеток естественных киллеров или моноцитов. Умеренные реакции в сайте инъекции возникали более часто в группе атацицепта, чем в группе плацебо. Не наблюдали никаких различий в частоте или типе побочных эффектов, а также не было никаких тяжелых или серьезных побочных эффектов у пациентов, которых подвергали лечению при использовании атацицепта. Фармакокинетики оценивали путем измерения сывороточных уровней свободного атацицепта(табл. 2 а), атацицепт/BlyS комплекса (табл. 3 а) и композитного атацицепта (определяется как свободный атацицепт + атацицепт-BlyS комплекс, табл. 4 а). Сывороточные уровни каждого из перечисленных выше количественно оценивали при использовании твердофазного иммуноферментного анализа. Сыворотку инкубировали с мышиными mAb, конъюгированными с биотином и специфическими для атацицепта(определение свободного или общего атацицепта) (ZymoGenetics, Inc., Seattle, WA), или с козьими поликлональными антителами, конъюгированными с биотином и специфическими либо для BlyS, либо для атацицепта (определение атацицепт/BlyS комплекса) (RD Systems, Minneapolis, MN), иммобилизованными на покрытых стрептавидином микропланшетах (Adaltis, Montreal, Quebec). Антитела инкубировали вместе с образцами, взятыми от пациентов, стандартными и контрольными образцами, разведенными 1:10, в течение 1 ч. После промывания специфическое для атацицепта мышиное mAb конъюгировали с пероксидазой хрена (HRP) (для измерения свободного атацицепта или атацицепт-BlyS комплека), или в случае композита ELISA mAb, направленные против атацицепта и BlyS (ZymoGenetics, Inc.), прибавляли и инкубировали при комнатной температуре в течение 1 ч. Во всех трех анализах сывороточные уровни атацицепта определяли и количественно оценивали при использовании стандартных хемилюминесцентных способов, т.е. после промывания прибавляли тетраметилбензидин (ТМВ) в качестве HRP субстрата(Sigma-Aldrich, St. Louis, МО). Реакцию останавливали через 20 мин при использовании 0,5 М серной кислоты и регистрировали поглощение при 450 нм. Концентрацию аналита в образце пациента пересчитывали при использовании стандартной кривой,с применением алгоритма выравнивания второго порядка для многочлена. Все образцы подвергали измерению в трехкратной повторности. Аналитические критерии эффективности с точностью до 15% коэффициента вариации (CV) для стандартных образцов и 20% для образцов пациента были приемлемыми. Нижние границы количественной оценки (LLOQ) анализов составляли 15,6 нг/мл для свободного атацицепта, 5 ед./мл для комплекса атацицепт-BlyS (1 ед./мл соответствует 1,82 нг/мл атацицепта - 0,44 нг/мл BlyS в молярном соотношении 3:1) и 25 нг/мл для композитных аналитов. Среднее значение восстановления добавленного аналита, определенное для анализа точности для низких, средних и высоких концентрациях аналита в образцах RA пациентов, соответствовало величинам восстановления 82,5-97,0,93,9 и 102,0-125,8% в трех анализах, соответственно. Сывороточные РК маркеры испытывали так, как описано ниже (i) для однократной дозы группы 1-4 - при базовом уровне и через 4, 8, 12 ч в день введения и после этого в дни исследования 2, 3, 4, 8, 15, 22, 29 и 43; (ii) для многократной дозы группы 5 и 6 при базовом уровне и после этого в дни исследования 8, 15, 22, 29, 36, 43, 64. Во всех группах PK образцы в день введения дозы указаны как минимум на графике. Концентрации несвязанного BlyS измеряли в сыворотке при базовом уровне. BlyS подвергали измерению с помощью ELISA. Биотинилированные mAb, специфические для BlyS, инкубировали вместе с образцами пациента, стандартными или контрольными образцами (разведенными 1:10) в течение 1 ч в микропланшетах, предварительно покрытых стрептавидином. После промывания анти-BlyS HRPконъюгированные мышиные mAb инкубировали при комнатной температуре в течение 1 ч. После про-7 022911 мывания прибавляли ТМВ в качестве HRP субстрата. Останавливали реакцию через 20 мин при использовании 0,5 М серной кислоты и регистрировали поглощение при 450 нм. Концентрацию аналита в образце пациента пересчитывали при использовании стандартной кривой, с применением алгоритма выравнивания второго порядка для многочлена. Все образцы подвергали измерению в трехкратной повторности. Аналитические критерии эффективности с точностью до 15% коэффициента вариации (CV) для стандартных образцов и 20% для образцов пациента были приемлемыми. Нижняя граница количественной оценки (LLOQ) составляла 15,6 нг/мл BlyS в сыворотке. Среднее значение восстановления добавленного аналита для низких, средних и высоких концентраций аналита в образцах RA пациентов соответствовало величинам восстановления 101-113%. Фармакодинамики оценивали путем измерения сывороточных уровней иммуноглобулинов (IgG,IgM, IgA), комплемента-3 (С 3) и антиядерных антител (ANA), и путем осуществления проточного цитометрического анализа поднаборов лимфоцитов. Иммуноглобулины и С 3 измеряли при использовании стандартных способов. ANA измеряли при использовании Athena Multianalyte ANA аналитической системы (Zeus Scientific Inc, Raritan, NJ, USA). IgG, IgM, и IgA оценивали в крови как маркеры биологической активности. Биомаркеры измеряли при базовом уровне и через 8 ч в день введения (только группы 1-4) и после это в дни исследования 8, 15, 22, 29, 36, 43 и 64. Панель типов мононуклеарных клеток периферической крови (поднаборы В- и Т-клеток, клетки естественных киллеров [NK] и моноциты) оценивали в образцах периферической крови, окрашенных антителами, при использовании четырехцветной проточной цитометрии. Анализ включал: суммированные Тклетки(CD45+,CD3+,СВ 4+,CD8-),Тцитотоксические/супрессорные клетки (CD45+, CD3+,CD4-, CD8+), суммированные В-клетки (CDI 9+),зрелые В-клетки (CDI 9+, IgD+, CD27-), моноциты (CD45+, CD3-, CD14+, CD56-) и NK клетки (CD45+,CD3-, CD14-, CD56+). Организация, с которой был заключен договор (Esoterix, Groningen, The Netherlands), осуществляла обработку образцов, окрашивание антителами и комплектование, анализ и качественный контроль данных. Авторы осуществляли дальнейший анализ и качественный контроль на поднаборах В-клеток. Для поднаборов В-клеток аналитический фильтр был увеличен для включения малых и больших лимфоцитов, с последними, которые были подобны по своим размерам моноцитам. Медицинские истории собирали при включении в исследование и исследование состояния здоровья осуществляли на еженедельной основе. Гематологические профили и профили химии крови проводили еженедельно и подвергали оценке при использовании общих критериев токсичности Национального института рака. Образцы крови для фармакокинетических оценок собирали еженедельно для групп повторяемой дозы и в день 1 через 4 и 8 ч, а также в дни 2, 3, 4 и 8 и после этого еженедельно для групп однократной дозы. Образцы крови для фармакодинамических оценок собирали еженедельно для групп повторяемой дозы и в дни 2, 3, 8 и после этого еженедельно для групп однократной дозы. Электрокардиограмму после дня D4 проводили один раз в две недели в группах однократной дозы и еженедельно у пациентов, которые получали повторяемые дозы исследуемого лекарственного средства. Несмотря на то что исследование не было направлено на определение воздействия лечения на активность заболевания, приведенные ниже измерения получали для обеспечения предварительных данных относительно эффективности. SELENA SLEDAI оценки определяли при базовом уровне и в дни 29 и 43 (группы 1-4), а также в дни 22 и 64 (группы 5 и 6). Уровни анти-дцДНК антитела и C3 измеряли при базовом уровне, в дни 15, 29 и 43 (группы 1-4), а также в дни 15, 22, 29, 43 и 64 (группы 5 и 6). Способы анализа данных, которые включали профили концентрация-время, подвергали некомпартментному анализу (NCA; WinNonLin программное обеспечение, версия 5.0.1). Игнорировали все измерения, ниже LLOQ для NCA. Данные на основе использования биомаркеров (IgM, IgG или IgA) превращали в формат "отличие от базового уровня" и потом индивидуальные профили биомаркер-время также подвергали NCA. Полученные NCA-выведенные измерения для воздействия (PK) и ответа последовательно подвергали анализу вместе для исследования существующих взаимоотношений воздействиеответ. Было получено подтверждение нелинейной фармакокинетики, последовательное с фармакокинетиками насыщаемого связывания взаимодействий лиганд-рецептор (фиг. 1 и 2). Профили концентрациявремя для свободного и композитного атацицепта продемонстрировали мультифазные фармакокинетики с четкой быстрой абсорбцией, Tmax составляло приблизительно 24 ч после введения первой дозы, и начальная фаза распределения длилась 7-14 дней. Наблюдали низкую аккумуляцию свободного атацицепта в группах повторяемой дозы; аккумуляция композитного атацицепта была незначительно выше, а комплекс атацицепт-BlyS, как было обнаружено, подвергался аккумуляции в течение периода введения дозы. Лечение с помощью атацицепта начальным, временным повышением уровня зрелых и суммарных В-клеток, после чего следовало замедленное зависимое от дозы снижение (фиг. 3 В). В группах однократной дозы 3 мг/кг и 9 мг/кг и в группах повторяемой дозы снижение на 35% по сравнению с базовым уровнем в случае зрелых В-клеток наблюдали в день 29. В группах однократной дозы это снижение длилось вплоть до дня 43; в группах повторяемой дозы снижение приблизительно на 60% наблюдали в день 43, и оно стабилизировалось на 45-60% до последней оценки в день 64. Модели, наблюдаемые для суммарных В-клеток, были подобными таковым для зрелых В-клеток. В группе однократной дозы 3 мг/кг снижение по сравнению с базовым уровнем приблизительно на 30% для суммарных В-клеток наблюдали в день 29, и оно оставалось стабильным до дня 43. В группах повторяемой дозы снижение приблизительно на 40-50% наблюдали в день 43, и оно стабилизировалось на 35-60% до последней оценки в день 64(фиг. 3 В). Не существовало значимых изменений в количестве суммарных, хелперных или цитотоксических Т-клеток, NK клеток или моноцитов. Зависимое от дозы снижение уровней иммуноглобулинов наблюдали у пациентов, которых подвергали лечению с помощью атацицепта (фиг. 3 А и 3 В, см. также табл. 5 а). Этот эффект был наиболее значительным в группах повторяемой дозы. Уровни IgM продемонстрировали наибольшее снижение при лечении, достигая приблизительно 50% в день 43 в группе повторяемой дозы 3 мг/кг. Уровни IgA снижались приблизительно на 33% в группе повторяемой дозы 3 мг/кг в день 29, а уровни IgG снижались приблизительно на 16% в группе повторяемой дозы 3 мг/кг в день 36. Самые низкие уровни возникали между днями 15 и 29 в группах однократной дозы между днями 29 и 43 в группах повторяемой дозы. После этого значения начинали возвращаться к базовому уровню. Последние наблюдаемые значения были на 5-30% ниже базового уровня в группах однократной дозы (за исключением группы 0,3 мг/кг,в которой значения IgM были выше базового уровня) и на 8-65% ниже базового уровня в группах повторяемой дозы. Эти результаты показывают, что более частое введение меньших доз атацицепта обеспечивает лучшую биологическую активность, чем более частое введение доз при более высоких дозах (фиг. 7 и 8). Пример 2. Внутривенное введение атацицепта. Это фаза Ib, двойное слепое, плацебо-контролируемое исследование с увеличением дозы включало четыре группы (n=6 каждая) пациентов, которых подвергали лечению при использовании внутривенного введения атацицепта или плацебо в соотношении 3:1. Группы 1-3 получали однократную дозу плацебо,3, 9 или 18 мг/кг атацицепта, вторая доза вводилась через три недели после начальной дозы. Результаты измерений включали: (i) системную и местную переносимость внутривенного атацицепта; (ii) частоту возникновения побочных эффектов (АЕ); (iii) фармакокинетику и фармакодинамику внутривенного атацицепта, включая влияния на субпопуляции лимфоцитов и уровни Ig; и (iv) измерения активности SLE заболевания. Субъектов подвергали оценки в течение периода 6 недель (группы 1-3) или периода 9 недель (группа 4); субъекты из групп 3 и 4 возвращались в дни исследования 84 и 120 для взятия образцов на PK и биомаркеры. Сывороточные PK маркеры испытывали так, как описано ниже (i) для групп однократной дозы 1 - при базовом уровне и через 0,25, 0,5 и 4 ч в день введения и после этого в дни 2, 3,4, 8, 15, 22, 29 и 43; (ii) для группы многократной дозы 4 - при базовом уровне и через 0,25, 0,5 и 4 ч в день первого введения и после этого в дни 8, 22, 22 (перед второй дозой и через 0,25 и 0,5 ч после введения второй дозы), 29, 36, 43, 64. Для групп 3 и 4 осуществляли измерение PK в дни 85 и 120. Во всех группах PK образцы в день введения дозы указаны как минимум на графике. Концентрации несвязанногоBlyS измеряли в сыворотке при базовом уровне. IgG, IgM и IgA оценивали в крови как маркеры биологической активности. Биомаркеры измеряли при базовом уровне и после в дни исследования 2, 3, 4, 8, 15(только группы 1-3), 22, 29, 36, 43 и 64 (только группа 4). А в группах 3 и 4 также осуществляли измерения Ig в дни исследования 85 и 120. Как и в примере 1, пациентов с SLE от слабой до умеренной степени вносили в список, и фармакокинетики оценивали путем измерения сывороточных уровней свободного атацицепта (табл. 2b), атацицепт/BlyS комплекса (табл. 3b) и композита атацицепта (определяется как свободный атацицепт + атацицепт-BlyS комплекс, табл. 4b). Биологическая активность атацицепта была продемонстрирована с помощью зависимых от дозы снижений уровней иммуноглобулина и количества зрелых В-клеток и общего количества В-клеток (см. фиг. 11, см. также фиг. 5b). Этот эффект был наиболее сильным в группе повторной дозы и не затухал в течение всего последующего периода. Не наблюдали никаких изменений в количестве Т-клеток, клеток естественных киллеров или моноцитов. Умеренные реакции в сайте инъекции возникали более часто в группе атацицепта, чем в группе плацебо. Не было никаких различий в частоте или типе побочных эффектов, а также не было никаких тяжелых или серьезных побочных эффектов у пациентов, которых подвергали лечению при использовании атацицепта. Сравнение между путями подкожного введения (см. пример 1) и внутривенного введения выявило весьма подобные фармакокинетики (нелинейная PK, опосредованная лигандами) и подобную PK, которая была прогнозируемой и последовательной с однократной и многократной дозами (фиг. 9 и 10). Несмотря на то что не было выявлено преимуществ внутривенного введения (невзирая на более высокую биодоступность при использовании этого способа введения, см. фиг. 4), эти результаты также поддерживают вывод о том, что более частое ведение меньших доз атацицепта обеспечивает лучшую биологическую активность, чем не такое частое введение доз при более высоких дозах (фиг. 7 и 8). Эти результаты также указывают на то, что несмотря на более низкую биодоступность лекарственного средства при использовании подкожного введение, профили связывания для двух способов являются весьма сравнимыми (см. фиг. 7). Таблица 1 Ветви дозировок в фазе I SLE исследованиях при использовании атацицептаQW - каждую неделю. Таблица 2 а Фармакокинетические параметры для свободного атацицепта, полученные из некомпартментного анализа, исследование 1AUC336 - площадь под кривой концентрация-время от момента времени 0 ч до момента времени 336 ч; AUCINF - AUC от момента времени 0 ч до бесконечности; Cmax - максимальная концентрация; SD - стандартное отклонение; T1/2 - конечный период полувыведения; Ттах - время достижения максимальной концентрации. Последняя доза вводилась в момент времени 504 ч. N=6 SLE пациентов на группу. Н.О. - не оценивали в соответствии с планом взятия образцов после введения последней дозы. Таблица 2b Фармакокинетические параметры для свободного атацицепта, полученные из некомпартментного анализа, исследование 2AUC336 - площадь под кривой концентрация-время от момента времени 0 ч до момента времени 336 ч; AUCINF - AUC от момента времени 0 ч до бесконечности; Cmax - максимальная концентрация; SD - стандартное отклонение; T1/2 конечный период полувыведения; Tmax время достижения максимальной концентрации. Последняя доза вводилась в момент времени 504 ч. N=6 SLE пациентов на группу. Н.О. - не оценивали в соответствии с планом взятия образцов после введения первой дозы. Таблица 3 а Фармакокинетические параметры для композита атацицепта, полученные из некомпартментного анализа, исследование 1AUC336 - площадь под кривой концентрация-время от момента времени 0 ч до момента времени 336 ч; AUCINF - AUC от момента времени 0 ч до бесконечности; Cmax - максимальная концентрация; SD - стандартное отклонение; T1/2 - конечный период полувыведения; Tmax - время достижения максимальной концентрации. Последняя доза вводилась в момент времени 504 ч. N=6 SLE пациентов на группу. Н.О. - не оценивали в соответствии с планом взятия образцов после введения последней дозы. Таблица 3b Фармакокинетические параметры для композита атацицепта, полученные из некомпартментного анализа, исследование 2AUC336 - площадь под кривой концентрация-время от момента времени 0 ч до момента времени 336 ч; AUCINF - AUC от момента времени 0 ч до бесконечности;Cmax - максимальная концентрация; SD - стандартное отклонение; T1/2 - конечный период полувыведения; Tmax - время достижения максимальной концентрации. Последняя доза вводилась в момент времени 504 ч. N=6 SLE пациентов на группу. Н.О. - не оценивали в соответствии с планом взятия образцов после введения первой дозы. Таблица 4 а Фармакокинетические параметры для комплекса BlyS-атацицепт,полученные из некомпартментного анализа, исследование 1AUC336 - площадь под кривой концентрация-время от момента времени 0 ч до момента времени 336 ч; AUCINF - AUC от момента времени 0 ч до бесконечности; Cmax максимальная концентрация; SD - стандартное отклонение; T1/2 - конечный период полувыведения; Tmax - время достижения максимальной концентрации. Последняя доза вводилась в момент времени 504 ч. N=6 SLE пациентов на группу.T1/2 и AUCINF не являются достоверными оценками для этой величины по причине терминальной формы профилей. Таблица 4b Фармакокинетические параметры для комплекса BlyS-атацицепт, полученные из некомпартментного анализа, исследование 2AUC336 - площадь под кривой концентрация-время от момента времени 0 ч до момента времени 336 ч; AUCINF - AUC от момента времени 0 ч до бесконечности; Cmax - максимальная концентрация; SD - стандартное отклонение; T1/2 - конечный период полувыведения; Tmax - время достижения максимальной концентрации. Последняя доза вводилась в момент времени 504 ч. N=6 SLE пациентов на группу. Н.О. - не оценивалиT1/2 и AUCINF не являются достоверными оценками для этой величины по причине терминальной формы профилей. Таблица 5 а Результаты некомпартментного анализа для (Ig)M, IgA, и IgG биомаркеров исследование 1 Пациенты активной дозы для групп 1-6 (n=6). Плацебо группа, все плацебо-пациенты, объединенные вместе (n=12).Tmax - время максимального истощения Ig. д.о. - данные отсутствуют. Таблица 5b Результаты некомпартментного анализа для (Ig)M, IgA, и IgG биомаркеров исследование 2 Пациенты активной дозы для групп 1-4 (n=5). Плацебо группа, все плацебо-пациенты, объединенные вместе (n=4).Tmax - время максимального истощения Ig. Ссылки Упоминания, цитируемые в данном изобретении, включая патенты, опубликованные заявки и другие публикации, введены в данное описание как ссылки. Перечень последовательностей ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения пациента, страдающего I или II стадией системной красной волчанки, включающий еженедельное введение в дозе приблизительно от 1 до приблизительно 10 мг/кг в течение приблизительно от 2 до приблизительно 52 недель слитой молекулы, которая включает:(i) TACI внеклеточный домен или его фрагмент, который связывается с BlyS;(ii) константный домен иммуноглобулина человека. 2. Способ по п.1, где указанный TACI внеклеточный домен имеет последовательность, включающую SEQ ID NO: 1. 3. Способ по п.1, где указанный TACI внеклеточный домен является по крайней мере на 50% идентичным SEQ ID NO: 1. 4. Способ по п.1, где указанный TACI внеклеточный домен имеет последовательность, включающую аминокислоты 30-110 SEQ ID NO: 1. 5. Способ по п.1, где указанный константный домен иммуноглобулина человека имеет последовательность, включающую SEQ ID NO: 2. 6. Способ по п.1, где указанная слитая молекула представляет собой атацицепт. 7. Способ по п.1, где указанная композиция вводится в количестве приблизительно от 1 до приблизительно 9 мг/кг. 8. Способ по п.1, где этот способ предусматривает дополнительное введение пациенту второго лекарственного средства, которое выбрано из группы, состоящей из NSAID, противомалярийных средств,кортикостероидов, иммуносупрессивных агентов, IVIg, DHEA и талидомида. 9. Способ по п.8, где указанная слитая молекула представляет собой атацицепт. 10. Способ по п.1, где указанная слитая молекула вводится подкожно, перорально или внутривенно. 11. Способ по п.1, где пациент представляет собой человека.
МПК / Метки
МПК: A61K 9/00, A61K 9/06, A61K 38/00
Метки: красной, системной, пациента, стадией, волчанки, лечения, страдающего, способ
Код ссылки
<a href="https://eas.patents.su/30-22911-sposob-lecheniya-pacienta-stradayushhego-i-ili-ii-stadiejj-sistemnojj-krasnojj-volchanki.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения пациента, страдающего i или ii стадией системной красной волчанки</a>
Предыдущий патент: Способ проведения электромагнитной разведки