Способы улучшения дизайна, биодоступности и эффективности композиций полимеров со случайной последовательностью путем основанной на сыворотке детекции композиций полимеров со случайной последовательностью
Номер патента: 22399
Опубликовано: 30.12.2015
Авторы: Занелли Эрик, Кригер Джефф, Коннолли Джо, Коллинз Кэтрин Х.
Формула / Реферат
1. Способ детекции композиции RSP, включающий:
a) предоставление, по существу, чистого препарата одного или более улавливающих полипептидов;
b) связывание одного или более улавливающих полипептидов со средством для количественной детекции композиции RSP;
c) определение связывания композиции RSP с одним или более из указанных улавливающих полипептидов.
2. Способ детекции элементов в композиции RSP, включающий:
a) предоставление, по существу, чистого препарата одного или более улавливающих полипептидов;
b) связывание одного или более улавливающих полипептидов с твердой подложкой;
c) приведение твердой подложки в контакт с композицией RSP;
d) определение связывания отдельных элементов композиции RSP с твердой подложкой.
3. Способ по п.1 или 2, где один или более улавливающих полипептидов согласно (а) идентифицируют путем:
i) связывания композиции RSP с твердой подложкой;
ii) приведения в контакт указанной твердой подложки согласно (i) с содержащей белок биологической жидкостью;
iii) идентификации белков согласно (ii), специфично связавшихся с твердой подложкой согласно (i);
где белок, идентифицированный в (ii), представляет собой улавливающий полипептид.
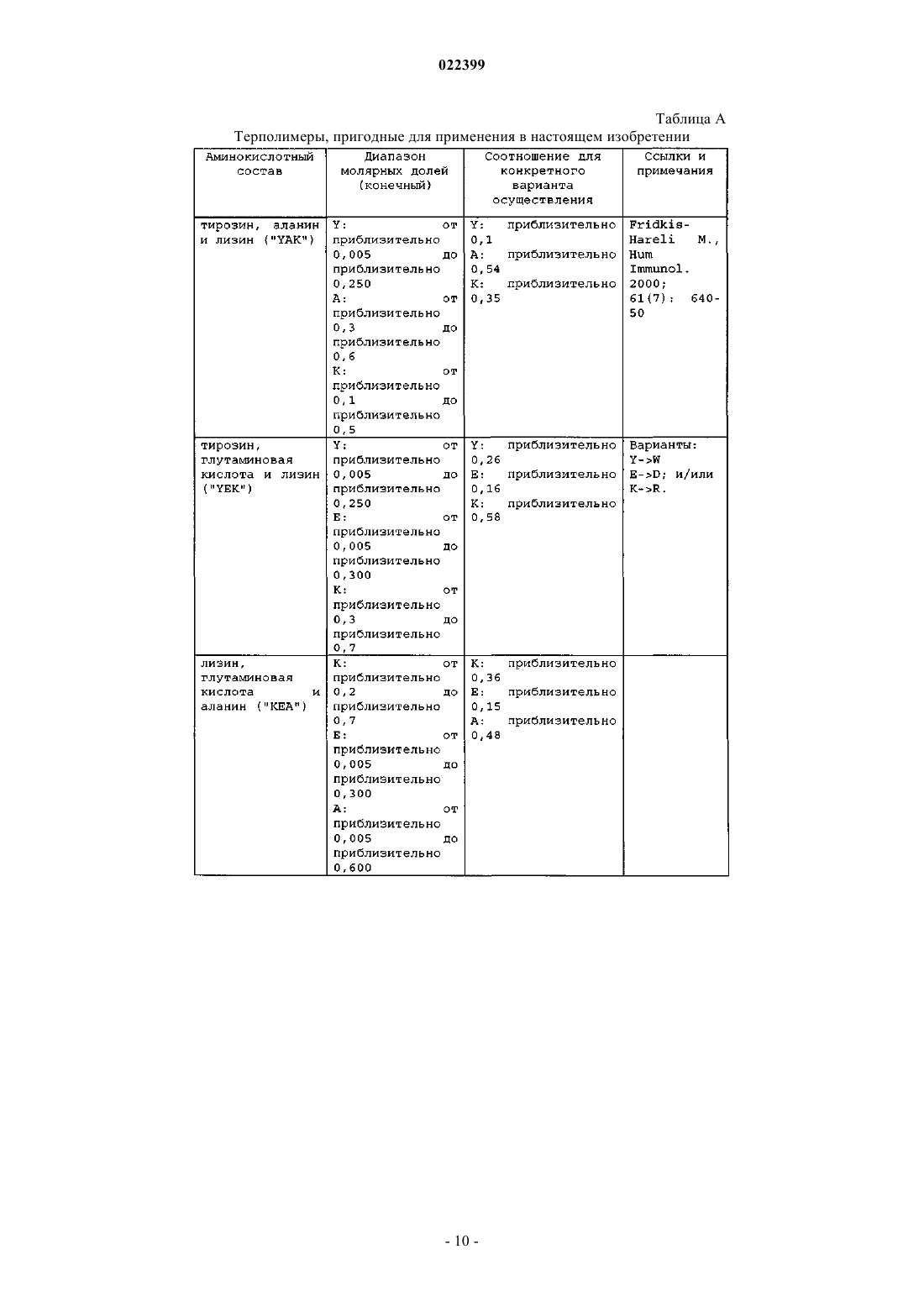
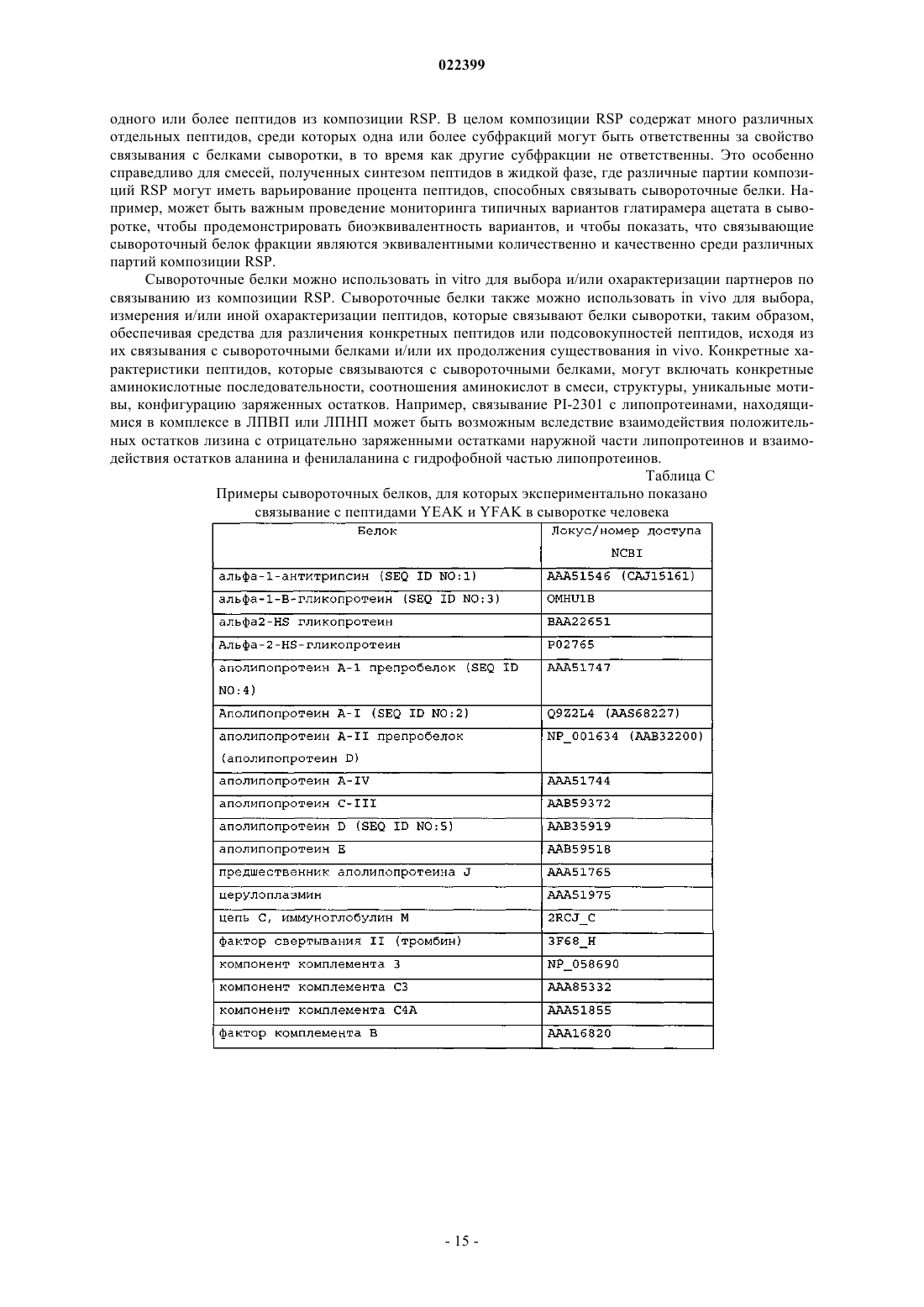
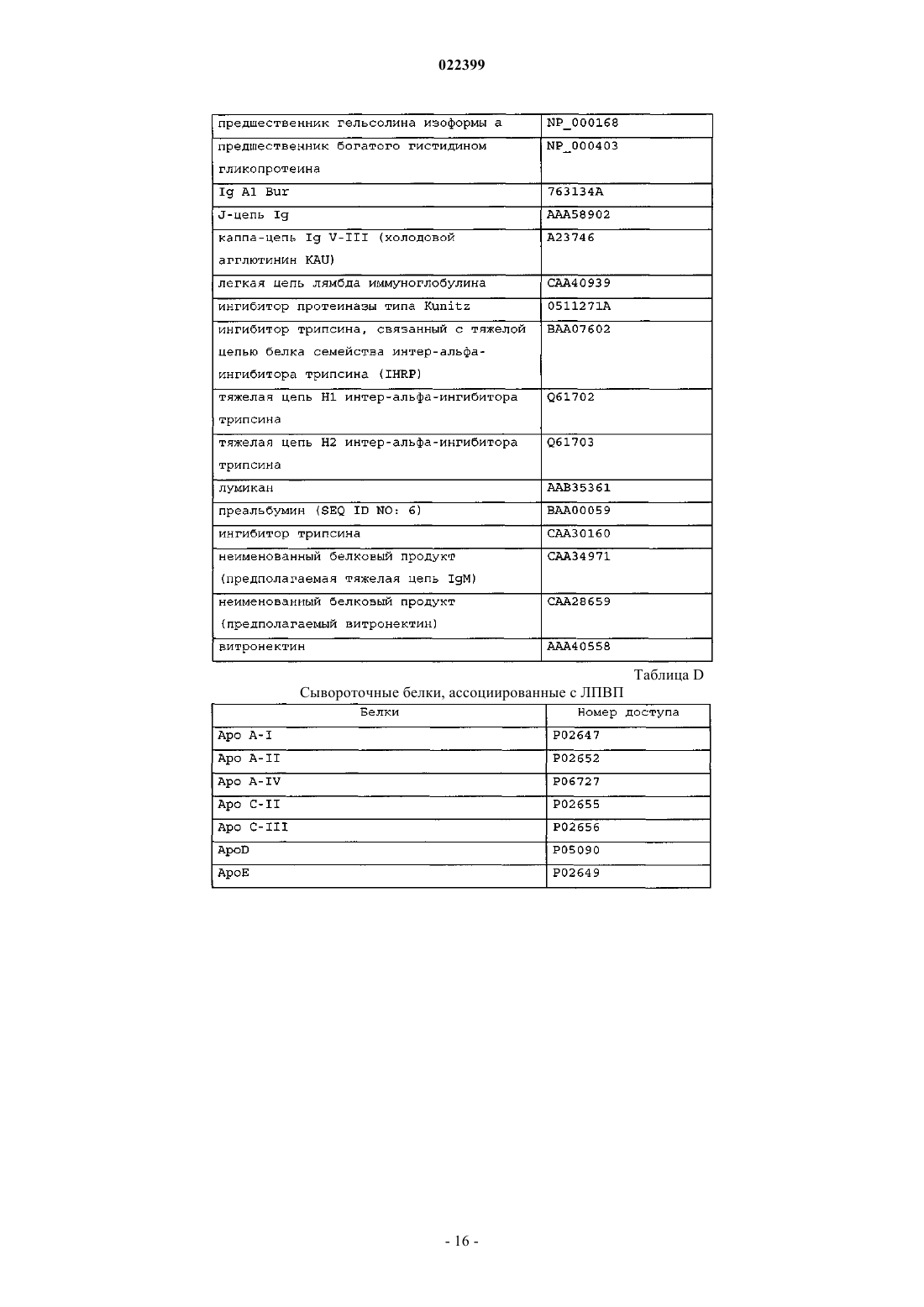
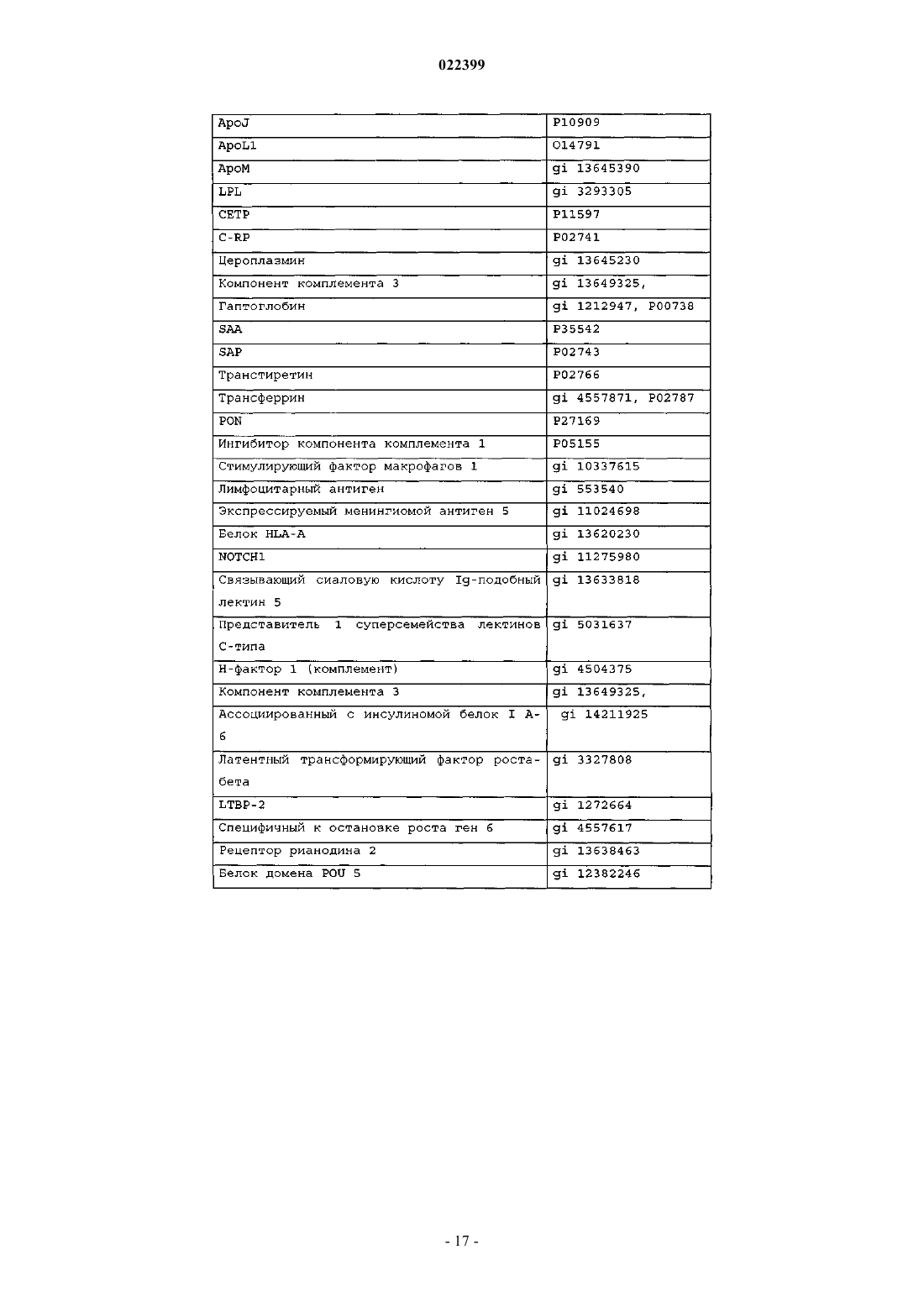
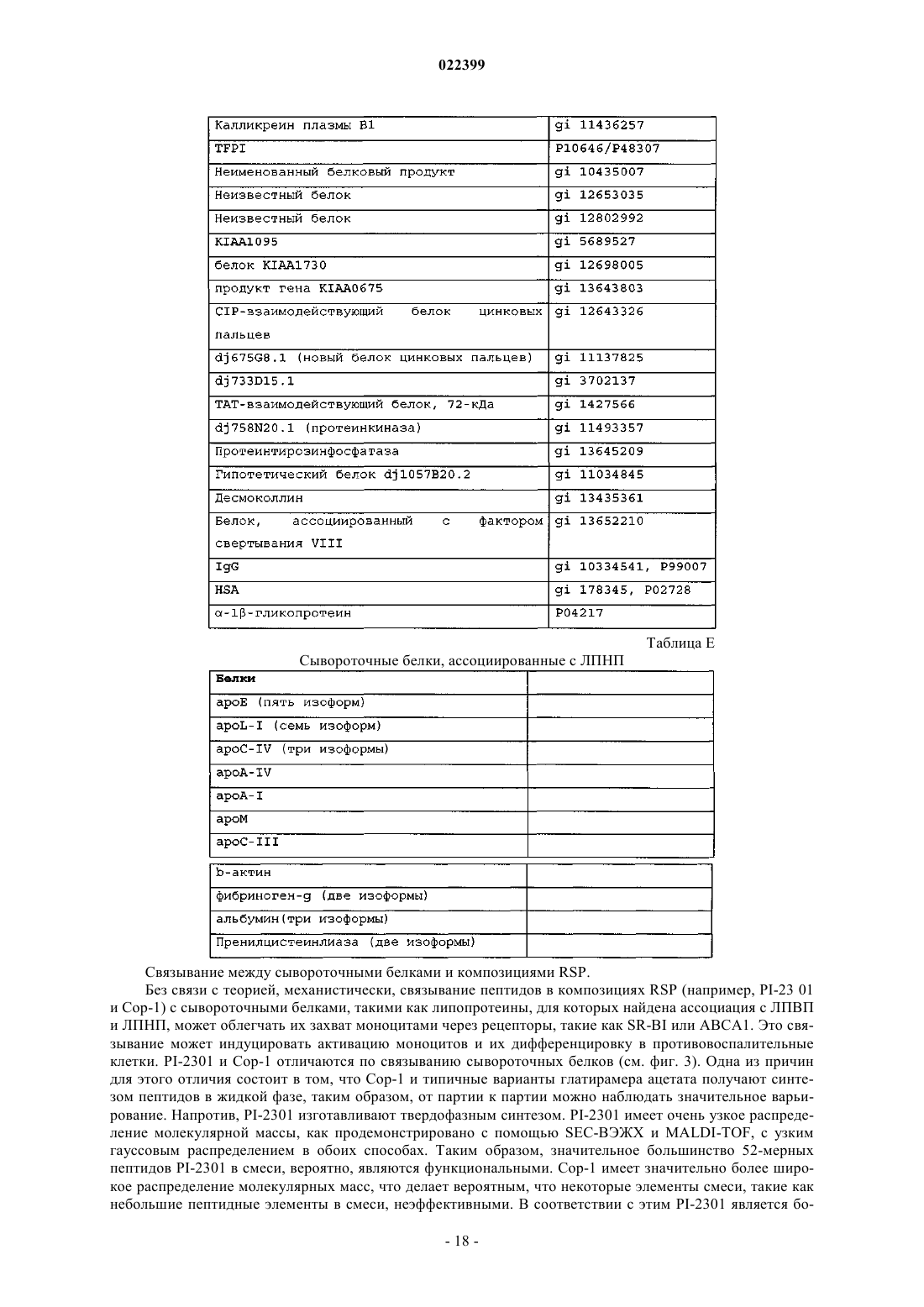
4. Способ по любому из пп.1-3, где улавливающий полипептид выбран из компонента комплемента С3, препробелка аполипопротеина A-I, препробелка аполипопротеина A-II (аполипопротеин D), компонента комплемента С4А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интеральфа-ингибитора трипсина (IHRP), альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина A-IV, церулоплазмина, неименованного белкового продукта (локус/№ доступа NCBI САА34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа2-HS-гликопротеина, предшественника аполипопротеина J, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/№ доступа NCBI САА28659) и J-цепи Ig.
5. Способ определения присутствия композиции RSP, включающий стадии:
a) связывания одного или более белков, выбранных из компонента комплемента С3, препробелка аполипопротеина A-I, препробелка аполипопротеина A-II (аполипопротеин D), компонента комплемента С4А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интер-альфа-ингибитора трипсина (IHRP), альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина А-IV, церулоплазмина, неименованного белкового продукта (локус/№ доступа NCBI CAA34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа2-HS-гликопротеина, предшественника аполипопротеина J, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/№ доступа NCBI CAA28659) и J-цепи Ig, со средством для количественной детекции указанной композиции RSP в образце; и
b) определения уровня указанной композиции RSP в указанном образце.
6. Способ по п.1 или 2, где улавливающий полипептид выбран из компонента комплемента С3, препробелка аполипопротеина A-I, препробелка аполипопротеина А-II (аполипопротеин D), компонента комплемента С4А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интер-альфа-ингибитора трипсина (IHRP), альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина А-IV, церулоплазмина, неименованного белкового продукта (локус/№ доступа NCBI CAA34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа2-HS-гликопротеина, предшественника аполипопротеина J, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/№ доступа NCBI CAA28659) и J-цепи Ig.
7. Способ детекции присутствия композиции RSP в биологическом образце, включающий:
a) приведение в контакт биологического образца по меньшей мере с одним улавливающим полипептидом, содержащимся в нормальной сыворотке человека, нормальной сыворотке не являющегося человеком примата, нормальной сыворотке кролика, нормальной сыворотке мыши, нормальной сыворотке крысы, нормальной сыворотке хорька, нормальной сыворотке свиньи, нормальной сыворотке собаки, нормальной сыворотке лошади, нормальной сыворотке овцы, нормальной сыворотке коровы;
b) детекцию наличия или отсутствия связывания улавливающего полипептида с композицией RSP,
где наличие связывания указывает на присутствие композиции RSP в биологическом образце.
8. Способ по п.7, где улавливающий полипептид выбран из полипептида, содержащего по меньшей мере один компонент протеома ЛПВП, протеома ЛПНП или по меньшей мере один сывороточный белок.
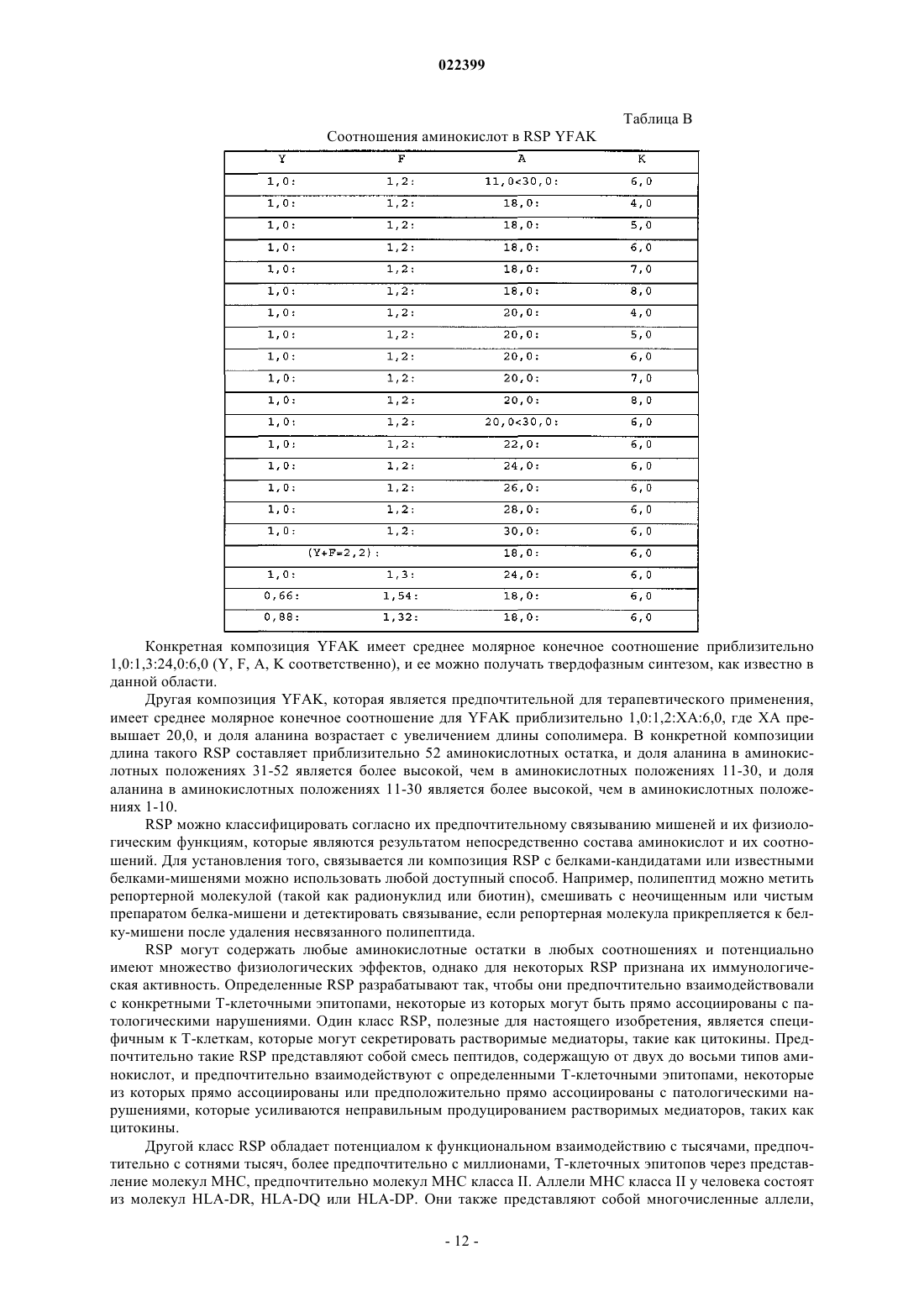
9. Способ по п.7, где композиция RSP содержит пептиды YFAK.
10. Способ по п.7, где композиция RSP содержит пептиды YEAK.
11. Способ детекции присутствия композиции RSP, содержащей пептиды YFAK или YEAK, в биологическом образце, включающий:
a) приведение в контакт биологического образца по меньшей мере с одним улавливающим полипептидом, содержащим пептид, выбранный из компонента комплемента С3, препробелка аполипопротеина A-I, препробелка аполипопротеина A-II (аполипопротеин D), компонента комплемента С4А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интеральфа-ингибитора трипсина (IHRP), альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина А-IV, церулоплазмина, неименованного белкового продукта (локус/№ доступа NCBI САА34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа2-HS-гликопротеина, предшественника аполипопротеина J, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/№ доступа NCBI САА28659) и J-цепи Ig; и
b) детекцию наличия или отсутствия связывания улавливающего полипептида с композицией RSP,
где наличие связывания указывает на присутствие пептидов YFAK или YEAK в биологическом образце.
12. Способ измерения количества композиции RSP, содержащей пептиды YFAK или YEAK, в биологическом образце, включающий:
a) приведение в контакт биологического образца по меньшей мере с одним улавливающим полипептидом, содержащим пептид, выбранный из компонента комплемента С3, препробелка аполипопротеина A-I, препробелка аполипопротеина A-II (аполипопротеин D), компонента комплемента С4А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интеральфа-ингибитора трипсина (IHRP), альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина А-IV, церулоплазмина, неименованного белкового продукта (локус/№ доступа NCBI САА34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа2-HS-гликопротеина, предшественника аполипопротеина J, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/№ доступа NCBI САА28659) и J-цепи Ig;
b) количественное определение уровня связывания улавливающего полипептида с композицией RSP;
где уровень связывания указывает на количество композиции RSP в биологическом образце.
13. Способ определения биодоступности композиции RSP, содержащей пептиды YFAK или YEAK, у млекопитающего, включающий:
a) введение млекопитающему дозы композиции, содержащей композицию RSP;
b) взятие биологического образца от индивидуума;
c) приведение в контакт биологического образца по меньшей мере с одним улавливающим полипептидом, содержащим пептид, выбранный из компонента комплемента С3, препробелка аполипопротеина A-I, препробелка аполипопротеина А-II (аполипопротеин D), компонента комплемента С4А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интеральфа-ингибитора трипсина (IHRP), альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина А-IV, церулоплазмина, неименованного белкового продукта (локус/№ доступа NCBI САА34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа2-HS-гликопротеина, предшественника аполипопротеина J, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/№ доступа NCBI САА28659) и J-цепи Ig;
чем определяется биодоступность композиции RSP в биологическом образце.
14. Способ определения подходящей дозы композиции RSP, содержащей пептиды YFAK или YEAK, для введения индивидууму, нуждающемуся в этом, включающий:
a) введение индивидууму дозы композиции RSP;
b) взятие биологического образца от индивидуума;
c) приведение в контакт биологического образца по меньшей мере с одним улавливающим полипептидом, содержащим пептид, выбранный из компонента комплемента С3, препробелка аполипопротеина A-I, препробелка аполипопротеина А-II (аполипопротеин D), компонента комплемента С4А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интеральфа-ингибитора трипсина (IHRP), альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина А-IV, церулоплазмина, неименованного белкового продукта (локус/№ доступа NCBI САА34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа2-HS-гликопротеина, предшественника аполипопротеина J, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/№ доступа NCBI САА28659) и J-цепи Ig;
d) определение уровня улавливающего полипептида в биологическом образце;
e) необязательно, повторение стадий (а)-(d) с использованием отличающейся дозы и
f) сравнение уровней с заданным подходящим уровнем композиции RSP в биологическом образце;
где подходящая доза представляет собой дозу, которая приводит к заданном подходящему уровню композиции RSP в биологическом образце.
15. Способ лечения или профилактики нежелательного иммунного ответа у индивидуума, включающий:
а) введение индивидууму подходящей дозы композиции RSP, содержащей пептиды YFAK или YEAK, где такую подходящую дозу определяют путем:
(i) введения индивидууму дозы композиции RSP;
(ii) взятия биологического образца от экспериментального индивидуума;
(iii) приведения в контакт биологического образца по меньшей мере с одним улавливающим полипептидом, выбранным из компонента комплемента С3, препробелка аполипопротеина A-I, препробелка аполипопротеина А-II (аполипопротеин D), компонента комплемента С4А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интер-альфа-ингибитора трипсина (IHRP), альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина А-IV, церулоплазмина, неименованного белкового продукта (локус/№ доступа NCBI CAA34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа2-HS-гликопротеина, предшественника аполипопротеина J, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/№ доступа NCBI CAA28659) и J-цепи Ig;
(iv) определения уровня улавливающего полипептида в биологическом образце;
(v) необязательно, повторения стадий (i)-(iv) с использованием отличающейся дозы и
(vi) сравнения уровня(ей) против заданного подходящего уровня композиции RSP в биологическом образце;
где подходящая доза представляет собой дозу, которая приводит к заданному подходящему уровню композиции RSP в указанном биологическом образце.
16. Способ по любому из пп.11-15, где улавливающий полипептид является меченым.
17. Способ по любому из пп.11-15, где улавливающий полипептид связан с твердой подложкой.
18. Способ по любому из пп.11-15, дополнительно включающий выделение комплекса, содержащего улавливающий полипептид, связанный с композицией RSP.
19. Способ по любому из пп.11-15, дополнительно включающий детекцию связывания улавливающего полипептида с композицией RSP с антителами к улавливающему полипептиду.
20. Способ по любому из пп.11-15, где композицию вводят подкожно.
21. Композиция для детекции композиции RSP, содержащей пептиды YFAK или YEAK, в биологическом образце, содержащая по меньшей мере один улавливающий полипептид, содержащий пептид, выбранный из компонента комплемента С3, препробелка аполипопротеина A-I, препробелка аполипопротеина A-II (аполипопротеин D), компонента комплемента С4А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интеральфа-ингибитора трипсина (IHRP), альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина A-IV, церулоплазмина, неименованного белкового продукта (локус/№ доступа NCBI САА34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа2-HS-гликопротеина, предшественника аполипопротеина J, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/№ доступа NCBI САА28659) и J-цепи Ig.
22. Способ выделения пептидов из образца, включающего композицию RSP, содержащую пептиды YFAK или YEAK, включающий:
а) приведение в контакт образца по меньшей мере с одним улавливающим полипептидом, содержащим пептид, выбранный из компонента комплемента С3, препробелка аполипопротеина A-I, препробелка аполипопротеина А-II (аполипопротеин D), компонента комплемента С4А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интер-альфа-ингибитора трипсина (IHRP), альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина A-IV, церулоплазмина, неименованного белкового продукта (локус/№ доступа NCBI CAA34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа2-HS-гликопротеина, предшественника аполипопротеина J, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/№ доступа NCBI CAA28659) и J-цепи Ig;
b) отделение пептидов, которые связываются с улавливающим полипептидом, от смеси.
23. Способ по п.22, где улавливающий полипептид иммобилизован на твердой подложке.
24. Способ по п.23, где улавливающий полипептид является меченным эпитопом.
25. Способ по п.22, дополнительно включающий отделение связавшихся пептидов от улавливающих полипептидов.
26. Способ по п.22, дополнительно включающий определение характеристик выделенных пептидов.
27. Способ по п.26, где определение характеристик включает определение аминокислотной последовательности связавшегося пептида или определение относительных соотношений аминокислот в связавшихся пептидах.
28. Способ идентификации биодоступных пептидов в композиции RSP, содержащей пептиды YFAK или YEAK, у индивидуума, включающий:
a) сначала введение композиции RSP индивидууму;
b) затем после введения взятие образца ткани от пациента и
c) идентификацию пептидов в образце, которые связываются по меньшей мере с одним улавливающим полипептидом, содержащим пептид, выбранный из компонента комплемента С3, препробелка аполипопротеина A-I, препробелка аполипопротеина A-II (аполипопротеин D), компонента комплемента С4А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интеральфа-ингибитора трипсина (IHRP), альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина A-IV, церулоплазмина, неименованного белкового продукта (локус/№ доступа NCBI САА34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа2-HS-гликопротеина, предшественника аполипопротеина J, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/№ доступа NCBI САА28659) и J-цепи Ig.
29. Способ получения композиции RSP, содержащей пептиды YFAK или YEAK, обладающей сниженной токсичностью, включающий:
а) приведение в контакт композиции RSP по меньшей мере с одним улавливающим полипептидом, содержащим пептид, выбранный из компонента комплемента С3, препробелка аполипопротеина A-I, препробелка аполипопротеина A-II (аполипопротеин D), компонента комплемента С4А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интер-альфа-ингибитора трипсина (IHRP), альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина А-IV, церулоплазмина, неименованного белкового продукта (локус/№ доступа NCBI CAA34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа2-HS-гликопротеина, предшественника аполипопротеина J, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/№ доступа NCBI CAA28659) и J-цепи Ig;
b) отделение пептидов, которые связываются с улавливающим полипептидом, от смеси;
c) определение характеристик отделенных пептидов;
d) получение набора пептидов с характеристиками отделенных пептидов.
30. Способ получения композиции RSP, содержащей пептиды YFAK или YEAK, обладающей усиленной эффективностью, включающий:
a) приведение в контакт композиции RSP по меньшей мере с одним улавливающим полипептидом, содержащим пептид, выбранный из компонента комплемента С3, препробелка аполипопротеина A-I, препробелка аполипопротеина A-II (аполипопротеин D), компонента комплемента С4А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интер-альфа-ингибитора трипсина (IHRP), альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина А-IV, церулоплазмина, неименованного белкового продукта (локус/№ доступа NCBI CAA34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа2-HS-гликопротеина, предшественника аполипопротеина J, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/№ доступа NCBI CAA28659) и J-цепи Ig;
b) отделение пептидов, которые связываются с улавливающим полипептидом, от смеси;
c) определение характеристик отделенных пептидов;
d) получение набора пептидов с характеристиками отделенных пептидов.
31. Способ лечения или профилактики нежелательного иммунного ответа у индивидуума, включающий:
a) предоставление композиции RSP, содержащей пептиды YFAK или YEAK;
b) введение композиции RSP испытуемому индивидууму;
c) взятие биологического образца от испытуемого индивидуума;
d) приведение в контакт биологического образца по меньшей мере с одним улавливающим полипептидом, содержащим пептидную последовательность, выбранную из компонента комплемента С3, препробелка аполипопротеина A-I, препробелка аполипопротеина А-II (аполипопротеин D), компонента комплемента С4А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интеральфа-ингибитора трипсина (IHRP), альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина A-IV, церулоплазмина, неименованного белкового продукта (локус/№ доступа NCBI САА34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа2-HS-гликопротеина, предшественника аполипопротеина J, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/№ доступа NCBI САА28659) и J-цепи Ig;
e) отделение пептидов, которые связываются с улавливающим полипептидом, от смеси;
f) определение характеристик отделенных пептидов;
g) получение набора пептидов с характеристиками отделенных пептидов;
h) введение нового набора пептидов индивидууму.
32. Способ по п.28 или 31, где пептиды вводят индивидууму более одного раза.
33. Способ по п.32, где пептиды вводят индивидууму с интервалами 1, 2, 3, 4, 6, 12, 18, 24, 36, 48 или 72 ч.
34. Способ сравнения различных препаратов композиции RSP, содержащей пептиды YFAK или YEAK, включающий:
а) приведение в контакт первой композиции и RSP по меньшей мере с одним улавливающим полипептидом, содержащимся в нормальной сыворотке человека, нормальной сыворотке не являющегося человеком примата, нормальной сыворотке кролика, нормальной сыворотке мыши, нормальной сыворотке крысы, нормальной сыворотке хорька, нормальной сыворотке свиньи, нормальной сыворотке собаки, нормальной сыворотке лошади, нормальной сыворотке овцы, нормальной сыворотке коровы; и
b) приведение в контакт второй композиции RSP по меньшей мере с одним улавливающим полипептидом, содержащим пептид, выбранный из нормальной сыворотки человека, нормальной сыворотки не являющегося человеком примата, нормальной сыворотки кролика, нормальной сыворотки мыши, нормальной сыворотки крысы, нормальной сыворотки хорька, нормальной сыворотки свиньи, нормальной сыворотки собаки, нормальной сыворотки лошади, нормальной сыворотки овцы, нормальной сыворотки коровы;
c) при необходимости повторение стадии (b);
d) отделение пептидов, которые связываются с улавливающим полипептидом, от смесей стадий (а-с);
e) определение характеристик отделенных пептидов со стадии (d);
f) сравнение указанного отделенного набора пептидов с характеристиками отделенных пептидов стадии (d).
Текст
СПОСОБЫ УЛУЧШЕНИЯ ДИЗАЙНА, БИОДОСТУПНОСТИ И ЭФФЕКТИВНОСТИ КОМПОЗИЦИЙ ПОЛИМЕРОВ СО СЛУЧАЙНОЙ ПОСЛЕДОВАТЕЛЬНОСТЬЮ ПУТЕМ ОСНОВАННОЙ НА СЫВОРОТКЕ ДЕТЕКЦИИ КОМПОЗИЦИЙ ПОЛИМЕРОВ СО СЛУЧАЙНОЙ ПОСЛЕДОВАТЕЛЬНОСТЬЮ В данной области существуют способы детекции простых пептидов. Однако способы определения эффективной концентрации в плазме смесей пептидов в качестве совокупности, а не в качестве отдельных пептидов с определенной аминокислотной последовательностью, являются трудными,вследствие гетерогенности пептидов, подлежащих детекции. В данном изобретении предложены усовершенствованные способы детекции и оценки композиций полимеров со случайной последовательностью (RSP), способы детекции и количественного определения композиций RSP,средства для определения и увеличения содержания подсовокупности пептидов в композиции RSP на основе взаимодействий подсовокупности с определенными улавливающими полипептидами,способы введения композиций RSP индивидууму, нуждающемуся в этом, где режим дозирования и количество можно определять или оценивать на основе вышеупомянутых способов детекции и количественного определения. Родственные заявки По заявке на данный патент испрашивается приоритет условной заявки США 61/281470, поданной 17 ноября 2009 г., и условной заявки США 61/386909, поданной 27 сентября 2010 г. Уровень техники В данной области существуют способы детекции простых пептидов. Однако способ определения эффективной концентрации в плазме смесей пептидов в качестве совокупности, а не отдельных пептидов с определенной аминокислотной последовательностью, затруднен гетерогенностью пептидов, подлежащих детекции. Например, композиции полимеров со случайной последовательностью (RSP) содержат комплексную смесь аминокислот, случайным образом включенных в пептидные цепи. Композиции RSP определяют по типу и соотношению аминокислот, а не по определенной последовательности. Учитывая эту разнородность, требуются усовершенствованные способы оценки единообразия и состава этих композиций RSP среди множества производимых препаратов. Определение статуса композиции RSP in vivo имеет иммунологическое значение, поскольку, в зависимости от пути и/или частоты введения и сывороточных белков, которые связывают композицию RSP, смесь может задействовать первичный воспалительный (TH1-типа) или первичный регуляторный (ТН 2-типа) ответы, приводя к варьированию фармакокинетических и фармакодинамических эффектов у индивидуума. Более точный дизайн и постоянное введение композиции RSP могут увеличить терапевтическую эффективность или снизить потенциальные неблагоприятные воспалительные ответы. Таким образом, существует потребность в способах количественного анализа композиций RSP, например, для способствования оценке in vivo таких смесей и для определения пригодного количества и способов введения для терапевтических целей. Сущность изобретения В данном изобретении предоставлены усовершенствованные способы детекции и оценки композиций RSP. Настоящее изобретение относится к способам детекции и количественного определения композиций RSP. Настоящее изобретения относится к средствам для определения и увеличения содержания подсовокупности пептидов в композиции RSP на основе взаимодействий подсовокупности с определенными улавливающими полипептидами. Кроме того, настоящее изобретение относится к способам введения композиций RSP индивидууму, нуждающемуся в этом, где режим дозирования и количество можно определять и оценивать на основе упомянутых выше способов детекции и количественного определения. Также настоящее изобретение относится к способу детекции композиции RSP, включающему стадии (а) связывания указанной композиции RSP с твердой подложкой; (b) приведения указанной твердой подложки в контакт согласно (а) с содержащей белок биологической жидкостью; (с) идентификации белков согласно (b), специфично связавшихся с твердой подложкой согласно (а); (d) получения, по существу, чистых препаратов связавшихся белков согласно (с); (е) связывания указанных белков согласно (с) со средством для количественной детекции указанной композиции RSP; и (f) определения связывания указанной композиции RSP с каждым отдельным указанным белком согласно (е). Также настоящее изобретение относится к способу усовершенствования дизайна композиции RSP,включающему стадии:(a) связывания указанной композиции RSP с твердой подложкой;(b) приведения в контакт указанной твердой подложки согласно (а) с содержащей белок биологической жидкостью;(с) идентификации белков согласно (b), специфично связавшихся с твердой подложкой согласно (а);(d) получения, по существу, чистых препаратов связавшихся белков согласно (с);(е) связывания указанных белков согласно (с) со средством для количественной детекции указанной композиции RSP;(f) определения связывания указанной композиции RSP с каждым отдельным указанным белком согласно (е);(g) корректирования дизайна указанной композиции RSP либо для усиления, либо для снижения связывания одного или более белков согласно (е);(i) необязательно, повторения стадий (f-h), где коррекция дизайна указанной композиции RSP приводит к любому одному или более из группы, включающей увеличение биодоступности, снижение токсичности и увеличение эффективности. Более того, данное изобретение относится к способу детекции элементов композиции RSP, включающему стадии (а) связывания указанной композиции RSP с твердой подложкой; (b) приведения в контакт указанной твердой подложки согласно (а) с содержащей белок биологической жидкостью; (с) идентификации белков согласно (b), специфично связавшихся с твердой подложкой согласно (а); (d) получения, по существу, чистых препаратов связавшихся белков согласно (с); (е) связывания указанных белков согласно (с) с твердой подложкой; (f) приведения в контакт указанной твердой подложки согласно (е) с указанной композицией RSP; и (g) определения связывания отдельных элементов указанной композицииRSP с указанной твердой подложкой согласно (f). Кроме того, данное изобретение относится к способу усовершенствования дизайна элементов в композиции RSP, включающему стадии (а) связывания указанной композиции RSP с твердой подложкой;(b) приведения в контакт указанной твердой подложки согласно (а) с содержащей белок биологической жидкостью; (с) идентификации белков согласно (b), специфично связавшихся с твердой подложкой согласно (а); (d) получения, по существу, чистых препаратов связавшихся белков согласно (с); (е) связывания указанных белков согласно (с) с твердой подложкой; (f) приведения в контакт указанной твердой подложки согласно (е) с указанной композицией RSP; (g) определения связывания отдельных элементов указанной композиции RSP с указанной твердой подложкой согласно (f); (h) корректирования дизайна указанной композиции RSP либо для усиления, либо для снижения связывания одного или более белков согласно (f); (i) повторения стадии (g); и (j) необязательно, повторения стадий (g-i), где корректирование дизайна элементов указанной композиции RSP приводит к одному или более из группы, включающей увеличение биодоступности, снижение токсичности и увеличение эффективности. С использованием способов, описанных в настоящем изобретении, исследователи могут не только более надежно выявить более низкие количества компонентов композиции RSP, но также специфично выявить элементы в композициях RSP, которые отвечают за представляющую интерес биологическую активность, например, токсичность или эффективность, или вносят в нее вклад. Открытие, которое лежит в основе настоящего изобретения, состоит в специфическом связывании отдельного пептида или множества пептидов в композиции RSP определенными белковыми материалами. Напротив, после идентификации таких белковых материалов, в настоящем изобретении называемых"улавливающими полипептидами", один или более из улавливающих полипептидов можно использовать для количественного анализа пептидов в композиции RSP, выделения функционально лучших подсовокупностей пептидов в композиции RSP, или классификации компонентов композиции RSP на основе специфичности связывания. Для применения на практике настоящего изобретения улавливающий полипептид, который связывается с пептидами, идентифицируют и приготавливают в форме, пригодной для осуществления на практике настоящего изобретения, т.е. выделенным и очищенным в достаточной степени, чтобы его связывание с пептидами не нарушалось присутствием других компонентов. Один из аспектов настоящего изобретения относится к способу оценки или определения варьирования в продуктах различных производимых препаратов, различных способах производства или различных способах переработки после производства композиции RSP. Конкретным способом по изобретению является сравнение связывания различных препаратов композиции RSP с улавливающим полипептидом для определения сходства и/или различий между препаратами. Следующий аспект изобретения относится к способу количественного анализа пептидов, которые встречаются в композиции RSP или образце, содержащем композицию RSP. Некоторые варианты осуществления изобретения представляют собой способы определения биологически доступного количества или концентрации in vivo (например, концентрации в плазме) вводимой композиции RSP. Способ по настоящему изобретению состоит в детекции присутствия композиций RSP в ткани индивидуума, причем указанный индивидуум ранее контактировал или его подвергали лечению композицией RSP, где способ осуществляют один или более раз непосредственно сразу после такого контакта,или через по меньшей мере приблизительно 10, 20, 30 или 45 мин, или 1, 2, 4, 6, 12, 24, 36 или 48 ч, или 3, 4, 5, 6, 7 или 10 суток, или 2, 3, 4, 6, 8 или 12 недель после такого контакта. Конкретным способом по настоящему изобретению является детекция присутствия составляющих композиции RSP в сыворотки или плазме млекопитающего, причем указанного млекопитающего ранее лечили указанной композициейRSP перед проведением указанного способа в течение периода времени, описанного выше. В определенных вариантах осуществления указанным млекопитающим является человек. В определенных вариантах осуществления способ включает определение присутствия и, необязательно, количества композиций RSP путем связывания пептидов с одним или более заданными улавливающими полипептидами с последующим способом детекции, таким как способ иммунологической детекции. Таким образом, один из аспектов изобретения включает выбор или идентификацию сывороточного белка, который предпочтительно связывает композицию RSP. В определенных вариантах осуществления способ идентификации одного или более сывороточных белков включает приведение в контакт композиции RSP с биологическим образцом, содержащим сыворотку, детекцию связывания, при его наличии, пептидов в композиции RSP с одним или более компонентами сыворотки, выделение связанных компонентов и идентификацию одного или более из связавшихся компонентов. В некоторых вариантах осуществления связавшиеся компоненты можно выделять путем приведения в контакт образца с аффинной колонкой, предназначенной для связывания пептидов композиции RSP и затем элюирования связавшейся фракции, с последующей идентификацией связавшегося компонента(ов). В описанных выше способах можно использовать любые сывороточные связывающие белки, которые связывают пептиды композиций RSP. Пригодные способы детекции включают прямой конкурентный твердофазный иммуноферментный анализ (ELISA), вестерн-блоттинг, иммунную проточную цитометрическую детекцию, радиоиммунный анализ (RIA) или любой другой иммунологический способ детекции, который позволяет количественную детекцию конкретных антигенов. Одним из аспектов настоящего изобретения является способ детекции присутствия композицииRSP в биологическом образце, включающий приведение в контакт биологического образца по меньшей мере с одним улавливающим полипептидом; и детекцию присутствия или отсутствия связывания улавливающего полипептида с композицией RSP, где присутствие связывания указывает на присутствие пептидных компонентов композиции RSP в биологическом образце. Кроме того, такой способ может быть расширен для измерения количества или концентрации композиции RSP в образце. Другим аспектом настоящего изобретения является способ определения биодоступности композиции RSP у млекопитающего, включающий введение млекопитающему дозы композиции RSP; взятие биологического образца от индивидуума; и приведение в контакт биологического образца по меньшей мере с одним улавливающим полипептидом; тем самым определяя биодоступность или степень биодоступности композиции RSP в биологическом образце. Другой аспект настоящего изобретения относится к способам введения композиций RSP индивидууму-млекопитающему в таком количестве, которое определено исходя из биодоступной части дозируемого количества при определении способом, описанным выше или другими способами, описанными в настоящем описании. В определенных вариантах осуществления способ дополнительно включает добавление контрольного образца, проведение фармакодинамического теста для определения изменений физиологических маркеров, таких как гормоны, ферменты, сывороточные белки, цитокины,иммуномодуляторы или эффектор или регулятор любого из этих функциональных белков, между контрольным образцом и тестируемыми образцами путем сравнения двух результатов, и определение дозировки, эффективной для индукции желаемых изменений фармакодинамического параметра. В определенных вариантах осуществления наблюдают изменения поведения, субъективные изменения,сообщаемые индивидуумом, такие как смягчение боли или симптома заболевания, или другие признаки непрямых эффектов. В определенных вариантах осуществления указанным млекопитающим является грызун, такой как мышь или крыса. В других вариантах осуществления указанным индивидуумом является человек. варианты осуществления этого аспекта изобретения относятся к способу определеОпределенные ния подходящей дозы композиции RSP для введения индивидууму, нуждающемуся в этом, включающему (а) введение индивидууму дозы композиции RSP; (b) взятие биологического образца от индивидуума;(с) приведение в контакт биологического образца по меньшей мере с одним улавливающим полипептидом; (d) определение уровня компонентов композиции RSP в биологическом образце; (е) необязательно повторение стадий (а)-(d) с использованием другой дозы; и (g) сравнение уровней с заданным подходящим уровнем композиции RSP в биологическом образце; где подходящая доза представляет собой дозу,которая приводит к заданному пригодному уровню композиции RSP в биологическом образце. Некоторые варианты осуществления изобретения относятся к способам предсказания части биодоступной фракции композиции RSP. Такие способы включают приведение в контакт образца, содержащего композицию RSP, с заданным улавливающим полипептидом, который находится in situ в области, где предусмотрены введение и доставка такой композиции RSP, и определение связывания композиции RSP с улавливающим полипептидом. Связывание композиции RSP большой фракцией может указывать на более высокую долю пептидов, которые являются терапевтически и/или физиологически значимыми, и более прочное связывание (при определении по константе диссоциации) может указывать на защитный эффект, который продлевает время полужизни этих пептидов in vivo. Следующий аспект настоящего изобретения относится к способам предсказания терапевтически эффективного количества композиции RSP, подлежащей введению индивидууму (например, индивидууму-человеку), исходя из данных, полученных от экспериментальных индивидуумов. В определенных вариантах осуществления способ включает введение композиции RSP не являющемуся человеком экспериментальному индивидууму-млекопитающему, определение биодоступной части дозированного количества (например, с использованием способа количественной детекции, описанного в настоящем описании), определение функциональных данных и предсказание терапевтически эффективного количества композиции RSP, подлежащей доставке подвергаемому терапии индивидууму, исходя из данных, полученных для экспериментального индивидуума-млекопитающего, и сопоставление соотношения между подвергаемым лечению и экспериментальным индивидуумами. Для целей настоящего изобретения"функциональными данными" может быть фенотип или функция индивидуума, фенотип или функция клеточного материала, полученного от индивидуума, или состав одной или более жидкостей, полученных от индивидуума. Дополнительно или альтернативно, функциональные данные могут включать измерение одного или более компонентов биосинтеза или метаболизма, таких как гормоны, ферменты, сывороточные белки, цитокины, хемокины, факторы роста, иммуномодуляторы, и эффектор или регулятор указанных функциональных данных. В определенных вариантах осуществления стадию детекции можно повторять через различные регулярные или нерегулярные временные интервалы для определения изменения с течением времени биодоступности, метаболизма и/или выведения после введения. В определенных вариантах осуществления таким путем можно определять время полужизни композиции RSP в плазме. В следующем варианте осуществления таким путем можно определять время полужизни элементов композиции RSP. В конкретных вариантах осуществления экспериментальным индивидуумом является грызун, такой как мышь или крыса. Другой аспект настоящего изобретения относится к практичному и эффективному способу лечения пациента путем введения композиции RSP, включающему получение композиции RSP путем синтеза пептидов (например, по отдельности с последующим объединением множества пептидов или одновременно с использованием наборов мономеров аминокислот в каждом цикле элонгации), получение фармацевтически приемлемого состава указанной композиции RSP, введение указанной композиции RSP индивидууму, получение образца ткани от указанного индивидуума, определение количеств и/или концентраций композиции RSP в указанном образце ткани, определение функциональных данных, сопоставление количеств композиции RSP с функциональными данными, и корректирование дозировки композиции RSP для индивидуума в целях улучшения функциональных данных. Другой аспект изобретения относится к способу лечения или предупреждения нежелательного иммунного ответа у индивидуума, включающему введение индивидууму подходящей дозы композицииRSP, где такую подходящую дозу определяют путем (i) введения индивидууму дозы композиции RSP;(ii) извлечения биологического образца из экспериментального индивидуума; (iii) приведения в контакт биологического образца по меньшей мере с одним улавливающим полипептидом; (iv) определения уровня улавливающего полипептида в биологическом образце; (v) необязательно повторения стадий (i)-(iv) с использованием другой дозы; и (vi) сравнения уровня(ей) против заданного подходящего уровня композиции RSP в биологическом образце; где подходящая доза представляет собой дозу, которая приводит к заданному подходящему уровню композиции RSP в указанном биологическом образце. В некоторых из указанных выше аспектов и вариантов осуществления улавливающий полипептид является меченым. В некоторых вариантах осуществления улавливающие полипептиды связаны с твердой подложкой. В некоторых вариантах осуществления комплекс, содержащий улавливающий полипептид и один или более пептидных компонентов композиции RSP, выявляют и/или выделяют. В конкретных вариантах осуществления комплекс выявляют и/или выделяют с помощью антител, специфичных к комплексу, но не к улавливающему полипептиду или пептидному компоненту композиции RSP. Другой аспект настоящего изобретения относится к способу выделения выбранной подсовокупности пептидов, которые составляют композицию RSP. В конкретных случаях подсовокупность может состоять из пептидов, имеющих одну или более отличающихся аминокислотных последовательностей. В других случаях улавливающие полипептиды можно использовать для классификации компонентов композиции RSP, исходя из специфичности связывания. В определенных вариантах осуществления способ выделения пептидов из образца, содержащего композицию RSP, включает (а) приведение в контакт образца по меньшей мере с одним улавливающим полипептидом и (b) отделения пептидов, которые связываются с улавливающим полипептидом, от смеси. В некоторых таких вариантах осуществления улавливающие полипептиды связаны с твердой подложкой. В некоторых вариантах осуществления улавливающие полипептиды являются маркированными эпитопом или мечеными. В некоторых вариантах осуществления способ дополнительно включает отделение связавшихся пептидов от улавливающих полипептидов для выделения пептидов. В конкретных вариантах осуществления способ дополнительно включает определение характеристик выделенных пептидов,таких как аминокислотный состав совокупности выделенных пептидов и/или аминокислотные последовательности выделенных пептидов. В определенных вариантах осуществления способ идентификации биодоступных пептидов композиции RSP у индивидуума включает (а) введение композиции RSP индивидууму; (b) взятие образца ткани от индивидуума после проведения стадии (а); и (с) идентификацию пептидов в образце, которые связываются по меньшей мере с одним улавливающим пептидом. В определенных вариантах осуществления способ идентификации подсовокупности пептидов, которые связываются с улавливающим полипептидом, включает получение композиции RSP согласно протоколу, приведение в контакт указанной композиции RSP с заданным улавливающим полипептидом (например, который является желательным в качестве мишени или носителя in vivo), определение связывания пептидов в композиции RSP, идентификацию характеристик, которые отличают пептиды, которые связываются, от пептидов, которые не связываются, и получение улучшенной композиции RSP, отражающей одну или более из отличительных характеристик. Другой аспект изобретения относится к способу усовершенствования способа производства композиции, содержащей композицию RSP. В некоторых вариантах осуществления композицию RSP разрабатывают, исходя из указанного выше способа идентификации подсовокупности пептидов, которые связываются с улавливающим полипептидом. В некоторых вариантах осуществления композицию RSP разрабатывают так, чтобы аминокислотный состав и/или аминокислотная последовательность приблизительно соответствовала им у подсовокупности пептидов, связывающихся с улавливающим полипептидом. В некоторых вариантах осуществления композиция RSP имеет увеличенную эффективность по сравнению с эталонной композицией RSP, где эталонная композиция RSP является такой же или по существу такой же, как и исходная композиция RSP, которую приводили в контакт с улавливающим полипептидом. В других вариантах осуществления, композиция RSP имеет более низкую токсичность по сравнению с эталонной композицией RSP. В альтернативных вариантах осуществления способ включает получение композиции RSP согласно протоколу, получение состава композиции, содержащей RSP, определение биодоступного количестваRSP в указанной композиции путем детекции уровня или степени функциональных данных, сравнение таких данных против стандарта и корректирование протокола или состава композиции для достижения желаемой биодоступности. Другим аспектом изобретения является нацеливание терапевтических средств в конкретные ткани путем связывания композиции RSP (например, эталонной композиции RSP или усовершенствованной композиции RSP, полученной способами, описанными в настоящем описании) или компонента композиции RSP с представляющим интерес терапевтическим средством, где указанная композиция RSP или ее компонент связывается с улавливающим полипептидом, который обладает свойствами тканеспецифического нацеливания. Такие связанные средства можно вводить пациенту для нацеливания средства в ткань, ассоциированную с соответствующим улавливающим полипептидом. Некоторые варианты осуществления этого аспекта изобретения относятся к способу доставки терапевтического средства в конкретную ткань у индивидуума, причем такой способ включает (а) выделение пептидной метки путем приведения в контакт композиции RSP с тканеспецифическим пептидом и отделение пептидов, которые связываются с тканеспецифическим пептидом, от смеси; (b) связывание пептидной метки с терапевтическим средством; и (с) введение конъюгата индивидууму. Другие варианты осуществления изобретения включают способ получения такого нацеленного терапевтического средства с помощью стадий (а) и (b) описанного выше способа, и нацеленное терапевтическое средство, полученное таким путем. Следующим аспектом настоящего изобретения является композиция, пригодная и используемая в любом из способов, описанных выше. Вариантом осуществления этого аспекта изобретения является композиция для детекции композиции RSP, содержащей пептиды YEAK или YFAK, в биологическом образце, содержащая по меньшей мере один улавливающий полипептид. В определенных вариантах осуществления улавливающий полипептид выбран из компонента нормальной сыворотки человека, нормальной сыворотки не являющегося человеком примата, нормальной сыворотки кролика, нормальной сыворотки мыши, нормальной сыворотки крысы, нормальной сыворотки хорька, нормальной сыворотки свиньи, нормальной сыворотки собаки, нормальной сыворотки лошади, нормальной сыворотки овцы,нормальной сыворотки коровы, компонента происходящего из млекопитающих протеома ЛПВП, компонента происходящего из млекопитающих протеома ЛПНП, компонента комплемента С 3, препробелка аполипопротеина А-1, препробелка аполипопротеина А-II (аполипопротеин D), компонента комплемента С 4 А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интеральфа-ингибитора трипсина (IHRP), альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина A-IV, церулоплазмина,неименованного белкового продукта (поиск BLAST идентифицирует его как тяжелую цепь IgM), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа 2-HS-гликопротеина,предшественника аполипопротеина J, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HSгликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус NCBI/ доступа САА 28659) и J-цепи Ig. В любом из представленных выше вариантов осуществления и аспектов композиция RSP может содержать либо пептиды YEAK, либо пептиды YFAK. Пептиды YFAK или YEAK известны в данной области, описаны ниже и представляют собой пептиды, которые составляют композицию RSP, а именно композицию YFAK RSP или композицию YEAK RSP. Кроме того, независимо от выбора пептидовYFAK или YEAK, в конкретных вариантах осуществления улавливающий полипептид может представлять собой сывороточный связывающий белок. В более конкретных вариантах осуществления улавливающий полипептид выбран из альфа-1-антитрипсина, аполипопротеина A-I, альфа-1-В-гликопротеина,аполипопротеина A-IV, аполипопротеина D и преальбумина, или из улавливающих полипептидов, перечисленных в абзаце, непосредственно предшествующем этому, или из сывороточных полипептидов,описанных в настоящем описании. Кроме того, в любом из указанных выше вариантов осуществления связывание пептидов в композиции RSP с улавливающим полипептидом, таким как сывороточный белок, можно проводить в присутствии дополнительных физиологически значимых компонентов. В конкретных вариантах осуществления дополнительным компонентом является липид, такой как холестерин или триглицериды. В конкретных вариантах осуществления дополнительным компонентом является комплекс ЛПВП или ЛПНП, по существу, свободный от белковых компонентов, отличных от улавливающего полипептида. Краткое описание фигур На фиг. 1 схематично представлен анализ, используемый для определения связывания композицииRSP со связанными с подложкой сывороточными белками. После идентификации сывороточных белков их связывают с твердой подложкой. К подложке добавляют композицию RSP либо отдельно, либо содержащуюся в сыворотке. Добавляют первичное антитело против композиции RSP (или против конъюгата между композицией RSP и сывороточным белком) и проводят детекцию связывания первичного антитела с его мишенью(ями) с помощью вторичного антитела и реагента для детекции. На фиг. 2 представлено колориметрическое поглощение А 450 конъюгированных с HRP антител против YFAK и против YEAK после связывания антител с их мишенями. Мишени содержат композиции(или внесенными в) нормальной сыворотке человека. При более высоких концентрациях композицийRSP, детекция конъюгатов с помощью антител против YEAK или против YFAK является более высокой,чем при более низких концентрациях композиций RSP. 12,5 нг/мл соответствуют дозе приблизительно 2 мг у пациента-человека. На фиг. 3 представлен список белков сыворотки, которые связываются с PI-2301 или копаксоном. Источником белков сыворотки является либо нормальная сыворотка мыши, либо нормальная сыворотка человека, как указано. PI-2301 может быть ацетилированным или неацетилированным. Связывающие комплексы PI-2301 или копаксона выявляют с помощью антител против YFAK или против YEAK, и подвергают детекции с помощью вторичных антител и реагентов для детекции. Сывороточные белки элюируют из комплекса и идентифицируют. Белкам присваивают показатель, исходя из поглощения А 450 реагента для детекции. Показатель 70 соответствует р=0,001 по сравнению с фоновым поглощением, и его считают статистически значимым. На фиг. 4 представлен YEAK в сыворотке мышей, которым вводили YEAK внутривенно в дозе 4 мг/кг или подкожно в дозе 21 мг/кг с использованием колориметрического поглощения А 450 конъюгированных с HRP антител против YEAK после связывания YEAK с его мишенью, состоящей из пептидовYEAK, связанных с белками сыворотки, содержащимися в нормальной сыворотке человека. На фигуре показано, что фрагменты GA (глатирамера ацетат) достигают максимальной концентрации в сыворотке 1800 нг/мл приблизительно через 15 мин после введения дозы. Оцененная биодоступность копаксона,вводимого подкожно, составляла 12%, по сравнению с копаксоном, вводимым внутривенно. ФракцияGA все еще выявлялась в сыворотке через 2 часа после введения дозы. На фиг. 5 представлен пример быстрого высвобождения растворимых факторов в сыворотке или плазме в ответ на введение YEAK у мышей, в этом случае CCL22, также известного как MDC. Как видно на фигуре, существует линейная корреляция между дозой YEAK, вводимой подкожно мышам, и наблюдаемой максимальной концентрацией CCL22 в плазме. На фиг. 6 представлены профили пептидов, наблюдаемые с помощью LC-MS, из сывороточных белков, элюированных от фрагментов YEAK, иммобилизованных на колонке CNBr-Seph. Последовательности пептидов идентифицировали с использованием средства поиска Mascot. В кратком изложении,фрагменты YEAK, полученные путем расщепления триптическим ферментом, связывали с Sepharose с цианоген бромидом (CNBr-Seph) 4b, и инкубировали в течение двух часов при комнатной температуре с сывороткой либо человека, либо мыши. Сывороточные белки, связавшиеся с фрагментами YEAK, элюировали с использованием раствора 0,1 М глицин-HCl, рН 2,8, и расщепляли трипсином в смеси 50% метанол/50 мМ бикарбонат аммония, сушили, разделяли с использованием жидкостной хроматографии(LC), десольватировали, ионизировали, впрыскивали в масс-спектрометр (MS), визуализировали и идентифицировали с использованием средства поиска Mascot. На фиг. 7 представлен анализ ELISA с использованием способов по настоящему изобретению,представленных на фиг. 1, где YEAK вносили в нормальную сыворотку мужчин и женщин и объединенную нормальную сыворотку мужчин и женщин. Анализ демонстрирует линейный диапазон, детектирующий YEAK в сыворотке между 1 и 100 нг/мл. Этот анализ не может быть воспроизведен ни с использованием сыворотки мышей, ни при использовании неподходящих контролей, таких как полисыворотка к гемоцианину лимфы улитки (KLH). На фиг. 8 представлен профиль эксклюзионнной ВЭЖХ партий копаксона (YEAK) P53218 и 119142 с молекулярными массами, показавшей наличие сходных профилей. На фиг. 9 представлены две партии копаксона, представленные на фиг. 8, используемые в способах по настоящему изобретению, представленных на фиг. 1. На фиг. 10 показаны две партии копаксона, используемые на фиг. 8 и 9, в биоанализе, где моноцитарная клеточная линия RAW264.7, подвергнутая воздействию YEAK, высвобождала CCL22 зависимым от концентрации образом. На фиг. 11 представлена определенная с использованием MALDI-TOF прямая линейная взаимосвязь между истинными и теоретическими средними молекулярными массами сополимеров YEAK с различной определенной длиной. Теоретические величины вычисляли умножением длины сополимера в аминокислотах, т.е. 20, 40, 60 и 80, на среднюю молекулярную массу теоретической аминокислоты плюс одна молекула воды. Массу одной теоретической аминокислоты вычисляли с использованием соответствующей массы Y, Е, А и K минус одна молекула воды, утраченная в ходе присоединения аминокислоты и соотношения аминокислот 1,0, 1,5, 4,5, 3,6. На фиг. 12 представлены конечные отношения, нормализованные к 100 аминокислотам сополимеров YEAK различной длины, изготовленных твердофазным синтезом, определенные аминокислотным анализом, а также тем же анализом, проведенным на двух партиях копаксона, представленных на фиг. 8, 9 и 10. Стандартные кривые получали с использованием сополимеров YEAK из 20, 40, 60 и 80 аминокислот. Для сравнения также получали стандартную кривую с использованием копаксона. На фиг. 12 проил-6 022399 люстрирована взаимосвязь между размером сополимеров YEAK и детекцией конкурентных анализов РК на основе ELISA. 20-мерный сополимер YEAK имел небольшой ингибиторный эффект, однако полученная стандартная кривая с 80-мерным сополимером YEAK перекрывается с кривой, полученной для копаксона. На фиг. 13 представлен анализ ELISA, где фракция Ig полисыворотки кролика взаимодействует сильно с копаксоном, и продемонстрировано увеличение распознавания по мере увеличения длины синтезированных на твердой фазе сополимеров YEAK. На фиг. 14 представлен анализ ELISA с использованием существовавшего ранее способа РК (как описано в публикации РСТ WO 2009/075854, включенной в настоящее описание в качестве ссылки в полном объеме) с синтезированными на твердой фазе сополимерами YEAK, демонстрирующий взаимосвязь между размером сополимеров YEAK и детекцией способами существовавшей ранее системы анализа. На фиг. 15 показано, что моноцитарная клеточная линия RAW264.7, культивированная с синтезированными на твердой фазе сополимерами различных размеров, наблюдаемых на фиг. 12, 13 и 14, продуцирует возрастающие количества CCL22 по мере увеличения длины сополимера. На фиг. 16 представлена способность двух партий копаксона, используемых на фиг. 8, 9, 10 и 12,и синтезированных на твердой фазе сополимеров YEAK различной длины, используемых на фиг. 12, 13,14 и 15, индуцировать пролиферацию ex vivo спленоцитов из мышей, иммунизированных каждую неделю в течение 3 недель 2,5 мг/кг копаксона. Через неделю после последнего подкожного введения селезенки собирали, получали клеточные суспензии и клетки культивировали в течение 4 суток с различными концентрациями различных сополимеров. Пролиферацию спленоцитов определяли путем измерения включения меченого тритием тимидина с использованием способов, хорошо известных в данной области. Подробное описание изобретения Композиции полимеров со случайной последовательностью (RSP). Композиции полимеров со случайной последовательностью (RSP) для целей описания настоящего изобретения могут представлять собой любую смесь аминокислотных полимеров (как правило, связанных пептидными связями), содержащих два или более случайным образом расположенных аминокислотных остатков в различных соотношениях, и они пригодны для стимуляции или ослабления определенных иммунологических и других реакций при введении млекопитающему. Вследствие случайного разнообразия смеси последовательностей, в смеси присутствует большое количество пептидных последовательностей. Разнообразие пептидных последовательностей может обеспечивать увеличенную эффективность относительно менее разнообразных композиций. Композиция RSP определяется набором аминокислот последовательности полимера и относительным молярным соотношением этих аминокислот. Например, YFAK обозначает композицию RSP, состоящую из тирозина (Y), фенилаланина (F), аланина (А) и лизина (K), но это не указывает на то, что полимеры имеют аминокислотную последовательность Y-F-A-K в этом порядке; эти аминокислотные остатки включены в случайной последовательности, и, таким образом, композиция RSP содержит пептиды, имеющие различные последовательности Y, F, А и K, и свободна или по существу свободна от других аминокислот. Относительное молярное соотношение может быть выражено двумя путями: молярное исходное соотношение и молярное конечное соотношение. "Молярное исходное соотношение" означает молярное соотношение аминокислот, которые используют для синтеза RSP. Например, если говорят, чтоRSP имеет молярное исходное соотношение 1:1:10:6 для Y:F:A:K, тогда, при синтезе способом твердофазного синтеза, для каждого цикла элонгации смесь защищенных аминокислот Y, F, А и K в молярном соотношении 1:1:10:6 подвергают реакции для удлинения пептидной цепи. С другой стороны, "молярное конечное соотношение" означает молярное соотношение аминокислот в конечных пептидах RSP. Молярное конечное соотношение определяют путем анализа содержания аминокислот в композиции RSP. Исходное и конечное соотношения не являются идентичными вследствие различий эффективности включения аминокислот. Пригодные RSP включают RSP, описанные в международных публикациях РСТWO 00/05250,WO 00/05249; WO 02/59143, WO 0027417, WO 96/32119, в публикациях патентов СШАUS 2008/0021192, 2004/003888, 2002/005546, 2003/0004099, 2003/0064915 и 2002/0037848, в патентах США 6514938, 5800808 и 5858964, и RSP, описанные в заявке РСТ PCT/US05/06822. В этих источника литературы описаны способы синтеза RSP, композиций, содержащих RSP, терапевтических составов RSP,способы введения композиций RSP индивидууму, заболевания, которые можно лечить с помощью RSP,и дополнительные терапевтически эффективные средства, которые можно вводить индивидууму совместно с RSP. Дополнительные RSP для применения в настоящем изобретении, и способы их синтеза могут быть найдены в литературе, как например, в Shukaliak Quandt, J. et al. (2 004) Mol. Immunol. 40(14-15): 1075-87; Montaudo, MS (2004) J. Am. Soc. Mass Spectrom. 15(3):374-84; Takeda, N. et al. (2004) J. ControlT. et al. (2000) Bioorg. Med. Chem. 8(8): 1903-9; и Cady, CT et al. (2000) J. Immunol. 165(4): 1790-8. Указания всех этих патентов, заявок и публикаций включены в настоящее описание в качестве ссылок в полном объеме, в частности в отношении структуры, получения и функции RSP, описанных в настоящем описании. Определенные RSP могут содержать пригодное количество аминокислоты с положительным электрическим зарядом, такой как лизин или аргинин, в комбинации с аминокислотой с отрицательным электрическим зарядом (предпочтительно в меньшем количестве), такой как глутаминовая кислота или аспарагиновая кислота, необязательно в комбинации с электрически нейтральной аминокислотой, такой как аланин или глицин, служащей в качестве промежуточного компонента, и, необязательно, может дополнительно включать аминокислоту, пригодную для того, чтобы придавать сополимеру иммуногенные свойства, такую как ароматическая аминокислота, такая как тирозин или триптофан. Такие композиции могут включать любую из композиций, описанных в WO 00/005250, полное содержание которой включено в настоящее описание в качестве ссылки, с особым вниманием на те ее части, в которых обсуждается структура, получение и функция RSP, описанных в настоящем описании. В определенных вариантах осуществления изобретения композиция RSP представляет собой смесь полимеров, имеющих случайную или частично случайную аминокислотную последовательность и содержащих аминокислоты из следующих четырех групп: (а) положительно заряженные аминокислоты, т.е. лизин и аргинин; (b) отрицательно заряженные аминокислоты, т.е. глутаминовая кислота и аспарагиновая кислота; (с) небольшие нейтральные аминокислоты, т.е. аланин, треонин, серин и глицин; и (d) объемные аминокислоты, т.е. лейцин,изолейцин, валин, тирозин, фенилаланин и триптофан. Конкретные варианты осуществления таких RSP представляют собой YEAK (включая Сор-1, описанный ниже), VEAK и FEAK. В других вариантах осуществления RSP представляют собой тройные сополимеры, состоящие из трех аминокислот, причем каждая из этих трех аминокислот выбрана из трех различных групп среди четырех вышеуказанных групп. Конкретные варианты осуществления представляют собой YAK, YEK, KEA и YEA, дополнительно описанные ниже. В других вариантах осуществления изобретения композиция RSP представляет собой смесь полимеров, имеющих рандомизированные или частично рандомизированные аминокислотные последовательности и содержащих (а) глутаминовую кислоту, (b) аспарагиновую кислоту, и аминокислоты из каждой из следующих групп: (с) небольшие нейтральные аминокислоты, т.е. аланин, треонин, серин и глицин; и (d) гидрофобные аминокислоты, т.е. валин, лейцин и изолейцин. Конкретные варианты осуществления таких RSP представляют собой DALE, DAIE, DAVE, DGLE, DGIE и DGVE. Другие варианты осуществления RSP, пригодные для настоящего изобретения, представляют собой RSP без гидрофобных аминокислот. Конкретные варианты осуществления представляют собой DASE, DATE, DGSE и DGTE. Другие пригодные RSP представляют собой смеси полимеров, имеющих рандомизированные или частично рандомизированные аминокислотные последовательности и содержащих аминокислоты из каждой из следующих четырех групп:(а) отрицательно заряженные аминокислоты т.е. аспарагиновая кислота и глутаминовая кислота;(c) гидрофобные алифатические аминокислоты т.е. лейцин, изолейцин, валин, метионин; и(d) аминокислоты с небольшими гидрофильными боковыми цепями (такие как серин, цистеин, треонин); кроме того, сополимер может содержать остатки пролина. В одном варианте осуществления сополимер получен с использованием аминокислот глутамина (Е) и/или аспарагиновой кислоты (D), лейцина (L), серина (S) и аланина (А), и в настоящем описании он обозначается как сополимер "ELSA". В некоторых других вариантах осуществления RSP представляют собой смесь рандомизированных или частично рандомизированных аминокислотных последовательностей, содержащих аминокислоты из следующих четырех групп: (а) отрицательно заряженные аминокислоты (такие как аспарагиновая кислота, глутаминовая кислота); (b) гидрофобные алифатические аминокислоты, т.е. лейцин, изолейцин, валин, метионин; (с) объемные гидрофобные аминокислоты, т.е. тирозин, фенилаланин; и (d) аминокислоты с небольшими нейтральными боковыми цепями, т.е. серин, треонин, аланин, глицин; кроме того, сополимер может содержать остатки пролина. Иллюстративный сополимер получают с использованием аминокислотных остатков глутамина (Е) и/или аспарагиновой кислоты (D), лейцина (L), тирозина (Y) иVal (V), и его называют в настоящем описании сополимером "DLYV". Другими конкретными вариантами осуществления RSP являются VYAK, VWAK и YFAK, которые дополнительно описаны ниже. В других вариантах осуществления RSP, пригодные для применения в настоящем изобретении, включают аминокислотные остатки K, Е, А, S, V и, необязательно, Р. Более предпочтительно соотношение K:E:A:S:V составляет 0,3:0,7:9:0,5:0,5:0,3. Предпочтительно RSP имеют длину приблизительно от 10 до 100 аминокислотных остатков, более предпочтительно от 20 до 80 аминокислотных остатков, еще более предпочтительно от 40 до 60 аминокислотных остатков и наиболее предпочтительно приблизительно 50 аминокислотных остатков. Типичный препарат RSP представляет собой смесь пептидов различной длины, большинство из которых имеют желаемую длину, но могут содержать определенные более короткие или более длинные пептиды. Конкретным RSP, пригодным для композиций и способов, описанных в настоящем описании, является YEAK, который содержит комбинацию L-аланина (А), L-глутаминовой кислоты (Е), L-лизина (K) иL-тирозина (Y), и имеет общий положительный электрический заряд. Одним конкретным примером является сополимер 1 (Сор-1), также называемый глатирамера ацетатом. Сор-1 одобрен в нескольких странах для лечения рассеянного склероза (MS) под торговым названием Копаксон (торговый знак TevaPharmaceuticals Ltd., Petah Tikva, Израиль). Поскольку Сор-1 является смесью случайных полипептидов,возможно, что все или только подсовокупность входящих в него пептидов являются "активными". Представляющий интерес RSP Сор-1 имеет молекулярную массу от приблизительно 2000 до приблизительно 40000 дальтон (Да) и более конкретно от приблизительно 2000 до приблизительно 13000 Да. Сор-1 имеет среднюю молекулярную массу от приблизительно 4700 до приблизительно 13000 Да, но также включает пептиды меньших и больших размеров. Представляющая наибольший интерес молекулярная масса для Сор-1 составляет от приблизительно 5000 до приблизительно 9000 Да. Таким образом, RSP Сор-1 может представлять собой полипептид длиной от приблизительно 15 до приблизительно 100 аминокислотных остатков, предпочтительно от приблизительно 40 до приблизительно 80 аминокислотных остатков. В конкретном варианте осуществления длина RSP Сор-1 составляет от 35 до 75 аминокислотных остатка. Более конкретно, длина RSP Сор-1 составляет от 35 до 65 аминокислотных остатков. В конкретном варианте осуществления длина Сор-1 составляет приблизительно 50 аминокислот. В другом конкретном варианте осуществления длина RSP Сор-1 составляет приблизительно 52 аминокислоты. В определенных вариантах осуществления Сор-1 имеет среднее молярное исходное соотношение приблизительно 1,0:2,0:6,0:5,0 для Y:E:A:K, соответственно, синтезированных либо жидкофазными, либо твердофазными химическими способами, хорошо известными в данной области. В противоположность традиционному синтезу пептидов и аналогично получению других RSP, синтез Сор-1 проводят добавлением смеси надлежащим образом защищенных Y, Е, А и K в заданном соотношении, а не единичной аминокислоты, для каждого цикла. Вариабельность конечных соотношений между различными аминокислотами включает уровень приблизительно 10%. Диапазоны молекулярных масс и способы получения предпочтительной формы Сор-1 описаны в патенте США 5800808, содержание которого включено в настоящее описание в качестве ссылки в полном объеме, и в частности, в отношении структуры, получения и функции описанных выше RSP. В определенных вариантах осуществления RSP Сор-1 приблизительно из 52 аминокислотных остатков, доля аланина в положениях аминокислот 31-52 превышает долю аланина в композиции в положениях аминокислот 11-30, и доля аланина в композиции в положениях аминокислот 11-30 превышает долю аланина в положениях аминокислот 1-10. В конкретном варианте осуществления остатки 1-10 последовательности RSP Сор-1 имеют молярное конечное соотношение приблизительно 1,0:2,0:5,5:5,0,остатки 11-30 имеют молярное конечное соотношение приблизительно 1,0:2,0:6,0:5,0, и остатки 31-52 имеют молярное конечное соотношение приблизительно 1,0:2,0:6,5:5,0, где все соотношения указаны для молярного соотношения среди Y, Е, А, К в указанном порядке. Для целей настоящего изобретения выражение "Сор-1 или связанный с Сор-1 пептид или полипептид" включает любой пептид или полипептид, который функционально перекрестно реагирует с основным белком миелина (МБР) и способен конкурировать с МБР на МНС класса II при представлении антигена. Ожидается, что активность Сор-1 для применений, описанных в настоящем описании, сохранится,если внести одну или более из следующих замен: аспарагиновая кислота (D) вместо глутаминовой кислоты (Е), глицин (G) вместо аланина (А), аргинин (R) вместо лизина (К) и триптофан (W) вместо тирозина (Y). В других вариантах осуществления композиция RSP содержит три различных аминокислоты из групп (а) отрицательно заряженные аминокислоты (такие как аспарагиновая кислота, глутаминовая кислота); (b) гидрофобные алифатические аминокислоты, т.е. лейцин, изолейцин, валин, метионин; (с) объемные гидрофобные аминокислоты, т.е. тирозин, фенилаланин; и (d) аминокислоты с небольшими нейтральными боковыми цепями, т.е. серин, треонин, аланин, глицин; кроме того, сополимер может содержать остатки пролина. Эти сополимеры называют в настоящем описании "терполимерами". Средняя молекулярная масса составляет от 2000 до приблизительно 40000 Да, и предпочтительно от приблизительно 3000 до приблизительно 35000 Да. В более конкретном варианте осуществления средняя молекулярная масса составляет от приблизительно 5000 до приблизительно 25000 Да. Иллюстративные терполимеры представлены в таблице. Средняя молярная доля аминокислот в этих терполимерах может варьировать и представлена в качестве общих диапазонов. Таблица А Терполимеры, пригодные для применения в настоящем изобретении В конкретных вариантах осуществления, молярная доля аминокислоты в терполимере сходна с молярной долей для Сор-1, например, глутаминовая кислота - приблизительно 0,14, аланин приблизительно 0,43, тирозин - приблизительно 0,10, и лизин - приблизительно 0,34. Другие пригодные RSP содержат комбинацию L-аланина (А), L-фенилаланина (F), L-лизина (K) иL-тирозина (Y), и в настоящем описании их обозначают как YFAK. Длина любого из таких RSP составляет приблизительно от 25 до 300 аминокислотных остатков. RSP YFAK, который является предпочтительным для применения в терапевтической композиции, имеет от 35 до 75 аминокислотных остатков. Более предпочтительно длина RSP составляет от 35 до 65 аминокислотных остатков. ПредпочтительныйRSP имеет длину приблизительно 50 или 52 аминокислот. Конкретная композиция YFAK (L-тирозин, L-фенилаланин, L-аланин и L-лизин) имеет молярное конечное соотношение приблизительно 1,0:1,2:ХА:6,0 соответственно, где ХА превышает 11,0 и меньше 30,0, более конкретно превышает 20,0 и меньше 30,0, и вариабельность конечных соотношений между различными аминокислотами включает диапазон приблизительно 10%. Молярные конечные соотношения YFAK для случайных сополимеров, предпочтительных для терапевтического применения, представлены в табл. В ниже. Конкретная композиция YFAK имеет среднее молярное конечное соотношение приблизительно 1,0:1,3:24,0:6,0 (Y, F, А, K соответственно), и ее можно получать твердофазным синтезом, как известно в данной области. Другая композиция YFAK, которая является предпочтительной для терапевтического применения,имеет среднее молярное конечное соотношение для YFAK приблизительно 1,0:1,2:ХА:6,0, где ХА превышает 20,0, и доля аланина возрастает с увеличением длины сополимера. В конкретной композиции длина такого RSP составляет приблизительно 52 аминокислотных остатка, и доля аланина в аминокислотных положениях 31-52 является более высокой, чем в аминокислотных положениях 11-30, и доля аланина в аминокислотных положениях 11-30 является более высокой, чем в аминокислотных положениях 1-10.RSP можно классифицировать согласно их предпочтительному связыванию мишеней и их физиологическим функциям, которые являются результатом непосредственно состава аминокислот и их соотношений. Для установления того, связывается ли композиция RSP с белками-кандидатами или известными белками-мишенями можно использовать любой доступный способ. Например, полипептид можно метить репортерной молекулой (такой как радионуклид или биотин), смешивать с неочищенным или чистым препаратом белка-мишени и детектировать связывание, если репортерная молекула прикрепляется к белку-мишени после удаления несвязанного полипептида.RSP могут содержать любые аминокислотные остатки в любых соотношениях и потенциально имеют множество физиологических эффектов, однако для некоторых RSP признана их иммунологическая активность. Определенные RSP разрабатывают так, чтобы они предпочтительно взаимодействовали с конкретными Т-клеточными эпитопами, некоторые из которых могут быть прямо ассоциированы с патологическими нарушениями. Один класс RSP, полезные для настоящего изобретения, является специфичным к Т-клеткам, которые могут секретировать растворимые медиаторы, такие как цитокины. Предпочтительно такие RSP представляют собой смесь пептидов, содержащую от двух до восьми типов аминокислот, и предпочтительно взаимодействуют с определенными Т-клеточными эпитопами, некоторые из которых прямо ассоциированы или предположительно прямо ассоциированы с патологическими нарушениями, которые усиливаются неправильным продуцированием растворимых медиаторов, таких как цитокины. Другой класс RSP обладает потенциалом к функциональном взаимодействию с тысячами, предпочтительно с сотнями тысяч, более предпочтительно с миллионами, Т-клеточных эпитопов через представление молекул МНС, предпочтительно молекул МНС класса II. Аллели МНС класса II у человека состоят из молекул HLA-DR, HLA-DQ или HLA-DP. Они также представляют собой многочисленные аллели,- 12022399 кодирующие каждый тип этих молекул HLA. Молекулы МНС класса II экспрессируются, главным образом, на поверхностях В-лимфоцитов и антигенпредставляющих клеток, таких как макрофаги. Белок МНС класса II состоит изисубъединиц приблизительно равного размера, обе из которых являются трансмембранными белками. Связывающий пептид желобок образуется N-концевыми частями как-, так и субъединиц. Этот связывающий пептид желобок представляет собой центр представления антигена Тклеткам. Определенные аллельные варианты белков МНС класса II ассоциированы с аутоиммунными и другими иммунологическими нарушениями. Одним таким конкретным нарушением является рассеянный склероз (MS). Ассоциированные с MS молекулы HLA-DR2 (DRB11501) связываются с основным белком миелина (МБР) с высокой аффинностью, вызывая атаку Т-клетками миелиновой оболочки. Сор-1, описанный выше, связывается с высокой аффинностью и пептид-специфическим образом с очищенным HLA-DR2 (DRB11501), HLA-DR1(DRB10101) и HLA-DR4 (DRB10401). Другие RSP, такие как YFAK, также могут иметь сходную или более высокую аффинность к антигенсвязывающему желобку такого белка МНС класса II, относительно Сор-1. Таким образом, эти RSP могут ингибировать или вытеснять связывание аутоантигенов миелина из такого белка МНС класса II. Аналогично, композиция RSP, пригодная в способах, описанных в настоящем описании, может быть пригодна для лечения артритического состояния, например, ревматоидного артрита (RA) или остеоартрита (ОА). HLA-DR1 (DRB10101) или HLA-DR4 (DRB10401), которые связываются с Сор-1,ассоциированы с ревматоидным артритом (RA). Сор-1, YFAK и другие RSP, полезные для этого изобретения, могут иметь более высокую аффинность к антигенсвязывающему желобку такого HLA, чем пептид 261-273 коллагена типа II, мишень патологии ревматоидного артрита. Таким образом, эти RSP могут ингибировать связывание или вытеснять пептид 261-273 коллагена типа II из антигенсвязывающего желобка белка МНС класса II. Другие RSP, пригодные для определенных вариантов осуществления способа по изобретению,представляют собой RSP, которые связываются с молекулами HLA-DQA1, и еще более предпочтительно с одной или более молекулами HLA, кодируемыми аллелями DQA10501-DQB10201, DQA10301,DQB10401 и DQA103-DQB10302. В конкретных вариантах осуществления RSP связываются с определенными молекулами HLA-DQ,которые вызывают предрасположенность у носителя таких молекул к аутоиммунным заболеваниям, таким как диабет типа I и глютеновая болезнь, с константой диссоциации (Kd), по меньшей мере в 10 раз меньшей, чем Kd сополимера, в отношении связывания молекул HLA-DR и/или других изотипов DQ. Такие молекулы HLA-DQ представляют собой комбинированные белковые продукты конкретных аллелей HLA-DQB1 и DQA1, известных как DQB10201, DQB10302, DQB10304, DQB10401, DQB10501,DQB10502; и DQAl0301, DQA10302, DQA10303 и DQA10501. Эти аллели могут кодироваться одними и теми же гаплотипами ("цис"-аллели), как например, DQB10201-DQA10501-DRB10301 иDQB10302-DQA10301-DRB10401. Полученную молекулу HLA, содержащую полипептидные продукты "цис"-аллелей, называют "цис-димером". Альтернативно, аллели могут кодироваться различными гаплотипами ("транс"-аллели). Молекулы HLA, содержащие полипептидные продукты "транс"-аллелей,называют "транс"-димером. Примером "транс"-аллелей является комбинация DQB10201 наDQB10201-DQA10501-DRB10301 и DQA10301 на DQB10301-DQA10301-DRB10404. В конкретных вариантах осуществления композиции RSP, пригодные для настоящего изобретения,связываются с одним или более изотипами DQ со средней Kd 1 мкМ или менее, более предпочтительно со средней Kd менее 100, 10 нМ или даже менее 1 нМ. Другой путь идентификации предпочтительных сополимеров основан на мере вытеснения сополимером других молекул в конкурентных анализах связывания, описанных в Sidney et al., 2002, J. Immunol. 169:5098, которая выражается в качестве величиныIC50. Предпочтительные RSP по настоящему изобретению имеют IC50 менее 1 мкМ, более предпочтительно менее 500 нМ и еще более предпочтительно менее 100 нМ. Некоторые RSP, которые обладают специфичностью к HLA-DQ, представляют собой ELSA и VLYV. В некоторых других вариантах осуществления способы по изобретению связаны с RSP, имеющими определенные характеристики APL, исходя из эпитопов, ассоциированных с заболеваниями. В определенных вариантах осуществления RSP, пригодные для настоящего изобретения, изготавливают в качестве терапевтического средства, так чтобы они имели полидисперсность менее 25000, более предпочтительно менее 10000, 5000, 1000, 500, 100, 50 или даже менее 10. Фармакокинетические способы. В некоторых вариантах осуществления можно определять всасывание и распределение композицийRSP. Также можно определять скорость, с которой композиция RSP обеспечивает изменение и сохранение эффекта, а также химические изменения композиции RSP. Определенные композиции RSP сохраняются в сыворотке и других биологических жидкостях значительно дольше по сравнению с другими смесями. Например, препарат YFAK, PI-23 01, выявлен в концентрации в сыворотке, в 10 раз Сор-1, вводимый в той же концентрации в расчете по массе на объем(публикация заявки США 2009-0275496). В некоторых случаях введенные пептиды изолируются или связываются in situ некоторым компонентом in vivo, результатом которого является более длительное время полужизни в этой среде, с увеличением биодоступности или без него. В определенном варианте осуществления среда представляет собой плазму крови или лимфу. В альтернативном варианте осуществления среда представляет собой спинномозговую или церебральную жидкость. В других вариантах осуществления среда представляет собой любую ткань или орган, локально в которые доставляются пептиды из композиций RSP. Идентификация физиологических полипептидов и белков, которые связывают аминокислотные полимеры из композиций RSP. Одним из аспектов настоящего изобретения является идентификация улавливающего полипептида,который связывает композицию RSP. Термин "улавливающий полипептид" используют в настоящем описании для обозначения любого полипептида, белка, фрагмента белка, протеолипида или другой молекулы, содержащей белковый материал, находящийся в нормальных тканях и органах. Он может представлять собой один полипептид или белок, содержащий множество полипептидов и/или субъединиц,или комплекс, содержащий белок, связанный (ковалентно или нековалентно) с другими материалами,такими как липиды, которые могут далее иметь определенные структуры, которые являются желательными или необходимыми, чтобы улавливающий полипептид связывал композицию RSP. Часто улавливающий полипептид не является временным, т.е. существует основное стабильное количество, которое имеется все время, независимо от того, существует ли временно индуцированное или усиленное присутствие. Предпочтительно улавливающий полипептид представляет собой белок. Более предпочтительно улавливающий полипептид представляет собой белок, находящийся в биологической жидкости, такой как сывороточный. Некоторые варианты осуществления этого аспекта изобретения представляют собой способы идентификации улавливающего полипептида, который связывается с пептидами, которые составляют композицию RSP, где способы включают приведение в контакт образца, содержащего некоторое количество композиции RSP, с нормальным образцом ткани; и детекцию связывания пептидов композиции RSP с любым компонентом нормального образца ткани. В определенных вариантах осуществления пептиды композиции RSP иммобилизуют либо на смоле (через ковалентную связь путем реакции пептидов с активированной смолой), либо на твердом субстрате, таком как полистирол. Например, образец ткани можно приводить в контакт с иммобилизованными пептидами и инкубировать, промывать для удаления неспецифического связывания, и идентифицировать материалы, связавшиеся с пептидами, которые были в образце ткани. Связавшиеся материалы можно идентифицировать любым пригодным способом, например, воздействием на материалы панели специфических антител; микросеквенированием материалов,если такие материалы предположительно являются полипептидами или нуклеотидами; расщеплением трипсином с последующей жидкостной хроматографией, сопряженной с тандемной масс-спектрометрией(LC-MS/MS), воздействием на такие материалы определенных красителей, если такие материалы предположительно являются полисахаридами; или любым аналитическим способом с достаточно высокой чувствительностью. В качестве неограничивающего примера описанной выше идентификации, можно использовать PI2301 или Сор-1 для прямого анализа ELISA (см. Материалы и Способы) для идентификации сывороточных белков, которые связываются с композицией RSP, содержащей YFAK или YEAK. В табл. С ниже приведены сывороточные белки, для которых экспериментально показано, что они связываются с пептидами YEAK и/или YFAK в нормальной сыворотке человека. Было выявлено, что пептиды YEAK и YFAK имеют различную специфичность связывания; напротив, можно сказать, что белки связываются с пептидами YEAK и YFAK с различной специфичностью. В таблицах D и Е приведены сывороточные белки,которые связываются с ЛПВП и ЛПНП соответственно. Любые сывороточные белки могут связываться с композицией RSP, описанной в настоящем описании, с различной аффинностью и селективностью. После идентификации улавливающего полипептида, который связывает пептиды, которые состоят из композиций RSP, можно определять специфичность связывания против сходных пептидов или против практически случайных пептидов. Затем идентифицированный и охарактеризованный улавливающий полипептид (либо те же самые молекулы, в действительности идентифицированные, либо подобные молекулы, полученные из другого источника) можно в свою очередь использовать для количественного анализа композиций RSP, с которыми выявлено его связывание. Сывороточные белки. В некоторых вариантах осуществления связывание композиций RSP с сывороточными белками составляет важный аспект их биологической активности. Связывание композиций RSP с сывороточными белками может способствовать их распределению в тканях и улавливанию антигенпредставляющими клетками, такими как моноциты и макрофаги. Как указано выше, связывание пептидов с белками сыворотки может защищать их от деградации и/или обновления. Например, PI-2301 (пловамер, RSP YFAK) и Сор-1 (глатирамер ацетат, YEAK RSP) может быть выявлен в сыворотке различных видов, включая человека, через несколько часов после подкожного введения, в то время как контрольные RSP исчезали из сыворотки после короткого промежутка времени [публикация заявки США 2009-027496]. Таким образом, сывороточные белки можно использовать для улавливания и/или идентификации одного или более пептидов из композиции RSP. В целом композиции RSP содержат много различных отдельных пептидов, среди которых одна или более субфракций могут быть ответственны за свойство связывания с белками сыворотки, в то время как другие субфракции не ответственны. Это особенно справедливо для смесей, полученных синтезом пептидов в жидкой фазе, где различные партии композиций RSP могут иметь варьирование процента пептидов, способных связывать сывороточные белки. Например, может быть важным проведение мониторинга типичных вариантов глатирамера ацетата в сыворотке, чтобы продемонстрировать биоэквивалентность вариантов, и чтобы показать, что связывающие сывороточный белок фракции являются эквивалентными количественно и качественно среди различных партий композиции RSP. Сывороточные белки можно использовать in vitro для выбора и/или охарактеризации партнеров по связыванию из композиции RSP. Сывороточные белки также можно использовать in vivo для выбора,измерения и/или иной охарактеризации пептидов, которые связывают белки сыворотки, таким образом,обеспечивая средства для различения конкретных пептидов или подсовокупностей пептидов, исходя из их связывания с сывороточными белками и/или их продолжения существования in vivo. Конкретные характеристики пептидов, которые связываются с сывороточными белками, могут включать конкретные аминокислотные последовательности, соотношения аминокислот в смеси, структуры, уникальные мотивы, конфигурацию заряженных остатков. Например, связывание PI-2301 с липопротеинами, находящимися в комплексе в ЛПВП или ЛПНП может быть возможным вследствие взаимодействия положительных остатков лизина с отрицательно заряженными остатками наружной части липопротеинов и взаимодействия остатков аланина и фенилаланина с гидрофобной частью липопротеинов. Таблица С Примеры сывороточных белков, для которых экспериментально показано связывание с пептидами YEAK и YFAK в сыворотке человека Связывание между сывороточными белками и композициями RSP. Без связи с теорией, механистически, связывание пептидов в композициях RSP (например, PI-23 01 и Сор-1) с сывороточными белками, такими как липопротеины, для которых найдена ассоциация с ЛПВП и ЛПНП, может облегчать их захват моноцитами через рецепторы, такие как SR-BI или АВСА 1. Это связывание может индуцировать активацию моноцитов и их дифференцировку в противовоспалительные клетки. PI-2301 и Сор-1 отличаются по связыванию сывороточных белков (см. фиг. 3). Одна из причин для этого отличия состоит в том, что Сор-1 и типичные варианты глатирамера ацетата получают синтезом пептидов в жидкой фазе, таким образом, от партии к партии можно наблюдать значительное варьирование. Напротив, PI-2301 изготавливают твердофазным синтезом. PI-2301 имеет очень узкое распределение молекулярной массы, как продемонстрировано с помощью SEC-ВЭЖХ и MALDI-TOF, с узким гауссовым распределением в обоих способах. Таким образом, значительное большинство 52-мерных пептидов PI-2301 в смеси, вероятно, являются функциональными. Сор-1 имеет значительно более широкое распределение молекулярных масс, что делает вероятным, что некоторые элементы смеси, такие как небольшие пептидные элементы в смеси, неэффективными. В соответствии с этим PI-2301 является бо- 18022399 лее эффективным, чем Сор-1, с точки зрения эффективности в доклинических моделях рассеянного склероза и болезни Крона и достигает более высокой экспозиции в сыворотке. В анализах сывороточных белков, которые связываются с PI-2301 или Сор-1, различные подгруппы сывороточных белков связываются с пептидами YFAK и YEAK (см. фиг. 3). Сывороточный белок может связываться с композицией RSP в качестве части комплекса холестерина, такого как комплекс ЛПВП или ЛПНП, и/или вместе с другими белками и полипептидами (любой из которых отдельно может также функционировать как улавливающий полипептид), ассоциация которых найдена с сывороточным белком в физиологических условиях. Таким образом, способы по изобретению предусматривают наличие дополнительных компонентов, находящихся в сыворотке при связывании композиции RSP с сывороточным белком. Детекция композиции RSP в биологическом образце, определение биодоступности. Один из аспектов настоящего изобретения представляет собой способ детекции присутствия композиции RSP в биологическом образце, включающий: приведение в контакт биологического образца по меньшей мере с одним улавливающим полипептидом; и детекцию присутствия или отсутствия связывания улавливающего полипептида с композицией RSP, где наличие связывания указывает на присутствие пептидных компонентов композиции RSP в биологическом образце. Кроме того, такой способ может быть расширен для измерения количества или концентрации композиции RSP в образце. В некоторых вариантах осуществления присутствие композиции RSP (например, содержащей пептиды YFAK или YEAK) можно выявлять в биологическом образце путем приведения в контакт биологического образца по меньшей мере с одним улавливающим полипептидом (например, содержащим пептид, выбранный из альфа-1-антитрипсина, аполипопротеина A-I, альфа-1-В-гликопротеина, аполипопротеина А-IV, аполипопротеина D и преальбумина); и детекции присутствия или отсутствия связывания улавливающего полипептида с композицией RSP. В этом анализе наличие связывания указывает на присутствие пептидов YFAK или YEAK в биологическом образце. Кроме того, изобретение относится к способам определения количества композиции RSP, содержащей пептиды YFAK или YEAK, в биологическом образце путем приведения в контакт биологического образца по меньшей мере с одним улавливающим полипептидом (например, содержащим пептид, выбранный из альфа-1-антитрипсина, аполипопротеина A-I, альфа-1-В-гликопротеина, аполипопротеина A-IV, аполипопротеина D и преальбумина); и количественного определения уровня связывания улавливающего полипептида с композицией RSP. Другие варианты осуществления изобретения относятся к способам определения биодоступности композиции RSP (например, содержащей пептиды YFAK или YEAK) у индивидуума, включающим введение индивидууму дозы композиции, содержащей композицию RSP; взятие биологического образца от индивидуума; и приведение в контакт биологического образца по меньшей мере с одним улавливающим полипептидом (например, содержащим пептид, выбранный из альфа-1-антитрипсина, аполипопротеинаA-I, альфа-1-В-гликопротеина, аполипопротеина A-IV, аполипопротеина D и преальбумина). Предусматривается, что пептиды композиции RSP активно связываются с улавливающим полипептидом in vivo. Тем не менее, для дальнейшей охарактеризации можно использовать антитела, специфичные к комплексам, содержащим пептиды композиции RSP и улавливающий пептид, но не к каждому из них по отдельности, для детекции биодоступной композиции RSP. Улучшение дозировки и способов введения. Другой аспект настоящего изобретения относится к способам введения композиций RSP индивидууму-млекопитающему в количестве, определенном, исходя из биодоступной части вводимого количества, как определяют способом, описанным выше или другими способами, описанными в настоящем описании. В определенных вариантах осуществления способ дополнительно включает добавление контрольного образца, проведение фармакодинамического теста для определения изменения физиологических маркеров, таких как гормоны, ферменты, сывороточные белки, цитокины, иммуномодуляторы или эффектор или регулятор любого из этих функциональных белков, между контрольным образцом и тестируемыми образцами путем сравнения двух результатов, и определение дозировки, эффективной для индукции желаемых изменений фармакодинамического параметра. В определенных вариантах осуществления наблюдают изменения поведения, описываемые индивидуумом, такие как смягчение боли или симптома заболевания, или другие признаки непрямых эффектов. В определенных вариантах осуществления указанным индивидуумом-млекопитающим является грызун, такой как мышь или крыса. В других вариантах осуществления указанным индивидуумом является человек. В более общем смысле, способ лечения или предупреждения нежелательного иммунного ответа у индивидуума может включать предоставление композиции RSP (например, содержащей пептиды YFAK или YEAK); введение композиции RSP испытуемому индивидууму; взятие биологического образца у тестируемого индивидуума; приведение в контакт биологического образца по меньшей мере с одним улавливающим полипептидом (например, содержащим пептидную последовательность, выбранную из альфа-1-антитрипсина, аполипопротеина A-I, альфа-1-В-гликопротеина, аполипопротеина А-IV, аполипопротеина D и преальбумина); отделение пептидов, которые связываются с улавливающим полипептидом, от смеси; определение характеристик отделенных пептидов; получение набора пептидов с характеристиками отделенных пептидов и введение полученного набора пептидов индивидууму. В этих способах композиции RSP можно вводить индивидууму более одного раза. Композиции RSP можно вводить индивидууму с интервалами, например, 1, 2, 3, 4, 6, 12, 18, 24, 36, 48 или 72 ч. Таким образом, некоторые варианты осуществления изобретения представляют собой способы введения подходящей дозы композиции RSP (например, содержащей пептиды YFAK или YEAK) индивидууму, нуждающемуся в этом, где пригодную дозу определяют путем введения индивидууму первой дозы композиции RSP; взятия биологического образца от индивидуума; приведения в контакт биологического образца по меньшей мере с одним улавливающим полипептидом (например, содержащим пептид, выбранный из альфа-1-антитрипсина, аполипопротеина A-I, альфа-1-В-гликопротеина, аполипопротеина А-IV, аполипопротеина D и преальбумина); определения уровня улавливающего полипептида в биологическом образце; необязательно повторения предшествующих стадий с использованием второй отличающийся дозы; и сравнения уровней с заданным подходящим уровнем композиции RSP в биологическом образце. В этих условиях подходящая доза представляет собой дозу, которая приводит к заданному подходящему уровню композиции RSP в биологическом образце. Пригодный уровень композицииRSP в биологическом образце представляет собой уровень, при котором получают желаемые функциональные данные, или изменение заместительного маркера. Функциональными данными могут быть фенотип или функция индивидуума, фенотип или функция клеточного материала, полученного от индивидуума, или состав жидкостей, полученных от индивидуума. В конкретном варианте осуществления стадию детекции повторяют через определенные временные интервалы для определения изменения с течением времени биодоступности после введения. В определенном варианте осуществления из такого изменения с течением времени определяют время полужизни композиции RSP в качестве группы. Примерами функциональных данных в случаях YFAK или YEAK об усилении иммунного ответа или блокировании ответа являются: увеличение или детекция TNF, IL-6, CXCL1, CXCL2 и IL-12p70 в качестве индикаторов нежелательной стимуляции иммунной системы, и увеличение или детекция IL-1ra, CXCL13 и CCL22 в качестве индикаторов желаемых положительных изменений. Изменения этих маркеров легко определить с помощью способов и материалов, известных и хорошо доступных в данной области. Определенные варианты осуществления изобретения упрощают сравнение эффективных доз среди видов. Сравнение эффективных доз у человека и экспериментальных животных, таких как мыши или крысы, является трудным не только вследствие различий в массе тела и отличий в общем метаболизме,но также поскольку было выявлено, что биодоступность терапевтических средств отличается между видами животных. Аспектом настоящего изобретения является то, что биодоступность композиций RSP коррелирует, частично вследствие связывания составляющих пептидов с сывороточными белками, что может обеспечить более длительное время полужизни и определенное распределение в тканях. Таким образом, некоторые варианты осуществления изобретения представляют собой способы определения пригодной дозировки композиции RSP у индивидуума, причем такие способы включают определение первой подходящей дозировки композиции RSP в модели на экспериментальных животных, где первая подходящая дозировка представляет собой такую дозировку, которая обеспечивает благоприятные данные и которая соответствует уровню композиции RSP, связавшейся с сывороточным белком in vivo, и определение второй подходящей дозировки композиции RSP у индивидуума путем введения индивидууму так, чтобы уровень композиции RSP, связавшейся с сывороточным белком in vivo у индивидуума,был сходен или идентичен с уровнем, достигаемым введением первой подходящей дозировки экспериментальному животному. В конкретных вариантах осуществления введение композиции RSP (такой как RSP YFAK илиYEAK, используемые для лечения или профилактики нежелательного иммунного ответа у индивидуума) может быть усилено с использованием способов по настоящему изобретению. Один способ включает введение индивидууму подходящей дозы композиции RSP (например, включающей композицию RSPYFAK или YEAK), где такую подходящую дозу определяют путем введения индивидууму дозы композиции RSP; извлечения биологического образца из экспериментального индивидуума; приведения в контакт биологического образца по меньшей мере с одним улавливающим полипептидом (например, выбранным из альфа-1-антитрипсина, аполипопротеина A-I, альфа-1-В-гликопротеина, аполипопротеина АIV, аполипопротеина D и преальбумина); определения уровня улавливающего полипептида в биологическом образце; необязательно, повторения всех предшествующих стадий и сравнения уровня(ей) с заданным подходящим уровнем композиции RSP в биологическом образце. Подходящую дозировку определяют, как описано выше, исходя из благоприятных данных. Пептиды можно метить любыми подходящими способами, такими как присоединение флуоресцентных групп, радиоактивных меток, образование химических конъюгатов, биотинилирование, добавление эпитопных меток или любой другой группы, которая облегчает детекцию. Сывороточные белки,действующие в качестве детекторных полипептидов, как описано выше, могут быть связаны с твердой подложкой. После связывания сывороточных белков с одним или более пептидами из композиции RSP,можно выделять связанный комплекс, содержащий улавливающий полипептид, связанный с композицией RSP. Способы выделения связанных комплексов могут включать иммунопреципитацию, ELISA, иммунодетекцию или детекцию меченых улавливающих полипептидов. Детекцию связывания улавливающего полипептида с композицией RSP можно проводить с помощью антител к улавливающему полипептиду,антител к композиции RSP (таких как поликлональные антитела против YFAK или против YEAK) или антител, полученных для распознавания связанного комплекса. Композиции RSP можно вводить подкожно, внутримышечно, внутривенно, интраназально или через любое отверстие или слизистую оболочку. В некоторых вариантах осуществления композиция для детекции композиции RSP, содержащей пептиды YFAK или YEAK, в биологическом образце может содержать по меньшей мере один улавливающий полипептид, содержащий пептид, выбранный из альфа-1-антитрипсина, аполипопротеина A-I,альфа-1-В-гликопротеина, аполипопротеина A-IV, аполипопротеина D и преальбумина. Выбор конкретных пептидов из композиции RSP. Одним из аспектов настоящего изобретения является его применение для идентификации и/или выделения пептидов или подсовокупности пептидов из композиции RSP. Хотя одним из преимущественных признаков композиций RSP по сравнению с образцами с одним типом пептидов или олигоспецифических пептидов является их гетерогенность, возможно, что одна подсовокупность пептидов, которые составляют смесь, является более эффективной, чем другая подсовокупность, или что одна подсовокупность в действительности является нежелательной. Таким образом, настоящее изобретение относится к способам идентификации и/или выделения пептидов из образца, содержащего композицию RSP, на основе аффинности пептидов к определенным улавливающим полипептидам. В конкретных случаях, подсовокупность может содержать пептиды, имеющие одну или более различных аминокислотных последовательностей. В других случаях, улавливающие полипептиды можно использовать для классификации компонентов композиции RSP на основе специфичности связывания. В некоторых вариантах осуществления способ идентификации подсовокупности пептидов, которые связываются с улавливающим полипептидом, включает получение композиции RSP согласно протоколу,приведение в контакт указанной композиции RSP с заданным улавливающим полипептидом (например,который является желательным в качестве мишени или носителя in vivo), определение связывания пептидов в композиции RSP, идентификацию характеристик, которые отличают пептиды, которые связываются, от пептидов, которые не связываются, и получение улучшенной композиции RSP, отражающей одну или более из отличительных характеристик. В определенных вариантах осуществления образец, содержащий композицию RSP, приводят в контакт с улавливающим полипептидом, и выделяют и идентифицируют пептиды, которые составляют композицию RSP, связывающиеся с улавливающим полипептидом. В некоторых вариантах осуществления композиция RSP представляет собой композицию RSP YFAK и в конкретном варианте осуществления смесь представляет собой PI-2301. В других вариантах осуществления RSP композиция представляет собой композицию RSP YEAK, и в конкретном варианте осуществления смесь представляет собой Cop1. В определенных вариантах осуществления композицию RSP приводят в контакт по меньшей мерес одним сывороточным белком, который действует в качестве улавливающего полипептида. В более конкретных вариантах осуществления такой сывороточный белок выбран из альфа-1-антитрипсина, аполипопротеина A-I, альфа-1-В-гликопротеина, аполипопротеина А-IV, аполипопротеина D и преальбумина. Улавливающий полипептид может быть иммобилизован на твердой подложке и/или он может быть меченным способами, известными в данной области. Иммобилизацию и мечение можно использовать в последующих стадиях отделения связавшихся пептидов от улавливающих полипептидов, и/или определения характеристик выделенных пептидов. Такие характеристики могут включать аминокислотную последовательность связавшегося пептида, относительные соотношения аминокислот в связавшихся пептидах, конфигурацию или расположение заряженных остатков в последовательности, структуру пептида,заряд или любую другую подходящую характеристику. Связывание между композициями RSP и сывороточными белками также можно использовать для идентификации биодоступных пептидов в композиции RSP, например, биодоступных пептидов, содержащих пептиды YFAK или YEAK в биологическом образце, взятом от индивидуума. Здесь, сначала можно вводить композицию RSP; а затем, после введения, образец ткани можно извлекать из пациента. В образце ткани можно идентифицировать пептиды, которые связываются по меньшей мере с одним улавливающим полипептидом, например, содержащим пептид, выбранный из альфа-1-антитрипсина, аполипопротеина A-I, альфа-1-В-гликопротеина, аполипопротеина А-IV, аполипопротеина D и преальбумина. Усовершенствованное получение композиций RSP. Другой аспект изобретения относится к способу усовершенствования процесса производства композиции, содержащей композицию RSP. В некоторых вариантах осуществления композицию RSP разрабатывают, исходя из указанного выше способа идентификации подсовокупности пептидов, которые связываются с улавливающим полипептидом. В некоторых вариантах осуществления композицию RSP разрабатывают так, чтобы аминокислотный состав и/или аминокислотная последовательность практически соответствовала им в подсовокупности пептидов, которые связываются с улавливающим полипептидом. В определенных вариантах осуществления способ получения композиции RSP (например, содержащей пептиды YFAK или YEAK), обладающей пониженной токсичностью, может включать приведение в контакт композиции RSP по меньшей мере с одним улавливающим полипептидом (например, со- 21022399 держащим пептид, выбранный из альфа-1-антитрипсина, аполипопротеина A-I, альфа-1-Вгликопротеина, аполипопротеина A-IV, аполипопротеина D и преальбумина); отделение пептидов, которые связываются с улавливающим полипептидом, от смеси; определение характеристик отделенных пептидов; и получение набора пептидов с характеристиками отделенных пептидов. Аналогично, способ получения композиции RSP (например, содержащей пептиды YFAK илиYEAK), обладающей усиленной эффективностью, может включать приведение в контакт композицииRSP по меньшей мере с одним улавливающим полипептидом, содержащим пептид (например, выбранный из альфа-1-антитрипсина, аполипопротеина A-I, альфа-1-В-гликопротеина, аполипопротеина A-IV,аполипопротеина D и преальбумина); и отделение пептидов, которые связываются с улавливающим полипептидом, от смеси; определение характеристик отделенных пептидов; и получения набора пептидов с характеристиками отделенных пептидов. В некоторых вариантах осуществления желаемую подсовокупность композиции RSP можно получать с использованием иммобилизованных улавливающих полипептидов в предварительном масштабе. Композицию RSP получают, как предусмотрено и описано ранее, и приводят в контакт с иммобилизованными улавливающими полипептидами, связанными с желаемым усовершенствованием. Несвязанные пептиды удаляют промыванием образца, и связавшуюся часть композиции RSP элюируют с использованием подходящих условий диссоциации, таких как измененное значение рН, концентрация соли или добавление органических растворителей. Объединенную связавшуюся часть обрабатывают соответствующим образом для концентрирования и удаления терапевтически нежелательных компонентов, например,органического растворителя, путем выпаривания или дальнейшей очистки подходящими способами хроматографии или кристаллизации или других способов очистки. Полученную таким образом подсовокупность композиции RSP используют в качестве терапевтических средств. Кроме того, этот аспект изобретения можно комбинировать с описанными выше усовершенствованиями дозировки и введения. Когда получают лучше подобранные композиции RSP, можно ожидать, что дозировку и путь введения можно корректировать соответственно. Таким образом, в альтернативных вариантах осуществления способ включает получение композиции RSP согласно протоколу, изготовление композиции, содержащей композицию RSP, определение биодоступного количества композицииRSP в указанной композиции путем детекции уровня или степени функциональных данных, сравнение таких данных со стандартом, и корректирование протокола или состава композиции для получения желаемой биодоступности. Тканеспецифическое нацеливание терапевтических средств. Другим потенциальным применением взаимосвязи между композициями RSP и сывороточными белками является тканеспецифическое нацеливание терапевтических средств. В одном варианте осуществления способ получения терапевтического средства для заданной ткани у индивидуума может включать предоставление композиции RSP (например, содержащей пептиды YFAK или YEAK); и связывание терапевтического средства с композицией RSP с образованием конъюгата. Таким образом, некоторые варианты осуществления изобретения относятся к способам доставки терапевтического средства в конкретную ткань у индивидуума путем выделения пептидной метки приведением в контакт композиции RSP (например, содержащей пептиды YFAK или YEAK) с тканеспецифическим пептидом (например, содержащим пептид, выбранный из альфа-1-антитрипсина, аполипопротеина A-I, альфа-1-В-гликопротеина, аполипопротеина А-IV, аполипопротеина D и преальбумина); и отделением пептидов, которые связываются с тканеспецифическим пептидом, от смеси; связывания пептидной метки с терапевтическим средством; и (с) введения конъюгата индивидууму. Другие варианты осуществления изобретения включают способ получения конъюгата, содержащего терапевтическое средство, связанное с пептидной меткой, и сами полученные конъюгаты. Пептидная метка, предусмотренная в рамках настоящего патента, может представлять собой, например, пептидYFAK или YEAK. Такой пептид можно выделять из композиции RSP на основе аффинности связывания с альфа-1-антитрипсином, аполипопротеином A-I, альфа-1-В-гликопротеином, аполипопротеином A-IV,аполипопротеином D и преальбумином. Терапевтическое средство может представлять собой низкомолекулярную органическую молекулу или биологическую макромолекулу, и конкретная ткань может представлять собой ткань головного мозга, легкого или печени. Пептидная метка может содержать пептид YFAK или YEAK. Пептидная метка может быть связана с терапевтическим средством ковалентной связью, посредством комплексов включения, ионными связями или водородными связями. Примерами терапевтических средств, пригодных для применения на практике этого изобретения, являются противоопухолевые средства, включающие антиметаболиты, ингибиторы цитокинов и факторов роста, ингибиторы киназы, антиангиогенные средства,противовоспалительные средства, специфичные к заболеванию антитела, вакцины и антибиотики. Стандартные иммунологические, биохимические и молекулярно-биологические способы, которые можно использовать в рамках изобретения, известны в данной области. Примеры стандартных протоколов могут быть найдены, например, в серии Current Protocols, опубликованной John Wiley and Sons, и всех дополнениях, доступных в настоящее время, включая Current Protocols in Molecular Biology, in Immunology, in Cell Biology, in Protein Chemistry, in Pharmacology, и других. Все ссылки и патенты и па- 22022399 тентные заявки, цитированные в настоящем описании, включены в качестве ссылок в полном объеме. Примеры Пример 1. Детекция PI-2301 и Сор-1 в нормальной сыворотке человека. Композиции RSP PI-2301 (YFAK) или Сор-1 (YEAK) получали в концентрации 500 нг/мл и разбавляли в 5% нормальной сыворотке человека в PBS до концентраций 100, 50, 25 или 12,5 нг/мл и добавляли к нормальной сыворотке человека. Детекцию связывания композиций RSP с белками сыворотки, содержащимися в нормальной сыворотке человека, проводили путем добавления антитела кролика противYFAK или антитела кролика против YEAK. Непокрытый планшет для ELISA блокировали PBS/0,1% Tween 20 в течение 2 ч при комнатной температуре. Образцы PI-2301 или Сор-1 подвергали серийному разведению в PBS/5% нормальной сыворотке человека и добавляли в блокированные и промытые лунки планшета для ELISA. PI-2301 или Сор-1 в нормальной сыворотке человека связывались с планшетом и несвязанные PI-2301 или Сор-1 удаляли промыванием планшета PBS/0,05% Tween 20. Добавляли очищенное с помощью белка А противокроличье антитело против PI-2301 или противокроличье антитело против Сор-1, разбавленные до подходящей концентрации, исходя из титра, на 1 ч при RT. После другой стадии промывания для удаления не связавшегося антитела кролика против 2301 или антитела кролика против Сор-1, в лунку добавляли вторичное антитело, антитело козы против IgG кролика-HRP (конъюгированное с пероксидазой хрена антитело к IgG кролика). После смывания любого не связавшегося вторичного антитела, в лунки добавляли субстрат для HRP и инкубировали в течение 15 минут, что приводило к синему цвету, который становился желтым при добавлении стоп-раствора, причем интенсивность этого желтого цвета коррелирует с количеством общего PI-2301 или Сор-1 в лунке. Оптическую плотность измеряли при 450 нм с помощью устройства для считывания ELISA и получали титрационную кривую для каждого набора образцов сыворотки, в которые добавлены PI-2301 и Сор-1 соответственно. Предел детекции сывороточного PI-2301 или сывороточного Сор-1 определяется как концентрация, которая приводит к поглощению А 450 нм,которое в 3 раза превышает фоновый уровень. Лунки планшета для ELISA, использованные для определения фонового уровня, обрабатывали, как описано выше, за исключением того, что пептиды из композиций RSP исключали. Результаты нанесены на график на фиг. 2. На оси х указана концентрация композиции RSP. На оси у представлено колориметрическое поглощение А 450 для конъюгированных с HRP вторичных антител. При более высоких концентрациях композиций RSP, детекция конъюгатов антителами против PI-2301 или против Сор-1 является более высокой при более низких концентрациях композиций RSP. 12,5 нг/мл соответствует дозе приблизительно 2 мг у пациента-человека. Пример 2. Улавливание комплексов на колонке. Иммобилизованные композиции RSP получали путем реакции пептидов с CNBr-активированнойSepharose, предварительно активированной средой для хроматографии с крупными порами, используемой для иммобилизации лигандов (белки, пептиды, нуклеиновые кислоты), содержащих первичные амины, с использованием способа цианогенбромида. В кратком изложении, после отвешивания желаемого количества лиофилизированную CNBr-Sepharose промывали 1015 мин холодной 1 мМ HCl (с использованием приблизительно 200 мл 1 мМ HCl/грамм высушенной Sepharose), а затем 2 буфером для связывания. Лиганд растворяли в буфере для связывания до желаемой концентрации, комбинировали сCNBr-Sepharose в соотношении 1:2 (с использованием 1 объема лиганда на 2 объема промытого геляCNBr-Sepharose), а затем инкубировали в течение ночи при 4 С на качающей платформе. Любые остающиеся активные участки на геле блокировали, а затем промывали для удаления любого избыточного лиганда. Для очистки лиганд-специфического белка, гель после связывания промывали 2 фосфатносолевым буфером (PBS), добавляли желаемый реагент (сыворотка, клеточный супернатант) в соотношении 1:2 (1 объем реагента на 2 объема промытого геля CNBr-Sepharose), а затем инкубировали в течение ночи при 4 С на качающей платформе. Взвесь гель/реагент помещали в одноразовую колонку, промывали для удаления не связавшегося реагента, затем лиганд-специфический белок элюировали буфером с низким рН. После нейтрализации рН, считывали поглощение при 280 нм элюированных фракций для идентификации фракций, содержащих лиганды. Колонку промывали и хранили при 4 С для повторного применения. Пример 3. Идентификация белков, связавшихся с PI-2301 или Сор-1. Образцы, содержащие связывающие PI-2301 белки или связывающие Сор-1 белки, получали способом согласно примеру 1 или примеру 2. Затем эти образцы ферментативно расщепляли и анализировали жидкостной хроматографией - тандемной масс-спектрометрией (LC-MS/MS) для идентификации белков,которые связывают PI-2301 или Сор-1. В кратком изложении, аликвоту каждого образца расщепляли специфичной к последовательности протеазой - трипсином. После расщепления белково-пептидную смесь анализировали с помощью LC-MS/MS. Пептиды разделяли, исходя из их удержания на колонке с высвобождающей фазой, а затем впрыскивали в масс-спектрометр. В процессе впрыскивания пептид получал заряд +2 или +3 и масс-спектрометры проводили мониторинг отношения массы к заряду. Если пептид имел значительное отношение массы к заряду, тогда его фрагментировали столкновением с газами и паттерны фрагментов регистрировали. Затем эти паттерны фрагментов можно сравнивать с теоретическими паттернами фрагментов для всех известных белков. Это сопоставление паттернов экспериментальных фрагментов с теоретическими паттернами фрагментов привело к идентификации нескольких липопротеинов из комплексов ЛПВП и ЛПНП. Эти липопротеины были выявлены как в образце PI-2301,так и в образце Сор-1. Образец Сор-1 также имел несколько уникальных белков, включая белки комплемента, такие как С 3 и С 4 А. На фиг. 3 обобщенно представлены сывороточные белки в нормальной сыворотке мыши или нормальной сыворотке человека, которые были идентифицированы путем связывания с PI-2301 или Сор-1.PI-2301 может быть ацетилированным или неацетилированным. Образцы белков получали способом,сходным со способом примера 1, где композиции RSP смешивали и связывали с компонентами сыворотки. Связывание комплексов PI-2301 или Сор-1 распознавали с помощью антител против YFAK или против YEAK, и их детекцию проводили с помощью вторичных антител и реагентов для детекции. Сывороточные белки элюировали из комплекса и идентифицировали. Белкам присваивают показатель, исходя из поглощения А 450 реагента для детекции. Показатель 70 соответствует величине значимости р 0,001, по сравнению с фоновым поглощением и его считают статистически значимым. Пример 4. Сравнение пептидного состава среди композиций RSP с различными длинами и в различных партиях. После синтеза композиций RSP с различными длинами, например, путем твердофазного синтеза или жидкофазного синтеза, отдельные партии и серин, полученные одним и тем же способом производства, и отдельные партии смесей, полученных различными способами производства, тестируют и сравнивают в отношении варьирования с использованием биологических анализов, таких как высвобождениеCCL22 моноцитарной клеточной линией RAW264.7, в анализы пролиферации ex vivo и измерение связывания белков сыворотки с пептидами в композиции RSP; можно определить подсовокупности пептидов или даже отдельные пептиды, которые присутствуют в любом данной процессе или партии. Процессы и партии композиций RSP можно сравнивать для определения того, присутствуют ли те же самые подсовокупности пептидов и/или типы пептидов постоянно в различных процессах и партиях. Получают множество идентифицирующих смол путем иммобилизации выбранных сывороточных белков на твердой подложке. Для анализа Сор-1 или PI-2301, сывороточные белки могут представлять собой один или более белков, идентифицированных в примере 1 (см. фиг. 3) как связывающие Сор-1 илиPI-2301 соответственно. Можно использовать другие белки, дополнительно идентифицированные как связывающие Сор-1 или PI-2301, в соответствующих случаях. Каждая твердая подложка содержит по меньшей мере один сывороточный белок, и, если более одного сывороточного белка связано с твердой подложкой, тогда соотношение отдельных сывороточных белков, связавшихся с данной твердой подложки, будет постоянным для каждой идентифицирующей смолы. Аликвоту из каждой партии Сор-1 илиPI-2301 можно наносить на ее собственную подложку в условиях, которые позволяют подсовокупности пептидов Сор-1 или PI-2301 связываться с сывороточными белками. После смывания несвязанных пептидов, связавшиеся пептиды можно элюировать. Пептиды Сор-1, выделенные этим путем, можно далее охарактеризовывать в отношении (1) присутствия различных пептидов Сор-1, (2) соотношений пептидов друг с другом, (3) соотношений пептидов, которые связываются с сывороточным связывающим белком,относительно всей композиции RSP, (4) присутствия связывающих мотивов и пептидных последовательностей, (5) аминокислотного состава и соотношений аминокислот, и/или других характеристик пептидов. Характеристики выделенных пептидов Сор-1 из каждой партии можно сравнивать друг с другом. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ детекции композиции RSP, включающий:a) предоставление, по существу, чистого препарата одного или более улавливающих полипептидов;b) связывание одного или более улавливающих полипептидов со средством для количественной детекции композиции RSP;c) определение связывания композиции RSP с одним или более из указанных улавливающих полипептидов. 2. Способ детекции элементов в композиции RSP, включающий:a) предоставление, по существу, чистого препарата одного или более улавливающих полипептидов;b) связывание одного или более улавливающих полипептидов с твердой подложкой;c) приведение твердой подложки в контакт с композицией RSP;d) определение связывания отдельных элементов композиции RSP с твердой подложкой. 3. Способ по п.1 или 2, где один или более улавливающих полипептидов согласно (а) идентифицируют путем:ii) приведения в контакт указанной твердой подложки согласно (i) с содержащей белок биологической жидкостью;iii) идентификации белков согласно (ii), специфично связавшихся с твердой подложкой согласно (i); где белок, идентифицированный в (ii), представляет собой улавливающий полипептид. 4. Способ по любому из пп.1-3, где улавливающий полипептид выбран из компонента комплемента С 3, препробелка аполипопротеина A-I, препробелка аполипопротеина A-II (аполипопротеин D), компонента комплемента С 4 А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интеральфа-ингибитора трипсина (IHRP), альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина AIV, церулоплазмина, неименованного белкового продукта (локус/ доступа NCBI САА 34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа 2-HS-гликопротеина,предшественника аполипопротеина J, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HSгликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/ доступа NCBI САА 28659) и J-цепи Ig. 5. Способ определения присутствия композиции RSP, включающий стадии:a) связывания одного или более белков, выбранных из компонента комплемента С 3, препробелка аполипопротеина A-I, препробелка аполипопротеина A-II (аполипопротеин D), компонента комплемента С 4 А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интер-альфа-ингибитора трипсина (IHRP), альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина А-IV, церулоплазмина,неименованного белкового продукта (локус/ доступа NCBI CAA34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа 2-HS-гликопротеина, предшественника аполипопротеина J, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J,Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта(локус/ доступа NCBI CAA28659) и J-цепи Ig, со средством для количественной детекции указанной композиции RSP в образце; иb) определения уровня указанной композиции RSP в указанном образце. 6. Способ по п.1 или 2, где улавливающий полипептид выбран из компонента комплемента С 3, препробелка аполипопротеина A-I, препробелка аполипопротеина А-II (аполипопротеин D), компонента комплемента С 4 А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интер-альфаингибитора трипсина (IHRP), альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина А-IV,церулоплазмина, неименованного белкового продукта (локус/ доступа NCBI CAA34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа 2-HS-гликопротеина,предшественника аполипопротеина J, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HSгликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/ доступа NCBI CAA28659) и J-цепи Ig. 7. Способ детекции присутствия композиции RSP в биологическом образце, включающий:a) приведение в контакт биологического образца по меньшей мере с одним улавливающим полипептидом, содержащимся в нормальной сыворотке человека, нормальной сыворотке не являющегося человеком примата, нормальной сыворотке кролика, нормальной сыворотке мыши, нормальной сыворотке крысы, нормальной сыворотке хорька, нормальной сыворотке свиньи, нормальной сыворотке собаки, нормальной сыворотке лошади, нормальной сыворотке овцы, нормальной сыворотке коровы;b) детекцию наличия или отсутствия связывания улавливающего полипептида с композицией RSP,где наличие связывания указывает на присутствие композиции RSP в биологическом образце. 8. Способ по п.7, где улавливающий полипептид выбран из полипептида, содержащего по меньшей мере один компонент протеома ЛПВП, протеома ЛПНП или по меньшей мере один сывороточный белок. 9. Способ по п.7, где композиция RSP содержит пептиды YFAK. 10. Способ по п.7, где композиция RSP содержит пептиды YEAK. 11. Способ детекции присутствия композиции RSP, содержащей пептиды YFAK или YEAK, в биологическом образце, включающий:a) приведение в контакт биологического образца по меньшей мере с одним улавливающим полипептидом, содержащим пептид, выбранный из компонента комплемента С 3, препробелка аполипопротеина A-I, препробелка аполипопротеина A-II (аполипопротеин D), компонента комплемента С 4 А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интеральфа-ингибитора трипсина (IHRP),альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина А-IV, церулоплазмина, неименованного белкового продукта (локус/ доступа NCBI САА 34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа 2-HS-гликопротеина, предшественника аполипопротеинаJ, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur,гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/ доступа NCBI САА 28659) и J-цепи Ig; иb) детекцию наличия или отсутствия связывания улавливающего полипептида с композицией RSP,где наличие связывания указывает на присутствие пептидов YFAK или YEAK в биологическом образце. 12. Способ измерения количества композиции RSP, содержащей пептиды YFAK или YEAK, в биологическом образце, включающий: а) приведение в контакт биологического образца по меньшей мере с одним улавливающим полипептидом, содержащим пептид, выбранный из компонента комплемента С 3, препробелка аполипопротеина A-I, препробелка аполипопротеина A-II (аполипопротеин D), компонента комплемента С 4 А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интеральфа-ингибитора трипсина (IHRP),альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина А-IV, церулоплазмина, неименованного белкового продукта (локус/ доступа NCBI САА 34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа 2-HS-гликопротеина, предшественника аполипопротеинаJ, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur,гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/ доступа NCBI САА 28659) и J-цепи Ig;b) количественное определение уровня связывания улавливающего полипептида с композициейRSP; где уровень связывания указывает на количество композиции RSP в биологическом образце. 13. Способ определения биодоступности композиции RSP, содержащей пептиды YFAK или YEAK,у млекопитающего, включающий:a) введение млекопитающему дозы композиции, содержащей композицию RSP;b) взятие биологического образца от индивидуума;c) приведение в контакт биологического образца по меньшей мере с одним улавливающим полипептидом, содержащим пептид, выбранный из компонента комплемента С 3, препробелка аполипопротеина A-I, препробелка аполипопротеина А-II (аполипопротеин D), компонента комплемента С 4 А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интеральфа-ингибитора трипсина (IHRP),альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина А-IV, церулоплазмина, неименованного белкового продукта (локус/ доступа NCBI САА 34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа 2-HS-гликопротеина, предшественника аполипопротеинаJ, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur,гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/ доступа NCBI САА 28659) и J-цепи Ig; чем определяется биодоступность композиции RSP в биологическом образце. 14. Способ определения подходящей дозы композиции RSP, содержащей пептиды YFAK илиa) введение индивидууму дозы композиции RSP;b) взятие биологического образца от индивидуума;c) приведение в контакт биологического образца по меньшей мере с одним улавливающим полипептидом, содержащим пептид, выбранный из компонента комплемента С 3, препробелка аполипопротеина A-I, препробелка аполипопротеина А-II (аполипопротеин D), компонента комплемента С 4 А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интеральфа-ингибитора трипсина (IHRP),альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина А-IV, церулоплазмина, неименованного белкового продукта (локус/ доступа NCBI САА 34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа 2-HS-гликопротеина, предшественника аполипопротеинаJ, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur,гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/ доступа NCBI САА 28659) и J-цепи Ig;d) определение уровня улавливающего полипептида в биологическом образце;e) необязательно, повторение стадий (а)-(d) с использованием отличающейся дозы иf) сравнение уровней с заданным подходящим уровнем композиции RSP в биологическом образце; где подходящая доза представляет собой дозу, которая приводит к заданном подходящему уровню композиции RSP в биологическом образце. 15. Способ лечения или профилактики нежелательного иммунного ответа у индивидуума, включающий: а) введение индивидууму подходящей дозы композиции RSP, содержащей пептиды YFAK илиYEAK, где такую подходящую дозу определяют путем:(i) введения индивидууму дозы композиции RSP;(ii) взятия биологического образца от экспериментального индивидуума;(iii) приведения в контакт биологического образца по меньшей мере с одним улавливающим полипептидом, выбранным из компонента комплемента С 3, препробелка аполипопротеина A-I, препробелка аполипопротеина А-II (аполипопротеин D), компонента комплемента С 4 А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интер-альфа-ингибитора трипсина (IHRP), альфа-1-Вгликопротеина, альфа-1-антитрипсина, аполипопротеина А-IV, церулоплазмина, неименованного белкового продукта (локус/ доступа NCBI CAA34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа 2-HS-гликопротеина, предшественника аполипопротеина J, цепи С,иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидинбогатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/ доступа(iv) определения уровня улавливающего полипептида в биологическом образце;(v) необязательно, повторения стадий (i)-(iv) с использованием отличающейся дозы и(vi) сравнения уровня(ей) против заданного подходящего уровня композиции RSP в биологическом образце; где подходящая доза представляет собой дозу, которая приводит к заданному подходящему уровню композиции RSP в указанном биологическом образце. 16. Способ по любому из пп.11-15, где улавливающий полипептид является меченым. 17. Способ по любому из пп.11-15, где улавливающий полипептид связан с твердой подложкой. 18. Способ по любому из пп.11-15, дополнительно включающий выделение комплекса, содержащего улавливающий полипептид, связанный с композицией RSP. 19. Способ по любому из пп.11-15, дополнительно включающий детекцию связывания улавливающего полипептида с композицией RSP с антителами к улавливающему полипептиду. 20. Способ по любому из пп.11-15, где композицию вводят подкожно. 21. Композиция для детекции композиции RSP, содержащей пептиды YFAK или YEAK, в биологическом образце, содержащая по меньшей мере один улавливающий полипептид, содержащий пептид,выбранный из компонента комплемента С 3, препробелка аполипопротеина A-I, препробелка аполипопротеина A-II (аполипопротеин D), компонента комплемента С 4 А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интеральфа-ингибитора трипсина (IHRP), альфа-1-В-гликопротеина,альфа-1-антитрипсина, аполипопротеина A-IV, церулоплазмина, неименованного белкового продукта(локус/ доступа NCBI САА 34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа 2-HS-гликопротеина, предшественника аполипопротеина J, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig(холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/ доступа NCBI САА 28659) и J-цепи Ig. 22. Способ выделения пептидов из образца, включающего композицию RSP, содержащую пептидыYFAK или YEAK, включающий: а) приведение в контакт образца по меньшей мере с одним улавливающим полипептидом, содержащим пептид, выбранный из компонента комплемента С 3, препробелка аполипопротеина A-I, препробелка аполипопротеина А-II (аполипопротеин D), компонента комплемента С 4 А, ингибитора трипсина,связанного с тяжелой цепью белка семейства интер-альфа-ингибитора трипсина (IHRP), альфа-1-Вгликопротеина, альфа-1-антитрипсина, аполипопротеина A-IV, церулоплазмина, неименованного белкового продукта (локус/ доступа NCBI CAA34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа 2-HS-гликопротеина, предшественника аполипопротеина J, цепи С,иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидинбогатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/ доступаb) отделение пептидов, которые связываются с улавливающим полипептидом, от смеси. 23. Способ по п.22, где улавливающий полипептид иммобилизован на твердой подложке. 24. Способ по п.23, где улавливающий полипептид является меченным эпитопом. 25. Способ по п.22, дополнительно включающий отделение связавшихся пептидов от улавливающих полипептидов. 26. Способ по п.22, дополнительно включающий определение характеристик выделенных пептидов. 27. Способ по п.26, где определение характеристик включает определение аминокислотной последовательности связавшегося пептида или определение относительных соотношений аминокислот в связавшихся пептидах. 28. Способ идентификации биодоступных пептидов в композиции RSP, содержащей пептидыa) сначала введение композиции RSP индивидууму;b) затем после введения взятие образца ткани от пациента иc) идентификацию пептидов в образце, которые связываются по меньшей мере с одним улавливающим полипептидом, содержащим пептид, выбранный из компонента комплемента С 3, препробелка аполипопротеина A-I, препробелка аполипопротеина A-II (аполипопротеин D), компонента комплемента С 4 А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интеральфа-ингибитора трипсина (IHRP), альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина A-IV, церулоплазмина,неименованного белкового продукта (локус/ доступа NCBI САА 34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа 2-HS-гликопротеина, предшественника аполипопротеина J, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J,Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта(локус/ доступа NCBI САА 28659) и J-цепи Ig. 29. Способ получения композиции RSP, содержащей пептиды YFAK или YEAK, обладающей сниженной токсичностью, включающий: а) приведение в контакт композиции RSP по меньшей мере с одним улавливающим полипептидом,содержащим пептид, выбранный из компонента комплемента С 3, препробелка аполипопротеина A-I,препробелка аполипопротеина A-II (аполипопротеин D), компонента комплемента С 4 А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интер-альфа-ингибитора трипсина (IHRP), альфа 1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина А-IV, церулоплазмина, неименованного белкового продукта (локус/ доступа NCBI CAA34971), аполипопротеина Е, фактора комплемента В,преальбумина, аполипопротеина C-III, альфа 2-HS-гликопротеина, предшественника аполипопротеина J,цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин),V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/ доступа NCBI CAA28659) и J-цепи Ig;c) определение характеристик отделенных пептидов;d) получение набора пептидов с характеристиками отделенных пептидов. 30. Способ получения композиции RSP, содержащей пептиды YFAK или YEAK, обладающей усиленной эффективностью, включающий:a) приведение в контакт композиции RSP по меньшей мере с одним улавливающим полипептидом,содержащим пептид, выбранный из компонента комплемента С 3, препробелка аполипопротеина A-I,препробелка аполипопротеина A-II (аполипопротеин D), компонента комплемента С 4 А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интер-альфа-ингибитора трипсина (IHRP), альфа 1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина А-IV, церулоплазмина, неименованного белкового продукта (локус/ доступа NCBI CAA34971), аполипопротеина Е, фактора комплемента В,преальбумина, аполипопротеина C-III, альфа 2-HS-гликопротеина, предшественника аполипопротеина J,цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин),V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HS-гликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/ доступа NCBI CAA28659) и J-цепи Ig;c) определение характеристик отделенных пептидов;d) получение набора пептидов с характеристиками отделенных пептидов. 31. Способ лечения или профилактики нежелательного иммунного ответа у индивидуума, включающий:c) взятие биологического образца от испытуемого индивидуума;d) приведение в контакт биологического образца по меньшей мере с одним улавливающим поли- 28022399 пептидом, содержащим пептидную последовательность, выбранную из компонента комплемента С 3,препробелка аполипопротеина A-I, препробелка аполипопротеина А-II (аполипопротеин D), компонента комплемента С 4 А, ингибитора трипсина, связанного с тяжелой цепью белка семейства интеральфаингибитора трипсина (IHRP), альфа-1-В-гликопротеина, альфа-1-антитрипсина, аполипопротеина A-IV,церулоплазмина, неименованного белкового продукта (локус/ доступа NCBI САА 34971), аполипопротеина Е, фактора комплемента В, преальбумина, аполипопротеина C-III, альфа 2-HS-гликопротеина,предшественника аполипопротеина J, цепи С, иммуноглобулина М, легкой цепи лямбда иммуноглобулина, фактора свертывания II (тромбин), V-III каппа-цепи Ig (холодный агглютинин KAU), предшественника аполипопротеина J, Ig A1 Bur, гистидин-богатого предшественника гликопротеина, альфа-2-HSгликопротеина, предшественника изоформы а гельсолина, ингибитора протеазы типа Kunitz, неименованного белкового продукта (локус/ доступа NCBI САА 28659) и J-цепи Ig;f) определение характеристик отделенных пептидов;g) получение набора пептидов с характеристиками отделенных пептидов;h) введение нового набора пептидов индивидууму. 32. Способ по п.28 или 31, где пептиды вводят индивидууму более одного раза. 33. Способ по п.32, где пептиды вводят индивидууму с интервалами 1, 2, 3, 4, 6, 12, 18, 24, 36, 48 или 72 ч. 34. Способ сравнения различных препаратов композиции RSP, содержащей пептиды YFAK илиYEAK, включающий: а) приведение в контакт первой композиции и RSP по меньшей мере с одним улавливающим полипептидом, содержащимся в нормальной сыворотке человека, нормальной сыворотке не являющегося человеком примата, нормальной сыворотке кролика, нормальной сыворотке мыши, нормальной сыворотке крысы, нормальной сыворотке хорька, нормальной сыворотке свиньи, нормальной сыворотке собаки, нормальной сыворотке лошади, нормальной сыворотке овцы, нормальной сыворотке коровы; иb) приведение в контакт второй композиции RSP по меньшей мере с одним улавливающим полипептидом, содержащим пептид, выбранный из нормальной сыворотки человека, нормальной сыворотки не являющегося человеком примата, нормальной сыворотки кролика, нормальной сыворотки мыши,нормальной сыворотки крысы, нормальной сыворотки хорька, нормальной сыворотки свиньи, нормальной сыворотки собаки, нормальной сыворотки лошади, нормальной сыворотки овцы, нормальной сыворотки коровы;c) при необходимости повторение стадии (b);d) отделение пептидов, которые связываются с улавливающим полипептидом, от смесей стадий (ас);e) определение характеристик отделенных пептидов со стадии (d);f) сравнение указанного отделенного набора пептидов с характеристиками отделенных пептидов стадии (d).
МПК / Метки
МПК: G01N 33/53
Метки: эффективности, основанной, путем, дизайна, случайной, способы, улучшения, биодоступности, полимеров, сыворотке, композиций, последовательностью, детекции
Код ссылки
<a href="https://eas.patents.su/30-22399-sposoby-uluchsheniya-dizajjna-biodostupnosti-i-effektivnosti-kompozicijj-polimerov-so-sluchajjnojj-posledovatelnostyu-putem-osnovannojj-na-syvorotke-detekcii-kompozicijj-polimerov.html" rel="bookmark" title="База патентов Евразийского Союза">Способы улучшения дизайна, биодоступности и эффективности композиций полимеров со случайной последовательностью путем основанной на сыворотке детекции композиций полимеров со случайной последовательностью</a>
Предыдущий патент: Устройство для установки инструмента в скважинном трубном изделии
Следующий патент: Восстановление для повторного использования текучей среды для обслуживания скважин
Случайный патент: Лечение воспалительных состояний