Способ прогнозирования эффективности лекарственных соединений для пациента
Номер патента: 21945
Опубликовано: 30.10.2015
Авторы: Лазарь Владимир, Сория Жан-Шарль, Дюкрё Мишель, Турс Томас
Формула / Реферат
1. Способ прогнозирования относительной эффективности множества лекарственных средств при лечении рака у пациента, включающий
определение дерегулированных генов в опухолевом образце пациента путем
получения образца опухолевой ткани у пациента и нормального образца, который является нормальным гистологическим эквивалентом опухоли того же пациента, и
сравнения экспрессии генов, количества копий гена или мутаций в генах между опухолевым образцом и нормальным образцом и
определения генов, которые дифференциально экспрессируются в опухоли в сравнении с нормальным образцом, и/или генов с увеличенным или сниженным числом копий в опухоли в сравнении с нормальным образцом, и/или генов, у которых присутствуют мутации в опухолевом образце по сравнению с тем же геном из нормального образца;
предоставление базы данных, содержащей гены-мишени для каждого из множества лекарственных средств, где гены-мишени - это любые документированные гены, которые вовлечены в механизм действия лекарственного средства, которые вовлечены в метаболизм лекарственного средства, генная экспрессия которых модифицирована в присутствии лекарственного средства, которые связаны с устойчивостью к лекарственному средству или которые связаны с токсичностью лекарственного средства;
определение процента генов, которые дерегулированы в опухолевом образце, среди генов-мишеней для каждого из лекарственных средств из базы данных;
определение балльной оценки для каждого лекарственного средства, которое основано на проценте генов, которые дерегулированы в опухолевом образце, среди генов-мишеней для каждого лекарственного средства, при этом более высокая балльная оценка прогнозирует более высокую относительную эффективность лекарственного средства при лечении опухоли у пациента.
2. Способ по п.1, в котором стадия определения дерегулированных генов включает определение кратности изменения (F) для дифференциально экспрессируемых генов и/или для увеличения или снижения числа копий генов и, необязательно, включает стадию дополнительного определения интенсивности генной транскрипции (Int) для дифференциально экспрессируемых генов.
3. Способ по любому из пп.1, 2, в котором гены-мишени для каждого лекарственного средства группируются в базе данных на основные гены-мишени (СМ), минорные гены-мишени (Cm) и гены устойчивости (CR).
4. Способ по любому из пп.1-3, в котором балльная оценка (W) для конкретного лекарственного средства определяется следующим алгоритмом:
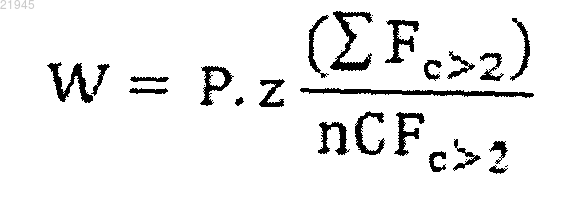
где Р является процентом генов-мишеней для конкретного лекарственного средства, которые дерегулированы в опухоли пациента;
z - коэффициентом, связанным с наличием мутации в гене-мишени конкретного лекарственного средства, где z равен 1, если мутации нет, и находится в диапазоне от 10 до 1000, если мутация есть;
Fc>2 - кратностью изменения каждого дерегулированного гена-мишени для конкретного лекарственного средства, если кратность изменения больше чем 2;
nCFc>2 - числом генов-мишеней для конкретного лекарственного средства, имеющих кратность изменения больше чем 2.
5. Способ по п.4, в котором Fc>2 является кратностью изменения для каждого сверхэкспрессированого гена-мишени для конкретного лекарственного средства, a nCFc>2 является количеством генов-мишеней для конкретного лекарственного средства, предпочтительно количеством сверхэкспрессированных генов-мишеней для конкретного лекарственного средства.
6. Способ по любому из пп.1-4, в котором балльная оценка (W) для конкретного лекарственного средства определяется следующим алгоритмом:

где Р является процентом генов-мишеней для конкретного лекарственного средства, которые дерегулированы в опухоли пациента;
СМ - это основные гены-мишени для конкретного лекарственного средства;
Cm - это минорные гены-мишени для конкретного лекарственного средства;
CR - это гены устойчивости для конкретного лекарственного средства;
n1CM, n2Cm и n3CR являются количеством дерегулированных генов-мишеней с порогом, равным по меньшей мере 2 или больше чем 2, для основных генов-мишеней, минорных генов-мишеней и генов устойчивости соответственно;
FCM, FCm и FCR являются кратностью изменения каждого гена, которое выше порога, равного по меньшей мере 2 или больше чем 2, для основных генов-мишеней, минорных генов-мишеней и генов устойчивости соответственно;
q1, q2 и q3 являются необязательными коэффициентами для основных генов-мишеней, минорных генов-мишеней и генов устойчивости соответственно, где коэффициенты для генов-мишеней могут находиться в диапазоне от 10 до 1000 для основных генов-мишеней (q1), от 0,1 до 10 для минорных генов-мишеней (q2) и от 10 до 1000 для генов устойчивости (q3);
z1, z2 и z3 являются коэффициентами, связанными с наличием мутации в основном гене-мишени, минорном гене-мишени и гене устойчивости соответственно, где z1, z2 и z3 равны 1, если мутаций нет, и в зависимости от функционального воздействия мутации могут находиться в диапазоне от 10 до 1000.
7. Способ по любому из пп.1-3, в котором балльная оценка (W) для конкретного лекарственного средства определяется следующим алгоритмом:
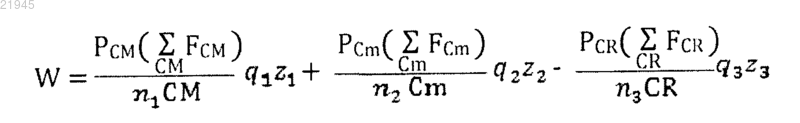
где значение CM, Cm, CR, FCM, FCm, FCR, q1, q2, q3, z1, z2 и z3 являются такими же, как и выше, а РСМ, PCm и PCR являются процентами генов-мишеней для конкретного лекарственного средства, которые дерегулированы в опухоли индивидуума для основных генов-мишеней, минорных генов-мишеней и генов устойчивости соответственно.
8. Способ по любому из пп.1-3, в котором балльная оценка (W) для конкретного лекарственного средства определяется одним из следующих алгоритмов:

или
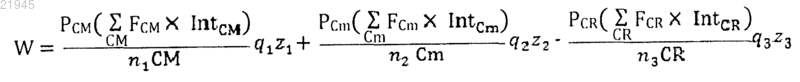
где значения CM, Cm, CR, FCm, FCm, FCR, q1, q2, q3, z1, z2 и z3 и, если присутствуют, РСМ, PCm и PCR такие же, что и выше, a IntCM, IntCm и IntCR являются интенсивностями генной транскрипции для основных генов-мишеней, минорных генов-мишеней и генов устойчивости соответственно.
9. Способ по любому из пп.1-3, в котором балльная оценка (W) для конкретного лекарственного средства определяется одним из следующих алгоритмов:

где значения CM, CR, FCM, FCR, q1, q3, z1 и z3 и, в случае их присутствия, РСМ, PCR, IntCM и IntCR такие же, что и определенные выше.
10. Способ по любому из пп.6-9, где Fcm, FCm и FCR являются кратностью изменения каждого сверхэкспрессированного гена-мишени для конкретного лекарственного средства с порогом, равным по меньшей мере 2 или больше чем 2, а n1CM, n2Cm и n3CR являются количеством генов-мишеней для конкретного лекарственного средства с порогом, равным по меньшей мере 2 или больше чем 2, предпочтительно количеством сверхэкспрессированных генов-мишеней для конкретного лекарственного средства с порогом, равным по меньшей мере 2 или больше чем 2.
Текст
СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ЛЕКАРСТВЕННЫХ СОЕДИНЕНИЙ ДЛЯ ПАЦИЕНТА Настоящее изобретение касается способа прогнозирования относительной эффективности множества лекарственных соединений при лечении опухоли у индивидуума, который включает описание молекулярных характеристик опухоли и расчет балльной оценки для множества лекарственных средств, преимущественно основанном на проценте дерегулированных геновмишеней.(71)(73) Заявитель и патентовладелец: УОРЛДУАЙД ИНОВЕЙТИВ НЕТУОРК (FR) Область техники Настоящее изобретение относится к области медицины, конкретнее, относится к области персонализированной медицины при терапии злокачественных новообразований. Предшествующий уровень техники Лечение пациентов со злокачественными новообразованиями, как правило, основано на хирургии,радиотерапии и химиотерапии, которые применяют в соответствии со стандартными протоколами. Излечивающее оперативное вмешательство заключается в удалении всей опухолевой массы. Однако даже после отсечения наблюдаемой части опухоли опытными хирургами не всегда возможно гарантировать отсутствие остаточных явлений заболевания. Поэтому хирургию, как правило, применяют в комбинации с радиотерапией и/или химиотерапией. Химиотерапия и/или радиотерапия могут быть применены в качестве неоадъювантной терапии или вспомогательной или адъювантной терапии, или отдельно, когда хирургическое вмешательство является невозможным. Неоадъювантную терапию, как правило, применяют, когда опухолевая масса слишком значительная и требует уменьшения перед хирургическим вмешательством. Вспомогательную или адъювантную химиотерапию применяют для лечения остаточных явлений опухолевых заболеваний и для ограничения локальных рецидивов или метастатических обострений. При обнаружении опухоли в неоперабельной стадии лечение основано только на химиотерапии и/или радиотерапии. В данном контексте хирургию применяют незначительно, и она имеет паллиативные цели. В любом случае выбор химиотерапии всегда приводит к следующим вопросам: какое лекарство или комбинация лекарств применимы к данному типу злокачественного новообразования Что является наиболее применимой терапевтической стратегией для данного пациента Какие шансы наблюдать терапевтический эффект с выбранными лекарственными средствами Текущая медицинская практика заключается в лечении пациентов в соответствии с существующими терапевтическими протоколами. В большинстве случаев выбор терапевтического протокола основан на анатомо-патологических и клинических данных. Эти протоколы применяют в первой, второй и даже третьей терапевтической линии. В случае терапевтической неудачи или при метастатических стадиях некоторых пациентов включают в клинические исследования, в которых, как правило, применяют широкие критерии отбора, определяемые главным образом, локализацией первичной опухоли, развитием заболевания, ситуацией с жизненными функциями пациента и некоторыми конкретными противопоказаниями лекарственного препарата в условиях исследования. Вне зависимости от терапевтического подхода (стандартного или клинического исследования) только часть обработанной популяции получает пользу от лечения, тогда как оставшаяся часть пациентов не реагирует на лечение и демонстрирует прогрессию заболевания даже в процессе лечения. Для улучшения данной ситуации в течение многих лет врачи и исследователи пытаются идентифицировать маркеры для прогнозирования эффективности лечения конкретного пациента и для адаптации лечения для каждого пациента. Таким образом, концепция персонализированной медицины заключается в адаптации выбора метода лечения в соответствии с анатомо-патологическими, клиническими характеристиками, но особенно в соответствии с биологическими характеристиками опухоли. Известны несколько примеров, которые не дают эффективного решения для любого пациента со злокачественным новообразованием. Первый подход, который назвали "тест-компаньон" анализ, впервые применили для трастузумаба(Herceptin), моноклонального антитела, направленно воздействующего на рецептор HER2/Neu. При раках молочной железы данное лекарственное средство вводят только, если наблюдается амплификация/сверхэкспрессия данного рецептора. Однако такая сверхэкспрессия не гарантирует терапевтического ответа. Некоторые устойчивости к Herceptin могут быть объяснены активацией, например, сигнального пути Akt. Объединение с ингибитором mTOR (направленно воздействующего на сигнальный путь Akt) может восстановить чувствительность к Herceptin. Тем не менее, у некоторых пациентов терапевтический эффект наблюдали в отсутствие амплификации рецептора. Измерение уровня экспрессии рецептора HER2 является первым примером теста-компаньона, и большая часть фармацевтических компаний или исследователей пытаются воспроизвести эту модель,которую считают первым примером персонализированной медицины. Для иллюстрации концепции отбора пациентов, которые могут получить пользу от конкретного лекарственного средства, уместны следующие примеры: мутация или амплификация рецептора EGFR и эрлотиниб (erlotinib)/гефитиниб (gefitinib); мутации c-Kit/PDGFRa и иматиниб (imatinib); транслокация Bcr-Abl и иматиниб; амплификация HER2 и ингибиторы HER2; амплификация ТОР 2 А и антрациклины; делеция PTEN и ингибиторы mTOR; амплификация FGFR1 и ингибиторы FGFR1; лечение ERCC1-отрицательных опухолей и соли платины; мутации RAS и лечение рака толстой кишки и т.д. В случае рака молочной железы доступны прогностические молекулярные признаки, такие как в тесте Mamaprint (разработанный компанией "Agendia") или OncotypeDX (компания "Genomic Health"). Эти характерные признаки применяют для определения необходимости вспомогательной химиотерапии. И хотя эти тесты дают возможность определить потребность во вспомогательной терапии, они не дают возможности выбора оптимальной терапии. Одним словом, концепция персонализированной медицины является отбором пациентов по биологическим критериям для увеличения шансов ответа на конкретную терапию. На данный момент тестыкомпаньоны либо применяют при лечении таргетными терапиями, либо они дают возможность отобрать пациентов, которые вероятно получат пользу от конкретной терапии, но не дают возможность выбрать наилучшую терапию для конкретного пациента. Эта основная концептуальная разница, в которой заключается основной интерес настоящего изобретения по сравнению с другими маркерами, предложенными к настоящему времени. Аномально сильные амплитуды количества копий генов (амплификации или делеции) модифицируют уровни экспрессии генов. Этот механизм геномной дерегуляции вовлечен в отногенез многих типов злокачественных новообразований. Амплификации гена EGFR обнаруживаются примерно в 30% раков легкого. При такой патологии ингибирование амплифицированного EGFR связано со значительной пользой. Подобным образом, MYCN амплифицирован примерно в 25% нейробластом, и в нескольких исследованиях показано прогностическое значение этой аномалии при данной патологии. Другие онкогены/антионкогены (опухолевые супрессоры) часто амплифицируются/делетируются в других типах опухолей, например, такие как HER, PTEN, PUTS и т.п. При раке молочной железы показана значительная частота хромосомных аберраций. Ген HER2(ErbB2) амплифицирован в 10-20% случаев. Эта амплификация связана с гиперэкспрессией белка HER2 и вовлечена в опухолевую трансформацию. Терапевтическая стратегия, основанная на направленном воздействии на эту аномалию, оказалось полезной для пациентов с положительным по HER2 раком молочной железы. Кроме того, примерно в 7% случаев рака молочной железы амплифицирован ген, кодирующий топоизомеразу II. Эта амплификация коррелирует с хорошей чувствительностью к антрациклинам, классу лекарственных средств, направленно воздействующих на топоизомеразу II. При раке молочной железы часто наблюдаются другие аномалии. Ген А 1 В 1 амплифицирован в 10% случаев и приводит к онтогенезу через активацию AKT посредством IGFR. Ген FGF1R амплифицирован в 10% случаев. Направленное воздействие на этот белок ингибитором тирозинкиназ приводит in vitro к уменьшению размножения клеток. Подобным образом, амплификации генов EGFR, IGF1R или делеции PTEN могут быть обработаны молекулами, направленно воздействующими на EGFR, IGF1R или mTOR соответственно. В научной литературе в некоторых работах, среди которых работы A. Potti et al., предлагается прогнозировать эффективность лекарственных средств, главным образом цитотоксичность, на основе анализа экспрессии генов, выбранных из экспериментов на традиционных клеточных линиях (панель NCI60). Эти данные позволяют идентифицировать профили экспрессии, связанные с ответом на каждую протестированную молекулу и этот прогноз переносится на человеческие опухоли. Однако если этот подход дает молекулу посредством молекулярного прогноза, он не дает возможность сравнить эффективность каждой молекулы для конкретного пациента для выбора лучшего лекарственного средства. Кроме того,специалисту в данной области известны ограничения in vitro модели для осуществления in vivo прогнозов. Эти подходы стремятся обогатить когорту пациентов для конкретной химиотерапии, а не выбрать целевую индивидуальную терапию для конкретного пациента на основании внутренних характеристик опухоли. Однако выбор подходящей химиотерапии при лечении злокачественных заболеваний является животрепещущей проблемой. Действительно, большинство химиотерапии имеет значимые побочные эффекты и ошибочный выбор (т.е. лечение без какого-либо терапевтического эффекта) может привести к прогрессии злокачественного заболевания. До сегодняшнего дня не существовало эффективных маркеров для выбора наиболее оптимальной терапевтической стратегии для конкретного индивидуума со злокачественным новообразованием. Поэтому в области лечения злокачественных новообразований существует острая потребность в способах персонализированной медицины, позволяющих выбрать для конкретного индивидуума наиболее подходящие стратегии химиотерапии. Сущность изобретения Настоящее изобретение касается способа прогнозирования относительной эффективности множества лекарственных средств при лечении у пациента злокачественного новообразования, включающего описание характеристик молекулярных аномалий в образце опухоли или метастаза у пациента в сравнении с нормальным образцом у того же пациента с определением посредством этого генов, дерегулированных в опухоли; предоставление базы данных, содержащей гены-мишени для каждого из множества лекарственных средств; определение балльной оценки для каждого из множества лекарственных средств, которое преимущественно основано на проценте дерегулированных генов среди генов-мишеней для каждого лекарственного средства в опухолевом образце у пациента, при этом более высокая балльная оценка прогнозирует более высокую относительную эффективность лекарственного средства при обработке опухоли у пациента. Предпочтительно, если нормальный образец является нормальным гистологическим эквивалентом первичной опухоли. В частности, стадия описания характеристик молекулярных аномалий опухолевого образца включает определение генов, которые дифференциально экспрессируются в опухоли в сравнении с нормальным образцом, и/или включает определение увеличения или снижения числа копий генов, и/или включает определение наличия мутаций в гене. Предпочтительно, если стадия описания характеристик молекулярных аномалий опухолевого образца включает определение кратного изменения (F) для дифференциально экспрессируемых генов и/или включает определение увеличения или снижения числа копий генов и, необязательно, включает стадию дополнительного определения интенсивности генной транскрипции(Int) для дифференциально экспрессируемых генов. Предпочтительно, если гены-мишени для каждого лекарственного средства группируются в базе данных на основные гены-мишени (МС), минорные гены-мишени (Мс) и гены устойчивости (CR). В первом воплощении балл (W) для конкретного лекарственного средства определяют по одному из следующих алгоритмов: где W является балльной оценкой для конкретного лекарственного средства; Р - процентом дерегулированных в опухоли пациента генов-мишеней для конкретного лекарственного средства;Fc2 - кратным изменением каждого дерегулированного гена-мишени для конкретного лекарственного средства с кратным изменением больше 2;nCFc2 относится к числу генов-мишеней для конкретного лекарственного средства с кратным изменением больше 2. Предпочтительно, если Fc2 является кратным изменением для каждого сверхэкспрессированого гена-мишени для конкретного лекарственного средства с кратным изменением больше 2, а nCFc2 является либо количеством генов-мишеней для конкретного лекарственного средства с кратным изменением больше 2, либо количеством сверхэкспрессированных генов-мишеней для конкретного лекарственного средства с кратным изменением больше 2. Во втором воплощении балл (W) для конкретного лекарственного средства определяют по следующему алгоритму: где W является балльной оценкой для конкретного лекарственного средства; Р является процентом дерегулированных в опухоли пациента генов-мишеней для конкретного лекарственного средства;является суммой; СМ относится к основным генам-мишеням для конкретного лекарственного средства;Cm относится к минорным генам-мишеням для конкретного лекарственного средства;CR относится к генам устойчивости для конкретного лекарственного средства;n1CM, n2Cm и n3CR являются количеством дерегулированных генов-мишеней с определенным порогом для основных генов-мишеней, минорных генов-мишеней и генов устойчивости соответственно;FCM, FCm и FCR являются кратными изменениями каждого гена, которые выше определенного порога для основных генов-мишеней, минорных генов-мишеней и генов устойчивости соответственно;q1, q2 и q3 являются коэффициентами умножения для основных генов-мишеней, минорных геновмишеней и генов устойчивости соответственно;z1, z2 и z3 являются необязательными коэффициентами умножения, связанными с наличием мутации в основном гене-мишени, минорном гене-мишени и гене устойчивости соответственно. В третьем воплощении балл (W) для конкретного лекарственного средства определяют по следующему алгоритму: где значение W, , CM, Cm, CR, FCM, FCm, FCR, q1, q2, q3, z1, z2 и z3 являются такими же, как и в предшествующем алгоритме, а РСМ, PCm и PCR являются процентами дерегулированных в опухоли индивидуума генов для конкретного лекарственного средства для основных генов-мишеней, минорных генов-мишеней и генов устойчивости соответственно. В четвертом воплощении балл (W) для конкретного лекарственного средства определяют по одному из следующих алгоритмов: где значения W, , CM, Cm, CR, FCM, FCm, FCR, q1, q2, q3, z1 z2 и z3, и если присутствуют РСМ, PCm и PCR,такие же, что и в предшествующем алгоритме, a IntCM, IntCm и IntCR являются интенсивностями для основных генов-мишеней, минорных генов-мишеней и генов устойчивости соответственно. В пятом воплощении балл (W) для конкретного лекарственного средства определяют по одному из следующих алгоритмов: где значения W, , CM, CR, FCM, FCR, q1, q3, Z1 и Z3 и в случае их присутствия РСМ, PCR, IntCM и IntCR такие же, что и в предшествующих алгоритмах. Предпочтительно, если в воплощении со второго по пятое FCM, FCm и FCR являются кратным изменением каждого сверхэкспрессированного гена-мишени для конкретного лекарственного средства с определенным порогом, a n1CM, n2Cm и n3CR являются либо количеством генов-мишеней для конкретного лекарственного средства с определенным порогом, либо количеством сверхэкспрессированных геновмишеней для конкретного лекарственного средства с определенным порогом. Более предпочтительно,если определенный порог является кратным изменением, равным по меньшей мере 2 или больше чем 2. Кроме того, в воплощении со второго по пятое коэффициенты умножения для генов-мишеней могут находиться в диапазоне от 10 до 1000 для основных генов-мишеней (q1), от 0,1 до 10 для минорных генов-мишеней (q2) и от 10 до 1000 для генов устойчивости (q3). Более того, в воплощении со второго по пятое связанные с мутацией коэффициенты умножения z1,z2 и z3 равны 1, если мутаций нет, и в зависимости от функционального воздействия мутации могут находиться в диапазоне от 10 до 1000. Краткое описание чертежей Фиг. 1 - томограмма грудной полости пациента из примера 1 в октябре 2005 г. Фиг. 2 - томограмма грудной полости пациента из примера 1 в ноябре 2008 г. Фиг. 3 - томограмма грудной полости пациента из примера 1 в апреле 2009 г. Фиг. 4 - томограмма грудной полости пациента из примера 1 в июле 2009 г. Фиг. 5 - томограммы грудной полости пациента из примера 3 в январе и марте 2010 г. Подробное описание изобретения В настоящем изобретении предлагается новая концепция отбора наиболее соответствующей терапии на индивидуальном уровне. Отбор лекарственного соединения основан на биологических характеристиках опухоли подвергаемого лечению индивидуума в сравнении с нормальным образцом того же индивидуума. На основании балльной оценки, преимущественно базирующейся на проценте дерегулированных генов-мишеней или микроРНК для каждого лекарственного средства, относительная эффективность лекарственного средства может быть спрогнозирована для лечения конкретной опухоли у индивидуума. Общая концепция Общая концепция находится на уровне выбора оптимальной терапевтической стратегии, которая применяется в задаче настоящего изобретения. Для отбора наиболее подходящей терапевтической стратегии в способе настоящего изобретения принимаются во внимание, с одной стороны, совокупность биологических данных подвергаемой обработке опухоли, а с другой стороны, принимается во внимание множество лекарственных средств, предпочтительно все существующие лекарственные средства (либо зарегистрированные, либо находящиеся в разработке). Балльная оценка определяется для каждого лекарственного средства на основании биологических характеристик конкретной подвергаемой обработке опухоли у конкретного объекта. Эта балльная оценка дает возможность расположить различные лекарственные средства в порядке уменьшения их потенциальной эффективности. Врач может применить эти балльные оценки для выбора оптимального лекарственного средства или для выбора комбинации лекарственных средств для конкретного объекта. Этот подход, позволяющий связать каждое лекарственное средство с балльной оценкой в зависимости от биологических характеристик опухоли, составляет основу этого изобретения. Следовательно, данное изобретение, скорее всего, соответствует существующим потребностям персонализированной медицины. Способ может быть применен как для зарегистрированных лекарственных средств, так и для разрабатываемых лекарственных средств (например, с временным разрешением на применение или находящихся на этапе клинических исследований). Эта концепция, таким образом, заключается в рассмотрении выбора терапии пациента на индивидуальном уровне в зависимости от внутренних характеристик его опухоли, а не в зависимости от глобальных результатов, полученных на большой группе индивидуумов. Настоящее изобретение основано на комбинации трех фундаментальных элементов, детально описанных ниже, которые были объединены вместе для оптимизации выбора стратегии для каждого индивидуума со злокачественным новообразованием. Первый элемент соответствует анализу, настолько полному, насколько это возможно, биологических или генных аномалий (амплификаций, делеций, мутаций, генной экспрессии, экспрессии микроРНК и т.п.), который характеризует конкретную опухоль в индивидууме. Второй элемент заключается в идентификации генов, для которых известна связь с лекарственным средством. Третий элемент соответствует установлению связи между каждым лекарственным средством и аномалиями, которые обнаружены в опухоли подвергаемого лечению индивидуума. Алгоритм был определен для расчета балльной оценки каждого лекарственного средства, принимая во внимание опухолевые характеристики и гены с известной связью с лекарственным средством. Способ изобретения позволит проводить выбор терапии, поскольку доступные лекарственные средства будут выстроены на основе их балльных оценок, которые отражают их потенциальную терапевтическую эффективность в случае конкретной опухоли у индивидуума. Одно преимущество настоящего способа заключается в том, что относительная эффективность множества лекарственных средств может быть спрогнозирована для индивидуума без экспонирования индивидуума лекарственным средствам. Под множеством лекарственных средств понимается по меньшей мере около 10, 20, 30, 40, 50 или 100 различных лекарственных соединений. Действительно, если для лечения доступна панель лекарственных средств, невозможно предусмотреть лечение пациента каждым лекарственным средством. Настоящий способ позволяет рассмотреть все потенциальные терапевтические стратегии и отобрать наиболее подходящие для пациента. Действительно, балльные оценки для множества лекарственных средств делают возможным определение относительной эффективности множества лекарственных средств при обработке опухоли в рассматриваемом индивидууме. Действительно, лекарственное средство, имеющее более высокую балльную оценку, чем другое лекарственное средство, по прогнозу имеет более высокую эффективность при лечении опухоли. Под лечением подразумевается, что лекарственное средство позволяет остановить или снизить рост опухоли и/или уменьшить размер опухоли даже вплоть до ее полного исчезновения. Под лечением также подразумевается возможность избежать метастазирования, рецидива или обострения заболевания. Другое преимущество заключается в том, что способ не зависит от типа злокачественного новооб-5 021945 разования. Способ изобретения также может быть применен для любого типа злокачественного новообразования, включая гематологическую опухоль (например, лейкоз, лимфому), злокачественные новообразования мочевого пузыря, молочной железы, желудка, щитовидной железы, простаты, яичка, печени,поджелудочной железы, кости, поджелудочной железы, почки, эндометрия, меланому, злокачественные новообразования легкого, ободочной и прямой кишки, предстательной железы, головы и шеи, мозга,нейробластому и злокачественные новообразования яичников. В предпочтительном воплощении пациентом или индивидуумом является человек. Описание характеристик опухолей Описание характеристик опухолей соответствует анализу, настолько полному, насколько это возможно, биологических или генных аномалий (амплификаций, делеций, мутаций, генной экспрессии, экспрессии микроРНК и т.п.), который характеризует конкретную опухоль у индивидуума. В частности,аномалии определяются в опухоли пациента при сравнении с нормальной тканью того же пациента. Предпочтительно, если опухолевый образец и образец нормальной ткани получены из одного типа ткани. Для описания характеристик опухоли доступны и могут быть объединены несколько технологий. Первой технологией является генный анализ. Этот анализ может быть проведен с помощью CGH(сравнительной геномной гибридизации, англ. Comparative Genomic Hybridization), которая позволяет сравнить опухолевую ДНК с нормальной ДНК одного и того же индивидуума для обнаружения хромосомных аберраций, т.е. хромосомных утрат и приобретений. Эта технология хорошо известна специалистам в данной области. Для иллюстрации этих данных могут быть процитированы следующие обзоры или справочные материалы: Davies et al. (2005, Chromosome Research, 13, 237-248). Эта технология также может помочь при идентификации транслокаций. Она может быть легко применена на замороженных биопсиях или опухолевом материале в парафине. Результаты CGH выражены как соотношения количества копий в опухолевом материале и в нормальной ткани. Порог 0,5 признается как описывающий приобретение или утрату. Чем больше это соотношение, тем более значительна амплитуда аномалии. Таким образом, значительная аномалия, вероятно, оказывает реальное воздействие на биологическом уровне. Однако хромосомные аберрации представляют собой только незначительную часть источников дерегуляции генной экспрессии. По этой причине необходимы другие технологии. CGH имеет другое преимущество, которое заключается в подтверждении наличия опухолевых образцов в опухолевой биопсии или биопрепарате, всякий раз когда была обнаружена аберрация. Второй технологией, предоставляющей возможность осуществления функционального геномного анализа, является измерение мРНК и микроРНК. Определение изменения уровней экспрессии этих РНК проводят путем сравнения уровней экспрессии в опухолевой ткани и в соответствующей нормальной ткани. Например, в случае аденокарциномы толстой кишки, соответствующей нормальной тканью является нормальная ткань слизистой толстой кишки. Анализ экспрессии генов позволяет исследовать независимые дерегуляции или дерегуляции из-за хромосомных аберраций. Действительно, регуляция трансформированной активности генов является сложной и включает множество уровней регуляции: транс/цис-транскрипционные факторы, промоторы, регуляцию хроматина и т.п. В целом, все дерегуляции (сверхэкспрессии или недостаточные экспрессии) рассматриваются при соотношении опухолевая/нормальная, равном по меньшей мере 2. Этот порог, называемый "кратное изменение" может, таким образом, иметь положительное значение 2 и отрицательное значение-2. Такая концепция применяется и для микроРНК, которые играют важную роль в посттранскрипционной регуляции генов и, следовательно, для экспрессии белков. Технологии, которые могут быть использованы, включают нозернанализ, мРНК- или кДНК-микроэрреи, ОТ-ПЦР (в частности, количественный ОТ-ПЦР) и т.п. Уровень транскрипции может быть определен на уровне мРНК или на уровне кодируемого белка. Экспрессия белков может быть оценена вестерн-блоттингом, иммуноанализом, инструментами протеомики или масс-спектрометрией. Эти два типа анализа, CGH и определение экспрессии РНК могут быть дополнены анализом мутационного статуса генов. Действительно, наличие мутации, ведущей к приобретению или утрате функции,оказывает значительное воздействие на биологию опухоли без постоянной связи с изменениями генной экспрессии или количеством копий генов. Известно множество мутаций, которые имеют прямой эффект на активность лечения путем индукции повышенных чувствительностей или устойчивостей. Например,мутации в домене тирозинкиназы EGFR часто связаны с чувствительностью к малым молекулам, ингибирующим EGFR, мутации в гене KRAS связаны с устойчивостью к лечению моноклональными антителами, направленно воздействующими на EGFR. В дополнение к мутационному статусу также можно определить несколько SNP. Действительно, SNP также могут быть связаны с приобретением или утратой функции, устойчивостью или токсичностью лекарственного средства. Мутационный статус может быть определен любым способом, известным в данной области, например секвенированием, микросеквенированием или гибридизацией. Одним словом, высокопроизводительные геномные технологии могут быть применены для описания наиболее исчерпывающим возможным способом характеристик биологических аномалий конкретной опухоли из подвергаемого лечению индивидуума. Экспериментальные данные для каждой опухоли накапливают в основные файлы, используемые в применении алгоритмов, которые позволяют рассчи-6 021945 тать балльную оценку для каждого лекарственного средства. Эти файлы содержат количество копий генов, мутации кратные изменения интенсивностей сигналов (пропорциональны количеству транскриптов или количеству копий генов) для нормальной ткани (интенсивность I или I1) и для опухолевой ткани(интенсивность 2 или 12). Функциональный геномный анализ делает возможным одновременное измерение 44000 или большего количества (например, 244000) последовательностей РНК, покрывающих весь геном. Предпочтительно применение фильтрации для сохранения только тех зондов, которые имеют соотношения или кратные изменения больше или меньше чем 2 и чьи средние интенсивности I1 и I2 больше 100 единиц флюоресценции (относительные единицы). Термин "молекулярные аномалии" относится в данном документе к расхождениям в генной экспрессии (любой из экспрессий мРНК, микроРНК или белка) из-за увеличения или снижения числа копий генов или из-за наличия мутаций. В конкретном воплощении изобретения исчерпывающее описание характеристик опухоли замещается описанием характеристик генов-мишеней из базы данных лекарственных средств. В этом воплощении конкретный эррей может быть приготовлен для определения уровня генной экспрессии всех геновмишеней базы данных. База данных лекарственных средств Для способа изобретения необходимо обеспечить базу данных с перечнем генов-мишеней для каждого лекарственного средства в базе данных. Как объяснено выше, ген-мишень для лекарственного средства может быть, без ограничения, любым документированным геном, который вовлечен в механизм действия лекарственного средства, который вовлечен в метаболизм лекарственного средства, генная экспрессия которого модифицирована в присутствии лекарственного средства, который связан с устойчивостью к лекарственному средству и который связан с токсичностью лекарственного средства. База данных может быть получена на основе поиска в публичных базах данных (таких как "CTD", "DrugBank", "PubMed" и т.п.) для идентификации генов, связанных с каждым лекарственным средством. Например, база данных может быть построена на основе данных "CTD" (базы данных сравнительной токсикогеномики,англ. Comparative Toxicogenomics Database, http://ctd.mdibl.org/) для поиска лекарственных средств и их молекулярных мишеней (генов), ограниченных человеком (ID 9606). Эти данные могут быть совмещены с информацией о генах из "LocusLink" (символ гена, RefSeq NM, описание гена). И наконец, каждое взаимодействие лекарственное средство/ген в базе данных может быть определено из доступных публикаций для определения типа взаимодействий: некоторые положительные взаимодействия (мишень, чувствительность, активатор лекарственного средства, переносчик лекарственного средства, переключатель токсичности), некоторые отрицательные взаимодействия (устойчивость, токсичность, метаболизм лекарственного средства, апоптоз, смерть). Идентифицированные гены могут иметь различные роли и значимость. Следовательно, в предпочтительном воплощении гены-мишени группируются в трех категориях: основные гены-мишени, минорные гены-мишени и гены устойчивости. Идентификация этих генов из публичных данных (публичные банки литературы и данных) и их группировка по трем категориям образуют интегральную часть этого изобретения. Основными генами-мишенями являются те, для которых было продемонстрировано наличие явной причинно-следственной связи с механизмом действия лекарственного средства. Например, генHER2 рассматривается как основной ген-мишень для трастузумаба, ген VEGFA рассматривается как основной ген-мишень для бевацизумаба и т.д. Конкретное лекарственное средство может иметь один или несколько основных генов-мишеней. Эта категория также включает гены с признанным участием в метаболизме лекарственного средства, когда известно, что лекарственные средства становятся активными только при образовании активного метаболита. Минорными генами-мишенями являются те, для которых обнаружена модификация уровня их регуляции в присутствии лекарственного средства, без прямой связи с механизмом действия лекарственного средства. Гены устойчивости включают гены, известные индукцией прямой устойчивости к лекарственному средству, а также гены, связанные с основной токсичностью. Например, ген ERCC1 является геном-мишенью устойчивости при применении солей платины. Например, некоторые изоформы цитохрома Р 450 связаны с основной токсичностью. В конкретном воплощении изобретения рассматриваемые гены-мишени могут принадлежать только к двум следующим категориям: основным генам-мишеням и генам устойчивости. Первая база данных лекарственных средств была создана авторами и раскрыта в табл. 1. Для некоторых лекарственных средств гены-мишени были сгруппированы по категориям. База данных лекарственных средств может расти с течением времени, посредством распределения лекарственных средств по категориям, и/или путем добавления новых лекарственных средств, новых генов-мишеней, и/или путем включения комбинированных данных (например, комбинаций лекарственных средств с радиотерапией или комбинаций лекарственных средств). Чем более полной является база данных лекарственных средств, тем более точным является прогноз. Однако способ прогнозирования относительной эффективности лекарственных средств может быть осуществлен только при готовности предварительной базы данных. Алгоритм Алгоритм был определен для расчета балльной оценки каждого лекарственного средства, принимая во внимание опухолевые характеристики и гены с известной связью с лекарственным средством. Этот расчет может быть проведен конкретным программным обеспечением путем применения скриптов, разработанных, например, в среде R и позволяющих определить частоты и ассоциирующие связи между файлом генов-мишеней для лекарственного средства и файлом, интегрирующим данные геномного анализа, которые получены биологическим исследованием опухоли индивидуума. В алгоритме может быть учтен следующий параметр: 1) итоговый процент дерегуляции генов-мишеней лекарственного средства. В силу этого для определения процента дерегулированных генов для этого соединения сравнивают список генов-мишеней для конкретного лекарственного средства с перечнем дерегулированных генов. Например, если для конкретного лекарственного средства и для конкретной опухоли были идентифицированы 10 генов-мишеней и если 4 из 10 генов-мишеней были обнаружены дерегулированными, то процент дерегулированных генов для этого лекарственного средства равен 40%; 2) степень дерегуляции и направление дерегуляции (например, сверх- или недостаточная экспрессия) генов-мишеней, определенных посредством кратного изменения (Fc) и средней интенсивности (AvgInt). Эти параметры могут быть определены либо для всех генов-мишеней либо для каждой категории(например, для основных генов-мишеней, минорных генов-мишеней и генов-мишеней устойчивости); 3) наличие мутаций в генах-мишенях, известных своим воздействием на конкретное лекарственное средство. Алгоритм применяют для расчета балльной оценки для каждого лекарственного средства в базе данных с учетом описания характеристик опухоли подвергаемого лечению объекта. В способе может быть применен следующий основной первый алгоритм: где W является балльной оценкой для конкретного лекарственного средства; Р - процентом дерегулированных в опухоли пациента генов-мишеней для конкретного лекарственного средства;z - необязательным коэффициентом умножения связанным с наличием мутации в гене-мишени;- суммой;Fc2 - кратным изменением каждого дерегулированного гена-мишени для конкретного лекарственного средства с кратным изменением больше 2;nCFc2 относится к числу генов-мишеней для конкретного лекарственного средства с кратным изменением больше 2. В конкретном воплощении этого алгоритма Fc2 является кратным изменением для каждого сверхэкспрессированого гена-мишени для конкретного лекарственного средства с кратным изменением больше 2, a nCFc2 является либо количеством генов-мишеней для конкретного лекарственного средства с кратным изменением больше 2, либо количеством сверхэкспрессированных генов-мишеней для конкретного лекарственного средства с кратным изменением больше 2. Конечно, алгоритм можно усложнить, если учесть категорию генов-мишеней (например, основные гены-мишени, минорные гены-мишени или гены-мишени устойчивости), например, путем введения коэффициента умножения. Таким более сложным алгоритмом может быть следующий: где W является балльной оценкой для конкретного лекарственного средства; Р является процентом дерегулированных в опухоли пациента генов-мишеней для конкретного лекарственного средства;является суммой; СМ относится к основному гену-мишени для конкретного лекарственного средства;Cm относится к минорному гену-мишени для конкретного лекарственного средства;CR относится к гену устойчивости для конкретного лекарственного средства;n1CM, n2Cm и n3CR являются количеством дерегулированных генов-мишеней с определенным порогом для основных генов-мишеней, минорных генов-мишеней и генов устойчивости соответственно;FCM, FCm и FCR являются кратными изменениями каждого гена, которые выше определенного порога для основных генов-мишеней, минорных генов-мишеней и генов устойчивости соответственно;q1, q2 и q3 являются коэффициентами умножения для основных генов-мишеней, минорных геновмишеней и генов устойчивости соответственно;z1 z2 и z3 являются необязательными коэффициентами умножения, связанными с наличием мутации в основном гене-мишени, минорном гене-мишени и гене устойчивости соответственно. Например, коэффициенты умножения для генов-мишеней могут находиться в диапазоне от 10 до 1000 для основных генов-мишеней, от 0,1 до 10 для минорных генов-мишеней и от 10 до 1000 для генов устойчивости. Не исключаются другие значения для коэффициентов умножения. Связанные с мутацией коэффициенты умножения равны 1, если мутации нет. В зависимости от функционального воздействия мутации коэффициент z может находиться, например, в диапазоне от 10 до 1000. Не исключаются другие значения для связанных с мутацией коэффициентов умножения. В предпочтительном воплощении определенный порог является кратным изменением по меньшей мере в 2 раза или больше чем в 2 раза. Однако в настоящем способе не исключается рассмотрение более низкого порога, поскольку кратное изменение 1,5 может быть значимо для некоторых генов. В конкретном воплощении FCM, FCm и FCR могут быть кратным изменением для каждого сверхэкспрессированного гена-мишени для конкретного лекарственного средства с определенным порогом, an1CM, n2Cm и n3CR могут относиться к числу генов-мишеней для конкретного лекарственного средства с определенным порогом или числу сверхэкспрессированных генов-мишеней для конкретного лекарственного средства с определенным порогом. В альтернативном сложном алгоритме формула может быть следующей: где значение W, , CM, Cm, CR, FCM, FCm, FCR, q1, q2, q3, z1, z2 и z3 являются такими же, как и в предшествующем алгоритме, а РСМ, PCm и PCR являются процентом генов для конкретного лекарственного средства, которые дерегулированы в опухоли индивидуума, для основных генов-мишеней, минорных геновмишеней и генов устойчивости соответственно. Подобным образом, в предпочтительном воплощении определенный порог является кратным изменением, равным по меньшей мере 2 или больше чем 2. Однако в настоящем способе не исключается рассмотрение более низкого порога, поскольку для некоторых генов может быть значимо кратное изменение 1,5. В конкретном воплощении, FCM, FCm и FCR могут быть кратными изменением каждого сверхэкспрессированного гена-мишени для конкретного лекарственного средства с определенным порогом, n1CM,n2Cm и n3CR могут относиться к числу генов-мишеней для конкретного лекарственного средства с определенным порогом или числу сверхэкспрессированных генов-мишеней для конкретного лекарственного средства с определенным порогом. В конкретном воплощении в алгоритме может быть учтена средняя интенсивность или изменение интенсивности. Этот параметр свидетельствует об уровне транскрипции генов. Действительно можно считать, что для того кратного изменения, равного 2, генная дерегуляция может иметь различное влияние в зависимости от интенсивности транскрипции, например 200/100 по сравнению с 200000/100000. Соответственно, еще более сложный алгоритм может быть одним из следующих: где значения W, , CM, Cm, CR, FCM, FCm, FCR, q1, q2, q3, z1, z2 и z3, если присутствуют РСМ, PCm и PCR такие же, что и в предшествующем алгоритме, a IntCM, IntCm и IntCR являются интенсивностями для основных генов-мишеней, минорных генов-мишеней и генов устойчивости соответственно. "Int" может быть интенсивностью генной транскрипции в опухолевом образце, разницей генной транскрипции между опухолевым образцом и нормальным образцом из индивидуума. В дополнительном воплощении способ может быть сфокусирован на основных генах-мишенях и генах устойчивости без учета минорных генов-мишеней. В этом воплощении алгоритм может быть одним из следующих: где значения W, , CM, CR, FCM, FCR, q1, q3, z1 и z3 и, в случае их присутствия, РСМ, PCR, IntCM и IntCR такие же, что и в предшествующем алгоритме. Предпочтительно, если выбранный алгоритм проверяют с двумя моделями: ретроспективной моделью (например, на опухолях, лечение которых осуществлялось химиотерапией и для которых ответ на лечение известен) и перспективной моделью, позволяющей оценить эффективность конкретного лечения в свете балльной оценки. В ходе тестов проверки алгоритма могут быть скорректированы некоторые переменные, в частности, коэффициенты умножения, с учетом средней интенсивности или без нее, порог кратного изменения. Кроме того, в ходе этой стадии можно определить целесообразность применения CGH или функционального геномного анализа или и того, и другого. В способе также рассматриваются другие варианты алгоритма, которые могут быть предложены,при этом конечной целью остается расчет балльной оценки для каждого лекарственного средства на основании характеристик опухоли подвергаемого лечению индивидуума, в частности на основании биологических и генетических аномалий опухоли. Дополнительные аспекты и преимущества этого изобретения будут раскрыты в следующих примерах, которые рассматриваются как наглядные и не ограничивающие объем притязаний этого изобретения. Примеры Пример 1. При постановке диагноза 70% случаев рака легкого находятся в поздних стадиях. Они являются неоперабельными с плохим клиническим исходом. Способ настоящего изобретения применяли в случае заболевания для того, чтобы помочь врачу выбрать наиболее подходящее для пациента лечение. Пациентом был белый мужчина 58 лет. Он страдал от немелкоклеточной карциномы легкого(NSCLC), с Т 4, N0, M1. Было использовано девять терапевтических линий, а именно цисплатин-Гемзар,таксотер, навелбин, таксол-карбоплатин, медиастинальная радиотерапия, иресса, алимта, тарцева и HKI 272 (ингибитор рецепторов Her широкого действия). Для HKI 272 пациент был включен в клиническое исследование. Курс HKI 272 начался в октябре 2005 г. На фиг. 1 показан ЯМР медиастенального лимфоузла (С 1) и надпочечного узла (С 2). HKI оказался эффективным; пациент оставался в исследовании почти три года. Однако через 37 месяцев курса HKI 272 наблюдали прогрессию заболевания (фиг. 2). Появились новые подключичные метастазы. Одна из самых больших проблем в онкологии на сегодняшний день заключается в том, что, даже если есть первоначальная реакция, часто встречается вторичная резистентность к лечению. Соответственно, решение остановить лечение HKI 272 было принято из-за появления новых метастазов. Важно упомянуть, что в это время практикующие врачи считали, что HKI 272 является последней терапевтической линией, доступной для этого пациента. Подключичный метастаз удалили и использовали для полного молекулярного профилирования. Признаками профилирования являлись 1 - сравнение опухолевой ткани с нормальной легочной тканью (Опухоль против Нормы); 2 - сравнительная геномная гибридизация (CGH) (Опухоль против Нормы); 3 - сравнение генной экспрессии (GE) (Опухоль против Нормы); 4 - профилирование микроРНК (Опухоль против Нормы); 5 - секвенирование генов, включая гены EGFR, р 53, CTNNB1, AKT1, BRAF, KRAS, HRAS, NRAS,PIK3CA, FBXW7, EGFR, ERBB2, KIT, NOTCH1, PTEN, STKI1, ТР 53, АРС, MET, RB1, FGFR2, FGFR3,JAK2, TSC1, TSC2, CDKN2A, CDKN2A, TOP1, TOP2A, PDGFRA, VHL, CDK4, JAK1, TYK. 6 - ни в одном из этих генов не было обнаружено релевантных мутаций (например, не было мута- 10021945 ций EGFR или других генов). Следовательно, для этого пациента мутации не оказывают влияние на алгоритм. Использовали только релевантные результаты генной экспрессии. Затем для прогнозирования эффективности лекарственных средств к этим данным применили алгоритм настоящего изобретения. Балльную оценку для каждого лекарственного средства рассчитывали на основе собранных данных. Был применен следующий алгоритм: где W является балльной оценкой для конкретного лекарственного средства; Р является процентом дерегулированных в опухоли пациента генов-мишеней для конкретного лекарственного средства;z равно 1, потому что в этом примере не были обнаружены мутации;является суммой;Fc2 является кратным изменением каждого дерегулированного гена-мишени для конкретного лекарственного средства с кратным изменением больше 2;nCFc2 относится к числу генов-мишеней для конкретного лекарственного средства с кратным изменением больше 2. В табл. 2 представлены рассчитанные балльные оценки. Можно видеть, что лекарственные средства, примененные в предыдущих терапевтических линиях, ассоциированы с низкими балльными оценками, а именно 108 для Цисплатин (cisplatine), 70 для Гемзар (gemzar), 77 для Таксотер (taxotere), 147 для Таксол (taxol), 82 для Карбоплатин (carboplatin), 66 для Иресса (Iressa) и 73 для Алимта (Alimta). В декабре 2008 г. курс HKI 272 остановили и начали лечение комбинацией Кселода (Xeloda) (3600 мг/день, с дня 1 по день 14, каждые 21 день) и Лапатиниб (Lapatinib) (1250 мг/день). В начале этого лечения у пациента наблюдались быстрая прогрессия заболевания, и пациент демонстрировал быструю прогрессию заболевания и ухудшение здоровья. Введение Лапатиниба, ингибитора HER-1 и HER-2 было оправдано, даже несмотря на то, что в EGFR не было обнаружено мутаций, так как у пациента был сверхэкспрессирован в 15 раз EGF, и это требовало продолжения введения HKI 272. Действительно,сверхэкспрессия EGF в опухоли индуцирует постоянную активацию EGFR, в связи с чем логичным показалось обеспечить переход с HKI 272 на другое средство против EGFR в целях улучшения покрытия такого же спектра. Кселода (балльная оценка 555) отобрали на основании балльной оценки алгоритма. Заболевание было стабильным, но наблюдался паралич возвратного нерва. Соответственно, в феврале 2009 г. было принято решение добавить Тиотепа (Thiotepa), который демонстрирует наивысшую балльную оценку по алгоритму (балльная оценка 713). Через два месяца лечения комбинацией Кселода(3600 мг/день, 5 дней в неделю, 3 недели на 4 недели), Лапатиниб (1250 мг/день) и Тиотепа (15-30 мг/день, дни 1 и 2, каждые 4 недели), заболевание стало стабильным (фиг. 3). Заболевание оставалось стабильным в течение 11 месяцев (фиг. 4), паралич возвратного гортанного нерва не проявлялся, и пациент демонстрировал хорошее общее состояние. Кроме того, настоящий способ позволяет определить будущие терапевтические комбинации. Действительно, в ходе лечения злокачественных заболеваний часто возникает устойчивость. По меньшей мере три других лекарственных средства продемонстрировали высокие балльные оценки и могут быть использованы в случае устойчивости вместе с Ксилодом, Лапатинибом и Тиотепом, а именно Фотемустин (fotemustine, балльная оценка 627), Ритуксимаб (rituximab, балльная оценка 761) и Трабектидин (trabectidin, балльная оценка 376). При применении настоящего способа выбора лекарственных средств были получены неожиданные результаты. Действительно, без балльной оценки, прогнозирующей потенциальную эффективность лекарственного средства для конкретного пациента, врач не выбрал бы ни Кселода, ни Тиотепа. Действительно, нет указаний для применения этих лекарственных средств при раке легкого, в частности NSCLC. Настоящий способ позволяет достичь четырнадцати месяцев стабильности с хорошим общим состоянием для пациента, принимая во внимание то, что в начале лечения комбинацией Кселода и Тиотепа прогноз продолжительности жизни составлял всего лишь несколько недель. В заключение необходимо отметить, что данный пример служит доказательством ценности способа настоящего изобретения при выборе подходящего лекарственного средства на основании индивидуальных данных для помощи практикующему врачу. Ретроспективно применение нового способа прогнозирования ясно показало, что в соответствии с описанием все предшествующие терапевтические линии, являясь абсолютно неэффективными, были связаны с балльной оценкой с очень низкой прогностической ценностью. Цель этого инновационного способа в полной мере заключается в способности обеспечивать прогнозируемое определение эффективности лекарственных средств, и этот пример является прекрасным подтверждением концепции, поскольку все применяемые неэффективные лекарственные средства были связаны с низкой балльной оценкой. Эксперименты с данной новой процедурой на других пациентах и конкретная практическая выгода настоящего способа подтверждают то, что каждый пациент нуждается в уникальной комбинации лекарственных средств. Способ, следовательно, является чрезвычайно уместным в области индивидуализированного отбора условий лечения. Пример 2. Пациенту было 64 г. Он страдал от бронхиальной аденокарциномы Т 4 с костными и плевральными метастазами. Были применены две терапевтические линии, а именно Цисплатин-Алимта (cisplatinAlimta) и Тарцева (Tarceva). Первая терапевтическая линия была связана с прогрессией заболевания, а вторая была неэффективной и привела к быстрой прогрессии. Были взяты биопсии нормальной бронхиальной слизистой и опухоли, которые были использованы для мутационного анализа секвенированием, для CGH, для анализа микроРНК и для анализа экспрессии генома. Профиль CGH содержал множество альтераций (утрат и приобретений), что подтверждало опухолевый статус биопсии. Мутационный анализ, включающий гены, перечисленные в примере 1, идентифицировал мутациюG464V в гене BRAF (B-Raf - протоонкоген, серин/треонин протеинкиназа, GeneID 673). Эта мутация постулируется как активирующая внутренние митотические сигналы. Следовательно, можно было бы рассмотреть лечение сорафинибом. На основании анализа экспрессии генома были подсчитаны балльные оценки так, как это подробно описано в примере 1, которые представлены в таблице ниже только для некоторых релевантных лекарственных средств. Соответственно, можно видеть, что используемые в двух терапевтических линиях лекарственные средства, которые не обеспечивали терапевтической эффективности, связаны с низкими балльными оценками, а именно 80 для Цисплатин, 156 для Алитма и 143 для Тарцева. Соответственно, способ изобретения должен избежать выбора для лечения таких вариантов. С января 2010 г. для лечения пациента был выбран Винорелбин (Vinorelbine) с балльной оценкой 290. Вначале у пациента было ухудшенное общее состояние. В течение трех месяцев заболевание оставалось стабильным, затем стало прогрессировать. В заключении необходимо отметить, что, хотя лекарственное средство с лучшей балльной оценкой не было выбрано, выбранное лекарственное средство продемонстрировало эффективность, которая заключалась в сохранении жизни в течение трех месяцев. Пример 3. Пациенту в мае 2007 г. был поставлен диагноз первичной бронхиальной аденокарциномы с билатеральными пульмонарными метастазами и асимптотическими церебральными метастазами. Хирургическое вмешательство было проведено в ноябре 2008 г. и были применены две терапевтические линии, а именно тринадцать циклов Цисплатин-Гемцитабин в первой линии и Алимта во второй линии. Первая линия была связана с частичным ответом, за которым последовала прогрессия заболевания, а вторая линия связана только с прогрессией заболевания. Были взяты биопсии нормальной бронхиальной слизистой и пульмонарных метастазов, которые были использованы для мутационного анализа секвенированием, для CGH, для анализа микроРНК и для анализа экспрессии генома. Профиль CGH содержал множество альтераций (утрат и приобретений), что подтверждало опухолевый статус биопсии. Мутационный анализ, включающий гены, перечисленные в примере 1, не привел к обнаружению какой-либо мутации. На основании анализа экспрессии генома были подсчитаны балльные оценки так, как это подробно описано в примере 1, которые представлены в таблице ниже только для некоторых релевантных лекарственных средств. Прежде всего следует отметить, что балльные оценки, связанные с лекарственными средствами из первой и второй терапевтических линий, являются низкими (Гемцитабин = 129; Цисплатин = 80 и Алимта = 0). Эти балльные оценки соответствуют наблюдаемым клиническим данным. Однако на основании этой таблицы баллов был выбран авастатин с балльной оценкой 384. Лечение было начато в январе 2010 г. и основной ответ наблюдали после двух циклов лечения, что показано на томограммах фиг. 5. Этот основной ответ подтверждает настоящий способ и несомненную пользу для пациента. Пример 4. Пациенту было 59 лет. Он страдал от немелкоклеточной бронхиальной карциномы с метастазами в надпочечники. Были использованы две терапевтические линии, а именно три цикла Цисплатин-Алимта и три цикла Таксотер-Цисплатин-Авастатин. Эти терапевтические линии были связаны с первой стадией стабилизации, а затем со стадией прогрессии заболевания. Были взяты биопсии нормальной и опухолевой ткани бронха, которые были использованы для мутационного анализа секвенированием, для CGH, для анализа микроРНК и для анализа экспрессии генома. Профиль CGH представлен на фиг. 6 и содержит хромосомные аберрации на хромосоме 11. Мутационный анализ, включающий гены, перечисленные в примере 1, не привел к обнаружению какой-либо мутации. На основании анализа экспрессии генома были подсчитаны балльные оценки так, как это подробно описано в примере 1, которые представлены в таблице ниже только для некоторых релевантных лекарственных средств. Соответственно, представленные ниже балльные оценки ассоциированы с лекарственными средствами первой и второй терапевтических линий: Цисплатин (48), Алимта (88), Таксотер (107) и Авастатин(0). Эти балльные оценки соответствуют клиническим данным. При этом другие лекарственные средства ассоциированы с лучшими балльными оценками, например Трабестедин (512), Гемтузумаб (232) и Гидроксимочевина (179). Пример 5. Пациент страдал от рабдомиосаркомы с метастазами в легкие, что доказывает эффективность настоящего способа при прогнозировании терапевтической эффективности для любого типа опухолей. Это развивающееся метастатическое заболевание происходит из фибромиксоидной саркомы ягодичной мышцы. Первичную опухоль удалили при излечивающем оперативном вмешательстве в 2006 г. Впоследствии в 2007 г. у пациента развились плевральные мезотелиальные метастазы. После шести циклов лечения комбинацией Алимта и Цисплатин с действительно слабым ответом пациента подвергли плевраэктомии. Потом было обнаружено новое метастатическое образование в легких со сложным расположением, препятствующим какому-либо хирургическому вмешательству. Были взяты биопсии нормальной мышцы и метастазов в легких, которые были использованы для мутационного анализа секвенированием, для CGH, для анализа микроРНК и для анализа экспрессии генома. Профиль CGH показал значительную амплификацию на хромосоме 16. Она соответствовала амплификации локуса PDGA. Мутационный анализ, включающий гены, перечисленные в примере 1, не привел к обнаружению какой-либо мутации. На основании анализа экспрессии генома были подсчитаны балльные оценки так, как это подробно описано в примере 1, которые представлены в таблице ниже только для некоторых релевантных лекарственных средств. Примечательно, что Нилотиниб, ассоциированный с высокой балльной оценкой 324, известен своей активностью в сигнальном пути PDGFRA и PDGFRB. Соответственно, авторы исследовали более точно сигнальный путь PDGF и получили следующие результаты. Видна очень сильная активация. Профили CGH и генной экспрессии подтверждают значение сигнального пути PDGF в качестве важного фактора канцерогенеза для этого новообразования. Действительно, PDGFD сверхэкспрессирован в 18 раз в опухоли по сравнению с нормальной тканью и активирует рецептор бета-бета. Стоит отметить, что PDGFRB также сверхэкспрессирован в 3 раза. PDFGA сверхэкспрессирован в 8 раз, а рецепторPDGFRA сверхэкспрессирован в 10 раз. В совокупности Нилотиниб является хорошим кандидатом для таргетной терапии, потому что ингибирует оба рецептора. Пациент ожидает нормативного разрешения на лечение Нилотинибом. Его лечащий врач признал этот терапевтический выбор. В заключение необходимо отметить, что у всех исследуемых пациентов был неблагоприятный итог лечения. У всех них не было терапевтического выбора, и их общее состояние не позволяло включить их в клинические исследования. Данный способ применили на основании письменного согласия и по запросу врачей-онкологов. Настоящий способ позволяет ассоциировать лекарственные препараты, примененные в предшествующих терапевтических линиях с низкими балльными оценками, что иллюстрирует хорошую корреляцию между низкими балльными оценками и терапевтической эффективностью. Ретроспективно эксперты могут себе представить, что при применении такой стратегии можно было бы избежать использования неэффективных лекарственных средств, что сохранило бы пациенту время. Важно отметить, что для исследованных пациентов продемонстрированы вполне уникальные профили, что подтверждает потенциал концепции для персонализированной медицины. Способ можно применить к любому типу опухолей, поскольку для пациента можно сравнить нормальные и опухолевые клетки одинакового гистологического типа. Другое преимущество заключается в том, что способ может дать решение с потенциальным терапевтическим эффектом для всех пациентов, тогда как текущие способы, основанные на тестах-компаньонах, могут применяться только на ограниченном круге пациентов с конкретной аномалией.
МПК / Метки
МПК: G06F 19/00
Метки: соединений, эффективности, пациента, способ, прогнозирования, лекарственных
Код ссылки
<a href="https://eas.patents.su/30-21945-sposob-prognozirovaniya-effektivnosti-lekarstvennyh-soedinenijj-dlya-pacienta.html" rel="bookmark" title="База патентов Евразийского Союза">Способ прогнозирования эффективности лекарственных соединений для пациента</a>
Предыдущий патент: Замещенные пиперидины
Следующий патент: (11β,17β)-17-гидрокси-11-[4-(метилсульфонил)фенил]-17-(пентафторэтил)эстра-4,9-диен-3-он и лекарственное средство, его содержащее
Случайный патент: Теплообменник












