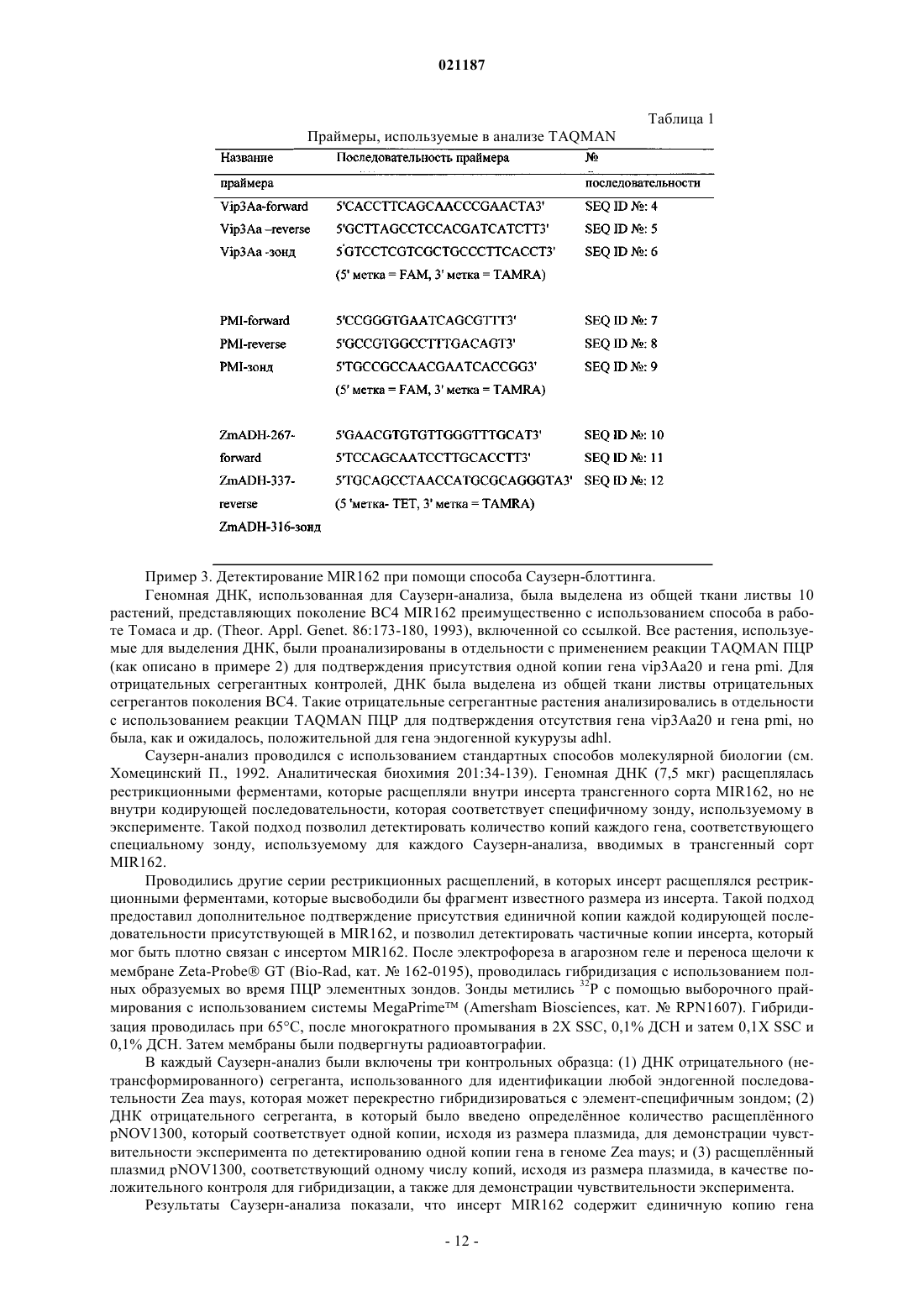
Хромосомный целевой сайт кукурузы и способ получения трансгенной кукурузы
Номер патента: 21187
Опубликовано: 30.04.2015
Авторы: Лонг Найколл, Мегджи Моез, Цю Цюдэн, Харт Хоуп, Боттомс Джефф, Пуллиам Деррик
Формула / Реферат
1. Хромосомный целевой сайт кукурузы, расположенный на хромосоме 5 между молекулярным маркером opie2, описанным в виде нуклеотидов 1680-3338 SEQ ID №: 106, и молекулярным маркером gag, описанным в виде нуклеотидов 43275-45086 SEQ ID №: 106, причем целевой сайт содержит гетерологичную нуклеиновую кислоту.
2. Целевой сайт по п.1, расположенный между нуклеотидами 25454 и 25513 SEQ ID №: 106.
3. Целевой сайт по п.1, который фланкируется 5'-нуклеотидами 5454-25454 SEQ ID №: 106 и 3'-нуклеотидами 25513-45513 SEQ ID №: 106.
4. Способ получения трансгенного растения кукурузы, включающий встраивание гетерологичной нуклеиновой кислоты в целевой сайт на хромосоме 5, расположенный между молекулярным маркером opie2, описанным в виде нуклеотидов 1680-3338 SEQ ID №: 106, и молекулярным маркером gag, описанным в виде нуклеотидов 43275-45086 SEQ ID №: 106.
5. Способ по п.4, в котором указанная гетерологичная нуклеиновая кислота встраивается в хромосому 5 между нуклеотидами 25454 и 25513 SEQ ID №: 106.
6. Способ по п.4, в котором указанная гетерологичная нуклеиновая кислота фланкирована 5'-нуклеотидами 5454-25454 SEQ ID №: 106 и 3'-нуклеотидами 25513-45513 SEQ ID №: 106.
Текст
ХРОМОСОМНЫЙ ЦЕЛЕВОЙ САЙТ КУКУРУЗЫ И СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННОЙ КУКУРУЗЫ В изобретении описаны хромосомный целевой сайт кукурузы, расположенный на хромосоме 5 между молекулярным маркром opie2, который представляет собой последовательность нуклеотидов 1680-3338 SEQ ID : 106, и молекулярным маркром gag, который представляет собой последовательность нуклеотидов 43275-45086 SEQ ID : 106, причем этот целевой сайт содержит гетерологичную нуклеиновую кислоту, и способ продуцирования трансгенного растения кукурузы,предусматривающий встраивание гетерологичной нуклеиновой кислоты в этот сайт. 021187 Настоящее изобретение относится в основном к области молекулярной биологии растений, трансформации и селекции растений. В частности, изобретение связано с хромосомным целевым сайтом кукурузы и получением трансгенного растения кукурузы. Сельскохозяйственные вредители являются основной причиной потери мирового сельскохозяйственного урожая. Только в США убытки от повреждения урожая сельскохозяйственными вредителями,включая насекомых, составляют около 8 миллиардов долларов. Кроме причинения ущерба полевым культурам сельскохозяйственные вредители также доставляют большие неудобства фермерам, выращивающим овощи, фрукты, декоративные цветы, а также садоводам-любителям. Количество насекомых-вредителей контролируется в основном интенсивным использованием химических пестицидов, которые задерживают рост насекомых, препятствуют питанию и размножению насекомых или приводят к их гибели. Таким образом, достигается хороший контроль над численностью насекомых, но данные химикаты могут навредить и другим, полезным насекомым. Другая проблема,вызванная широким применением химических пестицидов, заключается в появлении видов насекомых,устойчивых к их воздействию. Частично данная проблема была решена путем внедрения различных методов повышения стойкости к повреждениям, но наблюдается увеличение спроса на альтернативные агенты для борьбы с вредителями. Биологические агенты для борьбы с вредителями, например штаммыBacillus thuringiensis (Bt), экспрессирующие пестицидные токсины, например -эндотоксин, также применялись для растений кукурузы и показывали удовлетворительные результаты, являясь альтернативой или дополнением к химическим пестицидам. Выделены гены, кодирующие некоторые из эндотоксинов, и показана их экспрессия в гетерологичных хозяевах. Гены оказались другим средством для контроля популяцией вредных насекомых, приносящих убытки экономике. В частности, экспрессия-эндотоксинов Bt обеспечила эффективную защиту от выбранных вредных насекомых, а трансгенные растения, экспрессирующие такие токсины, принесли коммерческую пользу, позволяя фермерам снизить объем применения химических агентов для борьбы с насекомыми. Также установлено другое семейство инсектицидных белков, продуцируемых видами Bacillus во время вегетативной стадии роста (вегетативные инсектицидные белки (Vip. В патентах США 5877012,6107279 и 6137033, которые включены в настоящий документ со ссылкой, описан новый класс инсектицидных белков под названием Vip3. В других публикациях, включая WO 98/18932, WO 98/33991,WO 98/00546 и WO 99/57282, также было дано определение гомологам белков класса Vip3. Кодирующие последовательности Vip3 кодируют белки около 88 кДа, которые проявляют инсектицидную активность по отношению к ряду чешуекрылых вредителей, включая, без ограничения, совку-ипсилон (BCW, Agrotisipsilon), совку травяную (FAW, Spodoptera frugiperda), табачную листовертку (TBW, Heliothis virescens),огневку сахарного тростника, (SCB, Diatraea saccharalis), малого сверлильщика стеблей кукурузы (LCB,Elasmopalpus lignosellus) и червя коробочного (CEW, Helicoverpa zea), и проявляют экспрессию в трансгенных растениях, например кукурузе (Zea mays), обеспечивая защиту растения от пожирания насекомыми. В целом, способы трансформации растений приводят к произвольной интеграции трансгенов, например vip3, в геном растения-хозяина. Такое произвольное инсертирование представленной введнной ДНК в геном растения может оказаться летальным, если также в растение инсертируется чужеродная ДНК, и, таким образом, мутирует критически важный нативный ген. Кроме того, даже если произвольная инсерция не нарушит функционирование гена клетки-хозяина, на экспрессию инсертированного чужеродного гена могут повлиять "эффекты положений", вызванные окружающей геномной ДНК. В некоторых случаях ген инсертируется в сайты, в которых эффекты положения достаточно сильны для предупреждения синтеза эффективного количества продукта из введнного гена. Например, было обнаружено,что в растениях присутствует большое число вариаций с точки зрения уровней экспрессии гетерологичного гена, введнного в хромосому растения, среди индивидуально выбранных объектов. Также может возникнуть различия в пространственных или временных структурах экспрессии, например, различия в относительной экспрессии трансгена в различных тканях растения, которые могут не соответствовать структурам, которые ожидаются от транскрипционных регуляторных элементов, присутствующих в структуре встроенного гена. В других случаях, перепродукция генного продукта может иметь отрицательные последствия для клетки. На фоне таких потенциальных проблем принято разрабатывать сотни различных объектов и проводить скрининг таких объектов для выявления единственного объекта, который обладает желательными моделями и уровнями экспрессии трансгена из коммерческих соображений. Тем не менее, сразу, как только будет выявлен коммерчески ценный сайт внутри генома растения, будет целесообразным доставить представляющие интерес гены-мишени в такой невредный сайт. Были описаны некоторые способы направленного инсертирования представляющей интерес нуклеотидной последовательности в специфичный хромосомный сайт в клетке растения. Сайт-специфичные системы рекомбинации обнаружены в некоторых прокариотических и низших эукариотических организмах. Как правило, такие системы объединяют один или несколько белков, которые распознают две копии специальной нуклеотидной последовательности, расщепляют и лигируют такие нуклеотидные последовательности, и обеспечивают точный, сайт-специфичный обмен генетической информацией. Для такого-1 021187 способа известно несколько сайт-специфичных рекомбиназ. Сюда относятся, включая, без ограничения,бактериофаги системы PI Cre/lox (Остин и др. (1981), Клетка 25: 729-736), систему рекомбиназы R/RS из плазмиды pSRl дрожжей Zygosaccharomyces rouxii (Араки и др. (1985), Дж. Мол. биол. 182: 191-203),систему Gin/gix фага Mu (Мезер и Кальман (1991), Мол. генная генетика 230: 170-176), систему рекомбиназы FLP/FRT от плазмиды 2.mu.m дрожжей Saccharomyces cerevisiae (Броач и др. (1982), Клетка 29:227-234), рекомбиназу Int от бактериофага Lambda (Ланди (1989), Ежег. ред. Биохимия. 58: 912-949; Ланди (1993) Тек. ред. Генетика. Часть. 3: 699-707; Лорбах и др. (2000) Дж. Мол. биол. 296: 1175-1181; иWO 01/16345). Один отдельный пригодный сайт-специфичный способ направленной доставки, описанный в патенте США, заявка на публикацию 2006/0130179, включенный в данной документ со ссылкой, использует рекомбинацию, опосредованную лямбда-интегразой. Этот способ предусматривает введение в клетку растения мишеневой нуклеотидной последовательности, содержащей первый сайт распознавания интегразы; введение в клетку растения донорной нуклеотидной последовательности, содержащей второй сайт распознавания интегразы; и введение в клетку растения интегразы или комплекса интегразы. Другой пригодный сайт-специфичный способ направленной доставки раскрыт в патенте США,заявка на публикацию 2006/0253918, включенном в данный документ со ссылкой, который использует гомологичную рекомбинацию для интеграции одного или нескольких генов (стэкинг генов) в отдельные места в геноме. Объект, который обладает необходимыми уровнями или структурами трансгенной экспрессии, пригоден для интрогрессии трансгена в другой генетический фон путем полового скрещивания с применением традиционных способов получения. Потомство таких скрещиваний поддерживает характеристики трансгенной экспрессии первоначального трансформанта. Такой способ используется для обеспечения надежной экспрессии гена в большом количестве видов, которые хорошо адаптированы к локальным условиям произрастания. Также было бы целесообразно обнаружить присутствие отдельного сорта с целью определения того, содержит ли потомство полового скрещивания представляющий интерес трансген. Кроме того, способ детектирования отдельного объекта был бы полезен для соблюдения положений,требующих утверждения до поступления на рынок и маркировки продуктов питания, полученных, например, из рекомбинантных растений кукурузы. Существует необходимость детектирования присутствия трансгена путем применения хорошо известного способа детектирования нуклеиновых кислот,включая, без ограничения, термическую амплификацию (полимеразная цепная реакция (ПЦР с использованием полинуклеотидных праймеров или гибридизацию ДНК при помощи зондов нуклеиновой кислоты. Как правило, ради простоты и единообразия реагентов и методологии для использования при детектировании определнной конструкции ДНК, используемой для трансформации различных видов растений, такие способы детектирования, как правило, фокусируются на часто используемых генетических элементах, например промоторах, терминаторах и генах-маркрах, так как для многих структур ДНК область кодирующей последовательности является взаимозаменяемой. В результате, такие способы пригодны для определения различия между конструкциями, которые отличаются только с точки зрения кодирующей последовательности. Кроме того, такие способы могут оказаться бесполезными для определения различия между различными сортами, в частности теми, которые получают при использовании той же структуры ДНК, если только не известна последовательность хромосомной ДНК, расположенной рядом с инсертированной гетерологичной ДНК ("фланкирующая ДНК"). Ввиду вышеуказанных причин есть потребность в трансгенных сортах кукурузы, устойчивых к поражению насекомыми-вредителями, содержащих новые последовательности нуклеиновых кислот, уникальные для трансгенного сорта кукурузы, пригодные для определения трансгенного сорта кукурузы и для детектирования нуклеиновых кислот трансгенного сорта кукурузы в биологическом образце, а также в наборах, содержащих реагенты, необходимых для детектирования таких нуклеиновых кислот в биологическом образце. Также есть дальнейшая потребность в предоставлении специфичных целевых сайтов внутри генома кукурузы для направленной доставки и контроля за инсертированием нуклеотидных последовательностей, вводимых в геном кукурузы. Краткие выводы Данное изобретение относится к хромосомному целевому сайту кукурузы, расположенному на хромосоме 5 между молекулярным маркром opie2, описанным в виде нуклеотидов 1680-3338 SEQ ID : 106, и молекулярным маркром gag, описанным в виде нуклеотидов 43275-45086 SEQ ID : 106, в котором целевой сайт содержит гетерологичную нуклеиновую кислоту. Кроме того, заявлен способ продуцирования трансгенного растения кукурузы, включающего в себя инсертирование гетерологичной нуклеиновой кислоты в положение на хромосоме 5, расположенной между молекулярным маркром opie2, описанным в виде нуклеотидов 1680-3338 SEQ ID : 106, и молекулярным маркром gag, описанным в виде нуклеотидов 43275-45086 SEQ ID : 106. Описание последовательности в списке последовательностейSEQ ID : 4-12 - праймеры и зонды, пригодные для количественного анализа TAQMAN.SEQ ID : 106 - последовательность области хромосомы 5 кукурузы, содержащей указанный хромосомный сайт-мишень.SEQ ID : 107 - геномная последовательность кукурузы, которая замещается в результате инсерции гетерологичной ДНК в MIR162. Подробное описание Для более четкого описания данного изобретения и получения справочной информации по общепринятым специальным знаниям, используемым в данном изобретении, представлены следующие определения и способы. Если не указано иное, то понятия, используемые в данном документе, следует толковать в соответствии с их традиционным пониманием в обычных знаниях в соответствующей области. Определения общих понятий в молекулярной биологии можно найти в работе Ригера и др. "Глоссарий терминов генетики: классической и молекулярной", 5-е издание, Шпрингер-Верлаг: Нью-Йорк, 1994. Номенклатура для оснований ДНК и аминокислот, используемых здесь, изложена в Своде федеральных правил 37,1.822. В том значении, в котором оно используются в данном документе, понятие "амплифицированный" обозначает конструирование многочисленных копий, комплементарных молекуле нуклеиновых кислот, с использованием по меньшей мере одной из молекул нуклеиновых кислот в качестве матрицы. Системы амплификации включают, без ограничения, систему полимеразной цепной реакции (ПЦР), систему лигазной цепной реакции (ЛЦР), последовательность нуклеиновой кислоты на основе амплификации (амплификация, основанная на последовательности нуклеиновых кислот (NASBA), Канген, Миссисауга,Онтарио), систем репликазы Q-бета, системы амплификации на основании транскрипции (TAS) и амплификации замещением цепей (SDA). См., к примеру, "Диагностическая молекулярная микробиология: Принципы и применение, Д.Н. Персинг и др., ред., Американское общество микробиологов, Вашингтон(1993). Продукт амплификации называется ампликоном."Кодирующая последовательность" - последовательность нуклеиновых кислот, которая транскрибируется в РНК, например мРНК, рРНК, тРНК, миРНК, смысловую РНК или антисмысловую РНК. Предпочтительно РНК затем транслируется в организме для продуцирования белка. В том значении, в котором он используется в данном документе, термин "кукуруза" означает видZea mays или кукуруза и включает все разнообразия растений, которые можно выводить при помощи кукурузы, включая виды дикой кукурузы."Набор для детектирования", в том значении, в каком он используется в данном документе, относится к набору компонентов, пригодных для детектирования присутствия или отсутствия ДНК, характерной для растений трансгенного сорта MIR162 в образце, причем комплект содержит зонды на основе нуклеиновой кислоты и/или праймеры настоящего изобретения, которые специфически гибридизируются в строгих условиях с последовательностью мишеневой ДНК, и другие материалы, необходимые для проведения методов гибридизации полинуклеотидов или амплификации. В том значении, в котором он используется в данном документе, термин трансгенный "сорт" относится к рекомбинантному растению, продуцируемому путем трансформации и регенерации клетки или ткани растения при помощи гетерологичной ДНК, например, полигенного экспрессирующего кластера,который включает в себя представляющий интерес ген. Понятие "сорт" относится к оригинальному трансформанту и/или потомству трансформанта, которые содержат гетерологичную ДНК. Понятие"сорт" также относится к потомству, продуцируемому путем полового скрещивания между трансформантом и другой линией кукурузы. Даже после повторного обратного скрещивания с рекуррентным родителем, инсертированная ДНК и фланкирующая ДНК трансформированного родителя присутствует в потомстве скрещивания с тем же положением хромосом. Понятие "сорт" также относится к ДНК от ори-3 021187 гинального трансформанта, содержащего инсертированную ДНК и фланкирующую геномную последовательность, непосредственно прилегающую к инсертированной ДНК, как ожидается, передаваемую потомству, которое получает инсертированную ДНК, в том числе представляющий интерес трансген, в результате полового скрещивания одной родительской линии, которая содержит инсертированную ДНК(например, оригинальный трансформант и потомство, образовавшееся путем самовоспроизведения), и родительской клеточной линии, которая не содержит инсертированную ДНК. Как правило, трансформация ткани приводит к образованию множество сортов, каждый из которых представляет инсерцию конструкции ДНК в различные участки генома клетки растения. На основе экспрессии трансгена или прочих желаемых характеристик, селектируется определнный сорт. Поэтому термины "трансгенный сортMIR162", "MIR162" или "MIR162 сорт" могут использоваться, взаимно заменяя друг друга. Растение кукурузы MIR162, устойчивое к поражению насекомыми-вредителями, может селектироваться путем первоначального полового скрещивания первого родительского растения кукурузы, состоящего из растения кукурузы, выращенного из растения кукурузы трансгенного сорта MIR162, например растения кукурузы MIR162, выращенного из семени, депонированного в АКТК под входящимРТА-6188, и его потомства, полученного в результате трансформации полигенными экспрессирующими кластерами вариантов выполнения данного изобретения, которое наделяет его стойкостью к повреждению насекомыми-вредителями, и второго родительского растения кукурузы, у которого отсутствует устойчивость к повреждению насекомыми-вредителями, создавая при этом многообразие растений первого потомства; а затем проводя селекцию растения первого потомства, стойкого к повреждению насекомыми; и самовоспроизводя растение первого потомства, создавая при этом многообразие растений второго потомства; а затем проводя селекцию растения, стойкого к повреждению насекомыми, из растений второго потомства. Кроме того, такие шаги могут включать в себя обратное скрещивание растения первого потомства, стойкого к повреждению насекомыми, или растения второго потомства, стойкого к повреждению насекомыми, для получения второго родительского растения кукурузы или третьего родительского растения кукурузы, создавая при этом растение кукурузу, стойкое к повреждению насекомыми."Полигенный экспрессирующий кластер", в том значении, в котором такое понятие используется в этом тексте, обозначает молекулу нуклеиновой кислоты, способную к направляющей экспрессии определнной нуклеотидной последовательности в соответствующей клетке-хозяине, содержащей промотор,функционально связанный с представляющей интерес нуклеотидной последовательностью, которая в свою очередь функционально связана с сигналами терминации. Как правило, она также содержит последовательности, необходимые для надлежащей соответствующей трансляции нуклеотидной последовательности. Полигенный экспрессирующий кластер может также включать в себя последовательности, не требующиеся для прямой экспрессии представляющей интерес нуклеотидной последовательности, но которые присутствуют по причине соответствующих сайтов рестрикции для извлечения кассеты из вектора экспрессии. Полигенный экспрессирующий кластер, объединяющий в себе представляющую интерес нуклеотидную последовательность, может быть химерным, что означает, что по меньшей мере один из его компонентов является гетерологичным по отношению хотя бы к одному из его компонентов. Полигенный экспрессирующий кластер может быть одним из тех, которые присутствуют в природе, но были получены в рекомбинантной форме, пригодной для гетерологичной экспрессии. Тем не менее, как правило, полигенный экспрессирующий кластер является гетерологичным по отношению к хозяину, т.е. отдельная последовательность нуклеиновой кислоты полигенного экспрессирующего кластера не существует в природе в клетке-хозяине и должна быть введена в клетку-хозяин или предка клетки-хозяина,при помощи способа трансформации, известного в данной области. Экспрессия нуклеотидной последовательности в полигенном экспрессирующем кластере может контролироваться конститутивным промотором или индуцируемым промотором, который инициирует транскрипцию только тогда, когда клеткахозяин подвержена воздействию некоторого отдельного внешнего раздражителя. В случае с многоклеточными организмами, например с растениями, промотор также может быть специфичен для определенной ткани или органа или стадии развития. Полигенный экспрессирующий кластер или его фрагмент также может называться как "инсертированная последовательность" или "инсерционная последовательность" при трансформации в растении."Ген" - определенная область, расположенная в геноме, которая, кроме вышеуказанной кодирующей последовательности, может объединять другие, преимущественно регуляторные последовательности полинуклеотидов, ответственные за регулирование экспрессии, т.е. за транскрипцию и трансляцию кодирующей области. Ген может также объединять в себе 5' и 3' нетранслируемые последовательности и терминационные последовательности. Прочие элементы, которые могут присутствовать, это, например,интроны."Представляющий интерес ген" относится к любому гену, который, если переносится в растение,наделяет его необходимыми характеристиками, например, устойчивостью к антибиотикам, вирусостойкостью, устойчивостью к повреждениям насекомыми-вредителями, устойчивостью к заболеваниям или устойчивостью к прочим насекомым-вредителям, устойчивостью к гербицидам, повышенной питательной ценностью, повышенной производительностью в любом промышленном процессе или изменнной способностью к размножению."Генотип", в том значении, в каком это понятие используется в данном документе, является генетическим материалом, унаследованным от родительского растения кукурузы, не вс из которого обязательно экспрессируются в потомственных растениях кукурузы. Генотип MIR162 относится к гетерологичному генетическому материалу, трансформируемому в геном растения, а также к генетическому материалу,фланкирующему инсертированную последовательность."Гетерологичная" последовательность нуклеиновых кислот является последовательностью нуклеиновых кислот, не связанной в природе с клеткой-хозяином, в которую она вводится, включая многочисленные копии неприродного происхождения природной последовательности нуклеиновых кислот."Гомологичная" последовательность нуклеиновых кислот является последовательностью нуклеиновых кислот, естественно связанной с клеткой-хозяином, в которую она вводится."Функционально связанный" относится к ассоциации последовательности нуклеиновых кислот на отдельном фрагменте нуклеиновой кислоты так, что функционирование одной влияет на функционирование другой кислоты. Например, промотор функционально связан с кодирующей последовательностью или функциональной РНК, если он способен оказывать влияние на экспрессию такой кодирующей последовательности или функциональной РНК (т.е. кодирующая последовательность или функциональная РНК находится под транскрипционным контролем промотора). Кодирующая последовательность в смысловой или антисмысловой ориентации может быть функционально связана с регуляторной последовательностью."Праймеры", в том значении, в каком это понятие используется в данном документе, являются изолированной нуклеиновой кислотой, которая ренатурируется до комплементарной нити мишеневой ДНК путем гибридизации нуклеиновой кислоты для образования гибрида между праймером и нитью мишеневой ДНК, и затем удлиняется вдоль нити ДНК при помощи полимеразы, например ДНК-полимеразы. Пары праймеров или наборы применимы для амплификации молекулы нуклеиновой кислоты, например,путем полимеразной цепной реакции (ПЦР) или прочими традиционными методами амплификации нуклеиновой кислоты."Зонд" является изолированной нуклеиновой кислотой, к которой прикрепляется стандартная определяемая метка или репортерная молекула, например, радиоактивный изотоп, лиганд, хемилюминесцентный агент или фермент. Такой зонд комплементарен нити мишеневой нуклеиновой кислоты в данном изобретении нити геномного ДНК сорта MIR162 кукурузы. ДНК MIR162 может быть получена из растения кукурузы или из отдельного образца, который содержит ДНК трансгенного сорта MIR162. Зонды в соответствии с данным изобретением включают в себя не только дезоксирибонуклеиновую кислоту или рибонуклеиновую кислоту, но и полиамиды, и прочие материалы зонда, которые специфично связываются с мишеневой последовательностью ДНК и могут использоваться для обнаружения присутствия такой мишеневой последовательности ДНК. Длина праймеров и зондов в целом варьируется от 10 и 15 нуклеотидов в цепочке. Длина праймеров и зондов также может быть не менее 20 нуклеотидов или больше, или по меньшей мере 25 нуклеотидов или более, или 30 нуклеотидов или более. Такие праймеры и зонды специфично гибридизируются с целевой последовательностью в строгих условиях. Праймеры и зонды в соответствии с данным изобретением могут содержать полную последовательность с комплиментарностью к мишеневой последовательности, хотя зонды и отличаются от мишеневой последовательности, и сохраняют способность к гибридизации с мишеневой последовательностью, и создаются традиционными способами. В том значении, в котором он используется в данном документе, термин "стэкинг" генов или признаков обозначает объединение необходимых признаков в одну трансгенную линию. Агрономыселекционеры объединяют трансгенные признаки путем скрещивания между родителями, каждый из которых обладает желаемым признаком, и затем определяют потомство, которое обладает обоими желаемыми признаками. Другим способом стэкинга генов является встраивание двух или более генов в ядро клетки растения во время трансформации. Еще одним способом стэкинга генов является повторная трансформация трансгенного растения при помощи другого "представляющего интерес гена". Например,стэкинг генов может использоваться для объединения двух различных признаков стойкости к повреждениям насекомыми-вредителями, признака стойкости к повреждениям насекомыми-вредителями и признака устойчивости к болезням или признака устойчивости к гербицидам. Использование селектируемого маркра в дополнение к "представляющему интерес гену" также может рассматриваться как стэкинг генов."Строгие условия" или "строгие условия гибридизации" относят к условиям, при которых зонд гибридизируется со своей мишеневой последовательности, с гораздо более заметной степенью, чем с другой последовательностью. Жесткие условия являются зависимыми от мишеневой последовательности, и различаются в зависимости от структуры полинуклеотида. Контролируя строгость гибридизации и/или условия промывки, возможно определение мишеневой последовательности, которая на 100% комплементарна зонду (гомологичное зондирование). В качестве альтернативного варианта, жесткие условия регулируются таким образом, чтобы допустить некоторую несогласованность в последовательностях для обнаружения меньших степеней подобия (гетерологичное зондирование). Более длинные последовательности специфично гибридизируются при более высоких температурах. Подробное руководство по гибриди-5 021187 зации нуклеиновых кислот можно найти в труде Тиджссена (1993) "Лабораторные методы в биохимии и гибридизация с зондами нуклеиновой кислоты в молекулярной биологии", часть I, глава 2 "Обзор принципов гибридизации и методика количественного анализа зондов нуклеиновой кислоты", Эльсевье: НьюЙорк; и в "Текущих протоколах по молекулярной биологии", часть 2, Аусубель и др. ред., Грин Паблишинг и Уайли-Интерсайэнс: Нью-Йорк (1995), а также Самбрук и др. (2001) Молекулярное клонирование: Лабораторный практикум (5-я ред. лаборатория Коулд Спринг Харбор, Коулд Спринг Харбор, НьюЙорк). Как правило, специфичность является функцией промывания после гибридизации, критическими факторами является ионная сила и температура конечного промывочного раствора. В целом, гибридизация в строгих условиях и условия промывания задаются на уровне 5 С ниже температуры плавления от теплового излучения (Tm) для специфичной последовательности при определенной ионной силе и рН.Tm - температура (при определенной ионной силе и рН), при которой 50% мишеневой последовательности гибридизируются с полностью подходящим зондом. Как правило, в жестких условиях строгости зонд гибридизируется со своей мишеневой последовательностью, но не с другой последовательностью. Примером условий высокой строгости для гибридизации комплементарных нуклеиновых кислот,которые содержат более 100 комплементарных остатков на фильтре при нозерн- или саузерн-блоттинге,является 50% формамид с 1 мг гепарина при 42 С, при проведении гибридизации за ночь. Примером очень строгих условий при промывании является 0,15 М NaCl при 72 С в течение около 15 мин. Примером очень строгих условий промывания является 0.2 SSC при 65 С в течение 15 мин (см. Самбрук, инфра, для описания буферного раствора SSC). Примерные условия гибридизации для данного изобретения включают в себя гибридизацию в 7% ДСН, 0,25 М NaPO4 с рН 7,2 при 67 С за ночь, после двух промываний в 5% SDS, 0,20 М NaPO4 с рН 7,2 при 65 С в течение 30 мин для каждого промывания и двух промываний в 1% ДСН, 0,20 М NaPO4 с рН 7,2 при 65 С в течение 30 мин для каждого промывания. Характерной средой для промывки при строгих условиях для дуплекса, например более 100 нуклеотидов, является 1 ДСН при 45 С в течение 15 мин. Примером промывки при менее строгих условиях для дуплекса, например более 100 нуклеотидов, является 4-6 SSC при 40 С в течение 15 мин. Для зондов около 10 до 50 нуклеотидов условия высокой строгости, как правило, включают в себя концентрацию соли менее 1,0 М ионов Na, как правило, с концентрацией около от 0,01 до 1,0 М ионовNa (или других солей) при рН от 7,0 до 8,3, и при температуре, как правило, не менее 30 С. Условия высокой строгости также можно достичь при добавлении агентов дестабилизации, например формамида. В целом, соотношение сигнала к шуму 2 (или выше) в отличие от того, которое наблюдается для неродственного зонда в отдельном количественном анализе гибридизации, показывает обнаружение отдельной гибридизации. Нуклеиновые кислоты, которые не гибридизируются друг с другом, при более строгих условиях, все еще остаются преимущественно идентичными, если белки, которые они кодируют, преимущественно идентичны. Это происходит, например, когда копия нуклеиновой кислоты создается при максимальном вырождении кодона, допускаемое генетическим кодом. Ниже приводится примерная группа условий гибридизации/промывания, которые применимы для гибридизации нуклеотидных последовательностей, преимущественно идентичным стандартным нуклеотидным последовательностям данного изобретения: стандартная нуклеотидная последовательность предпочтительно гибридизуется со стандартной нуклеотидной последовательностью в 7% растворе додецилсульфата натрия (ДСН), 0,5 М NaPO4, 1 мМ ЭДТУ при 50 С с промывкой в 2 Х SSC, 0,1% ДСН при 50 С, более предпочтительно в 7% растворе додецилсульфата натрия (ДСН), 0,5 М NaPO4, 1 мМ ЭДТУ при 50 С с промывкой в 1X SSC, 0,1% ДСН при 50 С, более предпочтительно еще в 7% растворе додецилсульфата натрия (ДСН), 0,5 М NaPO4, 1 мМ ЭДТУ при 50 С с промывкой в 0.5 Х SSC, 0,1% ДСН при 50 С, предпочтительно в 7% растворе додецилсульфата натрия (ДСН), 0,5 М NaPO4, 1 мМ ЭДТУ при 50 С с промывкой в 0,1 Х SSC, 0,1% ДСН при 50 С, более предпочтительно в 7% растворе додецилсульфата натрия (ДСН), 0,5 М NaPO4, 1 мМ ЭДТУ при 50 С с промывкой в 0,1 Х SSC, 0,1% ДСН при 65 С. Последовательность данного изобретения может обнаруживаться во всех вышеуказанных условиях. В целях определения изобретения используются условия высокой строгости."Трансформация" - процесс введения гетерологичной нуклеиновой кислоты в клетку-хозяин или организм. В частности, "трансформация" означает устойчивую интеграцию молекулы ДНК в геном соответствующего организма."Трансформированный/трансгенный/рекомбинантный" относится к организму-хозяину, например к бактерии или растению, в которые была введена молекула нуклеиновой кислоты. Молекула нуклеиновой кислоты может устойчиво интегрироваться в геном хозяина, или молекула нуклеиновой кислоты также может присутствовать в качестве внехромосомной молекулы. Такая внехромосомная молекула может подвергаться ауторепликации. Подразумевается, что трансформированные клетки, ткани или растения включают в себя не только конечный продукт процесса трансформации, но и его трансгенное потомство.-6 021187 дикого типа, т.е. бактерии или растению, которые не содержат гетерологичную молекулу нуклеиновой кислоты. В том значении, в котором оно используется в данном документе, понятие "трансгенный" относится к растению, клетке растения или многообразию структурированных или не структурированных клеток растения с интегрированной путем применения хорошо известных способов генетического манипулирования и инсерции гена, последовательностью нуклеиновой кислоты, представляющей "представляющий интерес ген", в геном растения, и, как правило, в хромосому ядра клетки, митохондрию или в другие хромосомы, содержащие органеллу, на локусе который отличается от локуса нативного растения или клетки растения или для количества копий, превышающих то количество, которое присутствует в нативном растении или клетке растения. Трансгенные растения появляются в результате манипуляции и инсерции таких последовательностей нуклеиновых кислот, по сравнению с мутацией, происходящей естественным путем, для продуцирования ненатурального растения или растения с ненатуральным генотипом. Способы трансформации растений и клеток растений хорошо известны в данной области и могут предусматривать, например, электропорацию, микроинъекцию, трансформацию, опосредуемую агробактериями, и баллистическую трансформацию. В том значении, в котором оно используется в данном документе, понятие "уникальный" дляMIR162 означает отличительную характеристику MIR162. Поэтому нуклеиновые кислоты, уникальные для трансгенного сорта MIR162, не обнаружены в других растениях кукурузы, не относящихся к трансгенному сорту MIR162. Класс белков "Vip3" включает в себя, например, Vip3Aa, Vip3Ab, Vip3Ac, Vip3Ad, Vip3Ae, VipAf,Vip3Ag, Vip3Ba и Vip3Bb и их гомологи. "Гомолог" означает, что указанный белок или полипептид имеют определенную связь с членами класса белков Vip3. "Vip3Aa20" - гомолог Vip3, уникальный для трансгенного сорта MIR162. Он был создан путем спонтанных мутаций, встроенных в ген vip3Aa19, оптимизированный для кукурузы, содержащийся в pNOV1300 (SEQ ID : 3) во время процесса трансформации растения. Данное изобретение описывает специфичный сайт на хромосоме 5 в геноме кукурузы, который подходит для встраивания гетерологичной нуклеиновой кислоты. Также описываются молекулярный маркр 5' (opie2; нуклеотиды 1680-3338 SEQ ID : 106) и молекулярный маркр 3' (gag; нуклеотиды 43275-45086 SEQ ID : 106), пригодные для определения расположения целевого сайта на хромосоме 5. Поэтому данное изобретение предлагает способы введения гетерологичной нуклеиновой кислоты в заранее определенный выбранный сайт или вблизи этого выбранного сайта. Одним из вариантов для выполнения такого направленного инсертирования является замена различного инсерта вместо полигенного экспрессирующего кластера, vip3Aa20, представленного здесь. В данном общем отношении, целевая гомологичная рекомбинация, например, без ограничения может использоваться в соответствии с данным изобретением. "Гомологичная рекомбинация" относится к реакции между любой парой нуклеотидных последовательностей с соответствующими сайтами, содержащими аналогичную нуклеотидную последовательность (например, гомологичную последовательность), через которую две молекулы могут взаимодействовать (рекомбинировать) для образования новой, рекомбинантной последовательности ДНК. Сайты аналогичной нуклеотидной последовательности называются здесь как "гомологичная последовательность". В целом, частота гомологичной рекомбинации увеличивается с увеличением длины гомологичной последовательности. Поэтому в то время, как гомологичная рекомбинация может происходить между двумя нуклеотидными последовательностями, которые менее идентичны, частота рекомбинации (или эффективность) уменьшается с увеличением дивергенции между двумя последовательностями. Рекомбинация может проводиться с использованием одной гомологичной последовательности на каждом доноре и молекулах-мишенях, создавая продукт регенерации "единичный кроссовер". В качестве альтернативного варианта, две гомологичные последовательности могут располагаться на каждой мишеневой и донорской нуклеотидной последовательности. Рекомбинация между двумя гомологичными последовательностями на доноре с двумя гомологичными последовательностями на мишени приводят к появлению продукта рекомбинации "двойного кроссовер". В случае, если гомологичные последовательности на молекуле донора фланкирует с последовательностью, которой можно управлять (например, представляющая интерес последовательность), то соединение двойного кроссовера с молекулой-мишенью может привести к получению продукта рекомбинации, причем представляющая интерес последовательность заменяет последовательность ДНК, которая была первоначально между гомологичной последовательностью на молекуле-мишени. Замена последовательности ДНК между мишенью и донором за счет рекомбинации двойного кроссовера называется "замена последовательности." Данный тип технологии является, к примеру, темой патентной заявки США 2006/0253918, включенной в документ со ссылкой. При помощи описанного целевого сайта и последовательностей окружающих выбранный сайт, специалист,знакомый с данной областью, подтвердит, что могут использоваться прочие способы для направленной интеграции гетерологичной нуклеиновой кислоты. Такие способы, например, без ограничения, раскрыты в патентной заявке 2007/0039074 и патентной заявке США 2006/0130179. В одном варианте исполнения данное изобретение объединяет в себе хромосомный целевой сайт кукурузы, расположенный на хромосоме 5 между молекулярным маркром opie2, описываемым в виде нуклеотидов 1680-3338 SEQ ID : 106, и молекулярным маркром gag, описываемым в виде нуклеоти-7 021187 дов 43275-45086 SEQ ID : 106, причем целевой сайт содержит гетерогенную нуклеиновую кислоту. В другом варианте исполнения хромосомный целевой сайт кукурузы расположен на хромосоме 5 между нуклеотидами 25454 и 25513 SEQ ID : 106. Еще в другом варианте исполнения хромосомный целевой сайт 5' фланкируется нуклеотидами 5454-25454 SEQ ID : 106 и 3' фланкируется с нуклеотидами 2551345513 SEQ ID : 106. В одном варианте исполнения данное изобретение объединяет в себе способ получения трансгенного растения кукурузы, предусматривающий инсертирование гетерогенной нуклеиновой кислоты в положении на хромосоме 5, расположенной между молекулярным маркром opie2, описываемым в виде нуклеотидов 1680-3338 SEQ ID : 106, и молекулярным маркром gag, описываемым в виде нуклеотидов 43275-45086 SEQ ID : 106. В другом варианте исполнения гетерологичная нуклеиновая кислота инсертируется на хромосому 5 между нуклеотидами 25454 и 25513 SEQ ID : 106. Еще в другом варианте исполнения инсертированная гетерологичная нуклеиновая кислота 5' фланкируется с нуклеотидами 5454-25454 SEQ ID : 106 и 3' фланкируется с нуклеотидами 25513-45513 SEQ ID : 106 Трансгенный генотип данного изобретения может встраиваться в любой кукурузный инбред или гибрид при помощи признанных методик скрещивания. Цель селекции растений - объединить в одно многообразие или гибрид различные желаемые признаки. Для полевых растений такие признаки могут включать в себя сопротивление к повреждению насекомыми и стойкость к болезням, стойкость к гибридам, стойкость к теплу и засухе, уменьшение времени на спелость, повышение урожая, и улучшение агрономических характеристик. При машинной уборке кукурузы единообразие характеристик растения,например прорастание и образование ствола, ежегодный прирост, зрелость и высота растения и высота початка, имеют важное значение. Полевые сорта кукурузы выращиваются с применением способов, которые имеют преимущества над способом опыления растений. Растение самоопыляется, если пыльца от одного цветка переносится на тот же или другой цветок того же растения. Растение перекрестно опыляется, если пыльца переходит от цветка на другое растение. Растения, которые самоопыляются и подбираются по типу, стали гомозиготными почти на всех локусах генов и дают равномерную популяцию потомства для разведения гомозигот. Скрещивание между двумя разными гомозиготными линиями дает равномерную популяцию гибридных растений, которые могут быть гетерозиготными для большинства локусов генов. Скрещивание двух растений, каждое из которых является гетерозиготным для ряда локусов генов, дают популяцию гибридных растений, отличающихся генетически, и не будут равномерными. Кукурузу (Zea mays L.) можно выращивать путем применения как методик гомоклинного опыления, так и перекрестного опыления. Кукуруза содержит отдельно женские и мужские цветки на одном и том же растении, расположенные на метелке и початке соответственно. Естественное опыление происходит на кукурузе, когда ветер сдувает пыльцу из метелки на пестичные столбики, которые выступают с верхней части початка. Надежный способ контроля оплодотворяющей способности в растениях дат возможность улучшенного скрещивания растения. Это особенно необходимо для развития гибридов кукурузы, что зависит в некоторой степени от системы мужской стерильности. Есть несколько вариантов контроля над оплодотворяющей способностью, доступной для селекционеров, а именно ручное или механическое удаление несозревших пестиков (или удаление метелок), цитоплазматическая мужская стерильность, генетическая мужская стерильность, гаметоциды и др. Как правило, семена гибридной кукурузы вырабатываются при помощи системы мужской стерильности, включающей в себя ручное или механическое удаление несозревших цветков. Чередующиеся стрипы двух кукурузных инбредов выращиваются высаживаются в поле, и метелки, наполненные пыльцой, срезаются с инбредов (женских). При условии, что есть достаточная изоляция от источников пыльцы от чужого зерна, початки обессултаненного инбреда оплодотворяются только от другого инбреда(мужского), и получившееся семя становится гибридом и образует гибридное растение. Трудоемкий и зачастую ненадежный процесс обреза метелок можно не использовать, а применять несколько способов создания генетической мужской стерильности в данном способе, каждый из которых имеет свои преимущества и недостатки. В таких способах используют большое многообразие подходов,например, доставка в растение гена, кодирующего цитотоксическую субстанцию, связанную тканеспецифичным промотором ткани мужской особи или с антисмысловой системой, в которой определяется ген, важный для фертильности и затем антисенс такого гена инсертируется в растение (см. Фабинянский и др. ЕРО 89/3010153.8, публикация 329308 и публикация РСТ/СА 90/00037, опубликованная какWO 90/08828). Использование инбредов, обладающих мужской стерильностью, является единственным фактором при селекции гибридов кукурузы. Способы получения растений известны в данной области и могут использоваться в программе селекции растения кукурузы, включая, без ограничения, рекуррентную селекцию, обратное скрещивание, племенной подбор, улучшенную селекцию путем ограничения длины полиморфизмов, улучшенная селекция генетических маркров и трансформацию. Развитие гибридов кукурузы в программе выращивания растения кукурузы, в целом, требует разработки инбредных гомозиготных-8 021187 линий, скрещивания таких линий и оценки скрещиваний. Племенной подбор и методы рекуррентной селекции используются для развития инбредных линий из популяции скрещивания. Программы скрещивания растения кукурузы объединяют в себе генетический фон от двух или более инбредных линий или различных прочих источников зародышевой плазмы в пулы скрещивания, на основе которых разрабатываются новые инбредные линии путем самоопыления и селекции нужных фенотипов. Новые инбреды скрещиваются с прочими инбредными линиями, и гибриды от таких скрещиваний оцениваются для определения того, какие из них обладают коммерческой ценностью. Селекция растений и развитие гибридов, как это осуществляется в программе селекции растения кукурузы, является затратным процессом,требующим много времени. Племенной подбор начинается со скрещивания двух генотипов, каждый из которых может иметь одну или несколько требуемых характеристик, которая отсутствует в другом или которая дополняет другой. В случае, если два оригинальных родителя не обладают всеми необходимыми характеристиками, то другие источники могут быть включены в популяцию скрещивания. Согласно методу племенного подбора высшие растения самоопыляются и селектируются в последующих поколениях. В последующих поколениях гетерозиготное состояние изменяется для гомологичных линий в результате гомоклинного опыления и селекции. Как правило, при племенном подборе скрещивания используется пять или более поколений для самоопыления и селекции: F1F2; F2F3; F3F4; F4F5 и т.д. Скрещивание рекуррентной селекции, например обратное скрещивание, применимо для усовершенствования инбредной линии и гибрида, который получается при использовании таких инбредов. Обратное скрещивание может использоваться для передачи отдельного специфичного признака от одного инбреда или источника к инбреду, у которого такой признак отсутствует. Например, это может проводиться путем первого скрещивания высшего инбреда (рекуррентный родитель) с инбредным донором(небэккроссируемый родитель), который предоставляет соответствующий(е) ген(ы) для рассматриваемого признака. Потомство такого скрещивания затем заново скрещивается с высшим рекуррентным родителем после селекции в получившемся потомстве для передачи желаемого признака от небэккроссируемого родителя. После пяти или более поколений обратного скрещивания с селекцией желаемого признака, потомство становится гомозиготными для локуса, контролирующего передаваемую характеристику,но становится схожим с высшим родителем практически по всем генам. Последнее поколение обратного скрещивания затем самоопыляется для чистого разведения потомства для передаваемого(ых) гена(ов). Гибрид, полученный из инбредов, содержащих передаваемый(е) ген(ы), практически тот же самый, что и гибрид, полученный из тех же инбредов без передачи гена(ов). Элитные инбредные линии, т.е. чистопородное разведение, гомозиготные инбредные линии, также могут использоваться как сырь для скрещивания или исходной популяции, из которой развиваются другие инбредные линии. Такие инбредные линии, полученные из элитных инбредных линий, могут разрабатываться с использованием чистопородного разведения и способов рекуррентной селекции, описанных ранее. В качестве примера, если используется возвратное скрещивание для создания таких производных линий в программе скрещивания растения кукурузы, элитные инбреды применимы в качестве родительской клеточной линии или сырья или исходного поколения и могут служить в качестве либо донора, либо рекуррентного родителя. Результаты простого скрещивания гибрида кукурузы полученного путм скрещивания двух инбредных линий, каждая из которых имеет генотип, который комплементирует генотип другого инбреда. Гибридное потомство первого поколения обозначается как F1. Для разработки коммерческих гибридов в программе скрещивания растения кукурузы используется только гибридное растение F1. Предпочитаемые гибриды F1 более эффективны, чем их инбредные родители. Такая гибридная сила или гетерозис может проявляться во многих полигенных признаках, включая увеличение темпов вегетативного роста и урожайности. Разработка гибрида кукурузы в программе скрещивания растения кукурузы включает в себя три этапа: (1) селекцию растений из различных пулов зародышевой плазмы для первоначального скрещивания; (2) самоопыление выбранных растений из скрещивания для различных поколений для выращивания серии инбредных линий, которые, хотя они и отличаются друг от друга, точно скрещиваются и довольно единообразны; (3) скрещивание выбранных инбредных линий с различными инбредными линиями для выращивания гибридного потомства (F1). Во время процесса инбридинга кукурузы эффективность линий уменьшается. Сила восстанавливается, если две разные инбредные линии скрещиваются для выращивания гибридного потомства (F1). Важным последствием гомозиготности и гомогенности инбредных линий является то, что гибрид между парой инбредов всегда остается тем же самым. Как только инбреды, которые дают высший инбред, будут определены, семя гибрида может воспроизводиться до бесконечности,до гомогенности инбредных родителей. Простой гибрид продуцируется, когда две инбредные линии скрещиваются для выращивания потомства F1. Двойной гибрид продуцируется из четырех инбредных линий, скрещенных парами (А X В и С X D), и затем два гибрида F1 скрещиваются вновь (А X В) X (С X D). Трехлинейный гибрид вырабатывается из трех инбредных линий, когда две инбредные линии скрещиваются (А X В), и вновь образуемый гибрид F1 скрещивается с третьим инбредом (А X В) X С. Большая часть гибридной силы, проявляемой у-9 021187 гибрида F1, теряется в следующем поколении (F2). Следовательно, семена гибридов не используются в качестве посадочного материала. Селекция гибридного семени требует сокращения или уменьшения активности пыльцы, выработанной женской особью. Неполное исключение или уменьшение активности пыльцы приводит к возможному самоопылению. Такое семя, самоопыление которого произошло непроизвольно, может случайно собираться и упаковываться с гибридным семенем. Сразу после того, как растение будет посажено, есть возможность определить и выбрать путем селекции такие растения с самоопылением. Растения с самоопылением генетически эквивалентны женской инбредной линии для продуцирования гибрида. Как правило, такие растения с самоопылением можно определять и выбирать из-за их уменьшенной силы. Женские виды могут идентифицироваться по их менее четкому броскому виду для вегетативных и/или репродуктивных характеристик, включая укороченную высоту растения, меньший размер початка,форму початка и ядра, цвет стержня кукурузного початка или прочие характеристики. Идентификация таких линий с самоопылением может проводиться путем анализа молекулярных маркров. См. п. "Идентификация женских особей в гибридной кукурузе: Сопоставление с использованием электрофореза и морфологии", Смит Дж.Эс.Си. и Вяч Р.Д. Seed Science and Technology 14, с. 1-8(1995), информация о которых включена в данный документ со ссылкой. Используя такие технологии,гомозиготность линии самоопыления может проверяться путем анализа аллеломорфного состава на различных локусах в геноме. Такие методы позволяют быстро определить сорт, указанный в данном документе. См. также "Идентификация атипичных растений в семенах гибридной кукурузы путем контроля после завершения процедуры и электрофореза" Сарка В и др. Probleme de Genetica Teoritica si AplicataVol. 20 (1), с. 29-42. Для специалиста в данной области совершенно очевидно что, вышеприведнное - только лишь некоторые из способов, посредством которых можно получить инбред данного изобретения, в попытках встраивания трансгенного генотипа в другие линии зерна. Есть и другие средства, и приведнные примеры представлены только в качестве иллюстрации. Цель следующих примеров только дать наглядное представление об одном или нескольких предпочитаемых вариантах исполнения, и они не должны толковаться как ограничивающие объем изобретения. Примеры Пример 1. Трансформация и селекция трансгенного сорта MIR162. Сорт MIR604 было получен путем трансформации опосредуемой агробактериями запатентованной линии кукурузы (Zea mays). Незрелые эмбрионы были трансформированы, преимущественно способом,указанным в работе Негротто и др. (Отчеты о растительных клетках 19: 798-803, 2000), включенной в настоящий документ ссылкой, с помощью фрагмента ДНК из плазмида pNOV1300 (SEQ ID : 3).pNOV1300 содержит нуклеотидную последовательность, включающую в себя последовательные полигенные экспрессирующие кластеры. Первый полигенный экспрессирующий кластер содержит промоторную область ZmUbilnt полибикитинового гена Zea mays, который содержит первый интрон (входящий номер в GenBank S94464), функционально связанный с кодирующей последовательностью vip3Aa19,далее функционально связанный с интроном 9 пептидазы-С гена фосфоенолпируваткарбоксилазы(входящий номер в GenBank X15239) Zea mays (Матсуока и Минамиб 1989. European J. of Biochem. 181:593-598), и 35S терминаторной последовательностью РНК 35S генома вируса мозаики цветной капусты (аналогично входящему номеру в GenBank AF140604). Его функция заключается в обеспечении полиаденильной последовательности (Фрэнк и др., 1980. Клетка 21:285-294). Ген vip3Aa19 в pNOV1300 включает синтетическую кодирующую последовательность vip3Aa, оптимизированную для кукурузы(Эстрах и др., 1999), синтезированную для обеспечения предпочтительного использования кодона для кукурузы (Муррэй и др., 1989). Синтетическая кодирующая последовательность vip3Aa19, используемая в трансформациях растений, кодирует идентичную аминокислотную последовательность в качестве нативной кодирующей последовательности vip3Aa1, обнаруженной в штамме АВ 88 (патент США 5877012) почвенных бактерий Bacillus thuringiensis, кроме единственного различия в аминокислоте в положении 284; нативная кодирующая последовательность vip3Aa1 кодирует лизин, а синтетическая кодирующая последовательность кодирует глютамин в данном положении. Кодирующая последовательность vip3Aa1 кодирует белок для борьбы с насекомыми, vip3Aa19, который обеспечивает устойчивость к чешуекрылым насекомым. Второй полигенный экспрессирующий кластер состоит из промотора ZmUbilnt, функционально связанного с кодирующей последовательностью pmi (также известной как E.coli manA), кодирующей фосфоманнозаизомеразу (входящий номер в GenBank M15380), которая катализирует изомеризацию манноза-6-фосфат в фруктоза-6 фосфат (Негротто и др., 2000). Кодирующая последовательность pmi далее функционально связана с синтаза 3' терминацией конечной транскрипции и полиаденильной последовательностью. Незрелые эмбрионы были извлечены из 8-12 дневных початков и промыты свежей средой при подготовке к трансформации. Эмбрионы смешивались с суспензией клеток Agrobacterium, содержащей вектор трансформации pNOV1300, взбалтывали в течение 30 с и помещали в инкубатор еще на 5 мин. Избы- 10021187 точный раствор, содержащий Agrobacterium, удалили, а эмбрионы поместили в чашечки, содержащие неселективную питательную среду. Эмбрионы выращивались совместно с оставшимися Agrobacterium при температуре 22 С в течение 2-3 дней в темноте. Затем эмбрионы были помещены в питательную среду с тицарциллином (100 мг/мл) и нитратом серебра (1,6 мг/л) и выращивались в инкубаторе в темноте 10 дней. Эмбрионы, продуцирующие эмбриогенный каллюс, были помещены в среду культивирования клеток, содержащую маннозу. Регенерированные ростки были исследованы при помощи анализа TAQMAN ПЦР (см. пример 2) на присутствие обоих генов pmi и vip3Aa19, а также на отсутствие гена резистентности к спектиномициновым антибиотикам. Позднее было обнаружено (см. пример 4 ниже), что в процессе трансформации, в кодирующую последовательность vip3Aa19 были встроены две мутации, одна из которых привела к изменению аминокислоты в белке vip3Aa19. Поэтому такая новая кодирующая последовательность vip3Aa,присущая только трансгенному сорту MIR162, была обозначена как vip3Aa20. Кодирующая последовательность vip3Aa20 кодирует изолейцин в положении 129 вместо остатков метионина, кодируемых геном vip3Aa19. Культуры, положительные на присутствие обоих трансгенов и отрицательные на ген spec, были помещены в теплицу для дальнейшего развития. Положительные сорта были идентифицированы и проведн их скрининг при помощи биоанализа в отношении совки травяной. Инсектицидные сорта были характерны для ряда копий при анализе TAQMAN. MIR162 был выбран для дальнейшего анализа на основании наличия единственной копии трансгенов, хорошей экспрессии белка, установленной иммуноферментным твердофазным анализом, и хорошего инсектицидного действия в отношении совки травяной. Генеалогическая схема селекции трансгенного сорта MIR162 следующая: растение Т 0 MIR162 (хB9620). Материал растения поколения ВС 4 использовался для саузерн-анализа, определения количества копий и последовательности инсерционной ДНК. Негативные контроли для экспериментов состояли из 10 отдельных отрицательных растений поколения ВС 4. Пример 2. MIR162. Детектирование при помощи TAQMAN ПЦР. Анализ TAQMAN проводился в основном, как это описано в работах Ингхэм и др. (Биотехнология,31:132-140, 2001), включенных в настоящий документ ссылкой. Кратко, геномная ДНК была выделена из листьев трансгенных и нетрансгенных растений кукурузы с использованием набора для извлечения геномной ДНК Puregene ("Gentra Systems", Миннеаполис, штат Миннесота) в соответствии с инструкцией производителя, за исключением того, что все этапы выполнялись в 1,2 мл 96-ячеечных чашечках. Сухой остаток ДНК поместили для повторного растворения в буферный раствор ТЕ (10 мМ трис-HCl, рН 8,0, 1 мМ ЭДТА). Реакции ПЦР TAQMAN проводились в 96-ячеечных чашечках. Для эндогенного генетического контроля кукурузы были разработаны праймеры и зонды, характерные для кодирующей последовательности спиртовой дегидрогеназы (adhl) Zea mays (входящий номер в Genbank AF044295). Специалист,знакомый с данной областью, признает, что другие гены растений кукурузы могут использоваться в качестве средств эндогенного контроля. Реакции были усилены, чтобы одновременно увеличить vip3Aa иadhl или pmi и adhl. Для каждого праймера была создана основная смесь, состоящая из 20 мкл извлеченной геномной ДНК и 35 мкл 2 х универсальной мастер-смеси для проведения ПЦР TAQMAN ("AppliedBiosystems"), дополненная праймерами до окончательной концентрации 900 нМ каждая, зондами с окончательной концентрацией 100 нМ каждый, и водой с окончательным объемом 70 мкл. Такая смесь была разлита в трех экземплярах по 20 мкл в 96-ячеечные чашечки для амплификации и запечатана оптически чистой теплоизолирующей пленкой ("Marsh Bio Products"). ПЦР проводилась в аппарате "ABI Prism 7700" со следующими параметрами амплификации: 2 мин при 50 С и 10 мин при 95 С, за которыми следуют 35 циклов по 15 с при 95 С и 1 мин при 60 С. Результаты анализа TAQMAN показали, что трансгенный сорт MIR162 имел только одну копию гена vip3Aa20 и одну копию гена pmi. Праймеры и зонды, используемые в реакциях ПЦР при проведении TAQMAN, указаны в табл. 1. Пример 3. Детектирование MIR162 при помощи способа Саузерн-блоттинга. Геномная ДНК, использованная для Саузерн-анализа, была выделена из общей ткани листвы 10 растений, представляющих поколение ВС 4 MIR162 преимущественно с использованием способа в работе Томаса и др. (Theor. Appl. Genet. 86:173-180, 1993), включенной со ссылкой. Все растения, используемые для выделения ДНК, были проанализированы в отдельности с применением реакции TAQMAN ПЦР(как описано в примере 2) для подтверждения присутствия одной копии гена vip3Aa20 и гена pmi. Для отрицательных сегрегантных контролей, ДНК была выделена из общей ткани листвы отрицательных сегрегантов поколения ВС 4. Такие отрицательные сегрегантные растения анализировались в отдельности с использованием реакции TAQMAN ПЦР для подтверждения отсутствия гена vip3Aa20 и гена pmi, но была, как и ожидалось, положительной для гена эндогенной кукурузы adhl. Саузерн-анализ проводился с использованием стандартных способов молекулярной биологии (см. Хомецинский П., 1992. Аналитическая биохимия 201:34-139). Геномная ДНК (7,5 мкг) расщеплялась рестрикционными ферментами, которые расщепляли внутри инсерта трансгенного сорта MIR162, но не внутри кодирующей последовательности, которая соответствует специфичному зонду, используемому в эксперименте. Такой подход позволил детектировать количество копий каждого гена, соответствующего специальному зонду, используемому для каждого Саузерн-анализа, вводимых в трансгенный сортMIR162. Проводились другие серии рестрикционных расщеплений, в которых инсерт расщеплялся рестрикционными ферментами, которые высвободили бы фрагмент известного размера из инсерта. Такой подход предоставил дополнительное подтверждение присутствия единичной копии каждой кодирующей последовательности присутствующей в MIR162, и позволил детектировать частичные копии инсерта, который мог быть плотно связан с инсертом MIR162. После электрофореза в агарозном геле и переноса щелочи к мембране Zeta-Probe GT (Bio-Rad, кат.162-0195), проводилась гибридизация с использованием полных образуемых во время ПЦР элементных зондов. Зонды метились 32 Р с помощью выборочного праймирования с использованием системы MegaPrime (Amersham Biosciences, кат.RPN1607). Гибридизация проводилась при 65 С, после многократного промывания в 2 Х SSC, 0,1% ДСН и затем 0,1 Х SSC и 0,1% ДСН. Затем мембраны были подвергнуты радиоавтографии. В каждый Саузерн-анализ были включены три контрольных образца: (1) ДНК отрицательного (нетрансформированного) сегреганта, использованного для идентификации любой эндогенной последовательности Zea mays, которая может перекрестно гибридизироваться с элемент-специфичным зондом; (2) ДНК отрицательного сегреганта, в который было введено определнное количество расщеплнногоpNOV1300, который соответствует одной копии, исходя из размера плазмида, для демонстрации чувствительности эксперимента по детектированию одной копии гена в геноме Zea mays; и (3) расщеплнный плазмид pNOV1300, соответствующий одному числу копий, исходя из размера плазмида, в качестве положительного контроля для гибридизации, а также для демонстрации чувствительности эксперимента. Результаты Саузерн-анализа показали, что инсерт MIR162 содержит единичную копию генаvip3Aa20 и гена pmi и не содержит базовой последовательности pNOV1300. Зонд vip3Aa19 (SEQ ID : 13) использовался для Саузерн-анализа vip3Aa20. Нуклеотидные последовательности vip3Aa19 иvip3Aa20 отличаются двумя нуклеотидами, и на 99,9% являются идентичными. Поэтому зонд vip3Aa19 гибридизировался с последовательностью vip3Aa20, присутствующей в MIR162 при более строгих условиях. Использование зонда vip3Aa19, гидролизата KpnI и EcoRV привело к отдельным бэндам гибридизации примерно 8 и 13 kb соответственно. Кроме того, двойное расщепление NcoI привело к единичны бэндам гибридизации, соответствующим ожидаемому размеру 4,6 kb. Использование зонда pmi (SEQ ID: 14), Асс 65I и гидролизата BamHI, привело к появлению бэнда гибридизации размером около 4 kb и 6kb соответственно. Кроме того, двойное расщепление XmaI + HindIII привело к появлению отдельному бэнду гибридизации, соответствующему ожидаемому размеру в 8,1 kb. Бэнд размером 8,1 kb XmaI +HindIII pNOV 1300 (положительный контроль) также гибридизировался с зондами vip3Aa19 и pmi, как ожидалось. Была обнаружена некоторая перекрестная гибридизация только в ряде плазмидов с лэддерным зондом ДНК. Как правило, коммерчески доступные лэддеры ДНК могут содержать некоторые векторные последовательности, которые могут перекрестно гибридизироваться с контрольными последовательностями плазмида, как установлено в данном эксперименте, но это не влияет на результаты исследования. И, наконец, основной зонд pNOV1300 не гибридизировался, что явилось признаком отсутствия включения любой основной последовательности вектора pNOV1300 в MIR162 во время процесса трансформации. Пример 4. Секвенирование инсерта гетерологичной ДНК. Определены нуклеотидная последовательность vip3Aa и кодирующие последовательности pmi в молекуле гетерологичной ДНК, инсертируемой в MIR162, для демонстрации общей целостности инсерта, смежности функциональных элементов и для детектирования любых индивидуальных изменений в паре оснований. Кодирующая последовательность была амплифицирована от ДНК, полученного из поколения ВС 4. ПЦР амплификация проводилась с использованием либо системы ПЦР высокой точности(Expand High Fidelity) (Роше, кат.1732650) или PfuUltra Hotstart ДНК полимеразы высокой точности(Stratagene, кат.600390). Каждый продукт ПЦР был индивидуально клонирован либо в любой из векторов pCR-XL-TOPO (Invitrogen, кат.K4700-20) либо в вектор pCR-BluntII-ТОРО (Invitrogen, кат.K2800-20), и три отдельных клона для каждого продукта ПЦР были определены и секвенированы. Секвенирование последовательности проводилось с помощью анализатора ABI3730XL при помощи химии ABI BigDye 1.1 или Big Dye 3.1 dGTP (для GC-богатых матриц, насыщенных). Анализ последовательности проводился с использованием пакета Phred, Phrap и Consed из Университета Вашингтона, до процента ошибок менее 10,000 случаев (Эвинг и Грин, 1998. исследование геномов 8:186-194). Окончательная консенсусная последовательность для каждого гена определялась путем комбинации данных последовательности от трех индивидуальных клонов для генерации одной консенсусной последовательности для каждого гена. Выравнивание последовательности проводилось с использованием программыClustalW со следующими параметрами: матрица количественной оценки blosum55, поправка на открытие гэпа 15, поправка на открытие гэпа 6.66 (Томпсон и др., 1994. исследование нуклеиновой кислоты 22:4673-4680). Полная кодирующая последовательность vip3Aa20 - это ПЦР амплифицированная с использованием праймеров MOV3Aa-01-5': 5'ATGAACAAGAACAACACCAA3' (SEQ ID : 15) и MOV3Aa-01-3': 5'CTACTTGATGCTCACGTCGTAG3' (SEQ ID : 16) и фермент PfuUltra Hotstart, генерирующий продукт 2370bp. ПЦР ампликон был секвенирован с использованием праймеров, показанных в табл. 2. Две другие реакции ПЦР перекрывали кодирующую последовательность vip3Aa20. Конец 5'vip3Aa20 был охвачен в результате ПЦР амплификации с использованием праймеров 162INSERT-F2: 5'ACACCAATGATGCAAATAGGC3'VIPR4 5'GAAGGTGTTCAGGTAGAACTCGAAG3' (SEQ ID : 37) и Expand High Fidelity enzyme. Вторая реакция перекрыла 3' окончание vip3Aa20; продукт был амплифицирован праймерами VIP-F3:(SEQ ID : 43) и Expand High Fidelity enzyme. Ампликоны, сгенерированные в результате двух реакций,содержали нуклеотидную последовательность 2946 bp (SEQ ID : 38) и нуклеотидную последовательность 2577 bp (SEQ ID : 44) соответственно. Данные по консенсусной последовательности выявили два изменения в нуклеотидах в кодирующей последовательности vip3Aa в MIR162 (обозначенная как vip3Aa20), по сравнению с кодирующей последовательностью vip3Aa в pNOV1300 (обозначенная как vip3Aa19), которая использовалась для трансформации трансгенного сорта MIR162. Первое нуклеотидное изменение, мутация G в Т, произошло в положении 387 кодирующей последовательности vip3Aa19 (SEQ ID : 3). Такая мутация привела к изменению метионина в положении 129 vip3Aa19, на изолейцин в Vip3Aa20 (M129I). Второе нуклеотидное изменение произошло в положении 1683 кодирующей последовательности, мутация G на С, но не привело к аминокислотному изменению. Поэтому кодирующая последовательность vip3Aa20 и белокVip3Aa20 являются уникальными для трансгенного сорта MIR162 и применимы для идентификации любого растения, содержащего трансгенный генотип MIR162. Кодирующая последовательность pmiMIR162 была идентична той, которая наблюдалась для трансформационного плазмида pNOVBOO. Сравнительный анализ первичной структуры инсектицидных белков Vip3Aa20 и vip3Aa19 представлен в табл. 3.- 14021187 Таблица 3 Сравнение аминокислотной последовательности Vip3Aa20 и vip3Aa19 Затененная графа указывает на изменение аминокислоты. Пример 5. Анализ фланкирующей последовательности ДНК. Известно несколько способов для специальных знаний по амплификации неизвестных последовательностей ДНК, располагающихся по соседству с областью ядра последовательности. Такие способы включают в себя, без ограничения, обратную ПЦР (i-ПЦР) [Охман и др. Генетика 120:621-623 (1988); Триглия и др., Нуклеиновая кислота. 16:8186 (1988)], принудительную ПЦР [Джонс и Винисторфер,Нуклеиновая кислота 20:595-600 (1992); Джонс и Винисторфер, Биотехнологии 23:132-138 (1997)], ПЦР с заякоренной кассетой сшивания [Мюллер и Вольд, Science 246:780-786 (1989)], vectorette ПЦР [Рили и др., нуклеиновая кислота. 18:2887-2890 (1990)], новый Alu-ПЦР [Пускас и др., нуклеиновая кислота 22:3251-3252 (1994)] и Thermal Assymetric Interlaced PCR (TAIL-PCR) [Лиу и Виттир, Genomics 25:673681 (1995)]. Другой способ, используемый для амплификации последовательности геномной ДНК кукурузы,фланкирующей гетерологичную ДНК, инсертируемую в трансгенный сорт MIR162, был vectorette PCR,описанный у Рили и др., Нуклеиновые кислоты Res. 18:2887-2890 (1990), включенный со ссылкой. Подтверждены фланкирующая последовательность 5' и связующая последовательность при помощи стандартных процедур ПЦР. Использовались следующие пары праймеров или их комплементов для подтверждения последовательности: 162INSERT-F2: 5'ACACCAATGATGCAAATAGGC3' (SEQ ID : 36)/(SEQ ID : 40). Получившийся ампликон содержит последовательность, указанную в SEQ ID : 41, и объединяет в себе 5' связующую последовательность SEQ ID : 45. Установлено, что другие последовательности праймеров могут использоваться для подтверждения фланкирующей и связующей последова- 16021187 тельности. При помощи данного способа, был обнаружен инсерт MIR162, 5'-фланкируемый нуклеотидами 1040-1088 геномной последовательности кукурузы, указанной в SEQ ID : 46. Более крупная область 5'-фланкирующей последовательности трансгенного сорта MIR162 был создана при помощи набора Seegene DNA Walking SpeedUp в соответствии с инструкциями производителя. Первая реакция ПЦР проводилась независимо в четырех пробирках с использованием праймераFE1002: 5'CGTGACTCCCTTAATTCTCCGCT3' (SEQ ID : 50) с одним из праймеров DW-ACP 1, 2, 3 или 4, поставляемых производителем. В ПЦР пробирке на льду были перемешаны следующие реагенты: 100 мкг геномной ДНК MIR162, 4 мкл 2,5 мкМ DW-ACP (каждый с DW-ACP 1, 2, 3 или 4), 4 мкл 2,5 мкМ FE1002, 19 мкл дистиллированной воды и 25 мкл 2 Х SeeAmpTM ACPTM Master Mix II. Колбы были помещены в заранее нагретый (94 С) термоциклер. ПЦР проводилась с использованием следующей программы: один цикл при 94 С в течение 5 мин, при 42 С в течение 1 мин и при 72 С в течение 2 мин,30 циклов при 94 С в течение 40 с, при 55 С в течение 40 с и при 72 С в течение 90 с, и один цикл при 72 С в течение 7 мин. Продукты ПЦР были очищены при помощи экзонуклеазы I и щелочной фосфатазы из креветок. Вторая реакция ПЦР проводилась независимо в четырех отдельных пробирках с использованием праймера FE1003: 5'GATCAGATTGTCGTTTCCCGCCTT3' (SEQ ID : 51) с праймером DW-ACPN, поставляемым производителем набора. В колбе ПЦР на льду смешивались следующие реагенты: 3 мкл очищенного продукта ПЦР, 1 мкл 10 мкМ DW-ACPN, 1 мкл 10 мкМ FE1003, 5 мкл дистиллированной воды и 10 мкл 2 Х SeeAmpTM ACPTM Master Mix II. Колбы были помещены в заранее нагретый (94 С) термоциклер. ПЦР выполнялась с использованием следующей программы: один цикл при 94 С в течение 5 мин, 35 циклов при 94 С в течение 40 с, 60 С в течение 40 с и 72 С в течение 90 с, и один цикл при 72 С в течение 7 мин. Третья реакция ПЦР проводилась независимо в четырех индивидуальных пробирках при помощи праймера FE1004: 5'GATTGTCGTTTCCCGCCTTCAGTT3' (SEQ ID : 52) с универсальным праймером,поставляемым производителем. В пробирке для ПЦР на льду смешивались следующие реагенты: 2 мкл очищенного продукта ПЦР, 1 мкл 10 мкМ универсального праймера, 1 мкл 10 мкМ FE1004, 6 мкл дистиллированной воды, и 10 мкл 2 Х SeeAmpTM ACPTM Master Mix II. Колбы были помещены в заранее нагретый (94 С) термоциклер. ПЦР проводился с использованием следующей программы: один цикл при 94 С в течение 5 мин, 35 циклов при 94 С в течение 40 с, при 60 С в течение 40 с и при 72 С в течение 90 с и один цикл при 72 С в течение 7 мин. 10 мкл продуктов ПЦР были помещены на 1% агарозный гель, содержащий бромид этидия. Из агарозного геля был извлечн соответствующий бэнд и очищен при помощи набора Qiagen Qiaquick GelExtraction Kit в соответствии с инструкциями производителя. Полученный ДНК был клонирован в клонирующем векторе Invitrogen TOPO-XL в соответствии с инструкциями производителя. Данный клон был трансформирован в Е. coli, а ДНК плазмиды была экстрагирована из клеток после выращивания при помощи набора Qiagen Miniprep Kit в течение ночи в соответствии с инструкциями производителя. Данный плазмид использовался для конечного секвенирования. Новый праймер была разработан в рамках новой, ранее не известной последовательности, которая должна используемой с праймером в инсерте гетерологичной ДНК для амплифицирования полной 1 kb фланкирующей последовательности вне геномной ДНК. Праймер фланкирующей последовательности 162DWConf3: 5'CCTGTGTTGTTGGAACAGACTTCTGTC3' (SEQ ID : 53) и праймер инсерта ДНКFE0900: 5'GGCTCCTTCAACGTTGCGGTTCTGTC3' (SEQ ID : 54) использовались для амплификации молекулы нуклеиновой кислоты, содержащей 5' фланкирующую последовательность для подтверждения. Последовательность получившегося ампликона указана в SEQ ID : 55. Данный 5' ампликон содержит 5' связующую последовательность, как указано в SEQ ID : 45. 10 мкл продукта ПЦР (ампликон) были помещены на 1% агарозный гель, содержащий этидия бромид. Соответствующий бэнд была извлечн из агарозного геля с использованием набора Qiagen Qiaquick Gel Extraction Kit согласно инструкциям производителя. Извлеченный ДНК был клонирован в клонирующем векторе Invitrogen TOPO-XL согласно инструкциям производителя. Данный клон был трансформирован в Е. coli. ДНК плазмиды была извлечена из клеток после ночного роста в среде при помощи использования набора Qiagen Miniprep Kit в соответствии с инструкциями производителя. Три плазмида были полностью секвенированы с использованием праймеров, как показано в табл. 4. Плазмидные последовательности были сгруппированы для завершения подтвержденной 5'-фланкирующей последовательности. При использовании данного способа было определено примерно 1 kb 5'-фланкирующая последовательность (SEQ ID : 46). 3'-фланкирующая последовательность трансгенного сорта MIR162 была создана с использованием универсального набора Clonetech GenomeWalker (Clonetech Laboratories, Inc.) в соответствии с инструкциями производителя. Сначала были сконструированы пулы неклонированных, адаптор-легированных фрагментов геномной ДНК, известных как "библиотеки" GenomeWalker. Каждая библиотека создавалась путем расщепления геномной ДНК MIR162 рестрикционным ферментом (DraI, EcoRV, PvuII, StuI и XmnI), как указано далее: например, 25 мкл геномной ДНК MIR162 (0,1 мкг/мкл), 8 мкл рестрикционного фермента (10 ед./мкл), 10 мкл буферного раствора рестрикционного фермента (10 Х), и 57 мкл дистиллированной Н 20 были смешаны в пробирке и инкубировались при 37 С с вечера до утра. Затем ДНК очищалась путем многократной экстракции в феноле/хлороформе. И, наконец, ДНК осаждалась и промывалась этанолом, высушивалась и растворялась в 20 мкл буферного раствора. Для лигирования концов адаптора GenomeWalker с геномной ДНК MIR162, перемешивали 4 мкл расщеплнного, очищенного геномного ДНК с 1,9 мкл адаптера Genome Walker (25 мкМ), 1,6 мкл 10 Х буфера для лигирования, и 0,5 мкл Т 4 ДНК лигазы (6 ед./мкл). Такие реакции проводились в течение ночи при 16 С. Реакция останавливали при инкубировании при 70 С в течение 5 мин. После приостановления реакции 72 мкл 1 ТЕ было добавлено в каждую колбу, и содержимое было тщательно перемешано. Первая реакция ПЦР проводилась с использованием праймера API, поставляемого производителем,с различными праймерами, разработанными в рамках известной инсерционной последовательности гетерологичной ДНК (круг 1 "праймеры, специфичные для генов" или "GSP1"). В пробирке для ПЦР на льду были перемешаны следующие реагенты: 1 мкл соответствующей библиотеки ДНК трансгенного сортаMIR162, 1 мкл 10 мкМ AP1, 1 мкл 10 мМ GSP1, 1 мкл 10 мМ d-НТФ, 5 мкл 10 Х ПЦР буфера Advantage 2,1 мкл полимеразы BD Advantage 2 и 40 мкл дистиллированной воды. ПЦР проводился с использованием следующей программы: семь циклов при 94 С в течение 25 с и при 72 С в течение 4 мин, 32 цикла при 94 С в течение 25 с и при 67 С в течение 4 мин и один цикл при 67 С в течение 4 мин. Каждая начальная реакция ПЦР разбавлялась в 50 раз при добавлении 1 мкл первичного продукта ПЦР 49 мкл дистиллированной воды. Реакция, используемыми здесь, были (1) библиотеки DraI и XmnI с праймером GSP1 162GW3F1: 5'TCTCTTGCTAAGCTGGGAGCTCGATCCG3' (SEQ ID : 56) и праймер AP1. Вторая реакция ПЦР проводилась независимо с использованием праймера АР 2, поставляемого производителем, с различными праймерами, разработанными в рамках известной инсерционной последовательности гетерологичной ДНК (круг 2 "праймеры, специфичные для гена" или "GSP2"). Следующие реагенты были перемешаны в колбе для ПЦР на льду: 1 мкл соответствующего растворенного первичного продукта ПЦР, 1 мкл 10 мкМ АР 2, 1 мкл 10 мкМ GSP2, 1 мкл 10 мкМ d-НТФ, 5 мкл буфера ПЦР 10 ХAdvantage 2, 1 мкл полимеразы BD Advantage 2 и 40 мкл дистиллированной воды. ПЦР проводилась с использованием следующей программы: пять циклов при 94 С в течение 25 с и при 72 С в течение 4 мин, 20 циклов при 94 С в течение 25 с и при 67 С в течение 4 мин и один цикл при 67 С в течение 4 мин. Реакции, используемые здесь: (1) библиотеки DraI и XmnI с праймером GSP2 162GW3F2: 5'AAGATTGAATCCTGTTGCCGGTCTTGCG3' (SEQ ID : 57) и праймер АР 2. 10 мкл продуктов ПЦР наносилось на 1% агарозный гель, содержащий бромид этидия. Соответствующий бэнд был извлечн из агарозного геля и очищен при помощи набора Qiagen Qiaquick Gel Extraction Kit в соответствии с инструкциями производителя. Извлечнный ДНК был клонирован в клонирую- 18021187 щем векторе Invitrogen TOPO-XL в соответствии с инструкциями производителя. Такой клон был трансформирован в Е. coli, а ДНК плазмиды извлечена из клеток после ночного роста при помощи набораQiagen Miniprep kit в соответствии с инструкциями производителя. Такой плазмид был секвенирован в результате конечного секвенирования. Был разработан новый праймер в рамках ранее неизвестной последовательности, которая использовалась с праймером в инсерте ДНК для амплификации приблизительно 1 kb 3'-фланкирующей последовательности вне геномной ДНК. Праймер инсерта ДНК 162GW3F1: 5'TCTCTTGCTAAGCTGGGAGCTCGATCCG3' (SEQ ID : 56) и праймера 3' фланкирующей последовательности 1623'GWR1: 5CTGGTGAACCGATTTTTACGGAGG3' (SEQ ID : 58) использовали для амплификации молекулы нуклеиновой кислоты, содержащей 3'-фланкирующую последовательность для подтверждения. Последовательность полученного ампликона указана в SEQ ID : 59. Такой 3'-ампликон содержит 3'-связующую последовательность, как указано в SEQ ID : 47. 10 мкл ампликона ПЦР наносилось на 1% агарозный гель, содержащий бромид этидия. Соответствующий бэнд был извлечн из агарозного геля при помощи набора Qiagen Qiaquick Gel Extraction Kit в соответствии с инструкциями производителя. Полученная ДНК была клонирована в клонирующем векторе Invitrogen TOPO-XL в соответствии с инструкциями производителя. Такой клон был трансформирован в Е. coli, а ДНК плазмиды была извлечена из клеток в среде после ночного роста в среде с набором Qiagen Miniprep kit в соответствии с инструкциями производителя. Три плазмида были полностью секвенированы при помощи праймеров,указанных в табл. 5. Плазмидные последовательности были сгруппированы для образования полной подтвержденной 3'-фланкирующей последовательности (SEQ ID : 48). Таблица 5 Последовательности праймеров Пример 6. Детектирование белка Vip3Aa20 в MIR162 при помощи иммуноферментного твердофазного анализа (ELISA). Были подготовлены экстракты из листьев, корней, мякоти, сердцевины, сырца, пыльцы и всего растения трансгенного сорта MIR162. Провели количественный анализ количественный анализ на Vip3Aa20 при помощи иммуноферментного твердофазного анализа (ELISA) с использованием иммуноаффинных козлиных анти-Vip3A и очищенных от белка - кроличьих анти-Vip3A поликлональных антител с использованием утвержднных процедур ELISA. Vip3Aa20 был обнаружен во всех тканях, проанализированных на всех стадиях роста. Средний уровень белка Vip3Aa20, обнаруженный во всм растении при цветении и созревании семени, составил 10 мкг/г свежей массы и 16 мкг/г свежего веса соответственно. Средний уровень белка Vip3Aa20 в листьях при цветении составил 22 мкг/г свежей массы.- 19021187 Пример 7. Эффективность MIR162 в поле. Трансгенный сорт MIR162 был испытан в поле на эффективность защиты от совки травяной (FAW,Spodoptera frugiperda), совки хлопковой (CEW, Helicoverpa zea), совки-ипсилон (BCW, Agrotis ipsilon), и европейского мотылька кукурузного (ЕСВ, Ostrinia nubilalis). Результаты анализа трансгенного сортаMIR162 сравнили с эффективностью Warrior (Syngenta, Inc.), используемого стандартного инсектицида, наносимого со скоростью 11,2 г активного компонента/акр. Трансгенный сорт Bt11, содержащий генcrylAb и гибрид Bt11 X MIR162, получали путем скрещивания инбредной линии Bt11 с инбредной линией MIR162. 21 испытательное растение было выращено в 13 штатах, представляющих основные области выращивания кукурузы континентальных Соединенных Штатов. Опытные растения были выращены по схеме согласно рандомизированному полноблочному плану с четырьмя повторяющимися участками на блок. Величина участков составляла 17,5 футов в ряду на обрабатываемую область на повторяющемся участке. Плотность насаждения составила примерно 30000 растений/акр. Иммунодиагностические маркры использовались для подтверждения присутствия или отсутствия белков Vip3Aa20 и CrylAb в различных группах обработки. Естественное заражение вредителями использовалось в исследованиях, в которых популяция была достаточно высокая; когда ее не хватало, проводилось искусственное заражение. Искусственное заражение между 2-м и 3-м периодом между линьками гусеницы при V1-V2 использовалось в испытаниях наBCW. Участки земли оценивались после 3, 7 и 14 дней после заражения. Повреждение от BCW было зафиксировано в виде частичного повреждения растений и полностью уничтоженных растений. Участки земли с FAW оценивались по истечении 7 и 14 дней после заражения или после 3 - периода между линьками гусеницы, и наблюдались на контрольных растениях. Для оценки повреждения от FAW и CEW использовалась следующая шкала: 0,01 - нет видимых повреждений листвы; 1 - повреждение в виде маленьких точек на некоторых листьях; 2 - небольшое количество листовой пятнистости на некоторых листьях; 3 - листовая пятнистость на некоторых листьях; 4 - листовая пятнистость и повреждения на некоторых листьях; 5 - повреждения на некоторых листьях; 6 - крупные повреждения на некоторых листьях; 7- крупные повреждения и выеденные места на небольшом количестве листьев; 8 - крупные повреждения и выеденные места на некоторых листьях; 9 - крупные повреждения и выеденные места на многих листьях. Повреждения растений оценивались как для первого, так и второго поколения ЕСВ. Для классификации повреждений первого поколения использовалась следующая шкала, как правило, если личинки находились на 3-й или 4-й возрастной стадии: 1 - нет видимых повреждений листвы; 2 - небольшое количество листовой пятнистости на некоторых листьях; 3 - сплошная листовая пятнистость на некоторых листьях; 4- некоторые повреждения в виде отверстий и продолговатых повреждений; 5 - некоторые листья с продолговатыми повреждениями; 6 - некоторые листья с продолговатыми повреждениями размером около 2,5 см; 7 - сплошные крупные повреждения примерно на половине листьев; 8 - сплошные большие повреждения примерно на двух третьих части листьев; 9 - много листьев с большими повреждениями. Повреждения от ЕСВ второго поколения оценивались через три-четыре недели после искусственного заражения или окончания периода откладывания яиц. Проводились следующие измерения: количество живых личинок/цветоножку, количество живых личинок/стебель, количество живых личинок/ножку,количество живых личинок/початок, количество проходов/цветоножку, общая длина проходов(см)/цветоножку, общая длина проходов (см)/стебель, количество проходов/початок, общая длина проходов на повреждении зерна (см)/початок и % зараженных растений. Опытные исследования на CEW, в целом, проводились на выращенных позднее растениях для увеличения естественного уровня заражений. Повреждения выеданием по гнезду оценивалось, когда личинки CEW, находившиеся на контрольных растениях, были на стадии роста L5-L6. Классификация початков включала запись количества обнаруженных личинок на початок и длину видимого выедания зерна,измеренное от верхушки початка до среднего нижнего разрушенного зерна. Результаты полевых испытаний на BCW представлены в табл. 6. Менее 3% от растений трансгенного сорта MIR162 и растений Bt11 X MIR162 было срезано личинками BCW. Значительное число Bt11 и контрольных растений были уничтожены. Растения, содержащие генотип трансгенного сорта MIR162,имели меньше повреждений выеданием BCW, чем растения, обработанные стандартным инсектицидом.- 20021187 Таблица 6 Классификация повреждений ножки по 5 исследованиям на BCW после 21 с момента заражения. Повреждения оценивались как процентное количество от общего числа уничтоженных растений Результаты полевых исследований на FAW представлены в табл. 7. Повреждения выеданием FAW измерялись по шкале 0,01 до 9. Среднее число повреждений выеданием в гибридах MIR162 было очень низким ( 1) и значительно ниже, чем число средних повреждений, наблюдаемых у Bt11 и при стандартных методах обработки инсектицидами. Численность насекомых в таких опытах была высокой и составила примерно от 50 до 100 новорожденных личинок/растение. Растение Bt11 показало некоторую защиту от повреждений, причем традиционная обработка инсектицидами не дала никакой защиты, и сохранился тот же уровень повреждений, что и для контрольного растения. Таблица 7 Повреждения выеданием листвы на примере пяти исследований для FAW. Средний уровень повреждений по истечении 14 дней после заражения представлен по каждому виду защиты Результаты исследований для оценки повреждений от первого поколения ЕСВ представлены в табл.8. Уровень выедания ЕСВ оценивался по шкале 1-9. В данных исследованиях трансгенного сортMIR162 придавал минимальную защиту от выедания ЕСВ. Bt11 полностью защищал растения от выедания ЕСВ. Растения Bt11 X MIR 162 обладали тем же уровнем защиты, что и растения Bt11. Традиционная обработка инсектицидами обеспечила лучший уровень защиты, чем трансгенного сорт MIR162, но значительно меньший уровень защиты, чем для Bt11. Таблица 8 Повреждения выеданием листвы в ходе полевых испытаний. Средний коэффициент повреждений по истечении 14 дней после заражения Результаты по повреждениям от второго поколения ЕСВ представлены в табл. 9. Повреждения выеданием оценивались в виде общей длины прохода в каждом стебле кукурузы (если было обнаружено несколько проходов, то их суммарная длина проходов). Обработка Bt11 и Bt11 X MIR162 обеспечила лучшую защиту от появления отверстий в стебле, но не удалось обеспечить защиту от появления проходов отдельно агентом MIR162 или инсектицидной обработкой.- 21021187 Таблица 9 Классификация повреждений стебля по семи исследованиям на уровень наличия личинок второго поколения ЕСВ, измеряемых в длине прохода (см) на стебель. Измерения проводились через три-четыре недели после искусственного заражения Результаты исследований по оценке повреждения от CEW представлены в табл. 10. Повреждения выеданием оценивались в виде длины повреждения зерна на початок, измеренной с верхней части початка до среднего самого нижнего поврежденного зерна. Значительные повреждения зерна наблюдались дляBt11, инсектицида, и на контрольных участках. Bt11 оказывал некоторый уровень защиты по сравнению с необработанным контрольным растением и был сопоставим с защитой, которая обеспечивалась традиционной инсектицидной обработкой. MIR162 и Bt11 X MIR 162 оказывали практически полную защиту початков от повреждений выеданием гусеницами CEW. Таблица 10 Классификация повреждений початка по шести исследованиям для CEW, измеренных в виде средней длины повреждения выеданием. Измерения проводились для контрольных растений, когда личинкиCEW находились на стадии развития L5-L6 Пример 8. Эффективность MIR162 для защиты от западной совки, пожирающей фасоль (WBC). Данные коммерческие трансгенные сорта, продуцирующие белок CrylAb, не обеспечивали нужного уровня защиты от западной совки, пожирающей фасоль (WBCW, Striacosta albicosta). Поэтому MIR 162 сам по себе и вместе с другими трансгенными генотипами был исследован на эффективность защиты отWBCW. Яйца WBCW были собраны от диких бабочек женского пола. До проведения эксперимента личинок вскармливали согласно рациону совок - ипсилон. Растения кукурузы были выращены в полевых условиях. Испытаны следующие виды обработки: MIR162, Bt11, MIR604, MIR162 XBt11, MIR162 X MIR604,MIR604 X Bt11, Force (Syngenta, Inc.), традиционная обработка инсектицидами применялась на насаждениях до отрицательной изолинии и двух отрицательных контрольных изолиний. MIR604 является новым трансгенным сортом, который содержит ген cty3 А 055, кодирующий белок, активный для защиты от личинок диабротики (Diabrotica spp.). Он описан в патентной заявке США, публикация 2005/0216970 от 29 сентября 2005 г., включенной со ссылкой. Для экспериментов двухдюймовые нити зеленого шелка и листовой обертки были срезаны с початка полевой растений кукурузы зерновых для каждой обработке и повтора. Концевые коричневые части шлка были удалены, а обртка снята. Около 1,5-дюймовые рыльца было помещены в индивидуальные 14 мл пластиковые банки. Затем в каждую банку помещали по одной личинке и банку закупоривали. Изучали несколько стадий развития личинок в диапазоне от 3-го до 6-го периода между линьками. Банки, содержащие рыльца и личинки, выдерживались в течение дня и комнатной температуре на протяжении эксперимента. Выживаемость личинок фиксировалась по истечении восьми дней. Обработка повторялась четыре раза в ходе эксперимента. Результаты эксперимента на WBCW представлены в табл. 11. Выживание WBCW на рыльцах от использования отрицательных изолиний и после традиционной инсектицидной обработки составляло около 100%. Выживание личинок WBCW на рыльцах Bt11 и MIR604, исследованная либо по отдельности, либо в сочетании на том же самом растении, не отличалось от выживания на отрицательных изолиниях. Относительное значение выживания личинки WBCW снизилось, когда личинка питалась рыльцами от трансгенного сорта MIR162. Использование комплекса MIR162 X Bt11 на том же растении не уменьшило относительное значение выживаемости, кроме трансгенного сорта MIR162. Тем не менее, удивительно то, что когда трансгенный генотип трансгенного сорта MIR162 объединялся с трансгенным генотипом MIR604 на одном и том же растении, то смертность личинок значительно увеличивалась по сравнению с каждым из сортов MIR162 или MIR604 отдельно. Пример 9. Использование инсерционного сайта трансгенного сорта MIR162 для направленной интеграции в кукурузу. Фланкирующая последовательность MIR162, описанная в SEQ ID : 46 и SEQ ID : 48, использовалась для поиска геномных баз данных для кукурузы. Идентичные соответствия обеим фланкирующим последовательностям были обнаружены на клоне ВАС, СН 201-307 Р 5, хромосомы 5 (NCBI входящий номер АС 185313) на Contig 13 (SEQ ID : 106). Что более характерно, инсерт MIR162 на хромосоме 5 между 5'-молекулярным маркром, обозначаемым как маркр Opie2 (нуклеотиды 1680-3338 SEQ ID : 106), и 3'-молекулярным маркром, обозначаемым как маркр gag (нуклеотиды 43275-45086 SEQ ID : 106). При помощи данной информации, было установлено, что гетерологичная ДНК, инсертированная вMIR162, заменила 58 нуклеотидов геномной ДНК кукурузы, нуклеотиды от 25455 до 25512 SEQ ID : 106 (также показана как SEQ ID : 107), которая находится между 5'-фланкирующей последовательностью (нуклеотиды 1-25454 SEQ ID : 106) и 3'-фланкирующей последовательностью (нуклеотиды 25513-51328 SEQ ID : 106). Постоянные агрономические показатели трансгена сорта MIR162 для нескольких поколений в полевых условиях показывают, что эти установленные области вокруг инсерционного сайта MIR162 обеспечивают хорошее геномное положения для направленной интеграции прочих трансгенных представляющих интерес генов. Такая направленная интеграция позволяет преодолеть сложности с так называемым "эффектами положения" и риском появления мутации в геноме после интеграции трансгена в хозяина. Прочие преимущества такого направленного встраивания включают в себя, без ограничения,уменьшение большого количества трансформаций, за которыми необходимо наблюдать и проверять до получения трансгенного растения, проявляющее необходимый уровень трансгенной экспрессии без каких-либо отклонений в результате безвозвратного инсертирования трансгена в важный локус генома хозяина. Более того, такое направленное встраивание позволяет проводить стэкинг трансгенов для селекции элитных линий растений для обоих генов, что более эффективно. При использовании вышеуказанной идеи квалифицированный специалист может использовать способы, известные в данной области, для нацеливания представляющих интерес гетерологичных нуклеиновых кислот на тот же инсерционный сайт на хромосоме 5, что и в MIR162, или на сайт, находящийся в непосредственной близости к инсерционному сайту MIR162. Один такой метод описан в патентной заявке США, публикация 20060253918, полностью включенной в данный документ со ссылкой. Если говорить более кратко, то до 20 Kb геномной последовательности, 5'-фланкирующей с инсерционным сайтом (нуклеотиды от 5454 до 25454 SEQ ID : 106) и до 20 Kb геномной последовательности, 3'фланкирующей с инсерционным сайтом (нуклеотиды 25513 по 45513 SEQ ID : 106), используется для фланкирования гена или представляющих интерес генов, предназначенных для инсертирования в положение в геноме на хромосоме 5 путем гомологичной рекомбинации. Такие последовательности далее могут фланкироваться с Т-ДНК граничными повторами, например повторные последовательности левой границы (LB) и правой граница (RB) и других вспомогательных последовательностей для повышения эффективности доставки Т-ДНК. Ген или представляющие интерес гены могут располагаться точно на так как и на инсерционном сайте MIR162 или могут располагаться в любом другом месте внутри 20 Kb областей вокруг инсерционных сайтов MIR162 для придания постоянного уровня трансгенной экспрессии, не оказывая отрицательного влияния на растение. Векторы ДНК, содержащие ген или представляющие интерес гены и фланкирующие последовательности, могут доставляться в растительные клетки при помощи одного из нескольких способов, известных в данной области, включая, без ограничения,трансформацию опосредуемую агробактериями. Инсертирование векторов ДНК целевой сайт трансгенного сорта MIR162 далее может улучшаться в результате применения одного из нескольких способов,включая, без ограничения, совместную экспрессию или активирование генов для усиления рекомбина- 23021187 ции, или подавление эндогенных генов супрессирующих рекомбинацию. Кроме того, известно, что расщепление специфичных последовательностей в геноме может применяться для увеличения частоты гомологичной рекомбинации, поэтому возможно улучшить инсерцию инсерционный в сайт MIR162 и е фланкирующие области за счт экспрессии естественных или специально разработанных эндонуклеаз для расщепления указанных последовательностей. Поэтому при использовании такого подхода, любая гетерогенная последовательность нуклеиновой кислоты может быть инсертирована на хромосому 5 кукурузы на целевом сайте, расположенном между нуклеотидами 25454 и 45513 SEQ ID : 106 или на целевом сайте рядом с таким сайтом. Пример 10. Использование инсерционного сайта трансгенного сорта MIR162 и фланкирующих последовательностей для стабилизации экспрессии гена. Геномные последовательности, фланкирующие инсерционный сайт трансгенного сорта MIR162,могут также использоваться для стабилизации экспрессии другого(их) представляющего(их) интерес гена(ов) при встраивании в качестве трансгена в другое геномные положения в кукурузе и прочих сортов кукурузы. Как правило, до 20 Kb геномной последовательности, 5'-фланкирующей с инсерционным сайтом (нуклеотиды от 5454 до 25454 SEQ ID : 106) и до 20Kb геномной последовательности, 3'фланкирующей с инсерционным сайтом (нуклеотиды от 25513 до 45513 SEQ ID : 106), используются для фланкирования гена или представляющих интерес генов, которые предназначены для инсертирования в геном растений. Такие последовательности, кроме того, могут фланкироваться с граничными повторами Т-ДНК, например повторными последовательностями левой границы (LB) и правой границы(RB) повторной последовательности и другими вторичными последовательностями для повышения эффективности доставки Т-ДНК. Ген или представляющие интерес гены могут располагаться точно так как в инсерционном сайте MIR162 или могут располагаться в любом другом в пределах областей 20 Kb вокруг инсерционного сайта трансгенного сорта MIR162 для придания постоянного уровня экспрессии трансгену. Векторы ДНК, содержащие ген или представляющие интерес гены и инсерционный сайт трансгенного сорта MIR162, фланкирующий последовательность, могут доставляться в клетки растения при помощи одного из нескольких способов, известных тем в данной области, включая, без ограничения,трансформацию протопласта, биолистическую трансформацию и агробактериальную трансформацию. Доставляемая ДНК может выборочно интегрироваться в геном растения или может также присутствовать как часть независимых сегрегирующих генетических единиц, например, как искусственная хромосома или мини-хромосома. Векторы ДНК, содержащие представляющий(е) интерес ген(ы) и инсерционный сайт MIR162, фланкирующий последовательности, может доставляться в клетки растения. Поэтому при окружении гена или представляющих интерес генов геномной последовательностью, фланкирующей инсерционный сайт трансгенного сорта MIR162, экспрессия таких генов стабилизируется в трансгенном растении - хозяине, например, в двудольных или однодольных растениях, таких как злаки. Депонирование Заявители подали заявку на депонирование семени кукурузы трансгенного сорта MIR162, описанного выше 23 января 2007 г. в соответствии с Будапештской конвенцией при Американской коллекции типовых культур (АКТК), 1801 University Boulevard, Манассас, штат Виржиния 20110 с номеромРТА 8166. Депонирование будет храниться в депозитарии в течение 30 лет, или по истечении 5-летнего срока с момента последней заявки, или в течение срока действия патента, в зависимости от того, какой срок более длительный, и заменяется, по необходимости, в течение данного периода. Заявители не накладывают каких-либо ограничений на доступ к депонированному материалу в АКТК; тем не менее, заявители не имеют права отклонять любые ограничения, возложенные в силу закона на передачу биологического материала или его транспортировку в коммерческие компании. Заявители не отклоняют ни одного нарушения своих прав, предоставленных по данному патенту или в соответствии с Законом об охране сорта растений (7 USC 2321 и др. версии). Все публикации и опубликованные патентные документы, указанные в данной спецификации,включены со ссылкой в том же объеме, как если бы каждый индивидуальный патентный документ был отдельно и индивидуально указан, как включенный со ссылкой.
МПК / Метки
МПК: A01H 1/00, A01H 5/00, C12N 15/11, C12N 15/05
Метки: хромосомный, целевой, кукурузы, сайт, способ, трансгенной, получения
Код ссылки
<a href="https://eas.patents.su/30-21187-hromosomnyjj-celevojj-sajjt-kukuruzy-i-sposob-polucheniya-transgennojj-kukuruzy.html" rel="bookmark" title="База патентов Евразийского Союза">Хромосомный целевой сайт кукурузы и способ получения трансгенной кукурузы</a>
Предыдущий патент: Композиции, включающие интерлейкин-1 и пептиды
Следующий патент: Многонаправленный торсионный гистерезисный демпфер
Случайный патент: Экскаватор (варианты)