Пиразолохиназолины
Номер патента: 20703
Опубликовано: 30.01.2015
Авторы: Дизингрини Тереза, Анджолини Мауро, Сильваньи Марко, Кальдарелли Марина, Сальса Маттео, Коломбо Риккардо, Постери Элена, Нуволони Стефано
Формула / Реферат
1. Соединение формулы (I)
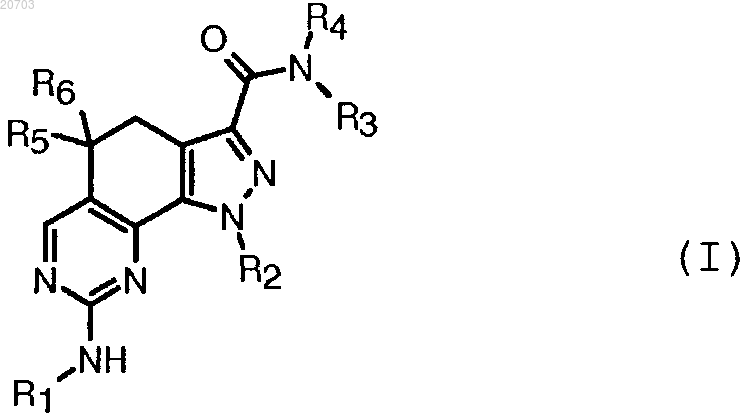
где R1 означает ортозамещенную фенильную группу, или пиперидинил, или циклогексил;
R2 представляет собой линейную или разветвленную C1-C6-алкильную группу;
R3 представляет собой арил;
R4 представляет собой атом водорода или C1-C6-алкильную группу, эта группа может быть необязательно циклизована вместе с одним атомом группы R3 с образованием индолила;
R5 и R6 представляют собой, каждый независимо, атом водорода или C1-C6-алкил;
группы ортозамещенный фенил, арил, пиперидинил, циклогексил, индолил, C1-C6-алкил могут быть необязательно замещенными 1-6 группами, независимо выбранными из следующих: атом галогена, нитро, циано, C1-C6-алкил, полифторированный алкокси, гидроксиалкил, фенилалкил, гетероциклил, циклогексил, алкокси, карбокси, трет-бутоксикарбонил, амино, алкиламино, диалкиламино, гетероциклиламино, этилкарбониламино, аминокарбонил, алкиламинокарбонил, алкилсульфониламино, формил, алкилкарбонил, арилкарбонил, гетероциклилкарбонил, алкилсульфонил, арилсульфонил, причем
гетероциклил представляет собой собой 4-7-членное насыщенное карбоциклическое кольцо, где один или более атомов углерода заменен азотом или кислородом; и
арил представляет собой собой ароматическую карбоциклическую или гетероциклическую группу, содержащую от одного циклического фрагмента до двух конденсированных циклических фрагментов, где по меньшей мере одно кольцо является ароматическим; если присутствует, любое ароматическое гетероарильное кольцо представляет собой собой 5-6-членное кольцо, содержащее от 1 до 2 гетероатомов, выбранных из N, О или S,
и его фармацевтически приемлемые соли.
2. Соединение формулы (I) по п.1, отличающееся тем, что R1 означает ортозамещенный фенил формулы A
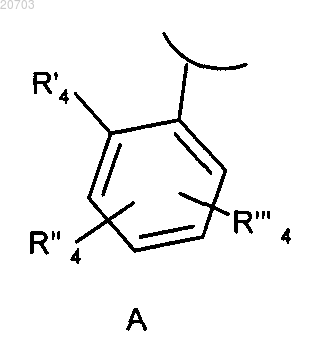
где R'4 означает атом галогена, циано, C1-C6-алкил, полифторированный алкокси или алкокси;
R"4 и R'"4, независимо, представляют собой водород или имеют одно из значений, выбранных из атома галогена, нитро, C1-C6-алкила, гетероциклила, карбокси, трет-бутоксикарбонила, амино, диалкиламино, гетероциклиламино, аминокарбонила, формила и гетероциклилкарбонила,
и его фармацевтически приемлемые соли.
3. Соединение формулы (I) по п.1, имеющее формулу (Ia)
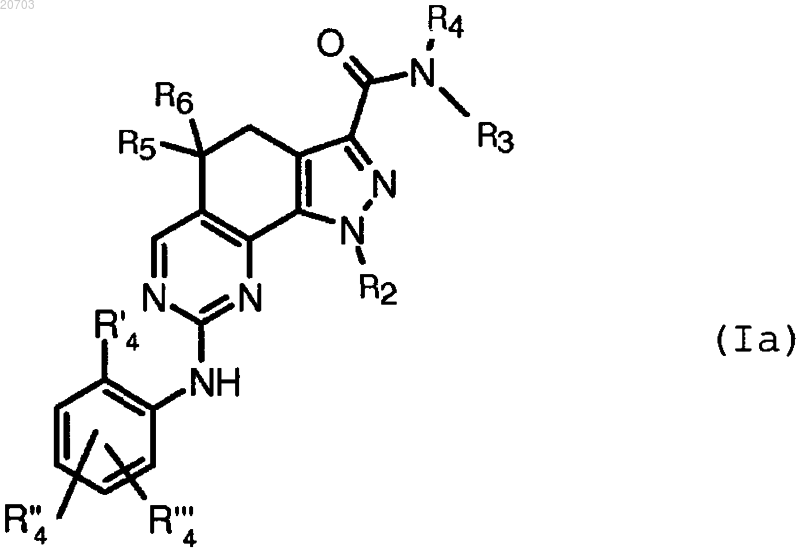
где R'4, R''4 и R'"4 имеют указанные в п.2 значения;
R2 означает необязательно замещенную прямую или разветвленную C1-C3-алкильную группу;
R3 означает арил;
R4 представляет собой атом водорода или C1-C6-алкил, который может быть необязательно циклизован вместе с одним из атомов группы R3 с образованием индолила; и
R5 и R6 имеют указанные в п.1 значения,
или его фармацевтически приемлемая соль.
4. Соединение формулы (I) по п.1, отличающееся тем, что R1 представляет собой пиперидинил или циклогексил формулы D

где Z означает атом углерода или азота;
n=2;
R'1 представляет собой атом водорода, C1-C6-алкил, фенилалкил, трет-бутоксикарбонил, амино, этилсульфониламино, алкилкарбонил, гетероциклилкарбонил, алкилсульфонил, арилсульфонил и диметиламиносульфонил;
R'2 и R'3 представляют собой, каждый независимо, атом водорода или C1-C3-алкил.
5. Соединение формулы (I) по п.1, имеющее формулу (Ib)
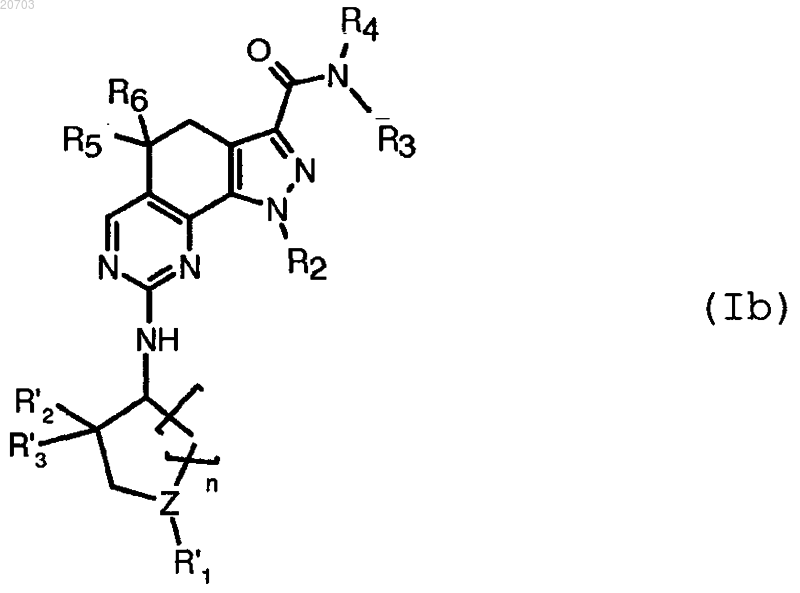
где Z представляет собой атом углерода или азота;
n= 2;
R'1 имеет указанные в п.4 значения;
R'2 и R'3, независимо, представляют собой атом водорода или C1-C2-алкильную группу;
R2 означает необязательно замещенную прямую или разветвленную C1-C6-алкильную группу;
R3 означает арил;
R4 представляет собой атом водорода или C1-C6-алкил, который может быть необязательно циклизован вместе с одним из атомов арильной группы R3 с образованием индолила; и
R5 и R6 имеют указанные в п.1 значения,
или его фармацевтически приемлемая соль.
6. Соединение формулы (I) по п.1 или его фармацевтически приемлемая соль, которое является одним из соединений, перечисленных ниже:
4) 8-[(4-карбамоил-2-метилфенил)амино]-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
6) 8-[(4-бром-2-метоксифенил)амино]-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
10) трет-бутил 4-({3-[(2,6-диэтилфенил)карбамоил]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-8-ил}амино)-3-метоксибензоат;
13) 8-[(4-карбамоил-2-метоксифенил)амино]-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
17) N-(2,6-диэтилфенил)-8-[(2-метокси-4-нитрофенил)амино]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
35) 8-[(2-хлорфенил)амино]-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
36) 8-[(4-бром-2-цианофенил)амино]-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
37) 8-[(2-бромфенил)амино]-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
38) N-(2,6-диэтилфенил)-8-[(2-метоксифенил)амино]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
44) 8-[(4-бром-2-метоксифенил)амино]-N-(2,6-диметилфенил)-1,5,5-триметил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
45) N-(2,6-диэтилфенил)-8-[(2-йодфенил)амино]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
48) 8-[(5-бром-2-метоксифенил)амино]-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
53) трет-бутил 4-({3-[(2,6-диэтилфенил)карбамоил]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-8-ил}амино)пиперидин-1-карбоксилат;
54) N-(2,6-диэтилфенил)-1-метил-8-(пиперидин-4-иламино)-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид, гидрохлорид;
57) N-(2,6-диэтилфенил)-1-метил-8-{[1-(метилсульфонил)пиперидин-4-ил]амино}-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
58) 8-[(1-ацетилпиперидин-4-ил)амино]-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
59) N-(2,6-диэтилфенил)-1-метил-8-{[1-(фенилкарбонил)пиперидин-4-ил]амино}-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
62) N-(2,6-диэтилфенил)-1-метил-8-{[1-(фенилсульфонил)пиперидин-4-ил]амино}-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
64) 8-[(1-бензилпиперидин-4-ил)амино]-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
68) N-(2,6-диэтилфенил)-8-[(1-этилпиперидин-4-ил)амино]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
77) N-(2,6-диэтилфенил)-8-{[2-метокси-4-(тетрагидро-2Н-пиран-4-иламино)фенил]амино}-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
78) трет-бутил 4-({3-[(2,6-диэтилфенил)карбамоил]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-8-ил}амино)-3-метилбензоат;
81) 8-[(4-амино-2-метоксифенил)амино]-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
87) 8-[(4-бром-2-хлорфенил)амино]-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
98) N-(2,6-диэтилфенил)-8-{[4-(гидроксиметил)-2-метоксифенил]амино}-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
100) трет-бутил 4-({3-[(2,6-диэтилфенил)карбамоил]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-8-ил}амино)-3,3-диметилпиперидин-1-карбоксилат;
107) N-(2,6-диэтилфенил)-8-{[1-(диметилсульфамоил)пиперидин-4-ил]амино}-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
114) 8-[(транс-4-аминоциклогексил)амино]-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
118) N-(2,6-диэтилфенил)-1-метил-8-{[1-(пиримидин-4-илкарбонил)пиперидин-4-ил]амино}-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
119) N-(2,6-диэтилфенил)-1-метил-8-{[1-(1Н-пиррол-2-илкарбонил)пиперидин-4-ил]амино}-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
120) N-(2,6-диэтилфенил)-8-{[1-(1Н-имидазол-4-илкарбонил)пиперидин-4-ил]амино}-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
121) N-(2,6-диэтилфенил)-1-метил-8-{[1-(пиридин-3-илкарбонил)пиперидин-4-ил]амино}-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
122) N-(2,6-диэтилфенил)-1-метил-8-{[1-(пиридин-2-илкарбонил)пиперидин-4-ил]амино}-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
123) N-(2,6-диэтилфенил)-1-метил-8-{[1-(1Н-пиразол-4-илкарбонил)пиперидин-4-ил]амино}-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
124) N-(2,6-диэтилфенил)-1-метил-8-{[1-(тиофен-3-илкарбонил)пиперидин-4-ил]амино}-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
125) N-(2,6-диэтилфенил)-1-метил-8-{[1-(пиридин-4-илкарбонил)пиперидин-4-ил]амино}-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
126) N-(2,6-диэтилфенил)-1-метил-8-{[1-(1Н-пиррол-3-илкарбонил)пиперидин-4-ил]амино}-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид и
128) N-(2,6-диэтилфенил)-8-[(4-формил-2-метоксифенил)амино]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид.
7. Соединение или его фармацевтически приемлемая соль, которое является одним из соединений, перечисленных ниже:
1) N-(2,6-диэтилфенил)-1-метил-8-({4-[(1-метилпиперидин-4-ил)карбамоил]-2-(трифторметокси)фенил}амино)-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
2) N-(2,6-диэтилфенил)-8-({2-метокси-4-[(1-метилпиперидин-4-ил)карбамоил]фенил}амино)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
3) N-(2,6-диэтилфенил)-1-метил-8-{[4-(4-метилпиперазин-1-ил)-2-(трифторметокси)фенил]амино}-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
5) N-(2,6-диэтилфенил)-8-{[2-метокси-4-(4-метилпиперазин-1-ил)фенил]амино}-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
7) N-(2,6-диэтилфенил)-8-[(4-{[3-(диметиламино)пропил](метил)амино}-2-метоксифенил)амино]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
8) N-(2,6-диэтилфенил)-8-({4-[4-(диметиламино)пиперидин-1-ил]-2-метоксифенил}амино)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
9) N-(2,6-диэтилфенил)-8-{[2-метокси-4-(4-метил-1,4-диазепан-1-ил)фенил]амино}-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
10) трет-бутил 4-({3-[(2,6-диэтилфенил)карбамоил]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-8-ил}амино)-3-метоксибензоат;
11) 4-({3-[(2,6-диэтилфенил)карбамоил]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-8-ил}амино)-3-метоксибензойная кислота;
12) N-(2,6-диэтилфенил)-8-[(4-{[2-(диметиламино)этил](метил)амино}-2-метоксифенил)амино]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
14) N-(2,6-диэтилфенил)-8-[(4-{[2-(диметиламино)этил]карбамоил}-2-метоксифенил)амино]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
15) 1-метил-8-({4-[(1-метилпиперидин-4-ил)карбамоил]-2-(трифторметокси)фенил}амино)-N-фенил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
16) N-(2-этилфенил)-1-метил-8-({4-[(1-метилпиперидин-4-ил)карбамоил]-2-(трифторметокси)фенил}амино)-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
18) N-(2,6-диэтилфенил)-8-({2-метокси-4-[(2-метоксиэтил)карбамоил]фенил}амино)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
19) N-(2,6-диэтилфенил)-8-[(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}-2-метоксифенил)амино]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
20) N-(2,6-диэтилфенил)-8-[(2-метокси-4-{[(2S)-2-(пирролидин-1-илметил)пирролидин-1-ил]карбонил}фенил)амино]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
21) N-(2,6-диэтилфенил)-8-[(2-метокси-4-{[(2R)-2-(пирролидин-1-илметил)пирролидин-1-ил]карбонил}фенил)амино]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
22) N-(2-этилфенил)-8-{[2-метокси-4-(4-метилпиперазин-1-ил)фенил]амино}-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
23) N-(2,3-дигидро-1Н-инден-5-ил)-8-{[2-метокси-4-(4-метилпиперазин-1-ил)фенил]амино}-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
24) 8-{[2-метокси-4-(4-метилпиперазин-1-ил)фенил]амино}-1-метил-N-(5,6,7,8-тетрагидронафталин-1-ил)-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
25) 3-(2,3-дигидро-1Н-индол-1-илкарбонил)-N-[2-метокси-4-(4-метилпиперазин-1-ил)фенил]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-8-амин;
26) N-(2,6-диметилфенил)-8-{[2-метокси-4-(4-метилпиперазин-1-ил)фенил]амино}-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
27) N-(2-этил-6-метилфенил)-8-{[2-метокси-4-(4-метилпиперазин-1-ил)фенил]амино}-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
28) 8-{[2-метокси-4-(4-метилпиперазин-1-ил)фенил]амино}-N-(2-метоксифенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
29) N-1,3-бензотиазол-5-ил-8-{[2-метокси-4-(4-метилпиперазин-1-ил)фенил]амино}-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
30) N-(2-хлор-6-метилфенил)-8-{[2-метокси-4-(4-метилпиперазин-1-ил)фенил]амино}-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
31) N-[2,6-бис-(1-метилэтил)фенил]-8-{[2-метокси-4-(4-метилпиперазин-1-ил)фенил]амино}-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
32) N-(2,6-диэтилфенил)-8-({4-[(2-гидроксиэтил)карбамоил]-2-метоксифенил}амино)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
33) 8-{[2-циано-4-(4-метилпиперазин-1-ил)фенил]амино}-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
34) 8-{[2-циано-4-(4-метил-1,4-диазепан-1-ил)фенил]амино}-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
39) N-(2,6-диэтилфенил)-8-({2-метокси-4-[(3-пирролидин-1-илазетидин-1-ил)карбонил]фенил}амино)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
40) N-(2,6-диэтилфенил)-8-{[2-метокси-4-(3-пирролидин-1-илазетидин-1-ил)фенил]амино}-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
41) N-(2,6-диметилфенил)-8-{[2-метокси-4-(4-метилпиперазин-1-ил)фенил]амино}-1,5,5-триметил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
42) N-(2,6-диэтилфенил)-8-({2-метокси-4-[(4-метил-1,4-диазепан-1-ил)карбонил]фенил}амино)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
43) N-(2,6-диэтилфенил)-8-({2-метокси-4-[(2-метоксиэтил)амино]фенил}амино)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
46) N-(2,6-диэтилфенил)-8-({4-[(3S)-3-(диметиламино)пирролидин-1-ил]-2-метоксифенил}амино)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
47) N-(2,6-диэтилфенил)-8-({4-[(3R)-3-(диметиламино)пирролидин-1-ил]-2-метоксифенил}амино)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
49) N-(2,6-диэтилфенил)-8-{[2-метокси-5-(4-метилпиперазин-1-ил)фенил]амино}-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
50) N-(2,6-диэтилфенил)-8-({4-[4-(2-гидроксиэтил)пиперазин-1-ил]-2-метоксифенил}амино)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
51) N-(2,6-диэтилфенил)-8-[(4-{[2-(диметиламино)этил]амино}-2-метоксифенил)амино]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
52) N-(2,6-диэтилфенил)-8-({2-метокси-4-[(4-метилпиперазин-1-ил)карбонил]фенил}амино)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
55) N-(2,6-диэтилфенил)-8-{[1-(этенилсульфонил)пиперидин-4-ил]амино}-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
56) N-(2,6-диэтилфенил)-1-метил-8-[(1-{[2-(метиламино)этил]сульфонил}пиперидин-4-ил)амино]-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
60) N-(2,6-диэтилфенил)-1-метил-8-({1-[(1-метилпиперидин-4-ил)карбонил]пиперидин-4-ил}амино)4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
61) N-(2,6-диэтилфенил)-1-метил-8-({1-[(4-метилпиперазин-1-ил)карбонил]пиперидин-4-ил}амино)-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
63) 8-[(1-акрилоилпиперидин-4-ил)амино]-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
65) 8-({1-[(3-хлорпропил)сульфонил]пиперидин-4-ил}амино)-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
66) N-(2,6-диэтилфенил)-1-метил-8-{[1-(N-метил-бета-аланил)пиперидин-4-ил]амино}-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
67) N-(2,6-диэтилфенил)-8-{[1-(N,N-диметил-бета-аланил)пиперидин-4-ил]амино}-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
69) N-(2,6-диэтилфенил)-1-метил-8-[(1-{[3-(метиламино)пропил]сульфонил}пиперидин-4-ил)амино]-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид, гидрохлорид;
70) N-(2,6-диэтилфенил)-1-метил-8-[(1-{[2-(4-метилпиперазин-1-ил)этил]сульфонил}пиперидин-4-ил)амино]-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
71) N-(2,6-диэтилфенил)-8-[(1-{[2-(диметиламино)этил]сульфонил}пиперидин-4-ил)амино]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
72) N-(2,6-диэтилфенил)-1-метил-8-({1-[(2-пиперидин-1-илэтил)сульфонил]пиперидин-4-ил}амино)-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
73) N-(2,6-диэтилфенил)-1-метил-8-({1-[(2-морфолин-4-илэтил)сульфонил]пиперидин-4-ил}амино)-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
74) N-(2,6-диэтилфенил)-1-метил-8-({1-[(2-пирролидин-1-илэтил)сульфонил]пиперидин-4-ил}амино)-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
75) 8-({1-[(2-аминоэтил)сульфонил]пиперидин-4-ил}амино)-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
76) N-(2,6-диэтилфенил)-8-{[2-метокси-4-(4-пирролидин-1-илпиперидин-1-ил)фенил]амино}-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
79) N-(2,6-диэтилфенил)-8-({2-метокси-4-[(1-метилпиперидин-4-ил)амино]фенил}амино)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
80) 8-({1-[(3-хлорметил)сульфонил]пиперидин-4-ил}амино)-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
81) 8-[(4-амино-2-метоксифенил)амино]-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
82) N-(2,6-диэтилфенил)-8-[(2-метокси-4-{[(1-метилпиперидин-4-ил)карбонил]амино}фенил)амино]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
83) 4-({3-[(2,6-диэтилфенил)карбамоил]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-8-ил}амино)-3-метилбензойная кислота;
84) N-(2,6-диэтилфенил)-8-[(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}-2-метилфенил)амино]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
85) N-(2,6-диэтилфенил)-8-[(4-{[2-(диметиламино)этил]карбамоил}-2-метилфенил)амино]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
86) N-(2,6-диэтилфенил)-8-[(4-{[4-(диметиламино)бутаноил]амино}-2-метоксифенил)амино]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид трифторацетат;
88) 8-{[2-хлор-4-(4-метилпиперазин-1-ил)фенил]амино}-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
89) N-(2,6-диэтилфенил)-1-метил-8-[(2-метил-4-{[(2R)-2-(пирролидин-1-илметил)пирролидин-1-ил]карбонил}фенил)амино]-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
90) 8-[(2-хлор-4-{[3-(диметиламино)пропил](метил)амино}фенил)амино]-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
91) N-(2,6-диэтилфенил)-1-метил-8-({2-метил-4-[(4-метил-1,4-диазепан-1-ил)карбонил]фенил}амино)-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
92) 8-({2-хлор-4-[4-(диметиламино)пиперидин-1-ил]фенил}амино)-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
93) N-(2,6-диэтилфенил)-8-({4-[(4-гидроксициклогексил)амино]-2-метоксифенил}амино)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
94) N-(2,6-диэтилфенил)-8-({2-метокси-4-[(3-пиперидин-1-илпропаноил)амино]фенил}амино)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
95) N-(2,6-диэтилфенил)-1-метил-8-({2-метил-4-[(4-пирролидин-1-илпиперидин-1-ил)карбонил]фенил}амино)-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
96) 8-{[4-(1-азабицикло[2.2.2]окт-3-иламино)-2-метоксифенил]амино}-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
97) 8-{[4-({[трет-бутил(диметил)силил]окси}метил)-2-метоксифенил]амино}-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
99) N-(2,6-диэтилфенил)-8-({2-метокси-4-[(4-метилпиперазин-1-ил)метил]фенил}амино)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
101) N-(2,6-диэтилфенил)-8-[(3,3-диметил-1-{[2-(метиламино)этил]сульфонил}пиперидин-4-ил)амино]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
102) N-(2,6-диэтилфенил)-1-метил-8-({1-[(2,2,2-трифторэтил)сульфонил]пиперидин-4-ил}амино)-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
103) N-(2,6-диэтилфенил)-1-метил-8-({1-[(трифторметил)сульфонил]пиперидин-4-ил}амино)-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
104) N-(2,6-диэтилфенил)-1-метил-8-{[1-(1Н-пиразол-4-илсульфонил)пиперидин-4-ил]амино}-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
105) N-(2,6-диэтилфенил)-8-{[1-(1Н-имидазол-4-илсульфонил)пиперидин-4-ил]амино}-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
106) N-(2,6-диэтилфенил)-1-метил-8-({1-[(4-метил-3,4-дигидро-2Н-1,4-бензоксазин-7-ил)сульфонил]пиперидин-4-ил}амино)-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
108) N-(2,6-диэтилфенил)-1-метил-8-({1-[(1-метил-1Н-имидазол-4-ил)сульфонил]пиперидин-4-ил}амино)-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
109) N-(2,6-диэтилфенил)-1-метил-8-{[1-(пиридин-3-илсульфонил)пиперидин-4-ил]амино}-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
110) 8-[(1-{[4-(ацетиламино)фенил]сульфонил}пиперидин-4-ил)амино]-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
111) 8-({1-[(4-аминофенил)сульфонил]пиперидин-4-ил}амино)-N-(2,6-диэтилфенил)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид, гидрохлорид;
112) N-(2,6-диэтилфенил)-8-({1-[(2-гидроксиэтил)сульфонил]пиперидин-4-ил}амино)-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
113) N-(2,6-диэтилфенил)-8-({1-[(2-метоксиэтил)сульфонил]пиперидин-4-ил}амино)-1-метил-4,5-дигидро-1H-пиразоло[4,3-h]хиназолин-3-карбоксамид;
115) N-(2,6-диэтилфенил)-8-[(1-{[2-(этиламино)этил]сульфонил}пиперидин-4-ил)амино]-1-метил-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
116) N-(2,6-диэтилфенил)-1-метил-8-({1-[(5-метилизоксазол-4-ил)карбонил]пиперидин-4-ил}амино)-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид;
117) N-(2,6-диэтилфенил)-1-метил-8-({1-[(1-метил-1Н-имидазол-4-ил)карбонил]пиперидин-4-ил}амино)-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид и
127) N-(2,6-диэтилфенил)-1-метил-8-{[транс-4-({[2-(метиламино)этил]сульфонил}амино)циклогексил]амино}-4,5-дигидро-1Н-пиразоло[4,3-h]хиназолин-3-карбоксамид.
8. Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение формулы (I) или его фармацевтически приемлемую соль по любому из пп.1-7 в смеси с приемлемым разбавителем или носителем.
9. Применение соединения формулы (I) или его фармацевтически приемлемой соли по любому из предшествующих пунктов в терапии рака.
10. Применение соединения формулы (I) или его фармацевтически приемлемой соли по любому из предшествующих пунктов для лечения болезней, вызываемых и/или связанных с измененной активностью протеинкиназы.
11. Применение соединения формулы (I) по п.10, отличающееся тем, что измененной активностью протеинкиназы является MPS-1.
12. Применение по п.9, отличающееся тем, что рак выбран из таких его разновидностей, как карцинома, такая как молочной железы, толстой кишки, почек, легких, включая мелкоклеточный рак легких, яичника, поджелудочной железы, шеи, щитовидной железы, простаты и кожи; гематопоэтические новообразования лимфоидного происхождения, такие как острый лимфобластный лейкоз, Т-клеточная лимфома; гематопоэтические новообразования миелоидного происхождения, такие как хронические миелогенные лейкозы; опухоли мезенхимального происхождения, включая фибросаркому и рабдомиосаркому; опухоли центральной и периферической нервной системы, включая астроцитому и глиому.
13. Применение по п.9, отличающееся тем, что соединение формулы (I) используют для лечения болезней вместе с лучевой терапией или режимом химиотерапии в сочетании по меньшей мере с одним цитостатическим или цитотоксическим агентом.
14. Применение соединения формулы (I) по п.1 в производстве лекарственного средства для лечения болезней, вызываемых и/или связанных с измененной активностью протеинкиназы.
15. In vitro способ ингибирования активности протеинкиназы, включающий контактирование указанной киназы с эффективным количеством соединения формулы (I) по п.1.
Текст
Изобретение относится к пиразолохиназолинам, характеризующимся ортозамещенным ариламино-, гетероциклиламино- или C3-C7-циклоалкиламино остатком при положении 8 и арилом,гетероциклилом или C3-C7-циклоалкилом в качестве заместителя карбоксамида при положении 3 основной структуры молекулы. Соединения по данному изобретению модулируют активность протеинкиназ и поэтому применимы при лечении болезней, вызываемых разупорядоченной активностью протеинкиназы, в особенности MPS1/TTK. Изобретение относится также к способам получения указанных соединений, фармацевтическим композициям, содержащим эти соединения,и способам лечения болезней с применением фармацевтических композиций, содержащих эти соединения.(71)(73) Заявитель и патентовладелец: ЛЕ ЛАБОРАТУАР СЕРВЬЕ (FR) 020703 Данное изобретение относится к конкретным замещенным соединениям пиразолохиназолина, которые модулируют активность протеинкиназ. Соединения по изобретению поэтому применимы при лечении болезней, вызываемых разупорядоченной активностью протеинкиназы. Данное изобретение относится также к способам получения указанных соединений, фармацевтическим композициям, содержащим эти соединения, и способам лечения болезней с применением фармацевтических композиций, содержащих эти соединения. Применение митотических ингибиторов в терапии рака является широко распространенной клинической стратегией для лечения широкого диапазона раковых заболеваний человека. Таксаны (паклитаксел и доцетаксел) и винка-алкалоиды (винкристин и винбластин) действуют либо стабилизируя, либо дестабилизируя микротрубочки с катастрофическими последовательностями в клетках, прогрессирующих по пути митоза. Они являются терапевтическими средствами первой линии против различных типов опухолей и второй линии при не поддающихся лечению цисплатином злокачественных заболеваниях,таких как карцинома яичника, рак молочной железы, легких, мочевого пузыря и пищевода (таксаны). Однако из-за роли микротрубочек в таких способах, как движение клетки, фагоцитоз и аксональный транспорт, с указанными агентами часто наблюдаются некоторые токсичности, такие как периферическая невропатия. Прохождение через митоз является требованием всех пролиферирующих клеток, и поэтому способы лечения рака, которые имеют мишенями митоз, применимы обычно к широкому диапазону типов опухолей. Некоторые протеинкиназы играют ключевые роли в гармонии клеточного цикла, и некоторые из них уже являются предметом направленных терапевтических мероприятий в области онкологии, включая Cdk-2 и Aurora-A. Правильность митоза является делом первостепенной важности, и в нормальных клетках существуют свои "контрольные точки", чтобы поддерживать целостность хромосомы во время клеточного цикла. Контрольная точка сборки веретена (SAC) особенно необходима для надлежащего расхождения хромосом в две дочерние клетки при клеточном делении. Это гарантирует, что сестринские хроматиды,упорядоченные при метафазной пластинке, не разделятся до биполярного прикрепления всех дуплицированных хромосом к митотическому веретену (Mussacchio A. and Salmon D. Nat. Rev. Mol. Cell Biol.,May 2007, 8(5): 379-93). Даже единственной неупорядоченной хромосомы достаточно, чтобы запустить сигнал SAC, т.е. ограниченный в пространстве регулируемый путь, который в конечном счете имеет результатом ингибирование опосредованной промотирующим анафазу комплексом/циклосомой (АРС/С) полиубикутиляции и деградации двух ключевых компонентов: циклина В 1 и секурина. Секурин особенно необходим, чтобы вызвать разделение сестринских хроматид и переход к анафазе, взамен циклин В 1 инактивирует главную митотическую киназу CDK1, промотирующую выход из митоза (Mussacchio A. and Salmon D. Nat. Rev.Mol. Cell Biol., May 2007, 8(5): 379-93). Большая группа белков, как уже было установлено, играет роль в функциях SAC: киназа MPS1 (монополярного веретена 1) человека (известная как TTK) имеет особенно важную роль. MPS1 является двойной тирозин- и серин/треонинкиназой, тщательно сохраняемой организмами от дрожжей до млекопитающих. Геном человека кодирует только один член генного семейства MPS1, который не имеет сильных подобий последовательности с другими протеинкиназами.MPS1 является регулирующим клеточный цикл ферментом, который апрегулируется и активируется в митозе при фосфорилировании (Stucke V.M., et al., Embo J. 21(7): 1723, 2002). В Saccharomyces cerevisiae MPS1 контролирует дупликацию полярного тела веретена (Winey M. etal., J. Cell Biol. 114: 745, 1991), сборку веретена (Jones, M.H. et al., Curr. Biol. 15: 160, 2005) и контрольную точку сборки веретена (Weiss and Winey, J. Cell. Biol. 132: 111, 1996). Вместо этого в высших эукариотах активность киназы MPS1 вовлекается, главным образом, в регуляцию и функции SAC (Jelluma, N.et al., Cell 132: 233, 2008). Эксперименты по вмешательству RNA показывают, что в отсутствие MPS1 функции SAC нарушаются: продолжительность митоза уменьшается, и клетки делятся быстро без выстраивания метафазной пластинки, что в конце концов приводит к аберрантной анэуплоидизации, митотической катастрофе и больше не совместимо с выживанием клеток (Jelluma N. et al., Cell, 132: 233, 2008; Tighe A. et al., J. CellBiol. 2008; Jelluma N. et al., Plos ONE 3(6): e2415, 2008). Кроме того, в подтверждение этих результатов был описан маломолекулярный ATP-конкурентный MPS1 ингибитор и было показано, что, несмотря на его неясный профиль селективности, он способен инактивировать функции SAC, инактивировать опосредуемую нокодазолом и таксолом остановку митоза и промотировать клеточную гибель, главным образом, в онкогенных клеточных линиях (Schmidt et al., EMBO Rep. 6(9), 866, 2005). Несмотря на то что большинство опухолей являются анэуплоидными, MPS1 никогда не был замечен в мутации до рака, вместо этого была выявлена его апрегуляция в некоторых опухолях различного происхождения, таких как карцинома мочевого пузыря, анапластической щитовидной железы, молочной железы и простаты (Yuan В. et al., Clin. Cancer Res., 12(4): 1121, 2006). Более того, был обнаружен в списке верхних 25 генов, сверхэкспрессированных в CIN, и анэуплоидных опухолях, что прогнозирует клинический исход рака молочной железы и легких, медуллобластомы, глиомы, мезотелиомы и лимфомы(Carter S.L. et al., Nat. Genet. 38(9): 1043, 2006). И, наконец, его содержание сильно повышено в метаста-1 020703 тических опухолях, и, как было обнаружено, он сверхэкспрессирован в карциномах р 53 видоизмененной молочной железы (Bertheau P. et al., Plos. Med. 4(3): e90, 2007). Вместе с тем, было также найдено, что другие компоненты SAC, такие как MAD2, BUBR1 илиBUB1, подвержены повышающей регуляции в различных опухолях (deCarcer G. et al., Curr. Med. Chem. 14(9): 969, 2007), это выглядит так, что функции SAC могут быть необходимыми и существенными, чтобы удерживать опухолевые сильно анэуплоидные клетки способными к сегрегации, и опухолевая селективность ингибиторов SAC является прогнозируемой, в особенности для сильно анэуплоидных опухолей, таких как карциномы толстой кишки, легких и молочной железы (Kops G.J. et al., Nat. Rev. Cancer, 5: 773, 2005). И, наконец, основательная индукция анэуплоидии и прекращение регуляции SAC, как было показано, уменьшают онкогенез у подверженных опухоли мышей, подтверждая гипотезу, что ингибированиеSAC могло бы способствовать подавлению роста опухоли (Weaver et al., Cancer Cell, 11(1): 25, 2007). Таким образом, по указанным причинам фармакологическое ослабление функции MPS1 может иметь терапевтический полезный эффект при лечении отдельных разных типов рака. Конденсированные бициклические производные пиримидина для лечения гиперпролиферативных болезней раскрыты в WO 96/40042 на имя Pfizer Inc. Конденсированные полициклические производные пиримидина в качестве ингибиторов протеинкиназы также раскрыты в WO 98/58926 и WO 98/28281, обе, на имя Celltech Therapeutics Ltd. Конденсированные трициклические соединения пиразола, известные как ингибиторы протеинкиназы, раскрыты в WO 03/070236 и WO 03/070706 на имя Pharmacia Italia S.P.A. и Pharmacia Corp. соответственно. Производные пиразолохиназолина, имеющие ингибирующую киназу активность, также раскрыты вWO 04/104007 и WO 2008/074788 на имя самого заявителя. Никакие конкретные соединения, описанные и заявленные в них, не являются предметом данного изобретения. Несмотря на эти разработки, все еще сохраняется потребность в эффективных агентах против указанной болезни. Авторы данного изобретения открыли, что соединения формулы (I), описанные ниже, являются ингибиторами киназы и поэтому применимы в терапии в качестве противоопухолевых агентов и лишены, в смысле и токсичности, и побочных эффектов, вышеупомянутых недостатков, связанных с доступными в настоящее время противоопухолевыми лекарственными средствами. Соответственно, первой задачей данного изобретения является создание замещенных соединений пиразолохиназолина формулы (I) где R1 означает ортозамещенную арильную группу, или гетероциклил, или C3-C7-циклоалкил;R2 представляет собой атом водорода или линейную или разветвленную C1-C6-алкильную,C2-C6-алкенильную, C2-C6-алкинильную, C3-C7-циклоалкильную или гетероциклическую группу;R3 представляет собой собой арил, гетероциклил или C3-C7-циклоалкил;R4 представляет собой собой атом водорода, гидроксильную или C1-C6-алкильную группу, эта группа может быть необязательно циклизована вместе с одним атомом группы R3 с образованием конденсированной C4-C7-циклической группы;R5 и R6 представляют собой, каждый независимо, атом водорода, C1-C6-алкил или необязательно циклизованы вместе с атомом углерода, к которому они присоединены, так что образуютC3-C7-циклоалкильную группу; группы ортозамещенный арил, арил, гетероциклил, C3-C7-циклоалкил, C4-C7-циклоалкил,C1-C6-алкил, C2-C6-алкенил и C2-C6-алкинил могут быть необязательно (дополнительно) замещенными,при условии, что следующие соединения исключены: 1 Н-пиразоло[4,3-h]хиназолин-3-карбоксамид, N-циклопропил-4,5-дигидро-1-метил-8-[(1-метил-4 пиперидинил)амино] и 1 Н-пиразоло[4,3-h]хиназолин-3-карбоксамид, N-циклогексил-8-(циклопентиламино)-4,5-дигидроN-гидрокси-1-метил,и их фармацевтически приемлемые соли. Данное изобретение также относится к способам получения замещенных соединений пиразолохиназолина, представленных формулой (I), получаемых путем способа, состоящего из стандартных синтетических преобразований и их изомеров, таутомеров, гидратов, сольватов, комплексов, метаболитов,пролекарств, носителей, N-оксидов.-2 020703 Данное изобретение также относится к способу лечения болезней, вызываемых и/или связанных с нарушенной активностью протеинкиназы, hMPS1 (TTK), членов семейства PLK, протеинкиназы C в различных изоформах, Met, PAK-4, PAK-5, STLK-2, DDR-2, Aurora 1, Aurora 2, Bub-1, Chk1, Chk2, HER-2,raf1, MEK1, MAPK, EGF-R, PDGF-R, FGF-R, IGF-R, PI3K, weel киназы, Src, Abl, Akt, MAPK, ILK, MK-2,IKK-2, Cdc7, Nek, семейства Cdk/циклинкиназы, который содержит введение млекопитающему, при необходимости, эффективного количества замещенного соединения пиразолохиназолина, представленного формулой (I). Указанный способ особенно применим для лечения болезней, вызываемых и/или связанных с нарушенной функцией MPS1 человека. Предпочтительным способом по данному изобретению является лечение болезни, вызываемой и/или связанной с нарушенной активностью протеинкиназы, выбранной из группы, состоящей из рака,клеточных пролиферативных расстройств, вирусных инфекций, аутоиммунных и нейродегенеративных расстройств. Другим предпочтительным способом по данному изобретению является лечение специфических типов рака, включая, но без ограничения указанным, карциному, такую как рак мочевого пузыря, молочной железы, толстой кишки, почек, печени, легких, включая мелкоклеточную карциному легких, рак пищевода, желчного пузыря, яичника, поджелудочной железы, желудка, шеи, щитовидной железы, простаты и кожи, включая плоскоклеточную карциному; гематопоэтические новообразования лимфоидного происхождения, включая лейкоз, острый лимфоцитарный лейкоз, острый лимфобластный лейкоз, Вклеточную лимфому, Т-клеточную лимфому, лимфому Ходжкина, неходжкинскую лимфому, лимфому волосистых клеток и лимфому Беркитта; гематопоэтические новообразования миелоидного происхождения, включая острые и хронические миелогенные лейкозы, миелодиспластический синдром и промиелоцитарный лейкоз; опухоли мезенхимального происхождения, включая фибросаркому и рабдомиосаркому; опухоли центральной и периферической нервной системы, включая астроцитому, нейробластому,глиому и невриномы; иные новообразования, включая меланому, семиному, тератокарциному, остеосаркому, пигментную ксеродерму, кератоксантому, фолликулярный рак щитовидной железы и саркому Капоши, мезотелиому, сильно анэуплоидные опухоли и опухоли, которые сверхэкспрессируют компоненты митотических контрольных точек, такие как MPS1, MAD2, MAD1, BUB1, BUBR1, BUB3 и др. Другим предпочтительным способом по данному изобретению является лечение специфических клеточных пролиферативных расстройств, таких как, например, доброкачественная гиперплазия простаты, семейный аденоматоз, полипоз, нейрофиброматоз, псориаз, сосудистая плоскоклеточная пролиферация, связанная с атеросклерозом, пневмосклерозом, артритом, гломерулонефритом и постхирургическим стенозом и рестенозом. В дополнение, способ по данному изобретению также относится к ингибированию ангиогенеза и метастаза опухоли, а также к лечению отторжения трансплантированного органа и иммунологической реакции отторжения трансплантата. Данное изобретение также относится к фармацевтической композиции, содержащей одно или несколько соединений формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый наполнитель, носитель или разбавитель. Данное изобретение дополнительно относится к фармацевтической композиции, содержащей соединение формулы (I) в сочетании с известными противораковыми лечебными мероприятиями, такими как лучевая терапия или режим химиотерапии, в сочетании с цитостатическими или цитотоксическими агентами, агентами антибиотического типа, алкилирующими агентами, антиметаболитными агентами,гормональными агентами, иммунологическими агентами, агентами типа интерферона, ингибиторами циклооксигеназы (например, ингибиторами СОХ-2), ингибиторами матричной металлопротеиназы, ингибиторами теломеразы, ингибиторами тирозинкиназы, агентами против рецептора фактора роста, антиHER агентами, анти-EGFR агентами, агентами против ангиогенеза (например, ингибиторами ангиогенеза), ингибиторами фарнезилтрансферазы, ингибиторами пути сигнальной трансдукции ras-raf, ингибиторами клеточного цикла, другими cdks ингибиторами, связывающими тубулин агентами, ингибиторами топоизомеразы I, ингибиторами топоизомеразы II и т.п. Если не оговорено иное, при ссылке на соединения формулы (I) сами по себе, а также на какуюлибо их фармацевтическую композицию или какое-либо терапевтическое лечение, содержащее их, данное изобретение включает все гидраты, сольваты, комплексы, метаболиты, пролекарства, носители,N-оксиды и фармацевтически приемлемые соли соединений по данному изобретению. Другими словами, если из соединений формулы (I), которая определена выше, легко образуются изомеры, таутомеры, гидраты, сольваты, комплексы, метаболиты, пролекарства, носители и N-оксиды, то они также являются предметом данного изобретения. Метаболит соединения формулы (I) является каким-либо соединением, в которое это самое соединение формулы (I) превращается in vivo, например, при введении млекопитающему при необходимости этого. Обычно, однако не ограничиваясь, при введении соединения формулы (I) это самое производное может быть превращено в разнообразные соединения, например включая более растворимые производные, такие как гидроксилированные производные, которые легко выделяются из организма. Поэтому в-3 020703 зависимости от пути метаболизма, происходящего таким образом, какое-либо из этих гидроксилированных производных может рассматриваться как метаболит соединений формулы (I). Пролекарствами являются какие-либо ковалентно связанные соединения, которые высвобождают inN-оксиды являются соединениями формулы (I), где азот и кислород связаны через семиполярную связь. Если стереогенный центр или другая форма изомерного центра присутствует в соединении по данному изобретению, все формы такого изомера или изомеров, включая энантиомеры и диастереомеры,включены в объем данного изобретения. Соединения, содержащие стереогенный центр, могут быть использованы в виде рацемической смеси, энантиомерно обогащенной смеси или рацемическая смесь может быть разделена с применением хорошо известных технических приемов, и отдельный энантиомер может быть использован один. В случаях, когда соединения имеют ненасыщенные углерод-углеродные двойные связи, и цис- (Z), и транс- (Е) изомеры входят в объем изобретения. В случаях, когда соединения могут существовать в таутомерных формах, таких как таутомеры кетоенол, каждая таутомерная форма рассматривается как включенная в данное изобретение, присутствует ли она в равновесии или преимущественно в одной форме. В данном описании, если не оговорено иное, под термином "ортозамещенный арил", который представляет собой собой одно из значений R1, подразумевается любая арильная группа, определение которой дано ниже, связанная с -NH-группой, указанный арил является всегда замещенным в ортоположении, т.е. на атоме кольца, расположенном рядом с тем, который связан с -NH-группой, и также необязательно замещенным в других свободных положениях. Под термином "арил" подразумеваются ароматические, карбоциклические или гетероарильные группы, содержащие от 1 до 2 кольцевых групп, либо конденсированных, либо связанных друг с другом ординарными связями, где по меньшей мере одно из колец является ароматическим; если присутствует,какое-либо ароматическое гетероарильное кольцо (известное также как ароматическая гетероциклическая группа) содержит 5-6-членное кольцо, содержащее от 1 до 3 гетероатомов, выбранных из N, О илиS. Примерами арильных групп по изобретению являются, в частности, фенил, бифенил, - или -нафтил,дигидронафтил, тиенил, бензотиенил, фурил, бензофуранил, пирролил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, пиридил, пиразинил, пиримидинил, пиридазинил, индолил,изоиндолил, пуринил, хинолил, изохинолил, дигидрохинолинил, хиноксалинил, бензодиоксолил, инданил, инденил, триазолил и т.п. Под термином "гетероциклил" (известным также как "гетероциклоалкил") подразумевается 3-7-членное насыщенное или частично ненасыщенное карбоциклическое кольцо, где один или несколько атомов углерода заменены гетероатомами, такими как азот, кислород и сера. Неограничительными примерами гетероциклических групп являются, например, пиран, пирролидин, пирролин, имидазолин, имидазолидин, пиразолидин, пиразолин, тиазолин, тиазолидин, дигидрофуран, тетрагидрофуран,1,3-диоксолан, пиперидин, пиперазин, морфолин и т.п. Под термином "C3-C7-циклоалкил", соответственно охватывающим C4-C7-циклоалкил, подразумевается, если не оговорено иное, 3-7-членное полностью углеродное моноциклическое кольцо, которое может содержать одну или несколько двойных связей, но не должно иметь полностью конъюгированнойC1-C4-алкил, подразумевается какая-либо из групп, таких как, например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, втор-бутил, н-пентил, н-гексил и т.п. Под термином "прямой или разветвленный C2-C6-алкенил" подразумевается какая-либо из групп,такая как, например, винил, аллил, 1-пропенил, изопропенил, 1-бутенил, 2-бутенил, 3-бутенил,2-пентенил, 1-гексенил и т.п. Под термином "прямой или разветвленный C2-C6-алкинил" подразумевается какая-либо из групп,такая как, например, этинил, 2-пропинил, 4-пентинил и т.п. Согласно данному изобретению и если не оговорено иное, любая из указанных групп R1, R2, R3, R4,R5 и R6 может быть необязательно замещенной, в любом из ее свободных положений одной или несколькими группами, например 1-6 группами, независимо выбранными из следующих: атом галогена, нитро,оксогруппа (=O), циано, C1-C6-алкил, полифторированный алкил, полифторированный алкокси, алкенил,алкинил, гидроксиалкил, арил, арилалкил, гетероциклил, C3-C7-циклоалкил, гидрокси, алкокси, арилокси,гетероциклилокси, метилендиокси, алкилкарбонилокси, арилкарбонилокси, циклоалкенилокси, гетероциклилкарбонилокси, алкилиденаминоокси, карбокси, алкоксикарбонил, арилоксикарбонил, циклоалкилоксикарбонил, гетероциклилоксикарбонил, амино, уреидо, алкиламино, диалкиламино, ариламино, диариламино, гетероциклиламино, формиламино, алкилкарбониламино, арилкарбониламино, гетероциклил-4 020703 карбониламино, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, ариламинокарбонил,гетероциклиламинокарбонил, алкоксикарбониламино, гидроксиаминокарбонил, алкоксиимино, алкилсульфониламино, арилсульфониламино, гетероциклилсульфониламино, формил, алкилкарбонил, арилкарбонил, циклоалкилкарбонил, гетероциклилкарбонил, алкилсульфонил, арилсульфонил, аминосульфонил, алкиламиносульфонил, диалкиламиносульфонил, ариламиносульфонил, гетероциклиламиносульфонил, арилтио, алкилтио, фосфонат и алкилфосфонат. В свою очередь, когда свойственно, каждый из указанных заместителей может быть дополнительно замещенным одной или несколькими вышеуказанными группами. Что касается термина "атом галогена", он означает атом фтора, хлора, брома или йода. Под термином "циано" подразумевается остаток -CN. Под термином "нитро" подразумевается группа -NO2. Под термином "алкенил" или "алкинил" подразумевается какая-либо из указанных прямых или разветвленных C2-C6-алкильных групп, дополнительно несущая двойную или тройную связь. Неограничительными примерами алкенильных или алкинильных групп по изобретению являются, например, винил,аллил, 1-пропенил, изопропенил, 1-бутенил, 2-бутенил, 3-бутенил, 2-пентенил, 1-гексенил, этинил,2-пропинил, 4-пентинил и т.п. Под термином "полифторированный алкил" или "алкокси" подразумевается какая-либо из указанных прямых или разветвленных C1-C6-алкильных или алкоксигрупп, которые являются замещенными более чем одним атомом фтора, таких как, например, трифторметил, трифторэтил,1,1,1,3,3,3-гексафторпропил, трифторметокси и т.п. Под терминами "алкокси", "арилокси", "гетероциклилокси" и их производными подразумевается какая-либо из указанных C1-C6-алкильных, арильных или гетероциклических групп, связанных с остальной частью молекулы через атом кислорода (-O-). Из всего сказанного выше специалисту понятно, что любая группа, наименование которой является составным наименованием, таким как, например, ариламино, должна рассматриваться как обычно поясняемая частями, из которых она происходит, например аминогруппа, которая дополнительно замещена арилом, где арил имеет указанные выше значения. Подобным образом, любой из терминов, таких как, например, "алкилтио", "алкиламино", "диалкиламино", "алкоксикарбонил", "алкоксикарбониламино", "гетероциклилкарбонил", "гетероциклилкарбониламино", "циклоалкилоксикарбонил" и т.п., включает группы, в которых их части алкил, алкокси,арил, C3-C7-циклоалкил и гетероциклил имеют указанные выше значения. Когда R4 связан с одним атомом циклической группы, которую представляет собой собой R3, они образуют 4-7-членную циклическую группу, такую как, например: где х означает целое число от 2 до 4;R3 означает фенил (арил), гетероциклил (Met) или C3-C7-циклоалкильную группу (Cycl.). Фармацевтически приемлемые соли соединений формулы (I) включают кислотно-аддитивные соли с неорганическими или органическими кислотами, например азотной, хлористо-водородной, бромистоводородной, серной, перхлорной, фосфорной, уксусной, трифторуксусной, пропионовой, гликолевой,фумаровой, молочной, щавелевой, малоновой, яблочной, малеиновой, виннокаменной, лимонной, бензойной, коричной, миндальной, метансульфоновой, изетионовой и салициловой кислотами. Предпочтительно кислотно-аддитивная соль соединений по изобретению выбрана из солей гидрохлорида или мезилата. Фармацевтически приемлемые соли соединений формулы (I) также включают соли с неорганическими или органическими основаниями, например, с такими как гидроксиды, карбонаты или бикарбонаты щелочных или щелочно-земельных металлов, особенно натрия, калия, кальция, аммония или магния,карбонаты или бикарбонаты, ациклические или циклические амины, предпочтительно метиламин,этиламин, диэтиламин, триэтиламин, пиперидин и т.п.-5 020703 Предпочтительными соединениями формулы (I) являются соединения, гдеR1 означает ортозамещенный арил формулы А, В или С:R4 и R4, независимо, представляют собой водород или имеют одно из значений, указанных дляR'4. Другими предпочтительными соединениями формулы (I) являются соединения, где R1 представляет собой собой гетероциклическую или C5-C7-циклоалкильную группу формулы (D) где Z означает атом углерода или азота;R'1 представляет собой собой атом водорода, C1-C6-алкил, полифторированный алкил, полифторированный алкокси, алкенил, алкинил, гидроксиалкил, арил, арилалкил, гетероциклил, C3-C7-циклоалкил,гидрокси, алкокси, арилокси, гетероциклилокси, метилендиокси, алкилкарбонилокси, арилкарбонилокси,циклоалкенилокси, гетероциклилкарбонилокси, алкилиденаминоокси, карбокси, алкоксикарбонил, арилоксикарбонил, циклоалкилоксикарбонил, гетероциклилоксикарбонил, амино, уреидо, алкиламино, диалкиламино, ариламино, диариламино, гетероциклиламино, формиламино, алкилкарбониламино, арилкарбониламино, гетероциклилкарбониламино, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, ариламинокарбонил, гетероциклиламинокарбонил, алкоксикарбониламино, гидроксиаминокарбонил, алкоксиимино, алкилсульфониламино, арилсульфониламино, гетероциклилсульфониламино, формил, алкилкарбонил, арилкарбонил, циклоалкилкарбонил, гетероциклилкарбонил, алкилсульфонил,арилсульфонил, аминосульфонил, алкиламиносульфонил, диалкиламиносульфонил, ариламиносульфонил, гетероциклиламиносульфонил, арилтио, алкилтио, фосфонат и алкилфосфонат;R'2 и R'3 представляют собой, каждый независимо, атом водорода или C1-C3-алкил, необязательно циклизованные вместе с атомом углерода, к которому они присоединены, так что образуют циклопропильную группу. Предполагается, что между квадратными скобками в группе формулы D может быть один или несколько атомов углерода или гетероатомов. Дополнительный предпочтительный класс соединений формулы (I) представлен соединениями формулы (Ia): где R'4, R4 и R4 имеют указанные выше значения;R2 означает необязательно замещенную прямую или разветвленную C1-C6-алкильную илиR3 означает необязательно замещенный арил;R4 представляет собой собой атом водорода или C1-C6-алкил, который может быть необязательно циклизован вместе с одним из атомов группы R3 с образованием конденсированной C4-C7-циклической группы; иR5 и R6 имеют указанные выше значения,или их фармацевтически приемлемыми солями. Дополнительный предпочтительный класс соединений формулы (I) - это соединения формулы (Ib) где Z представляет собой собой атом углерода или азота;R'1 имеет указанные выше значения;R'2 и R'3, независимо, представляют собой атом водорода или C1-C2-алкильную группу;R2 означает необязательно замещенную прямую или разветвленную C1-C6-алкильную илиR3 означает необязательно замещенный арил;R4 представляет собой собой атом водорода или C1-C6-алкил, который может быть необязательно циклизован вместе с одним из атомов арильной группы R3 с образованием конденсированнойR5 и R6 имеют указанные выше значения,или их фармацевтически приемлемые соли. Другой особенно предпочтительный класс соединений формулы (I) образуют соединения формулы где R'4, R4 и R4 имеют указанные выше значения;R2 означает необязательно замещенную прямую или разветвленную C1-C6-алкильную илиR3 имеет указанные выше значения;R4 представляет собой собой атом водорода или C1-C6-алкил, который может быть необязательно циклизован вместе с одним из атомов группы R3 с образованием конденсированной C4-C7-циклической группы;R5 и R6 представляют собой атом водорода или метильную группу,или их фармацевтически приемлемые соли.-7 020703 Другой особенно предпочтительный класс соединений формулы (I) образуют соединения формулы (Ib') где Z представляет собой собой атом углерода или азота;R'1 имеет указанные выше значения;R'2 и R'3, независимо, представляют собой атом водорода или C1-C2-алкильную группу;R2 означает необязательно замещенную прямую или разветвленную C1-C6-алкильную илиR3 представляет собой собой необязательно замещенный арил;R4 представляет собой собой атом водорода или C1-C6-алкил, который может быть необязательно циклизован вместе с одним из атомов арильной группы R3 с образованием конденсированнойR5 и R6 представляют собой атом водорода или метил,или его фармацевтически приемлемая соль. Предпочтительными конкретными соединениями формулы (I) являются соединения, перечисленные ниже, или их фармацевтически приемлемые соли: 1)N-(2,6-диэтилфенил)-8-[(4-формил-2-метоксифенил)амино]-1-метил-4,5-дигидро-1 Нпиразоло[4,3-h]хиназолин-3-карбоксамид. Относительно какого-либо конкретного соединения формулы (I) по изобретению, необязательно в форме фармацевтически приемлемой соли, см. экспериментальную часть и формулу изобретения. Данные изобретения также относятся к способам получения соединений формулы (I), определение которой дано выше. Соответственно, способ по данному изобретению включает:st. A1) взаимодействие соединения формулы (II) где R5 и R6 имеют указанные выше значения,с производным гидразина формулы (III) где R2 имеет указанные выше значения,в присутствии уксусной кислоты, если необходимо, алкилирование полученного соединения формулы где R5 и R6 имеют указанные выше значения и R2 представляет собой собой водород,с соединением формулы (V) где Y представляет собой собой соответствующую уходящую группу, такую как мезил, тозил, атомR2 имеет указанные выше значения, но не атом водорода;st. A2) взаимодействие полученного соединения формулы (IV), определение которой дано выше,если необходимо, после алкилирования диметилформамид-ди-трет-бутилацеталем или диметилформамид-диизопропилацеталем;st. A3) взаимодействие полученного соединения формулы (VI) где R2, R5 и R6 имеют указанные выше значения,в соответствии с одной из альтернативных стадий (st. A3a) или (st. A3b):st. A3a) или с гуанидином, или с его солью и замещение аминогруппы полученного соединения формулы (VII) где R2, R5 и R6 имеют указанные выше значения,йодом путем взаимодействия с изоамилнитритом и дийодметаном или йодидом цезия в присутствии йода и CuI и затем взаимодействием полученного йодпроизводного формулы (VIII) где R1, R2, R5 и R6 имеют указанные выше значения,с соединением формулы где R1 имеет указанные выше значения;st. A3b) или с производным гуанидина формулы (XI) где R1 имеет указанные выше значения;st. A4) гидролиз полученного соединения формулы (X) где R1, R2, R5 и R6 имеют указанные выше значения,в кислой или щелочной среде;st. A5) взаимодействие полученного соединения формулы (XIII) или соответствующей соли где R1, R2, R5 и R6 имеют указанные выше значения,с амином формулы (XIV) где R3 и R4 имеют указанные выше значения,в присутствии соответствующих агентов конденсации с получением соединения формулы (I) где R1, R2, R3, R4, R5 и R6 имеют указанные выше значения,и необязательно превращение соединения формулы (I) в другое, отличающееся от него соединение формулы (I) и, если желательно, превращение соединения формулы (I) в его фармацевтически приемлемую соль или превращение соли в свободное соединение (I). Другой способ по данному изобретению включает st. A4a1) взаимодействие соединения формулы(X), определение которого дано выше, с амином формулы (IX), определение которого дано выше, в присутствии сильного основания с получением соединения формулы (I) где R1, R2, R3, R4, R5 и R6 имеют указанные выше значения, и необязательно превращение соединения формулы (I) в другое, отличающееся от него соединение формулы (I) и, если желательно, превращение соединения формулы (I) в его фармацевтически приемлемую соль или превращение соли в свободное соединение (I). Другой способ по данному изобретению включает:st. B1) гидролиз соединения (VIII), определение которого дано выше, в условиях кислотного или основного характера;st. B2) взаимодействие полученного соединения формулы (XV) или соответствующей соли: где R2, R5 и R6 имеют указанные значения,с амином формулы (XIV), определение которого дано выше, в присутствии подходящих агентов конденсации;st. B3) взаимодействие полученного соединения формулы (XVI) где R2, R4, R5 и R6 имеют указанные выше значения,с амином формулы (IX), определение которого дано выше, с получением соединения формулы (I): где R1, R2, R3, R4, R5 и R6 имеют указанные выше значения,и необязательно превращение соединения формулы (I) в другое, отличающееся от него соединение формулы (I) и, если желательно, превращение соединения формулы (I) в его фармацевтически приемлемую соль или превращение соли в свободное соединение (I).- 14020703 Другой способ по данному изобретению включает: или st. C1) гидролиз соединения формулы (VII), определение которого дано выше, в кислой или щелочной среде иst. C2) взаимодействие полученного соединения формулы (XVII) или его соответствующей соли: где R2, R5 и R6 имеют указанные выше значения,с амином формулы (XIV), определение которого дано выше, в присутствии подходящих агентов конденсации; или st. C1a) взаимодействие соединения формулы (VII), определение которого дано выше, с амином формулы (IX), определение которого дано выше, в присутствии сильного основания с получением соединения формулы (XVIII) где R2, R3, R4, R5 и R6 имеют указанные выше значения;st. C3) взаимодействие соединения формулы (XVIII), определение которого дано выше, с изоамилнитритом и дийодметаном или йодидом цезия в присутствии йода и CuI;st. C4) превращение полученного соединения формулы (XVI), определение которого дано выше, в желательное соединение формулы (I), определение которого дано выше, путем, описанным в st. B3) выше. Другой способ по данному изобретению включает st. D1) взаимодействие соединения (XVIII), определение которого дано выше, с соединением формулы (XII) где R'4, R4 и R4 имеют указанные выше значения,чтобы получить соединение формулы (Ia) где R'4, R4 и R'"4, R2, R3, R4, R5 и R6 имеют указанные выше значения,и необязательно превращение соединения формулы (Ia) в другое, отличающееся от него соединение формулы (Ia) и, если желательно, превращение соединения формулы (Ia) в его фармацевтически приемлемую соль или превращение соли в свободное соединение (Ia). Другой способ по данному изобретению включает st. E1) взаимодействие соединения формулы где R2' означает тритильную группу и R3, R4, R5 и R6 имеют указанные выше значения,в кислотных условиях;st. E2) взаимодействие полученного соединения формулы (XXI) где R3, R4, R5 и R6 имеют указанные выше значения,или с соединением формулы (V), определение которого дано выше, или со спиртом формулыR2-OH (XXXII),где R2 имеет указанные выше значения, но не атом водорода, иst. E3) превращение полученного соединения формулы (XXII) где R3, R4, R5 и R6 имеют указанные выше значения;R2 имеет указанные выше значения, но не атом водорода,в желательное соединение формулы (I), определение которого дано выше, путем, аналогичным пути,который описан в st. D1), st. C3) и st. C4) выше или в st. F1) ниже. Другой способ по данному изобретению включает st. F1) взаимодействие соединения формулы(XVIII), определение которого дано выше, с соединением формулы (XXIII) где n, Z, R'1, R'2 и R'3 имеют указанные выше значения,в присутствии триацетоксиборгидрида натрия [NaBH(OAc)3] и трифторуксусной кислоты, чтобы получить соединение формулы (Ib), где Z, n, R'1, R'2, R'3, R2, R3, R4, R5 и R6 имеют указанные выше значения, и необязательно превращение соединения формулы (Ib) в другое, отличающееся от него соединение формулы (Ib) и, если желательно, превращение соединения формулы (Ib) в его фармацевтически приемлемую соль или превращение соли в свободное соединение формулы (Ib). Другой способ по данному изобретению включает st. G1) взаимодействие соединения формулы(VII), определение которого дано выше, с соединением формулы (XII), определение которого дано выше,и превращение полученного соединения формулы (X), где R1 означает ортозамещенный арил, в желательное соединение формулы (Ia), определение которого дано выше, путем действий, аналогичных пути,который описан в st. A4) и st. A5) выше. Другой способ по данному изобретению включает st. H1) взаимодействие соединения формулы(VII), определение которого дано выше, с соединением формулы (XXIII') где n, R'2 и R'3 имеют указанные выше значения и Boc означает трет-бутоксикарбонильную группу,в условиях,аналогичных описанным в st. F1) выше; иst. H2) взаимодействие, если необходимо или желательно, полученного соединения формулы (XXV)st. H3) взаимодействие полученного соединения формулы (XXVII) где n, R'2, R'3, R2, R5 и R6 имеют указанные выше значения,с соединением формулыR'1Y (XXVI),где Y имеет указанные выше значения и R'1 имеет указанные выше значения, но не атом водорода;st. H4) превращение полученного соединения формулы (XXVIII) где n, R'1, R'2, R'3, R2, R5 и R6 имеют указанные выше значения,в желательное соединение формулы (Ib), определение которого дано выше, путем действий аналогичных пути, который описан в st. A4) и st. A5) выше. Другой способ по данному изобретению включает st. I1) взаимодействие соединения формулы(VIII), определение которого дано выше, с соединением формулы (XXXIV) где n, Z, R'1, R'2 и R'3 имеют указанные выше значения,и превращение полученного соединения формулы (XXVIIIbis) где n, R'1, R'2 и R'3 R2, R5 и R6 имеют указанные выше значения,в желательное соединение формулы (Ib), определение которого дано выше, путем действий аналогичных пути, который описан в st. A4) и st. A5) выше. Как указано выше, соединения формулы (I), (Ia) и (Ib), которые получают согласно способу по изобретению, могут быть легко превращены в другие соединения формулы (I), (Ia) или (Ib) путем выполнения действий в соответствии с хорошо известными условиями синтеза, далее приведены примеры возможных превращений.conv.a) Превращение соединения формулы (I), где R2 означает тритил (trityl) и R1, R3, R4, R5 и R6 имеют указанные выше значения, в соединение формулы (I), где R2 представляет собой собой атом водорода, R1, R3, R4, R5 и R6 имеют указанные выше значения, в кислотных условиях:conv.b) Превращение соединения формулы (I), где R2 представляет собой собой атом водорода и R1,R3, R4, R5 и R6 имеют указанные выше значения, в соединение формулы (I), где R2 имеет указанные выше значения, но не атом водорода, и R1, R3, R4, R и R6 имеют указанные выше значения, при взаимодействии с соединением формулы (V), определение которого дано выше:conv.c) Превращение соединения формулы (I), где R2 представляет собой собой атом водорода и R1,R3, R4, R5 и R6 имеют указанные выше значения, в соединение формулы (I), где R2 имеет указанные выше значения, но не атом водорода, и R1, R3, R4, R5 и R6 имеют указанные выше значения, при взаимодействии со спиртом формулыconv.d) Превращение соединения формулы (Ia), определение которого дано выше, где R'4, R4 илиR'"4 означают Br и R2, R3, R4, R5 и R6 имеют указанные выше значения, в соединение формулы (Ia), гдеR'4, R4 или R4 представляют собой группы формулы -NR7R8, где R7 и R8 представляют собой, каждый независимо, атом водорода или необязательно замещенный C1-C6-алкил, полифторированный алкил, алкенил, алкинил, гидроксиалкил, арил, арилалкил, гетероциклил, C3-C7-циклоалкил, алкиламино,ариламино или гетероциклиламиногруппу, взятые вместе с атомом азота, к которому они присоединены,образуют необязательно замещенное гетероциклическое кольцо, такое как, например, морфолино, пирролидино, пирролидин-1-илметилпирролидино, диметиламинопирролидино, 4-пирролидинпиперидино,пиперидино, диметиламинопиперидино, пиперазино, N-метилпиперазино, 2-гидроксиэтилпиперазино или 4-метил-1,4-диазепано, путем обработки амином формулыR7R8-NH, (XIV') где R7 и R8 имеют указанные выше значения.conv.e) Превращение соединения формулы (Ia), определение которого дано выше, где R'4, R4 илиR'"4 означают NO2 и R2, R3, R4, R5 и R6 имеют указанные выше значения, в соединение формулы (Ia), гдеR'4, R"4 или R'"4 означают аминогруппу, путем восстановления по традиционным способам.conv. f) Превращение соединения формулы (Ia), где R'4, R4 или R'"4 означают NH2 и R2, R3, R4, R5 иR6 имеют указанные выше значения, в соединение формулы (Ia), где R'4, R4 или R4 означают группу-NHCOR9, где R9 означает необязательно замещенный C1-C6-алкил, полифторированный алкил, алкенил,алкинил, арил, арилалкил, гетероциклил, C3-C6-циклоалкил, алкиламино, ариламино или гетероциклиламино и R2, R3, R4, R5 и R6 имеют указанные выше значения, путем обработки соединением формулыR9-COOH, (XX) где R9 имеет указанные выше значения,в присутствии подходящих агентов конденсации.conv.g) Превращение соединения формулы (Ia), где где R'4, R"4 или R4 означают третбутилоксикарбонильную группу и R2, R3, R4, R5 и R6 имеют указанные выше значения, в кислотных условиях в соединение формулы (Ia), где R'4, R4 или R4 означают -COOH, и R2, R3, R4, R5 и R6 имеют указанные выше значения.conv.h) Превращение соединения формулы (Ia), где R'4, R"4 или R'"4 означают -COOH и R2, R3, R4,R5 и R6 имеют указанные выше значения, в соединение формулы (Ia), где R'4, R4 или R'"4 означают группу -CONR7R8 и R2, R3, R4, R5 и R6 имеют указанные выше значения, путем обработки амином формулы(XIV), определение которого дано выше, в присутствии подходящих агентов конденсации.conv.i) Превращение соединения формулы (Ia), где R'4, R"4 или R'"4 означают Br и R2, R3, R4, R5 и R6 имеют значения, указанные выше, в соединение формулы (Ia), где R'4, R4 или R4 означают йод и R2, R3,R4, R5 и R6 имеют указанные выше значения, путем обработки CuI, I2 и NaI.conv.l) Превращение соединения формулы (Ia), где R'4, R"4 или R4 означают CH2OH и R2, R3, R4, R5 и R6 имеют указанные выше значения, в соединение формулы (Ia), где R'4, R4 или R'"4 означают CHO иR2, R3, R4, R5 и R6 имеют указанные выше значения, окислением, например, MnO2.conv.m) Превращение соединения формулы (Ia), где R'4, R"4 или R'"4 означают CHO и R2, R3, R4, R5 и R6 имеют указанные выше значения, в соединение формулы (Ia), где R'4, R"4 или R'"4 означаютCH2NR7R8 и R2, R3, R4, R5, R6, R7 и R8 имеют указанные выше значения, восстановительным аминирова- 18020703 нием амином формулы (XIV), определение которого дано выше.conv.n) Превращение соединения формулы (Ia), где R'4, R"4 или R'"4 означают NH2 и R2, R3, R4, R5 иR6 имеют указанные выше значения, в соединение формулы (Ia), где R'4, R"4 или R'"4 означают NR7R8 иR2, R3, R4, R5, R6, R7 и R8 имеют указанные выше значения, восстановительным аминированием соединением формулыR7COR8, (XXXIII) где R7 и R8 имеют указанные выше значения.conv.o) Превращение соединения формулы (Ib), где Z означает атом азота, R'1 означает третбутилоксикарбонильную группу и R'2, R'3, n, R2, R3, R4, R5 и R6 имеют указанные значения, в кислотных условиях в соединение формулы (Ib), где Z означает атом азота, R'1 представляет собой собой атом водорода и R'2, R'3, n, R2, R3, R4, R5 и R6 имеют указанные выше значения.conv.p) Превращение соединения формулы (Ib), где Z означает атом азота, R'1 представляет собой собой атом водорода и R'2, R'3, n, R2, R3, R4, R5 и R6 имеют указанные значения, путем взаимодействия с соединением формулы (XXVI), определение которого дано выше, в соединение формулы (Ib),где Z означает атом азота, R'1, R'2, R'3, n, R2, R3, R4, R5 и R6 имеют указанные выше значения:conv.q) Превращение соединения формулы (Ib), где Z означает атом азота, R'1 представляет собой собой атом водорода и R'2, R'3, n, R2, R3, R4, R5 и R6 имеют указанные значения, путем взаимодействия с соединением формулы (XX), определение которого дано выше, в соединение формулы (Ib), где Z означает атом азота, R'1 означает -COR9, где R9 имеет указанные выше значения и R'2, R'3, n, R2, R3, R4, R5 и R6 имеют указанные выше значения:conv.r) Превращение соединения формулы (Ib), где Z означает атом азота, R'1 представляет собой собой атом водорода и R'2, R'3, n, R2, R3, R4, R5 и R6 имеют указанные значения, путем взаимодействия с соединением формулыR9-SO2Cl, (XIX) где R9 имеет указанные выше значения,в соединение формулы (Ib), где Z означает атом азота, R'1 означает R9-SO2 и R9, R'2, R'3, n, R2, R3, R4,R5 и R6 имеют указанные выше значения:conv.s) Превращение соединения формулы (Ib), где Z означает атом азота, R'1 представляет собой атом водорода и R'2, R'3, n, R2, R3, R4, R5 и R6 имеют указанные значения, путем взаимодействия с соединением формулы ClCH2CH2SO2Cl, в соединение формулы (Ib), где Z означает атом азота, R'1 означает-SO2CH=CH2 и R'2, R'3, n, R2, R3, R4, R5 и R6 имеют указанные выше значения:conv.t) Превращение соединения формулы (Ib), где Z означает атом азота, R'1 представляет собой атом водорода и R'2, R'3, n, R2, R3, R4, R5 и R6 имеют указанные значения, путем взаимодействия с соединением формулы BrCH2CH2COCl в соединение формулы (Ib), где Z означает атом азота, R'1 означает-COCH=CH2, R'2, R'3, n, R2, R3, R4, R5 и R6 имеют указанные выше значения:conv.u) Превращение соединения формулы (Ib), где Z означает атом азота, R'1 означает -COCH=CH2 и R'2, R'3, n, R2, R3, R4, R5 и R6 имеют указанные значения, путем взаимодействия с соединением формулыR7R8NH, (XXX) где R7 и R8 имеют указанные выше значения, в соединение формулы (Ib), где Z означает атом азота,R'1 означает -COCH2CH2NR7R8 и R7, R8, R'2, R'3, n, R2, R3, R4, R5 и R6 имеют указанные выше значения:conv.v) Превращение соединения формулы (Ib), где Z означает атом азота, R'1 означает-SO2CH=CH2 и R'2, R'3, n, R2, R3, R4, R5 и R6 имеют указанные значения, путем взаимодействия с соединением формулы (XXX), определение которого дано выше, в соединение формулы (Ib), где Z означает атом азота, R'1 означает -SO2CH2CH2NR7R8, R'2, R'3, n, R2, R3, R4, R5 и R6 имеют указанные выше значения:- 20020703 Все указанные способы в каком-либо из вышеупомянутых вариантов являются аналогичными способами, которые могут быть проведены в соответствии с хорошо известными методами и в соответствующих условиях, известных специалистам. Согласно стадии (st. A1) способа соединение формулы (II) подвергают взаимодействию с производным гидразина формулы (III) в присутствии уксусной кислоты, так что получают соединение формулы(IV). Реакцию предпочтительно проводят при комнатной температуре. Если желательно или необходимо, соединение формулы (IV), где R2 представляет собой атом водорода, может быть превращено в соединение формулы (IV), где R2 имеет указанные выше значения, но не атом водорода, путем взаимодействия с подходящим соединением формулы (V), определение которого дано выше. Когда Y означает атом галогена, это предпочтительно хлор, бром или йод, и реакцию проводят в присутствии основания, такого как гидрид натрия или триэтиламин или карбонат цезия, в подходящем растворителе, например дихлорметане, тетрагидрофуране, диоксане или диметилформамиде, при температуре от комнатной до 100C. Согласно стадии (st. A2) способа соединение формулы (IV) подвергают взаимодействию сN,N-диметилформамид-ди-трет-бутилацеталем или N,N-диметилформамид-диизопропилацеталем в присутствии подходящего растворителя, такого как, например, диметилформамид, с тем чтобы получить соединения формулы (VI), определение которых дано выше. Предпочтительно реакцию проводят при температуре от комнатной до около 80C. Согласно стадии (st. A3a) способа соединение формулы (VI), определение которого дано выше,подвергают взаимодействию с гуанидином или солями гуанидина, чтобы получить соединение формулы(VII), определение которого дано выше, через образование кольца пиримидина. Соединения формулы (X), где R1 представляет собой ортозамещенную арильную группу, могут быть получены из соответствующих йод-производных формулы (VIII), которые, в свою очередь, получают из соответствующих соединений формулы (VII), определение которых дано выше. Получение йодпроизводных формулы (VIII), определение которых дано выше, может быть осуществлено в подходящем растворителе, таком как тетрагидрофуран, диэтиловый простой эфир или диметоксиэтан, при температуре от комнатной до около 80C и в течение времени от около 2 до около 48 ч. Последующее превращение йод-производного формулы (VIII), определение которого дано выше, в соединения формулы (X), определение которых дано выше, может быть проведено в присутствии амина формулыR1-NH2, (IX) определение которого дано выше, в подходящем растворителе, таком как диметилформамид, диметоксиэтан или ацетонитрил, и в присутствии каталитических количеств ацетата палладия,(2,2'-бис-(дифенилфосфино)-1,1'-бинафталина (BINAP) и основания, такого как карбонат калия, фосфат калия или карбонат цезия, при температуре от комнатной до 110C и в течение времени от около 2 до около 24 ч. Согласно стадии (st. A3b) способа соединение формулы (VI), определение которого дано выше,подвергают взаимодействию с производными гуанидина формулы (XI), определение которых дано выше,с тем чтобы получить соответствующее соединение формулы (X), определение которого дано выше, через формирование кольца пиримидина. Любую из указанных реакций проводят согласно традиционным методикам. В качестве примера реакции с гуанидином или его солями, такими как гидрохлорид, карбонат или нитрат, или с производным гуанидина формулы (XI), определение которого дано выше, как изложено для стадий (st. A3a) или (st. A3b), проводят в диметилформамиде при температуре от 80C до температуры кипения с обратным холодильником возможно в присутствии карбоната калия. Согласно стадии (st. A4) способа соединения формулы (X) могут быть превращены в производные карбоновой кислоты формулы (XIII) или соответствующую соль путем гидролиза в щелочной или кислой среде, что широко известно в области техники. Согласно стадии (st. A5) способа соединения формулы (XIII), определение которых дано выше, могут быть превращены в карбоксамидопроизводные формулы (I), где R3 и R4 имеют указанные выше значения. Реакцию проводят с амином формулы (XIV), определение которого дано выше, в щелочной среде,предпочтительно с N,N-диизопропил-N-этиламином или триэтиламином, в подходящем растворителе,таком как дихлорметан, диметилформамид, тетрагидрофуран или диоксан, и в присутствии подходящего агента конденсации, такого как N,N'-дициклогексилкарбодиимид (DCC), N-(3-диметиламинопропил)-N'этилкарбодиимид гидрохлорид (EDCI) или О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилизоуроний тетрафторборат (TBTU); каталитические количества (бензотриазол-1-илокси)трипирролидинофосфоний гексафторфосфата (PyBOP) или N-гидроксибензотриазола также могут потребоваться; при температуре от комнатной до 80C и в течение времени от около 2 до около 24 ч. Согласно стадии (st. A4a1) способа соединение формулы (X) может быть превращено в карбоксамидопроизводные формулы (I), где R3 и R4 имеют указанные выше значения. Реакцию проводят с амином формулы (IX) в щелочной среде, предпочтительно с литий бис-(триметилсилил)амидом или натрий бис-(триметилсилил)амидом в подходящем растворителе, таком как тетрагидрофуран или диоксан, при температуре от 0 до 40C и в течение времени от около 1 до около 24 ч.- 21020703 Согласно стадии (st. B1) способа соединения формулы (VIII), определение которых дано выше, могут быть превращены в производные карбоновой кислоты формулы (XV), определение которых дано выше, или их соответствующие соли путем гидролиза в щелочной или кислой среде, что хорошо известно в области техники. Согласно стадии (st. B2) способа соединения формулы (XV), определение которых дано выше, могут быть превращены в карбоксамидопроизводные формулы (XVI), где R3 и R4 имеют указанные выше значения. Реакцию проводят с амином формулы (XIV), определение которого дано выше, в щелочной среде, предпочтительно с N,N-диизопропил-N-этиламином или триэтиламином, в подходящем растворителе, таком как дихлорметан, диметилформамид, тетрагидрофуран или диоксан, и в присутствии подходящего агента конденсации,такого как(DCC),N-(3-диметиламинопропил)-N'-этилкарбодиимид гидрохлорид (EDCI) или О-(бензотриазол-1-ил)N,N,N',N'-тетраметилизоуроний тетрафторборат (TBTU), могут потребоваться также каталитические количестваN-гидроксибензотриазола, при температуре от комнатной до 80C и в течение времени от около 2 до около 24 ч. Согласно стадии (st. B3) способа соединение формулы (XVI), определение которого дано выше,превращают в соединение формулы (I), где R1, R2, R3, R4, R5 и R6 имеют указанные выше значения, при взаимодействии с амином формулы (IX), определение которого дано выше. Реакцию проводят в присутствии амина формулы (IX), определение которого дано выше, в подходящем растворителе, таком как диметилформамид, диметоксиэтан или ацетонитрил, и в присутствии каталитических количеств ацетата палладия, (2,2'-бис-(дифенилфосфино)-1,1'-бинафталина (BINAP) и основания, такого как карбонат калия, фосфат калия или карбонат цезия, при температуре от комнатной до 110C и в течение времени от около 2 до около 24 ч. Согласно стадии (st. C1) способа соединения формулы (VII), определение которых дано выше, могут быть превращены в производные карбоновой кислоты формулы (XVII), определение которых дано выше, или их соответствующие соли путем гидролиза в щелочной или кислой среде, широко известных в области технике. Согласно стадии (st. C2) способа соединения формулы (XVII), определение которых дано выше, могут быть превращены в карбоксамидопроизводные формулы (XVIII), где R3 и R4 имеют указанные выше значения. Реакцию проводят в присутствии амина формулы (XIV), определение которого дано выше, в щелочной среде, предпочтительно с N,N-диизопропил-N-этиламином или триэтиламином, в подходящем растворителе, таком как дихлорметан, диметилформамид, тетрагидрофуран или диоксан, и в присутствии подходящего агента конденсации,такого как(DCC),N-(3-диметиламинопропил)-N'-этилкарбодиимид гидрохлорид (EDCI) или О-(бензотриазол-1-ил)N,N,N',N'-тетраметилизоуроний тетрафторборат (TBTU); могут потребоваться также каталитические количестваN-гидроксибензотриазола. Согласно стадии (st. C1a) способа соединение формулы (VII) может быть превращено в карбоксамидопроизводные формулы (XVIII), где R3 и R4 имеют указанные выше значения. Реакцию проводят с амином формулы (IX) в щелочной среде, предпочтительно с литий бис-(триметилсилил)амидом или натрий бис-(триметилсилил)амидом, в подходящем растворителе, таком как тетрагидрофуран или диоксан,при температуре от 0 до 40C и в течение времени от около 1 до около 24 ч. Согласно стадии (st. C3) способа соединения формулы (XVIII), определение которых дано выше,могут быть превращены в производные формулы (XVI), где R2, R3, R4, R5 и R6 имеют указанные выше значения. Реакцию проводят в подходящем растворителе, таком как диметоксиэтан, тетрагидрофуран или диэтиловый простой эфир, в присутствии йодида цезия, йода, йодида меди и изопентилнитрита при температуре от 50 до 80C и в течение времени от около 2 до около 24 ч. Согласно стадии (st. D1) способа соединения формулы (XVIII), определение которых дано выше,подвергают взаимодействию с соединениями формулы (XII), определение которых дано выше, согласно традиционным способам. В качестве примера реакция может быть проведена в подходящем растворителе, таком как диметилформамид, диметоксиэтан или ацетонитрил, и в присутствии ортозамещенного арилйода формулы(XII),каталитических количеств ацетата палладия или трис-(дибензилиденацетон)дипалладия (Pd2(dba)3), 2,2'-бис-(дифенилфосфино)-1,1'-бинафталина (BINAP) или 2-(дициклогексилфосфино)-2',4',6'-триизопропил-1,1'-бифенила (X-phos) и основания, такого как карбонат калия, фосфат калия или карбонат цезия, при температуре от комнатной до 110C и в течение времени от около 2 до около 24 ч. Согласно стадии (st. E1) способа соединения формулы (XVIII'), определение которых дано выше,подвергают взаимодействию в кислой среде, например, с трифторуксусной кислотой, и в присутствии подходящего растворителя, такого как дихлорметан, чтобы получить соединение формулы (XXI), определение которого дано выше, при температуре от комнатной до 50C и в течение времени от около 1 до около 12 ч.- 22020703 Согласно стадии (st. E2) способа соединение формулы (XXI), определение которого дано выше,подвергают взаимодействию или с подходящим соединением формулы (V), определение которого дано выше, в присутствии основания, такого как гидрид натрия, или триэтиламин, или карбонат цезия, в подходящем растворителе,например дихлорметане, тетрагидрофуране, диоксане или диметилформамиде, при температуре от комнатной до 100C и в течение времени от около 1 до около 12 ч; или со спиртом формулы (XXXI), определение которого дано выше, в присутствии ди-третбутилазадикарбоксилата и трифенилфосфина или трифенилфосфина на полимерном носителе, в подходящем растворителе, таком как, например, тетрагидрофуран, при температуре от комнатной до 60C и в течение времени от около 1 до около 12 ч с получением соединения формулы (XXII), определение которого дано выше. Согласно (st. F1) способа соединение формулы (XVIII) подвергают взаимодействию с соединением формулы (XXIII), определение которого дано выше, в присутствии триацетоксиборгидрида натрия(NaBH(OAc)3) и трифторуксусной кислоты в присутствии ди-трет-бутилазадикарбоксилата и трифенилфосфина или трифенилфосфина на полимерном носителе, в подходящем растворителе, таком как, например, тетрагидрофуран, при температуре от комнатной до 60C и в течение времени от около 1 до около 12 ч с получением соединения формулы (Ib). Согласно стадии (st. G1) способа соединение формулы (VII), определение которого дано выше,подвергают взаимодействию с соединениями формулы (XII), где R1 представляет собой ортозамещенный-арилиодид, согласно традиционным способам. В качестве примера реакция может быть проведена в подходящем растворителе, таком как диметилформамид, диметоксиэтан или ацетонитрил, и в присутствии ортозамещенного арилйода формулы (XII), каталитических количеств ацетата палладия,(2,2'-бис (дифенилфосфино)-1,1'-бинафталин (BINAP) и основания, такого как карбонат калия, фосфат калия или карбонат цезия, при температуре от комнатной до 110C и в течение времени от около 2 до около 24 ч. Согласно (st. H1) способа соединение формулы (VII) подвергают взаимодействию с соединением формулы (XXIII'), определение которого дано выше, в присутствии триацетоксиборгидрида натрия(NaBH(OAc)3) и трифторуксусной кислоты в присутствии ди-трет-бутилазадикарбоксилата и трифенилфосфина или трифенилфосфина на полимерном носителе, в подходящем растворителе, таком как, например, тетрагидрофуран, при температуре от комнатной до 60C и в течение времени от около 1 до около 12 ч с получением соединения формулы (XXV), определение которого дано выше. Согласно (st. H2) способа соединение формулы (XXV), определение которого дано выше, подвергают взаимодействию в кислой среде, например, с хлороводородной или трехфтористой кислотой в подходящем растворителе, например тетрагидрофуране или диоксане, при температуре от комнатной температуры до 60C и в течение периода от около 1 до около 12 ч с получением соединения формулы(XXVII), определение которого дано выше. Согласно стадии (st. H3) способа соединение формулы (XXVII), определение которого дано выше,подвергают взаимодействию с подходящим соединением формулы (XXVI), определение которого дано выше, где Y означает атом галогена, предпочтительно хлор, бром или йод, в присутствии основания, такого как гидрид натрия или триэтиламин или карбонат цезия, в подходящем растворителе, например дихлорметане, тетрагидрофуране, диоксане или диметилформамиде, при температуре от комнатной до 100C и в течение времени от около 1 до около 12 ч с получением соединения (XXVIII), определение которого дано выше. Согласно (st. I1) способа соединение формулы (VIII) подвергают взаимодействию с соединением формулы (XXXIV), определение которого дано выше, в подходящем растворителе, таком как, например,тетрагидрофуран или ацетонитрил, при температуре кипения с обратным холодильником и в течение времени от около 30 мин до около 12 ч с получением соединения формулы (XXVIII), определение которого дано выше. Согласно превращению (con.а) способа соединение формулы (I), где R2 представляет собой тритил,может быть превращено в другое соединение формулы (I), где R2 представляет собой атом водорода, путем реакции в кислотных условиях, например с трифторуксусной кислотой или хлористо-водородной кислотой, и в присутствии подходящего растворителя, такого как дихлорметан или диоксан, при температуре от комнатной до 50C и в течение времени от около 1 до около 12 ч. Согласно превращению (con.b) способа соединение формулы (I), где R2 представляет собой атом водорода, может быть превращено в другое соединение формулы (I), где R2 имеет указанные выше значения, кроме атома водорода, путем взаимодействия с подходящим соединением формулы (V), определение которого дано выше, и где Y представляет собой атом галогена, предпочтительно хлор, бром или йод, в присутствии основания, такого как гидрид натрия или триэтиламин или карбонат цезия, в подходящем растворителе, например дихлорметане, тетрагидрофуране, диоксане или диметилформамиде, при температуре от комнатной до 100C и в течение времени от около 1 до около 12 ч. Согласно превращению (con.с) способа соединение формулы (I), где R2 представляет собой атом водорода, может быть превращено в другое соединение формулы (I), где R2 имеет указанные выше зна- 23020703 чения, кроме атома водорода, при взаимодействии со спиртом формулы (XXXII), определение которого дано выше, в присутствии ди-трет-бутилазадикарбоксилата и трифенилфосфина или трифенилфосфина на полимерном носителе, в подходящем растворителе, таком как, например, тетрагидрофуран, при температуре от комнатной до 60C и в течение времени от около 1 до около 12 ч. Согласно превращению (con.d) способа соединение формулы (Ia), где R'4, R"4 или R'"4 означают бром, может быть превращено в другое соединение формулы (Ia), где R'4, R"4 или R'"4 означают -NR7R8,где R7 и R8 имеют указанные выше значения, путем обработки амином формулы (XIV), определение которого дано выше, в подходящем растворителе, таком как тетрагидрофуран или диоксан, и в присутствии каталитических количеств трис-(дибензилиденацетон)дипалладия, 2-дициклогексилфосфино-2'-(N,Nдиметиламино)бифенила и основания, такого как LiN(TMS)2 при температуре от комнатной до температуры кипения с обратным холодильником и в течение времени от 1 до около 24 ч. Согласно превращению (con.е) способа соединение формулы (Ia), где R'4, R"4 или R'"4 означаютNO2, может быть превращено в другое соединение формулы (Ia), где R'4, R"4 или R'"4 означают -NH2,разнообразными путями согласно традиционным способам восстановления нитро- до аминогруппы. Предпочтительно эту реакцию проводят в подходящем растворителе, таком как, например, метанол, этанол, вода, тетрагидрофуран, 1,4-диоксан, N,N-диметилформамид, уксусная кислота или их смесь, в присутствии подходящего восстановителя, такого как, например, водород и катализатор гидрирования, или путем обработки циклогексеном или циклогексадиеном, или муравьиной кислотой, или формиатом аммония и катализатором гидрирования, или металлом, таким как железо или цинк, в присутствии неорганической кислоты, такой как хлористо-водородная кислота, или путем обработки хлоридом олова(II) при температуре от 0C до температуры кипения с обратным холодильником и в течение времени, изменяющегося от около 1 до около 96 ч. Катализатором гидрирования обычно является металл, наиболее часто палладий, который может быть использован как таковой или на углеродном носителе. Согласно превращению (con.f) способа соединение формулы (Ia), где R'4, R"4 или R'"4 означают-NH2, может быть превращено в другое соединение формулы (Ia), где R'4, R"4 или R'"4 означают-NHCOR9, при взаимодействии с кислотой формулы (XX), определение которой дано выше, в щелочной среде, предпочтительно с N,N-диизопропил-N-этиламином или триэтиламином, в подходящем растворителе, таком как дихлорметан, диметилформамид, тетрагидрофуран или диоксан, и в присутствии подходящего агента конденсации,такого как(DCC),N-(3-диметиламинопропил)-N'-этилкарбодиимид гидрохлорид (EDCI) или О-(бензотриазол-1-ил)N,N,N',N'-тетраметилизоуроний тетрафторборат (TBTU), могут потребоваться также каталитические количестваN-гидроксибензотриазола, при температуре от комнатной до 60C и в течение времени от около 1 до около 24 ч. Согласно превращению (con.g) способа соединение формулы (Ia), где R'4, R"4 или R'"4 означают трет-бутилоксикарбонильную группу, может быть превращено в другое соединение формулы (Ia), где где R'4, R4 или R'"4 означают -COOH, при взаимодействии в кислой среде, например с хлористоводородной кислотой или трифтористой кислотой, в подходящем растворителе, например тетрагидрофуране или диоксане, при температуре от комнатной до 60C и в течение времени от около 1 до около 12 ч. Согласно превращению (con.h) способа соединение формулы (Ia), где R'4, R4 или R'"4 означают-COOH, может быть превращено в другое соединение формулы (Ia), где R'4, R4 или R'"4 означают-CONR7R8, где R7 и R8 имеют указанные выше значения, путем взаимодействия с амином формулы(XIV), определение которого дано выше, в щелочной среде, предпочтительно с N,N-диизопропил-Nэтиламином или триэтиламином, в подходящем растворителе, таком как дихлорметан, диметилформамид, тетрагидрофуран или диоксан, и в присутствии подходящего агента конденсации, такого как(EDCI) или О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилизоуроний тетрафторборат (TBTU); могут потребоваться также каталитические количества (бензотриазол-1-илокси)трипирролидинофосфоний гексафторфосфата (PyBOP) или N-гидроксибензотриазола, при температуре от комнатной до 60C и в течение времени от около 1 до около 24 ч. Согласно превращению (con.i) способа соединение формулы (Ia), где R'4, R"4 или R'"4 означают -Br,может быть превращено в другое соединение формулы (Ia), где R'4, R4 или R'"4 означают -I, реакцию проводят в подходящем растворителе, таком как тетрагидрофуран, диэтиловый простой эфир, диоксан или диметоксиэтан, используя в качестве источника йода, например, NaI, CuI и I2, при температуре от комнатной до около 180C и в течение времени от около 2 до около 48 ч. Согласно (con.l) способа соединение формулы (Ia), где R'4, R4 или R'"4 означают CH2OH, может быть превращено в другое соединение формулы (Ia), где R'4, R4 или R'"4 означают -CHO, различными путями согласно традиционным способам окисления бензилового спирта до альдегидной группы. Предпочтительно эту реакцию проводят в подходящем растворителе, таком как, например, дихлорметан или хлороформ, в присутствии подходящего окислителя, такого как, например, MnO2, при температуре от 0C до температуры кипения с обратным холодильником и в течение времени, изменяющегося от около 1 до около 96 ч.- 24020703 Согласно (con.m) способа соединение формулы (Ia), где R'4, R4 или R'"4 означают CHO, может быть превращено в другое соединение формулы (Ia), где R'4, R4 или R'"4 означают CH2NR7R8, разнообразными путями согласно традиционным способам восстановительного аминирования. Предпочтительно эту реакцию проводят в подходящем растворителе, таком как, например, метанол, этанол, дихлорметан, тетрагидрофуран, 1,4-диоксан, уксусная кислота или их смесь, в присутствии восстановителя, такого как,например, NaBH(AcO)3 и подходящего амина, R7R8-NH (XIV), при температуре от 0C до температуры кипения с обратным холодильником и в течение времени, изменяющегося от около 1 до около 96 ч. Согласно (con.n) способа соединение формулы (Ia), где R'4, R4 или R'"4 означают NH2, может быть превращено в другое соединение формулы (Ia), где R'4, R"4 или R'"4 означают NR7R8, разнообразными путями согласно традиционным способам восстановительного аминирования. Предпочтительно эту реакцию проводят в подходящем растворителе, таком как, например, метанол, этанол, дихлорметан, тетрагидрофуран, 1,4-диоксан, уксусная кислота или их смесь, в присутствии восстановителя, такого как, например, NaBH(AcO)3 и подходящего кетона, такого как, например, R7COR8 (XXXIII), при температуре от 0C до температуры кипения с обратным холодильником и в течение времени, изменяющегося от около 1 до около 96 ч. Согласно превращению (con.о) способа соединение формулы (Ib), где Z означает атом азота иR'1 означает трет-бутилоксикарбонильную группу, может быть превращено в другое соединение формулы (Ib), где Z означает атом азота и R'1 представляет собой атом водорода, путем реакции в кислой среде,например, с хлористо-водородной кислотой или трифтористой кислотой в подходящем растворителе,например тетрагидрофуране или диоксане, при температуре от комнатной до 60C и в течение времени от около 1 до около 12 ч. Согласно превращению (con.p) способа соединение формулы (Ib), где Z означает атом азота иR'1 представляет собой атом водорода, может быть превращено в другое соединение формулы (Ib), гдеZ означает атом азота и R'1 имеет указанные выше значения, кроме атома водорода, путем взаимодействия с подходящим соединением формулы R'1Y (XXXI), где R'1 имеет указанные выше значения, но не атом водорода, и Y представляет собой атом галогена, предпочтительно хлор, бром или йод, в присутствии основания, такого как гидрид натрия или триэтиламин или карбонат цезия, в подходящем растворителе, например дихлорметане, тетрагидрофуране, диоксане или диметилформамиде, при температуре от комнатной до 100C и в течение времени от около 1 до около 12 ч. Согласно превращению (con.q) способа соединение формулы (Ib), где Z означает атом азота иR'1 представляет собой атом водорода, может быть превращено в другое соединение формулы (Ib), гдеZ означает атом азота и R'1 означает -NHCOR9, где R9 имеет указанные выше значения, при взаимодействии с кислотой формулы (XX), определение которой дано выше, в щелочной среде, предпочтительно сN,N-диизопропил-N-этиламином или триэтиламином, в подходящем растворителе, таком как дихлорметан, диметилформамид, тетрагидрофуран или диоксан, и в присутствии подходящего агента конденсации,такого как(DCC),N-(3-диметиламинопропил)-N'этилкарбодиимид гидрохлорид (EDCI) или О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилизоуроний тетрафторборат (TBTU); также могут потребоваться каталитические количества (бензотриазол-1 илокси)трипирролидинофосфоний гексафторфосфата (PyBOP) или N-гидроксибензотриазола, при температуре от комнатной до 60C и в течение времени от около 1 до около 24 ч. Согласно превращению (con.r) способа соединение формулы (Ib), где Z означает атом азота иR'1 представляет собой атом водорода, может быть превращено в другое соединение формулы (Ib), гдеZ означает атом азота и R'1 означает SO2R9, где R9 имеет указанные выше значения, при взаимодействии с кислотой формулы (XIX), как определено выше, в щелочной среде, предпочтительно сN,N-диизопропил-N-этиламином или триэтиламином, в подходящем растворителе, таком как дихлорметан, диметилформамид, тетрагидрофуран или диоксан, при температуре от комнатной до 60C и в течение времени от около 1 до около 24 ч. Согласно превращению (con.s) способа соединение формулы (Ib), где Z означает атом азота иR'1 представляет собой атом водорода, может быть превращено в другое соединение формулы (Ib), гдеZ означает атом азота и R'1 означает -SO2-CH=CH2, путем взаимодействия с соединением формулыClCH2CH2SO2Cl в щелочной среде, предпочтительно с N,N-диизопропил-N-этиламином или триэтиламином, в подходящем растворителе, таком как дихлорметан, диметилформамид, тетрагидрофуран или диоксан, при температуре от комнатной до 60C и в течение времени от около 1 до около 24 ч. Согласно превращению (con.t) способа соединение формулы (Ib), где Z означает атом азота иR'1 представляет собой атом водорода, может быть превращено в другое соединение формулы (Ib), гдеZ означает атом азота и R'1 означает -CO-CH=CH2, при взаимодействии с соединением формулыBrCH2CH2COCl в щелочной среде, предпочтительно с N,N-диизопропил-N-этиламином или триэтиламином в подходящем растворителе, таком как дихлорметан, диметилформамид, тетрагидрофуран или диоксан, в присутствии подходящего агента конденсации, такого как N,N'-дициклогексилкарбодиимид(DCC), N-(3-диметиламинопропил)-N'-этилкарбодиимид гидрохлорид (EDCI) или О-(бензотриазол-1-ил)N,N,N',N'-тетраметилизоуроний тетрафторборат (TBTU); могут также потребоваться каталитические количестваN-гидроксибензотриазола, при температуре от комнатной до 60C и в течение времени от около 1 до около 24 ч. Согласно превращению (con.u) способа соединение формулы (Ib), где Z означает атом азота иR'1 означает -COCH=CH2, может быть превращено в другое соединение формулы (Ib), где Z означает атом азота и R'1 означает -COCH2CH2NR7R8, где R7 и R8 имеют указанные выше значения, путем взаимодействия с амином формулы (XXX), определение которого дано выше, в подходящем растворителе, таком как дихлорметан, диметилформамид, тетрагидрофуран или диоксан, при температуре от комнатной до 60C и в течение времени от около 1 до около 24 ч. Согласно превращению (con.v) способа соединение формулы (Ib), где Z означает атом азота иR'1 означает SO2CHCH3, может быть превращено в другое соединение формулы (Ib), где Z означает атом азота и R'1 означает -SO2CH2CH2NR7R8, где R7 и R8 имеют указанные выше значения, путем взаимодействия с амином формулы (XXX), определение которого дано выше, в подходящем растворителе, таком как дихлорметан, диметилформамид, тетрагидрофуран или диоксан, при температуре от комнатной до 60C и в течение времени от около 1 до около 24 ч. Излишне говорить также, что любые промежуточные соединения указанных способов могли быть превращены в другие промежуточные соединения, если желательно или необходимо, путем осуществления операций, аналогичных описанным здесь выше реакциям превращения. Из всего сказанного выше специалисту очевидно, что любое соединение формулы (I), несущее функциональную группу, может быть дополнительно дериватизировано до другой функциональной группы путем обработки согласно хорошо известным специалистам способам, приводящим к другим соединениям формулы (I), и это должно быть включено в сферу действия данного изобретения. Согласно любому варианту способа получения соединений формулы (I) исходные материалы и любые другие реагенты известны или легко могут быть получены в соответствии с известными методами. В качестве примера, пока исходный материал соединений формулы (II) коммерчески доступен, соединения формулы (II) могут быть получены, как описано в вышеупомянутой публикации WO 04/104007. Соединения формул (III), (V), (IX), (XI), (XIV), (XIV), (XIX), (XX), (XXIII), (XXVI), (XXIX), (XXX), (XXXI) и(XXXIII) коммерчески доступны, другие могут быть получены, см. следующие примеры. Из всего сказанного выше специалисту ясно, что при получении соединений формулы (I) по любому из указанных выше вариантов способа необязательные функциональные группы в исходных материалах или их промежуточных соединениях, которые могут давать начало нежелательным побочным реакциям, должны быть соответствующим образом защищены согласно традиционным технологиям. Подобно этому превращение этих последних в свободные соединения также может быть проведено согласно известным процедурам. Как легко можно понять, если соединения формулы (I), приготовленные согласно способу, описанному выше, получают как смесь изомеров, их разделение с применением традиционных технических приемов на отдельные изомеры формулы (I) находится в сфере действия данного изобретения. Традиционные технологии разделения рацематов включают, например, раздельную кристаллизацию диастереоизомерных солевых производных или препаративную хиральную HPLC. В дополнение, соединения формулы (I) по изобретению могут быть также получены согласно комбинаторным химическим технологиям, широко известным в области техники, например осуществлением указанных реакций между несколькими промежуточными соединениями параллельно и/или последовательно и переработкой в условиях твердофазного синтеза (SPS). Фармакология. Соединения формулы (I) активны как ингибиторы протеинкиназы и поэтому применимы, например,для ограничения нерегулируемой пролиферации опухолевых клеток. В терапии они могут быть применены при лечении различных опухолей, таких как указанные ранее, а также при лечении других клеточных пролиферативных расстройств, таких как доброкачественная гиперплазия простаты, семейный аденоматоз, полипоз, нейрофиброматоз, псориаз, сосудистая плоскоклеточная пролиферация, связанная с атеросклерозом, пневмосклерозом, артритом, гломерулонефритом и постхирургическим стенозом и рестенозом. Ингибирующая активность предполагаемых ингибиторов MPS1 и действенность выбранных соединений определяли анализами, описанными ниже. Сокращения и аббревиатуры, используемые в данном описании, имеют следующие значения: Клонирование, экспрессия и очистка рекомбинантного белка MPS1 полной длины. Полная длина MPS1 (соответствующая остаткам 2-857 полной последовательности, см. Swiss-Prot,инвентарный номер Р 33981) была PCR амплифицирована из человеческого гена полной длины MPS1,- 26020703 имеющегося в наличии в виде клона pGEX4tMPS1. Амплификацию осуществляли, используя "прямой" олигонуклеотид: Для целей клонирования олигонуклеотиды включали сайты attB, чтобы получитьattB-фланкированный PCR продукт, подходящий для клонирования с использованием технологииGateway (Invitrogen). Кроме того, для целей очистки прямой праймер включал сайт расщепления протеазы. Полученный PCR продукт клонировали в плазмиде pDONR201 и затем переносили в бакуловирусный экспрессирующий вектор pVL 1393GST(Invitrogen) Gateway-модифицированный. Клонирование осуществляли согласно протоколам, описанным в руководстве Gateway. Бакуловирусы создавали путем сотрансфекции клеток Sf9 насекомых экспрессирующим вектором и вирусной DNA с использованием набора для трансфекции BaculoGold (Pharmingen). Вирусный супернатант извлекали через 5 дней и подвергали 3 раундам амплификации, чтобы повысить вирусный титр. Рекомбинантный белок получали путем заражения клеток High5 насекомых. После 72 ч заражения при 21C клетки извлекали, гранулировали и замораживали при -80C. Для очистки рекомбинантного белка гранулу оттаивали, повторно суспендировали в лизисном буфере (PBS, NaCl 150 мМ, глицерин 10%, CHAPS 0,1%, DTT 20 мМ, ингибиторы протеазы и фосфатазы) и подвергали лизису с помощьюGaulin. Лизат осветляли центрифугированием и загружали в аффинную колонку GST. После исчерпывающего промывания рекомбинантный белок расщепляли специфической протеазой и элюировали путем инкубации. Чтобы получить полностью активированный фермент, белок затем подвергали аутофосфорилированию в присутствии ATP 1 мМ при 25C в течение 2 ч в киназном буфере (Hepes pH 7,5 50 мМ, MgCl2 2,5 мМ, MnCl2 1 мМ, DTT 1 мМ, ингибиторы фосфатазы); ATP затем удаляли, используя обессоливающую колонку. Биохимический анализ ингибиторов активности MPS1 киназы. Ингибирующую активность предполагаемых ингибиторов киназы и действенность выбранных соединений определяли с использованием анализа трансфосфорилирования. Специфические пептидные или белковые субстраты трансфосфорилировали их специфическимиser-thr или tyr киназами в присутствии ATP, меченной 33 РATP, и в присутствии их собственного оптимального буфера и кофакторов. В конце реакции фосфорилирования более чем 98% немеченой ATP и радиоактивной ATP улавливается избытком ионообменной смолы DOWEX; смола затем оседает на дне реакционного планшета за счет гравитации. Супернатант впоследствии отбирают и переносят на счетную пластинку, затем оценивают путем -подсчета. Реагенты/условия анализа.i. Получение смолы DOWEX. 500 г влажной смолы (SIGMA, приготовленной на заказ смолы DOWEX 18 200-400 меш, 2,5 кг) взвешивают и разбавляют до 2 л в 150 мМ формиате натрия, рН 3,00. Смоле дают возможность осаждаться (несколько часов) и затем супернатант удаляют. После трех промываний, как указано выше, в течение 2 дней смоле дают возможность осаждаться и добавляют два объема (на объем смолы) буфера 150 мМ формиата натрия. Затем измеряют рН, он должен быть около 3,00. Промытая смола остается стабильной в течение более чем одной недели, запасную смолу держат при 4C до использования.ii. Киназный буфер (KB). Буфер для анализа MPS1 составляли из Hepes 50 мМ при рН 7,5 с 2,5 мМ MgCl2, 1 мМ MnCl2, 1 мМiii. Условия анализа. Анализ проводили с конечной концентрацией MPS1 5 нМ в присутствии 15 мкМ ATP и 1,5 нМ 33 РATP, субстратом был P38tide, используемый при 200 мкМ. Роботизированный dowex анализ. Смесь для испытания состояла из следующего: 1) 3 ферментная смесь (приготовленная в киназном буфере 3), 5 мкл/лунка; 2) 3 субстрат и ATP смесь (приготовленная в ddH2O) вместе с 33 РATP, 5 мкл/лунка; 3) 3 испытуемые соединения (разбавленные в ddH2O - 3% DMSO), 5 мкл/лунка. Разбавление соединения и схему анализа см. ниже. Разбавление соединения и схема анализа определены ниже.i. Разбавление соединений. Испытуемые соединения получают как 1 мМ раствор в 100% DMSO, распределенный на 96- или 384-луночных планшетах:a) для исследований процентного ингибирования (HTS) на планшетах индивидуального разбавления при 1 мМ проводят разбавление при 3 концентрации (30 мкМ) в ddH2O (3% DMSO = конечная концентрация) с помощью автоматизированной пипеточной платформы Beckman NX. Такой же инструмент используют для распределения разбавленных маточных планшетов на планшеты для испытаний;b) для определения IC50 (платформа KSS) 100 мкл каждого соединения при 1 мМ в 100% DMSO переносят с первоначального планшета в первую колонку другого 96-луночного планшета (от А 1 до G1),лунку H1 оставляют пустой для внутреннего стандартного ингибитора, обычно стауроспорина. Автоматизированную станцию для последовательных разбавлений (Biomek FZ, Backman) используют для осуществления разбавлений 1:3 в 100% DMSO от линии А 1 до А 10 и для всех семи соединений в колонке. Кроме того, 4-5 копий дочерних планшетов подготавливают путем преобразования 5 мкл из этого первого набора планшетов разбавления в 100% DMSO в 384-луночные планшеты с глубокими лунками: одна копия дочерних планшетов с последовательными разбавлениями испытуемых соединений должна быть разморожена в первый день экспериментов, восстановлена при 3 концентрации водой и использована в анализах определения IC50. В стандартном эксперименте наивысшая концентрация (3) всех соединений равна 30 мкМ, тогда как низшая - 1,5 нМ. Каждый 384-луночный планшет должен содержать лунки сравнения (полная ферментная активность против отсутствия ферментной активности) для Z' и сигнала для оценки фона.ii. Схема анализа. 384-луночные планшеты с V-образным дном (планшеты для испытания) готовят с 5 мкл разбавления соединения (3) и затем помещают на роботизированную станцию Plate Trak 12 (Perkin Elmer, робот имеет одну головку с 384 пипеточными кончиками для начала анализа плюс одну головку с 96 кончиками для распределения смолы) вместе с одним резервуаром для ферментной смеси (3) и одним для ATP смеси (3). В начале опыта робот всасывает 5 мкл ATP смеси, делает воздушный зазор внутри кончиков (2 мкл) и всасывает 2 мкл MPS1 смеси. Последующая раздача в планшеты позволяет начаться реакции киназы под воздействием 3 циклов перемешивания, осуществляемых самим роботом. В этот момент восстанавливается правильная концентрация для всех реагентов. Робот инкубирует планшеты в течение 60 мин при комнатной температуре и затем прекращает реакцию введением пипеткой 70 мкл суспензии смолы dowex в реакционную смесь. Три цикла перемешивания делают сразу же после добавления смолы. Суспензия смолы очень плотная, чтобы избежать закупоривания кончиков, для ее раздачи используют кончики с широкими отверстиями. Другой цикл перемешивания осуществляют после того, как все планшеты остановлены, в это время используют нормальные кончики, планшетам затем дают возможность отстояться около 1 ч, чтобы довести до максимума улавливание ATP. В этот момент 20 мкл супернатанта переносят в 384-оптипланшеты(Perkin-Elmer, с 70 мкл Microscint 40 (Perkin-Elmer), после 5 мин орбитального взбалтывания планшеты считывают на счетчике радиоактивности Perkin-Elmer Top Count.iii. Данные анализа. Данные анализируют с применением специально приспособленной для этого версии программы SW"Assay Explorer", которая обеспечивает либо % ингибирование для первичных анализов, либо сигмоидальные подгонки кривых десятикратных разбавлений для определения IC50 во вторичных анализах/операциях подтверждения совпадений. Биохимический анализ ингибиторов активности киназы PLK-1. Ингибирующую активность предполагаемых ингибиторов киназы и действенность выбранных соединений определяли с помощью анализа трансфосфорилирования. Специфические пептидные или белковые субстраты трансфосфорилируют их специфическими серин-треонин или тирозинкиназами в присутствии ATP, меченной 33 РATP, в присутствии ее собственного оптимального буфера и кофакторов. В конце реакции фосфорилирования более чем 98% немеченой ATP и радиоактивной ATP улавливают избытком ионообменной смолы DOWEX; смола затем оседает на дне реакционного планшета за счет гравитации. Супернатант, содержащий фосфорилированный субстрат, впоследствии отбирают и переносят на счетную пластинку, затем оценивают путем -подсчета. Реагенты/условия анализа. Получение смолы DOWEX. 500 г влажной смолы (SIGMA, приготовленной на заказ смолы DOWEX 18 200-400 меш, 2,5 кг) взвешивают и разбавляют до 2 л в 150 мМ формиате натрия, рН 3,00. Смоле дают возможность осаждаться (несколько часов) и затем супернатант удаляют. После трех промываний, как указано выше, в течение 2 дней смоле дают возможность осаждаться,- 28020703 супернатант удаляют и добавляют два объема буфера 150 мМ формиата натрия на объем гранулы. Затем измеряют рН, и он должен быть около 3,00. Промытая смола остается стабильной в течение более чем одной недели, запасную смолу держат при 4C до использования.ii. Киназный буфер (KB). Киназный буфер составляли из 50 мМ Hepes при рН 7,9, содержащего 10 мМ MgCl2, 1 мМ DTT,3 мкМ NaVO3 и 0,2 мг/мл BSA, 10 мкМ -глицерофосфата.iii. Условия анализа. Киназный анализ проводили с конечной концентрацией фермента PLK-1 3 нМ в присутствии 40 мкМ ATP, 3 нМ 33 РATP и 85 мкМ субстратом альфа-казеином, SIGMA,С-3240. Роботизированный dowex анализ 1) 3 ферментная смесь (приготовленная в киназном буфере 3), 5 мкл/лунка; 2) 3 субстрат и ATP смесь (приготовленная в ddH2O) вместе с 33 РATP, 5 мкл/лунка; 3) 3 испытуемые соединения (разбавленные в ddH2O - 3% DMSO), 5 мкл/лунка. Разбавление соединения и схема анализа определены ниже.i. Разбавление соединений. 10 мМ стандартные растворы испытуемых соединений в 100% DMSO распределяли в 96-луночные титрационные микропланшеты формата 128. Для исследований процентного ингибирования готовят планшеты индивидуального разбавления при 1 мМ, 100 и 10 мкМ в 100% DMSO, затем проводят разбавление при 3 концентрации (30, 3 и 0,3 мкМ) в ddH2O, 3% DMSO. Multimek 96 (Beckman) используют для разбавлений и соединение вносят пипеткой в планшеты для испытаний. Для определения IC50 соединения получают как 1 мМ растворы в 100% DMSO, помещают в первую колонку титрационного микропланшета (от А 1 до G1), 100 мкл.Biomek 2000 (Backman) используют для последовательных разбавлений 1:3 в воде, 3% DMSO от колонки А 1 до А 10 и для всех семи соединений в планшете. В стандартном эксперименте наивысшая концентрация всех соединений равна 30 мкМ, затем разбавленная в конечной испытуемой смеси до 10 мкМ.ii. Схема анализа. 384-луночные планшеты с V-образным дном (планшеты для испытания) готовят с 5 мкл разбавления соединения (3) и затем помещают на роботизированную станцию Plate Trak 12 (Perkin Elmer, робот имеет одну головку с 384 пипеточными кончиками для начала анализа плюс одну головку с 96 кончиками для распределения смолы) вместе с одним резервуаром для ферментной смеси (3) и одним для ATP смеси (3). В начале опыта робот всасывает 5 мкл ATP смеси, делает воздушный зазор внутри кончиков(3 мкл) и всасывает 5 мкл PLK-1 смеси. Последующая раздача в планшеты позволяет начаться реакции киназы под воздействием 3 циклов перемешивания, осуществляемых самим роботом. В этот момент восстанавливается правильная концентрация для всех реагентов. Робот инкубирует планшеты в течение 60 мин при комнатной температуре и затем прекращает реакцию введением пипеткой 70 мкл суспензии смолы dowex в реакционную смесь. Три цикла перемешивания осуществляют сразу же после добавления смолы. Другой цикл перемешивания осуществляют после того, как все планшеты остановлены, в это время используют нормальные кончики, планшетам затем дают возможность отстояться около 1 ч, чтобы довести до максимума улавливание ATP. В этот момент 20 мкл супернатанта переносят в 384-оптипланшеты(Perkin-Elmer) с 70 мкл Microscint 40 (Perkin-Elmer), после 5 мин орбитального взбалтывания планшеты считывают на счетчике радиоактивности Perkin-Elmer Top Count.iii. Данные анализа. Данные анализируют с применением специально приспособленной для этого версии программы SW"Assay Explorer", которая обеспечивает либо % ингибирование для первичных анализов, либо сигмоидальные подгонки кривых десятикратных разбавлений для определения IC50 во вторичных анализах/операциях подтверждения совпадений. Биохимический анализ ингибиторов активности киназы Aurora-2.In vitro анализ ингибирования киназы проводили таким же образом, как описано для ферментаi. Киназный буфер (KB) для Aurora-2. Киназный буфер составляли из 50 мМ Hepes, pH 7,0, 10 мМ MgCl2, 1 мМ DTT, 3 мкМ NaVO3 и 0,2 мг/мл BSA.ii. Условия анализа для Aurora-2 (конечные концентрации). Киназный анализ проводили с ферментной концентрацией 2,5 нМ, 10 мкМ ATP, 1 нМ 33 РATP и 8 мкМ субстратом, состоящим из 4 LRRWSLG повторов. Анализ ингибирования активности Cdk2/циклина А. Киназная реакция: субстрат 1,5 мкМ гистон H1, 25 мкМ ATP (0,2 мкКи 33 РATP), 30 нг бакуловирусного совместно экспрессированного Cdk2/циклина А, 10 мкМ ингибитор в конечном объеме буфера
МПК / Метки
МПК: A61P 35/00, C07D 487/04, A61K 31/517
Метки: пиразолохиназолины
Код ссылки
<a href="https://eas.patents.su/30-20703-pirazolohinazoliny.html" rel="bookmark" title="База патентов Евразийского Союза">Пиразолохиназолины</a>







