Пиридонкарбоксамиды и их применение, средства защиты растений, способ защиты полезных растений от фитотоксического побочного действия агрохимикатов, способ избирательной борьбы с вредными растениями в культурах полезных растений
Номер патента: 20453
Опубликовано: 28.11.2014
Авторы: Бикерс Удо, Вильмс Лотар, Цимер Франк, Хакер Эрвин, Розингер Кристофер Юг, Аулер Томас
Формула / Реферат
1. Применение соединения формулы (I) или его солей,
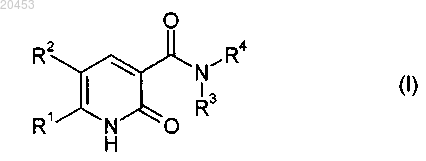
в которой
R1 означает (С1-С4)-галоидалкил и
R2 означает водород или галоген и
R3 означает водород, (С1-С10)-алкил, (С2-С10)-алкенил или (С2-С10)-алкинил, причем каждый из трех последних остатков возможно замещен одним или несколькими заместителями из группы, включающей (С1-С4)-алкокси, (С1-С4)-галоидалкокси, (С1-С4)-алкилтио, [(С1-С4)-алкокси]карбонил,
R4 означает (С1-С10)-алкил, (С2-С10)-алкенил или (С2-С10)-алкинил, каждый из которых возможно замещен одним или несколькими заместителями из группы, включающей галоген, гидрокси, циано, (С1-С4)-алкокси, (С1-С4)-галоидалкокси, (С1-С4)-алкилтио, (С1-С4)-алкиламино, ди[(С1-С4)-алкил]амино, [(С1-С4)-алкокси]карбонил, [(С1-С4)-галоидалкокси]карбонил, (С3-С6)-циклоалкил, который возможно замещен (С1-С4)-алкилом, фенил, который возможно замещен одним или несколькими заместителями из группы, включающей галоген, (С1-С4)-алкил, (С1-С4)-галоидалкил, (С1-С4)-алкокси, (С1-С4)-галоидалкокси и (С1-С4)-алкилтио, и
3-9-членный гетероциклил с 1-3 гетероатомами в цикле из группы N, О и S, который возможно замещен одним или несколькими заместителями из группы, включающей галоген, (С1-С4)-алкил, (С1-С4)-галоидалкил, (С1-С4)-алкокси, (С1-С4)-галоидалкокси, (С1-С4)-алкилтио и оксо,
или (С3-С6)-циклоалкил, который с одной стороны цикла может быть сконденсирован с 4-6-членным насыщенным или ненасыщенным карбоциклом, возможно замещенным одним или несколькими заместителями из группы, включающей (С1-С4)-алкил, или R3 означает (С1-С4)-алкокси, (С2-С4)-алкенилокси, (С2-С6)-алкинилокси или (С2-С4)-галоидалкокси и R4 означает водород или (С1-С4)-алкил, или
R3 и R4 вместе с непосредственно связанным с ними N-атомом означают 4-8-членный гетероцикл, который наряду с атомом азота также может содержать в цикле до двух других гетероатомов, из группы, включающей N, О и S, и который возможно замещен одним или несколькими заместителями из группы, включающей галоген, циано, нитро, (С1-С4)-алкил, (С1-С4)-галоидалкил, (С1-С4)-алкокси, (С1-С4)-галоидалкокси и (С1-С4)-алкилтио, или
R3 и R4 вместе с непосредственно связанным с ними N-атомом означают группу -N=CR5-NR6R7, в которой R5 означает водород или (С1-С6)-алкил, и
R6, R7 независимо друг от друга означают водород или (С1-С4)-алкил, или R6 и R7 вместе с непосредственно связанным с ними атомом азота образуют 5-7-членный гетероцикл,
в качестве средств защиты полезных растений для снижения или предотвращения вредного воздействия гербицидов на полезные растения.
2. Применение по п.1, отличающееся тем, что R1 означает остаток (С1-С4)-галоидалкил, R2 означает галоген, R3 означает водород и R4 означает водород.
3. Применение по п.1, отличающееся тем, что R1 означает остаток формулы CF2Cl, CF2H, CF2CF3, CF2CF2H, CF2CF2Cl, CFClCF3, CFHCF3, CF(CF3)2, CH(CF3)2, CF2CF2CF3 или C(CH3)2F, R2 означает водород, R3 означает водород и R4 означает водород.
4. Применение по п.1, отличающееся тем, что R1 означает CF3, CF2Cl, CF2H, CF2CF3, CF2CF2H, CF2CF2Cl, CF2CF2CF3 или C(CH3)2F, R2 означает водород или галоген.
5. Соединение формулы (I) или его соли,
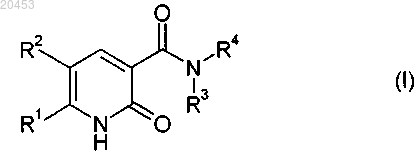
в которой
R1 означает (С1-С4)-галоидалкил,
R2 означает водород или галоген,
R3 означает водород, (С1-С10)-алкил, (С2-С10)-алкенил или (С2-С10)-алкинил, причем каждый из трех последних остатков возможно замещен одним или несколькими заместителями из группы, включающей (С1-С4)-алкокси, (C1-С4)-галоидалкокси, (С1-С4)-алкилтио, [(С1-С4)-алкокси]карбонил, и
R4 означает (С1-С10)-алкил, (С2-С10)-алкенил или (С2-С10)-алкинил,
каждый из которых возможно замещен одним или несколькими заместителями из группы, включающей галоген, гидрокси, циано, (C1-C4)-алкокси, (С1-С4)-галоидалкокси, (С1-С4)-алкилтио, (С1-С4)-алкиламино, ди[(С1-С4)-алкил]амино, [(С1-С4)-алкокси]карбонил, [(С1-С4)-галоидалкокси]карбонил,
или (С3-С6)-циклоалкил, который может быть с одной стороны цикла сконденсирован с 4-6-членным насыщенным или ненасыщенным карбоциклом, возможно замещенным одним или несколькими заместителями из группы, включающей (С1-С4)-алкил,
фенил, который возможно замещен одним или несколькими заместителями из группы, включающей галоген, (С1-С4)-алкил, (С1-С4)-галоидалкил, (С1-С4)-алкокси, (С1-С4)-галоидалкокси и (С1-С4)-алкилтио, и
3-9-членный гетероциклил с 1-3 гетероатомами в цикле из группы N, О и S, который возможно замещен одним или несколькими заместителями из группы, включающей галоген, (С1-С4)-алкил, (С1-С4)-галоидалкил, (С1-С4)-алкокси, (С1-С4)-галоидалкокси, (С1-С4)-алкилтио и оксо, или R3 означает (С1-С4)-алкокси, (С2-С4)-алкенилокси, (С2-С6)-алкинилокси или (С2-С4)-галоидалкокси и R4 означает водород или (С1-С4)-алкил, или
R3 и R4 вместе с непосредственно связанным с ними N-атомом означают 4-8-членный гетероцикл, который наряду с атомом азота также может содержать в цикле до двух других гетероатомов, из группы, включающей N, О и S, и который возможно замещен одним или несколькими заместителями из группы, включающей галоген, циано, нитро, (С1-С4)-алкил, (С1-С4)-галоидалкил, (С1-С4)-алкокси, (С1-С4)-галоидалкокси и (С1-С4)-алкилтио, или
R3 и R4 вместе с непосредственно связанным с ними N-атомом означают группу -N=CR5-NR6R7, в которой R5 означает водород или (С1-С6)-алкил, и
R6, R7 независимо друг от друга означают водород или (С1-С4)-алкил, или R6 и R7 вместе с непосредственно связанным с ними атомом азота образуют 5-7-членный гетероцикл.
6. Соединение по п.5, отличающееся тем, что R1 означает остаток (С1-С4)-галоидалкил, R2 означает галоген, R3 означает водород и R4 означает водород.
7. Соединение по п.5, отличающееся тем, что R1 означает остаток формулы CF2CF3, CF2CF2H, CF2CF2Cl, CFClCF3, CFHCF3, CF(CF3)2, CH(CF3)2, CF2CF2CF3 или C(CH3)2F, R2 означает водород, R3 означает водород и R4 означает водород.
8. Средство защиты растений, отличающееся тем, что оно содержит одно или несколько соединений формулы (I) или их солей по одному из пп.5-7.
9. Средство защиты растений по п.8, отличающееся тем, что оно содержит дополнительно вспомогательные средства для препаративных форм или один или несколько гербицидов и при необходимости вспомогательные средства для препаративных форм.
10. Способ защиты полезных растений от фитотоксического побочного действия агрохимикатов, отличающийся тем, что эффективные количества одного или нескольких соединений формулы (I) или их солей по одному из пп.5-7 наносят на растения, части растений, семена растений или посевной материал перед, после или одновременно с нанесением гербицида или гербицидов.
11. Способ избирательной борьбы с вредными растениями в культурах полезных растений, отличающийся тем, что эффективные количества одного или нескольких соединений формулы (I) или их солей по одному из пп.5-7 наносят на растения, части растений, семена растений или посевной материал перед, после или одновременно с нанесением одного или нескольких гербицидов.
Текст
ПИРИДОНКАРБОКСАМИДЫ И ИХ ПРИМЕНЕНИЕ, СРЕДСТВА ЗАЩИТЫ РАСТЕНИЙ, СПОСОБ ЗАЩИТЫ ПОЛЕЗНЫХ РАСТЕНИЙ ОТ ФИТОТОКСИЧЕСКОГО ПОБОЧНОГО ДЕЙСТВИЯ АГРОХИМИКАТОВ, СПОСОБ ИЗБИРАТЕЛЬНОЙ БОРЬБЫ С ВРЕДНЫМИ РАСТЕНИЯМИ В КУЛЬТУРАХ ПОЛЕЗНЫХ РАСТЕНИЙ или их соли, где R1-R4 определены, как в формуле (I) п.1, пригодны в качестве средства защиты растений для снижения или предотвращения вредного воздействия агрохимикатов на полезные растения. Некоторые из соединений формулы (I) или их соли являются новыми (см. п.5). Также данное изобретение относится к способу защиты полезных растений от фитотоксического побочного действия агрохимикатов, способу избирательной борьбы с вредными растениями в культурах полезных растений.(71)(73) Заявитель и патентовладелец: БАЙЕР КРОПСАЙЕНС АГ (DE) Данное изобретение относится к соединениям, обладающим свойствами средств защиты полезных растений, к их применению и к средствам, которые содержат специальные соединения в качестве защитных средств для снижения фитотоксического воздействия агрохимикатов, особенно гербицидов. В частности, изобретение относится к производным пиридона в качестве защитных средств. Также данное изобретение относится к способу защиты полезных растений от фитотоксичесого побочного действия агрохимикатов, способу избирательной борьбы с вредными растениями в культурах полезных растений. При борьбе с нежелательными организмами в сельскохозяйственных и лесохозяйственных технических культурах с использованием пестицидов применяемыми пестицидами часто более или менее сильно повреждаются также и полезные растения. Этот нежелательный фитотоксический побочный эффект особенно сильно проявляется при использовании многочисленных гербицидов в культурах полезных растений, таких как, например, кукуруза, рис или зерновые, в особенности при так называемом применении гербицидов после появления всходов. При использовании так называемых защитных средств или антидотов во многих случаях полезные растения могут быть защищены от фитотоксических свойств пестицидов, не снижая при этом пестицидного воздействия на вредные организмы или не влияя существенно на него. Во многих случаях наблюдалось даже улучшение пестицидного воздействия на вредные организмы, такие как сорняки. Соединения, известные к настоящему времени в качестве защитных средств, относятся к большому числу различных классов химических соединений, при этом их пригодность для использования в качестве защитных средств, как правило, зависит от химического строения пестицида и от культур полезных растений. Давно известны защитные свойства соединений из группы производных фенокси- или гетероарилоксиалканкарбоновых кислот, когда эти соединения применяют в комбинации с гербицидами. Примерами таких соединений являются МСРА и аналогичные соединения, которые одновременно обладают гербицидной активностью против вредных растений, или клоквинтоцет-мексил. Далее, известны защитные средства из группы производных N-фенилзамещенных сложных эфиров гетероароматических карбоновых кислот с несколькими гетероатомами в гетероцикле. Примерами таких защитных средств являются применяемые в продуктах торгового качества защитные средства мефенпир-диэтил и изоксадифенэтил. Из WO 2004/084631 известно применение гидроксизамещенных производных ароматических карбоновых кислот. В WO 2005/015994 описаны некоторые производные салициловой кислоты в качестве защитных средств. Они особенно пригодны для применения в качестве защитных средств в культурах сои и кукурузы. Далее, из 2005/112630 известны производные 1,2-дигидрохиноксалин-2-она в качестве защитных средств. Из литературы известны биологически активные вещества из химического класса пиридонов с пестицидными свойствами. Описаны различные виды биологической активности; так, например, в WO 2001/014339 описана фунгицидная активность некоторых замещенных пиридонкарбоксамидов, в WO 2005/042492 и WO 2005/042493 описана среди прочих фунгицидная активность гетероциклилкарбоксанилидов. В ЕР-А-544151 сообщается о гербицидной активности гидроксизамещенных пиридонкарбоксамидов. Кроме того, известны представители с фармакологическими свойствами. Так в WO 2001/055115 описаны никотинанилиды в качестве индукторов апоптоза, а также в US 2004/0116479 сообщается о диалкилникотинамидах в качестве ингибиторов ангиогенеза. Далее, в ЕР-А-522392 описаны пиридонкарбоксамиды с 6-трифторметильным заместителем в качестве предшествующих продуктов для синтеза сульфонилмочевин с гербицидной активностью. В Helv.Chim. Acta 71 (1988) 596-601 и GB 2305174 упоминаются 1,2-дигидро-2-оксо-6-трифторметилпиридин-3 карбоксамид, 6-хлор(дифтор)метил-1,2-дигидро-2-оксо-пиридин-3-карбоксамид, а также 6-дифторметил 1,2-дигидро-2-оксо-пиридин-3-карбоксамид в качестве промежуточных продуктов в синтезе пиранопиридинов. В WO 2007/041052 описан 1,2-дигидро-2-оксо-6-трифторметилпиридин-3-карбоксамид в качестве промежуточного продукта в синтезе фармакологически активных спиропиперидинов. Применение соединений такого рода в качестве защитных средств в комбинации с определенными пестицидами еще не известно. В WO 2006/007981 описан способ обнаружения соединений, индуцирующих отражение патогенов растений, при этом рост экспрессии эндогенных растительных генов оценивается как признак для индукции. При этом 1,2-дигидро-2-оксо-6-трифторметилпиридин-3-карбоксамид упоминается среди группы из шести соединений, которые названы как защитные средства. Доказанная биологическими тестами на растениях активность как защитных средств для этих соединений до сих пор еще не известна и также не описана в WO 2006/007981 в достаточном объеме. В частности, величины экспрессии, которые получены с соединениями согласно WO 2006/007981 и которые отчасти находятся на гораздо более низком уровне, чем у там же названных коммерчески доступных защитных средств, позволяют ожидать, что эти соединения как защитные средства должны быть менее пригодны, если вообще пригодны для этой цели. При использовании защитных средств для защиты полезных растений от повреждений пестицидами оказалось, что известные защитные средства во многих случаях могут иметь недостатки. К ним относится то, что защитные средства снижают эффект воздействия пестицидов, в частности гербицидов, на вредные растения,защитные свойства не достаточны для полезных растений,в комбинациях с некоторыми гербицидами спектр полезных растений, в которых должна использоваться комбинация, защитное средство/гербицид, не достаточно велик,определенное защитное средство способно комбинироваться лишь с небольшим количеством гербицидов,применение защитных средств увеличивает используемые нормы расхода и количества препаративной формы и вследствие этого может вызвать определенные проблемы в применении. Исходя из вышеперечисленного, существует потребность в предоставлении альтернативных соединений, обладающих свойствами средств защиты культурных растений. Предметом изобретения является применение соединений формулы (I) или их солей в которой R1 означает (С 1-C4)-галоидалкил, предпочтительно остаток формулы CF2Cl, CF2H,CF2CF3, CF2CF2H, CF2CF2Cl, CFClCF3, CFHCF3, CF(CF3)2, CH(CF3)2, CF2CF2CF3 или C(CH3)2F и R2 означает водород или галоген, иR3 означает водород, (С 1-С 10)-алкил, (С 2-С 10)-алкенил или (С 2-С 10)-алкинил, причем каждый из трех названных последними остатков не имеет заместителей или имеет один или несколько заместителей из(C1-C4)-алкокси,алкокси]карбонил, R4 означает (С 1-С 10)-алкил, (С 2-С 10)-алкенил или (С 2-С 10)-алкинил,причем каждый из трех названных последними остатков возможно замещен одним или несколькими заместителями из группы, включающей галоген, гидрокси, циано, (C1-C4)-алкокси, (C1-C4)-галоидалкокси, (C1C4)-алкилтио,(C1-C4)-алкиламино,ди[(C1-C4)-алкил]амино,[(С 1-С 4)-алкокси]карбонил,[(C1-C4)галоидалкокси]карбонил,(С 3-С 6)-циклоалкил, который возможно замещен (C1-C4)-алкилом, фенил, который возможно замещен одним или несколькими заместителями из группы, включающей галоген, (C1-C4)-алкил, (C1-C4)галоидалкил, (C1-C4)-алкокси, (C1-C4)-галоидалкокси и (C1-C4)-алкилтио,3-9-членный гетероциклил с 1-3 гетероатомами в цикле из группы N, О и S, который возможно замещен одним или несколькими заместителями из группы, включающей галоген, (C1-C4)-алкил, (C1-C4)галоидалкил, (C1-C4)-алкокси, (C1-C4)-галоидалкокси, (C1-C4)-алкилтио и оксо,или (С 3-С 6)-циклоалкил, который с одной стороны цикла может быть сконденсирован с 4-6 членным насыщенным или ненасыщенным карбоциклом,причем названный последний остаток возможно замещен одним или несколькими заместителями из группы, включающей (C1-C4)-алкил, илиR4 означает водород или (C1-C4)-алкил, илиR3 и R4 вместе с непосредственно связанным с ними N-атомом означают 4-8-членный гетероцикл,который наряду с атомом азота может содержать в цикле до двух других гетероатомов, из группы, включающей N, О и S, и который может быть незамещенным или иметь один или несколько заместителей из группы, включающей галоген, циано, нитро, (C1-C4)-алкил, (C1-C4)-галоидалкил, (C1-C4)-алкокси, (C1-C4)галоидалкокси и (C1-C4)-алкилтио, илиR5 означает водород или (С 1-С 6)-алкил, при этом водород является предпочтительным, иR6, R7 независимо друг от друга означают водород или (C1-C4)-алкил, илиR6 и R7 вместе с непосредственно связанным с ними N-атомом образуют 5-7-членный, предпочтительно насыщенный гетероцикл, такой как, например, пиперидинил, пирролидинил или морфолинил,в качестве средства защиты полезных растений для снижения или предотвращения вредного воздействия агрохимикатов, предпочтительно пестицидов, особенно гербицидов, на полезные растения. В дальнейшем соединения формулы (I) и их соли в некоторых случаях будут также обозначаться кратко как используемые согласно изобретению соединения (I)или как соединения (I)согласно изобретению. Соединения формулы (I) включают также таутомеры, которые могут быть образованы за счет сдвига водорода и которые структурно формально не подпадают под формулу (I). При всем этом эти таутомеры также охватываются определениями соединений формулы (I) согласно изобретению. В частности,-2 020453 среди определений соединений формулы (I) согласно изобретению включены таутомерные структуры формулы (Ia) (2-гидроксипиридин-3-карбоксамиды) или их соли в которой R1, R2, R3 и R4 такие же, которые определены в формуле (I). Некоторые соединения согласно изобретению формулы (I) или их соли являются новыми и также представляют собой предмет изобретения. Предметом изобретения являются также средства защиты растений, которые содержат соединения формулы (I) или их соли. Средства защиты растений могут содержать дополнительно вспомогательные средства для составления препаративных форм. Предметом изобретения являются также средства защиты растений, которые содержат соединения формулы (I) или их соли в комбинации с другими агрохимикатами, преимущественно пестицидами, особенно гербицидами, и при необходимости вспомогательные средства для препаративных форм. Некоторые соединения формулы (I) уже описаны в качестве промежуточных продуктов при получении биологически активных веществ; см. уже упомянутое патентное сообщение GB-A-2305174 (соединения формулы (I), где R1 = CF3, CF2Cl или CF2H и R3 = R4 = Н). В уже упомянутом патенте ЕР-А 522392 среди прочих в качестве промежуточных продуктов синтеза сульфонилмочевин в общем виде описаны соединения (I). Активность соединений как защитных средств не описана. Предметом изобретения являются также соединения формулы (I) или их соли в которых R1 означает остаток (C1-C4)-галоидалкил, предпочтительно остаток формулы CF2Cl,CF2H, CF2CF3, CF2CF2H, CF2CF2Cl, CFClCF3, CFHCF3, CF(CF3)2, CH(CF3)2, CF2CF2CF3 или С(СН 3)2F, особенно предпочтительно остаток формулы CF2Cl, CF2H, CF2CF3, CF2CF2H, CF2CF2Cl, CF2CF2CF3 или С(СН 3)2F, далее наиболее предпочтительно CF2Cl, CF2H, CF2CF3, CF2CF2H, CF2CF2Cl или CF2CF2CF3, иR2 означает водород или галоген иR3 означает водород, (С 1-С 10)-алкил, (С 2-С 10)-алкенил или (С 2-С 10)-алкинил,причем каждый из трех названных последними остатков не имеет заместителей или имеет один или несколько заместителей из группы, включающей (C1-C4)-алкокси, (C1-C4)-галоидалкокси, (С 1-С 4)алкилтио, [(C1-C4)-алкокси]карбонил,R4 означает (С 1-С 10)-алкил, (С 2-С 10)-алкенил или (С 2-С 10)-алкинил,причем каждый из трех названных последними остатков не имеет заместителей или имеет один или несколько заместителей из группы, включающей галоген, гидрокси, циано, (C1-C4)-алкокси, (C1-C4)галоидалкокси, (C1-C4)-алкилтио, (C1-C4)-алкиламино, и [(C1-C4)-алкил]амино, [(C1-C4)-алкокси]карбонил и [(C1-C4)-галоидалкокси]карбонил,(С 3-С 6)-циклоалкил, который возможно замещен (C1-C4)-алкилом, фенил, который возможно замещен одним или несколькими заместителями из группы, включающей галоген, (C1-C4)-алкил, (C1-C4)галоидалкил, (C1-C4)-алкокси, (C1-C4)-галоидалкокси и (C1-C4)-алкилтио, и 3-9-членный гетероциклил с 1-3 гетероатомами в цикле из группы N, О и S, который возможно замещен одним или несколькими заместителями из группы, включающей галоген, (C1-C4)-алкил, (C1-C4)-галоидалкил, (C1-C4)-алкокси, (C1C4)-галоидалкокси, (C1-C4)-алкилтио и оксо, или (С 3-С 6)-циклоалкил, который с одной стороны цикла может быть сконденсирован с 4-6-членным насыщенным или ненасыщенным карбоциклом,причем названный последний остаток возможно замещен одним или несколькими заместителями из группы, включающей (C1-C4)-алкил, илиR4 означает водород или (C1-C4)-алкил, илиR3 и R4 вместе с непосредственно связанным с ними N-атомом означают 4-8-членный гетероцикл,который наряду с атомом азота может содержать в цикле до двух других гетероатомов, из группы, включающей N, О и S, и который может быть замещен один или несколькими заместителями из группы,включающей галоген, циано, нитро, (C1-C4)-алкил, (C1-C4)-галоидалкил, (C1-C4)-алкокси, (C1-C4)галоидалкокси и (C1-C4)-алкилтио, илиR5 означает водород или (С 1-С 6)-алкил, при этом водород является предпочтительным, иR6, R7 независимо друг от друга означают водород или (C1-C4)-алкил, преимущественно (C1-C2)алкил, или R6 и R7 вместе с непосредственно связанным с ними N-атомом образуют 5-7-членный, предпочтительно насыщенный гетероцикл, такой как, например, пиперидинил, пирролидинил или морфолинил. Соединения общей формулы (I) в зависимости от типа заместителей и их сочетания могут существовать в виде стереоизомеров. Возможные стереоизомеры, определяемые их специфическим объемом,такие как энантиомеры, диастереомеры, Z- и Е-изомеры, все охвачены формулой (I). Если, например, имеются одна или несколько алкенильных групп, то могут появиться диастереомеры (Z- и Е-изомеры). Если, например, имеются один или несколько асимметрических атомов углерода, то могут появиться энантиомеры и диастереомеры. Стереоизомеры можно выделить из смесей, образующихся при получении, с помощью обычных методов разделения, например, с помощью хроматографических методов разделения. Стереоизомеры могут быть получены также за счет использования стереоселективных реакций с применением оптически активных исходных и/или вспомогательных веществ. Изобретение относится также ко всем стереоизомерам, которые охватываются общей формулой (I), но не указаны при помощи их специфических пространственных формул, и к их смесям. Возможности комбинирования различных заместителей в общей формуле (I) следует понимать так,что должны соблюдаться общие принципы строения химического соединения, т.е. формула (I) не охватывает соединения, о которых специалисту известно, что они химически не возможны. Обозначения, использованные до этого и далее ниже, являются общепринятыми у специалистов и имеют, в частности, значения, разъясненные далее. Выражение(C1-C4)-алкил означает краткое написание нециклического алкила с числом углеродных атомов от 1 до 4, соответствующих области данных для С-атомов, т.е. охватывает остатки метил,этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метилпропил или трет.-бутил. Общие алкильные остатки с большим указанным диапазоном С-атомов, например, (С 1-С 6)-алкил, охватывают соответственно неразветвленные и разветвленные алкильные остатки с большим числом атомов углерода, т.е. в соответствии с примером также алкильные остатки с числом атомов углерода 5 и 6. Если не указано ничего специально, для углеводородных остатков, таких как алкильные, алкенильные и алкинильные остатки, а также в сложных остатках, предпочтительными являются низшие углеродные скелеты, например, с числом Сатомов от 1 до 6 или для ненасыщенных групп с числом С-атомов от 2 до 6. Алкильные остатки, также и в сложных значениях, таких как алкокси, галоидалкил и т.п., означают, например, метил, этил, н- или изо-пропил, н-, изо-трет.- или 2-бутил, пентилы, гексилы, такие как н-гексил, изо-гексил и 1,3 диметилбутил, гептилы, такие как н-гептил, 1-метилгексил и 1,4-диметилпентил; алкенильные и алкинильные остатки имеют значения остатков, соответствующих возможным ненасыщенным алкильным остаткам; алкенил означает, например, винил, аллил, 1-метил-2-пропенил, 2-метил-2-пропенил, 2 бутенил, пентенил, 2-метилпентенил или гексенил, предпочтительно аллил, 1-метилпроп-2-ен-1-ил, 2 метил-проп-2-ен-1-ил, бут-2-ен-1-ил, бут-3-ен-1-ил, 1-метил-бут-3-ен-ил или 1-метил-бут-2-ен-1 ил. (С 2 С 6)-алкинил означает, например, этинил, пропаргил, 1-метил-2-пропинил, 2-метил-2-пропинил, 2 бутинил, 2-пентинил или 2-гексинил, предпочтительно пропаргил, бут-2-ин-1-ил, бут-3-ин-1-ил или 2 метил-бут-3-ин-1-ил. Циклоалкил означает карбоциклическую насыщенную циклическую систему предпочтительно с 3 - 6 атомами углерода, например, циклопропил, циклобутил, циклопентил или циклогексил. В случае замещенного циклоалкила охватываются циклические системы с заместителями, причем включены также заместители с двойной связью у циклоалкильного остатка, например, алкилиденовая группа, такая как метилиден. В случае замещенного циклоалкила охватываются также полициклические алифатические системы, такие как, например, бицикло[1.1.0]бутан-1-ил, бицикло[1.1.0]бутан-2-ил, бицикло[2.1.0]пентан-1-ил, бицикло[2.1.0]пентан-2 ил, бицикло[2.1.0]пентан-5-ил, адамантан-1-ил и адамантан-2-ил. Обозначение галоген означает, например, фтор, хлор, бром или иод. Галоидалкил, галоидалкенил и галоидалкинил означают частично или полностью замещенный одинаковыми или различными атомами галогенов, предпочтительно из группы фтор, хлор и бром, особенно из группы фтор и хлор, алкил, алкенил или алкинил, например, моногалоидалкил (= моногалогеналкил), такой как CH2CH2Cl, CH2CH2F,CH2ClCH3, CH2FCH3, CH2Cl, CH2F; пергалоидалкил, такой как CCl3, или CF3, или CF3CF2; полигалоидалкил, такой как CHF2, CH2F, CH2FCHCl, CHCl2, CF2CF2H, CH2CF3, CH2ClCH3, CH2FCH3; галоидалкокси представляет собой, например, OCF3, OCHF2, OCH2F, CF3CF2O, OCH2CF3 и OCH2CH2Cl; аналогичное действительно для галоидалкенила и других замещенных галоидами остатков. Если основная структура имеет один или несколько заместителей из перечисленных остатков (= групп) или производных определенных групп остатков, то это соответственно включает одновременное замещение несколькими одинаковыми и/или различными по структуре заместителями. Замещенные остатки, такие как замещенный алкильный, алкенильный, алкинильный, циклоалкильный, циклоалкенильный, фенильный, бензильный, гетероциклильный и гетероарильный остаток, означают, например, замещенный остаток, производный от незамещенной основной структуры, причем заместители, например, один или несколько, предпочтительно 1, 2 или 3 остатка из группы, включающей галоген, алкокси, алкилтио, гидрокси, амино, нитро, карбокси, циано, азидо, алкоксикарбонил, алкилкарбонил, формил, карбамоил, моно- и диалкиламинокарбонил, замещенный амино, такой как ациламино,моно- и диалкиламино, триалкилсилил и при необходимости замещенный циклоалкил, при необходимости замещенный фенил, при необходимости замещенный гетероциклил, причем каждая из названных последними циклических групп также может быть связана через гетероатом или двухвалентную функциональную группу как у упомянутых алкильных остатков, и алкилсульфинил, алкилсульфонил и, в случае циклических остатков (=циклическая основная структура) означают также алкил, галоидалкил, алкилтио-алкил, алкокси-алкил, при необходимости замещенный моно- и диалкил-аминоалкил и гидроксиалкил; понятие замещенные остатки, такие как замещенный алкил и т.п., включают в качестве заместителей дополнительно к названным насыщенным остаткам, содержащим углеводороды, соответствующие ненасыщенные алифатические или ароматические остатки, такие как при необходимости замещенные алкенил, алкинил, алкенилокси, алкинилокси, фенил, фенокси и т.п. В случае замещенных циклических остатков с алифатическими частями в цикле охватываются также циклические системы с такими заместителями, которые связаны с кольцом с помощью двойной связи, например, с помощью алкилиденовой группы, такой как метилиден или этилиден, или оксогруппы, иминогруппы или замещенной иминогруппы. Названные в качестве примера заместители (заместители первого порядка) могут, если они содержат углеводородные части, при необходимости иметь в них заместители (заместители второго порядка), например, быть замещенными одним из заместителей, которые определены для заместителей первого порядка. Возможны соответственно заместители последующих порядков. Предпочтительно понятием замещенный остаток охватывается только один или два порядка заместителей. Предпочтительными заместителями для порядков заместителей являются, например, амино, гидрокси, галоген, нитро, циано, меркапто, карбокси, карбонамид, SF5, аминосульфонил, алкил, циклоалкил,алкенил, циклоалкенил, алкинил, моноалкил-амино, диалкил-амино, N-алканоил-амино, алкокси, алкенилокси, алкинилокси, циклоалкокси, циклоалкенилокси, алкокси-карбонил, алкенилокси-карбонил, алкинилокси-карбонил, арилоксикарбонил, алканоил, алкенил-карбонил, алкинил-карбонил, арилкарбонил, алкилтио, циклоалкилтио, алкенилтио, циклоалкенилтио, алкинилтио, алкилсульфинил, алкилсульфонил, моноалкил-аминосульфонил, диалкил-аминосульфонил, N-алкил-аминокарбонил, N,Nдиалкил-аминокарбонил, N-алканоил-амино-карбонил, N-алканоил-N-алкил-аминокарбонил, арил, арилокси, бензил, бензилокси, бензилтио, арилтио, ариламино, бензиламино, гетероциклил и триалкилсилил. В случае остатков с атомами углерода предпочтительными являются остатки с 1-6 С-атомами, особенно предпочтительны с 1-4 С-атомами, наиболее предпочтительны с 1 или 2 С-атомами. Предпочтительными являются, как правило, заместители, выбранные из группы, включающей галоген, например,фтор и хлор, (C1-С 4)-алкил, предпочтительно метил или этил, (С 1-С 4)-галоидалкил, предпочтительно трифторметил, (C1-C4)-алкокси, предпочтительно метокси или этокси, (C1-C4)-галоидалкокси, нитро и циано. Наиболее предпочтительными при этом являются заместители метил, метокси, фтор и хлор. Замещенный амино, такой как моно- или дизамещенный амино, означает остаток из группы замещенных амино-остатков, которые имеют у атома азота, например, один или два одинаковых или различных заместителя из группы, включающей алкил, алкокси, ацил и арил; предпочтительно моно- и диалкил-амино, моно- и диарил-амино, ациламино, N-алкил-N-ариламино, N-алкил-N-ациламино, а также насыщенные N-гетероциклы; при этом предпочтительны алкильные остатки с числом атомов углерода от 1 до 4; арил при этом означает преимущественно фенил или замещенный фенил; для ацила справедливо определение, названное далее, предпочтительно (С 1-С 4)-алканоил. Аналогичное справедливо для замещенных гидроксиламино или гидразино. Замещенный амино включает также четвертичные соединения аммония (соли) с четырьмя органическими заместителями у атома азота. При необходимости замещенный фенил представляет собой предпочтительно фенил, который не имеет заместителей или имеет один или несколько, предпочтительно до трех, одинаковых или разных заместителя, выбранных из группы, включающей галоген, (C1-C4)-алкил, (C1-C4)-алкокси, (C1-C4)галоидалкил, (C1-C4)- и галоидалкокси, например, о-, м- и п-толил, диметилфенилы, 2-, 3- и 4-хлорфенил,2-, 3-и 4-фторфенил, 2-, 3- и 4-трифторметил- и -трихлорметилфенил, 2,4-, 3,5-, 2,5- и 2,3-дихлорфенил,о-, м- и п-метоксифенил. При необходимости замещенный циклоалкил представляет собой предпочтительно циклоалкил, который не имеет заместителей или имеет один или несколько, предпочтительно до трех, одинаковых или разных заместителя, выбранных из группы, включающей (C1-C4)-алкил, особенно один или два остатка(C1-C4)-алкил. При необходимости замещенный гетероциклил представляет собой предпочтительно гетероциклил,который не имеет заместителей или имеет один или несколько, предпочтительно до трех, одинаковых или разных заместителя, выбранных из группы, включающей галоген, (C1-C4)-алкил, (C1-C4)-алкокси,(C1-C4)-галоидалкил, (C1-C4)-галоидалкокси и оксо, в частности, имеет один или несколько заместителей,выбранных из группы, включающей галоген, (C1-C4)-алкил, (C1-C4)-алкокси, (C1-C4)-галоидалкил и оксо,наиболее предпочтительно имеет один иди два заместителя (C1-С 4)-алкил. Если вообще остаток определен как водород, то это означает атом водорода. С помощью положение ил обозначено место связи в остатке. Соответственно общие определения означают(C1-С 6)-алкил метильный, этильный, пропильный, изопропильный, 1-бутильный, 2-бутильный, 2 метилпропильный и трет-бутильный остаток; следовательно, (C1-C10)-алкил охватывает вышеупомянутые алкильные остатки, а также изомерные пентильные остатки, такие как п-пентил, 1,1-диметилпропил или 2-метилбутил, изомерные гексильные, гептильные, октильные, нонильные или децильные остатки.(С 2-С 4)-алкинил означает, например, этинил, пропаргил или 2-бутин-1-ил,(С 3-С 10)-алкинил означает, например, пропаргил, 2-бутин-1-ил, 2-пентин-1-ил, 2-метилпентин-3 ил, гексинил, гептинил, октинил, нонинил или децинил. Если углеродная цепь алкильного остатка неоднократно прерывается атомами кислорода, то это означает, что два атома кислорода не должны находиться в непосредственном соседстве.(C3-C6)-циклоалкил означает остаток циклопропил, циклобутил, циклопентил или циклогексил,(C3-C10)-циклоалкил означает моноциклический алкильный остаток, такой как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил или циклодецил, а для бициклических алкильных остатков такие остатки, как норборнил или бицикло[2.2.2]октил, или для конденсированной системы, такие как декагидронафтил.(C4-C10)-циклоалкенил означает моноциклический циклоалкиленовый остаток, такой как циклобутенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил или циклодеценил, для бициклических алкильных остатков такие остатки, как норборненил или бицикло[2.2.2]октенил, или для конденсированных систем такие остатки, как тетра-, гекса- или октагидронафтил.(C1-C4)-алкокси и (C1-C10)-алкокси представляют собой алкоксигруппы, углеводородные остатки которых имеют значения, указанные для выражений (C1-C4)-алкил и (C1-C4)-алкил. Прежде всего, исходя из более высокого защитного воздействия на культурные и полезные растения (эффект защитного средства), лучшей избирательности и/или лучшей доступности при получении,особый интерес представляет собой применение согласно данному изобретению соединений названной формулы (I) и их солей, в которых отдельные остатки имеют уже названные значения или значения, которые будут названы далее, или особенно такие, в которых встречаются комбинации одного или нескольких уже названных значений со значениями, которые будут названы далее. Предпочтительно, если в рамках названных выше общих определений охватывается формулой (I),R1 означает остаток (C1-C4)-галоидалкил, предпочтительно CF3, CF2Cl, CF2H, CF2CF3, CF2CF2H,CF2CF2Cl, C(CH3)2F или CF2CF2CF3, более предпочтительно CF3, CF2Cl, CF2H, CF2CF2CF3 или CF2CF3,особенно предпочтительно CF3, CF2Cl, CF2CF2CF3 или CF2CF3, наиболее предпочтительно CF3, CF2Cl илиCF2CF3. Предпочтительно R2 означает водород или галоген. Галоген при этом означает преимущественно фтор, хлор, бром или иод, предпочтительно хлор, бром или иод, особенно предпочтительно хлор или бром. Предпочтительно R3 означает водород, (C1-C4)-алкил, (С 2-С 10)-алкенил или (С 2-С 10)-алкинил,причем каждый из названных последними 3 остатков не имеет заместителей или имеет один или несколько заместителей из группы, включающей (C1-C4)-алкокси, (C1-C4)-галоидалкокси, (C1-С 4)алкилтио, [(C1-C4)-алкокси]карбонил, и R4 означает (C1-C10)-алкил, (С 2-С 10)-алкенил или (С 2-С 10)алкинил,причем каждый из названных последними 3 остатков не имеет заместителей или имеет один или несколько заместителей из группы, включающей галоген, гидрокси, циано, (C1-C4)-алкокси, (C1-C4)галоидалкокси,(C1-C4)-алкилтио,(C1-C4)-алкиламино,ди[(C1-C4)-алкил]амино,[(C1-C4)алкокси]карбонил, [(C1-C4)-галоидалкокси]карбонил,(С 3-С 6)-циклоалкил, который не имеет заместителей или имеет один или несколько заместителей из группы, включающей (С 1-С 4)-алкил, фенил, который не имеет заместителей или имеет один или несколько заместителей из группы, включающей галоген, (C1-C4)-алкил, (C1-C4)-галоидалкил, (C1-C4)-алкокси,(C1-C4)-галоидалкокси и (C1-C4)-алкилтио,3-9-членный гетероциклил с 1-3 гетероатомами в цикле из группы N, О и S, который не имеет заместителей или имеет один или несколько заместителей из группы, включающей галоген, (C1-C4)-алкил,(C1-C4)-галоидалкил, (C1-C4)-алкокси, (C1-C4)-галоидалкокси, (C1-C4)-алкилтио и оксо, предпочтительно не имеющий заместителей или имеющий один или несколько заместителей из группы, включающей (C1C4)-алкил, (C1-C4)-галоидалкил, (C1-C4)-алкокси,Далее предпочтительноR3 означает водород, (C1-C10)-алкил, (С 2-С 10)-алкенил или (С 2-С 10)-алкинил,причем каждый из названных последними 3 остатков не имеет заместителей или имеет один или несколько заместителей из группы, включающей (C1-C4)-алкокси, (C1-C4)-галоидалкокси, (C1-C4)алкилтио, [(C1-C4)-алкокси]карбонил, иR4 означает, как уже определено выше для R4 или предпочтительно, (C1-C10)-алкил, (С 2-С 10)алкенил или (С 2-С 10)-алкинил,причем каждый из названных последними 3 остатков не имеет заместителей или имеет один или несколько заместителей из группы, включающей галоген, гидрокси, циано, (C1-C4)-алкокси, (C1-C4)галоидалкокси, (C1-C4)-алкилтио, [(C1-C4)-алкокси]карбонил, [(C1-C4)-галоидалкокси]карбонил, фенил,который не имеет заместителей или имеет один или несколько заместителей из группы, включающей галоген, (C1-C4)-алкил, (C1-C4)-галоидалкил, (C1-C4)-алкокси, (C1-C4)-галоидалкокси и (C1-C4)-алкилтио, и или (С 3-С 6)-циклоалкил, который с одной стороны цикла сконденсирован с 4-6-членным насыщенным или ненасыщенным карбоциклом,причем каждый из названных последними 2 остатков является незамещенным или имеет один или несколько заместителей из группы, включающей (C1-C4)-алкил. Далее предпочтительноR3 означает водород, (C1-C10)-алкил, (С 2-С 10)-алкенил или (С 2-С 10)-алкинил,причем каждый из названных последними 3 остатков является незамещенным или имеет один или несколько заместителей из группы, включающей (C1-C4)-алкокси, (C1-C4)-галоидалкокси, (C1-C4)алкилтио и [(C1-C4)-алкокси]карбонил,предпочтительно водород, (C1-C6)-алкил, (С 2-С 6)-алкенил или (С 2-С 6)-алкинил, и R4 означает, как уже определено выше для R4 или предпочтительно, (C1-C10)-алкил, (С 2-С 10)-алкенил или (С 2-С 10)алкинил,причем каждый из названных последними 3 остатков не имеет заместителей или имеет один или несколько заместителей из группы, включающей (C1-C4)-алкокси, (C1-C4)-галоидалкокси, (C1-C4)алкилтио и [(C1-C4)-алкокси]карбонил,предпочтительно (C1-C6)-алкил, (С 2-С 6)-алкенил или (С 2-С 6)-алкинил,причем каждый из названных последними 3 остатков не имеет заместителей или имеет один или несколько заместителей из группы, включающей (C1-C4)-алкокси, (C1-C4)-галоидалкокси, (C1-C4)алкилтио и [(C1-C4)-алкокси]карбонил. Особенно предпочтительным является применение согласно изобретению с соединениями формулыR1 означает CF2CF2CF3 или CF2CF3, предпочтительно CF2CF3 и R2 означает водород или галоген,предпочтительно водород, иR3 водород, (C1-C10)-алкил, (С 2-С 10)-алкенил или (С 2-С 10)-алкинил,причем любой из названных последними 3 остатков является незамещенным или имеет один или несколько заместителей из группы, включающей (C1-С 4)-алкокси, (C1-C4)-галоидалкокси, (C1-C4)алкилтио и (C1-C4)-алкоксикарбонил,предпочтительно водород, (C1-C6)-алкил, (C2-C6)-алкенил или (C2-C6)-алкинил, причем любой из названных последними 3 остатков является незамещенным или имеет один или несколько заместителей из группы (C1-C4)-алкокси, (C1-C4)-галоидалкокси, (C1-C4)-алкилтио и (C1-C4)-алкоксикарбонил,наиболее предпочтительно водород или (C1-C4)-алкил, иR4 означает (C1-C10)-алкил, (С 3-С 10)-алкенил или (С 3-С 10)-алкинил,причем любой из названных последними 3 остатков является незамещенным или имеет один или несколько заместителей из группы, включающей галоген, гидрокси, циано, (C1-C4)-алкокси, (C1-C4)галоидалкокси,(C1-C4)-алкилтио,(C1-C4)-алкиламино,ди[(C1-C4)-алкил]амино,[(C1-C4)алкокси]карбонил, [(C1-C4)-галоидалкокси]карбонил, фенил, который является незамещенным или имеет один или несколько заместителей из группы, включающей галоген, (C1-C4)-алкил, (C1-C4)-галоидалкил,(C1-C4)-алкокси, (C1-C4)-галоидалкокси и (C1-C4)-алкилтио, и 3-9-членный гетероциклил с 1-3 гетероатомами в цикле из группы N, О и S, который является незамещенным или имеет один или несколько заместителей из группы, включающей галоген, (C1-C4)-алкил,(C1-C4)-галоидалкил, (C1-C4)-алкокси, (C1-C4)-галоидалкокси и (C1-C4)-алкилтио и оксо,или (С 3-С 6)-циклоалкил, который с одной стороны цикла сконденсирован с 4-6-членным насыщенным или ненасыщенным карбоциклом,причем каждый из названных последними 2 остатков является незамещенным или имеет один или несколько заместителей из группы, включающей (C1-C4)-алкил, предпочтительно (С 1-С 10)-алкил, (С 2 С 10)-алкенил или (С 2-С 10)-алкинил,причем любой из названных последними 3 остатков является незамещенным или имеет один или несколько заместителей из группы, включающей (C1-C4)-алкокси, (C1-C4)-галоидалкокси, (C1-C4)алкилтио и (C1-C4)-алкоксикарбонил,особенно предпочтительно (С 1-С 6)-алкил, (С 2-С 6)-алкенил или (С 2-С 6)-алкинил, причем любой из названных последними 3 остатков является незамещенным или имеет один или несколько заместителей из группы,включающей (C1-C4)-алкокси, (C1-C4)-галоидалкокси, (C1-C4)-алкилтио и (C1-C4)-алкоксикарбонил,илиR3 и R4 вместе с атомом азота, с которым они непосредственно связаны, означают 4-8-членный ге-7 020453 тероцикл, предпочтительно 5- или 6-членный гетероцикл, который наряду с N-атомом может содержать также и другие гетероатомы, предпочтительно до двух других гетероатомов из группы N, О и S и который не содержит заместителей или имеет один или несколько заместителей из группы, включающей галоген, циано, нитро, (C1-C4)-алкил, (C1-C4)-галоидалкил, (C1-C4)-алкокси, (C1-C4)-галоидалкокси и (C1C4)-алкилтио, илиR3 и R4 вместе с атомом азота, с которым они непосредственно связаны, означают группу -N=CR56 7R5 означает водород или (C1-C4)-алкил, при этом водород предпочтителен, иR6, R7 независимо друг от друга означают водород или (C1-C4)-алкил, предпочтительно (С 1-С 2)алкил или R6 и R7 вместе с атомом азота, с которым они непосредственно связаны, образуют 5- или 6 членный, предпочтительно насыщенный гетероцикл, такой как, например, пиперидинил, пирролидинил или морфолинил. Особенно предпочтительным является также применение согласно изобретению с соединениями формулы (I) или их солями, гдеR4 означает водород. Также особенно предпочтительным является применение согласно изобретению с соединениями формулы (I) или их солями, гдеR3 означает водород или (C1-C4)-алкил иR4 означает водород. Особенно предпочтительным является также применение согласно изобретению с соединениями формулы (I) или их солями, где остатки соответствуют остаткам R1, R2, R3 и R4, которые указаны в примерах в таблицах или включают их. Особенно предпочтительным является также применение согласно изобретению с новыми соединениями формулы (I) или их солями, где остатки R1, R2, R3 и R4 имеют значения, названные для предпочтительных применений. Соединения общей формулы (I) могут быть получены, например, следующим образом:(а) карбоновая кислота общей формулы (II) в которой R1 и R2 определены, как в получающемся соединении формулы (I), взаимодействует с амином формулы (III) или его солью, в которой R3 и R4 определены, как в получающемся соединении, при необходимости в присутствии активирующего карбоновую кислоту реагента, например, N,N-карбонилдиимидазола (CDI), или водоотнимающего средства, например, дициклогексилкарбодиимида (DCC) с образованием соединения формулы (I) или(b) сложный эфир карбоновой кислоты общей формулы (IV) в которой R1 и R2 определены, как в получающемся соединении формулы (I), и алкил означает алкильный остаток, например, метил или этил, взаимодействует с амином формулы (III) или его солью, в которой R3 и R4 определены, как в получающемся соединении, с образованием соединения фор-8 020453(с) галоидангидрид или ангидрид карбоновой кислоты общей формулы (V) в которой R1 и R2 определены, как в получающемся соединении формулы (I), а Гал означает атом галогена, например, хлор, или остаток ацилокси, взаимодействует с амином формулы (III) или его солью, в которой R3 и R4 определены, как в получающемся соединении формулы (I), с образованием соединения формулы (I),(d) в случае, когда R3 и R4 в получающемся соединении формулы (I) означают соответственно водород, соединение формулы (VI) в которой R1 определен, как в получающемся соединении формулы (I), и алкил означает алкильный остаток, например, метил или этил, взаимодействует с диамидом малоновой кислоты с образованием соединения формулы (I). Образование амида по варианту (а) может осуществляться, например, в инертных органических растворителях в диапазоне температур между 0 и 150 С, преимущественно между 0 и 50 С. В качестве органических растворителей пригодны, например, полярные протонные и апротонные растворители, такие как простые эфиры, например, диэтиловый эфир, тетрагидрофуран и диоксан, или нитрилы, такие как ацетонитрид, или амиды, такие как диметилформамид. Образование амида по варианту (b) может осуществляться, например, в инертных органических растворителях в диапазоне температур между 0 и 150 С, преимущественно между 50 и 100 С. В качестве органических растворителей пригодны, например, полярные протонные и апротонные растворители, такие как простые эфиры, например, тетрагидрофуран и диоксан, или нитрилы, такие как ацетонитрид, или амиды, такие как диметилформамид. Однако предпочтительным является образование амида по варианту(b) при повышенных температурах путем взаимодействия реакционных партнеров без растворителя. Образование амида по варианту (с) может осуществляться, например, в присутствии связывающего кислоту средства в инертном органическом растворителе в диапазоне температур между 0 и 150 С, преимущественно между 0 и 50 С. В качестве органических растворителей пригодны, например, полярные протонные и апротонные растворители, такие как простые эфиры, например, диэтиловый эфир, тетрагидрофуран и диоксан, или нитрилы, такие как ацетонитрид, или амиды, такие как диметилформамид. Связывающими кислоту средствами являются, например, карбонаты щелочных и щелочно-земельных металлов, такие как карбонаты натрия, калия или кальция, гидроксиды щелочных и щелочно-земельных металлов, такие как гидроксиды натрия, калия или кальция, или гидриды или амиды щелочных металлов,такие как гидриды натрия или калия, или амиды натрия или калия, или также органические основания,такие как триэтиламин, пиридин, диметиламинопиридин, DBU (1,8-диазабицикло[5.4.0]ундек-7-ен), DBN(1,5-диазабицикло[4.3.0]нон-5-ен) и 1,4-диазабицикло[2.2.2]октан. Образование амида по варианту (d) может осуществляться по аналогии со способами, описанными в ЕР 522392 и Helv. Chim. Acta 1988, 71, 596-601 и GB 2305174. Диамид малоновой кислоты, как правило, в органическом безводном полярном протонном или апротонном растворителе, например, в спирте,может превращаться в реакционно-способную соль с помощью сильных оснований, таких как щелочной металл, гидрид щелочного металла или алкоголят щелочного металла, и затем взаимодействовать с соединением формулы (VI). Реакция с соединением формулы (VI), как правило, может происходить в диапазоне температур между 0 С и температурой кипения растворителя (в зависимости от растворителя до 150 С). Соединения общих формул (II), (III), (IV) и (V) либо являются коммерчески доступными, либо могут быть синтезированы по известным специалисту методикам или по аналогии с ними (например, Helv.Chim. Acta 1988, 71, 596; ЕР 502740; ЕР 522392). Соединения общих формул (II), (III), (IV) и (V) являются либо коммерчески доступными, либо могут быть получены известными специалисту методами или по аналогии с ними (например, Helv. Chim. могут быть получены взаимодействием простых алкоксивиниловых эфиров формулы (VI) со смешанными амидами-сложными эфирами малоновой кислоты формулы (VII). Соединения формулы (VI) являются либо коммерчески доступными, либо могут быть получены известными методами (например, Synthesis 2000, 738-742; J. Fluor. Chem., 107, 2001, 285-300; Organometallics 15, 1996, 5374-5379). Соединения формулы (IV), в которых R2 означает атом галогена, можно получить обычным галогенированием соединений формулы (IVa). В качестве галогенирующего агента для пиридина, например,используют хлор (J. Org. Chem. 23, 1958, 1614), бром (Synth. Commun. 19, 1989, 553-560; US P 2532055),иод (Tetrahedron Lett. 45, 2004, 6633-6636), гипохлорит натрия (J. Org. Chem. 49, 1984, 4784-4786; J. Med.Chem. 36, 1993, 2676-2688, US P 4960896), гипобромит натрия (J. Med. Chem. 32, 1989, 2178-2199), тионилхлорид (Organic Letters, 6, 2004, 3-5), N-хлорсукцинимид (J. Med. Chem. 46, 2003, 702-715), Nбромсукцинимид (Chem. Pharm. Bull. 48, 2000, 1847-1853), N-иодсукцинимид (J. Med. Chem. 36, 1993,2676-2788). Далее, соединения формулы (IV) могут быть получены из соединений формулы (IVa) последовательно путем нитрования (например, J. Med. Chem. 36, 1993, 2676-2688; J. Heterocycl. Chem. 33, 1996,287-294), восстановления (например, J. Med. Chem. 33, 1990, 1859-1865), диазотирования и последующего преобразования соли диазония с помощью реакции Зандмейера или реакции Шимана. Те соединения формулы (I), где R3 и R4 вместе атомом азота, с которым они непосредственно связаны, означают группу -N=CR5-NR6R7, могут быть получены следующим образом: соединение формулы(I), где R3 и R4 означают водород, взаимодействует с соединением формулы (VIII), где R5, R6 и R7 имеют названные выше значения, по известным методикам (см., например, Synthesis 1980, 119-121; J. Med. Chem., 33, 1990, 20522059). Предметом изобретения является также способ защиты культурных или технических растений от фитотоксического воздействия агрохимикатов, таких как пестициды, или в особенности гербициды, которое вызывает повреждения культурных или технических растений, отличающийся тем, что в качестве защитных средств применяют соединения формулы (I) или их соли, на растения, части растений или их семена (или посевной материал) наносят предпочтительно эффективные количества соединений формулы (I). Соединения (I) (= защитные средства), применяемые вместе с биологически активными веществами(пестицидами), могут применяться для избирательной борьбы с вредными организмами в целом ряде культурных растений, например, в экономически значимых культурах, таких как зерновые (пшеница,ячмень, тритикале, рожь, рис, кукуруза, просо), сахарная свкла, сахарный тростник, рапс, хлопчатник,подсолнечник, горох, фасоль и соя. Наибольший интерес представляет собой при этом их применение в однодольных культурах, таких как зерновые (пшеница, ячмень, рожь, тритикале, сорго), включая кукурузу и рис, и однодольных овощных культурах, а также в двудольных культурах, таких как, например,соя, рапс, хлопчатник, виноград, овощные культуры, плодовые культуры и декоративные растения. Комбинации гербицид-защитное средство с защитными средствами (I) также пригодны для борьбы с вредными растениями на клумбах и полях с техническими и декоративными растениями, например, на лужайках с полезными растениями и декоративными травами, особенно с плевелом, мятликом и бермудской травой. В случае технических культур и культурных растений, в которых могут применяться комбинации гербицид-защитное средство с защитными средствами (I), представляют интерес также полностью или частично устойчивые к некоторым пестицидам мутантные культуры или полностью или частично устойчивые трансгенные культуры, например, сорта кукурузы, которые резистентны к глуфозинату или глифозату, или сорта сои, которые резистентны к гербициду имидазолинону. Наибольшее преимущество используемых защитных средств нового типа состоит в их эффективном воздействии в культурах, кото- 10020453 рые обычно не достаточно устойчивы к предлагаемым для использования пестицидам. Соединения согласно изобретению формулы (I) могут применяться вместе с пестицидами одновременно или вноситься в любой последовательности с биологически активными веществами и тогда они в состоянии уменьшить или полностью снять вредное побочное воздействие этих биологически активных веществ на культурные растения, не снижая существенно эффективности этих биологически активных веществ по отношению к нежелательным вредным организмам. При этом они также могут существенно уменьшить или полностью исключить повреждения, которые возникают вследствие применения нескольких пестицидов, например, нескольких гербицидов или гербицидов в комбинации с инсектицидами или фунгицидами. Таким образом, может быть значительно расширена область использования обычных пестицидов. Для случая, когда средства согласно данному изобретению содержат пестициды, эти средства после соответствующего разбавления наносятся либо непосредственно на посевные площади, на уже проросшие вредные и/или полезные растения или на уже появившиеся всходы вредных и/или полезных растений. Для случая, когда средства согласно данному изобретению не содержат пестициды, эти средства можно применять так называемым способом смесей в емкостях - т.е. непосредственно перед нанесением на обрабатываемые поверхности пользователем осуществляется смешивание и разбавление отдельно приготовленных продуктов (= средство защиты растений и пестицид) - или по времени перед применением пестицида, или по времени после применения пестицида, или для предварительной обработки посевного материала, т.е., например, для протравливания посевного материала полезных растений. Предпочтительным является близкое по времени применение защитного средства и пестицида, особенно если защитное средство наносят на растения после гербицида. Полезные свойства соединений (I) согласно данному изобретению наблюдаются, когда их применяют вместе с пестицидами до появления всходов или после появления всходов, например, при одновременном внесении в виде смеси в емкости или в виде совместных препаративных форм или при раздельном одновременном внесении или использовании друг за другом (раздельное нанесение). Можно также повторять обработку несколько раз. Иногда может иметь смысл комбинировать обработку до появления всходов с обработкой после появления всходов. Чаще всего предлагается применение в виде обработки ими полезных и культурных растений после появления всходов с одновременной или более поздней обработкой пестицидом. Подходит также применение соединений (I) согласно данному изобретению для протравливания семян, обработкой (обмакиванием) проростков растений (например, риса) или обработкой другого материала для размножения (например, клубней картофеля). Часто при применении соединений (I) согласно данному изобретению в комбинации с гербицидами наряду с защитным действием наблюдается также усиление воздействия гербицида на вредные растения. Далее, во многих случаях улучшается рост полезных и культурных растений и может увеличиваться урожай. Средства согласно данному изобретению могут содержать один пестицид или несколько пестицидов. В качестве пестицидов учитываются, например, гербициды, инсектициды, фунгициды, акарициды и нематициды, которые соответственно при использовании только их одних вызывали бы фитотоксическое повреждение культурных растений или для которых было бы вероятным причинение вреда. Особый интерес представляют соответствующие биологически активные вещества с пестицидным действием из группы гербициды, инсектициды, акарициды, нематициды и фунгициды, особенно гербициды. Массовое соотношение защитного средства и пестицида может варьироваться в широком диапазоне и, как правило, лежит в диапазоне от 1:100 до 100:1, предпочтительно от 1:20 до 20:1, наиболее предпочтительно от 1:10 до 10:1. Оптимальное массовое отношение защитного средства к пестициду, как правило, зависит как от соответствующего используемого защитного средства и соответствующего пестицида,так и от вида полезных и культурных растений, подлежащих защите. Необходимые нормы расхода защитного средства могут варьироваться в широких границах в зависимости от используемого пестицида и вида полезных растений, подлежащих защите, и, как правило, лежат в диапазоне от 0,001 до 10 кг, предпочтительно 0,01 до 1 кг, наиболее предпочтительно от 0,05 до 0,5 кг защитного средства на гектар. Необходимые для успешной обработки количества и массовые соотношения могут быть определены с помощью простых предварительных опытов. В случае протравливания семян используется, например, от 0,005 до 20 г защитного средства на килограмм посевного материала, предпочтительно от 0,01 до 10 г защитного средства на килограмм посевного материала, наиболее предпочтительно от 0,05 до 5 г защитного средства на килограмм посевного материала. Если при обработке посевного материала пользуются растворами защитных средств и посевной материал или саженцы смачиваются растворами, то подходящая концентрация, как правило, лежит в диапазоне от 1 до 10000 ppm, предпочтительно от 100 до 1000 ppm в расчете на мас. Необходимые для надлежащей обработки количества и массовые соотношения могут быть определены путем простых предварительных опытов. Защитные средства могут обычным образом входить в отдельную препаративную форму или в препаративную форму вместе с пестицидами. Поэтому предметом изобретения является также средство за- 11020453 щиты полезных и культурных растений. Предпочтительным является совместное применение защитного средства и пестицида, особенно защитного средства и гербицида в виде готовой препаративной формы или применение их методом смесей в емкостях. Также предпочтительным является применение защитных средств (I) в обработке посевного материала с последующим нанесением пестицидов, преимущественно гербицидов, после посева до появления всходов или после появления всходов. Соединения формулы (I) или их соли могут применяться как таковые или в форме их композиций(препаративных форм) с другими веществами с пестицидной активностью, такими как, например, инсектициды, акарициды, нематициды, гербициды, фунгициды, защитные средства, удобрения и/или регуляторы роста, например, в виде готовых препаративных форм или в виде баковых смесей. Комбинированные препаративные формы при этом могут быть получены на основе вышеназванных препаративных форм, при этом должны учитываться физические свойства и стабильность комбинируемых биологически активных веществ. В качестве комбинационных партнеров для биологически активных веществ согласно данному изобретению в смешанных составах или смесях в емкостях можно использовать, например, известные, преимущественно гербицидные активные вещества, действие которых основывается на ингибировании, например, ацетолактат-синтазы, ацетил-коэнзим-А-карбоксилазы, PS I, PS II, HPPDO, фитоен-десатуразы,протопорфириноген-оксидазы, глутамин-синтетазы, биосинтеза целлюлозы, 5-енолпирувилшикимат-3 фосфат-синтетазы. Такие соединения, а также другие используемые соединения с частично неизвестным или другим механизмом воздействия описаны, например, в Weed Research 26, 441-445 (1986), или в справочнике "The Pesticide Manual", 12-e издание 2000 г., или 13-е издание 2003 г., или 14-е издание 2006/2007 гг., или в соответствующей электронной версии e-Pesticide Manual", версия 4 (2006), соответственно изданной British Crop Protection Council (далее обозначенной для краткости также как "РМ"), и цитированной в них литературе. Списки "общепринятых названий" доступны также в интернете в "TheCompendium of Pesticide Common Names". В качестве известных из литературы гербицидов, которые могут комбинироваться с соединениями формулы (I), можно назвать следующие биологически активные вещества (примечание: соединения обозначаются либо с помощью "Common name" в соответствии с Международной организацией по стандартизации (ISO), либо с помощью химических названий, при необходимости вместе с обычным кодовым номером) ацетохлор; ацибензолар-S-метил; ацифлуорфен(-натрий); аклонифен; AD-67; АКН 7088, т.е. 1-[5[2-хлор-4-(трифторметил)фенокси]-2-нитрофенил]-2-метоксиэтилиден]амино]окси]уксусная кислота и метиловый эфир этой кислоты; алахлор; аллоксидим(-натрий); аметрин; амикарбазон; амидохлор; амидосульфурон; аминопиралид; амитрол; АМС, т.е. сульфамат аммония; анцимидол; анилофос; азулам; атразин; авиглицин; азафенидин; азимсульфурон (DPX-A8947); азипротрин; барбан; BAS 516 Н, т.е. 5-фтор 2-фенил-4 Н-3,1-бензоксазин-4-он; бефлубутамид (UBH-509); беназолин(-этил); бенкарбазон; бенфлуралин; бенфурезат; беноксакор; бенсульфурон(-метил); бенсулид; бентазон; бензфендизон; бензобициклон; бензофенап; бензофлуор; бензоилпроп(-этил); бензтиазурон; биалафос; бифенокс; биспирибак(-натрий)(KIN-2023); боракс; бромацил; бромобутид; бромофеноксим; бромоксинил; бромурон; буминафос; бузоксинон; бутахлор; бутафенацил; бутамифос; бутенахлор (KH-218); бутидазол; бутралин; бутроксидим; бутилате; кафенстрол (СН-900); карбетамид; карфентразон(-этил); CDAA, т.е. 2-хлор-N,N-ди-2 пропенилацетамид; CDEC, т.е. 2-хлораллиловый эфир диэтилдитиокарбаминовой кислоты; хлометоксифен; хлорамбен; хлоразифоп-бутил, хлорбромурон; хлорбуфам; хлорфенак; хлорфенпроп; хлорфлурекол(-метил); хлорфлуренол(-метил); хлоридазон; хлоримурон(-этил); хлормекват(-хлорид); хлорнитрофен; хлорофталим (MK-616); хлоротолурон; хлороксурон; хлорпрофам; хлорсульфурон; хлорталдиметил; хлортиамид; хлортолурон; цинидон(-метил и -этил); цинметилин; циносульфурон; клефоксидим; клетодим; клодинафоп и его сложно-эфирные производные (например, клодинафоп-пропаргил); клофенцет; кломазон; кломепроп; клопроп; клопроксидим; клопиралид; клопирасульфурон(-метил); клоквинтоцет(-мексил); клорансулам(-метил); кумилурон (JC 940); цианамид; цианазин; циклоат; циклосульфамурон (АС 104); циклоксидим; циклурон; цигалофоп и его сложно-эфирные производные (например, бутиловый эфир, DEH-112); циперкват; ципразин; ципразол; ципросульфамид; даимурон; 2,4-D; 2,4DB; далапон; даминозид; дазомет; н-деканол; десмедифам; десметрин; ди-аллате; дикамба; дихлобенил; дихлормид; дихлорпроп(-Р)-соли; диклофоп и его сложные эфиры, такие как диклофоп-метил; диклофоп-Р(-метил); диклосулам; диэтатил(-этил); дифеноксурон; дифензокват(-метилсульфат); дифлуфеникан; дифлуфензопир(-натрий); димефурон; димепиперате; диметахлор; диметаметрин; диметазон; диметенамид (SAN-582H); диметенамид-Р; диметиларсиновая кислота; диметипин; диметрасульфурон; динитрамин; динозеб; динотерб; дифенамид; дипропетрин; дикват-соли; дитиопир; диурон; DNOC; эглиназин-этил; EL 77, т.е. 5-циано-1-(1,1-диметилэтил)-N-метил-1H-пиразол-4-карбоксамид; эндотал; эпопродан; ЕРТС; эспрокарб; эталфлуралин; этаметсульфурон-метил; этефон; этидимурон; этиозин; этофумезат; этоксифен и его сложные эфиры (например, этиловый эфир, HN-252); этоксисульфурон; этобензанид ноксапроп-Р, а также их сложные эфиры, например, феноксапроп-Р-этил и феноксапроп-этил; феноксидим; фентразамид; фенурон; ферроуз сульфат; флампроп(-метил, или изопропил, или -изопропил-L); флампроп-М(-метил или -изопропил); флазасульфурон; флорасулам; флуазифоп и флуазифоп-Р и их сложные эфиры, например, флуазифоп-бутил и флуазифоп-Р-бутил; флуазолат; флукарбазо(-натрий); флуцетосульфурон; флухлоралин, флуфенацет; флуфенпир(-этил); флуметралин; флуметсулам; флуметурон; флумиклорак(-пентил); флумиоксазин (S-482); флумипропин; флуометурон; флуорохлоридон; флуородифен; флуорогликофен(-этил); флупоксам (KNW-739); флупропацил (UBIC-4243); флупропаноат; флупирсульфурон(-метил)(-натрий); флуразол; флуренол(-бутил); флуридон; флурохлоридон; флуроксипир(-мептил); флурпримидол; флуртамон; флутиацет(-метил) (KIN-9201); флутиамид; флуксофеним; фомезафен; форамсульфурон; форхлорфенурон; фозамин; фурилазол; фурилоксифен; гиббериллиновая кислота; глуфозинат(-аммоний); глифозат(-изопропиламмоний); галозафен; галосульфурон(-метил); галоксифоп и его сложные эфиры; галоксифоп-Р (=R-галоксифоп) и его сложные эфиры; НС-252; гексазинон; имазаметабенз(-метил); имазаметапир; имазамокс; имазапик; имазапир; имазаквин и соли, такие как соль аммония; имазэтаметапир; имазэтапир; имазосульфурон; инабенфид; инданофан; индол-3-уксусная кислота; 4-индол-3-илмасляная кислота; иодосульфурон-метил(-натрий); иоксинил; изокарбамид; изопропалин; изопротурон; изоурон; изоксабен; изоксахлортол; изоксадифен(-этил); изоксафлутол; изоксапирифоп; карбутилат; лактофен; ленацил; линурон; гидразид малеиновой кислоты (МН); МСРА; МСРВ; мекопроп(-Р); мефенацет; мефенпир(-диэтил); мефлуидид; мепикват(-хлорид); мезосульфурон(-метил); мезотрион; метам; метамифоп; метамитрон; метазахлор; метабензтиазурон; метам; метазол; метоксифенон; метиларсиновая кислота (methylarsonic acid); метилциклопропен; метилдимрон; метилизотиоцианат; метабензтиазурон; метобензурон; метобромурон; (альфа-)метолахлор; метозулам (XRD 511); метоксурон; метрибузин; метсульфурон-метил; молинат; моналид; монокарбамида дигидрогенсульфат; монолинурон; монурон; МТ 128, т.е. 6-хлор-N-(3-хлор-2-пропенил)-5-метил-N-фенил-3-пиридазинамин; МТ 5950, т.е. N-[3-хлор-4-(1-метилэтил)фенил]-2-метилпентанамид; напроанилид; напропамид; напталам;NC 310, т.е. 4-(2,4-дихлорбензоил)-1-метил-5-бензилоксипиразол; небурон; никосульфурон; нипираклофен; нитралин; нитрофен; нитрофенолатов смесь; нитрофлуорфен; нонановая кислота; норфлуразон; орбенкарб; ортасульфамурон; оксабетринил; оризалин; оксадиаргил (RP-020630); оксадиазон; оксасульфурон; оксацикломефон; оксифлуорфен; паклобутразол; паракват(-дихлорид); пебулат; пеларгоновая кислота; пендиметалин; пенокссулам; пентахлорфенол; пентанохлор; пентоксазон; перфлуидон; петоксамид; фенизофам; фенмедифам; пиклорам; пиколинафен; пиноксаден; пиперофос; пирибутикарб; пирифеноп-бутил; претилахлор; примисульфурон(-метил); пробеназол; прокарбазон(-натрий); проциазин; продиамин; профлуралин; профоксидим; прогексадион(-кальций); прогидроясмон; проглиназин(-этил); прометон; прометрин; пропахлор; пропанил; пропаквизафоп; пропазин; профам; пропизохлор; пропоксикарбазон(-натрий) (MKH-6561); н-пропил-дигидроясмонат; пропизамид; просульфалин; просульфокарб; просульфурон (CGA-152005); принахлор; пираклонил; пирафлуфен(-этил) (ЕТ-751); пирасульфотол; пиразолинат; пиразон; пиразосульфурон(-этил); пиразоксифен; пирибензоксим; пирибутикарб; пиридафол; пиридат; пирифталид; пириминобак(-метил) (KIH-6127); пиримисульфан (KIH-5996); пиритиобак(натрий) (KIN-2031); пироксасульфон KIN-485); пироксофоп и его сложные эфиры (например, пропаргиловый эфир); пирокссулам; квинклорак; квинмерак; квинокламин; квинофоп и его сложно-эфирные производные, квизалофоп и квизалофоп-Р и их сложно-эфирные производные, например, квизалофопэтил; квизалофоп-Р-тефурил и -этил; ренридурон; римсульфурон (DPX-E9636); S 275, т.е. 2-[4-хлор-2 фтор-5-(2-пропинилокси)фенил]-4,5,6,7-тетрагидро-2 Н-индазол; сафлуфенацил (N'-[2-хлор-4-фтор-5-(3 метил-2,6-диоксо-4-(трифторметил)-3,6-дигидро-1(2 Н)-пиримидинил)бензоил]-N-изопропил-Nметилсульфамид); секбуметон; сетоксидим; сидурон; симазин; симетрин; синтофен; SN 106279, т.е. 2-7[2-хлор-4-(трифторметил)фенокси]-2-нафталенил]окси]пропановая кислота и метиловый эфир 2-7-[2 хлор-4-(трифторметил)фенокси]-2-нафталенил]окси]пропановой кислоты; сулкотрион; сульфентразонDOWCO-535; DK-8910; V-53482; РР-600 и МВН-001. Инсектицидами, которые одни или вместе с гербицидами могут вызвать повреждения у растений,являются, например, следующие: органофосфаты, например, тербуфос (Counter), фонофос (Dyfonate),форате (Thimet), хлорпирифос (Reldan), карбаматы, такие как карбофуран (Furadan), инсектицидыпиретроиды, такие как тефлутрин (Force), делтаметрин (Decis) и тралометрин (Scout), а также другие инсектицидные средства с механизмом воздействия другого типа. Гербициды, побочное фитотоксическое воздействие которых на культурные растения можно уменьшить с помощью соединений формулы (I), это, например, гербициды из группы, включающей карбаматы, тиокарбаматы, галоидацетанилиды, производные замещенных фенокси-, нафтокси- и феноксифенокси-карбоновых кислот, а также гетероарилоксифенокси-производные алканкарбоновых кислот,такие как сложные эфиры хинолилокси-, хиноксалилокси-, пиридилокси-, бензоксазолилокси- и бензтиазолилоксифенокси-алканкарбоновых кислот, циклогександион-оксимы, бензоилциклогександионы, бензоилизоксазолы, бензоилпиразолы, имидазолиноны, пиримидинилокси-производные пиридинкарбоновой кислоты, пиримидинилокси-производные бензойной кислоты, сульфонилмочевины, сульфониламинокарбонил-триазолиноны, производные тиазоло-пиримидин-сульфонамида, производные фосфиновой кислоты и их соли, производные глицина, триазолиноны, триазиноны, а также сложные эфиры S-(Nарил-N-алкилкарбамоилметил)дитиофосфорной кислоты, пиридинкарбоновые кислоты, пиридины, пиридинкарбоксамиды, 1,3,5-триазины и другие. Предпочтительными являются при этом сложные эфиры и соли феноксифенокси- и гетероарилоксифеноксикарбоновых кислот, оксимы циклогександионов, бензоилциклогександионы, бензоилизоксазолы, бензоилпиразолы, сульфонилмочевины, сульфониламинокарбонилтриазолиноны, имидазолиноны, а также смеси названных биологически активных веществ друг с другом и/или с биологически активными веществами, используемыми для расширения спектра воздействия гербицидов, такими как, например,бентазон, цианазин, атразин, бромоксинил, дикамба и другие листовые гербициды. Подходящими гербицидами, которые могут комбинироваться с защитными средствами согласно данному изобретению, являются следующие: А) гербициды типа производных феноксифенокси- и гетероарилоксифенокси-карбоновых кислот,такие как А 1) производные феноксифенокси- и бензилоксифенокси-карбоновых кислот, например, метиловый эфир 2-(4-(2,4-дихлорфенокси)фенокси)пропионовой кислоты (диклофоп-метил),метиловый эфир 2-(4-(4-бром-2-хлорфенокси)фенокси)пропионовой кислоты (DE-A-2601548),метиловый эфир 2-(4-(4-бром-2-фторфенокси)фенокси)пропионовой кислоты (US-A-4808750),метиловый эфир 2-(4-(2-хлор-4-трифторметилфенокси)фенокси)пропионовой кислоты (DE-A2433067),метиловый эфир 2-(4-(2-фтор-4-трифторметилфенокси)фенокси)пропионовой кислоты (US-A480750),метиловый эфир 2-(4-(2,4-дихлорбензил)фенокси)пропионовой кислоты (DE-A-2417487),этиловый эфир 4-(4-(4-трифторметилфенокси)фенокси)пент-2-еновой кислоты,метиловый эфир 2-(4-(4-трифторметилфенокси)фенокси)пропионовой кислоты (DE-A-2433067),бутиловый эфир (R)-2-[4-(4-циано-2-фторфенокси)фенокси]пропионовой кислоты (цигалофопбутил); А 2) одноядерные производные гетероарилоксифенокси-алканкарбоновых кислот, например,этиловый эфир 2-(4-(3,5-дихлорпиридил-2-окси)фенокси)пропионовой кислоты (ЕР-А-0002925),пропаргиловый эфир 2-(4-(3,5-дихлорпиридил-2-окси)фенокси)пропионовой кислоты (ЕР-А-0003114),метиловый эфир (RS)- или (R)-2-(4-(3-хлор-5-трифторметил-2-пиридил-окси)фенокси)пропионовой кислоты (галоксифоп-метил или галоксифоп-Р-метил),этиловый эфир 2-(4-(3-хлор-5-трифторметил-2-пиридилокси)фенокси)пропионовой кислоты (ЕР-А 0003890),пропаргиловый эфир 2-(4-(5-хлор-3-фтор-2-пиридилокси)фенокси)пропионовой кислоты (клодинафоппропаргил),бутиловый эфир (RS)- или (R)-2-(4-(5-трифторметил-2-пиридилокси)фенокси)пропионовой кислоты В) Гербициды из ряда сульфонилмочевин, такие как пиримидин- или триазиниламинокарбонил[бензол-, пиридин-, пиразол-, тиофен- и (алкилсульфонил)алкиламино]сульфамиды. Предпочтительными в качестве заместителей у пиримидинового или триазинового цикла являются алкокси, алкил, галоидалкокси, галоидалкил, галоген или диметиламино, причем все заместители могут комбинироваться независимо друг от друга. Предпочтительными заместителями в бензольной, пиридиновой, пиразольной, тиофеновой или (алкилсульфонил)алкиламинной части являются алкил, алкокси, галоген, нитро, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкоксиаминокарбонил, галоидалкокси, галоидалкил, алкилкарбонил, алкоксиалкил, (алкилсульфонил)алкиламино. Такими подходящими сульфонилмочевинами являются, например,B1) фенил- и бензилсульфонилмочевины и родственные соединения, например,1-(2-хлорфенилсульфонил)-3-(4-метокси-6-метил-1,3,5-триазин-2-ил)мочевина (хлорсульфурон),1-(2-этоксикарбонилфенилсульфонил)-3-(4-хлор-6-метоксипиримидин-2-ил)мочевина диметил-4,5-дигидро-изоксазол-3-ил)-1,3-диметил-1 Н-пиразол-5-сульфонамид; В 4) производные сульфондиамида, например, 3-(4,6-диметоксипиримидин-2-ил)-1-(N-метил-Nметилсульфониламиносульфонил)мочевина (амидосульфурон) и ее структурные аналоги (ЕР-А-0131258 и Z. Pfl. Krankh. Pfl. Schutz, Sonderheft XII, 1990, 489-497);(никосульфурон),1-(3-этилсульфонилпиридин-2-илсульфонил)-3-(4,6-диметоксипиримидин-2-ил)мочевина(римсульфурон),метиловый эфир 2-[3-(4,6-диметоксипиримидин-2-ил)уреидосульфонил]-6-трифторметил-3-пиридинкарбоновой кислоты,натриевая соль (DPX-KE 459, флупирсульфурон-метил-натрий),3-(4,6-диметоксипиримидин-2-ил)-1-(3-N-метилсульфонил-N-метил-аминопиридин-2-ил)сульфонилмочевина или ее соли (DE-A-4000503 и DE-A-4030577),1-(4,6-диметоксипиримидин-2-ил)-3-(3-трифторметил-2-пиридилсульфонил)мочевина(флазасульфурон),натриевая соль 1-(4,6-диметоксипиримидин-2-ил)-3-[3-(2,2,2-трифторэтокси)-2-пиридилсульфонил]мочевины(трифлоксисульфурон-натрий);(1RS,2RS;1RS,2RS)-1-3-[(4,6-диметоксипиримидин-2-илкарбамоил)сульфамоил]-2-пиридил-2 фторпропил-метоксиацетат (флуцетосульфурон); В 6) алкоксифеноксисульфонилмочевины, например, 3-(4,6-диметоксипиримидин-2-ил)-1-(2-этоксифенокси)сульфонилмочевина или ее соли (этоксисульфурон); В 7) имидазолилсульфонилмочевины, например, 1-(4,6-диметоксипиримидин-2-ил)-3-(2-этилсульфонилимидазо[1,2-а]пиридин-3-ил)сульфонилмочевина (MON 37500, сульфосульфурон), 1-(2-хлоримидазо[1,2 а]пиридин-3-илсульфонил)-3-(4,6-диметоксипиримидин-2-ил)мочевина (имазосульфурон); 2-хлор-N-[(4,6 диметоксипиримидин-2-ил)карбамоил]-6-пропилимидазо[1,2-b]пиридазин-3-сульфонамид; В 8) фениламиносульфонилмочевины, например, 1-[2-(циклопропилкарбонил)фениламиносульфонил]-3(4,6-диметокси-пиримидин-2-ил)мочевина (циклосульфамурон); 1-(4,6-диметоксипиримидин-2-ил)-3-[2(диметилкарбамоил)фенил-сульфамоил]мочевина (ортосульфамурон);K) сульфониламинокарбонилтриазолиноны, например, натриевая соль 4,5-дигидро-3-метокси-4 метил-5-оксо-N-(2-трифторметокси-фенилсульфонил)-1H-1,2,4-триазол-1-карбоксамида (флукарбазоннатрий), натриевая соль метилового эфира 2-(4,5-дигидро-4-метил-5-оксо-3-пропокси-1H-1,2,4-триазол- 17020453N) производные глицина, например, N-(фосфонометил)глицин и его соли (глифозат и соли, например, натриевая соль или изопропиламмониевая соль), N-(фосфонометил)глицин-тримезиумсоль (сульфозат); О) производные пиримидинилоксипиридинкарбоновой кислоты; производные пиримидинилоксибензойной кислоты или производные пиримидинилтиобензойной кислоты, например,бензиловый эфир 3-(4,6-диметоксипиримидин-2-ил)окси-пиридин-2-карбоновой кислоты (ЕР-А 0249707),метиловый эфир 3-(4,6-диметоксипиримидин-2-ил)окси-пиридин-2-карбоновой кислоты (ЕР-А 0249707),1-(этоксикарбонил-оксиэтил)овый эфир 2,6-бис[(4,6-диметоксипиримидин-2-ил)окси]бензойной кислоты (ЕР-А-0472113),2,6-бис[(4,6-диметоксипиримидин-2-ил)-окси]бензойная кислота (биспирибак-натрий),изопропил-4-2-[(4,6-диметокси-2-пиримидин)окси]фенил]метил]амино]бензоат(пирибамбенз-изопропил, WO 2002034724),пропил-4-2-[(4,6-диметокси-2-пиримидин)окси]фенил]метил]амино]бензоат(пирибамбенз-пропил,WO 2002034724),пирибензоксим, пирифталид, пириминобак-метил, пиритиобак-натрий, пиримисульфан; Р) сложные эфиры S-(N-арил-N-алкил-карбамоилметил)дитиофосфоновой кислоты, такие как S-[N(4-хлорфенил)-N-изопропил-карбамоилметил]-О,О-диметил-дитиофосфат (анилофос);X) пиразолы, например, 3-[5-(дифторметокси)-1-метил-3-(трифторметил)пиразол-4-илметилсульфонил]-4,5-дигидро-5,5-диметил-1,2-оксазол (пироксасульфон). Гербициды групп от А до W известны, например, из названных выше работ и из "The Pesticide Manual", The British Crop Protection Council, 14-е издание, 2006, или из e-Pesticide Manual, Version 4.0, BritishCrop Protection Council, 2006, или также из "Compendium of Pesticide Common Names". В случае применения в виде препаративных форм биологически активных веществ или совместных препаративных форм последние при необходимости содержат, как правило, обычные средства, улучшающее адгезию, смачиватели, диспергаторы, эмульгаторы, пенетраторы, консерванты, антифризы и растворители, наполнители, вещества-носители и красители, пеногасители, замедлители испарения, а также средства, влияющие на величину pH или вязкость. Соединения общей формулы (I) и их комбинации с одним или несколькими названными пестицидами в зависимости от заданных физико-химических и биологических параметров могут входить в препаративные формы различного вида. В качестве типов препаративныхформ пригодны следующие: концентраты для эмульсий, которые могут быть получены путем растворения биологически активных веществ в органическом растворителе, например, в бутаноле, циклогексаноне, диметилформамиде,- 18020453 ксилоле или в более высоко кипящих углеводородах или смесях органических растворителей, с добавлением одного или нескольких поверхностно-активных веществ ионного и/или неионного типа (эмульгаторы). Подходящими эмульгаторами являются, например, кальциевые соли алкиларилсульфокислот, сложные эфиры полигликолей и жирных кислот, простые эфиры алкиларилполигликолей, простые эфиры алифатических спиртов и полигликолей, продукты конденсации пропиленоксида и этиленоксида, простые алкилполиэфиры, сложные эфиры сорбита и сложные эфиры жирных кислот и полиоксиэтиленсорбита; средства для распыления, которые могут быть получены путем размалывания биологически активных веществ вместе с тонко измельченными твердыми неорганическими или органическими веществами, например, тальком, природными глинами, такими как каолин, бентонит и пирофиллит, диатомовая земля, или порошкообразными веществами; концентраты для суспензий на основе воды или масла, которые могут быть получены, например,путем мокрого размола с помощью бисерных мельниц; растворимые в воде порошки; растворимые в воде концентраты; грануляты, такие как растворимые в воде грануляты, диспергируемые в воде грануляты, а также грануляты для внесения путем разбрасывания или внесения в почву; порошки для распыления, которые наряду с биологически активными веществами содержат вещества для разбавления или инертные вещества и поверхностно-активные вещества; капсюльные суспензии и микрокапсулы; препараты для ультрамалообъемного опрыскивания. Названные выше типы препаративных форм известны специалисту и описаны, например, в K. Martens, "Spray Drying Handbook", 3-е издание, G.Goodwin Ltd., Лондон, 1979; W. van Valkenburg, "PesticideFormulations", Marcel Dekker, Нью-Йорк, 1973; Winnaker-Kuchler, "Chemische Technologie", т. 7, издательство С. Hanser, Мюнхен, 4-е издание, 1986; "Perry's Chemical Engineer's Handbook", 5-е издание,McGraw-Hill, Нью-Йорк, 1973, стр. 8-57. Необходимые вспомогательные средства для препаративных форм, такие как инертные материалы,поверхностно-активные вещества, растворители и другие добавки также известны и описаны, например,в McCutcheon's "Detergents and Emulsifiers Annual", MC Publ. Corp., Ridgewood N.J.; C. Marsden, "SolventsGuide", 2-е издание, Interscience, Нью-Йорк 1963; H. von Olphen, "Introduction to Clay Colloid Chemistry",2-е издание, J. WileySons, Нью-Йорк; "Grenzflchenaktive thylenoxidaddukte", Wiss. Verlagsgesellschaft, Штуттгарт 1976; Sisley and Wood, "Encyclopedia of Surface Active Agents", Chem Publ. Co. Inc.,Нью-Йорк 1964; Watkins, "Handbook of Insecticide Dust Diluents and Carriers", 2-е издание, Darland Books,Caldwell N.J.; Winnaker-Kchler, "Chemische Technologie", т. 7, издательство С. Hanser, Мюнхен, 4-е издание, 1986. Кроме вышеупомянутых вспомогательных средств для препаративных форм средства для защиты полезных растений при необходимости могут содержать обычные средства, улучшающие адгезию, смачиватели, диспергаторы, пенетраторы, эмульгаторы, консерванты, антифризы, наполнители, веществаносители и красители, пеногасители, замедлители испарения, а также средства, влияющие на величинуpH или вязкость. В зависимости от типа препаративной формы средства защиты полезных растений содержат, как правило, от 0,1 до 99 мас.%, предпочтительно от 0,2 до 95 мас.%, одного или нескольких защитных средств общей формулы (I) или комбинации защитного средства и пестицида. Кроме того, они содержат от 1 до 99,9 мас.%, предпочтительно от 4 до 99,5 мас.%, одного или нескольких твердых или жидких добавок и от 0 до 25 мас.%, предпочтительно от 0,1 до 25 мас.% поверхностно-активного вещества. В концентратах для эмульсий концентрация биологически активных веществ, т.е. концентрация защитного средства и/или пестицида, как правило, составляет от 1 до 90 мас.%, предпочтительно от 5 до 80 мас.%. Средства для распыления содержат обычно от 1 до 30 мас.%, предпочтительно от 5 до 20 мас.% биологически активных веществ. В порошках для распыления концентрация биологически активных веществ,как правило, составляет от 10 до 90 мас.%. В диспергируемых в воде гранулятах содержание биологически активных веществ лежит, например, в диапазоне от 1 до 95 мас.%, предпочтительно от 10 до 80 мас.%. Для применения препаративные формы, существующие в форме торгового качества составов, при необходимости разбавляют обычным образом, например, в случае порошков для распыления, концентратов для эмульсий, дисперсий и диспергируемых в воде гранулятов водой. Пылеподобные препаративные формы, грануляты, а также растворы для опрыскивания перед применением обычно немного разбавляют другими инертными веществами. С изменением внешних условий, таких как температура, влажность,тип используемого гербицида и т.п., изменяются необходимые нормы расхода защитных средств. В нижеследующих примерах, которые поясняют, но не ограничивают изобретение, все количественные данные базируются на весе, если не определено ничего другого. Примеры 1. Примеры препаративных форм 1.1. Средство для распыления Средство для распыления получают, смешивая 10 массовых частей соединения формулы (I) или смеси биологически активных веществ, состоящей из пестицида (например, гербицида) и защитного средства формулы (I), и 90 массовых частей талька в качестве инертного вещества и размельчая смесь в ударной мельнице. 1.2 Диспергируемый в воде порошок Легко диспергируемый в воде гидрофильный порошок получают, смешивая 25 массовых частей соединения формулы (I) или смеси биологически активных веществ, состоящей из пестицида (например,гербицида) и защитного средства формулы (I), 64 массовые части содержащего каолин кварца в качестве инертного вещества, 10 массовых частей лигнинсульфокислого калия и 1 массовую часть олеоилметилтауринокислого натрия в качестве смачивателя и диспергатора и размалывая смесь на стержневой мельнице. 1.3 Диспергируемый в воде концентрат Легко диспергируемый в воде концентрат для дисперсий получают, смешивая 20 массовых частей соединения формулы (I) или смеси биологически активных веществ, состоящей из пестицида (например,гербицида) и защитного средства формулы (I), с 6 массовыми частями простого эфира алкилфенола и полигликоля (Triton X 207), 3 массовыми частями простого эфира изотридеканола и полигликоля и 71 массовой частью парафинового минерального масла и размалывая смесь на трочно-шаровой мельнице до тонины помола менее 5 микрон. 1.4 Концентрат для эмульсии Концентрат для эмульсии получают из 15 массовых частей соединения формулы (I) или смеси биологически активных веществ, состоящей из пестицида (например, гербицида) и защитного средства формулы (I), 75 массовых частей циклогексанона в качестве растворителя и 10 массовых частей оксэтилированного нонилфенола в качестве эмульгатора. 1.5 Диспергируемый в воде гранулят Диспергируемый в воде гранулят получают, смешивая 75 массовых частей защитного средства формулы (I) или смеси из пестицида и защитного средства формулы (I), 10 массовых частей лигнинсульфокислого кальция, 5 массовых частей лаурилсульфата натрия, 3 массовых части поливинилового спирта и 7 массовых частей каолина, размалывая смесь на стержневой мельнице и гранулируя порошок в кипящем слое путем разбрызгивания воды в качестве гранулирующей жидкости. Диспергируемый в воде гранулят получают также, гомогенизируя 25 массовых частей защитного средства формулы (I) или смеси из пестицида и защитного средства формулы (I), 5 массовых частей 2,2'динафтилметан-6,6'-дисульфокислого натрия, 2 массовые части олеоиметилтауринокислого натрия, 17 массовых частей карбоната кальция, 50 массовых частей воды и 1 массовую часть поливинилового спирта на коллоидной мельнице, размельчая, затем размалывая на бисерной мельнице и распыляя полученную таким образом суспензию в скруббере и высушивая. 2. Примеры получения Пример А 1N-циклобутил-2-оксо-6-(трифторметил)-1,2-дигидропиридин-3-карбоксамид А 1.1) 4-Бутокси-1,1,1-трифторбут-3-ен-2-он При перемешивании и температуре 5 С смесь из 29,9 г (0,38 моль) пиридина и 50,0 г (0,38 моль) бутилвинилового эфира в 200 мл трихлорметана объединяли с 79,9 г (0,38 моль) ангидрида трифторуксусной кислоты, растворенного в 100 мл трихлорметана. После чего перемешивали еще 15 ч при комнатной температуре. Затем реакционную смесь смешивали с 300 мл воды, органическую фазу отделяли, сушили и концентрировали. Получали 59 г (79% от теорет.) желтоватого масла. 1 Н-ЯМР: [CDCl3] 0,96 (t, 3 Н); 1,41 (m, 2H); 1,73 (m, 2H); 4,04 (t, 2H); 5,85 (d, 1H); 7,90 (d, 1H).A1.2) Метиловый эфир 2-оксо-6-(трифторметил)-1,2-дигидропиридин-3-карбоновой кислоты После растворения 2,15 г (94 ммоль) натрия в 300 мл метанола добавляли 15,3 г (78 ммоль) 4 бутокси-1,1,1-трифторбут-3-ен-2-она и 9,13 г (78 ммоль) метилмалонат-моноамида и смесь кипятили с обратным холодильником 18 ч. После упаривания смеси остаток смешивали с водой и промывали дихлорметаном. Добавлением 2 н раствора соляной кислоты подкисляли водную фазу до рН 2 и экстрагировали дихлорметаном. После высушивания и упаривания экстракта оставалось 12 г (69% от теоретич.) бесцветного порошка. 1 Н-ЯМР: [CDCl3] 4,03 (s, 3 Н); 7,31 (d, 1H); 8,39 (d, 1H).A1.3) 2-Оксо-6-(трифторметил)-1,2-дигидропиридин-3-карбоновая кислота Растворяли при комнатной температуре 4,73 г (21,4 ммоль) метилового эфира 2-оксо-6(трифторметил)-1,2-дигидропиридин-3-карбоновой кислоты в 45 мл метанола и 15 мл воды, смешивали с 1,80 г (42,8 ммоль) литийгидроксида моногидрата и после этого 2 ч кипятили с обратным холодильником. После концентрирования смеси до объема примерно 15 мл промывали е дихлорметаном и добавлением 2 н раствора соляной кислоты подкисляли водную фазу до рН 2. Снова экстрагировали дихлорметаном, органическую фазу сушили и упаривали. Получали 4,2 г (94% от теоретич.) бесцветного порошка. 1 Н-ЯМР: [DMSO] 7,41 (d, 1H); 8,35 (d, 1H).A1.4) N-Циклобутил-2-оксо-6-(трифторметил)-1,2-дигидропиридин-3-карбоксамид После растворения 600 мг (2,9 ммоль) 2-оксо-6-(трифторметил)-1,2-дигидропиридин-3-карбоновой кислоты в 5 мл тетрагидрофурана и добавления 658 мг (4,1 ммоль) N,N-карбонилдиимидазола смесь выдерживали сначала 30 мин при комнатной температуре, а затем 30 мин кипятили с обратным холодильником. После чего добавляли по каплям раствор 247 мг (3,5 ммоль) циклобутиламина в 5 мл тетрагидрофурана и кипятили смесь с обратным холодильником еще 2 ч. После упаривания раствора досуха смешивали с этилацетатом, промывали 1 н раствором соляной кислоты и водой, сушили и упаривали. После очистки колоночной хроматографией получали 160 мг (19% от теоретич.) светло-коричневого порошка. 1 Н-ЯМР: [CDCl3] 1,80 (m, 2H); 2,00 (m, 2H); 2,42 (m, 2H); 4,55 (m, 1H); 6,88 (d, 1H); 8,65 (d,1H); 9,50 6-[Хлор(дифтор)метил]-N-(2-метоксиэтил)-2-оксо-1,2-дигидропиридин-3-карбоксамид А 2.1) 4-Бутокси-1-хлор-1,1-дифторбут-3-ен-2-он При перемешивании при температуре 5 С смесь из 1,60 г (20,2 ммоль) пиридина и 2,1 г (20,2 ммоль) бутилвинилового эфира в 30 мл трихлорметана объединяли с 5,0 г (20,2 ммоль) ангидрида хлордифторуксусной кислоты, растворенного в 10 мл трихлорметана. После чего перемешивали еще 15 ч при комнатной температуре. Затем реакционную смесь смешивали с 100 мл воды, органическую фазу отделяли, сушили и концентрировали. Получали 3,4 г (80% от теорет.) желтоватого масла. 1 Н-ЯМР: [CDCl3] 0,90 (t, 3 Н); 1,35 (m, 2H); 1,65 (m, 2H); 4,20 (t, 2H); 6,04 (d, 1H); 8,10 (d, 1H).A2.2) Метиловый эфир 6-[хлор(дифтор)метил]-2-оксо-1,2-дигидропиридин-3-карбоновой кислоты После растворения 1,47 г (61 ммоль) натрия в 220 мл метанола добавляли 10 г (47 ммоль) 4 бутокси-1-хлор-1,1-дифторбут-3-ен-2-она и 5,51 г (47 ммоль) метилмалонат-моноамида и смесь кипятили с обратным холодильником 21 ч. Добавлением 2 н раствора соляной кислоты устанавливали рН 4-5 и после этого отгоняли примерно 200 мл. Оставшийся раствор экстрагировали этилацетатом, экстракт сушили и упаривали. Остаток растирали с диизопропиловым эфиром, фильтровали и сушили. Получали 7,4 гA2.3a) 6-[Хлор(дифтор)метил]-2-оксо-1,2-дигидропиридин-3-карбоновая кислота После растворения 1,70 г (74 ммоль) натрия в 250 мл метанола добавляли 13,1 г (61,7 ммоль) 4 бутокси-1-хлор-1,1-дифторбут-3-ен-2-она и 7,22 г (61,7 ммоль) метилмалонат-моноамида и смесь кипятили 21 ч с обратным холодильником. После чего добавляли 250 мл воды и 2,9 г (67,9 ммоль) литийгидроксид-моногидрата и кипятили с обратным холодильником еще 2 ч. После упаривания смеси до объема около 200 мл промывали ее дихлорметаном и подкисляли водную фазу 2 н раствором соляной кислоты до рН 2. Выпавшее в осадок твердое вещество отфильтровывали и сушили в вакууме: 9,3 г (68% от теоретич.). А 2.3b) 6-[Хлор(дифтор)метил]-2-оксо-1,2-дигидропиридин-3-карбоновая кислота Кипятили 11,0 г (49,4 ммоль) 6-[хлор(дифтор)метил]-2-оксо-1,2-дигидропиридин-3-карбоксамида с 77 мл 50%-ной серной кислоты с обратным холодильником в течение 7 ч. Затем выливали смесь в ледяную воду, осадок отфильтровывали и сушили. Получали 7,2 г (65% от теоретич.) желтоватого порошка. Т. пл.: 145-147 С 1 Н-ЯМР: [DMSO] 7,36 (d, 1H); 8,34 (d, 1H). А 2.4) 6-[Хлор(дифтор)метил]-N-(2-метоксиэтил)-2-оксо-1,2-дигидропиридин-3-карбоксамид После растворения 500 мг (2,2 ммоль) 6-[хлор(дифтор)метил]-2-оксо-1,2-дигидропиридин-3 карбоновой кислоты в 10 мл тетрагидрофурана и добавления 508 мг (3,1 ммоль) N,Nкарбонилдиимидазола смесь выдерживали сначала 30 мин при комнатной температуре, а затем кипятили с обратным холодильником 30 мин. После чего добавляли по каплям раствор 202 мг (2,7 ммоль) 2 метоксиэтиламина в 2 мл тетрагидрофурана и кипятили смесь с обратным холодильником еще 2 ч. Раствор упаривали досуха, остаток смешивали с этилацетатом, промывали 1 н раствором соляной кислоты и водой, сушили и упаривали. Получали 360 мг (54% от теоретич.) светло-коричневого порошка. 1 Метил N-(6-[хлор(дифтор)метил]-2-оксо-1,2-дигидропиридин-3-илкарбонил)глицинат После растворения 300 мг (1,34 ммоль) 6-[хлор(дифтор)метил]-2-оксо-1,2-дигидропиридин-3 карбоновой кислоты в 5 мл тетрагидрофурана и добавления 435 мг (2,68 ммоль) N,Nкарбонилдиимидазола смесь выдерживали сначала 30 мин при комнатной температуре, а затем кипятили с обратным холодильником 30 мин. После чего добавляли смесь 168 мг (1,34 ммоль) гидрохлорида метилового эфира глицина и кипятили смесь с обратным холодильником еще 2 ч. Раствор упаривали досуха,остаток смешивали с этилацетатом, промывали 1 н раствором соляной кислоты и водой, сушили и упаривали. Получали 92 мг (23% от теоретич.) светло-коричневого порошка. 1 Н-ЯМР: [ДМСО] 3,65 (s, 3 Н); 4,12 (d, 2 Н); 7,28 (d, уш.л., 1 Н); 8,42 (d, 1H); 9,25 (t, уш.л., 1 Н); 13,6N-(1-Метилпролил)-2-оксо-6-(пентафторэтил)-1,2-дигидропиридин-3-карбоксамид А 4.1) 1-Бутокси-4,4,5,5,5-пентафторпент-1-ен-3-он При перемешивании и температуре -10 С смесь из 8,11 г (102 ммоль) пиридина и 9,33 г (93,2 ммоль) бутилвинилового эфира в 200 мл дихлорметана соединяли с 17,0 г (93,2 ммоль) пентафторпропионилхлорида, растворенного в 20 мл дихлорметана. После чего перемешивали при комнатной температуре еще 15 ч. Затем реакционную смесь объединяли с 200 мл воды, органическую фазу отделяли,сушили и упаривали. Получали 18,9 г (82% от теоретич.) желтоватого масла. 1 Н-ЯМР: [ДМСО] 0,85 (t, 3 Н); 1,32 (m, 2H); 1,63 (m, 2H); 4,20 (t, 2H); 6,06 (d, 1H); 8,11 (d, 1H).A4.2) Этиловый эфир 2-оксо-6-(пентафторэтил)-1,2-дигидропиридин-3-карбоновой кислоты После растворения 0,56 г (24,4 ммоль) натрия в 150 мл этанола добавляли 5 г (20,3 ммоль) 1 бутокси-4,4,5,5,5-пентафторпент-1-ен-3-она и 2,66 г (20,3 ммоль) метилмалонат-моноамида и смесь кипятили с обратным холодильником 6 ч. После упаривания реакционной смеси до объема примерно 50 мл смешивали ее с 500 мл 1 н раствора соляной кислоты и затем экстрагировали этилацетатом. После высушивания и упаривания получали 2,3 г (40% от теоретич.) желтоватой смрлы. 1 Н-ЯМР: [CDCl3] 1,45 (t, 3 Н); 4,50 (q, 2H); 7,35 (d, 1H); 8,40 (d, 1H); 11,4 (уш.л., 1H).A4.3) N-(1-Метилпропил)-2-оксо-6-(пентафторэтил)-1,2-дигидропиридин-3-карбоксамид Перемешивали при комнатной температуре 160 мг (0,56 ммоль) этилового эфира 2-оксо-6(пентафторэтил)-1,2-дигидропиридин-3-карбоновой кислоты в 5 мл 2-бутиламина в течение 14 ч. После чего добавлением 1 н раствора соляной кислоты устанавливали рН 2, при этом выпадал бесцветный осадок. После фильтрования и высушивания получали 160 мг (91% от теорет.) продукта. 1 Н-ЯМР: [CDCl3] 0,97 (t, 3 Н); 1,22 (d, 3 Н); 1,59 (m, 2H); 4,10 (m, 1H); 6,88 (d, 1H); 8,72 (d, 1H); 9,24 2-Оксо-6-(пентафторэтил)-1,2-дигидропиридин-3-карбоксамид После растворения 0,22 г (9,7 ммоль) натрия в 50 мл этанола добавляли 2 г (8,1 ммоль) 1-бутокси 4,4,5,5,5-пентафторпент-1-ен-3-она и 0,86 г (8,1 ммоль) метилмалонат-моноамида и смесь кипятили с обратным холодильником 7 ч. После упаривания реакционную смесь смешивали с 1 н раствором соляной кислоты. Выпавший при этом осадок отсасывали и сушили. Получали 1,9 г (94% от теоретич.) желтого порошка. 1 Н-ЯМР: [ДМСО] 7,45 (d, 1H); 8,15 (уш.л., 1H); 8,45 (уш.л., 1H); 8,50 (d, 1H); 13,7 (уш.л., 1 Н).N-[(Диметиламино)метилен]-2-оксо-6-(трифторметил)-1,2-дигидропиридин-3-карбоксамид Смешивали 1,00 г (4,85 ммоль) 2-оксо-6-(трифторметил)-1,2-дигидропиридин-3-карбоксамида в 5 мл толуола с 0,87 г (7,28 ммоль) N,N-диметилформамид-диметилацеталя и кипятили 4 ч с обратным холодильником. После охлаждения выпавший осадок отсасывали и сушили: 0,5 г (39% от теоретич.). 1 Н-ЯМР: [CDCl3] 3,25 (s, 3 Н); 3,35 (s, 3 Н); 7,25 (d, 1H); 8,58 (d, 1H); 8,76 (s, 1H); 13 С-ЯМР. [CDCl3] 35 (NMe2); 106 (С-5); 115 (С-3); 122 (q, CF3); 143 (С-4); 151 (С-6); 164 (N=CN); 167 5-Хлор-2-оксо-6-(трифторметил)-1,2-дигидропиридин-3-карбоксамид Смешивали при комнатной температуре 300 мг (1,46 ммоль) 2-оксо-6-(трифторметил)-1,2 дигидропиридин-3-карбоксамида в 5 мл 1,2-дихлорэтана и 2,3 г (0,25 мл) пиридина с 0,39 г (2,9 ммоль) сульфурилхлорида и затем кипятили 2 ч с обратным холодильником. После чего реакционную смесь смешали с 0,5 н раствором соляной кислоты. После отделения органической фазы последнюю сушили и упаривали, при этом было получено 144 мг (41% от теоретич.) коричневатого порошка. 1 Н-ЯМР: [ДМСО] 8,25 (уш.л., 1 Н); 8,35 (уш.л., 1H); 8,50 (s, 1H); 13,8 (уш.л., 1 Н); 13 С-ЯМР. [ДМСО] 118 (С-5); 120 (С-6); 120,5 (q, CF3); 144 (С-4); 161 (С-2); 166 (COONH2). Пример А 8N-Аллил-5-бром-2-оксо-6-(трифторметил)-1,2-дигидропиридин-3-карбоксамид А 8.1) Метиловый эфир 5-бром-2-оксо-6-(трифторметил)-1,2-дигидропиридин-3-карбоновой кислоты Суспензию 0,3 г (1,36 ммоль) метилового эфира 2-оксо-6-(трифторметил)-1,2-дигидропиридин-3 карбоновой кислоты в 10 мл ледяной уксусной кислоты смешивали при комнатной температуре с 0,36 г(2,04 ммоль) N-бромсукцинимида и затем кипятили 2 дня с обратным холодильником. После этого реакционную смесь смешивали с водой и экстрагировали дихлорметаном. Дальнейшую очистку после упаривания экстракта осуществляли с помощью препаративной ВЭЖХ. При этом получали 227 мг (56% от теоретич.) бесцветного порошка. 1 Н-ЯМР: [ДМСО] 3,85 (s, 3 Н); 8,45 (s, 1H); 12,80 (уш.л., 1H); 13 С-ЯМР.[ДМСО] 53 (ОСН 3); 105 (С-3); 148 (С-4); 161 (С-2); 164 (СООМе). А 8.2) N-Аллил-5-бром-2-оксо-6-(трифторметил)-1,2-дигидропиридин-3-карбоксамид Перемешивали 250 мг (0,83 ммоль) метил-5-бром-2-оксо-6-(трифторметил)-1,2-дигидропиридин-3 карбоксилата при комнатной температуре в 5 мл аллиламина в течение 18 ч. После чего путем добавления 2 н раствора соляной кислоты устанавливали рН 2, при этом выпадал бесцветный осадок. После отсасывания и высушивания получали 134 мг (50% от теоретич.) продукта. 1 Н-ЯМР: [ДМСО] 3,94 (t, 2H); 5,18 (dd, 2H); 5,89 (m, 1H); 8,52 (s, 1H); 8,85 (t, уш.л., 1 Н). Пример А 9 6-Дифторметил-N-изопропил-2-оксо-1,2-дигидропиридин-3-карбоксамид А 9.1) 4-Бутокси-1,1-дифторбут-3-ен-2-он При перемешивании при температуре 5 С смесь из 4,41 г (4,5 мл, 55,7 ммоль) пиридина и 5,7 г (55,7 ммоль) бутилвинилового эфира в 330 мл трихлорметана соединяли с 10,0 г (55,7 ммоль) ангидрида дифторуксусной кислоты. После чего перемешивали еще 15 ч при комнатной температуре. Затем реакци- 23020453 онную смесь смешивали с 300 мл воды, органическую фазу отделяли, сушили и упаривали. Получали 5,7 г (57% от теоретич.) желтоватого масла. 1 Н-ЯМР: [CDCl3] 0,95 (t, 3 Н); 1,42 (m, 2H); 1,72 (m, 2H); 4,00 (t, 2H); 5,78 (t, 1H); 5,90 (d, 1H); 7,85 (d,1H).A9.2) Метиловый эфир 6-(дифторметил)-2-оксо-1,2-дигидропиридин-3-карбоновой кислоты После растворения 1,21 г (52,9 ммоль) натрия в 200 мл метанола добавляли 7,9 г (44 ммоль) 4 бутокси-1,1-дифторбут-3-ен-2-она и 5,3 г (44 ммоль) метилмалонат-моноамида и смесь кипятили с обратным холодильником 15 ч. После упаривания смеси остаток смешивали с 100 мл 1 н раствора соляной кислоты. Полученный осадок отсасывали и сушили: 7,4 г (82% от теоретич.). 1 Н-ЯМР: [ДМСО] 3,82 (s, 3H); 6,85 (t, 1H); 7,02 (d, уш.л., 1H); 8,20 (d, 1H); 12,4 (уш.л., 1H). А 9.3) 6-(Дифторметил)-2-оксо-1,2-дигидропиридин-3-карбоновая кислота Растворяли 7,4 г (36,4 ммоль) метилового эфира 6-(дифторметил)-2-оксо-1,2-дигидропиридин-3 карбоновой кислоты в 100 мл метанола и смешивали с раствором 1,3 г (54,6 ммоль) гидроксида лития в 50 мл воды. После двухчасового кипячения с обратным холодильником смесь упаривали до объема примерно 50 мл и раствор промывали дихлорметаном. Затем подкисляли водную фазу 2 н раствором соляной кислоты и экстрагировали этилацетатом. После высушивания и упаривания экстракта оставалось 5,6 г(82% от теоретич.) коричневатого порошка. А 9.4) 6-(Дифторметил)-N-изопропил-2-оксо-1,2-дигидропиридин-3-карбоксамид После растворения 200 мг (1,1 ммоль) 6-(дифторметил)-2-оксо-1,2-дигидропиридин-3-карбоновой кислоты в 25 мл тетрагидрофурана и добавления 206 мг (1,3 ммоль) N,N-карбонилдиимидазола смесь выдерживали сначала 30 мин при комнатной температуре и затем 30 мин кипятили с обратным холодильником. После чего прибавляли по каплям раствор 66 мг (1,1 ммоль) изопропиламина в 5 мл тетрагидрофурана и кипятили смесь с обратным холодильником еще 2 ч. После упаривания раствора досуха прибавляли этилацетат, промывали 2 н раствором соляной кислоты и водой, сушили и упаривали. После очистки хроматографией на колонке получали 150 мг (61% от теоретич.) бесцветного порошка. 1 Н-ЯМР: [CDCl3] 1,25 (d, 6 Н); 4,22 (m, 1H); 6,55 (t, 1H); 6,69 (d, 1H); 8,64 (d, 1H); 9,42 (d, уш.л., 1 Н); 13,0 (уш.л., 1 Н). Пример А 10 6-(Гептафторпропил)-2-оксо-N-пропил-1,2-дигидропиридин-3-карбоксамид А 10.1) 1-Бутокси-4,4,5,5,6,6,6-гептафторгекс-1-ен-3-он При перемешивании при -10 С смесь из 8,11 г (102 ммоль) пиридина и 9,33 г (93,2 ммоль) бутилвинилового эфира в 200 мл дихлорметана объединяли с 21,7 г (93,2 ммоль) гептафторбутирилхлорида, растворенного в 50 мл дихлорметана. После чего перемешивали еще 15 ч при комнатной температуре. Затем соединяли смесь с 300 мл воды, органическую фазу отделяли, сушили и упаривали. Получали 28,2 г (82% от теоретич.) желтоватого масла, которое подвергали дальнейшим превращениям без дополнительной очистки. 1 Н-ЯМР: [CDCl3] 0,96 (t, 3 Н); 1,40 (m, 2H); 1,75 (m, 2H); 4,04 (t, 2H); 5,95 (d, 1H); 7,93 (d, 1H).A10.2) Метиловый эфир 6-(гептафторпропил)-2-оксо-1,2-дигидропиридин-3-карбоновой кислоты После растворения 2,63 г (114 ммоль) натрия в 250 мл метанола добавляли 28,2 г (95,5 ммоль) 1 бутокси-4,4,5,5,6,6,6-гептафторгекс-1-ен-3-она и 11,18 г (95,5 ммоль) метилмалонат-моноамида и смесь кипятили с обратным холодильником 18 ч. После упаривания реакционной смеси остаток смешивали с водой и промывали дихлорметаном. Затем добавлением 2 н раствора соляной кислоты подкисляли водную фазу до рН 2 и экстрагировали дихлорметаном. После высушивания, упаривания и очистки экстракта хроматографированием на колонке оставалось 15,2 г (49% от теоретич.) желтого порошка. 1 Н-ЯМР: [CDCl3] 4,06 (s, 3 Н); 7,35 (d, 1H); 8,40 (d, 1H); 11,4 (уш.л., 1H).A10.3) 6-(Гептафторпропил)-2-оксо-N-пропил-1,2-дигидропиридин-3-карбоксамид Кипятили с обратным холодильником в течение 5 ч 250 мг (0,78 ммоль) метил-6(гептафторпропил)-2-оксо-1,2-дигидропиридин-3-карбоксилата в 5 мл пропиламина. После чего добавлением 1 н раствора соляной кислоты устанавливали рН 2 и экстрагировали смесь дихлорметаном. После высушивания и упаривания получали 240 мг (88% от теоретич.) порошка бежевого цвета. 1 Н-ЯМР: [ДМСО] 0,90 (t, 3H); 1,54 (m, 2H); 3,25 (q, 2H); 7,41 (d, 1H); 8,40 (d, 1H); 8,85 (уш.л., 1 Н); 13,45 (уш.л., 1 Н).N-Метил-2-оксо-6-(1,1,2,2-тетрафторэтил)-1,2-дигидропиридин-3-карбоксамид А 11.1) 1-Бутокси-4,4,5,5-тетрафторпент-1-ен-3-он Смесь, состоящую из 14,4 г (182 ммоль) пиридина и 15,2 г (152 ммоль) бутилвинилового эфира в 250 мл дихлорметана, при перемешивании при 0 С объединяли с 25,0 г (152 ммоль) 3 Нтетрафторпропионилхлорида, растворенного в 20 мл дихлорметана. После чего перемешивали еще 15 ч при комнатной температуре. Затем смесь объединяли с 250 мл воды, органическую фазу отделяли, сушили и упаривали. Получали 12,5 г (36% от теоретич.) желтоватого масла. 1 Н-ЯМР: [CDCl3] 0,96 (t, 3 Н); 1,46 (m, 2H); 1,75 (m, 2 Н); 4,03 (t, 2 Н); 6,00 (d, 1H); 6,09 (tt, 1H); 7,90A11.2) Метиловый эфир 2-оксо-6-(1,1,2,2-тетрафторэтил)-1,2-дигидропиридин-3-карбоновой кислоты После растворения 1,39 г (60,3 ммоль) натрия в 500 мл метанола добавляли 11,5 г (50,3 ммоль) 1 бутокси-4,4,5,5-тетрафторпент-1-ен-3-она и 6,07 г (50,3 ммоль) метилмалонат-моноамида и смесь кипятили 6 ч с обратным холодильником. После упаривания реакционной смеси до объема около 100 мл смешивали ее с 500 мл 1 н раствора соляной кислоты и затем экстрагировали этилацетатом. После высушивания и упаривания получали 10,3 г (67% от теоретич.) желтоватой смолы. 1 Н-ЯМР: [CDCl3] 4,03 (s, 3 Н); 6,40 (tt, 1H); 7,38 (d, 1H); 8,39 (d, 1H).A11.3) N-Метил-2-оксо-6-(1,1,2,2-тетрафторэтил)-1,2-дигидропиридин-3-карбоксамид Перемешивали в течение 14 ч 300 мг (1,19 ммоль) метилового эфира 2-оксо-6-(1,1,2,2 тетрафторэтил)-1,2-дигидропиридин-3-карбоновой кислоты при комнатной температуре в 3,3 мл 40%ного водного раствора метиламина. После этого добавлением 1 н раствора соляной кислоты устанавливали рН 2 и экстрагировали дихлорметаном. После высушивания и упаривания экстракта получали 230 мг 2-Оксо-N-(2-пропинил)-6-(1,1,2,2-тетрафторэтил)-1,2-дигидропиридин-3-карбоксамид Перемешивали в течение 14 ч при комнатной температуре 300 мг (1,19 ммоль) метилового эфира 2 оксо-6-(1,1,2,2-тетрафторэтил)-1,2-дигидропиридин-3-карбоновой кислоты в 3,3 мл (41 ммоль) пропаргиламина. После чего добавлением 1 н раствора соляной кислоты устанавливали рН 2 и экстрагировали дихлорметаном. После высушивания и упаривания экстракта получали 280 мг (85% от теоретич.) продукта. 1 Н-ЯМР: [ДМСО] 3,15 (t, 1H); 4,13 (m, 2 Н); 6,82 (tt, 1 Н); 7,18 (уш.л., 1 Н); 8,41 (d, 1H); 9,35 (уш.л.,1 Н); 13,3 (уш.л., 1H). Пример А 13 5-Бром-6-(дифторметил)-N-(2-метокси-1-метилэтил)-2-оксо-1,2-дигидропиридин-3-карбоксамид А 13.1) Метиловый эфир 5-бром-6-(дифторметил)-2-оксо-1,2-дигидро-пиридин-3-карбоновой кислоты Растворяли 4,1 г (20 ммоль) метилового эфира 6-(дифторметил)-2-оксо-1,2-дигидропиридин-3 карбоновой кислоты в 20 мл N,N-диметилформамида и при комнатной температуре смешивали с 5,35 г(30 ммоль) N-бромсукцинимида. После двухчасового перемешивания реакционную смесь смешивали с водой и экстрагировали трет-бутилметиловым эфиром. Экстракт затем несколько раз промывали водой. После высушивания и упаривания получали в конце концов 3,7 г (65% от теоретич.) продукта. 1 Н-ЯМР: [ДМСО] 3,83 (s, 3 Н); 7,07 (t, 1 Н); 8,34 (s, 1H); 12,5 (s, уш.л, 1 Н). А 13.2) 5-Бром-6-(дифторметил)-N-(2-метокси-1-метилэтил)-2-оксо-1,2-дигидропиридин-3-карбоксамид Перемешивали при комнатной температуре 334 мг (1,19 ммоль) метилового эфира 5-бром-6- 25020453(дифторметил)-2-оксо-1,2-дигидропиридин-3-карбоновой кислоты в 3,3 мл (41 ммоль) 2-амино-1 мстоксипропана в течение 14 ч. После чего добавлением 1 н раствора соляной кислоты устанавливали рН 2 и экстрагировали дихлорметаном. После высушивания и упаривания экстракта получали 360 мг (89% от теоретич.) продукта. 1 Н-ЯМР: [CDCl3] 1,27 (d, 3 Н); 3,40 (s, 3 Н); 3,43 (m, 2H); 4,37 (m, 1H); 6,85 (t, 1H); 8,68 (s, 1H); 9,42 5-Бром-6-[хлор(дифтор)метил]-N-(циклопропилметил)-2-оксо-1,2-дигидропиридин-3-карбоксамид А 14.1) Метиловый эфир 5-бром-6-[хлор(дифтор)метил]-2-оксо-1,2-дигидропиридин-3-карбоновой кислоты Растворяли 1,30 г (5,47 ммоль) метилового эфира 6-[хлор(дифтор)метил]-2-оксо-1,2 дигидропиридин-карбоновой кислоты в 50 мл N,N-диметилформамида и смешивали при комнатной температуре с 1,46 г (8,21 ммоль) N-бромсукцинамида. После трехчасового перемешивания реакционную смесь смешивали с водой, при этом выпадал бесцветный осадок. После его отсасывания и высушивания получали 1,23 г (71% от теоретич.) продукта. 1 Н-ЯМР: [ДМСО] 3,85 (s, 3 Н); 8,45 (s, 1H); 12,7 (s, уш.л, 1H). А 14.2) 5-Бром-6-[хлор(дифтор)метил]-N-(циклопропилметил)-2-оксо-1,2-дигидропиридин-3 карбоксамид Растворяли при комнатной температуре 350 мг (1,11 ммоль) метилового эфира 5-бром-6[хлор(дифтор)метил]-2-оксо-1,2-дигидропиридин-карбоновой кислоты в 5 мл ацетонитрила и перемешивали с 0,5 мл аминометилциклопропана в течение 12 ч. После чего реакционную смесь соединяли с 1 н раствором соляной кислоты и отсасывали выпавший при этом осадок. После высушивания осадка его снова смешивали с 1 н раствором соляной кислоты, отсасывали и промывали водой. После высушивания получали 240 мг (62% от теоретич.) продукта. 1 Н-ЯМР: [ДМСО] 0,25 (m, 2 Н); 0,46 (m, 2 Н); 1,04 (m, 1 Н); 3,20 (t, 2H); 8,55 (s, 1H); 8,82 (t, уш.л.,1 Н); 13,6 (уш.л., 1 Н). Пример А 15 6-[Хлор(дифтор)метил]-N-(1-этилпропил)-5-иод-2-оксо-1,2-дигидропиридин-3-карбоксамид А 15.1) Метиловый эфир 6-[хлор(дифтор)метил]-5-иод-2-оксо-1,2-дигидропиридин-3-карбоновой кислоты Растворяли 10,0 г (42,1 ммоль) метилового эфира 6-[хлор(дифтор)метил]-2-оксо-1,2 дигидропиридинкарбоновой кислоты в 50 мл N,N-диметилформамида и при комнатной температуре смешивали с 6,32 г (63,1 ммоль) карбоната кальция и 20,5 г (126 ммоль) иодхлорида. После шестичасового перемешивания при 50 С реакционную смесь объединяли с водой, при этом выпадал бесцветный осадок, который промывали разбавленным раствором бисульфита натрия и водой. После отсасывания и высушивания получали 13,6 г (89% от теоретич.) продукта. 1 Н-ЯМР: [ДМСО] 3,84 (s, 3 Н); 8,61 (s, 1H); 12,6 (s, уш.л., 1 Н). А 15.2) 6-[Хлор(дифтор)метил]-N-(1-этилпропил)-5-иод-2-оксо-1,2-дигидропиридин-3-карбоксамид Растворяли 400 мг (1,1 ммоль) метилового эфира 6-[хлор(дифтор)метил]-5-иод-2-оксо-1,2 дигидропиридин-3-карбоновой кислоты при комнатной температуре в 5 мл ацетонитрила и перемешивали 12 ч с 0,5 мл 3-пентиламина. После чего объединяли реакционную смесь с 1 н раствором соляной кислоты, отсасывали выпавший при этом осадок и промывали его водой. После высушивания получали 370 мг (72% от теоретич.) продукта. 1 Н-ЯМР: [ДМСО] 0,87 (t, 6H); 1,43 (m, 2 Н); 1,55 (m, 2 Н); 3,78 (m, 1 Н); 8,55 (уш.л., 1 Н); 8,67 (s, 1 Н); 13,5 (уш.л., 1 Н). 5-Хлор-N,N-диэтил-6-(гептафторпропил)-2-оксо-1,2-дигидропиридин-3-карбоксамид А 16.1) Метиловый эфир 5-хлор-6-(гептафторпропил)-2-оксо-1,2-дигидропиридин-3-карбоновой кислоты Растворяли 16,7 г (52 ммоль) метилового эфира 6-(гептафторпропил)-2-оксо-1,2-дигидропиридин-3 карбоновой кислоты в 160 мл N,N-диметилформамида и при комнатной температуре смешивали с 7,08 г(52 ммоль) N-хлорсукцинимида. После трехчасового перемешивания при 50 С реакционную смесь соединяли с водой и экстрагировали несколько раз этилацетатом. Органическую фазу затем отделяли, промывали водой и сушили. Полученный сырой продукт после этого очищали препаративной обращенофазовой ВЭЖХ (RP-HPLC). Получали 10,1 г (54% от теоретич.) продукта в виде бесцветного порошка. 1 Н-ЯМР: [ДМСО] 3,85 (s, 3 Н); 8,35 (s, 1H); 12,8 (s, уш.л., 1 Н). А 16.2) 5 Хлор-6-(гептафторпропил)-2-оксо-1,2-дигидропиридин-3-карбоновая кислота Растворяли 1,54 г (4,33 ммоль) метилового эфира 5-хлор-6-(гептафторпропил)-2-оксо-1,2 дигидропиридин-3-карбоновой кислоты в 23 мл метанола и смешивали с раствором 0,16 г (6,5 ммоль) гидроксида лития в 13 мл воды. После двухчасового кипячения с обратным холодильником метанол отгоняли, а оставшийся водный раствор промывали дихлорметаном. После чего подкисляли водную фазу 2 н раствором соляной кислоты и экстрагировали дихлорметаном. После высушивания и упаривания экстракта получали 1,45 г (98% от теоретич.) коричневатого порошка. 1 Н-ЯМР: [ДМСО] 8,30 (s, 1H). А 16.3) 5-Хлор-N,N-диэтил-6-(гептафторпропил)-2-оксо-1,2-дигидропиридин-3-карбоксамид После растворения 355 мг (1,04 ммоль) 5-хлор-6-(гептафторпропил)-2-оксо-1,2-дигидропиридин-3 карбоновой кислоты в 30 мл тетрагидрофурана и добавления 337 мг (2,08 ммоль) N,Nкарбонилдиимидазола смесь выдерживали сперва 30 мин при комнатной температуре и затем 30 мин кипятили с обратным холодильником. После чего добавляли 152 мг (0,22 мл, 2,08 ммоль) диэтиламина и кипятили реакционную смесь с обратным холодильником еще 2 ч. После упаривания раствора досуха добавляли дихлорметан, промывали 1 н раствором соляной кислоты и водой, сушили и упаривали. Получали 300 мг (72% от теоретич.) продукта. 1 Н-ЯМР: [ДМСО] 1,03 (t, 3H); 1,15 (t, 3H); 3,12 (q, 2H); 3,45 (q, 2H); 8,05 (s, 1H); 12,5 (уш.л., 1 Н). Пример А 17 6-(2-Хлор-1,1,2,2-тетрафторэтил)-N-этил-2-оксо-1,2-дигидропиридин-3-карбоксамид А 17.1) 1-Бутокси-5-хлор-4,4,5,5-тетрафторпент-1-ен-3-он При перемешивании при 0 С смесь из 3,97 г (50,2 ммоль) пиридина и 5,03 г (50,2 ммоль) бутилвинилового эфира в 80 мл хлороформа объединяли с 10,0 г (50,2 ммоль) 3 хлортетрафторпропионилхлорида, растворенного в 20 мл хлороформа. После чего перемешивали еще 15 ч при комнатной температуре. Затем реакционную смесь соединяли с 100 мл воды, органическую фазу отделяли, сушили и упаривали. Получали 10,4 г (78% от теоретич.) желтоватого масла. 1 Н-ЯМР: [CDCl3] 0,96 (t, 3 Н); 1,43 (m, 2H); 1,75 (m, 2H); 4,04 (t, 2H); 5,97 (d, 1H); 7,91 (d, 1H).A17.2) Метиловый эфир 6-(2-хлор-1,1,2,2-тетрафторэтил)-2-оксо-1,2-дигидропиридин-3-карбоновой кислоты После растворения 0,32 г (13,7 ммоль) натрия в 50 мл метанола добавляли 3,0 г (11,4 ммоль) 1 бутокси-5-хлор-4,4,5,5-тетрафторпент-1-ен-3-она и 1,34 г (11,4 ммоль) метилмалонат-моноамида и кипятили смесь 6 ч с обратным холодильником. После упаривания реакционной смеси до объема примерно 30 мл е смешивали с 50 мл 1 н раствора соляной кислоты и затем экстрагировали несколько раз этилацетатом. После высушивания и упаривания полученный остаток смешивали с диэтиловым эфиром и фильтровали. После упаривания фильтрата получали 1,74 г (52% от теоретич.) желтоватого порошка. 1 Н-ЯМР: [ДМСО] 3,84 (s, 3 Н); 7,44 (d, 1H); 8,32 (d, 1H); 12,4 (уш.л., 1H). А 17.3) 6-(2-Хлор-1,1,2,2-тетрафторэтил)-N-этил-2-оксо-1,2-дигидропиридин-3-карбоксамид Перемешивали 300 мг (1,04 ммоль) метилового эфира 6-(2-хлор-1,1,2,2-тетрафторэтил)-2-оксо-1,2 дигидропиридин-3-карбоновой кислоты при комнатной температуре в 5 мл водного раствора этиламина(70%) в течение 14 ч. После чего добавлением 1 н раствора соляной кислоты устанавливали рН 2 и экстрагировали дихлорметаном. После высушивания и упаривания экстракта получали 310 мг (98% от теоре- 27020453 5-Бром-6-(2-хлор-1,1,2,2-тетрафторэтил)-2-оксо-1,2-дигидропиридин-3-карбоксамид А 18.1) 6-(2-Хлор-1,1,2,2-тетрафторэтил)-2-оксо-1,2-дигидропиридин-3-карбоксамид После растворения 0,53 г (22,8 ммоль) натрия в 50 мл метанола добавляли 5,0 г (19,0 ммоль) 1 бутокси-5-хлор-4,4,5,5-тетрафторпент-1-ен-3-она и 2,0 г (19,0 ммоль) диамида малоновой кислоты и кипятили реакционную смесь с обратным холодильником 6 ч. После упаривания смеси остаток смешивали с 1 н раствором соляной кислоты. Выпавший при этом осадок отсасывали и сушили. Получили 3,8 г (73% от теоретич.) коричневатого порошка. 1 Н-ЯМР: [ДМСО] 7,42 (уш.л., 1H); 8,10 (уш.л., 1H); 8,40 (уш.л., 1H); 8,46 (d, 1H); 13,6 (уш.л., 1H). А 18.2) 5-Бром-6-(2-хлор-1,1,2,2-тетрафторэтил)-2-оксо-1,2-дигидропиридин-3-карбоксамид Растворяли 0,49 г (1,8 ммоль) 6-(2-хлор-1,1,2,2-тетрафторэтил)-2-оксо-1,2-дигидропиридин-3 карбоксамида в 5 мл N,N-диметилформамида и при комнатной температуре смешивали с 0,48 г (2,7 ммоль) N-бромсукцинимида. После двухчасового перемешивания при комнатной температуре добавляли к реакционной смеси воду, при этом выпадал осадок. После отсасывания, промывания водой и высушивания получали 610 мг (96% от теоретич.) продукта в виде желтоватого порошка. 1 Н-ЯМР: [ДМСО] 8,25 (уш.л., 1H); 8,35 (уш.л., 1H); 8,61 (s, 1 Н); 13,7 (уш.л., 1H). Пример А 19 6-(1-Хлор-1,2,2,2-тетрафторэтил)-2-оксо-1,2-дигидропиридин-3-карбоксамид А 19.1) 1-Бутокси-4-хлор-4,5,5,5-тетрафторпент-1-ен-3-он Смесь из 4,19 г (50,0 ммоль) пиридина и 4,83 г (48,2 ммоль) бутилвинилового эфира в 75 мл дихлорметана смешивали по каплям при перемешивании при 0 С с 9,59 г (48,2 ммоль) 2 хлортетрафторпропионилхлорида. После чего перемешивали еще 15 ч при комнатной температуре. Затем реакционную смесь промывали 1 н раствором соляной кислоты и 2100 мл воды, органическую фазу отделяли, сушили и упаривали. Получали 6,33 г (50% от теоретич.) коричневого масла. 1 Н-ЯМР: [CDCl3] 0,97 (t, 3 Н); 1,48 (m, 2H); 1,75 (m, 2H); 4,03 (t, 2H); 5,98 (d, 1H); 7,89 (d, 1H).A19.2) 6-(1-Хлор-1,2,2,2-тетрафторэтил)-2-оксо-1,2-дигидропиридин-3-карбоксамид После растворения 0,33 г (14,4 ммоль) натрия в 50 мл метанола добавляли 3,16 г (12,03 ммоль) 1 бутокси-4-хлор-4,5,5,5-тетрафторпент-1-ен-3-она и 1,27 г (12,03 ммоль) диамида малоновой кислоты и реакционную смесь кипятили 7 ч с обратным холодильником. После упаривания смеси к ней добавляли 1 н раствор соляной кислоты. Выпавший при этом осадок отсасывали и сушили. Получили 380 мг (12% от теоретич.) желтоватого порошка. 1 Н-ЯМР: [ДМСО] 7,45 (d, 1 Н); 8,14 (уш.л., 1 Н); 8,42 (уш.л., 1H); 8,48 (d, 1H); 13,7 (уш.л., 1H). В нижеследующей табл. 1 приведен для примера ряд соединений общей формулы (I), которые могут быть получены по аналогии с приведенными выше примерами от A1 до A10 и с использованием вышеупомянутых методов. Аббревиатуры в таблице означают В соответствии с этим для сложных выражений действительны такие сокращения, как Если в таблице алкильный остаток приведен без других обозначений, то речь идет о неразветвленном алкильном остатке, т.е., например, Bu = н-Bu = н-бутил. Числовые индексы в формульных выражениях в таблице не приведены снизу, а расположены в той же высоте строки и приведены тем же размером шрифта, как и атомный символ. Например, формула CF3 в таблице соответствует формуле CF3 в соответствии с обычным способом написания с подстрочными индексами или формула СН 2 СН(СН 2 СН 3)2 соответствует формуле СН 2 СН(СН 2 СН 3)2 с подстрочными индексами. Для некоторых соединений (I) из табл. 1 указаны физико-химические данные в табл. 2 (как правило,данные спектров 1 Н-ЯМР). Отнесение данных к соединениям при этом происходит по номеру примера в соответствии с табл. 1. Таблица 1. Соединения формулы (I)
МПК / Метки
МПК: C07D 417/06, C07D 413/06, A01P 13/00, C07D 213/82, A01N 25/32, C07D 401/06
Метки: растений, применение, полезных, действия, защиты, избирательной, вредными, культурах, борьбы, побочного, фитотоксического, способ, средства, растениями, пиридонкарбоксамиды, агрохимикатов
Код ссылки
<a href="https://eas.patents.su/30-20453-piridonkarboksamidy-i-ih-primenenie-sredstva-zashhity-rastenijj-sposob-zashhity-poleznyh-rastenijj-ot-fitotoksicheskogo-pobochnogo-dejjstviya-agrohimikatov-sposob-izbiratelnojj-bor.html" rel="bookmark" title="База патентов Евразийского Союза">Пиридонкарбоксамиды и их применение, средства защиты растений, способ защиты полезных растений от фитотоксического побочного действия агрохимикатов, способ избирательной борьбы с вредными растениями в культурах полезных растений</a>
Предыдущий патент: Способ обработки твердых продуктов сгорания угля
Следующий патент: Производные бензофурана в качестве fxr модуляторов
Случайный патент: Защитное сооружение с большепролетным светопрозрачным покрытием


































