Производные циклогександиона и содержащие их гербициды
Номер патента: 1884
Опубликовано: 22.10.2001
Авторы: Насуно Итиро, Ямамото Хироси, Камано Хидеки, Коике Казуеси
Формула / Реферат
1. Производное циклогександиона общей формулы
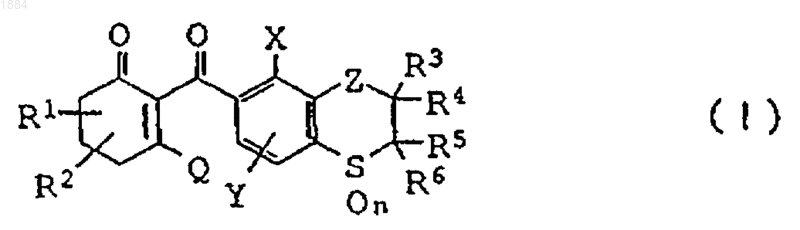
или его соль,
в которой каждая из групп от R1 до R6 независимо означает атом водорода или C1-C6 алкильную группу,
n равно 2,
Х означает C1-C6 алкильную группу, C1-C6 галогеналкильную группу или атом галогена,
Y означает атом водорода, C1-C6 алкильную группу или атом галогена,
Z означает группу (а) или (b)

в которой каждая из групп R7 и R8 независимо означает атом водорода, C1-C6 алкильную группу или C1-C6 алкоксигруппу,
при условии что, когда группы R7, R8 или обе являются C1-C6 алкильной или C1-C6 алкоксильной группой (группами), от 1 до 13 атомов водорода в них могут быть замещены от 1 до 13 атомами галогена или C1-C6 алкоксильными группами,
и что, когда число атомов углерода в них составляет C2-C6, эта группа (группы) могут содержать ненасыщенную связь, и
когда число атомов углерода в них составляет C3-C6, группа (группы) могут иметь циклическую структуру, и
при условии, что, когда оба R7 и R8 являются алкильными группами, исключаются соединения общей формулы (I), в которых Х означает C1-C6 алкильную группу, атом галогена или галогеналкильную группу и все группы R3, R4, R5 и R6 являются атомами водорода;
и при условии, что, когда одна из групп R7 и R8 является алкоксильной группой и когда другая является атомом водорода, исключаются соединения общей формулы (I), в которой Х является C1-C6 алкильной группой, а все группы R3, R4, R5 и R6 являются атомами водорода, когда атом водорода алкоксильной группы не замещен галогеном или когда алкоксильная группа не содержит ненасыщенной связи или циклической структуры; и
R9 означает атом кислорода или C1-C6 алкоксииминогруппу, при условии, что исключаются соединения общей формулы (I), в которой Х означает C1-C6 алкильную группу и все группы R3, R4, R5 и R6 являются атомами водорода, когда R9 является алкоксииминогруппой и когда ее атом водорода не замещен галогеном или алкоксииминогруппа не содержит ненасыщенной связи, и
Q означает гидроксильную группу или группу (с)
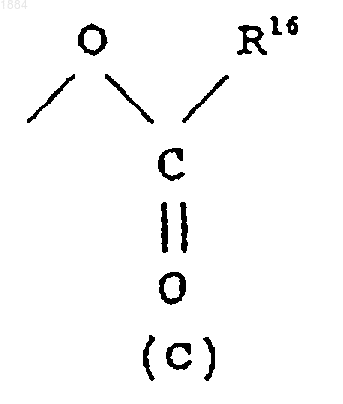
в которой R16 означает C1-C6 алкильную группу.
2. Производное циклогександиона общей формулы
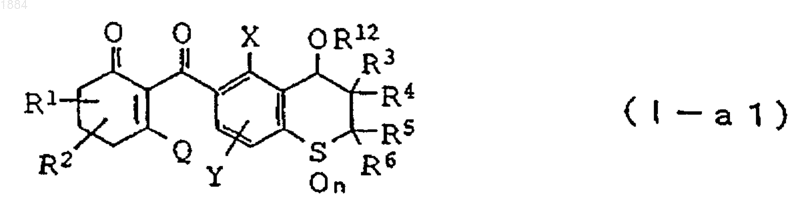
в которой каждая из групп от R1 до R6 независимо означает атом водорода или C1-C6 алкильную группу,
n равно 2,
Х означает C1-C6 алкильную группу, C1-C6 галогеналкильную группу или атом галогена,
Y означает атом водорода, C1-C6 алкильную группу или атом галогена,
R12 является C1-C6 алкильной группой или C1-C6 галогеналкильной группой,
при условии, что R12 может быть замещена C1-C6 алкоксигруппой, и что, когда число атомов углерода в R12 составляет C2-C6, R12 может содержать ненасыщенную связь, и что, когда число атомов углерода в R12 составляет C1-C6, R12 может иметь циклическую структуру, и далее, когда R12 является C1-C6 алкильной группой, исключаются соединения общей формулы (I-а1), в которых Х означает C1-C6 алкильную группу и все R3, R4, R5 и R6 являются атомами водорода, и
Q означает гидроксильную группу или группу (с)
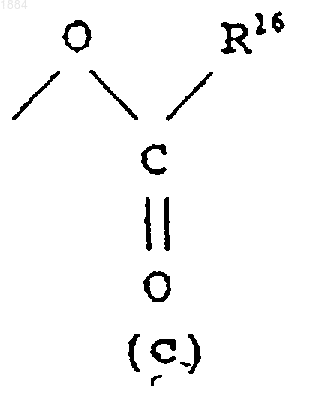
в которой R16 означает C1-C6 алкильную группу или его соль.
3. Производное циклогександиона общей формулы
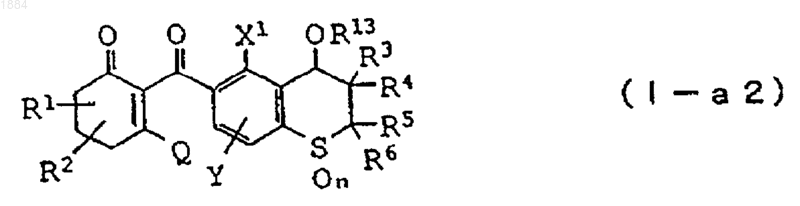
в которой каждая из групп от R1 до R6 независимо означает атом водорода или C1-C6 алкильную группу, R13 означает C1-C6 алкильную группу,
n равно 2,
X1 означает C1-C6 галогеналкильную группу или атом галогена,
Y означает атом водорода, C1-C6 алкильную группу или атом галогена,
Q является гидроксильной группой или группой (с)
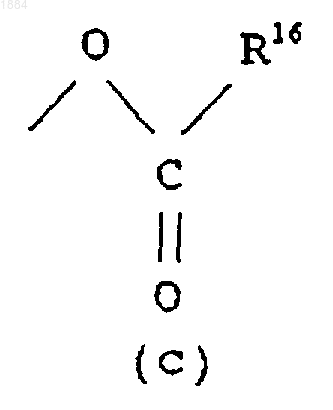
в которой R16 означает C1-C6 алкильную группу или его соль.
4. Производное циклогександиона общей формулы
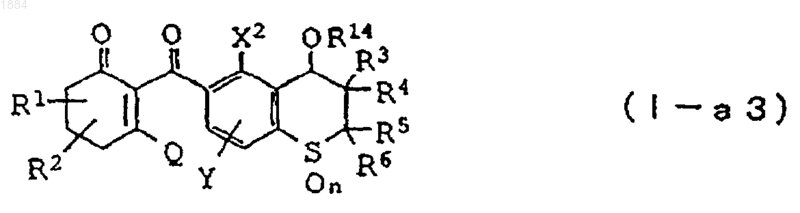
в которой каждая из групп от R1 до R6 независимо означает атом водорода или C1-C6 алкильную группу, R14 означает C1-C6 галогеналкильную группу, алкоксиалкильную группу, алкенильную группу или алкинилалкильную группу,
n равно 2,
X2 означает C1-C6 алкильную группу, C1-C6 галогеналкильную группу или атом галогена,
Y означает атом водорода, C1-C6 алкильную группу или атом галогена,
Q является гидроксильной группой или группой (с)
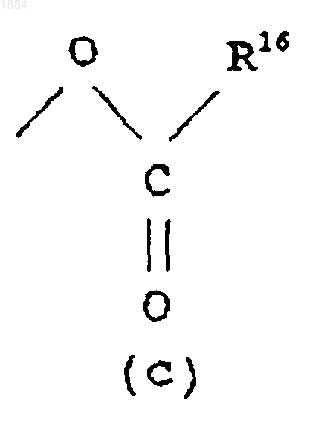
в которой R16 означает C1-C6 алкильную группу или его соль.
5. Производное циклогександиона общей формулы
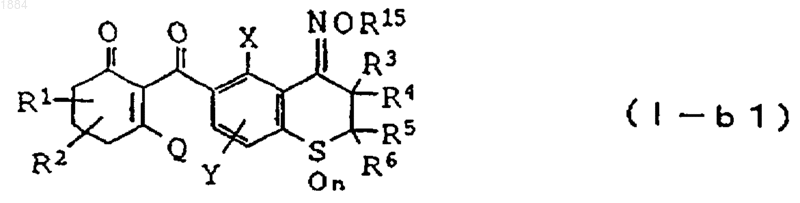
в которой каждая из групп от R1 до R6 независимо означает атом водорода или C1-C6 алкильную группу, R15 означает C1-C6 алкильную группу или C1-C6 алкенильную группу,
n равно 2,
Х означает C1-C6 алкильную группу, C1-C6 галогеналкильную группу или атом галогена,
Y означает атом водорода, C1-C6 алкильную группу или атом галогена,
при условии, что, когда R15 является C1-C6 алкильной группой, исключаются соединения общей формулы (I-b1), в которых Х является C1-C6 алкильной группой и все группы R3, R4, R5 и R6 являются атомами водорода, и
Q является гидроксильной группой или группой (с)
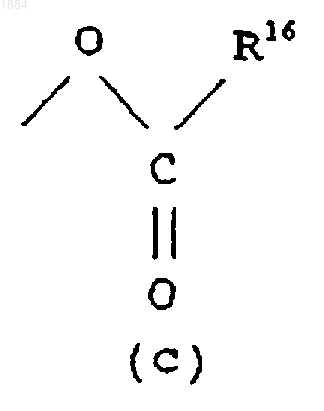
в которой R16 означает C1-C6 алкильную группу или его соль.
6. Производное циклогександиона общей формулы
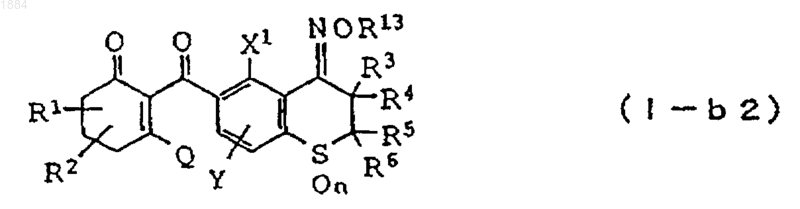
в которой каждая из групп от R1 до R6 независимо означает атом водорода или C1-C6 алкильную группу, R13 означает C1-C6 алкильную группу,
n равно 2,
X1 означает C1-C6 галогеналкильную группу или атом галогена,
Y означает атом водорода, C1-C6 алкильную группу или атом галогена,
Q является гидроксильной группой шыш группой (с)
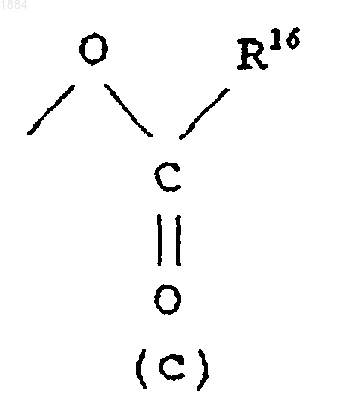
в которой R16 означает C1-C6 алкильную группу или его соль.
7. Производное циклогександиона общей формулы
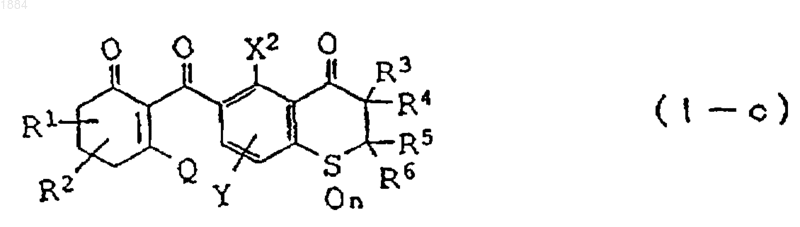
в которой каждая из групп от R1 до R6 независимо означает атом водорода или C1-C6 алкильную группу,
n равно 2,
X2 означает C1-C6 алкильную группу, C1-C6 галогеналкильную группу или атом галогена,
Y означает атом водорода, C1-C6 алкильную группу или атом галогена,
Q является гидроксильной группой или группой (с)
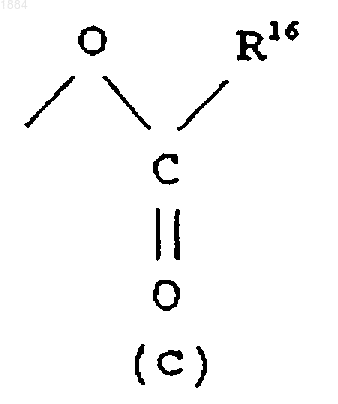
в которой R16 означает C1-C6 алкильную группу или его соль.
8. Производное циклогександиона по любому из пп.1-7, в котором каждая из групп R3, R4, R5 и R6 независимо означают атом водорода или метил.
9. Производное циклогександиона по любому из пп.1-7, в котором Y замещает 8 положение тиохроманового кольца.
10. Гербицид, содержащий в качестве активного ингредиента производное циклогександиона или его солей, перечисленных в любом из пп.1-9 формулы изобретения.
Текст
1 Область техники, к которой относится изобретение Настоящее изобретение относится к производным циклогександиона и содержащим их гербицидам, более конкретно, к производным циклогександиона, которые могут подавлять широкий набор сорняков нагорных полей при низкой дозе, не вызывая фитотоксичности по отношению к сельскохозяйственным культурам,таким как кукуруза, и к содержащим их гербицидам. Известный уровень техники Гербициды являются очень важными химическими продуктами для экономии труда в процессах, связанных с регуляцией количества сорняков, и для совершенствования производства сельскохозяйственных культур. В связи с этим гербициды были предметом энергичных и продолжающихся в течение долгого времени исследований, и в настоящее время в практическом использовании находится широкий набор таких препаратов. Однако до сих пор сохраняется необходимость в принципиально новых гербицидах, обладающих превосходящими прежние гербицидными свойствами, особенно в гербицидах, способных селективно контролировать только целевые сорняки при низких дозах, не проявляя фитотоксичности по отношению к выращиваемым культурам. Во время посадки кукурузы традиционно используются триазинсодержащие гербициды,такие как атразин, и гербициды, содержащие анилиды кислот, такие как алахлор и метолахлор. Однако атразин проявляет низкую эффективность к злаковым сорнякам, и с другой стороны, алахлор и метолахлор проявляют низкую эффективность к широколистным сорнякам. Поэтому в настоящее время трудно контролировать и злаковые, и широколистные сорняки одновременно одним единственным гербицидом. Кроме того, эти гербициды неудовлетворительны с точки зрения проблемы окружающей среды из-за необходимости применения высоких доз. В связи с вышесказанными обстоятельствами авторами настоящего изобретения разработаны новые производные циклогександиона с тиохромановым кольцом, и поданы патентные заявки (WO 94/04524 и WO 94/08988). Типичными примерами этих соединений являются следующие. Соединения, описанные в WO 94/04524 Были раскрыты в качестве производного циклогександиона с бициклической структурой следующие соединения (Европейский патент 94/28326.1) Однако нельзя утверждать, что вышеприведенные соединения обладают достаточной активностью, как при обработке до появления всходов, так и при обработке после их появления, так как они проявляют фитотоксичность к сорго и к свекле. Раскрытие сущности изобретения Целью настоящего изобретения в связи со всем вышесказанным является создание неописанного производного циклогександиона, которое может контролировать (подавлять) широкий набор сорняков нагорных полей при низкой дозе, не вызывая фитотоксичности к таким культурам, как кукуруза, и создание содержащего его гербицида. Авторы настоящего изобретения провели тщательные исследования для достижения вышеназванной цели и установили, что производное циклогександиона с конкретной структурой способно контролировать широкий набор наземных сорняков при низкой дозе, не вызывая фитотоксичности к таким культурам, как кукуруза, и настоящее изобретение полностью осуществлено на основании того, что приведено выше. Таким образом, первая цель настоящего изобретения достигнута с помощью одного из(1) производных циклогександиона общей формулы в которой каждый из R1 и R2 независимо означает атом водорода или C1-C6 алкильную группу,каждый из от R3 до R6 независимо означает атом водорода, C1-C6 алкильную группу, C1-C6 галогеналкильную группу или атом водорода,n равно 0, 1 или 2,Х означает C1-C6 алкильную группу, C1-C6 галогеналкильную группу, атом галогена, C1-C6 алкоксигруппу, C1-C6 галогеналкоксильную группу, C2-C6 алкоксиалкильную группу, C1-C6 алкилтиогруппу, C1-C6 галогеналкилтиогруппу,C1-C6 алкилсульфинильную группу или C1-C6 алкилсульфонильную группу,Y означает атом водорода, C1-C6 алкильную группу, C1-C6 галогеналкильную группу, 3 атом галогена, C1-C6 алкоксильную группу, C1C6 галогеналкоксильную группу или C2-C6 алкоксиалкильную группу,Z означает группу (а) или (b) в которой каждый из R7 и R8 независимо означают атом водорода, атом галогена, C1-C6 алкильную группу, C1-C6 алкоксильную группу,C1-C6 алкилтиогруппу или группу -NR10R11, при условии, что, когда группы R7, R8 или обе являются C1-C6 алкильной, C1-C6 алкоксильной илиC1-C6 алкилтиогруппой (группами), от 1 до 13 их атомов водорода могут быть замещены от 1 до 13 атомами галогена или C1-C6 алкоксильными группами,и что, когда число их атомов углерода составляет C2-C6, эта группа (группы) могут содержать ненасыщенную связь,и когда число атомов углерода составляетC3-C6, группа (группы) могут иметь циклическую структуру,каждая из R10 и R11 означает атом водорода, C1-C6 алкильную группу или C1-C6 алкилкарбонильную группу, при следующем условии,что, когда обе R7 и R8 являются C1-C6 алкильными группами, C1-C6 алкоксильными группами или C1-C6 алкилтиогруппами, то атомы углерода в R7 и R8 могут быть связаны друг с другом с образованием от 3- до 7-членного цикла, при условии, что, когда оба R7 и R8 являются алкильными группами, исключаются соединения общей формулы (I), в которых Х означает C1-C6 алкильную группу, атом галогена или галоалкильную группу и все R3, R4, R5 и R6, являются атомами водорода; при условии, что, когда один из R7 и R8 является алкоксильной группой и когда другой является атомом водорода, исключаются соединения общей формулы (I), в которой Х являетсяC1-C6 алкильной группой, а все R3, R4, R5 и R6 являются атомами водорода, когда атом водорода алкоксильной группы не замещен галогеном или алкоксильной группой или когда алкоксильная группа не содержит ненасыщенной связи или циклической структуры, иC1-C6 алкоксииминогруппу, при условии, что,когда R9 означает C1-C6 алкоксииминогруппу, а от 1 до 13 их атомов водорода могут быть замещены от 1 до 13 атомами галогена, и когда число атомов углерода в R9 составляет C2-C6, то C1C6 алкоксииминогруппа может содержать ненасыщенную связь, и при условии, что исключаются соединения общей формулы (I), в которой Х означает C1-C6 алкильную группу и все группы R3, R4, R5 и R6 являются атомами водорода,когда R9 является алкоксииминогруппой и когда ее атом водорода не замещен галогеном или 4 алкоксииминогруппа не содержит ненасыщенной связи, иQ означает гидроксильную группу или группу (с) или (d) в которой каждый из R16 и R17 означает C1-C6 алкильную группу, C1-C6 галогеналкильную группу или фенильную группу, которая может быть замещена C1-C6 алкильной группой, C1-C6 галогеналкильной группой, атомом галогена,цианогруппой или нитрогруппой, а m равно 0, 1 и 2, или его соли;(2) производных циклогександиона общей формулы в которой группы от R1 до R6, n, X, Y и Q определены выше, а R12 является C1-C6 алкильной группой или C1-C6 галогеналкильной группой,при условии, что R12 может быть замещена C1C6 алкоксильной группой, и что когда число атомов углерода в R12 составляет C2-C6, то R12 может содержать ненасыщенную связь, и что когда число атомов углерода в R12 составляетC3-C6, R12 может включать циклическую структуру, и, кроме того, когда R12 является C1-C6 алкильной группой, исключаются соединения общей формулы (I-а 1), в которых Х означает C1C6 алкильную группу и все R3, R4, R5 и R6 являются атомами водорода, или их солей;(3) производных циклогександиона общей формулы в которых группы от R1 до R6, n, Y и Q определены выше, R13 означает алкильную группу, и Х означает C1-C6 галогеналкильную группу, атом галогена, C1-C6 алкоксильную группу, C1-C6 галогеналкоксильную группу, C2-C6 алкоксиалкильную группу, C1-C6 алкилтиогруппу, C1-C6 галоалкилтиогруппу, C1-C6 алкилсульфинильную группу или C1-C6 алкилсульфонильную группу, или их солей;(4) производных циклогександиона общей формулы 5 в которой значения от R1 до R6, n, Y и Q такие,как указано выше, а R14 означает C1-C6 галогеналкильную группу, алкоксиалкильную группу,алкенильную группу, галогеналкенилалкильную группу или алкинилалкильную группу, а X2 является C1-C6 алкильной группой, C1-C6 галогеналкильной группой, атомом галогена, C1-C6 алкоксигруппой, C1-C6 галогеналкоксигруппой,C2-C6 алкоксиалкильной группой, C1-C6 алкилтиогруппой, C1-C6 галогеналкилтиогруппой, C1C6 алкилсульфинильной группой или C1-C6 алкилсульфонильной группой, или их солями;(5) производных циклогександиона общей формулы в которой группы от R1 до R6, n, X, Y и Q определены выше, R15 означает C1-C6 алкильную группу или C1-C6 алкенильную группу, при условии, что R15 является C1-C6 алкильной группой, исключаются соединения общей формулы(6) производных циклогександиона общей формулы в которой группы от R1 до R6, R13, n, Х 1, Y и Q определены выше, или их солей; и(7) производных циклогександиона общей формулы в которой группы от R1 до R6, n, X2, Y и Q определены выше, или их солей. Кроме того, вторая цель настоящего изобретения достигается гербицидом (который иногда здесь и далее обозначен как "гербицид по настоящему изобретению"), содержащим, по крайней мере, одно из производных циклогександиона вышеприведенной общей формулы (I),(I-а 1), (I-а 2), (I-а 3), (I-b1), (I-b2) и (I-с) и их соли. Лучшие варианты воплощения изобретения Производное циклогександиона настоящего изобретения будет определено в первую очередь. Производное циклогександиона настоящего изобретения имеет общую формулу 6 В общей формуле (I) X означает C1-C6 алкильную группу, C1-C6 галогеналкильную группу, атом галогена, C1-C6 алкоксильную группу,C1-C6 галогеналкоксильную группу, C2-C6 алкоксиалкильную группу, C1-C6 алкилтиогруппу,C1-C6 галогеналкилтиогруппу, C1-C6 алкилсульфинильную группу или C1-C6 алкилсульфонильную группу. Примеры вышеназванных C1-C6 алкильных групп включают метил, этил, пропил, бутил,пентил и гексил, и пропил, бутил, пентил и гексил могут быть нормальными, циклическими или разветвленными. C1-C6 галогеналкильная группа является группой, образованной замещением от 1 до 13 атомов водорода из указаннойC1-C6 алкильной группы от 1 до 13 атомами галогена (например, хлором, фтором, бромом и иодом). Их конкретные примеры включают-СF3, -C2F5, -C2H4F, -СН 2 Сl, -CHF2, -ССl3,-С 2 Н 3 Сl2, -С 2 Н 3F2, -С 2 Н 2F3, -С 2 Н 2 Сl3, -С 3 Н 6F,-C4H8F, -CH2Br, -CH2I, -С 3 Н 4F3 и -С 4H6F3. Атомы галогена включают хлор, фтор, бром и иод. Конкретные примеры C1-C6 алкоксигрупп включают метокси, этокси, пропокси, бутокси,пентокси и гексоксигруппы, и группы пропокси,бутокси, пентокси и гексокси могут быть нормальными, циклическими или разветвленными.C1-C6 галогеналкоксигруппа является группой,образованной замещением от 1 до 13 атомов водорода в указанной C1-C6 алкоксигруппе на от 1 до 13 атомов галогена (например, хлора, фтора, брома и иода). Их примеры включают группы -OCF3, -OC2F5, -OC2H4F, -OC2H4Cl, -OCHF2,-OCH2F, -ОССl3, -ОС 2 Н 3 Сl2, -ОС 2 Н 3F2, -ОСН 2 Вr и -OCH2I.C2-C6 алкоксиалкильная группа означает группу, образованную замещением одного атома водорода в указанной алкильной группе наC1-C6 алкоксигруппу (какую-нибудь из одной групп метокси, этокси, н-пропокси, изопропокси, н-бутокси, изо-бутокси, втор-бутокси,трет-бутокси, н-гексокси, изо-гексокси, вторгексокси и трет-гексокси). Их конкретные примеры включают-СН(СН 3)СH2 ОСН 3. Конкретные примеры C1-C6 алкилтиогрупп включают следующие группы: метилтио, этилтио, пропилтио, бутилтио, пентилтио и гексилтио, и группы пропилтио, бутилтио, пентилтио и гексилтио могут быть нормальными, циклическими или разветвленными. C1-C6 галогеналкилтиогруппа означает группу, образованную замещением от 1 до 13 атомов водорода в указанной C1-C6 алкилтиогруппе на от 1 до 13 атомов галогена (например, хлора, фтора, брома или иода). Их примеры включают группы -SСF3,-SC2F5, -SC2H4F, -SC2H4Cl, -SCHF2, -SCH2F,-SССl3, -SС 2 Н 3 Сl2, -SС 2 Н 3F2, -SCH2Br и -SCH2I. 7 Конкретные примеры C1-C6 алкилсульфинильной группы включают следующие группы: метилсульфинил, этилсульфинил, пропилсульфинил, бутилсульфинил, пентилсульфинил и гексилсульфинил, и группы пропилсульфинил,бутилсульфинил, пентилсульфинил и гексилсульфинил могут быть нормальными, циклическими или разветвленными. Примеры C1-C6 алкилсульфонильной группы включают группы метилсульфонил, этилсульфонил, пропилсульфонил, бутилсульфонил, пентилсульфонил и гексилсульфонил, и группы пропилсульфонил,бутилсульфонил, пентилсульфонил и гексилсульфонил могут быть нормальными, циклическими или разветвленными. Х означает предпочтительно C1-C6 алкильную группу, C1-C6 галогеналкильную группу или атом галогена, более предпочтителен метил,хлор или -СF3.Y означает атом водорода, C1-C6 алкильную группу, C1-C6 галоалкильную группу, атом галогена, C1-C6 алкоксильную группу, C1-C6 галогеналкоксильную группу и C2-C6 алкоксиалкильную группу. Указанная C1-C6 алкильная группа, C1-C6 галогеналкильная группа, атом галогена, C1-C6 алкоксильная группа, C1-C6 галогеналкоксильная группа, или C2-C6 алкоксиалкильная группа включает те же группы, которые были определены в отношении указанных групп X. Положение заместителя Y это 7 или 8 позиция тиохроманового кольца, особенно предпочтительно 8 положение. Y предпочтительно означает атом водорода, C1-C6 алкильную группу или атом галогена, особенно предпочтителен водород,метил или хлор. Каждая из групп R1 и R2 независимо являются атомом водорода или C1-C6 алкильной группой, и каждая из групп R3, R4, R5 и R6 независимо означают атом водорода, C1-C6 алкильную группу, C1-C6 галогеналкильную группу или атом галогена. Конкретными примерами вышеуказанных C1-C6 алкильных групп, C1-C6 галогеналкильных групп и атома галогена являются те же, которые были определены в отношении X. Предпочтительно, чтобы каждая из группR3, R4, R5 и R6 независимо означали атом водорода или C1-C6 алкильную группу, такую как метил, особенно предпочтительны атом водорода или метил. Обозначение n относится к числу атомов кислорода, связанных с атомом серы тиохроманового кольца, и принимает значения, равные 0 В группе (а) в определении Z каждая из групп R7 и R8 независимо означает атом водорода, атом галогена, C1-C6 алкильную группу, C1C6 алкоксильную группу, C1-C6 алкилтиогруппу или группу -NR10R11. Когда R7, R8 или обе эти группы означают C1-C6 алкил, C1-C6 алкокси или C1-C6 алкилтиогруппу (группы), от 1 до 13 атомов водорода этой группы (этих групп) могут быть замещены от 1 до 13 атомами галогена или C1-C6 алкоксигруппами, и когда число атомов углерода этой группы (групп) составляетC2-C6, эта группа (группы) может содержать ненасыщенные связи. Кроме того, когда вышеуказанное число равно C3-C6, группа (группы) может иметь циклическую структуру. Каждая изR10 и R11 означает атом водорода, C1-C6 алкильную группу, или C1-C6 алкилкарбонильную группу. Далее, когда обе группы R7 и R8 являются C1-C6 алкильными группами, C1-C6 алкоксигруппами или C1-C6 алкилтиогруппами, атомы углерода из R7 и R8 могут образовать, соединяясь друг с другом, 3-7-членные циклы. Однако, когда R7 и R8 обе являются алкильными группами, исключается тот случай,когда Х означает C1-C6 алкильную группу, атом галогена или галоалкильная группа и все из R3,R4, R5 и R6 являются атомами водорода. Далее, когда одна из R7 и R8 является алкоксильной группой, а другая атомом водорода,исключается случай, в котором Х означает C1-C6 алкильную группу и все из R3, R4, R5 и R6 являются атомами водорода, когда атомы водорода алкоксигруппы не замещены галогеном или когда алкоксигруппа не содержит ненасыщенной связи. Конкретными примерами атома галогена,C1-C6 алкильной группы, C1-C6 алкоксильной группы и C1-C6 алкилтиогруппы в вышеуказанных R7, R8, R10 и R11 являются те, которые определены в отношении X. Примеры C1-C6 алкилкарбонильной группы при определении значений R10 и R11 включают ацетил, пропионил, бутирил и валерил, и бутирил и валерил могут быть нормальными, циклическими или разветвленными. В группе (b) при определении значений ZR9 означает атом кислорода, атом серы или C1C6 алкоксииминогруппу. Когда R9 является C1C6 алкоксииминогруппой, от 1 до 13 атомов водорода этой группы могут быть замещены от 1 до 13 атомами галогена, и когда число атомов углерода в ней равно C2-C6, эта группа может содержать ненасыщенную связь. Однако, когдаR9 является C1-C6 алкоксииминогруппой, и когда ее атом водорода не замещен атомом гало 9 гена или когда эта группа не содержит ненасыщенной связи, исключается случай, в котором Х является C1-C6 алкильной группой и все из R3,R4, R5 и R6 являются атомами водорода. Предпочтительной алкоксииминогруппой является метоксиимино или этоксиимино.Q означает гидроксил или группу (с) и (d) алкильной группой, и X1 является C1-C6 галогеналкильной группой, атомом галогена, C1-C6 алкоксигруппой, C1-C6 галогеналкоксигруппой,C2-C6 алкоксиалкильной группой, C1-C6 алкилтиогруппой, C1-C6 галогеналкилтиогруппой, C1C6 алкилсульфинильной группой или C1-C6 алкилсульфонильной группой и производные циклогександиона общей формулы В группах (с) или (d) при определении значения Q каждая из R16 и R17 является C1-C6 алкильной группой, C1-C6 галогеналкильной группой или фенильной группой, замещенной C1-C6 алкильной группой, C1-C6 галогеналкильной группой, атомом галогена, циано- или нитрогруппой. Конкретные примеры C1-C6 алкильной группы и C1-C6 галогеналкильной группы включают примеры, определенные в отношении вышеуказанного X. Кроме того, в фенильные группы может быть введено от 0 до 5 C1-C6 алкильных групп, C1-C6 галогеналкильных групп,атомы галогена, циано- и нитрогруппы, а положение заместителей может быть от 2 до 6 положением. Значение m равно 0, 1 или 2, и при 0 это сульфид, при 1 это сульфоксид или при 2 это сульфон. Из производных циклогександиона общей формулы (I) предпочтительны производные циклогександиона общей формулы в которой группы от R1 до R6, n, Y и Q имеют указанные выше значения, R14 является C1-C6 галогеналкильной группой, алкоксиалкильной группой, алкенильной группой, галогеналкенилалкильной группой или алкинилалкильной группой и X2 является C1-C6 алкильной группой,C1-C6 галогеналкильной группой, атомом галогена, C1-C6 алкоксигруппой, C1-C6 галогеналкоксигруппой, C2-C6 алкоксиалкильной группой,C1-C6 алкилтиогруппой, C1-C6 галогеналкилтиогруппой, C1-C6 алкилсульфинильной группой или C1-C6 алкилсульфонильной группой. Далее предпочтительными являются производные циклогександиона общей формулы в которой группы от R1 до R6, n, X, Y и Q определены выше, и R12 означает C1-C6 алкильную группу или C1-C6 галогеналкильную группу, при условии, что R12 может быть замещен C1-C6 алкоксильной группой, так что, когда число их атомов углерода равно С 2-С 6, эта группа может содержать ненасыщенную связь, так что, когда число их атомов углерода равно C3-C6, группа может иметь циклическую структуру и далее,когда R12 является C1-C6 алкильной группой, то исключаются соединения общей формулы (Iа 1), в которой Х означает C1-C6 алкильную группу, и все из R3, R4, R5 и R6 являются атомами водорода. Из вышеназванных производных циклогександиона особенно предпочтительны производные циклогександиона общей формулы в которой группы от R1 до R6, n, Y или Q имеют указанные выше значения, R13 является C1-C6 в которой группы от R1 до R6, n, X, Y или Q имеют указанные выше значения, R15 являетсяC1-C6 алкильной группой или C2-C6 алкенильной группой, при условии, что, когда R15 является C1-C6 алкильной группой, исключаются соединения общей формулы (I-b1), в которых Х является C1-C6 алкильной группой, и все из R3,R4, R5 и R6 являются атомами водорода. Из указанных производных циклогександиона особенно предпочтительны производные циклогександиона общей формулы в которой группы от R1 до R6, R13, n, X1, Y и Q определены выше. Далее, также предпочтительны производные циклогександиона общей формулы в которой группы от R1 до R6, n, X2, Y и Q имеют указанные выше значения. Производные циклогександиона общей формулы (I) могут иметь следующие таутомерные структуры в том случае, когда Q является гидроксилом, и производное циклогександиона настоящего изобретения включает все соединения, имеющие эти структуры и их смеси. в которых X, Y, Z, R1, R2, R3, R4, R5, R6 и n определены выше. Далее, производные циклогександиона общей формулы (I) являются кислотными веществами и могут быть легко переведены в соли обработкой основанием. Производное циклогексанона настоящего изобретения также включает эти соли. Указанное основание может быть выбрано из известных оснований без какого-либо ограничения, и примеры этого основания включают органические основания, такие как амины и анилины, и неорганические основания, такие как соединения натрия и соединения калия. Примеры аминов включают алкиламины, такие как моноалкиламин, диалкиламин и триалкиламин. Алкильные группы алкиламинов обычно являются C1-C4 алкильными группами. Примеры анилинов включают анилин и алкиланилины,такие как моноалкиланилин и диалкиланилин. Алкильные группы алкиланилинов являются,как правило, C1-C4 алкилами. Примеры соединений натрия включают гидроксид натрия и карбонат натрия. Примеры соединений калия включают гидроксид калия и карбонат калия. Производные циклогексанона общей формулы (I) могут быть получены, например, следующим способом, когда Q означает ОН [общая формула (I-OH)] где X, Y, Z, R1, R2, R3, R4, R5, R6 и n принимают значения, определенные выше. Т.о. соединение общей формулы (II) реагирует с галогенирующим агентом с образованием соединения общей формулы (III), и соединение общей формулы (III) реагирует затем с соединением общей формулы (IV) для получения соединения общей формулы (V). Затем соединение общей формулы (V) подвергается перегруппировке с получением производного циклогександиона общей формулы (I-OH). Далее, соединение общей формулы (V) может быть получено реакцией соединения общей формулы (II) с соединением общей формулы (IV) в присутствии дегидратирующего агента, такого как дициклогексилкарбодимид (обозначенный здесь и далее как "DCC"). Каждая стадия будет подробно описана ниже. Стадия (а). В стадии (а) соединение общей формулы(II) реагирует с галогенирующим агентом (тионилхлоридом или оксихлоридом фосфора) с получением соединения общей формулы (III). На стадии (а) на моль соединения общей формулы (II) используют предпочтительно 1 моль или более галогенирующего агента. Реакция может быть проведена в разведении в среде инертного растворителя (метиленхлорид или хлороформ) или без какого-либо растворителя. Далее может быть использован избыток тионилхлорида как галогенирующего агента в качестве растворителя. Хотя нет конкретных ограничений, предпочтительна температура реакции от 0 С до температуры кипения растворителя,особенно предпочтительна температура от 60 С или около этого значения. Стадия (b). На стадии (b) соединение общей формулы(III), полученное на стадии (а), вводят во взаимодействие с соединением общей формулы (IV) для получения соединения общей формулы (V). На стадии (b) предпочтительно, чтобы молярное соотношение соединение общей формулы(III)/соединение общей формулы (IV), предпочтительно примерно от 1/1 до 1/3, и реакцию проводят в инертном растворителе, таком как диоксан, ацетонитрил, бензол, толуол, хлороформ, метиленхлорид или 1,2-дихлорэтан. Кро 13 ме того, реакцию можно проводить в среде с двухфазной системой, такой как вода-бензол,вода-толуол или вода-хлороформ. Реакция проходит гладко, когда в эквимолярном или более количестве присутствует основание, такое как гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, триэтиламин или пиридин. Температура реакции предпочтительно находится в области от 0 до 60 С, особенно предпочтительно в области от 0 С до комнатной температуры. Стадия (с). На стадии (с) соединение общей формулы(V), полученное на стадии (b), подвергают перегруппировке с получением производного циклогександиона общей формулы (I-OH). На стадии(с) реакцию предпочтительно проводят в инертном растворителе, таком как метиленхлорид,1,2-дихлорэтан, толуол, ацетонитрил, N,Nдиметилформамид или этилацетат. Особенно предпочтителен ацетонитрил. На стадии (с) подходящее основание (карбонат натрия, карбонат калия, триэтиламин или пиридин) используют в количестве, как правило, от 1 до 4 эквивалентов по массе, предпочтительно от 1 до 2 эквивалентов по массе на эквивалент соединения общей формулы (V). В этом случае реакция гладко проходит в присутствии каталитического количества цианистого водорода или соединения, способного генерировать в реакционной системе цианид-анион, так называемого "источника цианида". Источник цианида выбирают,например, из цианидов металлов, таких как цианид натрия или цианид калия и из циангидринов низших алкил (C3-C5) кетонов, таких как ацетонциангидрин и метилизопропилкетонциангидрин. При использовании цианида металла,реакция может протекать гладко при добавлении в процессе реакции катализатора фазового переноса, такого как краун-эфир. Количество источника цианида на моль соединения формулы (V) обычно составляет от 0,01 до 0,5 моль,предпочтительно от 0,05 до 0,2 моль. Температура реакции предпочтительно находится в пределах от 0 до 80 С, особенно предпочтительно в области от 20 до 40 С. Стадия (d). Стадия (d) представляет собой способ для получения соединения общей формулы (V), который отличается от вышеуказанного способа. Так в стадии (d) соединение (V) получают из соединения (II) и соединения (IV) конденсацией в присутствии дегидратирующего агента, такого как дициклогексилкарбодиимид (DCC). Несмотря на отсутствие конкретных ограничений,растворитель, используемый в вышеуказанной реакции конденсации, выбирают предпочтительно из ацетонитрила, третичного амина или спирта. Температура реакции не имеет конкретных ограничений, ввиду того, что она находится в области от 0 С до точки кипения растворителя, в то время как предпочтительно температура 14 реакции является комнатной температурой. Дегидратирующий агент может быть выбран из указанного дициклогексилкарбодимида (DCC) или другого реагента, такого как 1,1-карбонилдиимидазол (CDI) или 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDC). Количество дегидратирующего агента, приходящегося на соединение, составляет обычно от 1,0 до 3 эквивалентов по массе, предпочтительно от 1,0 до 1,5 эквивалентов по массе. Молярное соотношение соединение (II)/соединение (IV) обычно составляет от 1/1 до 1/3, предпочтительно от 1/1 до 1/1,5. Для проведения конденсации соединения (II) и соединения (IV) достаточно от 1 до 48 ч, и конденсация обычно завершается за примерно 8 ч. Таблица 1 16 В общей формуле (I-a2), Q=OH, каждая из групп R1 и R2 означает метил и связана с 4 положением циклогександионового кольца,R3=R4=R5=R6=H и n=2. В общей формуле (I-a2), Q=OH, каждая из групп R1 и R2 означает метил и связана с 4 положением циклогександионового кольца,R3=R4=R5=R6=H и n=2. В общей формуле (I-a2), Q=OH, каждая из групп R1 и R2 означает метил и связана с 5 положением циклогександионового кольца,R3=R4=R5=R6=H и n=2. В общей формуле (I-a2), Q=OH, каждая из групп R1 и R2 означает метил и связана с 5 положением циклогександионового кольца,R3=R4=R5=R6=H и n=2. В общей формуле (I-a3), Q=OH, каждая из групп R1 и R2 означает метил и связана с 4 положением циклогександионового кольца,R3=R4=R5=R6=H и n=2. В общей формуле (I-a3), Q=OH, каждая из групп R1 и R2 означает метил и связана с 4 положением циклогександионового кольца,R3=R4=R5=R6=H и n=2. В общей формуле (I-a3), Q=OH, каждая из групп R1 и R2 означает метил и связана с 5 положением циклогександионового кольца,R3=R4=R5=R6=H и n=2. В общей формуле (I-a3), Q=OH, каждая из групп R1 и R2 означает метил и связана с 5 положением циклогександионового кольца,R3=R4=R5=R6=H и n=2. В общей формуле (I-b2), Q=OH, каждая из групп R1 и R2 означает метил и связана с 4 положением циклогександионового кольца,R3=R4=R5=R6=H и n=2. В общей формуле (I-b2), Q=OH, каждая из групп R1 и R2 означает метил и связана с 5 положением циклогександионового кольца,R3=R4=R5=R6=H и n=2. В общей формуле (I-c), Q=OH, каждая из групп R1 и R2 означают метил и связана с 4 положением циклогександионового кольца,R3=R4=СН 3, R5=R6=H и n=2. Таблица 21Q=OH, В табл. 1-23 приведены предпочтительные свойства производных циклогександиона общей формулы (I-OH) настоящего изобретения, полученные как это описано выше. Производные циклогександиона общей формулы (I), в которой Q является отличным от ОН [общая формула (I-Q)], представленные в настоящем изобретении, получены, например,следующим способом(Q' является группой для образования Q, иHal является галогеном). (W является галогеном, гидроксильной группой или атомом галогена). Значения X, Y, Z, R1, R2, R3, R4, R5, R6 и n на схеме определены выше. Таким образом соединения общей формулы (I-OH) реагируют с соединением Q'Наl илиQW с образованием соединения общей формулы (I-Q). Соли производных получают реакцией соединений общей формулы (I-OH) с основанием. Каждая стадия на схеме объяснена ниже. Стадия (е). На стадии (е) соединение общей формулыQ'Hal, с образованием соединения (I-Q). На этой стадии (е) соединение, обозначенное как Q'Hal,используют предпочтительно в эквимолярном или большем количестве по отношению к соединению общей формулы (I-OH), и реакцию проводят в присутствии органического основания или неорганического основания. Реакцию предпочтительно проводят в инертном по отношению к реакции растворителе, таком как диоксан, бензол, толуол, хлороформ, метиленхлорид, 1,2-дихлорэтан или тетрагидрофуран. Кроме того, реакцию могут проводить в двухфазной системе такой, как вода-бензол или вода-хлороформ. Реакция протекает гладко в присутствии основания, такого как гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, триэтиламин или пиридин. Температура реакции находится предпочтительно в области от 0 до 60 С, особенно предпочтительно в области от 0 С до комнатной температуры. Стадия (f). На стадии (f) соединение общей формулы(I-OH) реагирует с соединением, обозначенном как QW, с получением соединения (I-Q). На стадии (f) соединение, обозначенное как QX, предпочтительно используют в эквимолярном или большем количестве, чем количество соединения общей формулы (I-OH). Реакцию предпочтительно проводят в растворителе, инертном по отношению к реакции, таком как диоксан, бензол, толуол, хлороформ, метиленхлорид, 1,2 дихлорэтан или тетрагидрофуран. Реакция протекает гладко. Температура реакции предпочтительно находится в области от 0 до 60 С, особенно предпочтительно в области от 0 С до комнатной температуры. В табл. 24 приведены предпочтительные свойства производных циклогександиона общей В табл. 1-24, например, обозначение 8-F в колонке Y означает, что атом фтора замещает 8 положение тиохроманового кольца. Гербицид настоящего соединения содержит в качестве обязательного компонента, производное циклогександиона общей формулы (I),представленного настоящим изобретением. Производное циклогександиона настоящего изобретения смешивают с жидким носителем,таким как растворитель или твердый носитель,такой как минеральный тонкоизмельченный порошок, и смесь может быть приготовлена в форме смачиваемого порошка, эмульгируемого концентрата, дуста, гранул или подобных форм. Может быть добавлено поверхностно-активное вещество для придания препарату эмульгируемости, диспергируемости и способности к распылению. При использовании гербицида настоящего изобретения в форме дуста, композицию обычно готовят смешением от 10 до 55 мас.% производного циклогександиона настоящего изобретения, от 40 до 88 мас.% твердого носителя и от 2 до 5 мас.% поверхностно-активного вещества,и композиция готова к использованию. Далее, когда она используется в форме эмульгируемого концентрата, этот концентрат может быть получен смешением от 20 до 50 мас.% производного циклогександиона настоящего изобретения, от 35 до 75 мас.% растворителя и от 5 до 15 мас.% поверхностно-активного вещества. При использовании гербицида настоящего изобретения в форме дуста, дуст обычно получают смешением от 1 до 15 мас.% производного циклогександиона настоящего изобретения, от 80 до 97 мас.% твердого носителя и от 2 до 5 мас.% поверхностно-активного вещества. Далее, при использовании гербицида в форме гранул, гранулы получают смешением от 1 до 15 мас.% производного циклогександиона настоящего изобретения, от 80 до 97 мас.% твердого носителя и от 2 до 5 мас.% поверхностно-активного вещества. Указанный твердый носитель может быть выбран из минеральных 28 тонкоизмельченных порошков, и минеральные тонкоизмельченные порошки включают оксиды,такие как диатомовая земля и известковое молоко, фосфаты, такие как апатит, сульфаты, такие как гипс, и силикаты, такие как тальк, пироферрит, глина, каолин, бентонит, кислотные глины, белая сажа, кварц в виде порошка и порошкообразный диоксид кремния. Растворитель выбирают из органических растворителей. Конкретные примеры растворителя включают ароматические углеводороды,такие как бензол, толуол и ксилол, хлорированные углеводороды, такие как о-хлортолуол,трихлорэтан и трихлорэтилен, спирты, такие как циклогексанол, амиловый спирт и этиленгликоль, кетоны, такие как изофорон, циклогексанон и циклогексилциклогексанон, простые эфиры, такие как бутилцеллюлозовый, диэтиловый эфир и метилэтиловый эфир, сложные эфиры,такие как изопропилацетат, бензилацетат и метилфталат, амиды, такие как диметилформамид,и их смеси. Кроме того, поверхностно-активные вещества могут выбираться из анионных, неионных,катионных и амфотерных поверхностноактивных веществ (аминокислота и бетаин). Гербицид настоящего изобретения может содержать в качестве активного ингредиента,другой гербицидно-активный компонент в сочетании с производным циклогександиона общей формулы (I), если нужно. "Другой" гербицидноактивный компонент включает известные гербициды, такие гербициды, которые основаны на следующих типах гербицидов: феноксипроизводные, дифениловые эфиры, триазины,мочевины, карбаматы, тиокарбаматы, анилиды кислот, пиразолы, фосфорная кислота, сульфонилмочевины и оксадиазолы, и он может быть должным образом выбран из числа этих гербицидов, если необходимо. Кроме того, гербицид настоящего изобретения может быть использован как смесь с одним из инсектицидов, бактерицидов, регуляторов роста растений и удобрений. Гербицид настоящего изобретения может быть использован в качестве гербицида нагорных полей при любом способе предвсходовой обработки, обработки путем смешения гербицида с почвой и при послевсходовой обработки. Сорняки пахотных угодий, к которым применимо соединение настоящего изобретения, включают широколистные сорняки, такие как сорняки семейства пасленовых, типичным примером которых является паслен черный (Solanum nigrum) и дурман вонючий (Datura stramonium); сорняки семейства мальвовых, типичным примером которых является канатник Теофрастаspinosa); вьюнковые сорняки, типичным примером которых являются ипомеи (Ipomoea spps.),такие как высокорослая ипомея (Ipomea purpurea) и повои заборные (Calystegia spps.); сор 29 няки семейства амарантовых, типичным примером которых является ширица синеватая (Amaranthus lividus); сложные сорняки, типичным примером которых является дурнишник (Xanthium strumarium), амброзия обыкновенная(Galinsoda ciliata), бодяк полевой (Cirsium arvense), крестовник (Senecio vulgaris) и однолетний мелколепестник (Erigeron annus); brassicaceous сорняки, типичным примером которых является желтушник (Rorippa indica), дикая горчица (Sinapis arvensis) и пастушья сумка обыкновенная (Capsella bursa-pastris); сорняки семейства горецов, типичным примером которых является горец вьющийся (Polygonum convolvulus) и горец вьющийся (Polygonum convolvulus); сорняки семейства портулаков, типичным примером которых является портулак огородный(Portulaca oleracea); сорняки семейства марей,типичным примером которых является марь белая (Chenopodium album), fig-leaved марь(марь с фиговыми листьями) (Chenopodium ficifolium) и kochia (Kochia scoparia); зерновые сорняки, типичным примером которых является звездчатка средняя (Stellaria media); scrophularaceous cорняки, типичным примером которых является вероника персидская (Veronica persica); сорняки семейства камелийных, типичным примером которых является коммелина обыкновенная (Commelina communis); губоцветные сорняки, типичным примером которых является яснотка стеблеобъемлющая (Laminum amplexicaule) и яснотка пурпурная (Lamium purpureum); сорняки семейства молочаев, типичным примером которых является молочай венчиковый(Euphorbia maculata); красные (rubiaceous) сорняки, типичным примером которых является подмаренник (Galium spurium), подмаренник цепкий (Galium aparine) и марена (Rubia akane); сорняки семейства фиалковых, типичным примером которых является фиалка (Viola arvensis); и бобовые сорняки, типичным примером которых является конопля sesbania (Sesbania exaltata) и резуха (Cassia obtusifolia); злаковые сорняки,типичным представителем которых является сорго двухцветное (Sorgum bicolor), просо опадающее (Panicum dichotomiflorum), джонсова трава (Sorghum halepense), просо петушье (Ehinocholoa crusgalli), henry ползучий сорняк(Digitaria adscendens), овсюг (Avena fatua),goosegrass (гусиная трава) (Eleusine indica), щетинник зеленый (Setaria viidis) и лисохвост водяной (Alopecurus aequalis); и сорняки семейства сытей, типичным примером которых являетсяpurple nutsedge (сыть пурпурная) (Cyperus rotundus, Cyperus esculentus). Далее, гербицид настоящего изобретения может также использоваться для любой предвсходовой обработки и послевсходовой обработки при поливе, в качестве гербицида для за 001884 30 ливных земель. Примеры сорняков на заливных землях включают сорняки семейства частух,типичным примером которых являются частуха обыкновенная восточная (Alisma canaliculatum),стрелолист (Sagittaria trifolia) и Sagittaria pygmaea, сорняки семейства сытей, типичным примером которых является зонтичная сыть (Cyperus difformis), Cyperus serotinus, камыш (Scirpusjuncoides) и каштан водяной (Eleochadaris kuroguwai); scrothulariaceous сорняки, типичным примером которых является лжебедренец (Lindernia pyxidaria); potenderiaceous сорняки, типичным примером которых является monochoria(Monochoria Vaginalis); сорняки семейства рдестовых, типичным примером которых является рдест широколистный (Potamogeton distinctus); вербейниковые сорняки, типичным примером которых является ротала индийская (Rotala indica); и злаковые сорняки, типичным примером которых является просо петушье (Echinochloacrus-galli). Примеры Настоящее изобретение будет лучше объяснено детально со ссылкой на препаративные примеры и примеры гербицидов, но в то же время настоящее изобретение не ограничивается этими примерами. Препаративный пример 1. 5-Хлор-8-фтор 6-(1',3'-диоксоциклогексан-2-ил-карбонил)-4 метоксииминотиохроман-1,1-диоксид (соединение 1). 1-1). Синтез 5-хлор-8-фтор-6-карбоксил-4 метоксииминотиохроман-1,1-диоксид. 5-Хлор-8-фтор-6-карбоксил-4-метоксииминотиохроман-1,1-диоксид был синтезирован по способу, описанному в WO 96/30368. 1H-ЯМР (CDCl3):3,35-3,45 (м, 2 Н), 3,633,69 (м, 2 Н), 4,08 (с, 3 Н), 7,69 (д, 1 Н). 1-2). Синтез 5-хлор-8-фтор-6-(3'-оксоциклогексенил)оксикарбонил-4-метоксииминотиохроман-1,1-диоксид. Растворяют 5-хлор-8-фтор-6-карбоксил-4 метоксииминотиохроман-1,1-диоксид (0,50 г; 1,6 ммоль) в 3 мл дихлорэтана, прибавляют 0,34 мл (3,0 экв., 4,7 ммоль) тионилхлорида и смесь кипятят с обратным холодильником в течение 3 ч. Затем растворитель отгоняют с получением хлорангидрида кислоты. Затем раствор полученного хлорангидрида кислоты в тетрагидрофуране прибавляют к раствору 0,18 г (1,0 экв.,1,6 ммоль) 1,3-циклогександиона в тетрагидрофуране и далее прибавляют по каплям 0,2 мл(1,0 экв., 1,6 ммоль) триэтиламина. Смесь перемешивают при комнатной температуре в течение 2 ч и растворитель отгоняют. Полученный остаток растворяют в этилацетате и последовательно промывают водным раствором 0,2 Н соляной кислоты, насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Затем промытый продукт сушат безводным сульфатом натрия и растворитель отгоняют. Остаток хроматографи 31 руют на колонке (этилацетат: н-гексан=1:1),получая 0,21 г (выход 58%) 5-хлор-8-фтор-6-(3'оксоциклогексенил)оксикарбонил-4-метоксииминотиохроман-1,1-диоксида. 1(м, 4 Н), 4,11 (с, 3 Н), 6,06 (уш.с, 1 Н), 7,54 (д, 1 Н). 1-3). Синтез 5-хлор-8-фтор-6-(1',3'-диоксоциклогексан-2-ил-карбонил)-4-метоксииминотиохроман-1,1-диоксида. Растворяют 5-хлор-8-фтор-6-(3'-оксоциклогексенил)оксикарбонил-4-метоксииминотиохроман-1,1-диоксида (0,22 г; 0,53 ммоль) в 4 мл ацетонитрила, прибавляют 0,1 мл (1,0 экв., 0,53 ммоль) триэтиламина и 3 капли ацетонциангидрина и смесь перемешивают при комнатной температуре в течение 1 дня. После завершения реакции, реакционную смесь экстрагируют насыщенным водным раствором гидрокарбоната натрия и водный слой промывают метиленхлоридом. Водный слой нейтрализуют 2%-ным раствором соляной кислоты и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия и растворитель отгоняют, получая 0,22 г (выход 100%) 5-хлор-8-фтор-6-(1',3'-диоксоциклогексан-2-ил-карбонил)-4-метоксииминотиохроман 1,1-диоксида. 1(м, 2 Н), 3,6-3,7 (м, 2 Н), 4,05 (с, 3 Н), 7,32 (д, 1 Н). ИК (КВr): 2950, 1710, 1680, 1250, 1150 см-1. Препаративный пример 2. 5-Хлор-8-фтор 6-(1',3'-диоксоциклогексан-2-ил-карбонил)-4-(2'фторэтокси)тиохроман-1,1-диоксид (соединение 2). 2-1). Синтез 5-хлор-8-фтор-6-карбоксил-4(2'-фторэтокси)тиохроман-1,1-диоксид. 5-Хлор-8-фтор-6-карбоксил-4-(2'-фторэтокси)тиохроман-1,1-диоксид был синтезирован по способу, описанному в WO 96/31507. 1H-ЯМР (ацетон-d6):2,3-3,2 (м, 2 Н), 3,34,5 (м, 5 Н), 4,88 (т, 1 Н), 5,07 (м, 1 Н), 7,79 (д,1 Н). Т.пл. 163-165 С. 2-2). Синтез 5-хлор-8-фтор-6-(3'-оксоциклогексенил)оксикарбонил-4-(2'-фторэтокси)тиохроман-1,1-диоксида. Растворяют 0,47 г (1,4 ммоль) 5-хлор-8 фтор-6-карбонил-4-(2'-фторэтокси)тиохроман 1,1-диоксида в 3 мл дихлорэтана, прибавляют 0,20 мл (2,0 экв., 2,8 ммоль) тионилхлорида и смесь перемешивают при 40-50 С в течение 3 ч. Затем растворитель отгоняют с получением хлорангидрида кислоты. Затем раствор полученного хлорангидрида кислоты в тетрагидрофуране прибавляют к раствору 0,17 г (1,0 экв.,1,4 ммоль) 1,3-циклогександиона в тетрагидрофуране и далее прибавляют по каплям 0,2 мл(1,0 экв., 1,6 ммоль) триэтиламина. Смесь перемешивают при комнатной температуре в течение 2 ч и растворитель отгоняют. Полученный 32 остаток растворяют в этилацетате и последовательно промывают водным раствором 0,2 Н соляной кислоты, насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Затем промытый продукт сушат над безводным сульфатом натрия и растворитель отгоняют. После этого остаток хроматографируют на колонке (этилацетат:н-гексан=1:1), получая 0,5 г (выход 81%) 5 хлор-8-фтор-6-(3'-оксоциклогексенил)оксикарбонил-4-(2'-фторэтокси)тиохроман-1,1-диоксида. 1(м, 4 Н), 4,85 (т, 1 Н), 4,96 (уш.с, 1 Н), 6,06 (уш.с,1 Н), 7,54 (д, 1 Н). 2-3). Синтез 5-хлор-8-фтор-6-(1',3'-диоксоциклогексан-2-ил-карбонил)-4-(2'-фторэтокси)1,1-диоксида. Растворяют 0,5 г (1,1 ммоль) 5-хлор-8 фтор-6-(3'-оксоциклогексенил)оксикарбонил-4(2'-фторэтокси)тиохроман-1,1-диоксида в 3 мл ацетонитрила, прибавляют 0,15 мл (1,0 экв., 1,1 ммоль) триэтиламина и 3 капли ацетонциангидрина и смесь перемешивают при комнатной температуре в течение 1 дня. После завершения реакции реакционную смесь экстрагируют насыщенным водным раствором гидрокарбоната натрия и водный слой промывают метиленхлоридом. Водный слой нейтрализуют 2%-ной соляной кислотой и экстрагируют этилацетатом. Органический слой промывают насыщенным водным растворам хлорида натрия и сушат над безводным сульфатом натрия, растворитель отгоняют, получая 0,5 г (выход 100%) 5-хлор-8 фтор-6-(1',3'-диоксоциклогексан-2-ил-карбонил)-4-(2'-фторэтокси)тиохроман-1,1-диоксида. 1(м, 5 Н), 4,85 (т, 1 Н), 4,98 (уш.с, 1 Н), 7,36 (д, 1 Н). ИК (КВr): 2975, 1690, 1320, 1170 см-1. Препаративный пример 3. 5-Хлор-8-метил 6-(1',3'-диоксоциклогексан-2-ил-карбонил)-4 метокситиохроман-1,1-диоксид (соединение 3). 3-1). Синтез 5-хлор-8-метил-6-карбоксил 4-метокситиохроман-1,1-диоксид. 5-Хлор-8-метил-6-карбоксил-4-метокситиохроман-1,1-диоксид был синтезирован по способу, описанному в WO 93/18031. 1 Н-ЯМР (ацетон-d6):2,4-4,0 (м, 4 Н), 2,73N,N-дициклогексилкарбодиимида и смесь перемешивают при комнатной температуре в течение 3 ч. Затем растворитель отгоняют, добавля 33 ют этилацетат и воду и нерастворившееся вещество удаляют фильтрованием. Затем органический слой промывают насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Затем промытый продукт сушат над безводным сульфатом натрия и растворитель отгоняют. После этого остаток хроматографируют на колонкеH-ЯМР (CDCl3):2,0-2,8 (м, 9 Н), 2,78 (с,3 Н), 3,0-3,4 (м, 1 Н), 3,49 (с, 3 Н), 3,6-4,2 (м, 1 Н),4,81 (т, 1 Н), 6,07 (уш.с, 1 Н), 7,69 (с, 1 Н). 3-3). Синтез 5-хлор-8-метил-6-(1',3'-диоксоциклогексан-2-ил-карбонил)-4-метокситиохроман-1,1-диоксида. Растворяют 0,40 г (1,0 ммоль) 5-хлор-8 метил-6-(3'-оксоциклогексенил)оксикарбонил-4 метокситиохроман-1,1-диоксида в 2,4 мл ацетонитрила, прибавляют 0,14 мл (1,0 экв., 1,0 ммоль) триэтиламина и 3 капли ацетонциангидрина и смесь перемешивают при комнатной температуре в течение 8 ч. После завершения реакции реакционную смесь экстрагируют насыщенным водным раствором карбоната натрия и водный слой промывают этилацетатом. Доводят рН водного слоя 5%-ной соляной кислотой до рН 1 и затем экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, растворитель отгоняют, получая 0,26 г (выход 65%) 5-хлор-8 метил-6-(1',3'-диоксоциклогексан-2-ил-карбонил)-4-метокситиохроман-1,1-диоксида. 1(соединение 4). 4-1). Синтез 5-трифторметил-3,3,8-триметил-6-карбоксил-тиохроман-4-он-1,1-диоксида. 5-Трифторметил-3,3,8-триметил-6-карбоксил-тиохроман-4-он-1,1-диоксид был синтезирован по способу синтеза 3,3,5,8-тетраметил-6 карбоксил-тиохроман-4-он-1,1-диоксида, описанному в WO 96/25413. 1 34 течение 1,5 ч. Затем растворитель отгоняют,получая хлорангидрид кислоты. Затем раствор полученного хлорангидрида кислоты в тетрагидрофуране прибавляют к раствору 0,14 г (1,1 экв., 1,3 ммоль) 1,3-циклогександиона в тетрагидрофуране и далее по каплям прибавляют 0,13 г (1,1 экв., 1,3 ммоль) триэтиламина. Смесь перемешивают при комнатной температуре в течение 2 ч и затем растворитель отгоняют. Полученный остаток растворяют в этилацетате и промывают 0,2 Н водным раствором соляной кислоты, насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Затем промытый продукт сушат над безводным сульфатом натрия и растворитель отгоняют, получая 0,29 г (выход 58%) 5-трифторметил-3,3,8-триметил-6-(3'-оксоциклогексенил)оксикарбонилтиохроман-4-он 1,1-диоксида. 1H-ЯМР (CDCl3):1,52 (с, 6 Н), 2,0-2,8 (м,6 Н), 2,85 (с, 3 Н), 3,61 (с, 2 Н), 6,09 (уш.с, 1 Н),7,73 (с, 1 Н). 4-3). Синтез 5-трифторметил-3,3,8 триметил-6-(1',3'-диоксоциклогексан-2-илкарбонил)тиохроман-4-он-1,1-диоксид. Растворяют 0,29 г (0,65 ммоль) 5 трифторметил-3,3,8-триметил-6-(3'-оксоциклогексенил)оксикарбонилтиохроман-4-он-1,1 диоксида в 1,5 мл ацетонитрила, прибавляют 0,07 г (1,1 экв., 0,69 ммоль) триэтиламина и 3 капли ацетонциангидрина и смесь перемешивают при комнатной температуре в течение 1 дня. После завершения реакции реакционную смесь экстрагируют насыщенным водным раствором гидрокарбоната натрия и водный слой промывают метиленхлоридом. Водный слой нейтрализуют 2%-ной соляной кислотой и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия и затем сушат над безводным сульфатом натрия,растворитель отгоняют, получая 0,15 г (выход 30%) 5-трифторметил-3,3,8-триметил-6-(1',3'диоксоциклогексан-2-ил-карбонил)тиохроман 4-он-1,1-диоксида. 1(с, 1 Н). ИК (КВr): 3000, 1730, 1690, 1300, 1195,1150 см-1. Препаративный пример 5. 3,3,5,8 Тетраметил-6-[1',3'-диоксоциклогексан-2-илкарбонил)тиохроман-4-он-1,1-диоксид (соединение 5). 5-1). Синтез 3,3,5,8-тетраметил-6 карбоксилтиохроман-4-он-1,1-диоксида. 3,3,5,8-Тетраметил-6-карбоксилтиохроман 4-он-1,1-диоксид был синтезирован по способу,описанному в WO 96/25413. 1(2,0 экв., 4,7 ммоль) тионилхлорида и смесь перемешивают при 55 С в течение 1,5 ч. Затем растворитель отгоняют, получая хлорангидрид кислоты. Затем раствор полученного хлорангидрида кислоты в тетрагидрофуране прибавляют к раствору 0,29 г (2,6 ммоль) 1,3 циклогександиона в тетрагидрофуране и далее прибавляют по каплям 0,27 г (1,1 экв., 2,7 ммоль) триэтиламина. Смесь перемешивают при комнатной температуре в течение 2 ч и затем растворитель отгоняют. Полученный остаток растворяют в этилацетате и последовательно промывают 0,2 Н водным раствором соляной кислоты, насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Затем промытый продукт сушат над безводным сульфатом натрия и растворитель отгоняют, получая 0,67 г (выход 68%) 3,3,5,8-тетраметил-6-(3'-оксоциклогексенил)оксикарбонилтиохроман-4-он-1,1-диоксида. 1(уш.с, 1 Н), 7,85 (с, 1 Н). 5-3). Синтез 3,3,5,8-тетраметил-6-(1',3'диоксоциклогексан-2-ил-карбонил)тиохроман 4-oн-1,1-диоксида. Растворяют 0,63 г (1,6 ммоль) 3,3,5,8 тетраметил-6-(3'-оксоциклогексенил)оксикарбонилтиохроман-4-он-1,1-диоксида в 3 мл ацетонитрила, прибавляют 0,17 г (1,1 экв., 1,7 ммоль) триэтиламина и 3 капли ацетонциангидрина и смесь перемешивают при комнатной температуре в течение 1 дня. После завершения реакции реакционную смесь экстрагируют насыщенным водным раствором гидрокарбоната натрия и водный слой промывают метиленхлоридом. Водный слой нейтрализуют 2%-ной соляной кислотой и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, растворитель отгоняют, получая 0,51 г (выход 81%) 3,3,5,8 тетраметил-6-(1',3'-диоксоциклогексан-2-илкарбонил)тиохроман-4-он-1,1-диоксида. 1(с, 1 Н). ИК (КВr): 2975, 1700, 1680, 1260, 1195,1125 см-1. В табл. 25 приведены структуры и ЯМРспектры исходных соединений, используемых в вышеуказанных препаративных примерах от 1 до 5, и в табл. 37-49 приведены структуры и данные по физическим свойствам полученных соединений. 36 Препаративные примеры 6-55. Соединения, приведенные в табл. 26-36,использовались в качестве исходных соединений, и соединения, приведенные в табл. 38-48,получены таким же образом, как в препаративном примере 5. В табл. 50-60 приведены данные по физическим свойствам полученных соединений. Препаративный пример 56. Синтез 5-хлор 8-метил-6-(1-ацетокси-3-оксоциклогексен-2-ил)4-(2-пропокси)тиохроман-1,1-диоксида. Растворяют 0,5 г 5-хлор-8-метил-6-(1,3 диоксоциклогексан-2-илкарбонил)-4-(2-пропокси)тиохроман-1,1-диоксида (соединение 15 в табл. 38), полученного в препаративном примере 6, в 5 мл 1,2-дихлорэтана и прибавляют 0,10 г триэтиламина. К полученному раствору добавляют 0,13 г ацетилхлорида и смесь перемешивают при комнатной температуре в течение 8 ч. Реакционную смесь разбавляют этилацетатом,дважды промывают 5%-ным водным раствором соляной кислоты, дважды промывают насыщенным водным раствором бикарбоната натрия,промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Осушитель отфильтровывают и маточник упаривают. Затем полученное масло очищают колоночной хроматoграфией, получая 0,30 г соединения 250, приведенного в табл. 38 (выход 54%). В табл. 60 приведены данные по физическим свойствам полученного соединения. Препаративный пример 57. Синтез соли триэтиламина 5-хлор-8-метил-6-(3-оксоциклогексен-2-ил)-4-(2-пропокси)тиохроман-1,1-диоксида. Растворяют 0,5 г 5-хлор-8-метил-6-(1,3 диоксоциклогексан-2-ил)-4-(2-пропокси)тиохроман-1,1-диоксида (соединение 15 в табл. 38), полученного в препаративном примере 6, в 5 мл 1,2-дихлорэтана и прибавляют 0,12 г триэтиламина. Смесь перемешивают при комнатной температуре в течение 1 ч. Образующиеся кристаллы выделяют фильтрованием, получая в качестве конечного продукта 0,3 соединения 251, приведенного в табл. 48 (выход 65%). В табл. 60 приведены данные по физическим свойствам полученного соединения. Далее в таблицах сокращения означают следующие: ставляемого Zeaklite Industry) как носителя, 1,5 мас.ч. алкилсульфоновой кислоты (товарное название: Neoplex, поставляемой Kao-Atlas К.К.) в качестве поверхностно-активного вещества и 1,5 мас.ч. неионного и анионного поверхностноактивного вещества (товарное название: Sorpol 800 А, поставляемого Toho Chemical Co., Ltd.) для приготовления носителя для смачиваемого порошка. Для получения гербицидов однородно измельчают и смешивают 90 мас.ч. указанного выше носителя для приготовления смачиваемого порошка и 10 мас.ч. одного из соединений настоящего изобретения. Далее в примерах гербицидов для сравнения сравниваемые гербициды приготовляют также из нижеприведенных соединений от (А) до (G) тем же самым способом.(2) Рейтинги оценок эффективности гербицидов и фитотоксичности по отношению к сельскохозяйственным культурам. 54 Рейтинг определяют как отношение массы оставшихся растений к массе растений на необработанном участке, что равно отношению(масса оставшихся растений на обработанном участке/масса растений на необработанном участке)100. Рейтинги (оценки) относятся к нижеприведенным биологическим тестам. Рейтинги Эффективность гербицида Отношение массы оставшихся растений к массе растений на необработанном участке (%) 0 81-100 1 61-80 2 41-60 3 21-40 4 1-20 5 0 Фитотоксичность к сельОтношение массы оставшихся скохозяйственным культу- растений к массе растений на рам необработанном участке (%) 100(а) Тест 1 (предвсходовая обработка нагорных полей). Тестирование при предвсходовой обработке нагорных полей проводят следующим образом по отношению к соединениям 1-5(примеры) и соединениям от (А) до (Е) (сравнительные примеры). Семена сорняков, таких как канатник Теофраста, дурман вонючий, паслен черный, просо петушье, гигантский сорняк ползучий (largecrabgrass) и семена кукурузы, сорго и хлопка высеивают в 1/5000 ар горшочки Вагнера, заполненные суходольной почвой и покрывают слоем той же почвы. Затем заранее определенное количество гербицида, полученного указанным способом (1), суспендируют в воде, и суспензию равномерно распыляют на поверхность почвенного слоя. Затем семена проращивают в теплице и на 20-й день после обработки гербицид оценивают с точки зрения гербицидной эффективности и уровня фитотоксичности к сельскохозяйственным культурам на основании рейтингов (оценок), приведенных в (2). Эти результаты приведены в табл. 61. Таблица 61 Гербицидная эффективность ВВ СС В табл. 61 показано, что гербициды настоящего изобретения могут селективно подавлять широкий набор сорняков суходольных земель при низких дозах, не вызывая фитотоксичности по отношению к кукурузе, сорго и хлопку. В противоположность этому также найдено,что соединение А малоэффективно при защите сорго и хлопка и что все соединения от В до Е являются мало эффективными по отношению ко всем тестируемым сорнякам.(b) Тест 1 (послевсходовая обработка нагорных полей). Тестирование при послевсходовой обработки проводилось следующим образом в отношении соединений 1-5 (примеры) и соединений (А), (С), (В) и (Е) (сравнительные примеры). Семена сорняков, таких как дурнушник,канатник Теофраста, дурман вонючий, просо петушье и гигантский ползучий сорняк (largecrabgrass) и семена кукурузы, сорго и свеклы высеивали в 1/5000 ар горшочки Вагнера, заполненные почвой нагорных полей и покрывали слоем почвы. Семена проращивались в теплице и на стадии от 3-го и 4-го листка этих растений,заранее определенное количество гербицида,полученного указанным способом (1), суспендировали в воде и суспензию равномерно распыляли на листья и стебли растений в количестве 2000 л/га. Затем растения выращивали в теплице и на 30-й день после обработки проводили оценку эффективности гербицида и фитотоксичности по отношению к культурам на основании рейтингов, приведенных в (2). Эти результаты приведены в табл. 62. Гербицидная эффективность АА ВВ СС В табл. 62 показано, что гербициды настоящего изобретения не проявляют фитотоксичости по отношению к кукурузе или сорго, обладают селективностью по отношению к свекле,и, кроме того, могут селективно контролировать широкий круг сорняков суходолья при низких дозах. В противоположность этому также показано, что соединения А, С и D малоэффективны для сохранности сорго и свеклы, а соединение Е малоэффективно по отношению ко всем тестируемым сорнякам.(с) Тест 2 предвсходовая обработка нагорных полей. Тестирование при предвсходовой обработке проводят следующим образом в отношении соединений 6, 15, 104 и 165 (примеры) и соединений (F) (сравнительные примеры). Семена сорняков, таких как канатник Теофраста, паслен черный, просо петушье, гигантский ползучий сорняк (large crabgrass), гигантский лисохвост и семена кукурузы и хлопка высеивались в 1/5000 ар горшочки Вагнера, заполненные почвой нагорных полей и покрытые этой же почвой. Затем заранее определенное количество гербицида, полученного указанным способом (1), суспендируют в воде и суспензию равномерно распыляют на поверхность почвенного слоя. Затем семена проращивают в теплице и на 20-й день после обработки гербицид оценивают с точки зрения гербицидной эффективности и уровня фитотоксичности по отношению к этим культурам на основании рейтингов, приведенных в (2). Эти результаты приведены в табл. 63. Гербицидная эффективность ВВ СС В табл. 63 показано, что гербициды настоящего изобретения не проявляют фитотоксичности по отношению к кукурузе и хлопку и могут селективно контролировать широкий набор сорняков суходолья при низкой дозе. В противоположность этому найдено, что соединение Е малоэффективно в отношении злаковых сорняков.(d) Тест 2 (послевсходовая обработка нагорных полей). Тестирование при послевсходовой обработки проводилось следующим образом в отношении соединений 15, 104, 165 и 202 тушье, гигантский ползучий сорняк (large crabgrass), гигантский лисохвост и семена кукурузы и сорго высеивали в 1/5000 ар горшочки Вагнера, заполненные почвой нагорных полей и покрывали слоем почвы. Семена проращивали в теплице и на стадии от 3-го до 4-го листа этих растений заранее определенное количество гербицида, полученного указанным способом (1),суспендировали в воде и суспензию равномерно распыляли на листья и стебли растений в количестве 2000 л/га. Затем растения выращивали в теплице и на 30-й день после обработки проводили оценку данного гербицида с точки зрения гербицидной эффективности и фитотоксичности по отношению к культурам на основании оценок, приведенных в (2). Эти результаты приведены в табл. 64. Гербицидная эффективность ВВ СС В табл. 64 показано, что гербициды настоящего изобретения не проявляют фитотоксичности по отношению к кукурузе или сорго и могут селективно контролировать широкий круг сорняков суходолья при низкой дозе. В противоположность этому также показано, что соединение F малоэффективно в отношении злаковых сорняков.(е) Тест 3 (послевсходовая обработка нагорных полей). Тестирование при наземной послевсходовой обработке проводилось следующим образом в отношении соединений 15 (пример) и соединения (G) (сравнительный пример). Семена сорняков, таких как канатник Теофраста, амброзия обыкновенная, просо петушье, Соед. гигантский лисохвост и семена кукурузы и сорго высеивали в 1/5000 ар горшочки Вагнера,заполненные почвой из нагорных полей и покрывали слоем почвы. Семена проращивали в теплице и на стадии от 3-го до 4-го листка этих растений заранее определенное количество гербицида, полученного указанным способом (1),суспендировали в воде и суспензию равномерно распыляли на листья и стебли растений в количестве 2000 л/га. Затем растения выращивали в теплице и на 30-й день после обработки проводили оценку данного гербицида с точки зрения гербицидной эффективности и фитотоксичности по отношению к культурам на основании рейтингов, приведенных в (2). Эти результаты приведены в табл. 65. Гербицидная эффективность ВВ СС В табл. 65 показано, что гербицид настоящего изобретения не проявляет фитотоксично сти по отношению к кукурузе или сорго и, кроме того, может селективно контролировать ос 59 новные сорняки суходолья при низкой дозе. В противоположность этому показано, что соединение G малоэффективно в отношении проса петушьего и лисохвоста гигантского, которые в основном должны контролироваться на посевных угодьях.(f) Тест 4 (послевсходовая обработка нагорных полей). Тестирование при послевсходовой обработке проводилось следующим образом в отношении соединений 7-9, 16, 17, 154, 168,169, 216-244, 250 и 251 (примеры) и соединения(large crabgrass), лисохвост зеленый и семена кукурузы высеивали в 1/5000 ар горшочки Вагнера, заполненные почвой из верхнего почвенного слоя, и покрывали почвой. Семена проращивали в теплице и на стадии от 3-го до 4-го листа этих растений, заранее определенное количество гербицида, полученного указанным способом (1), суспендировали в воде и суспензию равномерно распыляли на листья и стебли растений в количестве 2000 л/га. Затем растения выращивали в теплице и на 30-й день после обработки проводили оценку данного гербицида на основании рейтингов с точки зрения гербицидной эффективности и фитотоксичности по отношению к культурам, приведенных в (2). Эти результаты приведены в табл. 66. Таблица 66 60 В табл. 66 показано, что гербициды настоящего изобретения могут селективно контролировать сорняки суходолья при низкой дозе, почти не вызывая фитотоксичности по отношению к кукурузе. В противоположность этому показано, что соединение Е малоэффективно для сохранения посевов кукурузы и малоэффективно по отношению к сорнякам суходолья. Промышленная применимость Производное циклогександиона настоящего изобретения может селективно контролировать широкий круг сорняков нагорных полей при низкой дозе как в процессе предвсходовой обработки, так и послевсходовой обработки, не проявляя фитотоксичности к культурам, культивируемым на посевных угодьях, таким как кукуруза. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное циклогександиона общей формулы или его соль,в которой каждая из групп от R1 до R6 независимо означает атом водорода или C1-C6 алкильную группу,n равно 2,Х означает C1-C6 алкильную группу, C1-C6 галогеналкильную группу или атом галогена,Y означает атом водорода, C1-C6 алкильную группу или атом галогена,Z означает группу (а) или (b) в которой каждая из групп R7 и R8 независимо означает атом водорода, C1-C6 алкильную группу или C1-C6 алкоксигруппу,при условии что, когда группы R7, R8 или обе являются C1-C6 алкильной или C1-C6 алкоксильной группой (группами), от 1 до 13 атомов водорода в них могут быть замещены от 1 до 13 атомами галогена или C1-C6 алкоксильными группами,и что, когда число атомов углерода в них составляет C2-C6, эта группа (группы) могут содержать ненасыщенную связь, и когда число атомов углерода в них составляет C3-C6, группа (группы) могут иметь циклическую структуру, и при условии, что, когда оба R7 и R8 являются алкильными группами, исключаются соединения общей формулы (I), в которых Х означает C1-C6 алкильную группу, атом галогена или
МПК / Метки
МПК: A01N 43/18, C07D 335/06
Метки: содержащие, гербициды, производные, циклогександиона
Код ссылки
<a href="https://eas.patents.su/30-1884-proizvodnye-ciklogeksandiona-i-soderzhashhie-ih-gerbicidy.html" rel="bookmark" title="База патентов Евразийского Союза">Производные циклогександиона и содержащие их гербициды</a>
Предыдущий патент: Способ введения этиленовоненасыщенных функциональных групп в полимер алкилстирола и полимерные производные, полученные этим способом
Следующий патент: Способ проведения буровых работ на морском дне с использованием одного трубопровода
Случайный патент: Офтальмологический препарат для профилактики и лечения болезненных состояний глаз












