Синтез эфиров или тиоэфиров адипата
Номер патента: 18381
Опубликовано: 30.07.2013
Авторы: Де Вильдеман Стефаан Мари Андре, Трефцер Аксель Кристоф, Ван Дер Берг Марко Александр, Ву Лиан
Формула / Реферат
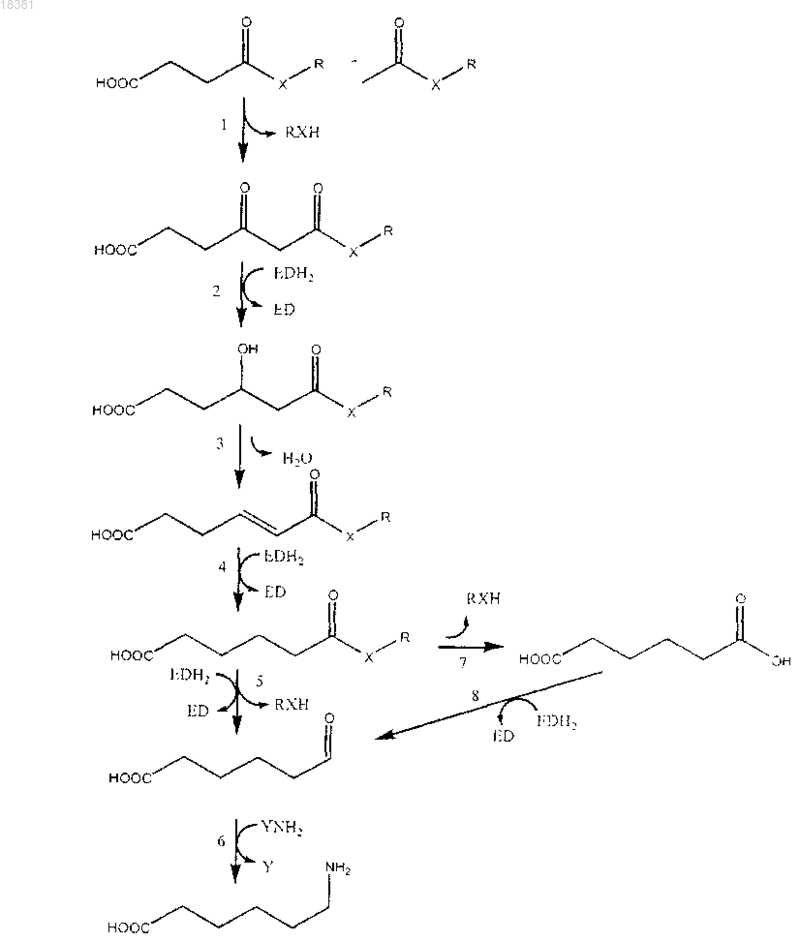
1. Способ получения сложного эфира адипата или тиоэфира адипата, включающий превращение эфира 2,3-дегидроадипата или тиоэфира 2,3-дегидроадипата в эфир адипата или тиоэфир адипата в одну стадию в присутствии биокатализатора, включающего фермент, который способен катализировать восстановление двойной связи углерод-углерод в 2,3-еноатной группировке или в 2-еноильной группировке, в условиях для лучшей активности фермента.
2. Способ по п.1, в котором биокатализатор включает фермент, выбранный из числа оксидоредуктаз, действующих на группу НС-СН доноров (ЕС 1.3.1 или 1.3.99), предпочтительно из числа оксидоредуктаз (ЕС 1.3.1 и 1.3.99), предпочтительно из числа еноил-СоА-редуктаз (ЕС 1.3.1.8, ЕС 1.3.1.38 и ЕС 1.3.1.44), из числа еноил[ацил-переносящий белок]редуктаз (ЕС 1.3.1.9, ЕС 1.3.1.10 и ЕС 1.3.1.39), из числа бутирил-СоА-дегидрогеназ (ЕС 1.3.99.2), ацил-СоА-дегидрогеназ (ЕС 1.3.99.3) и ацил-СоА-дегидрогеназ длинноцепочечных жирных кислот (ЕС 1.3.99.13).
3. Способ по любому из предыдущих пунктов, в котором биокатализатор включает фермент, который содержит аминокислотную последовательность, выбранную из числа аминокислотных последовательностей, представленных любой из SEQ ID NO: 42-67, 94, 96, 98, 100, 102, 103, 105, 107, 109, 111, 113, 115, 116, и их гомологов, в частности аминокислотную последовательность, выбранную из числа аминокислотных последовательностей, представленных любой из SEQ ID NO: 60, 63, 96, 100, и их гомологов.
4. Способ по любому из предыдущих пунктов, в котором биокатализатор включает фермент из организма, выбранного из числа Escherichia (в частности, Е. coli), Vibrio, Bacillus (в частности, В. subtilis), Clostridium (в частности, С. kluyveri, С. acetobutylicum и С. perfringens), Streptomyces (в частности, S. coelicolor и S. avermitilis), Pseudomonas (в частности, P. putida и P. aeruginosa), Shewanella, Xanthomonas, Xylella, Yersinia, Treponema (в частности, Т. denticola), Eubacterium (в частности, Е. pyruvativorans), Micorscilla (в частности, Micorscilla marina), Aeromonas (в частности, Aeromonas hydrophila), Megasphera (в частности, Megasphera elsdenii), Acinetobacter sp., Deinococcus (в частности, Deinococcus radiodurans), Yarrowia (в частности, Yarrowia lypolytica), Euglenozoa (в частности, Euglena gracilis), Saccharomyces (в частности, S. cerevisiae), Kluyveromyces (в частности, K. lactis), Schizosaccharomyces (в частности, S. pombe), Candida (в частности, С. tropicalis), Aspergillus (в частности, A. niger и A. nidulans), Penicillium (в частности, Р. chrysogenum), Arabidopsis (в частности, A. thaliana), Homo sapiens, Rattus norvegicus, Bos taurus, Cavia sp., Caenorhabditis elegans и Drosophila melanogaster.
5. Способ по любому из предыдущих пунктов, в котором эфир 2,3-дегидроадипата или тиоэфир 2,3-дегидроадипата получают путем превращения эфира 3-гидроксиадипата или тиоэфира 3-гидроксиадипата.
6. Способ по п.5, в котором эфир или тиоэфир 3-гидроксиадипата подвергают биокаталитическому превращению в присутствии биокатализатора, способного катализировать дегидратацию 3-гидроксиацилэфира или 3-гидроксиацилтиоэфира до 2-еноилэфира или -тиоэфира, причем биокатализатор предпочтительно содержит фермент, выбранный из числа гидролиаз (ЕС 4.2.1), предпочтительно из числа еноил-СоА-гидратаз (ЕС 4.2.1.17), 3-гидроксибутирил-СоА-дегидратаз (ЕС 4.2.1.55) и еноил-СоА-гидратаз длинноцепочечных жирных кислот (ЕС 4.2.1.74).
7. Способ по п.6, в котором биокатализатор содержит фермент из организма, выбранного из числа Acinetobacter (в частности, штамма ADP1 Acinetobacter sp. и А. calcoaceticus), Alcaligenes (в частности, Alcaligenes D2), Aspergillus (в частности, A. niger), Azoarcus (в частности, A. evansii), Bacillus (в частности, В. halodurans), Corynebacterium (в частности, С. glutamicum и С. aurantiacum), E. coli, Flavobacterium, Neurospora (в частности, N. crassa), Penicillium (в частности, P. chrysogenum), Pseudomonas (в частности, P. putida и P. fluorescens), Rhodopseudomonas (в частности, R. palustris), Rhodococcus (в частности, штамма RHA1 Rhodococcus sp.), Aeromonas (в частности, A. caviae), Clostridium (в частности, С. acetobutylicum и С. kluyveri), Gossypium (в частности, G. hirsutum), Rhodospirillum (в частности, R. rubrum), Ralstonia (в частности, Ralstonia eutropha), Euglenozoa (в частности, Euglena gracilis), Megasphera (в частности, М. elsdenii) и Saccharomyces (в частности, S. cerevisiae), а также млекопитающих (в частности, Bos taurus, Homo sapiens, Rattus norvegicus и Sus scrofa).
8. Способ по любому из пп.5, 6 или 7, в котором эфир или тиоэфир 3-гидроксиадипата получают путем превращения эфира 3-оксоадипата или тиоэфира 3-оксоадипата.
9. Способ по п.8, включающий биокаталитическое превращение эфира 3-оксоадипата или тиоэфира 3-оксоадипата в присутствии биокатализатора, в частности биокатализатора, способного катализировать восстановление карбонильной группы до спиртовой группы либо способного катализировать восстановление 3-оксоацилэфира или 3-оксоацилтиоэфира до соответствующего 3-гидроксиацилэфира или -тиоэфира, выбранного из числа дегидрогеназ (ЕС 1.1.1), предпочтительно из числа 3-гидроксиацил-СоА-дегидрогеназ (ЕС 1.1.1.35 и ЕС 1.1.1.36), 3-гидроксибутаноил-СоА-дегидрогеназ (ЕС 1.1.1.157), 3-гидроксипимелоил-СоА-дегидрогеназ (ЕС 1.1.1.259) и 3-гидроксиацил-СоА-дегидрогеназ длинноцепочечных жирных кислот (ЕС 1.1.1.211).
10. Способ по п.9, в котором биокатализатор включает фермент из организма, выбранного из числа Acinetobacter (в частности, штамма ADP1 Acinetobacter sp. и А. calcoaceticus), Alcaligenes (в частности, штамма D2 Alcaligenes и A. eutrophus), Arzoarcus (в частности, A. evansii), Bacillus (в частности, В. halodurans), Bordetella (в частности, В. pertussis), Burkholderia (в частности, В. pseudomallei и В. xenovorans), Corynebacterium (в частности, С. glutamicum, С. aurantiacum и С. efficiens), Deinococcus (в частности, D. radiodurans), E. coli, Flavobacterium, Klebsiella (в частности, K. pneumonia), Pseudomonas (в частности, P. putida и P. fluorescens), Rhodopseudomonas (в частности, R. palustris), Rodococcus (в частности, R. erythropolis, R. opacus и штамма RHA1 Rodococcus sp.), Aspergillus (в частности, A. niger), Neurospora (в частности, N. crassa), Penicillium (в частности, P. chrysogenum), Saccharomyces, Bos taurus, Rattus norvegicus, Sus scrofa, Homo sapiens, а также Clostridium (в частности, С. acetobutylicum и С. kluyveri), Euglenozoa (в частности, Euglena gracilis), Megasphera (в частности, Megasphera elsdenii), Ralstonia (в частности, Ralstonia eutropha) и Zoogloea (в частности, Zoogloea ramigera).
11. Способ по любому из пп.8, 9 или 10, в котором эфир 3-гидроксиадипата или тиоэфир 3-гидроксиадипата получают путем введения в реакцию эфира сукцината или тиоэфира сукцината с эфиром ацетата или тиоэфиром ацетата.
12. Способ по п.11, включающий проведение биокаталитической реакции эфира или тиоэфира сукцината с эфиром или тиоэфиром ацетата в присутствии биокатализатора, предпочтительно биокатализатора, включающего фермент, способный переносить ацетильные группы, выбранный из числа ацилтрансфераз (ЕС 2.3.1), в частности из числа ацетил-СоА:ацетил-СоА С-ацетилтрансфераз (ЕС 2.3.1.9), ацил-СоА:ацетил-СоА С-ацилтрансфераз (ЕС 2.3.1.16) и сукцинил-СоА:ацетил-СоА С-сукцинилтрансфераз (ЕС 2.3.1.174), более предпочтительно фермент, содержащий аминокислотную последовательность, приведенную в любой из SEQ ID NO: 1-13, либо ее гомолог.
13. Способ по п.11 или 12, в котором биокатализатор включает фермент из организма, выбранного из числа Acinetobacter (в частности, штамма ADP1 Acinetobacter sp. и A. calcoaceticus), Agrobacterium (в частности, A. tumefaciens), Alcaligenes (в частности, штаммов D2 Alcaligenes и A. eutrophus), Arthrobacter, Arzoarcus (в частности, А. evansii), Azomonas, Azotobacter, Bacillus (в частности, В. halodurans), Beijerinckia, Bradyrhizobium, Burkholderia, Clostridia (в частности, С. kluyveri), Comamonas, Corynebacterium (в частности, С. glutamicum и С. aurantiacum), E. coli, Enterobacter, Flavobacterium, Megasphera (в частности, М. elsdenii), Nocardia, Pseudomonas (в частности, P. putida, P. aeruginosa и штамма В13 Pseudomonas sp.), Ralstonia (в частности, R. eutropha), Rhizobium, Rhodopseudomonas (в частности, R. palustris), Rodococcus (в частности, R. erythropolis, R. opacus и штамма RHA1 Rodococcus sp.), Aspergillus (в частности, A. niger), Euglenozoa (в частности, Euglena gracilis), Neurospora (в частности, N. crassa), Penicillium (в частности, P. chrysogenum), Rhodotorula, Saccharomyces, Trichosporon (в частности, Т. cutaneum).
14. Способ по любому из предыдущих пунктов, в котором любой из указанных эфиров выбран из числа биологических активирующих групп, в частности из числа кофермента А, фосфопантетеина, который может быть связан с ацил- или пептидил-переносящим белком, N-ацетилцистеамина, метилтиогликолата, метилмеркаптопропионата, этилмеркаптопропионата, метилмеркаптобутирата, этилмеркаптобутирата и меркаптопропионата.
15. Способ получения адипиновой кислоты, включающий получение эфира адипата или тиоэфира адипата способом по любому из предыдущих пунктов и гидролиз эфира адипата или тиоэфира адипата, полученного способом по любому из предыдущих пунктов, причем гидролиз предпочтительно катализируется биокатализатором, в частности биокатализатором, включающим фермент, выбранный из числа гидролаз (ЕС 3.1.2).
16. Способ получения адипиновой кислоты, включающий получение эфира адипата или тиоэфира адипата способом по любому из пп.1-14 и перенос активирующей группы эфира адипата или тиоэфира адипата, полученного способом по любому из пп.1-14, причем перенос активирующей группы катализируется биокатализатором, предпочтительно биокатализатором, включающим фермент, катализирующий перенос содержащих серу групп (ЕС 2.8), более предпочтительно из числа СоА-трансфераз (ЕС 2.8.3).
17. Способ получения 5-формилпентаноата, включающий получение эфира адипата или тиоэфира адипата способом по любому из пп.1-14 либо получение адипиновой кислоты способом по п.15 или 16 и превращение эфира адипата, тиоэфира адипата или адипиновой кислоты в 5-формилпентаноат.
18. Способ по п.17, в котором превращение в 5-формилпентаноат катализируется биокатализатором, предпочтительно биокатализатором, включающим фермент, выбранный из числа оксидоредуктаз (ЕС 1.2.1), предпочтительно из числа альдегиддегидрогеназ (ЕС 1.2.1.3, ЕС 1.2.1.4 и ЕС 1.2.1.5), дегидрогеназ малонового полуальдегида (ЕС 1.2.1.15), дегидрогеназ янтарного полуальдегида (ЕС 1.2.1.16 и ЕС 1.2.1.24), дегидрогеназ глутарового полуальдегида (ЕС 1.2.1.20), дегидрогеназ аминоадипинового полуальдегида (ЕС 1.2.1.31), дегидрогеназ адипинового полуальдегида (ЕС 1.2.1.63) либо из числа альдегиддегидрогеназ (ацетилирующих) (ЕС 1.2.1.10), ацил-СоА-редуктаз жирных кислот (ЕС 1.2.1.42), ацил-СоА-редуктаз длинноцепочечных жирных кислот (ЕС 1.2.1.50), бутанальдегидрогеназ (ЕС 1.2.1.57) и дегидрогеназ янтарного полуальдегида (ацетилирующих).
19. Способ получения 6-аминокапроновой кислоты, включающий получение 5-формилпентаноата способом по п.17 или 18 и превращение 5-формилпентаноата в 6-аминокапроновую кислоту.
20. Способ по п.19, в котором превращение катализируется биокатализатором, в частности биокатализатором, способным катализировать трансаминирование и/или восстановительное аминирование, предпочтительно биокатализатором, включающим фермент, выбранный из числа аминотрансфераз (ЕС 2.6.1) и дегидрогеназ аминокислот (ЕС 1.4.1), более предпочтительно из числа β-аминоизобутират:α-кетоглутарат-аминотрансфераз, β-аланин-аминотрансфераз, аспартат-аминотрансфераз, 4-аминобутират-аминотрансфераз (ЕС 2.6.1.19), L-лизин-6-аминотрансфераз (ЕС 2.6.1.36), 2-аминоадипат-аминотрансфераз (ЕС 2.6.1.39), 2-аминовалерат-аминотрансфераз (ЕС 2.6.1.48), 2-аминогексаноат-аминотрансфераз (ЕС 2.6.1.67), лизин:пируват-6-аминотрансфераз (ЕС 2.6.1.71) и лизин-6-дегидрогеназ (ЕС 1.4.1.18).
21. Способ по п.19 или 20, в котором используют аминотрансферазу, содержащую аминокислотную последовательность согласно SEQ ID NO: 82, SEQ ID NO: 83, SEQ ID NO: 84, SEQ ID NO: 134, SEQ ID NO: 136, SEQ ID NO: 138 либо гомолог любой из этих последовательностей.
22. Способ по пп.19, 20 или 21, в котором биокатализатор включает фермент из организма, выбранного из числа Vibrio; Pseudomonas; Bacillus; Mercurialis; Asplenium; Ceratonia; млекопитающих; Neurospora; Escherichia; Thermus; Saccharomyces; Brevibacterium; Corynebacterium; Proteus; Agrobacterium; Geobacillus; Acinetobacter; Ralstonia и Salmonella.
23. Способ получения капролактама, включающий получение 6-аминокапроновой кислоты способом по любому из пп.19-22 и циклизацию 6-аминокапроновой кислоты с образованием капролактама.
24. Клетка-хозяин, содержащая одну или более последовательностей нуклеиновых кислот, кодирующих фермент, охарактеризованный в любом из пп.1-4, 6, 7, 9, 10, 12, 13, 15, 16, 18, 20-22, предпочтительно содержащая по меньшей мере две последовательности нуклеиновых кислот, кодирующих разные ферменты, охарактеризованные в любом из пп.1-3, 4, 6, 7, 9, 10, 12, 13, 15, 16, 18, 20-22.
25. Клетка-хозяин по п.24, содержащая последовательность нуклеиновой кислоты, кодирующей полипептид, представленный любой из SEQ ID NO: 42-67, SEQ ID NO: 74-81, 94, 96, 98, 100, 102, 103, 105, 107, 109, 111, 113, 115, 116, либо его гомолог.
26. Способ по любому из пп.1-23, включающий приведение в контакт клеток, содержащих биокатализатор, который может включать клетку-хозяина по п.24 или 25, либо другой биокатализатор, со сбраживаемым источником углерода, причем источник углерода содержит любые из тех соединений, которые подлежат превращению в получаемое соединение, или же клетки производят соединение, подлежащее превращению в получаемое соединение, из этого источника углерода.
27. Способ получения адипиновой кислоты из янтарной кислоты либо эфира или тиоэфира янтарной кислоты, необязательно по п.15 или 16, через множество реакций, причем по меньшей мере одна из реакций катализируется биокатализатором.
28. Способ по п.27, включающий:
(1) обеспечение эфира или тиоэфира сукцината и введение в реакцию данного эфира или тиоэфира с эфиром или тиоэфиром ацетата с образованием эфира или тиоэфира 3-оксоадипата;
(2) гидрогенизирование 3-оксогруппы эфира или тиоэфира 3-оксоадипата с образованием эфира или тиоэфира 3-гидроксиадипата;
(3) дегидратацию эфира или тиоэфира 3-гидроксиадипата с образованием эфира или тиоэфира 2,3-дегидроадипата;
(4) гидрогенизацию двойной связи С=С эфира или тиоэфира 2,3-дегидроадипата с образованием эфира или тиоэфира адипата и
(5) гидролиз сложноэфирной связи или тиоэфирной связи с образованием адипиновой кислоты.
29. Полипептид с аминокислотной последовательностью, имеющей по меньшей мере 90% идентичности с любой из последовательностей, соответствующей SEQ ID NO: 57, 68, 69, 70, 71, 72, 79 или 85.
30. Полинуклеотид, кодирующий полипептид по п.29.
Текст
СИНТЕЗ ЭФИРОВ ИЛИ ТИОЭФИРОВ АДИПАТА Настоящее изобретение касается способа получения сложных эфиров или тиоэфиров адипата. Изобретение также касается способа получения адипиновой кислоты из данных эфиров или тиоэфиров. Изобретением также предусмотрен ряд способов получения промежуточных соединений для данных эфиров или тиоэфиров. Также изобретение касается способа получения 6-аминокапроновой кислоты (6-АСА), способа получения 5-формилвалериановой кислоты (5-FVA) и способа получения капролактама. Кроме того, изобретение касается клеток хозяина для применения в способах по изобретению. Ву Лиан, Трефцер Аксель Кристоф (NL),Де Вильдеман Стефаан Мари Андре (BE),Ван дер Берг Марко Александр (NL)(71)(73) Заявитель и патентовладелец: ДСМ АйПи АССЕТС Б.В. (NL) Область техники, к которой относится изобретение Настоящее изобретение касается способа получения сложных эфиров или тиоэфиров адипата. Изобретение также касается способа получения адипиновой кислоты из данных эфиров или тиоэфиров. Изобретением также предусмотрен ряд способов получения промежуточных соединений для данных эфиров или тиоэфиров. Также изобретение касается способа получения 6-аминокапроновой кислоты (6-АСА),способа получения 5-формилвалериановой кислоты (5-FVA) и способа получения капролактама. Кроме того, изобретение касается клеток-хозяев для применения в способах по изобретению. Сведения о предшествующем уровне техники Адипиновая кислота (гександионовая кислота) применяется, среди прочего, для получения полиамида. Кроме того, эфиры адипиновой кислоты могут применяться в пластификаторах, смазывающих веществах, растворителях и в ряде полиуретановых смол. Другие применения адипиновой кислоты - в качестве пищевых подкислителей, а также в адгезивах, инсектицидах, при дублении и окрашивании. Известные способы получения включают окисление циклогексанола или циклогексанона либо их смеси(KA-масла) с помощью азотной кислоты. Капролактам - это лактам, который тоже может применяться для получения полиамида, к примеру,нейлона-6 или сополимеров капролактама-лауролактама (нейлона-6,12). Известны различные способы получения капролактама из валовых химикатов, которые включают получение капролактама из циклогексанона, толуола, фенола, циклогексанола, бензола или циклогексана. Промежуточные соединения для получения адипиновой кислоты или капролактама, как-то циклогексанол, циклогексанон или фенол, обычно получают из минерального масла (нефти). Ввиду все возрастающего стремления к получению материалов при помощи более восполняемой технологии было бы желательно обеспечить способ, в котором адипиновая кислота или капролактам получается из такого промежуточного соединения, которое можно получать из биологически возобновляемого источника либо по крайней мере из такого промежуточного соединения, которое превращается в адипиновую кислоту или капролактам биохимическим способом. В US 5487987 описан способ получения адипиновой кислоты, в котором используются бактериальные клетки, при этом источник углерода подвергается превращению в 3-дегидрошикимат под действием ферментов общего пути биосинтеза ароматических аминокислот бактериальной клетки с образованием цис, цис-муконовой кислоты при биокаталитическом превращении 3-дегидрошикимата. После этого цис,цис-муконовая кислота подвергается химическому восстановлению (с помощью платинового катализатора) с образованием адипиновой кислоты. Таким образом, на конечной стадии требуется химический катализ. Кроме того, авторы настоящего изобретения предвидят, что образующиеся в бактериальных клетках ароматические промежуточные продукты могут быть токсичными для клеток, из-за чего их концентрации должны быть низкими in vivo, а также в культуре клеток. Известно получение капролактама из 6-аминокапроновой кислоты (6-АСА), например, как описано в US-A 6194572. Как изложено в WO 2005/068643, 6-АСА можно получить биохимическим способом путем превращения 6-аминогекс-2-еновой кислоты (6-АНЕА) в присутствии фермента, обладающего,-еноатредуктазной активностью. 6-АНЕА можно получить из лизина, например, биохимическим способом или чисто химическим синтезом. Хотя 6-АСА и можно получить путем восстановления 6-АНЕА способами, изложенными в WO 2005/068643, но авторы изобретения обнаружили, что - в условиях восстановительной реакции - 6-АНЕА может спонтанно и практически необратимо подвергаться циклизации с образованием нежелательного побочного продуктагомопролина. Такая циклизация может стать узким местом при получении 6-АСА и привести к существенному снижению выхода. Целью изобретения является получение нового способа получения адипиновой кислоты или капролактама - которые могут использоваться, среди прочего, для получения полиамида - либо промежуточного соединения для адипиновой кислоты или капролактама, который может послужить альтернативой известным способам. Другой целью является получение нового способа, который мог бы преодолеть один или несколько недостатков, указанных выше. Одна или несколько других задач, которые могут быть решены в соответствии с изобретением, станут видны из нижеследующего описания. Сущность изобретения Авторы изобретения поняли, что адипат (либо его эфир или тиоэфир) может быть получен из сукцината (либо его эфира или тиоэфира). В частности, они решили, что (тио)эфир адипата может быть получен из (тио)эфира сукцината и (тио)эфира ацетата через серию специфических реакций, например, аналогично обратной последовательности -окисления и биосинтеза жирных кислот в живых клетках, как показано на фиг. 2. При этом каждый R независимо означает активирующую группу (способствующую реакции), например, как описано ниже. Каждый X независимо означает S или О. ED/EDH2 обозначают окисленные/восстановленные доноры электронов, к примеру, NAD/NADH, NADP/ NADPH, FAD/ FADH2 или окисленный ферредоксин/восстановленный ферредоксин. Фактический перенос электронов может происходить непосредственно либо при помощи промежуточных переносчиков электронов типа кофер-1 018381 ментов или переносящих электроны флавопротеидов (ETF). Y-NH2 обозначает донора аминогрупп, например, как описано ниже. Итак, авторы изобретения пришли к выводу, что адипиновую кислоту (либо е эфир или тиоэфир) можно будет получить биокаталитическим путем через каскад реакций из сукцината (либо его эфира или тиоэфира) и ацетата (либо его эфира или тиоэфира). Далее они поняли, что адипиновую кислоту биокаталитическим путем можно превратить в 5-формилпентановую кислоту (5-FVA, 5-формилвалериановую кислоту), которая является промежуточным соединением для получения 6-АСА, причем для этого превращения можно использовать специфический биокатализатор. Соответственно, настоящее изобретение касается способа получения эфиров или тиоэфиров адипата из эфиров или тиоэфиров сукцината посредством нескольких реакций, причем по крайней мере одна из этих реакций катализируется биокатализатором. В частности, изобретение касается способа получения эфиров адипата или тиоэфиров адипата,включающего превращение эфира 2,3-дегидроадипата (название по системе IUPAC: 5-карбокси-2 пентаноат) или тиоэфира 2,3-дегидроадипата в эфир или тиоэфир адипата в присутствии биокатализатора. При упоминании карбоновых кислот или карбоксилатов, например, 6-АСА, других аминокислот, 5FVA, адипиновой кислоты/адипата, янтарной кислоты/сукцината, уксусной кислоты/ацетата, эти термины должны охватывать протонированную карбоновую кислоту (свободную кислоту), соответствующий карбоксилат (е сопряжнное основание), а также их соли, если не указано иначе. При упоминании аминокислот, например 6-АСА, этот термин должен охватывать аминокислоты в виде цвиттерионов (у которых аминогруппа протонирована, а карбоксигруппа депротонирована), аминокислоты, у которых аминогруппа протонирована, а карбоксигруппа нейтральна, и аминокислоты, у которых аминогруппа нейтральна, а карбоксигруппа депротонирована, а также их соли. При упоминании эфиров или тиоэфиров карбоновых кислот, например эфиров или тиоэфиров адипата, эфиров или тиоэфиров ацетата, эфиров или тиоэфиров сукцината, эти термины должны охватывать любые активирующие группы, в частности любые биологические активирующие группы, включая кофермент А (также обозначается как СоА), фосфопантетеин, который может быть связан с ацилпереносящим белком или пептидил-переносящим белком (АСР или РСР, соответственно), Nацетилцистеамин, метилтиогликолат, метилмеркаптопропионат, этилмеркаптопропионат, метилмеркаптобутират, этилмеркаптобутират, меркаптопропионат и другие эфиры или тиоэфиры, выполняющие те же или аналогичные функции. В том случае, когда в качестве биокатализатора используются живые клетки, эфир или тиоэфир, в частности, СоА, может вырабатываться под действием данного биокатализатора либо исходить от организма, также способного вырабатывать подходящий фермент, катализирующий эту реакцию. СоА-лигазы и СоА-трансферазы идентифицированы у многих организмов и могут обеспечивать требуемые активированные эфиры или тиоэфиры. Получение эфира или тиоэфира адипата из эфира или тиоэфира сукцината, в частности, может включать следующие стадии реакции (цифры в скобках также соответствуют фиг. 1):(1) обеспечение эфира или тиоэфира сукцината и проведение реакции данного эфира или тиоэфира с эфиром или тиоэфиром ацетата, при этом образуется эфир или тиоэфир 3-оксоадипата;(2) гидрогенизирование 3-оксогруппы эфира или тиоэфира 3-оксоадипата, при этом образуется эфир или тиоэфир 3-гидроксиадипата;(3) дегидратирование эфира или тиоэфира 3-гидроксиадипата, при этом образуется эфир или тиоэфир 2,3-дегидроадипата;(4) гидрогенизирование двойной связи С=С эфира или тиоэфира 2,3-дегидроадипата, при этом образуется эфир или тиоэфир адипата. Изобретение также касается способа получения промежуточных соединений, пригодных для применения в способе получения адипиновой кислоты, который включает проведение одной или нескольких из данных стадий реакций 1-4 в присутствии биокатализатора, катализирующего такую стадию реакции. В одном воплощении эфир или тиоэфир адипата подвергается превращению в 5-FVA (5). Если нужно, эфир или тиоэфир адипата можно превратить в адипиновую кислоту. Это можно осуществить путем гидролиза сложноэфирной связи или тиоэфирной связи (7), при этом образуется адипиновая кислота, либо при реакции переноса, в которой спиртовая или тиоловая группировка (типа СоА) переносится из эфира или тиоэфира адипата на другую кислоту, чем адипиновая, при этом образуется адипиновая кислота и (тио)эфир другой кислоты, чем адипиновая (7). Если в качестве другой кислоты используется янтарная кислота или ацетат, то эта реакция может оказаться выгодной тем, что можно реутилизировать спиртовую или тиоловую группировку типа СоА. Например, можно подвергнуть превращению адипил-СоА + сукцинат или ацетат (обычно в присутствии СоА-трансферазы) с образованием сукцинил-СоА или ацетил-СоА + адипиновой кислоты. Затем сукцинил-СоА или ацетил-СоА можно использовать как исходное соединение в способе изобретения. Адипиновую кислоту (либо е эфир или тиоэфир) можно подвергнуть превращению, например, в 5FVA (8). В одном воплощении полученный способом изобретения 5-FVA подвергается превращению в 6-2 018381 АСА (6). После этого 6-АСА может быть превращена в капролактам, например, известным в этой области способом. В другом воплощении полученную способом изобретения адипиновую кислоту или капролактам можно использовать для получения полиамида. Употребление в настоящем изобретении термина в единственном числе определяется как "по меньшей мере одно", если не указано иначе. Если существительное (например, соединение, добавка и т.п.) приводится в единственном числе, то это значит, что включается и множественное число. Если приводится соединение, у которого есть несколько изомеров (например, цис- и транс-изомер,R- и S-энантиомер), то соединение в принципе включает все энантиомеры, диастереомеры и цис/трансизомеры этого соединения, которые могут использоваться в определенном способе изобретения. Если фермент приводится со ссылкой на классификацию фермента (ЕС) в скобках, то класс фермента означает класс, к которому он относится или может быть отнесен на основе Номенклатуры ферментов, представленной Комитетом по номенклатуре Международного союза по биохимии и молекулярной биологии (NC-IUBMB), которая приведена на: http://www.chem.qmul.ac.uk/iubmb/enzyme/. Она должна охватывать и другие подходящие ферменты, которые (еще) не были отнесены к определенному классу, но могут быть отнесены. Если белок приводится со ссылкой на номер доступа, то этот номер, в частности, используется для обозначения белка с последовательностью, приведенной в Uniprot по состоянию на 11 марта 2008 г., если не указано иначе. Термин "гомолог" в настоящем изобретении применяется, в частности, для тех полинуклеотидов или полипептидов, у которых последовательности идентичны по меньшей мере на 30%, предпочтительно по меньшей мере на 40%, более предпочтительно по меньшей мере на 60%, более предпочтительно по меньшей мере на 65%, более предпочтительно по меньшей мере на 70%, более предпочтительно по меньшей мере на 75%, более предпочтительно по меньшей мере на 80%, в особенности по меньшей мере на 85%, более предпочтительно по меньшей мере на 90%, по меньшей мере на 91%, на 92%, на 93%, на 94%, на 95%, на 96%, на 97%, на 98% или на 99%. Термин гомолог также охватывает последовательности нуклеиновых кислот (последовательности полинуклеотидов), которые отличаются от последовательности другой нуклеиновой кислоты вследствие вырожденности генетического кода, но кодируют последовательность одного и того же полипептида. Идентичность или сходство последовательностей при этом определяется как взаимосвязь между последовательностями двух или нескольких полипептидов либо двух или нескольких нуклеиновых кислот при определении путем сравнения последовательностей. Обычно сравнение последовательностей проводится по всей их длине, но оно может проводиться и по какой-то части последовательностей, совмещающихся друг с другом. В данной области "идентичность" или "сходство" также означает степень родства между последовательностями полипептидов или же последовательностями нуклеиновых кислот при определении по совпадению между такими последовательностями. Предпочтительные методы определения идентичности или сходства призваны дать наибольшее совпадение между тестируемыми последовательностями. В контексте настоящего изобретения предпочтительный метод определения идентичности или сходства между двумя последовательностями включает компьютерные программы BLASTP иBLASTN (Altschul S.F. et al., J. Mol. Biol. 1990, 215, 403-410), которые общедоступны из NCBI и других источников (BLAST Manual, Altschul S. et al., NCBI NLM NIH Bethesda, MD 20894). Предпочтительные параметры для сравнения последовательностей полипептидов методом BLASTP: открытие бреши 10.0,расширение бреши 0,5, матрица Blosum 62. Предпочтительные параметры для сравнения последовательностей нуклеиновых кислот методом BLASTN: открытие бреши 10.0, расширение бреши 0.5, полная матрица ДНК (матрица идентичности для ДНК). В способе по изобретению используется биокатализатор, т.е. по крайней мере одна стадия реакции в способе катализируется биологическим материалом или молекулой, происходящей из биологического источника, к примеру, организмом или происходящей из него биомолекулой. В частности, биокатализатор может включать один или несколько ферментов. Биокатализатор может использоваться в любом виде. В одном воплощении используется один или несколько ферментов, выделенных из естественной среды (из организма, в котором он вырабатывался), например, в виде раствора, эмульсии, дисперсии, (суспензии) лиофилизованных клеток, лизата, либо иммобилизованных на подложке. Использование фермента, выделенного из того организма, из которого он происходит, может быть полезным, в частности,принимая во внимание повышенную гибкость при подборе условий реакции с тем, чтобы равновесие реакции сместилось в нужную сторону. В одном воплощении один или несколько ферментов входят в состав живого организма (как-то живых целых клеток). Ферменты могут выполнять каталитические функции внутри клетки. Может быть и так, что ферменты секретируются в среду, в которой находятся клетки. Живые клетки могут представлять собой растущие клетки, покоящиеся или спящие клетки (например, споры) либо клетки в стационарной фазе. Также можно использовать ферменты, входящие в состав пермеабилизованных клеток (т.е. ставших проницаемыми для субстрата фермента либо предшественника субстрата фермента или ферментов). Биокатализатор, используемый в способе по изобретению, в принципе может представлять собой любой организм либо быть полученным или происходить из любого организма. Организм может представлять собой эукариоты, бактерии или архебактерии. В частности, организм может быть выбран из животных (включая человека), растений, бактерий, архебактерий, дрожжей и грибов. Подходящие бактерии, в частности, могут быть выбраны из числа Absidia, Achromobacter, Acinetobacter, Agrobacterium, Aeromonas, Alcaligenes, Arthrobacter, Arzoarcus, Azomonas, Azospirillum, Azotobacter, Bacillus, Beijerinckia, Bradyrhizobium, Burkholderia, Byssochlamys, Citrobacter, Clostridium, Comamonas, Corynebacterium, Deinococcus, Escherichia, Enterobacter, Flavobacterium, Fusobacterium, Gossypium,Klebsiella, Lactobacillus, Listeria, Megasphaera, Micrococcus, Mycobacterium, Nocardia, Porphyromonas,Propionibacterium, Pseudomonas, Ralstonia, Rhizobium, Rhodopseudomonas, Rhodospirillum, Rodococcus,Roseburia, Shewanella, Streptomycetes, Xanthomonas, Xylella, Yersinia, Treponema, Vibrio, Streptococcus,Lactococcus, Zymomonas, Staphylococcus, Salmonella, Brucella, Microscilla. Подходящие эукариоты могут быть выбраны, в частности, из числа грибов; метазоа; Viridiplantae (в частности, Arabidopsis и Chlamydomonadales); дипломонад (в частности, Giardiinae); Entamoebidae (в частности, Entamoeba); Euglenozoa (в частности, Euglena); Pelobiontida (в частности, Mastigamoeba) и Alveolata (в частности, Cryptosporidium). Подходящими грибами, в частности, являются грибки и дрожжи, выбранные из числа Rhizopus,Neurospora, Penicillium, Aspergillus, Piromyces, Trichosporon, Candida, Hansenula, Kluyveromyces, Saccharomyces, Rhodotorula, Schizosaccharomyces, Yarrowia (как-то Yarrowia lypolytica). Подходящими многоклеточными, в частности, являются метазоа, выбранные из числа млекопитающих (включая человека), в особенности выбранные из числа Leporidae, Muridae, Suidae, Bovidae,Hominidae. Биокатализатор может происходить из любой части многоклеточного организма, например печени, поджелудочной железы, мозга, почек, сердца или иного органа. Подходящими многоклеточными также могут быть, в частности, Caenorhabditis и Drosophila. Организмы, которые в особенности могут обеспечить подходящий биокатализатор для определенной стадии реакции, приведены ниже, при описании конкретных стадий реакции способа по изобретению. Специалистам в этой области должно быть ясно, что в способе по изобретению можно использовать природные биокатализаторы (дикого типа) или мутанты природных биокатализаторов с подходящей активностью. Свойства природных биокатализаторов могут быть улучшены биологическими методами,известными в этой области, такими, к примеру, как метод молекулярной эволюции или рационального проектирования. Так, мутанты биокатализаторов дикого типа могут быть получены путем модификации кодирующей ДНК организма, способного действовать в качестве биокатализатора либо способного вырабатывать биокаталитическую молекулу (как-то фермент), используя методы мутагенеза, известные в этой области (случайного мутагенеза, направленного мутагенеза, направленной эволюции, рекомбинации генов и др.). В частности, можно модифицировать ДНК таким образом, чтобы она кодировала фермент, отличающийся хотя одной аминокислотой от фермента дикого типа, чтобы она кодировала фермент, содержащий одну или несколько замен, делеций и/или вставок аминокислот по сравнению с диким типом, или чтобы мутанты сочетали последовательности двух или нескольких исходных ферментов, либо осуществлять экспрессию модифицированной таким образом ДНК в подходящих клетках-хозяевах. Последнее может совершаться методами, известными в этой области, как-то оптимизации кодонов или оптимизации пар кодонов, например на основе метода, описанного в WO 2008/000632). Мутантный биокатализатор может обладать улучшенными свойствами, например, по одному или нескольким из следующих аспектов: избирательности в отношении субстрата, активности, стабильности,устойчивости к растворителям, рН-профиля, температурного профиля, субстратного профиля, подверженности ингибированию, употреблению кофакторов и сродства к субстратам. Мутанты с улучшенными свойствами могут быть идентифицированы, например, с применением подходящих методов высокопроизводительного скрининга или отбора на основе известных методов. Можно модифицировать субстратную специфичность ферментов, действующих на алкильные эфиры или тиоэфиры. Можно применить метод молекулярной эволюции для создания разнообразия, а затем провести скрининг на наличие нужных мутантов, и/или метод рациональной инженерии связывающих субстрат карманов. Методы модификации субстратной специфичности ферментов, используемых в способе изобретения, могут быть основаны на методах, описанных в этой области. Например, рациональная инженерия с использованием информации о структуре и последовательности для разработки специфических мутаций применялась для модификации субстратной специфичности ацилтрансферазного домена 4 из эритромицин-поликетидсинтазы на прием альтернативных доноров ацильных групп. Было показано,что модификация предполагаемого сайта связывания субстрата привела к тому, что модифицированный связывающий карман может вмещать альтернативные субстраты и давать различные пропорции продуктов (Reeves CD., Murli S., Ashley G.W., Piagentini M., Hutchinson C.R., McDaniel R. Biochemistry 2001,40(51), 15464-15470). Методы рационального проектирования и молекулярной эволюции применялись для изменения субстратной специфичности биокатализатора ВМЗ, что привело к получению большого числа мутантов, обладающих способностью к окислению целого ряда различных алкенов, циклоалкенов,аренов и гетероаренов вместо или наряду с природньм субстратом - среднецепочечными жирными кислотами (например, миристиновой кислотой) (Peters M.W., Meinhold P., Glieder A., Arnold F.H. Journal ofU., Schmid R.D. Journal of Biotechnology 2001, 88(2), 167-171 и приведенные там ссылки). Если указан биокатализатор, в частности фермент, из определенного источника, то рекомбинантные биокатализаторы, в частности ферменты, происходящие из первого организма, но фактически вырабатываемые в (генетически модифицированном) втором организме, определенно причисляются к биокатализаторам, в частности, ферментам, из этого первого организма. Получение эфира или тиоэфира 3-оксоадипата (реакция 1) В одном воплощении изобретения эфир или тиоэфир 3-оксоадипата получают из сукцината и ацетата, причем сукцинат и/или ацетат обычно снабжаются активирующей группой, в частности, дающей эфир или тиоэфир, что способствует реакции. Получение эфира или тиоэфира 3-оксоадипата может осуществляться биокаталитическим или химическим путем, в частности, по конденсации Кляйзена, при которой происходит конденсация эфира или тиоэфира ацетата и эфира или тиоэфира сукцината. В предпочтительном способе изобретения получение включает биокаталитическую реакцию в присутствии биокатализатора, способного катализировать перенос ацильных групп. Поэтому фермент, обладающий такой каталитической активностью, может быть назван ацилтрансферазой. В предпочтительном способе происходит перенос ацильных групп между двумя ацилсодержащими тиоэфирами или ацилсодержащими эфирами. Предпочтительными ацил-тиоэфирами являются ацетилСоА и сукцинил-СоА. Предпочтительно данный биокатализатор избирателен в отношении данных ацилтиоэфиров. Биокатализатор, в частности, может включать фермент, способный переносить ацильные группы,выбранный из числа ацилтрансфераз (ЕС 2.3.1), предпочтительно из числа ацетил-СоА:ацетил-СоА Сацетилтрансфераз (ЕС 2.3.1.9), ацил-СоА:ацетил-СоА С-ацилтрансфераз (ЕС 2.3.1.16) и сукцинилСоА:ацетил-СоА С-сукцинилтрансфераз (ЕС 2.3.1.174, также известных как -кетоадипил-СоА-тиолазы). В базе данных KEGG (Kyoto Encyclopedia of Genes and Genomes) ацилтрансферазная активность описана,к примеру, при -окислении, биосинтезе жирных кислот, биосинтезе поликетидов или метаболизме бутаноата. Ацилтрансфераза, в частности, может представлять собой ацилтрансферазу из организма, выбранного из числа архебактерий, бактерий и эукариот. В частности, фермент может происходить из микроорганизма, способного разлагать органические соединения, содержащие ароматическую или алициклическую кольцевую структуру, в частности 5-, 6 или 7-членную кольцевую структуру. Органическое соединение необязательно может содержать один или несколько гетероатомов в кольце или в качестве заместителя или части заместителя. Например, органическая молекула может представлять собой ароматическое соединение, в частности ароматическое соединение, содержащее 6-членное кольцо. В частности, ароматическое соединение может быть выбрано из числа фенилацетата, бензоата, катехола, протокатехата и гентизата. Органическое соединение может представлять собой алициклическое соединение, в частности циклический спирт типа циклогексанола,циклический кетон типа циклогексанона или циклоалкан типа циклогексана. Органическое соединение может представлять собой лактам типа капролактама. В одном воплощении фермент происходит из организма, способного разлагать дикарбоновые кислоты (обычно С 6-С 10), в частности неразветвленные насыщенные дикарбоновые кислоты типа адипиновой кислоты. В другом воплощении фермент происходит из организма, способного синтезировать 3-кетоадипат,предпочтительно как составную часть вторичного метаболита (например, малономицина), к примеру, изStreptomycetes (в частности, Streptomyces rimosus), из Actinomyces, из других актинобактерий или иных известных продуцентов вторичных метаболитов. Предпочтительные микроорганизмы для обеспечения биокатализатора, способного катализировать получение эфира или тиоэфира 3-оксоадипата, также включают Acinetobacter (в частности, штамм ADP1glutamicum и С. aurantiacum), E. coli, Enterobacter, Flavobacterium, Megasphera (в частности, М. elsdenii),Nocardia, Pseudomonas (в частности, P. putida, P. aeruginosa и штамм В 13 Pseudomonas sp.), Ralstonia (в частности, R. eutropha), Rhizobium, Rhodopseudomonas (в частности, R. palustris), Rodococcus (в частности, R. erythropolis, R. opacus и штамм RHA1 Rodococcus sp.), Aspergillus (в частности, A. niger), Euglenozoa (в частности, Euglena gracilis), Neurospora (в частности, N. crassa), Penicillium (в частности, Р. chrysogenum), Rhodotorula, Saccharomyces, Trichosporon (в частности, Т. cutaneum). В конкретном воплощении биокатализатор включает фермент, содержащий аминокислотную по-5 018381 следовательность, приведенную в любом из SEQ ID NO: 1-13, либо гомологичную ей. Получение эфира или тиоэфира 3-гидроксиадипата (реакция 2) В одном воплощении эфир или тиоэфир 3-гидроксиадипата получают из эфира или тиоэфира 3 оксоадипата. Обычно 3-оксоадипат снабжается активирующей группой, как указано выше. В принципе эфир или тиоэфир 3-гидроксиадипата может быть получен химическим путем, например при избирательной гидрогенизации 3-оксогруппы в эфире или тиоэфире 3-оксоадипата. Эта реакция, в частности, может проводиться в присутствии биокатализатора, катализирующего стадию этой реакции, в частности биокатализатора, способного катализировать восстановление оксогруппы, в частности карбонильной группы, до гидроксильной группы. В конкретном воплощении 3-оксоадипат присутствует в виде тиоэфира с коферментом А (в дальнейшем тиоэфир 3-оксоадипата и кофермента А именуется как 3-оксоадипил-СоА). В предпочтительном способе изобретения получение включает биокаталитическую реакцию в присутствии биокатализатора, способного катализировать восстановление 3-оксоацил-(эфира или тиоэфира) до 3-гидроксиацил-(эфира или тиоэфира). Поэтому фермент, обладающий такой каталитической активностью, можно назвать 3-гидроксиацил-(эфир или тиоэфир)дегидрогеназой. А фермент, обладающий такой каталитической активностью в отношении тиоэфира - 3-гидроксиацил-СоА, может быть назван 3 гидроксиацил-СоА-дегидрогеназой. Предпочтительно данная 3-гидроксиацил-СоА-дегидрогеназа избирательна в отношении субстрата- 3-оксоадипил-СоА. Фермент, способный катализировать восстановление 3-оксоацил-(эфира или тиоэфира) до 3 гидроксиацил-(эфира или тиоэфира), в частности, может быть выбран из числа дегидрогеназ (ЕС 1.1.1),предпочтительно из числа 3-гидроксиацил-СоА-дегидрогеназ (ЕС 1.1.1.35 и ЕС 1.1.1.36), 3 гидроксибутаноил-СоА-дегидрогеназ (ЕС 1.1.1.157), 3-гидроксипимелоил-СоА-дегидрогеназ (ЕС 1.1.1.259) и 3-гидроксиацил-СоА-дегидрогеназ длинноцепочечных жирных кислот (ЕС 1.1.1.211). В качестве кофактора эти ферменты могут использовать NADH или NADPH. Согласно базе данных KEGG(Kyoto Encyclopedia of Genes and Genomes), 3-гидроксиацил-СоА-дегидрогеназная активность описана, к примеру, при метаболизме жирных кислот, биосинтезе поликетидов, метаболизме полигидроксиалканоатов, метаболизме бутаноата, а также при деградации ароматических соединений. В частности, фермент может происходить из микроорганизмов, способных разлагать органические соединения, приведенные выше (см. реакцию 1), в частности ароматические соединения, алициклические соединения или дикарбоновые кислоты. Другие предпочтительные организмы для обеспечения биокатализатора, способного катализировать получение эфира или тиоэфира 3-гидроксиадипата, включают Acinetobacter (в частности, штамм ADP1chrysogenum), Saccharomyces (в частности, S. cerevisiae). Подходящим организмом для обеспечения фермента ЕС 1.1.1.35, действующего на 3 кетогексаноил-СоА, может быть любой организм, включая млекопитающих, в частности млекопитающих из числа Bos tauras, Rattus norvegicus, Sus scrofa и Homo sapiens. Подходящий биокатализатор, участвующий в (анаэробном) синтезе жирных кислот, биосинтезе поликетидов или метаболизме полигидроксиалканоатов, может происходить из любых организмов, в частности микроорганизмов, включая Clostridium (в частности, С. acetobutylicum и С. kluyveri), Euglenozoa (в частности Euglena gracilis), Megasphera (в частности, Megasphera elsdenii), Ralstonia (в частности, Ralstonia eutropha) и Zoogloea (в частности, Zoogloea ramigera). В конкретном воплощении биокатализатор (катализирующий реакцию 2) включает фермент, содержащий аминокислотную последовательность, приведенную в любом из SEQ ID NO: 15-26 и 29, либо гомологичную ей. Предусматривается, в частности, что фермент, содержащий аминокислотную последовательность согласно SEQ ID NO: 26, может катализировать как реакцию 2, так и реакцию 3. Получение эфира или тиоэфира 2,3-дегидроадипата (реакция 3) В одном воплощении эфир или тиоэфир 2,3-дегидроадипата (5-карбокси-2-пентеноата) получают из эфира или тиоэфира 3-гидроксиадипата. Необязательно 2,3-дегидроадипат и 3-гидроксиадипат конъюгируют с коферментом, АСР или иной активирующей группой, как указано выше. В одном воплощении изобретения эфир или тиоэфир 2,3-дегидроадипата получают путем химического превращения эфира или тиоэфира 3-гидроксиадипата, например, при дегидратации в безводной среде в присутствии, например, серной кислоты. В частности, 2,3-дегидроадипат может быть получен из 3-гидроксиадипата с помощью по крайней мере одного биокатализатора. Предпочтительным биокатализатором является такой биокатализатор, который способен катализи-6 018381 ровать дегидратацию 3-гидроксиацил-эфира или -тиоэфира до его 2-еноил-эфира или 2-еноил-тиоэфира. В конкретном воплощении 2,3-дегидроадипат присутствует в виде тиоэфира с коферментом А (в дальнейшем тиоэфир 2,3-дегидроадипата и кофермента А именуется как 5-карбокси-2-пентеноил-СоА). В конкретном воплощении биокатализатор катализирует дегидратацию 3-гидроксиадипил-СоА до 5-карбокси-2-пентеноил-СоА. В частности, биокаталитическая реакция может проводиться в присутствии биокатализатора, способного катализировать дегидратацию 3-гидроксиацил-(тио)эфира до 2,3-дегидроацил-тиоэфира. Поэтому фермент, обладающий такой каталитической активностью, может быть назван 3-гидроксиацил-(эфир или тиоэфир)дегидратазой. А фермент, обладающий такой каталитической активностью в отношении тиоэфира - 3-гидроксиацил-СоА, может быть назван 3-гидроксиацил-СоА-дегидратазой. Предпочтительно данная 3-гидроксиацил-СоА-дегидратаза избирательна в отношении субстрата - 3-гидроксиадипилСоА. Фермент, способный катализировать дегидратацию 3-гидроксиацил-(эфира или тиоэфира) до 2,3 дегидроацил-(эфира или тиоэфира), в частности, может быть выбран из числа гидролиаз (ЕС 4.2.1),предпочтительно из числа еноил-СоА-гидратаз (ЕС 4.2.1.17), 3-гидроксибутирил-СоА-дегидратаз (ЕС 4.2.1.55) и еноил-СоА-гидратаз длинноцепочечных жирных кислот (ЕС 4.2.1.74). Согласно базе данныхKEGG, 3-гидроксиацил-СоА-дегидратазная активность описана, к примеру, при метаболизме жирных кислот, синтезе поликетидов и метаболизме бутаноата, а также при деградации ароматических соединений. 3-Гидроксиацил-(эфир или тиоэфир)дегидратаза может представлять собой 3-гидроксиацил-(эфир или тиоэфир)дегидратазу из организма, выбранного из числа архебактерий, бактерий и эукариот, например из числа дрожжей, грибов и млекопитающих. В частности, предпочтительным источником биокатализатора, катализирующего получение "эфира или тиоэфира 2,3-дегидроадипата, являются микроорганизмы, способные разлагать органические соединения, приведенные выше (см. реакцию 1), в частности, ароматические соединения, алициклические соединения или дикарбоновые кислоты. Микроорганизмы, способные разлагать ароматические соединения, алициклические соединения или дикарбоновые кислоты, включают Acinetobacter (в частности, штамм ADP1 Acinetobacter sp. и A.palustris), Rhodococcus (в частности, штамм RHA1 Rodococcus sp.). Предпочтительным организмом для обеспечения фермента ЕС 4.2.1.17, действующего на 3 гидроксигексаноил-СоА, является организм, выбранный из числа млекопитающих и микроорганизмов. Подходящий фермент ЕС 4.2.1.17 из млекопитающих, в частности, может происходить из млекопитающего, выбранного из числа Bos taurus, Homo sapiens, Rattus norvegicus и Sus scrofa. Подходящий фермент ЕС 4.2.1.17 из микроорганизмов, в частности, может происходить из микроорганизма, выбранного из числа Aeromonas (в частности, A. caviae), Clostridium (в частности, С. acetobutylicum), Gossypium (в частности, G. hirsutum), Rhodospirillum (в частности, R. rubrum) и Ralstonia (в частности, Ralstonia eutropha). Также предпочтительны микроорганизмы, способные к (анаэробному) биосинтезу жирных кислот. Такие микроорганизмы включают Clostridium (в частности, С. acetobutylicum и С. kluyveri), Euglenozoa (в частности, Euglena gracilis), Megasphera (в частности, М. elsdenii) и Saccharomyces (в частности, S. cerevisiae). Подходящий фермент, в частности, может содержать аминокислотную последовательность согласно любому из SEQ ID NO: 14, 27, 28, 30-41 и 92 либо гомологичную ей. Получение эфира или тиоэфира адипата из эфира или тиоэфира 2,3-дегидроадипата (реакция 4) В одном воплощении эфир или тиоэфир адипата получают из эфира или тиоэфира 2,3 дегидроадипата. Эфир или тиоэфир адипата может быть получен из эфира или тиоэфира 2,3 дегидроадипата химическим путем, например, при избирательной гидрогенизации двойной связи С 2=С 3,либо биокаталитическим путем. Обычно 2,3-дегидроадипат снабжается активирующей группой, как указано выше. Эфир или тиоэфир адипата предпочтительно получают из эфира или тиоэфира 2,3-дегидроадипата с помощью по крайней мере одного биокатализатора, катализирующего гидрогенизацию двойной связи С=С эфира или тиоэфира 5-карбокси-2-пентеноата. В предпочтительном способе изобретения получение включает биокаталитическую реакцию в присутствии биокатализатора, способного катализировать восстановление цис-или транс-2-еноил-(эфира или тиоэфира) до ацил-(эфира или тиоэфира). Биокатализатор может использовать целый ряд доноров электронов, например, из числа NADH, NADPH, FADH2 и восстановленного ферредоксина. Электроны могут переноситься непосредственно с донора электронов на биокатализатор или же при помощи, в частности,так называемых переносящих электроны флавопротеидов (ETF). Поэтому фермент, обладающий такой каталитической активностью, может быть назван 2-еноил-(эфир или тиоэфир)редуктазой (ER). А фер-7 018381 мент, обладающий такой каталитической активностью в отношении тиоэфира - 2-еноил-СоА, может быть назван 2-еноил-СоА-редуктазой. Предпочтительно данная 2-еноил-СоА-редуктаза избирательна в отношении субстрата -2,3-дегидроадипил-CoA. Фермент, способный катализировать восстановление 2-еноил-(эфира или тиоэфира), в частности,может быть выбран из числа оксидоредуктаз (ЕС 1.3.1 и ЕС 1.3.99), предпочтительно из числа еноилСоА-редуктаз (ЕС 1.3.1.8, ЕС 1.3.1.38 и ЕС 1.3.1.44), из числа еноил[ацил-переносящий белок]редуктаз(ЕС 1.3.1.9, ЕС 1.3.1.10 и ЕС 1.3.1.39), из числа бутирил-СоА-дегидрогеназ (ЕС 1.3.99.2), ацил-СоАдегидрогеназ (ЕС 1.3.99.3) и ацил-СоА-дегидрогеназ длинноцепочечных жирных кислот (ЕС 1.3.99.13). Согласно базе данных KEGG, транс-2-еноил-(эфир или тиоэфир)редуктазная активность описана, к примеру, при метаболизме жирных кислот, синтезе поликетидов, метаболизме бутаноата и митохондриальном биосинтезе жирных кислот. В принципе 2-еноил-(эфир или тиоэфир)редуктаза может быть получена или может происходить из любого организма. В частности, организм может быть выбран из числа бактерий, архебактерий и эукариот, как-то из числа дрожжей, грибов, простейших, растений и животных (включая человека). В одном воплощении организм выбирают из следующих бактерий: Е. coli, Vibrio, Bacillus (в частности, В. subtilis), Clostridium (в частности, С. kluyveri, С. acetobutylicum, С. beijerinckii и С. perfringens),Streptomyces (в частности, S. coelicolor и S. avermitilis), Pseudomonas (в частности, P. putida и P. aeruginosa), Shewanella, Xanthomonas, Xylella, Yersinia, Treponema (в частности, Т. denticola), Aeromonas (в частности, Aeromonas hydrophila), Microscilla (в частности, Microscilla marina), Megasphera (в частности,Megasphera elsdenii), Deinococcus (в частности, Deinococcus radiourans), Yarrowia (в частности, Y. lypolytica) и Eubacterium (в частности, Е. pyruvativorans). В одном воплощении 2-еноил-(эфир или тиоэфир)редуктаза происходит из организма, выбранного из числа Euglenozoa, в частности Euglena gracilis. В одном воплощении 2-еноил-(эфир или тиоэфир)редуктаза происходит из организма, выбранного из числа Saccharomyces (в частности, S. cerevisiae), Kluyveromyces (в частности, К. lactis), Schizosaccharomyces (в частности, S. pombe), Candida (в частности, С. tropicalis). В одном воплощении 2-еноил-(эфир или тиоэфир)редуктаза происходит из организма, выбранного из числа Aspergillus (в частности, A. niger и A. nidulans) и Penicillium (в частности, P. chrysogenum). В одном воплощении 2-еноил-(эфир или тиоэфир)редуктаза происходит из организма, выбранного из числа Arabidopsis (в частности, A. thaliana). В одном воплощении 2-еноил-(эфир или тиоэфир)редуктаза происходит из организма, выбранного из числа Homo sapiens, Rattus norvegicus, Bos taurus, Cavia sp., Caenorhabditis elegans и Drosophilamelanogaster. Подходящий фермент, в частности, может содержать аминокислотную последовательность согласно любому из SEQ ID NO: 42-67, 94, 96, 98, 100, 105, 107, 109, 111, 113 либо гомологичную ей, в частности, аминокислотную последовательность согласно любому из SEQ ID NO: 60, 63, 96, 100 либо гомологичную ей. Типичные нуклеотидные последовательности, кодирующие подходящие ферменты, катализирующие реакцию 4, т.е. 2-еноил-(эфир или тиоэфир)редуктазы, представлены SEQ ID NO: 93, 95, 97,99,104, 106, 108, 110 и 112. В предпочтительном воплощении наряду с 2-еноил-(эфир или тиоэфир)редуктазой используетсяETF, который может способствовать активности данной редуктазы. Такой ETF может быть получен или происходить из того же организма, что и редуктаза, как приведено выше. В частности, он может быть получен или происходить из организма того же рода, что и редуктаза, более предпочтительно того же вида, что и сама редуктаза. Конкретные белки ETF содержат аминокислотные последовательности, приведенные в SEQ ID NO: 102, 103, 115, 116. А в SEQ ID NO: 101 и 114 представлены нуклеотидные последовательности, кодирующие определенные ETF. Обычно такие ETF содержат две субъединицы (etfA andetfB), кодируемые двумя разными генами. Они обычно используются вместе, при этом образуется активный белок ETF. Например, можно использовать следующие комбинации: SEQ ID NO: 102 + SEQ ID NO: 103 или SEQ ID NO: 116 + SEQ ID NO: 115. Специалисты смогут выбрать и другие подходящие комбинации ETF, известные в данной области. В одном воплощении изобретения биокатализатор, сам по себе не обладающий требуемой активностью или субстратной специфичностью, может быть модифицирован известными в этой области методами, например, рационального проектирования или молекулярной эволюции, чтобы получить мутантов,способных катализировать превращение эфира или тиоэфира 2,3-дегидроадипата в эфир или тиоэфир адипата с требуемой скоростью или избирательностью. Предпочтительными являются биокатализаторы,обладающие активностью с производными 2-еноил-СоА с длиной цепи = 6, в частности, такие биокатализаторы из С. kluyveri, Bos taurus, Euglena gracilis, Cavia sp., S. cerevisiae, C. tropicalis, Homo sapiens и Е.pyruvativorans. Получение адипиновой кислоты (реакция 7) В соответствии с изобретением для получения адипиновой кислоты можно использовать эфир или тиоэфир адипата путем гидролиза сложноэфирной или тиоэфирной связи. Это может осуществляться химическим путем, например при химическом гидролизе в присутствии кислоты или основания, либо биокаталитическим путем. В предпочтительном способе изобретения получение включает биокаталитическую реакцию в присутствии биокатализатора, способного катализировать гидролиз ацил-(тио)эфира. Поэтому фермент, обладающий такой каталитической активностью, может быть назван ацил-(тио)эфир-гидролазой. А фермент, обладающий такой каталитической активностью в отношении тиоэфира - ацил-СоА, может быть назван ацил-СоА-гидролазой. Предпочтительно данная ацил-СоА-гидролаза избирательна в отношении субстрата - адипил-СоА. Фермент, способный катализировать гидролиз ацил-(тио)эфира, в частности, может быть выбран из числа гидролаз (ЕС 3.1.2), предпочтительно из числа ацил-СоА-гидролаз (ЕС 3.1.2.20), ацетил-СоАгидролаз (ЕС 3.1.2.1), ацил-СоА-гидролаз длинноцепочечных жирных кислот (ЕС 3.1.2.2), сукцинилСоА-гидролаз (ЕС 3.1.2.3) и ацил-[ацил-переносящий белок]гидролаз (ЕС 3.1.2.14). Биокатализатор может включать фермент, происходящий из любого организма, включая архебактерии, бактерии и эукариоты. В частности, биокатализатор может включать фермент из бактерий, выбранных из числа Е. coli,Brucella (в частности, Brucella melitensis), Agrobacterium (в частности, А. tumefaciens), Xanthomonas, Sinorhizobium (в частности, Sinorhizobium meliloti), Mesorhizobium (в частности, Mesorhizobium loti), Vibrio, Streptomyces (в частности, S. coelicolor и S. avermitilis), Rhodopseudomonas (в частности, Rhodopseudomonas palustris), Xylella, Yersinia, Pseudomonas (в частности, P. putida и P. aeruginosa), Shewanella, Shigella, Salmonella, Corynebacterium, Mycobacterium, Hyphomonas (в частности, Hyphomonas neptunium) иPropionibacterium. Подходящий биокатализатор, в частности, может встречаться в дрожжах, выбранных из числа Saccharomyces (в частности, Saccharomyces cerevisiae) и Kluyveromyces (в частности, K. lactis). Подходящий биокатализатор, в частности, может встречаться в грибках, выбранных из числа Aspergillus (в частности, A. niger, A. fumigatus и A. nidulans) и Penicillium (в частности, P. chrysogenum). В следующем воплощении организм выбирается из числа Arabidopsis (в частности, A. thaliana),Muridae (в частности, Rattus norvegicus, Mus musculus), Bovidae (в частности, Bos taurus, Ovis aries), Homosapiens и Caenorhabditis (в частности, Caenorhabditis elegans). В одном воплощении изобретения биокатализатор, сам по себе не обладающий требуемой активностью или субстратной специфичностью, может быть модифицирован известными в этой области методами, например, рационального дизайна или молекулярной эволюции, чтобы получить мутантов, способных эффективно превращать эфиры или тиоэфиры адипата в адипат. Предпочтительными являются биокатализаторы, обладающие исходной активностью с ацил-СоА-производными кислот С 4-С 8, предпочтительно включая дикарбоновые кислоты. Например, можно получить мутантов на основе ацил-СоАтиоэстеразы из Mus musculus (например, приведенной в SEQ ID NO: 73). В конкретном воплощении изобретения получение включает биокаталитическую реакцию в присутствии биокатализатора, способного катализировать перенос активирующей группы, в частности, эфира или тиоэфира, наиболее предпочтительно СоА. Поэтому фермент, обладающий такой каталитической активностью, может быть назван СоА-трансферазой. Предпочтительно данная СоА-трансфераза избирательна в отношении дикарбоксил-СоА как субстрата-донора СоА. Более предпочтительно данный дикарбоксил-СоА представляет собой адипил-СоА. Предпочтительно данная СоА-трансфераза избирательна в отношении ацетата как субстрата-акцептора СоА. Фермент, способный катализировать перенос групп СоА, в частности, может быть выбран из числа СоА-трансфераз (ЕС 2.8.3), предпочтительно из числа СоА-трансфераз дикарбоксил-СоА:дикарбоновых кислот, СоА-трансфераз сукцинил-СоА:адипат, СоА-трансфераз 3-оксокислот (ЕС 2.8.3.5), СоАтрансфераз 3-оксоадипата (ЕС 2.8.3.6) и СоА-трансфераз ацетата (ЕС 2.8.3.8). В принципе СоА-трансфераза может быть получена или может происходить из любого организма. Организм может представлять собой бактерии, архебактерии или эукариоты. В частности, предпочтительны организмы, способные разлагать дикарбоновые кислоты, в частности, адипиновую кислоту. В частности, организм может представлять собой бактерии, выбранные из числа Acinetobacter (в частности, штамм ADP1 Acinetobacter sp., A. calcoaceticus), Clostridium (в частности, С. kluyveri, С. acetobutylicum или С. beijerinckii), Pseudomonas (в частности, Р. putida и P. fluorescens), Agrobacterium, Alcaligenes, Athrobacter, Azomonas, Azospirillum, Azotobacter, Bacillus, Beijerinckia, Bradyrhizobium,Burkholderia, Comamonas, Corynebacterium, Nocardia, Rhizobium, Rhodotorula, Rodococcus, Trichosporon иRoseburia sp. В частности, организм может представлять собой дрожжи или грибки, выбранные из числа Aspergillus (в частности, A. niger), Penicillium (в частности, P. chrysogenum) и Neurospora. В частности, подходящая СоА-трансфераза может быть получена или может происходить из семейства Hominidea, в особенности из вида Homo sapiens. Подходящий фермент для реакции 7, в частности, может содержать аминокислотную последовательность согласно любому из SEQ ID NO: 68-73, 85, 116, 117, 119-124 либо гомологичную ей. Получение адипиновой кислоты из тиоэфира, в частности, может катализироваться биокатализатором, включающим ацил-СоА-гидролазу, содержащую аминокислотную последовательность согласно любому из SEQ ID NO: 68-73, 117, 119 либо гомологичную ей. Получение адипиновой кислоты из тиоэфира, в частности, может катализироваться биокатализатором, включающим СоА-трансферазу, содержащую аминокислотную последовательность согласно любому из SEQ ID NO: 85, 121, 122, 123, 124, 125, 126 либо гомологичную ей. СоА-трансфераза может кодироваться одним геном или более чем одним геном. Например, некоторые СоА-трансферазы содержат две субъединицы, кодируемые двумя разными генами. Они обычно используются вместе, при этом образуется активный белок СоА-трансферазы. Например, можно использовать следующие комбинации: SEQ ID NO: 121 + SEQ ID NO: 122 или SEQ ID NO: 125 + SEQ ID NO: 126. Получение 5-FVA из эфира адипата или тиоэфира адипата (реакция 5) В одном воплощении 5-формилпентаноат (5-FVA) получают из эфира адипата или тиоэфира адипата. Это может осуществляться химическим или биокаталитическим путем. В частности, адипат может быть конъюгирован с СоА или иной активирующей группой, как указано выше. В частности, настоящим изобретением также предусмотрен способ получения 5-FVA из эфира адипата или тиоэфира адипата, в частности, способ получения 5-FVA из тиоэфира - адипил-СоА, в присутствии биокатализатора, способного катализировать восстановление ацил-эфира или ацил-тиоэфира до альдегида. Поэтому фермент, обладающий такой каталитической активностью, может быть назван альдегиддегидрогеназой. А фермент, обладающий такой каталитической активностью в отношении ацилэфира или ацил-тиоэфира, к примеру, тиоэфира - ацил-СоА, может быть назван альдегиддегидрогеназой(ацетилирующей). Предпочтительно биокатализатор, включающий альдегиддегидрогеназу (ацетилирующую), избирателен в отношении субстрата - эфира или тиоэфира адипата. Фермент, способный катализировать восстановление ацил-(тио)эфира, в частности, может быть выбран из числа оксидоредуктаз (ЕС 1.2.1), предпочтительно из числа альдегиддегидрогеназ (ацетилирующих) (ЕС 1.2.1.10), ацил-СоА-редуктаз жирных кислот (ЕС 1.2.1.42), ацил-СоА-редуктаз длинноцепочечных жирных кислот (ЕС 1.2.1.50), бутанальдегидрогеназ (ЕС 1.2.1.57) и дегидрогеназ янтарного полуальдегида (ацетилирующих) (например, см. Sohling et al. 1996. J Bacteriol. 178: 871-880). В принципе альдегиддегидрогеназа может быть получена или может происходить из любого организма. Предусматривается, что фермент может быть получен и из метагеномного источника путем прямого выделения кодирующей его нуклеиновой кислоты и последующего определения активности в гетерологическом организме-хозяине либо путем выявления его в метагеномной ДНК по гомологичности последовательности. Организм может представлять собой бактерии, архебактерии или эукариоты. В частности, организм может быть выбран из бактерий, в особенности из числа Е. coli, Clostridium (в частности, С. kluyveri, С. beijerinckii, С. acetobutylicum, С. butyricum, С. tetani, С. perfringens и С. novyi), Porphyromonas gingivalis, Listeria, Propionibacterium (в частности, Р. freudenreichii), Enterococcus, Fusobacterium,Lactobacillus (в частности, L. lactis), Bacillus (в частности, В. thuringiensis), Burkholderia (в частности, В.Salmonella (в частности, S. typhimurium). Организм также может быть выбран из эукариот, в особенности из числа Giardia (в частности, G. lamblia), Entamoeba (в частности, Е. histolytica), Mastigamoeba balamuthi,Chlamydomonas reinhardtii, Polytomella, Piromyces, Cryptosporidium и Spironucleus barkhanus. Подходящая дегидрогеназа, в частности, может содержать аминокислотную последовательность согласно любому из SEQ ID NO: 74-81, 139-148 либо гомологичную ей. В одном воплощении изобретения биокатализатор, сам по себе не обладающий требуемой активностью или субстратной специфичностью, может быть модифицирован известными в этой области методами, например, рационального проектирования или молекулярной эволюции, чтобы получить мутантов,способных превращать эфиры или тиоэфиры адипата в 5-FVA. Предпочтительными являются биокатализаторы, обладающие альдегиддегидрогеназной (ацетилирующей) активностью с производными ацилСоА с длиной цепи = 4-8, в том числе такие биокатализаторы, как дегидрогеназы янтарного полуальдегида (ацетилирующие) из С. kluyveri (SEQ ID NO: 74) или Р. gingivialis (SEQ ID NO: 75) и бутилальдегиддегидрогеназы (ацетилирующие) из С. acetobutylicum (SEQ ID NO: 80, 81) или Propionibacterium freudenreichii (SEQ ID NO: 79). Получение 5-FVA из адипиновой кислоты (реакция 8) В соответствии с изобретением для получения 5-FVA можно использовать адипиновую кислоту. Это может осуществляться химическим путем, например, при избирательной химической реакции, необязательно включающей блокирование одной карбоксильной группы, или биокаталитическим путем. В предпочтительном способе изобретения получение включает биокаталитическую реакцию в присутствии биокатализатора, способного катализировать восстановление карбоновой кислоты. В качестве донора электронов биокатализатор может использовать NADH или NADPH. Поэтому фермент, обладающий такой каталитической активностью, может быть назван альдегиддегидрогеназой. Предпочтительно данная альдегиддегидрогеназа избирательна в отношении субстрата адипата. Фермент, способный катализировать восстановление карбоновой кислоты, в частности, может быть выбран из числа оксидоредуктаз (ЕС 1.2.1), предпочтительно из числа альдегиддегидрогеназ (ЕС 1.2.1.3,ЕС 1.2.1.4 и ЕС 1.2.1.5), дегидрогеназ малонового полуальдегида (ЕС 1.2.1.15), дегидрогеназ янтарного полуальдегида (ЕС 1.2.1.16 и ЕС 1.2.1.24), дегидрогеназ глутарового полуальдегида (ЕС 1.2.1.20), дегидрогеназ аминоадипинового полуальдегида (ЕС 1.2.1.31), дегидрогеназ адипинового полуальдегида (ЕС 1.2.1.63), которые также могут быть названы 6-оксогексаноатдегидрогеназами. В базе данных KEGG активность дегидрогеназ адипинового полуальдегида описана, к примеру, при разложении капролактама. В частности, можно использовать 6-оксогексаноатдегидрогеназу. Примерами 6-оксогексаноатдегидрогеназ являются ферменты, содержащие последовательность, приведенную в SEQ ID NO: 127, 128, либо гомологичную ей. В принципе альдегиддегидрогеназа может быть получена или может происходить из любого организма. Организм может быть прокариотическим или эукариотическим. В частности, организм может быть выбран из числа бактерий, архебактерий, дрожжей, грибов, простейших, растений и животных(включая человека). В одном воплощении бактерии выбирают из числа Acinetobacter (в частности, Acinetobacter sp.NCIMB9871), Ralstonia, Bordetella, Burkholderia, Methylobacterium, Xanthobacter, Sinorhizobium, Rhizobium, Nitrobacter, Brucella (в частности, В. melitensis), Pseudomonas, Agrobacterium (в частности, Agrobacterium tumefaciens), Bacillus, Listeria, Alcaligenes, Corynebacterium и Flavobacterium. В одном воплощении организм выбирают из числа дрожжей и грибков, в частности, из числа Aspergillus (в частности, A. niger и A. nidulans) и Penicillium (в частности, P. chrysogenum). В одном воплощении организм представляет собой растение, в частности Arabidopsis, в особенности A. thaliana. Получение 6-АСА (реакция 6) В одном воплощении изобретения для получения 6-АСА используют 5-FVA. В одном воплощении 6-АСА получают посредством гидрогенизации над PtO2 6-оксимокапроновой кислоты, полученной при реакции между 5-FVA и гидроксиламином (например, см. синтез гомологичной 12-аминододекановой кислоты в F.O. Ayorinde, E.Y. Nana, P.D. Nicely, A.S. Woods, E.O. Price, C.P.Nwaonicha, J. Am. Oil Chem. Soc. 1997, 74, 531-538). 6-АСА может быть получена с высоким выходом при восстановительном аминировании 5-FVA с помощью аммиака над катализатором гидрогенизации, к примеру, Ni на подложке из SiO2/Al2O3, как описано для 9-аминононановой кислоты (9-аминопеларгоновой кислоты) и 12-аминододекановой кислоты (12-аминолауриновой кислоты) в ЕР-А 628535 или DE 4322065. В следующем воплощении 6-АСА получают биокаталитическим путем. В предпочтительном способе получение 6-АСА из 5-FVA включает энзиматическую реакцию в присутствии фермента, способного катализировать реакцию трансаминирования в присутствии донора аминогрупп и выбранного из числа аминотрансфераз (ЕС 2.6.1). В общем, подходящая аминотрансфераза обладает 6-аминотрансферазной активностью в отношении 6-АСА и способна катализировать превращение 5-FVA в 6-АСА. В частности, аминотрансфераза может быть выбрана среди аминотрансфераз из млекопитающих;Bacillus, в частности, Bacillus weihenstephanensis и Bacillus subtilis; Legionella; Nitrosomas; Neisseria; или дрожжей, в частности Saccharomyces cerevisiae. В том случае, если фермент из млекопитающих, то он, в частности, может происходить из почек млекопитающих, печени млекопитающих, сердца млекопитающих или мозга млекопитающих. Например, подходящий фермент может быть выбран из числа -аминоизобутират: -кетоглутаратаминотрансфераз из почек млекопитающих, в частности из почек свиньи; -аланин-аминотрансфераз из печени млекопитающих, в частности из печени кролика; аспартат-аминотрансфераз из сердца млекопитающих, в частности из сердца свиньи; 4-аминобутират-аминотрансфераз из печени млекопитающих, в частности, из печени свиньи; 4-аминобутират-аминотрансфераз из мозга млекопитающих, в частности из мозга человека, свиньи или крысы; -кетоадипат:глутамат-аминотрансфераз из Neurospora, в частности,из Neurospora crassa; 4-аминобутират-аминотрансферазы из Е. coli либо -аминоадипатаминотрансферазы из Thermus, в частности из Thermus thermophilus, и 5-аминовалератаминотрансферазы из Clostridium, в частности, из Clostridium aminovalericum. Подходящая 2 аминоадипат-аминотрансфераза, например, может происходить из Pyrobaculum islandicum. В конкретном воплощении используется аминотрансфераза, содержащая аминокислотную последовательность согласно SEQ ID NO: 82, SEQ ID NO: 83, SEQ ID NO: 84, SEQ ID NO: 134, SEQ ID NO: 136,SEQ ID NO: 138 либо гомологичную любой из этих последовательностей. Последовательности SEQ IDID NO: 83 (=90). Последовательности SEQ ID NO: 133, 135, 137 представляют собой кодирующие после- 11018381 довательности для SEQ ID NO: 134, 136, 138 соответственно. В частности, донор аминогрупп может быть выбран из числа аммиака, ионов аммония, аминов и аминокислот. Подходящими аминами являются первичные амины и вторичные амины. Аминокислоты могут иметь D- или L-конфигурацию. Примерами доноров аминогрупп являются аланин, глутамат, изопропиламин, 2-аминобутан, 2-аминогептан, фенилметанамин, 1-фенил-1-аминоэтан, глутамин, тирозин,фенилаланин, аспартат, -аминоизобутират, -аланин, 4-аминобутират и -аминоадипат. В следующем предпочтительном воплощении способ получения 6-АСА включает биокаталитическую реакцию в присутствии фермента, способного катализировать реакцию восстановительного аминирования в присутствии источника аммиака и выбранного из числа оксидоредуктаз, действующих на группу CH-NH2 у доноров (ЕС 1.4), в частности, из числа дегидрогеназ аминокислот (ЕС 1.4.1). В общем,подходящая дегидрогеназа аминокислоты обладает активностью 6-дегидрогеназы 6-аминокапроновой кислоты, катализируя превращение 5-FVA в 6-АСА, либо обладает активностью 2-дегидрогеназы аминопимелата, катализируя превращение АКР в ААР. В частности, подходящая дегидрогеназа аминокислоты может быть выбрана из числа диаминопимелатдегидрогеназ (ЕС 1.4.1.16), лизин-6-дегидрогеназ(ЕС 1.4.1.18), глутаматдегидрогеназ (ЕС 1.4.1.3; ЕС 1.4.1.4) и лейциндегидрогеназ (ЕС 1.4.1.9). В одном воплощении дегидрогеназа аминокислоты может быть выбрана из числа дегидрогеназ аминокислот, относящихся к глутаматдегидрогеназам, работающим с NAD или NADP в качестве акцептора (ЕС 1.4.1.3), глутаматдегидрогеназам, работающим с NADP в качестве акцептора (ЕС 1.4.1.4), лейциндегидрогеназам (ЕС 1.4.1.9), диаминопимелатдегидрогеназам (ЕС 1.4.1.16) и лизин-6-дегидрогеназам(ЕС 1.4.1.18). В частности, дегидрогеназа аминокислоты может происходить из организма, выбранного из числаAcinetobacter, в частности Acinetobacter sp. ADP1; Ralstonia, в частности, Ralstonia solanacearam; Salmonella, в частности, Salmonella typhimurium; Saccharomyces, в частности, Saccharomyces cerevisiae; Brevibacterium, в частности, Brevibacterium flavum и Bacillus, в частности, Bacillus sphaericus, Bacillus cereus или Bacillus subtilis. Например, подходящая дегидрогеназа аминокислоты может быть выбрана среди диаминопимелатдегидрогеназ из Bacillus, в частности, Bacillus sphaericus; диаминопимелатдегидрогеназ из Brevibacterium sp.; диаминопимелатдегидрогеназ из Corynebacterium, в частности диаминопимелатдегидрогеназ из Corynebacterium glutamicum; диаминопимелатдегидрогеназ из Proteus, в частности диаминопимелатдегидрогеназы из Proteus vulgaris; лизин-6-дегидрогеназ из Agrobacterium, в частности Agrobacterium tumefaciens, лизин-6-дегидрогеназ из Geobacillus, в частности, из Geobacillus stearothermophilus; глутаматдегидрогеназ, работающих с NADH или NADPH в качестве кофактора (ЕС 1.4.1.3) из Acinetobacter, в частности глутаматдегидрогеназ из Acinetobacter sp. ADP1; глутаматдегидрогеназ (ЕС 1.4.1.3) изRalstonia, в частности глутаматдегидрогеназы из Ralstonia solanacearum; глутаматдегидрогеназ, работающих с NADPH в качестве кофактора (ЕС 1.4.1.4) из Salmonella, в частности глутаматдегидрогеназы изSalmonella typhimurium; глутаматдегидрогеназ (ЕС 1.4.1.4) из Saccharomyces, в частности глутаматдегидрогеназы из Saccharomyces cerevisiae; глутаматдегидрогеназ (ЕС 1.4.1.4) из Brevibacterium, в частности глутаматдегидрогеназы из Brevibacterium flavum; и лейциндегидрогеназ из Bacillus, в частности лейциндегидрогеназ из Bacillus cereus или Bacillus subtilis. В одном воплощении 6-АСА, полученная в способе изобретения, используется для получения капролактама. Такой способ включает циклизацию 6-аминокапроновой кислоты, необязательно в присутствии биокатализатора. Условия реакции для любой биокаталитической стадии в контексте настоящего изобретения можно выбирать в зависимости от известных условий для биокатализатора, в частности фермента, приведенной здесь информации и необязательно рутинного экспериментирования. В принципе рН реакционной среды можно выбирать в широких пределах до тех пор, пока биокатализатор будет активным при данном значении рН. Можно использовать щелочные, нейтральные или кислые условия, в зависимости от биокатализатора и других факторов. В том случае, если способ включает использование микроорганизмов, например, для экспрессирования фермента, катализирующего способ изобретения, значение рН выбирают таким образом, чтобы микроорганизм мог выполнять предназначенную ему функцию или функции. В частности, можно выбрать рН в пределах 4 единиц рН ниже нейтрального и 2 единиц рН выше нейтрального, т.е. между рН 3 и рН 9 в случае по сути водной системы при 25 С. Система считается водной, если вода является единственным растворителем или преобладающим растворителем ( 50 мас.%, в частности,90 мас.%, исходя из общих липидов), при этом в растворе может быть небольшое количество ( 50 мас.%, в частности,10 мас.%, исходя из общих липидов), например, спирта или другого растворителя (например, в качестве источника углерода) в такой концентрации, чтобы присутствующие в нем микроорганизмы оставались активными. В частности, при использовании дрожжей и/или грибков предпочтительными могут быть кислые условия, в частности значение рН может находиться в пределах от рН 3 до рН 8, исходя из практически водной системы при 25 С. При желании можно довести рН с помощью кислоты и/или основания либо забуферить с помощью подходящей комбинации кислоты и основания. В принципе условия инкубации можно выбирать в широких пределах до тех пор, пока биокатализатор проявляет достаточную активность и/или рост. Это включает аэробные, микроаэробные, ограниченные по кислороду и анаэробные условия. Анаэробные условия при этом определяются как условия без кислорода или при которых кислород практически не потребляется биокатализатором, в частности, микроорганизмом, что обычно соответствует потреблению кислорода менее 5 ммоль/л/ч, в частности, потреблению кислорода менее 2,5 ммоль/л/ч или менее 1 ммоль/л/ч. Аэробные условия есть такие условия, при которых в среде растворен кислород на уровне, достаточном для неограниченного роста, который может поддерживать потребление кислорода со скоростью по меньшей мере 10 ммоль/л/ч, более предпочтительно больше 20 ммоль/л/ч, еще более предпочтительно больше 50 ммоль/л/ч и наиболее предпочтительно больше 100 ммоль/л/ч. Условия ограничения кислорода можно определить как условия, при которых потребление кислорода ограничено переносом кислорода из газа в жидкость. Нижний предел условий ограничения кислорода определяется верхним пределом анаэробных условий, т.е. обычно по меньшей мере 1 ммоль/л/ч, в частности, по меньшей мере 2,5 ммоль/л/ч или по меньшей мере 5 ммоль/л/ч. Верхний предел условий ограничения кислорода определяется нижним пределом аэробных условий, т.е. менее 100 ммоль/л/ч, менее 50 ммоль/л/ч, менее 20 ммоль/л/ч или менее 10 ммоль/л/ч. Будут ли условия аэробными, анаэробными или ограниченными по кислороду - зависит от условий,в которых выполняется способ, в частности от количества и состава поступающего газа, фактических параметров смешивания/массообмена у используемого оборудования, типа используемых микроорганизмов и плотности микроорганизмов. В принципе температура не играет решающей роли до тех пор, пока биокатализатор, в частности,фермент, проявляет существенную активность. В общем, температура может составлять по меньшей мере 0 С, в частности, по меньшей мере 15 С, более предпочтительно по меньшей мере 20 С. Желательная максимальная температура зависит от биокатализатора. В общем, такая максимальная температура известна, напр., указана в спецификации на изделие в случае коммерчески доступного биокатализатора,либо может быть определена в рабочем порядке, исходя из общераспространенных сведений и приведенной здесь информации. Обычно температура составляет 90 С или меньше, в частности, 50 С или меньше, более предпочтительно 40 С или меньше. Далее для осуществления или ускорения определенной реакции можно выбирать растворители, дополнительные реагенты и другие вспомогательные вещества, например кофакторы (к примеру, кофакторы FAD/FADH и/или NAD/NADH), исходя из известных принципов реакции, и/или принимать меры для смещения равновесия в нужную сторону. В частности, если биокаталитическая реакция проводится вне организма-хозяина, можно использовать реакционную среду, содержащую органический растворитель в высокой концентрации (например, более 50% или более 90 мас.%), если только используемый фермент сохраняет достаточную активность в такой среде. Эфир или тиоэфир сукцината и эфир или тиоэфир ацетата, используемые в способе изобретения, в принципе могут быть получены любым способом. Например, сукцинат образуется естественным путем как промежуточный продукт цикла лимонной кислоты (цикла Кребса) либо как конечный продукт клеточного метаболизма. Таким образом, он может быть получен из возобновляемого источника углерода при помощи соответствующего биокатализатора. Для получения сукцината из подходящего источника углерода можно использовать биокатализаторы, в частности, микроорганизмы. Микроорганизмы могут относиться к прокариотам либо эукариотам. Микроорганизмы могут быть рекомбинантными или дикого типа. У рекомбинантного микроорганизма можно изменить метаболизм с тем, чтобы повысить выход сукцината и производительность на подходящем источнике углерода. Методы повышения продукции сукцината описаны для прокариот в Song and Lee, Enzyme and Microbial Technology, 2006, 39: 352-361. Сукцинат также может вырабатываться у эукариот. С другой стороны, можно применить метод адаптивной эволюции, как описано в патентной заявке US 2007/111294. Эфиры или тиоэфиры сукцината могут быть получены из сукцината любым способом. В частности, эфиры или тиоэфиры сукцината могут быть получены из сукцината при помощи биокатализатора. В частности, из сукцината можно получить сукцинил-СоА при помощи биокатализатора, включающего фермент, выбранный из числа тиоловых лигаз кислот (ЕС 6.2.1), предпочтительно из числа сукцинил-СоА-синтаз (ЕС 6.2.1.4 и ЕС 6.2.1.5). С другой стороны, сукцинил-СоА можно получить из сукцината при помощи биокатализатора, включающего фермент, выбранный из числа СоАтрансфераз (ЕС 2.8.3), приведенных для реакции 7. Эфиры или тиоэфиры сукцината также могут быть получены из других молекул, чем сукцинат, любым способом. В частности, сукцинил-СоА можно получить из 2-оксоглутарата с помощью биокатализатора, включающего 2-оксоглутаратдегидрогеназный комплекс. 2-Оксоглутаратдегидрогеназный комплекс представляет собой многоферментный комплекс, принимающий участие в цикле ТСА, который известен специалистам. С другой стороны, сукцинил-СоА можно получить из 2-оксоглутарата с помо- 13018381 щью биокатализатора, включающего 2-оксоглутарат:ферредоксин-оксидоредуктазу (ЕС 1.2.7.3). Ацетат является естественным промежуточным или конечным продуктом в клеточном метаболизме. Таким образом, он может быть получен из возобновляемого источника углерода при помощи соответствующего биокатализатора. Для получения ацетата из подходящего источника углерода можно использовать биокатализаторы, в частности, микроорганизмы. Микроорганизмы могут относиться к прокариотам либо эукариотам. Микроорганизмы могут быть рекомбинантньми или дикого типа. Эфиры или тиоэфиры ацетата могут быть получены из ацетата любым способом. В частности, эфиры или тиоэфиры ацетата могут быть получены из ацетата при помощи биокатализатора. В частности, из ацетата можно получить ацетил-СоА при помощи биокатализатора, включающего фермент, выбранный из числа тиоловых лигаз кислот (ЕС 6.2.1), предпочтительно ацетил-СоА-синтаз (ЕС 6.2.1.1 и ЕС 6.2.1.13). С другой стороны, ацетил-СоА можно получить из ацетата при помощи биокатализатора,включающего фермент, выбранный из числа СоА-трансфераз (ЕС 2.8.3), приведенных для реакции 7. Эфиры или тиоэфиры ацетата также могут быть получены из других молекул, чем ацетат, любым способом. В частности, ацетил-СоА можно получить из пирувата с помощью биокатализатора, включающего фермент, выбранный из числа пируватдегидрогеназного комплекса, пируватдегидрогеназы(NADP+) (EC 1.2.1.51), пируват-формиатлиазы (ЕС 2.3.1.54), либо биокатализатора или фермента, эффективно превращающего пируват в ацетил-СоА. Пируватдегидрогеназный комплекс представляет собой многоферментный комплекс, превращающий пируват в ацетил-СоА, который известен специалистам. С другой стороны, сукцинил-СоА можно получить из 2-оксоглутарата с помощью биокатализатора, включающего 2-оксоглутарат:ферредоксин-оксидоредуктазу (ЕС 1.2.7.3). Ацетил-СоА также может быть получен из ацетальдегида с помощью биокатализатора, включающего фермент, выбранный из числа оксидоредуктаз (ЕС 1.2.1), предпочтительно из числа альдегиддегидрогеназ (ацетилирующих) (ЕС 1.2.1.10), ацил-СоА-редуктаз жирных кислот (ЕС 1.2.1.42), бутанальдегидрогеназ (ЕС 1.2.1.57) и дегидрогеназ янтарного полуальдегида (ацетилирующих) (как описано в Sohling et al. 1996. J Bacteriol. 178: 871-880). Если биокатализатор относится к эукариотам, то запас ацетил-СоА, предпочтительно в цитозольном компартменте клеток хозяина, может быть повышен путем суперэкспрессии гомологичных и/или гетерологичных генов, кодирующих ферменты, катализирующие превращение молекул предшественника в ацетил-СоА. Молекулы предшественника, к примеру, могут представлять собой ацетат, как описано в Shiba et al., Metabolic Engineering, 2007, 9: 160-8. В предпочтительном способе изобретения, в частности, способе получения 6-АСА, адипиновой кислоты или промежуточного соединения для 6-АСА или адипиновой кислоты, применяется биотрансформация целыми клетками субстрата для 6-АСА, адипиновой кислоты или промежуточного соединения для них, включающая использование микроорганизма, в котором вырабатывается один или несколько ферментов, катализирующих любые из вышеприведенных реакций, а также источника углерода для микроорганизма. Источник углерода, в частности, может содержать по меньшей мере одно соединение, выбранное из числа одноатомных спиртов, многоатомных спиртов, карбоновых кислот, двуокиси углерода, жирных кислот, глицеридов, включая смеси, содержащие любые из данных соединений. Подходящие одноатомные спирты включают метанол и этанол. Подходящие полиоли включают глицерин и углеводы. Подходящие жирные кислоты или глицериды, в частности, могут поступать в виде пищевого масла, предпочтительно растительного происхождения. В частности, можно использовать углеводы, так как обычно углеводы можно получить в большом количестве из биологически возобновляемых источников, как-то сельскохозяйственных продуктов, к примеру, отходов сельского хозяйства. Предпочтительно используются углеводы из числа глюкозы,фруктозы, сахарозы, лактозы, сахаридов, крахмала, целлюлозы и гемицеллюлозы. Особенно предпочтительны глюкоза, олигосахариды, содержащие глюкозу, и полисахариды, содержащие глюкозу. В конкретном способе изобретения этот способ является способом брожения (ферментации). Такой способ, в частности, может включать контактирование клеток, составляющих биокатализатор - необязательно клеток хозяина, как описано в нем, со сбраживаемым источником углерода, причем источник углерода содержит любые из тех соединений, которые подлежат превращению в получаемое соединение,или же клетки производят соединение, подлежащее превращению в получаемое соединение, из этого источника углерода. Клетки, содержащие один или несколько ферментов, катализирующих стадию реакции в способе изобретения, могут быть созданы известными в этой области методами молекулярной биологии. Например, если нужно получить один или несколько биокатализаторов в гетерологической системе, то можно использовать такие методы для получения вектора, содержащего один или несколько генов, кодирующих один или несколько таких биокатализаторов. Вектор, содержащий один или несколько таких генов, может включать один или несколько регуляторных элементов, например один или несколько промоторов,которые могут быть функционально связаны с геном, кодирующим биокатализатор. В настоящем изобретении термин "функционально связан" обозначает соединение полинуклеотидных элементов (или кодирующих последовательностей или нуклеотидных последовательностей) в функ- 14018381 циональной взаимосвязи. Последовательность нуклеиновой кислоты "функционально связана", если она находится в функциональной взаимосвязи с другой последовательностью нуклеиновой кислоты. Например, промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию кодирующей последовательности. В настоящем изобретении термин "промотор" обозначает фрагмент нуклеиновой кислоты, который функционирует, контролируя транскрипцию одного или нескольких генов, и располагается перед сайтом инициации транскрипции гена относительно направления транскрипции, а в структурном отношении отличается наличием места связывания ДНК-зависимой РНК-полимеразы, сайтов инициации транскрипции и иных последовательностей ДНК, в том числе мест связывания факторов транскрипции, мест связывания белков-репрессоров и белков-активаторов и иных последовательностей нуклеотидов, известных в этой области, которые, действуя прямо или косвенно, регулируют степень транскрипции из промотора."Конститутивный" промотор есть такой промотор, который активен в большинстве экологических и онтогенетических ситуаций. "Индуцибельный" промотор есть такой промотор, который активен при экологической или онтогенетической регуляции. Термин "гомологичные", когда он используется для обозначения взаимосвязи между данной молекулой (рекомбинантной) нуклеиновой кислоты или полипептида и данным организмом или клеткамихозяевами, подразумевает то, что в природе эта молекула нуклеиновой кислоты или полипептида вырабатывается клетками хозяина или организмами того же самого вида, предпочтительно той же самой разновидности или штамма. Промотор, который может использоваться для осуществления экспрессии нуклеотидных последовательностей, кодирующих ферменты, используемые в способе изобретения, как-то описанные выше,может быть нативным для нуклеотидной последовательности, кодирующей экспрессируемый фермент,или может быть гетерологичным для той нуклеотидной последовательности (кодирующей последовательности), с которой он функционально связан. Предпочтительно промотор является гомологичным, т.е. эндогенным для клеток хозяина. Если используется гетерологичный (для нуклеотидной последовательности, кодирующей данный фермент) промотор, то он предпочтительно способен обеспечить более высокий стационарный уровень транскрипта, содержащего кодирующую последовательность (или способен продуцировать больше молекул транскрипта, т.е. молекул мРНК, за единицу времени), чем промотор, нативный для кодирующей последовательности. Подходящими промоторами в этом плане являются как конститутивные, так и индуцибельные природные промоторы, а также подвергнутые инженерии промоторы, которые хорошо известны специалистам в этой области."Сильный конститутивный промотор" есть такой промотор, который запускает транскрипцию мРНК с высокой частотой по сравнению с нативными клетками-хозяевами. Примеры таких сильных конститутивных промоторов в грамположительных микроорганизмах включают SP01-26, SP01-15, veg, pyc(промотор пируваткарбоксилазы) и amyЕ. Примеры индуцибельных промоторов в грамположительных микроорганизмах включают индуцируемый IPTG промотор Pspac и индуцируемый ксилозой промотор PxylA. Примеры конститутивных и индуцибельных промоторов в грамотрицательных микроорганизмах включают tac, tet, trp-tet, lpp, lac, lpp-lac, lacIq, T7, T5, T3, gal, trc, ara (PBAD), SP6, -PR и -PL. Термин "гетерологичные", когда он применяется в отношении нуклеиновой кислоты (ДНК или РНК) или белка, означает то, что нуклеиновая кислота или белок не встречается естественным образом в составе того организма, клетки, генома либо последовательности ДНК или РНК, в которых они находятся, или же они находятся в таких клетках или таком месте в геноме или последовательности ДНК или РНК, которые отличаются от тех, в которых они встречаются в природе. Гетерологичные нуклеиновые кислоты или белки не являются эндогенными для тех клеток, в которые они введены, а были получены из других клеток либо синтетическим или рекомбинантным способом. Обычно, хотя и не обязательно,такие нуклеиновые кислоты кодируют белки, которые в норме не вырабатываются теми клетками, в которых происходит транскрипция или экспрессия ДНК. Аналогичным образом экзогенная РНК кодирует белки, которые в норме не экспрессируются в тех клетках, в которых находится эта экзогенная РНК. Гетерологичные нуклеиновые кислоты и белки также могут именоваться чужеродными нуклеиновыми кислотами или белками. Любая нуклеиновая кислота или белок, которую специалист в этой области признает гетерологичной или чужеродной тем клеткам, в которых она подвергается экспрессии, в настоящем изобретении охватывается термином гетерологичная нуклеиновая кислота или белок. Способ по изобретению может выполняться с использованием организма, который может представлять собой организм-хозяина, в частности, микроорганизм-хозяина, или микроорганизм дикого типа. Соответственно, изобретение также касается новых клеток (хозяев), которые могут представлять собой микроорганизм, содержащий биокатализатор, способный катализировать по меньшей мере одну стадию реакции в способе изобретения, а предпочтительно клетки способны вырабатывать фермент или несколько ферментов, катализирующих две или несколько стадий реакции в способе изобретения. Изобретение также касается новых векторов, содержащих один или несколько генов, кодирующих один или несколько ферментов, способных катализировать по меньшей мере одну стадию реакции в способе изо- 15018381 бретения. В одном воплощении предусмотрены клетки или вектор, содержащие последовательность нуклеиновой кислоты, которая может быть рекомбинантной, кодирующей фермент с активностью гидрогеназы сложных эфиров или тиоэфиров 5-карбокси-2-пентеноата, в частности, с активностью гидрогеназы 5 карбокси-2-пентеноата. Предпочтительно клетки дополнительно содержат (рекомбинантный вектор, содержащий) последовательность нуклеиновой кислоты, кодирующей фермент, выбранный из числа ферментов, способных катализировать превращение эфиров или тиоэфиров адипата, в частности адипил-СоА, в 5-FVA, и ферментов, способных катализировать превращение сложных эфиров или тиоэфиров адипата, в частности адипил-СоА, в адипиновую кислоту. В частности, в одном воплощении, в котором клетки содержат фермент, способный катализировать превращение эфиров или тиоэфиров адипата в 5-FVA, клетки могут предпочтительно содержать (рекомбинантный вектор, содержащий) последовательность нуклеиновой кислоты, кодирующей фермент, способный катализировать превращение 5-FVA в 6-АСА. Такой фермент, в частности, может обладать активностью аминотрансферазы 5-FVA. Наряду с этим или вместо этого клетки-хозяева или же вектор содержат по меньшей мере одну из следующих последовательностей нуклеиновых кислот: последовательность нуклеиновой кислоты, кодирующей фермент, способный катализировать образование эфира или тиоэфира 3-оксоадипата при реакции эфира или тиоэфира сукцината с эфиром или тиоэфиром ацетата; последовательность нуклеиновой кислоты, кодирующей фермент, способный катализировать образование эфира или тиоэфира 3-гидроксиадипата из эфира или тиоэфира 3-оксоадипата; последовательность нуклеиновой кислоты, кодирующей фермент, способный катализировать образование эфира или тиоэфира 5-карбокси-2-пентеноата из эфира или тиоэфира 3-гидроксиадипата; последовательность нуклеиновой кислоты, кодирующей фермент, способный катализировать образование эфира или тиоэфира адипата из эфира или тиоэфира 5-карбокси-2-пентеноата. Один или несколько подходящих генов, в частности, можно выбрать среди генов, кодирующих ферменты, приведенные выше, более предпочтительно среди генов, кодирующих ферменты согласно любым из SEQ ID NO: 1-67, 94, 96, 98, 100, 102, 103, 105, 107, 109, 111, 113, 115, 116, либо гомологичные им. Клетки-хозяева могут быть прокариотическими или эукариотическими. В частности, клеткихозяева могут быть выбраны из числа бактерий, архебактерий, дрожжей, грибов, простейших, растений и животных (включая человека). В частности, клетки-хозяева по изобретению могут быть выбраны из группы родов, состоящей изAspergillus, Bacillus, Corynebacterium, Escherichia, Saccharomyces, Pseudomonas, Gluconobacter, Penicillium, Pichia. В частности, штамм и тем самым клетки-хозяева могут быть выбраны из числа Е. coli, Bacillus subtilis, Bacillus amyloliquefaciens, Corynebacterium glutamicum, Aspergillus niger, Penicillium chrysogenum, Pichia pastoris, Saccharomyces cerevisiae. Предпочтительными могут быть клетки-хозяева, способные вырабатывать короткоцепочечные жирные кислоты типа сукцината и/или ацетата и/или их эфиры либо тиоэфиры. Способные к этому организмы обычно присутствуют в рубце желудка жвачных. В частности, предпочтительны организмы, способные одновременно вырабатывать сукцинат и ацетат либо их эфиры или тиоэфиры. Микроорганизмы могут быть рекомбинантными или дикого типа. В частности, микроорганизмы,способные вырабатывать сукцинат, включают Е. coli, Actinobacillus (в частности, A. succinogenes), Mannheimia (в частности, М. succiniciproducens), Saccharomyces cerevisiae, Aspergillus (в частности, A. niger),Penicillium (в частности, Р. chrysogenum и P. simplicissimum) и другие организмы, указанные в KaemwichJantama, M.J. Haupt, Spyros A. Svoronos, Xueli Zhang, J.C. Moore, K.T. Shanmugam, L.O. Ingram. Biotechnology and Bioengineering (2007) 99, 5: 1140-1153. В частности, микроорганизмы, способные вырабатывать ацетат, включают Enterobacteriaceae (в частности, Е. coli, Salmonella и Shigella), уксуснокислые бактерии, в том числе Acetobacter (в частности,Acetobacter aceti), Gluconobacter (в частности, Gluconobacter oxidans), Acidomonas, Gluconacetobacter,Asaia, Kozakia, Swaminathania, Saccharibacter, Neoasaia, Granulibacter, Clostridium (в частности, С. aceticum, С. thermoaceticum, С. thermoautotrophicum, С. formicoaceticum, С. kluyveri, С. propionicum), Megasphaera (в частности, M. elsdenii), Acetobacterium (в частности, A. woodii и А. wieringae), Lactobacillus (в частности, L. plantarum, L. brevum), Bifidobacterium (в частности, В. bifidum) и Leuconostoc. Изобретение также касается новых полипептидов, соответственно и последовательностей нуклеотидов, кодирующих такие полипептиды. В частности, изобретение также касается полипептидов, содержащих аминокислотные последовательности согласно любым из SEQ ID NO: 57, 68-72, 79, 85, а также гомологичные им. В частности, изобретение также касается полинуклеотидов, кодирующих полипептиды, содержащие аминокислотные последовательности согласно любым из SEQ ID NO: 57, 68-72, 79, 85, а также гомологичные им. Далее изобретение раскрывается на следующих примерах. Сведения, подтверждающие возможность осуществления изобретения Примеры Пример 1. Общие методы Молекулярные и генетические методы Стандартные генетические методы и методы молекулярной биологии в общем известны и были описаны ранее (Maniatis et al. 1982 "Molecular cloning: a laboratory manual". Cold Spring Harbor Laboratory,Cold Spring Harbor, N.Y.; Miller 1972 "Experiments in molecular genetics", Cold Spring Harbor Laboratory,Cold Spring Harbor; Sambrook and Russell 2001 "Molecular cloning: a laboratory manual" (3rd edition), Coldmolecular biology", Green Publishing and Wiley Interscience, New York 1987). Плазмиды и штаммы Плазмиды pBAD/Myc-His С и pET21d получали из фирм Invitrogen (Carlsbad, CA, США) и EMDplasmid RP4 primase region in a multi-host-range tacP expression vector. Gene 48:119-131), которая содержит два сайта NotI в положениях 515 и 5178, соответственно, при нумерации, начинающейся из промотораpMS470 (Balzer D., Ziegelin G., Pansegrau W., Kruft V., Lanka E. Nucleic Acids Research 1992, 20(8), 18511858) были описаны ранее. Для всех процедур клонирования использовали Е. coli Top10 (Invitrogen,Carlsbad, CA, США). Для экспрессии белков использовали штаммы Е. coli Top10 (Invitrogen, Carlsbad,CA, США), Rv308 (ATCC31608), Rv308araB и BL21 Al (Invitrogen, Carlsbad, CA, США). Все векторы адаптировали путем вставки общего линкера, что позволяло применять одинаковую стратегию клонирования. Схема адаптирования и общая схема клонирования представлены на фиг. 2. Среды Для культивирования Е. coli использовали среду 2TY (16 г/л триптопептона, 10 г/л дрожжевого экстракта, 5 г/л NaCl). Для поддержания плазмид добавляли антибиотик (100 мкг/мл ампициллина). Для индуцирования экспрессии генов использовали арабинозу (для производных pBAD), IPTG (для производных pMS470 и pF113) и комбинацию из арабинозы и IPTG (для производных pET21d в Е. coli BL21A1) в конечных концентрациях 0,005-0,2% (арабиноза) и 0,1-0,5 мМ (IPTG). Идентификация плазмид Плазмиды, несущие различные гены, идентифицировали такими общеизвестными генетическими,биохимическими и/или фенотипическими способами, как устойчивость трансформантов к антибиотикам,диагностический анализ трансформантов методом ПЦР, очистка плазмидной ДНК и рестрикционный анализ очищенной плазмидной ДНК либо анализ последовательности ДНК. Анализ методом ВЭЖХ-МС для определения производных СоА Концентрации адипил-СоА и 6-карбокси-2,3-енгексаноил-СоА определяли методом ЖХ-МС. Для разделения использовали колонку Agilent SB-C18 2,150 мм со смесью ацетонитрил/вода, забуференной 750 мг/л ацетатом октиламмония (рН=7,5), в качестве подвижной фазы. Расход составлял 300 мкл/мин, а элюция проводилась с помощью градиента (начало: 70% воды, снижение до 58% за 3 мин, снижение до 45%, дальнейшее снижение до 20% за 1,5 мин, а затем уравновешивание колонки таким образом, что общее время работы составляло 7 мин). Использовали LTQ-orbitrap в режиме электрораспыления с отрицательной ионизацией, сканируя в интервале m/z 765-900. Адипил-СоА и 6-карбокси-2,3-енгексаноилСоА выходили через 2,25 и 2,5 мин, соответственно. Избирательность метода повышали путем наблюдения правильным образом протонированных молекул требуемых соединений (адипил-СоА: 894.15123894.16017, 6-карбокси-2,3-енгексаноил-СоА: 892.13437-892.14329). Для определения концентраций строили стандартную кривую на основе синтезированных соединений и рассчитывали детекторные характеристики для соответствующих ионов. Их использовали для расчета концентраций в искомых образцах. Адипат можно детектировать и количественно определять так, как описано в Kippenberger M., Winterhalter R., Moortgat G.K. Anal. Bioanal. Chem. 2008, 392(7-8), 1459-1470. Пример 2. Определение 6-карбокси-2,3-енгексаноил-СоА-редуктазной активности Экспрессирующие конструкции Предполагаемые 6-карбокси-2,3-енгексаноил-СоА-редуктазы отбирали из баз данных (табл. 1). Намеченные гены, кодирующие отобранные белки, подвергали оптимизации пар кодонов (по методике, описанной в WO 08000632) и конструировали путем синтеза (Geneart, Regensburg, Германия). Перед оптимизацией из аминокислотной последовательности удаляли наводящие последовательности(напр., сигналы секреции или последовательности, наводящие на пероксисомы/митохондрии). Такие наводящие последовательности можно идентифицировать хорошо известными методами биоинформатики,как-то описанными в Emanuelsson et al. 2007. Nature Protocols, 2: 953-971). При оптимизации избегали внутренних рестрикционных сайтов, а вводили общие рестрикционные сайты в начале и в конце, которые позволяли клонировать по стратегии, приведенной на фиг. 2. Эти модификации могут привести к небольшим изменениям в последовательностях соответствующих белков, что никоим образом не должно изменить свойства соответствующих белков. Каждому ORP предшествовал консенсусный сайт связывания с рибосомой и ведущая последовательность, направляющая трансляцию в плазмидах pF113, pMS470 и pET21d. В плазмиде pBAD сигналы инициации трансляции исходят от вектора. Целевые гены 'Adi4',Adi5', 'Adi8' и 'Adi 9' клонировали во все 4 плазмиды вместе с или без участка считывания до С-концевойHis-метки, исходящей от последовательности линкера. Экспрессирование белков в Е. coli Предварительные культуры выращивали в течение ночи в 96-луночных планшетах при 200 мкл среды на лунку. Переносили 40-160 мкл в новые 24-луночные планшеты с 4 мл среды. Для конструкцийpBAD в Е. coli ТОР 10 или Е. coli Rv308araB эта среда также содержала 0,005% арабинозы для индуцирования. Планшеты инкубировали на круговой качалке (Infors, 550 об./мин) при 25 С. Через 4-6 ч добавляли индукторы (0,5 мМ IPTG для pF113 и pMS470 в Е. coli Rv308, E. coli BL21 или Е. coli ТОР 10; 0,5 мМ IPTG и 0,2% арабинозы для pET21d в Е. coli BL21A1) и инкубировали планшеты еще 4-6 ч, после чего собирали клетки центрифугированием. Получение бесклеточных экстрактов и очистка белков с His-меткой Клетки из микрокультур (см. предыдущий абзац) собирали центрифугированием и отбрасывали супернатанты. Образовавшиеся при центрифугировании осадки клеток замораживали при -20 С как минимум на 16 ч, а затем оттаивали на льду. В каждую лунку добавляли 2 мл свежеприготовленного буфера для лизиса (50 мМ фосфата калия рН 7,5, 0,1 мг/мл ДНКазы I (Roche, Almere, NL), 2 мг/мл лизоцима, 0,5 мМ MgSO4, 1 мМ дитиотреитола и ингибиторы протеаз (полная смесь в свободных от ЭДТА таблеткахMini, Roche, Almere, NL, использовали согласно спецификации изготовителя и ресуспендировали клетки, обрабатывая планшет на вибрационной мешалке в течение 2-5 мин. Для осуществления лизиса планшет инкубировали при комнатной температуре в течение 30 мин. Чтобы удалить остатки клеток,планшет центрифугировали при 4 С и 6000g в течение 20 мин. Супернатанты переносили в новый планшет и держали на льду до дальнейшего использования. Для очистки белков с His-меткой использовали фильтровальные пластины His Multitrap HP (GE Healthcare Bioscience AB, Uppsala, Sweden) согласно инструкциям изготовителя. Синтез субстратов Субстраты (J.R. Stern, A. del Campillo, J. Biol. Chem., 1956, 985; A.K. Das, M.D. Uhler, A.K. Hajra, J.Chem., 2003, 6679-6684) и продукты нужных биохимических реакций синтезировали на фирме Syncom(Groningen, NL) по опубликованным методикам. Энзиматическое определение еноил-СоА Готовили реакционную смесь, содержащую 50 мМ К-фосфатного буфера (рН 7,5), по 0,7 мМ NADH и NADPH и примерно 20 мкМ субстрата 6-карбокси-2,3-енгексаноил-СоА. В каждую лунку 96 луночного планшета вносили 190 мкл реакционной смеси. В контроли добавляли 10 мкл бесклеточного экстракта, полученного из соответствующего штамма, несущего пустой вектор. Для запуска реакции в каждую лунку добавляли 10 мкл бесклеточного экстракта или очищенного белка. Реакционные смеси инкубировали при комнатной температуре (20-25 С) в течение от 15 мин до 24 ч при непрерывном отслеживании УФ-поглощения при 340 нм. По окончании реакций их останавливали добавлением равного объема МеОН и центрифугировали пробы. Супернатанты переносили в новый планшет и хранили при 80 С до дальнейшего анализа методом ВЭЖХ-МС. Как видно из табл. 1, был обнаружен адипил-СоА. Таблица 1. Адипил-СоА (количество указано по относительной площади пика), обнаруженный при энзиматическом определении Если полученный полипептид после модификации не начинается с метионина на N-конце, то данный полипептид подвергается дальнейшей модификации добавлением на N-конец метионина. 2 Приведенные результаты получены с Е. coli BL21, содержащими ген adi, клонированный вpMS470, после 20-часовой инкубации. Положительные результаты были также получены с другими экс- 18018381Rv308 и pF113 в Е. coli BL21) при другой продолжительности инкубации (например, 2 ч). Пример 3. Получение адипата при помощи гетерологичного микроорганизма Конструирование пути биосинтеза адипата Был разработан путь синтеза, состоящий из энзиматических активностей, представленных на фиг. 3. Ферменты, кодирующие эти активности, были идентифицированы в базах данных. Намеченные гены,кодирующие эти ферменты, подвергали оптимизации пар кодонов и конструировали путем синтеза (Geneart, Regensburg, Германия). При оптимизации удаляли внутренние рестрикционные сайты, нежелательные наводящие последовательности (например, сигналы секреции или последовательности, наводящие на пероксисомы/митохондрии), а вводили рестрикционные сайты в начале и в конце, которые позволяли собрать весь путь в экспрессирующих векторах согласно фиг. 4. Эти модификации могут привести к небольшим изменениям в последовательностях белков, что никоим образом не должно изменить свойства соответствующих белков. Каждому ORF предшествовал консенсусный сайт связывания с рибосомой и ведущая последовательность, направляющая трансляцию. Для реакций 1, 2 и 3 использовали комбинации adi21+22+23 или adi26+27+28. Для реакции 7 использовали adi29, adi30 или комбинацию adi24+25. Для реакции 4 можно использовать adi1-20 вместе с Конструирование продуцирующих адипат штаммов Е. coli Для конструирования продуцирующих адипат штаммов Е. coli соответствующие штаммы хозяина трансформировали плазмидами, кодирующими весь путь адипата, чтобы экспрессировать клонированные гены. Содержащими весь путь конструкциями pMS470 трансформировали Е. coli BL21, ТОР 10 иRv308. Конструкциями pBAD/Myc-His С трансформировали Е. coli ТОР 10 и Rv308araB. Трансформацию конструкциями в pF113 или pACYC-tac проводили вместе с совместимыми конструкциями pF113,pACYC-tac или pMS470 таким образом, чтобы конечный штамм содержал весь путь адипата. Этими плазмидами совместно трансформировали Е. coli ТОР 10, BL21 и Rv308. Получение адипата Для получения адипата выращивали предварительные культуры в течение ночи в 96-луночных планшетах с 200 мкл среды при 30 С. Переносили 50 мкл в новые 24-луночные планшеты с 4 мл среды и культивировали 4-6 ч при 25 С, а затем добавляли индукторы для индуцирования экспрессии пути адипата. Культуры инкубировали еще 12-72 ч при 25 С. Планшеты центрифугировали и готовили пробы для анализа методом ЖХ-МС. Супернатанты смешивали 1:1 с МеОН для осаждения белков, а затем подвергали анализу. Из клеток экстрагировали метаболиты, ресуспендируя осадки в 1 мл этанола. Суспензии клеток переносили в пробирки с винтовыми крышками и нагревали на кипящей водяной бане в течение 3 мин. После центрифугирования супернатанты переносили в новые пробирки и упаривали на установкеSpeed-vac. Перед анализом сухие образцы ресуспендировали в 100 мкл подвижной фазы. Пример 4. Получение S-FVA из адипил-СоА Анализ методом ВЭЖХ-МС для определения 5-FVA 5-FVA детектировали путем избирательного отслеживания реакции (SRM)-MS, измеряя переходm/z 12983. Концентрации 5-FVA рассчитывали путем измерения площади пика 5-FVA, выходящего примерно через 6 мин. Калибровку проводили по методике внешних стандартов. Все опыты по ЖХ-МС проводили на установке Agilent 1200 LC, состоящей из насоса для четырех компонентных смесей, автосамплера и печки для колонки, подсоединенной к масс-спектрометру с утроенным квадруполем Agilent 6410. Условия ЖХ Колонка: предколонка Nucleosil C18, 5 мкм, 504,6 мм (MacheryNagel), соединенная с колонкой Поток: 1,2 мл/мин, перед вхождением в МС разделяется 1:3 Вводимый объем: 2 мкл Условия МС Ионизация: электрораспыление отрицательных ионов параметры источника: напряжение при распылении ионов: 5 кВ температура: 350 С оптимизация напряжения на фрагментере и энергии столкновений Режим сканирования: режим избирательной реакции: переход m/z 12983. Экспрессирующие конструкции Отбирали предполагаемые адипил-СоА-редуктазы (SEQ ID NO: 74, 75, 77, 79, 80, 139-148). Разрабатывали экспрессирующие конструкции и получали их таким же образом, как описано ранее в примере 2, используя pBAD/Myc-His С и pET21d. Экспрессирование, экстрагирование и очистка белков Все операции выполняли так, как описано в примере 2. Энзиматическое определение адипил-СоА-редуктазы Готовили реакционную смесь, содержащую 50 мМ К-фосфатного буфера (рН 7,5), по 0,7 мМ NADH и NADPH и от 10 мкМ до 10 мМ субстрата - адипил-СоА. В каждую лунку 96-луночного планшета вносили 190 мкл реакционной смеси. Адипил-СоА получали так, как описано в примере 2. Для запуска реакции в каждую лунку добавляли 10 мкл бесклеточного экстракта или очищенного белка. В контроли добавляли 10 мкл бесклеточного экстракта, полученного из соответствующего штамма, несущего пустой вектор. Реакционные смеси инкубировали при комнатной температуре (20-25 С) в течение от 15 мин до 24 ч при непрерывной регистрации УФ-поглощения при 340 нм. По окончании реакций их останавливали добавлением равного объема МеОН и центрифугировали пробы. Супернатанты переносили в новый планшет и хранили при -80 С до определения 5-FVA методом ВЭЖХ-МС. Измерение 5-FVA отражает адипил-СоА-редуктазную активность отобранных ферментов. Пример 5. Получение 6-АСА из 5-FVA Анализ методом ВЭЖХ-МС для определения 6-АСА Калибровка Калибровку проводили по внешней калибровочной линии 6-АСА (m/z 132m/z 114, Rt = 7,5 мин). Все опыты по ЖХ-МС проводили на установке Agilent 1100, снабженной насосом дл четырехкомпонентных смесей, дегазатором, автосамплером, печкой для колонки и масс-спектрометром с одинарным квадруполем (Agilent, Waldbronn, Германия). Условия ЖХ-МС Колонка: Nucleosil 504 (Mancherey-Nagel) + Prevail C18 2504,6 (Alltech), обе при комнатной температуре (RT) Элюент: А = 0,1% об. муравьиная кислота в ультрачистой воде В = ацетонитрил (ч.д.а., Merck) Поток: 1,0 мл/мин, перед вхождением в МС разделяется 1:3 Градиент: начинается в t = 0 при 100% об. А, оставаясь таким в течение 15 мин, и меняется до 80% об. В за 15 мин (t = 30 мин), а с 30 до 31 мин он остается постоянным при 80% об. В Вводимый объем: 5 мкл МС-детекция: ESI(+)-MC Электрораспылительная ионизация (ESI) проводилась в положительном режиме сканирования при следующих условиях: m/z 50-500, фрагментер на 50 В, длина шага 0,1 m/z, температура осушающего газа 350 С, подача осушающего газа 10 л N2/мин, давление в распылителе 50 фунт/квадр.дюйм и напряжение в капилляре 2,5 кВ. Клонирование намеченных генов Проектирование экспрессирующих конструкций Во все гены добавляли сайты attB перед сайтом связывания с рибосомой и старт-кодоном и после стоп-кодона, что способствует клонированию по технологии Gateway (Invitrogen, Carlsbad, СА, США). Синтез генов и конструирование плазмид Синтетические гены получали из DNA2.0 и подвергали оптимизации кодонов для экспрессии в Е.coli по стандартным методикам DNA2.0. Гены аминотрансфераз из Vibrio fluvialis JS17 [SEQ ID No. 86] иBacillus weihenstephanensis KBAB4 [SEQ ID No. 89], которые кодируют аминокислотные последовательности -аминотрансферазы V. fluvialis JS17 [SEQ ID No. 82] и аминотрансферазы В. weihenstephanensisKBAB4 (ZP01186960) [SEQ ID No. 83], соответственно, подвергали оптимизации кодонов, а полученные при этом последовательности [SEQ ID No. 88] и [SEQ ID No. 91] получали путем синтеза ДНК. Клетки, снабженные данными генами, именуются ниже как Е. coli ТОР 10/pBAD-VflAT и Е. coliTOP10/pBAD-BweAT, соответственно. Клонирование методом ПНР Различные гены, кодирующие биокатализатор, амплифицировали из геномной ДНК методом ПЦР,используя специальную смесь PCR Supermix High Fidelity (Invitrogen) согласно спецификации производителя. Реакции ПЦР анализировали методом электрофореза в агарозном геле и продукты ПЦР правильного размера элюировали из геля с помощью набора для очистки QIAquick PCR purification kit (Qiagen, Hilden, Германия). Очищенные продукты ПЦР клонировали в экспрессирующие векторы pBAD/Myc-HisDEST по технологии Gateway (Invitrogen) через введенные сайты attB с помощью вектора для введенияpDONR-zeo (Invitrogen), как описано в методиках производителя. Последовательности генов, клонированных методом ПЦР, проверяли путем секвенирования ДНК. Таким образом получали экспрессирующие векторы pBAD-Bsugil6077991AT (содержащий ген, представленный в SEQ ID NO: 133, кодирующий пептид, представленный в SEQ ID NO: 134), pBAD-Paegi9946143AT (с помощью праймеров, приведенных в SEQ IDs NO: 130 и 131), pBAD-Paegi9951072AT (содержащий ген, представленный в SEQID NO: 135, кодирующий пептид, представленный в SEQ ID NO: 136), pBAD-Paegi9951630AT (содержащий ген, представленный в SEQ ID NO: 137, кодирующий пептид, представленный в SEQ ID NO: 138). Энзиматические реакции для превращения 5-формилпентановой кислоты в 6-АСА Если не указано иначе, готовили реакционную смесь, содержащую 10 мМ 5-формилпентановой кислоты, 20 мМ рацемического -метилбензиламина и 200 мкМ пиридоксаль-5'-фосфата в 50 мМ Кфосфатном буфере рН 7,0. В каждую лунку 96-луночного планшета вносили 100 мкл реакционной смеси. Для запуска реакции в каждую лунку добавляли 20 мкл бесклеточного экстракта. Реакционные смеси инкубировали на качалке при 37 С в течение 24 ч. Кроме того, при тех же условиях инкубировали химическую холостую смесь (без бесклеточного экстракта) и биологическую холостую пробу (Е. coli ТОР 10 сpBAD/Myc-His С). Пробы анализировали методом ВЭЖХ-МС. Результаты приведены в следующей таблице. Таблица 3. Образование 6-АСА из 5-FVA в присутствии аминотрансфераз метод отличался тем, что использовали 10 мкл бесклеточного экстракта вместо 20 мкл, концентрация пиридоксаль-5'-фосфата составляла 50 мкМ вместо 200 мкМ, а объем реакционной смеси в лунках составлял 190 мкл вместо 100 мкл Показано, что 6-АСА образуется из 5-FVA в присутствии аминотрансферазы, а Е. coli способны катализировать е образование. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения сложного эфира адипата или тиоэфира адипата, включающий превращение эфира 2,3-дегидроадипата или тиоэфира 2,3-дегидроадипата в эфир адипата или тиоэфир адипата в одну стадию в присутствии биокатализатора, включающего фермент, который способен катализировать восстановление двойной связи углерод-углерод в 2,3-еноатной группировке или в 2-еноильной группировке,в условиях для лучшей активности фермента. 2. Способ по п.1, в котором биокатализатор включает фермент, выбранный из числа оксидоредуктаз, действующих на группу НС-СН доноров (ЕС 1.3.1 или 1.3.99), предпочтительно из числа оксидоредуктаз (ЕС 1.3.1 и 1.3.99), предпочтительно из числа еноил-СоА-редуктаз (ЕС 1.3.1.8, ЕС 1.3.1.38 и ЕС 1.3.1.44), из числа еноил[ацил-переносящий белок]редуктаз (ЕС 1.3.1.9, ЕС 1.3.1.10 и ЕС 1.3.1.39), из числа бутирил-СоА-дегидрогеназ (ЕС 1.3.99.2), ацил-СоА-дегидрогеназ (ЕС 1.3.99.3) и ацил-СоАдегидрогеназ длинноцепочечных жирных кислот (ЕС 1.3.99.13). 3. Способ по любому из предыдущих пунктов, в котором биокатализатор включает фермент, который содержит аминокислотную последовательность, выбранную из числа аминокислотных последовательностей, представленных любой из SEQ ID NO: 42-67, 94, 96, 98, 100, 102, 103, 105, 107, 109, 111, 113,- 21018381 115, 116, и их гомологов, в частности аминокислотную последовательность, выбранную из числа аминокислотных последовательностей, представленных любой из SEQ ID NO: 60, 63, 96, 100, и их гомологов. 4. Способ по любому из предыдущих пунктов, в котором биокатализатор включает фермент из организма, выбранного из числа Escherichia (в частности, Е. coli), Vibrio, Bacillus (в частности, В. subtilis),Clostridium (в частности, С. kluyveri, С. acetobutylicum и С. perfringens), Streptomyces (в частности, S.taurus, Cavia sp., Caenorhabditis elegans и Drosophila melanogaster. 5. Способ по любому из предыдущих пунктов, в котором эфир 2,3-дегидроадипата или тиоэфир 2,3 дегидроадипата получают путем превращения эфира 3-гидроксиадипата или тиоэфира 3 гидроксиадипата. 6. Способ по п.5, в котором эфир или тиоэфир 3-гидроксиадипата подвергают биокаталитическому превращению в присутствии биокатализатора, способного катализировать дегидратацию 3 гидроксиацилэфира или 3-гидроксиацилтиоэфира до 2-еноилэфира или -тиоэфира, причем биокатализатор предпочтительно содержит фермент, выбранный из числа гидролиаз (ЕС 4.2.1), предпочтительно из числа еноил-СоА-гидратаз (ЕС 4.2.1.17), 3-гидроксибутирил-СоА-дегидратаз (ЕС 4.2.1.55) и еноил-СоАгидратаз длинноцепочечных жирных кислот (ЕС 4.2.1.74). 7. Способ по п.6, в котором биокатализатор содержит фермент из организма, выбранного из числаelsdenii) и Saccharomyces (в частности, S. cerevisiae), а также млекопитающих (в частности, Bos taurus,Homo sapiens, Rattus norvegicus и Sus scrofa). 8. Способ по любому из пп.5, 6 или 7, в котором эфир или тиоэфир 3-гидроксиадипата получают путем превращения эфира 3-оксоадипата или тиоэфира 3-оксоадипата. 9. Способ по п.8, включающий биокаталитическое превращение эфира 3-оксоадипата или тиоэфира 3-оксоадипата в присутствии биокатализатора, в частности биокатализатора, способного катализировать восстановление карбонильной группы до спиртовой группы либо способного катализировать восстановление 3-оксоацилэфира или 3-оксоацилтиоэфира до соответствующего 3-гидроксиацилэфира или тиоэфира, выбранного из числа дегидрогеназ (ЕС 1.1.1), предпочтительно из числа 3-гидроксиацил-СоАдегидрогеназ (ЕС 1.1.1.35 и ЕС 1.1.1.36), 3-гидроксибутаноил-СоА-дегидрогеназ (ЕС 1.1.1.157), 3 гидроксипимелоил-СоА-дегидрогеназ (ЕС 1.1.1.259) и 3-гидроксиацил-СоА-дегидрогеназ длинноцепочечных жирных кислот (ЕС 1.1.1.211). 10. Способ по п.9, в котором биокатализатор включает фермент из организма, выбранного из числаnorvegicus, Sus scrofa, Homo sapiens, а также Clostridium (в частности, С. acetobutylicum и С. kluyveri),Euglenozoa (в частности, Euglena gracilis), Megasphera (в частности, Megasphera elsdenii), Ralstonia (в частности, Ralstonia eutropha) и Zoogloea (в частности, Zoogloea ramigera). 11. Способ по любому из пп.8, 9 или 10, в котором эфир 3-гидроксиадипата или тиоэфир 3 гидроксиадипата получают путем введения в реакцию эфира сукцината или тиоэфира сукцината с эфиром ацетата или тиоэфиром ацетата. 12. Способ по п.11, включающий проведение биокаталитической реакции эфира или тиоэфира сукцината с эфиром или тиоэфиром ацетата в присутствии биокатализатора, предпочтительно биокатализатора, включающего фермент, способный переносить ацетильные группы, выбранный из числа ацил- 22018381 трансфераз (ЕС 2.3.1), в частности из числа ацетил-СоА:ацетил-СоА С-ацетилтрансфераз (ЕС 2.3.1.9),ацил-СоА:ацетил-СоА С-ацилтрансфераз(ЕС 2.3.1.16) и сукцинил-СоА:ацетил-СоА Ссукцинилтрансфераз (ЕС 2.3.1.174), более предпочтительно фермент, содержащий аминокислотную последовательность, приведенную в любой из SEQ ID NO: 1-13, либо ее гомолог. 13. Способ по п.11 или 12, в котором биокатализатор включает фермент из организма, выбранного из числа Acinetobacter (в частности, штамма ADP1 Acinetobacter sp. и A. calcoaceticus), Agrobacterium (в частности, A. tumefaciens), Alcaligenes (в частности, штаммов D2 Alcaligenes и A. eutrophus), Arthrobacter,Arzoarcus (в частности, А. evansii), Azomonas, Azotobacter, Bacillus (в частности, В. halodurans), Beijerinckia, Bradyrhizobium, Burkholderia, Clostridia (в частности, С. kluyveri), Comamonas, Corynebacterium (в частности, С. glutamicum и С. aurantiacum), E. coli, Enterobacter, Flavobacterium, Megasphera (в частности,М. elsdenii), Nocardia, Pseudomonas (в частности, P. putida, P. aeruginosa и штамма В 13 Pseudomonas sp.),Ralstonia (в частности, R. eutropha), Rhizobium, Rhodopseudomonas (в частности, R. palustris), Rodococcusniger), Euglenozoa (в частности, Euglena gracilis), Neurospora (в частности, N. crassa), Penicillium (в частности, P. chrysogenum), Rhodotorula, Saccharomyces, Trichosporon (в частности, Т. cutaneum). 14. Способ по любому из предыдущих пунктов, в котором любой из указанных эфиров выбран из числа биологических активирующих групп, в частности из числа кофермента А, фосфопантетеина, который может быть связан с ацил- или пептидил-переносящим белком, N-ацетилцистеамина, метилтиогликолата, метилмеркаптопропионата, этилмеркаптопропионата, метилмеркаптобутирата, этилмеркаптобутирата и меркаптопропионата. 15. Способ получения адипиновой кислоты, включающий получение эфира адипата или тиоэфира адипата способом по любому из предыдущих пунктов и гидролиз эфира адипата или тиоэфира адипата,полученного способом по любому из предыдущих пунктов, причем гидролиз предпочтительно катализируется биокатализатором, в частности биокатализатором, включающим фермент, выбранный из числа гидролаз (ЕС 3.1.2). 16. Способ получения адипиновой кислоты, включающий получение эфира адипата или тиоэфира адипата способом по любому из пп.1-14 и перенос активирующей группы эфира адипата или тиоэфира адипата, полученного способом по любому из пп.1-14, причем перенос активирующей группы катализируется биокатализатором, предпочтительно биокатализатором, включающим фермент, катализирующий перенос содержащих серу групп (ЕС 2.8), более предпочтительно из числа СоА-трансфераз (ЕС 2.8.3). 17. Способ получения 5-формилпентаноата, включающий получение эфира адипата или тиоэфира адипата способом по любому из пп.1-14 либо получение адипиновой кислоты способом по п.15 или 16 и превращение эфира адипата, тиоэфира адипата или адипиновой кислоты в 5-формилпентаноат. 18. Способ по п.17, в котором превращение в 5-формилпентаноат катализируется биокатализатором, предпочтительно биокатализатором, включающим фермент, выбранный из числа оксидоредуктаз(ЕС 1.2.1), предпочтительно из числа альдегиддегидрогеназ (ЕС 1.2.1.3, ЕС 1.2.1.4 и ЕС 1.2.1.5), дегидрогеназ малонового полуальдегида (ЕС 1.2.1.15), дегидрогеназ янтарного полуальдегида (ЕС 1.2.1.16 и ЕС 1.2.1.24), дегидрогеназ глутарового полуальдегида (ЕС 1.2.1.20), дегидрогеназ аминоадипинового полуальдегида (ЕС 1.2.1.31), дегидрогеназ адипинового полуальдегида (ЕС 1.2.1.63) либо из числа альдегиддегидрогеназ (ацетилирующих) (ЕС 1.2.1.10), ацил-СоА-редуктаз жирных кислот (ЕС 1.2.1.42), ацилСоА-редуктаз длинноцепочечных жирных кислот (ЕС 1.2.1.50), бутанальдегидрогеназ (ЕС 1.2.1.57) и дегидрогеназ янтарного полуальдегида (ацетилирующих). 19. Способ получения 6-аминокапроновой кислоты, включающий получение 5-формилпентаноата способом по п.17 или 18 и превращение 5-формилпентаноата в 6-аминокапроновую кислоту. 20. Способ по п.19, в котором превращение катализируется биокатализатором, в частности биокатализатором, способным катализировать трансаминирование и/или восстановительное аминирование,предпочтительно биокатализатором, включающим фермент, выбранный из числа аминотрансфераз (ЕС 2.6.1) и дегидрогеназ аминокислот (ЕС 1.4.1), более предпочтительно из числа -аминоизобутират:кетоглутарат-аминотрансфераз, -аланин-аминотрансфераз, аспартат-аминотрансфераз, 4-аминобутиратаминотрансфераз (ЕС 2.6.1.19), L-лизин-6-аминотрансфераз (ЕС 2.6.1.36), 2-аминоадипатаминотрансфераз (ЕС 2.6.1.39), 2-аминовалерат-аминотрансфераз (ЕС 2.6.1.48), 2-аминогексаноатаминотрансфераз (ЕС 2.6.1.67), лизин:пируват-6-аминотрансфераз (ЕС 2.6.1.71) и лизин-6-дегидрогеназ(ЕС 1.4.1.18). 21. Способ по п.19 или 20, в котором используют аминотрансферазу, содержащую аминокислотную последовательность согласно SEQ ID NO: 82, SEQ ID NO: 83, SEQ ID NO: 84, SEQ ID NO: 134, SEQ IDNO: 136, SEQ ID NO: 138 либо гомолог любой из этих последовательностей. 22. Способ по пп.19, 20 или 21, в котором биокатализатор включает фермент из организма, выбранного из числа Vibrio; Pseudomonas; Bacillus; Mercurialis; Asplenium; Ceratonia; млекопитающих; Neurospora; Escherichia; Thermus; Saccharomyces; Brevibacterium; Corynebacterium; Proteus; Agrobacterium; Geobacillus; Acinetobacter; Ralstonia и Salmonella. 23. Способ получения капролактама, включающий получение 6-аминокапроновой кислоты спосо- 23018381 бом по любому из пп.19-22 и циклизацию 6-аминокапроновой кислоты с образованием капролактама. 24. Клетка-хозяин, содержащая одну или более последовательностей нуклеиновых кислот, кодирующих фермент, охарактеризованный в любом из пп.1-4, 6, 7, 9, 10, 12, 13, 15, 16, 18, 20-22, предпочтительно содержащая по меньшей мере две последовательности нуклеиновых кислот, кодирующих разные ферменты, охарактеризованные в любом из пп.1-4, 6, 7, 9, 10, 12, 13, 15, 16, 18, 20-22. 25. Клетка-хозяин по п.24, содержащая последовательность нуклеиновой кислоты, кодирующей полипептид, представленный любой из SEQ ID NO: 42-67, SEQ ID NO: 74-81, 94, 96, 98, 100, 102, 103, 105,107, 109, 111, 113, 115, 116, либо его гомолог. 26. Способ по любому из пп.1-23, включающий приведение в контакт клеток, содержащих биокатализатор, который может включать клетку-хозяина по п.24 или 25, либо другой биокатализатор, со сбраживаемым источником углерода, причем источник углерода содержит любые из тех соединений, которые подлежат превращению в получаемое соединение, или же клетки производят соединение, подлежащее превращению в получаемое соединение, из этого источника углерода. 27. Способ получения адипиновой кислоты из янтарной кислоты либо эфира или тиоэфира янтарной кислоты, необязательно по п.15 или 16, через множество реакций, причем по меньшей мере одна из реакций катализируется биокатализатором. 28. Способ по п.27, включающий:(1) обеспечение эфира или тиоэфира сукцината и введение в реакцию данного эфира или тиоэфира с эфиром или тиоэфиром ацетата с образованием эфира или тиоэфира 3-оксоадипата;(2) гидрогенизирование 3-оксогруппы эфира или тиоэфира 3-оксоадипата с образованием эфира или тиоэфира 3-гидроксиадипата;(3) дегидратацию эфира или тиоэфира 3-гидроксиадипата с образованием эфира или тиоэфира 2,3 дегидроадипата;(4) гидрогенизацию двойной связи С=С эфира или тиоэфира 2,3-дегидроадипата с образованием эфира или тиоэфира адипата и(5) гидролиз сложноэфирной связи или тиоэфирной связи с образованием адипиновой кислоты. 29. Полипептид с аминокислотной последовательностью, имеющей по меньшей мере 90% идентичности с любой из последовательностей, соответствующей SEQ ID NO: 57, 68, 69, 70, 71, 72, 79 или 85. 30. Полинуклеотид, кодирующий полипептид по п.29. Фиг. 1 Получение эфира или тиоэфира адипата из эфира или тиоэфира сукцината Фиг. 2 Общая схема стратегии клонирования. Представлены лишь существенные особенности и рестрикционные сайты Фиг. 4 Стратегия клонирования для сборки пути адипата
МПК / Метки
МПК: C12P 7/44
Метки: синтез, эфиров, адипата, тиоэфиров
Код ссылки
<a href="https://eas.patents.su/30-18381-sintez-efirov-ili-tioefirov-adipata.html" rel="bookmark" title="База патентов Евразийского Союза">Синтез эфиров или тиоэфиров адипата</a>
Предыдущий патент: Пневматический воздухораспределитель с несколькими поршнями
Следующий патент: Способ получения изделия
Случайный патент: Способ окисления органических соединений












