Улучшенное определение экспрессии mage-a
Формула / Реферат
1. Олигонуклеотид, праймер или зонд, состоящий по существу или состоящий из любой нуклеотидной последовательности из SEQ ID NO: 5, 6, 7, 2 или 3, где олигонуклеотид, праймер или зонд используют для определения статуса метилирования гена MAGE A3.
2. Олигонуклеотид, представляющий собой праймер или зонд по п.1, где указанный олигонуклеотид содержит или состоит по существу или состоит из следующих непрерывных последовательностей в направлении 5'-3':
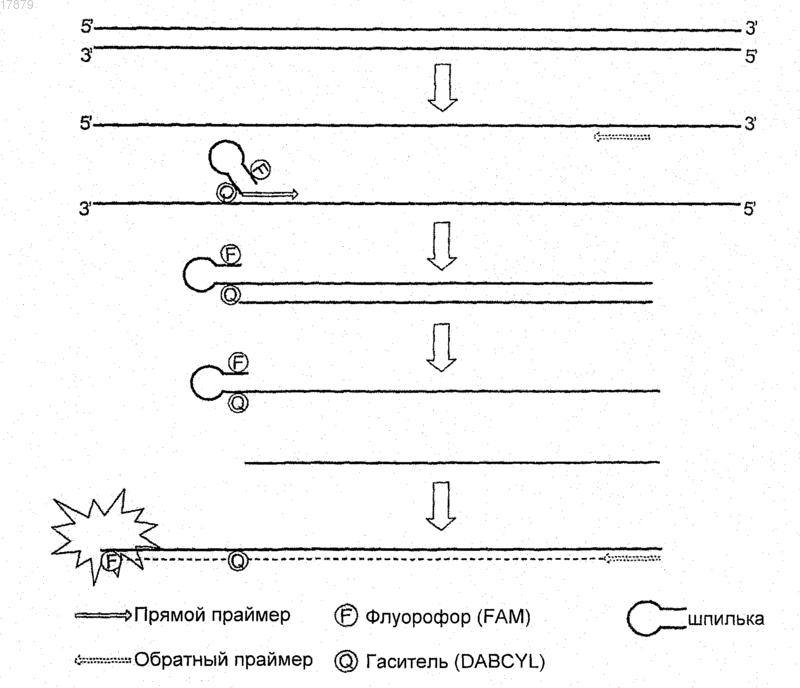
(а) первая нуклеотидная последовательность приблизительно из 6-30 нуклеотидов, где нуклеотид в указанной первой нуклеотидной последовательности мечен первой группировкой, выбранной из донорной группировки и акцепторной группировки из молекулярной пары для переноса энергии, где донорная группировка испускает флуоресценцию при одной или более конкретных длинах волн при возбуждении, а акцепторная группировка поглощает и/или гасит указанную флуоресценцию, испускаемую указанной донорной группировкой;
(б) вторая одноцепочечная нуклеотидная последовательность, содержащая, состоящая по существу или состоящая приблизительно из 3-20 нуклеотидов;
(в) третья нуклеотидная последовательность, содержащая, состоящая по существу или состоящая приблизительно из 6-30 нуклеотидов, где нуклеотид в указанной третьей нуклеотидной последовательности мечен второй группировкой, выбранной из указанной донорной группировки и указанной акцепторной группировки, и указанная вторая группировка является членом указанной группы, которая не метит указанную первую нуклеотидную последовательность, где указанная третья нуклеотидная последовательность обратно комплементарна указанной первой нуклеотидной последовательности, так что между указанной первой нуклеотидной последовательностью и указанной третьей нуклеотидной последовательностью может образовываться дуплекс, такой, что указанная первая группировка и вторая группировка находятся в такой близости, что, когда донорная группировка возбуждается и испускает флуоресценцию, акцепторная группировка поглощает и гасит указанную флуоресценцию, испускаемую указанной донорной группировкой; и
(г) на 3'-конце праймера, четвертая одноцепочечная нуклеотидная последовательность, содержащая, состоящая по существу или состоящая приблизительно из 18-40 нуклеотидов, которая на своем 3'-конце содержит или состоит по существу или состоит из любой последовательности из SEQ ID NO: 5, 7, 2 или 3 (и способна начать синтез с помощью полимеразы нуклеиновой кислоты нуклеотидной последовательности, комплементарной цепи нуклеиновой кислоты, содержащей участок неметилированной ДНК гена MAGE A3);
где в случае, когда указанный дуплекс не образуется, указанная первая группировка и указанная вторая группировка разделены расстоянием, которое препятствует переносу молекулярной энергии между указанной первой и второй группировкой.
3. Олигонуклеотид, праймер или зонд по п.1 или 2, дополнительно содержащие структуру "стебель-петля" SEQ ID NO: 1.
4. Пара праймеров, содержащая праймер по любому из пп.1-3.
5. Пара праймеров, содержащая праймеры, состоящие по существу или состоящие из нуклеотидной последовательности SEQ ID NO: 6 и 7 или SEQ ID NO: 2 и 3.
6. Набор для определения статуса метилирования гена MAGE A3, включающий по меньшей мере один олигонуклеотид, праймер или зонд, как определено в любом из пп.1-3, или пару праймеров, как определено в п.4 или 5.
7. Способ определения присутствия и/или количества неметилированного гена MAGE-А3 в ДНК-содержащем образце, включающий:
(а) приведение ДНК-содержащего образца в контакт с реагентом или обработку ДНК-содержащего образца реагентом, который избирательно модифицирует неметилированные остатки цитозина в ДНК с образованием детектируемых модифицированных остатков, но который не модифицирует метилированные остатки цитозина;
(б) амплификацию по меньшей мере участка интересующего неметилированного гена с использованием по меньшей мере одной пары праймеров, в которой по меньшей мере один праймер сконструирован таким образом, чтобы связываться только с последовательностью неметилированной ДНК после обработки реагентом, где по меньшей мере один праймер в паре праймеров состоит по существу или состоит из любой нуклеотидной последовательности из SEQ ID NO: 5, 6, 7, 2 или 3.
8. Способ диагностики рака или предрасположенности к раку, включающий определение статуса метилирования гена MAGE-А3 в образце с использованием олигонуклеотида, праймера или зонда, как определено в любом из пп.1-3, пары праймеров, как определено в любом из пп.4, 5, набора по п.6 или способа по п.7, где присутствие неметилированного MAGE-А3 в образце является признаком рака или предрасположенности к раку.
9. Способ идентификации и/или отбора пациента, подходящего для лечения иммунотерапевтическим MAGE-А3, включающий определение статуса метилирования гена MAGE-А3 в образце от пациента с использованием олигонуклеотида, праймера или зонда, как определено в любом из пп.1-3, пары праймеров, как определено в любом из пп.4, 5, набора по п.6 или способа по п.7, где в случае, если ген MAGE-А3 не метилирован, субъекта идентифицируют и/или отбирают для лечения иммунотерапевтическим MAGE-A3.
10. Способ прогнозирования вероятности успешного лечения рака, включающий определение статуса метилирования гена MAGE-А3 в образце от пациента с использованием олигонуклеотида, праймера или зонда, как определено в любом из пп.1-3, пары праймеров, как определено в любом из пп.4, 5, набора по п.6 или способа по п.7, где в случае, если ген MAGE-А3 не метилирован, вероятность успешного лечения иммунотерапевтическим MAGE-А3 выше, чем в случае метилированного гена.
11. Способ выбора подходящей схемы лечения рака, включающий определение статуса метилирования гена MAGE-А3 в образце от пациента с использованием олигонуклеотида, праймера или зонда, как определено в любом из пп.1-3, пары праймеров, как определено в любом из пп.4, 5, набора по п.6 или способа по п.7, где в случае неметилированного гена MAGE-А3 для лечения выбирают иммунотерапевтическое средство.
12. Применение композиции, содержащей MAGE-А3, в изготовлении лекарственного средства для лечения пациента, страдающего от опухоли или склонного к рецидиву MAGE-А3-экспрессирующей опухоли, который был выбран для лечения на основании измерения статуса метилирования гена MAGE-А3, с использованием олигонуклеотида, праймера или зонда, как определено в любом из пп.1-3, пары праймеров, как определено в любом из пп.4,5, набора по п.6 или способа по п.7.
13. Применение по п.12, где композиция, содержащая MAGE-A3, содержит полноразмерный MAGE-А3, по существу полноразмерный MAGE-A3 или фрагменты MAGE-А3, например пептиды MAGE-A3.
14. Применение по п.13, где пептиды MAGE-А3 выбраны из
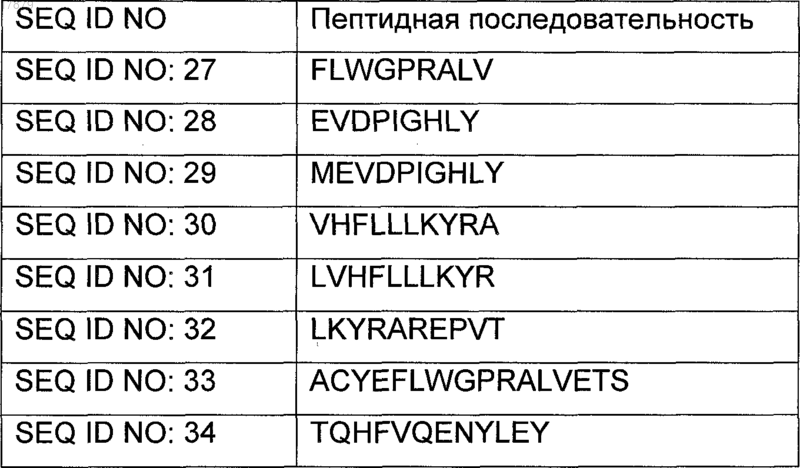
15. Применение по п.13, где MAGE-А3 представляет собой полноразмерный MAGE-А3 или по существу полноразмерный фрагмент MAGE3, в котором от 1 до 10 аминокислот делетированы из N-конца и/или С-конца белка MAGE-A3.
16. Применение по п.13, где MAGE-А3 представляет собой аминокислоты 3-314 MAGE3 (всего 312 аминокислот).
17. Применение по п.13, где белок, фрагмент или пептид MAGE-A3 связан с белком-партнером для слияния.
18. Применение по п.17, где белок-партнер для слияния представляет собой белок D, поверхностный белок грамотрицательной бактерии Haemophilus influenza В или их производное.
19. Применение по п.18, где производное белка D содержит первую 1/3 белка D, приблизительно первую 1/3 белка D, первые 100-110 N-концевых остатков белка D, первые 109 N-концевых остатков белка D.
20. Применение по п.18 или 19, где на N-конце белка D-партнера для слияния дополнительно включена секретирующая или сигнальная последовательность.
21. Применение по любому из пп.15-20, где MAGE-А3 представляет собой слитый белок, содержащий сигнальную последовательность белка D; аминокислоты 1-109 белка D; 312 аминокислот из белка MAGE-A3 (аминокислоты 3-314); спейсер и полигистидиновый "хвост".
22. Применение по п.17, где белок-партнер для слияния представляет собой LytA или его производное, содержащее или состоящее из повторяющегося участка молекулы LytA, обнаруженной в С-концевой области, начинающейся с остатка 178, или содержащей остатки 188-305; или где белок-партнер для слияния представляет собой NS1 (гемагглютинин) или его производное, содержащее 81 N-концевую аминокислоту из NS1.
23. Применение по любому из пп.12-22, где MAGE-А3 содержит дериватизированный свободный тиол.
24. Применение по любому из пп.12-23, где композиция содержит молекулу нуклеиновой кислоты, кодирующую белок, фрагмент или пептид MAGE-А3 или его слитый белок, и где молекула нуклеиновой кислоты возможно представлена в экспрессирующем векторе.
25. Применение по любому из пп.12-24, где MAGE-А3-содержащая композиция дополнительно содержит один или более чем один адъювант, иммуностимулирующий цитокин и хемокин.
Текст
УЛУЧШЕННОЕ ОПРЕДЕЛЕНИЕ ЭКСПРЕССИИ MAGE-A Предложены олигонуклеотид, праймер или зонд, содержащие любую нуклеотидную последовательность из SEQ ID NO: 5, 6, 7, 2, 3, 4, 8, 9, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 25. Олигонуклеотиды используют для определения статуса метилирования гена, в частности генаMAGE-А 3. Олигонуклеотиды используют в парах праймеров, наборах и способах для определения статуса метилирования гена MAGE-А 3 и для диагностики рака, направленной терапии и отбора субъектов для лечения. Праймер или зонд может содержать петлю или шпилькообразную структуру и может быть использован в ПЦР, специфической в отношении метилирования, в режиме реального времени. Описание изобретения Настоящее изобретение относится к определению экспрессии генов семейства MAGE-A. Более конкретно, изобретение относится к способам определения метилированных или неметилированных форм MAGE-А 3 и ассоциированных с ними олигонуклеотидов, праймеров, зондов, пар праймеров и наборов. Способы по изобретению включают методы амплификации, в частности, методы ПЦР на основе флуоресценции в режиме реального времени и в конечной точке, и имеют диагностическое, прогностическое и терапевтическое применение. Предшествующий уровень техники Гены MAGE принадлежат семейству раково-тестикулярных антигенов. Семейство генов MAGE включает более 20 членов и состоит из генов MAGE A, В, С и D (Scanlan et al., (2002) Immunol Rev. 188:22-32; Chomez et al., (2001) Cancer Res. 61 (14):5544-51). Они кластеризованы на хромосоме X (Lucaset al., 1998 Cancer Res. 58.743-752; Lucas et al., 1999 Cancer Res 59:4100-4103; Lucas et al., 2000 Int J Cancer 87:55-60; Lurquin et al., 1997 Genomics 46:397-408; Muscatelli et al., 1995 Proc Natl Acad Sci USA 92:49874991; Pold et al., 1999 Genomics 59:161-167; Rogner et al., 1995 Genomics 29:725-731), и имеют все еще неопределенную функцию (Ohman et al., 2001 Exp Cell Res. 265(2): 185-94). Гены MAGE являются высоко гомологичными, и члены семейства MAGE-A, в частности, имеют 60-98% гомологии. Человеческий ген MAGE-А 3 экспрессируется в различных типах опухолей, включая меланому (Furuta et al. 2004 Cancer Sci. 95, 962-968), рак мочевого пузыря, гепатоцеллюлярную карциному (Qiu et al. 2006. Clinical Biochemistry 39, 259-266), рак желудка (Honda et al. 2004 British Journal of Cancer 90, 838843), колоректальный рак (Kim et al. 2006 World Journal of Gastroenterology 12, 5651-5657) и рак легкого(NSCLC) (Scanlan et al. 2002 Immunol Rev. 188:22-32; Jang et al. 2001 Cancer Res. 61, 21: 7959-7963). Никакой экспрессии не наблюдалось в нормальных тканях взрослого, за исключением лишь зародышевых клеток семенников или плаценты (Haas et al. 1988 Am J Reprod Immunol Microbiol 18:47-51; Takahashi etal. 1995 Cancer Res 55:3478-382). Антигенспецифические антираковые иммунотерапевтические средства (ASCI) представляют собой новый класс лекарственных средств, предназначенных для "обучения" иммунной системы высоко специфическому распознаванию и элиминации раковых клеток. Фактически, ASCI позволяют осуществлять направленное лечение. ASCI имеют два основных компонента: "опухолевые антигены" для специфического направления иммунного ответа против раковой клетки и "адъювантные системы", которые включают иммуностимулирующие соединения, выбранные для увеличения противоопухолевого иммунного ответа. Антиген MAGE-А 3 и конструкции, подходящие для применения в ASCI, описаны в WO99/40188,и недавно были представлены обнадеживающие результаты фазы II испытания с использованием MAGEА 3 ASCI у пациентов с немелкоклеточным раком легких (NSCLC) (J. Clin. Oncol. Vol. 25, No. 18S (June 20 Suppl.) 2007: 7554). Важно иметь количественные анализы с высокой производительностью, способные специфически выявлять пациентов, экспрессирующих MAGE-A3, которые получат пользу от иммунотерапии, позволяющие осуществлять мониторинг экспрессии MAGE-А 3 с целью определения дозы, идентификацию образцов, экспрессирующих MAGE-А 3, в клинических испытаниях, или просто идентификацию пациентов с раком на ранней стадии. Целый ряд используемых методов диагностики был описан и включает в себя: полуколичественную GT-ПЦР (ПЦР с обратной транскрипцией) (De Plaen et al. 1994 Immunogenetics 40(5):360-9), другие методы на основе ПЦР и микрочипы низкой плотности (Zammatteo et al. 2002MAGE-А 3 ASCI был описан в WO 2007/147876. Самым большим недостатком существующих анализов является то, что они требуют выделения РНК для оценки экспрессии MAGEA3. Фиксация формалином или заключение опухолевой ткани в парафин (FFPE) является обычным способом сохранения опухолевой ткани в клинических центрах. Фиксация в формалине изменяет структуру молекул РНК в ткани, вызывая образование попоречных сшивок, а также частичную деградацию. Частичная деградация приводит к созданию меньших фрагментов РНК от 100 до 300 пар оснований. Эти структурные изменения РНК ограничивают применение РНК, экстрагированной из FFPE ткани для измерения уровней экспрессии MAGEA3. Целью настоящего изобретения является создание усовершенствованного анализа, в котором устранены недостатки существующих анализов. Метилирование генов является важным регулятором экспрессии генов. В частности, метилирование цитозиновых остатков, обнаруженное в CpG динуклеотидных парах в промоторной области специфических генов, может вносить вклад во многие болезненные состояния посредством понижающей регуляции экспрессии генов. Например, аберрантное метилирование опухолевых супрессорных генов может приводить к повышающей или понижающей регуляции этих генов и, таким образом, связано с наличием и развитием многих видов рака (Hoffmann et al. 2005 Biochem Cell Biol 83: 296-321). Картины аберрантного метилирования генов часто являются специфичными для ткани происхождения. Соответственно, определение статуса метилирования конкретных генов может иметь прогностическое и диагностическое значение и может быть использовано как для определения относительной стадии заболевания, так и для прогнозирования ответа на определенные типы терапии (Laird. 2003 Nat Rev Cancer 3: 253-266).-1 017879 ПЦР, специфическая в отношении метилирования (MSP), с визуализацией результатов на геле(MSP-анализ на основе геля) широко используется для определения эпигенетического выключения генов(Esteller M et al., Cancer Res 2001;61:3225-9.), хотя были разработаны и другие количественные анализы с использованием других технологий (Laird PW., Nat Rev Cancer 2003;3:253-66; Eads et al., Nucleic AcidsRes 2000; 28:E32; Mikeska T, et al., J Mol Diagn 2007). Для мониторинга реакций амплификации нуклеиновых кислот в режиме реального времени имеется ряд технологий, основанных на флуоресценции. Одна такая технология описана в US 6090552 и ЕР 0912597 и известна как Amplifluor. Этот метод также подходит для мониторинга реакций амплификации нуклеиновых кислот по конечной точке. Кроме того, Vlassenbroeck и др. (Vlassenbroeck et al. 2008.Journal of Molec. Diagn., V10, No. 4) описали стандартизированный, прямой MSP-анализ в режиме реального времени с использованием технологии Amplifluor. Краткое изложение сущности изобретения Настоящее изобретение относится к улучшенным способам и/или анализам измерения экспрессииMAGE-А 3. Кроме того, настоящее изобретение относится к определенным типам терапии, в частности,основанному на антигенспецифических антираковых иммунотерапевтических средствах (ASCI) лечения пациентов, выявленных по экспрессии MAGE-А 3, с использованием олигонуклеотидов, праймеров, зондов, пар праймеров, наборов и/или способов, как описано в данной заявке. Экспрессию белка MAGE-А 3 устанавливают путем определения статуса метилирования гена MAGE-А 3 скорее, чем по измерению самого уровня экспрессии гена. Авторы изобретения показали, что статус метилирования, полученный с помощью их анализов метилирования, хорошо согласуется с результатами, полученными с помощью ОТ-ПЦР анализа, который доказал прогностическую ценность экспрессии MAGE-А 3 при NSCLC в пользу MAGE-А 3 иммунотерапии. Таким образом, данные анализы полезны для отбора подходящих для лечения пациентов, для прогнозирования вероятности успешного лечения пациента и могут быть использованы для облегчения выбора терапии для пациента. В одном аспекте в настоящем изобретении предложен олигонуклеотид, праймер или зонд, содержащий или состоящий по существу или состоящий из любой нуклеотидной последовательности SEQ IDNO: 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 25, где олигонуклеотид, праймер или зонд используют для определения статуса метилирования гена. Олигонуклеотид, праймер или зонд предпочтительно содержит, состоит по существу или состоит из следующих непрерывных последовательностей в направлении 5'-3':(а) первая нуклеотидная последовательность приблизительно из 6-30 нуклеотидов, где нуклеотид в указанной первой нуклеотидной последовательности мечен первой группировкой, выбранной из донорной группировки и акцепторной группировки молекулярной пары для переноса энергии, где донорная группировка при возбуждении излучает флуоресценцию при одной или более конкретных длинах волн при возбуждении, а акцепторная группировка поглощает и/или гасит указанную флуоресценцию, излучаемую указанной донорной группировкой;(б) вторая одноцепочечная нуклеотидная последовательность, содержащая, состоящая по существу или состоящая приблизительно из 3-20 нуклеотидов;(в) третья нуклеотидная последовательность, содержащая, состоящая по существу или состоящая приблизительно из 6-30 нуклеотидов, где нуклеотид в указанной третьей нуклеотидной последовательности мечен второй группировкой, выбранной из указанной донорной группировки и указанной акцепторной группировки, и указанная вторая группировка является членом указанной группы, которая не метит указанную первую нуклеотидную последовательность, где указанная третья нуклеотидная последовательность обратно комплементарна указанной первой нуклеотидной последовательности, так что между указанной первой нуклеотидной последовательностью и указанной третьей нуклеотидной последовательностью может образовываться дуплекс, такой, что указанная первая группировка и вторая группировка находятся в такой близости, что, когда донорная группировка возбуждается и испускает флуоресценцию, акцепторная группировка поглощает и гасит флуоресценцию, излучаемую указанной донорной группировкой; и(г) на 3'-конце праймера, четвертая одноцепочечная нуклеотидная последовательность, содержащая, состоящая по существу или состоящая приблизительно из 8-40 нуклеотидов, которая содержит на своем 3'-конце любую нуклеотидную последовательность из SEQ ID NO: 2, 4, 5, 7, 8, 11, 13, 14, 16, 17, 19 или 25; где в случае, когда указанный дуплекс не образуется, указанная первая группировка и указанная вторая группировка разделены расстоянием, которое предотвращает перенос молекулярной энергии между указанными первой и второй группировкой. Конкретные нуклеотидные последовательности на 3'-конце позволяют определить статус метилирования гена MAGE-А 3. Эти праймеры связываются преимущественно с неметилированными формами гена MAGE-A3 после обработки соответствующим реагентом (как обсуждается в данной заявке). Свойства этих олигонуклеотидов обсуждаются в данной заявке, и это обсуждение используется с соответствующими изменениями. Специфические нуклеотидные последовательности способны быть затравкой-2 017879 для синтеза нуклеотидной последовательности, комплементарной цепи нуклеиновой кислоты, содержащей участок метилированной или неметилированной ДНК гена семейства MAGEA, с помощью полимеразы нуклеиновой кислоты. Наиболее предпочтительно, чтобы олигонуклеотид, праймер или зонд состоял из нуклеотидной последовательности SEQ ID NO: 3, 6, 9, 12, 15 или 18 и мог быть использован для амплификации участка интересующего гена. Кроме того, предложена пара праймеров, содержащая праймер, содержащий или состоящий по существу, или состоящий из нуклеотидной любой последовательности из SEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9,11, 12, 13, 14, 15, 16, 17, 18, 19 или 25. В другом аспекте предложен набор, содержащий по меньшей мере один праймер, пару праймеров или набор праймеров, содержащих или состоящих по существу, или состоящих из любой нуклеотидной последовательности из SEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 25. Данный набор предназначен для определения статуса метилирования гена, в частности гена семейства MAGE-A,такого как MAGE-A3. В другом аспекте в изобретении предложен способ определения статуса метилирования гена(а) приведение ДНК-содержащего образца в контакт с реагентом или обработку ДНК-содержащего образца реагентом, который избирательно модифицирует неметилированные остатки цитозина в ДНК с образованием детектируемых модифицированных остатков, но который не модифицирует метилированные остатки цитозина;(б) амплификацию по меньшей мере участка метилированного или интересующего неметилированного гена с использованием по меньшей мере одной пары праймеров, в которой по меньшей мере один праймер сконструирован таким образом, чтобы связываться только с последовательностью метилированной или неметилированной ДНК, соответственно, после обработки реагентом, где по меньшей мере один праймер в паре праймеров содержит, состоит по существу или состоит из любой нуклеотидной последовательности из SEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 25 (при необходимости). В другом аспекте предложен способ диагностики рака или предрасположенности к раку, включающий определение статуса метилирования гена MAGE-А 3 в образце с использованием олигонуклеотида,праймера или зонда, пары праймеров, набора или способа, как описано в данной заявке, где присутствие неметилированного MAGE-А 3 в образце является признаком рака или предрасположенности к раку. В другом аспекте предложен способ определения наличия MAGE-A3-положительной опухоли,включающий определение статуса метилирования гена MAGE-А 3 в образце с использованием олигонуклеотида, праймера или зонда, пары праймеров, набора или способа, как описано в данной заявке, где присутствие неметилированного MAGE-А 3 указывает на наличие MAGE-A3-положительной опухоли."MAGE-А 3-положительная опухоль" означает любую опухоль или опухолевые клетки (выделенные из пациента), которые экспрессируют антиген MAGE-A3. Кроме того, в изобретении предложен способ идентификации и/или отбора пациента, подходящего для лечения иммунотерапевтическим MAGE-A3, включающий определение статуса метилирования генаMAGE-А 3 в образце от пациента с использованием олигонуклеотида, праймера или зонда, пары праймеров, набора или способа, как описано в данной заявке, где в случае, если ген MAGE-А 3 не метилирован,субъекта (предпочтительно) идентифицируют и/или отбирают для лечения иммунотерапевтическимMAGE-А 3. Таким образом, предпочтительными являются пациенты с неметилированным MAGE-A3, а не пациенты, у которых данный ген метилирован. Альтернативно, если данный ген не является неметилированным, субъекта предпочтительно не идентифицируют и/или не отбирают для лечения иммунотерапевтическим MAGE-A3. В родственном аспекте в изобретении предложен способ прогнозирования вероятности успешного лечения рака, включающий определение статуса метилирования гена MAGE-А 3 в образце от пациента с использованием олигонуклеотида, праймера или зонда, пары праймеров, набора или способа, как описано в данной заявке, где в случае, если ген не метилирован, вероятность успешного лечения иммунотерапевтическим MAGE-А 3 выше, чем в случае метилированного гена. Альтернативно, отсутствие неметилированного MAGE-А 3 в образце указывает на то, что вероятность устойчивости к лечению иммунотерапевтическим MAGE-А 3 выше, чем в случае неметилированного гена. Таким образом, обнаружение метилированного гена MAGE-А 3 указывает на низкую вероятность успешного лечения иммунотерапевтическим средством. В другом родственном аспекте в изобретении предложен способ выбора подходящего режима лечения рака, включающий определение статуса метилирования гена MAGE-А 3 в образце от пациента с использованием олигонуклеотида, праймера или зонда, пары праймеров, набора или способа, как описано в данной заявке, где в случае неметилированного гена для лечения выбирают иммунотерапевтическое средство. Альтернативно, если ген не является неметилированным, лечение иммунотерапевтическим средством противопоказано.-3 017879 Также предложен способ лечения рака у субъекта, включающий введение иммунотерапевтического средства, когда субъект был выбран для лечения на основании измерения статуса метилирования генаMAGE-А 3, в соответствии с любым из способов по изобретению или с использованием олигонуклеотида, праймера или зонда, пары праймеров, набора или способа, как описано в данной заявке. Предпочтительно, для всех различных аспектов, описанных в данной заявке, обнаружение неметилированного гена MAGE-А 3 соответствует повышенному уровню белка MAGE-A3. Кроме того, в настоящем изобретении предложен способ лечения пациента, включающий измерение статуса метилирования гена MAGE-А 3 в соответствии с любым из способов по изобретению с использованием олигонуклеотида, праймера или зонда, пары праймеров, набора или способа, как описано в данной заявке, и затем введение указанному пациенту композиции, содержащей MAGE-А 3, как описано в данной заявке. Композицию предпочтительно вводят, если обнаружено, что ген MAGE-А 3 не метилирован. В настоящем изобретении также предложен способ лечения пациента, склонного к рецидивуMAGE-А 3-экспрессирующей опухоли, где пациента уже лечили с целью удаления опухолевой ткани,включающий измерение статуса метилирования гена MAGE-А 3 в опухолевой ткани, в соответствии с любым из способов по изобретению или с использованием олигонуклеотида, праймера или зонда, пары праймеров, набора или способа, как описано в данной заявке, и затем введение указанному пациенту композиции, содержащей MAGE-А 3, как описано в данной заявке. Композицию предпочтительно вводят, если обнаружено, что ген MAGE-А 3 не метилирован. В еще одном аспекте настоящего изобретения предложено применение композиции, содержащейMAGE-А 3, в изготовлении лекарственного средства для лечения пациента, страдающего от опухоли, где пациент был выбран для лечения на основании измерения статуса метилирования гена MAGE-А 3 в соответствии с любым из способов по изобретению или с использованием олигонуклеотида, праймера или зонда, пары праймеров, набора или способа, как описано в данной заявке. Также предложена композиция, содержащая MAGE-А 3, для применения в лечении пациента, страдающего от опухоли, где пациент был выбран для лечения на основании измерения статуса метилирования гена MAGE-А 3 в соответствии с любым из способов по изобретению или с использованием олигонуклеотида, праймера или зонда, пары праймеров, набора или способа, как описано в данной заявке. В еще одном воплощении предложено применение композиции, содержащей MAGE-А 3, в изготовлении лекарственного средства для лечения пациента, склонного к рецидиву MAGE-А 3-экспрессирующей опухоли, где пациент был выбран для лечения на основании измерения статуса метилирования гена MAGE-А 3 в соответствии с любым из способов по изобретению или с использованием олигонуклеотида, праймера или зонда, пары праймеров, набора или способа, как описано в данной заявке. Также предложена композиция, содержащая MAGE-А 3, для применения в лечении пациента, склонного к рецидиву MAGE-А 3-экспрессирующей опухоли, где пациент был выбран для лечения на основании измерения статуса метилирования гена MAGE-А 3 в соответствии с любым из способов по изобретению или с использованием олигонуклеотида, праймера или зонда, пары праймеров, набора или способа, как описано в данной заявке. Подробное описание изобретения В изобретении предложен анализ для определения присутствия и/или количества метилированного или неметилированного гена MAGE-А 3 в ДНК-содержащем образце. Для разработки этого анализа было необходимо идентифицировать участки, подверженные метилированию, в гене MAGE-А 3 и разработать конкретные олигонуклеотиды, которые могут различать неметилированные и метилированные формы гена MAGE-A3. Соответственно, в первом аспекте в изобретении предложены олигонуклеотиды, содержащие, состоящие по существу или состоящие из любой нуклеотидной последовательности из SEQ ID NO: 2, 3, 4,5, 6, 7, 8, 9, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 25. Эти олигонуклеотиды полезны в определении статуса метилирования интересующего гена. Олигонуклеотиды могут служить в качестве праймеров и/или зондов. В некоторых воплощениях олигонуклеотиды определяют неметилированную форму гена. Олигонуклеотиды, подходящие для определения неметилированной формы, содержат, состоят по существу или состоят из любой нуклеотидной последовательности из SEQ ID NO: 2, 4, 5, 7, 8, 11, 13 или 25. Олигонуклеотиды, подходящие для определения метилированной формы, содержат, состоят по существу или состоят из любой нуклеотидной последовательности из SEQ ID NO: 14, 16, 17 или 19. В некоторых воплощениях эти олигонуклеотиды содержат шпилечную структуру, как описано в настоящем изобретении. Такие предпочтительные олигонуклеотиды включают последовательности в соответствии с SEQ ID NO: 3, 6, 9, и 12 для определения неметилированной формы гена и SEQ ID NO: 15 и 18 для определения метилированной формы гена."Гены" или "интересующий ген" по изобретению представляют собой предпочтительно геныMAGEA3 и/или MAGEA6. MAGEA3 и MAGEA6 представляют собой символы гена, утвержденныеHUGO Gene Nomenclature Committee. Ген MAGEA3 локализован на хромосоме X (локализация q28) и последовательность гена зарегистрирована под номерами доступа NM005362 и ENSG00000197172. ГенMAGE-А 3 кодирует меланомный антиген семейства А, 3. Ген MAGEA6 локализован на хромосоме X(локализация q28). MAGE-A3 часто упоминается взаимозаменяемо как MAGE-3 или MAGEA3. Аналогично, MAGE-A6 часто упоминается взаимозаменяемо как MAGE-6 или MAGEA6; все используются в данной заявке. "Гипометилирование" этих генов может быть связано с частотой возникновения раковых заболеваний, таких как, например, меланома или рак легких (включая NSCLC). Динуклеотиды CpG, подверженные метилированию, обычно концентрируются в промоторной области человеческих генов. В предпочтительном воплощении статус метилирования гена оценивают путем определения уровней метилирования в промоторной области гена. "Промотор" представляет собой область, расположенную выше точки инициации транскрипции (TSS), находящуюся на расстоянии приблизительно 10 т.п.о., 3 т.п.о., 1 т.п.о., 500 п.о. или 150-300 п.о. от TSS. Для MAGE-3 распределение CpG в промоторной области является довольно редким. Термин "состояние метилирования" или "статус метилирования" относится к присутствию или отсутствию 5-метилцитозина ("5-mCyt") в одном или множестве динуклеотидов CpG в последовательности ДНК. "Гиперметилирование" определяют как увеличение уровня метилирования выше нормальных уровней. Таким образом, это относится к аберрантному метилированию цитозина (5-mCyt) в специфических сайтах CpG в гене, часто в промоторной области. Нормальные уровни метилирование могут быть установлены, например, путем определения статуса метилирования в нераковых клетках."Гипометилирование" относится к уменьшенному присутствию 5-mCyt в одном или множестве динуклеотидов CpG в последовательности ДНК (анализируемого образца ДНК), по сравнению с количеством 5-mCyt, обнаруженным в соответствующих динуклеотидах CpG в "нормальной" последовательности ДНК (обнаруженным в подходящем контрольном образце)."Нормальные" уровни метилирования также могут быть установлены, например, путем определения уровня метилирования в нераковых клетках. В данном изобретении гипометилирование гена MAGEА 3 и/или MAGE-A6 является признаком повышенной экспрессии этого гена опухолеассоциированного антигена, который является надежным индикатором рака. Во втором аспекте изобретения предложен способ определения присутствия и/или количества метилированного или неметилированного гена в ДНК-содержащем образце, включающий стадию приведения ДНК-содержащего образца в контакт по меньшей мере с одним олигонуклеотидом, содержащим,состоящим по существу или состоящим из любой нуклеотидной последовательности из SEQ ID NO: 2, 3,4, 5, 6, 7, 8, 9, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 25. Способ предпочтительно включает дополнительную стадию оценки того, является ли ген метилированным или неметилированным. Это может зависеть от того, насколько стабильно связывается олигонуклеотид с ДНК в ДНК-содержащем образце, как обсуждается в данной заявке. Способы оценки статуса метилирования основаны на различных подходах. Могут быть использованы любые подходящие способы, в которых используют олигонуклеотиды по изобретению. В одном воплощении в подходах для определения метилированных CpG-динуклеотидных мотивов используют реагент, который избирательно модифицирует неметилированные остатки цитозина в ДНК для получения детектируемых модифицированных остатков. Данный реагент не модифицирует метилированные остатки цитозина и, таким образом, позволяет установить различие между неметилированными и метилированными молекулами нуклеиновых кислот в нижележащем процессе, который предпочтительно может вовлекать амплификацию нуклеиновой кислоты. В одном воплощении реагент может влиять на избирательное дезаминирование неметилированных остатков цитозина. Таким образом, после взаимодействия с реагентом неметилированная ДНК содержит нуклеотидную последовательность, отличную от соответствующей метилированной ДНК. Дезаминирование цитозина приводит к образованию остатка урацила,который имеет такие же свойства при спаривании оснований, как тимин, но отличается от характера спаривания цитозиновых оснований. Это позволяет установить различие между метилированными и неметилированными цитозинами. В полезных традиционных методах оценки различий последовательностей используют олигонуклеотидные праймеры. Возможны два подхода к конструированию праймеров. Во-первых, могут быть сконструированы праймеры, которые сами не охватывают потенциальные сайты метилирования ДНК. Вариации последовательности в сайтах дифференциального метилирования локализованы между двумя сайтами связывания с праймерами и визуализация вариации последовательности требует дополнительных стадий анализа. Во-вторых, могут быть сконструированы праймеры, которые специфически гибридизуются либо с метилированным, либо с неметилированным вариантом первоначальной обработанной последовательности. После гибридизации может быть осуществлена реакция амплификации, и продукты амплификации анализируют с использованием любой системы обнаружения, известной в данной области техники. Присутствие продукта амплификации указывает на гибридизацию праймеров с ДНК. Специфичность праймера показывает, была ли ДНК модифицирована или нет, что, в свою очередь, показывает,была ли ДНК метилирована или нет. Если имеется достаточная область комплементарно cnbt с мишенью,например, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21 или 22 нуклеотидов, то праймер может содержать также дополнительные нуклеотидные остатки, которые не препятствуют гибридизации, но могут быть полезны для других манипуляций. Примерами таких других остатков могут быть сайты для расщепления рестрикционными эндонуклеазами, для связывания с лигандом или для связывания с фактором или линкеры,-5 017879 или повторы, или остатки с целью визуализации. Олигонуклеотидные праймеры могут быть или могут не быть специфичными для модифицированных метилированных остатков. Предпочтительные олигонуклеотиды для применения в качестве праймеров содержат, состоят по существу или состоят из любой нуклеотидной последовательности из SEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 25. Другой способ различать модифицированные и немодифицированные нуклеиновые кислоты состоит в использовании олигонуклеотидных зондов. Такие зонды могут гибридизоваться непосредственно с модифицированной нуклеиновой кислотой или другими продуктами модифицированной нуклеиновой кислоты, такими как продукты, полученные посредством амплификации. В анализах на основе зондов используют гибридизацию олигонуклеотидов со специфическими последовательностями и последующую детекцию гибрида. Также могут быть использованы дополнительные стадии очистки перед детекцией продукта амплификации, например, стадия осаждения. Олигонуклеотидные зонды могут быть мечены с использованием любой системы детекции, известной в данной области техники. Они включают в себя, но не ограничиваются этим, флуоресцентные группировки, меченные радиоизотопами группировки, биолюминесцентные группировки, люминесцентные группировки, хемилюминесцентные группировки, ферменты, субстраты, рецепторы или лиганды. Предпочтительные олигонуклеотиды для применения в качестве зондов содержат, состоят по существу или состоят из любой нуклеотидной последовательности из SEQ ID NO: 2, 4, 5, 7, 8, 11, 13, 14, 16, 17, 19 или 25."Олигонуклеотидный праймер" упоминается в данной заявке взаимозаменяемо как "праймер". Аналогично, "олигонуклеотидный зонд" упоминается в данной заявке взаимозаменяемо как "зонд". В предпочтительных воплощениях статус метилирования гена (или его участка, особенно CpGостровков) определяют с использованием ПЦР, специфической в отношении метилирования (MSP). Метод MSP знаком специалисту в данной области техники. При применении MSP подхода, ДНК может быть амплифицирована с использованием пары праймеров, сконструированных для того, чтобы отличать неметилированную ДНК от метилированной, воспользовавшись различиями в последовательности в результате обработки бисульфитом натрия (Herman JG et al., Proc Natl Acad Sci USA. 1996 Sep 3;93(18):9821-6 и WO 97/46705). Конкретный пример MSP метода представляет собой количественный(QMSP) в режиме реального времени, который делает возможным надежное количественное определение метилированной ДНК в режиме реального времени. Способы в режиме реального времени, как правило, основаны на непрерывном оптическом мониторинге за процедурой амплификации и в них используются флуоресцентно-меченые реагенты, включение которых в продукт может быть количественно определено и количество которых является показателем числа копий этой последовательности в матрице. Такой меченый реагент может быть флуоресцетным красителем, который предпочтительно связывается с двухцепочечной ДНК и флуоресценция которого значительно усиливается при связывании с двухцепочечной ДНК. Альтернативно, могут быть использованы меченые праймеры и/или меченые зонды. Они представляют собой конкретное применение хорошо известных и коммерчески доступных методов амплификации в режиме реального времени, таких какTAQMAN, MOLECULAR BEACONS, AMPLIFLUOR и SCORPION DzyNA, и др. Часто эти методы в режиме реального времени используют с полимеразной цепной реакцией (ПЦР). В технологии TaqMan используют линейные, гидролитические олигонуклеотидные зонды, которые содержат флуоресцентный краситель и гасящий краситель. При облучении возбужденный флуоресцентный краситель переносит энергию на соседнюю молекулу гасящего красителя, а не флуоресцентного красителя (принцип FRET). TaqMan зонды гибридизуются с внутренним участком ПЦР-продукта и расщепляются экзонуклеазной активностью полимеразы, когда она реплицирует матрицу. Это прекращает активность гасителя, и репортерный краситель начинает излучать флуоресценицию, которая увеличивается в каждом цикле пропорционально скорости расщепления зонда. Молекулярные маяки также содержат флуоресцентные красители и гасящие красители, но они предназначены для принятия шпилечной структуры в свободном виде в растворе с целью приведения обоих красителей в непосредственную близость для осуществления резонансного переноса энергии флуоресценции (FRET). Когда маяк гибридизуется с мишенью во время стадии отжига, шпилька линеаризуется, и оба красителя (донор и акцептор/гаситель) разделяются. Увеличение флуоресценции, обнаруженное от донора, будет коррелировать с количеством доступного ПЦР-продукта. При применении зондов - "скорпионов" последовательность - специфический прайминг и определение ПЦР-продукта достигаются с использованием одного олигонуклеотида. Зонд-"скорпион" поддерживает конфигурацию типа "стебель-петля" в негибридизованном состоянии и FRET происходит между флуорофором и гасителем. 3'-Участок стебля также содержит последовательность, которая комплементарна продукту удлинения праймера. Эта последовательность связана с 5'-концом конкретного праймера через неамплифицируемый мономер. После удлинения праймера -"скорпиона" последовательность конкретного зонда способна связываться с его дополнением в пределах удлиненного ампликона, таким образом открывая шпилечную петлю, разделяя флуорофор и гаситель и обеспечивая сигнал флуоресценции. В случае гиперметилирования прайминг является специфическим в отношении метилирования, но вместо самих праймеров эту специфичность обеспечивают неудлиняемые олигонуклеотидные блокато-6 017879 ры. Блокаторы связываются с бисульфит-обработанной ДНК специфическим в отношении метилирования образом, и их сайты связывания перекрываются с сайтами связывания праймеров. Когда блокатор связан, праймер не может связаться, и поэтому ампликон не образуется. Гиперметилирование может быть использовано в комбинации с детекцией в режиме реального времени. Системы кПЦР (количественная ПЦР) и кОТ-ПЦР Plexor имеют преимущество специфического взаимодействия между двумя модифицированными нуклеотидами для осуществления количественного ПЦР-анализа. Один из ПЦР-праймеров содержит флуоресцентную метку, примыкающую к остатку isodC (5'-метилизоцитозин) на 5'-конце. Второй ПЦР праймер является немеченым. Реакционная смесь содержит дезоксинуклеотиды и iso-dGTP, модифицированный гасителем dabcyl. Dabcyl-iso-dGTP преимущественно встраивается в положение, комплементарное остатку iso-dC. Встраивание dabcyl-iso-dGTP в это положение приводит к гашению флуоресцентного красителя на комплементарной цепи и уменьшению флуоресценции, что позволяет осуществлять количественное определение во время амплификации. Для этих мультиплексных реакций используют пару праймеров с разным флуорофором для каждой последовательности-мишени. Таким образом, олигонуклеотиды, содержащие, состоящие по существу или состоящие из любой нуклеотидной последовательности из SEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 25, могут быть использованы в качестве праймеров или зондов в вышеупомянутых способах для определения статуса метилирования интересующего гена. В предпочтительном воплощении в изобретении предложен способ определения в режиме реального времени присутствия и/или количества интересующего метилированного или неметилированного гена в ДНК-содержащем образце, включающий:(а) приведение ДНК-содержащего образца в контакт с реагентом или обработку ДНК-содержащего образца реагентом, который избирательно модифицирует неметилированные остатки цитозина в ДНК с образованием детектируемых модифицированных остатков, но который не модифицирует метилированные остатки цитозина;(б) амплификацию по меньшей мере участка интересующего метилированного или неметилированного гена с использованием по меньшей мере одной пары праймеров, в которой по меньшей мере один праймер сконструирован таким образом, чтобы связываться только с последовательностью метилированной или неметилированной ДНК, соответственно, после обработки реагентом, где по меньшей мере один праймер в паре праймеров содержит, состоит по существу или состоит из любой нуклеотидной последовательности из SEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 13, 14, 15, 16, 17, 18 или 19. Интересующий ген в способах по изобретению представляет собой предпочтительно ген MAGE-А 3 и/или MAGE-A6. Предпочтительно, по меньшей мере один праймер в паре праймеров является праймером, содержащим структуру "стебель-петля", несущую донорную и акцепторную группировку из молекулярной пары для переноса энергии, организованной таким образом, что в отсутствие амплификации акцепторная группировка гасит флуоресценцию, излучаемую донорной группировкой (после возбуждения) и во время амплификации, структура "стебель-петля" разрушается, чтобы в достаточной степени разделить донорную и акцепторную группировки для производства детектируемого флуоресцентного сигнала. Это может быть определено в режиме реального времени для обеспечения показания о присутствии интересующего метилированного или неметилированного гена. Праймер в паре праймеров, которая содержит, состоит по существу или состоит из любой нуклеотидной последовательности из SEQ IDNO: 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 13, 14, 15, 16, 17, 18 или 19, предпочтительно несет структуру "стебельпетля". В некоторых воплощениях определяют число копий метилированного или неметилированного гена. В этом случае способ, описанный в данной заявке, предпочтительно включает дополнительную стадию:(в) количественной оценки результатов определения в режиме реального времени относительно калибровочной кривой для интересующего метилированного или неметилированного гена для определения выхода числа копий гена. Предпочтительно, стадия (в) дополнительно отличается тем, что амплификация считается достоверной, когда пороговое значение циклов составляет менее 40. Для генов, таких как ген MAGEA3 и/или MAGEA6, определение неметилированного варианта гена может иметь первостепенное значение. Способы по изобретению позволяют определять в режиме реального времени присутствие в образце интересующего метилированного или неметилированного гена. Поскольку способы по изобретению являются количественными способами, то (относительные) количества метилированной или неметилированной формы интересующего гена также могут быть определены по мере протекания реакции. Однако нет необходимости использовать методы в режиме реального времени. Анализы могут быть осуществлены только для того, чтобы выяснить, присутствует ли целевая ДНК в образце или нет. В методах определения амплификации по конечной точке используют те же подходы, которые широко используются для ПЦР в реальном времени. Поэтому способы по изобретению могут охватывать способ определения присутствия и/или количества интересующего метилированного или неметилированного гена в ДНКсодержащем образце по конечной точке.-7 017879 Таким образом, в изобретении предложен способ (по конечной точке) определения присутствия и/или количества интересующего метилированного или неметилированный гена в ДНК-содержащем образце, включающий:(а) приведение ДНК-содержащего образца в контакт с реагентом или обработку ДНК-содержащего образца реагентом, который избирательно модифицирует неметилированные остатки цитозина в ДНК с образованием детектируемых модифицированных остатков, но который не модифицирует метилированные остатки цитозина;(б) амплификацию по меньшей мере участка интересующего метилированного или неметилированного гена с использованием по меньшей мере одной пары праймеров, в которой по меньшей мере один праймер сконструирован для связывания только с последовательностью метилированной или неметилированной ДНК, соответствено, после обработки реагентом, где по меньшей мере один праймер в паре праймеров содержит, состоит по существу или состоит из любой нуклеотидной последовательности изSEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 25. Как было упомянуто выше, интересующий ген в способах по изобретению представляет собой предпочтительно ген MAGE-А 3 и/или MAGE-A6. Предпочтительно, по меньшей мере один праймер в паре праймеров представляет собой праймер, содержащий структуру "стебель-петля", несущую донорную и акцепторную группировку из молекулярной пары для переноса энергии, имеющую характеристики, как описано в данной заявке. Праймер в паре праймеров, которая содержит, состоит по существу или состоит из любой нуклеотидной последовательности из SEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 13, 14,15,16, 17, 18 или 19, предпочтительно несет структуру "стебель-петля". Для гена MAGE-А 3 и/или MAGE-A6 определение неметилированного варианта гена может иметь первостепенное значение. Праймеры, содержащие, состоящие по существу или состоящие из любой нуклеотидной последовательности из SEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 13 или 25, были сконструированы с целью определения неметилированной ДНК MAGE-A3 после обработки реагентом. Отсутствие неметилированного гена будет указывать на присутствие метилированного гена. Однако определение метилированного гена также находится в рамках данного изобретения. Праймеры, содержащие, состоящие по существу или состоящие из любой нуклеотидной последовательности из SEQID NO: 14, 15, 16, 17, 18 или 19, были сконструированы с целью определения метилированной ДНКMAGEA3 после обработки реагентом. В случае, когда желательно определение числа копий метилированного или неметилированного гена, способ предпочтительно включает дополнительную стадию:(в) количественную оценку результатов определения интересующего метилированного или неметилированного гена относительно калибровочной кривой для определения выхода числа копий гена. Все воплощения изобретения применимы к аспектам изобретения по конечной точке и, следовательно, используются с соответствующими изменениями. Анализ по конечной точке может включать применение флуоресцентного планшет-ридера или других подходящих приборов для определения флуоресценции в конце амплификации. Способы по изобретению представляют собой наиболее предпочтительные способы ex vivo или invitro, осуществляемые на любом подходящем (ДНК-содержащем) тестируемом образце. Однако в одном воплощении способ также может включать стадию получения образца. Тестируемый образец представляет собой ДНК-содержащий образец, в частности ДНК-содержащий образец, содержащий интересующий ген. Способы по изобретению могут быть использованы для диагностики заболевания, в частности,когда (известно, что) метилирование интересующего гена связано с частотой возникновения заболевания. ДНК-содержащий образец может содержать образец из любой подходящей ткани или жидкость организма. Предпочтительно, когда тестируемый образец получают от субъекта-человека. Для применений в отношении рака, образец может содержать образец ткани, полученный из ткани, которая предположительно является раковой, или типичной жидкости организма. Гипометилирование гена MAGE-А 3 было связано с раком легкого. Таким образом, в одном воплощении тестируемый образец, используемый в способах по изобретению, включающий ген MAGE-А 3,предпочтительно содержит клетки легкого или нуклеиновые кислоты из клеток легкого. Наиболее предпочтительно, образец представляет собой ткань, фиксированную формалином и заключенную в парафин(FFPE). Существуют два типа рака легкого: немелкоклеточный рак легкого (NSCLC) и мелкоклеточный рак легкого (SCLC). Эти названия просто описывают тип клеток, обнаруженных в опухолях. Тестируемый образец предпочтительно содержит клетки или нуклеиновую кислоту из немелкоклеточной карциномы легкого (NSCLC). NSCLC включает в себя плоскоклеточную карциному, аденокарциному и крупноклеточную карциному и составляет около 80% от раков легкого. В предпочтительном воплощении,когда рак представляет собой NSCLC, тогда образец представляет собой образец ткани легкого или образец мокроты. NSCLC трудно вылечить и доступное лечение, как правило, имеет своей целью продление жизни, насколько это возможно, и облегчение симптомов заболевания. NSCLC является самым распространенным типом рака легкого и ассоциирован с плохими прогнозами. Гипометилирование гена MAGE-А 3 также связано с раком мочевого пузыря. Таким образом в до-8 017879 полнительных воплощениях другой предпочтительный тестируемый образец, используемый в способах по изобретению, также содержит клетки переходно-клеточного рака мочевого пузыря или клетки плоскоклеточной карциномы мочевого пузыря. Предпочтительно, тестируемый образец получают из ткани мочевого пузыря. Более предпочтительно, он происходит из мочи и содержит нуклеиновую кислоту из клеток переходно-клеточного рака мочевого пузыря или клеток плоскоклеточной карциномы мочевого пузыря. Тестируемый образец может быть получен из жидкой мочи, ее преципитата или осадка в моче. Ткани и жидкости организма могут быть собраны с использованием подходящего способа, многие из которых хорошо известны в данной области техники. Гипометилирование гена MAGE-А 3 также связано с меланомой. Меланома представляет собой пигментированное, легкодоступное поражение, которое было четко определено в гистопатологических терминах. Ранняя радиальная фаза роста (RGP) меланом может проникать в эпидермис и папиллярную дерму, но не имеет способности к метастазированию, резекция на этой стадии практически полностью излечивает. Последующая вертикальная фаза роста (VGP) означает переход к более агрессивной стадии,которая способна к метастазированию. Таким образом, изменения генной экспрессии, происходящие при переходе RGP/VGP, представляют большой интерес. Таким образом, в дополнительных воплощениях другой предпочтительный тестируемый образец, используемый в способах по изобретению, содержит клетки меланомы. Предпочтительно, тестируемый образец получают из повреждения кожи. Другие ДНК-содержащие образцы для применения в способах по изобретению включают образцы для диагностического, прогностического или индивидуального медицинского применений. Такие образцы могут быть получены из хирургических образцов, таких как биопсии или материал, полученный путем аспирации тонкой иглой, из тканей, заключенных в парафин, из замороженных образцов опухолевой ткани, из свежих образцов опухолевой ткани или из свежей или замороженной жидкости тела, например. Неограничивающие примеры включают в себя цельную кровь, костный мозг, спинномозговую жидкость,жидкость брюшной полости, плевральную жидкость, лимфатическую жидкость, сыворотку, плазму, мочу, хилус, кал, эякулят, мокроту, аспират из сосков, слюну, препараты мазков, образцы смывов толстой кишки и образцы, полученные с помощью кисточки. Ткани и жидкости тела могут быть собраны с использованием подходящего способа, многие такие способы хорошо известны в данной области техники. Оценка образца, заключенного в парафин, может быть осуществлена непосредственно или на срезе ткани. Термины "образец" и "образец от пациента" являются взаимозаменяемыми и предназначены для обозначения ДНК-содержащего образца от пациента, как описано выше. Способы по изобретению могут быть осуществлены на очищенных или неочищенных ДНКсодержащих образцах. Однако в предпочтительном воплощении до стадии (а) (стадия обработки реагентом) или в качестве предварительной стадии, ДНК выделяют/экстрагируют/очищают из ДНКсодержащего образца. Могут быть использован любой подходящий способ выделения ДНК. Примеры способов очистки можно найти в стандартных руководствах, таких как Molecular Cloning - A LaboratoryManual (третье издание), Sambrook and Russell (см., в частности, приложение 8 и главу 5 в нем). В одном предпочтительном воплощении очистка включает осаждение ДНК спиртом. Предпочтительные спирты включают этанол и изопропанол. Подходящие способы очистки также включают способы осаждения с использованием соли. Таким образом, в одном конкретном воплощении способ очистки ДНК включает использование высокой концентрации соли для осаждения примесей. Соль может включать, состоять по существу или состоять из ацетата калия и/или ацетата аммония, например. Способ может дополнительно включать стадии удаления примесей, которые были осаждены после выделения ДНК посредством осаждения спиртом. В альтернативном воплощении способ очистки ДНК основан на использовании органических растворителей для экстракции примесей из клеточных лизатов. Таким образом, в одном воплощении способ включает применение фенола, хлороформа и изоамилового спирта для экстракции ДНК. Подходящие условия используются для обеспечения того, чтобы примеси были отделены в органическую фазу, а ДНК осталась в водной фазе. В дополнительных наборах используют магнитные шарики, кремниевые мембраны и т.д. Такие наборы хорошо известны в данной области техники и имеются в продаже. В способах по изобретению можно использовать набор для очистки ДНК PUREGENE. В предпочтительных воплощениях этих способов очистки, экстрагированную ДНК извлекают посредством осаждения спиртом, такого как осаждение этанолом или изопропанолом. Фиксированная формалином и заключенная в парафин (FFPE) опухолевая ткань представляет собой обычный способ консервации опухолевой ткани в клинических центрах. Такие FFPE-заключенные образцы требуют стадии депарафинизации перед экстракцией ДНК. В предпочтительном воплощении образцы FFPE-ткани или материал образца, иммобилизованные на покровных стеклах, сначала депарафинизируют путем обработки ксилолом. Период контакта с ксилолом должен быть достаточным для того,чтобы позволить ксилолу контактировать и взаимодействовать с образцом. В более предпочтительном воплощении FFPE-образцы депарафинизируют в 100%-ном ксилоле в течение около 2 ч. Эту стадию можно повторить еще раз для обеспечения полной депарафинизации. После обработки ксилолом образцы подвергают регидратации с использованием 70%-ного этанола. Способы по изобретению также могут, при необходимости, включать (также до стадии (а) или в ви-9 017879 де предварительной стадии) количественное определение выделенной/экстрагированной/очищенной ДНК в образце. Количественное определение ДНК в образце может быть осуществлено с использованием любого подходящего способа. Количественное определение нуклеиновых кислот может быть основано, например, на использовании спектрофотометра, флуориметра или УФ-трансиллюминатора. Примеры подходящих способов описаны в стандартных руководствах, таких как Molecular Cloning - A LaboratoryManual (третье издание), Sambrook and Russell (см., в частности, приложение 8 в нем). В предпочтительном воплощении наборы, такие как набор для количественного определения дцДНК Picogreen, имеющийся в продаже от Molecular Probes, Invitrogen, могут быть использованы для количественного определения ДНК. Способы по изобретению основаны на реагенте, который избирательно модифицирует неметилированные остатки цитозина в ДНК с образованием детектируемых модифицированных остатков. Способ действия реагента был уже объяснен. В предпочтительном воплощении реагент, который избирательно модифицирует неметилированные остатки цитозина в ДНК с образованием детектируемых модифицированных остатков, но который не модифицирует метилированные остатки цитозина, содержит, состоит по существу или состоит из бисульфитного реагента (Frommer et al., Proc. Natl. Acad. Sci. USA 1992 89:18271831). Некоторые бисульфит-содержащие реагенты известны в данной области техники, и подходящие наборы для проведения реакции дезаминирования имеются в продаже (такие как набор для метилирования ДНК EZ от Zymo Research). Особенно предпочтительный реагент для применения в способах по изобретению содержит, состоит по существу или состоит из бисульфита натрия. После того, как ДНК в образце была обработана реагентом, необходимо затем определить различие в нуклеотидной последовательности, вызванной реагентом. Это делают с использованием методики амплификации нуклеиновых кислот. Как уже упоминалось, функционально значимое метилирование чаще всего связано с промоторными областями генов. В частности, так называемые "CpG-островки" включают относительно высокую частоту остатков CpG и часто обнаруживаются в промоторной области гена. Существуют различные компьютерные программы, позволяющие обнаруживать CpG-островки в интересующем гене, подлежащем идентификации. Соответственно, способы по изобретению могут включать амплификацию по меньшей мере участка интересующего метилированного или неметилированного гена с использованием по меньшей мере одной пары праймеров. Как описано выше, поскольку интересующие остатки, статус метилирования которых должен быть исследован, обычно обнаруживаются в определенных CpG-островках и/или в промоторной области интересующего гена, пара праймеров, как правило,амплифицирует только часть гена (в этой области), а не весь ген. Любой подходящий участок гена может быть амплифицирован в соответствии со способами по изобретению, при условии, что продукт амплификации является детектируемым в качестве надежного индикатора присутствия интересующего гена. Особенно легко обнаружить продукты амплификации, составляющие приблизительно от 50 до 250 п.о. Еще более предпочтительно, в результате амплификации с использованием по меньшей мере одной пары праймеров для амплификации интересующего метилированного или неметилированного гена получают продукт амплификации приблизительно от 100 до 200 п.о. или от 50 до 100 п.о. Это особенно актуально для образцов ткани, особенно образцов, заключенных в парафин, где обычно получают ограниченное качество ДНК и может быть желательно меньше ампликонов. В предпочтительном воплощении детектируемый продукт амплификации содержит по меньшей мере любую нуклеотидную последовательность из(около) 100 п.о., 110 п.о., 115 п.о., 120 п.о., 125 п.о., 126 п.о., 130 п.о., 135 п.о., 140 п.о. или 142 п.о. По меньшей мере один праймер в паре праймеров и предпочтительно оба праймера сконструированы таким образом, чтобы связываться только с последовательностью метилированной или неметилированной ДНК после обработки реагентом. Таким образом, праймер действует таким образом, чтобы установить различие между метилированным и неметилированным геном посредством спаривания оснований либо только с метилированной формой гена (которая остается немодифицированной после обработки реагентом), либо с неметилированной формой гена (которая модифицируется реагентом) в зависимости от применения, для которого используют данные способы. Поэтому праймер должен охватывать по меньшей мере один сайт метилирования в интересующем гене. Предпочтительно праймер связывается с областью гена, включающей по меньшей мере 1, 2, 3, 4, 5, 6, 7 или 8 сайтов метилирования. Наиболее предпочтительно, когда праймер сконструирован для связывания с последовательностью, в которой все остатки цитозина в парах CpG в пределах сайта связывания с праймером метилированы или не метилированы, то есть представляют собой "полностью метилированную" или "полностью неметилированную" последовательность. Однако, если только один или несколько сайтов метилирования имеют функциональное значение, то праймер может быть сконструирован для связывания с целевой последовательностью, в которой только эти остатки должны быть метилированы (остаются в виде цитозина) или не метилированы (превращаются в урацил) для того, чтобы произошло эффективное связывание. Других (функционально незначимых) потенциальных сайтов метилирования можно полностью избежать за счет соответствующей конструкции праймера, или могут быть сконструированы праймеры, которые связываются независимо от статуса метилирования этих менее значимых сайтов (например, путем включения смеси остатков G и А в соответствующем положении в праймерной последовательности). Соответственно,- 10017879 ожидается продукт амплификации, только если метилированная или неметилированная форма интересующего гена присутствовала в исходном ДНК-содержащем образце. Дополнительно или альтернативно,может быть целесообразным, по меньшей мере для одного праймера в паре праймеров, связываться только с последовательностью неметилированной ДНК после обработки реагентом, а для другого праймера -связываться с метилированной ДНК только после обработки - например, когда ген включает функционально важные сайты, которые метилированы, и отдельные функционально важные сайты, которые не метилированы. Предпочтительно, по меньшей мере один праймер в паре праймеров представляет собой праймер,содержащий структуру "стебель-петля" или "шпилечную" структуру, несущую донорную и акцепторную группировку из молекулярной пары для переноса энергии. Этот праймер может быть или может не быть праймером, который устанавливает различие между метилированной и неметилированной ДНК, при желании. Праймер сконструирован таким обраом, что в отсутствие амплификации акцепторная группировка гасит флуоресценцию, испускаемую донорной группировкой после возбуждения. Таким образом, до или в отсутствие амплификации, направляемой праймером, структура "стебель-петля" или "шпилечная" структура остается интактной. Флуоресценция, испускаемая донорной группировкой, эффективно принимается акцепторной группировкой, что приводит к гашению флуоресценции. Во время амплификации конфигурация структуры праймера типа "стебель-петля" или "шпилька" изменяется. В частности, если праймер встраивается в продукт амплификации и, в частности, в двухцепочечную ДНК, (особенно во время второго раунда амплификации), структура "стебель-петля" или"шпилька" разрушается. Это изменение в структуре разделяет донорную и акцепторную группировки в достаточной степени, чтобы акцепторная группировка больше не могла эффективно гасить флуоресценцию, испускаемую донорной группировкой. Таким образом, донорная группировка продуцирует детектируемый флуоресцентный сигнал. Этот сигнал определяют в режиме реального времени, чтобы дать представление о числе копий интересующего метилированного или неметилированного гена. Таким образом, в способах по изобретению могут быть использованы олигонуклеотиды для амплификации нуклеиновых кислот, которые мечены поддающимися детекции метками переноса молекулярной энергии (МЕТ). Праймеры содержат донорную и/или акцепторную группировку из пары МЕТ и встраиваются в амплифицированный продукт реакции амплификации, так что амплифицированный продукт содержит как донорную, так и акцепторную группировку из пары МЕТ. Когда амплифицированный продукт является двухцепочечным, тогда пара МЕТ, встраиваемая в амплифицированный продукт, может находиться на одной и той же цепи или, когда амплификация представляет собой триамплификацию, на противоположных цепях. В некоторых случаях, когда полимераза,используемая в амплификации, имеет 5'-3'-экзонуклеазную активность, одна из группировок в паре МЕТ может отщепляться по меньшей мере от некоторой части популяции амплифицированного продукта этой экзонуклеазной активностью. Такая экзонуклеазная активность не наносит ущерба способам амплификации по изобретению. Способы по изобретению, как описано в данной заявке, пригодны для многих способов амплификации последовательностей нуклеиновых кислот, включая полимеразную цепную реакцию (ПЦР), триамплификацию и другие системы амплификации. В предпочтительном воплощении МЕТ представляет собой резонансный перенос энергии флуоресценции (FRET), где олигонуклеотиды мечены донорной и акцепторной группировками, где донорная группировка представляет собой флуорофор, и акцепторная группировка может представлять собой флуорофор, так что флуоресцентная энергия, испускаемая донорной группировкой, поглощается акцепторной группировкой. Акцепторная группировка может представлять собой гаситель. Таким образом,праймер для амплификации представляет собой праймер со шпилечной структурой, который содержит как донорную, так и акцепторную группировки, и сконструирован таким образом, что акцепторная группировка гасит флуоресценцию донора. Когда праймер встраивается в продукт амплификации, его конфигурация изменяется, гашение прекращается и может быть определена флуоресценция донорной группировки. Способы по изобретению позволяют определять продукт амплификации без предварительного отделения невключенных олигонуклеотидов. Кроме того, они позволяют определять продукт амплификации непосредственно, путем включения меченого олигонуклеотида в продукт. В предпочтительном воплощении способы по изобретению также включают определение экспрессии эталонного гена. Эталонные гены важны для проведения сравнения между различными образцами. Выбрав соответствующий ген, который, как полагают, экспрессируется стабильно и надежно в сравниваемых образцах, при определении амплификации эталонного гена вместе с интересующим геном принимают во внимание вариабильность между образцами по таким параметрам, как количество вводимого материала, ферментативная эффективность, деградация образца и т.д. Эталонный ген, в идеале, в присутствии подтвержденного количества вводимой ДНК должен быть единственным геном, который постоянно экспрессируется в тестируемых образцах. Таким образом, результаты, полученные для интересующего гена, могут быть нормализованы относительно соответствующего числа копий эталонного гена. Подходящие эталонные гены для настоящего изобретения включают гены бета-актина, глицеральдегид-3- 11017879 фосфатдегидрогеназы (GAPDH), рибосомальной РНК, такие как ген 18S рибосомальной РНК и РНКполимеразы II (Radonic A. et al., Biochem Biophys Res Commun. 2004 Jan 23;313 (4):856-62). В конкретном предпочтительном воплощении эталонный ген представляет собой бета-актин. Таким образом, способы по изобретению могут быть дополнительно охарактеризованы при амплификации по меньшей мере участка эталонного гена с использованием по меньшей мере одной пары праймеров, где по меньшей мере один праймер в паре праймеров представляет собой праймер, содержащий структуру "стебель-петля", имеющую вышеупомянутые характеристики. Любой подходящий участок эталонного гена может быть амплифицирован в соответствии со способами по изобретению, при условии, что продукт амплификации является детектируемым в качестве надежного индикатора присутствия эталонного гена. Особенно легко детектируемые продукты амплификации составляют приблизительно от 50 до 250 п.о. Еще более предпочтительно, когда при амплификации с использованием по меньшей мере одной пары праймеров для амплификации эталонного гена получают продукт амплификации приблизительно от 100 до 200 п.о. Это особенно актуально для образцов ткани, особенно для образцов, заключенных в парафин, где, как правило, получают ограниченное качество ДНК. В воплощениях, в которых эталонный ген включают в способы по изобретению, данные способы могут дополнительно отличаться тем, что стадия способов, которая включают количественную оценку результатов определения (в режиме реального времени) относительно калибровочной кривой для интересующего метилированного или неметилированного гена, также включает количественную оценки результатов определения в режиме реального времени эталонного гена относительно калибровочной кривой для эталонного гена для получения выхода количества копий гена в каждом конкретном случае и возможно дополнительно включает нормализацию результатов путем деления числа копий интересующего метилированного или неметилированного гена на число копий эталонного гена. Кроме того, способы отличаются тем, что амплификация считается достоверной, когда пороговое значение циклов составляет менее 40. Это предпочтительно в случае как интересующего гена, так и эталонного гена. При амплификации по меньшей мере участка эталонного гена, как правило, используют по меньшей мере одну пару праймеров. Предпочтительно, по меньшей мере один праймер в паре праймеров представляет собой праймер, содержащий структуру "стебель-петля", несущую донорную и акцепторную группировки из молекулярной пары для переноса энергии, как для интересующего гена. Механизм действия такой структуры во время амплификации был объяснен в данной заявке."Шпилечные" праймеры для применения в способах по изобретению являются наиболее предпочтительными, как описано в US 6090552 и ЕР 0912597, описания которых таким образом включены во всей их полноте. Эти праймеры имеются в продаже в виде праймеров Amplifluor. Таким образом, в конкретном предпочтительном воплощении праймер, содержащий структуру "стебель-петля", используемую для амплификации участка интересующего гена и/или эталонного гена, содержит, состоит по существу или состоит из следующих непрерывных последовательностей в направлении 5'-3':(а) первая нуклеотидная последовательность приблизительно из 6-30 нуклеотидов, где нуклеотид в указанной первой нуклеотидной последовательности мечен первой группировкой, выбранной из донорной группировки и акцепторной группировки из молекулярной пары для переноса энергии, где донорная группировка испускает флуоресценцию при одной или более конкретных длинах волн при возбуждении и акцепторная группировка поглощает и/или гасит указанную флуоресценцию, испускаемую указанной донорной группировкой;(б) вторая одноцепочечная нуклеотидная последовательность, содержащая, состоящая по существу или состоящая приблизительно из 3-20 нуклеотидов;(в) третья нуклеотидная последовательность, содержащая, состоящая по существу или состоящая приблизительно из 6-30 нуклеотидов, где нуклеотид в указанной третьей нуклеотидной последовательности мечен второй группировкой, выбранной из указанной донорной группировки и указанной акцепторной группировки, и указанная вторая группировка является членом указанной группы, которая не метит указанную первую нуклеотидную последовательность, где указанная третья нуклеотидная последовательность обратно комплементарна указанной первой нуклеотидной последовательности, так что между указанной первой нуклеотидной последовательностью и указанной третьей нуклеотидной последовательностью может образовываться дуплекс, такой, что указанная первая группировка и вторая группировка находятся в такой близости, что, когда донорная группировка возбуждается и испускает флуоресценцию, акцепторная группировка поглощает и гасит указанную флуоресценцию, испускаемую указанной донорной группировкой; и(г) на 3'-конце праймера, четвертая одноцепочечная нуклеотидная последовательность, содержащая, состоящая по существу или состоящая приблизительно из 8-40 нуклеотидов, которая на своем 3'конце содержит любую последовательность из SEQ ID NO: 2, 4, 5, 7, 8, 11, 13, 14, 16, 17, 19 или 25 (и таким образом, способна начать синтез с помощью полимеразы нуклеиновой кислоты нуклеотидной последовательности, комплементарной цепи нуклеиновой кислоты, содержащей участок метилированной или неметилированной ДНК гена); где в случае, когда указанный дуплекс не образуется, указанная пер- 12017879 вая группировка и указанная вторая группировка разделены расстоянием, которое препятствует переносу молекулярной энергии между указанной первой и второй группировкой. В конкретном предпочтительном воплощении донорная группировка и акцепторная группировка образуют пару для резонансного переноса энергии флуоресценции (FRET). Перенос молекулярной энергии (МЕТ) представляет собой процесс, посредством которого энергия передается нерадиационно между донорной молекулой и акцепторной молекулой. Резонансный перенос энергии флуоресценции (FRET) представляет собой форму MET. FRET возникает из-за свойств некоторых химических соединений; при возбуждении воздействием определенных длин волн света, они излучают свет (то есть они флуоресцируют) при различных длинах волн. Такие соединения называются флуорофорами. При FRET энергия передается нерадиационно на большое расстояние (10-100) между донорной молекулой, которая является флуорофором, и акцепторной молекулой. Донор поглощает фотон и нерадиционно переносит эту энергию на акцептор (Forster, 1949, Z. Naturforsch. А 4: 321-327; Clegg, 1992, Methods Enzymol. 211: 353388). Когда два флуорофора, спектры возбуждения и излучения которых перекрываются, находятся в непосредственной близости, возбуждение одного флуорофора будет заставлять его излучать свет при длинах волн, которые поглощаются вторым флуорофором и которые стимулируют второй флуорофор,заставляя его, в свою очередь, флуоресцировать. Другими словами, энергия возбужденного состояния первого (донорного) флуорофора переносится посредством резонанс-индуцированного дипольдипольного взаимодействия на соседний второй (акцепторный) флуорофор. В результате время жизни донорной молекулы уменьшается и ее флуоресценция гасится, тогда как интенсивность флуоресценции акцепторной молекулы увеличивается и деполяризуется. Когда энергия возбуженного состояния донора переносится на акцептор, который не является флуорофором, флуоресценция донора гасится без последующего излучения акцептором. В этом случае акцептор функционирует как гаситель. И гасители, и акцепторы могут быть использованы в настоящем изобретении. Пары молекул, которые могут быть заняты в резонансном переносе энергии флуоресценции (FRET), называются FRET парами. Для того чтобы произошел перенос энергии, донорная и акцепторная молекулы должны, как правило, находиться в непосредственной близости (от 70 до 100 ) (Clegg, 1992, Methods Enzymol. 211: 353-388; Selvin, 1995, Methods Enzymol. 246: 300-334). Эффективность переноса энергии резко падает с расстоянием между донорными и акцепторными молекулами. Согласно Forster (1949, Z. Naturforsch. A4:321-327), эффективность переноса энергии пропорциональна D10-6, где D представляет собой расстояние между донором и акцептором. Фактическт это означает, что FRET может происходить наиболее эффективно на расстояниях около 70 . Молекулы, которые обычно используют в FRET, рассматриваются в отдельном разделе. Является ли флуорофор донором или акцептором, определяют по его спектрам возбуждения и излучения, а также по флуорофору, с которым он образует пару. Например, FAM наиболее эффективно возбуждается светом с длиной волны 488 нм и излучает свет со спектром от 500 до 650 нм, и максимумом излучения 525 нм. FAM является подходящим донором флуорофором для применения вместе с JOE, TAMRA иROX (которые все имеют свой максимум возбуждения при 514 нм). В одном конкретном предпочтительном воплощении указанная донорная группировка представляет собой флуоресцеин или его производное, и указанная акцепторная группировка представляет собойDABCYL. Предпочтительно, производное флуоресцеина содержит, состоит по существу или состоит из 6-карбоксифлуоресцеина. МЕТ-метки могут быть присоединены к любому подходящему месту в праймерах. В конкретном предпочтительном воплощении донорные и акцепторные группировки располагаются на комплементарных нуклеотидах в пределах структуры "стебель-петля", так что пока "стебель-петля" интактна, группировки находятся в непосредственной физической близости друг к другу. Однако праймеры по изобретению могут быть мечены группировками в любом положении, эффективном для обеспечения MET/FRET между соответствующим донором и акцептором в отсутствие амплификации и разделения донора и акцептора, как только праймер встроится в продукт амплификации. Последовательность структуры "стебель-петля" или шпилечной структуры не зависит от нуклеотидной последовательности гена-мишени (интересующего гена или эталонного гена), поскольку она не связывается с ней. Соответственно, могут быть сконструированы "универсальные" последовательности типа "стебель-петля" или "шпильки", которые затем могут быть объединены с последовательностью конкретного праймера для облегчения определения в режиме реального времени интересующей последовательности. Основное требование к последовательности заключается в том, чтобы последовательность образовывала структуру "стебель-петля"/шпилька"', которая стабильна в отсутствие амплификации (и таким образом обеспечивает эффективное гашение). Таким образом, последовательность-специфический участок праймера связывается с матричной цепью и направляет синтез комплементарной цепи. Поэтому праймер становится частью продукта амплификации в первом раунде амплификации. При синтезе комплементарной цепи амплификация происходит через структуру "стебель-петля"/шпилька". Это разделяет молекулы флуорофора и гасителя, вызывая таким образом генерацию флуоресценции по мере протекания амплификации. Структура "стебель-петля" предпочтительно находится на 5'-конце последовательности - специфического участка праймера, используемого для амплификации.- 13017879 Как упомянуто выше, этот детекторную последовательность обычно метят FRET-парой. Предпочтительно, одна группировка в FRET-паре находится по направлению к 5'-концу последовательности,около него или на 5'-конце последовательности, а другая группировка находится по направлению к 3'концу последовательности, около него или на 3'-конце последовательности, так что, когда структура"стебель-петля" или "шпилька" остается интактной, FRET является эффективным между двумя группировками. Как подробно показано в экспериментальной части, праймеры должны быть тщательно подобраны для того, чтобы обеспечить чувствительность и специфичность способов по изобретению. Соответственно, особенно предпочтительные праймеры для применения в определении статуса метилирования гена включают праймер, содержащий, состоящий по существу или состоящий из нуклеотидной последовательности, определенной как:SEQ ID NO: 1 представляет собой последовательность шпилечной структуры.SEQ ID NO: 2, 5, 8 или 11 представляют собой последовательности прямых праймеров, комплементарные бисульфит-конвертированной неметилированной последовательности промотора Mage.SEQ ID NO: 1 представляет собой последовательность шпилечной структуры.SEQ ID NO: 6, 9 и 12 содержат последовательность шпилечной структуры и последовательностьSEQ ID NO: 4, 7 и 13 представляют собой последовательность обратного праймера, комплементарную бисульфит-конвертированной неметилированной последовательности промотора Mage.SEQ ID NO: 3 содержит последовательность шпилечной структуры и последовательность SEQ IDSEQ ID NO: 14 и 17 представляют собой последовательности прямых праймеров, комплементарные бисульфит-конвертированной метилированной последовательности промотора Mage.SEQ ID NO: 16 и 19 представляют собой последовательность обратного праймера, комплементарную бисульфит-конвертированной метилированной последовательности промотора Mage.SEQ ID NO: 15 и 18 содержит последовательность шпилечной структуры и последовательностьSEQ ID NO: 16 и 19, соответственно. Как подробно показано в экспериментальной части, уровни экспрессии и метилирования MAGE-А 3 показали наилучшее соответствие в анализах, которые включали SEQ ID NO: 2, 5 или 11, все три праймера, содержащие последовательность 5'-TGGAATTTAGGGTAG-3' (SEQ ID NO: 25). Таким образом, в другом воплощении предпочтительный праймер, связывающийся с промоторным участком MAGE-А 3,содержит SEQ ID NO: 25. Часть праймера, комплементарная бисульфит-конвертированной последовательности MAGE-A3, составляет предпочтительно менее 25 п.о.; это предпочтительно 23, 22, 21, 20 или 19 п.о. в длину. Таким образом, MAGE-А 3-специфическая часть такого предпочтительного праймера составляет предпочтительно от 24 до 18 п.о. или от 23 до 19 п.о. в длину. Предпочтительно это 19 п.о. в длину. Таким образом, праймер может содержать любую последовательность из 23, 22, 21, 20 или 19 последовательных оснований из последовательности 5'-ATGTTTGGAATTTAGGGTAGTATTGT-3' (SEQID NO: 26). MAGE-А 3-специфическая часть праймера наиболее предпочтительно состоит из нуклеотидной последовательности, представленной в виде SEQ ID NO: 2, 4, 5 или 7. Праймер, содержащий, состоящий по существу или состоящий из любой нуклеотидной последовательности из SEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9, 11, 12 или 13, особенно полезен для определения гипометилированного (неметилированного) гена MAGE-А 3. Предпочтительные праймеры имеют нуклеотидную последовательность из SEQ ID NO: 2, 3, 4, 5, 6 или 7. Праймер, содержащий, состоящий по существу или состоящий из любой нуклеотидной последовательности из SEQ ID NO: 14, 15, 16, 17, 18 или 19 особенно полезен для определения гиперметилированного (метилированного) гена MAGE-A3. Предпочтительные пары праймеров для применения в способах/наборах и анализах по настоящему изобретению содержат по меньшей мере один праймер, содержащий, состоящий по существу или состоящий из любой нуклеотидной последовательности из SEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 13, 14, 15,16, 17, 18, 19 или 25. Предпочтительные пары праймеров содержат, состоят по существу или состоят из любой нуклеотидной последовательности из SEQ ID NO: 2 и 3; SEQ ID NO: 6 и 7; SEQ ID NO: 9 и 4; SEQID NO: 12 и 13; SEQ ID NO: 14 и 15; или SEQ ID NO: 17 и 18. Наиболее предпочтительная пара праймеров содержит, состоит по существу или состоит из нуклеотидной последовательности SEQ ID NO: 6 и 7. Либо один, либо оба праймера можно метить подходящей структурой "стебель-петля" или "шпилька" или синтезировать так, чтобы включить подходящую структуру "стебель-петля" или "шпилька", несущую донорную и акцепторную группировку, предпочтительно на 5'-конце, как подробно описано выше. В предпочтительном воплощении один или оба праймера метят структурой "стебель-петля" или синтезируют так, чтобы включить, предпочтительно на 5'-конце, структуру "стебель-петля", содержащую,состоящую по существу или состоящую из нуклеотидной последовательности, представленной в виде 5'AGCGATGCGTTCGAGCATCGCU-3' (SEQ ID NO: 1). Эту детекторную последовательность обычно метят FRET-парой. Предпочтительно, одна группировка в FRET-паре находится по направлению к 5'-концу последовательности, около него или на 5'-конце последовательности, а другая группировка находится по направлению к 3'-концу последовательности,около него или на 3'-конце последовательности, так что когда структура "стебель-петля" или "шпилька" остается интактной, FRET является эффективным между двумя группировками. В особенно предпочтительном воплощении структуру "стебель-петля" или "шпилька", особенно нуклеиновую кислоту, содержащую, состоящую по существу или состоящую из последовательности, представленной в виде SEQ IDNO: 1, метят на 5'-конце с помощью FAM и на 3'-конце с помощью DABCYL. Другие предпочтительные комбинации обсуждаются в данной заявке, и это обсуждение касается соответствующих изменений. Эти праймеры образуют отдельные аспекты настоящего изобретения. Дополнительные характеристики этих праймеров приведены в подробном описании (экспериментальная часть) ниже. Следует отметить, что в настоящем изобретении могут быть использованы варианты этих последовательностей. В частности, могут быть добавлены дополнительные фланкирующие последовательности, например, для улучшения специфичности связывания или образования структуры "стебель-петля", при необходимости. Различные последовательности предпочтительно имеют по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей- 15017879 мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности нуклеотидных последовательностей с нуклеотидными последовательностями праймеров и/или зондов, представленных в SEQ ID NO: 1 до 9 и 11 до 19 или 25. Праймеры и шпилечные структуры могут включать синтетические нуклеотидные аналоги, при необходимости, или могут быть основаны, например, на ДНК,РНК или ПНК, или их смесях. Аналогично, могут быть использованы альтернативные флуоресцентные донорные и акцепторные группировки/FRET-пары, при необходимости. В дополнение к мечению флуоресцентными донорными и акцепторными группировками, праймеры могут включать модифицированные олигонуклеотиды и другие дополнительные группы и метки, при условии, что функциональность в качестве праймера и/или структуры "стебель-петля"/шпилька" в способах по изобретению не нарушается. Для каждой пары праймеров по меньшей мере один праймер метят донорной и акцепторной группировкой из молекулярной пары для переноса энергии, организованной таким образом, что в отсутствие амплификации, акцепторная группировка гасит флуоресценцию, испускаемую донорной группировкой(при возбуждении) и во время амплификации, структура "стебель-петля" разрушается, чтобы в достаточной степени разделить донорную и акцепторную группировки для получения детектируемого сигнала флуоресценции, который определяют в режиме реального времени для обеспечения показателя числа копий гена. Предпочтительно указанная донорная группировка и указанная акцепторная группировка представляют собой FRET-пару. В одном воплощении указанная донорная группировка и указанная акцепторная группировка выбраны из 5-карбоксифлуоресцеина или 6-карбоксифлуоресцеина (FAM), 2'7'диметокси-4'5'-дихлор-6- карбоксифлуоресцеина (JOE), родамина, 6-карбоксиродамина (R6G), N,N,N'тетраметил-6-карбоксиродамина (TAMRA), 6-карбокси-Х-родамина (ROX), 5-(2'-аминоэтил)аминонафталин-1-сульфокислоты (EDANS), антраниламида, кумарина, хелатных производных тербия, малахитового зеленого, реактивного красного 4, DABCYL, тетраметилродамина, пиренбутирата, эозиннитротирозина, этидия и техасского красного. В еще одном воплощении указанная донорная группировка выбрана из флуоресценина, 5-карбоксифлуоресценина или 6-карбоксифлуоресценина (FAM), родамина, 5-(2'аминоэтил)аминонафталин-1-сульфокислоты (EDANS), антраниламида, кумарина, хелатных производных тербия, малахитового зеленого и реактивного красного 4, и указанная акцепторная группировка выбрана из DABCYL, родамина, тетраметилродамина, пиренбутирата, эозиннитротирозина, этидия и техасского красного. Предпочтительно, указанная донорная группировка представляет собой флуоресценин или его производное, и указанная акцепторная группировка представляет собой DABCYL, и наиболее предпочтительно, донорная группировка представляет собой 6-карбоксифлуоресценин. Другие предпочтительные комбинации, особенно в контексте мультиплексирования обсуждаются в данной заявке, и эти комбинации также рассматриваются для этих аспектов изобретения. В изобретении также предложены наборы, которые могут быть использованы для осуществления способов по изобретению. Наборы могут включать любые предпочтительные признаки, упомянутые в связи с различными способами (и применениями) по изобретению, описанными в данной заявке. Таким образом, в изобретении предложен набор для определения присутствия и/или количества интересующего метилированного или неметилированного гена в ДНК-содержащем образце, включающий по меньшей мере одну пару праймеров по изобретению. Предпочтительно, набор включает пару праймеров по изобретению для определения присутствия и/или количества неметилированного и/или метилированного гена MAGE-А 3 и пару праймеров для определения присутствия и/или количества эталонного гена, в частности бета-актина. Таким образом, набор может включать пары праймеров, содержащих праймер, содержащий, состоящий по существу или состоящий из нуклеотидной последовательности, представленной в виде SEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 25. Предпочтительно по меньшей мере один праймер в каждой паре праймеров метят соответствующей структурой "стебельпетля" или шпилечной структурой для облегчения определения в режиме реального времени, как описано выше (это обсуждение используется в данной заявке с соответствующими изменениями). Наиболее предпочтительно, по меньшей мере один праймер в каждой паре праймеров структуру включает "стебель-петля" или шпилечную структуру, которая содержит, состоит по существу или состоит из нуклеотидной последовательности, представленной в виде SEQ ID NO: 1. Структуру "стебель-петля" метят соответствующей донорной и акцепторной группировкой, как описано в данной заявке (это обсуждение используется в данной заявке с соответствующими изменениями). Как упомянуто выше, дополнительные характеристики праймеров по изобретению приведены в подробном описании (экспериментальная часть) ниже. В настоящем изобретении могут быть использованы варианты этих последовательностей, как описано в данной заявке. Альтернативные флуоресцентные донорные и акцепторные группировки/FRET-пары могут быть использованы при необходимости,как обсуждается в данной заявке. В одном воплощении набор по изобретению дополнительно включает реагент, который модифицирует неметилированный цитозин, как обсуждается в данной заявке (вместо метилированных остатков цитозина, которые защищены). Такой реагент полезен для различения метилированных и неметилированных остатков цитозина. В предпочтительном воплощении реагент содержит бисульфит, предпочтительно бисульфит натрия. Этот реагент способен превратить неметилированные остатки цитозина в ура- 16017879 цил, в то время как метилированные цитозины остаются неизмененными. Это различие между остатками может быть использовано для различения метилированной и неметилированной нуклеиновой кислоты в последующем процессе, таком как ПЦР с использованием праймеров, которые устанавливают различие между цитозином и урацилом (цитозин спаривается с гуанином, тогда как урацил спаривается с аденином). Как уже упоминалось в связи со способами по изобретению в данной заявке, подходящие контроли могут быть использованы для контроля качества этих способов. Соответственно, в одном воплощении набор по изобретению дополнительно включает, состоит по существу или состоит из одной или более контрольных молекул нуклеиновых кислот, статус метилирования которых известен. Эти (одна или более) контрольные молекулы нуклеиновых кислот могут включать обе нуклеиновые кислоты, которые,как известно, являются или обработаны таким образом, чтобы быть метилированными, и/или молекулы нуклеиновых кислот, которые, как известно, являются или обработаны таким образом, чтобы быть неметилированными. Одним примером подходящего внутреннего эталонного гена, который обычно является неметилированным, но может быть обработан таким образом, чтобы стать метилированным, является бета-актин. Наборы по изобретению могут дополнительно включать подходящие буферы и другие реагенты для проведения заявленных способов по изобретению. Таким образом, обсуждение, предложенное в отношении способов по изобретению, используется с соответствующими изменениями в данной заявке и не повторяется из соображений краткости. В одном воплощении набор по изобретению дополнительно содержит, состоит по существу или состоит из буферов для амплификации нуклеиновых кислот. Набор также может дополнительно включать, состоять по существу или состоять из ферментов, катализирующих амплификацию нуклеиновых кислот. Таким образом, набор также может дополнительно включать, состоять по существу или состоять из подходящей полимеразы для амплификации нуклеиновых кислот. Примеры включают полимеразы из семейств полимераз типа А и типа В, таких как Taq, Pfu,Vent и т.д. Различные компоненты набора могут быть упакованы отдельно в индивидуальных ячейках или могут храниться, например, вместе, при необходимости. Набор также может включать подходящие инструкции по использованию, которые могут быть напечатаны на отдельном листе или, например, включены в упаковку набора. Инструкции могут облегчить применение наборов по изобретению с соответствующим аппаратом амплификации в режиме реального времени, многие из которых имеются в продаже. Последняя стадия способов по изобретению в режиме реального времени включает количественную оценку результатов определения в режиме реального времени относительно калибровочной кривой для интересующего метилированного или неметилированного гена и возможно эталонного гена (если он включен). Калибровочные кривые могут быть получены с использованием набора стандартов. Каждый стандарт содержит известное число копий или концентрацию интересующего гена и/или эталонного гена, при необходимости. Как правило, фоновое значение флуоресценции будет установлено для учета фоновой флуоресценции. Например, в одном воплощении используют программное обеспечение The Sequence Detection System (SDS). Это программное обеспечение устанавливает по умолчанию базовый диапазон циклов от 3 до 15 реакции амплификации до определения продуктов амплификации. Пороговое значение флуоресценции затем определяют по статистически значимой величине выше этой базовой величины. Как правило, порог устанавливают на 10 стандартных отклонений выше базовой флуоресценции. Соответствующее программное обеспечение предложено вместе с апаратом для проведения реакций амплификации в режиме реального времени. Программное обеспечение автоматически вычисляет базовый уровень и пороговые значения для реакции. Пороговое значение цикла (Ct) затем может быть определено для каждого стандарта. Это число циклов, необходимых для достижения порогового уровня амплификации. Таким образом, чем больше исходная концентрация стандартного гена в реакционной смеси, тем меньше требуется циклов для получения определенного выхода амплифицированного продукта. Зависимость Ct относительно log10 известного исходного числа копий набора стандартных молекул ДНК представляет собой прямую линию. Это калибровочная кривая. Таким образом, каждое значение Ct для амплификации интересующего гена и эталонного гена, в случае использования, можно интерполировать относительно соответствующей калибровочной кривой для определения числа копий в ДНК-содержащем образце. Таким образом, результат способа представляет собой число копий гена для каждого интересующего гена и эталонного гена. Данные результаты могут быть нормализованы путем деления числа копий интересующего метилированного или неметилированного гена на число копий эталонного гена. В предпочтительном воплощении для осуществления способов по изобретению используют быструю ПЦРсистему в режиме реального времени Applied Biosystems 7900 НТ. Предпочтительно, используют SDS программное обеспечение, предпочтительно включающее подходящий алгоритм, такой как алгоритмAuto CT для автоматического образования базовых и пороговых значений для индивидуальных детекторов. Хотя способы по изобретению могут быть использованы с любым подходящим способом амплификации, наиболее предпочтительно, когда амплификацию осуществляют с использованием полимеразной- 17017879 цепной реакции (ПЦР). Таким образом, хотя ПЦР является предпочтительным способом амплификации,для включения вариантов основного способа, таких как "гнездовая" ПЦР, в объем изобретения также могут быть включены эквиваленты. Примеры включают, без ограничения, способы изотермической амплификации, такие как NASBA, 3SR, ТМА и триамплификация, которые все хорошо известны в данной области техники, и подходящие реагенты имеются в продаже. Другие подходящие способы амплификации включают, без ограничения, лигазную цепную реакцию (LCR) (Barringer et al., 1990), MLPA, селективную амплификацию целевых полинуклеотидных последовательностей (патент США 6410276), полимеразную цепную реакцию, праймированную консенсусной последовательностью (патент США 4437975), технологию invader (Third Wave Technologies, Madison, W1), технологию со смещением цепи,произвольно праймированную полимеразную цепную реакцию (WO 90/06995) и амплификацию со смещением разрывов (WO 2004/067726). Способы ПЦР в режиме реального времени по изобретению обычно включают стадии снижения температуры для отжига праймера, повышение температуры для удлинения праймера, повышение температуры для денатурации и понижение температуры для сбора данных. В одном конкретном воплощении стадию сбора данных осуществляют при температуре приблизительно от 60 до 64 С, наиболее предпочтительно приблизительно 62 С, поскольку это, как было показано, дает максимально точные и конкретные результаты, как описано в разделе примеров. В конкретном воплощении температурный профиль полимеразной цепной реакции включает от 40 до 50 повторов, предпочтительно приблизительно 45 повторов цикла:(г) приблизительно 62 С в течение приблизительно 1 мин. Предпочтительная схема реакции, которая, как показано, приводит к конкретным и точным результатам в способах по изобретению, представляет собой стадию 1: 50 С в течение 2 мин, стадию 2: 95 С в течение 10 мин, стадию 3: 95 С в течение 15 с, 59 С в течение 30 с, 59 С в течение 30 с (= плато-сбор данных) по 45 повторов. Можно использовать способы по изобретению для определения более чем одного интересующего гена в одной и той же реакции. Посредством применения нескольких конкретных наборов праймеров,амплификацию нескольких целевых нуклеиновых кислот можно осуществлять в одной и той же реакционной смеси. Это может назвать "мультиплексированием". В предпочтительном воплощении один или оба праймера для каждой мишени могут представлять собой шпилечные праймеры, меченые флуоресцентной группировкой и гасящей группировкой, которые образуют FRET-gapy. Амплификация нескольких целевых нуклеиновых кислот требует, чтобы разная флуоресцентная донорная и/или акцепторная группировка, с разной длиной волны излучения, была использована для мечения каждого набора праймеров. Во время определения и анализа после амплификации реакционную смесь облучают и считывают при каждой из конкретных длин волн, характерных для каждого из наборов праймеров, используемых в реакции. Таким образом, можно определить, какие конкретные целевые ДНК в смеси были амплифицированы и мечены. В конкретном воплощении используют две или более пар праймеров для амплификации различных соответствующих целевых последовательностей. Таким образом, присутствие и/или количество панели интересующих метилированных/неметилированных генов может быть определено в одном ДНК-содержащем образце. Мультиплексирование также может быть использовано применительно к определению как интересующего гена, так и эталонного гена в одной и той же реакции. В свою очередь, праймеры, меченые соответствующими различающимися донорными и/или акцепторными группировками, позволяют различить сигнал, образующийся в результате амплификации интересующего гена и эталонного гена, соответственно. В одном воплощении используют универсальный гаситель вместе с подходящими флуорофорными донорами, каждый из которых имеет различимый максимум длины волны излучения. Особенно предпочтительным гасителем является DABCYL. Вместе с DABCYL в качестве гасителя может быть использован каждый из следующих флуорофоров для обеспечения мультиплексирования: Кумарин (максимум излучения 475 нм), EDANS (491 нм), флуоресценин (515 нм), Люцифер желтый (523 нм), BODIPY (525 нм), эозин (543 нм), тетраметилродамин (575 нм) и техасский красный (615 нм) (Tyagi et al., Nature Biotechnology, Vol. 16, Jan 1998; 49-53). Другие предпочтительные комбинации обсуждаются в данной заявке. В альтернативном воплощении ДНК-содержащий образец может быть разделен, и способы по изобретению осуществляются на подходящих частях образца для того, чтобы непосредственно получить сравнимые результаты. Таким образом, когда определяют как интересующий ген, так и эталонный ген,образец может быть разделен на две части, чтобы сделать возможным определение амплификации интересующего гена в режиме реального времени в одном участке образца и определение амплификации эталонного гена в режиме реального времени в другом участке образца. Образец может быть дополнительно разделен для того, чтобы позволить осуществление подходящих контрольных реакций, при необходимо- 18017879 сти. Преимущество этой схемы в том, что универсальная FRET-пара может быть использована для мечения каждой пары праймеров и устраняет необходимость определения излучения в диапазоне длин волн. Однако этот способ исходно не зависит от получения подходящего образца для обеспечения разделения образца. Хотя может быть использован любой подходящий объем реакции, в одном конкретном воплощении общий объем реакции для стадии амплификации составляет приблизительно от 10 до 40 мкл, более предпочтительно приблизительно от 10 до 30 мкл и наиболее предпочтительно около 12 мкл. В одном аспекте олигонуклеотиды, праймеры или зонды, пары праймеров, наборы или способы по настоящему изобретению используют для диагностики рака или предрасположенности к раку, где присутствие неметилированного (или гипометилированного) MAGE-А 3 в образце является признаком рака или предрасположенности к раку. Таким образом, в настоящем изобретении предложены наборы, способы и праймеры для диагностики рака или предрасположенности к раку."Диагноз" определяют в данной заявке как включающий скрининг заболевания или предварительной стадии заболевания, идентификации заболевания или предварительной стадии заболевания, мониторинг стадии заболевания и состояние и развитие заболевания, проверка рецидива заболевания после лечения и мониторинг успеха конкретного лечения. Испытания также могут иметь прогностическое значение, и это включено в определение термина "диагноз". Прогностическое значение испытаний может быть использовано в качестве маркера потенциальной чувствительности к раку или в качестве маркера развития рака. Таким образом, пациенты с риском заболевания могут быть идентифицированы до того, как заболевание имеет шанс проявить себя в симптомах, идентифицируемых у пациента. В предпочтительном воплощении рак выбран из рака легких, меланомы или рака мочевого пузыря. В предпочтительном воплощении в способах и анализах для диагностики используют по меньшей мере один олигонуклеотид,содержащий, состоящий, состоящий по существу или состоящий из любой нуклеотидной последовательности из SEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 25. В предпочтительном воплощении при диагностике рака или предрасположенности к раку используют олигонуклеотиды, содержащие, состоящие, состоящие по существу или состоящие из любой нуклеотидной последовательности из SEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 13 или 25, и определяют неметилированную форму гена. В альтернативном воплощении в способах и анализах для диагностики используют по меньшей мере один олигонуклеотид, содержащий состоящий по существу или состоящий из любой нуклеотидной последовательности из SEQ ID NO: 14, 16, 17 или 19. Тестирование может быть осуществлено диагностически или в сочетании с терапевтической схемой. Как упомянуто выше, были описаны ОТ-ПЦР анализы, которые устанавливают прогностическое значение экспрессии MAGE-А 3 при NSCLC. Эти анализы находят свое применение в отборе пациентов,подходящих для лечения иммунотерапевтическим MAGE-А 3. Авторы изобретения показали, что анализ,предназначенный для определения неметилированного MAGE-А 3 с использованием олигонуклеотидов,праймеров или зондов, пар праймеров или наборов по изобретению, может надежно классифицировать образцы как экспрессирующие MAGE-А 3. Результат статуса метилирования, полученный с помощью теста на метилирование, хорошо согласуется с результатами, полученными с помощью существующего ОТ-ПЦР теста для определения MAGE-А 3, который используется на образцах РНК. Соответственно,тест на метилирование имеет клиническое применение. В дополнительном аспекте в изобретении предложен способ прогнозирования вероятности успешного лечения рака у субъекта, включающий:(а) приведение ДНК-содержащего тестируемого образца, полученного от субъекта, в контакт с реагентом или обработку ДНК-содержащего тестируемого образца, полученного от субъекта, реагентом,который избирательно модифицирует неметилированные остатки цитозина в ДНК, с получением детектируемых модифицированных остатков, но который не модифицирует метилированные остатки цитозина;(б) амплификацию по меньшей мере участка неметилированного гена MAGEA3 с использованием по меньшей мере одной пары праймеров, в которой по меньшей мере один праймер сконструирован таким образом, чтобы связываться только с последовательностью неметилированной ДНК, соответственно,после обработки реагентом, где по меньшей мере один праймер в паре праймеров содержит, состоит по существу или состоит из любой нуклеотидной последовательности из SEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9, 11,12, 13 или 25;(в) определение статуса метилирования гена MAGE-A3; где присутствие неметилированного MAGE-А 3 в образце указывает на то, что вероятность успешного лечения иммунотерапевтическим MAGE-А 3 выше, чем при определении отсутствия или более низких уровней неметилированного гена MAGE-A3. Стадия (в) включает идентификацию образования продукта амплификации. Идентификация продукта амплификации (с использованием любого подходящего способа, описанного в данной заявке) указывает на присутствие неметилированного или гипометилированного MAGEA3 в образце. Конечно, обратная ситуация также применима, и поэтому способы по изобретению также могут быть использованы для того, чтобы определить вероятность устойчивости к лечению или неуспешного лечения при применении иммунотерапевтического агента MAGEA3 - отсутствие неметилированногоMAGE-А 3 в образце указывает на вероятную устойчивость к лечению и/или что лечение, скорее всего,будет неуспешным. Праймеры, специфические к метилированной ДНК, также могут быть использованы в дополнительных способах в некоторых воплощениях. Способы по изобретению также могут быть использованы для выбора подходящего курса лечения для пациента - присутствие неметилированного MAGE-А 3 указывает на то, что введение иммунотерапевтических агентов MAGE-А 3 может быть полезным, тогда как отсутствие или низкий уровень неметилированного MAGE-А 3 указывает на то, что иммунотерапевтические агенты противопоказаны. Обсуждение, предложенное в связи с олигонуклеотидами, праймерами или зондами, парами праймеров, наборами или способами по изобретению, относится к настоящему аспекту с соответствующими изменениями, и поэтому все воплощения рассматриваются соответствующим образом для этого аспекта изобретения. Под "вероятностью успешного лечения" подразумевают возможность того, что лечение рака с использованием одного или более из перечисленных терапевтических агентов, предпочтительно иммунотерапевтическим MAGE-A3 или композицией, содержащей MAGE-А 3, будет успешным."Устойчивость" определяют как уменьшенную возможность того, что лечение рака будет успешным при применении любого из указанных иммунотерапевтических агентов и/или что для достижения терапевтического эффекта потребутся более высокая доза. Гипометилирование MAGE-А 3 может быть связано с определенными типами рака. Соответственно,в конкретном воплощении в изобретении предложен способ определения предрасположенности или частоты возникновения рака мочевого пузыря, рака легких, в том числе NSCLC или меланомы, в образце,включающий определение статуса метилирования гена MAGE-А 3 с использованием олигонуклеотидов,праймеров или зондов, пар праймеров, наборов или способов по изобретению, где определение неметилированного MAGE-А 3 в образце является признаком предрасположенности к раку, или частоты возникновения рака, в частности меланомы; рака легких, включающего немелкоклеточную карциному легкого (NSCLC); или рака мочевого пузыря, включая переходно-клеточную карциному. В другом воплощении опухоль или рак выбраны из рака молочной железы, рака головы и шеи, включающего рак пищевода, плоскоклеточный рак, семиному, рак печени, множественную миелому и рак толстой кишки. В другом аспекте предложен способ определения присутствия MAGE-A3-положительной опухоли,включающий определение статуса метилирования гена MAGE-А 3 в образце с использованием олигонуклеотидов, праймеров или зондов, пар праймеров, наборов или способов, описанных в данной заявке, где присутствие неметилированного MAGE-А 3 является признаком присутствия MAGE-А 3-положительной опухоли. Тестирование может быть осуществлено диагностически или в сочетании с терапевтической схемой. MAGE-А 3-специфические иммунотерапевтические средства (ASCI) были разработаны и в настоящее время оцениваются в клинических испытаниях. Тестирование также может быть использовано для определения того, какая терапевтическая или профилактическая схема может быть применена к пациенту и может использоваться для мониторинга эффективности терапевтической схемы. Соответственно, в изобретении также предложен способ идентификации и/или выбора пациента,подходящего для лечения иммунотерапевтическим MAGE-А 3, включающий определение статуса метилирования гена MAGE-А 3 в образце от пациента с использованием олигонуклеотидов, праймеров или зондов, пар праймеров, наборов или способов, описанных в данной заявке, где в случае, если ген MAGEА 3 является неметилированным, субъекта идентифицируют и/или отбирают для лечения иммунотерапевтическим MAGE-А 3. Альтернативно, если ген не является неметилированным, субъекта предпочтительно не отбирают для лечения иммунотерапевтическим MAGE-A3. В родственном аспекте в изобретении предложен способ прогнозирования вероятности успешного лечения рака, включающий определение статуса метилирования гена MAGE-А 3 в образце от пациента с использованием олигонуклеотидов, праймеров или зондов, пар праймеров, наборов или способов, описанных в данной заявке, где в случае, если ген является неметилированным, вероятность успешного лечения иммунотерапевтическим MAGE-А 3 выше, чем в случае метилированного гена. Альтернативно, отсутствие неметилированного MAGE-А 3 в образце указывает на то, что вероятность устойчивости к лечению иммунотерапевтическим MAGE-А 3 выше, чем в случае неметилированного гена. Таким образом, определение метилированного гена MAGE-А 3 (или отсутствие определения гипометилированного гена) указывает на низкую вероятность успешного лечения иммунотерапевтическим средством. Таким образом, группа пациентов может быть выбрана для лечения на основе их статуса метилирования в отношении гена MAGE-А 3. Это приводит к гораздо более конкретной и индивидуализированной форме терапии и, таким образом, приводит к повышению показателей успеха, так как пациентов будут лечить лекарственными средствами, которые, по всей вероятности, будут наиболее эффективными. В другом родственном аспекте в изобретении предложен способ выбора подходящей схемы лечения рака, включающий определение статуса метилирования гена MAGE-А 3 в образце от пациента с использованием олигонуклеотидов, праймеров или зондов, пар праймеров, наборов или способов, описан- 20017879 ных в данной заявке, где в случае неметилированного гена для лечения выбирают иммунотерапевтическое средство (в частности MAGE иммунотерапевтическое средство). Альтернативно, если ген не является неметилированным, лечение иммунотерапевтическим средством противопоказано. Кроме того, предложен способ лечения рака у субъекта, включающий введение иммунотерапевтического средства, где субъекта выбрали для лечения на основании измерения статуса метилирования гена MAGE-А 3 в соответствии с любым из способов по изобретению или с использованием олигонуклеотида, праймера или зонда, пары праймеров, набора или способа, как описано в данной заявке. Предпочтительно для всех различных аспектов, описанных в данной заявке, определение неметилированного гена MAGE-A3 соответствует повышенному уровню белка MAGE-A3.MAGE-А 3 иммунотерапевтические средства, полезные в настоящем изобретении, включают композиции на основе MAGE-А 3. Примеры композиций, содержащих MAGE-А 3, включают композиции, содержащие полноразмерный MAGE-А 3, по существу полноразмерный MAGE-А 3 и фрагменты MAGE-A3,например, пептиды MAGE-A3. Примеры пептидов, которые могут быть использованы в настоящем изобретении, включают следующие пептиды MAGE-A3: Белок MAGE может представлять собой полноразмерный MAGE-А 3 или может содержать по существу полноразмерный фрагмент из MAGE3, например, аминокислоты 3-314 MAGE3 (всего 312 аминокислот), или другие фрагменты MAGE-А 3, в которых от 1 до 10 аминокислот делетированы из N-конца и/или С-конца белка MAGE-A3. В одном воплощении белок, фрагмент или пептид MAGE-А 3 может быть связан с белкомпартнером для слияния. Белок, фрагмент или пептид MAGE-А 3 и белок-партнер для слияния могут быть химически конъюгированы или могут экспрессироваться в виде рекомбинантного слитого белка. В воплощении, где антиген и партнер экспрессируются в виде рекомбинантного слитого белка, это может привести к повышению продуцируемых уровней в экспрессирующей системе по сравнению с неслитым белком. Таким образом, белок-партнер для слияния может принимать участие в обеспечении Т-хелперных эпитопов (иммунологический белок-партнер для слияния), предпочтительно Т-хелперных эпитопов, распознаваемых человеком, и/или содействовать экспрессии белка (экспрессия энхансерного белка) с более высокими выходами, чем нативного рекомбинантного белка. В одном воплощении белок-партнер для слияния может представлять собой как иммунологический белок-партнер для слияния, так и белок-партнер для усиления экспрессии. В одном воплощении изобретения иммунологический белок-партнер для слияния, который может быть использован, происходит из белка D, поверхностного белка грамотрицательной бактерии Haemophilus influenza В (WO 91/18926) или его производного. Производное белка D может включать первую 1/3 белка или приблизительно первую 1/3 белка. В одном воплощении первые 109 N-концевых остатков белка D могут быть использованы в качестве партнера для слияния для обеспечения антигена MAGE-А 3 дополнительными экзогенными Т-клеточными эпитопами и увеличения уровня экспрессии в Е. coli (таким образом, действуя в качестве усилителя экспрессии). В альтернативном воплощении производное белка D может содержать первые 100-110 N-концевых аминокислот или приблизительно первые 100-110N-концевых аминокислот. В одном воплощении белок D или его производное могут быть липидированы,и липопротеин D может быть использован: липидный хвост может обеспечить оптимальное представление антигена антигенпредставляющим клеткам. В альтернативном воплощении белок D или его производное не липидированы. "Последовательность секреции" или "сигнальная последовательность" белка D относится приблизительно к аминокислотам 1-16, 17, 18 или 19 природного белка. В одном воплощении последовательность секреции или сигнальная последовательность белка D относится к 19 N-концевым аминокислотам белка D. В одном воплощении последовательность секреции или сигнальная последовательность включена в N-конец белка D-партнера для слияния. Как использовано в данной заявке, "первая треть (1/3)", "первые 109 аминокислот" и "первые 100-110 N-концевых аминокислот" относятся к аминокислотам последовательности белка D, следующим сразу за последовательностью секреции или сигналь- 21017879 ной последовательностью. Аминокислоты 2-К и 3-L сигнальной последовательности возможно могут быть заменены аминокислотами 2-М и 3-D. В одном воплощении MAGE-А 3 может представлять собой белок D-MAGE-A3-His, слитый белок из 432 аминокислотных остатков. Этот слитый белок содержит сигнальную последовательность белка D,аминокислоты 1-109 белка D, 312 аминокислот белка MAGE-А 3 (аминокислоты 3-314), спейсер и полигистидиновый хвост (His), который может облегчать очистку слитого белка во время процесса производства, например: 1) Сигнальную последовательность из 18 остатков и первые 109 N-концевых остатков белка D; 2) Два независимых остатка (метионин и аспарагиновая кислота); 3) Остатки 3-314 нативного белка MAGE-3; 4) Два глициновых остатка, функционирующих в качестве шарнирной области; и 5) Семь гистидиновых остатков. Аминокислотная последовательность для этой молекулы показана на фиг. 10 (SEQ ID NO: 40). Этот антиген и антигены, упомянутые ниже, описываются более подробно в WO 99/40188. В другом воплощении иммунологическим белком-партнером для слияния может быть белок, известный как LytA, или белок, полученный из него. LytA происходит из Streptococcus pneumoniae, который синтезирует N-ацетил-L-аланинамидазу, амидазу LytA (кодируемую геном LytA (Gene, 43 (1986)page 265-272, аутолизин, который специфически разрушает определенные связи в пептидогликановом скелете. С-концевой домен белка LytA ответственен за сродство к холину или к некоторым аналогам холина, таким как DEAE. Это свойство было использовано для разработки Е. coli C-LytAэкспрессирующих плазмид, полезных для экспрессии слитых белков. Очистка гибридных белков, содержащих фрагмент C-LytA на его аминоконце, была описана (Biotechnology: 10, (1992) page 795-798). В одном воплощении может быть использован С-концевой участок молекулы. Может быть использован повторяющийся участок молекулы LytA, обнаруженный на С-конце, начиная с остатка 178. В одном воплощении участок LytA может включать остатки 188-305. Другие партнеры для слияния включают неструктурный белок вируса гриппа NS1 (гемагглютинин). В одном воплощении используют 81 N-концевых аминокислот NS1, хотя могут быть использованы и другие фрагменты, при условии, что они включают Т-хелперные эпитопы. В одном воплощении настоящего изобретения белок MAGE-А 3 может содержать дериватизированный свободный тиол. Такие антигены были описаны в WO99/40188. В частности, могут быть использованы карбоксиамидированные или карбоксиметилированные производные. В другом воплощении композиция MAGE-А 3 содержит молекулу нуклеиновой кислоты, кодирующую белок, фрагмент или пептид MAGE-А 3 или слитый белок, как описано в данной заявке. В одном воплощении настоящего изобретения последовательности могут быть встроены в подходящий экспрессирующий вектор и использованы для ДНК/РНК-вакцинации. Микробные векторы, экспрессирующие нуклеиновую кислоту, также могут быть использованы в качестве вектор-доставляемых иммунотерапевтических средств. Примеры подходящих вирусных векторов включают ретровирусные, лентивирусные, аденовирусные, аденоассоциированные вирусные, герпесвирусные, включающие системы на основе вируса простого герпеса, альфа-вирусные, поксвирусные, такие как системы на основе вируса оспы птиц и вируса осповакцины. Способы переноса генов с использованием этих вирусов известны специалистам в данной области техники. Ретровирусные векторы, например, могут быть использованы для стабильной интеграции полинуклеотида по изобретению в геном хозяина, хотя такая рекомбинация не является предпочтительной. Аденовирусные векторы, дефектные по репликации, напротив, остаются эписомными и поэтому допускают временную экспрессию. Векторы, способные запускать экспрессию в клетках насекомых (например, бакуловирусные векторы), в человеческих клетках, дрожжах или в бактериях могут быть использованы для количественного получения белка MAGE-А 3, кодируемого полинуклеотидами по настоящему изобретению, например, для применения в качестве субъединичных вакцин или в иммунноанализах. В предпочтительном воплощении аденовирус, используемый в качестве живого вектора, является аденовирусом обезьяны, дефектным по репликации. Обычно эти вирусы содержат делецию Е 1 и могут выращиваться в клеточных линиях, которые трансформированы геном Е 1. Предпочтительные аденовирусы обезьян представляют собой вирусы, выделенные из шимпанзе. В частности, С 68 (также известный как Pan 9) (см. патент США 6083716) и Pan 5, 6 и Pan 7 (WO 03/046124) являются предпочтительными для применения в настоящем изобретении. Эти векторы могут быть использованы для вставки гетерологичного гена по изобретению, такого гена, продукт которого может экспрессироваться. Применение,приготовление в виде препарата и изготовление таких рекомбинантных аденовирусных векторов подробно изложены в WO 03/046142. Традиционные рекомбинантные методы получения последовательностей нуклеиновых кислот и получение экспрессирующих векторов описаны в Maniatis et al., Molecular Cloning - A Laboratory Manual;Cold Spring Harbor, 1982-1989. Для композиций на основе белка, белки по настоящему изобретению могут быть предложены либо- 22017879 растворимыми в жидкой форме, либо в лиофилизированной форме. Каждая человеческая доза может содержать от 1 до 1000 мкг белка. В одном воплощении доза может содержать от 30 до 300 мкг белка. Композиция, содержащая MAGE-А 3, как описано в данной заявке, дополнительно может содержать вакцинный адъювант и/или иммуностимулирующий цитокин или хемокин. Подходящие вакцинные адъюванты для применения в настоящем изобретении имеются в продаже,такие как, например, неполный адъювант и полный адъювант Фрейнда (Difco Laboratories, Detroit, Ml); адъювант 65 Merck (Merck and Company, Inc., Rahway, NJ); AS-2 (SmithKline Beecharrt, Philadelphia, PA); соли алюминия, такие как гель гидрата окиси алюминия (квасцы) или фосфат алюминия; соли кальция,железа или цинка; нерастворимая суспензия ацилированного тирозина; ацелированные сахара; дериватизированные катионами или анионами полисахариды; полифосфазены; биодеградируемые микросферы; монофосфориллипид А и quil А. В качестве адъювантов также могут быть использованы цитокины, такие как GM-CSF или интерлейкин-2, -7 или -12, и хемокины. В одном воплощении адъювант может содержать комбинацию монофосфориллипида А, такого как З-де-О-ацилированный монофосфориллипид A (3D-MPL) вместе с солью алюминия. Альтернативно,адъювант может содержать 3D-MPL или другие лиганды toll-подобного рецептора 4 (TLR4), такие как аминоалкилглюкозаминида фосфаты, как раскрыто в WO 98/50399, WO 01/34617 и WO 03/065806. Другой адъювант, который может быть использован, представляет собой сапонин, например QS21(Aquila Biopharmaceuticals Inc., Framingham, MA), который может быть использован отдельно или в комбинации с другими адъювантами. Например, в одном воплощении предложена комбинация монофосфориллипида А и производного сапонина, такая как комбинация QS21 и 3D-MPL, как описано в WO 94/00153, или композиция, в которой QS21 гасится холестерином, как описано в WO 96/33739. Другие подходящие препараты содержат эмульсию типа масло-в-воде и токоферол. В одном воплощении адъювант содержит QS21, 3D-MPL и токоферол в эмульсии типа масло-в-воде, как описано в WO 95/17210. Другие адъюванты для применения в настоящем изобретении могут содержать антагонисты TLR9,такие как неметилированные CpG-содержащие олигонуклеотиды, в которых динуклеотид CpG неметилирован. Такие олигонуклеотиды хорошо известны и описаны, например, в WO 96/02555. Подходящие олигонуклеотиды для применения в настоящем изобретении (в этом контексте) могут включать:CpG-содержащие олигонуклеотиды также могут быть использованы отдельно или в комбинации с другими адъювантами. Например, в одном воплощении адъювант содержит комбинацию CpGсодержащего олигонуклеотида и производного сапонина, в частности комбинацию CpG и QS21, как раскрыто в WO 00/09159 и WO 00/62800. Соответственно, предложена композиция, содержащая MAGE-А 3, как описано в данной заявке, где адъювант содержит один или более из 3D-MPL, QS21, CpG-олигонуклеотида, простого или сложного эфира полиэтилена или комбинации двух или более этих адъювантов. Компонент MAGE-А 3 в композиции может быть представлен в носителе-эмульсии типа масло-в-воде или вода-в-масле или в липосомальном препарате в некоторых воплощениях. В одном воплощении адъювант может содержать один или более из 3D-MPL, QS21 и иммуностимулирующего CpG-олигонуклеотида. В воплощении присутствуют все три адъювантных компонента. Компоненты могут быть представлены либо в липосомальном препарате, либо в эмульсии типа масло-вводе, такой, как описано в WO 95/17210. В другом воплощении 3D-MPL и Qs21 представлены в эмульсии типа масло-в-воде, в отсутствиеCpG-олигонуклеотида. Количество используемого 3D-MPL является обычно небольшим, но в зависимости от препарата может варьировать от 1 до 1000 мкг на дозу, предпочтительно от 1 до 500 мкг на дозу и более предпочтительно от 1 до 100 мкг на дозу. Количество CpG или иммуностимулирующих олигонуклеотидов в адъювантах по настоящему изобретению является обычно небольшим, но в зависимости от состава может варьировать от 1 до 1000 мкг на дозу, предпочтительно от 1 до 500 мкг на дозу и более предпочтительно от 1 до 100 мкг на дозу. Количество сапонина для применения в адъювантах по настоящему изобретению может варьировать от 1 до 1000 мкг на дозу, предпочтительно от 1 до 500 мкг на дозу, более предпочтительно от 1 до 250 мкг на дозу и наиболее предпочтительно от 1 до 100 мкг на дозу.- 23017879 Адъювантные препараты, как описано в данной заявке, могут дополнительно содержать эмульсию типа масло-в-воде и/или токоферол или могут быть приготовлены в липосомальной композиции. Другие подходящие адъюванты включают Монтанид ISA 720 (Seppic, France), SAF (Chiron, California, United States), ISCOMS (CSL), MF-59 (Chiron), Ribi Detox, RC-529 (GSK, Hamilton, MT) и другие аминоалкилглюкозаминид-4-фосфаты (AGPs). Как правило, каждая доза для человека может содержать 0,1-1000 мкг антигена, например 0,1-500 мкг, 0,1-100 мкг или 0,1-50 мкг. Оптимальное количество конкретного иммунотерапевтического средства может быть получено посредством стандартных исследований, включающих наблюдение за соответствующими иммунными ответами у вакцинированных субъектов. После первичной вакцинации субъекты могут получать одну или несколько бустерных иммунизаций с адекватным интервалом. Альтернативно, композиция для применения в способе по настоящему изобретению может содержать фармацевтическую композицию, содержащую MAGE-А 3, как описано в данной заявке, в фармацевтически приемлемом эксципиенте. Изобретение теперь будет описано со ссылкой на следующие неограничивающие примеры: Краткое описание графических материалов Фиг. 1 - локализация праймеров MAGEA3U на неконвертированной последовательности (Фиг. 1 а SEQ ID NO: 10) и соответствующей конвертированной последовательности (Фиг. 1b - SEQ ID NO: 41). Положение праймера MAGEA3GO1 U заключено в рамку, положение праймера MAGEA3GO2 U выделено, положение праймера MAGEA3FURUTA U выделено жирным шрифтом, положение праймераMAGEA3QIU U подчеркнуто, положение G, обозначенное соответствует сайту начала транскрипции. Фиг. 2 - локализация праймеров MAGEA3GO2U на неконвертированной последовательности(Фиг. 2 а - SEQ ID NO: 10) и соответствующей конвертированной последовательности (Фиг. 2b - SEQ IDNO: 41), сайт начала транскрипции подчеркнут. Фиг. 3 - предела графика определения. Фиг. 3 а - MAGEA3GO2U: вводимая U ДНК (клетки LNCaP) наносится на график относительно значений Ct, 1,5 нг вводимой U ДНК все еще определяются. Фиг. 3D - MAGEA3FurutaU: вводимая U ДНК (клетки Gerl) наносится на график относительно значений Ct, 1,5 нг вводимой U ДНК все еще определяются. Фиг. 4 - схематическое представление способа Amplifluor. По меньшей мере один праймер (прямой праймер в этом случае) в паре праймеров содержит "шпилечную" структуру, несущую донорную(FAM) и акцепторную группировка (DABCYL) из молекулярной пары для переноса энергии. В отсутствие амплификации флуоресценция, испускаемая донорной группировкой, эффективно поглощается акцепторной группировкой, что приводит к гашению флуоресценции. Во время амплификации праймер встраивается в продукт амплификации. Во время второго раунда амплификации структура "стебельпетля" или шпилечная структура разрушается. Акцепторная группировка больше не способна эффективно гасить флуоресценцию, испускаемую донорной группировкой. Таким образом, донорная группировка производит детектируемый флуоресцентный сигнал. Фиг. 5 - древо решений для классификации образца (метилированный, неметилированный или недостоверный); Фиг. 6 - статус метилирования MAGE-А 3 в образцах меланомы. Кривые функциональных характеристик приемника (Receiver Operating Characteristics) (ROC) рассчитывали для 4 анализов неметилированных MAGE-А 3 путем построения графика истинно-положительного уровня (чувствительность) в зависимости от ложно-положительного уровня (100-специфичность). Фиг. 6 а - GO1U анализ: чувствительность 91,7%, специфичность 76,5%, порог отсечения 214,8,площадь под кривой (AUC) равна 0,912. При 95% ДИ (доверительный интервал) диапазон составлял от 0,781 до 0,977 при уровне значимости Р = 0,0001 для площади=5. Фиг. 6b - GO2U анализ: чувствительность 87,5%, специфичность 100%, порог отсечения 292,6,площадь под кривой (AUC) равна 0,971. При 95% ДИ диапазон составлял от 0,863 до 0,996 при уровне значимости Р = 0,0001 для площади=5. Фиг. 6 с - FurutaU анализ: чувствительность 66,7%, специфичность 100%, порог отсечения 943,1,площадь под кривой (AUC) равна 0,939. При 95% ДИ диапазон составлял от 0,817 до 0,989 при уровне значимости Р = 0,0001 для площади=5. Фиг. 6d - QiuU анализ: чувствительность 83,3%, специфичность 94,1%, порог отсечения 431,1,площадь под кривой (AUC) равна 0,944. При 95% ДИ диапазон 0,824 до 0,990 при уровне значимости Р = 0,0001 для площади=5. Фиг. 6 е - сводная таблица результатов, полученных для каждого из четырех анализов. Фиг. 7 - статус метилирования MAGE-А 3 в биопсиях легкого. Кривые функциональных характеристик приемника (ROC) рассчитывали для 4 анализов неметилированных MAGE-А 3 путем построения графика истинно-положительного уровня (чувствительность) в зависимости от ложно-положительного уровня (100-специфичность).- 24017879 Фиг. 7 а - GO1U анализ: чувствительность 84,6%, специфичность 91,7%, порог отсечения 115,8,площадь под кривой (AUC) равна 0,954. При 95% ДИ диапазон составлял от 0,868 до 0,990 при уровне значимости Р = 0,0001 для площади=5. Фиг. 7b - GO2U анализ: чувствительность 88,5%, специфичность 94,4%, порог отсечения 108,28,площадь под кривой (AUC) равна 0,971. При 95% ДИ диапазон составлял от 0,893 до 0,996 при уровне значимости Р = 0,0001 для площади=5. Фиг. 7 с - FurutaU анализ: чувствительность 84,6%, специфичность 91,7%, порог отсечения 296,8,площадь под кривой (AUC) равна 0,949. При 95% ДИ диапазон составлял от 0,861 до 0,988 при уровне значимости Р = 0,0001 для площади=5. Фиг. 7d - Qiu U анализ: чувствительность 84,6%, специфичность 91,7%, порог отсечения 176,71,площадь под кривой (AUC) равна 0,948. При 95% ДИ диапазон составлял от 0,859 до 0,988 при уровне значимости Р = 0,0001 для площади=5. Фиг. 7 е - сводная таблица результатов, полученных для каждого из четырех анализов на биопсиях легкого. Фиг. 8 - статус метилирования MAGE-А 3 в FFPE образцах легких. Кривые функциональных характеристик приемника (ROC) рассчитывали для 4 анализов неметилированных MAGE-А 3 путем построения графика истинно-положительного уровня (чувствительность) в зависимости от ложно-положительного уровня (100-специфичность). Фиг. 8 а - GO1U анализ: чувствительность 84,0%, специфичность 96,0%, порог отсечения 21,88,площадь под кривой (AUC) равна 0,933. При 95% ДИ диапазон составлял от 0,825 до 0,984 при уровне значимости Р = 0,0001 для площади=5. Фиг. 8b - GO2U анализ: чувствительность 84,0%, специфичность 96,3%, порог отсечения 17,75,площадь под кривой (AUC) равна 0,932. При 95% ДИ диапазон составлял от 0,826 до 0,983 при уровне значимости Р = 0,0001 для площади=5. Фиг. 8 с - FurutaU анализ: чувствительность 80,0%, специфичность 96,2%, порог отсечения 214,26,площадь под кривой (AUC) равна 0,923. При 95% ДИ диапазон составлял от 0,813 до 0,979 при уровне значимости Р = 0,0001 для площади=5. Фиг. 8d - QiuU анализ: чувствительность 72,0%, специфичность 96,2%, порог отсечения 68,91,площадь под кривой (AUC) равна 0,912. При 95% ДИ диапазон составлял от 0,799 до 0,973 при уровне значимости Р = 0,0001 для площади=5. Фиг. 8 е - сводная таблица результатов, полученных для каждого из четырех анализов на FFPE образцах легкого. Фиг. 9 - эффект меланина на ингибирование ПЦР при мечении на различных стадиях реакционного процесса. Фиг. 9 а - материал клеточной линии LNCaP с и без меченого меланина, прошедший через MSPMAGE-А 3 U в режиме реального времени. ВТ = обработка бисульфитом. Фиг. 9b - материал клеточной линии MCF7 с и без меченого меланина, прошедший через MSP GstPi M в режиме реального времени. Фиг. 10 - белок D-MAGE-A3-His. Подчеркнуто одной линией = первые 109 аминокислот Белка D. Подчеркнуто двойной линией = сигнальная последовательность Белка D (18 а.к.). Заключено в рамку] = встроенные/замещенные последовательности: Met-Asp в положении 2-3 (замещенные); Met-Asp в положении 128-129 (встроенные) и Gly-Gly в положении 442-443 (встроенные). Жирный шрифт = фрагмент MAGE3: аминокислоты 3-314 MAGE3 (всего 312 а.к.). Серый = 7 хвостовых гистидинов. Подробное описание - экспериментальный раздел Пример 1. Анализ Amplifluor в режиме реального времени. Прямой, специфический в отношении метилирования ПЦР-анализ на основе флуоресценции в режиме реального времени (MSP-анализ в режиме реального времени) разработали для определения статуса метилирования промотора MGMT (Vlassenbroeck et al., J Mol Diagn 2008, 10:332-337). Эта технология проиллюстрирована и вкратце охарактеризована в пояснении к фиг. 4. Количественный анализ аналита для MAGE-А 3 успешно осуществляли с использованием этой технологии. Он состоял из параллельных процессов амплификации/количественного определения с использованием специфического праймера и пары праймер/детектор для MAGE-А 3 с помощью аналитического формата Amplifluor на приборе ABI Prism 7900HT (Applied Biosystems). Конечные концентрации праймеров в реакционной смеси составляли 100 нМ как для прямого праймера/детектора, так и для обратного праймера. 12,5 мкл iTaqTM Supermix вместе с Rox (BioRad,2 хбуфер) использовали для ПЦР реакции. Общий объем реакции, включая 5 мкл модифицированной матричной ДНК, составлял 25 мкл. Прибор ABI 7900HT SDS включали за 10 мин до использования, позволяя нагревательной крышке достичь 105 С. Использовали следующий температурный профиль: стадия 1: 50 С в течение 2 мин, стадия 2: 95 С в течение 10 мин, стадия 3: 95 С в течение 15 с, 62 С в течение 1 мин (=плато-сбор данных) по 45 повторов.- 25017879 Плазмидный материал, используемый в качестве калибровочной кривой, получали следующим образом: промоторную последовательность, как определено праймерами, амплифицируют с помощью ПЦР и клонируют (используя подходящую выделенную и бисульфит-модифицированную ДНК клеточной линии). Последовательность проверяли путем секвенирования и сравнения с опубликованной промоторной последовательностью. Калибровочную кривую (2106 - 20 копий) включали для определения числа копий неизвестных образцов путем интерполяции их значений Ct к калибровочной кривой. В качестве эталонного гена в анализе использовали -актин. Пример 2. Анализы MAGE-А 3 и конструирование праймеров. Праймеры, используемые для определения неметилированного MAGE-АЗ, как описано в Qiu et al.:Cancer Sci 95 (2004), 962-968, синтезировали и представили в табл. 1 в дополнение к новым последовательностям праймеров. Конструирование in silico прямых (F) и обратных (R) праймеров для определения неметилированной или, альтернативно, метилированной формы Mage A3 осуществляли с использованием программного обеспечения Primer3, адаптированного к требованиям MSP (http://fokker.wi.mit.edu/primer3/input.htm). Условия были следующими: размер ампликона: 60-120 н.; размер праймера: 18-27 н.; температура плавления: 55-65 С; максимальная 3' самокомплементарность = 0; Окно 200 п.о. около TSS (точка инициации транскрипции) (число для возврата = 2000).Uпраймеры конструировали для определения неметилированного MAGE-А 3, тогда как Мпраймеры конструировали для определения метилированного MAGE-А 3. В конце концов, праймерыMAGEA3GO1UF,MAGEA3GO2UR,MAGEA3GO1URAMP,MAGEA3GO2UFAMP, MAGEA3GO1MF, MAGEA3GO2MF, MAGEA3GO1MRAMP и MAGEA3GO2MRAMP сохраняли для дальнейшего исследования. Локализация U-праймеров относительно точки инициации транскрипции (TSS) показана на фиг. 1 и фиг. 2. Праймеры расположены около точки инициации транскрипции. Либо прямой, либо обратный праймер синтезировали для включения подходящей структуры "стебель-петля" или "шпилька", несущей донорную и акцепторную группировку на 5'-конце, имеющей нуклеотидную последовательность: 5'-AGCGATGCGTTCGAGCATCGCU-3' (SEQ ID NO: 1.) Тестировали различные комбинации MAGEA3 праймеров. В конце сохраняли 4 U-анализа и 2 Манализа для дальнейшей разработки. Выбранные комбинации праймеров для каждого анализа приведены в табл. 1. Таблица 1. Праймерные и amplifluor детекторные последовательности MAGEA3- 26017879 Расчетную эффективность (предел и специфичность определения) анализа демонстрировали с использованием реконструированных субстратов. Предел определения Для определения чувствительности MSP для неметилированного паттерна, материал из положительной подтвержденной клеточной линии (LNCaP и Gerl) последовательно разбавляли и смешивали с ДНК контрольной (отрицательной) клеточной линии (DU145). Делали разведения 1/10; 1/100 и 1/500 (см. табл. 2). Общее количество 750 нг ДНК (U ДНК + М ДНК), обрабатывали бисульфитом с использованием набора для метилирования ДНК EZ от Zymo Research. Таблица 2. Схема разведения клеточных смесей Затем 2,4 мкл химически обработанной ДНК использовали в качестве матрицы для MSP MAGEA3 в режиме реального времени с использованием специфических праймеров для неметилированногоGerl/DU145). Результаты представлены на фиг. 3. Как можно видеть, нижний предел определения MAGEA3 GO2U и MAGEA3Furuta MSP в режиме реального времени часто устанавливали на 1,5 нг (разведение 1/500), учитывая всю процедуру приготовления образца. Поскольку 10% образца используют для ПЦР реакции, конечная аналитическая чувствительность составляет 0,15 нг. Аналитическая специфичность Специфичность набора праймеров MAGEA3 GO1U/GO2U/FurutaU и QIUU подтверждали посредством MSP с использованием универсальной Метилированной/Неметилированной ДНК CpGenomeTM (Chemicon International, СА, USA; Кат. S7821 и Кат. S7822) и последующего анализа на агарозном геле. Кратко, MSP amplifluor в режиме реального времени осуществляли на циклере I (Bio-Rad),используя следующий температурный профиль: стадия 1: 50 С в течение 2 мин, стадия 2: 95 С в течение 10 мин, стадия 3: 95 С в течение 15 с, 62 С в течение 1 мин (= плато-сбор данных) по 45 повторов. Поскольку высокая специфичность имеет важное значение для определения на основе Amplifluor, для стадии 3 использовали температурный градиент для того, чтобы выбрать наилучшую температуру отжига(57 С, 58,1 С, 60,3 С и 61,8 С). Все полученные ПЦР-продукты проверяли на 3%-ном агарозном геле. Никакой полосы не обнаружили, когда универсальную метилированную ДНК CpGenomeTM использовали в качестве матричной ДНК (тестировали при 57 С), что подтверждает специфичность для неметилированной ДНК. Кроме того, специфичность MAGEA3 анализов исследовали среди других членов генов семейства Клонирование регуляторных последовательностей MAGE-А 3 и оценка калибровочной кривой Регуляторную последовательность MAGE-А 3 U ДНК из 364 п.о. клонировали с использованием фланкирующих праймеров, как показано в табл. 4. Таблица 4. Фланкирующие праймеры, используемые для получения MAGEA3 плазмидного материала Этот клонированный материал использовали в качестве материала для построения калибровочной кривой для MSP в режиме реального времени. Воспроизводимость сначала подтверждали применением 2 пластин 6 калибровочных кривых (2106-2101 копий) (2 разных оператора, 3 ПЦР смеси/оператор/ пластина). Наклон, эффективность ПЦР и значения R2 контролировали и получили приемлемые результаты. Расчетная калибровочная кривая Последовательное разведение плазмидного материала MAGEA3 (2106-2101 копий/5 мкл) наносили в двух повторностях с использованием специфического праймера и Amplifluor детекторной последовательности, указанной в Таблице 1, с соответствующим оптимизированным температурным профилем: стадия 1: 50 С в течение 2 мин, стадия 2: 95 С в течение 10 мин, стадия 3: 95 С в течение 15 с, 59 С в течение 30 с, 59 С в течение 30 с (= плато-сбор данных) по 45 повторов. Результаты получали с использованием программного обеспечения SDS 2.2 (Applied Biosystems) и представляли в виде значений Ct(число циклов, при которых кривые амплификации пересекают пороговое значение, установленное автоматически программным обеспечением). Параметры калибровочной кривой представлены в табл. 5. Таблица 5. Обобщение результатов о наклоне кривых и эффективностей ПЦР MAGEA3 Пример 4. Эффективность анализа на материале из клеточной линии. Статус метилирования MAGEA3 исследовали на 19 клеточных линий. Наиболее метилированные и неметилированные клеточные линии для MAGEA3 U и М анализа, соответственно, показаны ниже. Таблица 6. Клеточные линии, прошедшие через MAGEA3 U анализы Пример 5. Внутрилабораторная погрешность. Внутрилабораторная погрешность тестировали путем многократного осуществления одного и того же анализа для неметилированного и метилированного варианта промоторной последовательностиMAGEA3. Различные числа полностью модифицированных промоторных ДНК молекул MAGEA3 U иMAGEA3 М (материал для калибровочной кривой) измеряли многократно. Кроме того, операторный множитель тестировали путем повторного осуществления анализа в 2 разных дня 2 разными квалифицированными лаборантами (операторы А и В) (3 различных разведения для калибровочной кривой в двух повторностях применяли на оператора в день). Таблицы 8 и 9 обощают эксперименты, проведенные для тестирования внутрилабораторной погрешности GO1 и GO2 U и М MAGEA3 анализа. Было показано,что стандартные отклонения всех результатов, относящиеся к одинаковым количествам молекул, варьируют от 0,11 до 1,29. Обобщенная информация обо всех коэффициентах корреляции (разные операторы и дни) представлена в табл. 9, среднее R2 варьирует от 0,9959 до 0,9997). Таблица 8. Анализы, проведенные для тестирования внутрилабораторной погрешности (оператор А и В в 2 разных дня): колонка 1: число молекул (log), следующие колонки: среднее значений Ct и стандартное отклонение для каждого MAGEA3 анализа Таблица 9. Коэффициенты корреляции, найденные для каждой проанализированной серии разведений Пример 6. Интерференция меланина. Ранее была показана низкая эффективность ПЦР образцов, содержащих меланин. Eckhart и др.(2000) обнаружили, что как РНК-, так и кДНК-препараты, полученные из меланоцитов, содержат ингибитор ОТ-ПЦР, который очищается вместе с нуклеиновыми кислотами. Исследование предполагаемого ингибитора меланина обнаружило, что он обратимо связывается с термостабильной ДНК-полимеразой и ингибирует ее активность. Перед обработкой образцов меланомы посредством MAGEA3 U amplifluor анализов, исследовали потенциал ингибирования меланином. Синтетический меланин готовили, как описано у Eckhart и др. Вкратце, меланин (SIGMA M8631) растворяли в дистиллированной воде в концентрации 2 мг/мл, интенсивно перемешивали и подвергали ультразвуковой обработке в водяной бане при комнатной температуре в течение 10 мин. Нерастворенный меланин удаляли посредством центрифугирования при 9000 g. Потенциал эффекта ингибирования
МПК / Метки
МПК: C12Q 1/68
Метки: улучшенное, mage-a, экспрессии, определение
Код ссылки
<a href="https://eas.patents.su/30-17879-uluchshennoe-opredelenie-ekspressii-mage-a.html" rel="bookmark" title="База патентов Евразийского Союза">Улучшенное определение экспрессии mage-a</a>
Предыдущий патент: Макролидные соединения, обладающие противовоспалительной активностью
Следующий патент: Сухая декоративно-отделочная смесь
Случайный патент: Способ лечения гиперсекреции слизи