Улучшенное биологическое окисление сульфидных руд и концентратов
Формула / Реферат
1. Бактериальная культура для применения в бактериальном окислении сульфидных руд и концентратов, причем бактериальная культура адаптирована из культуры, депонированной в AGAL под No. NM99/07541, и дополнительно содержит один или несколько штаммов Sulfobacillus и Thermoplasma.
2. Способ бактериального окисления сульфидных руд и концентратов, отличающийся тем, что руду или концентрат выщелачивают с помощью бактериальной культуры, адаптированной из культуры, депонированной в AGAL под No. NM99/07541, причем бактериальная культура дополнительно содержит один или несколько штаммов Sulfobacillus и Thermoplasma.
3. Способ по п.2, отличающийся тем, что сульфидная руда или концентрат содержит халькопирит.
4. Способ по п.2 или 3, отличающийся тем, что выщелачивание проводят в форме, выбранной из группы, которая содержит кучное выщелачивание, бассейновое выщелачивание, чановое выщелачивание и отвальное выщелачивание.
5. Способ по одному из пп.2-4, отличающийся тем, что бактериальная культура не является аборигенной для руды или концентрата, которые подвергают окислению.
6. Способ по одному из пп.2-5, отличающийся тем, что руду или концентрат подают с размером измельчения или дробления, равным или большим чем P80 75 мкм.
7. Способ по одному из пп.2-5, отличающийся тем, что руду или концентрат подают с размером измельчения или дробления, равным или большим чем Р80 90 мкм.
8. Бактериальная культура по одному из предыдущих пунктов, отличающаяся тем, что культура пригодна для окисления сульфидных руд и концентратов в температурном диапазоне от 45 до 90шС.
9. Бактериальная культура по одному из пп.1-7, отличающаяся тем, что культура пригодна для окисления сульфидных руд и концентратов в температурном диапазоне от 45 до 65шС.
Текст
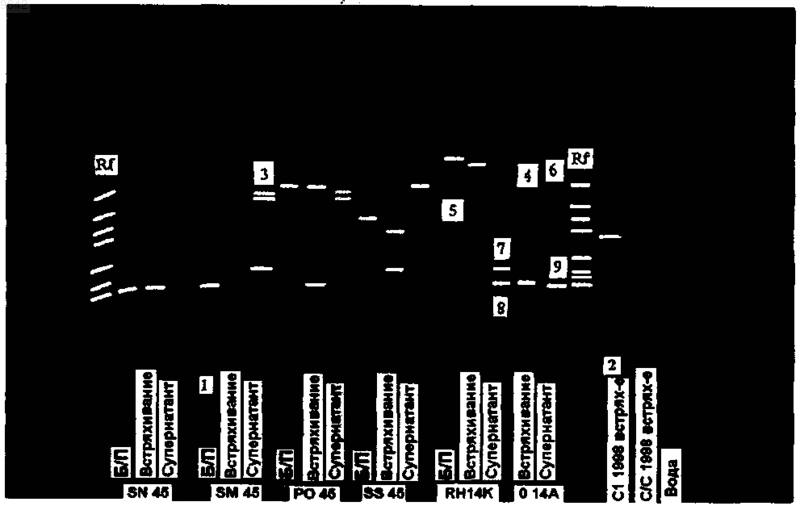
009642 Область изобретения Данное изобретение касается улучшенного бактериального окисления сульфидных руд и концентратов с использованием бактериальной культуры. Процесс бактериального окисления по данному изобретению особенно широко применяется в бактериальном окислении руд и концентратов, содержащих халькопирит. Известный уровень техники Бактериальное окисление успешно использовалось на протяжении ряда лет в обработке арсенопирита, пирита, пирротина, ковеллиновой и халькоцитовой руд и концентратов. Исключением являлось окисление халькопиритовых (CuFeS2) руд и концентратов. В предшествующем уровне техники в смесях бактерий, применяемых для облегчения окисления сульфидных руд и концентратов, кроме халькопиритовых руд и концентратов, использовали различные группы бактерий. Например, смешанная бактериальная культура, применяемая Gencor Limited из Южной Африки, включает преимущественно Thiobacillus ferrooxidans, Thiobacillus thiooxidans и Leptospirillumferrooxidans. Культуры Gencor состоят из смешанной популяции мезофильных бактерий, которые активны в температурном диапазоне от 35 до 45 С (DewMiller, 1997). Кроме того, в заявке на патент Финляндии 953488 Gencor Limited раскрывает применение Thiobacillus ferrooxidans, Thiobacillus thiooxidans и Leptospirillum ferrooxidans для окисления преимущественно при pH 3 при дроблении руды преимущественно до менее 6 мм. Бактериальная культура, используемая BacTech (Австралия) Pty Ltd., см., например, патент США 5429659, представляет собой умеренно термофильную бактериальную культуру, активную в температурном диапазоне от 46 до 50 С. Культура была обозначена Barrett и др. как "М 4" (1988) и описана Nobar и др. (1988) (Brierley, Brans, 1994). В методе бактериального окисления (MINBAC), разработанном англо-американской корпорациейMintek, расположенной в Рандбурге, Южная Африка, используется мезофильная смешанная бактериальная культура, включающая Thiobaciilus ferrooxidans/Leptospirillum ferrooxidans (Brierley, Brans, 1994). Бактериальные культуры, применяемые в настоящее время, не способны давать коммерчески приемлемые результаты для халькопирита либо без ультра тонкого измельчения (Р 80 20 мкм) руды или концентрата для облегчения бактериального окисления, либо без применения очень длинных периодов выщелачивания для осуществления окисления. Обычно эти периоды превышают 100 дней. Современные тенденции направлены на использование более высоких температур для облегчения окисления железа. Однако применение высоких температур приводит к необходимости охлаждения после окисления и разработки реакторов из специальных материалов, например из сорта хирургической нержавеющей стали. Оба условия увеличивают стоимость такой операции. Кучное выщелачивание является, безусловно, наиболее часто используемым бактериальным способом для восстановления меди из более легкоокисляемых вторичных медных минералов, таких как ковеллин и халькоцит. Способ включает укладывание раздробленной руды на специально подготовленную непроницаемую поверхность. Поверхность разработана таким образом, что обогащенный раствор, стекающий из кучи, собирается в точке, из которой он отводится в отстойник. Металлы восстанавливаются из обогащенного раствора путем осаждения, экстракции растворителя и/или электроэкстракции. Для успешного кучного выщелачивания очень важно поддерживать целостность кучи. Главным фактором, определяющим стабильность куч, является размер дробления руды. Дробление руды необходимо производить до такой степени, когда руда становится достаточно мелкой, чтобы позволить достаточное просачивание выщелачивателя сквозь кучу без чрезмерного канализирования, а также поддерживая объем пор, необходимый для достаточной дисперсии воздуха и оттока выщелачивателя. Если руда раздроблена слишком мелко, просачивание сквозь кучу может быть очень медленным. Будет наблюдаться недостаточный объем пор, и в куче будет происходить недостаточный отток, что приведет к накоплению влаги в куче и к повышению гидростатического давления грунтовых вод. С другой стороны, если размер частиц руды слишком большой, отток в куче будет быстрым, а уровень содержания металлов в растворе станет низким, кроме того, структура кучи может нарушиться, поскольку руда разрушается изза биологических и химических процессов. Во многих случаях раздробленную руду агломерируют со связующими веществами, серной кислотой и водой до укладывания, в результате наблюдается более однородный размер частиц и распределение кислоты по всей куче. До укладывания кучи обычно на поверхности размещают дренажный слой, который обычно состоит из нереакционноспособной породы, такой как кварцит, и обеспечивает достаточный отток обогащенного раствора. Кучи орошаются подкисленным бактериальным раствором, который действует как выщелачиватель для выщелачивания меди из руды. Бактерии, применяемые в кучном выщелачивании, обычно являются аэробными и поэтому нуждаются в кислороде. Его можно нагнетать в кучу путем воздуходувок с низким давлением, или воздух можно прокачать в кучу вытяжным эффектом, который наблюдается,поскольку при окислении бактериями руды повышается температура. Американская компания Geobiotics предложила способ Geocoat (см. WO 96/38381), который является вариантом кучного выщелачивания. Способ включает образование концентрата из сульфидной руды,добавление его в раздробленную кусковую породу и формирование кучи, которая может подвергаться-1 009642 бактериальному окислению. Важно, что изобретение этого способа, по-видимому, обеспечивает достаточный поток воздуха, жидкости и рассеивание тепла в куче. Отвальное выщелачивание очень похоже на кучное вищелачивание и обычно применяется для руд с низким содержанием металла. Часто отвальное выщелачивание будет рассматриваться как способ, сопутствующий кучному выщелачиванию, а не применяться отдельно. По существу, если пустую или низкосортную породу добывать и складывать с небольшой предварительной подготовкой грунта, то из материала можно извлечь определенную пользу. В куче будут присутствовать аборигенные бактерии, и все,что требуется для обеспечения их активности. Это достигается добавлением кислоты и питательных веществ в орошающий раствор, так же как при кучном выщелачивании. Разница заключается в стоимости. До укладывания выполняют или не выполняют небольшое дробление. Осуществляют только необходимый минимум подготовки поверхности без какой-либо принудительной аэрации. Полагают, что чановое выщелачивание по стоимости, сложности и продуктивности может находиться между кучным выщелачиванием и бассейновым выщелачиванием. При этом способе обогащаемый материал полностью погружают в щелочной раствор, но не перемешивают, по меньшей мере, значительно, хотя происходит некоторое перемешивание из-за потока воздуха и/или раствора. Этот способ имеет преимущество над кучным или отвальным выщелачиванием, которое заключается в достижении полного смачивания поверхностей минерала и позволяет избежать канализирования. Раздробленные частицы меньших размеров также удобнее обрабатывать в чане, хотя существует предел степени помола,продиктованный проницаемостью воздуха и раствора. При превышении этого предела возникает необходимость суспендировать материал в растворе. Если используются одноразовые чаны, их можно разработать с разделяющими перегородками, наклонными к одному углу для обеспечения циркуляции и восстановления щелочного раствора. Многократно используемые чаны должны иметь более прочную конструкцию, такую как бетонную или кирпичную. Аэрация должна осуществляться через погруженную трубу или иным способом с помощью периодического опорожнения чана и обеспечения проникновения воздуха в руду с помощью оттекающей жидкости. Бассейновое выщелачивание, как следует из названия, представляет бактериальное выщелачивание аэрированных минеральных взвесей в бассейнах с перемешиванием. Предусмотрено, что технология очень похожа на биовыщелачивание основных металлов, но до настоящего времени для меди система не получила коммерческого развития. Полученные результаты указывают на то, что затраты, связанные с ультратонким измельчением концентрата (P80 30 мкм), как ожидается, сделают капитальные и эксплуатационные расходы слишком высокими. Представленный способ преодолевает вышеупомянутые проблемы известного уровня техники, или,по меньшей мере, обеспечивают полезную альтернативу ему. Предшествующее обсуждение известного уровня техники предназначено только для облегчения понимания данного изобретения. Необходимо расценивать, что обсуждение не является подтверждением или признанием того, что какой-либо материал, на который делается ссылка, был частью общедоступных сведений до даты приоритета данной заявки. Во всем описании, если в контексте не указано обратное, выражение "включают" или варианты, такие как "включает" или "включающий", будет подразумевать включение установленного единого целого или группы единых целых, а не исключение какого-либо другого единого целого или группы единых целых. Следует понимать, что во всем описании ссылка на виды бактерий включает также их подвиды. Во всем описании под рудой понимают материал, который выделили из грунта и не подвергли какой-либо обработке для увеличения концентрации металла. Концентрат получают, подвергая руду способу обработки, обычно гравитационному или флотации, чтобы увеличить концентрацию необходимых металлов и уменьшить объем материала, который впоследствии обрабатывают для восстановления необходимых металлов. Описание изобретения Данное изобретение предусматривает бактериальную культуру для использования в бактериальном окислении сульфидных руд и концентратов, бактериальная культура адаптирована из Австралийской правительственной аналитической лаборатории (AGAL), где она депонирована под номеромNM99/07541 и, кроме того, содержит один или несколько штаммов Sulfobacillus и Thermoplasma. Данное изобретение, кроме того, предусматривает способ бактериального окисления сульфидных руд и концентратов, отличающийся тем, что руда или концентрат выщелачивается с помощью бактериальной культуры, адаптированной из AGAL, где она депонирована под номером NM99/07541, причем бактериальная культура содержит по меньшей мере один или несколько штаммов Sulfobacillus и Thermoplasma. В одной форме данного изобретения сульфидная руда или концентрат содержит халькопирит. Выщелачивание, используемое в способе по данному изобретению, можно выполнить в форме, выбранной из группы, состоящей из кучного выщелачивания,-2 009642 бассейнового выщелачивания,чанового выщелачивания и отвального выщелачивания. Бактериальная культура предпочтительно не является аборигенной для руды или концентрата, которые будут окислены. Бактериальная культура и способ по данному изобретению эффективны при окислении сульфидных руд или концентратов, если обеспечена степень помола или дробления руды или концентрата, равная или превышающая P80 90 мкм. Предпочтительно обеспечена степень помола или дробления руды или концентрата, равная или превышающая Р 80 75 мкм. В одной из форм данного изобретения культура окисляет сульфидные руды и концентраты при температурном диапазоне от 45 до 90 С. Предпочтительно культура окисляет сульфидные руды и концентраты при температурном диапазоне от 45 до 65 С. Краткое описание графических материалов Данное изобретение будет описано с помощью примера со ссылкой на сопровождающую фигуру,причем она представляет собой фотографию результатов в денатурирующем градиентном геле шести образцов бактериальной культуры по данному изобретению, обработанных тремя различными методами. Описание Чтобы создать культуру, способную обрабатывать халькопиритовые руды и концентраты, искали бактериальную культуру, аборигенную для халькопиритового минерала. Аборигенные бактериальные культуры обычно превосходят модифицированные выделенные культуры, поскольку аборигенная культура уже адаптирована к токсинам и минеральным компонентам, связанным с определенной рудой, что дает более эффективные и жизнеспособные штаммы бактерий. Бактериальные культуры, аборигенные для халькопиритовых руд, культивировали и анализировали по их способности окислять нативную для них руду/концентрат и другие халькопиритовые руды и концентраты. Во время этой программы исходную бактериальную культуру выделили из халькопиритового(CuFeS2) концентрата, полученного из руды основных металлов, обнаруженной в Нью-Брунсвике, Канада. После выделения бактериальной культуры культуру анализировали на нативной для нее руде и концентрате и на различных других рудах и концентратах. Во время анализа к первоначальной исходной культуре добавляли культуры из различных материалов, причем любые нативные бактерии, способные работать при параметрах анализа и способные работать конкурентно с введенной культурой, не только выжили, но и разрослись в окружающей среде. Таким образом, со временем любую бактерию, нативную для анализируемой руды или концентрата, включали в культуру. Кроме того, исходная культура успешно росла при различных температурах от 40 до 90 С и при различных уровнях кислотности с pH в диапазоне от 0,8 до 2,2. Полагают, что пределы pH от 0,5 до 3,0 являются приемлемыми. Исходную культуру успешно анализировали и в аэрируемых бассейновых реакторах с перемешиванием, и в аэрируемых колонках для облегчения колоночного выщелачивания. Успешно анализировали исходную культуру при различных температурах и на различных рудах и концентратах. Бактериальная культура по данному изобретению состоит из различных бактерий, окисляющих железо, сульфиды и серу, способных работать при температурах от 35 до 90 С и в диапазонах pH от 0,5 до 3,0, хотя наиболее предпочтительно от 0,8 до 2,5. Как полагают, смешанная бактериальная культура включает один или несколько представителей родов Sulfobacillus и Thermoplasma, потенциально вместе с рядом дополнительных видов бактерий. Так она может включать, не ограничиваясь, Sulfobacillus thermosulfidooxidans, Thiobacillus caldus и/или Thiobacillus ferrooxidans. Смешанная бактериальная культура по данному изобретению была депонирована согласно Будапештскому Соглашению в Австралийской Правительственной Аналитической Лаборатории под номеромNM99/07541. В общих чертах, в способе бактериального окисления сульфидных руд и концентратов по данному изобретению исходную бактериальную культуру, описанную выше, для адаптации соединяли с образцом руды или концентрата, которые подвергали выщелачиванию. Исходная культура не является аборигенной для руды или концентрата, к которым она адаптируется. Адаптированную культуру можно затем в свою очередь использовать для инокуляции кучи руды или концентрата, к которому она адаптирована. Альтернативно, можно использовать другие варианты выщелачивания как механизма, в котором адаптируемая культура подвергается воздействию руды или концентрата, включая чаны, бассейны и отвалы. Данное изобретение будет описано с помощью ссылки на ряд примеров без ограничения общей части изобретения, изложенной выше. Пример 1. До анализа какого-либо материала исходную бактериальную культуру, упомянутую выше, сначала адаптировали к интересующему материалу. Это осуществляли, помещая 2700 мл модифицированного 0 К раствора (1,0 г/л сульфата аммония, 0,5 г/л дикалия ортофосфата, 0,16 г/л гептогидрата сульфата магния,pH 1,6-1,8) в аэрируемый смесевой бассейновый реактор с перемешиванием, нагретый до необходимой температуры. К модифицированной 0 К среде добавили 150 г образца измельченного (P80 45 мкм) анали-3 009642 зируемого материала, а pH снижали до 1,6-1,8, при необходимости, с помощью концентрированной серной кислоты. В полученную взвесь ввели 300 мл взвеси образца исходного инокулюма. Перемешиваемый реактор аэрировали со скоростью 1 л/мин/л взвеси. В соответствии с расчетом, исходный инокулюм не является аборигенным для руды исследуемого материала. Адаптацию продолжали, пока уровень релевантных металлов, перешедших в раствор, не достигнет 100% или не достигнет плато. Образцы растворов оценили по уровням металлов в растворе с помощью индуктивно связанной плазмы (ICP), где соответствующий pH взвеси отрегулировали концентрированной серной кислотой так, чтобы pH составлял 1,6-1,8. В дополнение к уровням металлов, перешедших в раствор, развитие адаптации/анализа далее исследовали по их окислительно-восстановительному потенциалу (ORP), концентрации железа и концентрации растворенного кислорода (DO). Как только культура адаптировалась к интересующему материалу, ее использовали как инокулюм для последующих анализов в аэрированном смесевом бассейновом реакторе с перемешиванием или как инокулюм для анализа в куче или колонке. Адаптированный бактериальный инокулюм затем растворили добавлением кислотного основного питательного раствора, содержащего сульфат аммония, ортофосфат калия и сульфат магния. Концентрация этих питательных веществ в растворе может отличаться в лабораторных анализах и коммерческих процессах и может различаться между различными коммерческими процессами. Во всех случаях развитие окисления исследовали по уровням металлов, перешедших в раствор, pH, ORP, концентрации железа и содержанию растворенного кислорода. Бактериальную культуру по данному изобретению анализировали на ряде образцов, содержащих халькопирит, собранных в различных областях земного шара. Табл. 1 ниже иллюстрирует минералогию и происхождение халькопиритовых концентратов и руд, анализируемых с применением бактериальной культуры по данному изобретению. Таблица 1 Общая методика анализа Все анализы на образцах минералов проводили в аэрированных бассейновых реакторах с перемешиванием. В каждом анализе плотность твердых частиц составляла 10% вес/об., в реакторе производили аэрацию барботированием со скоростью 1 л воздуха в минуту на литр взвеси. Потери выпаривания из-за нагревания и аэрации взвеси восполнили до забора образцов анализов с помощью добавления водопроводной воды. Все взвеси были выполнены в запатентованной питательной среде с начальным pH 1,0. Забор образцов включил пробы раствора на содержание ионов железа, меди и других релевантных металлов. Кроме того, исследовали и зафиксировали окислительно-восстановительный потенциал (ORP),pH, уровни содержания двухвалентного железа и растворенного кислорода. Высвобождение меди использовали для исследования хода анализа, и как только он достигал устойчивого плато или достигал приблизительно 100% меди, перешедшей в раствор, анализ считали выполненным. После этого взвесь-4 009642 отфильтровали, окончательный выщелачивающий раствор проанализировали, а отфильтрованный осадок промыли подкисленной водой и высушили. Высушенный отфильтрованный осадок взвесили, а остаток анализировали для осуществления металлургического баланса. Результаты основного анализа, анализа размера частиц и результаты после окисления подытожены и приведены в табл. 2. Таблица 2 номинальная классификация по крупности "непосредственного" концентрата. Ряд образцов адаптированной бактериальной культуры по данному изобретению обычно выращивали при температурах от 35 до 65 С, хотя была отмечена активность при температуре около 90 С. Из каждой культуры выделили образцы и подготовили для определения с помощью 16S рРНК секвенирования. Перед РНК секвенированием образцы готовили тремя различными способами. Используемые способы и результаты, полученные с помощью 16S рРНК секвенирования, следующие. Способы. Анализировали шесть образцов (обозначенные SN45, SM45, Р 045, SS 45, RH 14K и 014 А). Образцы смешивали в ручном шейкере при максимальной скорости в течение 30 мин и обрабатывали следующим образом.A. Встряхивание. 500 мкл встряхиваемого образца немедленно осадили на стекловолоконных фильтрах (30 Sliecher и Schuell, Кин, Нью-Гампшир) в 1,5 мл микропробирке центрифугированием при 14000 об./мин в течение 4 мин. Супернатант осторожно слили, а осажденный материал дважды промыли в 1 мл воды для культуры тканей.B. Быстрое приготовление. Сразу же отобрали 500 мкл и гомогенизировали с помощью аппарата быстрого приготовления Savant BIO 101 (BioCan Scientific) со скоростью 4 за 20 с. Гомогенаты осадили и промыли, как описано выше.C. Супернатант. После перемешивания образцы выдержали в течение 5 мин, чтобы позволить твердым частицам осесть на дно пробирок. Затем 500 мкл супернатанта осадили и промыли, как описано выше. Изо всех образцов экстрагировали РНК с использованием InstaGene Matrix (BioRad, Геркулес, Калифорния) согласно инструкциям производителя. Концентрацию РНК определили ультрафиолетовой спектрофометрией (А 260), добавили 50 нг в смесь для реакции ПЦР (полимеразная цепная реакция) с окончательной концентрацией 2 мМ иона магния, 100 uM дезоксинуклеозидтрифосфата, 0,32 мкм каждого праймера и 0,625 единиц Taq Gold полимеразы. Для амплификации фрагмента длиной приблизительно 300 пар оснований 16S рибосомальной РНК гена использовали универсальные праймеры p515f и p806r(Relman, 1993). Передний праймер модифицировали GC-богатой последовательностью длиной 40 пар оснований, которая ограничивала миграцию амплифицированного продукта при различных концентрациях мочевины/формамида в денатурирующем градиентном геле (Sheffield и др., 1989; Muyzer и др.,1993). Интересующие полосы вырезали из денатурирующих гелей, а очищенный амплифицированный продукт подвергли циклическому секвенированию с помощью удлинения на Big Dye Terminator от обратного праймера при рекомендованных условиях (РЕ Applied Biosystems). Определение последователь-5 009642 ностей выполняли на генетическом анализаторе 310 (РЕ Applied Biosystems). Сравнения последовательностей проводили с помощью программы Basic Local Alignment Search Tool (метод поиска локальных совпадений) (BLAST; Altschul и др., 1990). Результаты. Каждый из трех образцов обработали методами, приводящими к различному профилю одного и того же образца, как показано на фиг. 1. Для секвенирования отобрали девять преобладающих полос. Секвенированные фрагменты длиной 300 пар оснований имели наибольшее совпадение с фрагментарными последовательностями 16S рРНК гена видов бактерий, перечисленных в колонке "Результат BLAST". Больший фрагмент 16S необходимо было секвенировать для более точного определения. Краткое описание результатов BLAST исследования для секвенированных фрагментов 16S рРНК гена длиной 300 пар оснований приведено в табл. 3. Числа в круглых скобках означают % гомологии между исследуемыми образцами и их наибольшие совпадения. Таблица 3 Предусмотрено, что виды бактерий можно упустить или заменить смешанной культурой, обозначенной выше, чтобы облегчить ее активность при различных температурах. Например, Thiobacillus thiooxidans, окисляющую серу бактерию, при более низких температурах можно заменить Thiobacillus caldus. Полагали, что по меньшей мере некоторые из начальных результатов при определении параметров бактериальной культуры по данному изобретению могут быть аномальными. Дальнейшую работу по определению параметров бактериальной культуры по данному изобретению выполняли, как изложено в примере 2. Со временем точность такой работы по определению параметров повышается благодаря усовершенствованию исследовательских устройств и обновления баз данных. Пример 2. Способы. Фрагменты 16S рДНК образца бактериальной культуры по данному изобретению подвергли электрофорезу в денатурирующем градиентном геле ("DGGE"). Этот метод, впервые описанный Muyzer и др.(1993), особенно подходит для профилирования комплексных микробиальных популяций. Шесть аликвот по 10 мл бактериальной культуры центрифугировали при 13000 об./мин в течение 15 мин. Общий образец ДНК экстрагировали из осадков с помощью модифицированной версии, ранее описанного способа (Plumb и др., 2001). Образцы осадков пересуспендировали в фосфатном буферном соляном растворе pH 7,2 для запускания клеточного лизиса. Дальнейший лизис клеток получили, обрабатывая образцы литическими ферментами, лизосомой и протеиназой K, а также концентрированным детергентом додецилсульфатом натрия (SDS). Затем образцы дважды экстрагировали фенолхлороформизоамиловым спиртом, ДНК осадили из раствора изопропанолом и ацетатом натрия. Экстрагированную ДНК затем очистили с помощью набора для очистки UltraClean (МО BIO Laboratories Inc.). Образцы ДНК визуализировали окрашиванием бромидом этидия после электрофореза в 1% мас./об. агарозном геле. В каждом образце ДНК с помощью полимеразной цепной реакции (ПЦР) амплифицировали полно-6 009642 размерные 16S рРНК гены. Наряду с HotStarTaq полимеразой (Qiagen) использовали специфические для бактерий и археобактерий ПЦР праймеры, как описано ранее (Plumb и др., 2002). Продукты ПЦР очистили с помощью набора для очистки для ПЦР UltraClean, а затем использовали как шаблон для DGGE ПЦР реакций. DGGE ПЦР выполняли с помощью ранее описанных наборов праймеров (Muyzer и др.,1993; Ovres и др., 1997). ДНК трех упомянутых штаммов, Leptospirillum ferroxidans, Sulfobacillus thermosulfidooxidans и Sulfolobus sp. Для обеспечения сравнения в DGGE анализе также использовали штаммJP2 для образования ПЦР фрагментов. DGGE выполнили с помощью универсальной системы, определяющей мутации, DCode (BioRad Laboratories, США) и 6% вес/об. полиакриламидные гели с денатурирующим градиентом от 30 до 70% (где 100% денатуранта содержит 7 М мочевины и 40% об./об. формамида). Электрофорез проводили в течение 16 ч при 100 V и 60 С. Гели окрасили в 1TAE буфере, содержащем 0,5 мг L-1 бромида этидия, и подтвердили с помощью светового трансиллюминатора Multilmage TM-26 (Alpha Innotech Corporation, США) и программного обеспечения Chemilmage V5.5. Выбранные полосы вырезали из гелей и перамплифицировали с помощью ПЦР с праймерами DGGE. Затем очищенные ПЦР продукты секвенировали с помощью автоматического циклического секвенирования,как описано ранее (Plumb и др., 2002). Данные последовательностей проанализировали с помощью BasicLocal Alignment Search Tool (BLAST, Altschul и др., 1990) для сравнения последовательностей с данными последовательностей в базе данных последовательностей неопределимых нуклеиновых кислот, доступной на http://www.ncbi.nlm.nih.gov/BLAST/. Результаты. Исследование образца с помощью фазово-контрастного микроскопа показала низкие количества небольших палочковидных клеток. ДНК успешно экстрагировали из каждого из шести образцов по 10 мл. Во время этапа очистки ДНК шесть образцов объединили, получив три очищенных образца ДНК. Из очищенной геномной ДНК амплифицировали полноразмерную 16S рДНК с помощью праймеров, специфических для бактерий и специфических для археобактерий. Результаты показали, что присутствуют бактерии и археобактерии. Эти ПЦР продукты очистили и применили как шаблоны для ПЦР амплификации фрагментов ДНК в DGGE анализе. С помощью специфических для бактерий и специфических для археобактерий ПЦР праймеров в DGGE анализе успешно амплифицировали фрагменты ДНК. Затем ПЦР фрагменты подвергли анализу с использованием DGGE для разделения фрагментов ДНК по их электрофоретической подвижности в гелевой матрице, содержащей повышенные концентрации денатурантов. Как и ожидалось, образцы ПЦР указанных штаммов дали исчерченные профили. Анализ фрагментов образцов инокулюма, образованных с помощью праймеров, специфических для бактерий, дает две едва заметные, но различимые полосы. Фрагмент образца, полученный с помощью праймеров, специфических для археобактерий, образует в геле только одну различимую полосу. Остальная часть профиля дает неразличимые расплывчатые области. ПЦР продукты из интересующих полос секвенировали и анализировали с помощью BLAST для определения идентичности последовательностей ДНК. Результаты BLAST анализа данных последовательностей приведены в табл. 4. Полоса А содержала ДНК, высоко подобную (99%) ДНК штаммов рода Sulfobacillus. Полосы В и С содержали ДНК, высоко подобную (98-99%) ДНК неизвестных штаммов Thermoplasma. Род Thermoplasma включает организмы, принадлежащие к археобактериям, которые характеризуются плеоморфной клеточной морфологией, обусловленной отсутствием клеточной стенки, и их способностью к росту в диапазоне температур от мезофильных до термофильных. Представители рода являются ацидофилами, способными гетеротрофически расти в аэробных и анаэробных условиях. Таблица 4BLAST анализ данных последовательностей полосы ДНК, вырезанной из DGGE профилей образца Не предполагали, что бактериальная культура, способная окислять сульфидную руду и концентраты при условиях, описанных выше, будет представлена родами Sulfobacillus и Thermoplasma с потенциалом для добавления одного или больше видов бактерий, определенных в примере 1. Предусмотрено, что материалы смешанной бактериальной культуры по данному изобретению можно использовать для обработки, включающей руды и концентраты основных металлов (медь, никель,кобальт, цинк и т.д.), руды и концентраты драгоценных металлов (золото и серебро) и руды и концентраты металлов платиновой группы (PGM). Также предусмотрено, что культуру можно использовать для окисления в кучном выщелачивании, бассейновом выщелачивании, чановом выщелачивании или от-7 009642 вальном выщелачивании. Бактериальная культура и способ по данному изобретению способны работать при широком диапазоне температур, что, таким образом, ведет к сокращению затрат, связанных с охлаждением систем бактериального окисления. Кроме того, способ предусматривает окисление всех форм халькопирита при определенных размерах дробленых частиц, что не требует существенных капитальных и эксплуатационных расходов. Полагают, что модификации и изменения, которые будут очевидными специалисту в данной области, попадают в объем данного изобретения. Ссылкиsingle base changes. Proc. Natl. Acad. Sci USA 86: 232-236. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Бактериальная культура для применения в бактериальном окислении сульфидных руд и концентратов, причем бактериальная культура адаптирована из культуры, депонированной в AGAL под No.NM99/07541, и дополнительно содержит один или несколько штаммов Sulfobacillus и Thermoplasma. 2. Способ бактериального окисления сульфидных руд и концентратов, отличающийся тем, что руду или концентрат выщелачивают с помощью бактериальной культуры, адаптированной из культуры, депонированной в AGAL под No. NM99/07541, причем бактериальная культура дополнительно содержит один или несколько штаммов Sulfobacillus и Thermoplasma. 3. Способ по п.2, отличающийся тем, что сульфидная руда или концентрат содержит халькопирит. 4. Способ по п.2 или 3, отличающийся тем, что выщелачивание проводят в форме, выбранной из группы, которая содержит кучное выщелачивание, бассейновое выщелачивание, чановое выщелачивание и отвальное выщелачивание. 5. Способ по одному из пп.2-4, отличающийся тем, что бактериальная культура не является аборигенной для руды или концентрата, которые подвергают окислению. 6. Способ по одному из пп.2-5, отличающийся тем, что руду или концентрат подают с размером измельчения или дробления, равным или большим чем P80 75 мкм. 7. Способ по одному из пп.2-5, отличающийся тем, что руду или концентрат подают с размером измельчения или дробления, равным или большим чем Р 80 90 мкм. 8. Бактериальная культура по одному из предыдущих пунктов, отличающаяся тем, что культура пригодна для окисления сульфидных руд и концентратов в температурном диапазоне от 45 до 90 С. 9. Бактериальная культура по одному из пп.1-7, отличающаяся тем, что культура пригодна для-8 009642 окисления сульфидных руд и концентратов в температурном диапазоне от 45 до 65 С.
МПК / Метки
Метки: биологическое, сульфидных, улучшенное, окисление, руд, концентратов
Код ссылки
<a href="https://eas.patents.su/10-9642-uluchshennoe-biologicheskoe-okislenie-sulfidnyh-rud-i-koncentratov.html" rel="bookmark" title="База патентов Евразийского Союза">Улучшенное биологическое окисление сульфидных руд и концентратов</a>
Предыдущий патент: Способ и устройство для определения целостности системы для нефтепромысловой машины
Следующий патент: Лечение состояний, включающих амилоидные бляшки
Случайный патент: Упаковка для жидкого продукта












