Белки слияния на основе rage, их композиции и способы их применения
Номер патента: 17291
Опубликовано: 30.11.2012
Авторы: Бенджамин Эрик Дж., Мджалли Аднан М.М., Ротлейн Роберт, Тянь Йе Эдвард, Вебстер Джеффри К.
Формула / Реферат
1. Композиция, включающая лиофилизированную смесь лиопротектора, белка слияния на основе RAGE и буфера, где белок слияния на основе RAGE включает полипептид RAGE, непосредственно присоединенный к полипептиду, включающему домен CH2 иммуноглобулина или функциональную часть домена CH2 иммуноглобулина, где полипептид RAGE включает сайт связывания лиганда RAGE, где лиопротектор включает невосстанавливающий сахар и где количество буфера является достаточным для обеспечения восстановленной композиции, имеющей рН в диапазоне от 6,0 до 6,7, когда концентрация белка слияния на основе RAGE в восстановленной композиции составляет от 1 до 400 мг/мл.
2. Композиция по п.1, отличающаяся тем, что белок слияния на основе RAGE включает междоменный линкер, полученный из RAGE, а не междоменный шарнирный полипептид, полученный из иммуноглобулина.
3. Композиция по п.1, отличающаяся тем, что белок слияния на основе RAGE включает (i) междоменный линкер RAGE, который разделяет V- и С1-домены RAGE; или (ii) линкер, который разделяет С1- и С2-домены RAGE, вместо шарнирной области тяжелой цепи иммуноглобулина.
4. Композиция по п.1, отличающаяся тем, что белок слияния на основе RAGE кодируется молекулой ДНК, включающей последовательность, представленную в SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 54 или SEQ ID NO: 55.
5. Композиция по п.1, отличающаяся тем, что композиция дополнительно включает по меньшей мере один из следующих компонентов: поверхностно-активное вещество, хелатирующий агент или наполнитель.
6. Композиция по п.1, отличающаяся тем, что невосстанавливающий сахар включает по меньшей мере один из следующих компонентов: сахарозу, маннит или трегалозу.
7. Композиция по п.1, отличающаяся тем, что буфер включает гистидин.
8. Композиция по п.1, отличающаяся тем, что полипептид RAGE включает сайт связывания лиганда RAGE, который включает аминокислотную последовательность, представленную в SEQ ID NO: 10, или последовательность, которая по меньшей мере на 90% ей идентична, или аминокислотную последовательность, представленную в SEQ ID NO: 47, или последовательность, которая по меньшей мере на 90% ей идентична.
9. Композиция по п.1, отличающаяся тем, что белок слияния на основе RAGE включает по меньшей мере одну из указанных аминокислотных последовательностей: SEQ ID NO: 32, 33, 34, 35, 36, 37, 56 или 57 или последовательность, которая по меньшей мере на 90% им идентична.
10. Композиция по п.9, отличающаяся тем, что последовательность, которая по меньшей мере на 90% идентична каждой из SEQ ID NO: 32, 33, 34, 35, 36, 37, 56 или 57, представляет собой аминокислотную последовательность, представленную в SEQ ID NO: 32, 33, 34, 35, 36, 37, 56 или 57 соответственно, без С-концевого лизина.
11. Восстановленная композиция, включающая лиофилизированный белок слияния на основе RAGE, восстановленный в разбавителе, где концентрация белка слияния на основе RAGE в восстановленной композиции составляет от 1 до 400 мг/мл, где восстановленная композиция включает лиопротектор, белок слияния на основе RAGE и буфер, и где белок слияния на основе RAGE включает полипептид RAGE, непосредственно присоединенный к полипептиду, включающему домен CH2 иммуноглобулина или функциональную часть домена CH2 иммуноглобулина, где полипептид RAGE включает сайт связывания лиганда RAGE, и где лиопротектор включает невосстанавливающий сахар, и где рН находится в диапазоне от 6,0 до 6,7.
12. Восстановленная композиция по п.11, отличающаяся тем, что концентрация белка слияния на основе RAGE в восстановленной композиции составляет от 40 до 100 мг/мл.
13. Восстановленная композиция по п.11, отличающаяся тем, что белок слияния на основе RAGE включает междоменный линкер, полученный из RAGE, а не междоменный шарнирный полипептид, полученный из иммуноглобулина.
14. Восстановленная композиция по п.11, отличающаяся тем, что белок слияния на основе RAGE включает (i) междоменный линкер RAGE, который разделяет V- и С1-домены RAGE; или (ii) линкер, который разделяет С1- и С2-домены RAGE, вместо шарнирной области тяжелой цепи иммуноглобулина.
15. Восстановленная композиция по п.11, отличающаяся тем, что белок слияния на основе RAGE кодируется молекулой ДНК, включающей последовательность, представленную в SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 54 или SEQ ID NO: 55.
16. Восстановленная композиция по п.11, отличающаяся тем, что полипептид RAGE включает сайт связывания лиганда RAGE, который включает аминокислотную последовательность, представленную в SEQ ID NO: 10, или последовательность, которая по меньшей мере на 90% ей идентична, или аминокислотную последовательность, представленную в SEQ ID NO: 47, или последовательность, которая по меньшей мере на 90% ей идентична.
17. Восстановленная композиция по п.11, отличающаяся тем, что белок слияния на основе RAGE включает по меньшей мере одну из указанных аминокислотных последовательностей: SEQ ID NO: 32, 33, 34, 35, 36, 37, 56 или 57 или последовательность, которая по меньшей мере на 90% им идентична.
18. Восстановленная композиция по п.17, отличающаяся тем, что последовательность, которая по меньшей мере на 90% идентична каждой из SEQ ID NO: 32, 33, 34, 35, 36, 37, 56 или 57, представляет собой аминокислотную последовательность, представленную в SEQ ID NO: 32, 33, 34, 35, 36, 37, 56 или 57 соответственно, без С-концевого лизина.
19. Восстановленная композиция по п.11, отличающаяся тем, что композиция включает 1-400 мг/мл белка слияния на основе RAGE, включающего последовательность, представленную в SEQ ID NO: 32, 33, 34, 35, 36, 37, 56 или 57, или последовательность, которая по меньшей мере на 90% ей идентична; от 1 до 100 мМ гистидинового буфера; от 60 до 65 мМ сахарозы; от 0,001 до 0,05% Твина 80; и характеризуется значением рН от 6,0 до 6,5.
20. Восстановленная композиция по п.11, отличающаяся тем, что композиция демонстрирует уровень разложения менее чем 5% после хранения в течение 1 недели при температуре 40°C.
21. Восстановленная композиция по п.11, отличающаяся тем, что менее чем 10% белка слияния на основе RAGE присутствует в виде агрегата в композиции при ее восстановлении.
22. Восстановленная композиция по п.11, отличающаяся тем, что невосстанавливающий сахар включает по меньшей мере один из следующих компонентов: сахарозу, маннит или трегалозу.
23. Восстановленная композиция по п.11, отличающаяся тем, что лиофилизированная композиция белка слияния на основе RAGE дополнительно включает по меньшей мере один из следующих компонентов: поверхностно-активное вещество, хелатирующий агент или наполнитель.
24. Восстановленная композиция по п.11, отличающаяся тем, что восстановленная композиция пригодна для подкожного или внутримышечного введения.
25. Набор, включающий контейнер, который содержит композицию по любому из пп.1-10, и инструкции по восстановлению композиции разбавителем, так чтобы концентрация белка слияния на основе RAGE в восстановленной композиции составляла от 1 до 400 мг/мл и рН составляло от 6,0 до 6,7.
26. Набор по п.25, отличающийся тем, что концентрация белка слияния на основе RAGE в восстановленной композиции составляет от 40 до 100 мг/мл.
27. Набор по п.25, дополнительно включающий второй контейнер, который содержит разбавитель для восстановления лиофилизированной композиции.
28. Способ получения стабильной восстановленной композиции белка слияния на основе RAGE, включающий восстановление лиофилизированной смеси белка слияния на основе RAGE, лиопротектора и буфера в разбавителе, так чтобы концентрация белка слияния на основе RAGE в восстановленной композиции составляла от 1 до 400 мг/мл и рН составляло от 6,0 до 6,7, где белок слияния на основе RAGE включает полипептид RAGE, непосредственно присоединенный к полипептиду, включающему домен CH2 иммуноглобулина или функциональную часть домена CH2 иммуноглобулина, где полипептид RAGE включает сайт связывания лиганда RAGE и где лиопротектор включает невосстанавливающий сахар.
29. Способ по п.28, отличающийся тем, что белок слияния на основе RAGE включает междоменный линкер, полученный из RAGE, a не междоменный шарнирный полипептид, полученный из иммуноглобулина.
30. Способ по п.28, отличающийся тем, что белок слияния на основе RAGE включает (i) междоменный линкер RAGE, который разделяет V- и С1-домены RAGE; или (ii) линкер, который разделяет С1- и С2-домены RAGE, вместо шарнирной области тяжелой цепи иммуноглобулина.
31. Способ по п.28, отличающийся тем, что лиопротектор включает по меньшей мере один из следующих компонентов: сахароза, маннит или трегалоза.
32. Способ по п.28, отличающийся тем, что лиофилизированная смесь дополнительно включает по меньшей мере один из следующих компонентов: поверхностно-активное вещество, хелатирующий агент или наполнитель.
33. Способ по п.28, отличающийся тем, что белок слияния на основе RAGE включает по меньшей мере одну из указанных аминокислотных последовательностей: SEQ ID NO: 32, 33, 34, 35, 36, 37, 56 или 57 или последовательность, которая по меньшей мере на 90% им идентична.
34. Применение композиции по любому из пп.1-10 для получения восстановленной композиции по любому из пп.11-24.
35. Применение восстановленной композиции по любому из пп.11-24 в качестве лекарственного средства.
36. Применение восстановленной композиции по любому из пп.11-24 для лечения диабета или симптома поздних осложнений диабета, амилоидоза, болезни Альцгеймера, рака, почечной недостаточности или воспаления, ассоциированного с аутоиммунным процессом, воспалительного заболевания кишечника, ревматоидного артрита, псориаза, рассеянного склероза, гипоксии, инсульта, сердечного приступа, геморрагического шока, сепсиса, трансплантации органа, остеопороза, плохого заживления ран или воспаления и/или отторжения, ассоциированного с трансплантацией по меньшей мере одного из следующего: органа, ткани или совокупности клеток из первого участка во второй участок.
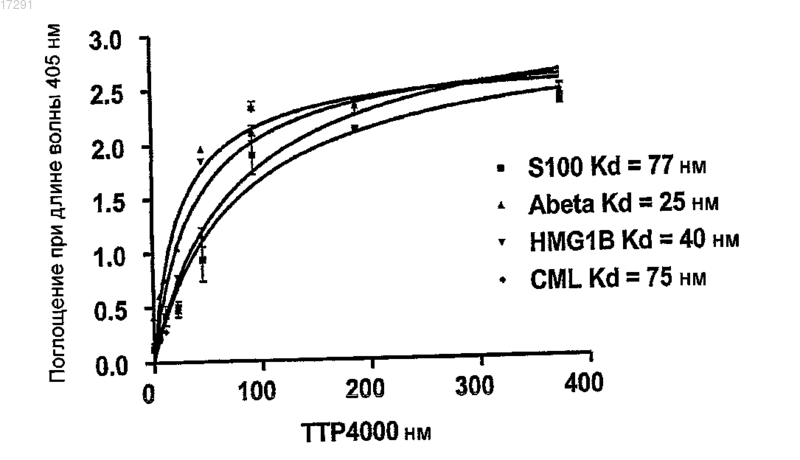
Текст
БЕЛКИ СЛИЯНИЯ НА ОСНОВЕ RAGE, ИХ КОМПОЗИЦИИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ Описываются белки слияния на основе RAGE, включающие полипептидные последовательностиRAGE, присоединенные к второму полипептиду, отличному от RAGE. В белке слияния на основе RAGE может использоваться полипептидный домен RAGE, включающий сайт связывания лиганда RAGE, и междоменный линкер, непосредственно присоединенный к N-концу CH2 домена иммуноглобулина. Описываются также композиции белка слияния на основе RAGE и использование белков слияния на основе RAGE и композиций белков слияния на основе RAGE в качестве терапевтических средств при RAGE-опосредованной патологии. 017291 Перекрестные ссылки на родственные заявки По настоящей заявке испрашивается приоритет в соответствии с положением 35 USC 119(е) относительно предварительной заявки на патент США, серийный 60/798455, поданной 4 мая 2006 г. Описание предварительной заявки на патент США 60/798455 включено полностью в настоящую заявку в качестве ссылки. Область техники, к которой относится изобретение Настоящее изобретение относится к регуляции рецептора высокогликозилированных конечных продуктов (Receptor for Advanced Glycated Endproducts; RAGE). Более конкретно, настоящее изобретение относится к белкам слияния, включающим полипептид RAGE, к способам получения таких белков слияния и к использованию таких белков для лечения нарушений, связанных с RAGE. Предпосылки создания изобретения Инкубация белков или липидов с альдозными сахарами приводит к неферментативному гликозилированию и окислению аминогрупп на белках с образованием аддуктов Амадори. С течением времени указанные аддукты подвергаются дополнительной перегруппировке, дегидратации и сшиванию с другими белками с образованием комплексов, известных как высоко гликозилированные конечные продукты(AGE). Факторы, которые способствуют образованию AGE, включают задержку белкового метаболизма(как, например, в случае амилоидозов), накопление макромолекул, характеризующихся высоким содержанием лизина, и высокие уровни глюкозы в крови (как, например, при диабете) (Hori et al., J. Biol.Chem. 270: 25752-761 (1995. AGE вовлечены в большое число нарушений, которые включают осложнения, ассоциированные диабетом, а также естественный процесс старения организма.AGE демонстрируют специфическое и насыщаемое связывание с рецепторами клеточной поверхности на моноцитах, макрофагах, эндотелиальных клетках микрососудистой сетки, гладкомышечных клетках, мезангиальных клетках и нейронах. Рецептор для высокогликозилированных конечных продуктов(RAGE) относится к семейству молекул иммуноглобулинового супергена. Внеклеточный (N-концевой) домен RAGE включает три участка иммуноглобулинового типа: один домен V типа (вариабельный), за которым следует два домена С-типа (константные) (Neeper, et al., J. Biol. Chem., 267: 14998-15004 (1992);Schmidt et al., Circ. (Suppl). 96194 (1997. За внеклеточным доменом следует один трансмембранный домен и короткий высокозаряженный цитозольный фрагмент. N-концевой внеклеточный домен может быть выделен путем протеолиза RAGE или с использованием стратегий молекулярной биологии с получением растворимого RAGE (sRAGE), включающего V- и С-домены.RAGE экспрессируется на клетках различных типов, включающих лейкоциты, нейроны, клетки микроглии и сосудистого эндотелия (Hori et al., J. Biol. Chem. 270: 25752-761 (1995). Повышенные уровни RAGE также обнаружены в стареющих тканях (Schleicher et al., J. Clin. Invest., 99 (3): 457-468 (1997 и в сетчатке, сосудистой сетке и почке у больных диабетом (Schmidt et al., Nature Med., 1: 1002-1004(1995. Кроме AGE, другие соединения также могут связываться и модулировать RAGE. RAGE связывается со множеством функционально и структурно различных лигандов, включая амилоид-бета (А), сывороточный амилоид A (SAA), конечные продукты с повышенным уровнем гликозилирования (AGE), S100CD11b/CD18 (Bucciarelli et al., Cell Mol. Life Sci., 59: 1117-128 (2002); Chavakis et al., Microbes Infect., 6: 1219-1225 (2004); Kokkola et al., Scand. J. Immunol., 61, 1-9 (2005); Schmidt et al., J. Clin. Invest., 108: 949955 (2001); Rocken et al., Am. J. Pathol., 162: 1213-1220 (2003. Было показано, что связывание лигандов, таких как AGE, S100/калгранулин, -амилоид, CML (Nкарбоксиметиллизин) и амфотерин, с RAGE модифицирует экспрессию большого числа генов. Указанные виды взаимодействия могут затем инициировать механизмы сигнальной трансдукции, включая активацию р 38, фосфорилирование p21ras, МАР-киназ, Erk1-2 и активацию медиатора транскрипции воспалительных сигнальных молекул, NF-B (Yeh et al., Diabetes, 50: 1495-1504 (2001. Например, в клетках большого числа типов взаимодействие между RAGE и его лигандами может вызвать окислительный стресс, который приводит к активации фактора транскрипции NF-B, чувствительного к свободным радикалом, и к активации генов, регулируемых NF-B, таких как цитокины IL-1 и TNF-. Кроме того,экспрессия RAGE активируется посредством NF-B, так что выявляется повышенный уровень экспрессии в участках воспаления или при окислительном стрессе (Tanaka et al., J. Biol. Chem. 275: 25781-25790(2000. Таким образом, связывание лиганда инициирует петлю регуляции по типу положительной обратной связи, которая может поддерживать нарастающую и часто неблагоприятную спираль. Активация RAGE в разных тканях и органах может приводить к большому числу патофизиологических последствий. RAGE вовлечен во множество состояний, включающих острое и хроническое воспаление (Hofmann et al., Cell. 97: 889-901 (1999, развитие поздних осложнений диабета, таких как повышенная проницаемость сосудов (Wautier et al., J. Clin. Invest., 97: 238-243 (1995, нефропатия (Teillet et(1999. RAGE также вовлечен в патогенез болезни Альцгеймера (Yan et al., Nature, 382: 685-691 (1996 и-1 017291 в инвазию и метастазирование опухоли (Taguchi et al., Nature, 405: 354-357 (2000. Несмотря на масштабную экспрессию RAGE и его явную плейотропную роль, продемонстрированную на множестве моделей различных заболеваний, по всей видимости, RAGE не является обязательным фактором в случае нормального развития. Например, мыши с нокаутом по RAGE не демонстрируют аномального фенотипа, указывая на то, что, хотя RAGE может играть определенную роль в патологии заболевания при хронической стимуляции, ингибирование RAGE, скорее всего, не вносит вклад в какойлибо нежелательный острый фенотип (Liliensiek et al., J. Clin. Invest., 113: 1641-50 (2004. Антагонистическое связывание физиологических лигандов с RAGE может подавлять патофизиологические изменения, создаваемые избыточными концентрациями AGE и других лигандов RAGE. За счет снижения уровня связывания эндогенных лигандов с RAGE могут быть снижены симптомы, ассоциированные с нарушениями, опосредованными RAGE. Растворимый RAGE (sRAGE) способен оказывать эффективное антагонистическое воздействие на связывание лигандов RAGE с RAGE. Однако sRAGE может, в случае его введения in vivo, обладать таким периодом полувыведения, который будет слишком мал для его терапевтического применения в случае одного или нескольких нарушений. Таким образом,существует потребность в разработке соединений, которые бы оказывали антагонистический эффект на связывание AGE и других физиологических лигандов с рецептором RAGE, и так, чтобы такие соединения имели желательный фармакокинетический профиль. Краткое описание сущности изобретения Варианты осуществления настоящего изобретения включают белки слияния на основе RAGE и способы использования таких белков. Настоящее изобретение может быть осуществлено в рамках множества способов. Варианты осуществления настоящего изобретения могут включать белок слияния на основеRAGE, содержащий полипептид RAGE, присоединенный к второму полипептиду, отличному от RAGE. В одном варианте белок слияния на основе RAGE включает сайт связывания лиганда RAGE. Белок слияния на основе RAGE может дополнительно включать полипептид RAGE, непосредственно присоединенный к полипептиду, включающему домен CH2 иммуноглобулина или часть домена CH2. В некоторых вариантах осуществления настоящего изобретения белок слияния на основе RAGE включает аминокислотную последовательность, представленную в SEQ ID NO: 56 или SEQ ID NO: 57, или последовательность, которая по меньшей мере на 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% идентична указанным последовательностям. Например, в некоторых вариантах последовательность, которая характеризуется по меньшей мере 90% идентичностью с SEQ ID NO: 56 или SEQ ID NO: 57, включает последовательностьSEQ ID NO: 56 или SEQ ID NO: 57 без С-концевого лизина. Настоящее изобретение также относится к способу получения белка слияния на основе RAGE. В одном варианте осуществления настоящего изобретения способ включает присоединение полипептидаRAGE ко второму полипептиду, отличному от RAGE. В одном варианте полипептид RAGE включает сайт связывания лиганда RAGE. Способ может включать присоединение полипептида RAGE непосредственно к полипептиду, включающему домен CH2 иммуноглобулина или часть домена CH2. В некоторых вариантах белок слияния на основе RAGE включает аминокислотную последовательность, представленную в SEQ ID NO: 56 или SEQ ID NO: 57, или последовательность, которая по меньшей мере на 70, 75,80, 85, 90, 95, 96, 97, 98 или 99% идентична указанным последовательностям. Например, в некоторых вариантах последовательность, по меньшей мере на 90% идентичная SEQ ID NO: 56 или SEQ ID NO: 57,включает последовательность SEQ ID NO: 56 или SEQ ID NO: 57 без С-концевого лизина. В других вариантах настоящее изобретение включает способы и композиции, подходящие для лечения RAGE-опосредованного нарушения у субъекта. Данный способ может включать введение белка слияния на основе RAGE по настоящему изобретению субъекту. Композиция может включать белок слияния на основе RAGE по настоящему изобретению в фармацевтически приемлемом носителе. В других вариантах настоящее изобретение относится к композициям, содержащим лиофилизированную смесь лиопротектора, белка слияния на основе RAGE и буфера. Так, например, в некоторых вариантах настоящее изобретение может включать стабильную восстановленную композицию, содержащую белок слияния на основе RAGE, в количестве по меньшей мере 50 мг/мл, и разбавитель, где восстановленную композицию получают из лиофилизированной смеси белка слияния на основе RAGE и лиопротектора. Некоторые варианты осуществления настоящего изобретения могут также включать изделия. В некоторых вариантах осуществления настоящего изобретения изделия могут включать контейнер, в котором содержится композиция, содержащая лиофилизированный белок слияния на основе RAGE. Изделие может также включать инструкции по восстановлению лиофилизированной композиции разбавителем. В других вариантах настоящее изобретение также включает способы получения стабильной восстановленной композиции белка слияния на основе RAGE. В некоторых вариантах способ может включать восстановление лиофилизированной смеси белка слияния на основе RAGE и лиопротектора в разбавителе так, чтобы белок слияния на основе RAGE имел концентрацию в восстановленной композиции, равную по меньшей мере 50 мг/мл. Например, в одном варианте осуществления настоящего изобретения описываемый в нем способ может включать стадии лиофилизации смеси, содержащей белок слияния на основе RAGE и лиопротекторное количество лиопротектора, и затем восстановления лиофилизирован-2 017291 ной смеси в разбавителе. Можно отметить различные преимущества, ассоциированные с конкретными вариантами осуществления настоящего изобретения. В одном варианте белки слияния на основе RAGE по настоящему изобретению могут быть метаболически стабильными при их введении субъекту. Кроме того, белки слияния на основе RAGE по настоящему изобретению могут демонстрировать высокую аффинность связывания с лигандами RAGE. В некоторых вариантах белки слияния на основе RAGE по настоящему изобретению связываются с лигандами RAGE со значениями аффинности, укладывающимися в диапазон от высоких наномолярных до низких микромолярных количеств. В ситуации связывания с высокой аффинностью с физиологическими лигандами RAGE белки слияния на основе RAGE по настоящему изобретению могут использоваться для ингибирования связывания эндогенных лигандов с RAGE, что может рассматриваться как способ облегчения заболеваний, опосредованных RAGE. Кроме того, белки слияния на основе RAGE по настоящему изобретению могут быть представлены в виде белка или нуклеиновой кислоты. В одном иллюстративном варианте белок слияния на основеRAGE может вводиться системно и оставаться в сосудистой сети для эффективного лечения сосудистых заболеваний, которые частично опосредованы RAGE. В другом иллюстративном варианте белок слияния на основе RAGE может вводиться местно для лечения заболеваний, патология которых включает лиганды RAGE. Альтернативно, конструкция нуклеиновой кислоты, кодирующая белок слияния на основеRAGE, может быть доставлена в нужный сайт путем использования соответствующего носителя, такого как вирус или оголенная ДНК, где временная местная экспрессия может локально ингибировать взаимодействие между лигандами RAGE и рецепторами. Таким образом, введение может быть временным(как, например, в случае введения белка слияния на основе RAGE) или более постоянным по своей природе (например, в том случае, когда белок слияния на основе RAGE вводят в виде рекомбинантной ДНК). Ниже описываются дополнительные особенности осуществления настоящего изобретения. Следует понимать, что данное изобретение не ограничивается деталями, приведенными в заявке, формуле изобретения и чертежах. Настоящее изобретение может быть осуществлено в виде других вариантов и может быть реализовано или выполнено различными способами. Краткое описание чертежей Различные особенности, аспекты и преимущества настоящего изобретения будут более понятными при рассмотрении их в сочетании с приведенными чертежами. На фиг. 1 показаны разные последовательности RAGE, а также последовательности иммуноглобулина, относящиеся к альтернативным вариантам осуществления настоящего изобретения. Панель A: SEQID NO: 1, аминокислотная последовательность RAGE человека; и SEQ ID NO: 2, аминокислотная последовательность RAGE человека без сигнальной последовательности аминокислот 1-22; панель В: SEQ IDNO: 3, аминокислотная последовательность RAGE человека без сигнальной последовательности аминокислот 1-23; панель С: SEQ ID NO: 4, аминокислотная последовательность sRAGE человека; SEQ ID NO: 5, аминокислотная последовательность sRAGE человека без сигнальной последовательности аминокислот 1-22 и SEQ ID NO: 6, аминокислотная последовательность sRAGE человека без сигнальной последовательности аминокислот 1-23; панель D: SEQ ID NO: 7, аминокислотная последовательность, включающая V-домен RAGE человека; SEQ ID NO: 8, альтернативная аминокислотная последовательность,включающая V-домен RAGE человека; SEQ ID NO: 9, N-концевой фрагмент V-домена RAGE человека;SEQ ID NO: 10, альтернативный N-концевой фрагмент V-домена RAGE человека; SEQ ID NO: 11, аминокислотная последовательность аминокислот 124-221 RAGE человека; SEQ ID NO: 12, аминокислотная последовательность аминокислот 227-317 RAGE человека; SEQ ID NO: 13, аминокислотная последовательность аминокислот 23-123 RAGE человека; панель Е, SEQ ID NO: 14, аминокислотная последовательность аминокислот 24-123 RAGE человека; SEQ ID NO: 15, аминокислотная последовательность аминокислот 23-136 RAGE человека; SEQ ID NO: 16, аминокислотная последовательность аминокислот 24-136 RAGE человека; SEQ ID NO: 17, аминокислотная последовательность аминокислот 23-226 RAGE человека; SEQ ID NO: 18, аминокислотная последовательность аминокислот 24-22 6 RAGE человека; панель F, SEQ ID NO: 19, аминокислотная последовательность аминокислот 23-251 RAGE человека; SEQID NO: 20, аминокислотная последовательность аминокислот 24-251 RAGE человека; SEQ ID NO: 21,междоменный линкер RAGE; SEQ ID NO: 22, второй междоменный линкер RAGE; SEQ ID NO: 23, третий междоменный линкер RAGE; SEQ ID NO: 24, четвертый междоменный линкер RAGE; панель G,SEQ ID NO: 25, ДНК, кодирующая аминокислотную последовательность аминокислот 1-118 RAGE человека; SEQ ID NO: 26, ДНК, кодирующая аминокислотную последовательность аминокислот 1-12 3 RAGE человека; и SEQ ID NO: 27, ДНК, кодирующая аминокислотную последовательность аминокислот 1-136RAGE человека; панель Н, SEQ ID NO: 28, ДНК, кодирующая аминокислотную последовательность аминокислот 1-230 RAGE человека; и SEQ ID NO: 29, ДНК, кодирующая аминокислотную последовательность аминокислот 1-251 RAGE человека; Панель I, SEQ ID NO: 38, частичная аминокислотная последовательность CH2- и CH3-доменов IgG человека; SEQ ID NO: 39, ДНК, кодирующая часть доменовCH2 и CH3 человека IgG человека; SEQ ID NO: 40, аминокислотная последовательность CH2- и CH3 доменов IgG человека; панель J, SEQ ID NO: 41, ДНК, кодирующая домены CH2 и CH3 человека IgG че-3 017291 ловека; SEQ ID NO: 42, аминокислотная последовательность CH2-домена IgG человека; SEQ ID NO: 43,аминокислотная последовательность CH3-домена IgG человека; и SEQ ID NO: 44, пятый междоменный линкер RAGE; панель K, SEQ ID NO: 45, аминокислотная последовательность sRAGE человека без сигнальной последовательности аминокислот 1-23, где остаток глютамина на N-конце циклизован с образованием пироглютаминовой кислоты; SEQ ID NO: 46, альтернативная аминокислотная последовательность, включающая V-домен sRAGE человека, где остаток глютамина на N-конце циклизован с образованием пироглютаминовой кислоты; SEQ ID NO: 47, альтернативный N-концевой фрагмент V-домена,где остаток глютамина на N-конце циклизован с образованием пироглютаминовой кислоты; SEQ ID NO: 48, аминокислотная последовательность аминокислот 24-123 RAGE человека, где остаток глютамина наN-конце циклизован с образованием пироглютаминовой кислоты; панель L, SEQ ID NO: 49, аминокислотная последовательность аминокислот 24-136 RAGE человека, где остаток глютамина на N-конце циклизован с образованием пироглютаминовой кислоты; SEQ ID NO: 50, аминокислотная последовательность аминокислот 24-226 RAGE человека, где остаток глютамина на N-конце циклизован с образованием пироглютаминовой кислоты; SEQ ID NO: 51, аминокислотная последовательность аминокислот 24251 RAGE человека, где остаток глютамина на N-конце циклизован с образованием пироглютаминовой кислоты; панель М, SEQ ID NO: 52, альтернативная последовательность ДНК, кодирующая часть доменов CH2 и CH3 человека IgG человека в SEQ ID NO: 38, и SEQ ID NO: 53, альтернативная последовательность ДНК, кодирующая домены CH2 и CH3 человека IgG человека в SEQ ID NO: 40. На фиг. 2 показаны альтернативные последовательности ДНК SEQ ID NO: 30 (панель А) и SEQ IDNO: 54 (панель В), которые кодируют кодирующий участок первого белка слияния на основе RAGE(TTP-4000), в соответствии с вариантом осуществления настоящего изобретения. Кодирующая последовательность 1-753, выделенная жирным шрифтом, кодирует N-концевую белковую последовательностьRAGE, тогда как последовательность на участке 754-1386 кодирует белковую последовательность IgG Fc(1) человека без шарнирной области. На фиг. 3 показаны альтернативные последовательности ДНК SEQ ID NO: 31 (панель А) и SEQ IDNO: 55 (панель В), которые кодируют кодирующий участок второго белка слияния на основе RAGE(TTP-3000), в соответствии с вариантом осуществления настоящего изобретения. Кодирующая последовательность 1-408, выделенная жирным шрифтом, кодирует N-концевую белковую последовательностьRAGE, тогда как последовательность 409-1041 кодирует белковую последовательность IgG Fc (1) человека без шарнирной области. На фиг. 4 показаны аминокислотные последовательности SEQ ID NO: 32, SEQ ID NO: 33, SEQ IDNO: 34 и SEQ ID NO: 56, каждая из которых кодирует четырехдоменный белок слияния на основе RAGE,в соответствии с альтернативными вариантами осуществления настоящего изобретения. Последовательность RAGE выделена жирным шрифтом. На фиг. 5 показаны аминокислотные последовательности SEQ ID NO: 35, SEQ ID NO: 36, SEQ IDNO: 37 и SEQ ID NO: 57, каждая из которых кодирует трехдоменный белок слияния на основе RAGE, в соответствии с альтернативными вариантами осуществления настоящего изобретения. Последовательность RAGE выделена жирным шрифтом. На фиг. 6, панель А, приведено сравнение белковых доменов RAGE человека и IgG 1 Fc белка человека, и точки расщепления, используемые для получения ТТР-3000 (в положении 136) и ТТР-4000 (в положении 251), в соответствии с альтернативными вариантами осуществления настоящего изобретения; и на панели В показана доменная структура ТТР-3000 и ТТР-4000 в соответствии с альтернативными вариантами осуществления настоящего изобретения. На фиг. 7 показаны результаты теста на связывание in vitro для sRAGE и первого белка слияния на основе RAGE, TTP-4000 (ТТ 4) и второго белка слияния на основе RAGE TTP-3000 (TT3) с лигандамиRAGE амилоид-бета (А), S100b (S100) и амфотерином (Ampho), в соответствии с альтернативным вариантом осуществления настоящего изобретения. На фиг. 8 показаны результаты теста на связывание in vitro для первого белка слияния на основеRAGE TTP-4000 (TT4) (белок) с амилоидом-бета в сравнении с отрицательным контролем, включающим только реагенты для иммунологического выявления (только комплекс) и продемонстрирован антагонизм такого присоединения под действием антагониста RAGE (лиганд RAGE), в соответствии с вариантом осуществления настоящего изобретения. На фиг. 9 показаны результаты теста на связывание in vitro для второго белка слияния на основеRAGE TTP-3000 (TT3) (белок) с амилоидом-бета в сравнении с отрицательным контролем, включающим только реагенты для иммунологического выявления (только комплекс) и продемонстрирован антагонизм такого присоединения под действием антагониста RAGE (лиганд RAGE) в соответствии с вариантом осуществления настоящего изобретения. На фиг. 10 показаны результаты клеточного теста, выполняемого для определения уровня ингибирования индуцированной S100b-RAGE продукции TNF- под действием белков слияния на основеRAGE TTP-3000 (TT3) и TTP-4000 (TT4), и sRAGE, в соответствии с вариантом осуществления настоящего изобретения.-4 017291 На фиг. 11 показаны результаты клеточного теста, выполняемого для определения уровня ингибирования индуцированной HMGB1-RAGE продукции TNF- под действием белка слияния на основеRAGE TTP-4000 и антитела к RAGE, в соответствии с вариантом осуществления настоящего изобретения. На фиг. 12 показан фармакокинетический профиль для белка слияния на основе RAGE TTP-4000, в соответствии с вариантом осуществления настоящего изобретения, где каждая из кривых относится к разным животным в одних и тех же экспериментальных условиях. На фиг. 13 показаны относительные уровни высвобождения TNF- из клеток ТНР-1 в результате стимуляции белком слияния на основе RAGE TTP-4000 и стимуляции IgG человека, как меры воспалительного ответа, в соответствии с вариантом осуществления настоящего изобретения. Фиг. 14 иллюстрирует использование белка слияния на основе RAGE TTP-4000 для снижении рестеноза у животных с диабетом, в соответствии с альтернативными вариантами осуществления настоящего изобретения, где на панели А показано, что белок слияния на основе RAGE TTP-4000 снижает соотношение интимы/среды в сравнении с отрицательным контролем (IgG), и на панели В показано, что белок слияния на основе RAGE TTP-4000 снижает пролиферацию гладкомышечных клеток сосудов зависимым от дозы способом. Фиг. 15 иллюстрирует использование белка слияния на основе RAGE TTP-4000 для снижения образования амилоида и дисфункции познавательного процесса у животных с болезнью Альцгеймера (БА) в соответствии с альтернативными вариантами осуществления настоящего изобретения, где на панели А показано, что белок слияния на основе RAGE TTP-4000 снижает амилоидную нагрузку мозга, а на панели В показано, что белок слияния на основе RAGE TTP-4000 улучшает познавательную функцию. На фиг. 16 приведены кривые, описывающие насыщение связывания для ТТР-4000 с различными иммобилизованными известными лигандами RAGE в соответствии с вариантом осуществления настоящего изобретения. Фиг. 17 иллюстрирует использование белка слияния на основе RAGE TTP-4000 для снижения отторжения трансплантатов аллогенных островковых клеток поджелудочной железы в соответствии с вариантами осуществления настоящего изобретения, где открытые (незачерненные) кружки обозначают животных, представляющих группу необработанного контроля; кружки с диагональной штриховкой обозначают животных, которым вводили ТТР-4000 в первой указанной дозе; кружки с волнистой штриховкой обозначают животных, которым вводили ТТР-4000 во второй указанной дозе; и кружки с ромбовидными заполняющими элементами обозначают животных, которым вводили PBS в качестве контрольного агента; и зачерненные кружки обозначают животных, которым вводили контрольный IgG. Фиг. 18 иллюстрирует использование белка слияния на основе RAGE TTP-4000 для снижения отторжения трансплантатов сингенных островковых клеток поджелудочной железы в соответствии с вариантами осуществления настоящего изобретения, где открытые (назачерненные) кружки обозначают животных, представляющих группу необработанного контроля; и зачерненные кружки обозначают животных, которым вводили ТТР-4000. Подробное описание изобретения В контексте настоящего описания, если из контекста не следует противоположное, численные параметры, приведенные далее в описании, являются приблизительными значениями, которые могут варьировать в зависимости от желательных свойств, нужных при осуществлении настоящего изобретения. В крайнем случае, но не с целью ограничения применения принципа эквивалентов применительно к настоящему изобретению, каждый численный параметр можно рассматривать как число, соответствующее значимым цифрам с применением обычной методики округления. Несмотря на то, что числовые диапазоны и параметры, приведенные в общем описании изобретения, даны в некотором приближении, числовые значения, приведенные в конкретных примерах, даны настолько точно, насколько это возможно. Однако каждое числовое значение может содержать в себе некоторую ошибку, возникающую в результате стандартного отклонения, присущего соответствующим методикам измерения. Более того, все указанные диапазоны следует понимать, как охватывающие любые и все входящие в них поддиапазоны. Например, диапазон, указанный как от 1 до 10, следует рассматривать как включающий любые и все поддиапазоны между приведенными значениями (и включая их) от минимального значения, равного 1, до максимального значения, равного 10, что означает, что все поддиапазоны, начинающиеся от минимального значения 1 или более, например от 1 до 6,1, и заканчивающиеся максимальным значением 10 или менее, например 5,5-10, входят в него. Дополнительно любые ссылки, обозначаемые как включенные в настоящий контекст, следует понимать как включенные полностью. Следует также отметить, что в контексте настоящего описания формы единственного числа включают формы множественного числа, если явно не следует иное. Термин или используется взаимозаменяемо с термином и/или, если из контекста явно не следует иное. Кроме того, термины часть и фрагмент, используемые взаимозаменяемо, относятся к частям по-5 017291 липептида, нуклеиновой кислоты или других молекулярных конструкций. Термины полипептид и белок используются взаимозаменяемо в тексте настоящего описания для обозначения молекул белка, которые могут включать либо частичные белки, либо белки полной длины. Как известно в данной области, белки, пептиды, полипептиды и олигопептиды представляют собой цепи на основе аминокислот (в типичном случае, L-аминокислот), в которых -углероды соединены пептидной связью, образованной в результате реакции конденсации между карбоксильной группой углерода одной аминокислоты и аминогруппой -углерода другой аминокислоты. В типичном случае аминокислоты, образующие белок, нумеруют в определенном порядке, начиная от аминоконцевого остатка в направлении остатка на карбоксильном конце белка. В контексте настоящего описания термин против направления считывания (upstream) относится к остатку, который является N-концевым относительно второго остатка, в том случае, если молекула является белком, или находится в 5'-положении относительно второго остатка, если молекула представляет собой нуклеиновую кислоту. Кроме того, в контексте настоящего описания термин в направлении считывания относится к остатку, который является С-концевым относительно второго остатка, если молекула является белком, или находится в 3'-положении относительно второго остатка, если молекула представляет собой нуклеиновую кислоту. Если не указано иное, все технические и научные термины, использованные в описании, имеют значения, общепринятые в данной области. Практикующим специалистам может быть рекомендовано известное руководство (Current Protocols in Molecular Biology (см. также Ansubel F.M. et al., Short Protocols in Molecular Biology, 4th Ed., Chapter 2, John WileySons, N.Y., где описаны определения и термины, используемые в данной области. Аббревиатуры аминокислотных остатков представлены стандартными трехбуквенными и/или однобуквенными кодами, используемыми в данной области для обозначения одной из 20 обычных L-аминокислот. Термин нуклеиновая кислота представляет собой полинуклеотид, такой как дезоксирибонуклеиновая кислота (ДНК) или рибонуклеиновая кислота (РНК). Термин используется для обозначения одноцепочечных нуклеиновых кислот, двуцепочечных нуклеиновых кислот и РНК и ДНК, полученных из нуклеотидных или нуклеозидных аналогов. Термин вектор относится к молекуле нуклеиновой кислоты, которая может использоваться для транспортировки второй молекулы нуклеиновой кислоты в клетку. В одном варианте осуществления настоящего изобретения такой вектор позволяет осуществлять репликацию последовательностей ДНК,введенных в вектор. Вектор может включать промотор для повышения экспрессии молекулы нуклеиновой кислоты, по меньшей мере, в некоторых клетках-хозяевах. Векторы могут реплицироваться автономно (внехромосомно) или могут быть интегрированы в хромосому клетки-хозяина. В одном варианте осуществления настоящего изобретения рассматриваемый в нем вектор может включать вектор экспрессии, способный продуцировать белок, полученный по меньшей мере из части последовательности нуклеиновой кислоты, встроенной в вектор. Как известно в данной области, условия гибридизации последовательностей нуклеиновых кислот друг с другом могут быть описаны в терминах, варьирующих от низкой до высокой жесткости. В основном, высокожесткие условия гибридизации относятся к промывке гибридов в низкосолевом буфере при высоких температурах. Гибридизация может включать фильтрование связанной ДНК с использованием растворов для гибридизации, стандартных для данной области, таких как растворы, включающие 0,5 МNaHPO4, 7% додецилсульфат натрия (ДСН), при температуре 65C и промывку в 0,25 М NaHPO4, содержащем 3,5% ДСН, с последующей промывкой в 0,1SSC/0,1% ДСН при температуре, варьирующей от комнатной температуры до 68C в зависимости от длины зонда. Например, условия высокой жесткости промывки включают промывку в 6SSC/0,05% пирофосфата натрия при температуре 37C в случае олигонуклеотидного зонда с 14 основаниями, или при температуре 48C в случае олигонуклеотидного зонда с 17 основаниями, или при температуре 55C в случае олигонуклеотидного зонда с 20 основаниями, или при температуре 60C в случае олигонуклеотидного зонда с 25 основаниями, или при температуре 65C в случае олигонуклеотидного зонда, включающего примерно 250 нуклеотидов в длину. Зонды нуклеиновой кислоты могут быть мечены радионуклидами, введенными в качестве концевой метки, например[-32 Р]АТР, или за счет включения радиоактивно меченых нуклеотидов, таких как [-32 Р]dCTP, введенных путем случайного мечения с использованием праймеров. Альтернативно, зонды могут быть мечены путем включения биотинилированных или меченых флуоресцеином нуклеотидов, где выявление зондов проводят с использованием стрептавидина или антител против флуоресцеина. В контексте настоящего описания термин малые органические молекулы относится к молекулам с молекулярным весом менее чем 2000 Да, которые содержат по меньшей мере один атом углерода. Термин белок слияния относится к белку или полипептиду, который имеет аминокислотную последовательность, полученную из двух или более белков. Белок слияния может также включать связующие участки аминокислот между аминокислотными частями, полученными из отдельных белков. В контексте настоящего описания термин полипептид, отличный от RAGE представляет собой-6 017291 любой полипептид, который был получен не из RAGE или его фрагмента. Такие полипептиды, отличные от RAGE, включают иммуноглобулиновые пептиды, димеризованные полипептиды, стабилизированные полипептиды, амфифильные пептиды или полипептиды, включающие аминокислотные последовательности, которые обеспечивают наличие соответствующих меток для целевой доставки белка или его очистки. В контексте настоящего описания термин иммуноглобулиновые пептиды может включать тяжелую цепь иммуноглобулина или ее часть. В одном варианте осуществления настоящего изобретения часть тяжелой цепи может представлять собой Fc-фрагмент или его часть. В контексте настоящего описания Fc-фрагмент включает шарнирную область тяжелой цепи полипептида, а также CH2 и CH3 домены тяжелой цепи иммуноглобулина в мономерной или димерной форме. В ином случае, CH1 и Fc-фрагмент могут использоваться в виде иммуноглобулинового полипептида. Тяжелая цепь (или ее часть) может быть получена из тяжелой цепи любого известного изотипа: IgG , IgM , IgD , IgEили IgA . Дополнительно тяжелая цепь (или ее часть) может быть получена из тяжелой цепи любого известного подтипа: IgG1 (1), IgG2 (2), IgG3 (3), IgG4 (4), IgA1 (1), IgA2 (2) или на основе мутантов данных изотипов или подтипов, которые содержат мутации, меняющие их биологическую активность. Примером такой биологической активности, которая может быть изменена, является снижение способности изотипа связываться с некоторыми рецепторами Fc, например, за счет модификации шарнирной области. Термины идентичность или процент идентичности относятся к идентичности на уровне последовательности, имеющейся между двумя аминокислотными последовательностями или между двумя последовательностями нуклеиновой кислоты. Процент идентичности может быть определен путем сопоставления последовательностей и относится к числу идентичных остатков (например, аминокислот или нуклеотидов) в положениях, общих для сравниваемых последовательностей. Сопоставление последовательностей и их сравнение может быть проведено с помощью известных для этого алгоритмов (см.,например, Smith and Waterman, 1981, Adv. Appl. Math. 2:482: Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443; Pearson and Lipman, 1988, Proc. Natl. Acad. Sci., USA, 85: 2444) или при использовании компьютерных версий указанных алгоритмов (пакет прикладных программ Wisconsin Genetics Software PackageRelease 7.0, Genetics Computer Group, 575 Science Drive, Madison, MI), которые широко доступны в виде программ BLAST и FASTA. Кроме того, для сравнения последовательностей может использоваться программа ENTREZ, доступная от Национального института здоровья, Бетезда, США (National Institutes ofHealth, Bethesda MD). В одном варианте осуществления настоящего изобретения процент идентичности двух последовательностей может быть определен при использовании GCG с весовым значением гэпа,равным 1, так что каждому аминокислотному гэпу присваивается весовое значение, соответствующее ошибке в одной аминокислоте между двумя последовательностями. В контексте настоящего описания термин консервативные остатки относится к аминокислотам,которые являются одинаковыми среди множества белков, имеющих одну и ту же структуру и/или функцию. Область консервативных остатков может иметь значение для описания структуры или функции белка. Так, соприкасающиеся консервативные остатки, идентифицируемые в трехмерном белке, могут быть важны для описания структуры или функции белка. Для выявления консервативных остатков или консервативных участков трехмерной структуры можно провести сравнение последовательностей одинаковых или сходных белков из разных видов или у индивидуумов одного и того же вида. В контексте настоящего описания термин гомолог обозначает полипептид, имеющий определенную степень гомологии с аминокислотной последовательностью дикого типа. Сравнение по гомологии может быть проведено на глаз или чаще всего с помощью легко доступных программ сравнения последовательностей. Такие коммерчески доступные компьютерные программы позволяют вычислить процент гомологии между двумя или более последовательностями (см., например, Wilbur, W.J. and Lipman,D.J., 1983, Proc. Natl. Acad. Sci., USA, 80: 726-730). Например, могут быть взяты гомологичные последовательности, включающие такие аминокислотные последовательности, которые в альтернативных вариантах по меньшей мере на 70, на 75, на 85, на 90, на 95, на 96, на 97, на 98 или на 99% идентичны друг другу. В контексте настоящего описания термин идентичный по меньшей мере на 90% обозначает последовательности, которые характеризуются показателем идентичности в диапазоне от 90 до 99,99% идентичности указанным последовательностям и которые включают все диапазоны между указанными значениями. Таким образом, термин идентичный по меньшей мере на 90% обозначает последовательности, которые характеризуются показателем идентичности, равным 91, 91,5, 92, 92,5, 93, 93,5, 94, 94,5,95, 95,5, 96, 96,5, 97, 97,5, 98, 98,5, 99 и 99,5%, применительно к указанной последовательности. Аналогично, термин идентичный по меньшей мере на 70% обозначает последовательности, которые характеризуются показателем идентичности в диапазоне от 70 до 99,99% идентичности, включая все диапазоны между ними. Определение процента идентичности проводят с использованием алгоритмов, приведенных в настоящем описании. В контексте настоящего описания полипептидный или белковый домен обозначает область полипептида или белка, которая включает независимую единицу. Домены могут быть определены с точки-7 017291 зрения структуры, последовательности и/или биологической активности. В одном варианте осуществления настоящего изобретения полипептидный домен может включать участок белка, который укладывается в пространственную структуру таким образом, что, по существу, не зависит от остальной части белка. Домены могут быть идентифицированы с использованием баз данных доменов, таких как, без ограничения, PFAM, PRODOM, PROSITE, BLOCKS, PRINTS, SBASE, ISREC PROFILES, SAMRT и PROCLASS. В контексте настоящего описания термин иммуноглобулиновый домен обозначает аминокислотную последовательность, которая характеризуется структурной гомологией или идентичностью с доменом иммуноглобулина. Длина последовательности аминокислот в иммуноглобулиновом домене может быть любого размера. В одном варианте осуществления настоящего изобретения иммуноглобулиновый домен может включать менее чем 250 аминокислот в длину. В одном иллюстративном варианте осуществления настоящего изобретения иммуноглобулиновый домен может составлять примерно 80-150 аминокислот в длину. Например, вариабельный домен и участки CH1, CH2 и CH3 в IgG, каждый, представляет собой иммуноглобулиновый домен. В другом варианте осуществления настоящего изобретения вариабельные участи CH1, CH2, CH3 и CH4 в IgM, каждый, представляют иммуноглобулиновый домен. В контексте настоящего описания иммуноглобулиновый домен RAGE представляет собой последовательность аминокислот белка в RAGE, которая характеризуется структурной гомологией или идентичностью с доменом иммуноглобулина. Например, домен иммуноглобулина RAGE может включать Vдомен RAGE, домен RAGE Ig-подобного C1 типа 1 (C1 домен) или домен RAGE Ig-подобного C2 типа 2(C2 домен). В контексте настоящего описания термин междоменный линкер обозначает полипептид, который соединяет вместе два домена. Fc-шарнирная область представляет собой пример междоменного линкера в IgG. В контексте настоящего описания термин непосредственно соединенный идентифицирует ковалентную связь между двумя разными группами (например, между последовательностями нуклеиновых кислот, полипептидов, полипептидными доменами), которые не содержат каких-либо встроенных атомов между двумя соединяемыми группами. В контексте настоящего описания термин лигандсвязывающий домен относится к домену белка,ответственному за связывание лиганда. Указанный термин лигандсвязывающий домен включает гомологи связывающего домена лиганда или его части. В этом контексте могут быть произведены осторожные замещения аминокислот в связывающем сайте лиганда с учетом сходства по полярности, заряду,растворимости, гидрофобности или гидрофильности остатков с тем, чтобы сохранить специфичность по связыванию домена, ответственного за связывание лиганда. В контексте настоящего описания термин сайт связывания лиганда включает остатки в белке, которые непосредственно взаимодействуют с лигандом, или остатки, вовлекаемые в осуществление такой локализации лиганда, чтобы он оставался в тесной близости к тем остаткам, которые непосредственно взаимодействуют с лигандом. Взаимодействие остатков в сайте связывания лиганда может быть определено по пространственной близости остатков к лиганду на примере модели или в самой структуре. Термин сайт связывания лиганда включает гомологи сайта связывания лиганда или его части. В этой связи, могут быть произведены осторожные замещения аминокислот в сайте связывания лиганда с учетом сходства по полярности, заряду, растворимости, гидрофобности или гидрофильности остатков с тем,чтобы сохранить специфичность сайта по связыванию с лигандом. Сайт связывания лиганда может находиться в одном или нескольких связывающих доменах белка или полипептида. В контексте настоящего описания термин взаимодействует относится к условиям, включающим близость между лигандом или соединением, или их частями, или фрагментами, и частью второй молекулы, представляющей определенный интерес. Взаимодействие может быть нековалентным, например,осуществляемым как результат действия водородных связей, может представлять собой взаимодействие под действием сил Ван дер Вальса или электростатическое или гидрофобное взаимодействие, или оно может быть ковалентным. В контексте настоящего описания термин лиганд относится к молекуле или соединению или другой структуре, которая взаимодействует с сайтом связывания лиганда, включая субстраты, или аналоги,или их части. В контексте настоящего описания, термин лиганд может относиться к соединениям, которые связываются с белком, представляющим интерес. Лиганд может представлять собой агонист, антагонист или модулятор. Или указанный лиганд может оказывать биологический эффект. Или указанный лиганд может блокировать связывание других лигандов и тем самым ингибировать биологический эффект. Лиганды могут включать, без ограничения, малые молекулы ингибиторов. Указанные малые молекулы могут включать пептиды, пептидомиметики, органические соединения и т.п. Лиганды могут также включать полипептиды и/или белки. В контексте настоящего описания термин соединение-модулятор относится с молекуле, которая изменяет или модифицирует биологическую активность молекулы, представляющей интерес. Соединение-модулятор может повышать или понижать активность или изменять физические или химические-8 017291 характеристики, а также функциональные или иммунологические свойства молекулы, представляющей интерес. В случае RAGE соединение-модулятор может повышать или снижать активность или изменять характеристики, или функциональные или иммунологические свойства RAGE или его части. Соединение-модулятор может включать природные и/или химически синтезированные или искусственные пептиды, модифицированные пептиды (например, фосфопептиды), антитела, углеводы, моносахариды, олигосахариды, полисахариды, гликолипиды, гетероциклические соединения, нуклеозиды или нуклеотиды или их части, а также малые органические или неорганические молекулы. Соединение-модулятор может представлять собой эндогенное физиологическое соединение или может быть природным или синтетическим соединением. Или соединение-модулятор может представлять собой малую органическую молекулу. Термин соединение-модулятор также включает химически модифицированный лиганд или химически модифицированное соединение, и включает их изомерные и рацемические формы. Термин агонист включает соединение, которое связывается с рецептором с образованием комплекса, который демонстрирует фармакологический ответ, специфичный для вовлекаемого рецептора. Термин антагонист включает соединение, которое связывается с агонистом или с рецептором с образованием комплекса, который не демонстрирует существенного фармакологического ответа и может ингибировать биологический ответ, индуцированный агонистом. Соответственно, агонисты RAGE могут связываться с RAGE и стимулировать RAGEопосредованные клеточные процессы, а антагонисты RAGE могут ингибировать опосредованные RAGE процессы, стимулируемые агонистом RAGE. Например, в одном варианте осуществления изобретения клеточный процесс, стимулируемый агонистами RAGE, включает активацию транскрипции гена TNF-. Термин пептидные миметики относится к структурам, которые служат в качестве заместителей пептидов в процессах взаимодействия между молекулами (Morgan et al., 1989, Ann. Reports Med. Chem.,24: 243-252). Пептидные миметики могут включать синтетические структуры, которые могут содержать аминокислотные и/или пептидные связи или могут не содержать их, но которые сохраняют структурные и функциональные особенности пептида, агониста или антагониста. Пептидные миметики также включат пептоиды, олигопептоиды (Simon et al., 1972, Proc. Natl. Acad. Sci., USA, 89: 9367) и пептидные библиотеки, содержащие пептиды заданной длины, отражающие все возможные последовательности аминокислот, соответствующие пептиду, агонисту или антагонисту согласно настоящему изобретению. Термин лечение относится к ослаблению симптома заболевания или нарушения и может включать излечивание нарушения, по существу, предотвращение начала развития нарушения или улучшение состояния субъекта. Термин терапия в контексте настоящего описания относится к полному спектру терапевтических методов, применяемых в случае того нарушения, которым страдает пациент, включая облегчение одного симптома или большей части симптомов, определяемых данным нарушением, излечивание конкретного нарушения или предотвращение развития нарушения. В контексте настоящего описания термин ЕС 50 определяется как концентрация агента, которая соответствует 50% от уровня измеряемого биологического эффекта. Например, ЕС 50 терапевтического агента, оказывающего заметный биологический эффект, может включать величину, при которой данный агент демонстрирует 50% уровень указанного биологического эффекта. В контексте настоящего описания термин IC50 определяется как концентрация агента, которая приводит к 50% ингибированию измеряемого эффекта. Например, IC50 антагониста связывания RAGE может включать значение, при котором антагонист снижает связывание лиганда с сайтом связывания лиганда RAGE на 50%. В контексте настоящего описания термин эффективное количество обозначает количество агента,которое является эффективным для проявления желательного эффекта у субъекта. Термин терапевтически эффективное количество обозначает количество лекарственного средства или фармацевтического агента, которое демонстрирует терапевтический ответ у животного или человека, для которого желателен такой ответ. Фактическая доза, которая включает эффективное количество, может зависеть от способа введения, размера субъекта и состояния его здоровья, от природы нарушения, подлежащего лечению,и т.п. Термин фармацевтически приемлемый носитель в контексте настоящего изобретения может относиться к соединениям и композициям, которые приемлемы для использования у человека или животного, например, может относиться к терапевтическим композициям, вводимым с целью лечения нарушения или заболевания, опосредованного RAGE. Термин фармацевтическая композиция в контексте настоящего описания обозначает композицию,которая может вводиться в организм хозяина-млекопитающего, например, перорально, парентерально,местно, путем ингаляции, интраназально или ректально, в стандартных дозированных формах, включая обычные нетоксичные носители, разбавители, адъюванты, наполнители и т.п. Термин парентеральный в контексте настоящего описания включает подкожные инъекции, внутривенную, внутримышечную, внутригрудинную инъекцию или методику инфузии. В контексте настоящего описания термин отторжение относится к иммунному или воспалительному ответу на ткань, который ведет к деструкции клеток, тканей или органов или который ведет к по-9 017291 вреждению клеток, тканей или органов. Отторгаемые клетки, ткань или орган могут быть получены от того же субъекта, который проявил реакцию отторжения, или они могут быть трансплантированы от другого субъекта в организм того субъекта, который демонстрирует указанную реакцию отторжения. В контексте настоящего описания термин клетка относится к структурным и функциональным единицам живой системы млекопитающего, где каждая из них включает независимую живую систему. Как известно в данной области, клетки включают ядро, цитоплазму, внутриклеточные органеллы и клеточную стенку, которая окружает клетку и позволяет клетке быть независимой от других клеток. В контексте настоящего описания термин ткань относится к агрегату клеток, которые обладают аналогичной структурой и функцией или которые действует сообща, выполняя определенную функцию. Ткань может включать объединение близких клеток и внутриклеточные вещества, которые окружают клетки. Ткани включают, без ограничения, мышечную ткань, нервную ткань и костную ткань. В контексте настоящего описания термин орган относится к полностью дифференцированной структурной и функциональной единице в организме животного, которая специализируется на выполнении конкретной функции. Орган может включать группу тканей, которые выполняют определенную функцию или группу функций. Органы включают, без ограничения, сердце, легкие, головной мозг, глаз,желудок, селезенку, поджелудочную железу, почки, печень, кишечник, кожу, матку, мочевой пузырь и кости. Термин стабильная применительно к композиции обозначает такую композицию, в составе которой белок слияния на основе RAGE, по существу, сохраняет свою физическую и химическую стабильность, а также биологическую активность при хранении. В данной области имеются различные доступные методики для определения стабильности белка, которые описаны в приведенных ниже обзорах (Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. (1991) иJones, A. Adv. Drug Delivery Rev. 10: 29-90 (1993. Стабильность может быть измерена при заданном значении температуры в течение выбранного периода времени. Для целей быстрого скрининга композиция может выдерживаться при температуре 40C в течение периода времени от 1 недели до 1 месяца, и в течение этого периода времени проводят измерение стабильности. Так, например, может использоваться показатель уровня агрегации после лиофилизации и хранения как индикатор стабильности белка слияния на основе RAGE (см. приведенные в тексте примеры). Например, стабильная композиция может представлять собой такую композицию, в которой меньше чем примерно 10% и предпочтительно меньше чем примерно 5%, белка слияния на основе RAGE присутствует в композиции в виде агрегата. В других вариантах осуществления настоящего изобретения может быть определено повышение уровня образования агрегатов после лиофилизации и хранения лиофилизированной композиции. Например, стабильная лиофилизированная композиция может представлять собой такую композицию, в случае которой повышение уровня агрегатов в такой лиофилизированной композиции составляет менее чем примерно 5% или менее чем примерно 3% в случае, если лиофилизированную композицию инкубируют при температуре 40C в течение по меньшей мере одной недели. В других вариантах осуществления настоящего изобретения стабильность композиции белка слияния на основе RAGE может быть измерена с использованием теста на биологическую активность, такого как тест на связывание согласно настоящему описанию. Восстановленная композиция представляет собой такую композицию, которую получают при растворении лиофилизированной композиции белка слияния на основе RAGE в разбавителе, так что белок слияния на основе RAGE диспергируется и/или растворяется в восстановленной композиции. Восстановленная композиция может быть пригодна для введения (например, парентерального введения) пациенту, подлежащему лечению с использованием белка слияния, и в некоторых вариантах осуществления настоящего изобретения может представлять собой композицию, подходящую для целей подкожного введения. Термин изотоническая применительно к композиции обозначает такую представляющую интерес композицию, которая имеет осмотическое давление в диапазоне значений от примерно 240 до примерно 340 мосм./кг. В одном варианте осуществления настоящего изобретения рассматриваемая в нем изотоническая композиция представляет собой такую композицию, которая характеризуется осмотическим давлением, которое, по существу, соответствует таковому для человеческой крови (285-310 мосм./кг). Изотоничность можно измерить в рамках процедуры оценки давления пара или с помощью осмометра, позволяющего определить снижение точки замерзания. Лиопротектор представляет собой такую молекулу, которая при ее объединении с белком слияния на основе RAGE, по существу, устраняет или снижает химическую и/или физическую нестабильность белка при его лиофилизации и последующем хранении. Иллюстративные лиопротекторы включают сахара, такие как сахароза или трегалоза; полиол, такой как сахарные спирты, например эритрит, арабит,ксилит, сорбит и маннит или их сочетания. В одном варианте осуществления настоящего изобретения лиопротектор может включать сахар. В другом варианте осуществления настоящего изобретения лиопротектор может включать невосстанавливающий сахар. В другом варианте осуществления настоящего изобретения лиопротектор может включать невосстанавливающий сахар, такой как сахароза. Указанный лиопротектор может добавляться к предварительно лиофилизированной композиции в лиопротектор- 10017291 ном количестве, что означает, что после лиофилизации белка в присутствии лиопротекторного количества лиопротектора, белок слияния на основе RAGE, по существу, сохраняет свою физическую и химическую стабильность, а также биологическую активность при лиофилизации и хранении. Термин разбавитель для лиофилизированной композиции согласно настоящему изобретению представляет собой такой разбавитель, который является фармацевтически приемлемым (безопасным и нетоксичным при введении человеку) и который используется для изготовления восстановленной композиции. Иллюстративные разбавители включают стерильную воду, бактериостатическую воду для инъекций (BWFI), забуференный по pH раствор (например, фосфатно-буферный раствор), стерильный физиологический раствор, раствор Рингера или раствор декстрозы. В одном варианте осуществления настоящего изобретения указанный разбавитель обеспечивает получение восстановленной композиции, пригодной для инъекций. В другом варианте осуществления настоящего изобретения, где указанный разбавитель обеспечивает получение восстановленной композиции, пригодной для инъекций, указанный разбавитель может включать воду для инъекций (WFI). Термин консервант для восстановленной композиции согласно настоящему изобретению представляет собой соединение, которое может быть добавлено к разбавителю или к восстановленной композиции для снижения, по существу, бактериального воздействия в восстановленной композиции. В одном варианте осуществления настоящего изобретения количество добавляемого консерванта может быть таким количеством, которое используется с целью облегчения производства восстановленной композиции для множественного применения. Примеры возможных консервантов включают хлорид октадецилметилбензиламмония, хлорид гексаметония, хлорид бензалкония (смесь хлоридов алкилбензилметиламмония, в которых алкильные группы представлены длинноцепочечными соединениями) и хлорид бензетония. Другие типы консервантов включают ароматические спирты, такие как фенол, бутиловый и бензиловый спирт, аллилпарабены, такие как метил- или пропилпарабен, катехол, резорцинол, циклогексанол,3-пентанол и м-крезол. Термин наполнитель для лиофилизированной композиции согласно настоящему изобретению представляет собой соединение, которое вносит дополнительную массу в лиофилизированную смесь и поддерживает физическую структуру лиофилизированной лепешки (например, облегчает получение, по существу, однородной лиофилизированной лепешки, которая сохраняет структуру с открытыми порами). Иллюстративные наполнители включают, без ограничения, маннит, глицин и ксорбитол. Белки слияния на основе RAGE. Варианты осуществления настоящего изобретения включают белки слияния на основе RAGE, способы получения таких белков слияния и способы использования таких белков слияния. Настоящее изобретение может осуществляться множеством способов. Так, например, варианты настоящего изобретения относятся к белкам слияния на основе RAGE,включающим полипептид RAGE, присоединенный к второму полипептиду, отличному от RAGE. В одном варианте белки слияния на основе RAGE могут включать сайт связывания лиганда RAGE. В одном варианте осуществления изобретения сайт связывания лиганда включает самый N-концевой домен белка слияния RAGE. Сайт связывания лиганда RAGE может включать V домен RAGE или его часть. В этом варианте сайт связывания лиганда RAGE включает SEQ ID NO: 9 или последовательность, на 90% ей идентичную, или SEQ ID NO: 10 или последовательность, на 90% ей идентичную, или SEQ ID NO: 47 или последовательность, на 90% ей идентичную (фиг. 1). В одном варианте полипептид RAGE может быть присоединен к полипептиду, включающему иммуноглобулиновый домен или его часть (например, фрагмент) иммуноглобулинового домена. В одном варианте полипептид, включающий иммуноглобулиновый домен, включает по меньшей мере часть одного из CH2 или CH3 доменов человеческого IgG. В некоторых вариантах осуществления настоящего изобретения белок слияния на основе RAGE включает аминокислотную последовательность, представленную в SEQ ID NO: 56 или SEQ ID NO: 57,или последовательность, которая по меньшей мере на 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% идентична ей. Так, например, в некоторых вариантах осуществления настоящего изобретения, последовательность,которая по меньшей мере на 90% идентична SEQ ID NO: 56 или SEQ ID NO: 57, включает последовательность SEQ ID NO: 56 или SEQ ID NO: 57 без С-концевого лизина. Белок или полипептид RAGE может включать человеческий белок RAGE полной длины (например,SEQ ID NO: 1) или фрагмент человеческого RAGE. В контексте настоящего описания фрагмент полипептида RAGE составляет по меньшей мере 5 аминокислот в длину, может включать более 30 аминокислот в длину, но имеет длину меньше, чем полная аминокислотная последовательность. В альтернативных вариантах, относящихся к белкам слияния, композициям и способам согласно настоящему изобретению,полипептид RAGE может включать последовательность, которая на 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% идентична человеческому RAGE или его фрагменту. Например, в одном варианте полипептидRAGE может включать человеческий RAGE или его фрагмент, при этом, скорее, первым остатком будет глицин, а не метионин (см., например, Neeper et al., (1992. Или в другом варианте человеческий RAGE может включать RAGE полной длины с удаленной сигнальной последовательностью (например, SEQ IDNO: 2 или SEQ ID NO: 3) (фиг. 1 А и 1B) или часть указанной аминокислотной последовательности. Белки слияния на основе RAGE согласно настоящему изобретению могут также включать sRAGE(например, SEQ ID NO: 4), полипептид, который на 90% идентичен sRAGE, или фрагмент sRAGE. В контексте настоящего описания sRAGE или белок RAGE не включает трансмембранный участок или цитоплазматический хвостовой фрагмент (Park et al., Nature Med., 4: 1025-1031 (1998. Так, например,полипептид RAGE может включать человеческий sRAGE или его фрагмент, при этом в первом положении будет находиться, скорее, глицин, а не метионин (см, например, Neeper et al., (1992. Или полипептид RAGE может включать человеческий sRAGE с удаленной сигнальной последовательностью (см.,например, SEQ ID NO: 5, или SEQ ID NO: 6, или SEQ ID NO: 45 (фиг. 1 или может включать часть указанной аминокислотной последовательности. В других вариантах белок RAGE может включать V домен RAGE (см., например, SEQ ID NO: 7,SEQ ID NO: 8 или SEQ ID NO: 46, фиг. 1) (Neeper et al., (1992); Schmidt et al., (1997. Или может быть использована последовательность, которая на 90% идентична V домену RAGE или его фрагменту. Или, в другом варианте, белок RAGE может включать V домен RAGE (например, SEQ ID NO: 9,SEQ ID NO: 10 или SEQ ID NO: 47, фиг. 1). В одном варианте белок RAGE может включать сайт связывания лиганда. В этом варианте сайт связывания лиганда может включать SEQ ID NO: 9 или последовательность, которая по меньшей мере на 90% идентична ей, или SEQ ID NO: 10 или последовательность,которая по меньшей мере на 90% идентична ей, или SEQ ID NO: 47 или последовательность, которая по меньшей мере на 90% идентична ей. В еще одном варианте фрагмент RAGE представляет собой синтетический пептид. В другом варианте осуществления настоящего изобретения сайт связывания лиганда может включать аминокислоты 23-53 из SEQ ID NO: 1 (фиг. 1). В другом варианте осуществления настоящего изобретения сайт связывания лиганда может включать аминокислоты 24-52 из SEQ ID NO: 1. В другом варианте осуществления настоящего изобретения сайт связывания лиганда может включать аминокислоты 31-52 из SEQ ID NO: 1. В другом варианте осуществления настоящего изобретения сайт связывания лиганда может включать аминокислоты 31-116 из SEQ ID NO: 1. В другом варианте осуществления настоящего изобретения сайт связывания лиганда может включать аминокислоты 19-52 из SEQ ID NO: 1. Например, сайт связывания лиганда может включать V домен RAGE или его часть, такую как домен связывания лиганда RAGE (например, аминокислоты на участках 1-118, 23-118, 24-118, 31-118, 1-116, 23116, 24-116, 31-116, 1-54, 23-54, 24-54, 31-54, 1-53, 23-53, 24-53 или 31-53 из SEQ ID NO: 1 или фрагменты указанных участков). Или могут использоваться фрагменты полипептидов, которые способны функционально связываться с лигандом RAGE. Или, в другом варианте, может использоваться последовательность, которая по меньшей мере на 70, 75, 80, 85, 90, 95, 97, 98 или 99% идентична V домену RAGE или его фрагменту (как было описано выше). Кроме того, как известно в данной области, в тех вариантах осуществления настоящего изобретения, где N-конец белка слияния представлен глютамином, например,как в случае удаления сигнальной последовательности, включающей остатки 1-23 из SEQ ID NO: 1 (например, Q24 в случае полипептида, включающего аминокислоты 24-118 или SEQ ID NO: 1), такой глютамин может быть циклизован с образованием пироглютаминовой кислоты (рЕ). Таким образом, полипептид RAGE, используемый в белках слияния согласно настоящему изобретению, может включать фрагмент RAGE полной длины. Как известно в данной области, RAGE включает трехдоменный полипептид иммуноглобулинового типа, в который входят V домен и C1 и C2 домены,каждый из которых соединен друг с другом с помощью междоменного линкера. RAGE полной длины также включает трансмембранный полипептид и цитоплазматический хвостовой фрагмент в направлении считывания информации (С-концевой) C2 домена и присоединен к C2 домену. В одном варианте полипептид RAGE не включает какие-либо остатки сигнальной последовательности. Сигнальная последовательность RAGE может включать либо остатки 1-22, либо остатки 1-23 изRAGE полной длины. Кроме того, как известно в данной области, в тех вариантах осуществления настоящего изобретения, где N-конец белка слияния представлен глютамином (например, в случае удаления сигнальной последовательности, включающей остатки 1-23), N-концевой глютамин (Q24) может быть циклизован с образованием пироглютаминовой кислоты (рЕ). Примеры соответствующих конструкций таких молекул включают полипептиды, имеющие аминокислотные последовательности, показанные в виде SEQ ID NO: 45, 46, 47, 48, 49, 50 и 51 (фиг. 1), а также белки слияния на основе RAGE,имеющие аминокислотные последовательности, показанные в виде SEQ ID NO: 56 и 57 (фиг. 4). Как известно в данной области, CH3 участок белков слияния на основе RAGE согласно настоящему изобретению может включать С-концевую аминокислоту, выщепляемую в ходе посттрансляционной модификации, при экспрессии в некоторых рекомбинантных системах (см., например, Li, et al., BioProcessing J., 4:23-30 (2005. В одном варианте осуществления настоящего изобретения выщепляемая Сконцевая аминокислота представляет собой лизин (K). Таким образом, в альтернативных вариантах осуществления настоящего изобретения белок слияния на основе RAGE согласно настоящему изобретению может включать полипептид, содержащий аминокислотную последовательность, представленную в SEQID NO: 32-37, 56 и 57 без С-концевого лизина (K). Таким образом, в разных вариантах осуществления настоящего изобретения полипептид RAGE- 12017291 может включать аминокислоты 23-116 из человеческого RAGE (SEQ ID NO: 7) или последовательность,которая по меньшей мере на 90% идентична ей, или аминокислоты 24-116 из человеческого RAGE (SEQID NO: 8) или последовательность, которая по меньшей мере на 90% идентична ей, или аминокислоты 24-116 из человеческого RAGE, где Q24 циклизуется с образованием рЕ (SEQ ID NO: 46), или последовательность, которая по меньшей мере на 90% идентична ей, соответствующую V домену RAGE. Или в другом варианте полипептид RAGE может включать аминокислоты 124-221 из человеческого RAGE(SEQ ID NO: 11) или последовательность, которая по меньшей мере на 90% идентична ей, соответствующую C1 домену RAGE. В другом варианте полипептид RAGE может включать аминокислоты 227317 из человеческого RAGE (SEQ ID NO: 12) или последовательность, которая по меньшей мере на 90% ей идентична, соответствующую C2 домену RAGE. Или в другом варианте полипептид RAGE может включать аминокислоты 23-123 из человеческого RAGE (SEQ ID NO: 13) или последовательность, которая по меньшей мере на 90% ей идентична, или аминокислоты 24-123 из человеческого RAGE (SEQ IDNO: 14) или последовательность, которая по меньшей мере на 90% идентична ей, соответствующую V домену RAGE и междоменному линкеру в направлении считывания информации. Или в другом варианте полипептид RAGE может включать аминокислоты 24-123 из человеческого RAGE, где Q24 циклизуется с образованием рЕ (SEQ ID NO: 48), или последовательность, которая по меньшей мере на 90% ей идентична. Или в другом варианте полипептид RAGE может включать аминокислоты 23-226 из человеческого RAGE (SEQ ID NO: 17) или последовательность, которая по меньшей мере на 90% ей идентична, или аминокислоты 24-226 из человеческого RAGE (SEQ ID NO: 18) или последовательность, которая по меньшей мере на 90% идентична ей, соответствующую V домену, C1 домену и междоменному линкеру,соединяющему указанные два домена. Или в другом варианте полипептид RAGE может включать аминокислоты 24-226 из человеческого RAGE, где Q24 циклизуется с образованием рЕ (SEQ ID NO: 50), или последовательность, которая по меньшей мере на 90% ей идентична. Или в другом варианте полипептидRAGE может включать аминокислоты 23-339 из человеческого RAGE (SEQ ID NO: 5) или последовательность, которая по меньшей мере на 90% ей идентична, или аминокислоты 24-339 из человеческогоRAGE (SEQ ID NO: 6) или последовательность, которая по меньшей мере на 90% ей идентична, соответствующую sRAGE (т.е. кодирующую V, C1 и C2 домены и междоменные линкеры). Или в другом варианте полипептид RAGE может включать аминокислоты 24-339 из человеческого RAGE, где Q24 циклизуется с образованием рЕ (SEQ ID NO: 45), или последовательность, которая по меньшей мере на 90% ей идентична. Или в другом варианте могут использоваться фрагменты каждой из указанных последовательностей. Аминокислотные последовательности этих полипептидов приведены на фиг. 1. Белок слияния на основе RAGE может включать несколько типов пептидов, которые не были получены из RAGE или его фрагмента. Второй полипептид из белка слияния на основе RAGE может включать полипептид, полученный из иммуноглобулина. В одном варианте иммуноглобулиновый полипептид может включать тяжелую цепь иммуноглобулина или ее часть (т.е. фрагмент). Например, фрагмент тяжелой цепи может включать полипептид, полученный из Fc-фрагмента иммуноглобулина, где фрагментFc включает шарнирную область тяжелой цепи полипептида и CH2 и CH3 домены тяжелой цепи иммуноглобулина в качестве мономера. Тяжелая цепь (или ее часть) может быть получена из тяжелой цепи любого известного изотопа: IgG, IgM, IgD, IgE или IgA. Дополнительно тяжелая цепь (или ее часть) может быть получена из любого известного подтипа тяжелой цепи: IgG1(1), IgG2(2), IgG3(3),IgG4(4), IgA1(1), IgA2(2) или на основе мутантов данных изотипов или подтипов, которые содержат мутации, изменяющие их биологическую активность. Второй полипептид может включать домены CH2 иCH3 человеческого IgG1, или любую часть, или оба указанных домена. В качестве примера варианта осуществления полипептид, содержащий домены CH2 и CH3 человеческого IgG1 или их фрагмент, может включать SEQ ID NO: 40 (фиг. 1) или ее часть. В качестве иллюстративного варианта можно указать полипептид, включающий домены CH2 и CH3 из человеческого IgG1 или их часть, которая может включатьSEQ ID NO: 38 или его фрагмент. Иммуноглобулиновый пептид может кодироваться последовательностью нуклеиновой кислоты SEQ ID NO: 39 или SEQ ID NO: 41 (фиг. 1). Иммуноглобулиновая последовательность, соответствующая SEQ ID NO: 38 или SEQ ID NO: 40, может также кодироваться SEQ ID NO: 52 или SEQ ID NO: 53 (фиг. 1), где молчащие изменения оснований в кодонах, которые кодируют пролин(CCG на ССС) и глицин (GGT на GGG) на С-конце последовательности удаляют сайт сплайсинга криптической РНК возле концевого кодона (например, нуклеотиды 622-627 из SEQ ID NO: 39 модифицируют с получением SEQ ID NO: 52 или нуклеотиды 652-657 из SEQ ID NO: 41 модифицируют с получениемSEQ ID NO: 53). Шарнирный участок Fc части цепи иммуноглобулина может обладать провоспалительным действием in vivo. Так, в одном варианте белок слияния на основе RAGE согласно настоящему изобретению включает междоменный линкер, полученный из RAGE, a не из шарнирной области междоменного полипептида, полученного из иммуноглобулина. Таким образом, в некоторых вариантах осуществления настоящего изобретения белок слияния на основе RAGE может также включать полипептид RAGE, непосредственно присоединенный к полипеп- 13017291 тиду, включающему CH2 домен иммуноглобулина или фрагмент или часть CH2 домена иммуноглобулина. В одном варианте CH2 домен или его фрагмент может включать SEQ ID NO: 42 (фиг. 1). В одном варианте фрагмент SEQ ID NO: 42 включает последовательность SEQ ID NO: 42, в которой удалены первые десять аминокислот, включающих по меньшей мере часть шарнирного участка Fc. В одном варианте полипептид RAGE может включать сайт связывания лиганда. Сайт связывания лиганда RAGE может включать V домен RAGE или его часть. В одном варианте сайт связывания лиганда RAGE включает SEQID NO: 9 или последовательность, которая по меньшей мере на 90% идентична ей, или SEQ ID NO: 10 или последовательность, которая на 90% ей идентична, или SEQ ID NO: 47 или последовательность, которая на 90% ей идентична. Полипептид RAGE, используемый в белках слияния на основе RAGE согласно настоящему изобретению, может включать иммуноглобулиновый домен RAGE. Дополнительно или альтернативно, фрагмент RAGE может включать междоменный линкер. Или в другом варианте полипептид RAGE может включать иммуноглобулиновый домен RAGE, присоединенный против направления считывания информации (т.е. ближе к N-концу) или в направлении считывания информации (т.е. ближе к С-концу) междоменного линкера. В еще одном варианте полипептид RAGE может включать два (или более) иммуноглобулиновых домена RAGE, которые соединяются друг с другом с помощью междоменного линкера. Полипептид RAGE может также включать RAGE с множеством иммуноглобулиновых доменов, соединенных друг с другом с помощью одного или нескольких междоменных линкеров и содержащих концевой междоменный линкер, присоединенный к N-концевому иммуноглобулиновому домену RAGE и/или к Сконцевому домену иммуноглобулина. Дополнительные сочетания иммуноглобулиновых доменов RAGE и междоменных линкеров также входят в область настоящего изобретения. В одном варианте полипептид RAGE включает междоменный линкер RAGE, присоединенный к иммуноглобулиновому домену RAGE, так что С-концевая аминокислота иммуноглобулинового доменаRAGE присоединена к N-концевой аминокислоте междоменного линкера и С-концевая аминокислота междоменного линкера RAGE непосредственно присоединена к N-концевой аминокислоте полипептида,включающего CH2 домен иммуноглобулина или его фрагмент. Полипептид, включающий CH2 домен иммуноглобулина, может включать CH2 и CH3 домены человеческого IgG1, или любую их часть, или оба указанных домена. В качестве иллюстративного варианта можно указать полипептид, включающий CH2 и CH3 домены или их часть из человеческого IgG1, который может включать SEQ ID NO: 40 или его часть. В одном варианте осуществления настоящего изобретения полипептид, включающий CH2 и CH3 домены из человеческого IgG1 или их часть, может включать SEQ ID NO: 38 или ее фрагмент. Или в другом варианте человеческий IgG1 может включать SEQ ID NO: 38 или SEQ ID NO: 40 с удаленным концевым лизином (K). Как было указано выше, белок слияния на основе RAGE согласно настоящему изобретению может включать один или множество доменов из RAGE. Кроме того, полипептид RAGE, включающий междоменный линкер, присоединенный к полипептидному домену RAGE, может включать фрагмент белкаRAGE полной длины. Например, полипептид RAGE может включать аминокислоты 23-136 из человеческого RAGE (SEQ ID NO: 15) или последовательность, которая по меньшей мере на 90% ей идентична,или аминокислоты 24-136 из человеческого RAGE (SEQ ID NO: 16) или последовательность, которая по меньшей мере на 90% ей идентична, или аминокислоты 24-136 из человеческого RAGE, где Q24 циклизуется с образованием рЕ (SEQ ID NO: 49), или последовательность, которая по меньшей мере на 90% ей идентична, соответствующую V домену RAGE и междоменному линкеру в направлении считывания информации. Или в другом варианте полипептид RAGE может включать аминокислоты 23-251 из человеческого RAGE (SEQ ID NO: 19) или последовательность, которая по меньшей мере на 90% ей идентична,или аминокислоты 24-251 из человеческого RAGE (SEQ ID NO: 20) или последовательность, которая по меньшей мере на 90% ей идентична, или аминокислоты 24-251 из человеческого RAGE, где Q24 циклизуется с образованием рЕ (SEQ ID NO: 51), или последовательность, которая по меньшей мере на 90% ей идентична, соответствующую V домену, C1 домену, междоменному линкеру, соединяющему два домена,и второму междоменному линкеру в направлении считывания информации для С 1. Например, в одном варианте белок слияния на основе RAGE может включать два иммуноглобулиновых домена, полученных из белка RAGE, и два иммуноглобулиновых домена, полученных из Fc полипептида человека. Белок слияния на основе RAGE может включать первый иммуноглобулиновый доменRAGE и первый междоменный линкер RAGE, присоединенный к второму иммуноглобулиновому домену RAGE и второму междоменному линкеру RAGE, так что N-концевая аминокислота первого междоменного линкера присоединена к С-концевой аминокислоте первого иммуноглобулиновового доменаRAGE, N-концевая аминокислота второго иммуноглобулинового домена RAGE присоединена к Сконцевой аминокислоте первого междоменного линкера, N-концевая аминокислота второго междоменного линкера присоединена к С-концевой аминокислоте второго иммуноглобулинового домена RAGE и С-концевая аминокислота второго междоменного линкера RAGE непосредственно присоединена к Nконцевой аминокислоте CH2 домена иммуноглобулина. В альтернативных вариантах, четырехдоменный белок слияния на основе RAGE кодируется SEQ ID NO:30 или SEQ ID NO:54 (фиг. 2). В одном варианте четыре домена белка слияния на основе RAGE могут включать SEQ ID NO:32 (фиг. 4). В альтернативных- 14017291 вариантах четырехдоменный белок слияния на основе RAGE включает SEQ ID NO:33, SEQ ID NO:34 или SEQ ID NO:56 (фиг. 4). Альтернативно, трехдоменный белок слияния на основе RAGE может включать один иммуноглобулиновый домен, полученный из RAGE, и два иммуноглобулиновых домена, полученных из Fc полипептида человека. Например, белок слияния на основе RAGE может включать один иммуноглобулиновый домен RAGE, присоединенный через междоменный линкер RAGE к N-концевой аминокислоте CH2 домена иммуноглобулина или части CH2 домена иммуноглобулина. В альтернативных вариантах трехдоменный белок слияния на основе RAGE кодируется SEQ ID NO:31 или SEQ ID NO:55 (фиг. 3). В одном варианте трехдоменный белок слияния на основе RAGE может включать SEQ ID NO:35 (фиг. 5). В альтернативных вариантах трехдоменный белок слияния на основе RAGE может включать SEQ IDNO:36, или SEQ ID NO:37, или SEQ ID NO:57 (фиг. 5). Фрагмент междоменного линкера RAGE может включать пептидную последовательность, которая соответствует считыванию в направлении транскрипции в естественном состоянии, и, таким образом,присоединяется к иммуноглобулиновому домену RAGE. Например, в случае V домена RAGE междоменный линкер может включать аминокислотные последовательности, которые считываются в естественном состоянии в направлении транскрипции V домена. В одном варианте линкер может включать последовательность SEQ ID NO: 21, соответствующую аминокислотам на участке 117-123 RAGE полной длины. Или в другом варианте линкер может включать пептид, содержащий дополнительные части природной последовательности RAGE. Например, может использоваться междоменный линкер, включающий несколько аминокислот (например, 1-3, 1-5, или 1-10, или 1-15 аминокислот) против направления или в направлении считывания информации для SEQ ID NO: 21. Таким образом, в одном варианте междоменный линкер включает SEQ ID NO: 23 включает аминокислоты на участке 117-136 из RAGE полной длины. Или в другом варианте могут использоваться фрагменты SEQ ID NO: 21, содержащие делецию, например, из 1, 2 или 3 аминокислот с любого конца линкера. В альтернативных вариантах линкер может включать последовательность, которая по меньшей мере на 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% идентична SEQ ID NO: 21 или SEQ ID NO: 23. В случае С 1-домена RAGE линкер может включать пептидную последовательность, которая считывается в естественном варианте по направлению транскрипции C1-домена. В этом варианте линкер может включать SEQ ID NO: 22, соответствующую аминокислотам на участке 222-251 из RAGE полной длины. Или в другом варианте линкер может включать пептид, содержащий дополнительные части природной последовательности RAGE. Например, может использоваться линкер, включающий несколько аминокислот (1-3, 1-5, или 1-10, или 1-15 аминокислот) против направления считывания или в направления считывания информации для SEQ ID NO: 22. Или в другом варианте могут использоваться фрагменты SEQ ID NO: 22, содержащие делецию, например, из 1-3, 1-5, или 1-10, или 1-15 аминокислот с любого конца линкера. Например, в одном варианте междоменный линкер RAGE может включать SEQ ID NO: 24, соответствующую аминокислотам на участке 222-226. В альтернативных вариантах указанный линкер может включать пептид, который по меньшей мере на 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% идентичен SEQ ID NO: 22 или SEQ ID NO: 24. Или междоменный линкер может включать последовательность SEQ ID NO: 44, которая соответствует аминокислотам на участке 318-342. В альтернативных вариантах, указанный линкер может включать пептид, который по меньшей мере на 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% идентичен SEQ IDNO: 44. Кроме того, для специалистов в данной области очевидно, что отдельные замещения, делеции или добавки, которые изменяют, добавляют или делетируют одну аминокислоту или небольшой процент аминокислот (в типичном случае, менее чем примерно 5%, чаще менее чем примерно 1%) в кодируемой последовательности, представляют собой консервативные вариации, где указанные изменения приводят к замещению одной аминокислоты другой, химически близкой аминокислотой. Таблицы, описывающие консервативные варианты замещений с получением функционально близких аминокислот, известны в данной области. Приведеннные ниже группы описывают те аминокислоты, которые могут рассматриваться в контексте консервативных замещений друг для друга: 1) алании (А), серин (S), треонин (Т); 2) аспарагиновая кислота (D), глютаминовая кислота (Е); 3) аспарагин (N), глютамин (Q); 4) аргинин (R), лизин (K); 5) изолейцин (I), лейцин (L), метионин (М), валин (V) и 6) фенилаланин (F), тирозин (Y), триптофан (W). Консервативное замещение представляет собой замещение, в рамках которого замещающая аминокислота (природная или модифицированная) структурно близка замещаемой аминокислоте, т.е. она имеет примерно тот же размер и характеризуется такими же электронными свойствами, что и замещаемая аминокислота. Так, замещающая аминокислота будет иметь такую же или близкую функциональную группу в боковой цепи, что и исходная аминокислота. Термин консервативное замещение таже относится к использованию замещающей аминокислоты, которая идентична замещаемой, с тем исключением,- 15017291 что функциональная группа в боковой цепи защищена подходящей защитной группой. Как известно в данной области, аминокислоты могут быть химически модифицированы относительно их природной структуры с использованием для этого механизмов, основанных либо на энзиматических, либо на неэнзиматических реакциях. Например, в одном варианте осуществления настоящего изобретения N-концевая аминокислота илиN-концевой глютамин могут быть циклизованы при потере воды с образованием пироглютаминовой кислоты (pyroE или pE) (Chelius et al., Anal. Cner, 78: 2370-2376 (2006); и Burstein et al., Proc. National Acad.Scu, 73:2604-2608 (1976. Альтернативно, в случае белка слияния, содержащего на N-конце пироглютаминовую кислоту, потенциальный вариант доступа может быть связан с последовательностью нуклеиновой кислоты, кодирующей глутаминовую кислоту, в том положении на белке, которое в результате посттрансляционного процессинга становится N-концом (например, где остаток 24 в SEQ ID NO: 1 представлен, скорее, глютаматом, а не глютамином). Способы получения белков слияния на основе RAGE. Настоящее изобретение также относится к способу получения белка слияния на основе RAGE. Так,в одном варианте настоящее изобретение относится к способу получения белка слияния на основеRAGE, включающему стадию ковалентного присоединения полипептида RAGE, присоединенного к второму полипептиду, отличному от RAGE, где полипептид RAGE включает сайт связывания лигандаRAGE. Например, присоединенный полипептид RAGE и второй полипептид, отличный от RAGE, могут кодироваться рекомбинантной конструкцией ДНК. Данный способ также относится к стадии включения конструкции ДНК в вектор экспрессии. Кроме того, указанный способ может включать стадию введения вектора экспрессии в клетку-хозяина. Например, варианты осуществления настоящего изобретения относятся к белкам слияния на основеRAGE, включающим полипептид RAGE, присоединенный к второму полипептиду, отличному от RAGE. В одном варианте белок слияния на основе RAGE может включать сайт связывания лиганда RAGE. В одном варианте сайт связывания лиганда включает большую часть N-концевого домена белка слияния. Сайт связывания лиганда RAGE может включать V домен RAGE или его часть. В одном варианте сайт связывания лиганда RAGE включает SEQ ID NO: 9 или последовательность, которая по меньшей мере на 90% ей идентична, или SEQ ID NO: 10 или последовательность, которая по меньшей мере на 90% ей идентична, или SEQ ID NO: 47 или последовательность, которая по меньшей мере на 90% ей идентична. В одном варианте полипептид RAGE может быть присоединен к полипептиду, включающему иммуноглобулиновый домен или часть (т.е. его фрагмент) иммуноглобулинового домена. В одном варианте полипептид, включающий иммуноглобулиновый домен, включает по меньшей мере часть по меньшей мере одного из доменов CH2 или CH3 доменов человеческого IgG. Таким образом, разные варианты осуществления настоящего изобретения могут включать выделенные молекулы ДНК, которые кодируют белки слияния на основе RAGE согласно настоящему изобретению. В некоторых вариантах молекулы ДНК кодируют белок слияния на основе RAGE, который включает аминокислотную последовательность, представленную в SEQ ID NO: 56 или SEQ ID NO: 57, или последовательность, которая по меньшей мере на 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% ей идентична. Например, в некоторых вариантах осуществления настоящего изобретения последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 56 или SEQ ID NO: 57, включает последовательностьSEQ ID NO: 56 или SEQ ID NO: 57 без С-концевого лизина. Так, в некоторых вариантах своего осуществления настоящее изобретения может включать молекулу ДНК, с последовательностью, которая показана в виде SEQ ID NO: 54 или SEQ ID NO: 55, или включает последовательность, которая по меньшей мере на 90% ей идентична. Белок слияния на основе RAGE может быть получен в рамках генноинженерной стратегии с использованием методик рекомбинантной ДНК. Например, в одном варианте настоящее изобретение может включать выделенную последовательность нуклеиновой кислоты, кодирующую полипептид RAGE,присоединенный к второму полипептиду, отличному от RAGE. В одном варианте полипептид RAGE может включать сайт связывания лиганда RAGE. Белок или полипептид RAGE может включать человеческий RAGE полной длины (например, SEQID NO: 1) или фрагмент человеческого RAGE. В одном варианте полипептид RAGE не включает какиелибо остатки из сигнальной последовательности. Сигнальная последовательность RAGE может включать остатки 1-22 или остатки 1-23 из полноразмерного RAGE (SEQ ID NO: 1). В альтернативных вариантах полипептид RAGE может включать последовательность, которая по меньшей мере на 70, 75, 80, 85, 90,95, 96, 97, 98 или 99% идентична человеческому RAGE или его фрагменту. Например, в одном варианте полипептид RAGE может включать человеческий RAGE или его фрагмент, в котором содержится в качестве первого остатка скорее глицин, а не метионин (см., например, Neeper et al., (1992. Или в другом варианте человеческий RAGE может включать полноразмерный RAGE с удаленной сигнальной последовательностью (например, SEQ ID NO: 2 или SEQ ID NO: 3) (фиг. 1A и 1B) или часть указанной аминокислотной последовательности. Белки слияния на основе RAGE согласно настоящему изобретению могут также включать sRAGE (например, SEQ ID NO: 4) или полипептид, который на 90% идентиченsRAGE или фрагменту sRAGE. Например, полипептид RAGE может включать человеческий sRAGE или- 16017291 его фрагмент, при этом в качестве первого остатка содержится скорее глицин, а не метионин (см., например, Neeper et al., (1992. Или в другом варианте человеческий RAGE может включать sRAGE с удаленной сигнальной последовательностью (см., например, SEQ ID NO: 5, SEQ ID NO: 6 или SEQ ID NO: 45, фиг. 1) или часть такой аминокислотной последовательности. В других вариантах белок RAGE может включать V домен (например, SEQ ID NO: 7, SEQ ID NO: 8 или SEQ ID NO: 46, фиг. 1). Или в другом варианте может использоваться последовательность, которая на 90% идентична V домену или его фрагменту. Или в другом варианте белок RAGE может включать фрагмент RAGE, включающий часть V домена (например, SEQ ID NO: 9, SEQ ID NO: 10 или SEQ ID NO: 47, фиг. 1). В одном варианте сайт связывания лиганда может включать SEQ ID NO: 9 или последовательность, которая по меньшей мере на 90% идентична ей, или SEQ ID NO: 10 или последовательность, которая по меньшей мере на 90% идентична ей, или SEQ ID NO: 47 или последовательность, которая по меньшей мере на 90% идентична ей. В еще одном варианте фрагмент RAGE представляет собой синтетический пептид. В одном варианте последовательность нуклеиновой кислоты включает последовательность SEQ IDNO: 25, которая кодирует аминокислоты на участке 1-118 из человеческого RAGE или его фрагмента. Например, может использоваться последовательность, включающая нуклеотиды 1-348 из SEQ ID NO: 25,которая кодирует аминокислоты на участке 1-116 из человеческого RAGE. Или в другом варианте нуклеиновая кислота может включать последовательность SEQ ID NO: 26, которая кодирует аминокислоты на участке 1-123 из человеческого RAGE. Или в другом варианте нуклеиновая кислота может включать последовательность SEQ ID NO: 27, которая кодирует аминокислоты 1-136 из человеческого RAGE. Или в другом варианте нуклеиновая кислота может включать последовательность SEQ ID NO: 28, которая кодирует аминокислоты 1-120 из человеческого RAGE. Или в другом варианте нуклеиновая кислота может включать последовательность SEQ ID NO: 29, которая кодирует аминокислоты на участке 1-251 из человеческого RAGE. Или в другом варианте могут использоваться фрагменты указанных последовательностей нуклеиновой кислоты, которые кодируют фрагменты полипептида RAGE. Белок слияния на основе RAGE может включать несколько типов пептидов, которые не были получены из RAGE или его фрагмента. Второй полипептид из белка слияния на основе RAGE может включать полипептид, полученный из иммуноглобулина. Тяжелая цепь иммуноглобулина (или ее часть) может быть получена из любого известного изотипа тяжелой цепи IgG, IgM, IgD, IgE или IgA. Кроме того, тяжелая цепь (или ее часть) может быть получена из любого известного подтипа тяжелых цепей: IgG1(1), IgG2(2), IgG3(3), IgG4(4), IgA1(1), IgA2(2) или на основе мутантов данных изотипов или подтипов, содержащих мутации, которые меняют биологическую активность. Второй полипептид может включать CH2 и CH3 домены человеческого IgG1, или часть любого из них, или оба указанных домена. В качестве иллюстративных вариантов можно указать полипептид, включающий домены CH2 иCH3 из человеческого IgG1 или их часть, который может включать SEQ ID NO: 38 или SEQ ID NO: 40. В одном варианте полипептид, включающий домены CH2 и CH3 из человеческого IgG1 или их часть, может включать SEQ ID NO: 38 или ее фрагмент. Иммуноглобулиновый пептид может кодироваться последовательностью нуклеиновой кислоты SEQ ID NO: 39 или SEQ ID NO: 41. В альтернативных вариантах иммуноглобулиновая последовательность SEQ ID NO: 38 или SEQ ID NO: 40 может также кодироватьсяFc-часть цепи иммуноглобулина может обладать провоспалительным действием in vivo. Так, белок слияния на основе RAGE согласно настоящему изобретению может включать междоменный линкер, полученный из RAGE, но не из шарнира междоменной области полипептида, полученного из иммуноглобулина. Таким образом, в одном варианте настоящее изобретение относится к способу получения белка слияния на основе RAGE, который включает стадию ковалентного присоединения полипептида RAGE к полипептиду, включающему домен CH2 иммуноглобулина или часть домена CH2 иммуноглобулина. В одном варианте белок слияния на основе RAGE может включать сайт связывания лиганда RAGE. Сайт связывания лиганда RAGE может также включать V домен RAGE или его часть. В одном варианте сайт связывания лиганда RAGE включает SEQ ID NO: 9 или последовательность, которая по меньшей мере на 90% идентична ей, или SEQ ID NO: 10 или последовательность, которая на 90% ей идентична, или SEQID NO: 47 или последовательность, которая на 90% ей идентична. Например, в одном варианте осуществления настоящего изобретения белок слияния может кодироваться рекомбинантной конструкцией ДНК. Данный способ может включать стадию введения конструкции ДНК в вектор экспрессии. Кроме того, рассматриваемый способ может включать трансфекцию вектора экспрессии в клетку-хозяина. Таким образом, разные варианты осуществления настоящего изобретения также включают векторы экспрессии с кодирующими молекулами ДНК, которые кодируют белки слияния на основе RAGE согласно настоящему изобретению. В некоторых вариантах молекулы ДНК кодируют белок слияния на основе RAGE, включающий аминокислотную последовательность, представленную в SEQ ID NO: 56 или SEQ ID NO: 57, или последовательность, которая по меньшей мере на 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% идентична ей. Например, в некоторых вариантах последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 56 или SEQ ID NO: 57, включает после- 17017291 довательность SEQ ID NO: 56 или SEQ ID NO: 57 без C-концевого лизина. Еще другие варианты осуществления настоящего изобретения включают клетки, трансфицированные вектором экспрессии с кодирующими молекулами ДНК, которые кодируют белки слияния на основеRAGE согласно настоящему изобретению. В некоторых вариантах молекулы ДНК кодируют белок слияния на основе RAGE, включающий аминокислотную последовательность, представленную в SEQ ID NO: 56 или SEQ ID NO: 57, или последовательность, которая по меньшей мере на 70, 75, 80, 85, 90, 95, 96, 97,98 или 99% идентична ей. Например, в некоторых вариантах последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 56 или SEQ ID NO: 57, включает последовательность SEQ ID NO: 56 или SEQ ID NO: 57 без С-концевого лизина. Например, в одном варианте настоящее изобретение включает нуклеиновую кислоту, кодирующую пептид RAGE, непосредственно присоединенный к полипептиду, включающему CH2 домен иммуноглобулина или его фрагмент. В одном варианте осуществления изобретения CH2 домен или его фрагмент включает SEQ ID NO: 42. В одном варианте фрагмент SEQ ID NO: 42 включает последовательность SEQID NO: 42, в которой удалены первые десять аминокислот. Второй полипептид может включать CH2 иCH3 домены из человеческого IgG1. В рамках иллюстративных вариантов осуществления изобретения полипептид, содержащий домены CH2 и CH3 из человеческого IgG1, может включать SEQ ID NO: 38 илиSEQ ID NO: 40. В одном варианте полипептид, включающий домены CH2 и CH3 из человеческого IgG1 или их часть, может включать SEQ ID NO: 38 или ее фрагмент. Пептид иммуноглобулина может кодироваться последовательностью нуклеиновой кислоты SEQ ID NO: 39 или SEQ ID NO: 41. Иммуноглобулиновая последовательность, соответствующая SEQ ID NO: 38 или SEQ ID NO: 40, может также кодироваться последовательностью SEQ ID NO: 52 или SEQ ID NO: 53, где молчащие изменения оснований в кодонах, которые кодируют пролин (CCG на ССС) и глицин (GGT на CGG) на С-конце последовательности, удаляют сайт сплайсинга криптической РНК возле концевого кодона (например, нуклеотиды 622627 из SEQ ID NO: 39 модифицируют с получением SEQ ED NO: 52 или нуклеотиды 652-657 из SEQ IDNO: 41 модифицируют с получением SEQ ID NO: 53). В одном варианте осуществления настоящего изобретения полипептид RAGE может включать междоменный линкер RAGE, присоединенный к иммуноглобулиновому домену RAGE, так что Сконцевая аминокислота иммуноглобулинового домена RAGE присоединена к N-концевой аминокислоте междоменного линкера, и С-концевая аминокислота междоменного линкера RAGE непосредственно присоединена к N-концевой аминокислоте полипептида, включающего CH2 домен иммуноглобулина или его фрагмент. Полипептид, включающий CH2 домен иммуноглобулина или его часть, может включать полипептид, включающий CH2 и CH3 домены из человеческого IgG1 или часть одного или обоих из указанных доменов. В рамках иллюстративных вариантов осуществления изобретения полипептид, включающий CH2 и CH3 домены из человеческого IgG1 и их часть, может включать SEQ ID NO: 38 или SEQID NO: 40. В одном варианте полипептид, включающий домены CH2 и CH3 из человеческого IgG1 или их часть, может включать последовательность SEQ ID NO: 38 или ее часть. В некоторых вариантах полипептид, включающий домены CH2 и CH3 из человеческого IgG1 или их часть, может включать последовательность SEQ ID NO: 38 или SEQ ID NO: 40 с удаленным С-концевым лизином (K). Белок слияния на основе RAGE согласно настоящему изобретению может включать один или множество доменов RAGE. Кроме того, полипептид RAGE, включающий междоменный линкер, присоединенный к иммуноглобулиновому домену RAGE, может включать фрагмент белка RAGE полной длины. Например, в одном варианте белок слияния на основе RAGE согласно настоящему изобретению может включать два иммуноглобулиновых домена, полученных из белка RAGE, и два иммуноглобулиновых домена, полученных из Fc человеческого полипептида. Белок слияния на основе RAGE может включать первый иммуноглобулиновый домен RAGE и первый междоменный линкер, присоединенный к второму иммуноглобулиновому домену RAGE и второму междоменному линкеру RAGE, так что N-концевая аминокислота первого междоменного линкера присоединена к С-концевой аминокислоте первого иммуноглобулинового домена RAGE, N-концевая аминокислота второго иммуноглобулинового домена RAGE присоединена к С-концевой аминокислоте первого междоменного линкера, N-концевая аминокислота второго междоменного линкера присоединена к С-концевой аминокислоте второго иммуноглобулинового домена RAGE и С-концевая аминокислота второго междоменного линкера RAGE непосредственно присоединена к N-концевой аминокислоте полипептида, включающего CH2 домен иммуноглобулина или его фрагмент. Например, полипептид RAGE может включать аминокислоты на участке 23-251 человеческого RAGE (SEQ ID NO: 19) или последовательность, которая по меньшей мере на 90% идентична ей,или аминокислоты на участке 24-251 человеческого RAGE (SEQ ID NO: 20) или последовательность,которая по меньшей мере на 90% идентична ей, или аминокислоты на участке 24-251 человеческогоRAGE, где Q24 циклизуют с образованием рЕ (SEQ ID NO: 51), или последовательность, которая по меньшей мере на 90% идентична ей, соответствующую V домену, C1 домену, междоменному линкеру,связывающему два указанных домена, и второму междоменному линкеру в направлении считывания информации С 1. В одном варианте осуществления изобретения конструкция нуклеиновой кислоты,включающая SEQ ID NO: 30 или его фрагмент, может кодировать четырехдоменный белок слияния на основе RAGE (фиг. 2 А). В другом варианте осуществления изобретения конструкция нуклеиновой ки- 18017291 слоты, включающая SEQ ID NO: 54 (фиг. 2 В), может кодировать четырехдоменный белок слияния на основе RAGE, где введены молчащие изменения оснований в кодонах, которые кодируют пролин (CCG на ССС) и глицин (GGT на CGG) на С-конце последовательности, для удаления сайта сплайсинга криптической РНК возле концевого кодона (например, нуклеотиды 1375-1380 из SEQ ID NO: 30 модифицируют с получением SEQ ID NO: 54). Альтернативно, трехдоменный белок слияния на основе RAGE может включать один иммуноглобулиновый домен, полученный из RAGE, и два иммуноглобулиновых домена, полученных из Fc человеческого полипептида. Например, белок слияния на основе RAGE может включать один иммуноглобулиновый домен RAGE, присоединенный через междоменный линкер RAGE к N-концевой аминокислоте полипептида, включающего иммуноглобулиновый домен CH2 или его фрагмент. Например, полипептидRAGE может включать аминокислоты на участке 23-136 из человеческого RAGE (SEQ ID NO: 15) или последовательность, которая по меньшей мере на 90% идентична ей, или аминокислоты на участке 24136 человеческого RAGE (SEQ ID NO: 16) или последовательность, которая по меньшей мере на 90% идентична ей, или аминокислоты на участке 24-136 человеческого RAGE, где Q24 циклизуют с образованием рЕ (SEQ ID NO: 49), или последовательность, которая по меньшей мере на 90% идентична ей,соответствующую V домену RAGE и междоменному линкеру в направлении считывания информации. В одном варианте осуществления настоящего изобретения конструкция нуклеиновой кислоты, включающая SEQ ID NO: 31 или ее фрагмент, может кодировать трехдоменный белок слияния на основе RAGE(фиг. 3 А). В другом варианте осуществления изобретения конструкция нуклеиновой кислоты, включающая SEQ ID NO: 55, может кодировать трехдоменный белок слияния на основе RAGE, где введены молчащие изменения оснований в кодонах, которые кодируют пролин (CCG на ССС) и глицин (GGT наCGG) на С-конце последовательности, для удаления сайта сплайсинга криптической РНК возле концевого кодона (например, нуклеотиды 1030-1035 из SEQ ID NO: 31 модифицируют с получением SEQ ID NO: 55) (фиг. 3 В). Фрагмент междоменного линкера RAGE может включать пептидную последовательность, которая соответствует направлению считывания информации в природном состоянии и которая, таким образом,присоединена к иммуноглобулиновому домену RAGE. Например, в случае V домена RAGE, междоменный линкер может включать аминокислотные последовательности, которые соответствуют направлению считывания информации из V домена. В одном варианте указанный линкер может включать SEQ ID NO: 21, соответствующую аминокислотам на участке 117-123 полноразмерного RAGE. Или в другом варианте линкер может включать пептид, содержащий дополнительные части из природной последовательности RAGE. Например, может использоваться междоменный линкер, включающий несколько аминокислот (например, 1-3, 1-5, или 1-10, или 1-15 аминокислот) против направления и в направлении считывания информации из SEQ ID NO: 21. Таким образом, в одном варианте осуществления изобретения междоменный линкер включает SEQ ID NO: 23, включающую аминокислоты на участке 117-136 из полноразмерного RAGE. Или могут использоваться фрагменты SEQ ID NO: 21, содержащие делецию из 1, 2,или 3 аминокислот с любого конца линкера. В альтернативных вариантах линкер может включать последовательность, которая по меньшей мере на 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% идентична SEQ IDNO: 21 или SEQ ID NO: 23. В случае C1 домена RAGE указанный линкер может включать пептидную последовательность, которая соответствует естественному направлению считывания информации из C1 домена. В одном варианте указанный линкер может включать SEQ ID NO: 22, соответствующую аминокислотам на участке 222-251 полноразмерного RAGE. Или в другом варианте указанный линкер может включать пептид, содержащий дополнительные части из природной последовательности RAGE. Например, может использоваться линкер, включающий несколько аминокислот (1-3, 1-5, или 1-10, или 1-15 аминокислот) против направления и в направлении считывания информации из SEQ ID NO: 22. Или могут использоваться фрагменты SEQ ID NO: 22, содержащие делецию, например, из 1-3, 1-5, или 1-10, или 1-15 аминокислот с любого конца линкера. Например, в одном варианте, междоменный линкер RAGE может включать SEQID NO: 24, соответствующую аминокислотам на участке 222-226. В альтернативных вариантах, указанный линкер может включать последовательность, которая по меньшей мере на 70, 75, 80, 85, 90, 95, 96,97, 98 или 99% идентична SEQ ID NO: 22 или SEQ ID NO: 24. Или в другом варианте междоменный линкер может включать SEQ ID NO: 44, соответствующую аминокислотам на участке 318-342 из RAGE. В альтернативных вариантах указанный линкер может включать последовательность, которая по меньшей мере на 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% идентична SEQ ID NO: 44. Описываемый способ может также включать стадию введения конструкции ДНК в вектор экспрессии. Так, в одном варианте своего осуществления настоящее изобретение включает вектор экспрессии,который кодирует белок слияния на основе RAGE, включающий полипептид RAGE, непосредственно присоединенный к полипептиду, включающему домен CH2 иммуноглобулина или часть домена CH2 иммуноглобулина. В одном варианте полипептид RAGE включает конструкции, такие как приведенные в настоящем описании, содержащие междоменный линкер RAGE, присоединенный к иммуноглобулиновому домену RAGE, так что С-концевая аминокислота иммуноглобулинового домена RAGE присоеди- 19017291 нена к N-концевой аминокислоте междоменного линкера и С-концевая аминокислота междоменного линкера RAGE непосредственно присоединена к N-концевой аминокислоте полипептида, включающегоCH2 домен иммуноглобулина или его часть. Например, вектор экспрессии, используемый для трансфекции клеток, может включать последовательность нуклеиновой кислоты SEQ ID NO: 30 или ее фрагмент,SEQ ID NO: 54 или ее фрагмент, SEQ ID NO: 31 или ее фрагмент или SEQ ID NO: 55 или ее фрагмент. Рассматриваемый способ может также включать стадию трансфекции клетки вектором экспрессии согласно настоящему изобретению. Так, в одном варианте своего осуществления настоящее изобретение включает клетку, трансфицированную вектором экспрессии, который экспрессирует белок слияния на основе RAGE согласно настоящему изобретению, так что клетка экспрессирует белок слияния на основеRAGE, включающий полипептид RAGE, непосредственно присоединенный к полипептиду, включающему CH2 домен иммуноглобулина или часть CH2 домена иммуноглобулина. В одном варианте полипептидRAGE включает конструкции, такие как приведенные в настоящем описании конструкции, содержащие междоменный линкер RAGE, присоединенный к иммуноглобулиновому домену RAGE, так что Сконцевая аминокислота иммуноглобулинового домена RAGE присоединена к N-концевой аминокислоте междоменного линкера и С-концевая аминокислота междоменного линкера RAGE непосредственно присоединена к N-концевой аминокислоте полипептида, включающего CH2 домен иммуноглобулина или его часть. Например, вектор экспрессии может включать последовательность нуклеиновой кислоты SEQ IDNO: 30 или ее фрагмент, SEQ ID NO: 54 или ее фрагмент, SEQ ID NO: 31 или ее фрагмент или SEQ IDNO: 55 или ее фрагмент. Например, плазмиды могут быть сконструированы таким образом, что они будут экспрессировать белки слияния RAGE-IgG, получаемые путем объединения 5'-последовательностей кДНК различной длины для человеческого RAGE с 3'-последовательностью кДНК человеческого IgG1 Fc(1). Последовательности кассет экспрессии могут быть вставлены в вектор экспрессии, такой как вектор экспрессииpcDNA3.1 (Invitrogen, CA) с использованием стандартных рекомбинантных методик. Кроме того, описываемый способ может включать трансфекцию вектора экспрессии в клеткухозяин. Белки слияния на основе RAGE могут быть экспрессированы в системах экспрессии млекопитающих, включая системы, в рамках которых векторы экспрессии вводят в клетки млекопитающего с использованием вируса, такого как ретровирус или аденовирус. Клеточные линии млекопитающих, где указанные клетки доступны в качестве клеток-хозяев для проведения экспрессии, хорошо известны в данной области и включают большое число иммортализованных клеточных линий, доступных от Американской коллекции типовых культур (American Type Culture Collection (ATCC, Указанные линии включают, в числе других, клетки яичника китайского хомяка (СНО), клетки NS0, SP2, клетки HeLa, клетки детенышей хомяка (BHK), клетки почки обезьяны (COS), клетки гепатоцеллюлярной карциномы человека (например, Hep G2), клетки А 549 и множество других клеточных линий. Клеточные линии могут быть отобраны по результатам определения, какие клеточные линии характеризуются высокими уровнями экспрессии белка слияния на основе RAGE. Другие клеточные линии, которые также могут использоваться, включают клеточные линии насекомых, такие как Sf9 клетки. Клетки-хозяева растений включают, например, клетки Nicotiana, Arabidopsis, ряски, кукурузы, пшеницы, картофеля и т.п. Бактериальные клетки-хозяева включают клетки Е. coli и различные виды Streptomyces. Клетки-хозяева дрожжей включают клетки Schizosaccharomyces pombe, Saccharomyces cerevisiae и Pichia pastoris. В том случае, когда в клетки-хозяева млекопитающего вводят рекомбинантные векторы экспрессии, содержащие гены, кодирующие белки слияния на основе RAGE, белки слияния на основе RAGE получают при культивировании клеток-хозяев в течение периода времени, достаточного для экспрессии белка слияния на основе RAGE в клетках-хозяевах, или при секреции белка слияния на основе RAGE в культуральную среду, в которой растят клетки-хозяева. Белки слияния на основе RAGE могут быть восстановлены из культуральной среды с использованием стандартных методов очистки белка. Молекулы нуклеиновой кислоты, кодирующие белки слияния на основе RAGE, и векторы экспрессии, включающие указанные молекулы, могут использоваться для трансфекции подходящей клеткихозяина млекопитающего, растения, бактериальной или дрожжевой клетки-хозяина. Трансформация может быть осуществлена в рамках известных способов введения полинуклеотидов в клетку-хозяин. Способы введения гетерологичных полинуклеотидов в клетки млекопитающего известны в данной области и включают методы трансфекции с использованием декстрана, трансфекции, включающей осаждение фосфатом кальция, трансфекции, опосредованной использованием полибрена, путем слияния протопластов, с использованием метода электропорации, инкапсулирования одного или нескольких полинуклеотидов в липосомы и непосредственную микроинъекцию ДНК в ядра. Дополнительно молекулы нуклеиновой кислоты могут быть введены в клетки млекопитающего с помощью вирусных векторов. Способы трансформации растительных клеток известны в данной области и включают, например, трансформацию с использованием Agrobacterium, biolistic-трансформацию, непосредственную инъекцию, электропорацию и вирусную трансформацию. Способы трансформации бактериальных и дрожжевых клеток также известны в данной области. Вектор экспрессии также может быть доставлен в систему экспрессии с использованием технологии биолистики ДНК, в рамках которой плазмиду осаждают на микроскопические частицы, предпочти- 20017291 тельно частицы золота, и затем такие частицы направляют на целевую клетку или систему экспрессии. Стратегии на основе биолистики ДНК известны в данной области и коммерчески доступны устройства,например устройство для бомбардировки генов генное ружье, для доставки микрочастиц в клетку (например, доступные от компании Helios Gene Gun, Bio-Rad Labs., Hercules, CA) и на кожу (PMED Device,PowderMed Ltd., Oxford, UK). Экспрессия белков слияния на основе RAGE в клеточных линиях, способных к их продукции, может быть усилена с помощью большого числа известных методов. Например, в качестве таких принятых стратегий усиления экспрессии в определенных условиях может использоваться система экспрессии гена глютаминсинтетазы (GS система) и система резистентности к неомицину, кодируемая на уровне плазмы. Белки слияния на основе RAGE, экспрессируемые различными клеточными линиями, могут иметь свой отличный от других характер гликозилирования. Однако все белки слияния на основе RAGE, кодируемые молекулами нуклеиновой кислоты согласно настоящему изобретению или включающие аминокислотные последовательности согласно настоящему изобретению, являются составной частью изобретения независимо от характера гликозилирования белков слияния на основе RAGE. В одном варианте рекомбинантный вектор экспрессии может быть трансфицирован в клетки яичника китайского хомяка (СНО), после чего проводится оптимизация экспрессии. В альтернативных вариантах клетки могут продуцировать от 0,1 до 20 г/л, или от 0,5 до 10 г/л, или примерно 1-2 г/л. Как известно в данной области техники, такие конструкции нуклеиновой кислоты могут быть модифицированы за счет мутаций, например путем ПЦР-амплификации матрицы нуклеиновой кислоты с использованием праймеров, включающих соответствующую мутацию. В рамках данного способа могут быть созданы полипептиды, включающие лиганды RAGE с варьирующей аффинностью. В одном варианте мутированные последовательности могут быть на 90% или более идентичны исходной ДНК. В качестве таковых варианты могут включать нуклеотидные последовательности, которые гибридизуются в жестких условиях (т.е. в условиях, эквивалентных примерно температуре 20-27C ниже температуры плавления (Тпл) дуплекса ДНК в 1 молярном растворе соли). Кодирующая последовательность может быть экспрессирована при трансфекции вектора экспрессии в соответствующую клетку-хозяина. Например, рекомбинантные векторы могут быть стабильно трансфицированы в клетки яичника китайского хомяка (СНО), после чего могут быть отобраны и клонированы клетки, экспрессирующие белок слияния на основе RAGE. В одном варианте клетки, экспрессирующие рекомбинантную конструкцию, отбирают по резистентности к неомицину, кодируемой плазмидой, при внесении антибиотика G418. При этом могут быть отобраны отдельные клоны и клоны, экспрессирующие высокие уровни рекомбинантного белка, выявленные по результатам вестерн-блот анализа клеточного супернатанта, могут быть размножены, а генный продукт далее очищен аффинной хроматографией с использованием колонок с белком А. Некоторые варианты рекомбинантных нуклеиновых кислот, которые кодируют белки слияния на основе RAGE согласно настоящему изобретению, показаны на фиг. 2 и 3. Например, в соответствии с приведенным выше описанием, белок слияния на основе RAGE, продуцируемый рекомбинантной конструкцией ДНК, может включать полипептид RAGE, присоединенный ко второму полипептиду, отличному от полипептида RAGE. Белок слияния на основе RAGE может включать два домена, полученных из белка RAGE, и два домена, полученных из иммуноглобулина. Один из примеров конструкций нуклеиновой кислоты, кодирующих белок слияния на основе RAGE, TTP-4000 (TT4), имеющий указанный тип конструкции, показан на фиг. 2 (SEQ ID NO: 30 и SEQ ID NO: 54). Как следует из SEQ ID NO: 30 и SEQID NO: 54, кодирующая последовательность на участке 1-753 (выделенная жирным шрифтом) кодируетN-концевую белковую последовательность RAGE, тогда как последовательность на участке 754-1386 кодирует белковую последовательность IgG Fc без шарнирной области. В случае получения из SEQ ID NO: 30 или SEQ ID NO: 54 последовательности, которая по меньшей мере на 90% идентична ей, белок слияния на основе RAGE может включать четырехдоменную аминокислотную последовательностью SEQ ID NO: 32 или полипептид с удаленной сигнальной последовательностью (например, SEQ ID NO: 33, SEQ ID NO: 34 или SEQ ID NO: 56, фиг. 4). В SEQ ID NO: 33,SEQ ID NO: 34 или SEQ ID NO: 56 аминокислотная последовательность RAGE выделена жирным шрифтом. Иммуноглобулиновая последовательность представлена иммуноглобулиновыми доменами CH2 иCH3 из IgG, без шарнирной области. Как фиг. 6 проиллюстрированы результаты сравнения полипептидных доменов, имеющихся вRAGE и IgG (фиг. 6 А), а также показана доменная структура белков слияния на основе RAGE, TTP-3000 и ТТР-4000. Как видно из фиг. 6 В, первые 251 аминокислота в полноразмерном белке слияния ТТР-4000RAGE содержит в качестве полипептидной последовательности RAGE сигнальную последовательность,включающую аминокислоты на участке 1-22/23, V домен иммуноглобулина (включая сайт связывания лиганда), включающий аминокислоты на участке 23/24-116, междоменный линкер, включающий аминокислоты 117-123, второй иммуноглобулиновый домен (С 1), включающий аминокислоты на участке 124221 и междоменный линкер в направлении считывания информации, включающий аминокислоты на участке 222-251.- 21017291 В одном варианте белок слияния на основе RAGE может необязательно включать второй иммуноглобулиновый домен RAGE. Например, белок слияния на основе RAGE может включать один иммуноглобулиновый домен, полученный из RAGE, и два иммуноглобулиновых домена, полученных из человеческого полипептида Fc. Пример конструкций нуклеиновой кислоты, кодирующих белки слияния на основе RAGE данного типа, показан на фиг. 3 (SEQ ID NO: 31 и SEQ ID NO: 55). Как следует из SEQ IDNO: 31 и SEQ ID NO: 55, кодирующая последовательность на участке нуклеотидов 1-408 (выделенная жирным шрифтом) кодирует N-концевую белковую последовательность RAGE, a последовательность на участке 409-1041 кодирует белковую последовательность IgG1 Fc(1). В случае получения из SEQ ID NO: 31, или SEQ ID NO: 55, или последовательности, которая по меньшей мере на 90% им идентична, белок слияния на основе RAGE может включать трехдоменную аминокислотную последовательность SEQ ID NO: 35 или полипептид с удаленной сигнальной последовательностью (см., например, SEQ ID NO: 36, SEQ ID NO: 37 или SEQ ID NO: 57, фиг. 5). Как показано на фиг. 5, в SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37 или SEQ ID NO: 57 аминокислотная последовательность RAGE выделена жирным шрифтом. Как видно из фиг. 6 В, первые 136 аминокислот в полноразмерном белке слияния на основе RAGE, TTP-3000, содержат в качестве полипептида RAGE, сигнальную последовательность, включающую аминокислоты на участке 1-22/23, V домен иммуноглобулина(включая сайт связывания лиганда), включающий аминокислоты на участке 23/24-116, и междоменный линкер, включающий аминокислоты на участке 117-136. Последовательность на участке 137-346 включает иммуноглобулиновые домены CH2 и CH3 из IgG, без шарнирной области. Белки слияния на основе RAGE согласно настоящему изобретению могут демонстрировать повышенную стабильность in vivo относительно полипептидов RAGE, которые не содержат второй полипептид. Белок слияния на основе RAGE может быть далее модифицирован для повышения стабильности,эффективности, активности и биологической доступности. Так, белки слияния на основе RAGE согласно настоящему изобретению могут быть модифицированы за счет посттрансляционного процессинга или путем химической модификации. Например, белок слияния на основе RAGE может быть получен в рамках процедур синтеза, так чтобы он включал L-, D- или неприродные аминокислоты, -двузамещенные аминокислоты или N-алкиламинокислоты. Дополнительно белки могут быть модифицированы путем ацетилирования, ацилирования, АДФ-рибозилирования, амидирования, присоединения липидов, таких как фосфатидилинозит, за счет образования дисульфидных связей и т.п. Кроме того, может быть добавлен полиэтиленгликоль для повышения биологической стабильности белка слияния на основе RAGE. Связывание антагонистов RAGE с белками слияния на основе RAGE. Белки слияния на основе RAGE согласно настоящему изобретению могут найти применение в рамках различных стратегий. Например, белок слияния на основе RAGE согласно настоящему изобретению может использоваться в тесте на связывание, для идентификации лигандов RAGE, таких как агонисты,антагонисты или модуляторы RAGE. Например, в одном варианте настоящее изобретение относится к способу выявления модуляторовRAGE, включающему (а) получение белка слияния на основе RAGE, включающего полипептид RAGE,присоединенный ко второму полипептиду, отличному от RAGE, где полипептид RAGE включает сайт связывания лиганда; (b) смешивание исследуемого соединения и лиганда, обладающего связывающей аффинностью для RAGE, с белком слияния на основе RAGE; и (с) оценка уровня связывания известного лиганда RAGE с белком слияния на основе RAGE в присутствии исследуемого соединения. В данном варианте сайт связывания лиганда включает большую часть N-концевого домена белка слияния на основе RAGE. Белки слияния на основе RAGE могут быть также представлены в виде наборов для выявления модуляторов RAGE. Например, в одном варианте набор согласно настоящему изобретению может включать (а) соединение, обладающее уже выявленной связывающей аффинностью с RAGE, в качестве позитивного контроля; (b) белок слияния на основе RAGE, включающий полипептид RAGE, присоединенный к второму полипептиду, отличному от RAGE, где полипептид RAGE включает сайт связывания лигандаRAGE; и (с) инструкции по применению. В одном варианте сайт связывания лиганда RAGE включает большую часть N-концевого домена белка слияния на основе RAGE. Например, белок слияния на основе RAGE может использоваться в тесте на связывание для идентификации потенциальных лигандов RAGE. В одном иллюстративном варианте такого теста на связывание известный лиганд RAGE может быть нанесен на твердый субстрат (например, на планшеты Максисорб (Maxisorb в концентрации примерно 5 мкг на ячейку, где каждая ячейка содержит общий объем примерно 100 мкл. Планшеты инкубируют при температуре 4C в течение ночи для абсорбции лиганда. Альтернативно, могут использоваться более короткие сроки инкубации при более высоких температурах(например, при комнатной температуре). После истечения периода времени, необходимого для того, чтобы лиганд связался с субстратом, содержимое ячеек отсасывают и добавляют блокирующий буфер (например, 1% БСА в 50 мМ имидазольном буфере, рН 7,2) для блокирования неспецифического связывания. Например, блокирующий буфер может быть добавлен к планшетам на 1 ч при комнатной температуре. Далее содержимое ячеек в планшетах отсасывают и/или промывают промывочным буфером. В таком варианте может быть использован буфер, включающий 20 мМ имидазола, 150 мМ NaCl, 0,05% Твин- 22017291 20, 5 мМ CaCl2 и 5 мМ MgCl2, рН 7,2, в качестве промывочного буфера. Далее к экспериментальным ячейкам может быть добавлен белок слияния на основе RAGE в возрастающих разведениях. После этого белок слияния на основе RAGE инкубируют в экспериментальных ячейках с иммобилизованным лигандом, так чтобы было достигнуто равновесие по связыванию. В одном варианте белок слияния на основеRAGE инкубируют с иммобилизованным лигандом примерно в течение 1 ч при температуре 37C. В альтернативных вариантах используют более длительные периоды инкубации и при более низких температурах. По окончании инкубации белка слияния на основе RAGE и иммобилизованного лиганда планшет промывают для удаления несвязанного белка слияния. Связанный с иммобилизованным лигандом белок слияния на основе RAGE может быть выявлен различными способами. В одном варианте для такой детекции используют методику анализа по процедуре ELISA. Так, в одном варианте к белку слияния на основе RAGE, иммобилизованному в экспериментальной ячейке, может быть добавлен комплекс для иммунологической детекции, содержащий моноклональный мышиный IgG1 против человеческого компонента, биотинилированный козий антимышиный IgG и связанную с авидином щелочную фосфатазу. Комплекс для иммунологической детекции может быть подвергнут связыванию с иммобилизованным белком слияния на основе RAGE, так чтобы достигалось состояние равновесия в процессе связывания между белком слияния на основе RAGE и комплексом для иммунологической детекции. Например, указанный комплекс может быть подвергнут связывания с белком слияния на основе RAGE в течение 1 ч при комнатной температуре. В этой точке несвязанный комплекс может быть удален при промывке экспериментальных ячеек промывочным буфером. Связанный комплекс может быть выявлен при добавлении субстрата щелочной фосфатазы, паранитрофенилфосфата (ПНФФ (PNPP с последующим измерением уровня превращения ПНФФ в паранитрофенол (ПНФ (PNP, определяемого как повышение поглощения при длине волны 405 нм. В одном варианте лиганд RAGE связывается с белком слияния на основе RAGE с наномолярной(нМ) или микромолярной (мкМ) аффинностью. На фиг. 7 проиллюстрирован эксперимент, демонстрирующий связывание лигандов RAGE с белками слияния на основе RAGE согласно настоящему изобретению. Готовят растворы ТТР-3000 (TT3) и ТТР-4000 (ТТ 4) с исходными концентрациями 1,082 мг/мл и 370 мкг/мл соответственно. Как показано на фиг. 7, белки слияния на основе RAGE ТТР-3000 и ТТР-4000 в разных разведениях способны связываться с иммобилизованными лигандами RAGE амилоидом(Abeta) (Amyloid Beta (1-40) от Biosource), S100b (S100) и амфотерином (Ampho), что приводит к повышению уровня поглощения. В отсутствие лиганда (например, при нанесении покрытия только из БСА),не отмечается повышения поглощения. Тест на связывание согласно настоящему изобретению может использоваться для количественного определения уровня связывания лиганда с RAGE. В альтернативных вариантах лиганды RAGE могут связываться с белком слияния на основе RAGE согласно настоящему изобретению с показателями связывающей аффинности, варьирующими от 0,1 до 1000 нМ, или от 1 до 500 нМ, или от 10 до 80 нМ. Белок слияния на основе RAGE согласно настоящему изобретению может также использоваться для идентификации соединений, обладающих способностью связываться с RAGE. Как показано на фиг. 8 и 9, соответственно, лиганд RAGE может быть исследован на его способность конкурировать с иммобилизованным амилоид- за связывание с белками слияния на основе RAGE, ТТР-4000 (ТТ 4) и ТТР-3000(TT3). Так, можно видеть, что лиганд RAGE в конечной, используемой в тесте концентрации (FAC), равной 10 мкМ, может вытеснять белок слияния на основе RAGE в реакции его связывания с амилоидом- в концентрациях 1:3, 1:10, 1:30 и 1:100 относительно исходного раствора ТТР-4000 (фиг. 8) или ТТР-3000(фиг. 9). Модуляция клеточных эффекторов. Варианты белков слияния на основе RAGE согласно настоящему изобретению могут использоваться для модуляции биологического ответа, опосредованного RAGE. Например, могут быть созданы белки слияния с целью модуляции RAGE-индуцированного повышения их генной экспрессии. Так, в одном варианте белки слияния согласно настоящему изобретению могут использоваться для модуляции функций биологических ферментов. Например, взаимодействие между RAGE и лигандами может вызывать окислительный стресс и активацию NF-кВ и генов, регулируемых NF-кВ, таких как цитокины IL-1,TNF- и т.п. Дополнительно было показано, что некоторые другие регуляторные пути, такие как пути,вовлекающие p21ras, МАР-киназы, ERK1 и ERK2, активируются при связывании AGE и других лигандов с RAGE. Использование белков слияния согласно настоящему изобретению для модуляции экспрессии клеточного эффектора TNF- показано на фиг. 10. Миелоидные клетки ТНР-1 культивируют в среде RPMI 1640 с добавкой 10% ФСТ и индуцируют секрецию TNF- путем стимуляции RAGE с использованиемS100b. В случае такой стимуляции в присутствии белка слияния RAGE индукция TNF- за счет связывания S100b с RAGE может быть ингибирована. Так, на фиг. 10 показано, что добавление 10 мкг белка слияния на основе RAGE ТТР-3000 (TT3) или ТТР-4000 (ТТ 4) снижает индукцию TNF- под действиемS100b примерно на 50-75%. Белок слияния ТТР-4000 может быть, по меньшей мере, столь же эффективен по блокированию индукции TNF- под действием S100b, как и sRAGE (фиг. 10). Специфичность- 23017291 ингибирования последовательностей RAGE для ТТР-4000 и ТТР-3000 показана в эксперименте, в рамках которого добавляют один IgG к S100b-стимулированным клеткам. Добавление IgG и S100b к тесту приводит к тем же уровням TNF-, что и добавление одного S100b. В рамках другого клеточного теста оценивают способность ТТР-4000 препятствовать взаимодействию лиганда RAGE HMGB1 с RAGE и другими рецепторами HMGB1. В отличие от анти-RAGE антител,которые связываются с RAGE и препятствуют взаимодействию лиганда RAGE с RAGE, ТТР-4000 может блокировать взаимодействие лиганда RAGE с RAGE за счет связывания с лигандом RAGE. Сообщалось,что HMGB1 является лигандом для RAGE и Toll-подобных рецепторов 2 и 4 (Park et al., J Biol Chem.,2004; 279 (9): 7370-7). Все три указанных рецептора (RAGE, Toll-подобный рецептор 2 и Toll-подобный рецептор 4) экспрессируются на клетках ТНР-1 cells (Parker, et al., J Immunol, 2004, 172 (8): 4977-86). В данном эксперименте ТНР-1 клетки стимулируют к продукции TNF- путем добавления HMGB1HMGB1 должен быть единственным индуктором TNF-. Результаты, приведенные на фиг. 11, показывают, что анти-RAGE антитело и белок слияния на основе RAGE, TTP-4000, блокируют взаимодействиеHMGB1 продукцию TNF- в большей мере, чем это делает анти-RAGE антитело. Таким образом, полученные результаты показывают, что ТТР-4000 может ингибировать активность HMGB1 в большей степени, чем анти-RAGE антитело, за счет ингибирования взаимодействия HMGB1 с Toll-подобными рецепторами 2 и 4, а также с RAGE, присутствующим на ТНР-1 клетках. Физиологические характеристики белков слияния на основе RAGE. Хотя sRAGE может оказывать терапевтический эффект при модуляции RAGE-опосредованных заболеваний, человеческий sRAGE может иметь ограничения при использовании его в качестве обособленного терапевтического средства, определяемые относительно коротким периодом полувыведенияsRAGE из плазмы. Например, тогда как sRAGE грызунов имеет период полувыведения у нормальных и диабетических крыс, равный примерно 20 ч, человеческий sRAGE имеет период полувыведения менее чем 2 ч при оценке по сохранению иммунореактивности sRAGE (Renard et al., J. Pharmacol. Exp. Ther.,290: 1458-1466 (1999. Для достижения терапевтического эффекта RAGE, который имеет близкие к sRAGE характеристики по связыванию, но более стабильный фармакокинетический профиль, может быть использован белок слияния на основе RAGE, включающий сайт связывания лиганда RAGE, присоединенный к одному или нескольким иммуноглобулиновым доменам человека. Как известно в данной области, иммуноглобулиновые домены могут включать Fc часть тяжелой цепи иммуноглобулина.Fc часть иммуноглобулина может придавать некоторые свойства белкам слияния на основе RAGE. Например, белок слияния с Fc может повышать период полувыведения таких белков слияния из сыворотки, часто от нескольких часов до нескольких дней. Повышение фармакокинетической стабильности в основном представляет собой результат взаимодействия линкера, находящегося между участками CH2 иCH3 фрагмента Fc, с рецептором FcRn (Wines et al., J. Immunol., 164: 5313-5318 (2000. Хотя белки слияния, включающие полипептид Fc иммуноглобулина, могут обеспечивать преимущество, определяемое повышенной стабильностью, иммуноглобулиновые белки слияния могут вызывать воспалительный ответ при введении в организм хозяина. Воспалительный ответ может определяться в основном Fc частью иммуноглобулина в белке слияния. Провоспалительный ответ может быть желательным, если целевое соединение экспрессируется в пораженных заболеванием клетках, которые следует удалить (например, в раковой клетке или в популяции лимфоцитов, вызывающих аутоиммунное заболевание). Провоспалительный ответ может быть нейтральной особенностью, если целевое соединение представляет собой растворимый белок, поскольку большая часть растворимых белков не активирует иммуноглобулины. Однако провоспалительный ответ может быть отрицательным свойством, если целевое соединение экспрессируется в клетках такого типа, разрушение которых может привести к нежелательным побочным эффектам. Кроме того, провоспалительный ответ также может быть отрицательной характеристикой, если воспалительный каскад устанавливается в сайте связывания белка слияния с тканью-мишенью, поскольку многие медиаторы воспаления могут быть вредны для окружающей ткани и/или могут вызвать системные эффекты. Первичный провоспалительный сайт на иммуноглобулиновых Fc-фрагментах находится на шарнирном участке между CH1 и CH2. Данный шарнирный участок взаимодействует с FcR1-3, находящихся на разных лейкоцитах, и направляет эти клетки для атаки на мишень (Wines et al., J. Immunol., 164: 53135318 (2000. Белки слияния на основе RAGE при их использовании в качестве терапевтических препаратов для лечения RAGE-опосредованных заболеваний необязательно вызывают воспалительный ответ. Так, некоторые варианты белков слияния RAGE по настоящему изобретению могут включать белок слияния,включающий полипептид RAGE, присоединенный к иммуноглобулиновому домену (доменам), где Fc шарнирный участок в иммуноглобулине удален и замещен полипептидом RAGE. В этом случае взаимодействие между белком слияния на основе RAGE и Fc рецепторами на воспалительных клетках может- 24017291 быть минимизировано. Однако может быть важно поддерживать соответствующие сцепляющие свойства и другие формы взаимодействия, определяемые трехмерной структурой, между различными иммуноглобулиновыми доменами белка слияния на основе RAGE. Так, варианты белков слияния согласно настоящему изобретению могут замещать биологически инертный, но структурно близкий междоменный линкер RAGE, который разделяет V и C1 домены RAGE, или линкер, который разделяет C1 и C2 доменыRAGE в нормальном шарнирном участке тяжелой цепи иммуноглобулина. Так, полипептид RAGE в белке слияния на основе RAGE может включать последовательность междоменного линкера, которая в природном состоянии соответствует направлению считывания информации из иммуноглобулинового домена RAGE, с образованием иммуноглобулинового домена/инкерного фрагмента RAGE. В рамках данного способа, удается сохранять пространственные взаимодействия между иммуноглобулиновыми доменами,определяемыми RAGE или иммуноглобулином. В одном варианте белок слияния на основе RAGE согласно настоящего изобретению может вызывать существенное повышение фармакокинетической стабильности в сравнении с sRAGE. Например, как видно из фиг. 12, при насыщении ТТР-4000 белка слияния на основе RAGE, его лигандами, может сохраняться период полувыведения более 300 ч. Это резко отличается от величины периода полувыведения для sRAGE, который насчитывает лишь несколько часов в плазме человека. Таким образом, белки слияния на основе RAGE согласно настоящему изобретению могут использоваться для антагонизации в процессе связывания физиологических лигандов с RAGE и представлять собой средство лечения RAGE-опосредованных заболеваний, не вызывая неприемлемого уровня воспаления. Белки слиянии на основе RAGE согласно настоящему изобретению могут приводить к существенному снижению воспалительного ответа в сравнении с IgG. Например, как видно из фиг. 13, ТТР-4000,белок слияния на основе RAGE, не стимулирует высвобождение TNF- из клеток в условиях, при которых выявляется высвобождение TNF-, стимулированное человеческим IgG. Лечение заболевания белками слияния на основе RAGE. Настоящее изобретение может также включать способы лечения RAGE-опосредованного нарушения у человека. В одном варианте данный способ может включать введение субъекту белка слияния на основе RAGE, включающего полипептид RAGE, который включает сайт связывания лиганда RAGE,присоединенный ко второму полипептиду, отличному от RAGE. В некоторых вариантах композиция на основе RAGE включает лиофилизированный белок слияния на основе RAGE. В некоторых вариантах своего осуществления настоящее изобретение относится к способам лечения RAGE-опосредованного нарушения, включающим введение субъекту терапевтически эффективного количества восстановленной композиции, включающей белок слияния на основе RAGE, лиопротектор и буфер. В любом варианте осуществления настоящего изобретения белок слияния на основе RAGE может использоваться для лечения заболевания в составе терапевтических композиций и препаратов согласно настоящему изобретению. Таким образом, белок слияния на основе RAGE может включать последовательность, полученную из сайта связывания лиганда RAGE, которая присоединена к иммуноглобулиновому полипептиду. Различные варианты белков слияния на основе RAGE могут включать полипептидRAGE, непосредственно присоединенный к полипептиду, включающему CH2 домен иммуноглобулина или часть CH2 домена иммуноглобулина. В некоторых вариантах осуществления настоящего изобретения полипептид RAGE может включать междоменный линкер RAGE, присоединенный к иммуноглобулиновому домену RAGE, так что С-концевая аминокислота из иммуноглобулинового домена RAGE присоединяется к N-концевой аминокислоте междоменного линкера, и С-концевая аминокислота междоменного линкера RAGE непосредственно присоединяется к N-концевой аминокислоте полипептида, включающего CH2 домен иммуноглобулина или его часть. Например, в некоторых вариантах белок слияния может включать первый иммуноглобулиновый домен RAGE и первый междоменный линкер RAGE, присоединенные ко второму иммуноглобулиновому домену RAGE и второму междоменному линкеруRAGE, так что N-концевая аминокислота из первого мождоменного линкера присоединяется к Сконцевой аминокислоте первого иммуноглобулинового домена RAGE, N-концевая аминокислота второго иммуноглобулинового домена RAGE присоединяется к С-концевой аминокислоте первого междоменного линкера, N-концевая аминокислота второго междоменного линкера присоединяется к С-концевой аминокислоте второго иммуноглобулинового домена RAGE, и С-концевая аминокислота второго междоменного линкера RAGE непосредственно присоединяется к N-концевой аминокислоте иммуноглобулинового домена CH2 или части CH2 домена иммуноглобулина. В альтернативных вариантах настоящего изобретения, относящихся к полидоменному белку слияния, полипептид RAGE может включать аминокислотную последовательность, представленную в SEQID NO: 10, или последовательность, которая по меньшей мере на 90% ей идентична, или аминокислотную последовательность, представленную в SEQ ID NO: 47, или последовательноость, которая по меньшей мере на 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% ей идентична. В других альтернативных вариантах настоящего изобретения белок слияния на основе RAGE может включать аминокислотную последовательность, показанную, по меньшей мере, в виде одной из приведенных ниже последовательностей SEQID NO: 32, 33, 34, 35, 36, 37, 56 или 57, или последовательность, которая по меньшей мере на 70, 75, 80,85, 90, 95, 96, 97, 98 или 99% ей идентична. Например, в некоторых вариантах осуществления настоящего изобретения последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 32, 33, 34,56, 35, 36, 37 или 57, включает полипептид SEQ ID NO: 32, 33, 34, 56, 35, 36, 37 или 57 без С-концевого лизина. Или в других вариантах осуществления настоящего изобретения последовательность составляет белок слияния на основе RAGE, используемый в композициях согласно настоящему изобретению. В композиции белка слияния на основе лиофилизированного RAGE может использоваться множество лиопротекторов. В некоторых вариантах указанный лиопротектор может включать невосстанавливающий сахар. Например, невосстанавливающий сахар может включать сахарозу, маннит или трегалозу. Кроме того, в композиции белка слияния на основе лиофилизированного RAGE может использоваться множество буферов. В некоторых вариантах осуществления настоящего изобретения указанный буфер может включать гистидин. Лиофилизированный белок слияния на основе RAGE может включать дополнительные компоненты. В некоторых вариантах осуществления настоящего изобретения композиция белка слияния на основеRAGE может также включать по меньшей мере одно поверхностно-активное вещество, хелатирующий агент или наполнитель. В одном варианте восстановленная композиция белка слияния на основе RAGE включает примерно 40-100 мг/мл белка слияния на основе RAGE, который включает последовательность, представленную в SEQ ID NO: 32, 33, 34, 56, 35, 36, 37 или 57; от примерно 2 до примерно 50 мМ гистидина; от примерно 60 до примерно 65 мМ сахарозы; от примерно 0,001 до примерно 0,05% Твина 80; и характеризуются значением рН примерно от 6,0 до 6,5. Так, например, восстановленная композиция белка слияния на основе RAGE может в некоторых вариантах включать примерно 40-50 мг/мл белка слияния на основе RAGE, который включает последовательность, представленную в SEQ ID NO: 32, 33,34, 56, 35, 36, 37 или 57; примерно 10 мМ гистидина, примерно 65 мМ сахарозы, примерно 0,01% Твина 80 и характеризуются значением рН примерно 6,0. Или могут использоваться другие концентрации белка слияния на основе RAGE в композициях, применяемых для лечения RAGE-опосредованных нарушений,при наличии такой необходимости. Композиция белка слияния на основе RAGE может включать стабильный терапевтический агент,который вводится в композицию для целей его использования в клинической практике или в качестве лекарственного средства, предписанного врачом. Например, в некоторых вариантах композиция белка слияния на основе RAGE может демонстрировать уровень разложения после недели хранения при температуре 40C менее чем 10%, или менее чем 5%, или менее чем 3%. Кроме того, композиция белка слияния на основе RAGE может быть стабильной при ее восстановлении разбавителем. В некоторых вариантах в композиции белка слияния на основе RAGE в форме агрегата присутствует менее чем примерно 10, 5, 4, 3, 2 или 1% от белка слияния на основе RAGE. Восстановленная композиция белка слияния на основе RAGE может быть пригодна для введения разными способами и может осуществляться в соответствии с потребностью, определяемой лечениемRAGE-опосредованного рассматриваемого нарушения. Так, введение белка слияния на основе RAGE согласно настоящему изобретению может осуществляться внутрибрюшинной (в/б) инъекцией. Альтернативно, белок слияния на основе RAGE может вводиться перорально, интраназально или в форме аэрозоля. В другом варианте введение представляет собой внутривенное введение (в/в). Белок слияния на основе RAGE может также инъецироваться подкожно. В другом варианте осуществляют внутриартериальное введение белка слияния. В еще одном варианте введение осуществляется сублингвально. Кроме того, для введения могут использоваться капсулы с пролонгированным высвобождением. В еще одном варианте введение может быть трансректальным, например с использованием суппозиториев и т.п. Например, может использоваться подкожное введение, которое полезно для лечения хронических заболеваний в тех случаях, когда желательно самостоятельное введение. Как описано здесь более подробно, RAGE вовлекается в патогенез множества болезненных состояний, и было показано, что белки слияния на основе RAGE согласно настоящему изобретению являются эффективными в направлении ослабления таких болезненных состояний. Таким образом, композиции белков слияния на основе RAGE согласно настоящему изобретению могут использоваться при лечении большого числа RAGE-опосредованных нарушений. В некоторых вариантах осуществления настоящего изобретения восстановленная композиция белка слияния на основе RAGE согласно настоящему изобретению может использоваться для лечения симптома диабета или симптома осложнений диабета, опосредованных RAGE. Например, симптомы диабета или поздние осложнения диабета могут включать по меньшей мере одно из приведенных состояний: диабетическую нефропатию, диабетическую ретинопатию, диабетическую язву стопы, сердечнососудистые осложнения диабета или диабетическую невропатию. В других вариантах восстановленная композиция белка слияния на основе RAGE согласно настоящему изобретению может использоваться для лечения по меньшей мере одного из приведенных состояний: амилоидоза, болезни Альцгеймера, рака, почечной недостаточности или воспаления, ассоциированного с аутоиммунным процессом, воспалительной болезни кишечника, ревматоидного артрита, псориаза,рассеянного склероза, гипоксии, инсульта, сердечного приступа, геморрагического шока, сепсиса, транс- 26017291 плантации органа или нарушения заживления ран. Или в другом варианте восстановленная композиция белка слияния на основе RAGE согласно настоящему изобретению может использоваться для лечения остеопороза. Например, в некоторых вариантах введение композиции белка слияния на основе RAGE согласно настоящему изобретению повышает плотность кости у субъекта или уменьшает уровень снижения плотности кости у субъекта. В некоторых вариантах аутоиммунное нарушение, подлежащее лечению с использованием композиций белка слияния на основе RAGE, согасно настоящему изобретению может включать отторжение по меньшей мере одного из приведенных видов клеток: клетки кожи, клетки поджелудочной железы, нервные клетки, мышечные клетки, эндотелиальные клетки, клетки сердца, клетки печени, клетки почки,клетки костного мозга, костные клетки, клетки крови, клетки артерий, клетки вен, клетки хряща, клетки щитовидной железы или стволовые клетки. Или в другом варианте восстановленная композиция белка слияния на основе RAGE согласно настоящему изобретению может использоваться для лечения почечной недостаточности. В некоторых вариантах восстановленная композиция белка слияния на основе RAGE согласно настоящему изобретению может использоваться для лечения воспаления и/или отторжения, ассоциированного с трансплантацией по меньшей мере одного органа, ткани или множества клеток из первого сайта во второй сайт. Указанные первый и второй сайт могут находиться в разных организмах или могут присутствовать у одного и того же субъекта. Трансплантация множества клеток разного типа может быть облегчена с использованием композиций белка слияния на основе RAGE согласно настоящему изобретению. Например, трансплантированные клетки, ткань или орган могут включать клетку, ткань или орган из поджелудочной железы, кожи, печени, почки, сердца, костного мозга, крови, кости, мышцы, артерии,вены, хряща, щитовидной железы, нервной системы или стволовые клетки. Примеры использования белков слияния на основе RAGE согласно настоящему изобретению при лечении таких заболеваний и состояний описаны в настоящем тексте. Для подтверждения полезности использования соединений, модулирующих RAGE, в качестве лекарственных средств оценивались результаты их применения у разных животных, взятых в качестве соответствующих моделей. Примеры таких моделей включают:a) ингибирование под действием sRAGE образования неоинтимы на модели крыс с рестенозом после повреждения артерий как у диабетических, так и нормальных крыс, путем ингибирования активации эндотелия, гладких мышц и макрофагов посредством RAGE (Zhou et al., Circulation 107: 2238-2243RAGE, снижение образования амилоидных бляшек на модели мышей с системным амилоидозом (Yan etal., Nat. Med., 6: 643-651 (2000. Снижение амилоидных бляшек сопровождается снижением уровня воспалительных цитокинов, интерлейкина-6 (IL-6) и макрофагального колониестимулирующего фактора(М-КСФ), а также сниженной активацией NF-kB у опытных животных;c) RAGE-трансгенные мыши (при наличии суперэкспрессии RAGE и доминантных отрицательных экспрессоров RAGE) демонстрируют образование бляшек и нарушения распознавательной способности,в рамках модели мышей с БА (Arancio et al., EMBO J., 23: 4096-4105 (2004;d) использование sRAGE при лечении мышей с диабетом снижает проницаемость сосудов (Bonnardel-Phu et al., Diabetes, 48: 2052-2058 (1998;e) лечение с использованием sRAGE снижает уровень атеросклеротических повреждений у диабетических мышей с аполипопротеином E-null и предотвращает появление функциональных и морфологических признаков диабетической нефропатии у db/db мышей (Hudson et al., Arch. Biochem. Biophys., 419: 80-88 (2003); иf) sRAGE ослабляет тяжесть воспаления на модели мышей с артритом, индуцированным коллагеном (Hofmann et al., Genes Immunol., 3: 123-135 (2002, на модели мышей с экспериментальным аллергическим энцефаломиелитом (Yan et al., Nat. Med., 9: 28-293 (2003 и на модели мышей с воспалительным заболеванием кишечника (Hofmann et al., Cell., 97: 889-901 (1999. Таким образом, в одном варианте белки слияния на основе RAGE согласно настоящему изобретению могут использоваться для лечения симптома диабета и/или осложнений диабета, развивающихся как следствие диабета, опосредованного участием RAGE. Например, симптомы диабета или поздние осложнения диабета могут включать диабетическую нефропатию, диабетическую ретинопатию, диабетическую язву стопы, сердечно-сосудистые осложнения диабета или диабетическую невропатию. Первоначально идентифицированный как рецептор молекул, экспрессия которых ассоциирована с патологией диабета, сам по себе RAGE является обязательным компонентом в патофизиологии диабетических осложнений. Было показано, что ингибирование взаимодействия RAGE с его лигандом(ами) invivo оказывает терапевтический эффект на многих моделях диабетических осложнений и воспаления(Hudson et al., Arch. Biochem. Biophys., 419: 80-88 (2003. Например, лечение в течение двух месяцев с использованием антител против RAGE нормализовало почечную функцию и снизило аномальную гистопатологию почки у мышей с диабетом (Flyvbjerg et al., Diabetes., 53: 166-172 (2004. Кроме того, лечение с использованием растворимой формы RAGE (sRAGE), которая связывается с лигандами RAGE и инги- 27017291 бирует взаимодействия RAGE/лиганд, снижает выраженность атеросклеротических повреждений у диабетических мышей с аполипопротеином E-null и снижает функциональную и морфологическую патологию диабетической нефропатии у мышей db/db (Bucciarelli et al., Circulation., 106: 2827-2835 (2002. Кроме того, было показано, что неэнзиматическая гликоксидация макромолекул, приводящая в итоге к образованию конечных продуктов с повышенным гликозилированием (AGE), усиливается в сайтах воспаления, при почечной недостаточности, в случае гипергликемии и других состояний, ассоциированных с системным или локальным окислительным стрессом (Dyer et al., J. Clin. Invest., 91: 2463-2469Degenhardt et al., Cell. Mol. Biol., 44: 1139-1145 (1998. Накопление AGE в сосудистой сети может быть очаговым и осуществляться, например, в суставном амилоиде, состоящем из АСЕ-2-микроглобулина,обнаруженного у пациентов с амилоидозом, вызванным диабетом (Miyata et al., J. Clin. Invest., 92: 12431252 (1993); Miyata et al., J. Clin. Invest., 99: 1088-1094 (1996, или в основном встречается в сосудистой сети и ткани пациентов с диабетом (Schmidt et al., Nature. Med., 1: 1002-1004 (1995. Прогрессирующее накопление AGE с течением времени у пациентов с диабетом говорит о том, что механизмы эндогенного клиренса не способны эффективно функционировать в сайтах осаждения AGE. Такие аккумулированныеAGE обладают способностью менять клеточные свойства за счет множества механизмов. Хотя RAGE экспрессируется на низких уровнях в нормальных тканях и в сосудистой сети, было показано, что в среде, где накапливаются лиганды рецептора, RAGE подвергается позитивной регуляции (Li et al., J. Biol.Chem., 275: 25781-25790 (2000. Экспрессия RAGE повышается в эндотелии, гладкомышечных клетках и инфильтрующих моноядерных фагоцитах сосудистой сети при диабете. Кроме того, исследования с использованием клеточной культуры показали, что взаимодействие AGE-RAGE вызывает изменения клеточных свойств, важных для сосудистого гомеостаза. Использование белков слияния на основе RAGE при лечении патологий, связанных с диабетом,проиллюстрировано на фиг. 14. Белок слияния на основе RAGE, TTP-4000, оценивают на модели рестеноза у крыс с диабетом при проведении измерения пролиферации гладких мышц и размножения клеток интимы после поражения сосудистой сети. Как показано на фиг. 14, лечение с использованием ТТР-4000 существенно снижает соотношение интима/среда (И/С) (фиг. 14 А, табл. 1) на модели ассоциированного с диабетом рестеноза, зависимым от дозы способом. Кроме того, лечение с использованием ТТР-4000 существенно снижает ассоциированную с рестенозом пролиферацию гладкомышечных клеток сосудистой сети зависимым от дозы способом (фиг. 14 В). Таблица 1 Эффект ТТР-4000 на модели крыс с рестенозом Р 0,05 В качестве высокой и низкой дозы используется нагрузочная доза, равная 3 мг/животное. В других вариантах белки слияния на основе RAGE согласно настоящему изобретению могут также использоваться для лечения или реверсирования амилоидоза или болезни Альцгеймера. RAGE представляет собой рецептор для -амилоида (А), а также других амилоидогенных белков, включая SAA и амилин (Yan et al., Nature, 382: 685-691 (1996); Yan et al., Proc. Natl. Acad. Sci. USA., 94: 5296-5301 (1997);Yan et al., Nat. Med., 6: 643-651 (2000); Sousa et al., Lab. Invest., 80: 1101-1110 (2000. Кроме того, лиганды RAGE, включая AGE, S100b и А белки, найдены в ткани, окружающей старческие бляшки у человека (Luth et al., Cereb. Cortex., 15: 211-220 (2005); Petzold et al., Neurosci. Lett., 336: 167-170 (2003); Sasaki etal., Brain Res., 12: 256-262 (2001); Yan et al., Restor. Neurol. Neurosci., 12: 167-173 (1998). Было показано,что RAGE связывается с фибриллярным -складчатым, независимо от состава субъединиц (пептид амилоид , амилин, сывороточный амилоид А, прионовый пептид) (Yan et al., Nature., 382: 685-691 (1996);Yan et al., Nat. Med., 6: 643-651 (2000. Кроме того, было показано, что отложение амилоида приводит к усилению экспрессии RAGE. Например, в мозге пациентов с болезнью Альцгеймера (БА) экспрессияRAGE повышается в нейронах и глии (Yan et al., Nature., 382: 685-691 (1996. Одновременно с экспрес- 28017291 сией лигандов RAGE, RAGE подвергается позитивной регуляции в астроцитах и микроглиальных клетках в гиппокампе индивидуумов с болезнью Альцгеймера, но не у индивидуумов с выраженной позитивной регуляцией, которые не имеют БА (Lue et al., Exp. Neurol., 171: 29-45 (2001. Приведенные данные позволяют полагать, что клетки, экспрессирующие RAGE, активируются за счет взаимодействийRAGE/лиганд RAGE вблизи старческих бляшек. Кроме того, А-опосредованная активация клеток микроглии in vitro может блокироваться антителами, направленными против домена связывания лиганда вRAGE (Yan et al., Proc. Natl. Acad. Sci. USA., 94: 5296-5301 (1997. Было также показано, что RAGE может служить в качестве очаговой точки для сборки фибрилл (Deane et al., Nat. Med., 9: 907-913 (2003. Кроме того, ингибирование in vivo взаимодействия RAGE/лиганда с использованием sRAGE или антител против RAGE может снижать образование амилоидных бляшек на модели мышей с системным амилоидозом (Yan et al., Nat. Med., 6: 643-651 (2000. У двойных трансгенных мышей, осуществляющих суперэкспрессию человеческого RAGE и белка-предшественника человеческого амилоида (АРР) с мутациями Swedish и London (мутант hAPP), в нейронах развиваются дефекты обучения и нейропатологические аномалии раньше, чем в случае их hAPP трансгенных вариантов с одной мутацией. И наоборот,двойные трансгенные мыши со сниженной А сигнальной способностью за счет нейронов, экспрессирующих доминантную негативную форму RAGE на фоне того же мутанта hAPP, демонстрируют задержанное развитие аномалий процесса обучения в сравнении с их трансгенным вариантом, содержащим один АРР (Arancio et al., EMBOJ., 23: 4096-4105 (2004). Кроме того, было показано, что ингибирование взаимодействия RAGE-амилоид снижает экспрессию клеточного RAGE и маркеров клеточного стресса (а также активацию NF-B) и снижает отложение амилоида (Yan et al., Nat. Med., 6: 643-651 (2000, что указывает на возможную роль взаимодействияRAGE-амилоида в перестройке клеточных свойств в окружении, обогащенном амилоидом (даже на ранних стадиях), а также при накоплении амилоида. Таким образом, белки слияния на основе RAGE согласно настоящему изобретению могут также использоваться для лечения с целью снижения амилоидоза, числа амилоидных бляшек, а также познавательной дисфункции, ассоциированной с болезнью Альцгеймера (БА). Как указывалось выше, на модели животных с БА было показано, что sRAGE снижает как образование амилоидных бляшек в мозге, так и последующее повышение уровня воспалительных маркеров. На фиг. 15 А и 15 В показано, что мыши с БА, которых лечили в течение 3 месяцев с использованием ТТР-4000 или мышиного sRAGE, имеют сниженный уровень амилоид-бета (А) бляшек и менее выраженную познавательную дисфункцию, чем животные, которые получали носитель или человеческий IgG, в качестве отрицательного контроля(IgG1). Как и sRAGE, TTP-4000 может также снижать уровень воспалительных цитокинов IL-1 и TNF(данные не показаны), ассоциированный с БА. Кроме того, белки слияния на основе RAGE согласно настоящему изобретению могут использоваться для лечения атеросклероза и других сердечно-сосудистых нарушений. Так, было показано, что ишемическая болезнь сердца особенно часто встречается у пациентов с диабетом (Robertson et al., Lab.Invest., 18: 538-551 (1986); Kannel et al., J. Am. Med. Assoc, 241: 2035-2038 (1979); Kannel et al., Diab. Care,2: 120-126 (1979). Кроме того, в других исследованиях было показано, что атеросклероз у пациентов с диабетом развивается быстрее и более масштабно, чем у пациентов без диабета (см., например, Waller etal., Am. J. Med., 69: 498-506 (1980); Crall et al., Am. J. Med., 64: 221-230 (1978); Hamby et al., Chest, 2: 251257 (1976) и Pyorala et al., Diab. Metab. Rev., 3 463-524 (1978. Хотя имется множество разных причин ускоренного развития атеросклероза при диабете, было показано, что снижение уровня AGE может приводить к сниженному образованию бляшек. Например, белки слияния на основе RAGE согласно настоящему изобретению могут также использоваться при лечении инсульта. При сравнении результатов применения ТТР-4000 с sRAGE на релевантной модели животных для инсульта было показано, что ТТР-4000 обеспечивает значительно большее снижение объема некроза. В рамках данной модели среднюю сонную артерию мыши лигируют и затем проводят реперфузию с образованием зоны некроза. Для оценки эффективности белков слияния на основе RAGE согласно настоящему изобретению в плане лечения или предупреждения инсульта мышам перед реперфузией вводят sRAGE, или ТТР-4000, или контрольный иммуноглобулин. Как показано в табл. 2, ТТР-4000 был более эффективным, чем sRAGE по ограничению площади некроза у данных животных,что указывает на то, что ТТР-4000 в связи с его лучшими показателями полувыведения из плазмы способен оказывать большую защиту, чем sRAGE.
МПК / Метки
МПК: A61K 38/17, C07K 16/00, C12N 15/13, C07K 14/705, C12N 15/62
Метки: композиции, белки, основе, применения, rage, способы, слияния
Код ссылки
<a href="https://eas.patents.su/30-17291-belki-sliyaniya-na-osnove-rage-ih-kompozicii-i-sposoby-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Белки слияния на основе rage, их композиции и способы их применения</a>


































