Антитела против фактора роста эндотелия сосудов (vegf) и способы их применения
Номер патента: 12835
Опубликовано: 30.12.2009
Авторы: Лианг Вей-Чинг, Фах Жермен, Виесманн Кристиан, Сидха Сачдев С., Феллуз Фредерик А., Гербер Ханспитер
Формула / Реферат
1. Антитело или его Fab фрагмент, способные связываться с фактором роста эндотелия сосудов (VEGF) мыши и человека с величинами Kd, отличающимися не более чем в 10 раз, и способные ингибировать связывание VEGF с рецептором VEGF, причем функциональный эпитоп человеческого VEGF, с которым связываются антитело или его Fab фрагмент, содержит остатки F17, I83 и Q89.
2. Антитело или его Fab фрагмент, способные связываться с VEGF мыши и человека с величинами Kd, отличающимися не более чем в 10 раз, и ингибировать связывание VEGF с рецептором VEGF, причем функциональный эпитоп человеческого VEGF, с которым связываются антитело или его Fab фрагмент, содержит остатки F17 и M18 человеческого VEGF.
3. Антитело или его Fab фрагмент по п.2, связывающие функциональный эпитоп, содержащий остатки F17 и М18 и Q89 человеческого VEGF.
4. Антитело или его Fab фрагмент, способные связываться с VEGF мыши и человека с величинами Kd, отличающимися не более чем в 10 раз, и ингибировать связывание VEGF с рецептором VEGF, причем функциональный эпитоп человеческого VEGF, с которым связываются антитело или его Fab фрагмент, содержит остатки F17, Y21 и Y25.
5. Антитело или его Fab фрагмент по п.4, связывающие функциональный эпитоп, содержащий остатки F17, Y21, Q22, Y25, D63 и I83 человеческого VEGF.
6. Антитело или его Fab фрагмент по п.4, связывающие функциональный эпитоп, содержащий остатки F17, Y21, Y25 и Q89 человеческого VEGF.
7. Антитело или его Fab фрагмент по любому из пп.1-4, связывающие функциональный эпитоп, содержащий остатки F17, Y21, Q22, Y25, D63, I83 и Q89 человеческого VEGF.
8. Антитело или его Fab фрагмент по любому из пп.2-4, связывающие функциональный эпитоп, содержащий остатки F17, М18, D19, Y21, Y25, Q89, I91, K101, Е103 и С104 человеческого VEGF.
9. Антитело или его Fab фрагмент по любому из пп.1, 2 или 4, связывающие функциональный эпитоп, содержащий комбинацию остатков, выбранных из группы, состоящей из F17, М18, Y21, Q22, Y25, K48, D63, L66, М81, I83, Н86, Q89, I91, С104 и Р106 человеческого VEGF.
10. Антитело или его Fab фрагмент по любому из пп.2-4, связывающие функциональный эпитоп, содержащий остатки F17, М18, Y21, Q22, Y25, K48, D63, L66, М81, I83, Н86, Q89, I91, С104 и Р106 человеческого VEGF.
11. Антитело или его Fab фрагмент по любому из пп.1-10, где рецептор представляет собой VEGF рецептор 2 (KDR).
12. Антитело или его Fab фрагмент по любому из пп.1-10, где рецептор представляет собой VEGF рецептор 1 (Flt-1).
13. Антитело или его Fab фрагмент по любому из пп.1-10, способные ингибировать связывание VEGF с VEGF рецептором 1 и VEGF рецептором 2.
14. Антитело или его Fab фрагмент по любому из пп.1-10, способные связываться с мышиным и человеческим VEGF с величинами Kd, равными 10 нМ или ниже.
15. Антитело или его Fab фрагмент по любому из пп.1-10, способные связываться с мышиным и человеческим VEGF с величинами Kd, равными 2 нМ или ниже.
16. Антитело или его Fab фрагмент по любому из пп.1-10, способные связываться с человеческим VEGF с константой ассоциации (kon) 1.0 или выше (10 М-1с-1).
17. Антитело или его Fab фрагмент, способные связываться с VEGF мыши и человека с величинами Kd, отличающимися не более чем в 10 раз, и ингибировать связывание VEGF с рецептором VEGF, и содержащие последовательность CDR-H3 любого из антител на фиг. 2, 7, 24-29 и 34-43.
18. Антитело или его Fab фрагмент по п.17, дополнительно содержащие последовательность CDR-H1 и последовательность CDR-H2 любого из антител на фиг. 2, 7, 24-29 и 34-43.
19. Антитело или его Fab фрагмент по п.18, где:
(a) CDR-H1 содержит непрерывную аминокислотную последовательность DYWIH (SEQ ID NO: 261);
(b) CDR-H2 содержит непрерывную аминокислотную последовательность GITPAGGYTYYADSVKG (SEQ ID NO: 474) и
(c) CDR-H3 содержит непрерывную аминокислотную последовательность FVFFLPYAMDY (SEQ ID NO: 475).
20. Антитело или его Fab фрагмент по п.18, дополнительно содержащие вариабельный домен легкой цепи, содержащий CDR-L1, CDR-L2 и CDR-L3 следующей структуры:
(a) CDR-L1 содержит непрерывную аминокислотную последовательность RASQDVSTAVA (SEQ ID NO: 48);
(b) CDR-L2 содержит непрерывную аминокислотную последовательность SASFLYS (SEQ ID NO: 49) и
(c) CDR-L3 содержит непрерывную аминокислотную последовательность KQGFANPFT (SEQ ID NO: 940).
21. Антитело или его Fab фрагмент по п.18, где:
(a) CDR-H1 содержит непрерывную аминокислотную последовательность ASWIH (SEQ ID NO: 936);
(b) CDR-H2 содержит непрерывную аминокислотную последовательность GAIYPYSGYTN (SEQ ID NO: 937) и
(c) CDR-H3 содержит непрерывную аминокислотную последовательность WGHSTSPW (SEQ ID NO: 931).
22. Антитело или его Fab фрагмент по п.18, где:
(a) CDR-H1 содержит непрерывную аминокислотную последовательность GSWIF (SEQ ID NO: 938);
(b) CDR-H2 содержит непрерывную аминокислотную последовательность GAIWFFGGYTH (SEQ ID NO: 939) и
(c) CDR-H3 содержит непрерывную аминокислотную последовательностьWGHSTSPW (SEQ ID NO: 931).
23. Антитело или его Fab фрагмент, способные связываться с VEGF мыши и человека, с величинами Kd, отличающимися не более чем в 10 раз, где антитело способно ингибировать связывание VEGF с рецептором VEGF и содержит последовательности вариабельной области тяжелой цепи, или легкой цепи, или обеих цепей любого из антител на фиг. 2, 7, 24-29 и 34-43.
24. Антитело или его Fab фрагмент по п.23, содержащие следующую аминокислотную последовательность вариабельного домена тяжёлой цепи (VH) и первого константного домена тяжёлой цепи (СН1):

25. Антитело или его Fab фрагмент по п.23 или 24, содержащие следующую аминокислотную последовательность лёгкой цепи:

26. Антитело или его Fab фрагмент по п.23 или 24, содержащие следующую аминокислотную последовательность лёгкой цепи:

27. Антитело или его Fab фрагмент по п.23 или 24, содержащие следующую аминокислотную последовательность лёгкой цепи:

28. Антитело или его Fab фрагмент по п.23 или 24, содержащие следующую аминокислотную последовательность вариабельного домена легкой цепи (VL):

29. Антитело или его Fab фрагмент по п.23, содержащие следующую аминокислотную последовательность лёгкой цепи:

30. Антитело или его Fab фрагмент по п.23 или 29, содержащие следующую аминокислотную последовательность вариабельного домена тяжёлой цепи:
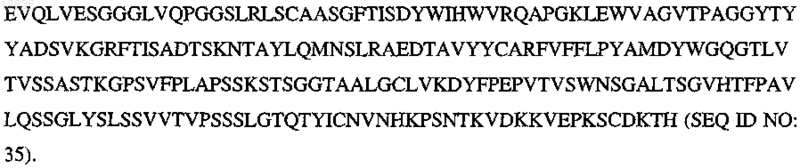
31. Антитело или его Fab фрагмент по п.23 или 29, содержащие следующую аминокислотную последовательность лёгкой цепи:
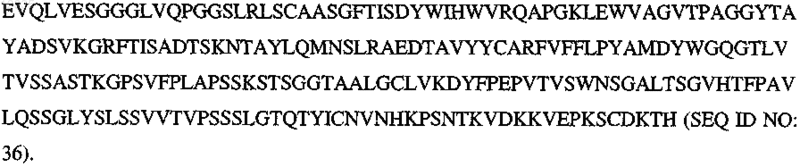
32. Антитело или его Fab фрагмент по п.23, содержащие следующую аминокислотную последовательность вариабельного домена тяжёлой цепи (VH):

33. Антитело или его Fab фрагмент по п.23 или 32, содержащие следующую аминокислотную последовательность лёгкой цепи:

или

34. Антитело или его Fab фрагмент по п.23, содержащие следующую аминокислотную последовательность вариабельного домена тяжёлой цепи (VH):

35. Антитело или его Fab фрагмент по п.23 или 34, содержащие следующую аминокислотную последовательность вариабельного домена легкой цепи (VL):

36. Антитело или его Fab фрагмент, способные связываться с VEGF мыши и человека с величинами Kd, отличающимися не более чем в 10 раз, и содержащие вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, в которых вариабельный домен тяжелой цепи содержит CDR-H1, CDR-H2 и CDR-H3 следующей структуры:
(a) CDR-H1 содержит непрерывную аминокислотную последовательность DYWIH (SEQ ID NO: 261);
(b) CDR-H2 содержит непрерывную аминокислотную последовательность GITPAGGYTYYADSVKG (SEQ ID NO: 474) и
(c) CDR-H3 содержит непрерывную аминокислотную последовательность FVFFLPYAMDY (SEQ ID NO: 475);
а вариабельный домен легкой цепи содержит CDR-L1, CDR-L2 и CDR-L3 следующей структуры:
(d) CDR-L1 содержит непрерывную аминокислотную последовательность RASQDVSTAVA (SEQ ID NO: 48);
(e) CDR-L2 содержит непрерывную аминокислотную последовательность SASFLYS (SEQ ID NO: 49) и
(f) CDR-L3 содержит непрерывную аминокислотную последовательность QQSYTTPPT (SEQ ID NO: 363),
причем указанные антитело или его Fab фрагмент способны ингибировать связывание VEGF с рецептором VEGF.
37. Антитело или его Fab фрагмент, способные связываться с VEGF мыши и человека с величинами Kd, отличающимися не более чем в 10 раз, и содержащие вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, в которых вариабельный домен тяжелой цепи содержит CDR-H1, CDR-H2 и CDR-H3 следующей структуры:
(a) CDR-H1 содержит непрерывную аминокислотную последовательность DYWIH (SEQ ID NO: 261);
(b) CDR-H2 содержит непрерывную аминокислотную последовательность GITPAGGYTYYADSVKG (SEQ ID NO: 474) и
(c) CDR-H3 содержит непрерывную аминокислотную последовательность FVFFLPYAMDY (SEQ ID NO: 475);
а вариабельный домен легкой цепи содержит CDR-L1, CDR-L2 и CDR-L3 следующей структуры:
(d) CDR-L1 содержит непрерывную аминокислотную последовательность RASQDVSTAVA (SEQ ID NO: 48);
(e) CDR-L2 содержит непрерывную аминокислотную последовательность SASFLYS (SEQ ID NO: 49) и
(f) CDR-L3 содержит непрерывную аминокислотную последовательность KQGYANPWT (SEQ ID NO: 143),
причем указанные антитело или его Fab фрагмент способны ингибировать связывание VEGF с рецептором VEGF.
38. Антитело или его Fab фрагмент, способные связываться с VEGF мыши и человека с величинами Kd, отличающимися не более чем в 10 раз, и содержащие вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, в которых вариабельный домен тяжелой цепи содержит CDR-H1, CDR-H2 и CDR-H3 следующей структуры:
(a) CDR-H1 содержит непрерывную аминокислотную последовательность DYWIH (SEQ ID NO: 261);
(b) CDR-H2 содержит непрерывную аминокислотную последовательность GITPAGGYTYYADSVKG (SEQ ID NO: 474) и
(c) CDR-H3 содержит непрерывную аминокислотную последовательность FVFFLPYAMDY (SEQ ID NO: 475);
а вариабельный домен легкой цепи содержит CDR-L1, CDR-L2 и CDR-L3 следующей структуры:
(d) CDR-L1 содержит непрерывную аминокислотную последовательность RASQDVSTAVA (SEQ ID NO: 48);
(e) CDR-L2 содержит непрерывную аминокислотную последовательность SASFLYS (SEQ ID NO: 49) и
(f) CDR-L3 содержит непрерывную аминокислотную последовательность QQGYGNPFT (SEQ ID NO: 52),
причем указанные антитело или его Fab фрагмент способны ингибировать связывание VEGF с рецептором VEGF.
39. Антитело или его Fab фрагмент, способные связываться с VEGF мыши и человека с величинами Kd, отличающимися не более чем в 10 раз, и содержащие вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, в которых вариабельный домен тяжелой цепи содержит CDR-H1, CDR-H2 и CDR-H3 следующей структуры:
(a) CDR-H1 содержит непрерывную аминокислотную последовательность DYWIH (SEQ ID NO: 261);
(b) CDR-H2 содержит непрерывную аминокислотную последовательность GITPAGGYTYYADSVKG (SEQ ID NO: 474) и
(c) CDR-H3 содержит непрерывную аминокислотную последовательность FVFFLPYAMDY (SEQ ID NO: 475);
а вариабельный домен легкой цепи содержит CDR-L1, CDR-L2 и CDR-L3 следующей структуры:
(d) CDR-L1 содержит непрерывную аминокислотную последовательность RASQDVSTAVA (SEQ ID NO: 48);
(e) CDR-L2 содержит непрерывную аминокислотную последовательность SASFLYS (SEQ ID NO: 49) и
(f) CDR-L3 содержит непрерывную аминокислотную последовательность QQGAGSPLT (SEQ ID NO: 68),
причем указанные антитело или его Fab фрагмент способны ингибировать связывание VEGF с рецептором VEGF.
40. Антитело или его Fab фрагмент, способные связываться с VEGF мыши и человека с величинами Kd, отличающимися не более чем в 10 раз, и содержащие вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, в которых вариабельный домен тяжелой цепи содержит CDR-H1, CDR-H2 и CDR-H3 следующей структуры:
(a) CDR-H1 содержит непрерывную аминокислотную последовательность ASWIH (SEQ ID NO: 936);
(b) CDR-H2 содержит непрерывную аминокислотную последовательность GAIYPYSGYTN (SEQ ID NO: 937) и
(c) CDR-H3 содержит непрерывную аминокислотную последовательность WGHSTSPW (SEQ ID NO: 931);
а вариабельный домен легкой цепи содержит CDR-L1, CDR-L2 и CDR-L3 следующей структуры:
(d) CDR-L1 содержит непрерывную аминокислотную последовательность RASQDVSTAVA (SEQ ID NO: 85);
(e) CDR-L2 содержит непрерывную аминокислотную последовательность SASFLYS (SEQ ID NO: 86) и
(f) CDR-L3 содержит непрерывную аминокислотную последовательность QQSYTTPPT (SEQ ID NO: 87),
причем указанные антитело или его Fab фрагмент способны ингибировать связывание VEGF с рецептором VEGF.
41. Антитело или его Fab фрагмент, способные связываться с VEGF мыши и человека с величинами Kd, отличающимися не более чем в 10 раз, и содержащие вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, в которых вариабельный домен тяжелой цепи содержит CDR-H1, CDR-H2 и CDR-H3 следующей структуры:
(a) CDR-H1 содержит непрерывную аминокислотную последовательность GSWIF (SEQ ID NO: 938);
(b) CDR-H2 содержит непрерывную аминокислотную последовательность GAIWPFGGYTH (SEQ ID NO: 939);
(c) CDR-H3 содержит непрерывную аминокислотную последовательность WGHSTSPW (SEQ ID NO: 931);
а вариабельный домен легкой цепи содержит CDR-L1, CDR-L2 и CDR-L3 следующей структуры:
(d) CDR-L1 содержит непрерывную аминокислотную последовательность RASQVIRRSLA (SEQ ID NO: 117);
(e) CDR-L2 содержит непрерывную аминокислотную последовательность AASNLAS (SEQ ID NO: 118) и
(f) CDR-L3 содержит непрерывную аминокислотную последовательность QQSNTSPLT (SEQ ID NO: 119),
причем указанные антитело или его Fab фрагмент способны ингибировать связывание VEGF с рецептором VEGF.
42. Антитело или его Fab фрагмент, способные связываться с VEGF мыши и человека с величинами Kd, отличающимися не более чем в 10 раз, и содержащие вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, в которых вариабельный домен тяжелой цепи содержит CDR-H1, CDR-H2 и CDR-H3 следующей структуры:
(a) CDR-H1 содержит непрерывную аминокислотную последовательность ASWIH (SEQ ID NO: 936);
(b) CDR-H2 содержит непрерывную аминокислотную последовательность GAIYPYSGYTN (SEQ ID NO: 937);
(c) CDR-H3 содержит непрерывную аминокислотную последовательность WGHSTSPW (SEQ ID NO: 931);
а вариабельный домен легкой цепи содержит CDR-L1, CDR-L2 и CDR-L3 следующей структуры:
(d) CDR-L1 содержит непрерывную аминокислотную последовательность RASQVIRRSLA (SEQ ID NO: 117);
(e) CDR-L2 содержит непрерывную аминокислотную последовательность AASNLAS (SEQ ID NO: 118);
(f) CDR-L3 содержит непрерывную аминокислотную последовательность QQSNTSPLT (SEQ ID NO: 119),
причем указанные антитело или его Fab фрагмент способны ингибировать связывание VEGF с рецептором VEGF.
43. Антитело или его Fab фрагмент, способные связываться с VEGF мыши и человека с величинами Kd, отличающимися не более чем в 10 раз, и ингибировать связывание VEGF с рецептором VEGF, содержащие последовательность CDR-H3, выбранную из группы, включающхщ: FVFFLPY (SEQ ID NO: 929), FVFFLPYAMDY (SEQ ID NO: 930), WGHSTSPW (SEQ ID NO: 931) и WGHSTSPWAMDY (SEQ ID NO: 932).
44. Антитело или его Fab фрагмент по любому из пп.1-43, отличающиеся тем, что антитело является моноклональным антителом.
45. Антитело или его Fab фрагмент по любому из пп.1-43, отличающиеся тем, что антитело является биспецифическим антителом.
46. Антитело или его Fab фрагмент по любому из пп.1-43, отличающиеся тем, что антитело является синтетическим антителом.
47. Антитело или его Fab фрагмент по любому из пп.1-43, способные связываться с VEGF человека с величиной Kd не более чем примерно 2 нМ.
48. Антитело или его Fab фрагмент по п.47, отличающиеся тем, что величина Kd составляет не более чем примерно 1 нМ.
49. Антитело или его Fab фрагмент по п.48, отличающиеся тем, что величина Kd составляет не более чем примерно 500 пМ.
50. Выделенная нуклеиновая кислота, кодирующая антитело или его Fab фрагмент по любому из пп.1-49.
51. Вектор, содержащий нуклеиновую кислоту по п.50.
52. Клетка-хозяин, содержащая вектор по п.51.
53. Способ получения антитела или его Fab фрагмента по любому из пп.1-49, включающий выращивание клетки-хозяина по п.52 в условиях, обеспечивающих экспрессию нуклеиновой кислоты, кодирующей антитело.
54. Способ по п.53, дополнительно включающий регенерацию антитела из культуры клетки-хозяина.
55. Способ по п.54, отличающийся тем, что антитело выделяют из культуральной среды клетки-хозяина.
56. Способ селекции антитела против hVEGF, которое способно связываться с VEGF мыши и человека с величинами Kd, отличающимися не более чем в 10 раз, и ингибировать связывание VEGF с рецептором VEGF, включающий:
а) создание библиотеки синтетических антител с заданным разнообразием по меньшей мере в одной из CDR;
б) обеспечение контактирования указанной библиотеки с VEGF человека;
в) отделение образовавшихся комплексов от свободных антител и VEGF человека, элюцию антител из указанных комплексов и их инкубацию в растворе с уменьшающимися количествами VEGF человека с концентрацией от примерно 0,1 до 1000 нМ и
г) отбор антител, которые могут связываться с VEGF человека в самых низких концентрациях и обладают аффинностью примерно 500 пМ-2 нМ.
57. Применение антитела или его Fab фрагмента по любому из пп.1-49 для лечения нарушения, обусловленного патологическим ангиогенезом у млекопитающего, нуждающегося в таком лечении.
58. Применение по п.57, отличающееся тем, что нарушение представляет собой рак, заболевание, вызванное окулярной неоваскуляризацией, поликистозное заболевание яичников, эндометриоз и фиброму матки.
59. Применение по п.58, отличающееся тем, что рак выбран из группы, включающей рак молочной железы, колоректальный рак, рак поджелудочной железы, немелкоклеточный рак лёгкого, неходжкинскую лимфому (NHL), рак почки, рак предстательной железы, рак печени, рак головы и шеи, меланому, рак яичников, мезотелиому и множественную миелому.
60. Способ лечения нарушения, обусловленного патологическим ангиогенезом у млекопитающего, включающий введение антитела или его Fab фрагмента по любому из пп.1-49 млекопитающему, нуждающемуся в таком лечении.
61. Способ по п.60, отличающийся тем, что лечение дополнительно включает введение второго терапевтического агента, выбранного из группы, состоящей из антиангиогенного агента, противоопухолевой композиции, химиотерапевтического агента и цитотоксического агента.
62. Способ по п.61, отличающийся тем, что антиангиогенный агент представляет собой антитело против VEGF человека, способное связываться с тем же VEGF эпитопом, что и антитело А4.6.1.
63. Применение по п.58, отличающееся тем, что нарушение, вызванное окулярной неоваскуляризацией, представляет собой диабетическую слепоту, ретинопатию, первичную диабетическую ретинопатию, возрастную дегенерацию жёлтого пятна или рубеоз.
64. Способ лечения млекопитающего, страдающего от повышенного риска развития воспалительного или иммунного нарушения, включающий введение млекопитающему антитела или его Fab фрагмента по любому из пп.1-49.
65. Способ по п.64, отличающийся тем, что воспалительное или иммунное нарушение представляет собой ревматоидный артрит, псориаз или псориатический артрит.
66. Способ лечения млекопитающего, страдающего от повышенного риска развития отека, включающий введение млекопитающему антитела или его Fab фрагмента по любому из пп.1-49.
67. Способ по п.66, отличающийся тем, что отек представляет собой церебральный отек, отек, связанный с опухолями мозга, или отек, связанный с инсультом.
68. Способ определения наличия VEGF в биологическом образце, включающий:
а) обеспечение контактирования образца с антителом по любому из пп.1-49 и
б) определение связывания антитела с образцом, что свидетельствует о наличии VEGF в образце.
69. Способ по п.68, отличающийся тем, что биологический образец представляет собой ткань, кровь, сыворотку или спинно-мозговую жидкость.
70. Диагностический набор, включающий контейнер и антитело или его Fab фрагмент по любому из пп.1-49.
71. Набор по п.70, дополнительно содержащий инструкции по применению антитела для определения наличия VEGF в биологическом образце.
72. Набор по п.71, где биологический образец представляет собой ткань, кровь, сыворотку или спинно-мозговую жидкость.
Текст
012835 Область техники Данное изобретение относится в общем к полипептидным последовательностям и антителам противVEGF с полезными свойствами для целей исследования, терапии и диагностики. Предпосылки создания изобретения Ангиогенез и VEGF. Ангиогенез является важным клеточным событием, при котором эндотелиальные клетки сосудов пролиферируют, удаляются и реорганизуются с образованием новых сосудов на основе ранее существовавшей сосудистой сети. Имеются неоспоримые доказательства того, что улучшение снабжения сосудов является обязательным для нормальных и патологических пролиферативных процессов (Folkman andKlagsbran (1987) Science 235: 442-447). Доставка кислорода и питательных веществ, а также удаление продуктов катаболизма представляют собой стадии, ограничивающие скорость в большинстве процессов роста, происходящих в многоклеточных организмах. Таким образом, общепринято, что сосудистый компартмент является необходимым, но не достаточным не только для развития органа и дифференцировки в процессе эмбриогенеза, но также для заживления ран и репродуктивных функций у взрослых. Ангиогенез также участвует в патогенезе различных нарушений, включая, но без ограничения, пролиферативные ретинопатии, возрастную дегенерацию жлтого пятна, опухоли, ревматоидный артрит(RA) и псориаз. Ангиогенез представляет собой каскадный процесс, состоящий из 1) деградации внеклеточного матрикса локального места после высвобождения протеазы; 2) пролиферации эндотелиальных клеток капилляров и 3) миграции капиллярных канальцев к ангиогенному раздражителю. Ferrara et al.(1992) Endocrine Rev. 13: 18-32. Ввиду большой важности ангиогенеза в физиологии и патологии большое количество работ посвящено выявлению факторов, способных регулировать этот процесс. Было предположено, что процесс ангиогенеза регулируется с помощью равновесия между про- и антиангиогенными молекулами и нарушается при различных заболеваниях, особенно при раке. Carmeliet and Jain (2000) Nature 407: 249-257. Сообщалось, что сосудисто-эндотелиальный фактор роста (VEGF), сильный митоген для эндотелиальных клеток сосудов, является основным регулятором как нормального, так и аномального ангиогенеза. Ferrara and Davis-Smyth (1997) Endocrine Rev. 18: 4-25; Ferrara (1999) J. Mol. Med. 77: 527-543. По сравнению с другими факторами роста, которые участвуют в процессе образования сосудов, VEGF является уникальным по своей специфичности в отношении эндотелиальных клеток в сосудистой системе. Недавно полученные данные показывают, что VEGF является необходимым для васкулогенеза. Carmelietet al. (1996) Nature 380: 435-439; Ferrara et al. (1996) Nature 380: 439-442. Кроме того, VEGF требуется для циклической пролиферации кровеносных сосудов. Ferrara et al. (1998) Nature Med. 4: 336-340; Gerber et al.(1999) Nature Med. 5: 623-628. Помимо того, что VEGF является ангиогенным фактором при ангиогенезе и васкулогенезе, он, в качестве плейотропного фактора роста, проявляет многие биологические эффекты в других биологических процессах, таких как продолжительность жизни эндотелиальных клеток, проницаемость и вазодилатация сосудов, хемотаксис моноцитов и инфлюкс калия. Ferrara and Davis-Smyth (1997), см. выше. Кроме того,недавно сообщалось о митогенном действии VEGF на некоторые типы не эндотелиальных клеток, такие как ретинальные пигментные эпителиальные клетки, клетки панкреатических протоков и клетки ШваннаEndocrinol. 126: 125-132; Sondell et al. (1999) J. Neurosci. 19: 5731-5740. Важное доказательство также подразумевает решающую роль VEGF в развитии состояний или заболеваний, которые включают патологический ангиогенез. мРНК VEGF сверхэкспрессируется большинством изученных человеческих опухолей (Berkman et al. J. Clin Invest 91: 153-159 (1993); Brown et al.Human Pathol. 26: 86-91 (1995); Brown et al. Cancer Res. 53: 4727-4735 (1993); Mattern et al. Brit. J. Cancer. 73: 931-934 (1996); и Dvorak et al., Am J. Pathol. 146: 1029-1039 (1995. Также концентрация VEGF в глазной жидкости хорошо коррелирует с наличием активной пролиферации кровеносных сосудов у пациентов с диабетической ретинопатией и другими типами ретинопатии, связанными с ишемией (Aiello etal. N. Engl. J. Med. 331: 1480-1487 (1994. Кроме того, недавние исследования продемонстрировали локализацию VEGF в хороидальных неоваскулярных мембранах пациентов, поражнных AMD (Lopez et al.Invest. Ophtalmo. Vis. Sci. 37: 855-868 (1996. Признание VEGF в качестве основного регулятора ангиогенеза при патологических состояниях привело к многочисленным попыткам блокировать активность VEGF. Ингибирование анти-VEGFрецепторных антител, растворимые рецепторные конструкции, антисмысловая стратегия, аптамеры РНК против VEGF и низкомолекулярные ингибиторы VEGF рецепторной тирозинкиназы (RTK) - все были предложены для применения в качестве препятствия передаче VEGF сигнала (Siemeister et al. Cancer Metastasis Rev. 17: 241-248 (1998. Действительно, показано, что нейтрализующие антитела против VEGF подавляют рост ряд человеческих опухолевых клеточных линий в бестимусных ("голых") мышах (Kim etRes. 56: 4032-4039 (1996); и Melnyk et al. Cancer Res. 56: 921-924 (1996 и также ингибируют интраокулярный ангиогенез на моделях ишемических ретинальных нарушений (Adamis et al. Arch. Ophthalmol. 114: 66-71 (1996. Следовательно, моноклональные антитела против VEGF или другие ингибиторы дей-1 012835 ствия VEGF являются весьма перспективными кандидатами для лечения солидных опухолей и различных интраокулярных неоваскулярных нарушений. Хотя молекула VEGF активируется в опухолевых клетках, а его рецепторы активируются в опухолевых инфильтрованных эндотелиальных клетках сосудов, экспрессия VEGF и его рецепторов остатся низкой в нормальных клетках, которые не ассоциируются с ангиогенезом. Терапевтические антитела. Моноклональные антитела можно получать методом рекомбинантной ДНК. Широкое применение нашли моноклональные антитела, в частности моноклональные антитела грызунов, однако нечеловеческие антитела часто являются антигенными в организме человека. В уровне техники делались попытки решить эту проблему путм создания "химерных" антител, в которых нечеловеческий антигенсвязывающий домен связан с человеческим константным доменом (Cabilly et al., патент США 4816567). Можно выбрать изотип человеческого константного домена, чтобы адаптировать химерное антитело к участию в антителозависимой клеточной цитотоксичности (ADCC, АЗКЦ) и в комплементзависимой цитотоксичности. При дальнейших попытках корригировать антигенсвязывающие функции и свести к минимуму применение гетерологичных последовательностей в человеческих антителах были получены гуманизированные антитела к различным антигенам, в которых последовательность, значительной меньшая, чем интактный человеческий вариабельный домен, заменена в областях на соответствующую последовательность нечеловеческого вида. Например, (CDR) остатки грызунов замещали соответствующие сегменты человеческого антитела. На практике гуманизированные антитела обычно представляют собой человеческие антитела, в которых некоторые остатки гипервариабельной области (CDR) и, возможно, некоторые остатки каркасной области (FR) заменены на остатки аналогичных сайтов антител грызунов. Jones et al.,Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-327 (1988); Verhoeyen et al. Science 239: 15341536 (1988). Было успешно получено несколько анти-VEGF антител, которые проявили заметную VEGFингибирующую активность как in vitro, так и in vivo. Presta et al. (1997) Cancer Research 57: 4593-4599;Chen et al. (1999) J. Mol. Biol. 293: 865-881. Одно специфичное гуманизированное анти-VEGF антитело,антитело Avastin, в настоящее время применяется в некоторых клинических испытаниях для лечения различных солидных опухолей; а другой высокоаффинный вариант гуманизированного анти-VEGF антитела в настоящее время проходит клинические испытания для лечения возрастной дегенерации жлтого пятна (AMD), связанной с хороидальной неоваскуляризацией. Перед применением терапевтического антитела для лечения человека обычно необходимы преклинические исследования для оценки эффективности и/или токсичности антитела. В идеале антитела, подвергающиеся таким исследованиям, способны распознавать и с высокой эффективностью реагировать с намеченным антигеном, эндогенным к животному-хозяину, такому как мышь или нечеловеческий примат. Фаговый дисплей. Метод фагового дисплея предоставил мощный инструмент для получения и селекции новых белков,которые связываются с лигандом, таким как антиген. Используя метод фагового дисплея, можно получать большие библиотеки вариантов белков и быстро отсортировать в них такие последовательности,которые связываются с нацеленным антигеном с высокой аффинностью. Нуклеиновые кислоты, кодирующие варианты полипептидов, сливается с нуклеотидной последовательностью, кодирующей оболочечный вирусный белок, такой как белок гена III или белок гена VIII. Получены моновалентные системы фагового дисплея, в которых нуклеотидные последовательности, кодирующие белок или полипептид,сливаются с нуклеотидной последовательностью, кодирующей часть белка гена III (Bass, S., Proteins, 8: 309 (1990); Lowman and Wells, Methods: A Companion to Methods in Enzymology, 3: 205 (1991. В моновалентной системе фагового дисплея наблюдаются низкие уровни экспрессии генного слияния, а также экспрессия белков гена III дикого типа, так что инфективность частиц сохраняется. Методы получения пептидных библиотек и скрининга этих библиотек раскрываются во многих патентах (например, в патентах США 5723286, 5432018, 5580717, 5427908 и 5498530). Демонстрация экспрессии пептидов на поверхности нитевидного фага и экспрессии функциональных фрагментов антитела в периплазме E.coli важно для развития фагового дисплея антител (Smith et al.,Science (1985), 228: 1315; Skerra and Pluckthun, Science (1988), 240: 1038). Библиотеки антител или антигенсвязывающих полипептидов получают различными путями, включая изменение единичного гена с помощью инсерции случайной ДНК-последовательности или клонированием семейства родственных генов. Методы визуализации антител или антигенсвязывающих фрагментов методом фагового дисплея описаны в патентах США 5575373, 5733743, 5837242, 5969108, 6172197, 5580717 и 5658727. Затем проводят скрининг библиотеки на экспрессию антител или антигенсвязывающих белков с заданными характеристиками. Метод фагового дисплея имеет ряд преимуществ перед обычными методами гибридом и рекомбинантными методами получения антител с заданными характеристиками. Этот метод позволяет создавать большие библиотеки антител с различными последовательностями за меньшее время и без использования животных. Получение гибридом или получение гуманизированных антител, весьма вероятно, может потребовать нескольких месяцев. Кроме того, так как не требуется никакой иммунизации, можно созда-2 012835 вать фаговые библиотеки антител для антигенов, которые являются токсичными или обладают низкой антигенностью (Hogenboom, Immunotechniques (1988), 4: 1-20). Можно также использовать фаговые библиотеки антител для создания и идентификации новых терапевтических антител. Библиотеки фагового дисплея использовали для создания человеческих антител при использовании иммунизированных, неиммунизированных людей, последовательностей зародышевой линии или популяции Ig наивных В клеток (BarbasBurton, Trends Biotech (1996), 14: 230; Griffiths et al., EMBO J.(1994), 13: 3245; Vaughan et al., Nat. Biotech. (1996), 14: 309; Winter EP 0368684 B1). Библиотеки антигенсвязывающих участков иммуноглобулинов, экспрессируемых наивными, или неимунными, клетками,получают с применением ряда лимфоидных тканей. Некоторые из этих библиотек выпускаются промышленно, как, например, библиотеки, полученные методом Cambridge Antibody Technology and Morphosys (Vaughan et al.(1996) Nature Biotech 14: 309; Knappik et al. (1999) J. Mol. Biol. 296: 57). Однако разнообразие многих из этих библиотек ограничено. Способность идентифицировать и изолировать высокоаффинные антитела с помощью библиотеки фагового дисплея важно для выделения новых антител для терапевтического применения. Выделение высокоаффинных антител при использовании библиотеки зависит от размера библиотеки, эффективности продуцирования в бактериальных клетках и разнообразия библиотеки. См., например, Knappik et al.,J. Mol. Biol. (1999), 296: 57. Размер библиотеки уменьшается при неэффективности продуцирования вследствие неподходящего складывания (скручивания) антитела или антигенсвязывающего белка и присутствия стоп-кодонов. Экспрессию в бактериальных клетках может быть ингибирована, если антитело или антигенсвязывающий домен складываются неподходящим образом. Экспрессию можно повысить с помощью мутаций остатков в поворотах на поверхности границы раздела вариабельной/константной областей, или в выбранных остатках CDR (Deng et al., J. Biol. Chem. (1994), 269: 9533, Ulrich et al., PNAS(1995), 92: 11907-11911; Forsberg et al., J. Biol. Chem. (1997), 272: 12430). Последовательность каркасной области является фактором обеспечения подходящего складывания, когда фаговые библиотеки антител продуцируются в бактериальных клетках. Создание разнообразной библиотеки антител или антигенсвязывающих белков также важно для изоляции высокоаффинных антител. Библиотеки с разнообразием в ограниченных CDR были созданы различными методами. См., например, Tomlinson, Nature Biotech. (2000), 18: 989-994. Области CDR3 отчасти представляют интерес, так как часто обнаруживается, что они участвуют в связывании с антигеном. Области CDR3 тяжлой цепи очень различны (меняются) по размеру, последовательности и структурной конформации. Можно создавать разнообразие рандомизацией CDR областей вариабельного домена тяжлой и лгкой цепей, используя все 20 аминокислот в каждом положении. Предполагалось, что применение всех 20 аминокислот даст в результате большое разнообразие последовательностей вариантов антител и повысит возможность идентификации новых антител (Barbas, PNAS 91: 3809 (1994); Yelton, D.E., J. Immunology, 155: 1994 (1995); Jackson, J.R., J. Immunology, 154: 3310 (1995) и Hawkins, R.E., J. Mol. Biology,226: 889 (1992. Также были предприняты попытки создать разнообразие, ограничивая группу аминокислотных замен в некоторых CDR, с целью отразить аминокислотное распределение в природных антителах. См.,например, GarrardHenner, Gene (1993), 128: 103; Knappik et al., J. Mol. Biol. (1999), 296: 57. Однако эти попытки проходят с переменным успехом, результаты не являются систематическими и количественными. Задачей было создание разнообразия в CDR при минимальном числе аминокислотных замен. Сущность изобретения Настоящее изобретение охватывает новые антитела и полипептидные последовательности. Настоящее изобретение также включает антитела, способные связываться с VEGF грызунов и человеческимVEGF с величинами Kd до 10-кратного (на порядок) увеличения каждого значения и способные ингибировать связывание VEGF с рецептором VEGF. Согласно одному варианту изобретения антитело способно связываться с любым, или с обоими, из Gly88Ala (G88A) или Gly88Ser (G88S) человеческих мутантных VEGF с величиной Kd в пределах значения, 10-кратного (на порядок выше) по сравнению с Kd немутантного человеческого VEGF. Настоящее изобретение охватывает антитела, способные связываться с человеческим VEGF и мышиным VEGF со значениями Kd, равными или более низкими чем 10 нМ при 25 С, и способные ингибировать связывание VEGF с рецептором VEGF. Согласно другому варианту изобретения значения Kd равны или ниже 2 нМ. Согласно другому варианту изобретения значения Kd равны или ниже 0.1 нМ. Согласно другому варианту изобретения антитело по данному изобретению связывает VEGF со значениями Kd не более примерно 1 нМ или не более примерно 500 пМ. Настоящее изобретение также охватывает антитела, которые способны связываться с человеческимVEGF и с любым, или с обоими, из G88A или G88S мутантов человеческого VEGF с величиной Kd 10 нМ или менее и которые способны ингибировать связывание VEGF с рецептором VEGF. В другом варианте изобретения антитела связываются с человеческим VEGF и с любым, или с обоими, из G88A илиG88S мутантов человеческого VEGF с величиной Kd 10 нМ или менее. Согласно другому варианту изобретения скорость ассоциации (kon) связывания антитела по данно-3 012835 му изобретению с человеческим и/или мышиным VEGF 1.0 или выше (10 M-1c-1). Согласно ещ одному варианту изобретения скорость ассоциации составляет 5.0 или более (10 M-1Vc-1). Согласно ещ одному варианту изобретения скорость ассоциации составляет 10.0 или более (10 M-1Vc-1). Согласно другому варианту изобретения антитела по данному изобретению контактируют менее чем с 80% общей площади поверхности (Ангстрем 2) G88 человеческого VEGF. Согласно другому варианту изобретения антитела по данному изобретению контактируют менее чем с 70% общей площади поверхности (Ангстрем 2) G88 человеческого VEGF. Согласно другому варианту изобретения антитела по данному изобретению контактируют менее чем с 60% общей площади поверхности (Ангстрем 2) G88 человеческого VEGF. Согласно другому варианту изобретения антитела по данному изобретению контактируют менее чем с 1% общей площади поверхности (Ангстрем 2) G88 человеческого VEGF. Такие антитела в общем способны также связываться с мышиным VEGF. Рецептор VEGF, связывание которого с VEGF нужно ингибировать, может быть VEGF рецептором 1 (Flt-1), VEGF рецептором 2 (KDR) или обоими рецепторами. Согласно одному варианту изобретения антитело по данному изобретению контактирует со спиралью из 20-30 остатков VEGF. Согласно ещ одному варианту изобретения антитело по данному изобретению контактирует со спиралью из 20-30 остатков VEGF и с петлй из 80-90 остатков человеческогоVEGF. Согласно одному варианту изобретения антитело по данному изобретению обладает относительной аффинностью к или способно контактировать с любым из остатков F17, М 18, Q22, Y25, D63, L66, С 104 и Р 106 человеческого VEGF. Согласно другому варианту изобретения антитело по данному изобретению обладает относительной аффинностью к или способно контактировать с F17, M18, Q22, Y25, D63, L66,С 104 и Р 106 человеческого VEGF. Согласно другому варианту изобретения антитело по данному изобретению обладает дополнительной относительной аффинностью к или способно контактировать с остатками F17 и Y21 человеческого VEGF. Согласно другому варианту изобретения антитело по данному изобретению обладает относительной аффинностью к или способно контактировать с Y25 VEGF. Согласно другому варианту изобретения антитело по данному изобретению обладает относительной аффинностью к или способно контактировать с M18 и Q89 человеческого VEGF. Согласно другому варианту изобретения антитело по данному изобретению обладает относительной аффинностью к или способно контактировать с M17, Y21 и Y25 человеческого VEGF. Согласно предпочтительному варианту изобретения антитело по данному изобретению представляет собой комбинацию из трх или более любых вышеописанных вариантов изобретения. В другом варианте изобретения антитело по данному изобретению содержит функциональный эпитоп по данному описанию. Согласно другому варианту изобретения функциональный эпитоп антитела по данному изобретению включает остатки F17 и I83 человеческого VEGF. Согласно другому варианту изобретения функциональный эпитоп включает остатки F17 и I83 и Q89 человеческого VEGF. Согласно одному варианту изобретения функциональный эпитоп антитела по данному изобретению включает остатки F17 и M18 человеческого VEGF. В другом варианте изобретения функциональный эпитоп включает остатки F17, М 18 и I89 человеческого VEGF. Согласно одному варианту изобретения функциональный эпитоп антитела по данному изобретению включает остатки F17, Y21 и Y25 человеческого VEGF. Согласно другому варианту изобретения функциональный эпитоп включает остатки F17, Y21, Q22, Y25,D63 и I83 человеческого VEGF. Согласно другому варианту изобретения функциональный эпитоп включает остатки F17, Y21, Y25 и Q89 человеческого VEGF. Согласно другому варианту изобретения функциональный эпитоп включает остатки F17, М 18, D19, Y21, Y25, Q89, I91, K101, E103 и С 104 человеческого VEGF. Согласно ещ одному варианту изобретения функциональный эпитоп включает остаткиF17, Y21, Q22, Y25, D63, I83 и Q89 человеческого VEGF. Функциональный эпитоп антитела по данному изобретению может включать комбинацию из любых остатков, выбранных из группы, состоящей из F17,М 18, Y21, Q22, Y25, K48, D63, L66, М 81, I83, Н 86, Q89, I91, С 104 и Р 106 человеческого VEGF. Согласно другому варианту изобретения функциональный эпитоп включает остатки F17, M18, Y21, Q22, Y25, K48,D63, L66, М 81, I83, Н 86, Q89, I91, С 104 и Р 106 человеческого VEGF. Согласно одному варианту изобретения антитело по данному изобретению содержит область CDRH3, включающую непрерывную аминокислотную последовательность X1X2FX4X5X6X7 (SEQ ID NO: 915),гдеX7 обозначает Y или F. Согласно другому варианту изобретения антитело дополнительно содержит область (участок) DRH2, включающую непрерывную аминокислотную последовательность GX2TPX5G (SEQ ID NO: 1), где Х 2 обозначает I или V либо другую гидрофобную аминокислоту и Х 5 обозначает любой аминокислотный остаток.-4 012835 Согласно ещ одному варианту изобретения антитело дополнительно содержит область (участок)CDR-H1, включающую непрерывную аминокислотную последовательность X1X2X3zIH (SEQ ID NO: 2),гдеX1 обозначает любой аминокислотный остаток;X12 обозначает Y или F; и Х 3 обозначает W или L. Согласно одному предпочтительному варианту изобретения антитело дополнительно содержит области CDR-L1, CDR-L2 и CDR-L3 любого из антител на фиг. 7. Согласно другому варианту изобретения участок CDR-L1 локализован приблизительно в остатках 28-33; участок CDR-L2 локализован приблизительно в остатках 50-55; участок CDR-L3 локализован приблизительно в остатках 91-96. Согласно другому варианту изобретения участок CDR-H1 локализован приблизительно в остатках 30-33; участокCDR-H2 локализован приблизительно в остатках 50-58; участок CDR-H3 локализован приблизительно в остатках 94-100 а. Согласно одному предпочтительному варианту изобретения антитело содержит каркасные области антитела G6, антитела G6-23 или антитела G6-31. Согласно другому варианту изобретения антитело содержит области CDR лгкой цепи или вариабельные области лгкой цепи антитела G6,антитела G6-23 или антитела G6-31. Согласно одному варианту изобретения антитело по данному изобретению представляет собой антитело, содержащее:(а) область (участок) CDR-L1, содержащую непрерывную аминокислотную последовательность(б) область (участок) CDR-L2, содержащую непрерывную аминокислотную последовательность Х 1 Х 2 Х 3 (SEQ ID NO: 917), где(с) область (участок) CDR-L3, содержащую непрерывную аминокислотную последовательностьX1 и Х 2 обозначают любую аминокислоту и Х 3 обозначает S или А. Согласно одному предпочтительному варианту изобретения антитело содержит каркасные области антитела В 20-4.1 или антитела В 20-4. Согласно другому варианту изобретения антитело содержит области CDR или вариабельную область тяжлой цепи В 20. Согласно другому варианту изобретения Х 1 Х 2 Х 3(SEQ ID NO: 917) области CDR-L2 кодируется X1ASX4LX6 (SEQ ID NO: 919), где Х 4 и Х 6 обозначают любую аминокислоту. Согласно другому варианту изобретения участок CDR-L1 локализован приблизительно в остатках 28-33; участок CDR-L2 локализован приблизительно в остатках 50-55; и участок CDRL3 локализован приблизительно в остатках 91-96. Согласно другому варианту изобретения участок CDRH1 локализован приблизительно в остатках 30-33; участок CDR-H2 локализован приблизительно в остатках 50-58; и участок CDR-H3 локализован приблизительно в остатках 94-100 а. Также рассматривается антитело, содержащее последовательность CDR-H3 любого из антител на фиг. 7, 24-29 и 34-43, и, возможно, дополнительно содержащее CDR-H2 и/или CDR-H1 того же антитела на фиг. 2, 7, 24-29 и 34-43. Также рассматривается антитело, выбранное из ряда, состоящего из антитела группы G6, антитела группы В 20, антитела группы YADS и антитела группы YS. Кроме того, другое антитело по данному изобретению представляет собой антитело, содержащее вариабельную область любого из антител на фиг. 2, 7, 24-29 и 34-43. Согласно одному предпочтительному варианту изобретения антитела по данному изобретению синтезируют скорее методами рекомбинантной ДНК, нежели непосредственно продуцируются гибридомой или образуют из последовательности антитела, продуцируемого гибридомой. В одном предпочтительном варианте изобретения антитело связывается с hVEGF с величиной Kd не более примерно 2 нМ,не более примерно 1 нМ или не более примерно 500 пМ. Согласно одному варианту изобретения антитело представляет собой моноклональное антитело. Согласно другому варианту изобретения антитело является полиспецифическим антителом (например, биспецифическим антителом). Ещ в одном варианте изобретения высокоаффинное анти-VEGF антитело также способно связываться с VEGF нечеловеческих млекопитающих с величиной Kd, сравнимой с или, по меньшей мере, в пределах значения, на порядок более высокого, чем величина Kd его связывания с hVEGF. Такие антитела с высокой аффинностью перекрстного связывания (между видами) особенно применимы для преклинического исследования, а также для целей диагностики и терапии. Некоторые антитела, предполагаемые для терапевтического применения, получены с применением нацеленного человеческого антигена в качестве иммуногена. Полученное антитело может быть "зависящим от вида", т.е. хотя оно специфически связывается с человеческим антигеном, оно может быть значительно менее эффективно при связывании с гомологом этого антигена в нечеловеческом млекопитающем. Это, как найдено в данном описа-5 012835 нии, остатся открытым, в особенности в тех случаях, когда на этом нечеловеческом млекопитающем должны проводиться преклинические испытания. Примером является анти-VEGF антитело, антителоAvastin, применяемое для лечения рака. Хотя антитело Avastin проявляет высокую аффинность связывания с человеческим VEGF (т.е. Kd 1.8 нМ), аффинность связывания с мышиным VEGF непригодна для проведения экспериментов на мышиных моделях. В одном аспекте антитела являются синтетическими антителами, содержащими по меньшей мере один вариант CDR в вариабельных доменах, причм вариант CDR содержит вариантную аминокислоту по меньшей мере в одном доступном для растворителя аминокислотном положении с большим разнообразием аминокислот, при этом вариантная аминокислота кодируется неслучайным набором кодонов и по меньшей мере 70% аминокислот, кодируемых неслучайным набором, являются нацеленными аминокислотами в данном положении в вариабельных доменах известных антител. Антитело может иметь вариабельный домен тяжлой цепи, который содержит по меньшей мере 1, 2 или 3 вариантных CDR, выбранных из группы, состоящей из CDR-H1, Н 2 и Н 3. Предпочтительно вариабельный домен тяжлой цепи содержит вариантный CDR-H3. Антитело может также содержать вариабельный домен лгкой цепи, который включает по меньшей мере 1, 2 или 3 вариантных CDR, выбранных из группы, состоящей из CDRL1, L2 и L3. Согласно другому варианту антитело по данному изобретению связывается с человеческим VEGF иVEGF грызунов с заданной аффинностью, но не связывается с любым или со всеми гомологами, родственными VEGF, выбранными из группы, состоящей из человеческого VEGF-B, человеческого VEGF-D и человеческого PIGF-2. Согласно одному предпочтительному варианту изобретения антитело по данному изобретению представляет собой комбинацию трх или более любых вышеописанных вариантов изобретения. Согласно другому варианту изобретения антитело Fab по настоящему изобретению конъюгируется с агентом,который повышает период полужизни Fab антитела. Согласно одному предпочтительному варианту изобретения агент представляет собой полипептид, содержащий последовательность DICLPRWGCLW. В предпочтительном варианте изобретения антитела по данному изобретению не связываются с PIGF,VEGF-D или VEGF-B. Изобретение также включает способ отбора hVEGF антитела из библиотеки синтетических антител,включающий: а) создание библиотеки синтетических антител с намеченным разнообразием по меньшей мере в одной из областей CDR; б) контактирование библиотеки с hVEGF с образованием связующих элементов; в) отделение связующих элементов от несвязующих, элюцию связующих из нацеленногоhVEGF и инкубацию связующих в растворе с уменьшающимися количествами нацеленного hVEGF с концентрацией от примерно 0.1 до 1000 нМ; и г) отбор связующих, которые могут связываться с нацеленным hVEGF, находящимся в самых низких концентрациях, и которые обладают аффинностью примерно 500 пМ-2 нМ. Также рассматриваются варианты синтетических антител с повышенной аффинностью связывания с hVEGF, или с VEGF нечеловеческого вида, или с обоими. В данном описании рассматриваются различные формы антитела и его варианты. Например, мутантное антитело может быть полноразмерным антителом (например, содержащим константную область человеческого иммуноглобулина) или фрагментом антитела (например, Fab или F(ab')2). Кроме того, мутантное антитело может быть мечено детектируемой меткой, иммобилизовано на тврдой фазе и/или конъюгировано с гетерологичным соединением (таким как цитотоксический агент). Рассматривается применение антитела в диагностике и терапии. В одном варианте диагностического применения изобретение включает способ определения присутствия важного (представляющего интерес) белка, заключающийся в экспозиции образца, предположительно содержащего белок, с мутантным антителом и в определении связывания мутантного антитела с образцом. Для подобного применения данное изобретение предусматривает набор, содержащий мутантное антитело, и инструкции по применению мутантного антитела для детектирования белка. Далее данное изобретение включает выделенную нуклеиновую кислоту, кодирующую антитело; вектор, содержащий нуклеиновую кислоту, возможно, функционально связанную с регуляторными последовательностями, распознаваемыми клеткой-хозяином, трансформированной с помощью вектора; клетку-хозяина, трансформируемую с помощью вектора; способ продуцирования антитела, включающий культивирование этой клетки-хозяина таким образом, чтобы экспрессировалась нуклеиновая кислота, и,возможно, регенерацию мутантного антитела из культуры клетки-хозяина (например, из культуральной среды клеток-хозяев). Изобретение также включает композицию, содержащую антитело и фармацевтически приемлемый носитель или разбавитель. Эта композиция для терапевтического применения является стерильной и может быть лиофилизирована. Также рассматривается применение антитела или полипептида по данному изобретению для получения препарата для лечения показания по данному описанию. Композиция может дополнительно содержать второй терапевтический агент, такой как химиотерапевтический агент, цитотоксический агент или антиангиогенный агент. Кроме того, данное изобретение включает способ лечения млекопитающего, заключающийся во-6 012835 введении млекопитающему эффективного количества антитела. Млекопитающее для лечения по данному способу может быть нечеловеческим млекопитающим, например приматом, подходящим для сбора преклинических данных, или грызуном (например, мышью, или крысой, или кроликом). Нечеловеческое млекопитающее может быть здоровым (например, в токсикологических исследованиях) или может страдать от нарушения, которое следует лечить представляющим интерес антителом. В одном варианте изобретения млекопитающее страдает от или имеет повышенный риск развития аномального ангиогенеза(например, патологического ангиогенеза). В одном конкретном варианте изобретения нарушение представляет собой рак, выбранный из группы, состоящей из колоректального рака, почечно-клеточной карциномы, рака яичников, рака лгкого, немелкоклеточного рака лгкого (NSCLC), бронхоальвеолярного рака и рака поджелудочной железы. В одном варианте изобретения нарушением является болезнь, вызванная окулярной неоваскуляризацией, например, диабетическая слепота, первичная диабетическая ретинопатия, возрастная дегенерация жлтого пятна и рубеоз. В другом варианте изобретения млекопитающее страдает от или имеет повышенный риск развития отка (например, отка, обусловленного опухолями мозга, отка, обусловленного ударом, или церебрального отка). В другом варианте изобретения млекопитающее страдает от или имеет повышенный риск развития нарушения или заболевания, выбранного из группы, состоящей из ревматоидного артрита, воспалительного кишечного заболевания, стойкого асцита, псориаза, саркоидоза, артериального артериосклероза, сепсиса, ожогов и панкреатита. Согласно другому варианту изобретения млекопитающее страдает от или имеет повышенный риск развития заболевания мочеполовой системы, выбранного из группы, состоящей из поликистозного заболевания яичников (POD), эндометриоза и фибромы матки. Количество вводимого антитела является количеством,терапевтически эффективным для лечения нарушения. В исследованиях с увеличением дозы млекопитающему можно вводить различные дозы антитела. В другом варианте изобретения терапевтически эффективное количество антитела вводят больному человеку для лечения нарушения у этого пациента. В одном предпочтительном варианте изобретения антитела по данному изобретению, применимые для лечения воспалительных или иммунных заболеваний по данному описанию (например, ревматоидного артрита), представляют собой Fab или scFv антитела, в особенности антитела Fab или scFv из антител группы G6 или В 20. Антитела, которые не вызывают агрегации VEGF и не агрегируются сами, такие как антитела группы В 20 класса IgG, особенно применимы для лечения воспалительных или иммунных заболеваний. Следовательно, такие антитела можно использовать при получении лекарственного препарата для лечения воспалительного или иммунного заболевания. Млекопитающее, страдающее от или имеющее повышенный риск развития нарушения или болезни по данному описанию, можно лечить, вводя второй терапевтический агент одновременно, последовательно или в комбинации с антителом по данному изобретению. Следует понимать, что в дополнение ко второму терапевтическому агенту можно вводить млекопитающему или использовать в производстве лекарственного препарата для этих показаний другие терапевтические агенты. Эти антитела и полипептиды можно применять для выяснения роли участия стромальных клетокхозяев в росте имплантированных "опухолей-не-хозяев", как, например, в мышиных моделях, которым имплантированы человеческие опухоли. Эти антитела и полипептиды можно применять в методах идентификации человеческих опухолей, при которых можно избежать анти-VEGF лечения, наблюдая или контролируя рост опухоли, имплантированной грызуну или кролику после лечения анти-VEGF антителами по данному изобретению. Антитела и полипептиды по данному изобретению можно также использовать для изучения и оценки комбинированной терапии с применением анти-VEGF антител по данному изобретению и других терапевтических агентов. Антитела и полипептиды по данному изобретению можно использовать для изучения роли VEGF в других заболеваниях, вводя антитела и полипептиды животному, страдающему от заболевания, и определения, облегчаются ли один или более симптомов данного заболевания. Краткое описание фигур Фиг. 1 представляет собой схематическую иллюстрацию различных типов фрагментов антитела,используемых в фаговом дисплее. На фиг. 2 сравниваются изменения в CDR тяжлой цепи антитела h4D5 матрицы и четырх выбранных новых синтетических антител (SEQ ID NO: 921-928). Также сравнивается связывание четырх антител с VEGF. На фиг. 3 показана способность рецепторов VEGF (Flt1-d2 и KDR) блокировать связывание новых анти-VEGF антител с VEGF. В качестве контроля используют Y0959A, анти-VEGF вариант. На фиг. 4 показано, что антитело G6 специфично связывается как с hVEGF, так и с mVEGF, но не с родственными VEGF антигенами. На фиг. 5 показано, что G6 эффективно блокирует как связывание hVEGF, так и связываниеmVEGF с KDR рецептором. В качестве контроля используют Fab-12 и Y0317. На фиг. 6 показано действие G6 на индуцированную VEGF пролиферацию HUVEC. На фиг. 7 проиллюстрированы стадии образования высокоаффинных анти-VEGF антител и дан список остатков и аффинностей связывания с различными G6 вариантами с повышенной (улучшенной) аффинностью (SEQ ID NO: 44-84).-7 012835 На фиг. 8 дано сравнение связывания с VEGF G6, G6-23 и Fab-12. Скорость ассоциации (on rate) какhVEGF, так и mVEGF измеряют во времени; приводятся расчтные kon, koff и Kd. На фиг. 9 сравниваются скорости ассоциации (при связывании) с VEGF G6 и дополнительно усовершенствованных вариантов G6-23. На фиг. 10 показано влияние антагонистов VEGF (G6-23 и Ftl1-3Fc) на вес тела и выживание новорожднных мышей. На фиг. 11 показано действие G6-23 на рост опухоли у бестимусных ("голых") мышей с ксенотрансплантированными человеческими опухолевыми клетками (клетками KM12 и клетками SW480),определяемое объмом опухоли в зависимости от дней лечения. На фиг. 12 показана экспрессия VEGF (как hVEGF, так и mVEGF) в ксенотрансплантате KM12 мышей в присутствии или отсутствие G6-23. На фиг. 13 показано влияние антагонистов VEGF (G6-23 и Ftl1-3Fc) на рост опухоли у бестимусных мышей с ксенотрансплантированной мышиной опухолью (LL2), определяемое объмом опухоли в зависимости от дней лечения. На фиг. 14 А и В показаны кодоны, предназначенные для считывания кодонов G6 и G6-23 методом дробовика ("шотган"-эксперимент). В случае каждого считывания вырожденные методом шотган кодоны для (А) тяжлой и (В) лгкой цепи предназначены для кодирования дикого типа аминокислоты и аланина(m1) при замене на аланин (alanine-scan) или аналогичную аминокислоту (m4) при замене на гомологи(homolog-scan) как для G6, так и для G6-23 Fab. Считываемые при шотган-эксперименте кодоны представлены с помощью кода IUB (K=G/T, M=A/C, R=A/G, S=G/C, V=A/C/G, W=A/T, Y=C/T). Большее количество замен (m2, m3 и m5) в некоторых остатках вызвано природой генетического кода. В случае аланина дикого типа "шотган-кодон" (кодон, считываемый в шотган-эксперименте) предназначен для кодирования аланина и глицина. Каждый остаток в CDR обозначается с помощью однобуквенного кода для аминокислоты, затем идт число, обозначающее е положение по номенклатуре Kabat et al., 1987. Положения, в которых последовательности G6 и G6-23 различаются, показаны двумя буквами, например,Q89K обозначает положение 89, которое занимает Gln или Lys в G6 или G6-23, соответственно. Звздочкамипоказаны считываемые кодоны как для аланина, так и для гомолога, кодирующие обычную замену. На фиг. 15 приводятся сведения о создании библиотек G6 и G6-23 со считыванием методом дробовика (шотган). Библиотеки со считыванием методом дробовика создают с целью мутировать кодоны для указанных остатков в тяжлой (hc) или лгкой (1 с) цепи G6 и G6-23 с применением "шотган-кодонов" для замены на аланин или гомолог (фиг. 14 А и 14 В). Всего создано восемь библиотек с применением мутагенных олигонуклеотидов, показанных в примере 1. Теоретическое разнообразие каждой библиотеки, общее число комбинаций аминокислот, кодируемых мутагенными олигонуклеотидами, превышает по меньшей мере в 100 раз существующее в настоящее время разнообразие создаваемой библиотеки. На фиг. 16 А и 16 В показаны результаты сканирования (считывания) методом шотган тяжлой цепиG6 и G6-23. Влияние каждой мутации (фиг. 14 А и В) на CDR остатки тяжлой цепи (A) G6 и (В) G6-23 оценивают, рассчитывая отношения wt/mut (масса/мутация) с применением последовательностей функциональных клонов, либо с помощью библиотек для замены на аланин (ml, m2, m3), либо библиотек для замены на гомолог (m4 и m5), выделенных после отбора по связыванию либо с hVEGF (нацеленный отбор), либо с анти-gG tag антителом (отбор с визуализацией, дисплей-отбор). Для количественной оценки воздействия каждой мутации на аффинность связывания G6 и G6-23 с hVEGF отношение функций(Fwt/mut) в каждом сайте мутации получают делением отношения Fwt/mut при нацеленном отборе на это отношение при отборе с визуализацией (дисплей-отборе). Вредные воздействия указываются значениямиFwt/mut выше 1.0, а мутации, которые вызывают заметные разрушительные воздействия (Fwt/mut 10),выделены жирным шрифтом. Некоторые мутации не наблюдаются при нацеленном отборе и для ихwt/mut отношения можно определить лишь нижний предел; поэтому значение Fwt/mut указывается как более значительный показатель. На фиг. 17 А и В показаны результаты сканирования (считывания) методом шотган лгкой цепи G6 и G6-23. Влияние каждой мутации (фиг. 14 А и В) на CDR остатки лгкой цепи (A) G6 и (В) G6-23 оценивают, рассчитывая отношения wt/mut (масса/мутация) с применением последовательностей функциональных клонов, либо с помощью библиотек для замены на аланин (m1, m2, m3), либо библиотек для замены на гомолог (m4 и m5), выделенных после отбора по связыванию либо с hVEGF (нацеленный отбор), либо с анти-gG tag антителом (отбор с визуализацией, дисплей-отбор). Для количественной оценки воздействия каждой мутации на аффинность связывания G6 и G6-23 с hVEGF отношение функций(Fwt/mut) в каждом сайте мутации получают делением отношения Fwt/mut при нацеленном отборе на это отношение при отборе с визуализацией (дисплей-отборе). Вредные воздействия указываются значениямиFwt/mut выше 1.0, а мутации, которые вызывают заметные разрушительные воздействия (Fwt/mut 10),выделены жирным шрифтом. На фиг. 18 датся сравнение активностей связывания FabG6 и G6 с точковыми мутациями с hVEGF с величинами функций (Fwt/mut) с применением считывания с помощью шотган-эксперимента. Относительные активности связывания каждого мутантного белка с hVEGF оценивают отношениемIC50,mut/IC50,wt, мерой уменьшения складок при активности связывания с hVEGF, вызванного каждой точковой мутацией. Значения IC50,wt для G6 и G6-23 равны 2.5 нМ и 20 пМ соответственно. По оценкам ошибка в соотношении, не вводящем стандартную ошибку, составляет 5%. Отношения для заметно вредных мутаций нельзя рассчитать точно, так как при наивысшей концентрации hVEGF (1 и 0.1 мкМ для G6 и G6-23 соответственно), применяемой в анализе, не наблюдается никакого ингибирования, и это отношение было показано только в виде нижнего предела (400 и 5000 для мутантных G6 и G6-23 соответственно) уменьшения складок при связывании с hVEGF. Значения функций (Fwt/mut) для шотган-эксперимента взяты из фиг. 16 и 17. Значения DDGmut-wt для обоих методов сканирования мутагенеза рассчитывают по уравнению, приведнному в пояснении к фиг. 22 А и В. На фиг. 19 даны относительные аффинности связывания, так как, по определению методом фагового ELISA, hVEGF1-109 мутант фага с единичной аланиновой заменой связывается с различными вариантами анти-hVEGF антител или hVEGF рецепторов (G6, G6-23 и В 20-4 Fab, моноклональным антителом А 4.6.1 и рецепторами Flt-1 (1-3), Flt-1D2 и KDR-Ig, соответственно). Влияние hVEGF мутантов фага с единичной аланиновой заменой на аффинность анти-hVEGF антитела и hVEGF рецептора оценивают как относительные IC50 значения, рассчитывая как IC50,ala/IC50,wt из фагового ELISA. Число больше 1.0 указывает на уменьшение аффинности связывания, а любой вариант со значительными относительными величинами IC50, более высокими чем 10, выделен жирным шрифтом. Значения IC50,wt для G6 и G6-23, соответственно, составляют 2.5 нМ и 20 пМ соответственно. По оценкам ошибка в соотношении, не вводящем стандартную ошибку, составляет 5%. Так как для фагового ELISA требуется значительное связывание мутантной фагмиды с нацеленным белком для получения измеримого сигнала, несвязующие (NB) нельзя точно количественно определить, но можно интерпретировать, что они обладают в значительной степени пониженной аффинностью связывания (величина IC50 более 1000). Звздочкапоказывает, что данные аланиновых замен в hVEGF для Fab-12 и hVEGF рецепторов взяты из Muller et al., (1997) PNASUSA 94: 7192-7197 и Li et al., (2000) Cancer Res. 57: 4593-4599. На фиг. 20 А и В показаны результаты шотган-эксперимента для тяжлой цепи FabG6 и G6-23. Величины Fwt/mut определят воздействие аланиновых (чрные столбцы) замен или замен на гомологи (белые столбцы) в областях CDR тяжлой цепи FabG6 и G6-23 на аффинность связывания с hVEGF. Данные шотган-эксперимента ("дробление" генома) для (А) тяжлой цепи FabG6 взяты из фиг. 16 А, и для (В) тяжлой цепи FabG6-23 взяты из фиг. 16 В. На фиг. 21 А и В даны результаты шотган-эксперимента для лгкой цепи FabG6 и G6-23. ВеличиныFwt/mut определяют воздействие аланиновых (чрные столбцы) замен или замен на гомологи (белые столбцы) в областях CDR лгкой цепи FabG6 и G6-23 на аффинность связывания с hVEGF. Данные шотган-эксперимента ("дробление" генома) для (А) лгкой цепи FabG6 взяты из фиг. 17 А, и для (В) лгкой цепи FabG6-23 взяты из фиг. 17 В. На фиг. 22 А и В даны величины DDGAla-wt из шотган-эксперимента для FabG6 и G6-23. ВеличиныDDGAla-wt, измеряющие действие аланиновых замен в областях CDR (A) FabG6 и (В) FabG6-23 на аффинность связывания сDDGAla-wt=RTln(Ka,wt/Ka,Ala)=RTln(Fwt/Ala), описанному ранее (Weiss et al., (2000) PNAS USA 97: 8950-8954), a величины Fwt/Ala взяты из фиг. 16 и 17. На фиг. 23 показаны результаты сенсограмм для инъекции 100 нМ Fab при 25 С в hVEGF, иммобилизованный на чипе BIAcore. Показано увеличение скорости ассоциации (on rate) для G6 варианта с аланиновой заменой в положении 58 области CDR-H2. Дополнительное увеличение скорости ассоциации(on rate) можно также наблюдать для этого варианта в случае замещения на валин в положении 51 CDRH2. Эта фигура построена с применением программы GraphPad Prism версия 4.0 (http://www.graphpad.com). На фиг. 24 показаны аминокислотные последовательности лгкой цепи G6 Fab и тяжлой цепи G6CDR1-HC, CDR2-HC или CDR3-HC по номенклатуре Kabat. На фиг. 25 показаны аминокислотные последовательности лгкой цепи G6-23 Fab и тяжлой цепиG6-23 Fab, соответственно, а также аминокислотные последовательности лгких цепей G6-31 и G6-8 Fab(SEQ ID NO: 30-33). Подчркнуто положение участков CDR по номенклатуре Kabat. На фиг. 26 показаны аминокислотные последовательности лгкой и тяжлой цепей G6-23.1 Fab иG6-23.2 Fab (SEQ ID NO: 34-36). Подчркнуто положение участков CDR по номенклатуре Kabat. На фиг. 27 показана аминокислотная последовательность лгкой и тяжлой цепей В 20 Fab (SEQ IDNO: 37-38). Подчркнуто положение участков CDR по номенклатуре Kabat. На фиг. 28 даны краткие сведения о высокоаффинных связующих VEGF, полученных с применением библиотеки на основе В 20 (SEQ ID NO: 85-140). На фиг. 29 показана аминокислотная последовательность лгкой и тяжлой цепей В 20-4 и В 20-4.1Fab (SEQ ID NO: 39-41). На фиг. 30 показано повышение аффинности Fab G6 против mVEGF с помощью рандомизации лг-9 012835 кой цепи. (А) сенсограммы для инъекции 500 нМ Fab при 37 С в BIAcore чип с иммобилизованным на нм mVEGF показывают повышение скорости диссоциации (off) и скорости ассоциации (on); (В) строят график зависимости полученной (экспериментальной) скорости (Kobs, s-1) образования комплекса междуG6 и вариантами Fab и mVEGF, как скорости понижения интенсивность флуоресценции, от концентрации mVEGF (нМ), и константу скорости ассоциации (on rate) (109 M-1Vc-1) рассчитывают исходя из наклона кривой псевдопервого порядка. На фиг. 31 показано, что G6 может эффективно блокировать связывание с Flt-1 рецептором какhVEGF, так и mVEGF. В качестве контрольных используют Fab-12 и Y0317. На фиг. 32 показаны скорости ассоциации (on rates), диссоциации (off rates), значения Kd и IC50 для взаимодействий белок Fab-человеческий VEGF или белок Fab-мышиный VEGF при 25 С и при 37 С,определнные методами поверхностного плазмонного резонанса (SPR) с применением BIAcore, или анализом связывания в растворе с применением конкурентного анализа ELISA или метода тушения флуоресценции с Fab-12 и Y0317 для сравнения. " NB" обозначает "не-связующее". "ND" обозначает "не определялось". На фиг. 33 А-Е показано ингибирование роста опухоли НМ 7 у бестимусных мышей после введения антитела G6, антитела G6-31, антитела Y0317 и антитела Avastin в (А) дозе 0.1 мг/кг дважды в неделю;(В) дозе 0.25 мг/кг дважды в неделю; (С) дозе 0.5 мг/кг дважды в неделю; (D) дозе 2 мг/кг дважды в неделю; и (D) дозе 5 мг/кг дважды в неделю. В качестве контрольного антитела используют антитело против аллергии к пыльце. На фиг. 34 суммированы варианты различных (А) лгких цепей и (В) тяжлых цепей G6 с учтом последовательности и IC50 анализа (SEQ ID NO: 361-488). IC50 дикого типа отражает среднее из значений, полученных в разных опытах. Положения с изменяющимися аминокислотами показаны жирным шрифтом. Остатки, отличные от остатков G6 дикого типа, выделены. Остатки обозначены с помощью однобуквенного кода для аминокислоты и числа, показывающего е положение по номенклатуре Kabat etal., 1987. На фиг. 35 суммированы варианты различных (А) лгких цепей и (В) тяжлых цепей G6-23 с учтом последовательности и IC50 анализа (SEQ ID NO: 141-272). IC50 дикого типа отражает среднее из значений, полученных в разных опытах. Положения с изменяющимися аминокислотами показаны жирным шрифтом. Остатки, отличные от остатков G6 дикого типа, выделены. Остатки обозначены с помощью однобуквенного кода для аминокислоты и числа, показывающего е положение по номенклатуре Kabat etal., 1987. На фиг. 36 показаны участки аминокислотных последовательностей антител YADS-1, YADS-2 иYADS-3 и других клонов (SEQ ID NO: 489-560). Представлены последовательности трх связующихhVEGF, выбранных из библиотеки YADS-II. Остатки, которые не были рандомизированы в библиотеке,закрашены серым. На фиг. 37 показаны аминокислотные последовательности группы антител YADS ряда (SEQ ID NO: 273-332). Представлены последовательности уникальных клонов, полученные сортингом библиотекиYADS-A против hVEGF. Остатки, которые не были рандомизированы в библиотеке, закрашены серым. На фиг. 38 показаны аминокислотные последовательности группы антител YADS ряда (SEQ ID NO: 333-360). Представлены последовательности уникальных клонов, полученные сортингом библиотекиYADS-В против hVEGF. Остатки, которые не были рандомизированы в библиотеке, закрашены серым. На фиг. 39 показаны Fab последовательности антител YADS-2 и YADS-3 (SEQ ID NO: 19-24). Жирным шрифтом показаны остатки вариабельной области. Подчркнутые участки показывают аппроксимируемые остатки CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 или CDR-H3. На фиг. 40 показаны NNK варианты антитела YADS-2 (SEQ ID NO: 723-794). "х" указывает СТОПкодон или "не считываемую" последовательность. На фиг. 41 показаны аминокислотные последовательности группы антител ряда YS (SEQ ID NO: 795-914). Они представляют собой последовательности связующих, полученных селекцией библиотекиYS-A и YS-B. На фиг. 42 показаны CDR последовательности анти-VEGF антител из YS библиотек (SEQ ID NO: 561-722). Клоны 1-52 отбирают из библиотеки В, тогда как клоны 53-63 отбирают из библиотеки А. Слева направо колонки 1-5 CDR-L3 относятся к положениям 91, 92, 93, 94 и 96, соответственно; колонки 1-5- 10012835 Подробное описание предпочтительных вариантов изобретенияI. Определения. Термин "антитело" применяется в самом широком смысле и конкретно охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, полиспецифические антитела (например, биспецифические антитела) и фрагменты антител, пока они проявляют нужную биологическую активность."Полипептид ряда G6" по данному изобретению представляет собой полипептид, включающий антитело по данному изобретению, который получен из последовательности антитела G6 или антитела,образованного из G6, по любой из фиг. 2, 7, 24-26 и 34-35 и который связывается с человеческим VEGF с нужной аффинностью по данному изобретению (например, 10 нМ или менее, 2 нМ или менее, 1 нМ или менее, 0.1 нМ или менее, 500 пМ или менее для Fab варианта антитела при 25 С)."Полипептид ряда В 20" по данному изобретению представляет собой полипептид, включающий антитело по данному изобретению, который получен из последовательности антитела В 20 или антитела,образованного из В 20, по любой из фиг. 27-29 и который связывается с VEGF с нужной аффинностью по данному изобретению."Полипептид ряда YADS" или "полипептид YADS" по данному изобретению представляет собой полипептид, включающий антитело по данному изобретению, который получен из последовательности антитела YADS по любой из фиг. 36-40 и который связывается с VEGF с нужной аффинностью по данному изобретению."Полипептид ряда YADS-2" или "полипептид YADS-2" по данному изобретению представляет собой полипептид, включающий антитело по данному изобретению, который получен из последовательности антитела YADS-2 по любой из фиг. 36 или 39 и который связывается с VEGF с нужной аффинностью по данному изобретению."Полипептид ряда YADS-3" или "полипептид YADS-3" по данному изобретению представляет собой полипептид, включающий антитело по данному изобретению, который получен из последовательности антитела YADS-3 по любой из фиг. 36 или 39 и который связывается с VEGF с нужной аффинностью по данному изобретению."Полипептид ряда YS" или "полипептид YS" по данному изобретению представляет собой полипептид, включающий антитело по данному изобретению, который получен из последовательности антитела YS по любой из фиг. 41-43 и который связывается с VEGF с нужной аффинностью по данному изобретению Согласно одному предпочтительному варианту изобретения полипептид ряда G, полипептид ряда В 20, полипептид ряда YADS, полипептид ряда YADS-2, полипептид ряда YADS-3 или полипептид ряда YS связывается с человеческим VEGF и VEGF нечеловеческого млекопитающего с величиной Kd,верхний предел которой в 10 раз больше нижнего. Согласно одному эксперименту величины KD для этих антител, связывающихся с человеческим VEGF и мышиным VEGF, составляют 10 нМ или менее. В другом эксперименте эти антитела связываются с человеческим VEGF и мышиным VEGF с величинамиKd 2 нМ или менее. В другом эксперименте эти антитела связываются с человеческим VEGF с величинами Kd 1 нМ или менее. Аффинность таких полипептидов ряда G6, ряда В 20, ряда YADS и YS в отношении VEGF можно улучшить такими методами, как например фаговый дисплей, представленный в данном описании. Выражение "вариабельный домен (вариабельная область) антитела" относится к участкам лгкой и тяжлой цепей молекул антитела, которые включают аминокислотные последовательности гипервариабельных участков (CDR; т.е. CDR1, CDR2 и CDR3) и каркасных участков (FR). VH относится к вариабельному домену тяжлой цепи. VL относится к вариабельному домену лгкой цепи. Согласно способам по изобретению аминокислотные положения, относящиеся к CDR и к FR, можно определить по номенклатуре Kabat (Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, MD.,1987 и 1991). Нумерация аминокислот в антителах или антигенсвязывающих фрагментах также соответствует номенклатуре Kabat. Применяемый в данном описании термин "гипервариабельные участки" (CDR; т.е. CDR1, CDR2 иCDR3) относится к аминокислотным остаткам вариабельного домена антитела, присутствие которых необходимо для связывания с антителом. Каждый вариабельный домен содержит обычно три участкаCDR, называемых CDR1, CDR2 и CDR3. Каждый гипервариабельный участок может содержать аминокислотные остатки "гипервариабельного участка" по Kabat (т.е. примерные остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене лгкой цепи и 31-35 (H1), 50-65 (Н 2) и 95-102 (Н 3) в вариабельном домене тяжлой цепи; Kabat (Sequences of Proteins of Immunological Interest 5th Ed. Public Health Service,National Institutes of Health, Bethesda, MD.(1991 и/или такие остатки из "гипервариабельной петли" (т.е. примерные остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене лгкой цепи и 26-32 (HI),53-55 (Н 2) и 96-101 (Н 3) в вариабельном домене тяжлой цепи; Clothia and Lesk J. Mol. Biol. 196: 901917(1987. В некоторых примерах гипервариабельный участок может включать аминокислоты как CDR участка по Kabat, так и гипервариабельной петли. Например, CDR-H1 тяжлой цепи антитела 4D5 включает аминокислоты 26-35."Каркасные участки" (далее в данном описании FR) представляют собой отличные от остатков CDR- 11012835 остатки вариабельного домена. Обычно каждый вариабельный домен содержит четыре FR, определяемых как FR1, FR2, FR3 и FR4. Если CDR участки определяют по Kabat, FR остатки лгкой цепи позиционируют примерно в остатках 1-23 (LCFR1), 35-49 (LCFR2), 57-88 (LCFR3) и 98-107 (LCFR4), a FR остатки тяжлой цепи позиционируют примерно в остатках 1-30 (HCFR1), 36-49 (HCFR2), 66-94(HCFR3) и 103-113 (HCFR4) тяжлой цепи. Если участки CDR содержат аминокислотные остатки из гипервариабельных петель, FR остатки лгкой цепи позиционируют примерно в остатках 1-25 (LCFR1), 3349 (LCFR2), 53-90 (LCFR3) и 97-107 (LCFR4), a FR остатки тяжлой цепи позиционируют примерно в остатках 1-25 (HCFR1), 33-52 (HCFR2), 56-95 (HCFR3) и 102-113 (HCFR4) тяжлой цепи. В некоторых примерах, когда CDR содержит аминокислоты как их CDR по Kabat, так и аминокислоты из гипервариабельной петли, остатки FR корректируют соответствующим образом. Например, CDR-H1 включает аминокислоты Н 26-Н 35, FR1 остатки тяжлой цепи находятся в положениях 1-25, a FR2 остатки находятся в положениях 36-49. Применяемый термин "набор кодонов" относится к различным нуклеотидным триплетам, применяемым для кодирования нужных вариантов аминокислот. Набор олигонуклеотидов можно синтезировать, например, твердофазным синтезом, включая последовательности, которые представляют все возможные комбинации нуклеотидных триплетов, обеспечиваемые набором кодонов и кодирующие заданную группу аминокислот. Стандартной формой обозначения кодонов является код IUB, известный в уровне техники и представленный в данном описании. Набор кодонов обычно изображают тремя заглавными буквами курсивом, например, NNK, NNS, XYZ, DVK и т.д. Таким образом "неслучайный набор кодонов" по данному описанию относится к набору кодонов, который кодирует выбранную аминокислоту, которая отвечает частично, предпочтительно, полностью критериям отбора аминокислот по данному описанию. Синтез олигонуклеотидов с выбранной "вырожденностью" нуклеотидного кода в некоторых положениях хорошо известна в уровне техники, например, подход TRIM (Knappek et al.; J. Mol. Biol.(1999), 296: 57-86; GarrardHenner, Gene (1993), 128: 103). Такие наборы олигонуклеотидов, имеющих определнные наборы кодонов, можно синтезировать на продажных синтезаторах нуклеиновых кислот(выпускаемых, например, Applied Biosystems, Foster City, CA), или их можно приобрести (например, отLife Technologies, Rockville, MD). Следовательно, набор синтезированных олигонуклеотидов, имеющих конкретный набор кодонов, обычно содержит множество олигонуклеотидов с различными последовательностями, причм различие устанавливается с помощью набора кодонов по всей последовательности. Олигонуклеотиды, применяемые по изобретению, имеют последовательности, которые допускают гибридизацию нуклеотидной матрицы вариабельного домена и также могут, но не обязательно, включать сайты рестриктаз, применимые, например, для целей клонирования. Фрагмент "Fv" является фрагментом антитела, который содержит полный сайт распознавания антигена и связывания с антигеном. Этот участок состоит из димера тесно связанных одного вариабельного домена тяжлой цепи и одного вариабельного домена лгкой цепи, эта связь может быть ковалентной по природе, например, в scFv. Именно в этой конфигурации взаимодействуют три CDR участка каждого вариабельного домена, идентифицируя сайт связывания антигена на поверхности димера VH-VL. Вместе шесть CDR участков или их набор сообщают антителу специфичность связывания с антигеном. Однако даже единичный вариабельный домен (или половина Fv, содержащая только три CDR, специфичных к антигену) обладает способностью распознавать и связывать антиген, хотя обычно с более низкой аффинностью, чем полный сайт связывания. Фрагмент "Fab" содержит вариабельный и константный домен лгкой цепи и вариабельный домен и первый константный домен (СН 1) тяжлой цепи. Фрагменты антитела F(ab')2 содержат пару Fab фрагментов, которые обычно ковалентно связаны между собой близ карбокси-концов с помощью цистеиновых остатков шарнирных участков. В уровне техники также известны другие соединения фрагментов антитела."Одноцепочечный Fv" или "scFv" фрагменты антитела содержат VH и VL домены антитела, причм эти домены присутствуют в единственной полипептидной цепи. Обычно FM полипептид дополнительно содержит полипептидный линкер между VH и VL доменами, который дат возможность scFv образовывать нужную структуру для связывания с антигеном. Обзор о scFv см. Pluckthun в Pharmacology of Monoclonal Antibodies, Vol. 113, Rosenburg and Moore eds. Springer-Verlag, New York, pp. 269-315 (1994). Термин "diabody" относится к малым фрагментам антител с двумя антигенсвязывающими сайтами,причм эти фрагменты содержат вариабельный домен тяжлой цепи (VH), связанный с вариабельным доменом лгкой цепи (VL) в той же самой полипептидной цепи (VH и VL). Используя линкер, слишком короткий, чтобы можно было осуществить спаривание между двумя доменами одной и той же цепи, домены принуждают спариваться с комплементарными доменами другой цепи и создавать два антигенсвязывающих сайта. "Diabody" более подробно описаны, например, в ЕР 404 097; WO 93/11161; и Hollingeret al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993). Выражение "линейные антитела" относится к антителам, описанным в Zapata et al., Protein Eng.,8(10): 1057-1062 (1995). Короче, эти антитела содержат пару тандемных повторов Fd сегментов (VH-CH1VH-CH1), которые, вместе с полипептидами комплементарной лгкой цепи, образуют пару антигенсвязывающих участков. Линейные антитела могут быть биспецифическими и моноспецифическими.- 12012835 Термин "моноклональное антитело" по данному описанию относится к антителу, полученному от популяции практически гомогенных антител, т.е. индивидуальные антитела, составляющие популяцию,идентичны, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высокоспецифическими, направленными против единичного антигенного сайта. Кроме того, в отличие от обычного (поликлонального) антитела, препараты, которые, как правило, включают различные антитела против различных детерминант(эпитопов), причм каждое моноклональное антитело направлено против единственной детерминанты на антигене. Определение "моноклональное" указывает на характер антитела как полученного из практически гомогенной популяции антител, его не следует истолковывать как требование получать антитело каким-либо конкретным методом. Например, моноклональные антитела для применения по настоящему изобретению можно получать методом гибридом, впервые описанным Kohler et al., Nature 256: 495(1975), или их можно получать методами рекомбинантной ДНК (см., например, патент США 4816567)."Моноклональные антитела" можно также выделять из фаговых библиотек антител, например, методами,описанными в Clackson et al., Nature 352: 624-628 (1991) и Marks et al., J. Mol. Biol. 222: 581-597 (1991). Моноклональные антитела по данному описанию могут включать "химерные" антитела (иммуноглобулины), в которых участок тяжлой и/или лгкой цепи идентичен или гомологичен соответствующим последовательностям в антителах, полученных от конкретных видов или принадлежащих к конкретному классу или подклассу, тогда как остаток цепи (цепей) идентичен или гомологичен соответствующим последовательностям в антителах от других видов или принадлежащих к другому классу или подклассу антител, а также фрагменты таких антител, пока они проявляют заданную биологическую активность"Гуманизированные" формы нечеловеческих (например, мышиных) антител представляют собой химерные антитела, которые содержат минимальную последовательность нечеловеческого иммуноглобулина. По большей части гуманизированные антитела являются человеческими иммуноглобулинами(антитело-реципиент), в которых остатки гипервариабельного участка реципиента заменены на остатки гипервариабельного участка нечеловеческого вида (донорного антитела), такого как мышиное, крысиное,кроличье или нечеловеческого примата, имеющие заданную специфичность, аффинность и способность. В некоторых примерах остатки Fv каркасной области (FR) человеческого иммуноглобулина заменены на соответствующие нечеловеческие остатки. Кроме того, гуманизированные антитела могут содержать остатки, не обнаруженные в антителе-реципиенте или в донорном антителе. Эти модификации осуществляют для дальнейшего уточнения характеристик антитела. Вообще гуманизированное антитело содержит практически все по меньшей мере из одного и обычно двух вариабельных доменов, в которых все или практически все гипервариабельные петли соответствуют гипервариабельным петлям нечеловеческого иммуноглобулина, и все или практически все FR области являются FR областями последовательности человеческого иммуноглобулина. Гуманизированное антитело, возможно, также содержит по меньшей мере часть константной области (Fc) иммуноглобулина, обычно человеческого иммуноглобулина. Подробнее см. Jones et al., Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-329 (1988); и"Видозависимое антитело" представляет собой антитело, которое обладает более сильной аффинностью связывания с антигеном млекопитающего первого вида, чем с гомологом этого антигена млекопитающего второго вида. Обычно видозависимое антитело "специфически связывается" с человеческим антигеном (например, имеет величину аффинности связывания (Kd) не более примерно 110-7 М, предпочтительно не более 110-8 М и наиболее предпочтительно не более 110-9 М), но имеет величину аффинности связывания с гомологом антигена второго нечеловеческого млекопитающего по меньшей мере примерно в 50 раз, или по меньшей мере примерно в 500 раз, или по меньшей мере примерно в 1000 раз слабее, чем его аффинность связывания с человеческим антигеном. Зависимое от вида антитело может быть любым из различных видов антител по определению выше, но предпочтительно является гуманизированным или человеческим антителом. Применяемое в данном описании выражение "мутантное антитело" или "вариант антитела" относится к варианту аминокислотной последовательности видозависимого антитела, в котором один или более аминокислотных остатков видозависимого антитела модифицирован. Такие мутанты непременно обладают менее чем 100%-ной идентичностью или сходством последовательности с видозависимым антителом. В предпочтительном варианте изобретения мутантное антитело имеет аминокислотную последовательность, по меньшей мере на 75% идентичную или сходную с аминокислотной последовательностью вариабельного домена либо тяжлой, либо лгкой цепи видозависимого антитела, более предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, более предпочтительно по меньшей мере на 90% и наиболее предпочтительно по меньшей мере на 95%. Идентичность или сходство в отношении этой последовательности определяется по данному описанию как процентное содержание аминокислотных остатков в кандидатной последовательности, идентичных (т.е. тот же самый остаток) или сходных (т.е. аминокислотный остаток той же группы, созданной на основании общих свойств боковой цепи, см. ниже) остаткам видозависимого антитела, после выравнивания последова- 13012835 тельностей и, при необходимости, введения гэпов, для достижения максимального процента идентичности. Ни один (ни одну) из N-концевых, С-концевых или внутренних удлиняющих сегментов, делеций или инсерций в последовательность антитела вне вариабельного домена не следует интерпретировать как влияющие на идентичность или сходство (подобие) последовательностей. Для повышения периода полужизни антител или полипептида, содержащего аминокислотные последовательности по данному изобретению, можно присоединить к антителу эпитоп связывания с рецептором-"мусорщиком" (особенно к фрагменту антитела), как описано, например, в патенте США 5739277. Например, нуклеодидную молекулу, кодирующую эпитоп связывания с рецептором-"мусорщиком",можно связывать в рамке считывания с нуклеиновой кислотой, кодирующей полипептидную последовательность по данному изобретению, таким образом, чтобы слитый (составной) белок, экспрессируемый при использовании созданной нуклеотидной молекулы содержал эпитоп связывания с рецептором"мусорщиком" и полипептидную последовательность по данному изобретению. Применяемое в данном описании выражение "эпитоп связывания с рецептором-"мусорщиком" относится к эпитопу Fc области молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), отвечающий за повышение in vivo периода полужизни в сыворотке молекулы IgG (например, Ghetie, V. et al., (2000) Ann. Rev. Immunol. 18: 739-766,табл. 1). Антитела с заменами в их Fc области и повышенный период полужизни в сыворотке также описаны в WO 00/42072 (Presta, L.), WO 02/060919; Shields, R.L, et al., (2001) JBC 276(9): 6591-6604; Hinton,P.R., (2004) JBC 279(8): 6213-6216). В другом варианте изобретения период полужизни в сыворотке можно также увеличить, например, присоединяя другие полипептидные последовательности. Например, антитела по данному изобретению или другой полипептид, содержащий аминокислотные последовательности по данному изобретению, можно присоединять к сывороточному альбумину или участку сывороточного альбумина, который связывается с FcRn рецептором или пептидом, связывающим сывороточный альбумин, таким образом, что сывороточный альбумин связывается с антителом или полипептидом,такие полипептидные последовательности описаны, например, в WO 01/45746. В одном предпочтительном варианте изобретения присоединяемый пептид для сывороточного альбумина содержит аминокислотную последовательность DICLPRWGCLW. В другом варианте изобретения период полужизни Fab по данному изобретению увеличивают этими методами. См. также Dennis, M.S., et al., (2002) JBC 277(38): 35035-35043 о пептидных последовательностях для связывания сывороточного альбумина."Выделенное" ("изолированное") антитело представляет собой антитело, которое было идентифицировано и отделено и/или регенерировано из компонентов его природного окружения. Загрязняющие компоненты его природного окружения представляют собой материалы, которые мешают применению антитела в диагностике или терапии, и могут включать ферменты, гормоны и другие белковые или небелковые растворы. В предпочтительных вариантах изобретения антитело очищают (1) так, чтобы степень чистоты была 95 вес.% антитела по методу Лаури (Lowry), наиболее предпочтительно более 99 вес.%, (2) до степени чистоты, достаточной, чтобы получить, по меньшей мере, 15 остатков Nконцевой или внутренней аминокислотной последовательности, используя секвенатор с вращающейся чашкой, или 3) до гомогенности методом SDS-PACE в условиях восстановления или без восстановления с применением окрашивания Кумасси голубым или, предпочтительно, серебром. Выделенное антитело включает антитело in situ в рекомбинантных клетках, так как по меньшей мере один компонент природного окружения антитела будет отсутствовать. Обычно, однако, выделенное антитело получают с применением по меньшей мере одной стадии очистки."Ангиогенный фактор или агент" представляет собой фактор роста, который стимулирует рост кровеносных сосудов, например, промотирует ангиогенез, рост эндотелиальных клеток, стабильность кровеносных сосудов и/или васкулогенез и т.д. Например, ангиогенные факторы включают, но без ограничения, VEGF и членов семейства VEGF,PIGF, семейства PDGF, семейства фактора роста фибробластов (FGF), TIE лиганды (ангиопоэтины), эфрины, Del-1, факторы роста фибробластов: кислые (aFGF) и основные (bFGF), фоллистатин, гранулоцитарный колониестимулирующий фактор (G-CSF), фактор роста гепатоцитов (HGF)/фактор рассеяния(SF), интерлейкин-8 (IL-8), лептин, мидкин, плацентарный фактор роста, фактор роста эндотелиальных клеток тромбоцитарного происхождения (PD-ECGF), тромбоцитарный фактор роста, особенно PDGF-BB или PDGFR-бета, плейотропин (PTN), програнулин, пролиферин, трансформирующий фактор ростаальфа (TGF-альфа), трансформирующий фактор роста-бета (TGF-бета), фактор некроза опухолевых клеток-альфа (TNF-альфа), сосудистый эндотелиальный фактор роста (VEGF)/ фактор сосудистый проницаемости (VPF) и т.д. Они также включают факторы, которые ускоряют заживление ран, например гормон роста, инсулиноподобный фактор роста-I (IGF-I), VIGF, эпидермальный фактор роста (EGF), CTGF и членов его семейства и TGF-альфа и TGF-бета. См., например, Klagsbrun and D' Amore, Annu. Rev.Medicine 5(12): 1359-1364 (1999); Tonini et al., Oncogene, 22: 6549-6556 (2003) (например, табл. 1, в которой перечислены известные ангиогенные факторы); и Sato Int. J. Clin. Oncol., 8: 200-206 (2003). Выражение "антиангиогенный агент" или "ангиогенный ингибитор" относится к низкомолекулярному веществу, полинуклеотиду, полипептиду, выделенному белку, рекомбинантному белку, антителу или их конъюгатам или составным (слитым) белкам, которые ингибируют ангиогенез, васкулогенез или- 14012835 нежелательную сосудистую проницаемость либо непосредственно, либо опосредованно. Следует понять,что антиангиогенный агент включает те агенты, которые связывают и блокируют ангиогенную активность ангиогенного фактора или его рецептор. Например, антиангиогенный агент представляет собой антитело или другой антагонист ангиогенного агента по определению выше, например, антитела кVEGF-A или к рецептору VEGF-A (например, рецептор KDR или рецептор Flt-1), анти-PDGFR ингибиторы, такие как Gleevec (иматиниба мезилат). Антиангиогенные агенты также включают нативные ангиогенные ингибиторы, например, ангиостатин, эндостатин и т.д. СМ., например, Klagsbran and D'Amore, Annu. Rev. Physiol., 53: 217-39 (1991); Streit and Detmar, Oncogene, 22: 3172-3179 (2003) (например, табл. 3, в которой перечисляется антиангиогенная терапия при злокачественной меланоме); FerraraAlitalo, Nature Medicine 5(12): 1359-1364 (1999); Tonini et al., Oncogene, 22: 6549-6556 (2003) (например, табл. 2, в которой перечислены известные ангиогенные факторы); и Sato Int. J. Clin. Oncol., 8: 200206 (2003) (например, табл. 1, в которой перечисляются антиангиогенные агенты, применяемые в клинических испытаниях)."Kd" или "величину (значение) Kd" по данному изобретению в одном предпочтительном варианте изобретения определяют радиоиммунным анализом связывания VEGF (RIA, РИА), осуществляемым с применением Fab варианта антитела и молекулой VEGF, как описано в нижеприведнном анализе, в котором измеряют аффинность связывания Fab с VEGF в растворе, уравновешивая Fab с минимальной концентрацией меченого (125I) VEGF(109) в присутствии титрованного ряда немеченого VEGF, затем"захватывая" связанный VEGF с помощью планшета, покрытого антителом против Fab (Chen, et al.,(1999) J. Mol. Biol. 293: 865-881). Для определения условий анализа микротитрационные планшеты(Dynex) в течение ночи покрывают 5 мкг/мл "захватывающего" антитела против Fab (Cappel Labs) в 50 мМ карбоната натрия (pH 9.6), а затем блокируют 2%-ным (об./вес.) раствором альбумина бычьей сыворотки в PBS от двух до пяти часов при комнатной температуре (приблизительно при 23 С). В неадсорбирующем планшете (Nunc 4269620), 100 пМ или 26 пМ [125I] VEGF(109) смешивают с интересующим Fab в серийном разведении, например, с Fab-12 (Presta et al., (1997) Cancer Res. 57: 4593-4599). Затем представляющий интерес Fab инкубируют в течение ночи; однако инкубация может продолжаться 65 часов,чтобы гарантировать достижение равновесия. Затем смеси переносят в планшет для улавливания ("захвата") с целью инкубации при комнатной температуре в течение часа. Затем раствор удаляют и планшет восемь раз отмывают с помощью 0.1% Tween-20 в PBS. Когда планшеты высушены, добавляют 150 мкл/лунка сцинтиллятора (MicroScint-20; Packard) и планшеты считают на гамма-счтчике Topcount(Packard) 10 мин. Концентрации каждого Fab, который дат 20% или менее максимального связывания, выбирают для применения в анализах конкурентного связывания. Согласно другому варианту изобретения Kd или величину Kd измеряют методом поверхностного плазмонного резонанса на BIAcore - 2000 илиBIAcore - 3000 (BIAcore, Inc., Piscataway, NJ) при 25 С с иммобилизованными hVEGF (8-109) CM5 чипами при 10 относительных единиц (единиц ответа) (response units) (RU). Коротко говоря, биосенсорные чипы с карбоксиметилированным декстраном (СМ 5, BIAcore Inc.) активируют с помощью гидрохлорида N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимида (NHS) в соответствии с инструкциями производителя. Человеческий VEGF разводят с помощью 10 мМ ацетата натрия, pH 4.8, до 5 мкг/мл (0.2 мкМ) перед инъекцией со скоростью потока 5 мкл/мин для получения,приблизительно, 10 единиц ответа (response units) (RU) сопряжнного белка. После инъекции человеческого VEGF, инъецируют 1 М этаноламина с целью блокировать непрореагировавшие группы. Для кинетических измерений двукратные серийные разведения Fab (от 0.78 нМ до 500 нМ) инъецируют в PBS с 0.05% Tween 20 (PBST) при 25 С при скорости потока, приблизительно, 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывают, используя простую модель связывания Ленгмюра один к одному (BIAcore Evaluation Software version 3.2), одновременной подгонкой сенсограмм (диаграмм чувствительности) ассоциации и диссоциации. Константу равновесной диссоциации (Kd) рассчитывают как отношение koff/kon. См., например, Chen, Y., et al., (1999) J. Mol. Biol. 293: 865-881. Если скорость ассоциации превышает 106 М-1 с-1 в вышеприведнном методе поверхностного плазмонного резонанса, тогда скорость ассоциации можно определить методом тушения флуоресценции, который позволяет измерять повышение или снижение интенсивности флуоресцентного излучения (возбуждение= 295 нм; эмиссия (излучение)=340 нм, 16 нм полоса пропускания) при 25 С 20 нМ анти-VEGF антитела(Fab форма) в PBS, pH 7.2, в присутствии повышающихся концентраций короткой формы человеческого(ThermoSpectronic) с кюветой с перемешиванием. Согласно данному изобретения "on rate" или "скорость ассоциации", или "kon", предпочтительно измеряют тем же методом поверхностного плазмонного резонанса, описанным выше, на BIAcore - 2000 или BIAcore - 3000 (BIAcore, Inc., Piscataway, NJ) при 25 С с иммобилизованными hVEGF (8-109) CM5 чипами при 10 единиц ответа (относительных единиц) (response units) (RU). Коротко говоря, биосенсорные чипы с карбоксиметилированным декстраном (СМ 5, BIAcore Inc.) активируют с помощью гидро- 15012835 хлорида N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимида (NHS) в соответствии с инструкциями производителя. Человеческий VEGF разводят с помощью 10 мМ ацетата натрия, pH 4.8, до 5 мкг/мл (0.2 мкМ) перед инъекцией со скоростью потока 5 мкл/мин для получения приблизительно 10 относительных единиц (response units) (RU) сопряжнного (составного) белка. После инъекции человеческого VEGF, инъецируют 1 М этаноламина с целью блокировать непрореагировавшие группы. Для кинетических измерений двукратные серийные разведения Fab (от 0.78 до 500 нМ) инъецируют в PBS с 0.05% Tween 20 (PBST) при 25 С при скорости потока, приблизительно, 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывают, используя простую модель связывания Ленгмюра один к одному (BIAcore Evaluation Software version 3.2), одновременной подгонкой сенсограмм (диаграмм чувствительности) ассоциации и диссоциации. Константу равновесной диссоциации(Kd) рассчитывают как отношение koff/kon. См., например, Chen, Y., et al., (1999) J. Mol. Biol. 293: 865-881. Однако, если скорость ассоциации превышает 106 M-1c-1 в вышеприведнном методе поверхностного плазмонного резонанса, тогда скорость ассоциации можно определить методом тушения флуоресценции,который позволяет измерять повышение или снижение интенсивности флуоресцентного излучения (возбуждение=295 нм; эмиссия (излучение)=340 нм, 16 нм полоса пропускания) при 25 С 20 нМ анти-VEGF антитела (Fab форма) в PBS, pH 7.2, в присутствии повышающихся концентраций короткой формы человеческого VEGF (8-109) или мышиного VEGF, измеряемой на спектрометре, таком как спектрофотометр,снабжнный отключением потока (Aviv Instruments), или спектрофотометр 8000-серии SLM-Aminco(ThermoSpectronic) с кюветой с перемешиванием. Выражение "функциональный эпитоп" по данному изобретению относится к аминокислотным остаткам антигена, которые вносят энергетический вклад в связывание антитела. Мутация любого из участвующих энергетически остатков антигена (например, мутация VEGF дикого типа с применением аланиновых замен или замен на его гомолог) нарушает связывание антитела таким образом, что отношение относительных аффинностей (IC50 мутантного VEGF/IC50 VEGF дикого типа) становится выше 5 (пример 2). В предпочтительном варианте изобретения отношение относительных аффинностей определяют методом ELISA связывания в растворе с помощью фагового дисплея. Коротко говоря, 96-луночные иммунопланшеты Maxisorp (NUNC) в течение ночи при 4 С покрывают испытуемой формой Fab антитела с концентрацией 2 мкг/мл в PBS и блокируют PBS, 0.5% BSA и 0.05% Tween 20 (PBT) в течение 2 ч при комнатной температуре. Серийное разведение полученного методом фагового дисплея мутанта hVEGF с аланиновыми точковыми мутациями (форма, содержащая остатки 8-109) или hVEGF (8-109) дикого типа в РВТ сначала инкубируют на покрытых Fab планшетах в течение 15 мин при комнатной температуре, и планшеты отмывают PBS, 0.05% Tween 20 (PBST). Связанный фаг детектируют с применением конъюгата моноклонального антитела против М 13 с пероксидазой хрена (Amersham Pharmacia), разведнного 1:5000 в РВТ, проявляемого субстратом 3,3',5,5'-тетраметилбензидина (ТМВ, KirkegaardPerry Labs,Gaithersburg, MD) примерно в течение 5 мин, гасят 1.0 М Н 3 РО 4 и читают на спектрофотометре при 450 нм. Отношение величин IC50 (IC50,ala/IC50,wt) представляет собой коэффициент кратности снижения аффинности связывания (относительная аффинность связывания). При анализе конкурентного связывания планшеты Maxisorb покрывают и блокируют, как описано выше, а серийные трхкратные разведения немеченого VEGF(109) готовят в буфере PBS/Tween в планшете Nunc. Добавляют [125I] VEGF(109), a затем представляющий интерес Fab с постоянной концентрацией. Конечные концентрации представляющего интерес Fab составляют 100 и 10 пМ, соответственно. После инкубации (как описано выше) связанный VEGF захватывается и количественно рассчитывается,как описано выше. Данные связывания анализируют с помощью компьютерной программы методом Скэтчарда (P. Munson et al., (1980) Anal. Biochem. (1980) 107: 220-239) для определения константы диссоциации при связывании, Kd. Применяемый в данном описании термин "библиотека" относится к множеству последовательностей антитела или фрагментов антитела (например, полипептидов по данному изобретению), или нуклеиновых кислот, которые кодируют эти последовательности, причм последовательности различаются комбинацией вариантных аминокислот, которые вводятся в эти последовательности по методам данного изобретения."Фаговый дисплей" представляет собой метод, при котором вариантные полипептиды визуализуются в виде белков, слитых по меньшей мере с частью белка, содержащегося в плнке (покрытии) планшета, на поверхности фаговых частиц, например, частиц нитевидного фага. Использование фагового дисплея лежит в основе того факта, что большие библиотеки рандомизированных вариантов белков можно быстро и эффективно сортировать по тем последовательностям, которые связываются с нацеленным антигеном с высокой аффинностью. Дисплей (визуализация) пептидных и белковых библиотек на фаге используют для скрининга миллионов полипептидов на полипептиды со свойствами специфического связывания. Методы поливалентного фагового дисплея применяют для визуализации малых случайных пептидов и малых белков путм слияния (химеризации) либо с геном III, либо с геном VIII нитевидного фага. Wells and Lowman, Curr. Opin. Struct. Biol., 3: 355-362 (1992) и цитируемые там ссылки. При моновалентном фаговом дисплее белковую или пептидную библиотеку сливают с геном III или его участком и- 16012835 экспрессируют с низкими уровнями в присутствии белка гена III дикого типа таким образом, что частицы фага визуализуют одну копию или ни одной копии слитых белков. Эффект авидности снижается по сравнению с поливалентным фагом, так что сортинг осуществляется за счт природной аффинности лиганда, и применяются фагмидные векторы, которые упрощают манипуляции с ДНК. Lowman and Wells,Methods: A companion to Methods in Enzymology, 3: 205-216 (1991)."Фагмида" представляет собой плазмидный вектор, содержащий бактериальный ориджин репликации, например, Co1E1, и копию межгенной области бактериофага. Фагмиду можно использовать на любом бактериофаге, включая нитевидный бактериофаг и лямбдоидный бактериофаг. Плазмида также обычно содержит селективный маркр устойчивости к антибиотику. Сегменты ДНК, клонированные в эти векторы, можно размножать в виде плазмид. Когда клетки, в которых находятся эти векторы, включают все гены, необходимые для продуцирования фаговых частиц, способ репликации плазмид меняется на репликацию свртывающегося цикла с образованием копий одной нити плазмидной ДНК и упаковкой фаговых частиц. Фагмида может образовывать инфекционные или неинфекционные фаговые частицы. Этот термин включает фагмиды, которые содержат ген оболочечного белка фага или его фрагмент, связанный с геном гетерологичного полипептида в виде генного слияния, так что гетерологичный полипептид визуализуется на поверхности фаговой частицы. Термин "фаговый вектор" означает двухнитевую репликативную форму бактериофага, содержащую гетерологичный ген и способную к репликации. Фаговый вектор содержит ориджин репликации фага,делающий возможной репликацию фага и образование фаговых частиц. Фаг предпочтительно представляет собой нитевидный бактериофаг, такой как фаг М 13, f1, fd, Pf3 или производный от них, или лямбдоидный фаг, такой как лямбда, 21, phi80, phi81, 82, 424, 434 и т.д. или производный от них. Применяемое в данном описании выражение "положение, доступное для растворителя" относится к положению аминокислотного остатка в вариабельных областях тяжлой и лгкой цепей источника антитела или антигенсвязывающего фрагмента, которое определяется, исходя из структуры, множества (ансамбля) структур и/или моделированной структуры антитела или антигенсвязывающего фрагмента, как потенциально доступное для подхода молекулы и/или для контакта с молекулой, такой как антиген, специфический в отношении антитела. Эти положения обычно находятся в CDR участках и на внешнем участке белка. Доступные для растворителя положения антитела или антигенсвязывающего фрагмента по данному описанию можно определит, используя ряд известных в уровне техники алгоритмов. Предпочтительно, доступные для растворителя положения определяют в координатах по 3-мерной модели антитела, предпочтительно используя компьютерную программу, такую как программа InsightII (Accelrys, San Diego, CA). Положения, доступные для растворителя, можно также определить, используя известные в технике алгоритмы (например, Lee and Richards, J. Mol. Biol. 55, 379 (1971) и Connolly, J. Appl.Cryst. 16, 548 (1983. Определение доступных для растворителя положений можно осуществлять, используя программу, пригодную для моделирования белка и информацию о 3-мерной структуре антитела. Программа, которую можно использовать для этих целей, включает программу SYBYL Biopolymer Module (Tripos Associates). Обычно и предпочтительно, если алгоритм (программа) требует, чтобы пользователь ввл параметр размера, "размер" образца, который используют в расчтах, устанавливают в радиусе около 1.4 ангстрем или менее. Кроме того, методы определения доступных для растворителя областей и площадей с помощью программ для персональных компьютеров, описанных Pacios 1994) "ARVOMOL/CONTOUR: площади поверхности и объмы молекул на персональных компьютерах". Comput.Biomolecules". J. Mol. Model. 1: 46-53). Термин "лечение" относится как к терапевтическому лечению, так и к профилактическим или предупредительным мерам. Нуждающиеся в лечении включают тех, кто уже имеет нарушение, а также тех,у которых нарушение следует предупредить. Термин "нарушение", "расстройство" представляет собой любое состояние, на которое лечение с применением антитела оказывает благотворное воздействие. Например, млекопитающие, страдающие от или нуждающиеся в профилактике аномального ангиогенеза (избыточный (интенсивный), неадекватный или неконтролируемый ангиогенез) или сосудистой проницаемости. Нарушение включает хронические и острые нарушения или заболевания, включая патологические состояния, которые предрасполагают млекопитающего к рассматриваемому нарушению. Неограничивающие примеры нарушений, которые можно лечить по данному описанию, включают злокачественные или доброкачественные опухоли; нелейкемические и лимфоидные злокачественные опухоли; нейронные, глиальные, астроцитные, гипоталамные и другие гландулярные, макрофагальные, эпителиальные, стромальные и бластоцельные нарушения; и воспалительные, ангиогенные и иммуногенные нарушения. Термин "аномальный ангиогенез" встречается в случае, если кровеносные сосуды либо растут интенсивно, или недостаточно, или неподходящим образом (например, локализация, время или начало ангиогенеза нежелательно с медицинской точки зрения) в состоянии болезни, либо таким образом, что это вызывает состояние болезни. Интенсивный (избыточный), неадекватный или неконтролируемый ангиогенез имеет место, когда происходит рост новых кровеносных сосудов, который способствует ухудшению болезненного состояния или вызывает болезненное состояние, такое как рак, в особенности васку- 17012835 ляризованные солидные опухоли и метастатические опухоли (включая рак толстой кишки, лгкого (в особенности мелкоклеточный рак лгкого) или простаты), заболевания, вызванные окулярной неоваскуляризацией, особенно диабетическая слепота, ретинопатии, первичная диабетическая ретинопатия или возрастная дегенерация жлтого пятна и рубеоз; псориаз, псориатический артрит, гемоангиобластома,такая как гемангиома; воспалительные почечные заболевания, такие как гломерулонефрит, особенно мезангиопролиферативный гломерулонефрит, гемолитико-уремический синдром, диабетическая нефропатия или гипертензивный нефросклероз; различные воспалительные заболевания, такие как артрит, особенно ревматоидный артрит, воспалительное кишечное заболевание, псориаз, саркоидоз, артериальный артериосклероз и заболевания после трансплантации, эндометриоз или хроническая астма и более 70 других состояний. Новые кровеносные сосуды могут питать больные ткани, разрушать нормальные ткани и, в случае рака, новые сосуды могут допустить попадание опухолевых клеток в кровоток и в другие органы (метастазы опухоли). Недостаточный ангиогенез встречается тогда, когда имеет место неадекватный рост кровеносных сосудов, который приводит к ухудшению болезненного состояния, например,при болезнях, таких как заболевание коронарной артерии, удар и замедленное заживление ран. Кроме того, язвы, удары и сердечные приступы могут возникать в результате отсутствия ангиогенеза, который обычно необходим для естественного заживания. Настоящее изобретение рассматривает лечение таких пациентов с повышенным риском заболевания вышеперечисленными болезнями. Другие пациенты, которые являются кандидатами на получение антител или пептидов по данному изобретению, являются пациентами с повышенным риском развития, аномальной пролиферации фиброваскулярной ткани, розовых угрей, синдрома приобретнного иммунодефицита, артериальной окклюзии,атопического кератита, болезни Бехчета, кровяных опухолей, обструктивного заболевания сонной артерии, хороидальной неоваскуляризации, хронического воспаления, хронической почечной недостаточности, хронического увеита, хронический витрит, усталости от ношения контактных линз, отторжения трансплантата роговицы, корнеальной васкуляризации, неоваскуляризации трансплантата роговицы, болезни Крона, болезни Илза, эпидемического кератоконъюнктивита, грибковых язв, герпесных инфекций,инфекций опоясывающего лишая, синдромов гипервязкости, саркомы Капоши, лейкемии, липидной дегенерации, болезни Лайма, краевого кератоза, язва Мурена, микобактериальных инфекций, отличных от проказы, миопии, глазной неоваскулярной болезни, ямок в диске зрительного нерва (оптических ямок),синдрома Ослера-Вебера (Ослера-Вебера-Рандю), остеоартрита, болезни Педжета, pars planitis, пемфигоида, филектенулза, осложнений после облучения лазером, полиартериита, протозойных инфекций,эластомы, pterygium keratitis sicca, радиальной кератотомии, ретинальной неоваскуляризации, ретинопатии недоношенных, ретролентальной фиброплазии, саркоида, склерита, серповидноклетчатой анемии,синдрома Сегрена, солидных опухолей, болезни Старгартса (Stargarts), болезни Стивена-Джонсона, кератит верхних конечностей, краевой дегенерации Терриена, токсоплазмоза, травмы, опухолей саркомы Юинга, опухолей нейробластомы, опухолей остеосаркомы, опухолей ретинобластомы, опухолей рабдомиосаркомы, язвенного колита, закупорки вен, дефицита витамина А и саркоидоза Вегенера, нежелательного ангионеза, связанного с диабетом, паразитарными болезнями, аномального заживления ран,послеоперационной гипертрофии, поражения или травмы, подавления роста волос, ингибирования овуляции и образования жлтого тела, ингибирования имплантации и ингибирования развития эмбриона в матке. Антиангиогенная терапия применима при обычном лечении отторжения трансплантата, воспаления лгких, нефротического синдрома, преэклампсии, экссудативного перикардита, такого, который связан с перикардитом, плеврального выпота, заболеваний и нарушений, характеризующихся нежелательной сосудистой проницаемостью, например, отка, обусловленного опухолями мозга, злокачественных асцитов, синдрома Мейгса, воспаления лгких, нефротического синдрома, экссудативного перикардита,плеврального выпота, проницаемостью, связанной с сердечно-сосудистыми заболеваниями, такими как состояние после инфаркта миокарда и удара и т.п. Другие зависящие от ангиогенеза заболевания по данному изобретению включают ангиофиброму(аномальная кровь в сосудах, предрасположенных к кровотечению), неоваскулярную глаукому (рост кровеносных сосудов глаза), артериовенозные мальформации (аномальное сообщение между артериями и венами), не срастающиеся переломы (переломы, которые не заживают), артериосклерозные бляшки(отвердение артерий), пиогенную гранулму (общее кожное поражение, состоящее из кровеносных сосудов), склеродермию (форму соединительнотканой болезни), гемангиому (опухоль, состоящая из кровеносных сосудов), трахому (основная причина слепоты в странах третьего мира), гемартроза, спаек сосудов и гипертрофических рубцов (образование аномальных рубцов). Термин "VEGF" или "hVEGF" по данному описанию относится к содержащему 165 аминокислот человеческому сосудисто-эндотелиальному фактору роста и родственным содержащим 121, 189 и 206 аминокислот человеческим сосудисто-эндотелиальным факторам роста, описанным Leung et al. Science,246: 1306 (1989), и Houck et al. Mol. Endocrin., 5: 1806 (1991),наряду с их природными аллельными и процессированными формами. Термин "VEGF" также относится к факторам VEGF нечеловеческого вида,такого как мышь, крыса или примат. Иногда VEGF конкретного вида указан терминами, такими какhVEGF для человеческого VEGF, mVEGF для мышиного VEGF и т.д. Термин "VEGF" также использует- 18012835 ся в отношении усечнных (процессированных) форм полипептида, содержащих аминокислоты 8-109 или 1-109 из содержащего 165 аминокислот человеческого сосудисто-эндотелиального фактора роста. Ссылка на любую из этих форм VEGF может быть в данном изобретении, например, как "VEGF (8-109)","VEGF (1-109)" или "VEGF165". Положения аминокислот для "усечнного" нативного VEGF имеют нумерацию, указанную в последовательности нативного VEGF. Например, аминокислотное положение 17(метионин) в усечнном нативном VEGF также является положением 17 (метионин) в нативном VEGF. Усечнный нативный VEGF имеет аффинность связывания с KDR и Flt-1 рецепторами, сравнимую с аффинностью связывания нативного VEGF. Термин "вариант VEGF" по данному описанию относится к полипептиду VEGF, который включает одну или более аминокислотных мутаций в нативной последовательности VEGF. Возможно, одна или более аминокислотных мутаций включают аминокислотную(ые) замену(ы). Для более краткого обозначения VEGF вариантов по данному описанию следует заметить, что номера относятся к аминокислотному положению по всей аминокислотной последовательности предполагаемого нативного VEGF (предоставленного в Leung et al., см выше, и Houck et al., см. выше). Термины "рак" и "раковый" относятся к физиологическому состоянию или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется неконтролируемым ростом клеток. Примеры рака включают, но без ограничения, карциному, лимфому, бластому, саркому и лейкемию. Более конкретные примеры этих типов рака включают плоскоклеточный рак, мелкоклеточный рак лгкого,немелкоклеточный рак лгкого, рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, цервикальный рак, рак яичника, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой (ободочной) кишки, колоректальный рак, эндометриальный рак, рак слюнных желз, рак почки, рак простаты, рак вульвы, рак щитовидной железы, рак печени и различные типы рака головы и шеи. "Млекопитающее" для целей лечения относится к любому животному, классифицируемому как млекопитающее, включая человека, домашних и сельскохозяйственных животных, нечеловеческих приматов, и животных в зоопарках, спортивных животных, таких как собаки, лошади, кошки, коровы и т.д. Термин "противоопухолевая композиция" относится к композиции, применимой при лечении рака,содержащей, по меньшей мере, один активный терапевтический агент, например, "противораковый агент". Примеры терапевтических агентов (противораковых агентов) включают, но без ограничения, химиотерапевтические агенты, ингибиторы роста, цитотоксические агенты, агенты, применяемые в лучевой терапии, антиангиогенные агенты, апоптотические агенты, антитубулиновые агенты и другие агенты для лечения рака, такие как анти-HER-2 антитела, анти-CD20 антитела, антагонист рецептора эпидермального фактора роста (EGFR) (например, ингибитор тирозинкиназы), ингибитор HER1/EGFR (например, эрлотиниб (Tarceva), ингибиторы тромбоцитарного фактора роста (например, Gleevec (иматиниба мезилат, ингибитор СОХ-2 (например, целекоксиб), интерфероны, цитокины, антагонисты (например, нейтрализующие антитела), которые связываются с одной или более следующих мишеней:ErbB2, ErbB3, ErbB4, PDGFR-бета, BlyS, APRIL, BCMA или VEGF рецептор(ы), TRAIL/Apo2, и другие биоактивные и органические агенты, и т.д. Изобретение также включает их комбинации. Термин "меченный эпитопом" по данному описанию относится к мутантному антителу, слитому с"эпитопной меткой". У полипептида эпитопной метки достаточно остатков для того, чтобы создать эпитоп, против которого может быть создано антитело, но этот полипептид достаточно короток для того,чтобы препятствовать активности мутантного антитела. Эпитопная метка предпочтительно также совершенно уникальна, поэтому антитело против него практически не реагирует перекрстно с другими эпитопами. Подходящий полипептидный "хвост" в общем содержит по меньшей мере 6 аминокислотных остатков, и обычно около 8-50 аминокислотных остатков (предпочтительно примерно 9-30 остатков). Примеры включают Flu НА "хвостовой" полипептид и антитело к нему 12 СА 5 (Field et al. Mol. Cell. Biol. 8: 2159-2165 (1988; метку c-myc и антитела против не 8F9, 3 С 7, 6 Е 10, П 4, В 7 и 9 Е 10 (Evan et al. Mol.Cell. Biol. 5(12): 3610-3616 (1985); и гликопротеиновый D (gD) "хвост" и антитело к нему (Paborsky et al.,Protein Engineering 3(6): 547-553. В некоторых вариантах изобретения эпитопная метка представляет собой "эпитоп связывания с рецептором-"мусорщиком". Термин "цитотоксический агент" по данному описанию относится к веществу, которое ингибирует или предупреждает функцию клеток и/или вызывает нарушение клетки. Предполагается, что термин включает радиоактивные изотопы (например, I131, I125, Y90 и Re186), химиотерапевтические агенты и токсины, такие как ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения или их фрагменты."Химиотерапевтический агент" представляет собой химическое соединение, применимое для лечения рака. Примеры химиотерапевтических агентов включают алкилирующие агенты, такие как тиотепа иCYTOXAN циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа и карбоквон, метуредопа (meturedopa) и уредопа (uredopa); этиленимины и метиламеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; ацетогенины (в особенности буллатацин и буллатацинон); камптотецин(включая синтетический аналог топотекан); бриостатин; каллистатин; СС-1065 (включая его синтетиче- 19012835 ские аналоги адоцелезин (adozelesin), карцелезин и бицелезин); криптофицины (в частности криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-289 и СВ-ТМ 1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотный мустин, такой как хлорамбуцил,хлорнафазин, хлорфосфамид, этрамустин, ифосфамид, мехлоретамин, мехлоретамина оксида гидрохлорид, мелфалан, новембицин, фенестрин, преднимустин, трофосфамид, урацил-мустард; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимустин; антибиотики,такие как энедииновые антибиотики (например, калихеамицин, особенно калихеамицин гамма I1 и калихеамицин омега I1 (см., например, Agnew, Chem Intl. Ed. Engl., 33; 183-186 (1994; динемицин, включая динемицин А; бисфосфонаты, такие как клодронат; эсдерамицин; а также неокарциностатин хромофор и родственные антибиотические хромофоры хромопротеина энедиина), аклациномизины, актиномицины,отрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-норлейцин, ADRIAMICIN доксорубицин (включая морфолино-доксорубицин, цианоморфолино-доксорубицин и дезоксидоксорубицин),эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофенольную кислоту, ногаламицин, оливомицин, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин (zinostatin), зорубицин; антиметаболиты, такие как метотрексат и 5 флуорацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6 меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6 азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; антиадреналины, такие как аминоглутетимид, митотан, трилостан, компенсатор (пополнитель) фолиевой кислоты, такой как фролиновая кислота; ацеглатон; гликозид альдофосфамид; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатрексат; дефофамин; демекольцин; диазиквон; эльфорнитин; ацетат эллиптиния; эпотилон; этоглюцид; нитрат галлия; гидроксимочевину; лентинан; лониданин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопидамнол; нитраерин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновую кислоту; 2 этилгидразид; прокарбазин; PSK комплекс полисахаридов (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран, спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2"-трихлортриэтиламин; трихотецены (особенно Т-2 токсин, верракурин А, роридин А и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-C"); циклофосфамид; тиотепа; таксоиды, например, TAXOL паклитаксел (Bristol-Myers Squibb Oncology, Princeton,N.J.), ABRAXANE не содержащий кремофора препарат паклитаксела с наночастицами альбуминаRorer, Antony, France); хлорамбуцил; GEMZAR гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; платиновые аналоги, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; NAVELBINE винорелбин; новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; кселода; ибандронат; иринотекан (Camptosar, СРТ-11) (включая схему лечения иринотеканом с 5-FU и леуковорином); ингибитор топоизомеразы RFS 2000; дифторметилорнитин(DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин; комбретастатин; леуковорин (LV); оксалиплатин, включая схему лечения с оксалиплатином (FOLFOX); ингибиторы РКС-альфа, Raf, H-Ras,EGFR (например, эрлотиниб (Tarceva и VEGF-A, которые снижают пролиферацию клеток, и фармацевтически приемлемые соли, кислоты или производные любого из вышеперечисленных агентов. Также данное определение охватывает антигормональные агенты, которые регулируют или ингибируют действие гормонов, такие как селективные модуляторы рецепторов эстрогенов (SERM), включая,например, тамоксифен (включая NOLVADEX тамоксифен), ралоксифен, дролоксифен, 4 гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и FARESTON торемифен; ингибиторы ароматазы, которые регулируют продуцирование эстрогена в надпочечниках, например, такие как 4(5)-имидазолы, аминоглютетимид, MEGASE мегестрола ацетат, AROMASIN эксеместан, форместан, фадрозол, RIVISOR ворозол, FEMARA летрозол и ARIMIDEX анастрозол; и антиандрогены,такие как флутамид, нилутамид, леупролид и гозелерин; а также троксацитабин (1,3-диоксолановый нуклеозид, аналог цитозина); антисмысловые олигонуклеотиды, в частности, те, которые ингибируют экспрессию генов, при которой пути передачи сигнала связаны с аберрантной пролиферацией клеток, например, такие как РКС-альфа, Raf и H-Ras; рибозимы, такие как ингибиторы экспрессии VEGF (например, ANGIOZYME рибозим) и ингибитор экспрессии HER2; вакцины, такие как генно-терапевтические вакцины, такие как, например, вакцина ALLOVECTIN, вакцина LEUVECTIN, и вакцина VAXTO;PROLEUKIN rIL-2; ингибитор LURTOTECAN топоизомеразы 1; ABARELIX rmRH; винорелбин и эсперамицины (см. патент США 4675187), и фармацевтически приемлемые соли, кислоты или производные любого из вышеперечисленных агентов. Термин "пролекарство", применяемый в данном изобретении, относится к предшественнику или производному фармацевтически активного вещества, которое менее токсично в отношении опухолевых- 20012835 клеток по сравнению с исходным лекарственным веществом и способно ферментативно активироваться или превращаться в более активную исходную форму. См., например, Wilman, "Prodrugs in Cancer Chemotherapy" Biochemical Society Transactions, 14, pp. 375-382, 615th Meeting Belfast (1986) и Stella et al.,"Prodrugs: A Chemical Approach to Targeted Drug Delivery," Directed Drug Delivery, Borchardt et al., (ed.),pp. 247-267, Humana Press (1985). Пролекарства по данному изобретению включают, но без ограничения,фосфатсодержащие пролекарства, тиофосфатсодержащие пролекарства, сульфатсодержащие пролекарства, пептидсодержащие пролекарства, пролекарства, модифицированные с помощью D-аминокислот,гликозилированные пролекарства, -лактамсодержащие пролекарства, необязательно замещнные феноксиацетамидсодержащие пролекарства или необязательно замещнные фенилацетамидсодержащие пролекарства, 5-флуороцитозиновые и другие 5-флуороуридиновые пролекарства, которые можно превратить в более активное цитотоксическое лекарственное вещество. Примеры цитотоксических лекарственных веществ, которые могут быть дериватизированы в форму пролекарства по данному изобретению,включают, но без ограничения, описанные выше химиотерапевтические агенты. Для лечения ревматоидного артрита пациента можно лечить антителом по изобретению в сочетании с любым из нижеприведнных лекарств: DMARDS (модифицирующие болезнь противоревматические препараты (например, метотрексат), NSAI или NSAID (нестероидные противовоспалительные препараты или средства, НСПВП или НСПВС), HUMIRA (адалимубаб; Abbott Laboratories), ARAVA(лефлюномид), REMICADE (инфликсимаб; Centocor Inc., of Malvern, Pa), ENBREL (этанерцепт; Immunex, WA), ингибиторы СОХ-2. Препаратами DMARD, обычно применяемыми при RA, являются гидроксихлорокин, сульфасалазин, метотрексат, лефлюномид, этанерцепт, инфликсимаб, азатиоприн, Dпеницилламин, золото (перорально), золото (внутримышечно), миноциклин, циклоспорин, иммуноадсорбция с использованием белка А стафилококка. Адалимубаб представляет собой человеческое моноклональное антитело, которое связывается с TNF. Инфликсимаб является химерным моноклональным антителом, которое связывается с TNF. Этанерцепт представляет собой слитый белок "иммуноадгезин",состоящий из внеклеточного лигандсвязывающего участка человеческого рецептора фактора некроза опухолей (TNFR) протяжнностью 75 кДа (р 75), связанного с Fc областью человеческого IgG1. Об общепринятых способах лечения RA см., например, "Guidelines for the management of rheumatoid arthritis"ArthritisRheumatism 46(2): 328-346 (February, 2002). В конкретном варианте изобретения пациента сRA лечат с применением антитела CD20 по изобретению в сочетании с метотрексатом (МТХ). Типичная доза МТХ составляет около 7.5-25 мг/кг/неделя. МТХ можно вводить перорально или подкожно. При анкилозирующем спондилоартрите и болезни Крона пациента можно лечить антителом по изобретению в сочетании, например, с Remicade (инфликсимаб; от Centocor Inc., of Malvern, Pa.), ENBREL(этанерцепт; Immunex, WA). Для лечения SLE пациенту можно давать антитело по изобретению в сочетании, например, с высокой дозой кортикостероидов и/или циклофосфамида (HDCC). Для лечения псориаза пациенту можно вводить антитело по изобретению в сочетании с препаратами местного действия, такими как стероиды местного действия, антралин, кальципотриен, клобетазол и тазаротен, или с метотрексатом, ретиноидами, циклоспорином, PUVA и UVB. В одном варианте изобретения больного псориазом лечат антителом с последовательным или одновременным введением циклоспорина."Выделенная" нуклеотидная молекула представляет собой нуклеотидную молекулу, которую идентифицируют и отделяют, по меньшей мере, от одной загрязняющей нуклеотидной молекулы, с которой она обычно ассоциируется в природном источнике нуклеиновой кислоты антитела. Выделенная нуклеотидная молекула находится в иной форме или в ином окружении, нежели в природе. Выделенные нуклеотидные молекулы отличаются от нуклеотидной молекулы, существующей в природных клетках. Однако выделенная нуклеотидная молекула включает нуклеотидную молекулу, содержащуюся в клетках,которые обычно экспрессируют антитело, где, например, нуклеотидная молекула находится в хромосоме в положении, отличном от е положения в природных клетках. Выражение "регуляторные последовательности" относится к последовательностям ДНК, необходимым для экспрессии функционально связанной кодирующей последовательности в конкретном организме-хозяине. Контролирующие последовательности, применимые для прокариот, например, включают промотор, возможно оператор, и сайт связывания рибосом. Известно, что эукариотические клетки используют промоторы, сигналы полиаденилирования и энхансеры. Нуклеиновая кислота "функционально связана", когда она находится в функциональной связи с другой нуклеотидной последовательностью. Например, ДНК для препоследовательности или секреторного лидера функционально связана с ДНК полипептида, если он экспрессируется в виде пребелка, который принимает участие в секреции полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию последовательности; или сайт связывания рибосом функционально связан с кодирующей последовательностью, если он позиционирован таким образом, чтобы облегчить трансляцию. Вообще "функционально связанный" означает, что последовательности ДНК, будучи связанными, являются непрерывными и, в случае секреторного лидера, непре- 21012835 рывными и в фазе считывания. Однако энхансеры не обязательно должны быть непрерывными. Связывание выполняется лигированием в соответствующих сайтах рестрикции. Если таких сайтов нет, то, в соответствии с обычной практикой, используют синтетические олигонуклеотидные адаптеры или линкеры. Применяемые в данном описании выражения "клетка", "линия клеток", "клеточная линия" и "культура клеток" ("клеточная культура") применяются взаимозаменяемо (поочердно) и все эти выражения включают потомство. Так, слова "трансформант" и "трансформированная клетка" включают клетки и культуры первичного субъекта, полученные при его использовании вне зависимости от числа пассажей. Понятно также, что все потомки могут не быть полностью идентичными по составу ДНК вследствие умышленных или случайных мутаций. Охватывается мутантное потомство, имеющее ту же самую функцию или биологическую активность, которая найдена в первоначально трансформированной клетке. Из контекста будет ясно, где предполагаются определнные обозначения.II. Способы осуществления изобретения. Синтетические высокоаффинные антитела против VEGF. Изобретение по данному описанию охватывает новые анти-VEGF антитела с высокой аффинностью связывания с VEGF. Типичные способы получения антител более подробно описаны в следующих разделах. Новые антитела против VEGF выбирают, используя антиген VEGF млекопитающего первого вида. Предпочтительно антигеном является человеческий VEGF (hVEGF). Однако в качестве первого нацеленного антигена могут применяться VEGF других видов, такие как мышиный VEGF (mVEGF). VEGF антигены млекопитающих различных видов можно выделять из природных источников. В других вариантах изобретения антиген получают методом рекомбинантной ДНК или другими известными в уровне техники методами. Выбранное антитело обычно имеет достаточно сильную аффинность к первому VEGF антигену. Например, антитело может связывать hVEGF с величиной Kd не более примерно 5 нМ, предпочтительно не более примерно 2 нМ и более предпочтительно не выше примерно 500 пМ. Аффинности антител можно определить, например, методом поверхностно-плазмонного резонанса (такого как анализ BIAcore,описанный в примерах); твердофазным иммуносорбентным анализом (ELISA); конкурентными анализами (например, RIA, РИА). Также антитело можно анализировать другими методами анализа биологической активности, например, чтобы оценить его эффективность в качестве терапевтического средства. Такие анализы известны в уровне техники и зависят от нацеленного антигена и предполагаемого применения антитела. Примеры включают анализ ингибирования HUVEC (описанный ниже, в примерах); анализы ингибирования фактора некроза опухолевых клеток (описанные, например, в WO 89/06692); анализы антителозависимой клеточной цитотоксичности (ADCC) и комплементзависимой клеточной цитотоксичности (CDC) (патент США 5500362); и анализ агонистической активности или гемопоэз (см. WO 95/27062). Для скрининга антител, которые связываются с конкретным эпитопом на представляющем интерес антигене, можно проводить обычный анализ кросс-блокирования, такой, который описан в Antibodies, ALaboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988). Или же для того, чтобы определить, связывается ли антитело с интересующим нас эпитопом, можно осуществлять эпитопное картирование, например, описанное в Champe et al., J. Biol. Chem. 270: 1388-1394 (1995). Затем определяют видоспецифичности новых антител. Аффинность связывания антитела с гомологом антигена, применяемую для того, чтобы выбрать антитело (если гомолог из "млекопитающего второго вида"), оценивают такими методами, как описанные выше. В предпочтительных вариантах изобретения млекопитающее второго вида является нечеловеческим млекопитающим, которому антитело вводят в преклинических исследованиях. Соответственно, млекопитающее второго вида может быть нечеловеческим приматом, таким как макака-резус, макака циномолгус, бабуин, шимпанзе и макака. В другом варианте изобретения млекопитающим второго вида может быть, например, грызун (например, мышь или крыса), кошка или собака. Хотя предпочтительным методом определения по данному изобретению видозависимости (и оценки мутантных антител с улучшенными свойствами; см. ниже) является количественный расчт аффинности связывания антитела, в других вариантах изобретения вместо определения аффинности связывания,или в дополнение к определению аффинности связывания, оцениваются одно или более биологических свойств синтетического антитела и вариантных антител. Примеры таких биологических анализов даны выше. Такие анализы в особенности применимы там, где они предоставляют данные, относящиеся к терапевтической эффективности антитела. Обычно, хотя не обязательно, антитела, которые проявляют улучшенные свойства в таких анализах, обладают также повышенной аффинностью связывания. Так, в одном варианте изобретения, в котором избранным анализом является анализ биологической активности,иной, нежели аффинность связывания, видозависимое антитело обычно использует имеющий "биологическую активность" "материал" (например, антиген, клетку, ткань, орган или целое животное) млекопитающего второго вида, которая по меньшей мере примерно в 50 раз, или по меньшей мере в 500 раз, или по меньшей мере примерно в 1000 раз менее эффективна, чем его (видеоспецифического антитела) био- 22012835 логическая активность в соответствующем анализе с применением реагентов, полученных из млекопитающего первого вида. Видозависимое антитело затем изменяют таким образом, чтобы получить мутантное антитело,имеющее более сильную аффинность связывания с антигеном млекопитающего второго вида, чем видозависимое антитело. Мутантное антитело предпочтительно имеет аффинность связывания с антигеном от нечеловеческого млекопитающего, которое по меньшей мере примерно в 10 раз сильнее, предпочтительно по меньшей мере примерно в 20 раз сильнее, более предпочтительно по меньшей мере примерно в 50 раз сильнее и иногда по меньшей мере примерно в 100 раз или в 200 раз сильнее, чем аффинность связывания видозависимого антитела с антигеном. Повышение аффинности антитела, желательное или требуемое, зависит от начальной аффинности связывания видозависимого антитела. Если используемый анализ является анализом биологической активности, мутантное антитело предпочтительно имеет биологическую активность в выбранном методе анализа, которая по меньшей мере примерно в 10 раз лучше,предпочтительно по меньшей мере примерно в 20 раз лучше, более предпочтительно по меньшей мере примерно в 50 раз лучше и иногда по меньшей мере примерно в 100 раз или в 200 раз лучше, чем биологическая активность видозависимого антитела в этом анализе. Для получения мутантного антитела одно или более изменений (например, замен) вводятся в одну или более гипервариабельных областей видоспецифического антитела. Или же, или помимо этого, одно или более изменений (например, замен) остатков каркасной области можно ввести в видозависимое антитело, если они приведут к улучшению аффинности связывания мутантных антител с антигеном млекопитающего второго вида. Примеры остатков для модификации каркасной области включают такие остатки, которые прямо связываются с антигеном нековалентным связыванием (Amit et al. Science 233: 747753 (1986; взаимодействуют с/влияют на конформацию CDR (Clothia et al. J. Mol. Biol. 196: 901-917(1987; и/или принимают участие в VL-VH интерфейсе (находятся на границе раздела) (ЕР 239400 В 1). В некоторых вариантах изобретения модификация одного или более таких остатков каркасной области приводит к повышению аффинности связывания антитела с антигеном млекопитающего второго вида. Например, в данном варианте изобретения можно изменить примерно от одного до пяти остатков каркасной области. Иногда этого может быть достаточно для того, чтобы получить мутантное антитело,пригодное для применения в преклинических испытаниях, даже если в нм не изменн ни один из остатков гипервариабельной области. Однако обычно мутантное антитело содержит дополнительное(ые) изменение(ия) в гипервариабельной области. Остатки в гипервариабельной области, которые изменяются, можно изменять случайно (рандомизированно), особенно если исходная аффинность связывания видозависимого антитела с антигеном от млекопитающего второго вида такова, что такие рандомизированно продуцированные антитела можно легко подвергнуть скринингу. Один полезный метод получения таких мутантных антител называется "аланиновый сканирующий мутагенез" (Cunnungham and Wells Science 244: 1081-1085 (1989. В этом случае один или более остатков гипервариабельной области заменяют на аланиновый(е) или полиаланиновый(е) остаток (остатки) для того, чтобы повлиять на взаимодействие аминокислот с антигеном млекопитающего второго вида. Этот(эти) остаток(остатки) гипервариабельной области, проявляющий(ие) функциональную восприимчивость к заменам, затем уточняют, вводя дополнительные или другие мутации в сайты замен или вместо сайтов замен. Таким образом, хотя сайт для введения варианта аминокислотной последовательности задан, сама по себе природа (характер) мутации не обязательно должен быть предопределн. Полученные таким образом ala-мутанты подвергают скринингу на их биологическую активность по данному описанию. Другой метод получения таких мутантных антител включает созревание аффинности с применением фагового дисплея (Hawkins, et al., J. Mol. Biol. 254: 889-896 (1992) и Lowman et al. Biochemistry 30(45): 10832-10837 (19911. Короче говоря, несколько сайтов гипервариабельной области (например, 6-7 сайтов) подвергают мутациям с целью получить все возможные замены в каждом сайте. Мутантные антитела, полученные таким образом, визуализуют моновалентное антитело при использовании фаговых частиц нитевидных фагов в виде слияний с генным III продуктом М 13, упакованных внутри каждой частицы. Мутанты, полученные методом фагового дисплея, затем подвергают скринингу на их биологическую активность (например, аффинность связывания), раскрываемому в данном описании. Данное изобретение также включает более систематический метод идентификации аминокислотных остатков для модификации. Согласно данному методу идентифицируют остатки гипервариабельной области видозависимого антитела, которые участвуют в связывании с антигеном млекопитающего первого вида и эти остатки гипервариабельной области включают в связывание гомолога этого антигена от млекопитающего второго вида. Для того чтобы это осуществить, проводят аланиновый сканирующий мутагенез остатков гипервариабельной области видозависимого антитела, причм каждый ala-мутант проверяется на связывание с антигеном млекопитающего первого и второго вида. Или же в полученных методом РСА кристаллических структурах комплексов антитело-антиген анализируют контактирующие остатки, а также остатки окружения (как описано в Примерах). Тем самым идентифицируются остатки гипервариабельной области, участвующие в связывании антигена млекопитающего первого вида (на- 23012835 пример, человека), и остатки гипервариабельной области, участвующие в связывании гомолога антигена от млекопитающего второго вида (например, нечеловеческого млекопитающего). Предпочтительно такой(ие) остаток(ки) гипервариабельной области, которые принимают заметное участие в связывании антигена млекопитающего второго вида (например, нечеловеческого млекопитающего), но не антигена млекопитающего первого вида (например, человека), выбирают в качестве кандидатов для модификации. В другом варианте такой(ие) остаток(ки) гипервариабельной области, которые принимают заметное участие в связывании антигена как млекопитающего второго вида, так и млекопитающего первого вида, выбирают в качестве возможных модифицируемых остатков (см. далее пример). Ещ в одном дополнительном, но менее предпочтительном варианте изобретения такие остатки, участвующие в связывании антигена млекопитающего первого вида, но не млекопитающего второго вида, выбирают для модификации. Такая модификация может включать делецию остатка или инсерцию одного или более остатков, прилегающих к этому остатку. Однако обычно модификация включает замену остатка на другую аминокислоту. Обычно начинают с консервативной замены, такой как приведнная ниже под заголовком "предпочтительные замены". Если такие замены приводят к изменению биологической активности (например,аффинности связывания), тогда вводят более значительные изменения, в представленной ниже таблице обозначенные как "типичные замены", или замены, подробнее описанные ниже в ссылке на классы аминокислот, и продукт подвергают скринингу. Предпочтительные замены Ещ более значительные модификации биологических свойств антител осуществляют, выбирая замены, которые значительно отличаются по своему действию на сохранение (а) структуры полипептидного остова в области замены, например, в виде складчатой или спиральной конформации, (б) заряда или гидрофобности молекулы в нацеленном сайте или (в) размера боковой цепи. Природные остатки делятся на группы на основе свойств боковых цепей:(5) остатки, влияющие на ориентацию цепи: gly, pro; и(6) ароматические: trp, tyr, phe. Неконсервативные замены влекут за собой обмен члена одного из этих классов на другой класс. В другом варианте изобретения сайты, выбранные для модификации, представляют собой сайты, в которых с применением фагового дисплея (см. выше) осуществляется созревание аффинности. Нуклеотидные молекулы, кодирующие мутантные аминокислотные последовательности, получают различными методами, известными в технике. Эти методы включают, но без ограничения, опосредованный олигонуклеотидами (или сайт-направленный) мутагенез, ПЦР мутагенез и кассетный мутагенез ранее полученного мутантного или немутантного варианта видозависимого антитела. Предпочтительным методом получения мутантов является сайт-направленный мутагенез (см., например, Kunkel, Proc. Natl.Acad. Sci. USA 82: 488 (1985. В некоторых вариантах изобретения мутантное антитело содержит только единичный заменнный остаток в гипервариабельной области. В других вариантах изобретения заменено два или более остатков в гипервариабельной области видозависимого антитела, например примерно произведено от двух до десяти замен в гипервариабельной области. Например, "муринизированный" вариант антитела противVEGF из представленного ниже примера содержит четыре замены в гипервариабельной области. Обычно мутантное антитело с улучшенными биологическими свойствами имеет аминокислотную последовательность, по меньшей степени на 75% идентичную или аналогичную (сходную) аминокислотной последовательности вариабельного домена либо тяжлой, либо лгкой цепи видозависимого антитела, более предпочтительно по меньшей степени на 80%, более предпочтительно по меньшей степени на 85%, более предпочтительно по меньшей степени на 90% и наиболее предпочтительно по меньшей степени на 95%. Идентичность или сходство в отношении данной последовательности определяется в данном описании как процентное содержание аминокислотных остатков в кандидатной (предполагаемой) последовательности, которые идентичны (т.е. тот же самый остаток) остаткам видозависимого антитела или сходны (т.е. аминокислотный остаток является остатков из той же самой группы на основе общих свойств боковой цепи, см. выше) с остатками видозависимого антитела, после выравнивания последовательностей и введения гэпов, для достижения максимальной идентичности последовательностей в про- 24012835 центах. Подразумевается, что ни одно из N-концевых, С-концевых или внутренних расширений, ни одна из делеций или инсерций в последовательность антитела вне вариабельного домена не влияют на идентичность или сходство последовательностей. После получения мутантного антитела определяют биологическую активность этой молекулы по сравнению с видозависимым антителом. Как отмечается выше, это может включать определение аффинности и/или другой биологической активности антитела. В предпочтительном варианте изобретения готовят панель мутантных антител как указано выше и подвергают скринингу на аффинность связывания с антигеном млекопитающего второго вида. Одно или более мутантных антител, выбранных в результате этого первоначального скрининга, необязательно проверяют с помощью одного или более дополнительных методов анализа на биологическую активность для подтверждения того, что мутантное(ые) антитело(а) с повышенной аффинностью связывания действительно применимы, например, в преклинических исследованиях. В предпочтительных вариантах изобретения мутантное антитело сохраняет способность связываться с антигеном млекопитающего первого вида с аффинностью связывания, аналогичной аффинности связывания с видозависимым антителом. Этого можно достичь, избегая того, чтобы изменялись остатки гипервариабельной области, участвующие в связывании антигена млекопитающего первого вида. В других вариантах изобретения мутантное антитело может иметь заметно изменнную аффинность связывания с антигеном млекопитающего первого вида (например, аффинность связывания с этим антигеном предпочтительно лучше, но может быть хуже, чем у видозависимого антитела). Выбранное(ые) таким образом мутантное(ые) антитело(а) можно подвергать дальнейшим модификациям, часто зависящим от предполагаемого применения антитела. Такие модификации могут включать дальнейшее изменение аминокислотной последовательности, слияние с гетерологическим(и) полипептидом(ами) и/или ковалентные модификации, такие как модификации, представленные выше. Что касается изменений аминокислотных последовательностей, типичные модификации представлены выше. Например, любой цистеиновый остаток, не включнный в сохранение надлежащей конформации мутантного антитела, также может быть заменн, обычно на серин, для повышения устойчивости к окислению молекулы и предупреждения аберрантного перекрстного связывания. Напротив, цистеиновую(ые) связь(и) можно добавлять к антителу для повышения его устойчивости (в особенности если антитело является фрагментом антитела, таким как фрагмент Fv). Другой тип аминокислотного мутанта имеет изменнный паттерн гликозилирования. Этого можно достичь делецией одного или более углеводных фрагментов,которые присутствуют в антителе, и/или добавлением одного или более сайтов гликозилирования, которые отсутствуют в антителе. Гликозилирование антител обычно является либо N-, либо Огликозилированием. N-гликозилирование обычно относится к связыванию углеводного фрагмента с боковой цепью аспарагинового остатка. Трипептидные последовательности аспарагин-Х-серин и аспарагин-Х-треонин, где X обозначает любую аминокислоту, кроме пролина, являются последовательностями узнавания для ферментативного присоединения углеводной частицы к боковой цепи аспарагина. Таким образом, присутствие любой их этих трипептидных последовательностей в полипептиде создат потенциальный сайт гликозилирования. О-гликозилирование относится к связыванию одного из сахаров Nацетилгалактозамина, галактозы или ксилозы с гидроксиламинокислотой, обычно серином или треонином, хотя также можно использовать 5-гидроксипролин или 5-гидроксилизин. Введение сайтов гликозилирования в антитело удобно выполнять, изменяя аминокислотную последовательность таким образом,чтобы она содержала одну из вышеприведнных трипептидных последовательностей (для N-связанных сайтов гликозилирования). Изменение можно также сделать путм добавления или замены с помощью одного или более сериновых или треониновых остатков к или в последовательности первоначального антитела (для О-связанных сайтов гликозилирования). Методы получения антител, которые могут быть видозависимыми и, следовательно, требуют модификации по представленным в данном описании способам, следующие. А. Получение высокоаффинных антител против VEGF из синтетической фаговой библиотеки антител. Изобретение также включает способ получения и селекции новых высокоаффинных анти-VEGF антител уникальным методом фагового дисплея. Метод включает получение синтетических фаговых библиотек антител на единичной каркасной матрице, дизайн достаточного разнообразия в вариабельных доменах, визуализация полипептидов с разнообразными (диверсифицированными) вариабельными доменами, селекцию кандидатных антител с высокой аффинностью к нацеленному VEGF антигену и выделение отобранных антител. Подробности методов фагового дисплея можно найти, например, в предварительной заявке США 60/385338 (поданной 3 июня 2002 г.) и родственных заявках, полное содержание которых специально вводится в данное описание в качестве ссылки. В одном аспекте библиотеки антител, используемые в данном изобретении, можно создавать мутацией доступных для растворителя и/или высокодиверсных (с высоким разнообразием) положений по меньшей мере в одной CDR области вариабельного домена антитела. Некоторые из или все CDR могут быть мутантными, полученными методами по данному описанию. В некоторых вариантах изобретения предпочтительно получать библиотеки разнообразных антител с помощью мутаций положений в CDR- 25012835H1, CDR-H2 и CDR-H3 с образованием отдельной библиотеки, или с помощью мутаций положений вCDR-L3 и CDR-H3 с образованием отдельной библиотеки, или с помощью мутаций положений в CDRL3 и CDR-H1, CDR-H2 и CDR-H3 с образованием отдельной библиотеки. Библиотеку вариабельных доменов антитела можно создать, например, с мутациями в доступных для растворителя и/или высокодиверсных (с высоким разнообразием) положений в CDR-H1, CDR-H2 иCDR-H3. Другую библиотеку можно создать с мутациями в CDR-L1, CDR-L2 и CDR-L3. Эти библиотеки можно также использовать в сочетании друг с другом для создания связующих нужной аффинности. Например, после одного или более раундов селекции библиотек (вариабельных доменов) тяжлых цепей для связывания с нацеленным антигеном, библиотеку лгких цепей можно поместить в популяцию связующих тяжлой цепи для следующих раундов селекции с целью увеличения аффинности связующих. Предпочтительно, библиотеку создают заменой первоначальных аминокислот вариантными аминокислотами в CDR-H3 области вариабельного домена последовательности тяжлой цепи. Полученная библиотека может содержать множество последовательностей антитела, в которой разнообразие (множественность) последовательностей находится главным образом в CDR-H3 области последовательности тяжлой цепи. В одном аспекте библиотеку создают в контексте (окружении) последовательности гуманизированного антитела 4D5, или каркасной аминокислотной последовательности гуманизированного антитела 4D5. Предпочтительно, библиотеку создают заменой, по меньшей мере, остатков 95-100 а тяжлой цепи на аминокислоты, кодируемые набором кодонов DVK, где набор кодонов DVK используют для кодирования набора вариантных аминокислот для любого из этих положений. Пример набора олигонуклеотидов, применимого для создания этих замен, содержит последовательность (DVK)7. В некоторых вариантах изобретения библиотеку создают заменой, по меньшей мере, остатков 95-100 а тяжлой цепи на аминокислоты, кодируемые наборами кодонов как DVK, так и NNK. Примером набора олигонуклеотидов,применимого для создания этих замен, является последовательность (DVK)7(NNK). В другом варианте изобретения библиотеку создают заменой, по меньшей мере, остатков 95-100 а тяжлой цепи на аминокислоты, кодируемые наборами кодонов как DVK, так и NNK. Пример набора олигонуклеотидов, применимого для создания этих замен, содержит последовательность (DVK)5(NNK). Другой пример подходящих олигонуклеотидных последовательностей, применимых для создания этих замен, содержит последовательность (NNK)6. Другие примеры подходящих олигонуклеотидных последовательностей специалист может определить в соответствии с критериями по данному описанию. В другом варианте изобретения использую различные дизайны CDR-H3 для выделения высокоаффинных связующих и для выделения связующих для множества эпитопов. Интервалы протяжнности(длины) CDR-H3, полученные в этой библиотеке, составляют 11-13 аминокислот, хотя можно получать также CDR-H3 иной длины. Разнообразие НЗ можно расширить, используя наборы кодонов NNK, DVK иNVK, а также более ограниченное разнообразие на N- и/или С-концах. Многообразие (разнообразие) можно также получить в областях CDR-H1 и CDR-H2. Дизайн разнообразия CDR-H1 и Н 2 следует стратегии нацеливания на то, чтобы имитировать спектр природных антител, описанный с модификацией, которая сосредоточена на разнообразии, более близко совпадающем с природным разнообразием, чем предыдущий дизайн. Для разнообразия в CDR-H3 можно по отдельности создать множественные библиотеки с Н 3 различной длины, а затем объединить, чтобы выбрать связующие для нацеленных антигенов. Множественные библиотеки можно объединять и осуществлять сортинг, используя методы твердофазной селекции и сортинга в растворе, описанные ранее и представленные ниже, в данном описании. Можно использовать многочисленные стратегии сортинга. Например, один вариант включает сортинг на мишени, связанной с тврдой фазой, с последующим сортингом по метке, которая может присутствовать в слитом полипептиде (например, анти-gD метка), а затем другой сортинг на мишени, связанной с тврдой фазой. Или же,библиотеки можно сортировать сначала на мишени, связанной с тврдой поверхностью, затем элюированные связующие сортируют, связывая с уменьшающимися концентрациями нацеленного антигена. Использование комбинаций различных методов сортинга обеспечивает минимизацию селекции лишь высокоэкспрессирующихся последовательностей и селекцию ряда различных высокоаффинных клонов. Высокоаффинные связующие для нацеленного VEGF антигена можно выделять из библиотек. Ограничение разнообразия в Н 1/Н 2 области снижает вырожденность примерно в 104-105 раз, а обеспечение большего разнообразия Н 3 дат связующие с более высокой аффинностью. Использование библиотек с различными типами разнообразия в CDR-H3 (например, полученных с применением DVK и NVT) обеспечивает выделение связующих, которые могут связываться с различными эпитопами нацеленного антигена. С помощью связующих, выделенных из описанных выше объединнных библиотек, было найдено,что аффинность можно дополнительно улучшить, обеспечивая ограниченное разнообразие в лгкой цепи. Разнообразие лгкой цепи создают в данном варианте изобретения следующим образом: в CDR-L1: аминокислоту в положении 28 кодируют при использовании RDT; аминокислоту в положении 29 кодируют с помощью RKT; аминокислоту в положении 30 кодируют с помощью RVW; аминокислоту в положении 31 кодируют с помощью ANW; аминокислоту в положении 32 кодируют с по- 26012835 мощью ТНТ; необязательно, аминокислоту в положении 33 кодируют с помощью CTG; аминокислоту в положении 50 кодируют с помощью KBG; аминокислоту в положении 53 кодируют с помощью AVC; и,необязательно, аминокислоту в положении 55 кодируют с помощью GMA; в CDR-L3: аминокислоту в положении 91 кодируют при использовании ТМТ или SRT или обоих; аминокислоту в положении 92 кодируют при использовании DMC; аминокислоту в положении 93 кодируют при использовании RVT; аминокислоту в положении 94 кодируют при использовании ТРТ; и аминокислоту в положении 96 кодируют при использовании TVT или YKG или обоих. В другом варианте изобретения создают библиотеку или библиотеки с разнообразием в областяхCDR-H1, CDR-H2 и CDR-H3. В этом варианте изобретения разнообразие в CDR-H3 получают, используя ряд длин участков Н 3 и, главным образом, наборы кодонов XYZ и NNK или NNS. Для специфичности клоны можно подвергнуть скринингу против заданного нацеленного антигена, а также других ненацеленных антигенов. Эти связующие с нацеленным VEGF антигеном затем можно подвергнуть скринингу на аффинность ELISA анализом конкурентного связывания в растворе или конкурентным спот-анализом. Связующие с высокой аффинностью можно выделят из библиотек с использованием наборов кодоновXYZ, как описано выше. Эти связующие можно легко получать в культуре клеток в виде антител или антигенсвязывающих фрагментов с высоким выходом. В некоторых вариантах изобретения может понадобиться получать библиотеки с большим разнообразием протяжнности области CDR-H3. Например, может быть желательным получить библиотеки областями CDR-H3 длиной около 7-19 аминокислот. Высокоаффинные связующие из библиотек в этих вариантах изобретения легко получают с высоким выходом в культуре бактериальных и эукариотических клеток. Можно создать векторы для того,чтобы легко удалять последовательности, такие как gD метки, последовательность вирусного оболочечного белкового компонента, и/или для того, чтобы добавлять в константные области последовательности для обеспечения продуцирования полноразмерных антител или антигенсвязывающих фрагментов с высоким выходом. Библиотеку с мутациями в CDR-H3 можно объединять с библиотекой, содержащей варианты других CDR, например, CDR-L1, CDR-L2, CDR-L3 и CDR-H1 и/или CDR-H2. Так, например, в одном варианте изобретения библиотеку CDR-H3 можно объединять с библиотекой CDR-L3, созданной в контексте последовательности гуманизированного 4D5 антитела с вариантными аминокислотами в положениях 28,29, 30, 31 и/или 32 с применением заданных наборов кодонов. В другом варианте изобретения библиотеку с мутациями в CDR-H3 можно объединять с библиотекой, содержащей вариант CDR-H1 и/или CDRH2 вариабельных доменов тяжлой цепи. В одном варианте изобретения библиотеку CDR-H1 создают с использованием последовательности гуманизированного антитела 4D5 с вариантами аминокислот в положениях 28, 30, 31, 32 и 33. Можно создать библиотеку CDR-H2 с использованием последовательности гуманизированного антитела 4D5 с вариантами аминокислот в положениях 50, 52, 53, 54, 56 и 58 с помощью заданных наборов кодонов. В. Векторы, клетки-хозяева и методы рекомбинантной ДНК. Анти-VEGF антитело по изобретению можно получать методом рекомбинантной ДНК с применением легкодоступных методов и материалов. Для получения антитела против VEGF методами рекомбинантной ДНК нуклеиновую кислоту, кодирующую его, выделяют и встраивают в реплицируемый вектор для дальнейшего клонирования (амплификация ДНК) или для экспрессии. ДНК, кодирующая антитело, легко выделяется или синтезируется обычными методами (например, с применением олигонуклеотидных зондов, способных связываться специфично с ДНК, кодирующими тяжлую и лгкую цепи антитела). Многие векторы являются доступными. Вектор обычно включает, но без ограничения, один или более из следующих компонентов: сигнальную последовательность, ориджин репликации, один или более маркерных генов, энхансер, промотор и последовательность терминации транскрипции.(i) Сигнальная последовательность. Антитело по данному изобретению можно получать методом рекомбинантной ДНК не только непосредственно, но также в виде слитого (составного, химерного) полипептида с гетерологическим полипептидом, который, предпочтительно, представляет собой сигнальную последовательность другого полипептида, имеющую специфический сайт расщепления на N-конце зрелого белка или полипептида. Выбранная предпочтительная гетерологическая сигнальная последовательность представляет собой последовательность, которая распознатся и процессируется (т.е. расщепляется сигнальной пептидазой) в клетке-хозяине. В случае прокариотических клеток-хозяев, которые не распознают и не процессируют нативную сигнальную последовательность антитела, сигнальная последовательность заменяется на прокариотическую сигнальную последовательность, выбранную, например, из группы лидерные пептиды щелочной фосфатазы, пенициллиназы, lpp или термоустойчивого энтеротоксина II. Для секреции в дрожжах нативную сигнальную последовательность можно заменить, например, на лидер инвертазы дрожжей, лидер глюкоамилазы С. albicans или на сигнал, описанный в WO 90/13646. Для экспрессии в клетках млекопитающих доступными являются сигнальные последовательности млекопитающих, а также вирусные секреторные лидеры, например gD сигнал герпес-вируса.(ii) Ориджин репликации. Как экспрессирующий, так и клонирующий векторы содержат нуклеотидную последовательность,которая позволяет вектору реплицироваться в одной или более выбранных клеток-хозяев. Обычно эта последовательность в клонирующих векторах является последовательностью, которая позволяет вектору реплицироваться независимо от хромосомной ДНК хозяина и включает ориджины репликации или автономно реплицирующиеся последовательности. Такие последовательности общеизвестны для различных бактерий, дрожжей и вирусов. Ориджин репликации плазмиды pBR322 пригоден для большинства грамотрицательных бактерий, ориджин плазмиды 2 применим для дрожжей, а ориджины различных вирусов (SV40, полиомы, аденовируса, VSV или BPV) пригодны для клонирования векторов в клетках млекопитающих. Вообще ориджин репликации не является необходимым для векторов экспрессии млекопитающих (ориджин репликации SV40 обычно используют только потому, что он содержит ранний промотор).(iii) Ген селекции. Экспрессирующие и клонирующие векторы могут содержать ген селекции, также называемый селективным (селектируемым) маркром. Типичные гены селекции кодируют белок, который (а) придат устойчивость к антибиотикам или другим токсинам, например ампициллину, неомицину, метотрексату или тетрациклину, (б) восполняет ауксотрофную недостаточность; или (в) поставляет важные нутриенты(питательные вещества), не поступающие из комплексных сред, например, ген, кодирующий Dаланинрацемазу для Bacilli. В одном примере селекционной схемы используется лекарственное вещество для прекращения роста клетки-хозяина. Такие клетки, которые успешно трансформируются при использовании гетерологического гена, продуцируют белок, который сообщает устойчивость к лекарству и, тем самым, сохраниться при этой схеме селекции. В примерах такой доминантной селекции используют лекарственные вещества неомицин, микофенольную кислоту и гиромицин. Другим примером подходящих селективных маркров для клеток млекопитающих являются такие селективные маркры, которые делают возможной идентификацию компетентных клеток, поглощающих нуклеиновую кислоту антитела, такие как DHFR, тимидинкиназа, металлотионеин-I и -II, предпочтительно, металлотионеиновые гены приматов, аденозиндеаминаза, орнитиндекарбоксилаза и т.д. Например, клетки, трансформированные с применением гена селекции DHFR, сначала идентифицируют, культивируя все трансформанты в культуральной среде, которая содержит метотрексат (Mtx),конкурентный антагонист DHFR. В случае использования DHFR дикого типа подходящей клеткойхозяином является клеточная линия яичников китайского хомячка (СНО), дефицитная по DHFR активности. Или же клетки-хозяева (в особенности хозяева дикого типа, которые содержат эндогенный DHFR),трансформированные или котрансформированные при использовании последовательностей ДНК, кодирующих антитело, белок DHFR дикого типа и другой селективный маркр, такой как аминогликозид 3'фосфотрансфераза (АРН), можно отбирать, выращивая клетки в среде, содержащей агент для селекции селективного маркра, такой как аминогликозидный антибиотик, например канамицин, неомицин илиG418. См. патент США 4965199. Геном селекции, подходящим для применения в дрожжах, является ген trp1, присутствующий в плазмиде дрожжей YRp7 (Stinchcomb et al., Nature, 282: 39 (1979. Ген trp1 предоставляет селективный маркр для мутантного штамма дрожжей, не способного расти в триптофане, например АТСС No. 44076 или РЕР 4-1. Jones, Genetics 85: 12 (1977). Наличие повреждения гена trp1 в геноме клетки-хозяина дрожжевой клетке в этом случае создат эффективное окружение для обнаружения трансформации с помощью выращивания в отсутствие триптофана. Аналогично, штаммы дрожжей, дефицитные по Leu-2,(ATCC 20622 или 38626), дополняются известными плазмидами, несущими ген Leu-2. Кроме того, векторы, полученные из 1.6 мкм круговой плазмиды pKD1, можно использовать для трансформации дрожжей Kluveromyces. Или же о системе экспрессии для получения в крупных масштабах телячьего химозина сообщалось для K.lactis. Van den Berg, Bio/Technology, 8: 135 (1990). Также описывались многокопийные векторы устойчивой экспрессии для секреции зрелого рекомбинантного человеческого сывороточного альбумина при использовании промышленных штаммов Kluveromyces. Fleer et(iv) Промотор. Экспрессирующий и клонирующий векторы обычно содержат промотор, узнаваемый организмомхозяином и функционально связывающийся с нуклеиновой кислотой антитела. Промоторы, пригодные для применения с прокариотическими хозяевами, включают промотор phoA, промоторные системы лактамазы и лактозы, щелочную фосфатазу, промоторную систему триптофана (trp) и гибридные промоторы, такие как промотор tac. Однако применимы другие известные бактериальные промоторы. Промоторы для применения в бактериальных системах также содержат последовательность Шайна-Дальгарно- 28012835 Промоторные последовательности известны для эукариот. В сущности все эукариотические гены содержат АТ-богатую область, расположенную примерно на расстоянии 25-30 оснований 3'-5' от сайта инициации транскрипции. Другой последовательностью, обнаруженной на расстоянии 70-80 основании 3'-5' от начала транскрипции многих генов, является область CNCAAT, где N может быть любым нуклеотидом. На 3' конце большинства эукариотических генов находится последовательность ААТААА,которая может быть сигнальной для присоединения поли(А) "хвоста" к 3' концу кодирующей последовательности. Все эти последовательности соответствующим образом вводятся в экспрессирующие векторы эукариот. Примеры подходящих промоторных последовательностей для применения в клетках-хозяевах дрожжевых клетках включают промоторы гена 3-фосфоглицераткиназы или других гликолитических ферментов, таких енолаза, глицеральдегид-3-фосфатдегидрогеназы, гексокиназы, пирувата декарбоксилазы, фосфофруктокиназы, глюкоза-6-фосфатизомеразы, 3-фосфоглицератмутазы, пируваткиназы, триозофосфатизомеразы, фосфоглюкозоизомеразы и глюкокиназы. Другие промоторы дрожжей, которые являются индуцибельными промоторами, имеющими дополнительное преимущество вследствие транскрипции, контролируемой условиями выращивания, представляют собой промоторы для алкогольдегидрогеназы, изоцитохрома С, кислой фосфатазы, расщепляющих ферментов, ассоциированных с азотным обменом (метаболизмом), металлотионеина, глицеральдегид-3-фосфатдегидрогеназы и ферментов, отвечающих за утилизацию мальтозы и галактозы. Векторы и промоторы, подходящие для применения в экспрессии в клетках дрожжей, подробнее описаны в ЕР 73657. Энхансеры дрожжей также преимущественно применяются с промоторами дрожжей. Транскрипция антитела с применением векторов в клетках-хозяевах млекопитающих осуществляется, например, под контролем промоторов, полученных из геномов вирусов, таких как вирус полиомы,вирус куриной оспы, аденовирус (такой как аденовирус 2), вирус бычьей папилломы, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита В и, наиболее предочтительно, вируса зелной мартышки 40 (SV40), из гетерологичных промоторов млекопитающих, например, промотора актина или промотора иммуноглобулина, промоторов теплового шока, при условии, что такие промоторы совместимы с системами клеток-хозяев. Ранний и поздний промоторы вируса SV 40 обычно получают в виде фрагмента рестрикции SV 40,которые также содержат вирусный ориджин репликации. Ближайший ранний промотор человеческого цитомегаловируса обычно получают в виде фрагмента рестрикции HindIII E. Система экспрессии ДНК в клетках-хозяевах млекопитающих с использованием вируса бычьей папилломы в качестве вектора раскрывается в патенте США 4419446. Модификация этой системы описана в патенте США 4601978. См. также Reyes et al., Nature 297: 598-601 (1982) об экспрессии кДНК человеческого -интерферона в мышиных клетках под контролем промотора тимидинкиназы герпес-вируса. Или же в качестве промотора можно использовать длинный концевой повтор вируса саркомы Рауса.(v) Энхансерные элементы. Транскрипция кДНК, кодирующей антитело по данному изобретению, высшими эукариотами часто повышается при инсерции энхансера в вектор. В настоящее время известно много энхансерных последовательностей генов млекопитающих (глобина, эластазы, альбумина, -фетопротеина и инсулина). Однако обычно используют эукариотический вирусный энхансер. Примеры включают энхансер SV40 на поздней стороне ориджина репликации (п.о. 100-270), ранний промотор энхансер цитомегаловируса, энхансер полиомы на поздней стороне ориджина репликации и энхансеры аденовируса. См. также Yaniv,Nature 297: 17-18 (1982) об энхансерных элементах для активации эукариотических промоторов. В результате сплайсинга энхансер может располагаться в векторе в положении 5' или 3' к последовательности, кодирующей антитело, но, предпочтительно, он расположен в сайте 5' от промотора.(vi) Компонент терминации транскрипции. Экспрессирующие векторы, используемые в эукариотических клетках-хозяевах (клетки дрожжей,грибов, насекомых, растений, животных, человека или ядросодержащие клетки других многоклеточных организмов), также содержат последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такими последовательностями являются обычно имеющиеся на 5' и, иногда, 3', нетранслируемые области эукариотических или вирусных ДНК или кДНК. Эти области содержат нуклеотидные сегменты, транскрибируемые в виде полиаденилированных фрагментов в нетранслируемом участке мРНК, кодирующей антитело. Одним применимым компонентом терминации транскрипции является область полиаденилирования бычьего гормона роста. См. WO 94/11026 и раскрываемый в этой заявке вектор экспрессии.(vii) Селекция (отбор) и трансформация клеток-хозяев. Подходящие клетки-хозяева для клонирования или экспрессии ДНК в векторах по данному описанию представляют собой прокариотические клетки, клетки дрожжей или высших эукариот, описанные выше. Подходящие для этой цели прокариоты включают эубактерии, такие как грамотрицательные или грамположительные организмы, например, Enterobacteriaceae, такие как Escherichia, например, E.coli,Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, Serratia, напри- 29012835 мер, Serratia marcescans, и Shigella, а также Bacilli, такие как В. subtilis и В. licheniformis (например, В.licheniformis 41P, раскрываемые в DD 266,710, опубликованном 12 апреля 1989 г.), Pseudomonas, такие как P. aeruginosa, и Streptomyces. Одними из предпочтительных E.coli хозяев для клонирования являютсяE.coli 294 (АТСС 31 446), хотя также пригодны другие штаммы, такие как E.coli В, E.coli X1776 (АТСС 31537) и E.coli W3110 (АТСС 27325). Эти примеры являются скорее иллюстративными, нежели ограничивающими. Помимо прокариот, подходящими хозяевами для клонирования или экспрессии векторов, кодирующих антитела, являются эукариотические микробы, такие как нитевидные грибы или дрожжи. Saccharomyces cerevisiae, или обычные пекарские дрожжи, являются наиболее общеупотребительными среди низших эукариотических микроорганизмов-хозяев. Однако общедоступными и применяемыми по данному описанию являются микроорганизмы других родов, видов и штаммов, такие как Schizosaccharomyces pombe; хозяева Kluyveromyces, например, такие как K.lactis, K.fragilis (АТСС 12424),K.bulgaricus (АТСС 16045), K.wickeramii (АТСС 24178), K.waltii (АТСС 56500), K.drosopilarum (АТСС 36906), K.thermotolerans, и K.marxianus, yarrowia (ЕР 402226); Pichia pastoris (ЕР 183070); Candida;Trichoderma reesia (ЕР 244234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; и нитевидные грибы, например, такие как Neurospora, Penicillium, Tolypocladium, и хозяева Aspergillus, такие как A.nidulans и A.niger. Клетки-хозяева, подходящие для экспрессии гликозилированного антитела, получают из многоклеточных организмов. Примеры клеток беспозвоночных включают растительные клетки и клетки насекомых. Идентифицированы многие бакуловирусные штаммы и варианты и соответствующие клеткихозяева разрешнных насекомых, таких как Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedesalbopictus (комар), Drosophila melanogaster (фруктовая мушка), и Bombyx mori. Общеизвестно множество вирусных штаммов для трансфекции, например, L-1 вариант Autographa californica NPV и штамм Bm-5Bombyx mori NPV, и такие вирусы можно использовать в качестве вирусов по описанию данного изобретения, в частности, для трансфекции клеток Spodoptera frugiperda. В качестве растений-хозяев можно также использовать хлопок, пшеницу, картофель, сою, петунью и табак. Однако наибольший интерес вызывают клетки позвоночных, и размножение клеток позвоночных в культуре (тканевой культуре) стало обычной процедурой. Примерами применяемых клеточных линий млекопитающих являются линия почечных клеток обезьян CV1, трансформированная с помощью SV40(C0S-7, АТСС CRL 1651); почечная линия клеток человеческого эмбриона (293 или 293 клетки, субклонированных для выращивания в суспензионной культуре клеток, Graham et al., J. Gen Virol 36: 59 (1977; почечные клетки детныша хомяка (BHK, АТСС CCL 10); клетки яичников китайского хомячка/DHFR(СНО, Urlaub et al., Proc. Natl. Acad. Sci. USA 77: 4216 (1980; мышиные sertoli клетки (ТМ 4, Mather,Biol. Reprod 23: 243-251 (1980; почечные клетки обезьян (CV1 АТСС CCL 70); почечные клетки африканской зелной мартышки (VERO-76, АТСС CRL-1587); человеческие клетки цервикальной карциномы(HELA, АТСС CCL 2); почечные клетки собак (MDCK, ATCC CCL 34); клетки печени крыс буффало(BRL 3 А, ATCC CRL 1442); клетки лгких человека (W138, ATCC CCL 75); клетки печени человека (HepG2, НВ 8065); клетки опухоли молочной железы мыши (ММТ 060562, ATCC CCL51); TRI клетки (Matheret al., Annals N.Y. Acad. Sci. 383: 44-68 (1982; клетки MRC 5; FS4 клетки; и клеточная линия человеческой гепатомы (Hep G2). Клетки-хозяева трансформируют вышеописанной экспрессией или клонированием векторов для продуцирования антител и культивируют в обычных питательных средах, модифицированных соответствующим образом для индуцирования промоторов, селекции трансформантов или амплификации генов,кодирующих заданные последовательности.(viii) Культивирование клеток-хозяев. Клетки-хозяева, используемые для продуцирования антитела по данному изобретению, можно культивировать в различных средах. Продажные среды, такие как Ham's F10 (среда Хэма) (Sigma), минимальная поддерживающая среда (Minimal Essential Medium) MEM), (Sigma), RPMI-1640 (Sigma), и среда Игла, модифицированная по Дульбекко DMEM), Sigma) применимы для культивирования клеток-хозяев. Кроме того, любую из сред, описанных в Ham et al., Meth. Enz. 58: 44 (1979), Barnes et al.,Anal. Biochem.102: 255 (1980), Патентах США 4767704; 4657866; 4927762; 4560655; или 5122469; WO 90/03430; WO 87/00195; или в Патенте Re (заменяющем) США 30985, можно использовать в качестве культуральных сред для клеток-хозяев. Любую из этих сред можно дополнить при необходимости гормонами и/или другими факторами роста (таким как инсулин, трансферрин или эпидермальный фактор роста), солями (таким как хлористый натрий, соли кальция, магния и фосфат), буферами (такими какHEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как препарат GENTAMYCIN), следовыми элементами (определяемыми как неорганические соединения, обычно присутствующими в микромолярных конечных концентрациях) и глюкозой или эквивалентным источником энергии. Можно также включать, в соответствующих количествах, любые другие необходимые добавки,известные специалистам в данной области техники. Условия в культуре, такие как температура, pH и т.п. такие, которые ранее применялись в случае клетки-хозяина, выбранной для экспрессии и которые очевидны для рядового специалиста.
МПК / Метки
МПК: C12N 15/13, C07K 16/00, A61P 35/00
Метки: фактора, vegf, антитела, сосудов, применения, против, роста, способы, эндотелия
Код ссылки
<a href="https://eas.patents.su/30-12835-antitela-protiv-faktora-rosta-endoteliya-sosudov-vegf-i-sposoby-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Антитела против фактора роста эндотелия сосудов (vegf) и способы их применения</a>
Предыдущий патент: Новые карбоксамидные соединения, обладающие антагонистическим в отношении мсн действием, содержащие эти соединения лекарственные средства и способ их получения
Следующий патент: Способ получения водорастворимых дитерпенов и их применение
Случайный патент: Синергичная гербицидная композиция, содержащая определенные пиридиновые или пиримидиновые карбоновые кислоты и определенные гербициды для зерновых культур и риса












