Ферментативное получение витамина с
Номер патента: 12165
Опубликовано: 28.08.2009
Авторы: Синдзон Масако, Даллуеге Мануэла, Тёпфер Кристине, Шеврё Бастьен, Гёзе Маркус, Бёзлен Оливье Мари-Габриэль, Мунси Найджел Джон, Схиппер Дик, Хаук Корина, Фоллебрехт Адрианус Вильхельмус Херманус, Майер Анн Франсуаз, Кукман Бертус Питер, Мейри Аня, Ли Конни, Гелдер Ван Марина
Формула / Реферат
1. Способ ферментативной продукции витамина С, где клетки хозяина культивируют в подходящих условиях культивации, что позволяет прямую продукцию витамина С из источника углерода, получаемую по пути метаболизма D-глюкозы или D-сорбита, и где геном упомянутой клетки хозяина является генетически измененным с помощью последовательности ДНК, включающей следующие полинуклеотиды:
а) полинуклеотид, кодирующий L-сорбозондегидрогеназу согласно ПОСЛ. ь 2, ее активный фрагмент или производное; и
б) хотя бы один полинуклеотид, кодирующий белок, выбранный из белков, вовлеченных в систему метаболизма сорбита/сорбозы (CMC), или белков, вовлеченных в систему дыхательной цепи (СДЦ);
и при необходимости, выделение витамина С из таких клеток или культуральной среды.
2. Способ по п.1, где экспрессия полинуклеотида по п.1а) относится к полинуклеотидной последовательности, которая в значительной степени идентична ПОСЛ. ь 1 и/или которую выбирают из группы, состоящей из:
а) полинуклеотидов, включающих нуклеотидную последовательность согласно ПОСЛ. ь 1;
б) полинуклеотидов, включающих нуклеотидную последовательность, полученную посредством амплификации нуклеиновой кислоты, такой как полимеразная цепная реакция, с применением геномной ДНК из микроорганизма в качестве матрицы и набора праймеров согласно ПОСЛ. ь 3 и ПОСЛ. ь 4;
в) полинуклеотидов, включающих нуклеотидную последовательность, кодирующую фрагмент или производное полипептида, включающего аминокислотную последовательность согласно ПОСЛ. ь 2 или кодирующую фрагмент или производное полипептида, кодируемого полинуклеотидом по любому из пп.а) или б), где у упомянутого производного или фрагмента один или более аминокислотный остаток консервативно замещен по сравнению с упомянутым полипептидом и упомянутый фрагмент или производное обладают активностью полипептида, с которым их сравнивают;
г) полинуклеотидов, комплементарные цепочки которых гибридизуются в жестких условиях с полинуклеотидом, кодирующим полипептид, включающий аминокислотную последовательность согласно ПОСЛ. ь 2, или полинуклеотидом, как определено по любому из пп.а)-в), которые кодируют полипептид, обладающий активностью L-сорбозондегидрогеназы; и
д) полинуклеотидов, которые не менее чем на 70%, а именно на 85, 90 или 95% идентичны полинуклеотиду, кодирующему полипептид, включающий аминокислотную последовательность согласно ПОСЛ. ь 2, или полинуклеотиду, как определено по любому из пп.a)-в), и которые кодируют полипептид, обладающий активностью L-сорбозондегидрогеназы;
или комплементарная цепочка такого полинуклеотида.
3. Способ по п.1 или 2, где упомянутая клетка хозяина включает полинуклеотид, кодирующий СДЦ белок, выбранный из группы, состоящей из белков, занятых в биосинтезе кофакторов и простетических групп и белков, выступающих в роли переносчиков, в частности белков, вовлеченных в биосинтез и развитие кофакторов и/или их предшественников, таких как ФАД, НАД, НАДФ, ПХХ, КоQ10, цитохромы а, b, c, d и гемы.
4. Способ по любому из пп.1-3, где упомянутая клетка хозяина содержит полинуклеотид, кодирующий CMC белок, выбранный из группы, состоящей из оксидоредуктаз [ЕС 1]; в частности оксидоредуктаз, действующих на СН-ОН группу доноров [ЕС 1.1].
5. Способ по любому из пп.1-4, где упомянутая клетка хозяина содержит хотя бы один полинуклеотид, выбранный из
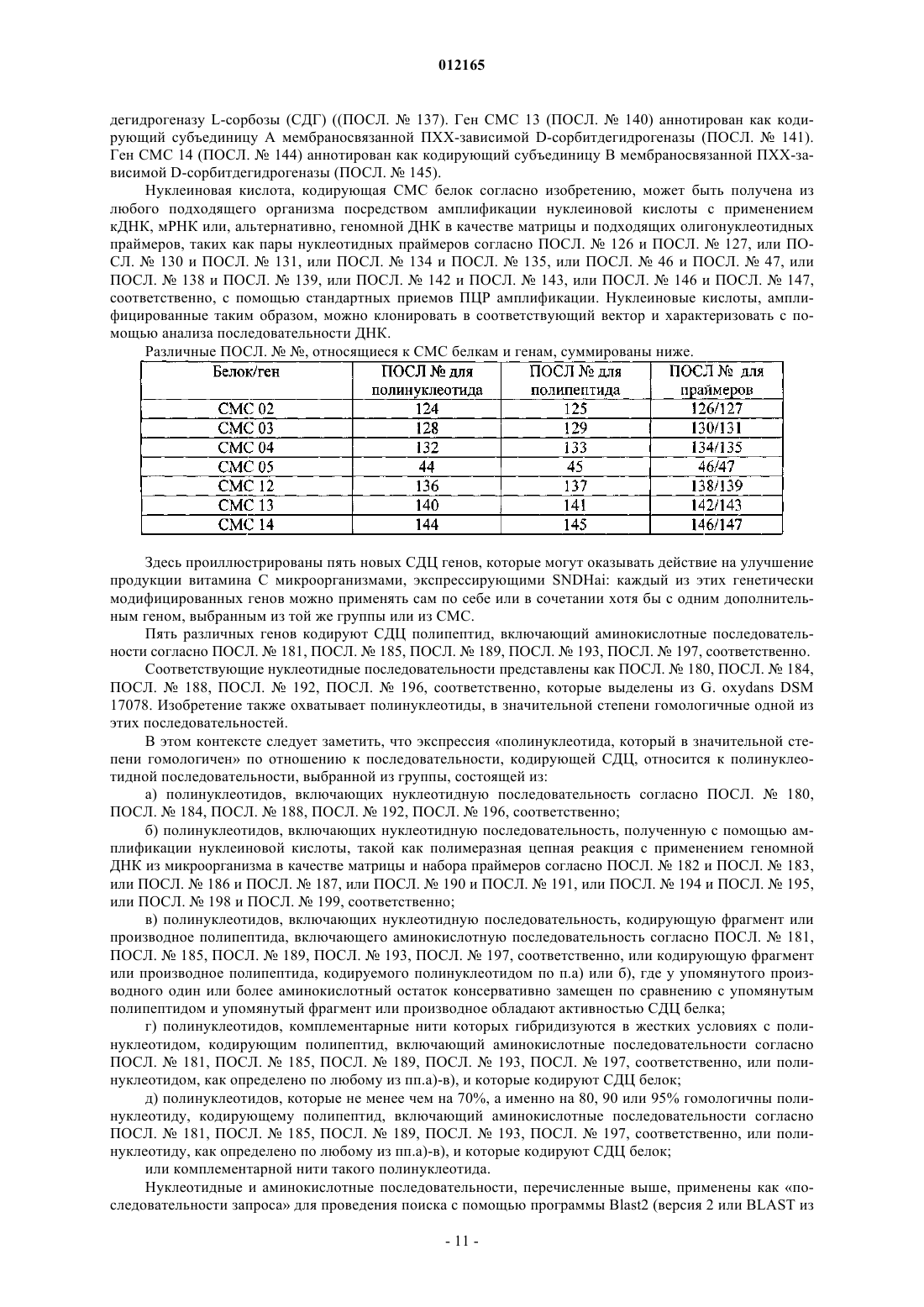
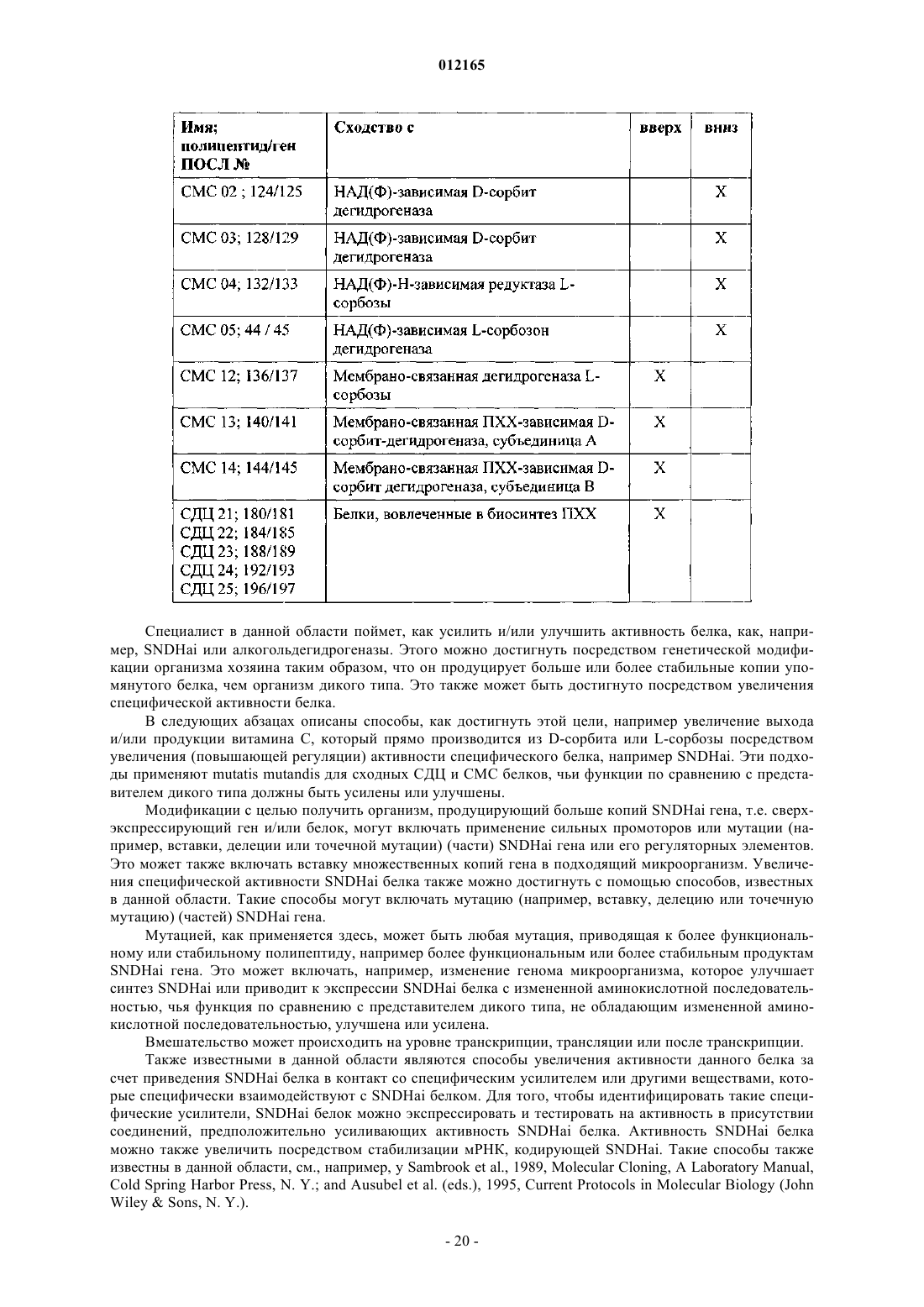
CMC группы, состоящей из ПОСЛ. ь 136, ПОСЛ. ь 140, ПОСЛ. ь 144 и их функциональных эквивалентов или гомологов; и
СДЦ группы, состоящей из ПОСЛ. ь 180, ПОСЛ. ь 184, ПОСЛ. ь 188, ПОСЛ. ь 192, ПОСЛ. ь 196 и их функциональных эквивалентов или гомологов.
6. Способ по любому из пп.1-5, где упомянутая клетка хозяина является генетически измененной с помощью хотя бы одного полинуклеотида с пониженной экспрессией или поврежденного из CMC группы, состоящей из ПОСЛ. ь 124, ПОСЛ. ь 128, ПОСЛ. ь 132, ПОСЛ. ь 44 и их функциональных эквивалентов или гомологов.
7. Способ по любому из пп.1-6, где упомянутую клетку хозяина культивируют в водной питательной среде в условиях, позволяющих прямую продукцию витамина С из D-сорбита или L-сорбозы.
8. Способ по любому из пп.1-7, где генетически измененная клетка хозяина является прокариорической клеткой, выбранной из группы, состоящей из Pseudomonas, Pantoea, Escherichia, Corynebacterium, Ketogulonicigenium и уксусно-кислых бактерий, как, например, Gluconobacter, Acetobacter или Gluconacetobacter, предпочтительно Acetobacter sp., Acetobacter aceti, Gluconobacter frateurii, Gluconobacter cerinus, Gluconobacter thailandicus, Gluconobacter oxydans, предпочтительно Gluconobacter oxydans, более предпочтительно
Gluconobacter oxydans DSM 17078.
9. Клетка хозяина, экспрессирующая полипептид, обладающий L-сорбозондегидрогеназной активностью, с аминокислотной последовательностью согласно ПОСЛ. ь 2, и/или содержащая полинуклеотид с ПОСЛ. ь 1, или полинуклеотид, гибридизующийся в строгих условиях с ПОСЛ. ь 1, причем указанная клетка хозяина генетически изменена с помощью хотя бы одного полинуклеотида, кодирующего белок, выбранный из белков, вовлеченных в систему метаболизма сорбита/сорбозы (CMC), или белков, вовлеченных в систему дыхательной цепи (СДЦ).
10. Клетка хозяина по п.9, где клетка хозяина является генетически измененной с помощью хотя бы одного полинуклеотида, как определено по любому из пп.2-6.
11. Клетка хозяина по п.9 или 10, где экспрессируется белок, выбранный из группы, состоящей из
ПОСЛ. ь 137, ПОСЛ. ь 141, ПОСЛ. ь 145;
ПОСЛ. ь 181, ПОСЛ. ь 185, ПОСЛ. ь 189, ПОСЛ. ь 193, ПОСЛ. ь 197
и их функциональных эквивалентов или гомологов.
12. Клетка хозяина по любому из пп.9-11, где белок, экспрессируемый на пониженном уровне или поврежденный, выбран из группы, состоящей из ПОСЛ. ь 125, ПОСЛ. ь 129, ПОСЛ. ь 133, ПОСЛ. ь 45 и их функциональных эквивалентов или гомологов.
13. Клетка хозяина по любому из пп.9-12, способная прямо продуцировать витамин С из D-сорбита в количествах 300 мг/л или более при измерении по способу для покоящихся клеток после периода инкубации 20 ч.
14. Клетка хозяина по любому из пп.9-12, способная прямо продуцировать витамин С из L-сорбозы в количествах 800 мг/л или более при измерении по способу для покоящихся клеток после периода инкубации 20 ч.
15. Клетка хозяина по любому из пп.9-14, которая является прокариотической клеткой, выбранной из группы, состоящей из Pseudomonas, Pantoea, Escherichia, Corynebacterium, Ketogulonicigenium и уксусно-кислых бактерий, таких как, например, Gluconobacter, Acetobacter или Gluconacetobacter, предпочтительно Acetobacter sp., Acetobacter aceti, Gluconobacter frateurii, Gluconobacter cerinus, Gluconobacter
thailandicus, Gluconobacter oxydans, предпочтительно Gluconobacter oxydans, более предпочтительно
Gluconobacter oxydans DSM 17078.
16. Способ получения клеток по п.9, включающий этап генетической модификации клеток с помощью полинуклеотидов, как определено по любому из пп.2-6.
17. Способ по п.16, где хотя бы одна из этих полинуклеотидных последовательностей изменена таким образом, который приводит к улучшенному выходу и/или эффективности получения витамина С у упомянутого микроорганизма.
Текст
012165 Область техники Настоящее изобретение относится к применению полинуклеотидов и полипептидов в качестве биотехнологических приемов при получении витамина С из микроорганизмов, где упомянутые полинуклеотиды и/или кодируемые ими полипептиды оказывают прямое или непрямое воздействие на выход, продукцию и/или эффективность получения продукта ферментации. Изобретение также относится к генетически модифицированным микроорганизмам и их применению для прямого получения витамина С. Уровень техники Витамин С является одним из очень важных и незаменимых факторов питания для человеческих существ. Витамин С применяется также при кормлении животных даже в случае, если некоторые сельскохозяйственные животные могут синтезировать его в своем организме. За последние 70 лет витамин С получают в промышленных масштабах из D-глюкозы с помощью хорошо известного способа Райхштайна. Все этапы этого процесса являются химическими, за исключением одного (превращения D-сорбита в L-сорбозу), который проводят с помощью микробного превращения. После его первоначального внедрения в промышленное производство витамина С применялись некоторые химические и технические модификации для улучшения эффективности способа Райхштайна. Недавние усовершенствования способа получения витамина С суммированы в Ульмановской энциклопедии промышленной химии Ullmann's Encyclopedia of Industrial Chemistry, 5th Edition, Vol. A27 (1996),pp. 547ff. Различные промежуточные этапы получения витамина С проводят с помощью микроорганизмов или изолированных из них ферментов. Так, 2-кето-L-гулоновая кислота (2-КГК), промежуточное соединение, которое можно химически превратить в витамин С с помощью реакции щелочной перегруппировки, может быть получена посредством ферментативного процесса из L-сорбозы с помощью штаммов,относящихся, например, к родам Ketogulonicigenium или Gluconobacter, или посредством другого ферментативного процесса из D-глюкозы с помощью рекомбинантных штаммов, относящихся к родамGluconobacter или Pantoea. Современные способы химического получения витамина С обладают некоторыми нежелательными характеристиками, такими как большое потребление энергии и использование больших количеств органических и неорганических растворителей. Поэтому в последние десятилетия проводится исследование других подходов к производству витамина С с применением превращения с участием микроорганизмов,что было бы более экономичным, а также экологичным. Ферментативное получение витамина С из ряда субстратов, включая D-сорбит, L-сорбозу или Lсорбозон, описано у ряда микроорганизмов, таких как водоросли и дрожжи, при применении разных способов культивации. Недостатком применения этих микроорганизмов, однако, является низкий выход получаемого витамина С; поскольку эти микроорганизмы, как известно, способны к производству как 2 кето-L-гулоновой кислоты, так и витамина С, выход продуцируемого микробиологически витамина С в этой связи ограничен относительно высокой продукцией 2-КГК, которая легче синтезируется упомянутыми микроорганизмами, что приводит, например, к тому, что соотношение концентраций витамина С и 2-КГК составляет менее 0,1. Поэтому желательно разработать системы, обладающие большей промышленной применимостью,например системы, модифицированные с целью увеличения титров и/или такие, у которых сокращены периоды ферментации. Одна особенно применимая система задействует гены, кодирующие мембраносвязанные L-сорбозондегидрогеназы или мембраносвязанные ПХХ (ПХХ, пирролохинолинхинон)зависимые D-сорбитдегидрогеназы. Пример такой системы применяет ген из Gluconobacter oxydans N44-1,кодирующий L-сорбозондегидрогеназу (здесь и далее называемый SNDHai), которая превращает L-сорбозон в L-аскорбиновую кислоту. Этот ген и его гомологи уже описаны в WO 2005/017159, который включен сюда. Имеется постоянная потребность в еще более оптимизированных ферментативных системах для микробиологического производства витамина С с целью достижения более высоких выходов, чем в системах, описанных выше. Сущность изобретения Неожиданно обнаружено, что в подходящих условиях культивации клетки хозяина, экспрессирующие SNDHai, можно применять для дальнейшей оптимизации прямой продукции витамина С. Этого можно достигнуть путем сопутствующего изменения специфического набора генов, как описано здесь далее. Такие гены можно выбирать из группы, состоящей из СДЦ или CMC генов. Эта группа генов/белков и осуществление изменений для каждого набора описаны и проиллюстрированы примерами далее. Термин прямая ферментация, прямая продукция, прямое превращение и т.п. означают, что микроорганизм способен превращать определенный субстрат в означенный продукт с помощью одного или более этапов биологического превращения без необходимости какого-либо дополнительного химического этапа превращения. Например, термин прямое превращение D-сорбита в витамин С обозначает процесс, где микроорганизм продуцирует витамин С и где D-сорбит применяется в качестве источника углерода без необходимости промежуточного этапа химического превращения. Одиночный микроор-1 012165 ганизм, способный к прямой ферментации витамина С, предпочтителен. Как применяется здесь, улучшенный или улучшенный выход витамина С, обусловленный генетическим изменением, означает увеличение не менее чем на 5, 10, 25, 30, 40, 50, 75, 100, 200 или даже более чем на 500% по сравнению с клетками, которые не изменены генетически. Такие неизмененные клетки также часто называют клетками дикого типа. Поэтому, во-первых, объектом настоящего изобретения является предоставление способа прямого ферментативного получения витамина С посредством культивации в подходящих условиях клетки хозяина, геном которой генетически изменен с помощью последовательностей ДНК, включающих следующие полинуклеотиды: а) полинуклеотид, кодирующий L-сорбозондегидрогеназу согласно номеру идентификации последовательности ПОСЛ.2 или его активный фрагмент или производное, и б) не менее одного полинуклеотида, кодирующего белок, выбранный из группы, состоящей из: 1) белков, включенных в систему метаболизма сорбита/сорбозы (CMC), и 2) белков, включенных в систему дыхательной цепи (СДЦ),и посредством выделения витамина С из таких клеток или культуральной среды. Термин генетически модифицированный или генетически измененный означает продуманное изменение структуры генетического материала живого организма. Это включает получение и применение рекомбинантных ДНК. Точнее, это применяется, чтобы отличить генетически измененный или модифицированный организм от организма, встречающегося в природе. Генетические изменения могут быть проделаны с помощью ряда технических приемов, известных в данной области, таких как, к примеру, замещение гена, амплификация гена, повреждение гена, трансфекция, трансформация с помощью плазмид, вирусов или других векторов. Генетически модифицированный организм, например генетически модифицированный микроорганизм, часто называют также рекомбинантным организмом, например рекомбинантным микроорганизмом.CMC белками являются белки, включенные в систему метаболизма сорбита/сорбозы. К полинуклеотидам и белкам, кодируемым этими полинуклеотидами, здесь применяется сокращение CMC. CMC белки функционируют в прямом метаболизме D-сорбита или L-сорбозы. СДЦ белки включены в систему дыхательной цепи. К полинуклеотидам и белкам, кодируемым этими полинуклеотидами, здесь применяется сокращение СДЦ. СДЦ белки функционируют в хорошо известной дыхательной цепи организма, известной также как электрон-транспортная система. В предпочтительном осуществлении белок, выбранный из CMC или СДЦ белков, изменен таким образом, что это приводит к улучшенному выходу и/или эффективности продукции витамина С упомянутой клеткой хозяина по сравнению с клеткой, несущей упомянутый белок дикого типа. Термин изменен применяется здесь для обозначения генетической модификации или изменения гена, включающей модификацию уровня его экспрессии, предпочтительно с помощью молекулярно-биологических подходов. В частности, термин включает повышающую и понижающую регуляции активности белка, такая регуляция может быть достигнута путем повышающей или понижающей регуляции гена, кодирующего белок. Другие способы для повышающей и понижающей регуляции активности определенного белка,рассмотренной выше, также можно применять в осуществлении данного изобретения. Объектом настоящего изобретения также является предоставление векторов, включающих такие полинуклеотиды, предпочтительно в виде экспрессирующих векторов. Далее, объектом настоящего изобретения является предоставление способа получения клеток хозяина, которые генетически модифицированы, например трансформированы, с помощью таких последовательностей ДНК или векторов. Этого можно достигнуть, например, путем переноса полинуклеотидов,как проиллюстрировано примерами здесь, в рекомбинантные или нерекомбинантные клетки хозяина,которые могут содержать или могут не содержать эндогенный эквивалент соответствующего гена. Такая трансформированная клетка также является объектом изобретения. Полезные осуществления изобретения становятся очевидными из соответствующих пунктов формулы изобретения. Эти и другие аспекты осуществлений настоящего изобретения должны быть очевидны для специалиста в данной области из вышеприведенного описания. Любая клетка, служащая реципиентом чужеродных молекул нуклеиновой кислоты, может применяться в качестве клетки хозяина, как, например, клетка, несущая воспроизводимый экспрессирующий вектор или клонирующий вектор, или клетка, генетически модифицированная или генетически измененная с помощью хорошо известных приемов так, что она содержит желаемые ген(ы) в своей хромосоме(ах) или геноме. Клетка хозяина может быть прокариотического или эукариотического происхождения, как, например, бактериальные клетки, клетки животного, включая клетки человека, клетки грибов,включая дрожжевые клетки, и клетки растений. Предпочтительно клетка хозяина является микроорганизмом. Более предпочтительно микроорганизм принадлежит к бактериям, которые могут экспрессировать L-сорбозондегидрогеназу в активной форме in vivo. Примеры известных бактерий, способных прямо продуцировать витамин С в достаточных количествах, будучи измененными в соответствии с настоящим изобретением, включают штаммы из родов-2 012165 Микроорганизмы, которые можно применять по настоящему изобретению для улучшения прямой продукции витамина С, могут быть общедоступными из разных источников, например Немецкого собрания микроорганизмов и клеточных культур (Deutsche Sammlung von Mikroorganismen und Zellkulturen(American Type Culture Collection (ATCC), P.O. Box 1549, Manassas, VA 20108 USA) или Подразделения коллекций культур (Culture Collection Division, NITE Biological Resource Center, 2-5-8, Kazusakamatari,Kisarazu-shi, Chiba, 292-0818, Japan (ранее: Institute for Fermentation, Osaka (IFO), 17-85, Juso-honmachi 2chome,Yodogawa-ku, Osaka 532-8686, Japan. Примерами предпочтительных бактерий, хранящихся в IFO,являются, например, Gluconobacter oxydans (ранее известная как G. melanogenus) IFO 3293, Gluconobactercerinus IFO 3266, Gluconobacter oxydans IFO 3287 и Acetobacter aceti subsp. orleanus IFO 3259, все помещенные на хранение 5 апреля 1954 г.; Acetobacter aceti subsp. xylinum IFO 13693, помещенная на хранение 22 октября 1975 г., и Acetobacter aceti subsp. xylinum IFO 13773, помещенная на хранение 8 декабря 1977 г. Штамм Acetobacter sp. ATCC 15164, который также является примером предпочтительной бактерии, помещен на хранение с АТСС. Штамм Gluconobacter oxydans (ранее известный как G. melanogenus) N 44-1 в качестве еще одного примера предпочтительной бактерии является производным штамма IFO 3293 и описан у Sugisawa et al., Agric. Biol. Chem. 54: 1201-1209, 1990. Уксусно-кислые бактерии являются предпочтительными по настоящему изобретению для прямого производства витамина С с высоким выходом из ряда субстратов, включая D-сорбит, L-сорбозу и L-сорбозон. Штаммы из родов Gluconobacter, Gluconacetobacter и Acetobacter являются более предпочтительными, обнаружено, что они способны прямо продуцировать витамин С из L-сорбозона, в то время как было обнаружено, что хотя бы Gluconobacter oxydans DSM 17078 способен продуцировать витамин С прямо из D-сорбита, L-сорбозы или L-сорбозона. Gluconobacter oxydans DSM 17078 (ранее известный какGluconobacter oxydans N44-1) помещен в Немецкое собрание микроорганизмов и клеточных культур(DSMZ, Mascheroder Weg IB, D-38124 Braunschweig, Germany) согласно Будапештской конвенции 26 января 2005 г. В частности, настоящее изобретение относится к способу прямой продукции витамина С, где комбинацию полинуклеотидов, как раскрыто здесь, или комбинацию модифицированных полинуклеотидных последовательностей, как описано далее, вводят в подходящий микроорганизм, рекомбинантный микроорганизм культивируют в условиях, позволяющих осуществлять получение витамина С с высокой продуктивностью, выходом и/или эффективностью, полученный продукт ферментации выделяют из культуральной среды и при необходимости далее очищают. Несколько субстратов можно применять в качестве источников углерода в вышеописанном процессе. Особенно подходящими источниками углерода являются таковые, которые получаются по путям метаболизма D-глюкозы или D-сорбита, такие как, например, D-глюкоза, D-сорбит, L-сорбоза, L-сорбозон,2-кето-L-гулонат, D-глюконат, 2-кето-D-глюконат или 2,5-дикетоглюконат. Предпочтительно субстрат выбирают из, например, D-глюкозы, D-сорбита, L-сорбозы или L-сорбозона, более предпочтительно изD-глюкозы, D-сорбита или L-сорбозы и наиболее предпочтительно из D-сорбита или L-сорбозы. Термины субстрат и субстрат продукции в связи с вышеупомянутым способом с применением микроорганизма являются здесь взаимозаменяемыми. Превращение субстрата в витамин С по вышеупомянутому способу с применением микроорганизма означает, что превращение субстрата в витамин С осуществляется микроорганизмом, т.е. субстрат может быть прямо превращен в витамин С. Упомянутый микроорганизм культивируют в условиях, позволяющих такое превращение субстрата, как определено выше. Средой, как применяется здесь по отношению к вышеописанному способу с применением микроорганизмов, может быть любая подходящая для продукции витамина С среда. Обычно средой является водная среда, включающая, например, соли, субстрат(ы) и имеющая определенный рН. Среда, в которой субстрат превращается в витамин С, называется также средой продукции. Ферментация, или продукция, или процесс ферментации, как применено здесь, могут быть применением растущих клеток с использованием среды, условий и процедур, известных специалисту в данной области, или применением нерастущих, так называемых покоящихся клеток, после того, как их культивировали с применением среды, условий и процедур, известных специалисту в данной области, в условиях, пригодных для превращения соответствующих субстратов в желаемый продукт, такой как витамин С. Из вышеописанного способа ясно, что вышеупомянутые микроорганизмы включают также синонимы или базонимы этих видов, обладающие такими же физиологическими свойствами, как определено Международным кодом номенклатуры прокариотов. Номенклатура микроорганизмов, как применяется здесь, является официально принятой (на момент регистрации предварительной заявки) Международным комитетом по систематике прокариотов и Отделением бактериологии и прикладной микробиологии Международного союза микробиологических обществ и опубликованной в официальном издании Международного журнала систематической и эволюционной микробиологии (IJSEM). Особая ссылка делается-3 012165 на Urbance et al., IJSEM (2001) vol. 51: 1059-1070, с коррекциями по IJSEM (2001) vol. 51: 1231-1233, описывающими таксономическую реклассификацию G. oxydans DSM 4025 как Ketogulonicigenium vulgare. Как применено здесь, покоящимися клетками называются клетки микроорганизма, которые, например, жизнеспособны, но не являются активно растущими, или которые растут с низкой удельной скоростью [], например со скоростью роста менее 0,02 ч-1, предпочтительно менее 0,01 ч-1. Клетки, демонстрирующие вышеприведенные скорости роста, называются пребывающими в покоящемся состоянии. Процесс по настоящему изобретению можно проводить в несколько этапов или фаз, предпочтительно микроорганизм культивируют на первом этапе (называемом также этапом (а) или фазой роста) в условиях, позволяющих рост. Эта фаза завершается при изменении условий так, что скорость роста микроорганизма замедляется, приводя к покоящимся клеткам, что называют также этапом (б), за чем следует получение витамина С из субстрата с применением (б), что называется также фазой продукции. Фазу роста и фазу продукции вышеописанного способа с применением микроорганизма можно проводить в той же емкости, например только одной емкости или в двух или более разных емкостях, при необходимости, с этапом отделения клеток между двумя фазами. Выработанный витамин С можно отделять от клеток любым подходящим способом. Отделение означает, например, что образованный витамин С можно выделять из среды продукции. При необходимости, полученный таким образом витамин С можно обрабатывать далее. Для целей настоящего изобретения, относящихся к вышеупомянутому способу, термины фаза роста, этап выращивания, этап роста и период роста применяются здесь взаимозаменяемо. То же относится к терминам фаза продукции, этап продукции, период продукции. Одним путем осуществления вышеописанного способа может быть процесс, где микроорганизм выращивают в первой емкости, так называемой емкости для выращивания, в качестве источника покоящихся клеток и хотя бы часть клеток переносят во вторую емкость, так называемую емкость продукции. Условия в емкости для продукции могут быть такими, что перенесенные из емкости для роста клетки становятся покоящимися, как определено выше. Витамин С продуцируется во второй емкости, и его выделяют оттуда. По вышеописанному процессу этап выращивания можно проводить в водной среде, т.е. среде роста,снабженной необходимыми питательными веществами для роста в аэробных условиях. Культивацию можно проводить, например, в отдельном объеме, в подпитываемом объеме в полунепрерывном или непрерывном режиме. Время выращивания может варьировать в зависимости от рода клеток, рН, температуры и питательной среды, которые применяются, и может составлять, например, от приблизительно 10 ч до приблизительно 10 дней, предпочтительно от приблизительно 1 до приблизительно 10 дней, более предпочтительно от приблизительно 1 до приблизительно 5 дней при проведении в отдельном объеме или в подпитываемом объеме в зависимости от микроорганизма. Если клетки выращивают в непрерывном режиме, продолжительность выдержки может быть, например, от приблизительно 2 до приблизительно 100 ч, предпочтительно от приблизительно 2 до приблизительно 50 ч в зависимости от микроорганизма. Если микроорганизм выбран из бактерий, культивацию можно проводить, например, при рН от приблизительно 3,0 до приблизительно 9,0, предпочтительно от приблизительно 4,0 до приблизительно 9,0, более предпочтительно от приблизительно 4,0 до приблизительно 8,0, еще более предпочтительно от приблизительно 5,0 до приблизительно 8,0. Если применены водоросли или дрожжи, культивацию можно проводить, например, при рН ниже приблизительно 7,0, предпочтительно ниже приблизительно 6,0,более предпочтительно ниже приблизительно 5,5 и наиболее предпочтительно ниже приблизительно 5,0. Подходящий интервал температур для проведения культивации с применением бактерий может быть,например, от приблизительно 13 до приблизительно 40 С, предпочтительно от приблизительно 18 до приблизительно 37 С, более предпочтительно от приблизительно 13 до приблизительно 36 С и наиболее предпочтительно от приблизительно 18 до приблизительно 33 С. В случае применения водорослей или дрожжей подходящий интервал температур для проведения культивации может находиться, например,от приблизительно 15 до приблизительно 40 С, предпочтительно от приблизительно 20 до приблизительно 45 С, более предпочтительно от приблизительно 25 до приблизительно 40 С, и еще более предпочтительно от приблизительно 25 до приблизительно 38 С, и наиболее предпочтительно от приблизительно 30 до приблизительно 38 С. Культуральная среда для выращивания обычно может содержать такие питательные вещества, как усвояемые источники углерода, например D-маннит, D-сорбит, L-сорбоза, эритрит, рибит, ксилит, арабит, инозит, дулыцит, D-рибоза, D-фруктоза, D-глюкоза, сахароза, предпочтительно L-сорбоза, D-глюкоза, D-сорбит, D-маннит и глицерин, а также утилизируемые источники азота, такие как органические вещества, например пептон, дрожжевой экстракт и аминокислоты. Среда может содержать или не содержать мочевину, жидкий экстракт зерновых и/или пекарские дрожжи. Различные неорганические вещества также можно применять в качестве источников азота, например нитраты и соли аммония. Далее, среда роста обычно содержит неорганические соли, например сульфат магния, сульфат марганца, фосфат калия и карбонат кальция. По вышеописанному способу удельные скорости роста составляют, например, не менее 0,02 ч-1. В случае клеток, растущих в отдельном объеме, или в подпитываемом объеме, или в полунепрерывном режиме, скорость роста зависит, например, от состава среды роста, рН, температуры и т.п. Обычно ско-4 012165 рость роста может находиться, например, в интервале от приблизительно 0,05 до приблизительно 0,2 ч-1,предпочтительно от приблизительно 0,06 до приблизительно 0,15 ч-1 и наиболее предпочтительно от приблизительно 0,07 до приблизительно 0,13 ч-1. В другом аспекте вышеописанного процесса покоящиеся клетки можно получить с помощью культивации соответствующего микроорганизма на чашках с агаром, служащих таким образом емкостью для роста, с применением, в основном, тех же условий, а именно времени культивации, рН, температуры,питательной среды, как описано выше, с добавлением агар-агара. Если фазы роста и продукции проводят в двух отдельных емкостях, то клетки после фазы роста можно собрать или концентрировать и перенести во вторую емкость, так называемую емкость продукции. Эта емкость может сдержать водную среду, дополненную любым подходящим субстратом продукции, который может быть превращен в витамин С с помощью клеток. Клетки из емкости для выращивания можно собрать или сконцентрировать любым подходящим способом, таким как, например, центрифугирование, мембранная фильтрация с поперечным потоком или микрофильтрация, фильтрация, декантация, флоккуляция. Полученные таким образом клетки можно перенести в емкость для продукции в виде исходного бульона из емкости для роста без предварительного сбора, концентрации или промывки,т.е. в форме суспензии клеток. В предпочтительном воплощении клетки переносят из емкости для роста в емкость для продукции в форме клеточной суспензии без этапа промывки или отделения в промежутке. Если фазы роста и продукции проводят в одной и той же емкости, клетки можно выращивать в подходящих условиях до желаемой клеточной плотности, вслед за чем заместить среду роста средой продукции, содержащей субстрат продукции. Такой заменой может быть, например, подача среды продукции в емкость в то же время и с той же скоростью, как отбор из емкости супернатанта. Чтобы удерживать покоящиеся клетки в емкости, можно применять операции по повторной циркуляции или удерживанию клеток, такие как, например, этапы повторной циркуляции клеток. Такие этапы повторной циркуляции, например, включают, но не ограничиваются этим, способы с применением центрифугирования,фильтров, мембранной микрофильтрации с поперечным потоком из этапов микрофильтрации, мембранные реакторы, флоккуляцию или иммобилизацию клеток на подходящих пористых, непористых или полимерных носителях. После переходной фазы емкость приводят к таким условиям процесса, при которых клетки оказываются на покоящейся стадии, как определено выше, и субстраты продукции эффективно превращаются в витамин С. Водная среда в емкости для продукции, которая применяется на этапе продукции по вышеописанному процессу с применением микроорганизма, называемая здесь средой для продукции, может содержать только субстрат(ы) продукции для превращения в витамин С или может содержать, например, дополнительные неорганические соли, например хлорид натрия, хлорид кальция, сульфат магния, сульфат марганца, фосфат калия, фосфат кальция и карбонат кальция. Среда продукции может также содержать усвояемые источники азота, такие как, например, органические вещества, например пептон, дрожжевой экстракт, мочевина, аминокислоты, жидкий экстракт зерновых, или неорганические вещества, например аммиак, сульфат аммония, и нитрат натрия, в таких концентрациях, чтобы поддерживать клетки в покоящемся состоянии, как определено выше. Среда может содержать или не содержать мочевину, жидкий экстракт зерновых и/или пекарские дрожжи. Этап продукции можно проводить, например, в отдельном объеме, в подпитываемом объеме в полунепрерывном или непрерывном режиме. В случае подпитываемого объема, полунепрерывного или непрерывного режима как клетки из емкости для роста, так и среду продукции можно подавать постоянно или периодически в емкость для продукции с необходимыми скоростями подачи. Альтернативно, можно подавать в емкость для продукции только среду продукции постоянно или периодически, в то время как клетки, поступающие из емкости для роста, переносят в емкость для продукции только один раз. Клетки из емкости для роста могут применяться внутри емкости для продукции в виде клеточной суспензии или могут применяться, например, как флоккулированные или иммобилизованные клетки на любом твердом носителе, таком как пористый или полимерный носитель. Период продукции, определяемый как период времени между поступлением субстрата в емкость для продукции и сбором супернатанта, содержащего витамин С, так называемого потока сбора, может варьировать в зависимости, например, от рода и концентрации клеток, рН, температуры и питательной среды, которые применяют, и предпочтительно находится между приблизительно 2 и приблизительно 100 ч. Значения рН и температуры могут отличаться от рН и температуры на этапе роста, но, в основном,являются такими же, как на этапе роста. В предпочтительном осуществлении этап продукции проводят в непрерывном режиме, означающем, что первый подаваемый поток, содержащий клетки из емкости роста, и второй подаваемый поток,содержащий субстрат, подаются непрерывно или периодически в емкость для продукции. Первый поток может либо содержать только клетки, выделенные/отделенные от среды роста, или клеточную суспензию, приходящую прямо с этапа роста без какого-либо промежуточного этапа отделения клеток, промывки и/или выделения. Второй подаваемый поток, как определено здесь, может включать все другие подаваемые потоки, необходимые для проведения этапа продукции, например среду продукции, включающую субстрат в виде одного или нескольких различных потоков, воду для разведения и основание-5 012165 По вышеописанному способу, когда оба потока подают непрерывно, соотношение скорости подачи первого потока к скорости подачи второго потока может варьировать между приблизительно 0,01 и приблизительно 10, предпочтительно между приблизительно 0,01 и приблизительно 5, наиболее предпочтительно между приблизительно 0,02 и приблизительно 2. Это соотношение зависит от концентрации клеток и субстрата в первом и во втором потоках, соответственно. Другой способ проведения вышеописанного процесса с применением микроорганизма по настоящему изобретению может быть процессом с применением определенной клеточной плотности покоящихся клеток в емкости для продукции. Клеточную плотность измеряют в единицах поглощения (оптической плотности) при 600 нм способами, известными специалисту в данной области. В предпочтительном осуществлении клеточная плотность на этапе продукции составляет не менее приблизительно 10,более предпочтительно между приблизительно 10 и приблизительно 200, еще более предпочтительно между приблизительно 15 и приблизительно 200, еще более предпочтительно между приблизительно 15 и приблизительно 120 и наиболее предпочтительно между приблизительно 20 и приблизительно 120. Для того, чтобы поддерживать клетки в емкости для продукции на желаемом уровне клеточной плотности в течение проведения фазы продукции, например в непрерывном или полунепрерывном режиме, применяют любые подходы, известные в данной области, такие как, например, повторная циркуляция клеток с помощью центрифугирования, фильтрации, мембранной ультрафильтрации с поперечным потоком или микрофильтрации, декантации, флоккуляции, удержания клеток в емкости с помощью мембранных приспособлений или иммобилизации клеток. Далее, в том случае, когда этап продукции проводят в непрерывном или полунепрерывном режиме и клетки подают непрерывно или периодически из емкости для роста, клеточную плотность в емкости для продукции можно поддерживать на постоянном уровне посредством, например, отбора определенного количества клеток из емкости для продукции, соответствующего количеству клеток, подаваемых из емкости для роста. По вышеописанному процессу продуцируемый витамин С, содержащийся в так называемом потоке сбора отделяют/отбирают из емкости для выращивания. Поток сбора может включать, например, свободный от клеток или содержащий клетки водный раствор, выходящий из емкости для продукции, который содержит витамин С как результат превращения субстрата продукции покоящимися клетками в емкости для продукции. Клетки, все еще присутствующие в потоке сбора, можно отделить от витамина С с помощью любой операции, известной в данной области, такой как, например, фильтрация, центрифугирование, декантация, мембранная ультрафильтрация с поперечным потоком или микрофильтрация, ультрафильтрация с отклоняющимся потоком (примечание: это то же самое, что с поперечным потоком) или микрофильтрация или фильтрация с прямым потоком. После этой операции по отделению клеток поток сбора, в основном, свободен от клеток. В дальнейшем аспекте способ по настоящему изобретению можно комбинировать с дальнейшими этапами отделения и/или очистки полученного витамина С от других компонентов, содержащихся в потоке сбора, т.е. так называемыми этапами нисходящей обработки. Эти этапы могут включать любые приемы, известные специалисту в данной области, такие как, например, концентрирование, кристаллизация,осаждение, адсорбция, ионный обмен, электродиализ, электродиализ с биполярной мембраной и/или обратный осмос. Витамин С можно далее очищать в виде свободной кислоты или любой из известных солей с помощью подходов, таких как, например, обработка активированным углем, ионный обмен, адсорбция и элюция, концентрирование, кристаллизация, фильтрация и сушка. В частности, первичное отделение витамина С от других компонентов в потоке сбора можно проводить с помощью любой подходящей комбинации или повторения, например, следующих способов: электродиализ с двумя или тремя отделениями, электродиализ с биполярной мембраной, обратный осмос или адсорбция, например, на ионообменных смолах или неионообменных смолах. Если конечная форма витамина С является солью витамина С,перевод соли в форму свободной кислоты можно проводить, например, с помощью электродиализа с биполярной мембраной, ионного обмена, хроматографических подходов с моделированием движущегося слоя и т.п. Комбинацию вышеупомянутых этапов, например электродиализа и электродиализа с биполярной мембраной, на одном этапе можно также применять, как и комбинацию упомянутых этапов, например этапов ионного обмена с применением хроматографических подходов с моделированием движущегося слоя. Любая из этих процедур сама по себе или в комбинации представляет подходящий способ для выделения и очистки продукта, например витамина С. Продукт, полученный таким способом,можно далее обрабатывать с помощью, например, концентрирования, кристаллизации, осаждения, промывки и сушки кристаллов и/или очищать, например, обработкой активированным углем, ионным обменом и/или перекристаллизацией. В предпочтительном осуществлении процесса витамин С очищают из потока сбора в серии нисходящих этапов обработки, как описано выше, без переноса в неводный раствор по ходу этой обработки,т.е. все этапы проводят в водном окружении. Такая предпочитаемая процедура нисходящей обработки может включать, например, концентрирование потока сбора, выходящего из емкости для продукции, с помощью электродиализа с двумя или тремя отделениями, превращение витамина С в солевой форме,присутствующего в концентрированном растворе, в кислотную форму с помощью электродиализа с биполярной мембраной и/или ионного обмена, очистку такими способами, как, например, обработка акти-6 012165 вированным углем, ионообменными или неионными смолами с последующим этапом концентрирования и кристаллизации. Такие кристаллы можно отделять, промывать и сушить. При необходимости, кристаллы можно опять растворить в воде, обработать активированным углем и/или ионообменными смолами и перекристаллизовать. Эти кристаллы можно далее отделить, промыть и высушить. Согласно изобретению клетки хозяина (в частности, рекомбинантные микроорганизмы из родовGluconobacter, Gluconacetobacter и Acetobacter), несущие SNDHai ген согласно изобретению и не менее одного генетически модифицированного гена, выбранного из CMC или СДЦ, как показано на примерах здесь, способны прямо продуцировать витамин С из подходящего источника углерода с существенно более высоким выходом, продуктивностью и/или эффективностью, чем другие известные микроорганизмы, например в количествах 300 мг/л или более или 800 мг/л или более из D-сорбита или L-сорбозы, соответственно, при измерении по способу для покоящихся клеток после периода инкубации 20 ч. Выход витамина С, продуцируемого из D-сорбита при измерении по способу для покоящихся клеток после периода инкубации 20 ч, может быть даже таким высоким, как 400, 600, 1000 мг/л или даже превышать 1,5,2, 4, 10, 20, 50, 100 г/л. Выход витамина С, продуцируемого из L-сорбозы, при измерении по способу для покоящихся клеток после периода инкубации 20 ч может быть даже таким высоким, как 1000 мг/л или даже превышать 1,5, 2, 4, 10, 20, 50, 100 г/л. Белок SNDHai согласно ПОСЛ.2, описанный здесь, выполняет важную функцию при прямой продукции витамина С в микроорганизмах, в частности в бактериях, таких как уксусно-кислые бактерии,такие как Gluconobacter, Acetobacter и Gluconacetobacter, т.е. где эта функция по сравнению с представителями дикого типа усилена или улучшена. Это означает, что прямая продукция витамина С усилена и/или увеличена, когда белок с SNDHai активностью экспрессируется или предпочтительно сверхэкспрессируется у особено подходящего организма хозяина. Продукция витамина С в таком организме хозяина еще более улучшена, когда хотя бы один полинуклеотид, кодирующий белок, выбранный из CMC или СДЦ систем, изменен в дополнение к этому. Белок SNDHai может кодироваться нуклеотидной последовательностью, как приведено в ПОСЛ.1,которая изолирована из G. oxydans DSM, или полинуклеотидом, который в значительной степени идентичен этому. В этом контексте следует упомянуть, что экспрессия полинуклеотида, который в значительной степени идентичен по отношению к последовательности, кодирующей SNDHai, относится к полинуклеотидной последовательности, выбранной из группы, состоящей из: а) полинуклеотидов, включающих нуклеотидную последовательность согласно ПОСЛ.1; б) полинуклеотидов, включающих нуклеотидную последовательность, полученную путем амплификации нуклеиновой кислоты, такой как полимеразная цепная реакция, с применением геномной ДНК из микроорганизма в качестве матрицы и набора праймеров согласно ПОСЛ.3 и ПОСЛ.4; в) полинуклеотидов, включающих нуклеотидную последовательность, кодирующую фрагмент или производное полипептида, включающего аминокислотную последовательность согласно ПОСЛ.2,или кодирующую фрагмент или производное полипептида, кодируемого полинуклеотидом по любому из(а) или (б), где в упомянутом производном или фрагменте один или более аминокислотный остаток консервативно замещен по сравнению с упомянутым полипептидом и упомянутый фрагмент или производное обладает активностью SNDHai полипептида; г) полинуклеотидов, комплементарные цепочки которых гибридизуются в жестких условиях с полинуклеотидом, кодирующим полипептид, включающий аминокислотную последовательность согласно ПОСЛ.2, или полинуклеотидом, как определено по любому из пп.а)-в), и которые кодируют SNDHai полипептид; д) полинуклеотидов, которые не менее чем на 70%, а именно на 85, 90 или 95% идентичны полинуклеотиду, кодирующему полипептид, включающий аминокислотную последовательность согласно ПОСЛ.2, или полинуклеотиду, как определено по любому из пп.а)-в), и которые кодируют SNDHai полипептид,или комплементарной цепочки такого полинуклеотида. Полипептид согласно ПОСЛ.2 изолирован из нескольких различных микроорганизмов по способу, описанному в примере 22, и его аннотированная функция подтверждена с помощью анализа активности, как описано в примерах 23 и 24. Активность SNDHai определяется здесь как ферментативная активность по превращению L-сорбозона прямо в аскорбиновую кислоту. Нуклеиновую кислоту, как определено выше, можно получать с помощью амплификации, применяя кДНК, мРНК или, альтернативно, геномную ДНК в качестве матрицы и подходящие олигонуклеотидные праймеры, такие как нуклеотидные праймеры согласно ПОСЛ.3 и ПОСЛ.4, с помощью стандартной техники ПЦР амплификации. Нуклеиновую кислоту, амплифицированную таким способом, можно клонировать в подходящий вектор и характеризовать с помощью анализа последовательности ДНК. Далее включены нуклеотидные последовательности, кодирующие частичные полипептидные последовательности полипептида, который сохраняет активность L-сорбозондегидрогеназы для получения витамина С из L-сорбозона, такие как, например, полипептиды, представленные последовательностями-7 012165 ПОСЛ.12, 14, 16, 18, 20, 22 и 27. Полипептиды включают предпочтительно частичные аминокислотные последовательности не менее чем из 25 последовательных аминокислотных остатков, выбранные из аминокислотных последовательностей полипептидов, раскрытых в настоящей заявке. Специалист в данной области осведомлен о том, что определенные участки полипептидов важны для биологической активности. Имеются, однако, другие области, где аминокислоты можно вставлять, удалять или замещать другими аминокислотами, предпочтительно такими аминокислотами, которые сходны с аминокислотами, которые ими собираются замещать. Как применяется здесь, активный фрагмент или производное означает полипептид, который сохраняет, в основном, такую же биологическую функцию или активность, как у полипептида согласно ПОСЛ.2. Примерами биологической активности могут быть, например, ферментативная активность,сигнальная активность или реактивность по отношению к антителам. Термин такая же биологическая функция или функциональный эквивалент, как применено здесь, означает, что белок обладает, в основном, такой же биологической активностью, т.е. энзиматической, сигнальной или реактивностью по отношению к антителам, как и полипептид согласно ПОСЛ.2. Метаболизм D-сорбита или L-сорбозы включает, с одной стороны, поступление этих соединений в цитозоль и дальнейшее превращение в метаболиты, применяемые в путях ассимиляции, таких как путь Эмбдена-Мейергофа-Парнаса, пентозофосфатный шунт, путь Энтнера-Дудорова и цикл трикарбоновых кислот, все из них вовлечены во все жизненные энергообразующие и анаболические реакции, необходимые для роста и поддержания живых клеток. С другой стороны, метаболизм D-сорбита или L-сорбозы также включает превращение этих соединений в более окисленные продукты, такие как L-сорбозон, 2 КГК и витамин С, с помощью так называемых процессов неполного окисления.CMC белки определяются здесь как белки, вовлеченные в систему метаболизма сорбита/сорбозы. Предпочтительно CMC белки выбирают из группы, состоящей из мембраносвязанной ПХХ-зависимойD-сорбитдегидрогеназы, мембраносвязанной дегидрогеназы L-сорбозы, мембраносвязанной L-сорбозондегидрогеназы, мембраносвязанной ФАД-зависимой D-сорбитдегидрогеназы, цитозольной НАД-зависимой D-сорбитдегидрогеназы, НАД(Ф)-зависимой D-сорбитдегидрогеназы (также называемой НАДФ-Нзависимая редуктаза сорбозы), НАД-зависимой ксилитдегидрогеназы, НАД-зависимой алкогольдегидрогеназы, мембраносвязанной дегидрогеназы L-сорбозы, НАД(Ф)-Н-зависимой редуктазы L-сорбозы, цитозольной НАДФ-зависимой сорбозондегидрогеназы, цитозольной НАД(Ф)-Н-зависимой L-сорбозонредуктазы, мембраносвязанной альдегиддегидрогеназы, цитозольной альдегиддегидрогеназы, глицерол-3 фосфатдегидрогеназы, глицеральдегид-3-фосфатдегидрогеназы. Еще более предпочтительно CMC белки выбирают из семейства оксидоредутаз, более предпочтительно оксидоредуктаз [ЕС 1], как рекомендовано Комитетом по номенклатуре международного союза по биохимии и молекулярной биологии (NomenclatureCommittee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB. Особенно предпочтительными являются оксидоредуктазы, действующие на СН-ОН группу доноров [ЕС 1.1], в частности оксидоредуктазы с НАД+ или НАДФ+ в качестве акцептора [ЕС 1.1.1] и оксидоредуктазы с другими акцепторами [ЕС 1.1.99], или оксидоредуктазы, действующие на альдегидную или оксогруппу доноров[ЕС 1.2], в частности оксидоредуктазы с НАД+ или НАДФ+ в качестве акцептора [ЕС 1.2.1]. Еще более предпочтительно их выбирают из дегидрогеназ, относящихся к классам ферментов [ЕС 1.1.1.1], [ЕС 1.1.1.15] или [ЕС 1.2.1.-]. Биологическая, энзиматическая или другая активность CMC белков может быть измерена способами, хорошо известными специалисту в данной области, как, например, с помощью инкубации клеточной фракции, содержащей CMC белок, в присутствии его субстрата, акцептора(ов) или донора(ов) электронов, включая феназинметосульфат (ФМС), дихлорофенолиндофенол (ДХФИФ), НАД, НАД-Н, НАДФ,НАДФ-Н, потребление которого можно прямо или косвенно замерить с помощью фотометрических, колориметрических или флуориметрических способов, и другие неорганические компоненты, которые могут быть необходимы для развития активности. Так, например, активность мембраносвязанной D-сорбитдегидрогеназы можно измерять с помощью такого анализа, когда мембранную фракцию, содержащую этот фермент, инкубируют в присутствии фосфатного буфера при рН 6, D-сорбита и искусственных акцепторов электронов ДХФИФ и ФМС. Скорость потребления ДХФИФ можно замерять при 600 нм, и она прямо пропорциональна D-сорбитдегидрогеназной активности, присутствующей в мембранной фракции. Так, например, посредством увеличения активности CMC белков, вовлеченных в неполное окисление на пути метаболизма D-сорбита, можно достигнуть повышения выходов превращения D-сорбита в такие продукты, как витамин С. В другом примере с помощью понижения активности CMC белков, вовлеченных в потребление D-сорбита в центральных метаболических путях, также можно достигнуть повышения выходов превращения D-сорбита в такие продукты, как витамин С. Известно, что СДЦ белки важны для механизмов, посредством которых электроны, полученные за счет любой окислительно-восстановительной реакции в клетке, переносятся далее, в основном, посредством серии окислительно-восстановительных реакций, включающих кофакторы и оксидазы, на конечный акцептор электронов. Основным механизмом, который применяют живые организмы для получения энергии, необходимой для их жизненной активности, является дыхание. У высших организмов углеводороды, белки, али-8 012165 фатические кислоты превращаются в ацетил-КоА посредством гликолитического катаболического пути и окисления в цитоплазме. Ацетил-КоА далее превращается в серии реакций, известных как цикл лимонной кислоты, которые происходят в митохондриях. Энергия, образующаяся по ходу этих реакций, применяется для получения восстановительной силы, сохраняемой в виде таких соединений, как ФАД-Н 2 и НАД-Н. Эти соединения затем используются в так называемой электрон-транспортной цепи, серии окислительно-восстановительных реакций, включающих различные компоненты, расположенные во внутренней мембране митохондрий. Конечным акцептором электронов является кислород, который затем реагирует с протонами, образующимися в цепи реакций, и образует воду. Градиент концентрации протонов, образующийся по ходу этого процесса, является движущей силой для синтеза АТФ. У бактерий этот основной процесс дыхания следует тому же физиологическому принципу, но может идти различными путями, включающими разные компоненты, интермедиаты, ферментные комплексы и конечные продукты. Эффективность бактериальных дыхательных процессов может сильно варьировать в зависимости от функциональных биологических компонентов, экспрессируемых каждым видом,что, в свою очередь, зависит от задействованного генетического аппарата и от данных условий роста. Как пример, уксусно-кислые бактерии, которые являются облигатными аэробами, грам-отрицательными микроорганизмами, принадлежащими к родам Acetobacter, Gluconobacter и Gluconacetobacter,представляют особенные характеристики с точки зрения процессов генерации энергии. Эти бактерии хорошо известны своей способностью к неполному окислению ряда субстратов, таких как спирты, сахара, сладкие спирты и альдегиды. Такие процессы, в основном, известны как окислительная ферментация,и они уже давно нашли свое применение в пищевой и химической промышленности, особенно в производстве уксуса и L-сорбозы. Полезными продуктами, которые, как известно, можно получать за счет неполного окисления с применением штаммов, принадлежащих к роду Gluconobacter, являются 2-кето-Lгулоновая кислота (2-КГК), получаемая из D-сорбита и L-сорбозы, и 5-кето-D-глюконовая кислота,предшественник в биосинтезе D-винно-каменной кислоты, получаемая из D-глюкозы. Неполное окисление является основном механизмом генерации энергии у уксусно-кислых бактерий. Они выполняют эти реакции с помощью различных дегидрогеназ, находящихся в периплазматическом пространстве, на периплазматической мембране, а также в цитоплазме. Различные кофакторы задействованы различными дегидрогеназами, наиболее распространенными являются ПХХ и ФАД в случае мембраносвязанных или периплазматических ферментов и НАД/НАДФ в случае цитоплазматических ферментов. Известно, что электрон-транспортные цепи штаммов Gluconobacter/Gluconacetobacter и Acetobacter включают коэнзим Q10 (КоQ10) и КоQ9, соответственно, в качестве универсального электрон-транспортного соединения для всех процессов, а также в некоторых случаях некоторые виды цитохрома c. Показано, что штаммы Gluconobacter не содержат цитохром c оксидазы, но обладают другими видами терминальных оксидаз, такими как оксидазы bo-типа. В одном предпочтительном осуществлении СДЦ белки или субъединицы белков, вовлеченные в перенос электронов, выбирают из белков дыхательной цепи, более предпочтительно их выбирают из тех,что заняты в биосинтезе кофакторов, простетических групп, или выступающих в роли транспортных белков, в частности белков, вовлеченных в биосинтез или развитие кофакторов и/или их предшественников, таких как ФАД, НАД, НАДФ, ПХХ, убихинон, включая КоQ10, цитохромы а, b, с, d и гем. Более предпочтительно их выбирают из белков биосинтеза ПХХ, таких как белки биосинтеза ПХХ А, В, С, D,Е, или экспортеров гема, таких как CcmA или CcmB. Биологическую, энзиматическую или другую активность СДЦ белков можно замерить с помощью подходов, хорошо известных специалисту в данной области, как, например, путем инкубации мембранной фракции или бесклеточного экстракта, содержащего СДЦ белок, в присутствии коэнзима Q2 (КоQ2),искусственного донора электронов, и измерения потребления кислорода такими способами, как с помощью кислородного электрода Кларка (Rank Brothers, Cambridge, United Kingdom). Так, например, активность убихинолоксидазы bd, устойчивой к цианиду терминальной оксидазы, можно замерить в такой пробе, где мембранную фракцию или бесклеточный экстракт, содержащий этот фермент, инкубируют в присутствии 50 мМ фосфатного буфера при рН 6,5, 0,02% детергента Tween20 и 100 мкМ цианида для инактивации других, чувствительных к цианиду оксидаз. Ферментативную реакцию можно начать посредством добавления 30 мМ восстановленного искусственного донора электронов, КоQ2 восст, с последующим измерением увеличения оптического поглощения при 275 нм. Скорость потребления кислорода можно замерить с помощью электрода Кларка, и она прямо пропорциональна активности убихинолоксидазы bd, присутствующей в мембранной фракции или бесклеточном экстракте. Так, например, модифицируя СДЦ полинуклеотид/белок, вовлеченные в биосинтез терминальных оксидаз таким образом, что они приобретают увеличенную активность, можно повысить общую активность производства ферментативных продуктов, зависящих от серии дегидрогеназных реакций, таких как витамин С или 2-КГК. В другом примере, модифицируя СДЦ полинуклеотид/белок, вовлеченные в биосинтез таких кофакторов, как, например, КоQ10 или цитохром с, так что уровень синтеза этих кофакторов повышается, можно увеличить общую емкость системы электронного переноса у бактерии, которая зависит от этих соединений как важных элементов дыхательной цепи, и оказать положительное воздействие на рост и продукцию соединений, зависящих от окислительно-восстановительных реакций,-9 012165 таких как витамин С. Еще в одном примере модификация СДЦ полинуклеотида/белков, вовлеченных в биосинтез устойчивых к цианиду оксидаз обходных путей (типа не образующих энергию) таким образом, что их активность увеличивается, может оказать положительное воздействие на общую емкость производства продукта ферментации бактериями даже в состоянии отсутствия роста или низкого общего метаболизма. Получение витамина С с помощью прямой ферментации может быть сильно улучшено, когда белок, выбранный из СДЦ или CMC, как раскрыто здесь, экспрессируется или модифицируется, как описано далее, в микроорганизме, который также экспрессирует SNDHai. Это здесь также называется сопутствующей (дополнительной) экспрессией. Если сопутствующая экспрессия является результатом генетической манипуляции, последняя также называется сопутствующей манипуляцией. Это можно осуществить,например, у микроорганизма, который экспрессирует SNDHai, такой как рекомбинантный SNDHai, последний микроорганизм тогда называется рекомбинантным микроорганизмом. Здесь проиллюстрированы также семь новых CMC генов, которые могут оказывать действие на улучшение продукции витамина С микроорганизмами, экспрессирующими SNDHai; каждый из таких генетически модифицированных генов можно применять сам по себе или в сочетании не менее чем с одним дополнительным геном, выбранным из той же группы или из СДЦ. Семь разных генов кодируют CMC полипептид, включающий аминокислотные последовательности согласно ПОСЛ.125, ПОСЛ.129, ПОСЛ.133, ПОСЛ.45, ПОСЛ.137, ПОСЛ.141,ПОСЛ.145, соответственно. Соответствующие нуклеотидные последовательности представлены как ПОСЛ.124, ПОСЛ.128,ПОСЛ.132, ПОСЛ.44, ПОСЛ.136, ПОСЛ.140, ПОСЛ.144, соответственно, которые выделены из G. oxydans DSM 17078. Изобретение также охватывает полинуклеотиды, в значительной степени гомологичные одной из этих последовательностей. В этом контексте следует заметить, что экспрессия полинуклеотида, который в значительной степени гомологичен по отношению к последовательности, кодирующей CMC, обозначает полинуклеотидную последовательность, выбранную из группы, состоящей из: а) полинуклеотидов, включающих нуклеотидную последовательность согласно ПОСЛ.124,ПОСЛ.128, ПОСЛ.132, ПОСЛ.44, ПОСЛ.136, ПОСЛ.140, ПОСЛ.144, соответственно; б) полинуклеотидов, включающих нуклеотидную последовательность, полученную с помощью амплификации нуклеиновой кислоты, такой как полимеразная цепная реакция с применением геномной ДНК из микроорганизма в качестве матрицы и набора праймеров согласно ПОСЛ.126 и ПОСЛ.127,или ПОСЛ.130 и ПОСЛ.131, или ПОСЛ.134 и ПОСЛ.135, или ПОСЛ.46 и ПОСЛ.47,или ПОСЛ.138 и ПОСЛ.139, или ПОСЛ.142 и ПОСЛ.143, или ПОСЛ.146 и ПОСЛ.147,соответственно; в) полинуклеотидов, включающих нуклеотидную последовательность, кодирующую фрагмент или производное полипептида, включающего аминокислотную последовательность согласно ПОСЛ.125,ПОСЛ.129, ПОСЛ.133, ПОСЛ.45, ПОСЛ.137, ПОСЛ.141, ПОСЛ.145, соответственно,или кодирующую фрагмент или производное полипептида, кодируемого полинуклеотидом по п.а) или б),где у упомянутого производного один или более аминокислотный остаток консервативно замещен по сравнению с упомянутым полипептидом и упомянутый фрагмент или производное обладают активностью CMC белка; г) полинуклеотидов, комплементарные цепочки которых гибридизуются в жестких условиях с полинуклеотидом, кодирующим полипептид, включающий аминокислотные последовательности согласно ПОСЛ.125, ПОСЛ.129, ПОСЛ.133, ПОСЛ.45, ПОСЛ.137, ПОСЛ.141, ПОСЛ.145,соответственно, или полинуклеотидом, как определено по любому из пп.а)-в), и которые кодируют CMC белок; д) полинуклеотидов, которые не менее чем на 70%, а именно на 80, 90 или 95% гомологичны полинуклеотиду, кодирующему полипептид, включающий аминокислотные последовательности согласно ПОСЛ.125, ПОСЛ.129, ПОСЛ.133, ПОСЛ.45, ПОСЛ.137, ПОСЛ.141, ПОСЛ.145,соответственно, или полинуклеотиду, как определено по любому из пп.а)-в), и которые кодируют CMC белок; или комплементарной нити такого полинуклеотида. Нуклеотидные и аминокислотные последовательности, перечисленные выше, применены как последовательности запроса для проведения поиска с помощью программы Blast2 (версия 2 или BLAST из Национального центра биотехнологии (National Center for Biotechnology (NCBI по базе данных PROSW-SwissProt (полная версия плюс текущие дополнения). Ген CMC 02 (ПОСЛ.124) аннотирован как кодирующий белок, демонстрирующий сходство с НАД(Ф)-зависимой D-сорбитдегидрогеназой из Bacillussubtilis (ПОСЛ.125). Ген CMC 03 (ПОСЛ.128) аннотирован как кодирующий белок, демонстрирующий сходство с НАД(Ф)-зависимой сорбитдегидрогеназой из Bacillus subtilis (ПОСЛ.129). ГенCMC 04 (ПОСЛ.132) аннотирован как кодирующий НАД(Ф)-зависимую редуктазу L-сорбозы (ПОСЛ.133). Ген CMC 05 (ПОСЛ.44) аннотирован как кодирующий НАД(Ф)-зависимую сорбозондегидрогеназу (ПОСЛ.45). Ген CMC 12 (ПОСЛ.136) аннотирован как кодирующий мембраносвязанную- 10012165 дегидрогеназу L-сорбозы (СДГ) ПОСЛ.137). Ген CMC 13 (ПОСЛ.140) аннотирован как кодирующий субъединицу А мембраносвязанной ПХХ-зависимой D-сорбитдегидрогеназы (ПОСЛ.141). Ген CMC 14 (ПОСЛ.144) аннотирован как кодирующий субъединицу В мембраносвязанной ПХХ-зависимой D-сорбитдегидрогеназы (ПОСЛ.145). Нуклеиновая кислота, кодирующая CMC белок согласно изобретению, может быть получена из любого подходящего организма посредством амплификации нуклеиновой кислоты с применением кДНК, мРНК или, альтернативно, геномной ДНК в качестве матрицы и подходящих олигонуклеотидных праймеров, таких как пары нуклеотидных праймеров согласно ПОСЛ.126 и ПОСЛ.127, или ПОСЛ.130 и ПОСЛ.131, или ПОСЛ.134 и ПОСЛ.135, или ПОСЛ.46 и ПОСЛ.47, или ПОСЛ.138 и ПОСЛ.139, или ПОСЛ.142 и ПОСЛ.143, или ПОСЛ.146 и ПОСЛ.147,соответственно, с помощью стандартных приемов ПЦР амплификации. Нуклеиновые кислоты, амплифицированные таким образом, можно клонировать в соответствующий вектор и характеризовать с помощью анализа последовательности ДНК. Различные ПОСЛ., относящиеся к CMC белкам и генам, суммированы ниже. Здесь проиллюстрированы пять новых СДЦ генов, которые могут оказывать действие на улучшение продукции витамина С микроорганизмами, экспрессирующими SNDHai: каждый из этих генетически модифицированных генов можно применять сам по себе или в сочетании хотя бы с одним дополнительным геном, выбранным из той же группы или из CMC. Пять различных генов кодируют СДЦ полипептид, включающий аминокислотные последовательности согласно ПОСЛ.181, ПОСЛ.185, ПОСЛ.189, ПОСЛ.193, ПОСЛ.197, соответственно. Соответствующие нуклеотидные последовательности представлены как ПОСЛ.180, ПОСЛ.184,ПОСЛ.188, ПОСЛ.192, ПОСЛ.196, соответственно, которые выделены из G. oxydans DSM 17078. Изобретение также охватывает полинуклеотиды, в значительной степени гомологичные одной из этих последовательностей. В этом контексте следует заметить, что экспрессия полинуклеотида, который в значительной степени гомологичен по отношению к последовательности, кодирующей СДЦ, относится к полинуклеотидной последовательности, выбранной из группы, состоящей из: а) полинуклеотидов, включающих нуклеотидную последовательность согласно ПОСЛ.180,ПОСЛ.184, ПОСЛ.188, ПОСЛ.192, ПОСЛ.196, соответственно; б) полинуклеотидов, включающих нуклеотидную последовательность, полученную с помощью амплификации нуклеиновой кислоты, такой как полимеразная цепная реакция с применением геномной ДНК из микроорганизма в качестве матрицы и набора праймеров согласно ПОСЛ.182 и ПОСЛ.183,или ПОСЛ.186 и ПОСЛ.187, или ПОСЛ.190 и ПОСЛ.191, или ПОСЛ.194 и ПОСЛ.195,или ПОСЛ.198 и ПОСЛ.199, соответственно; в) полинуклеотидов, включающих нуклеотидную последовательность, кодирующую фрагмент или производное полипептида, включающего аминокислотную последовательность согласно ПОСЛ.181,ПОСЛ.185, ПОСЛ.189, ПОСЛ.193, ПОСЛ.197, соответственно, или кодирующую фрагмент или производное полипептида, кодируемого полинуклеотидом по п.а) или б), где у упомянутого производного один или более аминокислотный остаток консервативно замещен по сравнению с упомянутым полипептидом и упомянутый фрагмент или производное обладают активностью СДЦ белка; г) полинуклеотидов, комплементарные нити которых гибридизуются в жестких условиях с полинуклеотидом, кодирующим полипептид, включающий аминокислотные последовательности согласно ПОСЛ.181, ПОСЛ.185, ПОСЛ.189, ПОСЛ.193, ПОСЛ.197, соответственно, или полинуклеотидом, как определено по любому из пп.а)-в), и которые кодируют СДЦ белок; д) полинуклеотидов, которые не менее чем на 70%, а именно на 80, 90 или 95% гомологичны полинуклеотиду, кодирующему полипептид, включающий аминокислотные последовательности согласно ПОСЛ.181, ПОСЛ.185, ПОСЛ.189, ПОСЛ.193, ПОСЛ.197, соответственно, или полинуклеотиду, как определено по любому из пп.а)-в), и которые кодируют СДЦ белок; или комплементарной нити такого полинуклеотида. Нуклеотидные и аминокислотные последовательности, перечисленные выше, применены как последовательности запроса для проведения поиска с помощью программы Blast2 (версия 2 или BLAST из- 11012165 Национального центра биотехнологии (National Center for Biotechnology (NCBI по базе данных PROSW-SwissProt (полная версия плюс текущие дополнения). Ген СДЦ 21 (ПОСЛ.180) аннотирован как кодирующий белок А биосинтеза коэнзима ПХХ (ПОСЛ.181). Ген СДЦ 22 (ПОСЛ.184) аннотирован как кодирующий белок В биосинтеза коэнзима ПХХ (ПОСЛ.185). Ген СДЦ 23 (ПОСЛ.188) аннотирован как кодирующий белок С биосинтеза коэнзима ПХХ (ПОСЛ.189). Ген СДЦ 24 (ПОСЛ.192) аннотирован как кодирующий белок D биосинтеза коэнзима ПХХ (ПОСЛ.193). Ген СДЦ 25(ПОСЛ.196) аннотирован как кодирующий белок Е биосинтеза коэнзима ПХХ (ПОСЛ.197). Нуклеиновая кислота, кодирующая СДЦ белок согласно изобретению, может быть получена из подходящего организма посредством амплификации нуклеиновой кислоты с применением кДНК, мРНК или, альтернативно, геномной ДНК в качестве матрицы и подходящих олигонуклеотидных праймеров,таких как пары нуклеотидных праймеров согласно ПОСЛ.182 и ПОСЛ 183, или ПОСЛ.186 и ПОСЛ.187, или ПОСЛ.190 и ПОСЛ.191, или ПОСЛ.194 и ПОСЛ.195, или ПОСЛ.198 и ПОСЛ.199, соответственно, с помощью стандартных приемов ПЦР амплификации. Нуклеиновые кислоты, амплифицированные таким образом, можно клонировать в соответствующий вектор и характеризовать с помощью анализа последовательности ДНК. Различные ПОСЛ., относящиеся к СДЦ белкам и генам, суммированы ниже. До того, как сопутствующая экспрессия будет проиллюстрирована далее, создание и экспрессия одиночного гена/полинуклеотида и изменение генома клетки хозяина, как проиллюстрировано выше,будут описаны более детально в отношении SNDHai. Если не указано обратное, описание также приложимо для создания и экспрессии CMC и СДЦ генов, раскрытых здесь. Для клонирования двухцепочечных ДНК можно применять большое разнообразие сочетаний хозяин/клонирующий вектор. Предпочтительные векторы для экспрессии генов по настоящему изобретению,например SNDHai гена, в Е. coli можно выбирать из векторов, обычно применяемых для Е. coli, таких как, например, pQE векторы, которые экспрессируют рекомбинантные белки с His-концом (QIAGEN AGSystems, Calif., USA), pACYC177 и pACYC184 и их производные, и векторы, произведенные на основе плазмид для широкого спектра хозяев, таких как RK2 и RSF1010. Предпочтительный вектор для экспрессии нуклеотидной последовательности по настоящему изобретению в бактериях, включающих Gluconobacter,Gluconacetobacter, Acetobacter и Pseudomonas, выбирают среди векторов, которые могут реплицироваться в Gluconobacter, Acetobacter, или Pseudomonas, а также в таком предпочтительном для клонирования организме, как Е. coli. Предпочтительным вектором является вектор для широкого спектра хозяев, как например, космидный вектор вроде pVK100 и его производные и RSF1010. Число копий и стабильность вектора следует подбирать внимательно для обеспечения стабильной и эффективной экспрессии клонированного гена, а также для эффективного выращивания клетки хозяина, несущей клонированный ген. Молекулы нуклеиновых кислот, содержащие, например, транспонируемые элементы, такие как Tn5,также можно применять в качестве вектора для введения нужного гена в клетки выбранного хозяина, в особенности в хромосому. Молекулы нуклеиновой кислоты, содержащие любые ДНК, выделенные из клеток предпочтительного хозяина вместе с SNDHai геном по настоящему изобретению, также можно применять для введения этого гена в клетки предпочтительного хозяина, в особенности в хромосому. Такие молекулы нуклеиновой кислоты можно переносить в клетки предпочтительного хозяина с помощью общепринятых способов, например трансформации, трансдукции, конъюгации или электропорации,которые хорошо известны в данной области, в зависимости от природы клеток хозяина и молекулы нуклеиновой кислоты. Нуклеотидные последовательности/ген L-сорбозондегидрогеназы можно лигировать в подходящий вектор, содержащий регуляторный район, такой как, например, промотор, участок связывания рибосомы и терминатор транскрипции, работающие в вышеописанных клетках хозяина, с помощью хорошо известных в данной области способов для получения экспрессирующего вектора. Полипептиды и полинуклеотиды, проиллюстрированные примерами здесь, предпочтительно предоставлены в изолированной форме и предпочтительно очищены до гомогенности. Термин изолированный означает, что материал извлечен из своего исходного окружения (например, природного окружения, если он встречается в природе). Например, встречающиеся в природе полипептид или полинуклеотид, присутствующие в живом микроорганизме, не являются изолированными,однако, те же полипептид или полинуклеотид, отделенные от некоторых или всех сосуществующих в- 12012165 природной системе материалов, являются изолированными. Такие полинуклеотиды могут быть частью вектора, и/или такие полинуклеотиды или полипептиды могут быть частью композиции и все-таки будут изолированными, поскольку вектор или композиция не являются частью их природного окружения. Изолированным полинуклеотидом или нуклеиновой кислотой, как применяется здесь, могут быть ДНК или РНК, которые не являются непосредственно смежными с кодирующими последовательностями, с которыми они являются непосредственно смежными (одна с 5'-конца и одна с 3'-конца) во встречающемся в природе геноме организма, из которого получены. Так, в одном осуществлении нуклеиновая кислота включает некоторые или все 5'-некодирующие (например, промотор) последовательности, которые являются непосредственно смежными с кодирующей последовательностью. Термин изолированный полинуклеотид, следовательно, включает, например, рекомбинантную ДНК, которая входит в состав вектора, автономно реплицирующейся плазмиды или вируса или в геномную ДНК прокариота или эукариота или которая существует как отдельная молекула (например, кДНК или фрагмент геномной ДНК, полученный посредством ПЦР или обработки рестриктазами) независимо от других последовательностей. Он также включает рекомбинантную ДНК, которая является частью гибридного гена, кодирующего дополнительный полипептид, которая, в основном, свободна от клеточного материала, вирусного материала или культуральной среды (при получении с помощью техники рекомбинантных ДНК) или химических предшественников или других химических веществ (при получении посредством химического синтеза). Далее, изолированный фрагмент нуклеиновой кислоты является фрагментом нуклеиновой кислоты, который не встречается в природе в виде фрагмента и который нельзя найти в естественном состоянии. Как применяется здесь, термины полинуклеотид, ген и рекомбинантный ген относятся к молекулам нуклеиновой кислоты, которые можно изолировать из хромосомной ДНК, которые включают участок с открытой рамкой считывания, кодирующий белок, например SNDHai белки из G. oxydans DSM 17078. Полинуклеотид может включать полинуклеотидную последовательность, как показано в ПОСЛ.1, или ее фрагмент и районы до и после последовательностей гена, которые могут включать, например, районы промоторов, регуляторные районы и районы терминаторов, важные для правильной экспрессии и стабилизации полипептида, получаемого таким образом. Ген может включать кодирующие последовательности, некодирующие последовательности, такие как, например, нетранслируемые последовательности, расположенные на 3'- и 5'-концах кодирующего района гена, и регуляторные последовательности. Далее, ген относится к изолированной молекуле нуклеиновой кислоты, как определено здесь. Более того, специалисту в данной области ясно, что полиморфизм последовательности ДНК, ведущий к изменениям аминокислотных последовательностей SNDHai белков, может существовать внутри популяции, например популяции Gluconobacter oxydans. Такой генетический полиморфизм для SNDHai гена может существовать среди особей внутри популяции благодаря естественным вариациям или в клетках из различных популяций. Такие естественные вариации, обычно,могут приводить к 1-2% различий в нуклеотидной последовательности SNDHai гена. Все и каждая из этих нуклеотидных вариаций и возникающий вследствие этого аминокислотный полиморфизм SNDHai являются результатом естественной изменчивости, и те, что не меняют функциональную активностьSNDHai белков, входят в область притязаний данного изобретения. Как применяется здесь, термин полинуклеотид или молекула нуклеиновой кислоты включают молекулы ДНК (например, кДНК или геномной ДНК), и молекулы РНК (например, мРНК), и аналоги ДНК и РНК, полученные с помощью аналогов нуклеотидов. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но предпочтительно является двухцепочечной ДНК. Нуклеиновая кислота может быть синтезирована с применением аналогов или производных олигонуклеотидов (например, инозина или фосфоротиоата). Такие олигонуклеотиды можно применять, например, для получения нуклеиновых кислот с измененными свойствами образования пар оснований или увеличенной устойчивостью к нуклеазам. Информацию о последовательностях, предоставленную здесь, не следует толковать столь узко, чтобы требовать включения ошибочно идентифицированных оснований. Отдельные последовательности,раскрытые здесь, можно успешно применять для выделения полных генов из рекомбинантного или нерекомбинантного микроорганизма, способного превращать данный источник углерода прямо в витамин С,в частности Gluconobacter oxydans, предпочтительно Gluconobacter oxydans DSM 17078, который, в свою очередь, можно с легкостью подвергать дальнейшему анализу последовательностей, идентифицируя таким образом ошибки секвенирования. Если не отмечено обратное, все нуклеотидные последовательности, определенные здесь с помощью секвенирования молекулы ДНК, определены с помощью автоматического секвенатора и все аминокислотные последовательности полипептидов, кодируемых молекулами ДНК, определенные здесь, предсказаны посредством трансляции последовательностей ДНК, определенных, как описано выше. Поэтому,как известно в данной области техники для любой последовательности ДНК, определенной таким автоматическим способом, любая нуклеотидная последовательность, определенная здесь, может содержать некоторые ошибки. Нуклеотидные последовательности, определенные автоматически, обычно являются не менее чем на 90% идентичными, более типично от не менее чем на 95% до не менее чем на 99,9%- 13012165 идентичными действительной нуклеотидной последовательности секвенированной молекулы ДНК. Действительную последовательность можно более точно определить с помощью других подходов, включая способы ручного секвенирования ДНК, хорошо известные в данной области. В данной области техники также хорошо известно, что одиночная вставка или делеция в определенной (путем секвенирования) нуклеотидной последовательности по сравнению с действительной последовательностью приведет к сдвигу рамки считывания при трансляции нуклеотидной последовательности, так что предсказанная аминокислотная последовательность, кодируемая полученной посредством секвенирования нуклеотидной последовательностью, станет совершенно отличной от аминокислотной последовательности, действительно кодируемой секвенируемой молекулой ДНК, начиная от точки такой вставки или делеции. Специалист в данной области может идентифицировать такие ошибочно идентифицированные основания и знает, как исправлять подобные ошибки. Молекула нуклеиновой кислоты согласно изобретению может включать только часть или фрагмент нуклеотидной последовательности, предоставленной данным изобретением, как, например, последовательности ПОСЛ.1, например фрагмент, который можно применять в качестве пробы или праймера,как, например, ПОСЛ.3 или ПОСЛ.4, или фрагмент, кодирующий часть белка согласно изобретению. Нуклеотидная последовательность, определенная из клонирования SNDHai гена, позволяет получать пробы или праймеры для применения с целью идентификации и/или клонирования других членов семейства SNDHai, а также SNDHai гомологов из других видов. Проба/праймер обычно включает в значительной степени очищенные олигонуклеотиды, которые обычно содержат район нуклеотидной последовательности, который гибридизуется предпочтительно в очень жестких условиях хотя бы с приблизительно 12 или 15, предпочтительно с приблизительно 18 или 20, более предпочтительно с приблизительно 22 или 25, еще более предпочтительно с приблизительно 30, 35, 40, 45, 50, 55, 60, 65, или 75, или более последовательными нуклеотидами или нуклеотидной последовательностью согласно ПОСЛ.1 или ее фрагментом или производным. Молекулу нуклеиновой кислоты, включающую всю или часть нуклеотидной последовательности согласно ПОСЛ.1, можно изолировать с помощью полимеразной цепной реакции (ПЦР) с применением синтетических олигонуклеотидных праймеров, созданных на основе информации о последовательностях, содержащейся здесь. Нуклеиновую кислоту согласно изобретению можно амплифицировать с применением кДНК,мРНК или, альтернативно, геномной ДНК в качестве матрицы и соответствующих олиигонуклеотидных праймеров с помощью стандартных приемов ПЦР амплификации. Нуклеиновую кислоту, амплифицированную таким способом, можно клонировать в подходящий вектор и характеризовать с помощью анализа последовательности ДНК. Фрагменты полинуклеотида могут также включать полинуклеотиды, не кодирующие функциональные полипептиды. Такие полинуклеотиды могут выступать в качестве проб или праймеров для ПЦР реакции. Нуклеиновые кислоты безотносительно того, кодируют ли они функциональные или нефункциональные полипептиды, можно применять как пробы для гибридизации или праймеры для полимеразной цепной реакции (ПЦР). Применения молекул нуклеиновой кислоты согласно настоящему изобретению,которые не кодируют полипептиды, обладающие SNDHai активностью, включают, среди прочего: (1) выделение гена, кодирующего белок настоящего изобретения, или его аллельных вариантов из библиотеки кДНК, например из организмов, отличных от Gluconobacter oxydans, и (2) анализ с помощью блоттинга(Northern blot) для детектирования эксрессии мРНК упомянутого белка в определенных клетках или (3) применение для усиления и/или улучшения функции или активности гомологов SNDHai генов в упомянутых организмах. Пробы, основанные на нуклеотидных последовательностях, предоставленных здесь, можно применять для детектирования транскриптов или геномных последовательностей, кодирующих те же или гомологичные белки, например, в других организмах. Молекулы нуклеиновых кислот, соответствующие естественным вариантам и происходящим не из G. oxydans гомологам SNDHai ДНК из G. oxydans согласно изобретению, которые также охвачены настоящим изобретением, можно изолировать, основываясь на их гомологии нуклеиновой кислоте SNDHai из G. oxydans, раскрытой здесь, с применением ДНКG. oxydans или его части в качестве гибридизационной пробы согласно стандартным техникам гибридизации, предпочтительно в очень жестких условиях гибридизации. В предпочтительных осуществлениях проба далее включает присоединенную к ней группу маркера,например, группой маркера может быть радиоизотоп, флуоресцентное соединение, фермент или кофактор фермента. Гомологи или в значительной степени идентичные последовательности генов можно изолировать,например, с помощью ПЦР с применением двух подборок вырожденных праймеров, созданных на основе нуклеотидной последовательности, как описано здесь. Матрицей для реакции может быть кДНК, полученная с помощью обратной транскрипции мРНК,полученной из штаммов, о которых известно или предполагается, что они экспрессируют полинуклеотид согласно изобретению. Продукт ПЦР можно субклонировать и секвенировать, чтобы удостовериться в том, что амплифицированные последовательности представляют последовательности новой нуклеиновой- 14012165 кислоты, как описано здесь, или ее функциональный эквивалент. ПЦР фрагмент можно далее применять для выделения кДНК клона в полную длину с помощью большого числа известных способов. Например, амплифицированный фрагмент можно пометить и применять для скрининга бактериофаговой или космидной библиотеки кДНК. С другой стороны, меченый фрагмент можно применять для скрининга геномной библиотеки. Технику ПЦР также можно применять для выделения последовательностей кДНК в полную длину из других организмов. Например, можно изолировать РНК согласно стандартным способам из подходящего источника клеточной или тканевой природы. Реакцию обратной транскрипции можно проводить с применением РНК с применением олигонуклеотидного праймера, специфичного для большей части 5'конца амплифицированного фрагмента для начала синтеза первой цепочки. К образующемуся РНК/ДНК гибриду можно затем добавить хвостик (например, из гуанинов) с помощью стандартной реакции с терминальной трансферазой, гибрид можно обработать с помощью РНКазы Н и начать синтез второй цепочки (например, с помощью поли-Ц праймера). Таким образом,последовательности кДНК, расположенные выше амплифицируемого фрагмента, можно легко изолировать. Для обзора полезных стратегий клонирования см., например, Sambrook et al., supra; and Ausubel etal., supra. Гомологи, в значительной степени идентичные последовательности, функциональные эквиваленты и ортологи генов, проиллюстрированных здесь, таких как SNDHai ген согласно ПОСЛ.1, можно получить из ряда различных микроорганизмов. Способы изоляции специфических генов и/или их фрагментов проиллюстрированы здесь. Следуя этим способам, SNDHai гены были успешно изолированы из Gluconobacter oxydans IFO 3292, Gluconobacter oxydans IFO 3287, Acetobacter sp. ATCC 15164 и Gluconobacter oxydans IFO 3244. Соответственно, нуклеиновые кислоты, кодирующие другие члены семейства SNDHai, которые, таким образом, имеют нуклеотидную последовательность, отличающуюся от нуклеотидной последовательности согласно ПОСЛ.1, находятся в области притязаний изобретения. Далее, нуклеиновые кислоты,кодирующие SNDHai белки из различных видов, которые таким образом обладают нуклеотидной последовательностью, которая отличается от нуклеотидной последовательности, приведенной в ПОСЛ.1,находятся в области притязаний изобретения. Изобретение также раскрывает изолированный полинуклеотид, способный к гибридизации в жестких условиях, предпочтительно в очень жестких условиях, с полинуклеотидом согласно настоящему изобретению, таким как, например, полинуклеотид согласно ПОСЛ.1. Преимущественно такой полинуклеотид можно получить из микроорганизма, способного превращать данный источник углерода прямо в витамин С, в частности Gluconobacter oxydans, предпочтительно Gluconobacter oxydans DSM 17078. Как применяется здесь, термин гибридизующие описывает условия для гибридизации и промывки, при которых нуклеотидные последовательности, хотя бы на приблизительно 50%, хотя бы на приблизительно 70%, более предпочтительно хотя бы на приблизительно 80%, еще более предпочтительно хотя бы на приблизительно 85-90%, наиболее предпочтительно хотя бы на 95% гомологичные друг другу,остаются гибридизованными друг с другом. В одном осуществлении нуклеиновая кислота изобретения является хотя бы на 40, 45, 50, 55, 60, 65,70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% или более гомологична последовательности нуклеиновой кислоты согласно ПОСЛ.1 или ее комплементу. Предпочтительным, но не ограничивающим примером таких условий гибридизации является гибридизация в 6 растворе хлористого натрия/цитрата натрия (SSC) при приблизительно 45 С с последующими одной или более промывками в 1 SSC, 0,1% ДСН (додецилсульфат натрия) при 50 С, предпочтительно при 55 С, более предпочтительно при 60 С и еще более предпочтительно при 65 С. Очень жесткие условия включают, например, инкубацию от 2 ч до 4 дней при 42 С с применением дигоксигенин (DIG)-меченной ДНК пробы (полученной с помощью системы введения DIG метки; RocheGmbH) в присутствии или в отсутствие 100 мкг/мл ДНК из спермы лосося, или в растворе, включающем 50% формамид, 5 SSC (150 мМ хлористого натрия, 15 мМ цитрата натрия трехзамещенного), 0,02% додецилсульфата натрия, 0,1% N-лаурилсаркозина и 2% блокирующего реагента (Roche DiagnosticsGmbH) с последующей промывкой фильтров дважды в течение от 5 до 15 мин в 2 SSC и 0,1% ДСН при комнатной температуре и затем промывкой дважды в течение 15-30 мин в 0,5 SSC и 0,1% ДСН или 0,1SSC и 0,1% ДСН при 65-68 С. Предпочтительно изолированная молекула нуклеиновой кислоты согласно изобретению, которая гибридизуется предпочтительно в очень жестких условиях с нуклеотидной последовательностью согласно изобретению, соответствует естественно встречающейся молекуле нуклеиновой кислоты. Как применяется здесь, естественно встречающаяся молекула нуклеиновой кислоты относится к молекуле ДНК или РНК, обладающей нуклеотидной последовательностью, которая встречается в природе (например,кодирует природный белок). В одном осуществлении нуклеиновая кислота кодирует природный SNDHai белок из G. oxydans.- 15012165 Специалист в данной области поймет, какие условия относятся к жестким и очень жестким условиям гибридизации. Дополнительная помощь в поиске таких условий легко доступна в данной области,например, у Sambrook et al., 1989, Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Press, N. Y.;and Ausubel et al. (eds.), 1995, Current Protocols in Molecular Biology, (John WileySons, N. Y.). Конечно,полинуклеотид, который гибридизуется только с последовательностью поли(А) (такой, как 3'-терминальная поли(А) часть мРНК) или с комплементарным участком Т (или У) остатков, не был бы включен в полинуклеотид по изобретению, применяемый для специфической гибридизации с частью нуклеиновой кислоты согласно изобретению, поскольку такой полинуклеотид гибридизовался бы с любой молекулой нуклеиновой кислоты, содержащей участок поли(А) или комплементарный ему (например, практически,с любой двухцепочечной клональной кДНК). В типичном случае, можно подвергать скринингу библиотеки геномной ДНК или кДНК, полученные из других организмов, например микроорганизмов, способных к превращению данного источника углерода, такого как D-сорбит, L-сорбоза, L-сорбозон, прямо в витамин С, в частности из других видовGluconobacter. Например, штаммы Gluconobacter можно подвергнуть скринингу на наличие гомологов полинуклеотидов с помощью блот-анализа (Northern blot analysis). При обнаружении транскриптов, гомологичных полинуклеотидам согласно изобретению, можно составить библиотеки ДНК на основе РНК, изолированных из соответствующего штамма, применяя стандартные техники, хорошо известные специалисту в данной области. С другой стороны, можно подвергать скринингу общую библиотеку геномной ДНК,применяя пробу, гибридизуемую с полинуклеотидом согласно изобретению. Молекулу нуклеиновой кислоты по настоящему изобретению, такую, например, как молекула нуклеиновой кислоты согласно ПОСЛ.1 или ее фрагмент или производное, можно изолировать с применением стандартных техник молекулярной биологии и информации о последовательностях, предоставленной здесь. Например, применяя все или часть последовательности нуклеиновой кислоты согласно ПОСЛ.1 в качестве гибридизационной пробы, молекулы нуклеиновой кислоты согласно изобретению можно изолировать с помощью стандартной техники гибридизации и клонирования (например, описанных у Sambrook, J., Fritsh, E.F., and Maniatis, T. Molecular Cloning: A Laboratory Manual. 2nd, ed., ColdSpring Harbor Laboratory, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989). Далее, олигонуклеотиды, соответствующие или гибридизуемые с нуклеотидными последовательностями согласно изобретению, можно получить с помощью стандартных техник синтеза, например применяя автоматический синтезатор ДНК. Термины гомология, идентично или процент идентичности применяются здесь взаимозаменяемо. Для целей настоящего изобретения здесь определено, что для выяснения процента идентичности двух аминокислотных последовательностей или двух нуклеотидных последовательностей эти последовательности сопоставляют (aligned) с целью оптимального сравнения (например, можно вставлять разрывы в первую аминокислотную или полинуклеотидную последовательность для оптимального сопоставления со второй аминокислотной или нуклеотидной последовательностью). Остатки аминокислот или нуклеотидов в соответствующих положениях затем сравнивают. Если положение в первой последовательности занято таким же аминокислотным остатком или нуклеотидом, как и соответствующее положение второй последовательности, то молекулы являются идентичными по этой позиции. Процент идентичности между двумя последовательностями является функцией числа идентичных позиций, поделенного на длину последовательностей (т.е. % идентичности=число идентичных позиций/общее число позиций (т.е. перекрывающихся позиций)100). Предпочтительно у двух последовательностей одинаковая длина. Специалист в данной области осведомлен о том, что доступно несколько компьютерных программ для определения гомологии между двумя последовательностями. Например, сравнение последовательностей и определение процента идентичности между двумя последовательностями может выполняться с помощью математического алгоритма. В предпочтительном осуществлении процент идентичности между двумя аминокислотными последовательностями определяют с помощью алгоритма Needleman andGCG (доступного на http://www.accelrys.com), с применением либо матрицы Blossom 62, либо матрицы РАМ 250 и веса участка разрыва (a gap weight) 16, 14, 12, 10, 8, 6 или 4 и веса протяженности (lengthweight) 1, 2, 3, 4, 5 или 6. Специалист в данной области поймет, что различия во всех этих параметрах приведут к слегка различным результатам, но на общем проценте идентичности двух последовательностей применение разных алгоритмов не скажется значительным образом. Еще в одном осуществлении процент идентичности между двумя нуклеотидными последовательностями определен с помощью программы GAP программного пакета GCG (доступного на http://www.accelrys.com) с применением NWSgapdna, матрицы СМР, веса участка разрыва 40, 50, 60, 70 или 80 и веса протяженности 1, 2, 3, 4, 5 или 6. В другом осуществлении процент идентичности между двумя нуклеотидными последовательностями определяют с помощью алгоритма Е. Meyers and W. Miller (CABIOS, 4: 11-17(1989, включенного в программу ALIGN (версия 2.0) (доступную на http://vega.igh.cnrs.fr/bin/alignguess.cgi), применяя таблицу веса остатков (weight residue table) РАМ 120, штраф за протяженность участка разрыва (a gap length penalty) 12 и штраф за участок разрыва (a gap penalty) 4.- 16012165 Последовательности нуклеиновой кислоты и белка согласно настоящему изобретению далее можно применять в качестве последовательности запроса для проведения поиска по общедоступным базам данных для того, чтобы, например, идентифицировать другие члены семейства или родственные последовательности. Такие поиски можно проводить с применением программ BLASTN и BLASTX (версия 2.0) по Altschul, et al. (1990) J. Mol. Biol. 215: 403-10. Поиск нуклеотидов с применением BLAST можно проводить с помощью программы BLASTN с параметрами счет=100, длина слова=12 для получения нуклеотидных последовательностей, гомологичных молекулам нуклеиновых кислот согласно настоящему изобретению. Поиск белков с применением BLAST можно проводить с помощью программы BLASTX с параметрами счет=50, длина слова=3 для получения аминокислотных последовательностей, гомологичных молекулам белков согласно настоящему изобретению. Для получения сопоставлений с разрывами с целями сравнения можно применять Gapped BLAST, как описано у Altschul et al. (1997) Nucleic AcidsRes. 25 (17): 3389-3402. При применении программ BLAST и Gapped BLAST можно применять параметры по умолчанию соответствующих программ (т.е. BLASTX и BLASTN). См. http://www.ncbi.nim.nih.gov. В другом осуществлении изолированная молекула нуклеиновой кислоты по изобретению включает молекулу нуклеиновой кислоты, которая является комплементарной нуклеотидной последовательности,такой как в настоящем изобретении, как, например, последовательность согласно ПОСЛ.1. Молекулой нуклеиновой кислоты, которая комплементарна нуклеотидной последовательности, раскрытой здесь,является такая, которая достаточно комплементарна нуклеотидной последовательности согласно ПОСЛ.1, так что она может гибридизоваться с упомянутой нуклеотидной последовательностью, таким образом образуя устойчивую пару (дуплекс). В другом осуществлении нуклеиновая кислота изобретения согласно ПОСЛ.1 или ее комплемент содержит хотя бы одну мутацию, приводящую к продукту гена с модифицированной функцией/активностью. Хотя бы одну мутацию можно ввести способами, известными в данной области или описанными здесь. По отношению к SNDHai хотя бы одна мутация приводит к SNDHai белку, функция которого по сравнению с представителем дикого типа является усиленной или улучшенной. Активность SNDHai белка таким образом увеличивается. Способы введения таких мутаций хорошо известны в данной области. Клетки с увеличенной SNDHai активностью являются предпочтительными, поскольку такие клетки будут продуцировать больше витамина С, в особенности, когда любой из других генов, выбранный изCMC или СДЦ генов, генетически изменен, как описано здесь. Другой аспект относится к векторам, содержащим нуклеиновую кислоту, кодирующую белок согласно изобретению или его функциональный эквивалент или часть. Как применяется здесь, термин вектор относится к молекуле нуклеиновой кислоты, способной переносить другую нуклеиновую кислоту, к которой она присоединена. Одним типом вектора является плазмида, что относится к кольцевой двухцепочечной ДНК, в которую можно лигировать дополнительный сегмент ДНК. Другим типом вектора является вирусный вектор, где дополнительные сегменты ДНК можно лигировать в вирусный геном. Определенные векторы способны к независимой репликации в клетке хозяина, в которую они введены (например, бактериальные векторы, имеющие бактериальное начало репликации). Другие векторы интегрируются в геном клетки хозяина после введения в клетку хозяина и вследствие этого реплицируются вместе с геномом хозяина. Далее, определенные векторы способны управлять экспрессией генов, с которыми они связаны на оперативном уровне. Такие векторы называются здесь экспрессирующими векторами. Обычно экспрессирующие векторы, применяемые в технике рекомбинантных ДНК, часто представлены в форме плазмид. Термины плазмида и вектор могут здесь применяться взаимозаменяемо, поскольку плазмида является наиболее распространенной формой вектора. Однако изобретение охватывает и такие иные формы экспресссируюших векторов, как вирусные векторы (например, ретровирусы с нарушенной репликацией, аденовирусы и аденосвязанные вирусы), которые выполняют такие же функции. Рекомбинантные векторы изобретения включают нуклеиновую кислоту изобретения в форме, подходящей для экспрессии нуклеиновой кислоты в клетке хозяина, что означает, что рекомбинантный экспрессирующий вектор включает одну или более регуляторную последовательность, выбранную в соответствии к клеткой хозяина, предназначенной для экспрессии, которая связана на оперативной уровне с последовательностью нуклеиновой кислоты, которую собираются экспрессировать. Внутри рекомбинантного экспрессирующего вектора связано на оперативной уровне означает, что рассматриваемая нуклеотидная последовательность связана с регуляторной последовательностью таким образом, который позволяет экспрессию нуклеотидной последовательности (например, как в случае системы in vitro транскрипции/трансляции или в клетке хозяина, когда вектор введен в клетку хозяина). Термин регуляторная последовательность включает промоторы, усилители и другие элементы контроля экспрессии (например,аттенюатор). Такие регуляторные последовательности описаны, например, у Goeddel; Gene ExpressionTechnology: Methods in Enzymology 185, Academic Press, San Diego, СА (1990). Регуляторные последовательности включают таковые, которые управляют конститутивной или индуцируемой экспрессией нуклеотидной последовательности у многих типов клеток хозяина, и такие, которые управляют экспрессией нуклеотидной последовательности только у определенных клеток хозяина (например, тканеспецифичные регуляторные последовательности). Специалисту в данной области будет ясно, что конструкция экспрес- 17012165 сирующего вектора может зависеть от таких факторов, как выбор клетки хозяина, которую будут трансформировать, желаемого уровня экспрессии белка и т.д. Экспрессирующие векторы согласно изобретению можно вводить в клетки хозяина, чтобы вследствие этого продуцировать белки или пептиды, кодируемые нуклеиновыми кислотами, как описано здесь, включая, но, не ограничиваясь этим, мутантные белки, их фрагменты, их варианты или функциональные эквиваленты и составные белки (fusion proteins),кодируемые нуклеиновой кислотой, как описано здесь, например SNDHai белки, мутантные формыSNDHai белков, составные белки и т.п. Функциональные эквиваленты полипептидов, как проиллюстрировано здесь, также могут быть частью настоящего изобретения и определены на основе аминокислотных последовательностей согласно настоящему изобретению посредством добавления, вставки, делеции и/или замещения одного или более аминокислотного остатка таких последовательностей, где такие производные предпочтительно сохраняют L-сорбозондегидрогеназную активность, измеряемую с помощью аналитического подхода, известного в данной области или специально описанного здесь. Такие функциональные производные можно получать либо с помощью химического синтеза пептидов, известного в данной области техники, либо с помощью рекомбинантных подходов на основе последовательностей ДНК, раскрытых здесь, с помощью способов, известных на данном уровне развития техники. Аминокислотные замены в белках и пептидах,которые не изменяют значительно активность таких молекул, известны. Рекомбинантные экспрессирующие векторы согласно изобретению можно конструировать для экспрессии SNDHai белков в подходящем микроорганизме. Например, белок согласно изобретению можно экспрессировать в бактериальных клетках, таких как штаммы, относящиеся к родам Gluconobacter,Gluconacetobacter или Acetobacter. Экспрессирующие векторы, применимые в настоящем изобретении,включают векторы хромосомного, эписомного и вирусного происхождения, т.е. векторы-производные бактериальных плазмид, бактериофага и векторы-производные их сочетаний, такие как полученные из генетических элементов плазмиды и бактериофага, такие как космиды и фагемиды. Вставка ДНК может быть связана на оперативном уровне с соответствующим промотором, который может быть как конститутивным, так и индуцируемым промотором. Специалист в данной области знает,как выбирать нужные промоторы. Экспрессирующие конструкции могут содержать участки инициации транскрипции, ее терминации и, в районе, подвергаемом транскрипции, участок связывания рибосом для осуществления трансляции. Кодирующая часть зрелых транскриптов, экспрессируемая конструкциями,может предпочтительно включать инициирующий кодон у начала и стоп-кодон, правильным образом расположенный на конце полипептида, предназначенного для трансляции. ДНК векторы можно ввести в подходящие клетки хозяина с помощью общепринятых техник трансформации или трансфекции. Как применяется здесь, термины трансформация, трансконъюгация и трансфекция относятся к разнообразию известных в данной области приемов для введения чужеродной нуклеиновой кислоты (например, ДНК) в клетку хозяина, включая соосаждение с фосфатом кальция или хлоридом кальция, трансфекцию, опосредованную ДЭАЭ-декстраном, трансдукцию, инфекцию, липофекцию, трансфекцию, опосредованную катионным липидом, или электропорацию. Подходящие способы трансформации или трансфекции клеток хозяина можно найти у Sambrook, et al. (supra),Davis et al., Basic Methods in Molecular Biology (1986) и в других лабораторных руководствах. Для того, чтобы идентифицировать и отобрать клетки, которые интегрировали чужеродную ДНК в свой геном, вместе с рассматриваемыми генами в клетки хозяина обычно вводят маркеры отбора (например, устойчивости к антибиотикам). Предпочтительные маркеры отбора включают те, которые придают устойчивость к лекарствам, таким как канамицин, тетрациклин, ампициллин и стрептомицин. Нуклеиновую кислоту, кодирующую маркер отбора, предпочтительно вводят в клетку хозяина в составе того же вектора, что и последовательность, кодирующую белок согласно изобретению, или вводят в составе отдельного вектора, такого как, например, суицидальный вектор, который не может реплицироваться в клетке хозяина. Клетки, устойчиво несущие введенную нуклеиновую кислоту, можно идентифицировать с помощью отбора на антибиотиках (т.е. клетки, которые включают маркер отбора, выживут, в то время как другие погибнут). Изобретение предоставляет также изолированный полипептид, обладающий аминокислотной последовательностью согласно ПОСЛ.2, или аминокислотной последовательностью, полученной посредством экспрессии полинуклеотида согласно настоящему изобретению, такого как, например, полинуклеотидная последовательность согласно ПОСЛ.1, в подходящем хозяине. Полипептиды согласно изобретению могут содержать только консервативные замещения одной или более аминокислоты в аминокислотной последовательности согласно ПОСЛ.2 или замещения, вставки или делеции несущественных аминокислот. Соответственно, несущественной аминокислотой является остаток, который можно заменить в аминокислотной последовательности согласно ПОСЛ.2, без значительного изменения биологической функции. Например, предсказано, что аминокислотные остатки, являющиеся консервативными среди белков настоящего изобретения, в особой степени не подвержены изменению. Далее, представляется маловероятным, что аминокислоты, являющиеся консервативными среди белков настоящего изобретения и других SNDHai белков, подвержены изменению. Термин консервативное замещение означает замещение, при котором аминокислотный остаток- 18012165 заменен аминокислотным остатком, имеющим сходную боковую цепь. В данной области техники известны семейства, которые включают аминокислоты с основными боковыми цепями (например, лизин,аргинин и гистидин), кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глютамин, серин,треонин, тирозин, цистеин), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), -разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Как отмечено выше, полинуклеотиды согласно настоящему изобретению можно применять для генетической модификации подходящей клетки хозяина, чтобы сделать ее лучше и более эффективной для ферментации, например процесса прямой ферментации с получением витамина С. Поэтому изобретение также относится к одновременному (сопутствующему) применению гена, кодирующего SNDHai белок или его активный фрагмент или производное, и гена, кодирующего полипептид, обладающий CMC или СДЦ активностью, или активный фрагмент или его производное, для получения рекомбинантной клетки хозяина. Такая клетка хозяина затем продемонстрирует улучшенную способность прямо продуцировать витамин С. Изменение генома микроорганизма можно получить, например, с помощью замещения посредством одинарного или двойного кроссинговера последовательности ДНК дикого типа последовательностью ДНК, содержащей изменение. Для удобного отбора трансформантов микроорганизма с изменением в геноме изменение может быть, например, последовательностью ДНК, кодирующей маркер устойчивости к антибиотикам или ген, дополняющий возможную ауксотрофность микроорганизма. Мутации включают, но не ограничиваются этим, делеции и вставки. Изменение генома микроорганизма, приводящее к более функциональному полипептиду, можно также получить с помощью случайного мутагенеза генома микроорганизма с применением, например,химических мутагенов, радиации или транспозонов и последующего отбора или скрининга мутантов,которые лучше или более эффективно продуцируют один или более продукт ферментатации. Стандартные способы скрининга и отбора известны специалисту в данной области. В отдельном осуществлении требуется вывести из строя (knockout) или подавить репрессор SNDHai гена согласно настоящему изобретению, например, так что экспрессия гена репрессора искусственно подавлена, чтобы улучшить выход, выработку и/или эффективность продукции продукта ферментации при введении в подходящие клетки хозяина. Способы, осуществления нокаута, а также микроорганизмы,несущие такие подавленные гены, хорошо известны в данной области. Как применяется здесь, подавление экспрессии гена включает полное или частичное подавление, а также подавление в определенных условиях, а также подавление экспрессии одного или двух аллелей. Стратегии вышеупомянутого мутагенеза для SNDHai белков могут приводить к повышенным выходам желаемого соединения, в частности витамина С. Этот список не должен быть ограничивающим; варианты стратегий мутагенеза очевидны специалисту в данной области. С помощью таких механизмов молекулы нуклеиновой кислоты и белка согласно настоящему изобретению можно применять для получения микроорганизмов, таких как Gluconobacter oxydans или родственные штаммы бактерий, экспрессирующие мутантные молекулы SNDHai нуклеиновой кислоты и белка, так что выход, продукция и/или эффективность продукции желаемого соединения, такого как витамин С, улучшены. Молекулы нуклеиновой кислоты, полипептиды, векторы, праймеры и рекомбинантные микроорганизмы, описанные здесь, можно применять для одного или более следующих подходов: идентификацияGluconobacter oxydans; идентификация и локализация рассматриваемых последовательностей Gluconobacteroxydans; эволюционные исследования; определение районов SNDHai белка, необходимых для его функции; изменение активности или функции SNDHai белка; изменение активности SNDHai пути и изменение клеточной продукции желаемого соединения, такого как витамин С. Активность SNDHai пептида можно определять способами, известными в данной области и далее проиллюстрированными здесь. Для того, чтобы проиллюстрировать изобретение более детально, здесь предоставлены несколько примеров, где работа с генами, выбранными из CMC или СДЦ генов, проиллюстрирована более детально. Для специалиста в данной области будет очевидно, как выбрать другие гены, кодирующие белки,выбранные из СДЦ или CMC, и работать с ними согласно пояснениям, предоставленным здесь, чтобы получить микроорганизм, продуцирующий витамин С с улучшенным выходом. Для того, чтобы предоставить дополнительные указания по вышеописанному способу, приведена следующая таблица, где более детально показано, как манипулировать отдельными генами, выбранными из СДЦ и CMC генов. Здесь выражения вверх и вниз относятся к предпочтительной повышенной экспрессии или пониженной экспрессии белков, соответственно, как это может быть достигнуто посредством повышающей регуляции или понижающей регуляции соответствующих генов, соответственно. Такие же результаты можно получить, когда активность соответствующих белков увеличена или понижена любым другим способом, отличным от генетической манипуляции. Специалист в данной области поймет, как усилить и/или улучшить активность белка, как, например, SNDHai или алкогольдегидрогеназы. Этого можно достигнуть посредством генетической модификации организма хозяина таким образом, что он продуцирует больше или более стабильные копии упомянутого белка, чем организм дикого типа. Это также может быть достигнуто посредством увеличения специфической активности белка. В следующих абзацах описаны способы, как достигнуть этой цели, например увеличение выхода и/или продукции витамина С, который прямо производится из D-сорбита или L-сорбозы посредством увеличения (повышающей регуляции) активности специфического белка, например SNDHai. Эти подходы применяют mutatis mutandis для сходных СДЦ и CMC белков, чьи функции по сравнению с представителем дикого типа должны быть усилены или улучшены. Модификации с целью получить организм, продуцирующий больше копий SNDHai гена, т.е. сверхэкспрессирующий ген и/или белок, могут включать применение сильных промоторов или мутации (например, вставки, делеции или точечной мутации) (части) SNDHai гена или его регуляторных элементов. Это может также включать вставку множественных копий гена в подходящий микроорганизм. Увеличения специфической активности SNDHai белка также можно достигнуть с помощью способов, известных в данной области. Такие способы могут включать мутацию (например, вставку, делецию или точечную мутацию) (частей) SNDHai гена. Мутацией, как применяется здесь, может быть любая мутация, приводящая к более функциональному или стабильному полипептиду, например более функциональным или более стабильным продуктамSNDHai гена. Это может включать, например, изменение генома микроорганизма, которое улучшает синтез SNDHai или приводит к экспрессии SNDHai белка с измененной аминокислотной последовательностью, чья функция по сравнению с представителем дикого типа, не обладающим измененной аминокислотной последовательностью, улучшена или усилена. Вмешательство может происходить на уровне транскрипции, трансляции или после транскрипции. Также известными в данной области являются способы увеличения активности данного белка за счет приведения SNDHai белка в контакт со специфическим усилителем или другими веществами, которые специфически взаимодействуют с SNDHai белком. Для того, чтобы идентифицировать такие специфические усилители, SNDHai белок можно экспрессировать и тестировать на активность в присутствии соединений, предположительно усиливающих активность SNDHai белка. Активность SNDHai белка можно также увеличить посредством стабилизации мРНК, кодирующей SNDHai. Такие способы также известны в данной области, см., например, у Sambrook et al., 1989, Molecular Cloning, A Laboratory Manual,Cold Spring Harbor Press, N. Y.; and Ausubel et al. (eds.), 1995, Current Protocols in Molecular Biology (John- 20012165 Термин увеличение активности, как применяется здесь, означает увеличение активности одного или более полипептидов в продуцирующем организме, которые, в свою очередь, кодируются соответствующими полинуклеотидами, описанными здесь. Имеется большое число способов, доступных в данной области, чтобы добиться увеличения активности данного белка, в данном случае SNDHai. Обычно можно увеличить специфическую активность белка или можно увеличить число копий белка. Термин увеличение активности или эквивалентные выражения также означают ситуацию, где активность SNDHai белка введена в клетку, которая не обладала такой активностью ранее, например, посредством введения гена, кодирующего SNDHai, в клетку, которая не содержала эквивалента этого гена ранее или которая не могла экспрессировать активную форму соответствующего белка ранее. Для облегчения такого увеличения число копий гена, соответствующего полинуклеотидам, описанным здесь, можно увеличить. С другой стороны, можно применить сильный промотор для управления экспрессией полинуклеотида. В другом осуществлении промотор, регуляторный район и/или участок связывания рибосомы выше расположения гена можно изменить для увеличения экспрессии. Экспрессию также можно усилить или увеличить посредством увеличения относительного времени полужизни мРНК. В другом осуществлении активность самого полипептида можно увеличить посредством применения одной или более мутаций аминокислотной последовательности полипептида, что увеличивает активность. Например, изменение относительной Km полипептида для соответствующего субстрата приведет к увеличенной активностью. Подобным образом, относительное время полужизни полипептида можно увеличить. В любом случае, как при усилении экспрессии гена, так и при увеличении специфической активности улучшения можно достигнуть посредством изменения состава клеточной культуральной среды и/или способов, применяемых для культивации. Усиленная экспрессия или улучшенная активность, как применяется здесь, означает увеличение хотя бы на 5, 10, 25, 50, 75, 100, 200 или даже более чем на 500%, по сравнению с белком, полинуклеотидом, геном дикого типа или активностью и/или концентрацией белка, имеющимися до того, как полинуклеотиды или полипептиды были усилены и/или улучшены. Активность SNDHai белка можно также усилить посредством приведения белка в контакт со специфическим или общим усилителем его активности. В других случаях, раскрытых здесь, активность CMC или СДЦ полипептида требуется уменьшить или устранить, чтобы выход витамина С, который прямо продуцируется из D-сорбита или L-сорбозона,дополнительно увеличился. Следующие подходы, относящиеся к уменьшению (понижающей регуляции) активности CMC 05 белка, применяют mutatis mutandis для CMC и СДЦ белков, в частности таковых, проиллюстрированных здесь, чьи функции по сравнению с соответствующими представителями дикого типа следует уменьшить. Для упрощения такого уменьшения число копий генов, соответствующих полинуклеотидам, описанным здесь, можно уменьшить, например, посредством пониженной экспрессии или повреждения гена. Ген называется экспрессируемым на низком уровне, если уровень транскрипции упомянутого гена уменьшен по сравнению с геном дикого типа. Это можно измерить, например, с помощью блот-анализа(Northern blot) с оценкой количества мРНК в качестве индикации экспрессии гена. Как применяется здесь, ген экспрессируется на низком уровне, если количество образуемой мРНК уменьшено хотя бы на 1, 2, 5, 10, 25, 50, 75 или 100% относительно количества мРНК, образуемого для гена дикого типа. С другой стороны, можно применять слабый промотор для управления экспрессией полинуклеотида. В другом осуществлении промотор, регуляторный район и/или участок связывания рибосомы выше расположения гена можно изменять для достижения пониженной экспрессии. Экспрессию также можно уменьшить посредством уменьшения относительного времени полужизни msPHK. В другом осуществлении активность самого полипептида можно уменьшить посредством применения одной или более мутации гена, кодирующего полипептид, приводящей к одной или более мутации аминокислотной последовательности полипептида, которая уменьшает активность. Например, изменение сродства полипептида к соответствующему субстрату может приводить к уменьшенной активности. Подобным образом, можно уменьшить относительное время полужизни полипептида. В любом случае, как при уменьшении экспрессии гена, так и при уменьшении активности уменьшение может быть достигнуто посредством изменения состава клеточной культуральной среды и/или способов, применяемых при культивировании. Уменьшенная экспрессия или уменьшенная активность, как применяется здесь, означает уменьшение хотя бы на 5, 10, 25, 50, 75 или 100% по сравнению с белком, полинуклеотидом или геном дикого типа. Активность данного белка также можно уменьшить посредством приведения белка в контакт со специфическим или общим ингибитором его активности. Термины уменьшенная активность, уменьшенная или уничтоженная активность применяются здесь взаимозаменяемо. Для улучшения продукции витамина С в определенной рекомбинантной клетке хозяина экспрессиюCMC 05 гена можно ингибировать в таком организме, например, выбирая нуклеотидные последовательности, комплементарные регуляторному району CMC 05 нуклеотидной последовательности (например,CMC 05 промотор и/или усилитель) для образования тройных спиральных структур, которые предотвращают транскрипцию CMC 05 гена в клетках мишени. См., в основном, Helene, С. (1991) AnticancerDrugDes.- 21012165 6 (6): 569-84; Helene, С. et al. (1992) Ann. N. Y. Acad. Sci. 660: 27-36, и Maher, L.J. (1992) Bioassays 14 (12): 807-15. Ингибирования или предотвращения экспрессии гена также можно достигнуть с помощью модификации CMC 05 гена, например, посредством введения одной или более мутации в CMC 05 ген, где упомянутая модификация приводит к CMC 05 белку с функцией, которая значительно уменьшена по сравнению с белком дикого типа. Мутация, как применяется здесь, может быть мутацией, приводящей к менее функциональному или нестабильному полипептиду, например менее функциональным или нестабильным продуктам CMC 05 гена. Это может включать, например, изменение в геноме микроорганизма, которое мешает синтезу CMC 05 или приводит к экспрессии CMC 05 белка с измененной аминокислотной последовательностью,функция которого по сравнению с белком дикого типа, обладающим неизмененной аминокислотной последовательностью, полностью или частично нарушена. Вмешательство может происходить на уровне транскрипции, трансляции или после трансляции. Изменение в геноме микроорганизма можно получить, например, посредством замены с помощью одинарного или двойного кроссинговера последовательности ДНК дикого типа последовательностью ДНК, содержащей изменения. Для удобного отбора трансформированных микроорганизмов с изменением в геноме это изменение может быть, например, последовательностью ДНК, кодирующей маркер устойчивости к антибиотикам или ген, дополняющий возможную ауксотрофность организма. Мутации включают, но не ограничиваются этим, делеции и вставки. Пример такого изменения включает повреждение гена, например возмущение гена таким образом, что продукт, который обычно продуцируется этим геном, не продуцируется в функциональной форме. Это может происходить из-за полной делеции,делеции или вставки маркера отбора, вставки маркера отбора, делеции со сдвигом рамки считывания,делеции в рамке считывания или точечной мутации, которая приводит к преждевременной терминации. В некоторых из этих случаев мРНК гена отсутствует целиком, в других случаях количество продуцированной мРНК варьирует. Во всех случаях полипептид, кодируемый упомянутым геном, не продуцируется в функциональной форме либо отсутствует, либо присутствует в мутированной форме, такой как, например, белок, обладающий уменьшенной активностью, как определено здесь. Изменение в геноме микроорганизма, приводящее к менее функциональному или нефункциональному полипептиду, можно также получить с помощью случайного мутагенеза генома микроорганизма с применением, например, химических мутагенов, радиации или транспозонов и последующего отбора или скрининга мутантов, которые лучше или более эффективно продуцируют один или более продукт ферментации. Стандартные способы скрининга и отбора известны специалисту в данной области. В отдельном осуществлении требуется вывести из строя (подвергнуть нокауту) CMC 05 ген согласно настоящему изобретению, например, когда экспрессия этого гена искусственно подавлена, чтобы улучшить выход, продуктивность и/или эффективность продукции продукта ферментации витамина С в соответствующей клетке хозяина. Способы, осуществления нокаута, а также микроорганизмы, несущие такие подавленные гены, хорошо известны в данной области. Подавление эндогенного CMC 05 гена можно индуцировать посредством удаления хотя бы части гена или его регуляторного района. Как применяется здесь, подавление экспрессии гена включает полное или частичное подавление, а также подавление в специфических условиях и также подавление экспрессии одного либо обоих аллелей. Для того, чтобы создать нокаут-микроорганизм, у которого экспрессия CMC 05 гена искусственно подавлена, во-первых, CMC 05 ген можно клонировать и затем можно построить вектор для гомологичной рекомбинации с применением гена, чтобы инактивировать эндогенный CMC 05 ген у организма мишени. Вектор для гомологичной рекомбинации в таком случае содержит последовательность нуклеиновой кислоты, созданную для инактивации эндогенного CMC 05 гена у организма мишени. Такая нуклеиновая кислота может быть, например, нуклеотидной последовательностью CMC 05 гена или его регуляторного района, такого как существующий фланкирующий район гена, который следует инактивировать(in cis), или существующий независимо район (in trans), содержащий хотя бы частичную делецию, или,альтернативно, это может быть последовательность нуклеиновой кислоты CMC 05 гена или его регуляторного района, содержащая другие гены. В качестве гена, который вставляют в CMC 05 ген или его регуляторный район, предпочтительно выбирают ген, который может также выступать в роли маркера. Гены для вставки, которые следует применять, включают, например, гены устойчивости к антибиотикам,как определено выше. Нет никакого особого ограничения по положению, куда можно вставлять гены вCMC 05 ген, настолько, насколько вставка приводит к подавлению экспрессии эндогенного CMC 05 гена у мишени. Во избежание противоположного действия вставки, можно внести молчащие делеции, не нарушающие рамки считывания, с применением, например, sacB системы или ПЦР с протяженными фланкирующими гомологиями (long-flanking homology PCR). Эти техники хорошо известны специалисту в данной области. Вышеупомянутые стратегии мутагенеза для CMC 05 белков могут приводить к увеличенным выходам желаемого соединения, в частности витамина С. Этот список не является ограничивающим; варианты стратегий мутагенеза вполне очевидны для любого специалиста в данной области. С помощью этих механизмов молекулы нуклеиновых кислот и белков изобретения можно применять для получения мик- 22012165 роорганизмов, таких как Gluconobacter oxydans или родственные штаммы бактерий, экспрессирующих мутантные молекулы CMC 05 нуклеиновой кислоты или белка, так что выход, продуктивность и/или эффективность продукции желаемого соединения, такого как витамин С, улучшены. В других случаях, раскрытых здесь, активность CMC или СДЦ полипептидов следует увеличить, чтобы выход витамина С, который прямо продуцируется из D-сорбита или L-сорбозы, дополнительно увеличился. Также особенно хорошие результаты получены, когда рекомбинантный организм, усиленно экспрессирующий SNDHai, трансформировали таким способом, что эндогенный ген CMC 05 (ПОСЛ.44),кодирующий НАД(Ф)-зависимую сорбозондегидрогеназу (ПОСЛ.45), подвергается нокауту согласно примерам 15-19. Также особенно хорошие результаты получены, когда рекомбинантный организм, усиленно экспрессирующий SNDHai, трансформировали таким способом, что ген СДЦ 21 (ПОСЛ.180), кодирующий белок(ПХХ А), вовлеченный в биосинтез ПХХ (ПОСЛ.181), усиленно экспрессируется согласно примерам 20 и 21. Данное изобретение далее проиллюстрировано следующими примерами, которые не следует рассматривать как ограничивающие. Содержание всех ссылок, патентных заявок, патентов и опубликованных патентных заявок, процитированных в настоящей заявке, таким образом включено посредством ссылки. Примеры Пример 1. Получение хромосомной ДНК и амплификация фрагмента ДНК с помощью ПЦР. Хромосомную ДНК Gluconobacter oxydans DSM 17078 получают из клеток, выращенных при 30 С в течение 1 дня в жидком бульоне с маннитом (МБ), содержащем 25 г/л маннита, 5 г/л дрожжевого экстракта (Difco) и 3 г/л бактопептона (Difco) по способу, описанному в Sambrook et al. (1989) MolecularCloning: A Laboratory Manual/Second Edition, Cold Spring Harbor Laboratory Press. Фрагменты ДНК получены с помощью ПЦР с хромосомной ДНК, полученной, как описано выше, и набором праймеров Pf (ПОСЛ.3) и Pr (ПОСЛ.4). Для проведения реакции применяют набор для ПЦР с высокой надежностью Expand High Fidelity PCR kit (Roche Diagnostics) и 10 нг хромосомной ДНК в общем объеме 100 мкл в соответствии с приложенной к набору инструкцией, чтобы получить ПЦР продукт, содержащий SNDHai последовательность ДНК (ПОСЛ.1). ПЦР продукт выделяют из реакционной смеси и правильность его последовательности подтверждают. Пример 2. Получение витамина С из L-сорбозона с применением покоящихся клеток, выращенных на агаризованном бульоне с маннитом. Штаммы IFO 3293, 3292, 3244, 3260, 3266, 3287, 3259, 13693 и 13773, а также Acetobacter sp. ATCC 15164 и Gluconobacter oxydans DSM 17078, производные штамма IFO 3293, применены для продукции витамина С из L-сорбозона. Штаммы IFO 13693 и IFO 13773 выращивают при 27 С в течение 3 дней на среде 350, содержащей 5 г/л бактопептона (Difco), 5 г/л дрожжевого экстракта (Difco), 5 г/л глюкозы, 5 г/л маннита, 1 г/лMgSO47H2O, 5 мл/л этанола и 15 г/л агара. Все другие штаммы Acetobacter и все штаммы Gluconobacter выращивают при 27 С в течение 3 дней на агаризованном бульоне с маннитом (МБ), содержащем 25 г/л маннита, 5 г/л дрожжевого экстракта (Difco Laboratories, Detroit, Mich., USA), 3 г/л бактопептона (Difco) и 18 г/л агара (Difco). Клетки соскребают с агаровых слоев, суспендируют в дистиллированной воде и применяют в реакциях с покоящимися клетками, проводимых при 30 С в течение 20 ч в пробирках на 5 мл на качалке при 230 об./мин. Реакционные смеси (0,5 мл) содержат 1% L-сорбозон, 0,3% NaCl, 1% СаСО 3 и клетки при конечной концентрации 10 ед. поглощения при 600 нм (OD600). По окончании инкубационного периода реакционные смеси анализируют с помощью жидкостной хроматографии с высоким разрешениемLiChrospher-100-RP18 (1254,6 мм) (Merck, Darmstadt, Germany), соединенной с колонкой Aminex-HPX78H (3007,8 мм) (Biorad, Reinach, Switzerland). Подвижной фазой является 0,004M серная кислота, и скорость тока составляет 0,6 мл/мин. Два сигнала регистрируют с помощью УФ-детектора (длина волны 254 нм) в сочетании с детектором показателя преломления. Дополнительно, идентификацию витамина С проводят с применением аминоколонки (YMC-Pack Polyamine-II, YMC, Inc., Kyoto, Japan) с детекцией в УФ при 254 нм. Подвижной фазой служит смесь 50 мМ NH4H2PO4 и ацетонитрила (40:60). Система Agilent Series 1100 HPLC-масс-спектрометр (МС) применяется для идентификации витамина С. Масс-спектрометр применяют в режиме для положительного иона с применением электроспрея. Разделение проводят с помощью колонки LUNA-C8(2) (1004,6 мм) (Phenomenex, Torrance, USA). Подвижной фазой является смесь 0,1% муравьиной кислоты с метанолом (96:4). Витамин С элюируют со временем удержания 3,1 мин. Идентичность витамина С подтверждают с помощью времени удержания и молекулярной массы соединения. Чтобы исключить присутствие D-изоаскорбиновой кислоты, идентификацию витамина С дополнительно проводят по времени удержания с применением аминоколонки (YMC-Pack Polyamine-II, YMC,Inc., Kyoto, Japan) с детекцией в УФ при 254 нм. Подвижной фазой является смесь 50 мМ NH4H2PO4 и ацетонитрила (40:60). Штаммы Gluconobacter и Acetobacter продуцируют витамин С из L-сорбозона, как показано в табл. 1. Контроль: реакцию проводят в реакционной смеси без клеток. Пример 3. Получение витамина С из L-сорбозы и D-сорбита при ферментации в пробирке и в колбе. Клетки G. oxydans DSM 17078 применяют для инокуляции 4 мл жидкой среды 3BD и культивируют в пробирке (диаметром 18 мм) при 30 С в течение 3 дней на качалке при 220 об./мин. 20 мг/л витамина С набирается к концу периода инкубации. Клетки штамма DSM 17078 культивируют (с тройным повтором) в 50 мл среды 5, содержащей 100 г/л D-сорбита, 0,5 г/л глицерина, 15 г/л дрожжевого экстракта (Difco), 2,5 г/л MgSO47H2O и 15 г/л СаСО 3 в качалочной колбе с отбойниками на 500 мл при 30 С на качалке при 200 об./мин. Через 72 ч инкубации количество витамина С, измеряемое с помощью HPLC в трех колбах, составило 400, 500 и 650 мг/л. Пример 4. Получение витамина С из D-сорбита при ферментации с подпиткой. Клетки G. oxydans DSM 17078 выращивают в 200 мл среды 5, содержащей 100 г/л D-сорбита, 0,5 г/л глицерина, 15 г/л дрожжевого экстракта (Fluka BioChemika, Buchs, Switzerland), 2,5 г/л MgSO4 и 15 г/л СаСО 3 в качалочной колбе с отбойниками на 2 л при 30 С на качалке при 180 об./мин. Через 48 ч инкубации 150 мл среды применяют для инокуляции биореактора на 10 л (В. Braun ED10, Melsungen, Germany),предварительно подготовленного к работе с 5,3 л среды, содержащей 20 г/л D-сорбита, 0,5 г/л глицерина,15 г/л дрожжевого экстракта (Fluka BioChemika, Buchs, Switzerland) и 2,5 г/л MgSO47H2O, и снабженного сенсорами температуры, рН и растворенного кислорода и петлями контроля. Температуру поддерживают при 30 С, рН поддерживают на 6,0 с помощью добавления 28% раствора аммиака, поток воздуха составляет 4,5 л/мин, и растворенный кислород поддерживают на уровне 30% с помощью регулировки скорости перемешивания (минимум, 300 об./мин). Через 6 ч процесса подают раствор сорбита (500 г/л) со скоростью 25 г/ч в течение 44 ч. Через 96 ч процесса в супернатанте остается около 1% субстата и продуцируется 950 мг/л витамина С. Пример 5. Получение витамина С из L-сорбозона и L-сорбозы с помощью фракции клеточных мембран. Клетки G. oxydans DSM 17078 культивируют в 100 мл жидкой среды 3BD в качалочной колбе с отбойниками при 30 С на качалке при 200 об./мин в течение 3 дней. Получившуюся культуру центрифугируют при 500 об./мин для удаления СаСО 3. Супернатант, получаемый на этом этапе, центрифугируют при 5000 об./мин для осаждения клеток. Собранные клетки суспендируют в 3 мл 50 мМ калийфосфатного буфера (рН 7,0) и клетки далее разрушают посредством двух пассов через ячейку пресса Френча (SIMAMINCO Spetronic Instruments, USA) при давлении 900 psi (фунт на квадратный дюйм). Полученный гомогенат вначале центрифугируют при 5000 об./мин для удаления клеточных обломков. Затем супернатант разводят до конечной концентрации белка 3 мг/мл. Такой разведенный образец называют бесклеточным экстрактом (БКЭ). БКЭ центрифугируют при 100000g в течение 60 мин. Супернатант отбрасывают и осадок собирают в качестве мембранной фракции. Реакцию (200 мкл) с мембранной фракцией (100 мкл) проводят в 50 мМ калийфосфатном буфере(рН 7,0) при перемешивании при 220 об./мин в течение 15 ч. Субстратами для тестирования являются Lсорбозон (конечная концентрация 1%) и L-сорбоза (конечная концентрация 2%). Конечная концентрация белка, применяемая при реакции, составляет 1,5 мг/мл. К концу периода инкубации получено 680 мг/л и 10 мг/л витамина С из 1% L-сорбозона и 2% L-сорбозы, соответственно. Пример 6. Получение витамина С из D-сорбита, L-сорбозы или L-сорбозона с применением покоящихся клеток, выращенных на агаризованной среде 3BD. Клетки G. oxydans DSM 17078 выращивают при 27 С в течение 3 дней на агаризованной среде 3BD,- 24012165 содержащей 70 г/л L-сорбозы, 0,5 г/л глицерина, 7,5 г/л дрожжевого экстракта (Difco), 2,5 г/лMgSO47H2O, 10 г/л СаСО 3 и 18 г/л агара (Difco). Реакции с покоящимися клетками (1 мл реакционной среды в пробирке на 10 мл) проводят с 2% D-сорбитом, 2% L-сорбозой или 1% L-сорбозоном при 30 С в течение 24 ч, как описано в примере 2. Штамм DSM 17078 продуцирует 280, 400 и 1780 мг/л витамина С из D-сорбита, L-сорбозы и L-сорбозона, соответственно. Другие реакции (0,5 мл реакционной смеси в пробирке на 10 мл) проводят с клетками DSM 17078,выращенными на агаризованной среде 3BD, в реакционных смесях, содержащих 2% D-сорбит, 2% L-сорбозу или 1% L-сорбозон в течение 2 дней, как описано в примере 2. Штамм DSM 17078 продуцирует 1,8,2,0 и 5,1 г/л витамина С из D-сорбита, L-сорбозы и L-сорбозона, соответственно. Реакцию с применением клеток G. oxydans IFO 3293 проводят с 2% L-сорбозоном, как описано выше. Штамм IFO 3293 продуцирует 5,7 г/л витамина С за 2 дня. Пример 7. Получение витамина С из D-сорбита с применением покоящихся клеток, выращенных в жидкой среде. Клетки G. oxydans DSM 17078 выращивают в 200 мл среды 5, содержащей 100 г/л D-сорбита, 0,5 г/л глицерина, 15 г/л дрожжевого экстракта (Fluka BioChemika, Buchs, Switzerland), 2,5 г/л MgSO47H2O и 15 г/л СаСО 3 в качалочной колбе с отбойниками на 2 л при 30 С на качалке при 180 об./мин. Через 24 ч культуру центрифугируют при 3220 g (Eppendorf 5810R, Hamburg, Germany) и клетки ресуспендируют в 0,9% растворе NaCl, опять центрифугируют при 3220 g и осадок клеток применяют для инокуляции одной качалочной колбы с отбойниками на 500 мл, содержащей 50 мл полной среды роста (100 г/л D-сорбита,0,5 г/л глицерина, 15 г/л дрожжевого экстракта, 2,5 г/л MgSO47H2O и 15 г/л СаСО 3) и другой качалочной колбы с отбойниками на 500 мл, содержащей 50 мл среды продукции (100 г/л D-сорбита, 3 г/л NaCl, 10 г/л СаСО 3). Исходная плотность клеток, измеренная по оптической плотности при 600 нм (OD600) в обеих колбах, составляет 10. Обе колбы инкубируют при 30 С на качалке при 180 об./мин. Через 48 ч клеточные суспензии в среде роста и в среде для продукции накапливают 1,06 и 1,18 г/л витамина С, соответственно. Никакого дополнительного роста в течение периода инкубации не наблюдается. Пример 8. Блот-анализ по Саузерну (Southern blot analysis) бактерий, продуцирующих витамин С изL-сорбозона. Хромосомную ДНК получают из клеток Gluconobacter oxydans IFO 3293, IFO 3292, IFO 3244, IFO 3287, Gluconobacter frateurii IFO 3260 и IFO 3265, Gluconobacter cerinus IFO 3266 и IFO 3269, AcetobacterATCC 15164 и Escherichia coli K-12. Штаммы IFO 13693 и IFO 13773 выращивают при 27 С в течение 3 дней на среде 350, содержащей 5 г/л бактопептона (Difco), 5 г/л дрожжевого экстракта (Difco), 5 г/л глюкозы, 5 г/л маннита, 1 г/л MgSO47H2O, 5 мл/л этанола и 15 г/л агара. Все другие штаммы Acetobacter и все штаммы Gluconobacter выращивают при 27 С в течение 3 дней на агаризованном бульоне с маннитом (МБ), содержащем 25 г/л маннита, 5 г/л дрожжевого экстракга (Difco Laboratories, Detroit, Mich.,USA), 3 г/л бактопептона (Difco) и 18 г/л агара (Difco). E. coli K-12 выращивают на агаризованной среде Луриа-бульон (LB). Препараты хромосомной ДНК применяют для проведения гибридизации по Саузерну в жестких условиях. Препараты хромосомной ДНК обрабатывают рестриктазой ClaI (для анализа района N-домена) или EcoRI (для анализа района С-домена) и 1 мкг фрагментов ДНК разделяют с помощью электрофореза на агарозном геле (1% агарозы). Гель обрабатывают 0,25 н. HCl в течение 15 мин и затем 0,5 н. NaOH в течение 30 мин и затем подвергают блоттингу с найлоновой мембраной при помощи аппаратаVacuum Blotter Model 785 (BIO-RAD Laboratories AG, Switzerland) согласно приложенной к аппарату инструкции. Пробы готовят с помощью набора ПЦР для внесения метки DIG (PCR-DIG labeling kit (RocheSNDHai, относящемуся к N-домену (вероятно, трансмембранный домен), в то время как ПЦР продукт П 2 соответствует району SNDHai, относящемуся к С-домену (вероятно, основной район дегидрогеназы). Таблица 2 Праймеры, применяемые при ПЦР для получения меченых проб для гибридизации по Саузерну Табл. 2 показывает результаты экспериментов по блот-гибридизации по Саузерну. При гибридизации с пробой П 1 (N-домен) наблюдаются ясные положительные полосы для G. oxydans IFO 3293, IFO 3292,IFO 3244, IFO 3287 и A. sp. ATCC 15164. При гибридизации с пробой П 2 (С-домен) наблюдаются ясные- 25012165 положительные полосы для штаммов IFO 3293, IFO 3292, IFO 3244, IFO 3287 и A. sp. ATCC 15164, в то время как слабые полосы наблюдаются для штаммов IFO 3260, IFO 3265, IFO 3266, IFO 3269 и IFO 13773. Контрольный штамм, Е. coli K-12, не демонстрирует различимых сигналов ни для одного из доменов. Таблица 3 Детекция сигналов гибридизации у различных штаммов, полученная с помощью гибридизации по Саузерну с пробами для N- и С-доменов SNDHai (пробы П 1 и П 2)DSM 17078. Препараты хромосомной ДНК (полученные, как описано в примере 8) применяют в качестве матриц для ПЦР с четырьмя наборами праймеров, приведенными в табл. 2. От 5 до 100 нг хромосомной ДНК применяет на каждую реакцию (общий объем 50 мкл). Если не оговорено обратное, применяют систему для ПЦР Expand High Fidelity PCR (Roche Diagnostics). Условия проведения ПЦР следующие: инкубация при 94 С в течение 2 мин; 30 циклов (1) этапа денатурации при 94 С в течение 15 с; (2) этапа прилегания комплементарных цепочек при 60 С в течение 30 с; (3) этапа синтеза при 72 С в течение от 45 до 120 с (время этапа синтеза для наборов праймеров П 1, П 2, П 3 и П 4 составляет 45, 120, 90 и 90 с,соответственно); завершающего этапа при 72 С в течение 7 мин. Образцы реакций ПЦР разделяют с помощью электрофореза на агарозном геле и полосы обнаруживают при просвечивании после окраски этидий бромидом. Результаты реакций ПЦР суммированы в табл. 4. Таблица 4 Детекция продуктов ПЦР П 1, П 2, П 3 и П 4 у различных штаммов, полученных с наборами праймеров,приведенными в табл. 2 (продукты наблюдали с помощью электрофореза на агарозном геле)+ - присутствует; но - не обнаруживается; на - не анализировали.- эту ПЦР проводят с системой для ГЦ-обогащенной ПЦР (GC-rich PCR system, Roche Diagnostics) с таким же реакционным циклом, как применяется для системы ПЦР с высокой надежностью (ExpandHigh Fidelity PCR). Когда на агарозном геле наблюдаются ясные полоски ПЦР продуктов (табл. 4), ПЦР продукты прямо применяются для секвенирования нуклеотидов с помощью стандартных способов. Нуклеотидные последовательности, полученные для различных ПЦР продуктов, и соответствующие аминокислотные последовательности сравнивают с последовательностью в полную длину SNDHai гена и белка из G. oxydansDSM 17078. Ортолог SNDHai из Gluconobacter oxydans IFO 3292 Продукт ПЦР (около 1 кб), полученный при амплификации с праймерами SNDH1391F (ПОСЛ.10) и SNDH2364R (ПОСЛ.8) и хромосомной ДНК из G. oxydans IFO 3292 в качестве матрицы, применяют для секвенирования с праймером SNDH1391F (ПОСЛ.10). Определенная нуклеотидная последовательность из 771 пар оснований (ПОСЛ.11) демонстрирует 98,7% (761/771) гомологии с нуклеотидами 1431-2201 последовательности SNDHai из G. oxydans DSM 17078 (ПОСЛ.1). Выведенная из нее аминокислотная последовательность из 256 аминокислотных остатков (ПОСЛ.12) демонстрирует 100% идентичность с аминокислотами 478-733 аминокислотной последовательности SNDH из G. oxydansDSM 17078 (ПОСЛ.2). Ортолог SNDHai из Gluconobacter oxydans IFO 3287 Продукт ПЦР (около 0,4 кб), полученный при амплификации с праймерами SNDH1F (ПОСЛ.5) и SNDH420R (ПОСЛ.6) и хромосомной ДНК из G. oxydans IFO 3287 в качестве матрицы, применяют для секвенирования с праймером SNDH420R (ПОСЛ.6). Определенная нуклеотидная последовательность из 350 пар оснований (ПОСЛ.13) демонстрирует 97,4% (341/350) гомологии с нуклеотидами 31380 последовательности ПОСЛ.1. Выведенная из нее аминокислотная последовательность из 116 аминокислотных остатков (ПОСЛ.14) демонстрирует 100% идентичность с аминокислотами 11-126 последовательности ПОСЛ.2. Продукт ПЦР (около 1,9 кб), полученный при амплификации с праймерами SNDH501F (ПОСЛ.7) и SNDH2364R (ПОСЛ.8), применяют для секвенирования с праймером SNDH501F (ПОСЛ.7). Определенная нуклеотидная последовательность из 808 пар оснований (ПОСЛ.15) демонстрирует 98,0%(745/808) гомологии с нуклеотидами 578-1385 последовательности ПОСЛ.1. Выведенная из нее аминокислотная последовательность из 268 аминокислотных остатков (ПОСЛ.16) демонстрирует 100% идентичность с аминокислотами 194-461 ПОСЛ.2. Продукт ПЦР (около 1 кб), полученный при амплификации с праймерами SNDH1391F (ПОСЛ.10) и SNDH2364R (ПОСЛ.8), применяют для секвенирования с праймером SNDH1391F (ПОСЛ.10). Определенная нуклеотидная последовательность из 800 пар оснований (ПОСЛ.17) демонстрирует 98,8% (790/800) гомологии с нуклеотидами 1469-2268 последовательности ПОСЛ.1. Выведенная из нее аминокислотная последовательность из 266 аминокислотных остатков (ПОСЛ.18) демонстрирует 100% идентичность с аминокислотами 491-756 ПОСЛ.2. Ортолог SNDHai из Acetobacter sp. ATCC 15164 Продукт ПЦР (около 0,4 кб), полученный при амплификации с праймерами SNDH1F (ПОСЛ.5) и SNDH420R (ПОСЛ.6) и хромосомной ДНК из A. sp. ATCC 15164 в качестве матрицы, применяют для секвенирования с праймером SNDH420R (ПОСЛ.6). Определенная нуклеотидная последовательность из 360 пар оснований (ПОСЛ.19) демонстрирует 97,8% (352/360) гомологии с нуклеотидами 31390 последовательности ПОСЛ.1. Выведенная из нее аминокислотная последовательность из 120 аминокислотных остатков (ПОСЛ.20) демонстрирует 100% идентичность с аминокислотами 11-130 ПОСЛ.2. Продукт ПЦР (около 1,9 кб), полученный при амплификации с праймерами SNDH501F (ПОСЛ.7) и SNDH2364R (ПОСЛ.8), применяют для секвенирования с праймером SNDH501F (ПОСЛ.7). Определенная нуклеотидная последовательность из 760 пар оснований (ПОСЛ.21) демонстрирует 98,0%(745/760) гомологии с нуклеотидами 563-1322 ПОСЛ.1. Выведенная из нее аминокислотная последовательность из 252 аминокислотных остатков (ПОСЛ.22) демонстрирует 100% идентичность с аминокислотами 189-440 ПОСЛ.2. Ортолог SNDHai из Gluconobacter oxydans IFO 3244 Полную нуклеотидную последовательность гена ортолога SNDHai из G. oxydans IFO 3244 определяют с применением продуктов ПЦР, полученных с хромосомной ДНК из G. oxydans IFO 3244 в качестве матрицы и следующими наборами праймеров: SNDH1F (ПОСЛ.5) и SNDH420R (ПОСЛ.6);SNDH501F (ПОСЛ.7) и SNDH1530R (ПОСЛ.9); SNDH1391F (ПОСЛ.10) и SNDH2364R (ПОСЛ.8); SNDH382 (ПОСЛ.23) и SNDH1530R (ПОСЛ.9); SNDH1F (ПОСЛ.5) и SNDH689R (ПОСЛ.24). Хромосомную ДНК, обработанную рестриктазами BglII и BamHI и лигированную, применяют для еще двух ПЦР со следующими наборами праймеров: SNDH420R (ПОСЛ.6) и SNDH501F (ПОСЛ.7) иSNDH1530R (ПОСЛ.9) и IS-50.3 (ПОСЛ.25). Полная нуклеотидная последовательность демонстрирует 98.4% гомологии с нуклеотидной последовательностью SNDHai из G. oxydans DSM 17078(ПОСЛ.1). Выведенная из нее аминокислотная последовательность (ПОСЛ.27) демонстрирует 100% идентичность с аминокислотной последовательностью ПОСЛ.2. Пример 10. Увеличенная продукция витамина С из L-сорбозона с помощью увеличения дозировкиSNDHai гена. Ген SNDHai с фланкирующими районами до и после амплифицируют с помощью ПЦР с хромосомной ДНК из штамма DSM 17078 в качестве матрицы и набором праймеров N1 (ПОСЛ.28) и N2(ПОСЛ.29). ПЦР проводят с системой ГЦ-обогащенного ПЦР (GC-rich PCR system (Roche Diagnostics согласно инструкциям поставщика. Амплифицированный фрагмент ДНК вставляют в вектор pCR2.1-TOPO (Invitrogen,Carlsbad, CA, USA). Получившуюся плазмиду далее обрабатывают рестриктазами HindIII и XhoI. Полученный фрагмент HindIII-XhoI, включающий SNDHai ген, лигируют в вектор pVK100 (доступный в коллекцииAmerican Type Culture Collection, catalog no. ATCC 37156), предварительно обработанный HindIII и XhoI. Смесь после лигирования применяют для трансформации Е. coli TG1. Нужную плазмиду, названнуюpVK-P-SNDHai-T, выделяют из Е. coli и вводят в G. oxydans штамм DSM 17078 посредством электропорации с помощью стандартных способов (Electrocell manipulator ECM600, ВТХ Inc., San Diego, CA, USA). Клетки G. oxydans штаммов DSM 17078 и DSM 17078, несущие плазмиду pVK-P-SNDHai-T, культивируют в 50 мл среды 5, содержащей 100 г/л D-сорбита, 0,5 г/л глицерина, 15 г/л дрожжевого экстракта (Difco), 2,5 г/л MgSO47H2O и 15 г/л СаСО 3 в качалочной колбе с отбойниками на 500 мл при 30 С на качалке при 200 об./мин. Через 48 ч культивации количества витамина С, измеряемые в супернатанте с помощью HPLC, в двух колбах составляют 110 и 200 мг/л, соответственно. Пример 11. Получение витамина С из L-сорбозона или D-сорбита покоящимися клетками рекомбинантных микроорганизмов с увеличенной дозировкой гена SNDHai. Ген SNDHai из G. oxydans DSM 17078 (ПОСЛ.1) с фланкирующими районами до и после амплифицировали с помощью ПЦР с хромосомной ДНК из штамма DSM 17078 в качестве матрицы и набором праймеров N1 (ПОСЛ.28) и N2 (ПОСЛ.29). ПЦР проводят с системой ГЦ-обогащенного ПЦР (GC-rich PCR system (Roche Diagnostics согласно инструкциям поставщика. Амплифицированный фрагмент ДНК вставляют в вектор pCR2.1-TOPO (Invitrogen,Carlsbad, CA, USA). Получившуюся плазмиду далее обрабатывают рестриктазами HindIII и XhoI. Полученный фрагмент HindIII-XhoI, включающий SNDHai ген, лигируют в вектор pVK100 (доступный в коллекции American Type Culture Collection, catalog no. ATCC 37156), предварительно обработанный HindIII иXhoI. Смесь после лигирования применяют для трансформации Е. coli TG1. Нужную плазмиду, названнуюpVK-P-SNDHai-T, выделяют из Е. coli и вводят в G. oxydans штамм DSM 17078 посредством электропорации с помощью стандартных способов (Electrocell manipulator ECM600, ВТХ Inc., San Diego, CA, USA). Три независимых трансформанта, названных DSM 17078(pVK-P-SNDHai-T) клонами 1, 2 и 3, вместе в родительским штаммом G. oxydans DSM 17078 выращивают раздельно на агаризованных средах 3BD и MB. Клетки соскребают с чашек и применяют для реакций с покоящимися клетками (1% L-сорбозон в качестве субстрата), как описано в примере 9. После выращивания на агаре 3BD по результатам анализа с покоящимися клетками штамм DSM 17078 продуцирует 2,5 г/л витамина С, в то время как штаммы DSM 17078(pVK-P-SNDHai-T) клоны 1, 2 и 3 продуцируют 4,2, 4,1 и 4,2 г/л витамина С, соответственно. После выращивания на МБ агаре по результатам анализа с покоящимися клеток штамм DSM 17078 продуцирует 0,12 г/л витамина С, в то время как штаммы DSM 17078(pVK-P-SNDHai-T) клоны 1,2 и 3 продуцируют 1,8, 2,5 и 0,94 г/л витамина С, соответственно. Другую реакцию проводят с применением клеток G. oxydans DSM 17078 и клона 2 (см. выше),культивированных в 50 мл среды 5 (100 г/л D-сорбита, 0,5 г/л глицерина, 15 г/л дрожжевого экстракта,2,5 г/л MgSO47H2O и 15 г/л СаСО 3) с двумя повторами в качалочных колбах с отбойниками на 500 мл при 30 С на качалке при 220 об./мин в течение 3 дней. Из одной колбы для каждого штамма получающийся бульон центрифугируют при 500 об./мин для удаления СаСО 3. Супернатант после этого этапа затем центрифугируют при 5000 об./мин для осаждения клеток. Собранные клетки ресуспендируют в 10 мл 0,9% раствора NaCl и опять центрифугируют при 5000 об./мин для осаждения клеток. Собранные клетки ресуспендируют в воде и применяют для инокуляции 1 мл среды для продукции (20 г/л D-сорбита, 3 г/лNaCl, 10 г/л СаСО 3) в пробирке на 10 мл при конечной плотности покоящихся клеток, соответствующей 5 ед. оптической плотности при 600 нм. Через 20 ч реакции при 30 С и 220 об./мин супернатант, отобранный из емкости для продукции, содержит 360 и 760 мг/л витамина С, соответственно, для штаммовDSM 17078 и DSM 17078, сверхэкспрессирующего SNDHai. В противоположность этому, супернатант,отобранный через 72 ч из оставшейся среды роста, содержит 0 и 440 мг/л витамина С, соответственно. Пример 12. Получение витамина С из L-сорбозона в покоящихся клетках Е. coli. Ген SNDHai без стоп-кодона, названный SNDHai-1, соответствующий нуклеотидам 1-2364 (ПОСЛ.1), амплифицируют на хромосомной ДНК из штамма DSM 17078 с помощью ПЦР (Roche High Fidelitykit), применяя пару праймеров SNDHai-Nde (ПОСЛ.30) и SNDHaiHis-X (ПОСЛ.31). Амплифицированную ДНК клонируют в pCR2.1-TOPO (Invitrogen, Carlsbad, CA, USA) для получения pCR2.1-TOPO-SNDHai-1, где правильность последовательности SNDHai подтверждают с помощьюNdeI и XhoI в pET-21b(+) (Novagen, Madison, WI, USA) для получения pET21b-SNDHaiHis; 6His добавлены к С-концу SNDHai. Плазмиду pET21b-SNDHaiHis вводят в Е. coli BL21 (DE3). 5 мл ночной культуры Е. coli BL21 (DE3)/pET21b-SNDHaiHis в среде LB с 50 мг/мл карбенициллина инокулируют в 200 мл такой же среды. Клетки культивируют при 230 об./мин при 37 С в течение 2 ч,затем индуцируют с помощью 1 мМ IPTG и продолжают культивировать при 230 об./мин при 25 С в течение 3 ч. Получившуюся культуру центрифугируют и промывают дважды физиологическим раствором и осадок клеток ресуспендируют в 2 мл воды. Клетки далее применяют в реакции с покоящимися клетками в реакционной смеси (500 мкл в пробирке на 5 мл), содержащей клетки при оптической плотности 10, 1% моногидрат сорбозона, 5 мкМ ПХХ, 5 мМ MgCl2, 0,3% NaCl и 1% СаСО 3, проводимой при 30 С в течение 15 ч. Через 15 ч инкубации продуцируется 0,14 г/л витамина С. Когда реакцию с покоящимися клетками проводят с 1 мкМ ПХХ (остальные условия такие же, как описанные выше), 0,05 г/л витамина С продуцируется через 3 ч инкубации. Пример 13. Получение витамина С из D-сорбита покоящимися клетками рекомбинантных микроорганизмов с увеличенной дозировкой гена SNDHai. Клетки G. oxydans DSM 17078, избыточно экспессирующие SNDHai, выращивают в 50 мл среды 5,содержащей 100 г/л D-сорбита, 0,5 г/л глицерина, 15 г/л дрожжевого экстракта (Fluka BioChemika, Buchs,Switzerland), 2,5 г/л MgSO47H2O и 15 г/л СаСО 3 в качалочной колбе с отбойниками на 500 мл при 30 С на качалке при 180 об./мин в течение 48 ч. Получившуюся суспензию клеток применяют для инокуляции биореактора на 2 л, называемого емкостью для роста (Biostat-MD, В. Braun Melsungen, Melsungen, Germany),содержащего 1,25 л среды, состоящей из 100 г/л D-сорбита, 15 г/л дрожжевого экстракта (Fluka BioChemika,Buchs, Switzerland), 2,5 г/л MgSO47H2O, 0,3 г/л KH2PO4 и 0,12 г/л CaSO4. Клетки культивируют при 30 С, скорости аэрации 1 л/мин, рН поддерживаемом на уровне 5,7 с помощью раствора Na2CO3, содержании растворенного кислорода, поддерживаемом на уровне 10% насыщения посредством изменения скорости перемешивания. Через 24 ч плотность клеток, измеряемая в единицах оптического поглощения при 600 нм, составляет 20. В этот момент в емкость роста подают подпитывающий раствор, содержащий 100 г/л D-сорбита, 15 г/л дрожжевого экстракта (Fluka BioChemika, Buchs, Switzerland), 2,5 г/лMgSO47H2O, 0,3 г/л KH2PO4 и 0,12 г/л CaSO4, со скоростью 125 мл/ч и бульон постоянно собирают при скорости отбора 125 мл/ч. Таким образом, объем среды в емкости для роста поддерживается постоянным и равняется 1,25 л. Другие параметры процесса поддерживаются на тех же уровнях, как описано выше. Эту культуральную среду постоянно подают со скоростью 125 мл/ч во второй реактор, называемый емкостью для продукции, заполненный 5 л среды продукции, содержащей 100 г/л D-сорбита, 0,3 г/л NaCl и 0,12 г/л CaSO4, и температуру поддерживают при 30 С, рН при 7,0 с помощью 20% раствора NaOH. Скорость аэрации поддерживают постоянной на 10 л/мин и содержание растворенного кислорода поддерживают на уровне 20% насыщения посредством изменения скорости перемешивания. Среду продукции такого же состава постоянно подают в емкость для продукции со скоростью подачи 375 мл/ч. Объем в емкости поддерживают постоянным на 5 л посредством постоянного отбора супернатанта со скоростью 500 мл/ч, получаемого в виде профильтрованного потока из модуля для ультрафильтрации с поперечным потоком с размером пор 500 кДа (UFP-500-E-9A, Amersham Biosciences), через который прогоняют суспензию клеток, отбираемую из емкости продукции, с помощью насоса (Masterflex pump) при скорости 50 л/ч. Удержанную суспензию подают с помощью насоса назад в емкость. Когда плотность клеток в емкости для продукции достигает 100 ед. оптической плотности при 600 нм, клетки начинают собирать из концентрированного потока клеток, текущего назад в емкость для продукции, со скоростью 25 мл/мин,чтобы поддерживать плотность клеток в этой емкости постоянной. Отбираемый поток бесклеточного супернатанта содержит 4 г/л витамина С и постоянно подается со скоростью 500 мл/ч в емкость для сбора с двойной рубашкой при 30 С (Ecoline Re112, Lauda, LaudaKoenigshofen, Germany). Из этой емкости постоянно подают супернатант в отсек разведения двухсекционной ячейки для электродиализа (кассета, содержащая 10 пар ячеек с катионообменными мембранамиCMX-S и анионообменными мембранами ASM, общая поверхность мембран 0,2 м 2, Eurodia Industries,Wissous, France) со скоростью 180 л/ч и постоянный поток отбирают из емкости, чтобы поддерживать объем в ней постоянным на уровне 2 л. Из другой емкости с двойной рубашкой, исходно содержащей деионизованную воду при 30 С, куда постоянно подают свежую деионизованную воду со скоростью 62,5 мл/ч,постоянно отводят водный раствор в отсек с концентратом ячейки для электродиализа со скоростью 200 л/ч и откачивают из нее постоянный поток сбора. Подаваемые растворы нагнетают в кассету для электродиализа с помощью перистальтического насоса (7518-00, Masterflex, USA), a рециркуляцию растворов в каждом отсеке для электродиализа производят с помощью ротационных насосов (MD-20, IWAK, Tokyo,Japan). Во время всего процесса к кассете для электродиализа прикладывают 14 В (источник питанияFuMATech TS001/5, St. Ingbert, Germany). Концентрация витамина С в потоке сбора составляет 16 г/л. Пример 14. Очистка витамина С, продуцированного покоящимися клетками, с помощью этапов нисходящей обработки. Поток сбора согласно примеру 13, содержащий 16 г/л витамина С, подают на связывающий носи- 29012165 тель (хелатор) (Amberlite IRC 748, Rohm and Haas, Philadelphia, PA, USA), чтобы убрать из потока двухвалентные катионы. Затем его собирают в охлажденной емкости (емкости подачи) и, когда набирается 10 л,их обрабатывают единовременно в ячейке для электродиализа с биполярной мембраной (кассета, содержащая 7 Neosepta BP1/СМВ мембран, общая площадь мембран 0,14 м 2, Eurodia Industries, Wissous,France). Раствор пропускают со скоростью 200 л/ч через отсек подачи ячейки для электродиализа и собирают обратно в емкость подачи. Раствор из другой охлажденной емкости (емкости с концентратом), содержащей исходно 5 л раствора NaOH (2 г/л), пропускают со скоростью 100 л/ч через отсек с концентратом электродиализной ячейки с биполярной мембраной. Прикладывая максимальное напряжение 25 В и максимальный электрический ток 20 А, переносят катионы натрия из отсека подачи в отсек с концентратом и таким образом натриевую форму витамина С, присутствующую в подаваемом потоке, переводят в соответствующую форму свободной кислоты. После достижения 90% выхода этого превращения процесс останавливают. В емкости с концентратом собирается 6 л раствора, содержащего 7,5 г/л NaOH, в емкости для разведения 9 л раствора, содержащего 16 г/л витамина С в форме свободной кислоты и 1,6 г/л витамина С в форме натриевой соли далее пропускают через катионообменник (Amberlite FPC 21 Н, Rohm and Haas, Philadelphia, PA, USA), чтобы увеличить выход превращения натриевой соли в форму свободной кислоты до приблизительно 99%. Альтернативно, 10 л раствора, содержащего 16 г/л витамина С в форме натриевой соли, поступившего с этапа электродиализа, прямо обрабатывают катионообменной смолой, превращая в свободную кислоту с выходом 99%. Поток витамина С в форме свободной кислоты,полученный по любому из способов, описанных выше, далее проводят через последовательность следующих этапов: анионообменник, обработка активированным углем, концентрирование, кристаллизация,фильтрация кристаллов и сушка. Окончательная чистота кристаллов составляет 98%, и выход достигаемый в результате всех этих этапов нисходящей обработки составляет 80%. Пример 15. Получение хромосомной ДНК и амплификация CMC 05 фрагмента ДНК с помощью ПЦР. Хромосомную ДНК из Gluconobacter oxydans DSM 17078 получают из клеток, культивированных при 30 С в течение 1 дня на бульоне с маннитом (МБ), состоящем из 25 г/л маннита, 5 г/л дрожжевого экстракта (Difco) и 3 г/л бактопептона (Difco) по способу, описанному в Sambrook et al. (1989) MolecularCloning: A Laboratory Manual/Second Edition, Cold Spring Harbor Laboratory Press. Фрагмент ДНК получают с помощью ПЦР с хромосомной ДНК, полученной, как описано выше, и набором праймеров Pf (ПОСЛ.46) и Pr (ПОСЛ.47). Для проведения реакции применяют набор для ПЦР с высокой надежностью Expand High Fidelity PCR kit (Roche Diagnostics) и 10 нг хромосомной ДНК в общем объеме 100 мкл согласно инструкции поставщика, чтобы получить ПЦР продукт, содержащий последовательность ДНК CMC 05 (ПОСЛ.44). ПЦР продукт выделяют из реакционной смеси и правильность последовательности подтверждают. Пример 16. Повреждение CMC 05 гена в G. oxydans DSM 17078. ПЦР продукт, полученный по примеру 15, клонируют в Е. coli вектор pCR2.1-ТОРО и трансформируют Е. coli TG1 для получения устойчивого к ампициллину (Apr) трансформанта, несущего pCR2.1-SMS 05. Затем подвергают pCR2.1-SMS 05 двум ПЦР реакциям: (1) ПЦР 1 с набором праймеров Psms5No(ПОСЛ.78) и Psms5Ni (ПОСЛ.79) с получением фрагмента SMS5No-Ni и (2) ПЦР 2 с набором праймеров Psms5Ci (ПОСЛ. 76) и Psms5Co (ПОСЛ.77). Получившиеся два ПЦР продукта применяют для 3-й ПЦР реакции (ПЦР 3) с набором праймеров Psms5No и Psms5Co с получением SMS5dNoСо. Затем фрагменты обрабатывают рестриктазами PstI и HindIII и лигируют с pK19mobsacB (A. Phler etal. Gene 145, 69-73, 1994), обработанной PstI и HindIII, и применяют для трансформации Е. coli TG для получения устойчивых к канамицину (Kmr) колоний, несущих pK19mobsacB-dSMS 05. Плазмиду применяют для трансформации G. oxydans DSM 17078 с помощью электропорации. Одну из Kmr колоний высевают штрихом на чашках со средой МБ с канамицином, 50 мкг/мл (МК),и затем проверяют на устойчивость к канамицину и чувствительность к сахарозе на чашках с МК и МБ с 10% сахарозой (МСах), соответственно, чтобы подтвердить устойчивость к канамицину (Kmr) и чувствительность к сахарозе (сахарозаs). Затем одну из колоний, устойчивых к канамицину и чувствительных к сахарозе, выращивают на чашке с агаром МБ и получившиеся растущие клетки соскребают, разводят нужным образом и рассевают на МБ агаре. Получившиеся 100 колоний высевают штрихом на чашках с агаром с МБ, МК и МСах, чтобы изолировать Kms сахарозаr колонии. Один из получившихся штаммов называют G. oxydans DSM 17078-dSMS 05. Пример 17. Полученин витамина С из D-сорбита, L-сорбозы или L-сорбозона с применением покоящихся клеток, выращенных на агаризованной среде 3BD, содержащей 7% L-сорбозу. Клетки G. oxydans DSM 17078 и G. oxydans DSM 17078- dSMS 05 выращивают при 27 С в течение 3 дней на агаризованной среде 3BD, содержащей 70 г/л L-сорбозы, 0,5 г/л глицерина, 7,5 г/л дрожжевого экстракта (Difco), 2,5 г/л MgSO47H2O, 10 г/л СаСО 3 и 18 г/л агара (Difco). Клетки соскребают с агаровых слоев, суспендируют в дистиллированной воде и применяют в реакциях с покоящимися клетками, проводимых при 30 С на качалке при 220 об./мин. По окончании инкубационного периода реакционные смеси анализируют с помощью жидкостной хроматографии с высоким разрешением (HPLC) по способу, описанному в примере 2. Серию реакций с покоящимися клетками (0,5 мл реакционной среды в пробирках на 5 мл) проводят
МПК / Метки
МПК: C12P 7/60, C12P 17/04, C12N 9/04
Метки: витамина, получение, ферментативное
Код ссылки
<a href="https://eas.patents.su/30-12165-fermentativnoe-poluchenie-vitamina-s.html" rel="bookmark" title="База патентов Евразийского Союза">Ферментативное получение витамина с</a>
Предыдущий патент: Антибиотик 107891, его факторы а1 и а2, фармацевтически приемлемые соли и композиции и их применение
Случайный патент: Галогенированные диэтилтолуолдиамины