Способ стабильной непрерывной выработки этанола
Номер патента: 6106
Опубликовано: 25.08.2005
Авторы: Базу Рахул, Филлипс Джон Рандалл, Арора Динеш К., Уикстром Карл В., Клосен Эдгар К., Ко Чинг-Ван, Гадди Джеймз Л.
Формула / Реферат
1. Способ стабильной непрерывной выработки этанола путем анаэробной бактериальной ферментации газообразного субстрата, включающий
культивирование в ферментационном устройстве анаэробных, ацетогенных бактерий, которые способны вырабатывать этанол, в жидкой питательной среде, в состав которой входит пантотенат кальция и которая имеет уровень pH менее 5;
подачу в упомянутое устройство газообразного субстрата, в состав которого входит монооксид углерода и необязательно (a) водород, (b) диоксид углерода или (c) диоксид углерода и водород, при этом ферментационный бульон вырабатывается во время ферментации;
поддержание уровня пантотената кальция в упомянутом устройстве в количестве от 0,5 до 50 мкг/г сухих клеток бактерий, выработанных в упомянутом устройстве; и
поддержание удельного коэффициента поглощения CO в количестве по меньшей мере 0,5 ммоль CO/грамм сухих клеток бактерий в минуту;
при этом условия процесса выбраны так, чтобы свободная уксусная кислота вырабатывалась в упомянутом устройстве при концентрации менее 5 г/л, этанол вырабатывается в ферментационном бульоне в указанном устройстве с производительностью более 10 г/л в день, а этанол и ацетат вырабатываются в упомянутом ферментационном бульоне в соотношении от 1:1 до 20:1 этанола к ацетату.
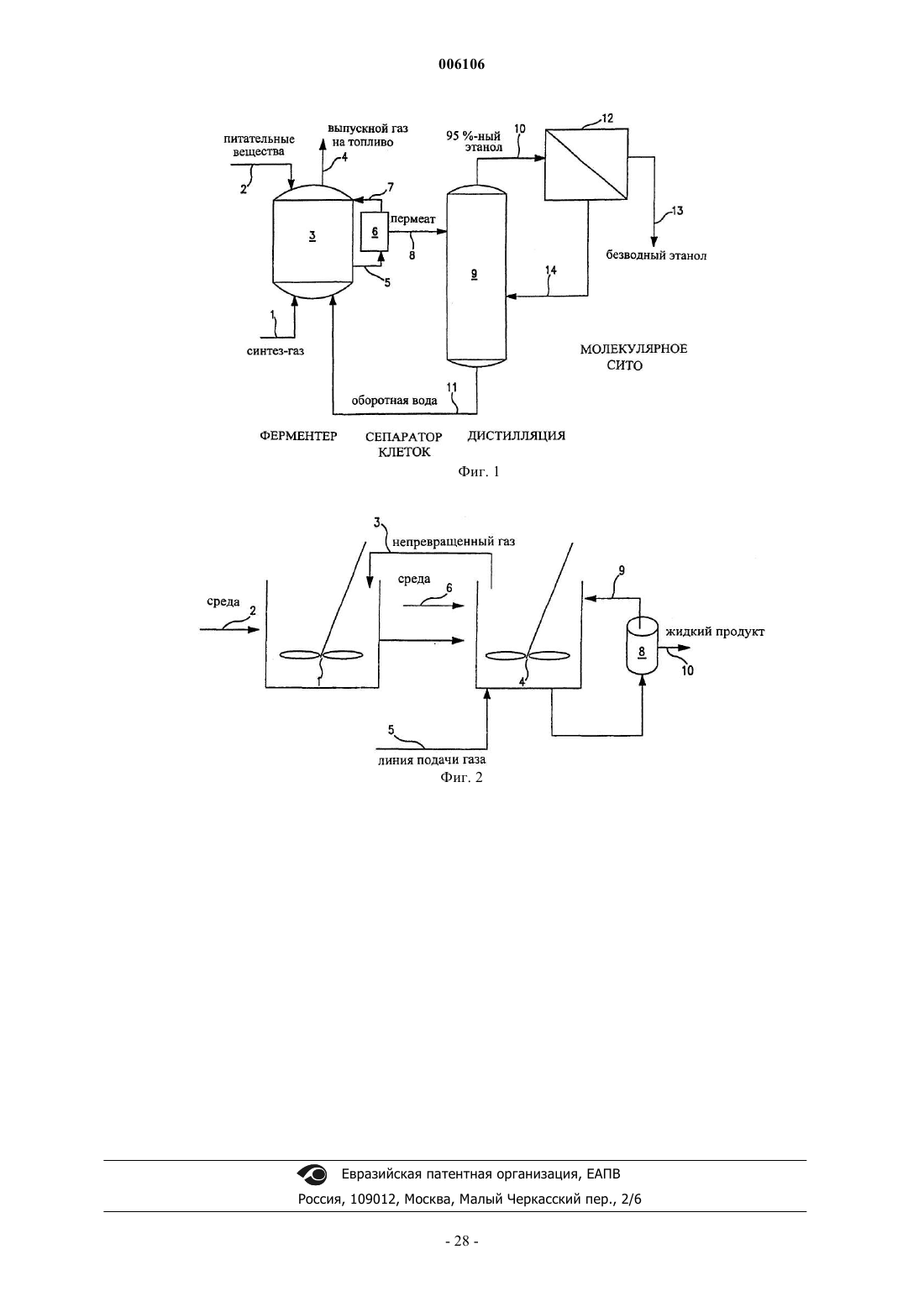
2. Способ по п.1, отличающийся тем, что упомянутое ферментационное устройство представляет собой биореактор роста, который состоит из двух камер, и в котором указанный ферментационный бульон подается из первой камеры во вторую камеру указанного устройства, при этом большая часть этанола вырабатывается в указанной второй камере.
3. Способ по п.1, дополнительно включающий этапы удаления упомянутого ферментационного бульона из упомянутого устройства, дистилляции этанола из упомянутого бульона и отбор упомянутого этанола.
4. Способ по п.3, дополнительно включающий этап рециркуляции воды, содержащей ацетат, отделяемой на упомянутом этапе дистилляции, обратно в упомянутое устройство.
5. Способ по п.1, отличающийся тем, что упомянутые бактерии выбирают из группы, включающей Acetobacterium woodii, Butyribacterium methylotrophicum, Clostridium aceticum, C. acetobutylicum, C. thermoaceticum, Eubacterium limosum, Clostridium ljungdahlii и Peptostreptococcus productus.
6. Способ по п.5, отличающийся тем, что упомянутые Clostridium ljungdahlii выбирают из штаммов, включающих PETC, ERI2, O-52 и C-01.
7. Способ по п.1, отличающийся тем, что упомянутый газообразный субстрат дополнительно включает азот или метан.
8. Способ по п.1, дополнительно включающий изменение по меньшей мере одного из параметров, выбранных из группы, включающей состав питательной среды, скорость подачи питательной среды, скорость подачи воды, рабочее давление, рабочий уровень pH, состав газообразного субстрата, скорость подачи газа, скорость перемешивания ферментационного бульона, плотность клеток, ингибирование субстратом и их комбинации.
9. Способ по п.8, отличающийся тем, что изменение рабочего уровня pH осуществляют путем его повышения до значений выше 4,5.
10. Способ по п.8, отличающийся тем, что изменение упомянутой плотности клеток включает постоянную очистку упомянутого устройства от упомянутых бактериальных клеток до получения концентрации клеток ниже стабильной концентрации, при которой используется весь газообразный субстрат или вся питательная среда в упомянутом устройстве.
11. Способ по п.8, включающий увеличение скорости подачи воды при превышении концентрации содержащейся в ацетате свободной уксусной кислоты в ферментационном бульоне значения 2 г/л для уменьшения нежелательного возрастания концентрации упомянутой свободной уксусной кислоты.
12. Способ по п.8, включающий снижение скорости подачи упомянутого газообразного субстрата для ослабления ингибирования субстратом и поддержания упомянутой производительности.
13. Способ по п.8, отличающийся тем, что упомянутая скорость перемешивания понижается для ослабления ингибирования субстратом и поддержания упомянутой производительности.
14. Способ по п.8, отличающийся тем, что упомянутый газообразный субстрат содержит монооксид углерода и подается в устройство со скоростью подачи газа от 0,3 до 2 ммоль CO/грамм сухих клеток бактерий в упомянутом устройстве в минуту.
15. Способ по п.14, отличающийся тем, что упомянутая скорость находится в диапазоне от 0,5 до 1,5 ммоль CO/грамм сухих клеток бактерий в упомянутом устройстве в минуту.
16. Способ по п.1, отличающийся тем, что упомянутое количество пантотената кальция является меньшим, чем это требуется для поддержания стабильной концентрации упомянутых бактерий, при которой будет полностью использован имеющийся пантотенат кальция.
17. Способ по п.1, отличающийся тем, что упомянутое количество пантотената кальция составляет от 1 до 25 мкг пантотената кальция/г сухих клеток выработанных бактерий.
18. Способ по п.17, отличающийся тем, что упомянутое количество пантотената кальция составляет от 2 до 25 мкг пантотената кальция/г сухих клеток выработанных бактерий.
19. Способ по п.8, отличающийся тем, что упомянутый газообразный субстрат дополнительно содержит водород, который подается в упомянутое устройство в количестве, при котором отношение молей газообразного водорода в подаваемом газе к сумме удвоенного количества молей превращенного монооксида углерода и утроенного количества молей превращенного диоксида углерода превышает 1,0.
20. Способ по п.8, отличающийся тем, что состав упомянутой питательной среды изменяется путем подачи в упомянутое устройство упомянутой питательной среды, дополнительно содержащей кобальт в количестве от 5 до 100 мкг кобальта / г сухих клеток бактерий, выработанных в упомянутом устройстве.
21. Способ по п.20, отличающийся тем, что упомянутое количество кобальта меньше, чем требуется для поддержания стабильной концентрации упомянутых бактерий, при которой будет полностью использован имеющийся кобальт.
22. Способ по п.20, отличающийся тем, что количество кобальта выбрано таким образом, чтобы поддерживалась преимущественная выработка этанола по сравнению с ацетатом.
23. Способ по п.20, отличающийся тем, что упомянутое количество кобальта составляет от 20 до 50 мкг кобальта/г сухих клеток выработанных бактерий.
Текст
006106 Данное изобретение относится к усовершенствованным способам микробной ферментации для получения этанола из газообразного субстрата, содержащего по меньшей мере один восстановительный газ, с использованием анаэробных (или факультативных) ацетогенных бактерий. Предпосылки изобретения Ранее авторами данного изобретения были описаны способы производства этанола, в числе других органических кислот, спиртов, водорода и солей органических кислот, путем микробной ферментации газообразных субстратов в среде, содержащей питательные вещества и микроэлементы, с использованием определенных анаэробных бактерий. Например, авторы описывали введение разбавленных газовых смесей в биореактор, содержащий один или несколько штаммов анаэробных бактерий, которые прямым путем используют компоненты отработанного газа с получением желаемого соединения. Это соединение выделяют из водной фазы в отдельном резервуаре или резервуарах подходящим способом выделения целевого продукта. К способам выделения относятся, например, экстракция, дистилляция или их комбинации, а также другие эффективные способы выделения. Бактерии можно извлекать из водной фазы и возвращать в биореактор для поддержания высоких концентраций клеток и максимально высокой производительности. Клетки отделяют, если это желательно, центрифугированием, путем мембранной фильтрации или другими способами. См., например, международную патентную заявкуWO 98/00558, публ. 8 января 1988; патент США 5,807,722; патент США 5,593,886 и патент США 5,821,111. Кроме основного продукта, которым является уксусная кислота, штаммы анаэробной бактерииClostridium ljungdahlii способны также вырабатывать этанол в качестве продукта превращения монооксида углерода (СО), водорода (Н 2) и диоксида углерода (СО 2). Выработка уксусной кислоты (СН 3 СООН) и этанола (С 2 Н 5 ОН) из СО, СО 2 и Н 2 происходит согласно следующих общих стехиометрических уравнений: 4 СО + 2 Н 2 ОСН 3 СООН + 2 СО 2 (1) 4 Н 2 + 2 СО 2 СН 3 СООН + 2 Н 2 О (2) 6 СО + 3 Н 2 ОС 2 Н 5 ОН + 4 СО 2 (3) 6 Н 2 + 2 СО 2 С 2 Н 5 ОН + 3 Н 2 О (4) К штаммами С. ljungdahlii относятся, например, штамм РЕТС (патент США 5,173,429), штаммERI2 (патент США 5,593,886) и штаммы С-01 и O-52 (патент США 6,136,577). Все эти штаммы депонированы в American Type Culture Collection, 10801 University Boulevard, Manassas, VA 20110-2209 под инвентарными номерами 55383 (ранее АТСС 49587), 55380, 55988 и 55989, соответственно. Каждый из штаммов С. ljungdahlii является анаэробной грам-положительной бактерией с гуаниновым и цитозиновым (G +C) нуклеотидным содержанием около 22 мол.%. Для роста эти бактерии используют разнообразные субстраты, за исключением метанола или лактата. Эти штаммы отличаются друг от друга СОтолерантностью, удельными скоростями поглощения газа и удельными производительностями. В "диких" штаммах, встречающихся в природе, отмечена крайне низкий уровень выработки этанола. Штаммы С. ljungdahlii в "диком" состоянии превосходно функционируют при 37 С, и обычно вырабатывают этанол и ацетил (что относится и к свободной, или молекулярной, уксусной кислоте, и к ее солям) в соотношении около 1:20 (1 ч. этанола на 20 ч. ацетила). Концентрации этанола обычно составляют лишь 1-2 г/л. Хотя эта способность вырабатывать этанол и представляет интерес, однако, из-за низкой производительности "дикие" бактерии не могут быть использованы для экономичного производства этанола в промышленном масштабе. При небольших усовершенствованиях питательной среды вышеупомянутые штаммы С. ljungdahlii были использованы для производства этанола и ацетила с соотношением продуктов 1:1 (равные части этанола и ацетила), однако, концентрация этанола составляла менее 10 г/л, в результате чего производительность не превышала 10 г/л в день. Кроме того, имеются проблемы со стабильностью культуры, главным образом из-за относительно высокой (8-10 г/л) концентрации ацетила (2,5-3 г/л молекулярной уксусной кислоты) в присутствии этанола. Более того, поскольку для увеличения выработки этанола увеличивается содержание газа, то происходит ингибирование культуры, сначала молекулярной уксусной кислотой, а затем СО. В результате культура становится нестабильной, теряет способность поглощать газ и вырабатывать дополнительный продукт. Далее, в предшествующей работе авторов показаны сложности выработки этанола и ацетила в соотношении более 2:1 при работе бактерий в устойчивом состоянии. См., например, Klasson et al., 1990 Applied Biochemistry and Biotechnology, Proceedings of the 11th Symposium on Biotechnology for Fuels and Chemicals, 24/25: 857; Phillips et al., 1993 Applied Biochemistry andBiotechnology, Proceedings of the 14th Symposium on Biotechnology for Fuels and Chemicals, 39/40: 59 и др. Во многих источниках описана ферментация Сахаров анаэробными бактериями, которые отличаются от С. ljungdahlii и не потребляют СО, СО 2 и Н 2 для выработки растворителей. Предпринимались попытки получить высокий выход этанола путем изменения таких разнообразных параметров, как типы питательных веществ, микроорганизмы, специфическое добавление восстановительных агентов, варьирования рН и добавления экзогенных газов. См., например, Rothstein et al., 1986 J. Bacteriol., 165(1):319320; Lovitt et al., 1988 J. Bacteriol., 170(6):2809; Taherzadeh et al., 1996 Appl. Microbiol. Biotechnol., 46:176. Таким образом, в данной области техники остается актуальной задача решения проблемы использо-1 006106 вания промышленных газообразных субстратов, возможности получения существенной выгоды от использования таких газов, в частности, таких отработанных газов, как Н 2, СО и СО 2. Существует также задача увеличения выработки этанола по отношению к выработке других продуктов, обычно получаемых ферментацией таких газов ацетогенными бактериями. Краткое изложение сущности изобретения В соответствии с указанной выше задачей, данное изобретение относится к новым способами непрерывного действия, которые обладают устойчивостью и обеспечивают получение этанола с концентрацией более 10 г/л при концентрации ацетата менее чем 8-10 г/л, при одновременном поддержании роста культуры и ее хорошей стабильности. В первом аспекте изобретение относится к стабильному способу непрерывной выработки этанола путем анаэробной бактериальной ферментации газообразного субстрата. Способ включает этапы культивирования в ферментационном биореакторе анаэробных, ацетогенных бактерий в жидкой питательной среде и подачу в биореактор газообразного субстрата, содержащего по меньшей мере один восстановительный газ, выбранный из группы, включающей СО и Н 2. Бактерии в биореакторе подвергаются воздействию путем снижения окислительно-восстановительного потенциала или увеличения отношенияNAD(P)H к NAD(P) в ферментационном бульоне после достижения бактериями устойчивого состояния,например, стабильной концентрации клеток в биореакторе. Концентрацию свободной уксусной кислоты в биореакторе поддерживают на уровне менее 5 г/л. Этапы культивирования и воздействия обеспечивают выработку бактериями в биореакторе этанола в ферментационном бульоне с производительностью более 10 г/л в день. Этанол и ацетат вырабатываются в ферментационном бульоне в соотношении от 1:1 до 20:1. В одном из вариантов осуществления этого способа воздействие включает один или несколько следующих этапов: изменение по меньшей мере одного параметра, выбранного из группы, включающей состав питательной среды, скорость подачи питательных веществ, скорость подачи воды, рабочее давление, рабочая рН, состав газообразного субстрата, скорость подачи газа, скорость перемешивания ферментационного бульона, ингибирование продуктом, плотность клеток и ингибирование субстратом. В другом варианте осуществления этого способа воздействие включает подачу в упомянутый биореактор упомянутого газообразного субстрата, содержащего восстановительный газ СО, при заданной скорости поглощения. Эта скорость предпочтительно составляет от 0,3 до 2 ммоль СО/грамм сухих клеток бактерий в упомянутом биореакторе в минуту. В следующем варианте осуществления этого способа воздействие включает подачу в упомянутый ферментационный биореактор упомянутой питательной среды, содержащей ограниченное количество пантотената кальция. Пантотенат кальция предпочтительно содержится в количестве от 0,5 до 50 мкг/г сухих клеток бактерий, выработанных в биореакторе. В следующем варианте осуществления способа используют подачу избытка восстановительного газа Н 2 в упомянутый биореактор до подачи ограниченного количества пантотената кальция. В следующем аспекте изобретение относится к способу, в котором этап воздействия включает подачу в упомянутый ферментационный биореактор упомянутой питательной среды, содержащей ограниченное количество кобальта. Кобальт предпочтительно содержится в количестве от 5 до 100 мкг/г сухих клеток бактерий, выработанных в упомянутом биореакторе. В следующем варианте осуществления способ по изобретению включает предотвращение акклиматизации упомянутых бактерий в упомянутом биореакторе к упомянутому количеству кобальта путем поддержания постоянной концентрации кобальта и регулирования одного или нескольких параметров,таких как скорость газа, скорость жидкости, скорость перемешивания и парциальное давление газообразного Н 2. Дополнительные необязательные этапы этих способов включают центрифугирование образца бульона для удаления клеток и контроля поддержания соотношения и/или производительности методом газовой хроматографии. В следующем варианте осуществления способ включает подачу в качестве газообразного субстрата некоторого количества Н 2 при незначительном превышении стехиометрического количества, требующегося для выработки этанола. В следующем варианте осуществления газообразный субстрат дополнительно содержит СО при незначительном превышении количества, которое требуется бактериями, при этом поглощение бактериями водорода ингибируется, и отношение NAD(P)H к NAD(P) в бульоне увеличивается. В следующем варианте осуществления способа предусмотрен этап, на котором ингибирование молекулярной уксусной кислотой снижают путем увеличения скорости подачи воды, когда молекулярная уксусная кислота, присутствующая в ферментационном бульоне, достигает или превышает концентрацию 2 г/л. В следующем варианте осуществления способа этап воздействия может включать перемешивание среды, бактерий и газообразного субстрата в биореакторе с заданной скоростью перемешивания. Например, снижение скорости перемешивания снижает количество СО, переносимого в ферментационный бульон. При таком снижении скорости переноса СО происходит увеличение превращения Н 2, в результа-2 006106 те чего количество восстановительного газ Н 2 в биореакторе превышает количество, требующееся для роста бактерий. Подобным образом, также может быть снижена скорость газа для уменьшения количества переносимого СО, за счет чего увеличивается превращение Н 2, в результате чего восстановительный газ Н 2 присутствует в ферментационном биореакторе в избытке сверх требуемого для роста бактерий количества. В следующем варианте осуществления способа концентрации клеток бактериальной культуры в биореакторе в начальной стадии может быть доведена до желаемой перед тем, как ограничивают концентрацию кальция пантотената или кобальта в питательной среде. В следующем варианте осуществления способа по данному изобретению использован двухступенчатый биореактор CSTR, который состоит из реактора роста, из которого ферментационный бульон подают в реактор производства, в котором вырабатывается основная часть этанола. В следующем аспекте изобретения способ, описанный выше, включает необязательные этапы выделения этанола путем удаления ферментационного бульона из биореактора, дистилляции этанола из бульона и отбор этанола. Дополнительно или предпочтительно, образец бульона подвергают центрифугированию для удаления клеток и при помощи газовой хроматографии контролируют поддержание соотношения. В следующем аспекте способ по изобретению может дополнительно включать этап рециркуляции воды (содержащей до 5 г/л ацетила) из реактора дистилляции этанола обратно в реактор для того, чтобы в реакторе установилось равновесие между этанолом и ацетилом. В результате этого для выработки этанола используется большее количество СО, СО 2 и Н 2, подаваемых в реактор и превращаемых в продукты. Другие аспекты и преимущества данного изобретения описаны ниже в подробном описании предпочтительных вариантов его осуществления. Краткое описание чертежей На фиг. 1 представлена принципиальная схема способа непрерывной ферментации с выделением продукта по данному изобретению. Газообразный субстрат 1 и жидкую питательную среду 2 подают в биореактор 3, в котором содержится соответствующая бактериальная культура. Превращение газообразного субстрата в этанол и уксусную кислоту осуществляется в биореакторе 3. Отходящий газ 4, содержащий такие газы, как непереработанные СО, СО 2 и Н 2 и другие газы, отводится из биореактора 3 и его используют в качестве топлива или сжигают в факеле. Если применяется рециркуляция клеток, то жидкий эффлюент 5 направляют в сепаратор клеток 6, где клетки 7 отделяют от пермеата 8. Клетки 7 направляют обратно в биореактор 3, а пермеат 8 направляют на выделение продукта. Этанол может быть выделен из пермеата 8 (или, в альтернативе, из эффлюента 5, если отделение клеток не используется). Пермеат 8 разделяют в дистилляционной колонне 9 с получением дистиллятного 95%-го этанола 10 и кубовой воды 11, которую направляют обратно в биореактор 3. Дистиллятный 95%-ный этанол 10 пропускают через молекулярное сито 12, где целевой конечный продукт в виде безводного этанола 13 отделяют от разбавленного этанола 14, который направляют обратно в дистилляционную колонну 9. На фиг. 2 представлена принципиальная схема двухступенчатой системы реакторов CSTR с непрерывным перемешиванием (CSTR - Continuous Stirred Tank Reactor) для более высокой стабильности культуры. На стадию роста CSTR 1 подают жидкую среду 2. Непревращенный газ 3 из стадии производства CSTR 4 подают на стадию роста CSTR 1. На стадию производства CSTR 4 ведет линия подачи свежего газа 5, линия подачи свежей среды 6, а также линия подачи культуры 7 из стадии роста CSTR 1. Рециркуляция клеток 8 используется для получения максимальной выработки клетками 9, которые направляют на стадию производства CSTR 4. Клетки 9 не возвращаются на стадию роста CSTR 1. Жидкий продукт 10, который состоит из раствора этанола в ферментационном бульоне, направляют на дистилляцию, где из него выделяют целевой продукт в виде безводного этанола, как это показано на фиг. 1. Подробное описание изобретения Данное изобретение включает способы анаэробной ферментации газообразных субстратов, содержащих по меньшей мере один восстановительный газ, в частности, газообразные компоненты промышленных отходов и синтез-газы (например, СО, СО 2 и Н 2), в этанол. Эти способы обеспечивают получение этанола с производительностью более 10 г/л в день путем воздействия с использованием биологических процессов соответствующих бактерий. Один из способов по изобретению вызывает образование избыткаNAD(P)H над NAD(P). Окисление NAD(P)H в NAD(P) приводит к восстановлению уксусной кислоты,продуцируемой культурой, в этанол. В альтернативе, один из способов выработки высоких концентраций этанола путем анаэробной ферментации по данному изобретению включает снижение окислительновосстановительного потенциала ферментационного бульона и, таким образом, восстановление уксусной кислоты в этанол. Способы по изобретению обеспечивают высокие концентрации этанола (более 10 г/л,предпочтительно более 15 г/л) и низкие концентрации ацетата (менее 5 г/л свободной уксусной кислоты в биореакторе). В этих способах также осуществляется эффективное управление параметрами технологического процесса, которые требуются для непрерывной выработки этанола и уксусной кислоты, и обеспечивается быстрое восстановление системы при сбоях технологического процесса. Кроме того, в способах по изобретению предотвращена акклиматизация культуры к низкой концентрации питательных-3 006106 веществ, губительная для производительности культуры. Данным изобретением обеспечивается надежный промышленный способ производства этанола.I. Определения. Если не указано иное, то перечисленные ниже термины, используемые в данном описании, обозначают следующее. Выражение "способ непрерывного действия" относится к способу ферментации, который включает непрерывные процессы подачи питательной среды, подачи субстрата, продуцирования клеток в биореакторе, удаления клеток (или очистки) из биореактора и удаления продукта. Эти непрерывные процессы подачи, удаления или продуцирования клеток могут осуществляться в одном или в разных потоках. Непрерывный процесс обеспечивает достижение устойчивого состояния внутри биореактора. Под "устойчивым состоянием" подразумевается, что все эти переменные, которые могут быть измерены (скорости подачи, концентрации субстрата и питательной среды, поддерживаемые в биореакторе, концентрация клеток в биореакторе и скорость удаления клеток из биореактора, скорость удаления продукта из биореактора, а также параметры среды типа температуры и давления) остаются постоянными во времени. Выражение "газообразные субстраты" означает только СО, или смесь СО и Н 2, или смесь СО 2 и Н 2,или смесь СО, СО 2 и Н 2, возможно, смешанные с другими элементами или соединениями, включая азот и метан в газообразном состоянии. Такие газообразные субстраты содержат газы или потоки, которые обычно выпускают или выбрасывают непосредственно в атмосферу или сжигают. В некоторых вариантах осуществления этого способа газообразный субстрат содержит СО. В других вариантах осуществления этого способа газообразный субстрат содержит СО 2 и Н 2. В некоторых вариантах осуществления газообразный субстрат содержит СО и Н 2. В наиболее предпочтительном варианте осуществления газообразный субстрат содержит СО, СО 2 и Н 2. Другие субстраты по изобретению могут включать упомянутые выше компоненты и, по меньшей мере, один такой газ, как азот, СО 2, этан или метан. Таким образом,эти субстраты содержат то, что обычно называют "синтез-газ", который образуется при газификации углеродных продуктов (включая метан), а также отработанные газы различных промышленных производств. Выражение "восстановительный газ" относится к СО или Н 2, или к обоим этим газам. Выражение"количество восстановительного газа большее, чем требуется для роста бактерий" означает такое количество восстановительного газа, которое превышает количество, которое бактерии могут использовать для роста или метаболизма при данных ингредиентах питательной среды. Это количество может быть достигнуто путем увеличения общего количества восстановительного газа, или же путем снижения концентрации ключевых питательных веществ, в результате чего избыточное количество газа достигается без увеличения подачи газа или путем увеличения скорости доставки газа к бактериям. Когда бактерии подвергаются воздействию большего количества восстановительного газа, чем требуется для роста, они реагируют увеличением выработки этанола. Выражение "соответствующие бактерии" означает ацетогенные анаэробные (или факультативные) бактерии, которые способны превращать СО и воду или Н 2 и СО 2 в этанол и уксусную кислоту. Полезные бактерии по изобретению включают, но не ограничены, штаммы Acetogenium kivui, Acetobacteriumacetobutylicum, C. thermoaceticum, Eubacterium limosum, С. ljungdahlii PETC, С. ljungdahlii ERI2, С. ljungdahlii C-01, С. ljungdahlii O-52 и Peptostreptococcus productus. Специалистами в данной области могут быть выбраны другие ацетогенные анаэробные бактерии для использования в этих способах. Под "смешанными штаммами" подразумевается смешанная культура из двух или более соответствующих бактерий. Такие "смешанные штаммы" перечисленных выше бактерий могут быть использованы в способах по изобретению. Термины "биореактор", "реактор" или "ферментационный биореактор" означает ферментационное устройство, которое состоит из одного или более резервуаров и/или колонн или системы трубопроводов,которое включает бак-реактор с непрерывным перемешиванием CSTR (Continuous Stirred Tank Reactor),реактор для иммобилизованных клеток ICR (Immobilized Cell Reactor), реактор со слоем струйного течения жидкости TBR (Tricle Bed Reactor), барботажную колонну, газлифтный ферментер, статическую мешалку или другое устройство, подходящее для создания газожидкостного контакта. В способе по изобретению предпочтительно, чтобы ферментационный биореактор содержал реактор роста, из которого ферментационный бульон поступает во второй ферментационный биореактор, в котором вырабатывается основная часть продукта - этанола. Выражение "питательная среда" здесь используется в целом для обозначения обычной среды для бактериального роста, которая содержит витамины и минералы в достаточном для роста выбранных соответствующих бактерий количестве. Сахара в эту среду не входят. Компоненты разнообразных питательных сред, пригодные для использования в данном изобретении, известны и описаны в предшествующих публикациях, включая публикации авторов данного изобретения. См., например, составы питательных сред, описанные в международной патентной заявкеWO 98/00558, патенте США 5,807,722, патенте США 5,593,886 и патенте США 5,821,111, а также в перечисленных выше публикациях. Типичная лабораторная питательная среда для производства ацетата из СО, СО 2 и Н 2 по дан-4 006106 ному изобретению содержит 0,9 мг/л пантотената кальция, тогда как известная типичная лабораторная питательная среда для производства этанола из СО, СО 2 и Н 2 содержит 0,02 мг/л пантотената кальция. Выражение "ограничивающий субстрат" или "ограничивающее питательное вещество" означает вещество питательной среды или газообразного субстрата, которое во время роста бактериальной культуры в биореакторе исчерпывается культурой до уровня, при котором перестает поддерживаться устойчивое состояние или стабильный бактериальный рост в биореакторе. Таким образом, все другие вещества в питательной среде или газообразном субстрате присутствуют в избытке и являются "неограничивающими". Признак ограничения заключается в том, что увеличение скорости добавления в культуру ограничивающего субстрата, т.е., скорости подачи питательного вещества или скорости подачи газа, вызывает соответствующее увеличение скорости поглощения газа (ммоль газа в минуту) благодаря увеличению плотности клеток. Если не указано иное, то выражение "ацетат" используется для обозначения смеси молекулярной или свободной уксусной кислоты и ее солей, присутствующей в ферментационном бульоне. Соотношение молекулярной уксусной кислоты и ацетата зависит от рН системы: чем ниже рН при постоянной концентрации "ацетата", тем выше концентрация молекулярной уксусной кислоты относительно ее солей. Выражение "концентрация клеток" в данном описании означает количество бактерий в сухом весе на литр образца. Концентрация клеток измеряется прямым измерением или путем вычисления из измерений оптической плотности. Выражение "природное состояние" означает любое соединение, элемент или среда, где не содержится дополнительных электронов или протонов сверх присутствующих обычно. И наоборот, выражение "восстановленное состояние" означает любое соединение, элемент или среду, где имеется один или несколько электронов в избытке. "Восстановленное состояние" достигается путем добавления одного или более электронов к "природному состоянию" и снижения окислительно-восстановительного потенциала ферментационного бульона."Производительность выработки этанола" означает объемную производительность, рассчитанную как отношение концентрации этанола в устойчивом состоянии к продолжительности удержания жидкости (LRT) в системах непрерывного действия, или отношение концентрации этанола ко времени, которое требуется для получения этой концентрации в системах периодического действия. Выражение "высокая производительность выработки этанола" означает объемную производительность свыше 10 г/л в день. Выражение "высокая концентрация этанола" означает более чем около 10 г/л, предпочтительно более 15 г/л этанола в ферментационном бульоне или соотношение этанола и ацетата 5:1 или более."Избыток Н 2" имеется в стадии производства этанола, когда отношение молей Н 2 в подаваемом газе к сумме удвоенного количества молей превращенного СО и утроенного количества молей превращенного СО 2 превышает 1,0. Если это отношение меньше 1,0, то избыток Н 2 отсутствует и этанол может быть выработан только посредством другого регулирующего механизма.II. Биологические процессы, используемые в способе по изобретению. Не претендуя на создание теории, авторы предположили, что способы увеличения анаэробной выработки этанола в технологических процессах, описанных здесь, основаны на биологических процессах,включающих превращение NAD(P)H в NAD(P) в основных циклах ацетогенного процесса автотрофного роста. Изобретение включает такое воздействие на эти процессы, которое обеспечивает возможность непрерывного производства и поддержания высоких концентраций этанола при низких концентрациях ацетата в стабильных рабочих условиях, что позволяет реализовать эффективное в промышленных масштабах производство этанола из промышленных газов. Сущность превращения NAD(P)H в NAD(P) в биологических процессах описывается следующим образом. Выработка этанола из газообразных компонентов, таких как СО, СО 2 и Н 2, осуществляется биологическим путем в три этапа. На первом этапе субстраты СО и Н 2 окисляются и при этом высвобождается NAD(P)H:NAD(P)NAD(P)H СО + Н 2 + Н 2 ОСО 2 + 4 Н+ Продукты этапа 1 затем превращаются в уксусную кислоту на этапе, на котором требуетсяNAD(P)HNAD(P) СО + СО 2 + 6 Н+СН 3 СООН + Н 2 О Наконец, если реакция этапа 1 осуществляется со скоростью большей, чем скорость реакции этапа 2 и образуется избыток NAD(P)H, то уксусная кислота восстанавливается в этанол:NAD(P)HNAD(P) СН 3 СООН + 4 Н+С 2 Н 5 ОН + Н 2 О Таким образом, наличие избытка NAD(P)H в результате окисления субстрата приводит к выработке этанола из уксусной кислоты. Известны два основных цикла в ацетогенном процессе: (1) цикл ацетил-СоА и (2) цикл THF, в ко-5 006106 тором СО 2 восстанавливается в метильную группу. Последовательность дальнейшей выработки этанола и уксусной кислоты показана у J. R. Phillips et al., 1994 Applied Biochemistry and Biotechnology, 45/46:145. Цикл ацетил-СоА имеет внутренний цикл, который здесь назван СО-циклом. Поскольку СО-цикл обычно происходит по часовой стрелке, то ферредоксин восстанавливается. Ферредоксин по мере того как он окисляется в реакции, катализируемой ферментом гидрогеназой, также может восстанавливаться посредством Н 2. В результате цикл ацетил-СоА также происходит по часовой стрелке и происходит окисление ферредоксина. Если внутренний СО-цикл и цикл ацетил-СоА осуществляются с одинаковой скоростью,ферредоксин находится в окислительно-восстановительном равновесии. Однако, если эти два цикла осуществляются с разными скоростями, т.е., если СО-цикл происходит с большей скоростью, чем цикл ацетил-СоА, то накапливается восстановленный ферредоксин. Кроме того, при избытке Н 2 восстановленный ферредоксин также может вырабатываться в избытке. Этот избыток восстановленного ферредоксина вызывает регенерацию (восстановление) NAD(P) в NAD(P)H, накапливающийся избыток которого должен быть снижен до равновесия, в процессе чего уксусная кислота восстанавливается в этанол. Цикл THF имеет определенное значение для клеточного роста и требуется для процесса непрерывного культивирования, поэтому он не может быть полностью остановлен. Снижение скорости цикла THF также повышает отношение NAD(P)H к NAD(P). NAD(P)H окисляется в двух местах. Путем ограничения этого окисления, которое будет поддерживать общее клеточное отношение NAD(P)H к NAD(P) в равновесии, NAD(P)H используется для восстановления уксусной кислоты в этанол. Второй основной способ восстановления уксусной кислоты в этанол состоит в прямом снижении окислительно-восстановительного потенциала ферментационного бульона. Восстановленное состояние,когда окислительно-восстановительный потенциал существенно ниже, чем в природном состоянии культуры, обусловливает избыток NAD(P)H и способствует восстановлению уксусной кислоты в этанол.III. Способы по изобретению. Основные этапы способа состоят в следующем. Способ непрерывной ферментации с выделением продукта описан со ссылкой на фиг. 1 и на основе приведенного ниже примера 1. Непрерывный поток газообразного субстрата 1, содержащего по меньшей мере один восстановительный газ, например, СО или Н 2, с заданной скоростью и непрерывный поток жидкой питательной среды 2 с заданной скоростью подаются в ферментационный биореактор 3, содержащий соответствующие бактерии. В биореакторе 3 среда и газообразный субстрат ферментируются бактериями с образованием этанола и уксусной кислоты. Когда достигается стабильная концентрация клеток в условиях устойчивого состояния, компоненты непрерывного процесса подвергаются воздействию, которое снижает окислительно-восстановительный потенциал или повышает отношение NAD(P)H к NAD(P) в ферментационном бульоне. При этом концентрация свободной уксусной кислоты в биореакторе поддерживается на уровне менее 5 г/л. Способы по данному изобретению обеспечивают и поддерживают выработку этанола и ацетата в ферментационном бульоне таким образом, чтобы производительность выработки этанола составляет более 10 г/л в день при соотношении этанола и ацетата от 1:1 до 20:1. В одном из вариантов осуществления это соотношение составляет более 3:1. В другом варианте осуществления это соотношение составляет более 5:1. В третьем варианте осуществления это соотношение составляет более 10:1. В следующем варианте осуществления это соотношение составляет более 15:1. Способ по данному изобретению эффективен для обеспечения стабильного непрерывного (осуществляемого в устойчивом состоянии) получения из СО, СО 2 и Н 2 высоких концентраций этанола (15-35 г/л этанола) и низких концентраций ацетата (0-5 г/л ацетата), а именно,при соотношении этанола и ацетата 3:1 или более, при хорошей стабильности технологического процесса. Периодически в ходе технологического процесса по изобретению отбирают образцы бульона для определения соотношения обычным аналитическим методом. Например, клетки выделяют из образца, в частности, путем центрифугирования, и затем анализируют свободный от клеток образец, предпочтительно методом газовая хроматография. Однако опытными специалистами в данной области могут быть выбраны и другие аналитические методики. Дополнительные необязательные этапы способа могут быть введены для достижения и/или поддержания нужного соотношения. В примере 2 показан такой метод анализа. Процесс воздействия на компоненты системы и поддержания и/или достижения заданной производительности выработки этанола или соотношения этанола и ацетата включает по меньшей мере один, а предпочтительно - комбинацию следующих этапов: изменение состава питательной среды, скорости подачи питательной среды, скорости подачи воды, рабочего давления, рабочей рН, состава газообразного субстрата, скорости подачи газа, скорости перемешивания ферментационного бульона, этап предотвращения ингибирования продуктом, снижение плотности клеток в биореакторе или предотвращение ингибирования субстратом. Некоторые предпочтительные воздействия включают подачу в биореактор жидкофазного ограничивающего питательного вещества (пантотената или кобальта), создание небольшого избытка СО и Н 2 в подаваемом газе, минимизацию концентрации ацетата, предотвращение акклиматизации культуры к низким концентрациям питательных веществ в жидкой фазе, доведение культуры до нужной концентрации клеток с относительно высокой скоростью, подъем рН культуры выше 4,5, очистка биореактора от бактериальных клеток до получения концентрации клеток ниже концентрации устой-6 006106 чивого состояния, при которой используется весь восстановительный газ или питательные субстраты в биореакторе, и увеличение скорости подачи воды в тот момент, когда доля свободной уксусной кислоты в ацетате, присутствующем в ферментационном бульоне, превышает 2 г/л, за счет чего предотвращается нежелательное увеличение концентрации свободной уксусной кислоты. Все эти этапы подробно описаны ниже. Отходящий газ 4, содержащий не переработанные в реакторе СО, СО 2 и Н 2 и другие газы, отводят из реактора через вентиляционные каналы и используют в соответствии с их теплотворной способностью. Если в качестве контрольного показателя используют избыток Н 2, то параметрами контроля соотношения этанола и ацетата на этом этапе являются парциальное давление Н 2 в отходящем газе и отношение парциального давления Н 2 к парциальному давлению СО 2 в отходящем газе. Для увеличения концентрации клеток внутри биореактора и, таким образом, усиления биокатализатора для превращения СО,СО 2 и Н 2, может быть использована (но не обязательно) рециркуляция клеток. В этом случае жидкий эффлюент из реактора 5 направляют в сепаратор клеток 6, где происходит его разделение на клетки 7 и пермеат (не содержащую клеток жидкость) 8. Клетки 7 направляют обратно в биореактор 3, а пермеат 8 направляют на выделение продукта. Клетки отделяют с помощью центрифуги непрерывного действия, фильтрационной системы на основе полых волокон или спиральных фильтрующих элементов, керамической фильтровальной системы или другого сепаратора жидкостей/твердых веществ. Этанол может быть выделен из пермеата (или, в альтернативе, эффлюента из реактора 5, если отделение клеток не используется) различными способами,включая дистилляцию и адсорбцию. Пермеат 8 разделяют в дистилляционной колонне с получением дистиллятного 95%-го этанола 10 и воды 11, которую направляют обратно в биореактор 3. Оборотная вода 11 содержит питательные вещества, которые не были использованы при ферментации. Витамины,если они присутствовали после ферментации или клеточного лизиса, в процессе термической дистилляции разрушаются. Дистиллятный 95%-й этанол 10 пропускают через молекулярное сито 12, где безводный этанол 13 - целевой конечный продукт, отделяют от разбавленного этанола 14, который направляют обратно в дистилляционную колонну 9. Непрерывные и одновременные процессы роста, гибели и удаления клеток обеспечивают поддержание постоянной концентрации клеток, в результате чего способ непрерывного действия, используемый в производстве этанола (и малых количеств уксусной кислоты), может осуществляться в течение многих месяцев при подаче СО, СО 2 и Н 2 и питательных веществ без пополнения культуры. В способах по изобретению поддерживаются и контролируются условия для непрерывного производства этанола и уксусной кислоты и предотвращаются или быстро устраняются сбои технологического процесса. В способах по изобретению также предотвращается губительная для производительности акклиматизация культуры к низкой концентрации питательных веществ. В приведенном ниже описании и в примерах,если не указано иное, давление равно 1 атмосфере, а значение температуры составляет 36-41 С. Температуры и давления могут быть заданы опытным специалистом в данной области в зависимости от микроорганизма, выбранного для использования в биореакторе. Различные воздействия, подробно описанные ниже, которые осуществляются в дополнение к основным этапам по изобретению, позволяют увеличить выработку этанола. Предпочтительно, ограничение жидкофазного питательного вещества (пантотената или кобальта) или использование избытка Н 2 или СО являются этапами способа по изобретению, которые подробно описаны и которые используются для достижения и поддержания заданной производительности выработки этанола и обеспечения стабильных концентраций и соотношений этанола и ацетата в ферментационном бульоне. В предпочтительном варианте осуществления отношение продуктов этанола и ацетата, вырабатываемых в ферментационном бульоне, составляет более 10:1, а концентрация этанола - более 15 г/л. А. Ограничение пантотенатом кальция. В одном из частных вариантов осуществления данного изобретения воздействие на биологические процессы, которое способствует выработке этанола и ограничивает выработку уксусной кислоты, включает ограничение количества пантотената кальция в питательной среде до величины, которая меньше,чем это требуется для поддержания стабильной и устойчивой концентрации бактерий, при которой может быть полностью использован имеющийся пантотенат кальция. Пантотенат является компонентом цикла ацетил-СоА и поэтому за счет дефицита пантотената кальция в питательной среде скорость цикла ацетил-СоА снижается относительно скорости цикла СО. Это вызывает накапливание восстановленного ферредоксина и восстановление NAD(P) в NAD(P)H, а следовательно, увеличивает выработку этанола в качестве конечного продукта. Дефицит пантотената имеется тогда, когда количество пантотената кальция в мкг, подаваемого в реактор на 1 г клеток (сухой вес), продуцируемых в реакторе, находится в диапазоне от 0,5 до 100. Более предпочтительное дефицитное количество пантотената лежит в диапазоне от 2 до 75 мкг пантотената кальция на грамм сухих клеток, продуцируемых в реакторе. В другом варианте это количество составляет около 1-25 мкг пантотената кальция на грамм клеток, продуцируемых в реакторе. В следующем варианте это количество составляет около 10-30 мкг пантотената кальция на грамм клеток, продуцируемых в реакторе. При таком количестве питательного вещества поддерживается преимущественная выработке-7 006106 этанола по сравнению с ацетатом. Один из вариантов этого способа показан в примере 4. В другом аспекте данного способа предотвращается акклиматизация бактерий в ферментационном биореакторе к низкой ограничивающей концентрации пантотената кальция за счет регулирования параметров ферментации таким образом, что концентрация пантотената кальция остается постоянной, в то время как по меньшей мере один, а иногда несколько параметров, таких как скорость подачи газа, скорость подачи жидкости, скорость перемешивания или парциальное давление Н 2, регулируется. Существенных изменений концентраций питательных веществ не происходит, наоборот, сохраняется относительно постоянная концентрация питательной среды. Если позволить культуре акклиматизироваться к низкому содержанию жидкофазных ограничивающих питательных веществ, то образуются неблагоприятные значения соотношения продуктов в 1,0 г этанола/г ацетата или менее, и технологический процесс становится необратимым. В этом случае реактор прекращает работу и требуется реинокуляция. Предпочтительно, биологический процесс контролируют с целью увеличения выработки этанола и ограничения выработки уксусной кислоты так, чтобы вначале подаваемый в биореактор газ содержал избыток Н 2,а затем ограничивают содержание пантотената кальция в питательной среде, как описано выше. Фактически, при запуске системы ограничивающее жидкофазное питательное вещество пантотенат кальция обычно содержится в избытке, что предотвращает акклиматизацию к его низким концентрациям, которая может привести к очень низкой производительности культуры и потере культурой способности обеспечивать высокую производительность выработки этанола на уровне более 10 г/л в день, если избыток Н 2 не используется. Пример такого регулирования параметров ферментации для конкретной бактериальной культуры показан в примере 17. В. Ограничение кобальтом. В другом варианте осуществления данного изобретения воздействие на биологические процессы,которое благоприятствует выработке этанола и ограничивает выработку уксусной кислоты, заключается в ограничении количества кобальта в питательной среде до величины, которая меньше, чем это требуется для поддержания стабильной и устойчивой концентрации бактерий, при которой может быть полностью использован имеющийся кобальт. Дефицит кобальта имеется тогда, когда количество подаваемого в реактор кобальта в мкг, на 1 грамм клеток (сухой вес), продуцируемых в реакторе, находится в диапазоне от 5 до 100. Предпочтительно, количество кобальтом ограничивают значениями от 20 до 50 мкг кобальта в реакторе на грамм клеток, продуцируемых в реакторе. При этом в количестве кобальта поддерживается преимущественная выработка этанола по сравнению с ацетатом. В примере 18 показан вариант способа ограничения кобальтом в реакторе в соответствии с изобретением. Дефицит кобальта в ферментационном бульоне также может снижать скорость цикла ацетил-СоА. Поскольку кобальт используется для переноса метильной группы из цикла THF в цикл ацетил-СоА, то дефицит кобальта в ферментационном бульоне также снижает функционирование цикла THF за счет ограничения переноса. Дефицит кобальта снижает скорость цикла THF, что также вызывает увеличение отношения NAD(P)H к NAD(P) и, следовательно, увеличение выработки этанола. Способ дополнительно включает воздействие, предотвращающее акклиматизацию к низкой ограничивающей концентрации кобальта. В основном таким же образом, как в случае предотвращения акклиматизации к низкой концентрации пантотената кальция, поддерживается постоянная концентрация кобальта при регулировании одного или нескольких параметров ферментации (скорости газа, скорости жидкости, скорости перемешивания, содержания СО 2 и парциального давления газообразного Н 2). Существенных изменений концентраций питательных веществ не происходит, наоборот, поддерживается относительно постоянная концентрация питательной среды. Пример такого регулирования параметров ферментации для конкретной бактериальной культуры показан в примере 19. Предпочтительно, для увеличения выработки этанола и ограничения выработки уксусной кислоты,в биореактор сначала подают избыток Н 2, а затем ограничивают кобальт в питательной среде, как описано выше. При запуске системы ограничивающее жидкофазное питательное вещество кобальт поддерживают в избытке для предотвращения акклиматизации к его низким концентрациям, которая может привести к очень низкой производительности культуры и потере способности культуры обеспечивать соотношение продуктов выше, чем 1:1. С. Избыточная подача водорода. В другом варианте осуществления изобретения воздействие на биологические процессы, благоприятствующее выработке этанола и ограничивающее выработку уксусной кислоты, заключается в избыточном содержании Н 2 в подаваемом газе или ограничение газообразного углерода, что приводит к избытку Н 2, который затем используется в биологическом процессе. Предпочтительно, восстановительный газ Н 2 содержится в избытке относительно СО, и этот избыток обуславливает выработку бактериями продуктов с высоким отношением этанола к ацетату в ферментационном бульоне. Если отношение Н 2 (в молях подаваемого газа) к сумме удвоенного количества превращенного СО (в молях газа) и утроенного количества молей превращенного СО 2 больше 1, то ферментация будет ограничиваться углеродом. Парциальное давление Н 2 в отходящем газе предпочтительно составляет более 0,4 атм. В конечном счете отношение парциального давления Н 2 к парциальному давлению СО 2 должно быть больше 3,0 для того,чтобы количество Н 2 было гарантированно достаточным для использования всего СО 2. Если парциальное-8 006106 давление СО 2 превышает 0,1 атм., то, скорее всего, рост был ограничен иным воздействием. См. пример 20, иллюстрирующий этот этап способа. Во время запуска использование избытка Н 2 является более благоприятным, чем ограничение питательными веществами, главным образом потому, что его легче контролировать. Преимущества использования избытка Н 2 состоят в том, что это позволяет предотвратить чрезмерную выработку уксусной кислоты, что может привести к нежелательным соотношениям продуктов и потенциальному ингибированию уксусной кислотой, а также к акклиматизации к низким концентрациям питательных веществ.D. Избыточная подача монооксида углерода. Другой способ воздействия на компоненты способа заключается в избыточной подаче восстановительного газа СО в составе газообразного субстрата с целью использования в процессе, который служит для прямого снижения окислительно-восстановительного потенциала ферментационного бульона. В соответствии с этим вариантом в биореактор подают содержащий СО газообразный субстрат, при этом количество СО, присутствующего в биореакторе, превышает количество, которое требуется для поддержания устойчивой, стабильной концентрации бактерий, при которой может быть полностью использован имеющийся СО. Подача СО является избыточной и служит для увеличения выработки этанола по сравнению с выработкой уксусной кислоты тогда, когда удельная скорость поглощения СО (миллимолей СО на грамм сухих клеток в реакторе за минуту, или ммоль/г клетокмин.) составляет более 0,3. Более предпочтительной является удельная скорость поглощения СО более 0,5. Это означает, что в среднем каждая клетка использует СО в своем метаболизме со скоростью по меньшей мере 0,3 ммоль/г клетокмин, желательно со скоростью по меньшей мере 0,5 ммоль/г клетокмин. Предпочтительно СО вводят со скоростью, при которой поглощение СО составляет от 0,3 до 2 ммоль СО/г сухих клеток бактерий в минуту. Пример 24 показывает один из вариантов осуществления этого этапа способа. Такая скорость поглощения СО поддерживает преимущественную выработку этанола по сравнению с уксусной кислотой. Если СО подается таким образом, что количество растворенного СО в ферментационном бульоне будет значительным за счет давления газа или очень хорошего массопереноса, то ферментационный бульон будет восстанавливаться сильнее. Избыточная подача СО обеспечивает два дополнительных преимущества. Избыток СО может обусловить функционирование СО-цикла в ускоренном режиме, и, если цикл ацетил-СоА ограничен другим способом и не может быть удержан в равновесии с циклом СО, то будет накапливаться восстановленный ферредоксин. СО может также замедлять этап 2 (выработку промежуточной уксусной кислоты) в общем трехступенчатом процессе за счет ингибирования субстратом. Эта пониженная скорость этапа 2 относительно этапа 1 обуславливает образование избытка NAD(P)H, что приводит к преобладанию выработки этанола над выработкой уксусной кислоты. Хотя избыток СО может привести к повышенной выработке этанола за счет прямого снижения окислительно-восстановительного потенциала ферментационного бульона, однако, присутствие избытка СО также ингибирует рост культуры путем ингибирования СО-дегидрогеназы и, следовательно, поглощение Н 2. Присутствие избытка СО, к сожалению, также приводит к ухудшению превращения Н 2, что может быть экономически неблагоприятным фактором. Последствием длительной работы в условиях ингибирования субстратом является ухудшение поглощения Н 2. В конечном счете это вызывает лизис клеток и необходимость перезапуска реактора. Если происходит непреднамеренное ингибирование субстратом (присутствие слишком большого для имеющихся клеток количества СО) во время первоначального роста культуры или после него, то снижают скорость подачи газа и/или перемешивания до тех пор,пока ингибирование субстратом не ослабляется. Иллюстрация того, как регулируется скорость газа или скорость перемешивания для осуществления этого эффекта, дана в примере 21. Е. Дополнительные этапы воздействия. В дополнение к основным этапам улучшения способа, описанным выше, способ производства этанола содержит еще несколько дополнительных приемов. 1. Увеличение массопереноса. Один из дополнительных вариантов осуществления включает обеспечение более быстрого массопереноса СО или Н 2 из линии подачи газа в жидкий ферментационный бульон по сравнению со способностью бактерий использовать растворенный газ. Например, если в биореактор, содержащий С. ljungdahlii, подается СО, СО 2 и Н 2, и биореактор работает без ограничений по питательным веществам (таких как пантотенат и кобальт) или без избытка Н 2, рост клеток ограничен количеством газа, переносимого в жидкую фазу, и система вырабатывает в качестве продукта уксусную кислоту. Если в культуру подается незначительный избыток СО или Н 2 по сравнению с требуемым для роста культуры количеством, то она вырабатывает этанол. Однако, если в жидкую фазу переносится намного больше газа, чем может использовать культура, происходит ингибирование субстратом, которое может привести к повреждению культуры и к гибели клеток. Таким образом, существует очень узкий диапазон, в котором возможна работа с избыточным массопереносом. Пример 22 иллюстрирует этот вариант. Рассмотрим снова цикл ацетил-СоА. Для того, чтобы вырабатывался избыточный восстановленный ферредоксин, СО-цикл или восстановление ферредоксина гидрогеназой должно осуществляться с боль-9 006106 шей скоростью, чем цикл ацетил-СоА. В описанных здесь способах ограничивают скорость, при которой микроорганизмы могут использовать растворенные газы, путем ограничения скорости, при которой незаменимые питательные вещества, например, пантотенат кальция или кобальт, или другие субстраты,такие как газообразный СО 2, подаются к бактериям, или путем подачи в культуру избыточного субстрата, Н 2 или СО. Может быть вычислена теоретическая скорость массопереноса, большая, чем скорость использования субстрата бактериями, даже без других ограничений. Когда эта скорость достигается, она ограничивается природной скоростью роста организма. Поэтому наиболее продуктивным будет такой вариант осуществления, в котором массоперенос (скорость течения газа или скорость перемешивания) превышает скорость, с которой максимально возможная концентрация клеток может использовать субстрат без ограничений. Рабочий диапазон будет очень узким, поскольку ингибирование субстратом может быстро вызывать гибель клеток и образование токсичной для культуры концентрации побочного продукта. 2. Избыточная подача СО и Н 2. В другом варианте осуществления данного изобретения стабильно высокая концентрация этанола и ограниченная выработка уксусной кислоты достигается тогда, когда ограничены кобальт или пантотенат кальция или создан избыток Н 2 или СО. В соответствии с этим, так как культура использует субстраты СО, Н 2 и СО 2 в качестве источников углерода и энергии, СО и Н 2 подают с небольшим избытком. Небольшой избыток СО и Н 2 создают путем установления устойчивого состояния, а затем постепенно повышают скорость подачи газа и/или скорость перемешивания (с 10% или меньшими приращениями), до тех пор, пока превращение СО и Н 2 не начнет падать. Это позволяет избежать ограничения массопереноса, которое способствует выработке уксусной кислоты, и обеспечить избыток восстановленного ферредоксина для восстановления NAD(P) в NAD(P)H и выработки этанола. Если СО и Н 2 не подаются с небольшим избытком, происходит ограничение массопереноса, и биологический процесс уравновешивается. Это приводит к нежелательным соотношениям этанола и ацетата (высоким концентрациям ацетата). Высокие концентрации ацетата могут в конечном счете привести к ингибированию уксусной кислотой,которое ограничивает способность бактерии поглощать Н 2 и в конце концов приводит к гибели культуры. Предотвращение ограничения массопереноса состоит в увеличении скорости перемешивания или скорости газа для переноса большего количества СО и Н 2 в жидкую фазу и, таким образом, снова возникает небольшой избыток СО и Н 2. Если возникает ингибирование продуктом в результате ограничения массопереноса, необходимо увеличить скорость подачи жидкости, чтобы прекратить ингибирование уксусной кислотой за счет разбавления до более низкой в результате концентрации ацетата. Поскольку при увеличении скорости подачи среды будет увеличиваться количество мкг пантотената или кобальта на 1 г продуцируемых клеток, это нужно делать кратковременно или следует удалять избыток пантотената или кобальта за счет регулирования концентрации среды или увеличения скорости подачи воды. 3. Контроль ингибирования вырабатываемой уксусной кислотой. В описанных выше способах если в биореакторе накапливается слишком много молекулярной уксусной кислоты (2 г/л), которая препятствует дальнейшему росту клеток и выработке этанола, то может произойти ингибирование вырабатываемой уксусной кислотой. Для предотвращения повреждения культуры используют еще один вид воздействия. Одна из модификаций включает кратковременное увеличение скорости подачи жидкости или воды для того, чтобы снизить концентрацию ингибирующей уксусной кислоты в жидкой фазе до величины менее 2 г/л. Описание этого варианта для конкретной культуры в реакторе приведено в примере 23. 4. Рециркуляция воды. Следующий необязательный прием поддержания стабильной культуры, которая вырабатывает этанол в качестве единственного продукта, без конечной выработки уксусной кислоты, способы по изобретению включают добавление оборотной воды из процесса дистилляции обратно в ферментационный реактор (см., в частности, пример 5). Как отмечалось выше, рециркуляция воды (содержащей до 5 г/л ацетата) обеспечивает то преимущество, что образовавшийся ацетат возвращается обратно в реактор и уксусная кислота в качестве конечного продукта не вырабатывается. Таким образом, в реакторе устанавливается равновесие между этанолом и ацетатом. В результате весь газ СО, СО 2 и Н 2, подаваемый в реактор и превращаемый в продукты, используется для выработки этанола, кроме той части, которая используется для поддержания культуры. 5. Уменьшение плотности клеток. Следующий метод воздействия, полезный в данном способе, состоит в осуществлении периодической или непрерывной очистки биореактора от бактериальных клеток для снижения концентрации клеток в биореакторе. Это воздействие направлено на уменьшение концентрации клеток до величины,меньшей, чем концентрация устойчивого состояния, при которой используется весь восстановительный газ или питательные субстраты в биореакторе. Таким образом, при изменении плотности клеток выработка этанола преобладает над выработкой ацетата в биореакторе. См., в частности, пример 25. 6. Двухступенчатая система CSTR. Одна из проблем, связанных с выработкой этанола посредством ограничения среды, заключается в- 10006106 способности или склонности культуры в конечном счете адаптироваться к ограничивающим условиям и прекращать выработку этанола через несколько месяцев работы. Вместо этанола доминирующим продуктом становится ацетат. Такая акклиматизация к низким ограничивающим концентрациям питательного вещества приводит к развитию культуры, которая производит больше уксусной кислоты, чем этанола(соотношение этанола и ацетата 1,0 или менее) и в результате дает низкие концентрации этанола (иногда всего лишь 1 г/л). Адаптация, вероятнее всего, происходит в случае, если культура не получает достаточного количества питательных веществ во время запуска, при котором скорость роста имеет более важное значение, чем скорость выработки этанола. Кроме того, существует опасность, что культура может акклиматизироваться к низким ограничивающим концентрациям при работе в устойчивом состоянии, в частности, когда концентрации ограничивающего питательного вещества снижаются для удаления ацетата из реакционной системы. Для предотвращения такой адаптации при использовании ограничения пантотената или кобальта,описанных выше, может быть применена другая модификация способа. Двухступенчатая система CSTR,в которой на первой стадии осуществляется активный первичный рост культуры при небольшом избытке ограничивающих питательных веществ (возможно, сопровождающийся выработкой уксусной кислоты),а на следующей стадии производства культура из первой стадии ограничивается ограничивающим питательным веществом и используется для выработки высокий концентраций этанола, представляет собой такую модификацию способа. Эта модификация дает возможность поддерживать стабильность культуры, которая не акклиматизируется к пониженным концентрациям пантотената или кобальта. Такая модификация включает работу двухступенчатой системы CSTR, в которой реактор роста (стадия 1) питает реактор производства (стадия 2), где происходит основная выработка этанола. В реактора роста не применяются ограничения питательных веществ, описанные выше, в результате чего культура не подвержена акклиматизации к ограниченному состоянию. Принципиальная схема такой двухступенчатой системы CSTR показана на фиг. 2, и далее описание содержит ссылки на эту фигуру. В соответствии с этим вариантом осуществления стадия роста происходит при продолжительности удержания жидкости (LRT) около 24 ч. Стадия роста CSTR 1 снабжается достаточным количеством пантотената или кобальта в среде 2 с получением здоровой культуры (а также с возможным образованием уксусной кислоты). Таким образом, в реакторе вырабатывается избыток уксусной кислоты, но повышается стабильность. Эта концентрация пантотената или кобальта превышает концентрацию, которая подавалась бы в одиночный CSTR, используемый для производства этанола. Газ,подаваемый в этот реактор, представляет собой непревращенный газ 3 из стадии производства 4, а подаваемая жидкость представляет собой свежую среду 2. Стадия роста CSTR 1 работает без рециркуляции клеток. В реакторе стадии роста решается задача получения свежей культуры для последующего производства этанола, которая не акклиматизируется к низким концентрациям пантотената. Реактор стадии производства 4 работает при номинальной LRT менее 20 ч. Этот CSTR с рециркуляцией клеток запитывают через линию подачи свежего газа 5 и может иметь низкие степени превращения. Он также запитывается через линию подачи свежей среды 6 и линию подачи культуры 7 из стадии роста. В этот реактор подается минимум пантотената или кобальта, поскольку имеется избыток из стадии роста. Рециркуляция клеток 8 используется в этом реакторе для получения максимальной выработки от клеток, направляемых обратно в реактор 4. Конечная концентрация этанола в жидком продукте 10 должна превышать 20 г/л. Особенности двухступенчатой системы CSTR состоят в небольших изменениях,касающихся акклиматизации к низким концентрациям пантотената или кобальта, общей LRT30 ч,ожидаемой повышенной производительности выработки этанола и повышенной концентрации этанола по сравнению с одиночным CSTR того же размера. 7. Модификации при запуске. Другие этапы способа, которые предпочтительно используются при практическом применении данного изобретения, включают продуцирование клеток во время первичного запуска ферментационной культуры. Запуск биореактора, питаемого СО, СО 2 и Н 2 для выработки этанола и уксусной кислоты, выполняют путем периодической инокуляции из маточной культуры (пример 11) или путем непрерывной подачи посевного материала из имеющегося реактора в виде линии подачи культуры (пример 12). Как было отмечено выше в описании предотвращения акклиматизации культуры к низким концентрациям пантотената или кобальта, наиболее предпочтительно культуру доводят до высокой концентрации клеток перед ограничением питательных веществ и подачей в культуру избытка Н 2. Такой быстрый запуск предотвращает акклиматизацию культуры и обеспечивает хорошие соотношения продуктов (высокие концентрации этанола и низкие концентрации уксусной кислоты). Если быстрый запуск не применяется, то могут возникать нежелательные соотношения продуктов и культура может акклиматизироваться к низким концентрациям жидкофазного питательного вещества, что приведет к необходимости реинокуляции реактора. Реактор запускают путем загрузки порции жидкой фазы (жидкая среда вначале не подается в реактор непрерывно) при низких скоростях перемешивания (возможно, 400-600 об/мин в лабораторном реакторе New Brunswick Scientific Bioflo) и при заданной рН. Таким образом, жидкая фаза в реакторе содержит порцию питательной среды с витаминами и солями, при номинальной концентрации ограничи- 11006106 вающего питательного вещества, пантотената кальция или кобальта (например, 20 мкг/л пантотената или 75 млн-1 кобальта). При использовании непрерывной инокуляции из имеющегося реактора загрузка порции жидкой фазы может быть необязательной. В этом случае газ непрерывно подают в реактор при первичном запуске с низкой скоростью. В идеале газовая фаза при запуске не должна содержать СО 2, должна содержать избыток Н 2, а скорость газа и скорость перемешивания должны быть небольшими для предотвращения ингибирования субстратом СО. Примерный общий протокол выработки и поддержания эффективных в промышленном масштабе концентраций этанола из СО, СО 2 и Н 2 состоит из трех отдельных фаз: (а) первичный запуск, при котором важнейшим фактором является продуцирование клеток; (b) запуск, при котором важнейшим фактором становится скорость выработки; и (с) работа в устойчивом состоянии. Первичный запуск по существу отличается инокуляцией порции жидкости, содержащей номинальное количество ограничивающего питательного вещества, выбранного из кобальта (75 млн-1) или пантотената кальция (20 мкг/л), при заданной рН (обычно 4,5-5,5). Для облегчения запуска скорость подачи газа и скорость перемешивания предпочтительно поддерживают низкими, а Н 2 подают в избытке. Фактором выработки этанола во время запуска является избыток Н 2; питательное вещество ограничивают позднее. Таким образом, во время запуска фактически присутствует избыток жидких питательных веществ, что предотвращает нежелательную акклиматизацию культуры к низкому содержанию питательных веществ. По мере продолжения ферментации в течение нескольких часов после инокуляции, происходит выработка СО 2 вырабатывается и потребление Н 2. Изменения в этих скоростях означают, что скорость перемешивания следует медленно повышать до номинальной (возможно, на 200-300 об/мин в лабораторном реакторе в течение 2-3 дней) для предотвращения ограничения массопереноса. Начало выработки СО 2 происходит гораздо быстрее в системах, в которых использована непрерывная инокуляция, в противоположность от однократной инокуляции из маточной культуры. Однако, если скорость перемешивания увеличивается слишком быстро, происходит ингибирование субстратом СО. Скорость перемешивания увеличивают относительно быстро под контролем за превращением Н 2 (или выработкой СО 2) высокой скоростью до тех пор, пока не будет достигнута целевая скорость перемешивания. В течение этого времени увеличения скорости перемешивания в порции жидкой культуры наиболее важное значение имеет процесс продуцирования клеток, а не выработка продукта. После достижения целевой скорости перемешивания (800-100 об/мин в лабораторном реакторе NewBrunswick Scientific Bioflo) культуру оставляют расти до устойчивого состояния для того, чтобы увеличить поглощение Н 2. Запуск переходит в режим, в котором важной становится скорость выработки. Желательно получить превращение СО более 80% и высокое парциальное давление Н 2 в отходящем газе (по меньшей мере 0,55 атм) для того, чтобы обеспечить выработку этанола при ограниченной концентрации ацетата и молекулярной уксусной кислоты. Затем включают подачу жидкой среды (для систем с однократной инокуляцией из маточной культуры) для инициирования непрерывной подачи жидкости, а скорость подачи газа увеличивают с 10%-ми приращениями до достижения целевой скорости течения. Н 2 остается в избытке для предотвращения избыточной выработки уксусной кислоты. По мере увеличения скорости газа жидкофазные питательные вещества ограничивают (пантотенат кальция или кобальт), в результате чего происходит небольшое спад в превращении Н 2 при целевой производительности. При работе в устойчивом состоянии достигается выработка 15-35 г/л этанола и 0-5 г/л ацетата. На этом этапе необходимы небольшие корректировки в отношении ограничивающих питательных веществ,скоростей подачи жидкости и скоростей подачи газа, которые выбираются опытным специалистом на основе теоретических достижений в данной области и руководств данного изобретения. Если способ производства этанола должен быть дополнен рециркуляцией клеток, то она вводится на этом этапе одновременно с регулированием скорости газа (увеличением) и концентрации питательного вещества (снижением). Вышеописанные способы непрерывной выработки и поддержания высоких концентраций этанола при низких концентрациях побочного ацетата в стабильных рабочих условиях улучшают использование соответствующих бактерий для промышленного производства этанола из СО, СО 2 и Н 2. В способе предпочтительно использование биореактора непрерывного действия, хотя периодическая ферментации и ферментация с подпиткой также применимы, но вряд ли будут экономически эффективными для крупномасштабного производства этанола. Следующие примеры иллюстрируют различные аспекты, способы и этапы способов по изобретению. Эти примеры не ограничивают изобретение, область которого изложена в прилагаемой формуле изобретения. Пример 1. Иллюстративный способ по данному изобретению. Синтез-газ или отработанный газ, содержащий СО и/или СО 2/Н 2 непрерывно вводят в бак-реактор с непрерывным перемешиванием, содержащий штамм С. ljungdahlii, вместе с обычной жидкой средой,содержащей витамины, микроэлементы и соли. Состав одной из предпочтительных питательных сред приведен ниже в табл. 1. При запуске с использованием инокулята культуры 10% или менее реактор работает при загрузке порции жидкой фазы, т.е., жидкую среду не подают в реактор непрерывно. Таким образом, жидкая фаза в- 12006106 реакторе состоит из порции питательной среды с номинальной концентрацией ограничивающего питательного вещества, пантотената кальция или кобальта. В альтернативе также может быть использована обогащенная среда, содержащая дрожжевой экстракт, триптиказу или другие комплексные питательные вещества. В идеале, газовая фаза во время запуска не содержит СО 2 и содержит избыток Н 2. Скорость газа и скорость перемешивания поддерживают на низком уровне (ниже 500 об/мин. в ферментационном биореакторе New Brunswick Scientific Bioflo) с получением СО и Н 2 с небольшим избытком, но в то же время с предотвращением ингибирования СО-субстратом. В однолитровом лабораторном ферментационном биореакторе New Brunswick Scientific Bioflo, например, в котором в состав подаваемого газа входит 63% Н 2, 32% СО и 5% СН 4, скорость перемешивания для первичного запуска составляет 400 об/мин, а скорость газа 20 мл/мин. Фактором выработки этанола во время запуска является избыток Н 2; ограничение питательного вещества осуществляется позднее. Таким образом, во время запуска фактически имеется избыток жидких питательных веществ (пантотената, кобальта), что предотвращает нежелательную акклиматизацию культуры к низкому содержанию питательных веществ. По мере продолжения ферментации в течение нескольких часов после инокуляции, СО 2 вырабатывается путем превращения СО, а Н 2 потребляется вместе с СО 2, что является сигналом к повышению скорости перемешивания до номинальной величины, чтобы избежать ограничения массопереноса. ВNew Brunswick Scientific Bioflo отходящий газ включает 25% СО, 67% Н 2, 2% СО 2 и 6% СН 4. Если скорость перемешивания увеличивается слишком быстро, происходит ингибирование субстратом СО,что определяется по снижению концентрации метана после ускорения перемешивания. Таким образом,скорость перемешивания, как правило, повышается на 200 об/мин. за 24 ч. Эта операция повышения скорости перемешивания при контроле за выработкой СО 2 (или превращением Н 2) осуществляется до тех пор, пока не будет достигнута целевая скорость перемешивания. Типичная целевая скорость перемешивания в ферментационном биореакторе New Brunswick Scientific Bioflo составляет 900 об/мин. В течение этого времени повышения скорости перемешивания в порции жидкой культуры наиболее важное значение имеет продуцирование клеток, а не выработка продукта. Таким образом, достигается концентрация клеток около 1,5 г/л, при этом типичные концентрации продуктов составляют 10 г/л этанола и 2 г/л ацетата из порции культуры. После достижения целевой скорости перемешивания культуру оставляют расти до тех пор, пока поглощение Н 2 не достигнет максимального значения. Желательно получить очень высокие концентрации Н 2 в отходящем газе (обычно 60 %), чтобы обеспечить выработку этанола при ограниченной выработке уксусной кислоты. Затем включают подачу жидкой среды (для систем с однократной инокуляцией из маточной культуры) для инициирования непрерывной подачи жидкости, а скорость газа повышают до целевой. В лабораторном ферментационном биореакторе New Brunswick Scientific Bioflo скорость подачи жидкости обычно составляет 0,5 мл/мин, а скорость течения газа увеличивают на 10-15% каждые 24 часа до достижения целевой скорости в 125 мл/мин. Важно обеспечить избыток Н 2 в подаваемом газе для предотвращения избыточной выработки уксусной кислоты. По мере увеличения скорости газа увеличивается продуцирование клеток, пока не возникнет ограничение в жидкофазных питательных веществах(пантотенат кальция или кобальт), что будет заметно по небольшому падению превращения Н 2 при целевой производительности. В CSTR New Brunswick Scientific Bioflo это можно заметить по 10%-му падению превращения Н 2 при целевой производительности 20 г/л в день. Затем технологический процесс и система реакторов поддерживают в устойчивом состоянии при выработке 15-35 г/л этанола и 0-5 г/л ацетата в качестве продуктов, лишь с небольшими корректировками в ограничивающих питательных веществах, скоростях жидкости и газа. Типичные условия устойчивого состояния в лабораторном ферментационном биореакторе New Brunswick Scientific Bioflo без рециркуляции клеток включают продолжительность удержания газа (жидкостный объем реактора/скорость течения газа) 20 мин, продолжительность удержания жидкости (жидкостный объем реактора/ скорость течения жидкости) 30 ч и скорость перемешивания 900 об/мин, с превращением СО 92% и превращением Н 2 60% при ограничении пантотенатом. В одном из вариантов осуществления этого способа система реакторов дополнена рециркуляцией клеток и рециркуляцию вводят на этом этапе одновременно с регулированием скорости газа (увеличением) и концентрации питательного вещества (уменьшением). При рециркуляции клеток в CSTR NewBrunswick Scientific Bioflo время удержания газа обычно составляет 8 мин, время удержания жидкости 40 ч, а скорость перемешивания 900 об/мин. Эти условия обычно обеспечивают превращение 92% СО и 50% Н 2 при ограничении пантотенатом. Пример 2. Анализ образцов путем газовой хроматографии. Для достижения и/или поддержания требующейся производительности и соотношения, периодически должны отбираться образцы ферментационного бульона из ферментационного биореактора. Образец больше чем 1,5 мл культуры отбирают из культуры в биореакторе. Образец помещают в микроцентрифужную пробирку, а пробирку помещают в центрифугу Fisher Scientific Micro 14 с необходимым балластом для равновесия. Образец центрифугируют при 8000 об/мин в течение 1,5 мин 0,500-мл образец су- 13006106 пернатанта помещают в 1,5-мл ампулу, предназначенную для использования в автодозаторе газового хроматографа. 0,500-мл образец внутреннего эталонного раствора содержит 5 г/л n-пропанола и 5%(об./об.) 85%-ной фосфорной кислоты в деионизированной воде. Наличие фосфорной кислоты гарантирует, что весь ацетат превратится в уксусную кислоту и будет обнаружен газовой хроматографией. 1 мкл подготовленного образца вводят при помощи автодозатора в Hewlett-Packard 5890 Series IIGas Gromatograph, оснащенный капиллярной колонкой 007 FFA Quadrex 25 м х 0,53 мм (внутренний диаметр) с плавленым кварцем. Анализ проводят с использованием гелия в качестве газа-носителя в двухпоточном режиме со скоростью 66 мл/мин. разделенного потока и 7,93 мл/мин инжекторной продувки. Давление на выходе колонки устанавливают на 27,6 кПа, что обеспечивает скорость течения носителя в колонке 7 мл/мин. Температурная программа включает выдержку при 75 С в течение 2 мин,подъем до 190 С со скоростью 30 С/мин и выдержку при 190 С в течение 5,17 мин. Общее время прогона составляет 8 мин. Прибор калибруют для этанола (0-25 г/л), уксусной кислоты (0-25 г/л), п-бутанола(0-5 г/л) и масляной кислоты (0-5 г/л). Пять эталонов, приготовленных из материалов с различным содержанием реагента, используют для калибровки. Если образец не попадает в калибровочный диапазон концентраций (например, 25 г/л этанола), 0,250 мл образца и 0,250 мл деионизированной воды помещают в ампулу с 0,500 мл внутреннего эталона и факт разбавления учитывают при анализе. Пример 3. Выработка кислоты в лабораторном CSTR с рециркуляцией клеток. В лабораторном ферментационном биореакторе New Brunswick Scientific Bioflo, работающем с рециркуляцией клеток, использовали С. ljungdahlii, штамм ERI2, АТСС 55380, для выработки уксусной кислоты из СО, СО 2 и Н 2. Подаваемый газ содержал 40% Н 2, 50% СО и 10% N2, а продолжительность удержания газа в однолитровом реакторе составляла 7,7-8,6 мин. Жидкую среду, содержащую витамины,соли и микроэлементы, подавали при продолжительности удержания жидкости от 2,6 до 2,9 ч. рН составляла 5,1-5,2, скорость перемешивания 1000 об/мин, а продолжительность удержания клеток - около 40 ч. В этих условиях ограничения массопереноса (но не ограничения питательного вещества) превращение СО составило 94-98%, а превращение Н 2 - 80-97%. Концентрация клеток составила 4-8 г/л, а ацетат вырабатывался с концентрацией 10-13 г/л. Этанол не вырабатывался. Хотя реактор работал в условиях ограничения массопереноса (ограничения возможности переноса газа в культуру) и, таким образом, вырабатывал в качестве продукта только уксусную кислоту, контролировались параметры, важные для выработки этанола путем ограничения пантотенатом, ограничения кобальтом или при избытке Н 2 или СО, которые служили сравнением для определения момента, когда этанол начинает вырабатываться как доминирующий продукт. Как показано в табл. 2, количество Ca-d-пантотената, подаваемое на единицу продуцируемых клеток, составило 1575-3150 мкг/г продуцируемых клеток. Подобным образом, количество кобальта на грамм продуцируемых клеток составило 1734-3468 мкг/г продуцируемых клеток. Удельная скорость поглощения СО составила 0,35-0,61 ммоль/г клетокмин. Отношение молей подаваемого Н 2 к сумме удвоенного количества молей превращенного СО и утроенного количества молей превращенного СО 2 составило менее 0,46. Таким образом, ни один из параметров не попадал в желаемый рабочий диапазон для выработки этанола культурой. Понятно, что пантотенат и кобальт подавались в указанный реактор в большом избытке во время выработки уксусной кислоты в качестве продукта в условиях ограничения массопереноса. То есть, уровни пантотената и/или кобальта могли быть существенно снижены, и все равно оставались бы выше ограничивающих уровней пантотената или кобальта. Чтобы показать это, однолитровый лабораторный ферментационный биореактор New Brunswick Scientific Bioflo модифицировали таким образом, чтобы существенно снизить подачу кобальта до уровня чуть выше концентрации ограничения кобальтом. Реактор снова содержал С. ljungdahlii, штамм ERI2, для выработки уксусной кислоты из СО, СО 2 и Н 2. Подаваемый газ содержал 55% Н 2, 25% СО и 5% СН 4, а продолжительность удержания газа составила 7,5-8,0 мин. Жидкую среду, содержащую витамины, соли и микроэлементы, подавали при продолжительности удержания жидкости от 3,0 до 3,5 ч, а продолжительность удержания клеток составила 40 ч. рН составляла 5,0-5,3, а скорость перемешивания 900-1000 об/мин. В этих условиях превращение СО составило 95-99%, а превращение Н 2 94-98%. Концентрация клеток составила 2,5-4 г/л, а ацетат был единственным продуктом, вырабатываемым с концентрацией 10-14 г/л. Количество Ca-d-пантотената, подаваемое на грамм продуцируемых клеток, составило 2250-3600 мкг пантотената/г продуцируемых клеток. Количество кобальта, подаваемого на единицу продуцируемых клеток, было снижено до диапазона 62,0-99,2 мкг кобальта/г продуцируемых клеток. Удельная скорость поглощения СО составила 0,325-0,4 ммоль/г клетокмин. Отношение молей подаваемого Н 2 к сумме удвоенного количества молей превращенного СО и утроенного количества молей превращенного СО 2 составило 0,875. Пример 4. Выработка этанола в лабораторных CSTRS с ограничением пантотената. Лабораторный ферментационный биореактор New Brunswick Scientific Bioflo II работал как прямоточный CSTR (без рециркуляции клеток) с использованием С. ljungdahlii, штамм С-01, АТСС 55988,для выработки этанола из СО, СО 2 и Н 2 при ограничении пантотенатом. Подаваемый газ содержал 63,3%- 14006106 Н 2, 31,4% СО и 5,3% С 2 Н 6 (газ сравнения); продолжительность удержания газа при подаче составила 27 мин. Жидкую среду, содержащую избыток солей и микроэлементов и ограниченное количество пантотената, подавали в 1,55-литровый реактор при продолжительности удержания жидкости 31,4 ч. рН составляла 4,6-4,7, а скорость перемешивания 650 об/мин. В этих условиях превращение СО составило 98%,превращение Н 2 - 83%, а концентрация клеток 1,5-2,0 г/л. Этанол вырабатывался с концентрацией 15-19 г/л, ацетат - с концентрацией 1,5 г/л. Производительность выработки этанола находилась в диапазоне от 11,5 до 14,5 г/лдень. При анализе параметров выработки этанола ограничение пантотенатом наблюдалось при подаче пантотената продуцируемым клеткам 17,7-23,6 мкг пантотената/г продуцируемых клеток. Сравните этот коэффициент с 2250-3600 мкг пантотената/г продуцируемых клеток и 1575-3150 мкг пантотената/г продуцируемых клеток в примере 3, где вырабатывалась уксусная кислота. Количество кобальта, подаваемое на единицу продуцируемых клеток, составило 5000-6000 мкг кобальта/г продуцируемых клеток, значительно более высокий уровень, чем в примере 3, в котором гарантированно отсутствовало ограничение кобальтом. Удельная скорость поглощения СО составила 0,23-0,30 ммоль/г клетокмин. Отношение подаваемого Н 2 к сумме удвоенного количества превращенного СО и утроенного количества превращенного СО 2 составило 1,03, а парциальное давление Н 2 в отходящем газе составило 0,55-0,64 атм. Вероятно,или избыток Н 2, или ограниченное количество пантотената обусловило выработку этанола. Ограничение пантотената для выработки этанола было также продемонстрировано в другом лабораторном реакторе New Brunswick Scientific Bioflo II, работающем с рециркуляцией клеток при использовании С. ljungdahlii, штамм С-01 АТСС 55988. В этот реактор подавали газ, содержащий 61,7% Н 2,30,6% СО и 5,2% С 2 Н 6 (газ сравнения) при продолжительности удержания газа 12,3 мин. Жидкую среду,содержащую ограниченное количество пантотената и избыток солей и микроэлементов, подавали в 2,4 литровый реактор при продолжительности удержания жидкости 24,8 ч. Рециркуляцию клеток проводили с использованием мембраны из полых волокон, и продолжительность удержания клеток составляла 69 ч. рН составляла 4,6, а скорость перемешивания 650 об/мин. В этих условиях превращение СО составило 90%, превращение Н 2 - 53%, а концентрация клеток 2,5 г/л. Этанол вырабатывался с концентрацией 18 г/л, ацетат - с концентрацией 3 г/л. Производительность выработки этанола составила 17,4 г/лдень. При анализе параметров выработки этанола (табл. 2) подача пантотената на единицу продуцируемых клеток составила 8,08 мкг пантотената/г продуцируемых клеток. Опять-таки, ограничение пантотената было обеспечено за счет работы системы при уровне пантотената намного меньшем, чем требуется для выработки ацетата. Количество кобальта, подаваемое на единицу продуцируемых клеток, составило 3960 мкг кобальта/г продуцируемых клеток. Удельная скорость поглощения СО составила 0,33 ммоль/г клетокмин. Отношение подаваемого Н 2 к сумме удвоенного количества превращенного СО и утроенного количества превращенного СО 2 составило 1,14, а парциальное давление Н 2 в отходящем газе составило 0,60-0,65 атм. Избыток Н 2 мог бы быть причиной выработки этанола, однако, высокое содержание СО 2 в отходящем газе (0,14 атм.) показывает, что рост был ограничен пантотенатом. В другом опыте в культуру С. ljungdahlii, штамм ERI2, подавали 1500-3600 мкг пантотената/г продуцируемых клеток во время выработки уксусной кислоты из СО, СО 2 и Н 2, что является условием, когда система не ограничена пантотенатом (или любым другим ограничивающим фактором, кроме возможности переноса газа в культуру), и этанол не был обнаружен в потоке продукта. Во время ограничения пантотенатом для выработки этанола из СО, СО 2 и Н 2 в С. ljungdahlii, штамм С-01 подавали 8-24 мкг пантотената/г продуцируемых клеток при поддержании всех других питательных веществ в избытке. В этих условиях штамм С-01 вырабатывал 15-19 г/л этанола и 1,5-3,0 г/л ацетата. Пример 5. Выработка этанола в лабораторных CSTRS с ограничением кобальтом. Лабораторный ферментационный биореактор New Brunswick Scientific Bioflo II работал как прямоточный CSTR (без рециркуляции клеток) с использованием С. ljungdahlii, штамм С-01, АТСС 55988,для выработки этанола из СО, СО 2 и Н 2 при ограничении кобальтом. Подаваемый газ содержал 60% Н 2,35% СО и 5% СН 4 (газ сравнения); продолжительность удержания газа при подаче составляла 14 мин. Жидкую среду, содержащую избыток солей, витаминов и микроэлементов и ограничивающее количество кобальта, подавали в 2,5-литровый реактор при продолжительности удержания жидкости 40 ч. рН составляла 4,9, а скорость перемешивания 650 об/мин. В этих условиях превращение СО составило 91%,превращение Н 2 изменялось от 20 до 80%, но номинально составляло 55%. Этанол вырабатывался с концентрацией 26 г/л, ацетат - с концентрацией 4 г/л, а концентрация клеток составляла 2,5 г/л. Производительность выработки этанола составила 15,6 г/лдень. При анализе параметров выработки этанола подача пантотената к продуцируемым клеткам составила 15,2 мкг пантотената/г продуцируемых клеток. Этот уровень настолько низок, что ограничение кобальтом может не иметь преимущества перед ограничением пантотенатом. Ограничение кобальтом наблюдалось при работе с количеством кобальта 33,3 мкг кобальта/г продуцируемых клеток, т.е., при уровне, который в 100 раз меньше, чем используется в реакторах без ограничения кобальтом. Отношение подаваемого Н 2 к сумме удвоенного количества превращенного СО и утроенного количества превращенного СО 2 составило 0,94. Удельная скорость поглощения СО составила 0,37 ммоль/г клетокмин.- 15006106 Ограничение кобальтом для выработки этанола было также продемонстрировано в CSTR с рециркуляцией клеток, использующем С. ljungdahlii, штамм С-01 АТСС 55988. Этот опыт был проведен для демонстрации ограничения кобальтом в присутствии избытка пантотената, в противоположность предыдущему опыту в этом примере. В лабораторный ферментационный биореактор New Brunswick ScientificBioflo 2000 с 0,2-мкм мембраной из полых волокон для рециркуляции клеток подавался газ, содержащий 60% Н 2, 35% СО и 5% СН 4 (газ сравнения) при продолжительности удержания газа 5 мин. Жидкую среду, содержащую избыток солей, витаминов и микроэлементов и, опять-таки, ограничивающее количество кобальта, подавали в 1,2-литровый реактор при продолжительности удержания жидкости 16 ч. рН составляла 5,1, а скорость перемешивания 825 об/мин. Продолжительность удержания клеток в этомCSTR с полыми волокнами для рециркуляции клеток составляла 40 ч. В этих условиях превращение СО составило 83%, превращение Н 2 - 50%, а концентрация клеток 4,2 г/л. Этанол вырабатывался с концентрацией 18 г/л, ацетат - с концентрацией 4 г/л. Производительность выработки этанола составила 27 г/лдень. При анализе параметров выработки этанола в этом реакторе (табл. 2) подача пантотената на единицу продуцируемых клеток составила 85,7 мкг пантотената/г продуцируемых клеток, т.е., в 5,5 раз больше, чем в предыдущем опыте в этом примере. Ограничение кобальтом наблюдалось при работе с 47,6 мкг кобальта/г продуцируемых клеток. Отношение подаваемого Н 2 к сумме удвоенного количества превращенного СО и утроенного количества превращенного СО 2 составило 1,03, а парциальное давление Н 2 в отходящем газе составило 0,60 атм. Опять-таки, избыток Н 2 мог бы быть причиной выработки этанола,однако высокое содержание СО 2 в отходящем газе (0,1-0,15 атм.) показывает, что рост был ограничен кобальтом. Удельное поглощение СО составило 0,50 ммоль/г клетокмин. Пример 6. Выработка этанола в лабораторных CSTRS при работе с избытком СО. Реактор высокого давления AUTOCLAV (Buchi) работал как CSTR с циркуляцией культуры и рециркуляцией клеток при использовании С. ljungdahlii, штамм С-01, для выработки этанола из СО, СО 2 и Н 2 в присутствии избытка СО в течение периода 50 ч. Реактор работал при 172 кПа, а подаваемый газ содержал 57% Н 2, 36% СО и 6% С 2 Н 6. Продолжительность удержания газа была переменной, но номинально составляла 3,0 мин. Жидкую среду, содержащую избыток солей, витаминов (включая пантотенат) и микроэлементов, подавали в 600-мл реактор при продолжительности удержания жидкости 8,2 ч. Продолжительность удержания клеток, полученная путем пропускания эффлюента из реактора через керамический фильтр с полыми волокнами, составляла 18,5 ч. рН составляла 4,5, скорость перемешивания 450 об/мин, а скорость рециркуляции жидкости 1,5- 2,0 л/мин. В этих условиях превращение газов было переменным, но превращение СО номинально составляло 72%, а превращение Н 2 номинально составляло 12%. Концентрация клеток была 2,7 г/л. Этанол вырабатывался с концентрацией 9,9 г/л, а ацетат - с концентрацией 2,6 г/л. Производительность выработки этанола составила 29,0 г/лдень. При анализе параметров выработки этанола подача пантотената на единицу продуцируемых клеток составила 978 мкг пантотената/г продуцируемых клеток. Этот уровень достаточно высок для гарантии того, чтобы концентрация пантотената не была ограничивающей. Количество кобальта, подаваемое на единицу продуцируемых клеток, 836 мкг кобальта/г продуцируемых клеток, также показывает, что концентрация кобальта не была ограничивающей. Отношение подаваемого Н 2 к сумме удвоенного количества превращенного СО и утроенного количества превращенного СО 2 составило 1,09, а парциальное давление Н 2 составило 1,6 атм. Высокое содержание СО 2 в отходящем газе (0,5 атм.) показывает, что избыток Н 2 не вызывал выработку этанола. Удельная скорость поглощения СО составила 1,34 ммоль/г клетокмин, т.е. уровень, который обеспечивает избыток СО как способ выработки этанола. Технология использования избытка СО для выработки этанола также была продемонстрирована в другом опыте с С. ljungdahlii, штамм С-01, в реакторе AUTOCLAV (Buchi), также с рециркуляцией клеток и с циркуляцией культуры, в течение периода 24 ч. В этом опыте в 600-мл реактор подавался газ,содержащий 15,8% Н 2, 36,5% СО, 38,4% N2 и 9,3% СО 2 при продолжительности удержания газа 1,4 мин. Давление в реакторе поддерживалось при 275 кПа. Жидкую среду, содержащую избыток солей, витаминов и микроэлементов, подавали при продолжительности удержания жидкости 4,8 ч, а продолжительность удержания клеток, полученная путем пропускания эффлюента из реактора через керамический фильтр с полыми волокнами, составляла 19,2 ч. рН составляла 4,5, скорость перемешивания 1000 об/мин,а скорость рециркуляции жидкости 0,4-0,5 галлонов в минуту. В этих условиях превращение СО составило 71,6%, а превращение Н 2 составило 11,8%. Концентрация клеток была 7,1 г/л, этанол вырабатывался с концентрацией 12,0 г/л, а ацетат - с концентрацией 2,7 г/л. Производительность выработки этанола составила 60 г/лдень. При анализе параметров выработки этанола (табл. 2) подача пантотената на единицу продуцируемых клеток составила 294 мкг пантотената/г продуцируемых клеток. Этот уровень намного выше минимального уровня, вызывающего выработку этанола вследствие ограничения пантотенатом. Количество кобальта, подаваемое на единицу продуцируемых клеток, составило 735 мкг кобальта/г продуцируемых клеток, также на уровне, обеспечивающем избыток кобальта. Отношение подаваемого Н 2 к сумме удвоенного количества превращенного СО и утроенного количества превращенного СО 2 составило 0,3. Ско- 16006106 рость поглощения СО составила 0,67 ммоль/г клетокмин, т.е. уровень, который снова обеспечивает избыток СО как фактор выработки этанола. Пример 7. Выработка этанола в присутствии избытка Н 2. Лабораторный ферментационный биореактор New Brunswick Scientific Bioflo работал как прямоточный CSTR (без рециркуляции клеток) с использованием С. ljungdahlii, штамм С-01, АТСС 55988, для выработки этанола из СО, СО 2 и Н 2 в присутствии избытка Н 2. Подаваемый в реактор газ содержал 77% Н 2, 19% СО и 4% СН 4 (газ сравнения); продолжительность удержания газа при подаче составляла 30 мин. Жидкую среду, содержащую избыток солей, витаминов и микроэлементов, подавали в реактор при продолжительности удержания жидкости 36 ч. рН составляла 5,0, а скорость перемешивания 1000 об/мин. В этих рабочих условиях превращение СО составило 97-99%, превращение Н 2 60-80%. Концентрация клеток составляла 0,8-1,0 г/л, этанол вырабатывался с концентрацией 10 г/л, а ацетат - с концентрацией 3,3 г/л. Производительность выработки этанола составила 6,7 г/лдень. При анализе параметров выработки этанола подача пантотената на единицу продуцируемых клеток составила 900-1125 мкг пантотената/г продуцируемых клеток, что гарантирует избыток пантотената. Подобным образом, количество кобальта, подаваемое на единицу продуцируемых клеток, составило 9911239 мкг кобальта/г продуцируемых клеток, что также гарантирует избыток кобальта. Удельная скорость поглощения СО составила 0,28-0,35 ммоль/г клетокмин, т.е. такой уровень СО, который не вызывает выработку этанола. Отношение молей подаваемого Н 2 к сумме удвоенного количества молей превращенного СО и утроенного количества молей превращенного СО 2 составило 1,96, т.е., коэффициент выше 1,0, означающий присутствие избытка Н 2, который может контролировать выработку этанола. Парциальное давление Н 2 в отходящем газе составило 0,70-0,87 атм, а отношение парциального давления Н 2 к парциальному давлению СО 2 в отходящем газе составило 65. Таким образом, реактор вырабатывал этанол благодаря присутствию избытка Н 2. Во втором опыте реактор высокого давления AUTOCLAV (Buchi) работал как CSTR с циркуляцией культуры и рециркуляцией клеток при использовании С. ljungdahlii, штамм С-01, для выработки этанола из СО, СО 2 и Н 2 в присутствии избытка Н 2. Подаваемый в реактор газ содержал 81% Н 2, 16% СО и 3% СН 4 (газ сравнения); продолжительность удержания газа при подаче составила 2,21 мин. Жидкую среду, содержащую избыток солей, витаминов и микроэлементов, подавали в реактор при продолжительности удержания жидкости 8,97 ч. Продолжительность удержания клеток составляла 22,7 ч, рН 4,5 и скорость перемешивания 800 об/мин. В этих рабочих условиях превращение СО составило 91,5%, а превращение Н 2 43,4%. Концентрация клеток составляла 5,5 г/л, а концентрация ацетата 2,85 г/л. Производительность выработки этанола в реакторе составила 215-240 г/лдень. При анализе параметров выработки этанола подача пантотената на единицу выработки клеток составила 46 мкг пантотената/г продуцируемых клеток, что может означать ограничение пантотенатом. Количество кобальта, подаваемое на единицу продуцируемых клеток, составило 460 мкг кобальта/г продуцируемых клеток, что гарантирует избыток кобальта. Удельная скорость поглощения СО составила 1,68 ммоль/г клетокмин, т.е., уровень, который мог бы означать присутствие избытка СО, если бы не высокая скорость поглощения Н 2 4,14 ммоль/г клетокмин, которая означает, что ингибирование субстратом, влияющее на поглощение Н 2, не происходило. Отношение молей подаваемого Н 2 к сумме удвоенного количества молей превращенного СО и утроенного количества молей превращенного СО 2 составило 5,67, т.е. намного выше коэффициента 1,0, означающего присутствие избытка Н 2. Парциальное давление Н 2 в отходящем газе составило 2,61 атм, а отношение парциального давления Н 2 к парциальному давлению СО 2 в отходящем газе составило 10,9. Таким образом, реактор вырабатывал этанол благодаря присутствию избытка Н 2. Суммарное сравнение параметров способа и результаты примеров 3-7 показаны в табл. 2, приведенной ниже. Пример 8. Сдвиг в соотношении продуктов в штаммах С. ljungdahlii ERI2, С-01 И РЕТС при использовании различных составовсреды. Способы по данному изобретению могут быть использованы для любого из штаммов С. ljungdahlii. Результаты опытов по изменению среды, использующих штаммы ERI2, С-01 и РЕТС, показаны в табл. 3,приведенной ниже. Целью этих опытов была демонстрация того, что на каждый из штаммов может быть оказано воздействие, обеспечивающее сдвиг от выработки уксусной кислоты к выработке этанола лишь за счет изменения среды. Так, в культуру подавали избыток питательных веществ (включая пантотенат и кобальт) для выработки уксусной кислоты в качестве доминирующего продукта, а затем ограничивали пантотенат или кобальт для выработки этанола в качестве доминирующего продукта. Следует подчеркнуть, что единственной целью этих опытов было показать, что изменение среды может привести к сдвигу в соотношении продуктов для каждого из штаммов. Таким образом, достижение высоких концентраций продуктов и производительностей не было целью этих опытов. Реактор работал как прямоточный CSTR (без рециркуляции клеток) в каждом опыте для различных культур. Продолжительность удержания газа была номинально установлена на 50 мин, продолжительность удержания жидкости была номинально установлена на 40 ч, а скорость перемешивания была но- 17006106 минально установлена на 1000 об/мин. Эти условия были выбраны для возможности сравнения штаммов,а не для достижения высоких производительностей. Как отмечено в табл. 3, штамм ERI2 был подвергнут пяти изменениям в среде, которые сдвигали соотношение продуктов вперед и назад от уксусной кислоты в качестве доминирующего продукта к этанолу в качестве доминирующего продукта. Было продемонстрировано ограничение пантотената и ограничение кобальта для выработки этанола этим штаммом. Выработку штамма С-01 сдвигали трижды, используя изменения среды, также продемонстрировав ограничение пантотената и ограничение кобальта в качестве механизма для выработки этанола. Выработку штамма РЕТС сдвигали только один раз, в виде выработки этанола за счет ограничения кобальтом. Каждый из штаммов показал более высокое превращение Н 2 при выработке уксусной кислоты, чем при выработке этанола в качестве доминирующего продукта. Это обусловлено тем, что уксусная кислота вырабатывается в условиях ограничения массопереноса (ограничения количества газа, подаваемого в культуру), в то время как этанол вырабатывается при ограничении питательных веществ и, следовательно, избытке газа, что может отрицательно повлиять на превращение газа. Малые количества ацетата всегда присутствуют в потоке продукта, когда доминирующим продуктом является этанол. Однако, когда доминирующим продуктом является уксусная кислота, этанол обычно не присутствует в измеримых концентрациях. При сдвиге доминирующих продуктов от этанола к уксусной кислоте путем изменения питательных веществ было показано, что очень трудно устранить все следы этанола. Полное устранение этанола происходит только через несколько недель непрерывной работы в среде, улучшающей выработку уксусной кислоты. Пример 9. Работа в устойчивом состоянии с/без рециркуляции клеток. Конечной целью промышленной выработки этанола из СО, СО 2 и Н 2 является достижение высоких устойчивых концентраций этанола и одновременно - получение высоких соотношений этанола и ацетата в конечном продукте и высокой производительности. Данные устойчивого состояния для выработки этанола из СО-обогащенного газа, содержащего 20% Н 2, 65% СО, 10% СО 2 и 5% СН 4, с использованием штамма С. ljungdahli C-01 в прямоточном (без рециркуляции клеток) CSTR приведены в табл. 4. В этой таблице GRT означает продолжительность удержания газа (жидкостный объем/скорость течения входящего газа), LRT означает продолжительность удержания жидкости (жидкостный объем/скорость течения жидкости) и XRT означает продолжительность удержания клеток (среднее время, которое клетки проводят в реакторе). Как отмечено в табл. 4, были получены концентрации этанола от 17,5 до 33 г/л и производительность выработки этанола в диапазоне от 14,4 до 21,1 г/лдень. Подобные результаты показаны для выработки этанола из газа, не столь обогащенного СО. Газ, используемый в опыте с С. ljungdahli C-01 без рециркуляции, результаты которого представлены в табл. 5,содержит 16% Н 2, 27% СО, 6% СО 2 и 51% N2. При помощи этого газа были получены концентрации этанола в диапазоне от 11 до 26 г/л, с 2,0-5,0 г/л ацетата в качестве вторичного продукта. Производительность выработки этанола составила от 11,1 до 20,1 г/лдень.Концентрация клеток приведена в табл. 5 на основе сухого веса клеток. Наконец, данные устойчивого состояния для превращения газа, содержащего 50% Н 2, 45% СО и 5% СН 4, в CSTR с рециркуляцией клеток при использовании С. ljungdahli 0-52 (инвентарный номер АТСС 55989) показаны в табл. 6. Были получены концентрации этанола 18-23,5 г/л и концентрации ацетата 3,05,7 г/л. Производительность выработки этанола составила от 21,1 до 39,0 г/лдень. Пример 10. Высокая производительность выработки этанола в CSTR с рециркуляцией клеток и под давлением. Реактор высокого давления AUTOCLAV (Buchi) работал как CSTR с циркуляцией культуры и рециркуляцией клеток при использовании С. ljungdahlii, штамм С-01, для выработки этанола из СО, СО 2 и Н 2. Реактор работал при 207 кПа, а подаваемый газ содержал 62% Н 2, 31% СО и 2% С 2 Н 6. Продолжительность удержания газа составляла 1,14 мин (на основе атмосферного давления), при действительной продолжительности удержания газа 3,5 мин. Жидкую среду, содержащую избыток солей, витаминов и микроэлементов, подавали в 600-мл реактор при продолжительности удержания жидкости 3,6 ч. рН составляла 4,5, а скорость перемешивания 825 об/мин. В этих условиях концентрация клеток составила 8 г/л, превращение СО 90%, а превращение Н 2 40 %. Поток продукта содержал 20 г/л этанола и 2,75 г/л ацетата. Производительность выработки этанола составила 150 г/лдень. Другой реактор высокого давления AUTOCLAV (Buchi), работающий как CSTR с циркуляцией культуры и рециркуляцией клеток при использовании С. ljungdahlii, штамм С-01, работал при 6 атм., а подаваемый в него синтез-газ содержал 55 % Н 2, 30 % СО, 5 % СН 4 и 10 % СО 2. Продолжительность удержания газа составляла 1 мин (на основе атмосферного давления), при действительной продолжительности удержания газа 6,0 мин. Жидкую среду, содержащую избыток солей, витаминов и микроэлементов, подавали в 600-мл реактор при продолжительности удержания жидкости 1,62 ч. Продолжительность удержания клеток составляла 24 ч, рН 4,5, а скорость перемешивания 800 об/мин. В этих условиях концентрация клеток составила 2,0 г/л, превращение СО 95%, а превращение Н 2 60%. Поток продукта содержал 25 г/л этанола и 3 г/л ацетата. Производительность выработки этанола составила 369 г/лдень. Пример 11. Запуск из маточной культуры при избытке Н 2.- 18006106 Запуск с использованием однократной инокуляции из маточной культуры обеспечивает здоровый инокулят, не содержащий примесей, но не всегда бывает успешной сама процедура инокуляции из-за довольно низкой используемой плотности клеток, в особенности, если параметры технологического процесса, такие как скорость газа и скорость перемешивания, повышаются слишком быстро сразу после инокуляции. Запуск с использованием однократной инокуляции из маточной культуры описан в этом примере. Для получения маточных культур для инокуляции реактора выращивали культуры С. ljungdahlii, штамм С-01 (инвентарный номер АТСС 55988) в 150-мл сывороточных колбах на СО, СО 2 и Н 2 в обогащенной среде, содержащей 1 г/л дрожжевого экстракта и 1 г/л триптиказы, соли и витамины. Концентрация витаминов составляла 0,4 мл/л среды водного раствора, содержащего 50,5 мг/л пантотената кальция, 20,6 мг/л d-биотина и 50,6 мг/л тиамина-HCl. Колбы инкубировали при 37 С в вибрационном инкубаторе. Культуры выращивали до экспоненциальной фазы роста, определяемой визуально. При каждой инокуляции около 90 мл маточной культуры переносили из сывороточных колб в 1 л среды, получая 9 %-ную инокуляцию (по объему). Успешная инокуляция описана ниже. Указанная процедура может повторяться несколько раз до получения успешной инокуляции. Для получения успешной инокуляции 90 мл/л инокулята добавляли в 1-литровую порцию основной питательной среды (показанной в табл. 1), содержащей 0,4 мл/л витаминов и солей (t=0). Скорость перемешивания составляла 240 об/мин, рН 5,3, температура 38,5 С и продолжительность удержания газа (при постоянном потоке газа) 110 мин. Подаваемый газ содержал 62% Н 2, 31% СО и 7% С 2 Н 6. Через 13 ч (t=13 ч.) было отмечено некоторое превращение СО, а при t=23 ч скорость перемешивания увеличили с 240 об/мин до 300 об/мин. Продолжительность удержания газа снижали до 100 мин при t=27 ч, а дальнейшее снижение продолжительности удержания газа проделали при t=46 ч. Скорость перемешивания также повышали с приращениями 100 об/мин при t=28 ч, 59 ч, 72 ч и 85 ч. При t=110 ч система работала при продолжительности удержания газа 80 мин и скорости перемешивания 600 об/мин. Концентрация клеток составила 0,5 г/л, а превращение СО - 35 %. Превращения Н 2 все еще не было, но малые количества этанола и ацетата (1 г/л каждого) накопились в этой порции культурального бульона. Все усилия до этого времени были направлены на рост культуры в реакторе. Течение среды с использованием тех же концентраций, что и в основной питательной среде, начали со скоростью 0,4 мл/мин при t=120 ч. Затем запустили программу номинальных приращений скорости газа, скорости перемешивания и скорости среды при осторожном поддержании избытка Н 2 в системе. При t=210 ч концентрация этанола составила 17 г/л, концентрация ацетата 1 г/л, концентрация клеток 1,6 г/л, превращение СО около 100% и превращение Н 2 составило 90%. Производительность выработки этанола достигла 11,4 г/лдень. Программа постепенного увеличения скорости газа была снова запущена. Были совместно увеличены количества витаминов (см. табл. 1) с доведением скорости введения витаминов до 0,7 мл/л среды. При t=610 ч реактор вырабатывал 20 г/л этанола и около 2 г/л ацетата. Превращение СО составило около 100%, а превращение Н 2 - 85%. Производительность выработки этанола достигла 14 г/лдень. Пример 12. Запуск с использованием инокулята из имеющегося CSTR. Запуск CSTR с использованием непрерывной подачи инокулята из имеющегося CSTR более быстрый и надежный, чем запуск из порционных колб маточной культуры. CSTR, содержащий изолят С.ljungdahlii, штамм С-01 (инвентарный номер АТСС 55988), который почти прекратил выработку этанола и продуцировал 2-3 г/л этанола, 7-8 г/л ацетата и около 0,3 г/л бутанола в виде жидкофазных продуктов,заново запустили с использованием непрерывной подачи инокулята из имеющегося CSTR.CSTR, из которого получали инокулят, вырабатывал около 17 г/л этанола и 1-2 г/л ацетата, работая при продолжительности удержания газа 25 мин, продолжительности удержания жидкости 32 ч, скорости перемешивания 650 об/мин, температуре 38,5 С и рН 4,66. Концентрация клеток составила 1,7 г/л, превращение СО составило по существу 100 %, а превращение Н 2 85 %. Когда начали непрерывную подачу инокулята (t=0), в это же время снизили скорость перемешивания до 500 об/мин, а продолжительность удержания газа установили на 38 мин. Эффлюент из реактора производства (0,5 мл/мин) служил в качестве непрерывно подаваемого инокулята для инокулируемогоCSTR, при непрерывной инокуляции в течение нескольких часов. Через t=5 ч (5 ч после начала непрерывной инокуляции) было отмечено превращение газа, и скорость перемешивания увеличили до 700 об/мин. Непрерывную подачу инокулята прекратили через t=28 ч. Превращение газов равномерно улучшалось, позволяя осуществлять равномерные повышения скорости газа (снижая продолжительности удержания газа) и повысить скорость перемешивания до 750 об/мин. Через t=30 ч превращение СО составило 95%, а превращение Н 2 80%. Концентрация этанола составила 13 г/л, концентрация ацетата 1,5 г/л, и эти количества были устойчивыми значительно дольше 100 ч. За это время производительность выработки этанола составила 10-15 г/лдень. Пример 13. Восстановление при серьезном нарушении технологического процесса. В CSTR с рециркуляцией клеток, содержащем С. ljungdahlii, штамм С-01, в который непрерывно подавали газ и жидкие питательные вещества и который вырабатывал 15-35 г/л этанола и 0-5 г/л ацетата- 19006106 в устойчивом состоянии (см., в частности, пример 1), произошел сбой из-за непредвиденных изменений в условиях технологического процесса, например, механических повреждений в реакторе. Сбой в реакторной системе может быть незначительным, таким как кратковременное увеличение скорости газа, которое вызывает кратковременное ингибирование субстратом, или значительным, таким как длительное увеличение скорости газа, которое в конечном счете приводит к повышенной выработке уксусной кислоты и более серьезному ингибированию вырабатываемой молекулярной уксусной кислотой. Кратковременные сбои легко исправляются путем простого регулирования нарушенных параметров(например, снижения скорости газа до первоначального уровня) и наблюдения за прогрессом реактора,чтобы удостовериться, что сбой не привел к долговременным проблемам. Однако ингибирование вырабатываемой молекулярной уксусной кислотой представляет собой более серьезную проблему. Если культурой вырабатывается избыток молекулярной уксусной кислоты в результате длительного ингибирования субстратом, избыточной подачи питательных веществ, накопления СО 2 или механических повреждений различного характера, в первую очередь должна быть устранена проблема, которая привела к избыточной выработке уксусной кислоты. Затем избыток уксусной кислоты, который быстро приводит к ингибированию продуктом, удаляют из системы путем увеличения скорости жидкости для вымывания уксусной кислоты (но, к сожалению, и этанола) из системы. Когда уровень ацетата составит 3-5 г/л, скорость жидкости восстанавливают и возвращают реактор в условия избыточной подачи Н 2 или ограничения витаминами или кобальтом (с рециркуляцией или без рециркуляции клеток). Возврат реактора в прежнее состояние включает снижение скорости газа для предотвращения ингибирования субстратом и/или скорости перемешивания до того, как начнется вымывание клеток и лизис. Затем увеличивают скорость перемешивания или скорость газа, как описано в примере 1. В данном примере CSTR с рециркуляцией клеток, содержащий С. ljungdahlii, штамм С-01, который вырабатывал этанол и уксусную кислоту из СО, СО 2 и Н 2, начал вырабатывать уксусную кислоту в ответ на механическую неисправность. В 2100-мл реактор подавали газ, содержащий 62% Н 2, 31% СО и 7% С 2 Н 6, при продолжительности удержания газа 15 мин. Реактор работал при скорости перемешивания 600 об/мин и рН 4,86. Продолжительность удержания жидкости составляла 23 ч, а продолжительность удержания клеток 68 ч. Раствор витамина В (водная смесь 50,5 мг/л пантотената кальция, 20,6 мг/л d-биотина и 50,6 мг/л тиамина-HCl) присутствовал в жидкой питательной среде, содержащей соли и витамины, при концентрации 0,4 мл витаминного раствора на литр среды (см. табл. 2). Концентрация этанола упала до 7 г/л, в то время как концентрация ацетата выросла до 7 г/л, создав условия, которые не являются ни стабильными для работы реактора, ни экономичными для производства этанола. Концентрация клеток составила 2,4 г/л, превращение СО 85% и превращение Н 2 25%. Стратегия, используемая для восстановления реактора, включала сначала резкое снижение скорости подачи газа в реактор, а затем постепенное восстановление реактора в присутствии избытка Н 2. Скорость подачи жидкости в реактор для предотвращения ингибирования продуктом в данном примере не снижали, так как концентрация ацетата не была слишком большой. Вместо этого концентрации ацетата позволили постепенно снижаться до неингибирующего уровня при снижении скорости течения газа и последующей работе в присутствии избытка Н 2. Подробная процедура восстановления реактора описана ниже. Рециркуляцию клеток прекратили и резко снизили скорость газа на 70% до продолжительности удержания газа 62 мин, при этом лишь незначительно изменив продолжительность удержания жидкости с 23 до 30 ч (t=0). Концентрацию витаминов в среде не изменяли. При этом изменении в скорости газа превращение СО увеличилось до 98%, а превращение Н 2 до 80%. Более важно то, что в системе появился избыток Н 2, о чем свидетельствовало снижение содержания СО 2 в отходящем газе с 19 до 5%. При появлении избытка Н 2 концентрация ацетата упала, а концентрация этанола увеличилась. Например, черезt=66 ч (66 ч после прекращения рециркуляции клеток) концентрация ацетата упала до 4 г/л, а концентрация этанола несколько поднялась до 7,5 г/л. Присутствие избытка Н 2 (и снижение концентрации ацетата) позволило осуществить последующее увеличение скорости газа, сначала медленно, а потом быстрее. Через t=215 ч продолжительность удержания газа составила 29 мин, концентрация этанола 12 г/л и концентрация ацетата 3 г/л. Производительность выработки этанола составила 8 г/лдень. СО 2 присутствовал в отходящем газе с концентрацией 6%,превращение СО составило 98% и превращение Н 2 80%. Через t=315 ч концентрация этанола составила 16 г/л, а концентрация ацетата 4 г/л, также при хорошей степени превращения газа и продолжительности удержания газа 20 мин. Производительность выработки этанола составила 11 г/лдень. Через t=315 ч концентрация этанола достигла 20 г/л, при содержании ацетата 3,5-4 г/л. Производительность выработки этанола составила 16 г/лдень. Продолжительность удержания газа упала до 16 мин, а превращение СО и Н 2 составило 95 и 73%, соответственно. Эти условия поддерживались почти 200 ч непрерывной работы,что показало восстановление способности реакторной системы вырабатывать этанол и, по существу, сохранение прежних рабочих условий. Пример 14. Способ производства этанола с избыточной подачей СО. Простой опыт был проведен в реакторе-баке высокого давления, непрерывного действия, с перемешиванием, использующем рециркуляцию клеток, для демонстрации сдвига от выработки уксусной ки- 20006106 слоты к выработке этанола благодаря присутствию высоких концентраций СО. Перед проведением опыта реактор, содержащий С. ljungdahlii, штамм С-01, работал под давлением 138 -172 кПа, где подаваемый газ содержал 57% Н 2, 36% СО и 7% С 2 Н 6. Продолжительность удержания газа составляла менее 2 мин,продолжительность удержания жидкости 38 ч, продолжительность удержания клеток 28 ч, скорость перемешивания 600 об/мин и температура 38 С. В этих условиях превращение СО было переменным и в среднем составляло 85%; превращение Н 2 было переменным и в среднем составляло 20%. Концентрация клеток составляла около 2,5 г/л, а поток продукта содержал 9 г/л этанола и 3 г/л ацетата. На первом этапе для подготовки опыта увеличили продолжительность удержания газа для обеспечения отсутствия избытка СО. Давление поддерживали при 159-166 кПа. рН контролировали достаточно долго, чтобы убедиться в ее стабильности в нормальном рабочем диапазоне 4,5-4,6. Затем чистый СО смешали с регулярно подаваемым газом для получения состава газа 47% Н 2, 47% СО и 6% С 2 Н 6, при продолжительности удержания газа 2,3 мин. Затем рН в реакторе, состав отходящего газа и поток продуктов наблюдали во времени. Табл. 7 показывает изменения рН и состав продуктов во времени после добавления избытка СО в систему. Через 30 мин после добавления СО рН в реакторе поднялась до 5,25 и соотношение в культуре сдвинулось до 1,54 г/л (0,0257 моль/л) ацетата к 1,12 г/л (0,0243 моль/л) этанола. Повышение рН произошло в результате превращения свободной уксусной кислоты в этанол. Это изменение сопровождалось снижением превращения СО с 91 до 71%. При уменьшении скорости циркуляции культуры с 1,5 л/мин до 0,6 л/мин. рН в реакторе упала, но концентрации этанола и ацетата сохранялись. Через 50 мин после введения СО концентрация этанола составила 11,29 г/л, а концентрация ацетата 1,75 г/л. В это время подачу избыточного СО прекратили, и концентрация этанола и рН начали падать, а концентрация ацетата - расти. Снижение рН было обусловлено превращением этанола в молекулярную уксусную кислоту. Таким образом, сдвиг этанол-уксусная кислота за счет подачи СО является обратимым. Пример 15. Рециркуляция воды для минимизации выработки ацетата. Рециркуляция используемой воды обратно в ферментационный биореактор после дистилляции с целью выделения этанола важна для минимизации выработки эффлюента и для максимизации выхода этанола, образуемого в реакторе, а также для ограничения выработки уксусной кислоты. Дистилляция оказалась наиболее экономичным способом для концентрирования 15-35 г/л этанола, полученного из реактора, до 95%-го этанола. Затем используется адсорбция при помощи молекулярных сит для дальнейшего концентрирования этанола до желаемой концентрации. При проведении дистилляции 95%-й этанол в воде образуется в виде дистиллята. Вода во время дистилляции вырабатывается как кубовый продукт. Кубовый продукт содержит уксусную кислоту из реактора, выработанную во время ферментации (3-5 г/л ацетата) и питательные вещества, неиспользованные во время ферментации или разрушенные воздействием тепла при дистилляции, такие как микроэлементы и другие минералы. Рециркуляция питательных веществ минимизирует количество эффлюента, который должен быть обработан, а также количество питательных веществ, которое впоследствии должно добавляться в ферментационный биореактор. Рециркуляция ацетата предотвращает образование дополнительной уксусной кислоты путем установления равновесия между этанолом и уксусной кислотой. Таким образом, при использовании рециркуляции воды уксусная кислота на выходе не образуется. Рециркуляция более 3-5 г/л ацетата может привести к ингибированию реактора уксусной кислотой. Таким образом, в результате рециркуляции воды вместе с ацетатом субстрат СО, СО 2 и Н 2 может превращаться в этанол в виде единственного продукта. Табл. 8 показывает результаты ферментации газа, содержащего 50% СО, 45% Н 2 и 5% СН 4 при использовании С. ljungdahlii, штамм 0-52, с рециркуляцией воды. В этих опытах пермеат после фильтрации через полые волокна, используемой для рециркуляции клеток, направляли на дистилляцию. После удаления этанола воду фильтровали через 0,2-мкм фильтр для удаления осажденных побочных продуктов. Фракция оборотной воды в общем количестве воды (в качестве среды), подаваемой в реактор, в этих опытах составляла от 25 до 100%. Опыт со 100% оборотной воды длился почти 500 ч или около 20 продолжительностей удержания жидкости. Из результатов со 100% оборотной воды видно, что уксусная кислота на выходе не вырабатывается. Фактически, в конечном счете было израсходовано небольшое количество уксусной кислоты. Производительность выработки этанола составила от 12 до 27 г/лдень. Пример 16. Двухступенчатая система CSTR с подачей пантотената на стадию роста. Правильная подача пантотената на стадию роста представляет собой переменную, которая должна оптимизироваться. Типичные результаты для реактора стадии роста с использованием С. ljungdahlii,штамм С-01, были описаны в пимерах 11 и 12, за исключением того, что в этом реакторе будет вырабатываться немного больше уксусной кислоты, поскольку на стадию роста подается дополнительное количество пантотената или кобальта для обеспечения выработки здоровой и стабильной культуры. Концентрация используемых витаминов составила 0,7-0,8 мл/л среды в виде водного раствора, содержащего 50,5 мг/л пантотената кальция, 20,6 мг/л d-биотина и 50,6 мг/л тиамина-HCl. CSTR стадии производства с рециркуляцией клеток получает эффлюент из реактора стадии роста и вырабатывает этанол в качестве доминирующего продукта. Концентрация пантотената, подаваемого в этот реактор, намного ниже, чем на стадии роста, всего 0,1-0,2 мл всех витаминов/л среды в виде водного раствора, содержащего 50,5 мг/л- 21006106 пантотената кальция, 20,6 мг/л d-биотина и 50,6 мг/л тиамина-HCl. Продолжительность удержания газа на стадии производства составляла 11-30 мин, продолжительность удержания жидкости составляла около 20 ч, продолжительность удержания клеток 30-50 ч, а скорость перемешивания 800-900 об/мин. рН составляла 5,0, а температура 38 С. По достижении реактором устойчивого состояния продолжительность удержания газа поддерживалась постоянной при 11 мин, продолжительность удержания жидкости была установлена на 19 ч, продолжительность удержания клеток была постоянной - 37 ч, а скорость перемешивания составляла 900 об/мин. Превращение СО в среднем составило 96%, а превращение Н 2 - в среднем 60%. Концентрация этанола установилась на 25-30 г/л, при этом также присутствовало 3 г/л ацетата. Производительность выработки этанола составила 31,6-37,9 г/лдень. Пример 17. Регулирование параметров ферментации для предотвращения акклиматизации к низкой ограничивающей концентрации пантотената кальция. Акклиматизацию культуры в ферментационном бульоне к низкой ограничивающей концентрации пантотената кальция предотвращают путем регулирования параметров ферментации (скорость газа, скорость жидкости, скорость перемешивания, парциальное давление Н 2), избегая существенных изменений в питательных веществах, вместо этого поддерживая сравнительно постоянную концентрацию подаваемых питательных веществ. Это осуществляют следующим образом. Во время запуска лабораторный CSTR New Brunswick Scientific Bioflo с С. ljungdahlii, штамм С 01, получал поток жидкой среды, содержащей витамины, микроэлементы и соли, необходимые для питания культуры. Концентрация пантотената в питательной среде составляла 20 мкг/л. Это концентрация,которая в сочетании с медленной скоростью подачи среды обеспечивает подачу более 100 мкг пантотената кальция на грамм вырабатываемых клеток (избыток пантотената) из-за низкой выработки клеток в биореакторе. Подобным образом, концентрация кобальта в среде составляла 1 млн-1, которая также обеспечивает избыток кобальта. Однако парциальное давление Н 2 в отходящем газе поддерживалось при избытке 0,55 атм путем подачи газа, не содержащего СО 2 и содержащего 63,3% Н 2, 31,4% СО и 5,3% С 2 Н 6,что обеспечило отношение Н 2 подаваемый/(2 СОпревр + 3 СO2 превр) больше 1, и путем осторожного регулирования скорости подачи газа и скоростей перемешивания, для достижения превращения СО более 95% и превращения Н 2 более 80%. По мере достижения этих высоких степеней превращения концентрация клеток увеличивается от исходного уровня около 0 г/л до 1,5 г/л. Поскольку концентрация пантотената во время запуска поддерживается постоянной, количество мкг пантотената на грамм продуцируемых клеток постепенно снижается до концентрации менее 15 мкг пантотената/г продуцируемых клеток, что является условием ограничения пантотенатом. Таким образом,по мере роста система переходит в условия ограничения пантотенатом. Высокие соотношения этанола и ацетата достигаются путем запуска с избытком Н 2. В альтернативе, на ранних стадиях запуска реактору дают возможность вырабатывать уксусную кислоту, а потом регулируют соотношение продуктов путем ограничения пантотената. Пример 18. Ограничение кобальта в реакторе. Культура С. ljungdahlii, штамм ERI2, получала 62-3500 мкг кобальта/г вырабатываемых клеток во время выработки уксусной кислоты из СО, СО 2 и Н 2, т.е., реактор не был ограничен кобальтом (или любым другим ограничивающим фактором, кроме возможности переноса газа в культуру), и этанол не обнаруживался в потоке продукта. Во время ограничения кобальтом для выработки этанола из СО, СО 2 и Н 2 в С. ljungdahlii, штамм С-01 подавали 33-48 мкг кобальта/г продуцируемых клеток при поддержании всех других питательных веществ в избытке. В этих условиях штамм С-01 вырабатывал 18-26 г/л этанола и около 4 г/л ацетата. Пример 19. Предотвращение акклиматизации к низкой ограничивающей концентрации кобальта. Акклиматизацию к низкой ограничивающей концентрации кобальта предотвращают путем регулирования параметров ферментации (скорость газа, скорость жидкости, скорость перемешивания, содержание СО 2), избегая существенных изменений в питательных веществах, вместо этого поддерживая сравнительно постоянную концентрацию подаваемых питательных веществ. Это осуществляют следующим образом. Во время запуска лабораторный CSTR New Brunswick Scientific Bioflo с С. ljungdahlii, штамм С 01, получал поток жидкой среды, содержащей витамины, микроэлементы и соли, необходимые для питания культуры. Концентрация кобальта в питательной среде составляла 75 млн-1. Это концентрация, которая в сочетании с медленной скоростью подачи среды обеспечивает подачу более 50 мкг кобальта на грамм вырабатываемых клеток (избыток кобальта) из-за низкой выработки клеток в биореакторе. Подобным образом, концентрация пантотената в среде составляла 20 мкг/л, которая также обеспечивает избыток пантотената. Однако парциальное давление Н 2 в отходящем газе поддерживалось при избытке 0,55 атм. путем подачи газа, содержащего большие количества Н 2 и не содержащего СО 2, и путем осторожного регулирования скорости подачи газа и скоростей перемешивания, для достижения превращения СО более 95% и превращения Н 2 более 80%. По мере достижения этих высоких степеней превращения концентрация клеток увеличивается от исходного уровня около 0 г/л до 1,5 г/л. Поскольку концентрация кобальта во время запуска поддерживается постоянной, количество мкг кобальта на грамм продуцируемых клеток постепенно снижается до концентрации менее 50 мкг кобальта/г продуцируемых клеток, что- 22006106 является условием ограничения кобальтом. Таким образом, по мере роста система переходит в условия ограничения кобальтом. Высокий выход этанола достигается путем запуска с избытком Н 2 в подаваемом газе. В альтернативе, на ранних стадиях запуска реактору дают возможность вырабатывать уксусную кислоту, а потом регулируют соотношение продуктов путем ограничения кобальтом. Пример 20. Подача избытка водорода. Во время работы лабораторного реактора AUTOCLAV (Buchi), работающего как CSTR с рециркуляцией жидкости и рециркуляцией клеток, культура С. ljungdahlii получала избыток витаминов, микроэлементов и солей, необходимых для питания культуры. Реактор работал с избытком Н 2 в подаваемом газе, так что отношение молей Н 2 в подаваемом газе к сумме удвоенного количества молей превращенного СО и утроенного количества молей превращенного СО 2 составляло 5,67. Если это отношение не больше 1,0, избыток Н 2 не может присутствовать в реакторе, и выработка этанола не может происходить. Кроме того, парциальное давление Н 2 в отходящем газе составляло 2,61 атм, т.е., уровень, превышающий условие 0,4 атм для выработки этанола за счет избытка Н 2. Наконец, соотношение парциального давления Н 2 и парциального давления СО 2 в отходящем газе составило 10,88, т.е., уровень, превышающий 3,0 и обеспечивающий присутствие достаточного количества Н 2 для использования всего присутствующего углерода. В этих условиях реактор вырабатывал почти 26 г/л этанола и менее 3 г/л ацетата. Производительность выработки этанола составила более 200 г/лдень. Если какой-либо из вышеупомянутых критериев не выполняется, реактор не может вырабатывать этанол за счет избытка Н 2. Второй аспект избыточной подачи Н 2 заключается в том, что она приводит к дополнительному восстановлению ферредоксина, окисляемого гидрогеназой. Пример 21. Ослабление ингибирования субстратом. Лабораторный CSTR New Brunswick Scientific Bioflo, работающий при скорости перемешивания 800 об/мин, показал на выходе концентрацию СО 10%, хотя до этого он работал лишь с 5% СО в отходящем газе. Путем снижения скорости перемешивания до 600 об/мин ингибирование СО было устранено, и концентрация СО на выходе вернулась к 5%. Это привело к повышению поглощения Н 2, необходимому условию эффективного использования всего газа, подаваемого в реактор. Пример 22. Массоперенос. Пример избыточного массопереноса, ведущего к выработке этанола, представляет лабораторныйCSTR с рециркуляцией клеток, содержащий С. ljungdahlii, штамм ERI2, и работающий без ограничения питательными веществами или избытка Н 2 или СО в подаваемом газе. Т.е., пантотенат подается со скоростью более 100 мкг пантотената кальция на г продуцируемых клеток, и кобальт подается со скоростью более 100 мкг на г продуцируемых клеток. Н 2 присутствует в отходящем газе при 0,2 атм, а удельная скорость поглощения СО составляет менее 0,3 ммоль СО/г клетокмин. Скорость перемешивания 800 об/мин. В этих условиях культура вырабатывает только уксусную кислоту (в потоке продукта этанол отсутствует). Если быстро увеличить скорость перемешивания до 900 об/мин или увеличить скорость газа примерно на 10%, тогда этанол обнаруживается в потоке продукта, до тех пор, пока концентрация клеток увеличивается, поглощая газ, или до тех пор, пока культура не погибнет из-за ингибирования субстратом. Пример 23. Контроль ингибирования вырабатываемой уксусной кислотой. В лабораторном CSTR, вырабатывающем 8 г/л уксусной кислоты и 10 г/л этанола, продолжительность удержания жидкости снизили с 24 до 12 ч на период 36 ч в попытке вымыть из реактора уксусную кислоту, которая ограничивает способность культуры вырабатывать больше этанола. Все другие рабочие условия реактора и питательная среда остались неизменными. По окончании этого периода продолжительность удержания жидкости вернули к 24 ч и получили поток продукта, содержащий 3 г/л ацетата и 15-25 г/л этанола. Для устранения ингибирования продуктом потребовалось несколько попыток. В альтернативе можно добавить Н 2 в подаваемый газ для регулирования избытком Н 2, поскольку избыток СО 2 также может привести к преобладанию выработки уксусной кислоты над выработкой этанола. Эти модификации предотвращают избыточную выработку уксусной кислоты и, следовательно, предотвращают нежелательное соотношение продуктов и низкую производительность выработки этанола. Затем возобновляют использование избытка Н 2 в подаваемом газе или ограничивающей концентрации жидкофазного питательного вещества. Пример 24. Избыточная подача монооксида углерода. Культура С. ljungdahlii, штамм ERI2, получающая избыток питательных веществ (избыток пантотената и кобальта) и не получающая избытка Н 2 в подаваемом газе, имела удельную скорость поглощения СО 0,23-0,48 ммоль/гмин, и этанол не обнаруживался в потоке продукта. Однако когда С. ljungdahlii,штамм С-01 подобным образом получала избыток питательных веществ и не получала избытка Н 2 в подаваемом газе, но находилась в условиях, когда избыточная подача СО вызывала выработку этанола,удельная скорость поглощения СО составляла 0,67-1,34 ммоль/гмин. В этих условиях культура вырабатывала 9,9-12,0 г/л этанола и 2,6-2,7 г/л ацетата. Пример 25. Контроль соотношений продуктов путем удаления клеток. Ферментация газообразного субстрата (30% СО, 15 Н 2, 10% СО 2, 45% N2) осуществляется в CSTR(рН 5,0, температура 38 С, давление 138 кПа) с использованием С. ljungdahlii, штамм С-01, с рециркуляцией клеток (продолжительность удержания клеток 40 ч и продолжительность удержания жидкости 6 ч); рост культуры не ограничивался кобальтом, пантотенатом кальция или каким-либо другим питательным веществом. По мере роста культуры достигается такая плотность клеток, что удельное поглощение(ммоль СО на грамм сухих клеток в минуту) составляет 0,5, и выработка уксусной кислоты преобладает над выработкой этанола. Чтобы предотвратить такую возможность, увеличивают скорость удаления клеток, чтобы предотвратить увеличение плотности клеток, так, чтобы устойчивая концентрация клеток сохранялась достаточно низкой для поддержания удельного поглощения выше 0,5 ммоль СО на грамм сухих клеток в минуту. За счет этого продолжительность удержания клеток снижается до 6-25 ч. Таблица 1. Среда для выработки этанолаb Раствор витаминов содержит 20,6 мг/л d-биотина, 50,6 мг/л тиамина-НСl и 50,5 мг/л кальциевой соли d-пантотеновой кислоты с Существенно изменяется от 0,3-0,5 мл во время инокуляции до 0,7-0,8 мл при высоких скоростях газа Таблица 2. Суммарное сравнение параметров технологического процесса и результаты примеров контролирующих механизмов Таблица 3. Результаты сдвига соотношения продуктов штаммов Clostridium ljungdahlii На основе сухого веса клеток- 24006106 Таблица 4. Данные устойчивого состояния для превращения СО-обогащенного газа в этанол с использованием С. ljungdahlii, штамм С-01 На основе сухого веса клеток Таблица 5. Данные устойчивого состояния для превращения газа, содержащего 27% СО, 16% Н 2, 51% N2,в этанол с использованием С. ljungdahlii, штамм С-01. Без рециркуляции клеток На основе сухого веса клеток Таблица 6. Данные устойчивого состояния для превращения газа, содержащего 50 % Н 2, 45 % СО и 5 % СН 4, в этанол с использованием изолята 0-52 в CSTR с рециркуляцией клеток На основе сухого веса клеток- 25006106 Таблица 7. рН и состав жидких образцов при сдвиге соотношения ацетата и этанола в присутствии избытка СО На основе сухого веса клеток Таблица 8. Данные ферментации газа изолятом 0-52 с рециркуляцией клеток и воды На основе сухого веса клеток Все опубликованные документы приводятся здесь в виде ссылок. Разнообразные модификации и вариации данного изобретения включаются в вышеизложенное описание и должны быть очевидны опытному специалисту в данной области. Такие модификации и видоизменения композиций и способов по изобретению входят в область изобретения, изложенную в приведенной ниже формуле изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ стабильной непрерывной выработки этанола путем анаэробной бактериальной ферментации газообразного субстрата, включающий культивирование в ферментационном устройстве анаэробных, ацетогенных бактерий, которые способны вырабатывать этанол, в жидкой питательной среде, в состав которой входит пантотенат кальция и которая имеет уровень рН менее 5; подачу в упомянутое устройство газообразного субстрата, в состав которого входит монооксид углерода и необязательно (а) водород, (b) диоксид углерода или (с) диоксид углерода и водород, при этом ферментационный бульон вырабатывается во время ферментации; поддержание уровня пантотената кальция в упомянутом устройстве в количестве от 0,5 до 50 мкг/г сухих клеток бактерий, выработанных в упомянутом устройстве; и поддержание удельного коэффициента поглощения СО в количестве по меньшей мере 0,5 ммоль СО/грамм сухих клеток бактерий в минуту; при этом условия процесса выбраны так, чтобы свободная уксусная кислота вырабатывалась в упомянутом устройстве при концентрации менее 5 г/л, этанол вырабатывается в ферментационном бульоне в указанном устройстве с производительностью более 10 г/л в день, а этанол и ацетат вырабатываются в упомянутом ферментационном бульоне в соотношении от 1:1 до 20:1 этанола к ацетату. 2. Способ по п.1, отличающийся тем, что упомянутое ферментационное устройство представляет собой биореактор роста, который состоит из двух камер, и в котором указанный ферментационный бульон подается из первой камеры во вторую камеру указанного устройства, при этом большая часть этанола вырабатывается в указанной второй камере. 3. Способ по п.1, дополнительно включающий этапы удаления упомянутого ферментационного бульона из упомянутого устройства, дистилляции этанола из упомянутого бульона и отбор упомянутого этанола. 4. Способ по п.3, дополнительно включающий этап рециркуляции воды, содержащей ацетат, отделяемой на упомянутом этапе дистилляции, обратно в упомянутое устройство. 5. Способ по п.1, отличающийся тем, что упомянутые бактерии выбирают из группы, включающей- 26006106 7. Способ по п.1, отличающийся тем, что упомянутый газообразный субстрат дополнительно включает азот или метан. 8. Способ по п.1, дополнительно включающий изменение по меньшей мере одного из параметров,выбранных из группы, включающей состав питательной среды, скорость подачи питательной среды,скорость подачи воды, рабочее давление, рабочий уровень рН, состав газообразного субстрата, скорость подачи газа, скорость перемешивания ферментационного бульона, плотность клеток, ингибирование субстратом и их комбинации. 9. Способ по п.8, отличающийся тем, что изменение рабочего уровня рН осуществляют путем его повышения до значений выше 4,5. 10. Способ по п.8, отличающийся тем, что изменение упомянутой плотности клеток включает постоянную очистку упомянутого устройства от упомянутых бактериальных клеток до получения концентрации клеток ниже стабильной концентрации, при которой используется весь газообразный субстрат или вся питательная среда в упомянутом устройстве. 11. Способ по п.8, включающий увеличение скорости подачи воды при превышении концентрации содержащейся в ацетате свободной уксусной кислоты в ферментационном бульоне значения 2 г/л для уменьшения нежелательного возрастания концентрации упомянутой свободной уксусной кислоты. 12. Способ по п.8, включающий снижение скорости подачи упомянутого газообразного субстрата для ослабления ингибирования субстратом и поддержания упомянутой производительности. 13. Способ по п.8, отличающийся тем, что упомянутая скорость перемешивания понижается для ослабления ингибирования субстратом и поддержания упомянутой производительности. 14. Способ по п.8, отличающийся тем, что упомянутый газообразный субстрат содержит монооксид углерода и подается в устройство со скоростью подачи газа от 0,3 до 2 ммоль СО/г сухих клеток бактерий в упомянутом устройстве в минуту. 15. Способ по п.14, отличающийся тем, что упомянутая скорость находится в диапазоне от 0,5 до 1,5 ммоль СО/г сухих клеток бактерий в упомянутом устройстве в минуту. 16. Способ по п.1, отличающийся тем, что упомянутое количество пантотената кальция является меньшим, чем это требуется для поддержания стабильной концентрации упомянутых бактерий, при которой будет полностью использован имеющийся пантотенат кальция. 17. Способ по п.1, отличающийся тем, что упомянутое количество пантотената кальция составляет от 1 до 25 мкг пантотената кальция/г сухих клеток выработанных бактерий. 18. Способ по п.17, отличающийся тем, что упомянутое количество пантотената кальция составляет от 2 до 25 мкг пантотената кальция/г сухих клеток выработанных бактерий. 19. Способ по п.8, отличающийся тем, что упомянутый газообразный субстрат дополнительно содержит водород, который подается в упомянутое устройство в количестве, при котором отношение молей газообразного водорода в подаваемом газе к сумме удвоенного количества молей превращенного монооксида углерода и утроенного количества молей превращенного диоксида углерода превышает 1,0. 20. Способ по п.8, отличающийся тем, что состав упомянутой питательной среды изменяется путем подачи в упомянутое устройство упомянутой питательной среды, дополнительно содержащей кобальт в количестве от 5 до 100 мкг кобальта/г сухих клеток бактерий, выработанных в упомянутом устройстве. 21. Способ по п.20, отличающийся тем, что упомянутое количество кобальта меньше, чем требуется для поддержания стабильной концентрации упомянутых бактерий, при которой будет полностью использован имеющийся кобальт. 22. Способ по п.20, отличающийся тем, что количество кобальта выбрано таким образом, чтобы поддерживалась преимущественная выработка этанола по сравнению с ацетатом. 23. Способ по п.20, отличающийся тем, что упомянутое количество кобальта составляет от 20 до 50 мкг кобальта/г сухих клеток выработанных бактерий.
МПК / Метки
МПК: C12P 7/06
Метки: непрерывной, способ, стабильной, этанола, выработки
Код ссылки
<a href="https://eas.patents.su/29-6106-sposob-stabilnojj-nepreryvnojj-vyrabotki-etanola.html" rel="bookmark" title="База патентов Евразийского Союза">Способ стабильной непрерывной выработки этанола</a>
Предыдущий патент: Способ адаптации бактерий для использования при выщелачивании руд и концентратов (варианты)
Следующий патент: Замещенные бициклические производные в качестве противораковых агентов
Случайный патент: Дисперсия порошка меламина, способ ее получения и ее применение