Антигистаминные спиросоединения
Формула / Реферат
1. Соединение формулы
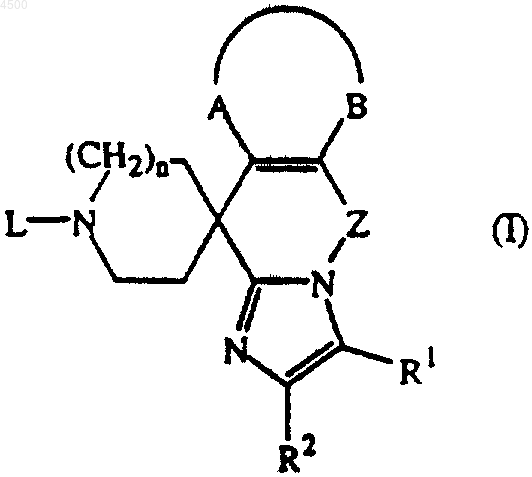
его пролекарство, N-оксид, соль присоединения, четвертичный амин и стереохимически изомерная форма, где R1 представляет собой водород, C1-6алкил, галоген, формил, карбоксил, C1-6алкилоксикарбонил, C1-6алкилкарбонил, N(R3R4)C(=O)-, N(R3R4)C(=O)N(R5)-, этенил, замещенный карбоксилом или C1-6алкилоксикарбонилом, или C1-6алкил, замещенный гидрокси, карбоксилом, C1-6алкилокси, C1-6алкилоксикарбонилом, N(R3R4)C(=O)-, C1-6алкил-C(=O)N(R5)-, C1-6алкилS(=O)2N(R5)- или N(R3R4)C(=O)N(R5)-;
где каждый R3 и каждый R4 независимо представляют собой водород или C1-4алкил;
R5 представляет собой водород или гидрокси;
R2 представляет собой водород, C1-6алкил, гидроксиC1-6алкил, C1-6алкилоксиC1-6алкил, N(R3R4)C(=O)-, арил или галоген;
n равно 1 или 2;
-A-B- представляет двухвалентный радикал формулы
| -Y-CH=CH- | (a-1) |
| -CH=CH-Y- | (a-2) или |
| -CH=CH-CH=CH- | (a-3), |
где каждый атом водорода в радикалах (a-1)-(a-3) может быть независимо замещен R6 и где R6 представляет собой C1-6алкил, галоген, гидрокси, C1-6алкилокси, этенил замещенный карбоксилом или C1-6алкилоксикарбонилом, гидроксиC1-6алкил, формил, карбоксил и гидроксикарбонилC1-6алкил;
каждый Y, независимо, представляет собой двухвалентный радикал формулы -O-, -S- или -NR7-; где R7 представляет собой водород, C1-6алкил или C1-6алкилкарбонил;
Z представляет собой двухвалентный радикал формулы
| -(CH2)p- | (b-1) |
| -CH=CH- | (b-2) |
| -CH2-CHOH- | (b-3) |
| -CH2-O- | (b-4) |
| -CH2-C(=O) - | (b-5) или |
| -CH2-C(=NOH)- | (b-6), |
при условии, что двухвалентные радикалы (b-3), (b-4), (b-5) и (b-6) присоединены к азоту имидазольного кольца через их -CH2-остаток, где p равно 1, 2, 3 или 4;
L представляет собой водород; C1-6алкил; C2-6алкенил; C1-6алкилкарбонил; C1-6алкилоксикарбонил; C1-6алкил, замещенный одним или несколькими заместителями, каждый независимо выбран из гидрокси, карбоксила, C1-6алкилокси, C1-6алкилоксикарбонила, арила, арилокси, циано или R8HN-,
где R8 представляет собой водород, C1-6алкил, C1-6алкилоксикарбонил, C1-6алкилкарбонил; или L представляет собой радикал формулы
| -Alk-Y-Het1 | (c-1) |
| -Alk-NH-CO-Het2 | (c-2) или |
| -Alk-Het3 | (c-3), |
где Alk представляет собой C1-4алкандиил;
Y представляет собой O, S или NH;
Het1, Het2 и Het3, каждый, представляет собой фуранил, тетрагидрофуранил, тиенил, оксазолил, тиазолил или имидазолил, каждый необязательно замещенный одним или двумя C1-4алкильными заместителями; пирролил или пиразолил, необязательно замещенный формилом, гидроксиC1-4алкилом, гидроксикарбонилом, C1-4алкилоксикарбонилом или одним или двумя C1-4алкильными заместителями; тиадиазолил или оксадиазолил, необязательно замещенный амино или C1-4алкилом; пиридинил, пиримидинил, пиразинил или пиридазинил, каждый необязательно замещенный C1-4алкилом, C1-4алкилокси, амино, гидрокси или галогеном; и Het3 может также представлять 4,5-дигидро-5-оксо-1H-тетразолил, замещенный C1-4алкилом, 2-оксо-3-оксазолидинил, 2,3-дигидро-2-оксо-1H-бензимидазол-1-ил или радикал формулы
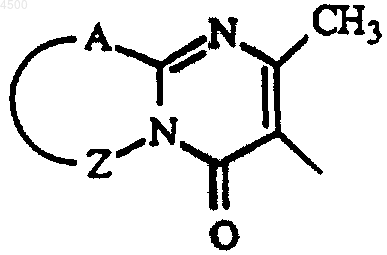
где A-Z представляет S-CH=CH, S-CH2-CH2, S-CH2-CH2-CH2, CH=CH-CH=CH или CH2-CH2-CH2-CH2;
арил представляет собой фенил или фенил, замещенный 1, 2 или 3 заместителями, каждый, независимо, выбран из галогена, гидрокси,C1-4алкила, полигалогенC1-4алкила, циано, аминокарбонила, C1-4алкилокси или полигалогенC1-4алкилокси,
при условии, что исключается 5,6-дигидроспиро[имидазо[1,2-b][3]бензазепин-11[11H],4'-пиперидин] и его фармацевтически приемлемые соли присоединения.
2. Соединение по п.1, где L представляет собой водород, C1-6алкил, C1-6алкилкарбонил, C1-6алкилоксикарбонил или C1-6алкил, замещенный гидрокси, карбоксилом, C1-6алкилокси или C1-6алкилоксикарбонилом.
3. Соединение по п.1, где L представляет собой C1-6алкил, замещенный арилом и C1-6алкилоксикарбонилом.
4. Соединение по любому из предыдущих пунктов, где -A-B- представляет собой двухвалентный радикал формулы -CH=CH-CH=CH- (a-3) или -CH=CH-Y- (a-2).
5. Соединение по любому из предыдущих пунктов, где Z представляет собой -(CH2)p- (b-1), -CH=CH- (b-2) или -CH2-O- (b-4).
6. Соединение по пп.1, 2, 4 или 5, где L представляет собой водород, C1-6алкил, гидроксиC1-6алкил, карбоксиC1-6алкил, C1-6алкилоксикарбонил или C1-6алкилоксикарбонилC1-6алкил.
7. Соединение по любому из предыдущих пунктов, где R1 представляет собой гидроксиC1-6алкил, формил, C1-6алкилоксикарбонил, C1-6алкилоксиC1-6алкил, N(R3R4)C(=O)-, галоген или водород.
8. Соединение по п.1, где соединение представляет собой
соед. 17: 5,6-дигидроспиро[11H-имидазо[2,1-b][3]бензазепин-11,4'-пиперидин]-3-карбоксамида дигидрохлорид;
соед. 3: 1'-бутил-5,6-дигидроспиро[имидазо[2,1-b][3]бензазепин-11-[11H],4'-пиперидин];
соед. 1: 6,11-дигидро-1'-метилспиро[5H-имидазо[2,1-b][3]бензазепин-11,4'-пиперидин]циклогексилсульфамат (1:2);
соед. 18a: 6,11-дигидроспиро[5-имидазо[2,1-b][3]бензазепин-11,4'-пиперидин]-3-метанол](E)-2-бутендиоат (2:1);
соед. 20: 3-хлор-6,11-дигидроспиро 5H-имидазо[2,1-b][3]бензазепин-11,4'-пиперидин](E)-2-бутендиоат (1:1);
соед. 58: 6,11-дигидро-3-(метоксиметил)спиро[5H-имидазо[2,1-b][3]бензазепин-11,4'-пиперидин](E)-2-бутендиоат (1:1);
соед. 62: 6,11-дигидро-1'-(2-гидроксиэтил)спиро[5H-имидазо[2,1-b][3]бензазепин-11,4'-пиперидин]-3-карбоксамид;
соед. 80: 6,11-дигидро-1'-метилспиро[5H-имидазо[2,1-b][3]бензазепин-11,4'-пиперидин]-3-карбоксамида моногидрат;
соед. 64: этил 3-(аминокарбонил)-6,11-дигидро-a-фенилспиро[5H-имидазо[2,1-b][3]бензазепин-11,4'-пиперидин]-1'-пропаноата моногидрохлорид;
соед. 79: 3-(аминокарбонил)-6,11-дигидроспиро[5H-имидазо[2,1-b][3]-бензазепин-11,4'-пиперидин]-1'-карбоксилат;
соед. 56a: спиро[10H-имидазо[1,2-a]тиено[3,2-d]азепин-10,4'-пиперидин];
соед. 53: 6,11-дигидроспиро[5H-имидазо[2,1-b][3]бензазепин-11,4'-пиперидин]-2,3-дикарбоксамида дигидрохлорид моногидрат;
его пролекарство, N-оксид, соль присоединения, четвертичный амин и стереохимически изомерную форму.
9. Применение соединения формулы
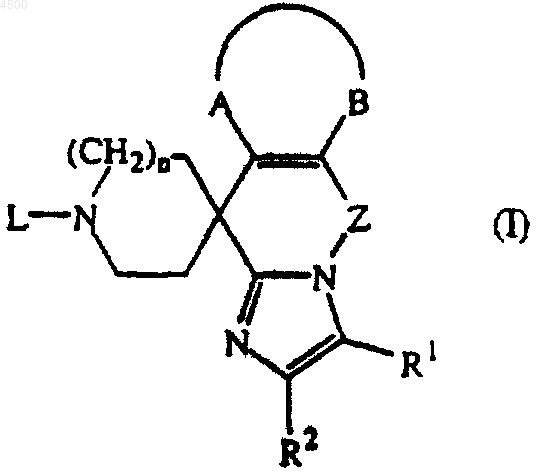
где R1 представляет собой водород, C1-6алкил, галоген, формил, карбоксил, C1-6алкилоксикарбонил, C1-6алкилкарбонил, N(R3R4)C(=O)-, N(R3R4)C(=O)N(R5)-, этенил, замещенный карбоксилом или C1-6алкилоксикарбонилом, или C1-6алкил, замещенный гидрокси, карбоксилом, C1-6алкилокси, C1-6алкилоксикарбонилом, N(R3R4)C(=O)-, C1-6алкил-C(=O)N(R5)-, C1-6алкилS(=O)2N(R5)- или N(R3R4)C(=O)N(R5)-;
где каждый R3 и каждый R4 независимо представляют собой водород или C1-4алкил;
R5 представляет собой водород или гидрокси;
R2 представляет собой водород, C1-6алкил, гидроксиC1-6алкил, C1-6алкилоксиC1-6алкил, N(R3R4)C(=O)-, арил или галоген;
n равно 1 или 2;
-A-B- представляет двухвалентный радикал формулы
| -Y-CH=CH- | (a-1) |
| -CH=CH-Y- | (a-2) или |
| -CH=CH-CH=CH- | (a-3), |
где каждый атом водорода в радикалах (a-1)-(a-3) может быть независимо замещен R6 и где R6 представляет собой C1-6алкил, галоген, гидрокси, C1-6алкилокси, этенил замещенный карбоксилом или C1-6алкилоксикарбонилом, гидроксиC1-6алкил, формил, карбоксил и гидроксикарбонилC1-6алкил;
каждый Y, независимо, представляет собой двухвалентный радикал формулы -O-, -S- или -NR7-; где R7 представляет собой водород, C1-6алкил или C1-6алкилкарбонил;
Z представляет собой двухвалентный радикал формулы
| -(CH2)p- | (b-1) |
| -CH=CH- | (b-2) |
| -CH2-CHOH- | (b-3) |
| -CH2-O- | (b-4) |
| -CH2-C(=O)- | (b-5) или |
| -CH2-C(=NOH) - | (b-6), |
при условии, что двухвалентные радикалы (b-3), (b-4), (b-5) и (b-6) присоединены к азоту имидазольного кольца через их -CH2-остаток,
где p равно 1, 2, 3 или 4;
L представляет собой водород; C1-6алкил; C2-6алкенил; C1-6алкилкарбонил; C1-6алкилоксикарбонил; C1-6алкил, замещенный одним или несколькими заместителями, каждый, независимо, выбран из гидрокси, карбоксила, C1-6алкилокси, C1-6алкилоксикарбонила, арила, арилокси, циано или R8HN-,
где R8 представляет собой водород, C1-6алкил, C1-6алкилоксикарбонил, C1-6алкилкарбонил; или L представляет собой радикал формулы
| -Alk-Y-Het1 | (c-1), |
| -Alk-NH-CO-Het2 | (c-2) или |
| -Alk-Het3 | (c-3), |
где Alk представляет собой C1-4алкандиил;
Y представляет собой O, S или NH;
Het1, Het2 и Het3, каждый, представляет собой фуранил, тетрагидрофуранил, тиенил, оксазолил, тиазолил или имидазолил, каждый необязательно замещенный одним или двумя C1-4алкильными заместителями; пирролил или пиразолил, необязательно замещенный формилом, гидроксиC1-4алкилом, гидроксикарбонилом, C1-4алкилоксикарбонилом или одним или двумя C1-4алкильными заместителями; тиадиазолил или оксадиазолил, необязательно замещенный амино или C1-4алкилом; пиридинил, пиримидинил, пиразинил или пиридазинил, каждый, необязательно замещенный C1-4алкилом, C1-6алкилокси, амино, гидрокси или галогеном; и Het3 может также представлять 4,5-дигидро-5-оксо-1H-тетразолил, замещенный C1-4алкилом, 2-оксо-3-оксазолидинил, 2,3-дигидро-2-оксо-1H-бензимидазол-1-ил или радикал формулы
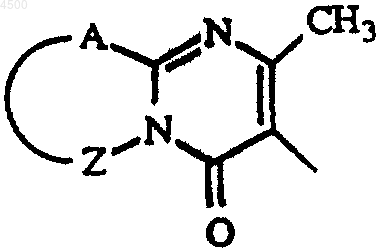
где A-Z представляет S-CH=CH, S-CH2-CH2, S-CH2-CH2-CH2, CH=CH-CH=CH, или CH2-CH2-CH2-CH2;
арил представляет собой фенил или фенил, замещенный 1, 2 или 3 заместителями, каждый независимо выбран из галогена, гидрокси, C1-4алкила, полигалогенC1-4алкила, циано, аминокарбонила, C1-4алкилокси или полигалогенC1-4алкилокси, и
его фармацевтически приемлемых солей присоединения, пролекарства, N-оксида, четвертичного амина и стереохимически изомерной формы, в качестве лекарственного средства.
10. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель, и, в качестве активного ингредиента, терапевтически эффективное количество соединения по любому из пп.1-9.
11. Способ получения композиции по п.10, отличающийся тем, что фармацевтически приемлемый носитель однородно смешивают с терапевтически эффективным количеством соединения по любому из пп.1-9.
12. Соединение формулы

его N-оксид, соль присоединения, четвертичный амин и стереохимически изомерная форма, где P является защитной группой и n, -A-B-, Z, R1 и R2 являются такими, как определено в п.1, при условии, что исключается 6,11-дигидро-1'-(фенилметил)-5H-спиро[имидазо[1,2-b][3]бензазепин-11, 4'-пиперидин](E)-2-бутендиоат (1:2).
13. Соединение по п.12, где P представляет собой бензил.
14. Способ получения соединения по п.1, включающий снятие защиты с промежуточного соединения формулы (II) с последующей необязательной дериватизацией либо пиперидинового фрагмента, либо имидазольного фрагмента, либо как пиперидинового фрагмента, так и имидазольного фрагмента

где -A-B-, Z, L, R1 и R2 и n определены в п.1 и P является защитной группой.
15. Способ получения соединения по п.1, включающий дериватизацию промежуточного соединения формулы (II) по имидазольному фрагменту с образованием промежуточного соединения формулы (II-a), с последующим снятием защиты с пиперидинового фрагмента и с последующей необязательной дериватизацией пиперидинового фрагмента
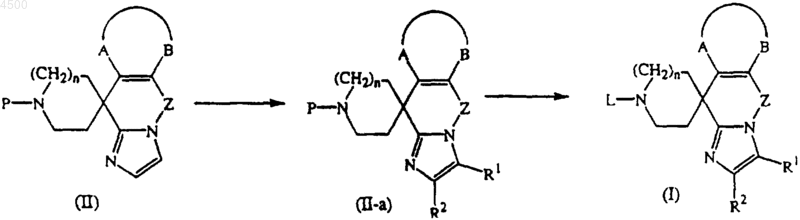
где -A-B-, Z, L, R1 и R2 и n определены в п.1 и P является защитной группой.
16. Способ получения соединения по п.1, включающий циклизацию промежуточного соединения формулы (III) в присутствии подходящей кислоты, с получением соединения формулы (I-a)
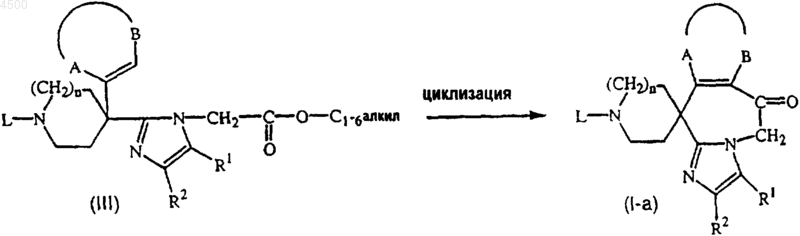
где -A-B-, L, R1 и R2 и n определены как в п.1.
17. Способ по пп.14-16, дополнительно, если желательно включающий превращение соединений формулы (I) и (I-a) друг в друга, следуя известным в данной области методикам, а также, если желательно, превращение соединения формулы (I), в терапевтически активную нетоксичную соль присоединения кислоты обработкой кислотой, или в терапевтически активную нетоксичную соль присоединения основания обработкой основанием, или подобным же образом превращение соли присоединения кислоты в свободное основание обработкой щелочью, или превращение соли присоединения основания в свободную кислоту обработкой кислотой; и, если это желательно, получение их стереохимически изомерных или N-оксидных форм.
18. Способ получения соединения по п.12, включающий циклизацию соединения формулы (XI) с помощью подходящей кислоты, с получением соединения формулы (II-k), с последующей необязательной дериватизацией имидазольного фрагмента с получением соединения формулы (II-a-1)
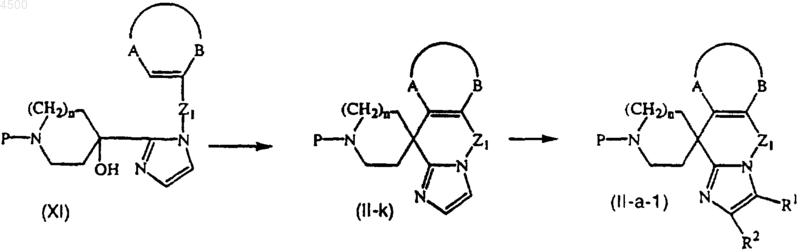
где -A-B-, R1, R2, n и P определены в п.13 и Z1 является двухвалентным радикалом формулы -(CH2)p-, где p равно 1, 2, 3 или 4.
19. Способ получения соединения по п.1, включающий взаимодействие трициклического фрагмента формулы (XIV) с реагентом формулы (XV) в инертной атмосфере и в реакционно-инертном растворителе, в присутствии соответствующего основания, с получением соединения формулы (II-1), с последующей необязательной дериватизацией имидазольного фрагмента, с получением соединения формулы (II-a-2)
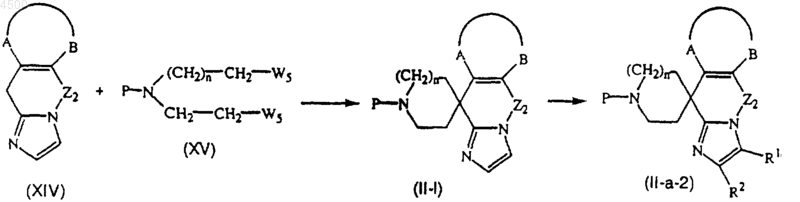
где -A-B-, R1, R2, n и P определены в п.13, W5 является соответствующей уходящей группой, например галогеном, и Z2 представляет собой двухвалентный радикал формулы -(CH2)p- или -CH2-O-, где p равно 1, 2, 3 или 4.
20. Применение соединения
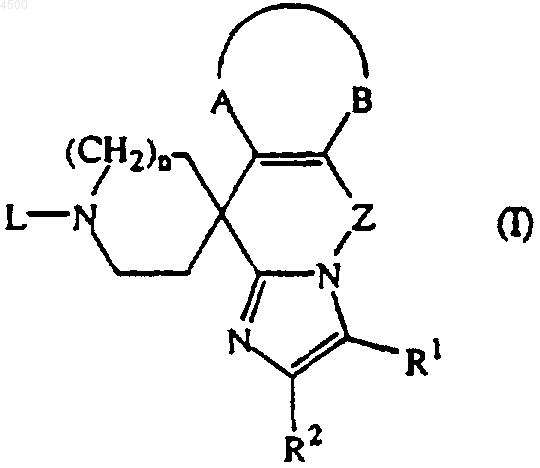
его пролекарства, N-оксида, соли присоединения, четвертичного амина и стереохимически изомерной формы, где R1 представляет собой водород, C1-6алкил, галоген, формил, карбоксил, C1-6алкилоксикарбонил, C1-6алкилкарбонил, N(R3R4)C(=O)-, N(R3R4)C(=O)N(R5)-, этенил, замещенный карбоксилом или C1-6алкилоксикарбонилом, или C1-6алкил, замещенный гидрокси, карбоксилом, C1-6алкилокси, C1-6алкилоксикарбонилом, N(R3R4)C(=O)-, C1-6алкил-C(=O)N(R5)-, C1-6алкилS(=O)2N(R5)- или N(R3R4)C(=O)N(R5)-;
где каждый R3 и каждый R4 независимо представляют собой водород или C1-4алкил;
R5 представляет собой водород или гидрокси;
R2 представляет собой водород, C1-6алкил, гидроксиC1-6алкил, C1-6алкилоксиC1-6алкил, N(R3R4)C(=O)-, арил или галоген;
n равно 1 или 2;
-A-B- представляет двухвалентный радикал формулы
| -Y-CH=CH- | (a-1) |
| -CH=CH-Y- | (a-2) или |
| -CH=CH-CH=CH- | (a-3), |
где каждый атом водорода в радикалах (a-1)-(a-3) может быть независимо замещен R6 и где R6 представляет собой C1-6алкил, галоген, гидрокси, C1-6алкилокси, этенил, замещенный карбоксилом или C1-6алкилоксикарбонилом, гидроксиC1-6алкил, формил, карбоксил и гидроксикарбонилC1-6алкил;
каждый Y независимо представляет собой двухвалентный радикал формулы -O-, -S- или -NR7-; где R7 представляет собой водород, C1-6алкил или C1-6алкилкарбонил;
Z представляет собой двухвалентный радикал формулы
| -(CH2)p- | (b-1) |
| -CH=CH- | (b-2) |
| -CH2-CHOH- | (b-3) |
| -CH2-O- | (b-4) |
| -CH2-C(=O)- | (b-5) или |
| -CH2-C(=NOH)- | (b-6), |
при условии, что двухвалентные радикалы (b-3), (b-4), (b-5) и (b-6) присоединены к азоту имидазольного кольца через их -CH2-остаток,
где p равно 1, 2, 3 или 4;
L представляет собой водород; C1-6алкил; C2-6алкенил; C1-6алкилкарбонил; C1-6алкилоксикарбонил; C1-6алкил, замещенный одним или несколькими заместителями, каждый, независимо, выбран из гидрокси, карбоксила, C1-6алкилокси, C1-6алкилоксикарбонила, арила, арилокси, циано или R8HN-, где R8 представляет собой водород, C1-6алкил, C1-6алкилоксикарбонил, C1-6алкилкарбонил; или
L представляет собой радикал формулы
| -Alk-Y-Het1 | (c-1) |
| -Alk-NH-CO-Het2 | (c-2) или |
| -Alk-Het3 | (c-3), |
где Alk представляет собой C1-4алкандиил;
Y представляет собой O, S или NH;
Het1, Het2 и Het3, каждый, представляхт собой фуранил, тетрагидрофуранил, тиенил, оксазолил, тиазолил или имидазолил, каждый, необязательно замещенный одним или двумя C1-4алкильными заместителями; пирролил или пиразолил, необязательно замещенный формилом, гидроксиC1-4алкилом, гидроксикарбонилом, C1-4алкилоксикарбонилом или одним или двумя C1-4алкильными заместителями; тиадиазолил или оксадиазолил, необязательно замещенный амино или C1-4алкилом; пиридинил, пиримидинил, пиразинил или пиридазинил, каждый, необязательно замещенный C1-4алкилом, C1-4алкилокси, амино, гидрокси или галогеном; и
Het3 может также представлять 4,5-дигидро-5-оксо-1H-тетразолил, замещенный C1-4алкилом, 2-оксо-3-оксазолидинил, 2,3-дигидро-2-оксо-1H-бензимидазол-1-ил или радикал формулы
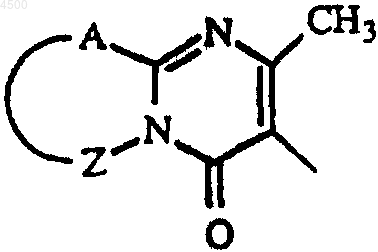
где A-Z представляет S-CH=CH, S-CH2-CH2, S-CH2-CH2-CH2, CH=CH-CH=CH или CH2-CH2-CH2-CH2;
арил представляет собой фенил или фенил, замещенный 1, 2 или 3 заместителями, каждый независимо выбран из галогена, гидрокси, C1-4алкила, полигалогенC1-4алкила, циано, аминокарбонила, C1-4алкилокси или полигалогенC1-4алкилокси в качестве активного агента в лечении аллергических заболеваний.
Текст
1 Настоящее изобретение относится к спиросоединениям, имеющим антигистаминную активность. Оно, кроме того, относится к их использованию в качестве лекарственного средства, к их получению, а также к композициям,содержащим их.WO 97/24356, опубликованная 10 июля 1997, раскрывает спиро-соединения 4-(имидазоазепин)пиперидина в качестве промежуточных соединений при получении спиросоединений 1-(1,2-дизамещенного пиперидинил)-4(имидазоазепин)пиперидина, имеющих активность антагонистов тахикинина. Неожиданно спиро-соединения 4-(имидазоазепин)пиперидина по настоящему изобретению демонстрируют представляющие интерес свойства антигистаминной активности. Настоящее изобретение относится к соединениям формулы (I) для использования в качестве лекарственного средства, при этом соединения формулы (I) определяются как 2 представляет собой двухвалентный радикал формулы -О-, -S- или -NR7-; где R7 представляет собой водород, C1-6 алкил или C1-6 алкилкарбонил;Z представляет собой двухвалентный радикал формулы-CH2-C(=NOH)(b-6) при условии, что двухвалентные радикалы (b-3),(b-4), (b-5) и (b-6) присоединены к азоту имидазольного кольца через их -СН 2-остаток, где р равно 1, 2, 3 или 4;L представляет собой водород; C1-6 алкил; С 2-6 алкенил; C1-6 алкилкарбонил; C1-6 алкилоксикарбонил; C1-6 алкил, замещенный одним или несколькими заместителями, каждый, независимо, выбран из гидрокси, карбоксила, C1-6 алкилокси, C1-6 алкилоксикарбонила, арила, арилокси, циано или R8HN-, где R8 представляет собой водород, C1-6aлкил, C1-6 алкилоксикарбонил, C1-6 алкилкарбонил; или L представляет радикал формулыN(R R )С(=O)N(R5)-; где каждый R3 и каждый R4, независимо,представляют собой водород или C1-4 алкил;R5 представляет собой водород или гидрокси;-А-В- представляет двухвалентный радикал формулыHet1, Het2 и Het3, каждый, представляют фуранил, тетрагидрофуранил, тиенил, оксазолил, тиазолил или имидазолил, каждый из них необязательно замещен одним или двумя С 1-4 алкильными заместителями; пирролил или пиразолил, необязательно замещенный формилом,гидроксиС 1-4 алкилом, гидроксикарбонилом, С 1-4 алкилоксикарбонилом или одним или двумя С 1-4 алкильными заместителями; тиадиазолил или оксадиазолил, необязательно замещенный амино или С 1-4 алкилом; пиридинил, пиримидинил,пиразинил или пиридазинил, каждый необязательно замещен С 1-4 алкилом, С 1-4 алкилокси,амино, гидрокси или галогеном; иHet3 может также представлять собой 4,5 дигидро-5-оксо-1 Н-тетразолил, замещенный С 1-4 алкилом,2-оксо-3-оксазолидинилом,2,3 дигидро-2-оксо-1 Н-бензимидазол-1-илом, или радикал формулы где каждый атом водорода в радикалах (а-1)-(а 3) может быть независимо замещен R6, где R6 выбран из C1-6 алкила, галогена, гидрокси, C1-6 алкилокси, этенила, замещенного карбоксилом или C1-6 алкилоксикарбонилом, гидроксиС 1-6 алкилом, формилом, карбоксилом и гидроксикарбонилС 1-6 алкилом; каждый Y, независимо, где A-Z представляет S-CH=CH, S-СН 2-СН 2, SCH2-CH2-CH2, CH=CH-CH=CH,или СН 2-СН 2-СН 2-СН 2; арил представляет собой фенил или фенил,замещенный 1, 2 или 3 заместителями, каждый 3 независимо выбран из галогена, гидрокси, С 1-4 алкила, полигалогенС 1-4 алкила, циано, аминокарбонила, С 1-4 алкилокси или полигалогенС 1-4 алкилокси. Соединения формулы (I), как предполагается, являются новыми, при условии, что 5,6 дигидроспиро[имидазо[1,2-b][3]-бензазепин 11[11 Н],4'-пиперидин] и их фармацевтически приемлемые соли присоединения исключаются и, таким образом, настоящее изобретение также относится к соединениям формулы (I), как определено выше, при условии, что 5,6 дигидроспиро[имидазо[1,2-b][3]бензазепин 11[11 Н],4'-пиперидин] и его фармацевтически приемлемые соли присоединения исключаются. Термин пролекарство, как используется по тексту, обозначает фармакологически приемлемые производные, такие, например, как сложные эфиры и амиды, так что получаемый в результате биологического превращения соединения продукт представляет собой активное лекарственное средство, как определено для соединений формулы (I). Сюда включается ссылкаof Therapeutics, 8th ed., McGraw-Hill, Int. Ed. 1992, "Biotransformation of Drugs", p. 13-15),описывающая пролекарства в целом. Как он используется здесь, термин С 1-4 алкил в качестве группы или части группы определяет насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющие от 1 до 4 атомов углерода, такие как метил, этил,пропил, 1-метилэтил, бутил и тому подобное;C1-6 алкил в качестве группы или части группы определяет насыщенные углеводородные радикалы с прямой или разветвленной цепью,имеющие от 1 до 6 атомов углерода, такие как группы, определенные для С 1-4 алкила и пентила,гексила, 2-метилпропила, 2-метилбутила и тому подобное; С 2-6 алкенил в качестве группы или части группы определяет насыщенные углеводородные радикалы с прямой или разветвленной цепью, содержащие одну двойную связь и имеющие от 2 до 6 атомов углерода, такие как этенил, 2-пропенил, 2-бутенил, 2-пентенил, 3 пентенил, 3-метил-2-бутенил, 3-гексенил, и тому подобное. Используемый здесь знак (=O) образует карбонильный остаток, когда он присоединяется к атому углерода, и сульфонильный остаток,когда он присоединяется через двойную связь к атому серы. Знак (=NOH) образует гидроксилиминовый остаток, когда присоединяется к атому углерода. Термин галоген является общим для фтора,хлора, брома и йода. Как он используется выше и далее, термин полигалогенС 1-4 алкил в качестве группы или части группы определяется как моно-или полигалогензамещенный С 1-4 алкил, в частности, метил с одним или несколькими атомами фтора, например, дифторметил или трифторметил. В случае, когда более чем один атома 4 галогена присоединен к алкильной группе, подпадающей под определение полигалогенС 1-4 алкил, они могут быть одинаковыми или различными. Когда каждая группа (например, R3, R4 и так далее) присутствует более чем один раз в каждом заместителе, каждое определение является независимым от других. Очевидно, что некоторые из соединений формулы (I), их пролекарств, N-оксидов, солей присоединения, четвертичных аминов и стереохимически изомерных форм могут содержать один или несколько центров хиральности и существовать в виде стереохимически изомерных форм. Термин "стереохимически изомерные формы", как он используется выше, определяет все возможные стереоизомерные формы, которые могут иметь соединения формулы (I), их пролекарства, N-оксиды, соли присоединения,четвертичные амины или физиологически функциональные производные. Если не указывается или не рассматривается иное, химическое обозначение соединений обозначает смесь всех возможных стереохимически изомерных форм,указанные смеси, включающие все диастереомеры и энантиомеры основной молекулярной структуры, а также каждую из индивидуальных изомерных форм формулы (I), их пролекарств,N-оксидов, солей присоединения или четвертичных аминов, по существу свободную, то есть связанную с менее чем 10%, предпочтительно менее, чем 5%, особенно, менее чем 2% и наиболее предпочтительно, менее чем 1% других изомеров. Стереохимически изомерные формы соединений формулы (I), разумеется, включены в объем настоящего изобретения. При терапевтическом использовании, соли присоединения соединений формулы (I) являются такими, что противоион является фармацевтически приемлемым. Однако, соли кислот и оснований, которые не являются фармацевтически приемлемыми, могут также найти применение, например, при получении или очистке фармацевтически приемлемых соединений. Все соли, как фармацевтически приемлемые, так и нет, включаются в объем настоящего изобретения. Фармацевтически приемлемые соли присоединения кислот и оснований, как рассмотрено выше, включают, как подразумевается, терапевтически активные формы нетоксичных солей присоединения кислот и оснований, которые способны образовывать соединения формулы(I). Фармацевтически приемлемые соли присоединения кислот удобно получать с помощью обработки основной формы соответствующей кислотой. Соответствующие кислоты включают,например, неорганические кислоты, такие как галогенводородные кислоты, например хлористо-водородную или бромисто-водородную кислоту, серную, азотную, фосфорную и тому по 5 добные кислоты; или органические кислоты такие как, например, уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная,щавелевая (то есть этандиойная), малоновая,янтарная (то есть бутандиойная кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и тому подобные кислоты. Подобным же образом указанные солевые формы могут быть преобразованы с помощью обработки соответствующим основанием в форму свободного основания. Соединения формулы (I), содержащие кислотный протон, могут также быть преобразованы в форму их солей присоединения с нетоксичными металлами или аминами с помощью обработки соответствующими органическими и неорганическими основаниями. Соответствующие формы основных солей включают, например, соли аммония, соли щелочных и щелочноземельных металлов, например, соли лития, натрия, калия, магния, кальция, и тому подобное,соли органических оснований, например, соли бензатина, N-метил-D-глюкамина, гидрабамина,и соли аминокислот, таких, например, как аргинин, лизин, и тому подобное. Термин соль присоединения, как он используется выше, также включает сольваты,которые могут образовывать соединения формулы (I), а также их соли. Такими сольватами являются, например, гидраты, алкоголяты и тому подобное. Некоторые из соединений формулы (I) могут также существовать в их таутомерной форме. Такие формы, хотя они не указываются конкретно в указанной выше формуле, являются включенными, как предполагается, в объем настоящего изобретения. Представляющая интерес группа соединений включает такие соединения формулы (I),где L представляет собой водород, C1-6 алкил, C1-6 алкилкарбонил, C1-6 алкилоксикарбонил или C1-6 алкил, замещенный гидрокси, карбоксил, C1-6 алкилокси или C1-6 алкилоксикарбонил. Другая представляющая интерес группа соединений включает такие соединения формулы (I), где -А-В- представляет собой двухвалентный радикал формулы -СН=СН-СН=СН- (а 3). Также представляющими интерес соединениями являются такие соединения формулы(I), где -А-В- представляет собой двухвалентный радикал формулы -CH=CH-Y- (а-2). Далее, представляющие интерес соединения представляют собой такие соединения формулы (I), где Z представляет собой -(СН 2)р- (b1), -СН=СН- (b-2), или -CH2-O- (b-4). Другие представляющие интерес соединения представляют собой соединения формулыC1-6 алкилоксикарбонилС 1-6 алкил. Далее представляющими интерес соединениями являются такие соединения формулы (I),где L представляет собой гидроксиС 1-6 алкил илиC1-6 алкил, замещенный арилом и C1-6 алкилоксикарбонилом. Также дополнительно представляющие интерес соединения представляют собой такие соединения формулы (I), где R1 представляет собой гидроксиС 1-6 алкил, формил, C1-6 алкилоксикарбонил, N(R3R4)С(=O)-, галоген или водород. Другие представляющие интерес соединения представляют собой такие соединения формулы (I), где R1 представляет собой C1-6 алкилоксиС 1-6aлкил. Конкретные соединения представляют собой такие соединения формулы (I), где применяется одно или несколько из следующих ограничений:-А-В- представляет собой двухвалентный радикал формулы -СН=СН-СН=СН- (а-3), где каждый водород может быть независимо замещен C1-6 алкилом, C1-6 алкилокси, галогеном или гидрокси;R2 представляет собой гидроксиС 1-6 алкил,С 1-6 алкилоксиС 1-6 алкил, галоген, амид. Наиболее предпочтительными соединениями являются 5,6-дигидроспиро[11 Н-имидазо[2,1-b][3] бензазепин-11,4'-пиперидин]-3-карбоксамида дигидрохлорид (соед. 17); 1'-бутил-5,6-дигидроспиро[имидазо[2,1-b][2,1-b][3]бензазепин-11,4'-пиперидин]-3-карбоксамида моногидрат (соед. 80); этил 3-(аминокарбонил)-6,11-дигидро-фенилспиро[5 Н-имидазо[2,1-b][3]-бензазепин 11,4'-пиперидин]-1'-пропаноата моногидрохлорид (соед. 64); 3-(аминокарбонил)-6,11-дигидроспиро[5Hимидазо[2,1-b][3]-бензазепин-11,4'-пиперидин]1'-карбоксилат (соед. 79); спиро[10 Н-имидазо[1,2-а]тиено[3,2-d]азепин-10,4'-пиперидин] (соед. 56 а); 6,11-дигидроспиро[5 Н-имидазо[2,1-b][3] бензазепин-11,4'-пиперидин]-2,3-дикарбоксамида дигидрохлорида моногидрат (соед. 53); их пролекарство, N-оксид, соль присоединения, четвертичный амин или стереохимически изомерная форма. Настоящее изобретение также относится к новым соединениям формулы их N-оксидам, солям присоединения, четвертичным аминам и стереохимически изомерным формам,где R1 представляет собой водород, С 1-6 алкил,галоген, формил, карбоксил, C1-6 алкилоксикарбонил, C1-6 алкилкарбонил, N(RЗR4)С(=O)-,N(RЗR4)С(=O)N(R5)-, этенил, замещенный карбоксилом или C1-6 алкилоксикарбонилом, или C1-6 алкил, замещенный гидрокси, карбоксилом, амино, C1-6 алкилокси, С 1-6 алкилоксикарбонилом,N(RЗR4)С(=O)-, С 1-6 алкилС(=O)N(R5)-, С 1-6 алкилS(=O)2N(R5)- или N(R3R4)С(=O)N(R5)-; где каждый R3 и каждый R4 независимо представляют водород или С 1-4 алкил;R5 представляет собой водород или гидрокси;-А-В-, Z, R2, и n являются такими, как определено для соединений формулы (I); и Р представляет собой защитную группу, например,бензил, или такие защитные группы, которые приведены в главе 7 "Protective Groups in Organic Synthesis" by T. Greene and P. Wuyts (John(1:2) исключен. Соединения формулы (II-а) являются пригодными для использования при получении соединений формулы (I). Представляющие интерес соединения представляют собой такие соединения формулы 8 Также представляющие интерес соединения представляют собой такие соединения формулы (II-а), где R1 представляет собой водород,галоген, формил, N(R3R4)С(=O)-, или C1-6 алкил,замещенный гидрокси, амино, C1-6 алкилС(=O)N(R5)-. Дополнительно представляющие интерес соединения представляют собой такие соединения формулы (II-а), где -А-В- представляет собой двухвалентный радикал формулы (а-3), где каждый атом водорода может быть, независимо,замещен C1-6 алкилом, галогеном, гидрокси, илиC1-6 алкилокси. Другими представляющими интерес соединениями являются такие соединения формулы (II-а), где Z представляет собой двухвалентный радикал формулы (b-1), и n равно 1. Соединения формулы (I), могут быть получены снятием защиты с промежуточного соединения формулы (II), где Р является защитной группой, например, бензилом, или такими защитными группами, которые рассмотрены в главе 7 "Protective Groups in Organic Synthesis" by T. Greene и Р. Wuyts (JohnWileySons, Inc. 1991). Указанная реакция снятия защиты может быть осуществлена с помощью, например, каталитического гидрирования в присутствии водорода и соответствующего катализатора в реакционноинертном растворителе. Соответствующим катализатором в указанной выше реакции является, например, платина-на-угле, палладийна-угле, и тому подобное. Соответствующим реакционно-инертным растворителем для указанного взаимодействия является, например,спирт, например, метанол, этанол, 2-пропанол, и тому подобное, сложный эфир, например этилацетат, и тому подобное, кислота,например, уксусная кислота, и тому подобное. Все полученные таким образом соединения со снятой защитой могут быть необязательно дополнительно дериватизованы либо заменой водорода на азоте пиперидина остатком, принадлежащим к L, либо введением на имидазольном остатке группы R1 или группы R2,или групп R1 и R2, либо с помощью дериватизации как пиперидинового остатка, так и имидазольного остатка. Промежуточное соединение формулы II может быть также сначала дериватизовано по имидазольному остатку с помощью введения группы R1 или группы R2, или групп R1 и R2, что приводит к получению промежуточного соединения формулы (II-а), а затем лишено защиты с последующей необязательной дериватизацией по азоту пиперидина.La, и указанные соединения, представлены формулой (I-b), могут быть получены взаимодействием соединения формулы (I), где L представляет собой водород, указанные соединения представлены формулой (I-с), с реагентом формулыLa-W1 (IV), где W1 представляет собой соответствующую уходящую группу, такую как атом галогена, например, атом хлора, или мезилат,тозилат, трифторметансульфонат. Альтернативно, соединения формулы (I),где Z представляет собой двухвалентный радикал формулы -СН 2-С(=O)- (b-5), указанные соединения, представленные формулой (I-а), могут быть получены с помощью циклизации промежуточного соединения формулы (III) в присутствии кислоты, например, трифторметансульфоновой кислоты, и тому подобное.(преобразования) одного из соединений формулы (I) в другое, в соответствии с одной из реакций преобразования групп, известных в данной области. Соединения формулы (I) могут быть преобразованы в соответствующие N-оксидные формы, следуя известным в данной области процедурам для преобразования трехвалентного азота в его N-оксидную форму. Указанная реакция N-окисления может быть, как правило,осуществлена с помощью взаимодействия исходного материала формулы (I) с соответствующей органической или неорганической перекисью. Соответствующие неорганические перекиси включают, например, перекись водорода, перекиси щелочных металлов или щелочно-земельных металлов, например, перекись натрия, перекись калия; подходящие органические перекиси могут включать пероксикислоты такие, например, как бензолкарбоперокси кислота или галоген-замещенная бензолкарбоперокси кислота, например, 3-хлорбензолкарбоперокси кислота, пероксоалкановые кислоты,например, пероксоуксусная кислота, алкилгидроперекиси, например, третбутил гидроперекись. Соответствующими растворителями являются, например, вода, низкоатомные спирты,например, этанол, и тому подобное, углеводороды, например, толуол, кетоны, например, 2 бутанон, галогенированные углеводороды, например, дихлорметан, и смеси таких растворителей. Указанное взаимодействие удобно проводить в реакционно-инертном растворителе таком, например, как ароматический углеводород,алканол, кетон, простой эфир, диполярный апротонный растворитель, галогенированный углеводород или смесь таких растворителей. Добавление соответствующего основания такого,например, как карбонат щелочного или щелочно-земельного металла, бикарбонат, алкоксид,гидрид, амид, гидроксид или оксид, или органического основания, такого, например, как амин,может использоваться для удаления кислоты,которая освобождается в ходе взаимодействия. В некоторых случаях желательно добавление йодидной соли, предпочтительно, йодида щелочного металла. Слегка повышенные температуры и перемешивание могут повысить скорость реакции. Соединения формулы (I-b), где La является необязательно замещенным C1-6 алкилом (указанный La представлен La1) и указанные соединения - формулой (I-b-1), могут быть преобразованы в соединения формулы (I-с) деалкилированием и последующим карбонилированием соединений формулы (I-b-1) с помощью реагента формулы (V), где W2 представляет собой соответствующую уходящую группу, такую как атом галогена, например, хлор, и La2 представляет собой C1-6 алкилоксикарбонил, что приводит к получению соединений формулы (I-b-2), и последующего гидролиза полученных таким образом соединений формулы (I-b-2). Взаимодействие с реагентом (V) удобно проводить с помощью перемешивания и нагревания исходного материала с реагентом в соответствующем растворителе и в присутствии соответствующего основания. Соответствующими растворителями являются, например, ароматические углеводороды, например, метилбензол, 11 диметилбензол, хлорбензол; простые эфиры,например 1,2-диметоксиэтан; метиленхлорид, и тому подобные растворители. Соответствующими основаниями являются, например, карбонаты щелочных и щелочно-земельных металлов,бикарбонаты, гидроксиды, или органические основания, такие как, N,N-диэтилэтанамин, N(1-метилэтил)-2-пропанамин, и тому подобное. Соединения формулы (I-b-2) гидролизируют в кислотных или основных средах, следуя обычным способам. Например, могут быть использованы концентрированные кислоты, такие как бромисто-водородная,хлористо-водородная кислота или серная кислота, или альтернативно,могут быть использованы основания, такие как гидроксиды щелочных и щелочно-земельных металлов, в воде, в алканоле или в смеси водаалканол. Соответствующими алканолами являются метанол, этанол, 2-пропанол и тому подобное. В порядке увеличения скорости реакции, является полезным нагревание реакционной смеси, в частности, до температуры кипения с обратным холодильником. Соединения формулы (I-b-2) могут быть также получены взаимодействием соединений формулы (I-с) с реагентом формулы (V) в присутствии соответствующего основания, например, N,N-диэтилэтанамина, в реакционноинертном растворителе, например, метиленхлориде, или с помощью взаимодействия соединений формулы (I-с) с реагентом формулы (VI),например, трет-бутилоксиангидридом, в соответствующем растворителе, таком, например,как метиленхлорид.R представляют собой гидроксиметил (указанные соединения представлены формулой (I-b-3) и (I-b-4, могут быть получены взаимодействием соединений формулы (I), где L представляет собой La, и R1 и R2 представляют собой водород,указанные соединения представлены формулой(I-b-5), с формальдегидом, необязательно в присутствии соответствующей смеси карбоновая кислота - карбоксилат, такой как, например,уксусная кислота - ацетат натрия, и тому подобное. Для увеличения скорости реакции полезно нагревание реакционной смеси до температуры кипения с обратным холодильником. Полученные таким образом соединения формулы (I-b-3) и (I-b-4) могут быть дополнительно окислены до соответствующего альдегида, представленного формулами (I-b-6) и (I-b-7),или до соответствующей карбоновой кислоты,представленной формулами (I-b-8) и (I-b-9),взаимодействием соответствующих реагентов,2 12 таких, например, как окись марганца (IV), соответственно, нитрат серебра. Соединения формулы (I-b-8) и (I-b-9) могут быть дополнительно преобразованы в соответствующий амид, представленный формулами Соединения формулы (I), где L представляет собой La, и R1 или R1 и R2 представляют собой галоген (указанные соединения представлены формулами (I-b-12) и (I-b-13 могут быть получены галогенированием соединения формулы (I-b-5) с помощью соответствующего галогенирующего реагента в реакционноинертном растворителе. Соответствующим галогенирующим реагентом для указанной выше реакции является,например, N-галогенированный амид, например,N-бромсукцинимид. Соответствующим реакционно-инертным растворителем для указанной реакции галогенирования является, например,N,N-диметилформамид, N,N-диметилацетамид,метиленхлорид, и тому подобное. Другим подходящим галогенирующим реагентом является,например, тетрабутиламмонийтрибромид в присутствии соответствующего основания, напри 13 мер, карбоната натрия, в соответствующем растворителе, например, 3-метил-2-бутаноне или в смеси дихлорметан/вода. Соединения формулы (I-b-12) могут быть преобразованы в соединение формулы (I-b-10) взаимодействием с CuCN в присутствии соответствующего растворителя, например, смеси(I-b-14 могут быть получены взаимодействием соединения формулы (I-b-6) с реагентом формулы (VII) в присутствии основания, например,пиперидина, пиридина, и тому подобное. Соединения формулы (I-b-14) могут быть дополнительно гидролизированы в соединение формулы (I-b), где R1 представляет собой карбоксиэтенил, в присутствии кислоты или основания, в случае, когда La представляет собой C1-6 алкил, или в присутствии основания, в случае,когдаC16 алкилоксикарбонил. Соединения формулы (I-b), где La представляет собой замещенный этил (указанный La представлен La3-CH2-CH2-, и указанные соединения - формулой (I-b-15 могут быть получены взаимодействием соединения формулы (I-с) с реагентом формулы (VIII) в присутствии соответствующего основания, например, бикарбоната натрия или триэтиламина, в соответствующем реакционно-инертном растворителе, например, N,N-диметилформамиде, или в соответствующем алканоле, например, в метаноле. Соединения формулы (I-с) могут также быть преобразованы в соединения формулы (Ib-15) (где La3 представляет собой гидрокси, указанные соединения представлены формулой (Ib-15-1 взаимодействием с этиленоксидом в присутствии соответствующего основания, например, триэтиламина, в соответствующем реакционно-инертном растворителе, таком как алканол, например, метанол. 14 Соединения формулы (I), где Z представляет собой двухвалентный радикал формулы CH2-CHOH- (b-3) (указанные соединения представлены формулой (I-d могут быть получены восстановлением соединения формулы (I-а) в присутствии восстанавливающего реагента, например, боргидрида натрия, в реакционноинертном растворителе, например, в метаноле, и тому подобное. Соединения формулы (I), где Z представляет собой двухвалентный радикал формулы CH2-C(=N-OH)- (b-6) (указанные соединения представлены формулой (I-е, могут быть получены взаимодействием соединения формулы Соединения формулы (I), где Z представляет собой двухвалентный радикал формулы СН=СН- (b-2) (указанные соединения представлены формулой (I-f, могут быть получены взаимодействием соединения формулы (I-d) в присутствии кислоты, например, метансульфоновой кислоты, и тому подобное. Соединения формулы (I-b) (где La представляет собой C1-6 алкил, замещенный C1-6 алкилоксикарбонилом или C1-6 алкилоксикарбонилNН-) могут быть преобразованы в соединения формулы (I-b), где La представляет собойC1-6 алкил или аминоС 1-6 алкил, реакцией гидролиза, описанной выше для получения соединений формулы (I-с). В приведенных выше и последующих получениях, реакционная смесь удаляется, следуя методикам, известным в данной области, и продукт реакции выделяется и, если это необходимо, дополнительно очищается. Как описано выше, промежуточные соединения формулы (II) могут быть дериватизованы по имидазольному фрагменту (указанные соединения представлены формулой (II-а перед снятием защиты. 15 Введение R1 или R1 и R2, где R1 и R2 представляют гидроксиметил, формил, карбоксил или амид, в соединение формулы (II) может быть осуществлено таким образом, как описывается выше для получения соединений формул(I-b-3), (I-b-4), (I-b-6), (I-b-7), (I-b-8), (I-b-9), (I-b10), (I-b-11). Промежуточные соединения формулы (IIa), где R1 представляет собой аминометил, и R2 представляет собой водород (указанные промежуточные соединения представлены формулой(II-b могут быть получены взаимодействием промежуточного соединения формулы (II-с) с водородом и смесью метанол/аммоний в присутствии соответствующего катализатора, например, родия на алюминии, в присутствии каталитического яда, например, раствора тиофена. Промежуточные соединения формулы (IIa), где R1 представляет собой -CH2NHC(=O)NH2,и R2 представляет собой водород (указанные промежуточные соединения представлены формулой (II-а могут быть получены взаимодействием промежуточного соединения формулы Промежуточные соединения формулы (IIb) могут также быть преобразованы в промежуточное соединение формулы (II-а), где R1 представляет собой -CH2NHC(=O)C1-6 алкил, и R2 представляет собой водород (указанное промежуточное соединение представлено формулой(IX), где W3 представляет собой соответствующую уходящую группу, такую как атом галогена, например, хлора, в присутствии соответствующего основания,например,N,N-диэтилэтанамина, в реакционно-инертном растворителе, таком, например, как метиленхлорид. Промежуточные соединения формулы (IIb) могут далее быть преобразованы в промежуточное соединение формулы (II-а), где R1 представляет собой -CH2NHS(=O)2C1-6 алкил, и R2 представляет собой водород (указанное проме 004500 16 жуточное соединение представлено формулой(X), где W4 представляет собой соответствующую уходящую группу, такую как атом галогена, например хлор, в присутствии соответствующего основания, например N,N-диэтилэтанамина, в реакционно-инертном растворителе, таком как метиленхлорид. Промежуточные соединения формулы (II) могут также быть галогенированы согласно процедуре, описанной для получения соединений формулы (I-b-12) и (I-b-13), с получением промежуточного соединения формулы (II-g) и Промежуточные соединения формулы (IIg) и (II-h) могут быть преобразованы в промежуточное соединение формулы (II-i) и (II-j) взаимодействием в атмосфере аммиака и моноокиси углерода при повышенных температурах в присутствии соответствующего катализатора,например, уксусной кислоты, соли палладия, и соответствующего лиганда, например, 1,3 бис(дифенилфосфино)пропана, в реакционноинертном растворителе, например, тетрагидрофуране. В следующих далее абзацах описаны несколько способов получения исходных материалов для указанных выше получений. Промежуточные соединения формулы (II),где Z представляет собой двухвалентный радикал формулы -(СН 2)р- (b-1), указанный Z представлен Z1, и указанные промежуточные соединения представлены формулой (II-k), могут быть получены с помощью циклизации спирта формулы (XI). Промежуточные соединения формулы (II-k) могут быть, необязательно, дериватизованы по имидазольному фрагменту с получением промежуточного соединения формулы (II-а-1) согласно методикам, описанным для получения соединения формулы (I-b-3), (I-b4), (I-b-6)-(I-b-11) и промежуточного соединения формулы (II-b)-(II-j).(XIV) могут быть получены циклизацией промежуточного соединения формулы (XVI) согласно процедуре, описанной для получения промежуточного соединения формулы (II-k). Указанную реакцию циклизации удобно проводить с помощью обработки промежуточного соединения формулы (XI) соответствующей кислотой, при этом получается реакционноспособное промежуточное соединение, которое циклизуется до промежуточного соединения формулы (II-k). Соответствующими кислотами являются, например, сильные кислоты, например метансульфоновая кислота, трифторуксусная кислота, и в особенности, системы суперкислот, например трифторметансульфоновая кислота, или кислоты Льюиса, такие как АlСl3 илиSnCl4. Очевидно, только те соединения формулы II, где Р является стабильным при данных условиях реакции, могут быть получены согласно указанной выше процедуре реакции. Промежуточные соединения формулы (XI) могут быть получены с помощью взаимодействия имидазольного соединения формулы (XII) с кетоном формулы (XIII). Указанную реакцию удобно проводить в реакционно-инертном растворителе таком, например, как тетрагидрофуран, в присутствии соответствующего основания, такого как литий диизопропиламид и бутиллитий. Промежуточные соединения формулы (II),где Z представляет двухвалентный радикал формулы -(CH2)p- (b-1), или -СН 2-O- (b-4), указанный Z представлен Z2, и указанные промежуточные соединения представлены формулой(II-1), могут также быть получены с помощью взаимодействия трициклического остатка формулы (XIV) с реагентом формулы (XV), где W5 представляет соответствующую уходящую группу, например, атом галогена, такой как хлор, в инертной атмосфере и в реакционноинертном растворителе, таком как тетрагидрофуран, в присутствии соответствующего основания, такого как, например, литий диизопропиламид и бутиллитий. Промежуточные соединения формулы (II-1) могут, необязательно, быть дериватизованы по имидазольному фрагменту с получением промежуточного соединения формулы (II-a-2) согласно процедурам, описанным для получения соединения формулы (I-b-3), (I-b4), (I-b-6)-(I-b-11) и промежуточного соединения формулы (II-b)-(II-j).(XVI) могут быть получены восстановлением из соответствующих альдегидов, указанные промежуточные соединения представлены формулой (XVII). Указанное восстановление может быть осуществлено в соответствующем растворителе,таком, например, как метанол, в присутствии соответствующего восстанавливающего агента,такого как боргидрид натрия. Промежуточные соединения формулы(XVI) могут также быть получены с помощью взаимодействия промежуточного соединения формулы (XVIII) с 38% раствором формола под давлением. Альтернативно, трициклические остатки формулы (XIV), где Z представляет двухвалентный радикал формулы -СН 2-, указанный Z представлен Z3, и указанные трициклические остатки представлены формулой (XIV-a), могут быть получены также сначала циклизацией промежуточного соединения формулы (XVII), где Z2 представляет Z3, указанное промежуточное соединение представлено формулой (XVII-a), обработкой указанного промежуточного соединения соответствующей кислотой, например,трифторуксусной кислотой, с получением промежуточного соединения формулы (XIX), а затем восстановлением в присутствии соответствующего восстанавливающего агента. Указанная реакция восстановления может быть осуществлена в присутствии водорода и соответствующего катализатора в реакционноинертном растворителе. Соответствующим катализатором в указанной выше реакции является, например, платина-на-угле, палладий-наугле, и тому подобное. Соответствующим реак 19 ционно-инертным растворителем для указанной реакции является, например, спирт, например метанол, этанол, 2-пропанол, и тому подобное,сложный эфир, например, этилацетат, и тому подобное, кислота, например, уксусная кислота,и тому подобное. Промежуточные соединения формулы (III) могут быть получены взаимодействием промежуточного соединения формулы (XX) с реагентом формулы (XXI), где W6 представляет собой соответствующую уходящую группу, такую как атом галогена, например, хлора, в присутствии соответствующего основания, например, гидрида натрия, в реакционно-инертном растворителе, например в N,N-диметилформамиде, и тому подобное.(указанные промежуточные соединения представлены формулой (ХХ-а, могут быть получены с помощью дебензилирования промежуточного соединения формулы (XXII). Указанная реакция дебензилирования может осуществляться с помощью, например, каталитического гидрирования в присутствии водорода и соответствующего катализатора в реакционно-инертном растворителе. Соответствующим катализатором для указанной выше реакции является, например, платина-на-угле,палладий-на-угле, и тому подобное. Соответствующим реакционно-инертным растворителем для указанной реакции является, например,спирт, например, метанол, этанол, 2-пропанол, и тому подобное, сложный эфир, например, этилацетат, и тому подобное, кислота, например,уксусная кислота, и тому подобное. Промежуточные соединения формулы(XXII) могут быть получены с помощью образования имидазола из промежуточного соединения формулы (XXIII) в кислоте, такой как хлористо-водородная кислота.(XXIII) могут быть получены с помощью взаимодействия промежуточного соединения фор 004500(XXIV) могут быть получены с помощью взаимодействия промежуточного соединения формулы (XXV) с тионилхлоридом.(XXV) могут быть получены с помощью замещения промежуточного соединения формулы Чистые стереохимические изомерные формы соединения формулы (I) могут быть получены с помощью применения процедур, известных в данной области. Диастереомеры могут быть разделены с помощью физических методов, таких как селективная кристаллизация и хроматографические методики, например, противоточное распределение, жидкостная хроматография, и тому подобное. Соединения формулы (I), как они получаются в описанных выше способах, являются, как правило, рацемическими смесями энантиомеров, которые могут быть отделены друг от друга, следуя известным в данной области процедурам разделения. Рацемические соединения формулы (I), которые являются достаточно основными или кислотными, могут быть преобразованы в соответствующие формы диастереомерных солей с помощью взаимодействия с соответствующей хиральной кислотой или хиральным основанием, соответственно. Указанные формы диастереомерных солей впоследствии разделяются, например, с помощью селективной или фракционной кристаллизации, и энантиомеры высвобождаются из них с помощью щелочи или кислоты. Альтернативный способ разделения энантиомерных форм соеди 21 нений формулы (I) включает жидкостную хроматографию, в частности, жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные чистые стереохимически изомерные формы могут также быть получены из соответствующих чистых стереохимически изомерных форм соответствующих исходных материалов, при условии, что взаимодействие осуществляется стереоспецифично. Предпочтительно, если желаемым является конкретный стереоизомер, указанное соединение синтезируется с помощью стереоспецифических способов получения. Эти способы предпочтительно используют стереохимически чистые исходные материалы. Ряд промежуточных соединений и исходных материалов являются коммерчески доступными или являются известными соединениями,которые могут быть получены в соответствии с известными методами взаимодействий, в целом известными в данной области. Например, получение 1-(1-фенилэтил)-1H-имидазола описано вWO 92/22551. Соединения формулы (I), их пролекарства,N-оксиды, соли присоединения, четвертичные амины и стереохимически изомерные формы обладают полезными фармакологическими свойствами. В частности, они являются активными антигистаминными агентами, активность которых может быть продемонстрирована, например, с помощью "Histamine-induced LethalityTher., 251, 39-51, 1981 and Drug Dev. Res., 8, 95102, 1986). Некоторые из промежуточных соединений формулы (II-а) также имеют фармакологические свойства, представляющие интерес. Соединения по настоящему изобретению имеют селективную аффинность связывания по отношению к H1 рецептору, более конкретно,они имеют очень низкую аффинность по отношению к рецептору серотонина 5HT2A и к рецептору серотонина 5 НТ 2C. Эта разница между аффинностью связывания с рецептором H1 и аффинностью связывания с рецепторами 5 НТ 2C и 5 НТ 2 А делает маловероятным для настоящих соединений стимуляцию аппетита и нежелательное увеличение веса, о котором сообщается для некоторых других антагонистов H1. Важным достоинством настоящих соединений является отсутствие у них седативных свойств при терапевтических уровнях доз, что является вызывающим проблемы побочным действием, связанным со многими антигистаминными и противоаллергическими соединениями. Неседативные свойства настоящих соединений могут быть продемонстрированы, например, с помощью результатов, полученных 22 при изучении цикла сон-бодрствование у крыс(Psychopharmacology, 97,436-442, (1989 и состояния бессонницы с использованием спектров ЭЭГ у бодрствующих крыс (Sleep Research 24A,118, (1995. Соединения по настоящему изобретению характеризуются также отсутствием сопутствующих кардио-гемодинамических и электрофизиологических эффектов, таких как пролонгация QTc. Дополнительным преимуществом некоторых из настоящих соединений является то, что они проявляют небольшие изменения метаболизма в печени животных и человека или их отсутствие, таким образом, указывая на низкий риск метаболических взаимодействий. Другая особенность настоящих соединений, представляющая интерес, относится к быстрому наступлению их действия и приемлемой длительности их действия. Последняя характеристика может сделать возможным введение соединения только раз в день. Настоящие соединения имеют благоприятные физико-химические свойства, в частности, в отношении растворимости и химической стабильности. Ввиду их физико-химических и фармакологических свойств, соединения формулы (I), их пролекарства, N-оксиды, соли присоединения,четвертичные амины и их стереохимически изомерные формы являются очень полезными при лечении большого набора аллергических заболеваний, таких как, например, аллергический ринит, аллергический конъюнктивит, хроническая крапивница, зуд, аллергическая астма,и тому подобное. Также, ввиду их полезных физикохимических и фармакологических свойств, рассматриваемые соединения могут быть приготовлены в различных фармацевтических формах для целей введения. Для приготовления противоаллергических композиций по настоящему изобретению, эффективное количество конкретного соединения, в форме соли присоединения основания или кислоты, в качестве активного ингредиента объединяется в однородной смеси с фармацевтически приемлемым носителем, этот носитель может принимать множество различных форм, в зависимости от желаемого препарата для введения. Эти фармацевтические композиции предпочтительно находятся в форме единичных стандартных дозировок, вводимых перорально, парентерально, подкожно, ректально или местно, для системного действия или для местного действия. В случае жидких фармацевтических препаратов для перорального введения, содержащих растворы, суспензии,сиропы, эликсиры и эмульсии, могут быть использованы любые обычные фармацевтические среды, такие, например, как вода, гликоли, масла, спирты, и тому подобное, в то время как в случае твердых фармацевтических препаратов 23 для перорального введения, содержащих порошки, пилюли, капсулы и таблетки, могут быть использованы наполнители, такие как крахмалы, сахара, каолин, связывающие вещества,связующие, разрыхляющие агенты, и тому подобное. Благодаря простоте их введения, таблетки и капсулы представляют собой самые преимущественные формы стандартных пероральных доз, в этом случае, очевидно, используются твердые фармацевтические носители. В случае фармацевтических композиций для инъекций, носитель обычно содержит стерильную воду, по меньшей мере, в большей части, хотя могут быть включены другие ингредиенты, такие, например, как полуполярные растворители,для повышения растворимости. Примеры носителей для растворов для инъекций включают солевой раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. Растворы для инъекций, содержащие соединения указанных выше формул, могут также быть приготовлены в масле для пролонгирования их действия. Соответствующие масла для этой цели представляют собой, например, арахисовое масло, кунжутное масло, хлопковое масло, кукурузное масло, соевое масло, синтетические глицериновые сложные эфиры жирных кислот с длинной цепью и смеси этих и других масел. Для приготовления суспензий для инъекций могут быть использованы соответствующие жидкие носители, суспендирующие агенты, и тому подобное. В композициях, предназначенных для подкожного введения, носитель необязательно содержит агент для улучшения проницаемости и/или соответствующий смачивающий агент, необязательно объединенный с соответствующими добавками любой природы в малых пропорциях, эти добавки не должны оказывать никаких значительных вредных воздействий на кожу. Указанные добавки могут облегчать введение в кожу и/или быть полезными для приготовления желаемых композиций. Эти композиции могут различными путями, например, как накожный пластырь, мушка, как мазь или как гель. В случае фармацевтических композиций для ректального введения, могут быть использованы любые обычные наполнители, включая наполнители на основе жиров и водорастворимые наполнители, необязательно объединенные с соответствующими добавками, такими как суспендирующие или смачивающие агенты. В качестве соответствующих композиций для местного нанесения могут быть упомянуты все композиции, обычно используемые для местного введения лекарственных средств, например,кремы, гели, повязки, примочки, шампуни, настойки, пасты, мази, лечебные мази, драже, порошки, ингаляции, спреи для носа, глазные капли, и тому подобное. Полутвердые композиции,такие как лечебные мази, кремы, гели, мази, и тому подобное, удобно использовать, но нанесение указанных композиций может происхо 004500 24 дить, например, также с помощью аэрозоля,например, с помощью пропеллента, такого как азот, двуокись углерода, фреон, или без пропеллента, например, с помощью механического распылителя или капель. Особенно удобно приготовление указанных выше фармацевтических композиций в форме стандартных единичных доз, для простоты введения и однородности дозирования. Единичная стандартная доза, как она используется в описании и формуле изобретения, относится к физически дискретным единицам, пригодным для использования в качестве стандартных доз,при этом каждая единица содержит заданное количество активного ингредиента, рассчитанного на осуществление желаемого терапевтического воздействия, в сочетании с требуемым фармацевтическим носителем. Примерами таких стандартных единичных доз являются таблетки (включая разделяемые или покрытые таблетки), капсулы, пилюли, пакетики с порошком,суппозитории, драже, облатки, растворы или суспензии для инъекций, дозы для чайной ложки, дозы для столовой ложки, и тому подобное,и их наборы с разделением дозировок. Настоящее изобретение также относится к способу лечения теплокровных животных, страдающих от аллергических заболеваний, введением указанным теплокровным животным эффективного противоаллергического количества соединения формулы (I), его пролекарства, Nоксида, соли присоединения, четвертичного амина или их стереохимически изомерной формы. Настоящее изобретение также относится к соединениям формулы (I), их пролекарствам, Nоксидам, солям присоединения, четвертичным аминам и их стереохимически изомерным формам для использования в качестве лекарственного средства, и, следовательно, использование настоящих соединений для производства лекарственного средства для лечения теплокровных животных, страдающих от аллергических заболеваний, также является частью настоящего изобретения. Как правило, предполагается, что эффективное противоаллергическое количество может составлять от около 0,001 мкг/кг до около 2 мг/кг массы тела, и более предпочтительно, от около 0,01 до около 0,5 мг/кг массы тела. В любом случае, эффективное противоаллергическое количество может зависеть от типа и тяжести заболевания, подлежащего лечению, и оценки врача, предписывающего лечение с помощью рассматриваемых лекарственных средств. Следующие далее примеры предназначаются для иллюстрации объема настоящего изобретения. Экспериментальная часть Далее, ТГФ обозначает тетрагидрофуран,DIPE обозначает диизопропиловый сложный 25 эфир, ДМФ обозначает N,N-диметилформамид,DIPA обозначает диизопропиламин. А. Приготовление промежуточных соединений. Пример А 1. а) Смесь DIPA (1,4 моль) в ТГФ (3000 мл) перемешивают при -70 С в потоке N2. По частям добавляют бутиллитий 2,5 М/гексан (1,3 моль) при температуре ниже -40 С. Смесь перемешивают при -70 С в течение 15 мин. 1 Фенилэтил-1 Н-имидазол (1 моль), растворенный в ТГФ, добавляют по каплям при температуре ниже -55 С. Смесь перемешивают при-70 С в течение 1 ч. 1-(Фенилметил)-4-пиперидинон (1,2 моль), растворенный в ТГФ, добавляют по каплям при температуре ниже-55 С. Смесь перемешивают при -70 С в течение 1 ч, затем температуру доводят до комнатной, перемешивают при комнатной температуре в течение ночи и разлагают с помощью Н 2 О. Органический растворитель выпаривают. Водный концентрат экстрагируют CH2Cl2. Органический слой отделяют, сушат (МgSO4), фильтруют, и растворитель выпаривают. Остаток кристаллизуют из DIPE (1100 мл). Осадок отфильтровывают, промывают DIPE и сушат, получая 271 г 4-[1-(2-фенилэтил)-1 Н-имидазол-2-ил]-1(фенилметил)-4-пиперидинола (75%) (промежуточное соединение 1).b) Смесь промежуточного соединения (1)(0,75 моль) в трифторметансульфоновой кислоте (1500 мл) перемешивают при 65 С в течение 120 ч, затем охлаждают, выливают на лед, подщелачивают NaOH 50% и экстрагируют СН 2 Сl2. Органический слой отделяют, сушат (МgSO4),фильтруют, и растворитель выпаривают. Остаток кристаллизуют из DIPE/CH3CN (99/1) (1200 мл). Осадок отфильтровывают и сушат, получая 169,6 г 5,6-дигидро-1'-(фенилметил)спиро[11Hимидазо[2,1-b][3]бензазепин-11,4'-пиперидина](66%) (промежуточное соединение 2). Пример А 2. 1-(Фенилметил)-4-[1-(фенилметил)-1 Нимидазол-2-ил]-4-пиперидинол (0,124 моль) и АlСl3 (0,31 моль) перемешивают в расплаве при 120 С в течение 1 ч. Смесь охлаждают, добавляют АlСl3 (0,31 моль), и смесь перемешивают при 120 С в течение 1 ч. Смесь выливают на лед, подщелачивают NaOH 50% и экстрагируют СН 2 Сl2. Органический слой сушат (MgSO4), отфильтровывают и выпаривают. Остаток очищают с помощью ВЭЖХ (элюент: CH2Cl2/(СН 3 ОН/NН 3) 99/1). Чистые фракции собирают и выпаривают. Остаток преобразуют в соль хлористо-водородной кислоты (1:2) в (C2H5)2O, получая 0,91 г 1'-(фенилметил)спиро [имидазо[1,2-b]изохинолин-10[5 Н],4'-пиперидин]дигидрохлорида дигидрата (2%) (промежуточное соединение 3; т.пл. 161,2 С). Пример A3. а) Смесь промежуточного соединения (2) 26 По частям добавляют 1-бром-2,5-пирролидиндион(0,09 моль) в течение 1-часового периода. Органический слой отделяют, промывают Н 2 О, сушат,фильтруют, и растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 97,5/2,595/5). Чистую фракцию собирают, и растворитель выпаривают. Остаток растворяют в этаноле и преобразуют в соль (Е)-2-бутендиойной кислоты[11 Н-имидазо[2,1-b][3]бензазепин-11,4'-пиперидина (Е)-2-бутендиоата (1:1) (36%) (промежуточное соединение 4). Часть этой фракции (16,5 г) извлекают с помощью H2O, K2 СО 3 и CH2Cl2. Смесь разделяют на слои. Водный слой экстрагируют СН 2 Сl2. Объединенный органический слой сушатb) Смесь промежуточного соединения (4 а)NH3 (10 атм) и СО (30 атм). Смесь фильтруют, и фильтрат выпаривают. Этот остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/С 2 Н 5OН 100/0 в течение 46 мин до 70/30). Чистые фракции собирают, и растворитель выпаривают, получая 36 г 5,6 дигидро-1'-(фенилметил)спиро[11 Н-имидазоa) Смесь промежуточного соединения (2)(0,16 моль) и ацетата натрия (45 г) в формоле 38% (300 мл) и уксусную кислоту (30 мл) перемешивают и нагревают с обратным холодильником в течение 6 ч, затем охлаждают, выливают на лед и подщелачивают раствором NaOH. Осадок отфильтровывают и очищают с помощью колоночной хроматографии на силикагелеb) Смесь промежуточного соединения (6)c) Смесь промежуточного соединения (7)(0,0296 моль) в СН 3 ОН/NН 3 (500 мл) гидрируют при 50 С, с Rh/Аl2 О 3 5% (2 г) в качестве катали 27 затора, в присутствии раствора тиофена (2 мл). После поглощения Н 2 (1 эквив.), катализатор отфильтровывают, и фильтрат выпаривают, получая 11 г 5,6-дигидро-1'-(фенилметил)спиро[11H-имидазо[2,1-b][3]бензазепин-11,4'-пиперидин]-3-метанамина (промежуточное соединение 8). Часть этой фракции (1 г) очищают с помощью колоночной хроматографии на силикагеле(элюент: CH2Cl2/(СН 3 ОН/NН 3) 95/5). Чистые фракции собирают, и растворитель выпаривают. Остаток растворяют в 2-пропаноле и преобразуют в соль хлористо-водородной кислоты (1:3) с помощью 2-пропанол/HCl. Смесь кристаллизуют из DIPE. Осадок отфильтровывают и сушат, получая 0,8 г 5,6-дигидро-1'-(фенилметил)спиро[11 Н-имидазо[2,1-b][3]бен-зазепин-11,4'пиперидин]-3-метанамин гидрохлорида (1:3) гидрата (1:1) (промежуточное соединение 8 а).d) Смесь промежуточного соединения (8)(0,0198 моль) в 1 н НСl (50 мл) перемешивают при 50 С. Добавляют по частям KОСN (0,023 моль) (4 х 0,5 г). Смесь перемешивают при 50 С в течение 2 ч, затем охлаждают, нейтрализуют раствором NaHCO3 и экстрагируют СН 2 Сl2. Органический слой отделяют, промывают Н 2O,сушат, фильтруют, и растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле(элюент: СН 2 Сl2/(СН 3 ОН/NН 3) 95/5). Чистые фракции собирают и растворитель выпаривают, получая 4,3 г N-5,6-дигидро-1'-(фенилметил)спиро[11 Н-имидазо[2,1-b][3]бензазепин]-3-ил]метил] метил]мочевины (промежуточное соединение 9). Пример А 5. Смесь промежуточного соединения (8)(0,0295 моль) и триэтиламина (0,035 моль) в СН 2 Сl2 (140 мл) перемешивают при комнатной температуре. Добавляют по каплям раствор ацетилхлорида (0,03 моль) в CH2Cl2 (10 мл). Смесь перемешивают при комнатной температуре в течение 1 ч и выливают в Н 2 О. ДобавляютK2 СО 3 (2 г). Смесь экстрагируют CH2Cl2. Органический слой отделяют, промывают Н 2O, сушат, фильтруют, и растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле(элюент: СН 2 Сl2/СН 3 ОН 97/3). Чистые фракции собирают и растворитель выпаривают. Часть остатка (1,3 г) очищают с помощью колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 95/5). Чистые фракции собирают, и растворитель выпаривают. Остаток растирают в DIPE,отфильтровывают и сушат, получая N-5,6 дигидро-1'-(фенилметил)спиро[11Hимидазо[2,1-b][3]бензазепин-11,4'-пиперидин]3-ил]метил]ацетамид (промежуточное соединение 10). Пример А 6. Смесь промежуточного соединения (8) 28 ке N2. Добавляют по каплям метансульфонилхлорид (0,013 моль). Смесь перемешивают в течение 2 ч. Добавляют Н 2O, и смесь экстрагируют CH2Cl2. Органический слой отделяют,промывают Н 2O, сушат, фильтруют, и растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 98/2). Чистые фракции собирают, и растворитель выпаривают, получая 2,1 г N-5,6-дигидро-1'-(фенилметил)спиро[11 Н-имидазо[2,1-b][3]бензазепин-11,4'-пиперидин]-3-ил]метил]метансульфонамида (промежуточное соединение 11). Пример А 7.a) 1-Метил-4-фенил-4-пиперидинкарбонилхлорид (0,49 моль) добавляют по частям при комнатной температуре к перемешиваемой смеси бензолметанамина (0,49 моль) и триэтиламина (1,223 моль) в СН 2 Сl2 (2500 мл). Смесь перемешивают при комнатной температуре в течение 1 ч. Добавляют K2 СО 3 (150 г) и Н 2O. Смесь перемешивают и разделяют на слои. Водный слой экстрагируют СН 2 Сl2. Объединенный органический слой сушат (МgSO4), фильтруют, и растворитель выпаривают, получая 144 г 1 метил-4-фенил-N-(фенилметил)-4-пиперидинкарбоксамида (95%) (промежуточное соединение 12).b) Смесь промежуточного соединения (12)(0,47 моль) в тионилхлориде (750 мл) перемешивают и нагревают с обратным холодильником в течение 1 ч. Растворитель выпаривают. Дважды добавляют толуол и выпаривают снова,получая 190 г N-[хлор(1-метил-4-фенил-4-пиперидинил)метилен]бензолметанамин моногидрохлорида (100%) (промежуточное соединение 13).c) Смесь промежуточного соединения (13)(0,47 моль) в ДМФ (750 мл) охлаждают на ледяной бане. Добавляют по каплям 2,2-диметоксиэтанамин (0,54 моль), растворенный в ДМФ. Смесь перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают, получая 210 г N-(2,2-диметоксиэтил)1-метил-4-фенил-N'-(фенилметил)-4-пиперидинкарбоксимидамид дигидрохлоридаd) Смесь промежуточного соединения (14)(0,47 моль) в НСl 6 н (1500 мл) перемешивают до тех пор, пока раствор не помутнеет, затем промывают CH2Cl2 (900 мл), перемешивают при 80 С в течение 1 ч, охлаждают, подщелачивают 50% раствором NaOH и экстрагируют СН 2 Сl2. Органический слой отделяют, сушат (MgSO4),фильтруют, и растворитель выпаривают. Остаток кристаллизуют из СН 3 СN. Осадок отфильтровывают и сушат, получая 38,3 г 1-метил-4 фенил-4-[1-(фенилметил)-1 Н-имидазол-2-ил] пиперидина (25%) (промежуточное соединение 15).e) Смесь промежуточного соединения (15) 29 комнатной температуре в течение 18 ч с палладием-на-угле 10% (3 г) в качестве катализатора. После поглощения H2 (1 эквив.), катализатор отфильтровывают, и фильтрат выпаривают. Остаток кристаллизуют из СН 3 СN. Осадок отфильтровывают и сушат, получая 42,3 г 4-(1 Нимидазол-2-ил)-1-метил-4-фенилпиперидинаf) Смесь гидрида натрия 60% (0,232 моль) в ДМФ (150 мл) перемешивают при комнатной температуре. Добавляют по каплям промежуточное соединение (16) (0,145 моль), растворенное в ДМФ (400 мл). Смесь перемешивают при комнатной температуре в течение 1 ч. Добавляют по каплям метил 2-хлорацетат (0,232 моль),растворенный в ДМФ (400 мл). Смесь перемешивают при комнатной температуре в течение 20 мин, выливают в раствор NаНСО 3 (20 г) вH2O (2000 мл) и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют, и растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагелеDIPA (0,455 моль) в ТГФ (500 мл) перемешивают при -78 С. Бутиллитий, 2,5 М/гексан (0,390 моль) добавляют по каплям при -40 С. Смесь перемешивают в течение 15 мин, затем повторно охлаждают до -78 С. Раствор 1-(4 фенилбутил)-1H-имидазола, полученный согласно процедуре, описанной в J. Chem. Soc.,Perkin Trans., 1 (1975), 17,1670-1671, (0,325 моль), в ТГФ (350 мл) добавляют по каплям при-60 С. Смесь перемешивают в течение 1 ч, затем повторно охлаждают до -78 С. Эту смесь добавляют по каплям к смеси N,N-диметилформамида (0,390 моль, сухой, ида.) в ТГФ (500 мл), перемешивают при -78 С. Реакционную смесь перемешивают в течение одного часа при-78 С, затем дают возможность нагреться до комнатной температуры, при этом перемешивая в течение ночи. Добавляют насыщенный водный раствор NH4Cl (400 мл), и эту смесь экстрагируют ТГФ. Отделенный органический слой сушат, фильтруют, и растворитель выпаривают,получая 74,2 г 1-(4-фенилбутил)-1 Н-имидазол 2-карбоксамида (промежуточное соединение 18).b) Смесь промежуточного соединения (18)(0,325 моль) в метаноле (1400 мл) перемешивают при комнатной температуре. Добавляют по частям NaBH4 (0,650 моль), и реакционную смесь перемешивают в течение 2 ч при комнатной температуре. Растворитель выпаривают. Остаток извлекают в воду, и эту смесь экстрагируют СН 2 Сl2. Отделенный органический слой 30 сушат, фильтруют, и растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагелеc) Смесь промежуточного соединения (19)(0,417 моль) в метансульфоновой кислоте (960 мл) перемешивают при 120 С в течение 40 ч,затем охлаждают, выливают на лед и подщелачивают с помощью NH4OH. Органический слой отделяют, сушат, фильтруют, и растворитель выпаривают. Эту фракцию очищают с помощью ВЭЖХ на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 97/3). Чистую фракцию собирают, и растворитель выпаривают. Остаток кристаллизуют изd) Смесь DIPA (0,151 моль) в ТГФ (650 мл) перемешивают при -78 С в потоке N2. Бутиллитий 2,5 М в гексане (0,144 моль) добавляют по каплям при температуре ниже -40 С. Смесь перемешивают при -78 С в течение 15 мин. Добавляют по каплям промежуточное соединение(20) (0,072 моль) в малом количестве ТГФ при температуре ниже -55 С. Смесь перемешивают при -78 С в течение 1 ч. N,N-бис(2-хлорэтил) бензолметанамин гидрохлорид в малом количестве ТГФ добавляют по каплям при температуре ниже -50 С. Смесь перемешивают при -78 С в течение 1 ч, дают возможность нагреться до комнатной температуры в течение ночи и разлагают с помощью Н 2 О. Органический растворитель выпаривают. Водный концентрат экстрагируют СН 2 Сl2. Органический слой отделяют, сушат, фильтруют, и растворитель выпаривают. Эту фракцию очищают с помощью колоночной хроматографии на силикагелеK2 СО 3 (0,68 моль) в ДМФ (400 мл) перемешивают при 90 С в течение 20 ч, охлаждают, выливают в Н 2O и фильтруют через дикалит. Фильтрат разделяют на слои. Органический слой промывают Н 2O, сушат (MgSO4), фильтруют, и растворитель выпаривают. Остаток очищают с помощью силикагеля на стеклянном фильтре (элюент: СН 2 Сl2/СН 3 ОН, 100/0-97/3). Чистые фракции собирают, и растворитель вы 31(промежуточное соединение 22). Пример А 10. Смесь промежуточного соединения (31)(промежуточное соединение 23). Пример A11. Смесь соединения (22) (0,0117 моль) и триэтиламина (0,0421 моль) в толуоле (100 мл) перемешивают и нагревают с обратным холодильником. Этилкарбонхлоридат (0,0702 моль) добавляют по каплям при температуре дефлегмации. Смесь перемешивают и нагревают с обратным холодильником в течение 1 ч, охлаждают, выливают в Н 2 О и K2 СО 3 (15 г) и разделяют на слои. Водный слой экстрагируют СН 2 Сl2. Объединенный органический слой сушат(МgSO4), фильтруют, и растворитель выпаривают. Остаток очищают с помощью силикагеля на стеклянном фильтре (элюент: СН 2 Сl2/этанол 96/4). Чистые фракции собирают, и растворитель выпаривают. Остаток кипятят в DIPE. Осадок отфильтровывают и сушат, получая 2,4 г [1'(этоксикарбонил)спиро[11 Н-имидазо-[2,1-b]-[3] бензазепин-11,4'-пиперидин)-6-ил]этилкарбоната (33%) (промежуточное соединение 24). Табл. 1 перечисляет промежуточные соединения, которые получают согласно одному из вышеописанных примеров. Таблица 1 В. Получение конечных соединений. Пример В 1 (пример получения). Смесь промежуточного соединения (2)(0,02 моль) в метаноле (150 мл) гидрируют палладием на угле 10% (2 г) в качестве катализатора при 50 С в течение 18 ч. После поглощения(соед. 6; в формуле изобретения не указывается). Эту фракцию преобразуют в соль хлористо-водородной кислоты (1:1) в СН 3 СN, получая 5 г 5,6-дигидроспиро[имидазо[1,2-b][3] бензазепин-11[11 Н],4'-пиперидин]моногидрохлорида (86%) (соед. 6 а; в формуле изобретения не указывается). Фракция, полученная указанным образом, может быть также преобразована в соль (Е)-2-бутендиойной кислоты. Пример В 2.a) Смесь соединения (6) (0,1 моль) и N,Nдиэтилэтанамина (0,13 моль) в CH2Cl2 (300 мл) перемешивают при температуре ниже 10 С. Этилкарбонохлоридат (0,12 моль) добавляют по каплям при этой температуре. Смеси дают возможность нагреться до комнатной температуры,а затем перемешивают при комнатной температуре в течение 1 ч. Добавляют воду и K2 СО 3 (10 г). Смесь разделяют на слои. Водный слой экстрагируют СН 2 Сl2. Объединенный органический слой сушат (МgSO4), фильтруют, и растворитель выпаривают, получая 35,4 г этил 5,6-дигидроспиро[11H-имидазо[2,1-b][3]бензазепин 11,4'-пиперидин]-1'-карбоксилата (100%) (соед. 4).b) Смесь соединения (4) (0,1 моль), ацетата натрия (0,3 моль) и уксусной кислоты (0,258 моль) в 38% растворе формальдегида (165 мл) перемешивают и нагревают с обратным холодильником в течение 10 ч. Смесь выливают на лед и раствор NaOH и экстрагируют CH2Cl2. Органический слой отделяют, сушат (МgSO4),фильтруют, и растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/этанол[11H-имидазо[2,1-b][3]бензазепин-11,4'-пиперидин]-3-метанола (88%) (соед. 18). Часть этой фракции (1 г) растворяют в СН 3 ОН и преобразуют в соль (Е)-2-бутендиойной кислоты (2:1). Осадок отфильтровывают и сушат, получая 0,6 г 5,6-дигидроспиро[11 Н-имидазо[2,1-b][3]бензазепин-11,4'-пиперидин]-3-метанольной соли (Е)2-бутендиойной кислоты (2:1) (соед. 18 а). Пример В 3. Смесь соединения (6) (0,01 моль) и(CH2O)n (0,066 моль) в метаноле (150 мл) и 4% раствор тиофена (1 мл) гидрируют с помощью палладия на угле 10% (1 г) в качестве катализатора при 50 С. После поглощения H2 (1 экв),катализатор фильтруют, и фильтрат выпаривают. Остаток извлекают в Н 2 О/K2 СО 3/NН 4 ОН и перемешивают. Смесь экстрагируют CH2Cl2,сушат, фильтруют и выпаривают. Остаток преобразуют в соль циклогексансульфаминовой кислоты (1:2) в 2-пропаноне и дважды перекристаллизовывают из 2-пропанола, получая 2,44 г 6,11-дигидро-1'-метилспиро[5 Н-имидазо[2,1-b]a) Смесь 1-бромбутана (0,012 моль), соединения (6) (0,01 моль), Na2CO3 (0,02 моль) и йодида калия (несколько кристаллов) в 2 бутаноне (200 мл) перемешивают и нагревают с обратным холодильником в течение ночи. Смесь выпаривают, остаток извлекают в воду и экстрагируют CH2Cl2. Органический слой сушат, отфильтровывают и выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле(СН 3 ОН/NН 3) 95/5). Чистые фракции собирают и выпаривают. Остаток преобразуют в соль хлористоводородной кислоты (1:2) в 2-пропаноле. Осадок фильтруют и сушат, получая 0,7 г 1'бутил-5,6-дигидроспиро[имидазо-[2,1-b][3]бензазепин-11-[11 Н],4'-пиперидин]дигидрохлорида хемигидрата (18%) (соед. 3). 34 ный слой экстрагируют CH2Cl2. Органический слой сушат (МgSO4), отфильтровывают и выпаривают. Остаток очищают с помощью силикагеля на стеклянном фильтре (элюент: CH2Cl2/ СН 3 ОН 90/10). Чистые фракции собирают и выпаривают. Остаток преобразуют в соль циклогексилсульфаминовой кислоты (1:2) в 2-пропаноне. Выход: 4,26 г 1'-[3-(4-фторфенокси)пропил]-5,6-дигидроспиро[имидазо[2,1-b][3]бензазепин-11-[11 Н],4'-пиперидин]циклогексилсульфамата (1:2) (37%); т.пл. 180 С (соед. 71).c) Смесь 1-хлор-3-метил-2-бутена (0,02 моль), 5,6-дигидроспиро[11 Н-имидазо[2,1-b][3] бензазепин-11,4'-пиперидина] (0,015 моль),Nа 2 СО 3 (0,015 моль) и KI (0,015 моль) в N,Nдиметилацетамиде (150 мл) перемешивают при комнатной температуре в течение ночи. Смесь фильтруют через дикалит и выпаривают. Остаток извлекают в CH2Cl2/вода, 95/5. Осадок отфильтровывают и сушат. Выход: 0,86 г 5,6 дигидро-1'-(3-метил-2-бутенил)спиро[имидазоd) Смесь 1-(2-бромэтил)-4-этил-1,4-дигидро-5 Н-тетразол-5-она (0,012 моль), 5,6-дигидроспиро[11H-имидазо[2,1-b][3]бензазепин 11,4'-пиперидина] (0,01 моль), Na2CO3 (0,01 моль) и KI (10 мг) в 4-метил-2-пентаноне (200 мл) перемешивают и нагревают с обратным холодильником в течение 18 ч. Смесь выливают в воду. Смесь отделяют, и водный слой экстрагируют 3-метил-2-бутаноном, сушат (МgSO4),фильтруют и выпаривают. Остаток очищают с помощью силикагеля на стеклянном фильтре(элюент: СН 2 Сl2/СН 3 ОН 95/5-93/7). Чистые фракции собирают и выпаривают. Остаток преобразуют в соль хлористо-водородной кислотыe) Смесь хлорацетонитрила (0,11 моль),5,6-дигидроспиро[11 Н-имидазо[2,1-b][3]бензазепин-11,4'-пиперидина] (0,1 моль) и N,N-диэтилэтанамина (0,12 моль) в ДМФ (400 мл) перемешивают при комнатной температуре в течение 48 ч. Смесь выливают в воду и экстрагируют СН 2 Сl2. Органический слой сушат(MgSO4), отфильтровывают и выпаривают. Остаток очищают с помощью силикагеля на стеклянном фильтре (элюент: СН 2 Сl2/CH3OH 96/4). Чистые фракции собирают и выпаривают. Остаток кристаллизуют из СН 3 СN. Выход: 18,5 г 5,6 дигидроспиро[имидазо[2,1-b][3]бензазепин-11[11 Н],4'-пиперидин]-1'-ацетонитрила(0,095 моль), растворенный в малом количестве СН 2 Сl2, добавляют по каплям к перемешиваемой смеси соединения (6) (0,079 моль) в СН 2 Сl2(250 мл). Смесь перемешивают при комнатной температуре в течение выходных, затем промывают Н 2 О, сушат, фильтруют, и растворитель выпаривают. Добавляют толуол, и выпаривают снова. Остаток перемешивают в DIPE. Осадок отфильтровывают, и фильтрат выпаривают. Эту фракцию очищают с помощью силикагеля на стеклянном фильтре (элюент: СН 2 Сl2/СН 3 ОН 100/0,99/1, 98/2 и 96/4). Чистые фракции собирают, и растворитель выпаривают. Остаток перемешивают в гексане. Осадок отфильтровывают и сушат, получая 15,05 г 1,1-диметилэтил 5,6-дигидроспиро[11 Н-имидазо[2,1-b][3]бензазепин-11,4'-пиперидин]-1'-карбоксилатаa) Смесь тетрагидро-2-фуранметанол метансульфоната (0,01 моль), соединения 6 (0,01 моль) и Na2CO3 (0,02 моль) в 4-метил-2 пентаноне (150 мл) перемешивают и нагревают с обратным холодильником в течение ночи. Реакционную смесь фильтруют через дикалит. Фильтрат выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/(СН 3 ОН/NН 3) 95/5). Чистые фракции собирают, и растворитель выпаривают. Остаток растворяют в 2-пропаноне и преобразуют в соль циклогексансульфаминовой кислоты (1:2). Осадок отфильтровывают и сушат. Выход: 1,48 г 5,6-дигидро-1'-[(тетрагидро 2-фуранил)метил]спиро[имидазо[2,1-b][3]бензазепин-11-[11 Н],4'-пиперидин]циклогексилсульфамата (1:2) моногидрата (20,7%); т.пл. 120,2 Сb) Смесь соединения 6 (0,02 моль) и 2 тиофенкарбоксальдегида (0,053 моль) в метаноле (300 мл) гидрируют никелем Ренея (2 г) в качестве катализатора. После поглощения H2 (1 экв), катализатор отфильтровывают, и фильтрат выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 95/5). Чистые фракции собирают и выпаривают. Остаток преобразуют в соль циклогексансульфаминовой кислоты (1:1) в 2-пропаноне. Осадок отфильтровывают и сушат. Остаток перекристаллизовывают из 2 пропанола. Осадок отфильтровывают и сушат. Выход: 0,72 г 5,6-дигидро-1'-(2-тиенилметил) спиро[имидазо[2,1-b][3]бензазепин-11-[11 Н],4'пиперидин]циклогексилсульфамата (1:1) (6,6%); т.пл. 211,1 С (соед. 73). Пример В 7.a) Смесь соединения (9) (0,155 моль), полученного согласно процедуре, описанной в пр.В 2b, и MnO2 (300 г), в хлороформе (1200 мл) перемешивают и нагревают с обратным холодильником в течение 90 мин. Смесь фильтруют через дикалит, и фильтрат выпаривают. Часть этой фракции (1 г) кристаллизуют из СН 3 СN. Осадок отфильтровывают и сушат, получая 0,5 г 1,1-диметилэтил 3-формил-5,6-дигидроспиро(2500 мл) перемешивают при комнатной температуре. Добавляют по каплям уксусную кислоту(45,5 мл). Смесь перемешивают и нагревают с обратным холодильником в течение 20 ч и фильтруют через дикалит. Фильтрат выпаривают. Остаток извлекают в Н 2 О, СН 2 Сl2 и К 2 СО 3. Смесь разделяют на слои. Водный слой экстрагируют СН 2 Сl2, Объединенный органический слой сушат (МgSO4), фильтруют, и растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 97/3). Чистую фракцию собирают, и растворитель выпаривают, получая 47,7 г метил (1,1-диметилэтил)5,6-дигидроспироNaOH (100 мл), Н 2 О (250 мл) и ТГФ (250 мл) перемешивают при комнатной температуре в течение 18 ч. Органический растворитель выпаривают. Водный концентрат нейтрализуют 1 н НСl (100 мл) и экстрагируют СН 2 Сl2. Органический слой отделяют, сушат (МgSO4), фильтруют, и растворитель выпаривают. Часть этой фракции (2 г) кристаллизуют из СН 3 СN. Осадок отфильтровывают и сушат, получая 1,16 г 1'[(1,1-диметилэтокси)карбонил]-5,6-дигидроспиро[11 Н-имидазо[2,1-b][3]бензазепин-11,4'-пиперидин]-3-карбоновой кислоты (соед. 14).N,N-диметил-4-пиридинамина (0,04 моль) в СН 2 Сl2 (300 мл) перемешивают до полного растворения. Добавляют N,N-диэтилэтанамин (0,05 моль). Затем добавляют по частям N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамин моногидрохлорид (0,05 моль). Смесь перемешивают при комнатной температуре в течение 30 мин. Добавляют N,N-диэтилэтанамин(0,06 моль), а затем добавляют по частям NH4Cl(0,05 моль). Смесь перемешивают при комнатной температуре в течение ночи, выливают вH2O и разделяют на слои. Водный слой экстрагируют СН 2 Сl2. Объединенный органический слой сушат (МgSO4), фильтруют и растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/CH3OH 97,5/2,5). Чистые фракции собирают, и растворитель выпаривают. Остаток кристаллизуют из СН 3 СN. Осадок отфильтровывают и сушат, получая 9,5 г 1,1-диметилэтил 3-(аминокарбонил)-5,6-дигидро-спиро[11 Нимидазо[2,1-b][3]бензазепин-11,4'-пиперидин]1'-карбоксилата (60%) (соед. 16). 37 5,6-дигидроспиро[11 Н-имидазо[2,1-b][3]-бензазепин-11,4'-пиперидин]-3-карбоксамида дигидрохлорида (94%) (соед. 17). Осадок может также быть преобразован в соль (Е)-2-бутендиойной кислоты.(50 мл) перемешивают и нагревают с обратным холодильником в течение 10 мин. Добавляют метил 2-пропеноат (0,0149 моль). Смесь перемешивают и нагревают с обратным холодильником в течение 3 ч, а затем охлаждают. Растворитель выпаривают при пониженном давлении. Остаток распределяют между H2O и СН 2 Сl2. Органический слой отделяют, сушат(MgSO4), фильтруют, и растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/(СН 3 ОН/NН 3) 95/5-90/10). Чистые фракции собирают, и растворитель выпаривают. Остаток снова очищают с помощью колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/(СН 3 ОН/NН 3) 99/1-97/3). Чистые фракции собирают, и растворитель выпаривают. Остаток нагревают с обратным холодильником в СН 3 ОН/диэтиловом эфире 2:8 (приводит к преципитации). Осадок отфильтровывают, промывают диэтиловым эфиром и сушат в вакууме при 40 С в течение ночи. Выход: 2,27 г соединения 61.g) N,N-диэтилэтанамин (0,0081 моль) добавляют при комнатной температуре к суспензии соединения 17 (0,004 моль) в метаноле (100 мл). Смесь охлаждают до 0 С. Оксиран барботируют через смесь в течение 45 мин. Смеси дают возможность нагреться до комнатной температуры, а затем перемешивают при комнатной температуре в течение 30 мин. Растворитель выпаривают при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/(СН 3 ОН/NН 3) 97/3-95/5). Чистые фракции собирают, и растворитель выпаривают. Остаток кристаллизуют из СН 3 ОН/СН 2 Сl2 1:4. Осадок отфильтровывают и сушат. Выход: 0,25 г 6,11 дигидро-1'-(2-гидроксиэтил)спиро[5 Н-имидазо[2,1-b][3]-бензазепин-11,4'-пиперидин]-3 карбоксамида (18%) (соединение 62).N,N-диэтилэтанамин (0,0113 моль) добавляют при комнатной температуре к суспензии соединения 17 (0,0054 моль) в метаноле (100 мл). Через 5 мин оксиран барботируют через(0,007 моль) и N,N-диэтилэтанамин (0,0054 моль). Смесь перемешивают и нагревают с обратным холодильником в течение 48 ч. Растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле(элюент: СН 2 Сl2/(СН 3 ОН/NН 3) 98/2-95/5). Собирают две фракции, и растворитель выпаривают. Фракцию 1 кристаллизуют из CH3OH/CH3CN 1:3. Осадок отфильтровывают и сушат. Остаток очищают с помощью колоночной хроматографии на силикагелеi) N,N-диэтилэтанамин (0,0271 моль) добавляют при комнатной температуре к суспензии соединения 17 (0,0129 моль) и этил метиленбензолацетата (0,0140 моль) в ДМФ(100 мл). Смесь перемешивают при комнатной температуре в течение выходных. Растворитель выпаривают. Остаток экстрагируют СН 2 Сl2/H2O. Смесь разделяют на слои. Осадок в органическом слое отфильтровывают. Выход: 2,6 г этил 3-(аминокарбонил)-6,11-дигидрофенилспироj) Получение соединения 65. Смесь соединения 17 (0,0027 моль), 1-(3 хлорпропил)-1,3-дигидро-2 Н-бензимидазол-2 она (0,003 моль), Na2CO3 (0,0027 моль) и KI (несколько кристаллов) в СН 3 СN (100 мл) перемешивают и нагревают с обратным холодильником в течение 48 ч. Растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле(элюент: СН 2 Сl2/(СН 3 ОН/NН 3) 99/1-95/5). Собирают две фракции, и их растворители выпаривают. Целевую фракцию очищают снова с помощью колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/(СН 3 ОН/NН 3) 97/3-95/5). Чистые фракции собирают, и растворитель выпаривают. Выход: 0,18 г соединения 65. 39 нагревают с обратным холодильником (масляная баня: 130 С) в течение ночи. Растворитель выпаривают (вакуум, 60 С). Добавляют воду. Добавляют СН 2 Сl2/СН 3 ОН 90/10. Органический слой отделяют, сушат (МgSO4), фильтруют, и растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/(СН 3 ОН/NН 3) 95/5). Желаемые фракции собирают, и растворитель выпаривают. Выход: 1,5 г соединения 66 (85,4%).HCl/2-пропанола (3 мл) в 2-пропаноле (30 мл) перемешивают при 80 С (масляная баня). Растворитель выпаривают (вакуум, 40 С). Добавляют 2-пропанол, затем выпаривают (2 х). Добавляют этанол, затем выпаривают. Остаток перемешивают в кипящем этаноле (50 мл), затем отфильтровывают через Р 4 стеклянный фильтр, и продукт сушат в потоке N2. Выход: 0,254 г (24,0%). Фильтрат перемешивают в течение 3 ч, при этом охлаждая на ледяной бане. Осадок отфильтровывают через Р 3 стеклянный фильтр и сушат (вакуум, 60 С, 3 ч). Выход: 0,304 г (28,7%). Фильтрат выпаривают. Остаток сушат (в течение выходных в потоке N2). Общий выход: 70,4% соединения 67.m) Добавляют метил хлорформиат (0,0036 моль) при комнатной температуре к суспензии соединения (17) (0,0032 моль) в СН 2 Сl2 (100 мл). Добавляют по каплям смесь N,N-диэтилэтанамина (0,0097 моль) в СН 2 Сl2 (20 мл). Смесь перемешивают при комнатной температуре в течение выходных. Растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН 2 Сl2/ СН 3 ОН 99/1-98/2). Чистые фракции собирают, и растворитель выпаривают. Остаток кристаллизуют из СН 3 СN. Осадок отфильтровывают и сушат. Выход: 0,68 г 3-(аминокарбонил)-6,11-дигидроспиро[5 Н-имидазо[2,1-b][3]-бензазепин-11,4'-пиперидин]-1'-карбоксилата (60%) (соед. 79).n) Смесь соединения (17) (0,005 моль),КОАс (2 г) и пара-формальдегида (0,5 г) в метаноле (100 мл) гидрируют с палладием на угле 10% (0,5 г) в качестве катализатора в присутствии раствора тиофена (1 мл). После извлечения Н 2 (1 эквив.), катализатор отфильтровывают, и фильтрат выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/(СН 3 ОН/NН 3) 97/3). Чистые фракции собирают, и растворитель выпаривают. Эту фракцию снова очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/(СН 3 ОН/NН 3) 97/3 95/5). Чистые фракции собирают, и растворитель выпаривают. Выход: 0,43 г 6,11-дигидро-1'-метилспиро[5 Н 004500CH2Cl2 (7500 мл) охлаждают до 0 С в потоке N2. Добавляют по частям 1-бром-2,5-пирролидиндион (1,63 моль) (29 г каждая). ДобавляютH2O (3000 мл). Смесь перемешивают в течение ночи. Органический слой отделяют, сушат,фильтруют и растворитель выпаривают. Эту фракцию очищают с помощью ВЭЖХ на силикагеле (элюент: CH2Cl2/СН 3 ОН 100/0, 98/2,90/10 и 100/0). Чистую фракцию собирают, и растворитель выпаривают, получая 189 г 1,1-диметил-этил 2,3-дибром-5,6-дигидроспиро[11 Нимидазо[2,1-b][3]бензазепин-11,4'-пиперидин]1'-карбоксилата (27%) (соед. 48). 3-Монобромный аналог (соед. 60; пр.В 10 а) может быть получен подобным же образом.b) Смесь соединения (48) (0,02 моль), уксусной кислоты, соли палладия (2+) (0,15 г) и 1,3-пропандиилбис[дифенилфосфина] (0,55 г) в ТГФ (150 мл) перемешивают в автоклаве при 150 С в течение 16 ч под давлением СО (30 бар) и NН 3 газа (10 атм). Смесь охлаждают, фильтруют, и фильтрат выпаривают. Эту фракцию очищают с помощью силикагеля на стеклянном фильтре (элюент: CH2Cl2/СН 3 ОН 95/5). Чистые фракции собирают, и растворитель выпаривают. Остаток кристаллизуют из СН 3 СN. Осадок отфильтровывают и сушат, получая 1,1-диметилэтил 2,3-бис(аминокарбонил)-5,6-дигидроспиро[11 Н-имидазо[2,1-b][3]-бензазепин-11,4'-пиперидин]-1'-карбоксилат (соед. 49). Пример В 9. Дибензоилпероксид (0,5 г) добавляют к перемешиваемой смеси соединения (7) (0,039 моль) в CH2Cl2 (210 мл). Добавляют по каплям 1-хлор-2,5-пирролидиндион (0,078 моль) в малом количестве CH2Cl2. Смесь перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают. Добавляют Н 2 О, и смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат, фильтруют, и растворитель выпаривают. Остаток очищают с помощью силикагеля на стеклянном фильтре (элюент:CH2Cl2/СН 3 ОН 100/0, 99/1, 98/2, 96/4 и 94/6). Чистые фракции собирают, и растворитель выпаривают. Часть исходного материала (7,5 г; 0,02 моль) рекуперируют. Реакцию осуществляют снова. Дибензоилпероксид (0,5 г) добавляют к перемешиваемой смеси соединения (7)(0,02 моль) в CH2Cl2 (210 мл). 1-Хлор-2,5 пирролидиндион (0,078 моль) в малом количестве CH2Cl2 добавляют по каплям. Смесь перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают. Добавляют Н 2 О, и смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат, фильтруют, и растворитель выпаривают. Остаток очищают с помощью силикагеля на стеклянном фильтре 41 Чистые фракции собирают, и растворитель выпаривают. Остаток объединяют с остатком, полученным из первой фракции, получая 14 г 1,1 диметилэтил 3-хлор-5,6-дигидроспиро[11 Нимидазо[2,1-b][3]бензазепин-11,4'-пиперидин]1'-карбоксилата (93%) (соед. 19). Пример В 10.(0,0582 моль) к отделенному органическому слою, и смесь охлаждают до 0-5 С (раствор 1). Добавляют Вr2 (0,0565 моль) к раствору тетрабутиламмонийбромида (0,0565 моль) и CH2Cl2(29 мл). Эту смесь перемешивают в течение 25 мин при 15-25 С и добавляют к раствору 1 в течение 1 ч. После перемешивания в течение 1 ч при 20 С, добавляют воду (58 мл). Отделенный органический слой выпаривают. 3-Метил-2 бутанон (87 мл) и воду (29 мл) добавляют к масляному остатку, и эту смесь нагревают до 80 С. Отделенный органический слой промывают водой (29 мл) при 80 С. Органический слой подвергают нагреву с азеотропной перегонкой до 116 С. 3-Метил-2-бутанон (40,7 мл) удаляют перегонкой и продукт кристаллизуют в течение 2 ч при 50 С. Кристаллизованный продукт отфильтровывают, промывают 3-метил-2 бутаноном и сушат (вакуум, 50 С). Выход: 13,03 г 1,1-диметилэтил 3-бром-5,6-дигидроспироb) Смесь соединения (60) (0,257 моль),ДМФ (515 мл), Н 2 О (26 мл) и CuCN (1,287 моль) нагревают до 132 С, перемешивают в течение 17 ч, а затем охлаждают до комнатной температуры. Смесь выливают в 2056 мл Н 2 О и перемешивают в течение 2 ч. Осадок отфильтровывают, промывают дважды Н 2 О (149 мл) и сушат(вакуум, 100 С). Полученный осадок нагревают с обратным холодильником в 3-метил-2 бутаноне (772 мл) в течение 30 мин, после чего охлаждают реакционную смесь до 50 С и фильтруют. NH4OH (129 мл) добавляют к фильтрату при 50 С и перемешивают в течение 30 мин. Слой 3-метил-2-бутанона отделяют и промывают NH4OH (129 мл), как описывается выше. Эту процедуру повторяют в течение еще 5 раз. Слой 3-метил-2-бутанона отделяют снова,подвергают азеотропной возгонке в течение 30 мин и частично выпаривают. Полученную смесь кристаллизуют, и осадок фильтруют, промывают 3-метил-2-бутаноном (7,7 мл) и сушат (вакуум, 50 С). Выход: 52,4 г 1,1-диметилэтил 3(аминокарбонил)-5,6-дигидроспиро[11 Н-имидазо[2,1-b][3]бензазепин-11,4'-пиперидин]-1'карбоксилата (53%) (соед. 16). Пример В 11. а) Смесь промежуточного соединения (18) 42 слоте (500 мл) перемешивают при 158 С в течение 90 ч. Смесь охлаждают, выливают на лед иK2 СО 3 (800 г) и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют, и растворитель частично выпаривают до 100 мл, при этом поддерживается температура ниже 40 С. Концентрат немедленно очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/(СН 3 ОН/NН 3), 95/5). Чистые фракции собирают, и растворитель выпаривают, получая 18,1 г 1-метилспиро[11 Нимидазо[2,1-b][3]бензазепин-11,4'-пиперидин]6(5 Н)-она (42%) (соед. 22). Часть этой фракцииb) Смесь промежуточного соединения (24)(0,041 моль) в 48% растворе НВr (250 мл) перемешивают и нагревают с обратным холодильником в течение 4 ч. Смесь выливают на лед иK2 СО 3 и экстрагируют CH2Cl2. Органический слой отделяют, сушат (МgSO4), фильтруют, и растворитель выпаривают, получая 10,4 г спиро[11 Н-имидазо[2,1-b][3]бензазепин-11,4'-пиперидин]-6(5 Н)-она (95%) (соед. 23). Часть этой фракции (0,9 г) растворяют в этаноле и преобразуют в соль (Е)-2-бутендиойной кислоты (2:3). Осадок отфильтровывают и сушат, получая 0,78 г спиро[11H-имидазо[2,1-b][3] бензазепин-11,4'пиперидин]-6(5 Н)-оновой соли (Е)-2-бутендиойной кислоты (2:3) (соед. 23 а).c) Смесь соединения (23) (0,01 моль) в метаноле (300 мл) перемешивают на ледяной бане. Добавляют NaBH4 (0,02 моль) по частям в течение 15-минутного периода. Смесь перемешивают на ледяной бане в течение 1 ч. Растворитель выпаривают при температуре ниже 40 С. Остаток извлекают в Н 2 О, и смесь экстрагируют СН 2 Сl2/СН 3 ОН 90/10. Органический слой отделяют, сушат (MgSO4), фильтруют, и растворитель выпаривают, получая 2 г 5,6-дигидроспироd) Смесь соединения (26) (0,0075 моль) в метансульфоновой кислоте (50 мл) перемешивают при комнатной температуре в течение 40 мин. Смесь выливают на лед, подщелачивают 50% раствором NaOH и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4),фильтруют, и растворитель выпаривают, получая 2 г спиро[11 Н-имидазо[2,1-b][3]бензазепин 11,4'-пиперидина] (100%) (соед. 27). Часть этой фракции (0,3 г) растворяют в этаноле и преобразуют в соль (Е)-2-бутендиойной кислоты (1:1). Осадок отфильтровывают и сушат, получая 0,26 г спиро [11H-имидазо[2,1-b][3]бензазепин-11,4'пиперидиновой]соли (Е)-2-бутендиойной кислоты (1:1) (соед. 27 а). 43 Пример В 12. Смесь соединения (24) (0,0128 моль) в Н 2SO4 (5 мл) и метанола (100 мл) перемешивают и нагревают с обратным холодильником в течение выходных дней. Растворитель выпаривают. Остаток извлекают в Н 2 О. Смесь подщелачивают раствором NaOH и экстрагируют CH2Cl2. Органический слой отделяют, сушат, фильтруют, и растворитель выпаривают, получая 4,4 г 5,6-дигидро-2,3-бис(метоксиметил)спиро[11 Нимидазо[2,1-b][3]бензазепин-11,4'-пиперидина](500 мл) гидрируют никелем Ренея (2 г) в качестве катализатора при комнатной температуре. После поглощения Н 2 (2 экв), катализатор отфильтровывают, и фильтрат выпаривают. Выход: 20,9 г 5,6-дигидроспиро[имидазо[2,1-b](0,01 моль) и Nа 2 СО 3 (0,02 моль) в 4-метил-2 пентаноне (200 мл) перемешивают и нагревают с обратным холодильником в течение 48 ч. Реакционную смесь фильтруют через дикалит. Фильтрат выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/(СН 3 ОН/NH3) 95/5). Чистые фракции собирают, и растворитель выпаривают. Остаток растворяют в 2-пропаноле и преобразуют в соль хлористо-водородной кислоты(1:3). Осадок отфильтровывают и сушат. Выход: 0,94 г 5,6-дигидро-N-2-пиримидинилспиро[имидазо[2,1-b][3]бензазепин-11-[11 Н],4'-пиперидин]-1'-этанамин тригидрохлорид моногидрат 2 пропанолята (1:1) (16,7%) (соед. 78). с) 3-Хлор-6-(3-метил-1,2,4-тиадиазол-5 ил)пиридазин (0,01 моль) и 5, 6-дигидроспиро[имидазо[2,1-b][3]бензазепин-11-[11 Н],4'пиперидин]-1'-этанамин (0,01 моль) перемешивают при 140 С в течение 2 ч. Смесь охлаждают и очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/(СН 3 ОН/NН 3) 95/5). Чистые фракции собирают и выпаривают. Остаток преобразуют в соль хлористо-водородной кислоты (1:4) в 2-пропаноле и сушат. Выход: 2,22 г 2-2-(5,6-дигидроспиро[имидазо[2,1-b][3]бензазепин-11-[11 Н],4'-пиперидин]-1'-ил)этил]амино]-4(1 Н)-пиримидинон тригидрохлорид 2-пропанолят (1:1) сесквигидрата (36,6%) (соед. 68). Следующие таблицы перечисляют соединения формулы (I), полученные согласно одному из вышеуказанных примеров.Lethality" для соединений формулы (I) перечислены ниже в таблице. СоединениеD. Примеры композиций. Следующие далее препараты представляют собой примеры типичных фармацевтических композиций, пригодных для системного или местного введения теплокровным животным согласно настоящему изобретению. Термин "активный ингредиент" (A.I.), как он используется в этих примерах, относится к соединению формулы (I), его пролекарству, соли присоединения, N-оксиду, четвертичному амину или стереохимической изомерной форме. Пример D1. Пероральные капли. 500 г A.I. растворяют в 0,5 л 2 гидроксипропанойной кислоты и 1,5 л полиэтиленгликоля при 6080 С. После охлаждения до 3040 С добавляют 35 л полиэтиленгликоля, и смесь тщательно перемешивают. Затем добавляют раствор 1750 г сахарина натрия в 2,5 л очищенной воды, и при перемешивании добавляют 2,5 л отдушки какао и полиэтиленгликоля по потребности до объема 50 л, создавая раствор пероральных капель, содержащий 10 мг/млA.I. Полученным раствором заполняют соответствующие контейнеры. Пример D2. Пероральные растворы. 9 г метил 4-гидроксибензоата и 1 г пропил 4-гидроксибензоата растворяют в 4 л кипящей очищенной воды. В 3 л этого раствора растворяют сначала 10 г 2,3-дигидроксибутандиойной кислоты, а затем 20 г A.I. Последний раствор объединяют с оставшейся частью предыдущего раствора, и к ним добавляют 12 л 1,2,3 пропантриола и 3 л 70% раствора сорбита. 40 г сахарина натрия растворяют в 0,5 л воды и добавляют 2 мл эссенции малины и 2 мл эссенции крыжовника. Последний раствор объединяют с предыдущим, добавляют по потребности воду,до объема 20 л, создавая пероральный раствор,содержащий 5 мг A.I. на столовую ложку (5 мл). Полученным раствором заполняют соответствующие контейнеры. Пример D3. Капсулы. 20 г A.I., 6 г лаурилсульфата натрия, 56 г крахмала, 56 г лактозы, 0,8 г коллоидной двуокиси кремния, и 1,2 г стеарата магния тщательно перемешивают вместе. Полученной смесью затем заполняют 1000 соответствующих твердых желатиновых капсул, каждая содержит 20 мг A.I. Пример D4. Покрытые таблетки. Приготовление сердцевины таблетки. Смесь 100 г A.I., 570 г лактозы и 200 г крахмала тщательно перемешивают, а затем увлажняют раствором 5 г додецилсульфата на 48 трия и 10 г поливинилпирролидона (Kollidon-K 90) примерно в 200 мл воды. Влажную смесь порошков просеивают, сушат и снова просеивают. Затем добавляют 100 г микрокристаллической целлюлозы (Avicel) и 15 г гидрогенизированного растительного масла (Sterotex) . Все это тщательно перемешивают и прессуют в таблетки, получая 10000 таблеток, каждая содержит 10 мг активного ингредиента. Покрытие. К раствору 10 г метилцеллюлозы (Methocel 60 HG) в 75 мл денатурированного этанола добавляют раствор 5 г этилцеллюлозы (Ethocel 22 cps) в 150 мл дихлорметана. Затем добавляют 75 мл дихлорметана и 2,5 мл 1,2,3 пропантриола. 10 г полиэтиленгликоля расплавляют и растворяют в 75 мл дихлорметана. Последний раствор добавляют к предыдущему,затем добавляют 2,5 г октадеканоата магния, 5 г поливинилпирролидона и 30 мл концентрированной суспензии красителя (Opaspray K-12109), и все вместе гомогенизируют. Сердцевины таблеток покрывают полученной таким образом смесью в устройстве для нанесения покрытия. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы его пролекарство, N-оксид, соль присоединения,четвертичный амин и стереохимически изомерная форма, где R1 представляет собой водород, C1-6 алкил, галоген, формил, карбоксил, C1-6 алкилоксикарбонил, С 1-6 алкилкарбонил, N(R3R4)C(=O)-,N(R3R4)С(=O)N(R5)-, этенил, замещенный карбоксилом или C1-6 алкилоксикарбонилом, или C1-6 алкил,замещенный гидрокси, карбоксилом, С 1-6 алкилокси,С 1-6 алкилоксикарбонилом, N(R3R4)С(=O)-, C1-6 алкил-С(=O)N(R5)-, C1-6 алкилS(=O)2N(R5)- илиN(R3R4)С(=O)N(R5)-; где каждый R3 и каждый R4 независимо представляют собой водород или С 1-4 алкил;R5 представляет собой водород или гидрокси;-А-В- представляет двухвалентный радикал формулы-СН=СН-СН=СН(а-3),где каждый атом водорода в радикалах (а-1)-(а 3) может быть независимо замещен R6 и где R6 49 представляет собой C1-6 алкил, галоген, гидрокси, C1-6 алкилокси, этенил замещенный карбоксилом или C1-6 алкилоксикарбонилом, гидрокси С 1-6 алкил, формил, карбоксил и гидроксикарбонилС 1-6 алкил; каждый Y, независимо, представляет собой двухвалентный радикал формулы -О-, -S- илиZ представляет собой двухвалентный радикал формулы(b-6),-CH2-C(=NOH)при условии, что двухвалентные радикалы (b-3),(b-4), (b-5) и (b-6) присоединены к азоту имидазольного кольца через их -СН 2-остаток, где р равно 1, 2, 3 или 4;L представляет собой водород; C1-6 алкил; С 2-6 алкенил; C1-6 алкилкарбонил; C1-6 алкилоксикарбонил; C1-6 алкил, замещенный одним или несколькими заместителями, каждый независимо выбран из гидрокси, карбоксила, C1C1-6 алкилоксикарбонила, арила,6 алкилокси,арилокси, циано или R8HN-,где R8 представляет собой водород, C1-6 алкил, C1-6 алкилоксикарбонил, C1-6 алкилкарбонил; или L представляет собой радикал формулыHet1, Het2 и Het3, каждый, представляет собой фуранил, тетрагидрофуранил, тиенил, оксазолил, тиазолил или имидазолил, каждый необязательно замещенный одним или двумя С 1-4 алкильными заместителями; пирролил или пиразолил, необязательно замещенный формилом,гидроксиС 1-4 алкилом, гидроксикарбонилом, С 1-4 алкилоксикарбонилом или одним или двумя С 1-4 алкильными заместителями; тиадиазолил или оксадиазолил, необязательно замещенный амино или С 1-4 алкилом; пиридинил, пиримидинил,пиразинил или пиридазинил, каждый необязательно замещенный C1-4 алкилом, С 1-4 алкилокси,амино, гидрокси или галогеном; и Het3 может также представлять 4,5-дигидро-5-оксо-1 Нтетразолил, замещенный С 1-4 алкилом, 2-оксо-3 оксазолидинил, 2,3-дигидро-2-оксо-1 Н-бензимидазол-1-ил или радикал формулы 50 арил представляет собой фенил или фенил, замещенный 1, 2 или 3 заместителями, каждый,независимо, выбран из галогена, гидрокси, С 1-4 алкила, полигалогенС 1-4 алкила, циано, аминокарбонила, С 1-4 алкилокси или полигалогенС 1-4 алкилокси,при условии, что исключается 5,6-дигидроспиро[имидазо[1,2-b][3]бензазепин-11[11 Н],4'-пиперидин] и его фармацевтически приемлемые соли присоединения. 2. Соединение по п.1, где L представляет собой водород, C1-6 алкил, C1-6 алкилкарбонил,C1-6 алкилоксикарбонил или C1-6 алкил, замещенный гидрокси, карбоксилом, C1-6 алкилокси или С 1-6 алкилоксикарбонилом. 3. Соединение по п.1, где L представляет собой C1-6 алкил, замещенный арилом и C1-6 алкилоксикарбонилом. 4. Соединение по любому из предыдущих пунктов, где -А-В- представляет собой двухвалентный радикал формулы -СН=СН-СН=СН- (а 3) или -CH=CH-Y- (a-2). 5. Соединение по любому из предыдущих пунктов, где Z представляет собой -(СН 2)р- (b1), -СН=СН- (b-2) или -СН 2-О- (b-4). 6. Соединение по пп.1, 2, 4 или 5, где L представляет собой водород, C1-6 алкил, гидроксиС 1-6 алкил, карбоксиС 1-6 алкил, C1-6 алкилоксикарбонил или C1-6 алкилоксикарбонилС 1-6 алкил. 7. Соединение по любому из предыдущих пунктов, где R1 представляет собой гидроксиС 1-6 алкил, формил, C1-6 алкилоксикарбонил, С 1-6 алкилоксиС 1-6 алкил, N(R3R4)С(=O)-, галоген или водород. 8. Соединение по п.1, где соединение представляет собой соед. 17: 5,6-дигидроспиро[11H-имидазоN(R R )C(=O)N(R )-, этенил, замещенный карбоксилом или C1-6 алкилоксикарбонилом, или C1-6 алкил, замещенный гидрокси, карбоксилом, C1-6 алкилокси, C1-6 алкилоксикарбонилом, N(R3R4) С(=O)-,C1-6 алкил-С(=O)N(R5)-,C1-6 алкил 5S(=O)2N(R )- или N(R3R4)C(=O)N(R5)-; где каждый R3 и каждый R4 независимо представляют собой водород или С 1-4 алкил;R5 представляет собой водород или гидрокси;-А-В- представляет двухвалентный радикал формулы-СН=СН-СН=СН(а-3),где каждый атом водорода в радикалах (а-1)-(а 3) может быть независимо замещен R6 и где R6 представляет собой C1-6 алкил, галоген, гидрокси, C1-6 алкилокси, этенил замещенный карбоксилом или C1-6 алкилоксикарбонилом, гидрокси С 1-6 алкил, формил, карбоксил и гидроксикарбонилС 1-6 алкил; каждый Y, независимо, представляет собой двухвалентный радикал формулы -О-, -S- илиZ представляет собой двухвалентный радикал формулы(b-6),-СН 2-С(=NОН) при условии, что двухвалентные радикалы (b-3),(b-4), (b-5) и (b-6) присоединены к азоту имидазольного кольца через их -CH2-остаток,где р равно 1, 2, 3 или 4;L представляет собой водород; C1-6 алкил; С 2-6 алкенил; C1-6 алкилкарбонил; C1-6 алкилоксикарбонил; C1-6 алкил, замещенный одним или несколькими заместителями, каждый, независимо, выбран из гидрокси, карбоксила, C1C1-6 алкилоксикарбонила, арила,6 алкилокси,арилокси, циано или R8HN-,где R8 представляет собой водород, С 1-6 алкил, C1-6 алкилоксикарбонил, C1-6 алкилкарбонил; или L представляет собой радикал формулыHet1, Het2 и Het3, каждый, представляет собой фуранил, тетрагидрофуранил, тиенил, оксазолил, тиазолил или имидазолил, каждый необязательно замещенный одним или двумя С 1-4 алкильными заместителями; пирролил или пиразолил, необязательно замещенный формилом,гидроксиС 1-4 алкилом, гидроксикарбонилом, С 1-4 алкилоксикарбонилом или одним или двумя С 1-4 алкильными заместителями; тиадиазолил или оксадиазолил, необязательно замещенный амино или С 1-4 алкилом; пиридинил, пиримидинил,пиразинил или пиридазинил, каждый, необязательно замещенный С 1-4 алкилом, С 1-6 алкилокси,амино, гидрокси или галогеном; и Het3 может также представлять 4,5-дигидро-5-оксо-1 Нтетразолил, замещенный С 1-4 алкилом, 2-оксо-3 оксазолидинил, 2,3-дигидро-2-оксо-1 Н-бензимидазол-1-ил или радикал формулы где A-Z представляет S-CH=CH, S-CH2-CH2, SCH2-CH2-CH2, CH=CH-CH=CH, или СН 2-СН 2 СН 2-СН 2; арил представляет собой фенил или фенил,замещенный 1, 2 или 3 заместителями, каждый независимо выбран из галогена, гидрокси, С 1-4 алкила, полигалогенС 1-4 алкила, циано, аминокарбонила, С 1-4 алкилокси или полигалогенC1-4 алкилокси,и его фармацевтически приемлемых солей присоединения, пролекарства, N-оксида, четвертичного амина и стереохимически изомерной формы, в качестве лекарственного средства. 10. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель,и, в качестве активного ингредиента, терапевтически эффективное количество соединения по любому из пп.1-9. 11. Способ получения композиции по п.10,отличающийся тем, что фармацевтически при 53 емлемый носитель однородно смешивают с терапевтически эффективным количеством соединения по любому из пп.1-9. 12. Соединение формулы его N-оксид, соль присоединения, четвертичный амин и стереохимически изомерная форма, где Р является защитной группой и n, -А-В-, Z, R1 иR2 являются такими, как определено в п.1, при условии, что исключается 6,11-дигидро-1'-(фенилметил)-5 Н-спиро[имидазо[1,2-b][3]бензазепин-11, 4'-пиперидин](Е)-2-бутендиоат (1:2). 13. Соединение по п.12, где Р представляет собой бензил. 14. Способ получения соединения по п.1,включающий снятие защиты с промежуточного соединения формулы (II) с последующей необязательной дериватизацией либо пиперидинового фрагмента, либо имидазольного фрагмента, либо как пиперидинового фрагмента, так и имидазольного фрагмента где -А-В-, Z, L, R1 и R2 и n определены в п.1 и Р является защитной группой. 15. Способ получения соединения по п.1,включающий дериватизацию промежуточного соединения формулы (II) по имидазольному фрагменту с образованием промежуточного соединения формулы (II-а), с последующим снятием защиты с пиперидинового фрагмента и с последующей необязательной дериватизацией пиперидинового фрагмента где -А-В-, Z, L, R1 и R2 и n определены в п.1 и Р является защитной группой. 16. Способ получения соединения по п.1,включающий циклизацию промежуточного соединения формулы (III) в присутствии подходящей кислоты, с получением соединения формулы (I-а) 54 где -А-В-, L, R1 и R2 и n определены как в п.1. 17. Способ по пп.14-16, дополнительно, если желательно включающий превращение соединений формулы (I) и (I-а) друг в друга, следуя известным в данной области методикам, а также, если желательно, превращение соединения фoрмулы (I), в терапевтически активную нетоксичную соль присоединения кислоты обработкой кислотой, или в терапевтически активную нетоксичную соль присоединения основания обработкой основанием, или подобным же образом превращение соли присоединения кислоты в свободное основание обработкой щелочью, или превращение соли присоединения основания в свободную кислоту обработкой кислотой; и, если это желательно, получение их стереохимически изомерных или N-оксидных форм. 18. Способ получения соединения по п.12,включающий циклизацию соединения формулы(XI) с помощью подходящей кислоты, с получением соединения формулы (II-k), с последующей необязательной дериватизацией имидазольного фрагмента с получением соединения формулы (II-a-1) где -А-В-, R1, R2, n и Р определены в п.13 и Z1 является двухвалентным радикалом формулы (СН 2)p-, где р равно 1, 2, 3 или 4. 19. Способ получения соединения по п.1,включающий взаимодействие трициклического фрагмента формулы (XIV) с реагентом формулы(XV) в инертной атмосфере и в реакционноинертном растворителе, в присутствии соответствующего основания, с получением соединения формулы (II-1), с последующей необязательной дериватизацией имидазольного фрагмента, с получением соединения формулы (II-a2) где -А-В-, R1, R2, n и Р определены в п.13, W5 является соответствующей уходящей группой,например галогеном, и Z2 представляет собой двухвалентный радикал формулы -(СН 2)р- или СН 2-O-, где р равно 1, 2, 3 или 4. 20. Применение соединенияN(R R )С(=O)N(R5)-; где каждый R3 и каждый R4 независимо представляют собой водород или С 1-4 алкил;R5 представляет собой водород или гидрокси;-А-В- представляет двухвалентный радикал формулы-СН=СН-СН=СН(а-3),где каждый атом водорода в радикалах (а-1)-(а 3) может быть независимо замещен R6 и где R6 представляет собой C1-6 алкил, галоген, гидрокси, C1-6 алкилокси, этенил, замещенный карбоксилом илиC1-6 алкилоксикарбонилом,гидроксиС 1-6 алкил, формил, карбоксил и гидроксикарбонилС 1-6aлкил; каждый Y независимо представляет собой двухвалентный радикал формулы -О-, -S- илиZ представляет собой двухвалентный радикал формулы-СН 2-С(=NОН)(b-6),при условии, что двухвалентные радикалы (b-3),(b-4), (b-5) и (b-6) присоединены к азоту имидазольного кольца через их -СН 2-остаток, 56 где р равно 1, 2, 3 или 4;C1-6 алкилоксикарбонил; C1-6 алкил, замещенный одним или несколькими заместителями, каждый, независимо, выбран из гидрокси, карбоксила, C1-6aлкилокси, C1-6 алкилоксикарбонила,арила, арилокси, циано или R8HN-, где R8 представляет собой водород, C1-6 алкил, C1-6 алкилоксикарбонил, C1-6 алкилкарбонил; илиL представляет собой радикал формулыHet1, Het2 и Het3, каждый, представляет собой фуранил, тетрагидрофуранил, тиенил, оксазолил, тиазолил или имидазолил, каждый, необязательно замещенный одним или двумя С 1-4 алкильными заместителями; пирролил или пиразолил, необязательно замещенный формилом,гидроксиС 1-4 алкилом, гидроксикарбонилом, С 1-4 алкилоксикарбонилом или одним или двумя С 1-4 алкильными заместителями; тиадиазолил или оксадиазолил, необязательно замещенный амино или С 1-4 алкилом; пиридинил, пиримидинил,пиразинил или пиридазинил, каждый, необязательно замещенный C1-4 алкилом, С 1-4 алкилокси,амино, гидрокси или галогеном; иHet3 может также представлять 4,5 дигидро-5-оксо-1 Н-тетразолил, замещенный С 1-4 алкилом, 2-оксо-3-oксазолидинил, 2,3-дигидро 2-оксо-1 Н-бензимидазол-1-ил или радикал формулы где A-Z представляет S-CH=CH, S-CH2-CH2, SCH2-CH2-CH2, CH=CH-CH=CH или CH2-СН 2 СН 2-CH2; арил представляет собой фенил или фенил,замещенный 1, 2 или 3 заместителями, каждый независимо выбран из галогена, гидрокси, С 1-4 алкила, полигалогенС 1-4 алкила, циано, аминокарбонила, С 1-4 алкилокси или полигалогенС 1-4 алкилокси в качестве активного агента в лечении аллергических заболеваний.
МПК / Метки
МПК: A61K 31/55, C07D 495/22, A61P 37/00, C07D 471/20
Метки: антигистаминные, спиросоединения
Код ссылки
<a href="https://eas.patents.su/29-4500-antigistaminnye-spirosoedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Антигистаминные спиросоединения</a>
Предыдущий патент: Замещенные гетероциклические соединения для лечения воспалительных процессов
Следующий патент: Производные 2,4-дизамещенного триазина
Случайный патент: Способ получения биологического масла и его использование в способе получения биодизеля