Композиции модафинила
Номер патента: 9949
Опубликовано: 28.04.2008
Авторы: Бургхол Хики Магали, Петерсон Мэттью, Оливейра Марк, Алмарссон Орн
Формула / Реферат
1. Фармацевтическая композиция, включающая смесь 2:1 R-(-)-модафинил:S-(+)-модафинил.
2. Фармацевтическая композиция по п.1, где:
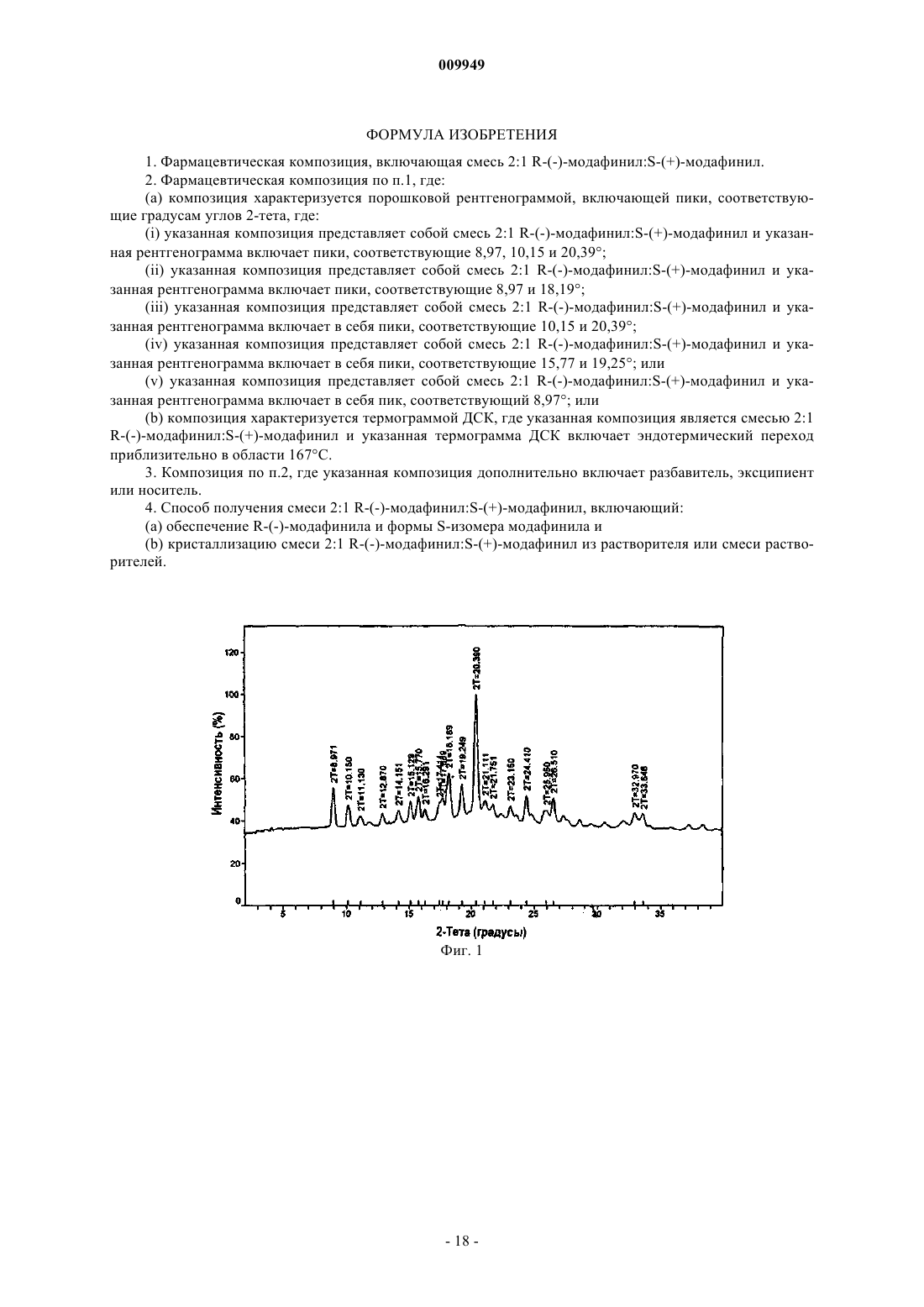
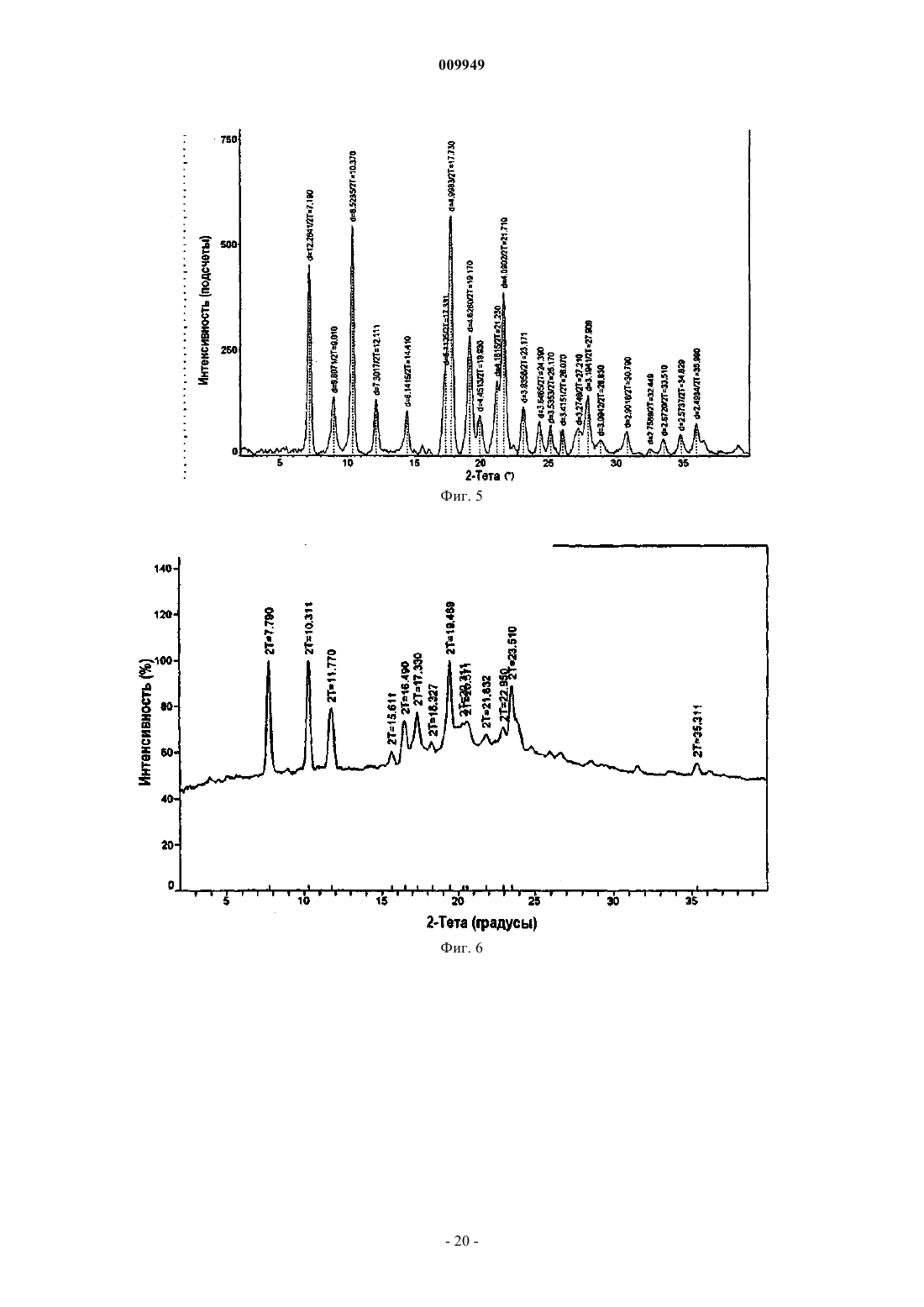
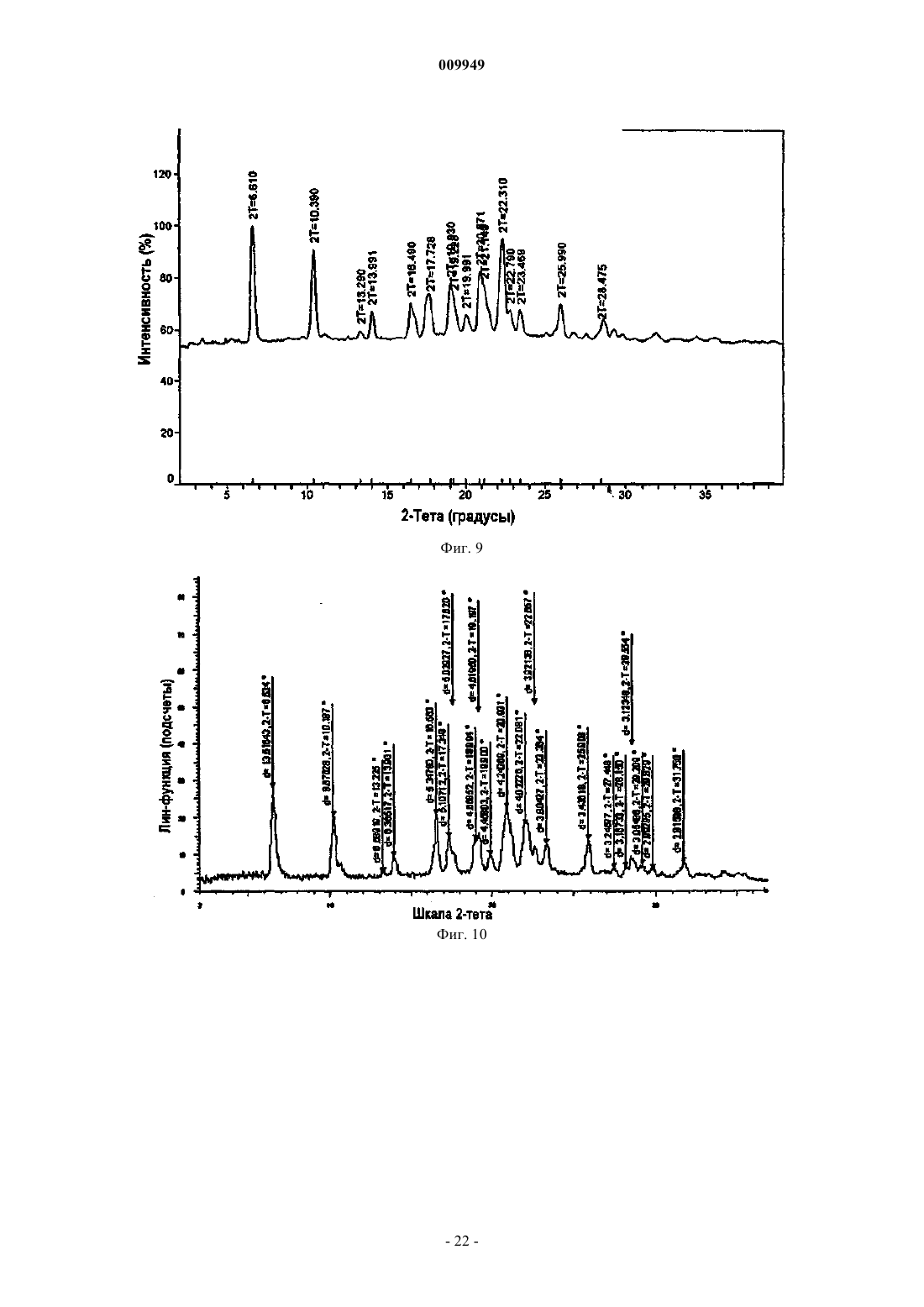
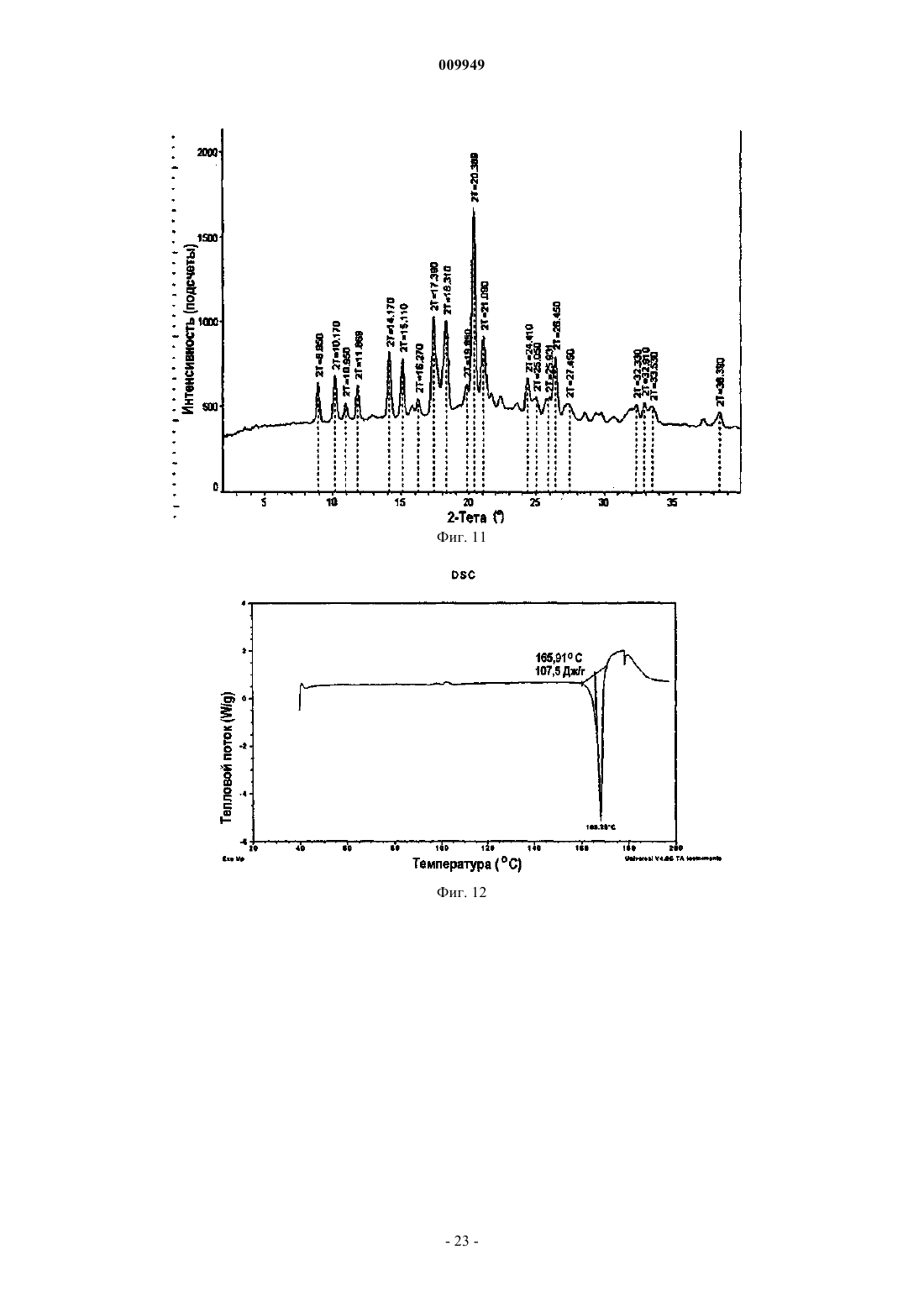
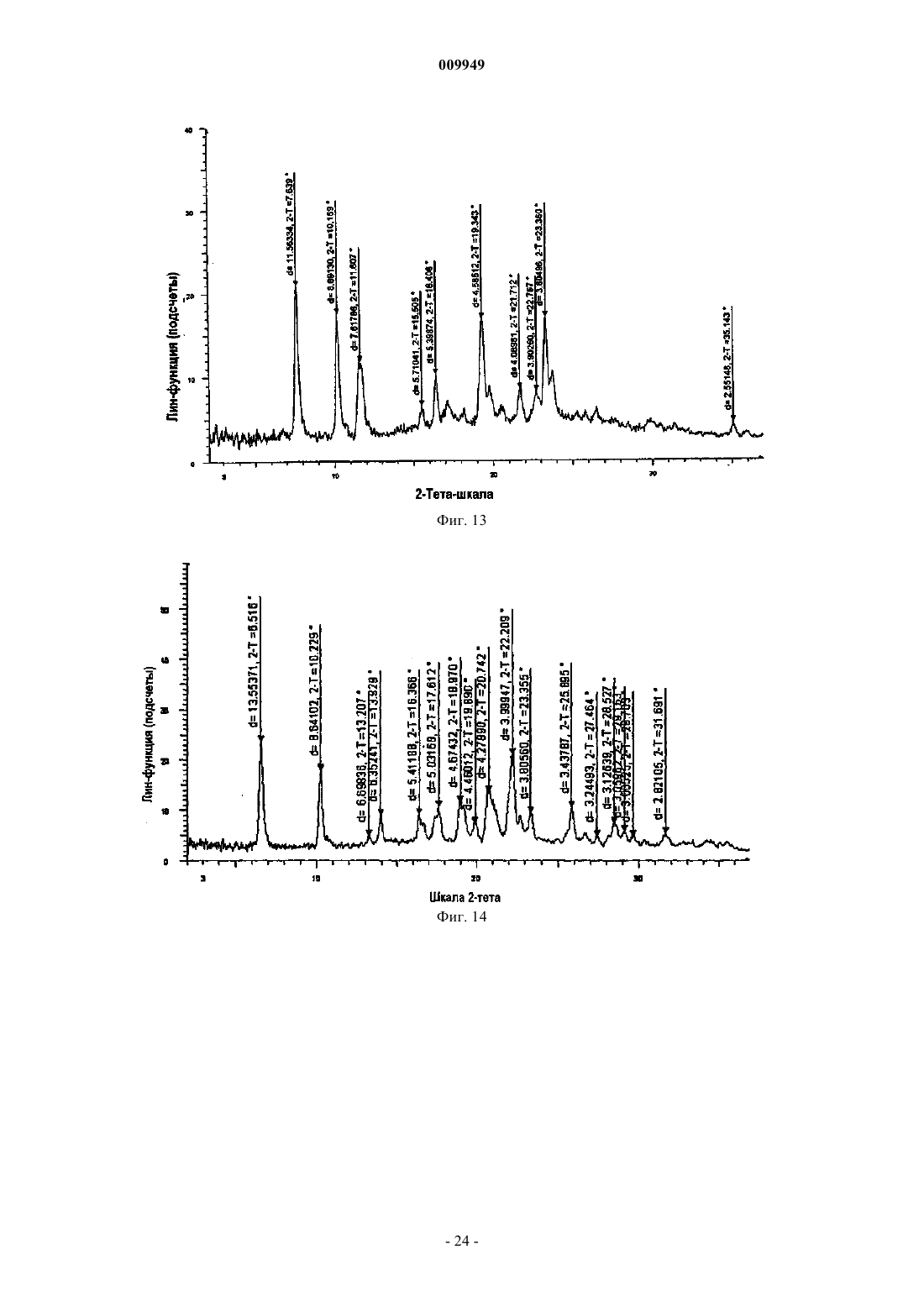
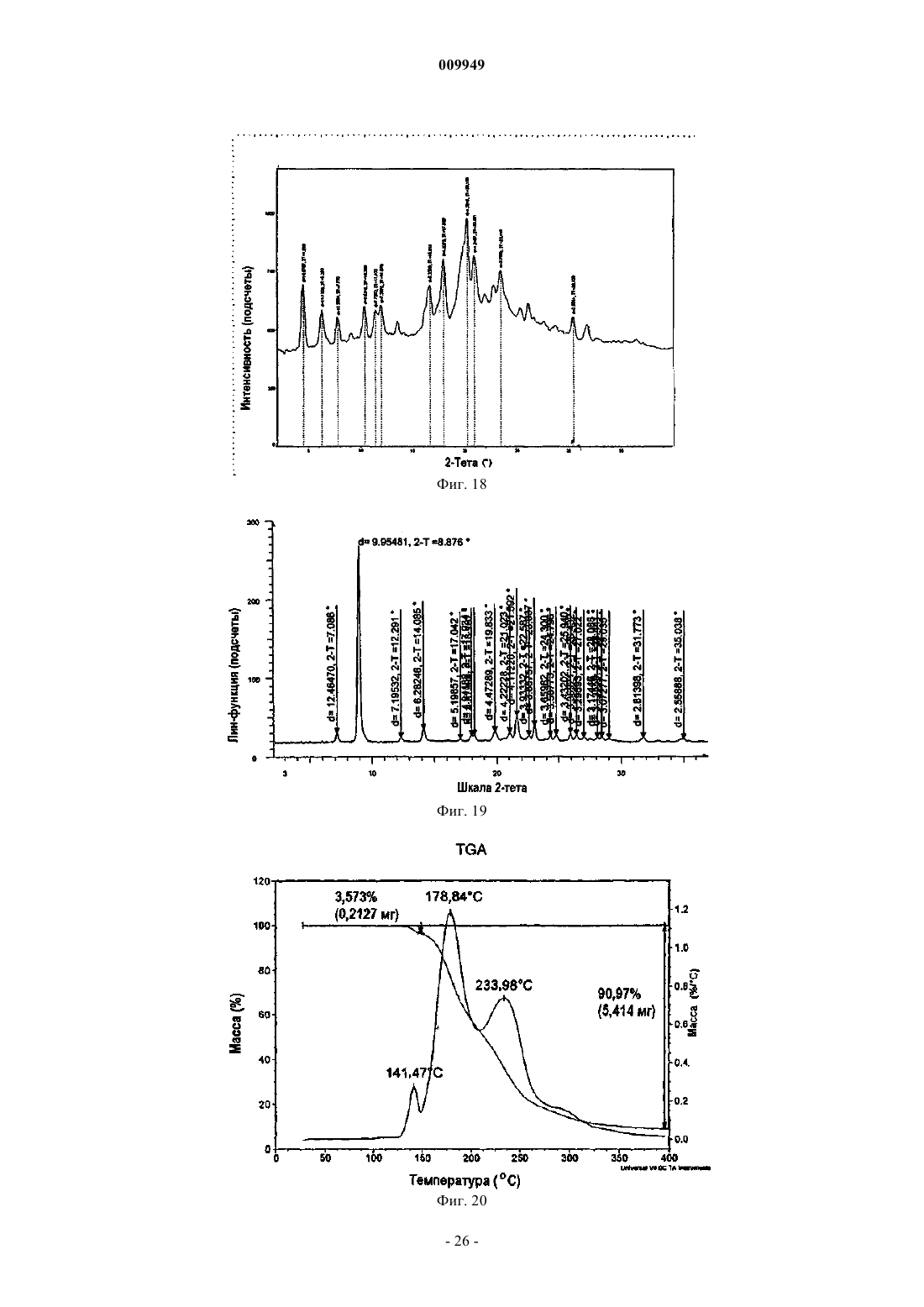
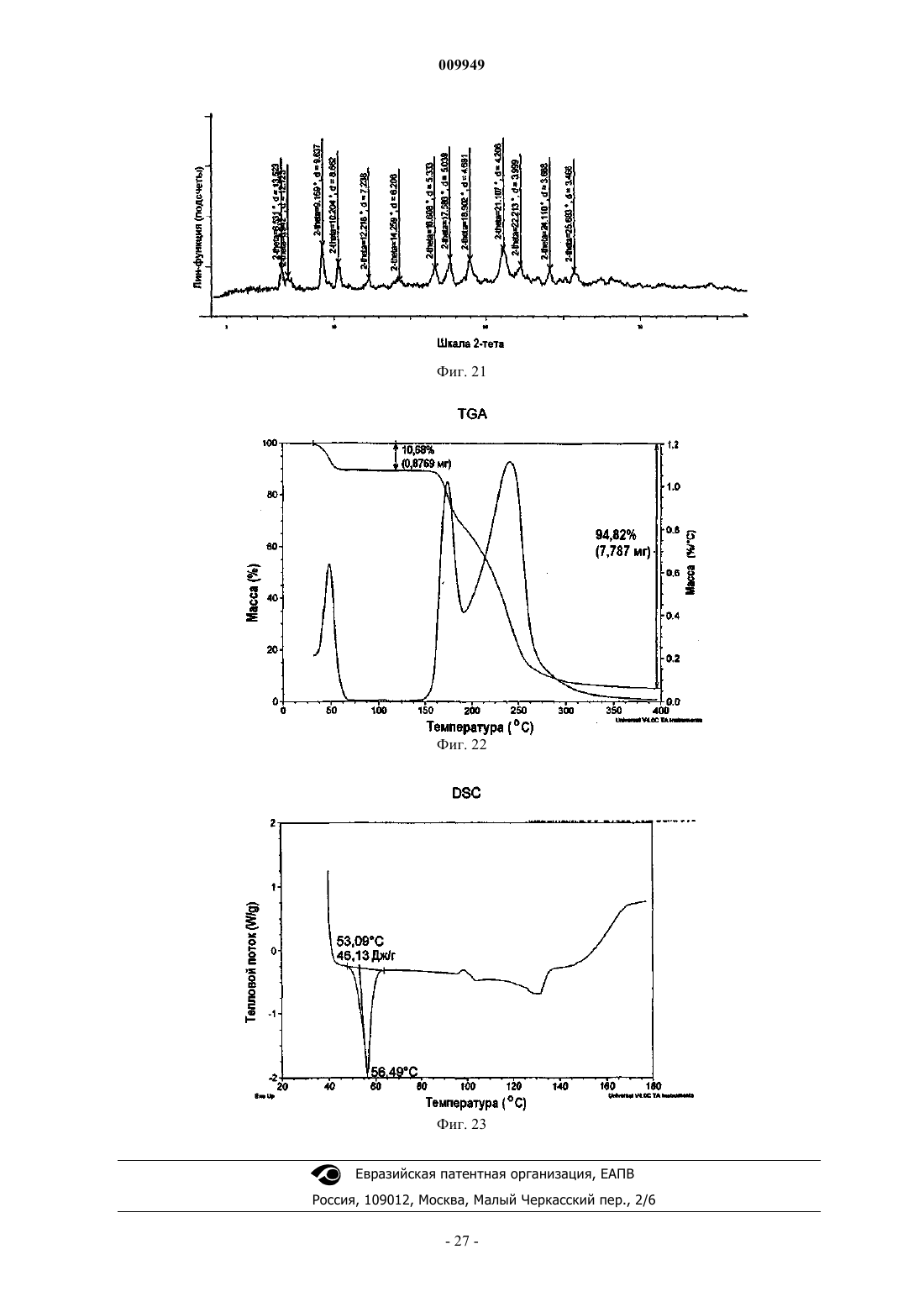
(a) композиция характеризуется порошковой рентгенограммой, включающей пики, соответствующие градусам углов 2-тета, где (i) указанная композиция представляет собой смесь 2:1 R-(-)-модафинил:S-(+)-модафинил и указанная рентгенограмма включает пики, соответствующие 8,97, 10,15 и 20,39ш;
(ii) указанная композиция представляет собой смесь 2:1 R-(-)-модафинил:S-(+)-модафинил и указанная рентгенограмма включает пики, соответствующие 8,97 и 18,19ш;
(iii) указанная композиция представляет собой смесь 2:1 R-(-)-модафинил:S-(+)-модафинил и указанная рентгенограмма включает в себя пики, соответствующие 10,15 и 20,39ш;
(iv) указанная композиция представляет собой смесь 2:1 R-(-)-модафинил:S-(+)-модафинил и указанная рентгенограмма включает в себя пики, соответствующие 15,77 и 19,25ш; или
(v) указанная композиция представляет собой смесь 2:1 R-(-)-модафинил:S-(+)-модафинил и указанная рентгенограмма включает в себя пик, соответствующий 8,97ш; или
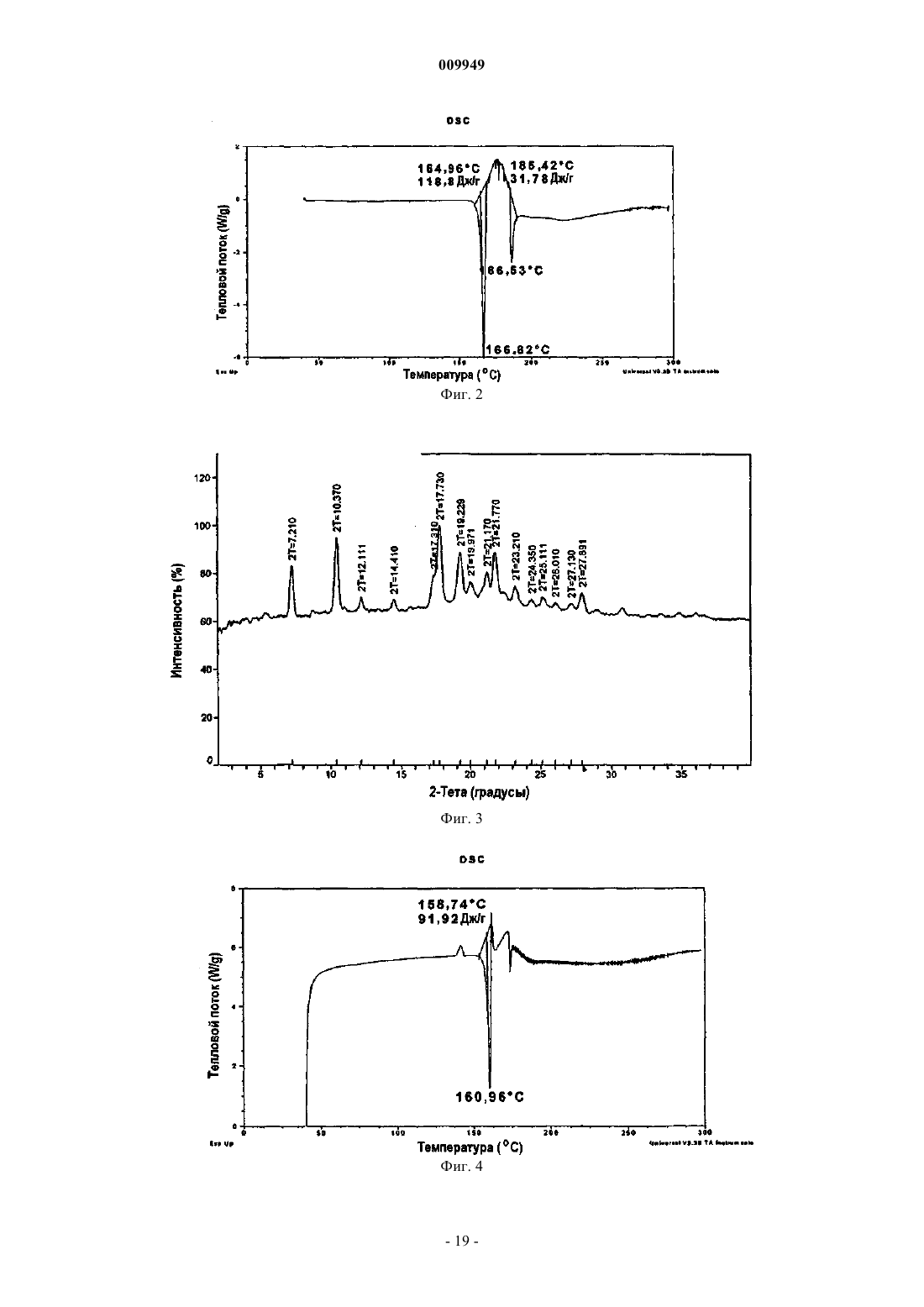
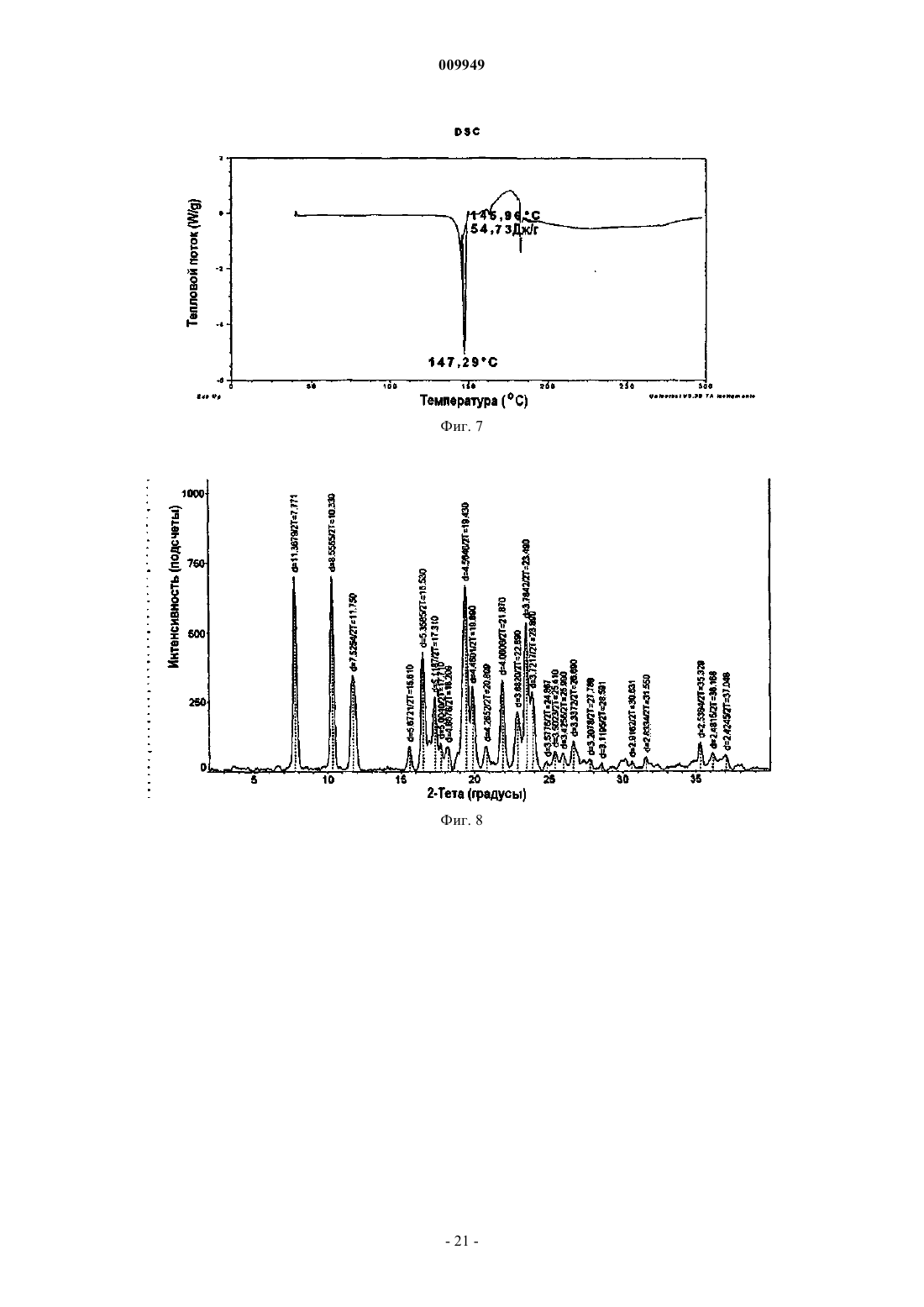
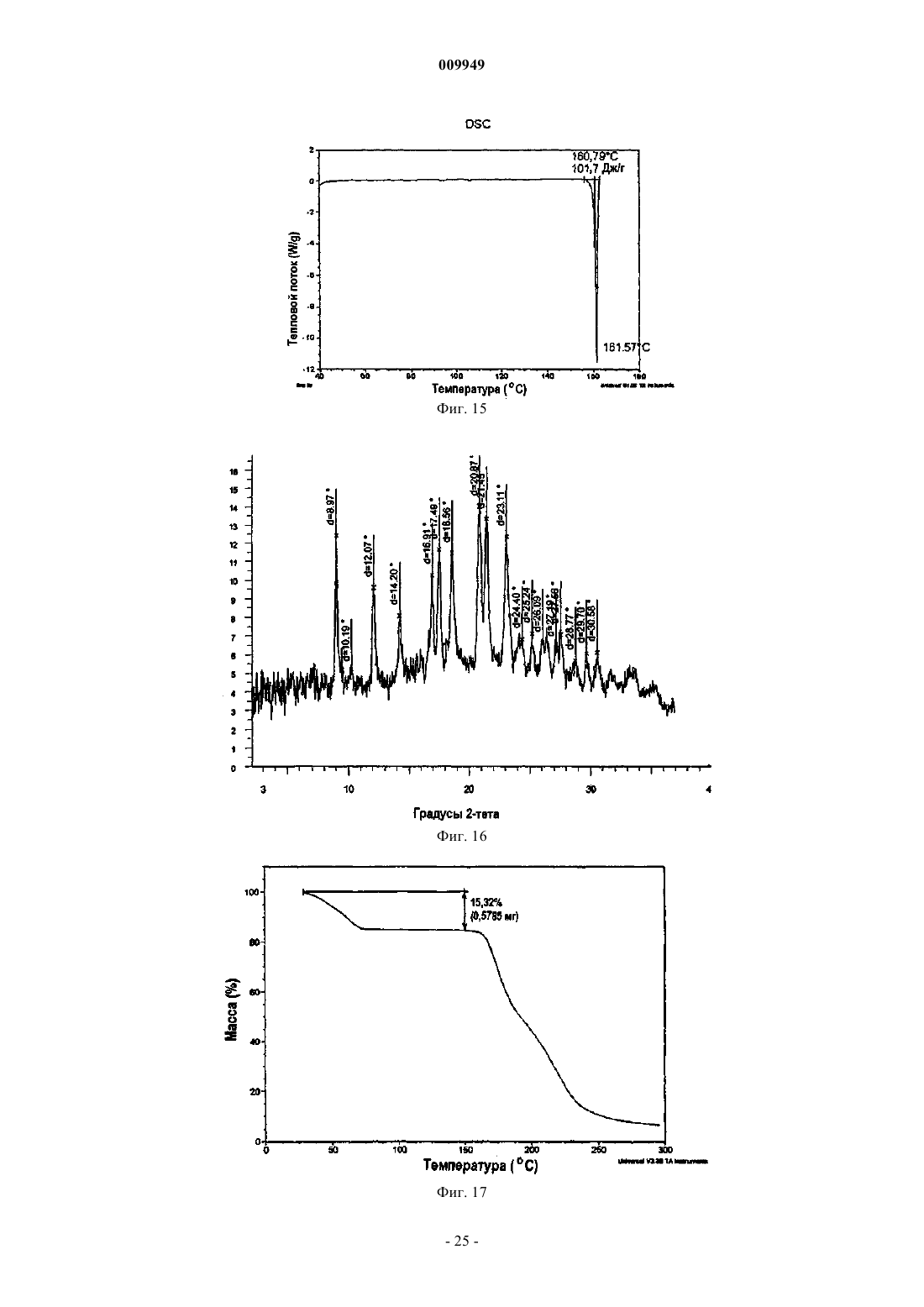
(b) композиция характеризуется термограммой ДСК, где указанная композиция является смесью 2:1 R-(-)-модафинил:S-(+)-модафинил и указанная термограмма ДСК включает эндотермический переход приблизительно в области 167шC.
3. Композиция по п.2, где указанная композиция дополнительно включает разбавитель, эксципиент или носитель.
4. Способ получения смеси 2:1 R-(-)-модафинил:S-(+)-модафинил, включающий:
(a) обеспечение R-(-)-модафинила и формы S-изомера модафинила и
(b) кристаллизацию смеси 2:1 R-(-)-модафинил:S-(+)-модафинил из растворителя или смеси растворителей.
Текст
009949 Область техники, к которой относится изобретение Настоящее изобретение относится к содержащим модафинил композициям, фармацевтическим композициям, включающим в себя модафинил, и способам их получения. Уровень техники Активные фармацевтические ингредиенты (API или APIs (множество в фармацевтических композициях могут быть получены в виде целого ряда различных форм. Такие APIs можно получить так, чтобы иметь целый ряд различных химических форм, включающих в себя химические производные, сольваты, гидраты, сокристаллы или соли. Такие APIs можно также получить, чтобы иметь различные физические формы. Например, APIs могут быть аморфными, могут иметь различные кристаллические полиморфы или могут существовать в различных состояниях сольватации или гидратации. Изменяя формыAPI, можно изменять его физические свойства. Например, кристаллические полиморфы обычно имеют растворимости, отличающиеся друг от друга, так что более термодинамически стабильный полиморф является менее растворимым, чем менее термодинамически стабильный полиморф. Фармацевтические полиморфы могут также различаться по свойствам, таким как срок годности, биологическая доступность, морфология, давление пара, плотность, цвет и сжимаемость. В соответствии с этим, изменение кристаллического состояния API является одним из многих путей для модулирования его физических свойств. Было бы выгодно располагать новыми формами этих APIs, которые имеют улучшенные свойства, в частности в виде пероральных препаратов. Особенно желательно идентифицировать улучшенные формыAPIs, которые проявляют значительно улучшенные свойства, в том числе повышенную растворимость в воде и стабильность. Кроме того, желательно улучшить обрабатываемость или получение фармацевтических препаратов. Например, иглоподобные кристаллические формы или габитусы APIs могут вызвать агрегацию, даже в композициях, в которых API смешан с другими веществами, так что получают неоднородную смесь. Иглоподобные морфологии могут также создавать проблемы при фильтровании (см.,например, Mirmehrabi et al. J. Pharm. Sci. Vol. 93,7, pp. 1692-1700, 2004). Желательно также повысить скорость растворения API-содержащих фармацевтических композиций в воде, повысить биологическую доступность перорально вводимых композиций и обеспечить более быстрое начало терапевтического действия. Желательно также иметь форму API, которая при введении субъекту быстрее достигает пикового уровня в плазме, имеет более длительно сохраняющуюся терапевтическую концентрацию в плазме и более сильное общее действие по сравнению с эквивалентными количествами API в его известной в настоящее время форме. Модафинил, API, применяемый для лечения субъектов с нарколепсией, является практически нерастворимым в воде. Модафинил (номер регистрации CAS: 68 693-11-8) представлен структурой (I) Модафинил является хиральной молекулой вследствие хиральной группы S=O. Поэтому модафинил существует в виде двух изомеров, R-(-)-модафинила и S-(-)-модафинила. Было бы выгодно иметь новые формы модафинила, которые имеют улучшенные свойства, в особенности, в виде пероральных препаратов. Особенно желательно идентифицировать улучшенные формы модафинила, которые проявляют значительно повышенную растворимость в воде и как химическую стабильность, так и стабильность формы. Желательно также повысить скорость растворения API-содержащих фармацевтических композиций в воде, повысить биологическую доступность перорально вводимых композиций и обеспечить более быстрое начало терапевтического действия. Желательно также иметь форму API, которая при введении субъекту быстрее достигает пикового уровня в плазме и/или имеет более длительно сохраняющуюся терапевтическую концентрацию в плазме и более сильное общее действие по сравнению с эквивалентными количествами API в его известной в настоящее время форме. Сущность изобретения Теперь обнаружено, что можно получить полиморфы и сольваты модафинила. Некоторые из них могут иметь свойства, отличающиеся от свойств свободной формы API. Настоящее изобретение относится к фармацевтической композиции, включающей смесь 2:1 R-(-)модафинил: S-(+)-модафинил. Более конкретно, предложенная композиция характеризуется (а) порошковой рентгенограммой, включающей пики, соответствующие градусам углов 2-, где:(i) указанная композиция представляет собой смесь 2:1 R-(-)-модафинил:S-(+)-модафинил и указанная рентгенограмма включает пики, соответствующие 8,97, 10,15 и 20,39; или(ii) указанная композиция представляет собой смесь 2:1 R-(-)-модафинил:S-(+)-модафинил и ука-1 009949 занная рентгенограмма включает пики, соответствующие 8,97 и 18,19; или(iii) указанная композиция представляет собой смесь 2:1 R-(-)-модафинил:S-(+)-модафинил и указанная рентгенограмма включает в себя пики, соответствующие 10,15 и 20,39; или(iv) указанная композиция представляет собой смесь 2:1 R-(-)-модафинил:S-(+)-модафинил и указанная рентгенограмма включает в себя пики, соответствующие 15,77 и 19,25; или(v) указанная композиция представляет собой смесь 2:1 R-(-)-модафинил:S-(+)-модафинил и указанная рентгенограмма включает в себя пик, соответствующий 8,97; или(b) термограммой ДСК, где указанная композиция является смесью 2:1 R-(-)-модафинил:S-(+)модафинил и указанная термограмма ДСК включает эндотермический переход приблизительно в области 167C. В предпочтительном варианте предложенная композиция дополнительно включает разбавитель, эксципиент или носитель. В следующем варианте осуществления настоящего изобретения предлагается способ получения 2:1(b) кристаллизацию смеси 2:1 R-(-)-модафинил:S-(+)-модафинил из растворителя или смеси растворителей. В описании имеются также сведения о новом полиморфе R-(-)-модафинила, в частности, о таких его формах, как формы III, IV и V R-(-)-модафинила. Описан способ получения R-(-)-модафинила, включающий в себя (а) обеспечение R-(-)- и (b) кристаллизацию полиморфа R-(-)-модафинила из подходящего растворителя. В частности, полиморф R-(-)-модафинила кристаллизуют из органического растворителя. В конкретных вариантах осуществления органическим растворителем может быть ацетонитрил, диметилформамид (ДМФА), метанол, метилэтилкетон, N-метилпирролидон, этанол, изопропанол, изобутанол, формамид, изобутилацетат, 1,4-диоксан, тетрагидрофуран (ТГФ), этилацетат, о-ксилол, изопропилацетат,дихлорметан, пропиленгликоль, уксусная кислота, вода, ацетон, нитрометан, толуол и бензиловый спирт. Согласно изобретению, в качестве органического растворителя рассматриваются как индивидуальные растворители, так и смешанные растворители. В конкретном варианте осуществления органическим растворителем является этанол. В другом варианте осуществления для кристаллизации полиморфа R-(-)модафинила применяют смешанную систему растворителей. Смешанными системами растворителей могут быть, например, этанол и изопропиловый спирт или этилацетат и этанол. В следующем варианте осуществления кристаллизацию в стадии (b) завершают посредством термической кристаллизации. В следующем варианте осуществления кристаллизацию в стадии (b) завершают посредством выпаривания растворителя. Фармацевтическая композиция согласно изобретению имеет модифицированный профиль. Модифицированный профиль высвобождения может включать в себя, например, два или больше максимумов концентрации в плазме, например, профиль двойного высвобождения. Описано лекарственное средство, включающее в себя полиморф или сольват модафинила, и способы его получения. Обычно лекарственное средство дополнительно включает в себя один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов. Лекарственные средства описаны более подробно ниже. Описан способ лечения субъекта, предпочтительно субъекта-человека, страдающего избыточной сонливостью в дневное время, связанной с нарколепсией, утомлением, связанным с рассеянным склерозом, бесплодием, нарушениями аппетита, расстройством, выражающимся в гиперактивности, приводящей к нарушению внимания (ADHD), болезнью Паркинсона, недержанием, приступами апноэ во сне или миопатией, где модафинил является эффективным фармацевтическим средством для указанного нарушения. Способ включает в себя введение субъекту терапевтически эффективного количества полиморфа или сольвата модафинила. Описан способ лечения субъекта, страдающего одним или несколькими указанными выше состояниями или нарушениями, включающими в себя, но не ограничивающимися указанным, нарушения сна,такие как нарколепсия, где указанный способ включает в себя введение субъекту терапевтически эффективного количества формы III R-(-)-модафинила, формы IV R-(-)-модафинила или формы V R-(-)модафинила. Краткое описание чертежей Фиг. 1 - дифрактограмма PXRD полиморфа 2:1 R-(-)-модафинил:S-(+)-модафинил; фиг. 2 - термограмма ДСК полиморфа 2:1 R-(-)-модафинил:S-(+)-модафинил; фиг. 3 - дифрактограмма PXRD полиморфа R-(-)-модафинила (форма III); фиг. 4 - термограмма ДСК полиморфа R-(-)-модафинила (форма III); фиг. 5 - дифрактограмма PXRD полиморфа R-(-)-модафинила (форма III); фиг. 6 - дифрактограмма PXRD полиморфа R-(-)-модафинила (форма IV); фиг. 7 - термограмма ДСК полиморфа R-(-)-модафинила (форма IV); фиг. 8 - дифрактограмма PXRD полиморфа R-(-)-модафинила (форма IV);-2 009949 фиг. 9 - дифрактограмма PXRD полиморфа R-(-)-модафинила (форма V); фиг. 10 - дифрактограмма PXRD полиморфа R-(-)-модафинила (форма V); фиг. 11 - дифрактограмма PXRD 2:1 R-(-)-модафинил:S-(+)-модафинил; фиг. 12 - термограмма ДСК 2:1 R-(-)-модафинил:S-(+)-модафинил; фиг. 13 - дифрактограмма PXRD формы IV R-(-)-модафинила; фиг. 14 - дифрактограмма PXRD формы V R-(-)-модафинила; фиг. 15 - термограмма ДСК формы V R-(-)-модафинила; фиг. 16 - дифрактограмма PXRD сольвата R-(-)-модафинила с хлороформом; фиг. 17 - термограмма ТГА сольвата R-(-)-модафинила с хлороформом; фиг. 18 - дифрактограмма PXRD сольвата R-(-)-модафинила с хлорбензолом; фиг. 19 - дифрактограмма PXRD канального сольвата рацемического модафинила с этилацетатом; фиг. 20 - термограмма ТГА канального сольвата рацемического модафинила с этилацетатом; фиг. 21 - дифрактограмма PXRD сольвата R-(-)-модафинила с уксусной кислотой; фиг. 22 - термограмма ТГА сольвата R-(-)-модафинила с уксусной кислотой; фиг. 23 - термограмма ДСК сольвата R-(-)-модафинила с уксусной кислотой. Подробное описание изобретения Структура модафинила включает в себя стереоцентр и поэтому он может существовать в виде рацемата, одного из двух чистых изомеров или пары двух изомеров в любом соотношении. Химическим названием рацемического модафинила является -2-[(дифенилметил)сульфинил]ацетамид. Изомерными парами рацемического модафинила являются R-(-)-2-[(дифенилметил)сульфинил]ацетамид или R-(-)модафинил и S-(+)-2-[(дифенилметил)сульфинил]ацетамид или S-(+)-модафинил. Применяемый здесь термин, если не оговорено особо, энантиомерно чистый включает в себя композицию, которая является, по существу, энантиомерно чистой и включает в себя, например, композицию с энантиомерным избытком, равным или большим, чем приблизительно 90, 91, 92, 93, 94, 95, 96,97, 98 или 99%. Энантиомерный избыток определяют процентом энантиомера А - процент энантиомера В или формулой процент ее = 100([R] - [S]/([R] + [S],где R представляет собой число молей R-(-)-модафинила и S представляет собой число молей S-(+)модафинила. Применяемый здесь термин модафинил включает в себя рацемат, другие смеси R- и S-изомеров и индивидуальные энантиомеры, но может быть конкретно определен как рацемат, R-изомер, S-изомер или любая смесь как R-, так и S-изомеров. Применяемый здесь термин, если не оговорено особо, рацемический относится к веществу (например, полиморфу или сольвату), которое состоит из эквимолярной смеси энантиомеров модафинила,растворителя или обоих. Например, сольват, включающий в себя модафинил и нестереоизомерную молекулу растворителя, является рацемическим сольватом, только когда здесь присутствует эквимолярная смесь энантиомеров модафинила. Аналогично этому, сольват, включающий в себя модафинил и молекулу стереоизомерного растворителя, является рацемическим сольватом, только когда здесь присутствует эквимолярная смесь энантиомеров модафинила и энантиомеров молекулы растворителя. Применяемый здесь термин, если не оговорено особо, энантиомерно чистый относится к веществу, которое состоит из модафинила и необязательно молекулы стереоизомерного или нестереоизомерного растворителя, где энантиомерный избыток стереоизомерного соединения больше или равен приблизительно 90% ее (энантиомерный избыток). Для целей настоящего изобретения химические и физические свойства модафинила в форме сольвата или полиморфа можно сравнить с эталонным соединением, которым является модафинил в другой форме. Эталонное соединение может быть определено как свободная форма или, более определенно, ангидрат (безводное соединение) или гидрат свободной формы, или, более конкретно, например, полугидрат, моногидрат, дигидрат, тригидрат, тетрагидрат, пентагидрат; или сольват свободной формы. Эталонное соединение может быть также определено как кристаллическое или аморфное. Эталонное соединение может быть определено как кристаллическое или аморфное. Эталонное соединение может быть также определено как наиболее стабильный известный полиморф определенной формы эталонного соединения. Модафинил и молекулы некоторых растворителей настоящего изобретения имеют один или несколько хиральных центров и могут существовать в различных стереоизомерных конфигурациях. Как результат этих хиральных центров модафинил и несколько сольватов настоящего изобретения существуют в виде рацематов, смесей энантиомеров и в виде индивидуальных энантиомеров, а также диастереомеров и смесей диастереомеров. Все такие рацематы, энантиомеры и диастереомеры находятся в пределах объема настоящего изобретения, в том числе, например, цис- и транс-изомеры, R- и S-энантиомеры и(D)- и (L)-изомеры. Сольваты настоящего изобретения могут включать в себя изомерные формы либо модафинила, либо молекул растворителя или того и другого. Изомерные формы модафинила и молекул растворителя включают в себя, но не ограничиваются указанным, стереоизомеры, такие как энантиомеры и диастереомеры. В одном варианте осуществления сольват включает в себя рацемический модафинил и-3 009949 молекулу растворителя. В другом варианте осуществления сольват включает в себя энантиомерно чистый R- или S-модафинил и молекулу растворителя. В другом варианте осуществления сольват настоящего изобретения включает в себя модафинил и/или молекулу растворителя с энантиомерным избытком приблизительно 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 96, 97, 98,99%, больше чем 99% или любой промежуточной величины. В другом варианте осуществления полиморф или сольват настоящего изобретения может включать в себя модафинил с энантиомерным избытком приблизительно 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 96, 97, 98,99%, больше чем 99% или любой промежуточной величины. Обогащенный модафинил согласно настоящему изобретению включает в себя как R-(-)-, так иS-(+)-изомеры модафинила в количествах, равных или больших чем приблизительно 5, 6, 7, 8, 9 или 10 мас.%, или равных или меньших чем 90, 91, 92, 93, 94 или 95 мас.%. Например, композиция, включающая в себя 67 мас.% R-(-)-модафинила и 33 мас.% S-(+)-модафинила, является обогащенной композицией модафинила. В таком примере композиция не является ни рацемической, ни энантиомерно чистой. Термин "обогащенный R-(-)-модафинил" можно применять для описания композиции модафинила с больше чем 50% R-(-)-модафинила и меньше чем 50% S-(+)-модафинила. Подобным же образом, термин"обогащенный S-(+)-модафинил" можно применять для описания композиции модафинила с больше чем 50% S-(+)-модафинил и меньше чем 50% R-(-)-модафинила. Термины R-(-)-модафинил и S-(+)-модафинил можно применять для описания обогащенного модафинила, энантиомерно чистого модафинила или по существу энантиомерно чистого модафинила, но могут также в частности включать в себя обогащенный модафинил, энантиомерно чистый модафинил и/или по существу энантиомерно чистый модафинил. Сольваты и полиморфы, включающие в себя энантиомерно чистые и/или энантиомерно обогащенные компоненты (например, модафинил или молекулу растворителя), могут обуславливать химические и/или физические свойства, которые модулированы относительно таких свойств соответствующей формы, включающей в себя рацемический компонент. Полиморфы и сольваты модафинила можно получить с рацемическим модафинилом, энантиомерно чистым модафинилом или с любой смесью R-(-)- и S-(+)-модафинилов (например, обогащенным модафинилом) согласно настоящему изобретению. В другом варианте осуществления композиции или лекарственные средства, включающие в себя сольваты и полиморфы настоящего изобретения, можно сравнить со свободной формой модафинила, какPROVIGIL (Cephalon, Inc.). (См. заменяющий патент СШАRE37516). В другом варианте осуществления настоящего изобретения предлагаются следующие сольваты модафинила: с хлороформом, хлорбензолом, этилацетатом и уксусной кислотой. Фармацевтически приемлемые формы можно вводить способами с регулируемым или замедленным высвобождением. Фармацевтические продукты с регулируемым высвобождением имеют общую цель улучшения лекарственной терапии по сравнению с терапией, достигаемой их аналогами без регулируемого высвобождения. В идеальном случае применение оптимально разработанного препарата с регулируемым высвобождением при консервативном лечении характеризуется минимальным количеством лекарственного вещества, применяемого для лечения или устранения состояния за минимально короткий срок времени. Преимущества препаратов с регулируемым высвобождением включают в себя: 1) расширенную активность лекарственного средства; 2) пониженную частоту введения дозы; 3) повышенную восприимчивость пациента; 4) употребление меньшего общего количества лекарственного средства; 5) снижение локальных или системных побочных действий; 6) минимизацию накопления лекарственного средства; 7) снижение колебаний уровня содержания в крови, 8) повышение эффективности лечения; 9) снижение потенцирования или потери активности лекарственного средства и 10) повышение скорости подавления заболеваний или состояний. (Kim, Cherng-ju, Controlled Release Dosage Form Design, 2 Technomic Publishing, Lancaster, Pa.: 2000). Общепринятые лекарственные формы обычно обеспечивают быстрое или немедленное высвобождение лекарственного средства из препарата. В зависимости от фармакологии и фармакокинетических характеристик лекарственного средства применение общепринятых лекарственных форм может привести к широким колебаниям в концентрациях лекарственного средства в крови и других тканях пациента. Эти колебания могут влиять на ряд параметров, таких как частота введения дозы, начало действия, продолжительность эффективности действия, поддержание терапевтических уровней в крови, токсичность,побочные действия и тому подобное. Препараты с регулируемым высвобождением преимущественно можно применять для регулирования начала действия, продолжительности действия, уровней в плазме в пределах терапевтического окна и пиковых уровней в крови лекарственного средства. В частности, лекарственные формы или препараты с регулируемым или замедленным высвобождением можно применять для гарантии того, что максимальная эффективность лекарственного средства достигается при минимизации потенциальных отрицательных действий и беспокойства за безопасность, которые могут иметь место как из-за недостаточной дозы лекарственного средства (т.е. действующего при уровне, ниже минимальных терапевтических уровней), так и превышения уровня токсичности для лекарственного средства.-4 009949 Большинство препаратов с регулируемым высвобождением разработаны для начального высвобождения количества лекарственного средства (активного ингредиента), которое быстро вызывает требуемое терапевтическое действием, и постепенного и непрерывного высвобождения других количеств лекарственного средства для поддержания этого уровня терапевтического или профилактического действия на протяжении длительного периода времени. Для поддержания этого постоянного уровня лекарственного средства в организме лекарственное средство должно высвобождаться из лекарственной формы со скоростью, которая будет возмещать количество лекарственного средства, которое метаболизируется и экскретируется из организма. Регулируемое высвобождение активного ингредиента можно стимулировать различными условиями, включающими в себя, но не ограничивающимися перечисленным, pH, ионную силу, осмотическое давление, температуру, ферменты, воду и другие физиологические условия или соединения. Для применения с сольватами, полиморфами и композициями изобретения можно адаптировать различные известные лекарственные формы, препараты и устройства с регулируемым или замедленным высвобождением. Примеры их включают в себя, но не ограничиваются перечисленным, примеры, описанные в патентах США 3845770; 3916899; 3536809; 3598123; 4008719; 5674533; 5059595; 5591767; 5120548; 5073543; 5639476; 5354556; 5733566 и 6365185 B1; каждый из которых включен здесь в качестве ссылки. Эти лекарственные формы можно применять для обеспечения медленного или регулируемого высвобождения одного или нескольких активных ингредиентов с применением, например, гидроксипропилметилцеллюлозы, других полимерных матриц, гелей, проницаемых мембран, осмотических систем(таких как OROS (Alza Corporation, Mountain View, Calif. USA, многослойных покрытий, микрочастиц, липосом или микросфер или их комбинации для обеспечения требуемого профиля высвобождения в варьируемых пропорциях. Кроме того, для получения иммобилизованных, абсорбированных полиморфов, и, таким образом, осуществления регулируемой доставки лекарственного средства можно применять ионообменные материалы. Примеры конкретных анионообменников включают в себя, но не ограничиваются перечисленным, Дуолит А 568 и Дуолит АР 143 (RohmHaas, Spring House, PA. USA). Один вариант осуществления изобретения включает в себя стандартную лекарственную форму, которая включает в себя фармацевтически приемлемый сольват, гидрат, дегидрат, безводную или аморфную форму и один или несколько фармацевтически приемлемых эксципиентов или разбавителей, где фармацевтическую композицию, лекарственное средство или лекарственную форму изготовляют для регулируемого высвобождения. В специфических лекарственных формах применяют осмотическую систему доставки лекарственного средства. Конкретная и хорошо известная осмотическая система доставки лекарственного средства называется OROS (Alza Corporation, Mountain View, Calif. USA). Эта технология может быть легко адаптирована для доставки соединений и композиций изобретения. Различные аспекты технологии описаны в патентах США 6375978 B1; 6368626 B1; 6342249 B1; 6333050 В 2; 6287295 B1; 6283953 B1; 6270787 B1; 6245357 B1 и 6132420, каждый из которых включен здесь в качестве ссылки. Конкретные адаптацииOROS, которые можно применять для введения соединений и композиций изобретения, включают в себя, но не ограничиваются перечисленным, системы OROS Push-Pull, Delayed Push-Pull, MultiLayer Push-Pull и Push-Stick, все из которых хорошо известны. См., например, http://www.alza.com. Дополнительные системы OROS, которые можно применять для регулируемой пероральной доставки соединений и композиций изобретения, включают в себя OROS-CT и L-OROS. Там же; см. такжеDelivery Times, vol. II, issue II (Alza Corporation). Общепринятые пероральные лекарственные формы OROS получают прессованием порошка лекарственного средства в твердую таблетку, покрытием таблетки производными целлюлозы с образованием полупроницаемой мембраны и затем сверлением отверстий в покрытии (например, лазером). Kim,Cherng-ju, Controlled Release Dosage Form Design, 231-238 (Technomic Publishing, Lancaster, Pa.: 2000). Преимуществом таких лекарственных форм является то, что на скорость доставки лекарственного средства не влияет физиологические или экспериментальные условия. Даже лекарственное средство с pHзависимой растворимостью можно доставлять при постоянной скорости, независимо от pH среды доставки. Но из-за того, что эти преимущества обеспечиваются созданием осмотического давления внутри лекарственной формы после введения общепринятых систем доставки лекарственного средства, OROS нельзя применять для эффективной доставки лекарственных средств с низкой растворимость в воде. Там же с.234. Конкретная дозированная лекарственная форма согласно изобретению включает в себя определяемую стенкой полость, стенку, имеющую выходное отверстие, образованное или образуемое в ней, причем по меньшей мере часть стенки является полупроницаемой; расширяемый слой, расположенный внутри полости, удаленный от выходного отверстия и связанный с полупроницаемой частью стенки посредством жидкости; слой лекарственного средства в сухом или по существу сухом состоянии, помещенный в этой полости рядом с выходным отверстием и в прямом или непрямом контакте с расширяемым слоем, и активирующий поток слой, расположенный между внутренней поверхностью стенки и, по меньшей мере, наружной поверхностью слоя лекарственного средства, расположенного в полости, где-5 009949 слой лекарственного средства включает в себя полиморф или его сольват, гидрат, дегидрат, безводную или аморфную форму. См. патент США 6368626, который включен здесь во всей его полноте в качестве ссылки. Другая конкретная дозированная лекарственная форма изобретения включает в себя определяемую стенкой полость, стенку, имеющую выходное отверстие, образованное или образуемое в ней, причем по меньшей мере часть стенки является полупроницаемой; расширяемый слой, расположенный внутри полости, удаленный от выходного отверстия и связанный с полупроницаемой частью стенки посредством жидкости; слой лекарственного средства, помещенный в этой полости рядом с выходным отверстием и в прямом или непрямом контакте с расширяемым слоем; слой лекарственного средства, включающего в себя состав жидкого активного агента, абсорбированного в пористых частицах, причем пористые частицы адаптированы для сопротивления силам сдавливания с образованием уплотненного слоя лекарственного средства без значительного выделения состава жидкого активного агента, причем лекарственная форма необязательно имеет слой плацебо между выходным отверстием и слоем лекарственного средства,где слой лекарственного средства включает в себя полиморф или его сольват, гидрат, дегидрат, безводную или аморфную форму. См. патент США 6342249, который включен здесь во всей его полноте в качестве ссылки. В другом варианте осуществления фармацевтическая композиция или лекарственное средство включает в себя смесь новой формы модафинила настоящего изобретения (например, полиморфа или сольвата) и рацемического модафинила. Этот вариант осуществления можно применять, например, в качестве лекарственной формы с регулируемым, непрерывным или замедленным высвобождением. В другом варианте осуществления лекарственная форма с замедленным высвобождением включает в себя рацемический модафинил и полиморф или сольват настоящего изобретения. В другом варианте осуществления фармацевтическая композиция или лекарственное средство имеет модифицированный профиль высвобождения одного или нескольких компонентов из рацемического модафинила, R-(-)-модафинила и S-(+)-модафинила. Модифицированный профиль высвобождения может включать в себя, например два или больше максимумов концентрации в плазме, такой как профиль с двойным высвобождением. Такой профиль с модифицированным высвобождением может помочь, например, подвергаемому лечению композицией или лекарственным средством пациенту, который страдает потерей бодрствования после полудня. Второй всплеск или высвобождение API по меньшей мере через 2, 3, 4, 5 или 6 ч после введения может помочь преодолеть такой эффект. В другом варианте осуществления можно применять фармацевтическую композицию или лекарственное средство, включающее в себя небольшую загружаемую дозу, высвобождаемую сразу после введения, с последующим высвобождением API по профилю приблизительно нулевого порядка на протяжении следующих 2, 3, 4, 5 или 6 ч. В такой композиции пиковые уровни в плазме могут быть достигнуты приблизительно в полдень. В другом варианте осуществления фармацевтическая композиция или лекарственное средство,имеющее модифицированный профиль высвобождения модафинила, может включать в себя R-(-)модафинил и S-(+)-модафинил, где R-(-)-модафинил обеспечивает начальное повышение (начальнаяCmax, обусловленная R-(-)-модафинилом) концентрации в плазме и S-(+)-модафинил обеспечивает задержанное повышение (последующая Cmax, обусловленная S-(+)-модафинилом) концентрации в плазме. Замедленное повышение в Cmax, обусловленное S-(+)-модафинилом, может быть спустя 2, 3, 4, 5, 6 или более часов после начального повышения в Cmax, обусловленного R-(-)-модафинилом. В другом варианте осуществления задержанное Cmax является приблизительно равным начальному Cmax. B другом варианте осуществления задержанное Cmax больше, чем начальное Cmax. В другом варианте осуществления задержанное Cmax меньше, чем начальное Cmax. В другом варианте осуществления задержанное Cmax обусловлено рацемическим модафинилом вместо S-(+)-модафинила. В другом варианте осуществления задержанное Cmax обусловлено R-(-)-модафинилом вместо S-(+)-модафинила. В другом варианте осуществления начальное Cmax обусловлено рацемическим модафинилом вместо R-(-)-модафинила. В другом варианте осуществления начальное Cmax обусловлено S-(+)-модафинилом вместо R-(-)-модафинила. В другом варианте осуществления модифицированный профиль высвобождения имеет 3, 4, 5 или больше всплесков концентрации в плазме. В другом варианте осуществления фармацевтическая композиция или лекарственное средство имеет модифицированный профиль высвобождения модафинила, когда один или несколько компонентов из рацемического модафинила, R-(-)-модафинила или S-(+)-модафинила присутствуют в форме сольвата или полиморфа. В другом варианте осуществления фармацевтическая композиция или лекарственное средство имеет модифицированный профиль высвобождения, когда R-(-)-модафинил применяют в пероральном препарате. Такая композиция может минимизировать метаболизм первого прохода модафинила в сульфон. В другом варианте осуществления фармацевтическая композиция или лекарственное средство имеет модифицированный профиль высвобождения, когда рацемический модафинил применяют в пероральном препарате. В другом варианте осуществления фармацевтическая композиция или лекарственное средство имеет модифицированный профиль высвобождения, когда S-(+)-модафинил применяют в пероральном-6 009949 препарате. В другом варианте осуществления фармацевтическая композиция или лекарственное средство имеет модифицированный профиль высвобождения, когда рацемический модафинил и R-(-)-модафинил применяют в пероральном препарате. В другом варианте осуществления фармацевтическая композиция или лекарственное средство имеет модифицированный профиль высвобождения, когда рацемический модафинил и S-(+)-модафинил применяют в пероральном препарате. В другом варианте осуществления фармацевтическая композиция или лекарственное средство имеет модифицированный профиль высвобождения, когда S-(+)-модафинил и R-(-)-модафинил применяют в пероральном препарате. В другом варианте осуществления фармацевтическая композиция или лекарственное средство имеет модифицированный профиль высвобождения, когда рацемический модафинил, S-(+)-модафинил и R-(-)-модафинил применяют в пероральном препарате. В другом варианте осуществления фармацевтическую композицию или лекарственное средство,имеющее модифицированный профиль высвобождения модафинила, вводят трансдермально. Такая трансдермальная (TD) доставка может предотвратить метаболизм первого прохода. Кроме того, можно применять стратегию пилюля-пластырь, при которой только часть суточной дозы доставляют через кожу, чтобы обеспечить основные системные уровни, к которым добавляют дозы пероральной терапии,чтобы обеспечить эффект бодрствования. Эксципиенты, применяемые в фармацевтических композициях и лекарственных средствах, могут быть твердыми, полутвердыми, жидкими или их комбинациями. Предпочтительно, эксципиенты являются твердыми. Композиции и лекарственные средства изобретения, содержащие эксципиенты, можно получать известной методикой фармации, которая включает в себя смешивание эксципиента с API или терапевтическим агентом. Фармацевтическая композиция или лекарственное средство изобретения содержит требуемое количество API на стандартную дозу и, если оно предназначено для перорального введения, может быть в форме, например, таблетки, маленькой капсулы, пилюли, твердой или мягкой капсулы, лепешки, крахмальной капсулы, дозируемого порошка, гранул, суспензии, эликсира, дисперсии,жидкости или любой другой формы, достаточно адаптированной для такого введения. Если композиция предназначена для парентерального введения, она может быть в форме, например, суспензии или чрезкожного пластыря. Если композиция предназначена для ректального введения, она может быть в форме,например, суппозитория. В настоящее время предпочтительными являются пероральные лекарственные формы, которые являются дискретными стандартными дозами, причем каждая содержит предварительно определенное количество API, такими как таблетки или капсулы. Ниже указываются неограничивающие примеры эксципиентов, которые можно применять для получения фармацевтических композиций или лекарственных средств изобретения. Фармацевтические композиции и лекарственные средства изобретения необязательно включают в себя один или несколько фармацевтически приемлемых носителей или разбавителей в качестве эксципиентов. Подходящие носители или разбавители иллюстративно включают в себя, но не ограничиваются перечисленным, либо по отдельности, либо в комбинации, лактозу, в том числе безводную лактозу и моногидрат лактозы; крахмалы, в том числе непосредственно прессуемый крахмал и гидролизованные крахмалы (например, Celutab и Emdex); маннит; сорбит; ксилит; декстрозу (например, Cerelose 2000) и моногидрат декстрозы; дигидрат гидрофосфата кальция; разбавители на основе сахарозы; кондитерский сахар; моногидрат сульфата кальция; дигидрат сульфата кальция; гранулированный тригидрат лактата кальция; декстраты; инозит, твердые вещества гидролизованных хлебных злаков; амилозу; целлюлозы, в том числе микрокристаллическую целлюлозу, альфа-целлюлозу и аморфную целлюлозу из источников пищевой категории (например, Rexcel J), порошкообразную целлюлозу, гидроксипропилцеллюлозу (HPC) и гидроксипропилметилцеллюлозу (HPMC); карбонат кальция; глицин; бентонит; блоксополимеры; поливинилпирролидон и тому подобное. Такие носители или разбавители, если они присутствуют, составляют всего от приблизительно 5 до приблизительно 99%, предпочтительно от приблизительно 10 до приблизительно 85% и более предпочтительно от приблизительно 20 до приблизительно 80% общей массы композиции. Выбранный носитель, носители, разбавитель или разбавители, предпочтительно, проявляют подходящие характеристики сыпучести и, когда требуются таблетки, прессуемость. Лактоза, маннит, гидрофосфат натрия и микрокристаллическая целлюлоза (особенно, микрокристаллическая целлюлоза авицел PH, такая как авицел PH 101), либо по отдельности, либо в комбинации,являются предпочтительными разбавителями. Эти разбавители являются химически совместимыми сAPIs. Экстрагранулированную микрокристаллическую целлюлозу (т.е. микрокристаллическую целлюлозу, добавленную к гранулированной композиции) можно применять для увеличения твердости (для таблеток) и/или времени дезинтеграции. Лактоза, особенно моногидрат лактозы, является особенно предпочтительной. Лактоза в типичном случае обеспечивает получение композиций, имеющих подходящие скорости высвобождения APIs, стабильность, сыпучесть перед прессованием и/или свойства сушки при относительно низкой стоимости разбавителя. Она обеспечивает получение субстрата с высокой плотностью, который помогает уплотнению во время грануляции (когда применяют мокрую грануляцию) и,следовательно, улучшает свойства сыпучести смеси и свойства таблетки. Фармацевтические композиции и лекарственные средства изобретения необязательно включают в себя один или несколько фармацевтически приемлемых дезинтегрирующих средств в качестве эксципи-7 009949 ентов, особенно для препаратов в виде таблеток. Подходящие дезинтегрирующие средства включают в себя, но не ограничиваются перечисленным, либо по отдельности, либо в комбинации, крахмалы, в том числе натриевую соль гликолята крахмала (например, Explotab или PenWest) и предварительно клейстеризованные кукурузные крахмалы (например, National 1551 of National Starch and Chemical Company, National 1550, and Colocorn 1500), глины (например, Veegum HV of R.T. Vanderbilt), целлюлозы, такие как очищенная целлюлоза, микрокристаллическая целлюлоза, метилцеллюлоза, карбоксиметилцеллюлоза и натриевая соль карбоксиметилцеллюлозы, натриевая соль кроскармеллозы (например,Ac-Di-Sol of FMC), альгинаты, кросповидон и камеди, такие как агар, камедь рожкового дерева, камедь бобов рожкового дерева, камедь карайи, пектин и трагакантовая камедь. Дезинтегрирующие средства можно добавлять на любой подходящей стадии по время получения композиции, особенно, перед грануляцией или во время стадии смазывания перед прессованием. Такие дезинтегрирующие средства, если они присутствуют, составляют всего от приблизительно 0,2 до приблизительно 30%, предпочтительно от приблизительно 0,2 до приблизительно 10% и более предпочтительно от приблизительно 0,2 до приблизительно 5% общей массы композиции. Натриевая соль кроскармеллозы является предпочтительным дезинтегрирующим средством для дезинтеграции таблетки или капсулы и, если присутствует, предпочтительно составляет от приблизительно 0,2 до приблизительно 10%, более предпочтительно от приблизительно 0,2 до приблизительно 7% и еще более предпочтительно от приблизительно 0,2 до приблизительно 5% общей массы композиции. Натриевая соль кроскармеллозы придает лучшие характеристики интрагранулярной дезинтеграции гранулированным фармацевтическим композициям и лекарственным средствам настоящего изобретения. Фармацевтические композиции и лекарственные средства изобретения необязательно включают в себя один или несколько фармацевтически приемлемых связывающих агентов или адгезивов в качестве эксципиентов, особенно для препаратов в виде таблеток. Такие связывающие агенты и адгезивы, предпочтительно, придают достаточную когезию порошку, который таблетируют, чтобы обеспечить возможность нормальных операций обработки, таких как проклейка, смазывание, прессование и упаковывание,но все же позволяют таблетке дезинтегрировать и композиции абсорбироваться после приема внутрь. Такие связывающие агенты могут также предотвращать или ингибировать кристаллизацию или перекристаллизацию API настоящего изобретения после того, как соль растворится в растворе. Подходящие связывающие агенты и адгезивы включают в себя, но не ограничиваются перечисленным, либо по отдельности, либо в комбинации, камедь акации; трагакантовую камедь; сахарозу; желатин; глюкозу; крахмалы, такие как, но без ограничения указанным, предварительно клейстеризованные крахмалы (например, National 1511 and National 1500); целлюлозы, такие как, но без ограничения перечисленным,метилцеллюлоза и натриевая соль кармеллозы (например, Tylose); альгиновая кислота и соли альгиновой кислоты; силикат магния-алюминия; ПЭГ; камедь рожкового дерева; полисахаридные кислоты; бентониты; повидон, например, повидон К-15, К-30 и К-29/32; полиметакрилаты; HPMC; гидроксипропилцеллюлоза (например, Klucel of Aqualon); и этилцеллюлоза (например, Ethocel of the Dow ChemicalCompany). Такие связывающие агенты и/или адгезивы, если они присутствуют, составляют всего от приблизительно 0,5 до приблизительно 25%, предпочтительно от приблизительно 0,75 до приблизительно 15% и более предпочтительно от приблизительно 1 до приблизительно 10% общей массы фармацевтической композиции или лекарственного средства. Многие из связывающих агентов являются полимерами, включающими в себя группы амида, сложного эфира, простого эфира, спирта или кетона, и как таковые, предпочтительно, включаются в фармацевтические композиции и лекарственные средства настоящего изобретения. Поливинилпирролидоны,такие как повидон К-30, являются особенно предпочтительными. Полимерные связывающие агенты могут иметь разные молекулярные массы, степени сшивания и марки полимеров. Полимерные связывающие агенты могут быть также сополимерами, такими как блок-сополимеры, которые содержат смеси звеньев этиленоксида и пропиленоксида. Изменение в отношениях этих звеньев в данном полимере влияет на свойства и характеристики. Примерами блок-сополимеров с изменяемыми составами звеньев блоков являются полоксамер 188 и полоксамер 237 (BASF Corporation). Фармацевтические композиции и лекарственные средства изобретения необязательно включают в себя один или несколько фармацевтически приемлемых увлажняющих агентов в качестве эксципиентов. Такие увлажняющие агенты, предпочтительно, выбраны для сохранения API в тесной связи с водой, условие, которое, как считается, повышает биологическую доступность композиции. Неограничивающие примеры поверхностно-активных веществ, которые можно применять в качестве увлажняющих агентов в фармацевтических композициях и лекарственных средствах изобретения,включают в себя четвертичные аммониевые соединения, например, хлорид бензалкония, хлорид бензетония и хлорид цетилпиридиния, натриевую соль диоктилсульфосукцината, полиоксиэтиленалкилфениловые простые эфиры, например, ноноксинол 9, ноноксинол 10 и октоксинол 9, полоксамеры (блоксополимеры полиоксиэтилена и полиоксипропилена), глицериды полоксиэтиленжирных кислот и масла,например, моно- и диглицериды полиоксиэтилен(8)каприловой/каприновой кислот (например, Labrasolof Gattefosse), полиоксиэтилен(35)касторовое масло и полиоксиэтилен(40)гидрогенизированное касторо-8 009949 вое масло; полиоксиэтиленалкиловые простые эфиры, например полиоксиэтилен(20)цетостеариловый простой эфир, эфиры полиоксиэтиленжирных кислот, например полиоксиэтилен(40)стеарат, сложные эфиры полиоксиэтиленсорбитана, например полисорбат 20 и полисорбат 80 (например, Tween 80 ICI),эфиры пропиленгликоля и жирных кислот, например лаурат пропиленгликоля (например, Lauroglycolof Gattefosse), лаурилсульфат натрия, жирные кислоты и их соли, например олеиновую кислоту, олеат натрия и олеат триэтаноламина, глицериловые эфиры жирных кислот, например глицерилмоностеарат,сложные эфиры сорбитана, например, монолаурат сорбитана, моноолеат сорбитана, монопальмитат сорбитана и моностеарат сорбитана, тилоксапол и их смеси. Такие увлажняющие средства, если они присутствуют, составляют всего от приблизительно 0,25 до приблизительно 15%, предпочтительно от приблизительно 0,4 до приблизительно 10% и более предпочтительно от приблизительно 0,5 до приблизительно 5% общей массы фармацевтической композиции или лекарственного средства. Предпочтительными увлажняющими средствами являются анионогенные поверхностно-активные вещества. Особенно предпочтительным увлажняющим агентом является лаурилсульфат натрия. Лаурилсульфат, если он присутствует, составляет от приблизительно 0,25 до приблизительно 7%, более предпочтительно от приблизительно 0,4 до приблизительно 4% и еще более предпочтительно от приблизительно 0,5 до приблизительно 2% общей массы фармацевтической композиции или лекарственного средства. Фармацевтические композиции и лекарственные средства изобретения необязательно включают в себя одно или несколько фармацевтически приемлемых смазывающих веществ (включающих агенты против прилипания и/или агенты, придающие скольжение) в качестве эксципиентов. Подходящие смазывающие вещества включают в себя, но не ограничиваются перечисленным, либо по отдельности, либо в комбинации, глицерилбегапат (например, Compritol 888 of Gattefosse); стеариновую кислоту и ее соли,в том числе стеараты магния, кальция и натрия; гидрогенизированные растительные масла (например,Sterotex of Abitec), коллоидальный диоксид кремния; тальк; воски; борную кислоту; бензоат натрия; ацетат натрия; фумарат натрия; хлорид натрия; DL-лейцин; ПЭГ (например, Carbowax 4000 and Carbowax 6000 of the Dow Chemical Company); олеат натрия; лаурилсульфат натрия и лаурилсульфат магния. Такие смазывающие вещества, если они присутствуют, составляют от приблизительно 0,1 до приблизительно 10%, предпочтительно от приблизительно 0,2 до приблизительно 8% и более предпочтительно от приблизительно 0,25 до приблизительно 5% общей массы фармацевтической композиции или лекарственного средства. Стеарат магния является предпочтительным смазывающим веществом, применяемым, например,для снижения трения между оборудованием и гранулированной смесью во время прессования для получения препаратов в виде таблеток. Подходящие агенты против прилипания включают в себя, но не ограничиваются перечисленным,тальк, кукурузный крахмал, DL-лейцин, лаурилсульфат натрия и стеараты металлов. Тальк является предпочтительным агентом против прилипания или агентом, придающим скольжение, применяемым,например, для снижения прилипания препарата к поверхностям оборудования, а также для уменьшения статики в смеси. Тальк, если он присутствует, составляют от приблизительно 0,1 до приблизительно 10%, более предпочтительно от приблизительно 0,25 до приблизительно 5% и еще более предпочтительно от приблизительно 0,5 до приблизительно 2% общей массы фармацевтической композиции или лекарственного средства. Агенты, придающие скольжение, можно применять для содействия сыпучести порошкообразного твердого препарата. Подходящие агенты, придающие скольжение, включают в себя, но не ограничиваются перечисленным, коллоидальный диоксид кремния, крахмал, тальк, фосфат кальция, порошкообразную целлюлозу и трисиликат магния. Особенно предпочтительным является коллоидальный диоксид кремния. Другие эксципиенты, такие как красящие вещества, корригенты и подслащивающие вещества, являются известными в фармацевтической области и их можно применять в фармацевтических композициях и лекарственных средствах настоящего изобретения. Таблетки могут быть покрытыми, например, энтеросолюбильным покрытием или могут быть непокрытыми. Композиции изобретения могут далее включать в себя, например, буферные агенты. Необязательно можно применять один или несколько агентов для придания шипучести в качестве дезинтегрирующих агентов и/или для усиления органолептических свойств фармацевтических композиций или лекарственных средств изобретения. Когда один или несколько агентов для придания шипучести присутствуют в фармацевтических композициях или лекарственных средствах для содействия дезинтеграции лекарственных форм, они предпочтительно присутствуют в общем количестве от приблизительно 30 до приблизительно 75 мас.% и предпочтительно от приблизительно 45 до приблизительно 70 мас.%, например приблизительно 60 мас.% фармацевтической композиции или лекарственного средства. Согласно особенно предпочтительному варианту осуществления изобретения, агент для придания шипучести, присутствующий в твердой лекарственной форме в количестве, меньшем, чем количество,-9 009949 эффективное для содействия дезинтеграции лекарственной формы, обеспечивает повышенное диспергирование API в водной среде. Без связи с теорией считают, что агент для придания шипучести является эффективным для ускорения диспергирования API из лекарственной формы в желудочно-кишечный тракте, тем самым дополнительно повышая абсорбцию и обеспечивая быстрое начало терапевтического действия. Когда агент для придания шипучести присутствует в фармацевтической композиции или лекарственном средстве изобретения для содействия диспергированию в желудочно-кишечном тракте, но не для повышения дезинтеграции, он предпочтительно присутствует в количестве от приблизительно 1 до приблизительно 20 мас.%, более предпочтительно от приблизительно 2,5 до приблизительно 15 мас.% и еще более предпочтительно от приблизительно 5 до приблизительно 10 мас.% фармацевтической композиции или лекарственного средства. Агент для придания шипучести здесь является агентом, включающим в себя одно или несколько соединений, которые, действуя вместе или по отдельности, выделяют газ при контактировании с водой. Выделяемым газом обычно является кислород или, чаще всего, диоксид углерода. Предпочтительные агенты для придания шипучести включают в себя кислоту и основание, которые взаимодействуют в присутствии воды с выделением газообразного диоксида углерода. Предпочтительно, основание включает в себя карбонат или бикарбонат щелочного металла или щелочно-земельного металла и кислота включает в себя алифатическую карбоновую кислоту. Неограничивающие примеры подходящих оснований в качестве компонентов агентов для придания шипучести, пригодных для изобретения, включают в себя карбонатные соли (например, карбонат кальция), бикарбонатные соли (например, бикарбонат натрия), полукарбонатные соли и их смеси. Карбонат кальция является предпочтительным основанием. Неограничивающие примеры подходящих кислот в качестве компонентов агентов для придания шипучести и/или твердых кислот, пригодных для изобретения, включают в себя лимонную кислоту, щавелевую кислоту (D-, L- или D/L-щавелевую кислоту), яблочную кислоту, малеиновую кислоту, фумаровую кислоту, адипиновую кислоту, янтарную кислоту, кислые ангидриды таких кислот, кислые соли таких кислот и их смеси. Лимонная кислота является предпочтительной кислотой. В предпочтительном варианте осуществления изобретения, в котором агент для придания шипучести включает в себя кислоту и основание, массовое отношение кислоты к основанию составляет от приблизительно 1:100 до приблизительно 100:1, более предпочтительно от приблизительно 1:50 до приблизительно 50:1, еще более предпочтительно от приблизительно 1:10 до приблизительно 10:1. В следующем предпочтительном варианте осуществления изобретения, в котором агент для придания шипучести включает в себя кислоту и основание, отношение кислоты к основанию является приблизительно стехиометрическим. Эксципиенты, которые растворяют соли металлов APIs, обычно имеют как гидрофильные, так и гидрофобные области, или являются, предпочтительно, амфифильными или имеют амфифильные области. Один тип амфифильного или частично амфифильного эксципиента включает в себя амфифильный полимер или является амфифильным полимером. Конкретным амфифильным полимером является полиалкиленгликоль, который обычно состоит из субъединиц этиленгликоля и/или пропиленгликоля. Такие полиалкиленгликоли могут быть этерифицированы в их концевых положениях карбоновой кислотой,сложным эфиром, ангидридом карбоновой кислоты или другой подходящей частью. Примеры таких эксципиентов включают в себя полоксамеры (симметричные блок-сополимеры этиленгликоля и пропиленгликоля, например, полоксамер 237), полиалкиленгликолированные сложные эфиры токоферола (включая эфиры, образованные из ди- или полифункциональных карбоновых кислот; например, сукцинат d-альфатокоферолполиэтиленгликоль-1000) и макроголглицериды (полученные алкоголизом масла и этерификацией полиалкиленгликоля с образованием смеси моно-, ди- и триглицеридов и сложных моно- и диэфиров; например, глицеридов стеароилмакрогола-32). Такие фармацевтические композиции и лекарственные средства преимущественно вводят перорально. Фармацевтические композиции и лекарственные средства настоящего изобретения могут включать в себя от приблизительно 10 до приблизительно 50 мас.%, от приблизительно 25 до приблизительно 50 мас.%, от приблизительно 30 до приблизительно 45 мас.% или от приблизительно 30 до приблизительно 35 мас.% API, от приблизительно 10 до приблизительно 50 мас.%, от приблизительно 25 до приблизительно 50 мас.%, от приблизительно 30 до приблизительно 45 мас.% или от приблизительно 30 до приблизительно 35 мас.% эксципиента, который ингибирует кристаллизацию, и от приблизительно 5 до приблизительно 50 мас.%, от приблизительно 10 до приблизительно 40 мас.%, от приблизительно 15 до приблизительно 35 мас.% или от приблизительно 30 до приблизительно 35 мас.% связывающего вещества. В одном примере массовое отношение API к эксципиенту, который ингибирует кристаллизацию, к связывающему агенту составляет приблизительно 1:1. Твердые лекарственные формы изобретения можно получить любым подходящим способом, не ограниченным способами, описанными здесь. Иллюстративный способ включает в себя (а) стадию смешивания соли изобретения с одним или несколькими эксципиентами с образованием смеси и (b) стадию таблетирования или капсулирования смеси с образованием таблеток или капсул, соответственно.- 10009949 В предпочтительном способе твердые лекарственные формы получают способом, включающим в себя (а) стадию смешивания соли API изобретения с одним или несколькими эксципиентами с образованием смеси, (b) стадию грануляции смеси с образованием гранулята и (с) стадию таблетирования или капсулирования смеси с образованием таблеток или капсул, соответственно. Стадию (b) можно выполнять любым способом сухой или мокрой грануляции, известным в данной области, но предпочтительной является стадия сухой грануляции. Соль настоящего изобретения преимущественно гранулируют с образованием частиц от приблизительно 1 до приблизительно 100 мкм, от приблизительно 5 до приблизительно 50 мкм или от приблизительно 10 до приблизительно 25 мкм. Предпочтительно добавляют один или несколько разбавителей, один или несколько дезинтегрирующих агентов и один или несколько связывающих агентов, например, на стадии смешивания, можно необязательно добавлять увлажняющий агент, например, на стадии грануляции и, что предпочтительно, добавляют один или несколько дезинтегрирующих агентов после грануляции, но перед таблетированием или капсулированием. Смазывающее вещество предпочтительно добавляют перед таблетированием. Смешивание и грануляцию можно проводить независимо при низком или высоком сдвигающем усилии. Предпочтительно, выбирают способ, при котором образуется гранулят, который является однородным по содержанию API, который легко дезинтегрируется, который достаточно легко сыпучий, так что изменение массы можно легко регулировать во время заполнения капсул или таблетирования, и который является достаточно плотным в массе, так что загрузку можно обрабатывать в выбранном оборудовании и отдельные дозы заполнять в определенные капсулы или штампы для таблетирования. В альтернативном варианте осуществления твердые лекарственные формы получают способом, который включает в себя стадию распылительной сушки, в которой API суспендируют с одним или несколькими эксципиентами в одной или нескольких разбрызгиваемых жидкостях, предпочтительно, непротонной (например, неводной или неспиртовой) разбрызгиваемой жидкости, и затем быстро подвергают распылительной сушке над потоком теплого воздуха. Гранулят или высушенный распылением порошок, полученный любым из указанных выше иллюстративных способов, можно прессовать или формовать для получения таблеток или капсулировать для получения капсул. Можно применять общепринятые способы таблетирования и капсулирования, известные в данной области. Когда нужны таблетки с покрытиями, подходящими являются общепринятые способы покрытия. Эксципиенты для таблетированных композиций изобретения предпочтительно выбирают для обеспечения времени дезинтеграции меньше чем приблизительно 30 мин, предпочтительно приблизительно 25 мин или меньше, более предпочтительно приблизительно 20 мин или меньше и еще более предпочтительно приблизительно 15 мин или меньше в стандартном анализе дезинтеграции. В другом варианте осуществления настоящего изобретения можно получить фармацевтическую композицию или лекарственное средство, включающее в себя модафинил и дополнительный API. Модафинил и дополнительный API могут быть включены в виде смеси или комбинации активных фармацевтических ингредиентов. Например, композиция может включать в себя модафинил и кофеин в виде комбинации. Композицию, включающую в себя модафинил и кофеин, можно применять в качестве терапевтического агента для лечения тех же состояний, для которых применяют модафинил. В такой композиции, включающей в себя модафинил и кофеин, кофеин может обеспечивать характеристику быстрого высвобождения (небольшое Tmax относительно модафинила) для профиля растворения, тогда как модафинил вызывает терапевтическое действие, которое продолжается в течение часов после введения. Например, Tmax кофеина может быть 0,001, 0,01, 0,05, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7 или 0,8 от величины Tmax модафинила. Комбинированные терапии включают в себя введение двух или более APIs в одном и том же препарате или в двух или более совместно вводимых препаратах. APIs можно вводить вместе в одно и то же время или по отдельности с определенными интервалами времени. В следующем варианте осуществления настоящего изобретения предлагается новый полиморфR-(-)-модафинила. В конкретном варианте осуществления настоящее изобретение предлагает формы III, IV иV R-(-)-модафинила. Настоящее изобретение предлагает также способ получения полиморфа R-(-)-модафинила. В следующем варианте осуществления настоящего изобретения предлагается способ получения полиморфа R-(-)-модафинила, включающий в себя:(b) кристаллизацию полиморфа R-(-)-модафинила из подходящего растворителя. В следующем варианте осуществления настоящего изобретения полиморф R-(-)-модафинила кристаллизуют из органического растворителя. В конкретном варианте осуществления органическим растворителем является этанол. В другом варианте осуществления для кристаллизации полиморфа R-(-)модафинила применяют смешанную систему растворителей. Смешанными системами растворителей могут быть, например, этанол и изопропиловый спирт или этилацетат и этанол. В следующем варианте осуществления кристаллизацию на стадии (b) завершают посредством термической перекристаллизации. В другом варианте осуществления кристаллизацию на стадии (b) завершают посредством выпаривания растворителя.- 11009949 Применения модафинила являются хорошо известными в данной области и включают в себя лечение нарколепсии, связанного с рассеянным склерозом утомления, бесплодия, нарушения аппетита, расстройства, выражающегося в гиперактивности, приводящей к нарушению внимания (ADHD), болезни Паркинсона, недержания, приступов апноэ во сне или миопатий. В другом варианте осуществления одну или несколько композиций модафинила настоящего изобретения можно применять при лечении одного или нескольких указанных выше состояний. Дозу и введение для композиций модафинила согласно настоящему изобретению можно определить с применением стандартных методов в данной области, но обычно она понижается до величины между приблизительно 50 и приблизительно 700 мг/день. В другом варианте осуществления предложен способ для лечения субъекта, страдающего одним или несколькими указанными выше состояниями или нарушениями, включающими в себя, но не ограничивающимися перечисленным, нарушения сна, такие как нарколепсия, где способ включает введение субъекту терапевтически эффективного количества формы III R-(-)-модафинила, формы IV R-(-)модафинила или формы V R-(-)-модафинила. В другом варианте осуществления композицию настоящего изобретения можно вводить млекопитающему посредством инъекции. Инъекции включают в себя, но не ограничиваются перечисленным,внутривенные, подкожные и внутримышечные инъекции. В другом варианте осуществления композицию настоящего изобретения изготовляют для инъекции млекопитающему, нуждающемуся в терапевтическом действии. Примеры Аналитические способы Дифференциальные сканирующие калориметрические анализы (ДСК) образцов проводили с применением дифференциального сканирующего калориметра Q1000 (ТА Instruments, New Castle, DE,U.S.A.), который использует преимущество для QW-Series, version 1.0.0.78, Thermal Advantage Release 2.0 (2001 TA Instruments-Water LLC). Кроме того, применяемым программным обеспечением для анализа был Universal Analysis 2000 for Windows 95/98/2000/NT, version 3.1 Е; Build 3.1.0.40 (2001 TA InstrumentsWater LLC). Для анализа ДСК применяемым газом для продувки был сухой азот, эталонным материалом была пустая чашка, изготовленная из гофрированного алюминия, и образец продували при 50 мл/мин. Анализ образца ДСК проводили помещением образца модафинила в алюминиевую чашку с крышкой для гофрированной чашки. Начальная температура была обычно 20C со скоростью нагрева 10C/мин и конечная температура была 200C. Все указанные переходы (фазовые) ДСК представляют собой температуру эндотермического или экзотермического перехода при их соответствующих пиках с ошибкой +/- 2 С, если не указано особо. Термогравиметрический анализ (ТГА) образцов проводили с применением термогравиметрического анализатора Q500 (ТА Instruments, New Castle, DE, U.S.A.), который использует преимущество дляQW-Series, version 1.0.0.78, Thermal Advantage Release 2.0 (2001 TA Instruments-Water LLC). Кроме того,применяемым программным обеспечением для анализа был Universal Analysis 2000 for Windows 95/98/2000/NT, version 3.1E; Build 3.1.0.40 (2001 TA Instruments-Water LLC). Для экспериментов ТГА применяемым газом для продувки был сухой азот, продувку для достижения равновесия проводили при 40 мл/мин N2, и продувку образца проводили при 60 мл/мин N2. ТГА проводили на образце помещением образца модафинила в платиновую чашку. Исходная температура была обычно 20C при скорости нагрева 10 С/мин и конечная температура была 300C. Порошковую рентгенограмму (PXRD) для образцов получали с применением D/Max Rapid, Contact(Rigaku/MSC, The Woodlands, TX, U.S.А), который применяет в качестве его контрольного программного обеспечения RINT Rapid Control Software, Rigaku Rapid/XRD, version 1.0.0 (1999 Rigaku Co). Кроме того,применяемым программным обеспечением для анализа было RINT Rapid display software, version 1/18(Rigaku/MSC) и JADE XRD Pattern Processing, versions 5.0 and 6.0 (1995-2002, Materials Data, Inc). Для анализа PXRD параметры при сборе данных были следующими: источником был Cu с линией К у 1,5406 ; стадия х-у была с ручным управлением; размер коллиматора был 0,3 мм; капиллярная трубка (Charles Supper Company, Natick, MA, U.S.A.) имела ID (внутренний диаметр) 0,3 мм; применяли способ отражения; мощность для рентгеновской трубки была 46 кВ; ток для рентгеновской трубки был 40 мА; омега-ось осциллировали в диапазоне 0-5 при скорости 1/мин; фи-ось вращали при угле 360 при скорости 2/с; коллиматор 0,3 мм; время сбора было 60 мин, температура была комнатная и нагреватель не применяли. Образец подвергали действию источника рентгеновских лучей в капилляре из стекла,богатого бором. Кроме того, параметры анализа были следующими: 2-тета-диапазон интеграции был 2-60; Хидиапазон интеграции был 0-360; число Хи-сигментов было 1; применяемый размер шага был 0,02; эффективность интеграции была Cylint; применяли нормализацию; темновые скорости счета были 8; омегасдвиг был 180 и Хи- и Фи-сдвиги были 0. Дифрактограммы PXRD получали также с помощью рентгеновского дифрактомера Bruker AXS D8Discover. Этот инструмент был снабжен GADDS (General Area Diffraction Detection System), детекто- 12009949 ром площади Bruker AXS Hi-Star на расстоянии 15,05 см согласно калибровке системы, медным источником излучения (Cu/К 1,54056 ), автоматизированной стадией x-y-z и коллиматором 0,5 мм. Образец прессовали в форму шарика и устанавливали на стадии x-y-z. Дифрактограмму получали в условиях окружающей среды (25 С) при установлении мощности 40 кВ и 40 мА в методе отражения, тогда как образец оставался в стационарном состоянии. Время воздействия меняли и определяли для каждого образца. Полученную дифрактограмму подвергали процедуре пространственного преобразования для вычисления геометрической подушкообразной дисторсии детектора площади, затем интегрировали вдоль угла ши от-118,8 до -61,8 и угла 2-тета 2,1-37 при размере шага 0,02 с установлением нормализации, чтобы нормализовать накопитель. Относительная интенсивность пиков на дифрактограмме не обязательно является ограничением картины PXRD, поскольку интенсивность пиков может варьировать от образца к образцу, например,вследствие кристаллических примесей. Кроме того, углы каждого пика могут варьировать приблизительно на +/-0,1, предпочтительно +/-0,05. Вся картина рентгенограммы или большинство пиков картины могут также сдвигаться от приблизительно +/-0,1 до приблизительно +/-0,2 вследствие различий в калибровке, регулировках и других изменений от инструмента к инструменту и от оператора к оператору. Все приведенные пики PXRD на фигурах, в примерах и в другом месте здесь, указываются с ошибкой приблизительно 0,1 2-тета. На основе данных PXRD, приведенных здесь, включая таблицы и фигуры, каждая композиция настоящего изобретения может быть охарактеризована любым одним, любыми двумя, любыми тремя, любыми четырьмя, любыми пятью, любыми шестью, любыми семью или любыми восемью или более пиками угла 2-тета. Для характеризации композиций настоящего изобретения можно также применять любой один, два, три, четыре, пять или шесть фазовых переходов ДСК. Для характеризации композиций настоящего изобретения можно также применять любой один, любые два, три, четыре, пять или шесть переходов ДСК. Для характеризации композиций можно также применять различные комбинации пиковPXRD и фазовых переходов ДСК. Термическую (с нагревательным столиком) микроскопию выполняли на микроскопе Zeiss Axioplan 2, снабженном регулятором Mettler Toledo FP90. Применяемым нагревательным столиком был MettlerToledo FP82HT. Все определения точек плавления проводили помещением образца на предметное стекло микроскопа и покрытием его покровным стеклом. Начальную температуру устанавливали 30C и температуру повышали со скоростью 10 С/мин. Плавление наблюдали через объектив микроскопа 5 х. Метод ВЭЖХ (адаптирован из метода Donovan et al. Therapeutic Drug Monitoring 25:197-202): колонка: Astec Cyclobond I 2000 RSP, 2504,6 мм (Part411121),подвижная фаза А: 20 мМ фосфат натрия, pH 3,0, В: смесь 70:30 подвижная фаза А: ацетонитрил,скорость потока: 1,0 мл/мин (1500 фунт/кв.дюйм),программа потока: градиентная,время опыта: 35 мин. Детектирование: УФ 225 нм. Объем инъекции: 10 мкл. Температура колонки: 30+/-1C. Стандартный разбавитель: смесь 90:10 (об./об.) подвижная фаза:ацетонитрил. Промывание иглы: ацетонитрилом. Растворитель для очисткипромывочная жидкость для герметизирующего материала: смесь 90:10(об./об.) вода:ацетонитрил. Получение подвижной фазы: 1. Получение 1M дигидрофосфата натрия: 120 г дигидрофосфата натрия растворяют в воде и объем доводят до 1000 мл, раствор фильтруют. 2. Получение подвижной фазы А (20 мМ фосфат натрия, pH 3,0): для получения каждого литра 20 мл 1M фосфата натрия разбавляют до 1000 мл водой, pH регулируют до 3,0 фосфорной кислотой. 3. Получение подвижной фазы В (смесь 70:30 (об./об.) 20 мМ фосфат натрия, pH 3,0:ацетонитрил): для получения каждого литра смешивают 700 мл подвижной фазы А и 300 мл ацетонитрила. Получение образца: 1. Образцы растворяют в смеси 90:10 (об./об.) 20 мМ фосфат натрия, pH 3,0: ацетонитрил до приблизительной концентрации 20 мкг/мл. Снятие спектров Рамана. Образец либо оставляли в стеклянной пробирке, в которой его приготовляли, либо аликвоту образца переносили в стеклянное предметное стекло. Стеклянную пробирку или предметное стекло помещали в камеру для образца. Измерения проводили с применением системы Almega Dispersive Raman (Almega Dispersive Raman, Thermo-Nicolet, 5225 Verona Road, Madison, WI 53711-4495), снабженной лазерным источником с 785 нм. Образец ручным способом доводят до фокуса с применением микроскопной части прибора с увеличением объектива 10x (если не указано особо), таким образом направляя лазер на поверхность образца. Спектр снимают с применением параметров, указанных в таблице А. (Время- 13009949 экспонирования и число экспонирований может меняться; изменения для параметров будут указаны для каждого снятия спектра). Таблица А Параметры снятия спектров Рамана Снятие ИК-спектров. ИК-спектр получали с применением Nexus TM 470 FT-IR, Thermo-Nicolet, 5225 Verona Road, Madison, WI 53711-4495 и анализировали с применением программного обеспечения для контроля и анализа:OMNIC, Version 6.0a, (С) Thermo-Nicolet, 1995-2004. Пример 1. Смесь 2:1 (R)-(-)-модафинил:(S)-(+)-модафинил Безводный газообразный аммиак барботируют через раствор, содержащий R-бензгидрилсульфинилметиловый сложный эфир (8,62 г, 0,0299 моль, смесь с массовым отношением приблизительно 80:20 R-изомер:S-изомер) в метаноле, в течение 10 мин. Давление, образуемое в результате реакции, вызывает обратное течение бикарбоната натрия из ловушки в реакционную смесь. Реакцию останавливают и осадок собирают. Фильтрат концентрируют при пониженном давлении, получая при этом желтый твердый остаток (2,8 г). Желтое твердое вещество пропускают через колонку (силикагель, сорт 9385,230-400 меш, 60 ) с применением смеси 3:1 об./об. этилацетат:гексан в качестве элюента. Фильтраты затем объединяют и концентрируют при пониженном давлении, получая при этом светло-желтое твердое вещество (большая часть желтого окрашивания остается на колонке). Твердое вещество затем перекристаллизовывают из этанола нагреванием смеси до ее кипячения и затем охлаждением до комнатной температуры, получая при этом смесь 2:1 R-(-)-модафинил:S-(+)-модафинил в виде бесцветного твердого вещества (580 мг). Анализ PXDR и ДСК проводили с полученным твердым веществом и обнаружили,что твердое вещество является чистой формой R-(-)-модафинила и S-(+)-модафинила приблизительно в массовом отношении 2:1. Твердую смесь 2:1 R-(-)-модафинил:S-(+)-модафинил, полученную выше, можно характеризовать любым одним, любыми двумя, любыми тремя, любыми четырьмя, любыми пятью или любыми шестью или большим числом пиков на фиг. 1, включающих в себя, но не ограничивающихся перечисленным,пики у 8,97, 10,15, 12,87, 14,15, 15,13, 15,77, 18,19 и 20,39 2-тета (полученные данные без обработки). ДСК твердого вещества, описанного выше, показала эндотермический переход фазы приблизительно при 167C (см. фиг. 2). Пример 2. Полиморфы R-(-)-модафинила Исследовали несколько полиморфов R-(-)-модафинила, каждый характеризовали PXRD. На фиг. 3,6 и 9 показаны эти дифрактограммы PXRD (полученные данные без обработки) полиморфов формы III,формы IV и формы V. Доказано, что перекристаллизация является эффективным способом для получения и обнаружения полиморфов R-(-)-модафинила. Подходящие растворители для кристаллизации одного или нескольких полиморфов R-(-)-модафинила включают в себя, но не ограничиваются перечисленным, ацетонитрил,диметилформамид (ДМФА), метанол, метилэтилкетон, N-метилпирролидон, этанол, изопропанол, изобутанол, формамид, изобутилацетат, 1,4-диоксан, тетрагидрофуран (ТГФ), этилацетат, о-ксилол, изопропилацетат, дихлорметан, пропиленгликоль, уксусную кислоту, воду, ацетон, нитрометан, толуол и бензиловый спирт. Для кристаллизации одного или нескольких полиморфов R-(-)-модафинила можно применять отдельные растворители или смеси растворителей. Форма III R-(-)-модафинила. Безводный газообразный аммиак барботировали через раствор,содержащийRбензгидрилсульфинилметиловый сложный эфир (8,3 г, 0,0288 моль) в метаноле (75 мл) в течение 10 мин. Реакционную смесь затем перемешивали на ледяной бане при 5C в течение 1 ч и газообразный аммиак барботировали через раствор в течение дополнительных 10 мин. Перемешивание продолжали в течение дополнительных 2 ч и аммиак снова барботировали через раствор в течение 10 мин. После перемешивания в течение еще одного часа образовывался осадок (575 мг), который собирали. Фильтрат затем ней- 14009949 трализовали с применением концентрированной HCl и дополнительно образованный осадок собирали. Твердый остаток затем перекристаллизовывали из смеси 1:1 об./об. этанола и изопропилового спирта нагреванием смеси до ее кипячения и затем охлаждением до комнатной температуры, получая при этом форму III R-(-)-модафинила в виде бесцветного твердого вещества (1,01 г). Форму III R-(-)-модафинила можно характеризовать любым одним, любыми двумя, любыми тремя,любыми четырьмя, любыми пятью или любыми шестью или большим числом пиков на фиг. 3, включающих в себя, но не ограничивающихся перечисленным, пики у 7,21, 10,37, 17,73, 19,23, 21,17, 21,77 и 23,21 2-тета (Rigaku PXRD, полученные данные без обработки). ДСК формы III R-(-)-модафинила, охарактеризованной на фиг. 3, обнаруживал эндотермический переход фазы приблизительно при 161C. Получали вторую порцию формы III R-(-)-модафинила для дополнительного анализа с помощью термической микроскопии и PXRD. Получали также данные растворимости. Эти данные обсуждаются ниже. Растворимость формы III R-(-)-модафинила была равна приблизительно 6,1-7,0 мг/мл. Растворимость измеряли в суспензии в изопропилацетате, перемешиваемой при 25 С. Измерение растворимости проводили с помощью ВЭЖХ. Твердое вещество из образцов для определения растворимости сушили в атмосфере азота и характеризовали PXRD и термической микроскопией. Во время проведения анализов не наблюдали превращения формы. Термическую (с нагревательным столиком) микроскопию применяли при скорости нагрева 10 С/мин для измерения точки плавления формы III R-(-)-модафинила, которая, как определено, была приблизительно 156-158C. Форму III R-(-)-модафинила можно характеризовать любым одним, любыми двумя, любыми тремя,любыми четырьмя, любыми пятью или любыми шестью или большим числом пиков на фиг. 5, включающих в себя, но не ограничивающихся перечисленным, пики у 7,19, 10,37, 12,11, 14,41, 17,73, 19,17,21,71, 23,17, 24,39, 25,17, 26,07 и 27,91 2-тета (Rigaku PXRD, данные с вычтенным фоном). Форма IV R-(-)-модафинила. Безводный газообразный аммиак барботировали через раствор,содержащийRбензгидрилсульфинилметиловый сложный эфир (8,3 г, 0,0288 моль) в метаноле (75 мл) в течение 10 мин. Реакционную смесь затем перемешивали на ледяной бане при 5 С в течение 1 ч и газообразный аммиак барботировали через раствор в течение дополнительных 10 мин. После перемешивания в течение еще одного часа образовывался осадок (422 мг), который собирали. Фильтрат затем нейтрализовали с применением концентрированной HCl и дополнительно образованный осадок собирали. Твердое вещество (3 г) пропускали через колонку (силикагель, сорт 9385, 230-400 меш, 60 ) с применением смеси 3:1 об./об. этилацетата и гексана в качестве элюента. Колонку затем промывали струей этилацетата (250 мл). Фильтраты объединяли и концентрировали при пониженном давлении, получая при этом форму IV R-(-)-модафинила в виде бесцветного твердого вещества (590 мг). Форму IV R-(-)-модафинила можно характеризовать любым одним, любыми двумя, любыми тремя,любыми четырьмя, любыми пятью или любыми шестью или большим числом пиков на фиг. 6, включающих в себя, но не ограничивающихся перечисленным, пики у 7,79, 10,31, 11,77, 16,49, 17,33, 19,47 и 23,5 2-тета (Rigaku PXRD, полученные данные без обработки). ДСК формы IV R-(-)-модафинила, охарактеризованной на фиг. 7, обнаруживала эндотермический переход фазы приблизительно при 147C. Получали вторую порцию формы IV R-(-)-модафинила для дополнительного анализа с помощью термической микроскопии и PXRD. Получают также данные растворимости. Эти данные обсуждаются ниже. Растворимость формы IV R-(-)-модафинила была равна приблизительно 3,5-4,0 мг/мл. Растворимость измеряли в суспензии в изопропилацетате, перемешиваемой при 25C. Измерение растворимости проводили с помощью ВЭЖХ. Твердое вещество из образцов для определения растворимости сушили в атмосфере азота и характеризовали PXRD и термической микроскопией. Во время проведения анализа не наблюдали превращения формы. Термическую (с нагревательным столиком) микроскопию применяли при скорости нагрева 10 С/мин для измерения точки плавления формы IV R-(-)-модафинила, которая, как определено, была приблизительно 147-158 С. Форму IV R-(-)-модафинила можно характеризовать любым одним, любыми двумя, любыми тремя,любыми четырьмя, любыми пятью или любыми шестью или большим числом пиков на фиг. 8, включающих в себя, но не ограничивающихся перечисленным, пики у 7,77, 10,33, 11,75, 16,53, 19,43, 19,89,21,87, 23,49 и 26,69 2-тета (Rigaku PXRD, данные с вычтенным фоном). Форма V R-(-)-модафинила. Форму IV R-(-)-модафинила (получена по указанной выше методике) нагревали в растворе этанола до кипячения смеси и затем охлаждали до комнатной температуры. Твердое вещество затем собирали и характеризовали как форму V R-(-)-модафинила.- 15009949 Форму V R-(-)-модафинила можно характеризовать любым одним, любыми двумя, любыми тремя,любыми четырьмя, любыми пятью или любыми шестью или большим числом пиков на фиг. 9, включающих в себя, но не ограничивающихся перечисленным, пики у 6,61, 10,39, 13,99, 16,49, 17,73, 19,03,20,87, 22,31 и 25,99 2-тета (Rigaku PXRD, полученные данные без обработки). Получали вторую порцию формы V R-(-)-модафинила для дополнительного анализа с помощью термической микроскопии и PXRD. Получали также данные растворимости. Эти данные обсуждаются ниже. Растворимость формы V R-(-)-модафинила была равна приблизительно 2,1-2,6 мг/мл. Растворимость измеряли в суспензии в изопропилацетате, перемешиваемой при 25C. Измерение растворимости проводили с помощью ВЭЖХ. Твердое вещество из образцов для определения растворимости сушили в атмосфере азота и характеризовали PXRD и термической микроскопией. Во время проведения анализа не наблюдали превращения формы. Термическую (с нагревательным столиком) микроскопию применяли при скорости нагрева 10C/мин для измерения точки плавления формы V R-(-)-модафинила, которая, как определено, была приблизительно 159 С. Форму V R-(-)-модафинила можно характеризовать любым одним, любыми двумя, любыми тремя,любыми четырьмя, любыми пятью или любыми шестью или большим числом пиков на фиг. 10, включающих в себя, но не ограничивающихся перечисленным, пики у 6,53, 10,19, 13,90, 16,56, 17,35, 17,62,18,99, 20,93, 22,08, 23,36 и 25,91 2-тета (Bruker PXRD, полученные данные без обработки). Полиморфы R-(-)-модафинила называют формами III, IV и V на основе найденного сходства в их дифрактограммах PXRD с такими дифрактограммами для соответствующих форм III, IV и V рацемического модафинила в заявке на патент США 20020043207, опубликованной 18 апреля 2002. Пример 3. R-(-)-модафинил:S-(+)-модафинил, 2:1 Получали раствор, содержащий R-(-)-модафинил (80,16 мг, 0,293 ммоль) и рацемический модафинил (20,04 мг, 0,0366 ммоль) в этаноле (2 мл). Смесь нагревали для кипячения, чтобы растворить все твердое вещество и затем охлаждали до комнатной температуры (25 С). После выдерживания при комнатной температуре в течение 15 мин раствор выдерживали при 5 С на протяжении ночи. Раствор затем декантировали и оставшиеся кристаллы сушили под потоком газообразного азота и характеризовали с применением ВЭЖХ, PXRD, ДСК и термической микроскопии. Полученные кристаллы содержали от приблизительно 63 до приблизительно 67% R-(-)модафинила, остальная часть кристаллов является S-(+)-модафинилом. Анализ ВЭЖХ показал, что кристаллы были фазой 2:1, содержащей две молекулы R-(-)-модафинила на каждую одну молекулу S-(+)модафинила.PXDR проводили на образце монокристалла R-(-)-модафинил:S-(+)-модафинил, 2:1. МонокристаллR-(-)-модафинил:S-(+)-модафинил, 2:1, можно характеризовать любым одним, любыми двумя, любыми тремя, любыми четырьмя, любыми пятью или любыми шестью или большим числом пиков на фиг. 6,включающих в себя, но не ограничивающихся перечисленным, 8,95, 10,17, 11,87, 14,17, 15,11, 17,39,18,31, 20,39, 21,09, 24,41 и 26,45 2-тета (Rigaku PXRD, полученные данные без обработки). ДСК R-(-)-модафинил:S-(+)-модафинил, 2:1, охарактеризованная на фиг. 12, обнаруживал эндотермический переход приблизительно при 168 С. Термическую (с нагревательным столиком) микроскопию применяли при скорости нагрева 5 С/мин для измерения точки плавления R-(-)-модафинил:S-(+)-модафинил 2:1, которая, как определено, была приблизительно 160-166C. Пример 4. Форма IV R-(-)-модафинила 105,9 мг R-(-)-модафинила суспендировали в 1,5 мл этанола в течение 2 дней. Жидкость отделяли фильтрованием и затем сушили над потоком газообразного азота. Образовавшееся твердое вещество анализировали с помощью PXRD и определили, что оно является формой IV R-(-)-модафинила (фиг. 13). Форму IV R-(-)-модафинила можно характеризовать любым одним, любыми двумя, любыми тремя,любыми четырьмя, любыми пятью или любыми шестью или большим числом пиков на фиг. 13, включающих в себя, но не ограничивающихся перечисленным, пики у 7,64, 10,17, 11,61, 16,41, 19,34, 21,71,22,77 и 23,36 2-тета (Bruker PXRD, полученные данные без обработки). Форму IV R-(-)-модафинила выделяли также посредством термической перекристаллизации из этанола и посредством медленного выпаривания растворителя этанола. Пример 5. Форма V R-(-)-модафинила 107,7 мг R-(-)-модафинила суспендировали в 3 мл этилацетата. Суспензию нагревали на нагревательном столике (60C) для растворения твердого вещества. Приблизительно от одной трети до половины нагретого растворителя выпаривают с потоком газообразного азота. Смесь затем охлаждали до комнатной температуры (25C). Фильтрующую центрифугу применяли для отделения твердого вещества от жидкости. Образовавшееся твердое вещество анализировали с помощью PXRD и ДСК и обнаружили, что оно является формой V R-(-)-модафинила (фиг. 14 и 15). Форму V R-(-)-модафинила можно характеризовать любым одним, любыми двумя, любыми тремя,- 16009949 любыми четырьмя, любыми пятью или любыми шестью или большим числом пиков на фиг. 14, включающих в себя, но не ограничивающихся перечисленным, пики у 6,52, 10,23, 13,93, 16,37, 17,61, 18,97,20,74, 22,21, 23,36 и 25,90 2-тета (Bruker PXRD, полученные данные без обработки). Выполняли анализ ДСК формы V R-(-)-модафинила. На фиг. 15 показан эндотермический переход фазы приблизительно при 161-162 (161,57)С. Пример 6. Сольват R-(-)-модафинила с хлороформом 200 мкл хлороформа добавляли к 30,5 мг R-(-)-модафинила. Смесь нагревали при 75 С в течение 30 мин и затем добавляли дополнительные 200 мкл хлороформа. Спустя дополнительные 30 мин твердое вещество полностью растворялось. Образец нагревали в течение дополнительных 2 ч. После нагревания образец охлаждали до 5 при скорости приблизительно 1/мин. После достижения 5 С образец все еще был гомогенным жидким раствором. Образец затем помещали под поток азота на одну минуту, вызывая тем самым начало образования кристаллов. Образец снова инкубировали при 5 С и получали дополнительное твердое вещество. Образец затем сушили под потоком азота и характеризовали PXRD и ТГА. Анализ PXRD выполняли для сольвата R-(-)-модафинила с хлороформом. Сольват R-(-)модафинила с хлороформом можно характеризовать любым одним, любыми двумя, любыми тремя, любыми четырьмя, любыми пятью или любыми шестью или большим числом пиков на фиг. 16, включающих в себя, но не ограничивающихся перечисленным, пики у 8,97, 12,07, 14,20, 16,91, 17,49, 18,56, 20,87,21,45, 23,11 и 25,24 2-тета (Bruker PXRD, полученные данные без обработки). Проводили ТГА сольвата R-(-)-модафинила с хлороформом. На фиг. 17 показано, что приблизительно 15 мас.% терялось между приблизительно 25 и приблизительно 150C. Пример 7. Сольват R-(-)-модафинила с хлорбензоломR-(-)-модафинил (102,6 мг, 0,375 ммоль) суспендировали в хлорбензоле (5 мл) и суспензию нагревали на нагревательном столике при 60C. Смеси давали возможность охладиться приблизительно до 25 С. Суспензию снова нагревали и добавляли ТГФ до растворения всех твердых веществ. Раствору затем давали возможность охладиться при сохранении при комнатной температуре в течение 4 дней в герметизированной ампуле. После хранения образовавшееся твердое вещество собирают посредством вакуумного фильтрования и характеризуют посредством PXRD.PXRD выполняли на сольвате R-(-)-модафинила с хлорбензолом. Сольват R-(-)-модафинила с хлорбензолом можно характеризовать любым одним, любыми двумя, любыми тремя, любыми четырьмя, любыми пятью или любыми шестью или большим числом пиков на фиг. 18, включающих в себя, но не ограничивающихся перечисленным, пики у 4,51, 6,25, 7,77, 10,37, 11,43, 11,97, 16,61, 17,95, 20,19, 20,89,23,41 и 30,43 2-тета (Bruker PXRD, полученные данные без обработки). Пример 8. Канальный сольват рацемического модафинила с этилацетатом Канальный сольват рацемического модафинила с этилацетатом получали из раствора рацемического модафинила (53,7 мг, 0,196 ммоль) и 1-гидрокси-2-нафтойной кислоты (75,5 мг, 0,401 ммоль) в 2,4 мл этилацетата, полученного растворением на нагревательном столике при 60C. После охлаждения в раствор вносили затравку измельченных сокристаллов R-(-)-модафинил:1-гидрокси-2-нафтойная кислота(см. пример 17 заявкиPCT/US2004/29013). Анализ PXRD проводили с канальным сольватом рацемического модафинила с этилацетатом. Канальный сольват рацемического модафинила с этилацетатом можно характеризовать любым одним, любыми двумя, любыми тремя, любыми четырьмя, любыми пятью или любыми шестью или большим числом пиков на фиг. 19, включающих в себя, но не ограничивающимися перечисленным, пики у 8,88, 14,09,19,83, 21,59, 23,04 и 25,94 2-тета (Bruker PXRD, полученные данные без обработки). Проводили ТГА канального сольвата с этилацетатом рацемического модафинила. На фиг. 20 показано, что приблизительно 3,6 мас.% теряется между приблизительно 25 и приблизительно 150C. Пример 9.Сольват R-(-)-модафинила с уксусной кислотой Сольват R-(-)-модафинила с уксусной кислотой получали размалыванием R-(-)-модафинила(105,5 мг) в 0,066 мл уксусной кислоты в течение 10 мин в цилиндре из нержавеющей стали дробилкой/смесителем Wig-L-Bug. Порошок затем анализировали ДСК, ТГА и PXRD. Получали PXRD сольвата R-(-)-модафинила с уксусной кислотой. Сольват можно характеризовать любым одним, любыми двумя, любыми тремя, любыми четырьмя, любыми пятью или любыми шестью или большим числом пиков на фиг. 21, включающих в себя, но не ограничивающихся перечисленным,пики у 9,17, 10,20, 16,61, 17,59, 18,90, 21,11 и 24,11 2-тета (Bruker PXRD, полученные данные без обработки). Проводили ТГА сольвата R-(-)-модафинила с уксусной кислотой. На фиг. 22 показано, что приблизительно 11 мас.% теряется между приблизительно 25 и приблизительно 125 С. Проводили анализ ДСК сольвата R-(-)-модафинила с уксусной кислотой. На фиг. 23 показан эндотермический переход приблизительно при 56 С. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, включающая смесь 2:1 R-(-)-модафинил:S-(+)-модафинил. 2. Фармацевтическая композиция по п.1, где:(a) композиция характеризуется порошковой рентгенограммой, включающей пики, соответствующие градусам углов 2-тета, где:(i) указанная композиция представляет собой смесь 2:1 R-(-)-модафинил:S-(+)-модафинил и указанная рентгенограмма включает пики, соответствующие 8,97, 10,15 и 20,39;(ii) указанная композиция представляет собой смесь 2:1 R-(-)-модафинил:S-(+)-модафинил и указанная рентгенограмма включает пики, соответствующие 8,97 и 18,19;(iii) указанная композиция представляет собой смесь 2:1 R-(-)-модафинил:S-(+)-модафинил и указанная рентгенограмма включает в себя пики, соответствующие 10,15 и 20,39;(iv) указанная композиция представляет собой смесь 2:1 R-(-)-модафинил:S-(+)-модафинил и указанная рентгенограмма включает в себя пики, соответствующие 15,77 и 19,25; или(v) указанная композиция представляет собой смесь 2:1 R-(-)-модафинил:S-(+)-модафинил и указанная рентгенограмма включает в себя пик, соответствующий 8,97; или(b) композиция характеризуется термограммой ДСК, где указанная композиция является смесью 2:1R-(-)-модафинил:S-(+)-модафинил и указанная термограмма ДСК включает эндотермический переход приблизительно в области 167C. 3. Композиция по п.2, где указанная композиция дополнительно включает разбавитель, эксципиент или носитель. 4. Способ получения смеси 2:1 R-(-)-модафинил:S-(+)-модафинил, включающий:(b) кристаллизацию смеси 2:1 R-(-)-модафинил:S-(+)-модафинил из растворителя или смеси растворителей.
МПК / Метки
МПК: C07C 317/10, A61K 31/165
Метки: модафинила, композиции
Код ссылки
<a href="https://eas.patents.su/28-9949-kompozicii-modafinila.html" rel="bookmark" title="База патентов Евразийского Союза">Композиции модафинила</a>
Предыдущий патент: Игровой автомат, относящийся к типу, в котором в игре участвует большое количество игроков
Следующий патент: Способ добычи материалов
Случайный патент: Композиции мезотриона