Способ скрининга ингибиторов/блокаторов репликации вич-1, псевдо-вич-1-частицы и набор для осуществления способа
Номер патента: 24077
Опубликовано: 31.08.2016
Авторы: Спирин Павел Владимирович, Прасолов Владимир Сергеевич, Прокофьева Мария Михайловна
Формула / Реферат
1. Псевдо-ВИЧ-1-частица, включающая белок оболочки G вируса везикулярного стоматита (ВВС), фермент обратной транскриптазы ВИЧ-1, фермент интегразы ВИЧ-1, структурные белки ВИЧ-1, формирующие белковый каркас вирусной частицы и ген зеленого флуоресцентного белка (GFP), где фермент обратной транскриптазы ВИЧ-1 и фермент интегразы ВИЧ-1 представляют собой мутантную форму.
2. Псевдо-ВИЧ-1-частица по п.1, в которой мутантная форма фермента обратной транскриптазы обладает лекарственной устойчивостью к нуклеозидным ингибиторам фермента обратной транскриптазы ВИЧ-1 и имеет одну из следующих аминокислотных последовательностей:
D67N, K70R (замена аспарагиновой кислоты на аспарагин в положении 67, замена лизина на аргинин в положении 70) следующей структуры:

D67N, K70R, T215F, K219Q (замена аспарагиновой кислоты на аспарагин в положении 67, замена лизина на аргинин в положении 70, замена треонина на фенилаланин в положении 215, замена лизина на глутамин в положении 219) следующей структуры:

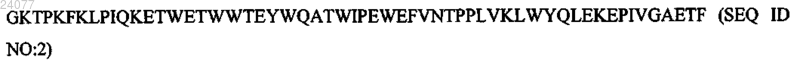
T215F, K219Q (замена треонина на фенилаланин в положении 215, замена лизина на глутамин в положении 219) следующей структуры:

3. Псевдо-ВИЧ-1-частица по п.1, в которой мутантная форма фермента обратной транскриптазы обладает лекарственной устойчивостью к ненуклеозидным ингибиторам фермента обратной транскриптазы ВИЧ-1 и имеет одну из следующих аминокислотных последовательностей:
K103N (замена лизина на аспарагин в положении 103) следующей структуры:

V106A (замена валина на аланин в положении 106) следующей структуры:

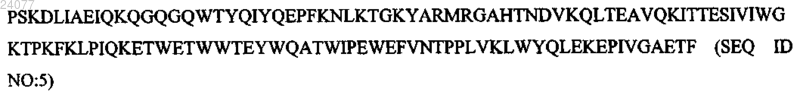
Y181C (замена тирозина на цистеин в положении 181) следующей структуры:

K103N, Y181C (замена лизина на аспарагин в положении 103, замена тирозина на цистеин в положении 181) следующей структуры:

4. Псевдо-ВИЧ-1-частица по п.1, в которой мутантная форма фермента интегразы обладает лекарственной устойчивостью к ингибиторам фермента интегразы ВИЧ-1 и имеет одну из следующих аминокислотных последовательностей:
Q148K (замена глутамина на лизин в положении 148) следующей структуры:

N155H (замена аспарагина на гистидин в положении 155) следующей структуры:

Q148K, G140S (замена глутамина на лизин в положении 148, замена глицина на серин в положении 140) следующей структуры:

Q148K, Е138K (замена глутамина на лизин в положении 148, замена глутаминовой кислоты на лизин в положении 138) следующей структуры:

N155H, Е92K (замена аспарагина на гистидин в положении 155, замена глутаминовой кислоты на лизин в положении 92) следующей структуры:

5. Плазмида, направляющая в упаковывающих клетках сборку псевдо-ВИЧ-1-частицы по пп.1-4, в состав которой входят гены gag ВИЧ-1 и pol ВИЧ-1, содержащая один из вариантов мутации гена pol, придающих ВИЧ-1 лекарственную устойчивость.
6. Плазмида по п.5, содержащая мутацию гена pol в кодоне AAA в положении 499, имеющая нуклеотидную последовательность, представленную на фиг. 1 (SEQ ID NO: 13).
7. Плазмида по п.5, содержащая мутацию гена pol в кодоне GTA в положении 508, имеющая нуклеотидную последовательность, представленную на фиг. 2 (SEQ ID NO: 14).
8. Плазмида по п.5, содержащая мутацию гена pol в кодоне ТАТ в положении 733, имеющая нуклеотидную последовательность, представленную на фиг. 3 (SEQ ID NO: 15).
9. Плазмида по п.5, содержащая мутации гена pol в кодоне AAA в положении 499 и в кодоне ТАТ в положении 733, имеющая нуклеотидную последовательность, представленную на фиг. 4 (SEQ ID NO: 16).
10. Плазмида по п.5, содержащая мутации гена pol в кодоне GAC в положении 391 и в кодоне AAA в положении 400, имеющая нуклеотидную последовательность, представленную на фиг. 5 (SEQ ID NO: 17).
11. Плазмида по п.5, содержащая мутации гена pol в кодоне GAC в положении 391, в кодоне AAA в положении 400, в кодоне АСС в положении 835 и в кодоне AAA в положении 847, имеющая нуклеотидную последовательность, представленную на фиг. 6 (SEQ ID NO: 18).
12. Плазмида по п.5, содержащая мутации гена pol в кодоне АСС в положении 835 и в кодоне AAA в положении 847, имеющая нуклеотидную последовательность, представленную на фиг. 7 (SEQ ID NO: 19).
13. Плазмида по п.5, содержащая мутацию гена pol в кодоне CAA в положении 2314, имеющая нуклеотидную последовательность, представленную на фиг. 8 (SEQ ID NO: 20).
14. Плазмида по п.5, содержащая мутацию гена pol в кодоне AAT в положении 2335, имеющая нуклеотидную последовательность, представленную на фиг. 9 (SEQ ID NO: 21).
15. Плазмида по п.5, содержащая мутации гена pol в кодоне CAA в положении 2314 и в кодоне GGC в положении 2290, имеющая нуклеотидную последовательность, представленную на фиг. 10 (SEQ ID NO: 22).
16. Плазмида по п.5, содержащая мутации гена pol в кодоне CAA в положении 2314 и в кодоне GAA в положении 2284, имеющая нуклеотидную последовательность, представленную на фиг. 11 (SEQ ID NO: 23).
17. Плазмида по п.5, содержащая мутации гена pol в кодоне AAT в положении 2335 и в кодоне GAG в положении 2146, имеющая нуклеотидную последовательность, представленную на фиг. 12 (SEQ ID NO: 24).
18. Способ сборки псевдо-ВИЧ-1-частицы по пп.1-4, включающий введение лентивирусного вектора, содержащего маркерный ген зеленого флуоресцентного белка (GFP), вместе с плазмидой по пп.5-16, направляющей синтез белков, необходимых для формирования псевдо-ВИЧ-1-частиц, плазмидой, содержащей ген env, направляющий синтез белка оболочки G вируса везикулярного стоматита, и плазмидой, содержащей ген rev, направляющий синтез регуляторного белка Rev в клетки HEK-293 методом Ca-фосфатной трансфекции, и через 24 ч после трансфекции инфекционные псевдо-ВИЧ-1-частицы начинают собирать с интервалом 12 ч.
19. Применение псевдо-ВИЧ-1-частицы по пп.1-7 для скрининга ингибиторов/блокаторов репликации ВИЧ-1.
20. Способ скрининга ингибиторов/блокаторов репликации ВИЧ-1, включающий добавление исследуемого ингибитора/блокатора репликации ВИЧ-1 к чувствительным клеткам, затем добавление псевдо-ВИЧ-1-частиц по пп.1-7 к чувствительным клеткам, выявление флуоресценции чувствительных клеток и определение по количеству флуоресцирующих клеток в трансдуцированной популяции эффективности воздействия ингибитора/блокатора репликации ВИЧ-1 на псевдо-ВИЧ-1-частицы.
21. Способ скрининга по п.19, в котором чувствительные клетки представляют собой клетки линий HEK-293, SC-1, Jurkat, CEM-SS и Kasumi-1.
22. Набор для скрининга потенциальных ингибиторов/блокаторов репликации ВИЧ-1, включающий панель псевдо-ВИЧ-1-частиц по пп.1-7, псевдо-ВИЧ-1-частицы, в которых интеграза и обратная транскриптаза ВИЧ-1 представляют собой форму дикого типа без лекарственной устойчивости, клетки линий HEK-293, SC-1, Jurkat, CEM-SS и Kasumi-1 и среду DMEM с добавлением 10% эмбриональной сыворотки крупного рогатого скота, 4 мМ L-глутамина, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина для клеток линий HEK-293 и SC-1, среду RPMI-1640 с добавлением 20% FCS, 4 мМ L-глутамина, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина для клеток линий Jurkat, CEM-SS и Kasumi-1; стандартный фосфатный буфер PBS.
Текст
СПОСОБ СКРИНИНГА ИНГИБИТОРОВ/БЛОКАТОРОВ РЕПЛИКАЦИИ ВИЧ-1,ПСЕВДО-ВИЧ-1-ЧАСТИЦЫ И НАБОР ДЛЯ ОСУЩЕСТВЛЕНИЯ СПОСОБА Изобретение относится к медицине, а именно - к молекулярной биологии, и может быть использовано для скрининга потенциальных ингибиторов/блокаторов репликации ВИЧ-1. Сущностью изобретения является способ скрининга ингибиторов/блокаторов репликации ВИЧ-1,включающий добавление исследуемого ингибитора/блокатора репликации ВИЧ-1 к чувствительным клеткам, затем добавление псевдо-ВИЧ-1-частиц к чувствительным клеткам,выявление флуоресценции чувствительных клеток и определение по количеству флуоресцирующих клеток в трансдуцированной популяции эффективности воздействия ингибитора/блокатора репликации ВИЧ-1 на псевдо-ВИЧ-1-частицы. Указанные псевдо-ВИЧ-1 частицы включают белок оболочки G вируса везикулярного стоматита (ВВС), фермент обратной транскриптазы ВИЧ-1, фермент интегразы ВИЧ-1, структурные белки ВИЧ-1, формирующие белковый каркас вирусной частицы и ген зеленого флуоресцентного белка (GFP), где фермент обратной транскриптазы ВИЧ-1 и фермент интегразы ВИЧ-1 представляют собой мутантную форму. Для осуществления способа скрининга ингибиторов/блокаторов репликации ВИЧ-1 предложен набор, который включает панель псевдо-ВИЧ-1-частиц, включая псевдо-ВИЧ-1 частицы, у которых фермент интегразы и фермент обратной транскриптазы ВИЧ-1 представляют собой форму дикого типа без лекарственной устойчивости, клетки линий НЕK-293, SC-1, Jurkat,CEM-SS и Kasumi-1 и среду DMEM с добавлением 10% эмбриональной сыворотки крупного рогатого скота, 4 мМ L-глутамина, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина для клеток линий НЕK-293 и SC-1, среду RPMI-1640 с добавлением 20% FCS, 4 мМ L-глутамина,100 ед./мл пенициллина, 100 мкг/мл стрептомицина для клеток линий Jurkat, CEM-SS и Kasumi1; стандартный фосфатный буфер PBS.a lentiviral vector". Science, 1996 Apr 12; БИОЛОГИИ ИМ. В.А. ЭНГЕЛЬГАРДТА 272(5259), p. 263-267 (реферат) [ он-лайн ] РОССИЙСКОЙ АКАДЕМИИ НАУК [найдено 12.02.2014]. Найдено из PubMed,ИСПОЛНИТЕЛЬ В РАМКАХPMID: 8602510 ГОСУДАРСТВЕННОГО КОНТРАКТА 16.512.12.2006 ОТ 14.09.2011 ГОДА,ЗАКАЗЧИК - МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ (RU) Изобретение относится к медицине, а именно - к молекулярной биологии, и предназначено для скрининга потенциальных ингибиторов/блокаторов репликации ВИЧ-1. Вирус иммунодефицита человека типа 1 (ВИЧ-1) - возбудитель одного из широко распространенных и наиболее опасных для жизни человека заболеваний - синдрома приобретенного иммунодефицита(СПИДа). По оценкам Всемирной Организации Здравоохранения, в 2009 году численность ВИЧ-инфицированных в мире составила около 35 млн, из них взрослых - 32 млн, а детей моложе 15 лет 3 млн. Россия занимает одно из первых мест в мире по темпам роста ВИЧ-инфекций. Исследования природного вируса могут проводиться только в сертифицированных лабораториях и организациях, имеющих необходимые условия, гарантирующие безопасность, и разрешение для работы с инфекционными материалами 3-го класса опасности. Надо учесть, что при использовании очищенных рекомбинантных ферментов невозможно получить адекватные данные об антиретровирусных свойствах веществ, так как такая система не позволяет определить цитотоксичность этих соединений, эффективность их проникновения в клетку, стабильность и возможные превращения в клетке. Для проведения скрининга потенциальных ингибиторов/блокаторов репликации ВИЧ-1 были созданы рекомбинантные лентивирусные векторы на основе вируса иммунодефицита человека типа 1 (ВИЧ 1 или HIV-1) дикого типа, т.е. их можно рассматривать как псевдо-ВИЧ-1-частицы. Впервые исследования на ВИЧ-1-подобных частицах проводились в 1996 году [1]. Таким образом, такие частицы способны переносить и направлять экспрессию целевых и маркерных генов, но не дают начало новым вирусным частицам. Иными словами, псевдо-ВИЧ-1-частицы являются "вирусами одноразового действия" и не вызывают развития вирусной инфекции, т.е. являются безопасными. Однако эти псевдо-ВИЧ-1-частицы содержат ферменты (обратную транскриптазу, интегразу и протеазу) ВИЧ-1 дикого типа и не содержат все гены, кодирующие вирусные белки, вместо них такие частицы содержат искусственно сконструированный рекомбинантный РНК-геном, содержащий целевой и маркерный гены. Следовательно, указанные псевдо-ВИЧ-1-частицы невозможно использовать для проведения скрининга потенциальных ингибиторов/блокаторов репликации лекарственно-устойчивых форм ВИЧ-1. Задачей, которую решает заявленное изобретение, является создание псевдо-ВИЧ-1-частиц и тестнабора для безопасного скрининга антиретровирусных соединений, подавляющих основные этапы репликации ВИЧ-1. В созданных псевдо-ВИЧ-1-частицах присутствуют вирусные ферменты (обратная транскриптаза,интеграза), сообщающие вирусу лекарственную устойчивость. При этом эти ферменты обеспечивают эффективный перенос и экспрессию маркерного гена в клетках-мишенях, подобно ферментам дикого типа. Так как работа с лекарственно-устойчивым ВИЧ-1, содержащим эти мутантные ферменты, не может проводиться (из соображений биобезопасности) в обычных лабораториях, то предлагаемые псевдоВИЧ-1-частицы являются адекватной и безопасной основой для поиска новых эффективных ингибиторов/блокаторов мутантных ферментов (обратной транскриптазы, интегразы), сообщающих ВИЧ-1 лекарственную устойчивость. В настоящее время уже существующие и постоянно возникающие лекарственноустойчивые формы ВИЧ-1 выявляются у большинства ВИЧ-1-инфицированных пациентов. Поэтому работы с псевдо-ВИЧ-1-частицами, содержащими мутантные ферменты, являются системой, позволяющей осуществлять быстрый и безопасный скрининг потенциальных лекарственных препаратов, необходимых для борьбы с лекарственно-устойчивыми формами ВИЧ-1. Наличие ферментов обратной транскриптазы ВИЧ-1, интегразы ВИЧ-1 обеспечивает возможность синтеза ДНК копии генома ВИЧ-1 и его встраивания в геном клетки-хозяина по тому же механизму, что и у инфекционного ВИЧ-1. Способ получения плазмид. Препараты экспрессирующих векторов, несущих мутантные гены обратной транскриптазы ВИЧ-1,были получены с помощью введения точечных мутаций в ген pol, кодирующий обратную транскриптазу,интегразу и протеазу ВИЧ-1 методом сайт-специфического мутагенеза, с использованием набора"GeneArt Site-Directed Mutagenesis System" (Invitrogen, США). Для наработки препаратов плазмидной ДНК использовали метод трансформации компетентных клеток E.coli. Трансформацию клеток E.coli и высев на селективную среду осуществляли согласно стандартному протоколу. Выделение чистой плазмидной ДНК в больших количествах осуществляли с использованием набора колонок и реактивов фирмы Qiagen (Plasmid extraction kit) по методике производителя. Чистота полученных препаратов плазмидной ДНК была подтверждена электрофорезом в агарозе. Концентрация исследуемого образца и степень загрязненности белковыми и низкомолекулярными органическими соединениями были определены с помощью спектрофотометра Nano Drop. Таким образом, были получены следующие плазмиды. Плазмида, содержащая мутацию гена pol в кодоне AAA в положении 499 (замена на AAT). Ген pol с этой мутацией направляет синтез фермента обратной транскриптазы с мутацией K103N. Плазмида, содержащая мутацию гена pol в кодоне GTA в положении 508 (замена GCA). Ген pol с этой мутацией направляет синтез фермента обратной транскриптазы с мутацией V106 А. Плазмида, содержащая мутацию гена pol в кодоне ТАТ в положении 733 (замена на TGT). Ген pol с этой мутацией направляет синтез фермента обратной транскриптазы с мутацией Y181C. Плазмида, содержащая мутации гена pol в кодоне AAA в положении 499 (замена на AAT) и в кодоне ТАТ в положении 733 (замена на TGT). Ген pol с этой мутацией направляет синтез фермента обратной транскриптазы с мутациями K103N и Y181C. Плазмида, содержащая мутации гена pol в кодоне GAC в положении 391 (замена на ААС) и в кодоне AAA в положении 400 (замена на AGA). Ген pol с этой мутацией направляет синтез фермента обратной транскриптазы с мутациями D67N и K70R. Плазмида, содержащая мутации гена pol в кодоне GAC в положении 391 (замена на ААС), в кодонеAAA в положении 847 (замена на CAA). Ген pol с этой мутацией направляет синтез фермента обратной транскриптазы с мутациями D67N, K70R, T215F и K219Q. Плазмида, содержащая мутации гена pol в кодоне АСС в положении 835 гена pol (замена на ТТС) и в кодоне AAA в положении 847 (замена на CAA). Ген pol с этой мутацией направляет синтез фермента обратной транскриптазы с мутациями T215F и K219Q. Плазмида, содержащая мутации гена pol в кодоне CAA в положении 2314 (замена на AAA). Ген pol с этой мутацией направляет синтез фермента интегразы с мутацией Q148K. Плазмида, содержащая мутацию гена pol в кодоне AAT в положении 2335 (замена на CAT). Ген pol с этой мутацией направляет синтез фермента интегразы с мутацией N155H. Плазмида, содержащая мутации гена pol в кодоне CAA в положении 2314 (замена на AAA) и в кодоне GGC в положении 2290 (замена на AGC). Ген pol с этой мутацией направляет синтез фермента интегразы с мутациями Q148K и G140S. Плазмида, содержащая мутации гена pol в кодоне CAA в положении 2314 (замена на AAA) и в кодоне GAA в положении 2284 (замена на AAA). Ген pol с этой мутацией направляет синтез фермента интегразы с мутацией Q148K и Е 138K. Плазмида, содержащая мутации гена pol в кодоне AAT в положении 2335 гена pol (замена на CAT) и в кодоне GAG в положении в 2146 гена pol (замена на AAG). Ген pol с этой мутацией направляет синтез фермента интегразы с мутацией N155H и Е 92K. Сборку псевдо-ВИЧ-1-частиц осуществляют в упаковывающих клетках. В качестве упаковывающих клеток, в которых происходит сборка псевдо-ВИЧ-1-частиц, используются клетки HEK-293, которые за 12-14 ч до начала трансфекции высевают на чашки Петри диаметром 100 мм в количестве 3,0-3,5106 клеток на чашку. ДНК плазмид, кодирующие вирусные структурные и регуляторные белки и ферменты, и вектор, содержащий маркерный ген (в качестве маркерного гена был использован ген усиленного зеленого флуоресцентного белка), вводят в клетки HEK-293 стандартным методомCa-фосфатной трансфекции согласно протоколу [2]. Непосредственно перед трансфекцией культуральную среду DMEM заменяют на аналогичную, содержащую 25 мкМ хлороквина. Спустя 12 ч после осуществления трансфекции среду заменяют на DMEM с 20 мМ HEPES. Первый сбор псевдо-ВИЧ-1-частиц осуществляют через 24 ч после трансфекции. Последующие три сбора псевдо-ВИЧ-1-частиц осуществляют с интервалом 10-14 ч. Собранную среду, содержащую псевдо-ВИЧ-1-частицы, фильтруют через фильтр Millipore Millex GP с диаметром пор 0,22 мкм, аликвотируют по 1 мл и хранят при -70 С. При таком хранении псевдо-ВИЧ-1-частицы сохраняют способность переносить маркерные гены в клеткимишени без потери эффективности как минимум 8-12 месяцев. Таким образом, были получены следующие всевдо-ВИЧ-1-частицы, которые включают белок оболочки G вируса везикулярного стоматита (ВВС), обратную транскриптазу ВИЧ-1, интегразу ВИЧ-1,структурные белки ВИЧ-1, формирующие белковый каркас вирусной частицы и ген зеленого флуоресцентного белка (GFP). При этом в зависимости от того, с какой мутацией гена pol были использованы плазмиды для сборки псевдо-ВИЧ-1-частиц, получили псевдо-ВИЧ-1-частицы, содержащие одну из следующих мутантных форм следующих ферментов. Мутантные формы фермента обратной транскриптазы, обладающие лекарственной устойчивостью к нуклеозидным ингибиторам фермента обратной транскриптазы ВИЧ-1:D67N, K70R (замена аспарагиновой кислоты на аспарагин в положении 67, замена лизина на аргинин в положении 70) следующей структуры:D67N, K70R, T215F, K219Q (замена аспарагиновой кислоты на аспарагин в положении 67, замена лизина на аргинин в положении 70, замена треонина на фенилаланин в положении 215, замена лизина на глутамин в положении 219) следующей структуры:T215F, K219Q (замена треонина на фенилаланин в положении 215, замена лизина на глутамин в положении 219) следующей структуры: Мутантные формы фермента обратной транскриптазы, обладающие лекарственной устойчивостью к ненуклеозидным ингибиторам фермента обратной транскриптазы ВИЧ-1:K103N (замена лизина на аспарагин в положении 103) следующей структуры:V106A (замена валина на аланин в положении 106) следующей структуры:Y181C (замена тирозина на цистеин в положении 181) следующей структуры:K103N, Y181C (замена лизина на аспарагин в положении 103, замена тирозина на цистеин в положении 181) следующей структуры: Мутантные формы фермента интегразы, обладающие лекарственной устойчивостью к ингибиторам фермента интегразы ВИЧ-1:Q148K (замена глутамина на лизин в положении 148) следующей структуры:N155H (замена аспарагина на гистидин в положении 155) следующей структуры:Q148K, G140S (замена глутамина на лизин в положении 148, замена глицина на серин в положении 140) следующей структуры:Q148K, Е 138 К (замена глутамина на лизин в положении 148, замена глутаминовой кислоты на лизин в положении 138) следующей структурыN155H, Е 92K (замена в 155 положении аспарагина на гистидин, замена глутаминовой кислоты на лизин в положении 92) следующей структуры: Полученные псевдо-ВИЧ-1-частицы были применены для скрининга ингибиторов/блокаторов репликации ВИЧ-1. Для скрининга ингибиторов/блокаторов репликации ВИЧ-1 был получен набор, включающий панель описанных выше псевдо-ВИЧ-1-частиц, клетки линий HEK-293 (клетки эмбриональной почки человека), SC-1 (эмбриональные фибробласты мыши), Jurkat (T-лифобластный лейкоз человека). CEM-SS(Т-лимфобластный лейкоз человека) и Kasumi-1 (острый миелоидный лейкоз человека) и среду DMEM с добавлением 10% эмбриональной сыворотки крупного рогатого скота (Fetal calf Serum, FCS), 4 мМL-глутамина, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина для клеток линий HEK-293 и SC-1,среду RPMI-1640 с добавлением 20% FCS, 4 мМ L-глутамина, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина для клеток линий Jurkat, CEM-SS и Kasumi-1; стандартный фосфатный буфер PBS. Скрининг потенциальных ингибиторов/блокаторов репликации ВИЧ-1 осуществляют следующим образом. Предварительно чувствительные клетки высевают на 24-луночные культуральные планшеты в количестве 4104. Через 24 ч к клеткам добавляют раствор анализируемых соединений в воде и через 2-8 ч(в зависимости от ингибитора и его скорости проникновения в клетку) трансдуцируют ПВЧ. Для повышения эффективности трансдукции культуральные планшеты центрифугируют в течение 1 ч при 1000g,20C. Относительный уровень трансдукции определяют методом проточной цитофлуориметрии на приборе Epics 4XL Beckman Coulter (США) через 48 ч после трансдукции. Краткое описание графических материалов Фиг. 1. Последовательность ДНК гена pol ВИЧ-1, содержащая мутацию в кодоне AAA в положении 499, соответствующая мутантной форме обратной транскриптазы с мутацией K103N. Фиг. 2. Последовательность ДНК гена pol ВИЧ-1, содержащая мутацию в кодоне GTA в положении 508 (замена GCA), соответствующая мутантной форме обратной транскриптазы с мутацией V106 А. Фиг. 3. Последовательность ДНК гена pol ВИЧ-1, содержащая мутацию в кодоне ТАТ в положении 733 (замена на TGT), соответствующая мутантной форме обратной транскриптазы с мутацией Y181C. Фиг. 4. Последовательность ДНК гена pol ВИЧ-1, содержащая мутации в кодоне AAA в положении 499 (замена на AAT) и в кодоне ТАТ в положении 733 (замена на TGT), соответствующая мутантной форме обратной транскриптазы с мутациями K103N u Y181C. Фиг. 5. Последовательность ДНК гена pol ВИЧ-1, содержащая мутации в кодоне GAC в положении 391 (замена на ААС) и в кодоне AAA в положении 400 (замена на AGA), соответствующая мутантной форме обратной транскриптазы с мутациями D67N и K70R. Фиг. 6. Последовательность ДНК гена pol ВИЧ-1, содержащая мутации в кодоне GAC в положении 391 (замена на ААС), в кодоне AAA в положении 400 (замена на AGA), в кодоне АСС в положении 835(замена на ТТС) и в кодоне AAA в положении 847 (замена на CAA), соответствующая мутантной форме обратной транскриптазы с мутациями D67N, K70R, T215F u K219Q. Фиг. 7. Последовательность ДНК гена pol ВИЧ-1, содержащая мутации в кодоне ACC в положении 835 гена pol (замена на ТТС) и в кодоне AAA в положении 847 (замена на CAA), соответствующая мутантной форме обратной транскриптазы с мутациями T215Fu K219Q. Фиг. 8. Последовательность ДНК гена pol ВИЧ-1, содержащая мутацию в кодоне CAA в положении 2314 (замена на AAA), соответствующая мутантной форме интегразы с мутацией Q148K. Фиг. 9. Последовательность ДНК гена pol ВИЧ-1, содержащая мутацию в кодоне AAT в положении 2335 (замена на CAT), соответствующая мутантной форме интегразы с мутацией N155H. Фиг. 10. Последовательность ДНК гена pol ВИЧ-1, содержащая мутации в кодоне CAA в положении 2314 (замена на AAA) и в кодоне GGC в положении 2290 (замена на AGC), соответствующая мутантной форме интегразы с мутациями Q148K и G140S. Фиг. 11. Последовательность ДНК гена pol ВИЧ-1, содержащая мутации в кодоне CAA в положении 2314 (замена на AAA) и в кодоне GAA в положении 2284 (замена на AAA), соответствующая мутантной форме интегразы с мутацией Q148K u E138K. Фиг. 12. Последовательность ДНК гена pol ВИЧ-1, содержащая мутации в кодоне AAT в положении 2335 гена pol (замена на CAT) и в кодоне GAG в положении в 2146 гена pol (замена на AAG), соответствующая мутантной форме интегразы с мутацией N155H u E92K. Фиг. 13. График, на котором показано действие невирапина на эффективность трансдукции клеток линии Jurkat под действием ПВЧ, содержащих обратную транскриптазу дикого типа или мутантные формы, лекарственно-устойчивые к ненуклеозидным ингибиторам ОТ ВИЧ-1. Фиг. 14. График, на котором показано действие невирапина на эффективность трансдукции клеток линии Jurkat под действием ПВЧ, содержащих обратную транскриптазу дикого типа или мутантные формы, лекарственно-устойчивые к нуклеозидным и нуклеотидным ингибиторам ОТ ВИЧ-1. Фиг. 15. График, на котором показано действие эфавиренца на эффективность трансдукции клеток линии Jurkat под действием ПВЧ, содержащих обратную транскриптазу дикого типа или мутантные формы, лекарственно-устойчивые к ненуклеозидным ингибиторам ОТ ВИЧ-1. Фиг. 16. График, на котором показано действие АЗТ на эффективность трансдукции клеток линииJurkat под действием ПВЧ, содержащих обратную транскриптазу дикого типа или ее мутантные формы,лекарственно-устойчивые к нуклеозидным и нуклеотидным ингибиторам ОТ ВИЧ-1. Фиг. 17. График, на котором показано действие ЗТС на эффективность трансдукции клеток линииJurkat под действием ПВЧ, содержащих обратную транскриптазу дикого типа или ее мутантные формы,лекарственно-устойчивые к нуклеозидным и нуклеотидным ингибиторам ОТ ВИЧ-1. Фиг. 18. График, на котором показано действие ралтегравира на эффективность трансдукции клеток линии Jurkat под действием ПВЧ, содержащих интегразу дикого типа или ее мутантные формы, лекарственно-устойчивые к ингибиторам интегразы ВИЧ-1. Приведенные далее примеры иллюстрируют данное изобретение без его ограничения только этими примерами. Пример 1. Оценка антиретровирусной активности невирапина. Наиболее широко используемым ненуклеозидным ингибитором ОТ ВИЧ-1 является невирапин. Утвержденное в качестве лекарственного средства в 1996 г. это анти-ВИЧ-1 соединение способно подавлять развитие ВИЧ-1-инфекции в клетках, зараженных природным вирусом, в концентрации 10-8-10-7 М. Невирапин был использован против ПВЧ, содержащих ОТ дикого типа или мутантные формы ОТ,несущие как мутации, сообщающие лекарственную устойчивость к ненуклеозидным ингибиторам ОТ ВИЧ-1, к которым относится невирапин (фиг. 13), так и мутации, сообщающие лекарственную устойчивость к нуклеозидным и нуклеотидным ингибиторам ОТ ВИЧ-1, для проверки специфичности мутаций ОТ ВИЧ-1 (фиг. 14). Как показано на фиг. 13, невирапин проявляет анти-ВИЧ-1 активность только в отношении контрольных ПВЧ, содержащих обратную транскриптазу дикого типа, но совершенно не эффективен против ПВЧ, содержащих ОТ с мутациями, сообщающими лекарственную устойчивость к ненуклеозидным ингибиторам ОТ ВИЧ-1. Как показано на фиг. 14, невирапин проявляет одинаковую анти-ВИЧ-1 активность в отношении как контрольных ПВЧ, содержащих обратную транскриптазу дикого типа, так и ПВЧ, содержащих ОТ с мутациями, сообщающими лекарственную устойчивость к нуклеозидным и нуклеотидным ингибиторам ОТ ВИЧ-1. Проведенная серия экспериментов показывает, что невирапин эффективно подавляет перенос гена зеленого флуоресцентного белка в клетки-мишени, в случае трансдукции клеток ПВЧ, в состав которых входит ОТ дикого типа. ПВЧ, содержащие ОТ, несущую мутации, сообщающие лекарственную устойчивость к ненуклеозидным ингибиторам ОТ ВИЧ-1, были устойчивы к действию ненуклеозидного ингибитора ОТ ВИЧ-1 невирапина. В то же время, ПВЧ, содержащие ОТ, несущую мутации, сообщающие лекарственную устойчивость к нуклеозидным и нуклеотидным ингибиторам ОТ ВИЧ-1, не обладали лекарственной устойчивостью к ненуклеозидному ингибитору ОТ ВИЧ-1 невирапину. Пример 2. Оценка антиретровирусной активности эфавиренца. Эфавиренц также относится к ненуклеозидным ингибиторам ОТ ВИЧ-1, это более новый препарат,чем невирапин. Эфавиренц был использован против ПВЧ, содержащих ОТ дикого типа или мутантные формы ОТ, несущие мутации, сообщающие лекарственную устойчивость к ненуклеозидным ингибиторам ОТ ВИЧ-1 (фиг. 15). Как показано на фиг. 15, эфавиренц проявляет анти-ВИЧ-1 активность как в отношении ПВЧ, содержащих обратную транскриптазу дикого типа, так и в отношении ПВЧ, содержащих ОТ с мутациями,сообщающими лекарственную устойчивость к ненуклеозидным ингибиторам ОТ ВИЧ-1. Однако, в случае ОТ дикого типа, эфавиренц эффективен в более низких концентрациях. Это соответствует известным данным, препарат в клинических условиях демонстрирует устойчивую эффективность и против мутантных форм ВИЧ-1. Пример 3. Оценка антиретровирусной активности азидотимидина. Первое и наиболее известное анти-ВИЧ-1-соединение - 3'-азидо-3'-дезокситимидин (Зидовудин,АЗТ), в наномолярных концентрациях способно ингибировать репликацию вируса дикого типа. В настоящее время азидотимидин используется редко, поскольку он неэффективен против лекарственноустойчивых форм ВИЧ-1. Азидотимидин был использован против ПВЧ, содержащих мутантные формы ОТ, несущие мутации, сообщающие лекарственную устойчивость к нуклеозидным и нуклеотидным ингибиторам ОТ ВИЧ 1, к которым относится азидотимидин (фиг. 16). Как показано на фиг. 16, азидотимидин проявляет анти-ВИЧ-1 активность только в отношении ПВЧ, содержащих обратную транскриптазу дикого типа, но малоэффективен против ПВЧ, содержащих ОТ с мутациями, сообщающими лекарственную устойчивость к ненуклеозидным ингибиторам ОТ ВИЧ-1. Сравнение противовирусной активности АЗТ в отношении ПВЧ с мутантными формами ОТ показало, что препарат гораздо слабее влиял на эффективность трансдукции мутантными частицами,причем падение ингибирующего эффекта коррелировало с увеличением числа мутаций. Пример 4. Оценка антиретровирусной активности ЗТС. 2',3'-Дидезокси-3'-тиоцитидин (ЗТС), как и АЗТ, представляет собой нуклеозидный ингибитор обратной транскриптазы ВИЧ-1. ЗТС был использован при испытаниях ПВЧ, содержащих мутантные формы ОТ, несущие мутации,сообщающие лекарственную устойчивость к нуклеозидным и нуклеотидным ингибиторам ОТ ВИЧ-1(фиг. 17). Как показано на фиг. 17, ЗТС проявляет анти-ВИЧ-1 активность только в отношении ПВЧ, содержащих обратную транскриптазу дикого типа, и значительно менее эффективен против ПВЧ, содержащих ОТ с мутациями, сообщающими лекарственную устойчивость к ненуклеозидным ингибиторам ОТ ВИЧ-1. Пример 5. Оценка антиретровирусной активности ралтегравира. Ралтегравир - первый из ингибиторов интегразы, ставший лекарственным препаратом, он был разрешен к применению в клинической практике с октября 2007 г. Несмотря на его недолгое использование в качестве лекарственного препарата, к настоящему времени уже распространены лекарственноустойчивые формы ВИЧ-1, против которых ралтегравир не эффективен. Ралтегравир был использован при испытаниях ПВЧ, содержащих мутантные формы интегразы, несущие мутации, сообщающие лекарственную устойчивость к ингибиторам интегразы ВИЧ-1 (фиг. 18). Как показано на фиг. 18, ралтегравир проявляет анти-ВИЧ-1 активность только в отношении контрольных ПВЧ, содержащих интегразу дикого типа, но малоэффективен или совершенно не эффективен против ПВЧ, содержащих интегразу с мутациями, сообщающими лекарственную устойчивость к ингибиторам интегразы ВИЧ-1. В работе использовали культуральную среду DMEM с добавлением 10% эмбриональной сыворотки крупного рогатого скота (Fetal Calf Serum, FCS), 4 мМ L-глутамина, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина; культуральную среду RPMI-1640 с добавлением 20% FCS, 4 мМ L-глутамина, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина; 1 М буфер HEPES; стандартный раствор трипсин-ЭДТА, содержащий 0,12% трипсина и 0,02% ЭДТА; 25 мМ хлороквин; набор для проведения Ca-фосфатной трансфекции Promega ProFection; фосфатный буфер PBS; диметилсульфоксид (DMSO); растворы ингибиторов в воде или в DMSO. Список литературы 1. Luigi Naldini, Ulrike Blomer, Philippe Gallay, Daniel Ory.Richard Mulligan, Fred H. Gage, Inder M.Lentiviral Vector. SCIENCE. Vol. 272, 263-267. 2. www.LentiGO-Vectors.de. 3. M.M. Прокофьева, П.В. Спирин, Д.В. Январев, А.В. Иванов, М.С. Новиков, О.А. Степанов,М.Б. Готтих, С.Н. Кочетков, В. Fehse, С. Stocking, В.С. Прасолов. 2011. Скрининг потенциальных ингибиторов/блокаторов репликации ВИЧ-1 с помощью безопасной лентивирусной системы in vitro. Actanaturae. Т. 3,4(11), 61-71 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Псевдо-ВИЧ-1-частица, включающая белок оболочки G вируса везикулярного стоматита (ВВС),фермент обратной транскриптазы ВИЧ-1, фермент интегразы ВИЧ-1, структурные белки ВИЧ-1, формирующие белковый каркас вирусной частицы и ген зеленого флуоресцентного белка (GFP), где фермент обратной транскриптазы ВИЧ-1 и фермент интегразы ВИЧ-1 представляют собой мутантную форму. 2. Псевдо-ВИЧ-1-частица по п.1, в которой мутантная форма фермента обратной транскриптазы обладает лекарственной устойчивостью к нуклеозидным ингибиторам фермента обратной транскриптазы ВИЧ-1 и имеет одну из следующих аминокислотных последовательностей:D67N, K70R (замена аспарагиновой кислоты на аспарагин в положении 67, замена лизина на аргинин в положении 70) следующей структуры:D67N, K70R, T215F, K219Q (замена аспарагиновой кислоты на аспарагин в положении 67, замена лизина на аргинин в положении 70, замена треонина на фенилаланин в положении 215, замена лизина на глутамин в положении 219) следующей структуры:T215F, K219Q (замена треонина на фенилаланин в положении 215, замена лизина на глутамин в положении 219) следующей структуры: 3. Псевдо-ВИЧ-1-частица по п.1, в которой мутантная форма фермента обратной транскриптазы обладает лекарственной устойчивостью к ненуклеозидным ингибиторам фермента обратной транскриптазы ВИЧ-1 и имеет одну из следующих аминокислотных последовательностей:K103N (замена лизина на аспарагин в положении 103) следующей структуры:V106A (замена валина на аланин в положении 106) следующей структуры:Y181C (замена тирозина на цистеин в положении 181) следующей структуры:K103N, Y181C (замена лизина на аспарагин в положении 103, замена тирозина на цистеин в положении 181) следующей структуры: 4. Псевдо-ВИЧ-1-частица по п.1, в которой мутантная форма фермента интегразы обладает лекарственной устойчивостью к ингибиторам фермента интегразы ВИЧ-1 и имеет одну из следующих аминокислотных последовательностей:Q148K (замена глутамина на лизин в положении 148) следующей структуры:N155H (замена аспарагина на гистидин в положении 155) следующей структуры:Q148K, G140S (замена глутамина на лизин в положении 148, замена глицина на серин в положении 140) следующей структуры:Q148K, Е 138K (замена глутамина на лизин в положении 148, замена глутаминовой кислоты на лизин в положении 138) следующей структуры:N155H, Е 92K (замена аспарагина на гистидин в положении 155, замена глутаминовой кислоты на лизин в положении 92) следующей структуры: 5. Плазмида, направляющая в упаковывающих клетках сборку псевдо-ВИЧ-1-частицы по пп.1-4, в состав которой входят гены gag ВИЧ-1 и pol ВИЧ-1, содержащая один из вариантов мутации гена pol,придающих ВИЧ-1 лекарственную устойчивость. 6. Плазмида по п.5, содержащая мутацию гена pol в кодоне AAA в положении 499, имеющая нуклеотидную последовательность, представленную на фиг. 1 (SEQ ID NO: 13). 7. Плазмида по п.5, содержащая мутацию гена pol в кодоне GTA в положении 508, имеющая нуклеотидную последовательность, представленную на фиг. 2 (SEQ ID NO: 14). 8. Плазмида по п.5, содержащая мутацию гена pol в кодоне ТАТ в положении 733, имеющая нуклеотидную последовательность, представленную на фиг. 3 (SEQ ID NO: 15). 9. Плазмида по п.5, содержащая мутации гена pol в кодоне AAA в положении 499 и в кодоне ТАТ в положении 733, имеющая нуклеотидную последовательность, представленную на фиг. 4 (SEQ ID NO: 16). 10. Плазмида по п.5, содержащая мутации гена pol в кодоне GAC в положении 391 и в кодоне AAA в положении 400, имеющая нуклеотидную последовательность, представленную на фиг. 5(SEQ ID NO: 17). 11. Плазмида по п.5, содержащая мутации гена pol в кодоне GAC в положении 391, в кодоне AAA в положении 400, в кодоне АСС в положении 835 и в кодоне AAA в положении 847, имеющая нуклеотидную последовательность, представленную на фиг. 6 (SEQ ID NO: 18). 12. Плазмида по п.5, содержащая мутации гена pol в кодоне АСС в положении 835 и в кодоне AAA в положении 847, имеющая нуклеотидную последовательность, представленную на фиг. 7(SEQ ID NO: 19). 13. Плазмида по п.5, содержащая мутацию гена pol в кодоне CAA в положении 2314, имеющая нуклеотидную последовательность, представленную на фиг. 8 (SEQ ID NO: 20). 14. Плазмида по п.5, содержащая мутацию гена pol в кодоне AAT в положении 2335, имеющая нуклеотидную последовательность, представленную на фиг. 9 (SEQ ID NO: 21). 15. Плазмида по п.5, содержащая мутации гена pol в кодоне CAA в положении 2314 и в кодоне(SEQ ID NO: 22). 16. Плазмида по п.5, содержащая мутации гена pol в кодоне CAA в положении 2314 и в кодоне(SEQ ID NO: 23). 17. Плазмида по п.5, содержащая мутации гена pol в кодоне AAT в положении 2335 и в кодоне(SEQ ID NO: 24). 18. Способ сборки псевдо-ВИЧ-1-частицы по пп.1-4, включающий введение лентивирусного вектора, содержащего маркерный ген зеленого флуоресцентного белка (GFP), вместе с плазмидой по пп.5-16,направляющей синтез белков, необходимых для формирования псевдо-ВИЧ-1-частиц, плазмидой, содержащей ген env, направляющий синтез белка оболочки G вируса везикулярного стоматита, и плазмидой, содержащей ген rev, направляющий синтез регуляторного белка Rev в клетки HEK-293 методом Caфосфатной трансфекции, и через 24 ч после трансфекции инфекционные псевдо-ВИЧ-1-частицы начинают собирать с интервалом 12 ч. 19. Применение псевдо-ВИЧ-1-частицы по пп.1-7 для скрининга ингибиторов/блокаторов репликации ВИЧ-1. 20. Способ скрининга ингибиторов/блокаторов репликации ВИЧ-1, включающий добавление исследуемого ингибитора/блокатора репликации ВИЧ-1 к чувствительным клеткам, затем добавление псевдо-ВИЧ-1-частиц по пп.1-7 к чувствительным клеткам, выявление флуоресценции чувствительных клеток и определение по количеству флуоресцирующих клеток в трансдуцированной популяции эффективности воздействия ингибитора/блокатора репликации ВИЧ-1 на псевдо-ВИЧ-1-частицы. 21. Способ скрининга по п.19, в котором чувствительные клетки представляют собой клетки линийHEK-293, SC-1, Jurkat, CEM-SS и Kasumi-1. 22. Набор для скрининга потенциальных ингибиторов/блокаторов репликации ВИЧ-1, включающий панель псевдо-ВИЧ-1-частиц по пп.1-7, псевдо-ВИЧ-1-частицы, в которых интеграза и обратная транскриптаза ВИЧ-1 представляют собой форму дикого типа без лекарственной устойчивости, клетки линийHEK-293, SC-1, Jurkat, CEM-SS и Kasumi-1 и среду DMEM с добавлением 10% эмбриональной сыворотки крупного рогатого скота, 4 мМ L-глутамина, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина для клеток линий HEK-293 и SC-1, среду RPMI-1640 с добавлением 20% FCS, 4 мМ L-глутамина, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина для клеток линий Jurkat, CEM-SS и Kasumi-1; стандартный фосфатный буфер PBS.
МПК / Метки
МПК: C12Q 1/00, C12N 7/01, C12N 15/49
Метки: псевдо-вич-1-частицы, репликации, способ, набор, вич-1, способа, скрининга, осуществления
Код ссылки
<a href="https://eas.patents.su/25-24077-sposob-skrininga-ingibitorov-blokatorov-replikacii-vich-1-psevdo-vich-1-chasticy-i-nabor-dlya-osushhestvleniya-sposoba.html" rel="bookmark" title="База патентов Евразийского Союза">Способ скрининга ингибиторов/блокаторов репликации вич-1, псевдо-вич-1-частицы и набор для осуществления способа</a>
Предыдущий патент: Многокомпонентный фильтр для курительного изделия
Следующий патент: Промышленная экстракция урана карбонатом аммония с применением мембранного разделения
Случайный патент: Вентильная головка сантехнической арматуры












