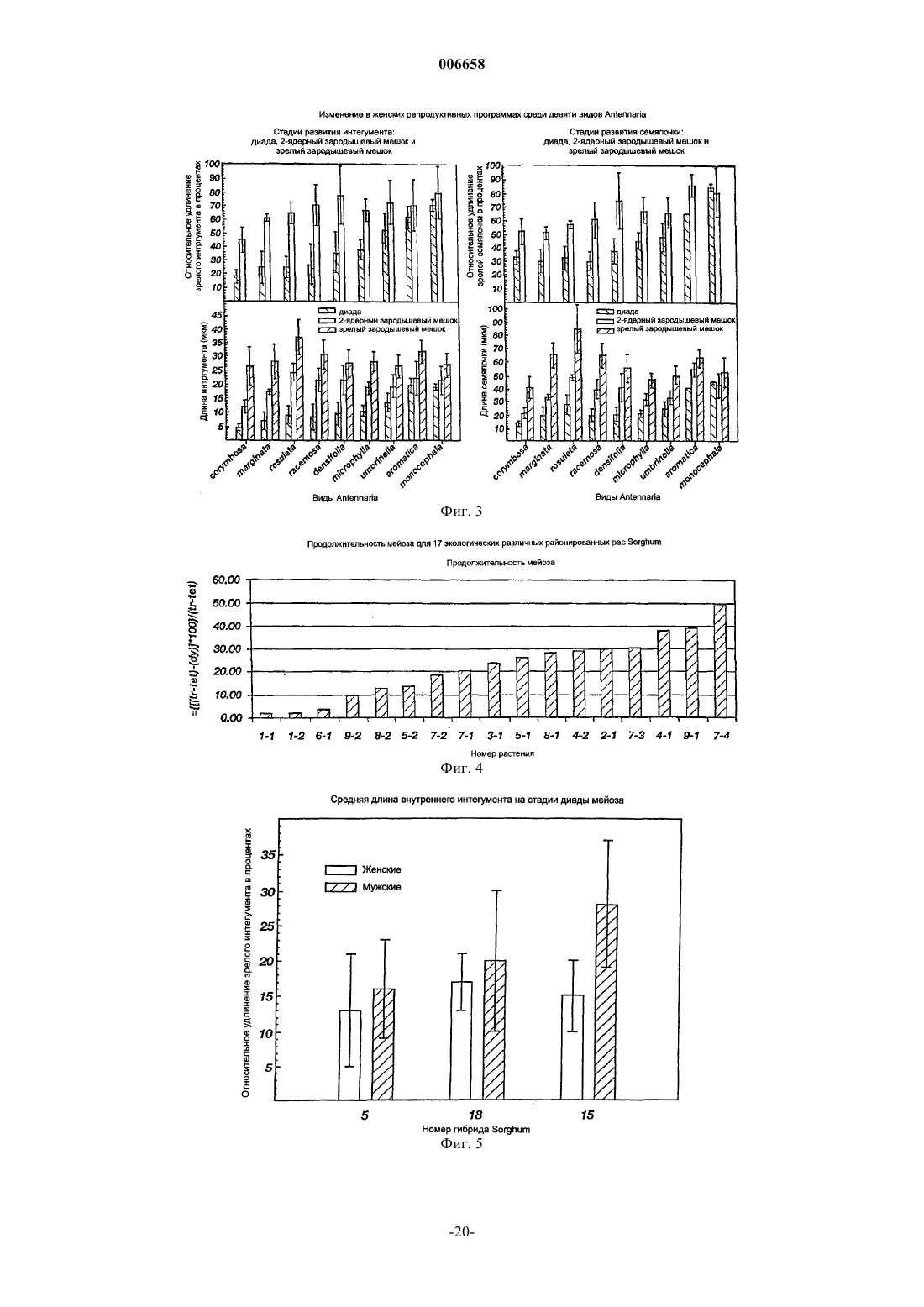
Способ получения апомиктичного растения
Формула / Реферат
1. Способ получения апомиктичного растения, проявляющего повышенную генетическую стабильность апомиксиса, от покрытосеменного апомиктичного родительского растения, которое проявляет генетическую нестабильность апомиксиса, предусматривающий:
(a) измерение степени генетической нестабильности апомиксиса родительского растения;
(b) если родительское растение проявляет генетическую нестабильность апомиксиса, получение одного или нескольких растений-потомков от родительского растения, где каждое из растений-потомков содержит двойной хромосомный набор родительского растения;
(c) измерение степени генетической нестабильности апомиксиса одного или нескольких растений-потомков;
(d) сравнение степени генетической нестабильности апомиксиса одного или нескольких растений-потомков со степенью генетической нестабильности апомиксиса родительского растения; и
(e) селекцию по меньшей мере одного из одного или нескольких растений-потомков, проявляющих повышенную генетическую стабильность апомиксиса по сравнению с родительским растением.
2. Способ по п.1, где одно или несколько растений-потомков получают обработкой родительского растения ингибитором веретена.
3. Способ по п.2, где ингибитор веретена представляет собой колхицин.
4. Способ по п.1, где одно или несколько растений-потомков получают культивированием родительского растения или его части в тканевой культуре.
5. Способ по п.1, где одно или несколько растений-потомков получают:
(a) самоопылением родительского растения или скрещиванием родительского растения с другим растением того же вида, рода или семейства и получением первого потомства; и
(b) подсчет хромосом в первом потомстве и выбор амфиплоида или частичного амфиплоида, имеющего все хромосомы от родительского растения в случае самоопыления такого родительского растения, или все хромосомы от родительского растения и один или несколько наборов хромосом от другого растения того же вида, рода или семейства, или все хромосомы от другого растения того же вида, рода или семейства и один или несколько наборов хромосом от родительского растения в случае скрещивания родительского растения с другим растением того же вида, рода или семейства.
6. Способ по п.5, дополнительно предусматривающий обратное скрещивание частичного амфиплоида с родительским растением или с другим растением того же самого вида, рода или семейства и получение от них второго потомства и селекцию амфиплоида, имеющего равный (четный) уровень плоидности.
7. Способ по п.5, где частичный амфиплоид является эуплоидом или анэуплоидом.
8. Способ по п.5 или 6, где амфиплоид является эуплоидом или анэуплоидом.
9. Способ по любому из пп.1-8, дополнительно предусматривающий повышение фертильности выбранных растений-потомков путем самоопыления или гибридизации с другим растением, получение от них семян, высевание указанных семян и селекцию полученных половым путем апомиктичных гибридных растений, которые обнаруживают повышенную частоту не сниженной фертильности яйцеклеток или партеногенез.
10. Способ получения апомиктичного сегментного аллополиплоидного растения, проявляющего повышенную генетическую стабильность апомиксиса, от покрытосеменного межсортового гибридного растения, которое проявляет генетическую нестабильность апомиксиса, предусматривающий:
(a) измерение степени генетической нестабильности апомиксиса межсортового гибридного растения;
(b) если межсортовое гибридное растение проявляет генетическую нестабильность апомиксиса, получение одного или нескольких растений-потомков от межсортового гибридного растения, где каждое из растений-потомков содержит двойной хромосомный набор межсортового гибридного растения, приводя к появлению одного или нескольких апомиктичных сегментных аллополиплоидных растений;
(c) измерение степени генетической нестабильности апомиксиса одного или нескольких апомиктичных сегментных аллополиплоидных растений; и
(d) сравнение степени генетической нестабильности апомиксиса одного или нескольких апомиктичных сегментных аллополиплоидных растений со степенью генетической нестабильности апомиксиса межсортового гибридного растения для проверки того, увеличена ли генетическая стабильность апомиксиса одного или нескольких апомиктичных сегментных аллополиплоидных растений по сравнению с межсортовым гибридным растением.
11. Способ по п.10, дополнительно предусматривающий повышение фертильности одного или нескольких апомиктичных сегментных аллополиплоидных растений путем их самоопыления или гибридизации с другим растением, получение от них семян, высевание указанных семян и селекцию полученных половым путем апомиктичных сегментных аллополиплоидных растений, которые обнаруживают повышенную частоту не сниженной фертильности яйцеклеток или партеногенез.
12. Способ получения апомиктичного аллополиплоидного растения, проявляющего повышенную генетическую стабильность апомиксиса, от покрытосеменного межвидового гибридного растения, проявляющего генетическую нестабильность апомиксиса, предусматривающий:
(a) измерение степени генетической нестабильности апомиксиса межвидового гибридного растения и
(b) получение одного или нескольких апомиктичных аллополиплоидных растений-потомков от указанного межвидового гибридного растения и селекцию апомиктичного аллополиплоидного растения-потомка, проявляющего повышенную генетическую стабильность апомиксиса.
13. Способ по п.12, дополнительно предусматривающий повышение фертильности выбранного апомиктичного аллополиплоидного растения-потомка путем самоопыления или гибридизации с другим растением, получение семян, высевание указанных семян и селекцию полученных половым путем апомиктичных аллополиплоидных растений, которые обнаруживают повышенную частоту не сниженной фертильности яйцеклеток или партеногенез.
14. Способ получения апомиктичного растения, проявляющего повышенную генетическую стабильность апомиксиса, от покрытосеменного, внутривидового, межсортового или межвидового гибридного растения, проявляющего генетическую нестабильность апомиксиса, предусматривающий:
(a) измерение степени генетической нестабильности апомиксиса внутривидового, межсортового или межвидового гибридного растения и
(b) получение апомиктичных аутополиплоидных, сегментных аллополиплоидных или аллополиплоидных растений-потомков внутривидового, межсортового или межвидового гибридного растения и селекцию апомиктичного растения, проявляющего повышенную генетическую стабильность апомиксиса.
15. Способ по п.14, дополнительно предусматривающий повышение фертильности отобранного апомиктичного растения путем самоопыления или гибридизации с другим растением, получение семян, высевание указанных семян и селекцию полученных половым путем апомиктичных растений-потомков, которые обнаруживают повышенную частоту не сниженной фертильности яйцеклеток или партеногенез.
16. Способ генетической стабилизации апомиксиса покрытосеменного, апомиктичного, внутривидового, межсортового или межвидового гибридного растения, проявляющего генетическую нестабильность апомиксиса, предусматривающий измерение степени генетической нестабильности апомиксиса внутривидового, межсортового или межвидового гибридного растения и получение растения-потомка от указанного апомиктичного внутривидового, межсортового или характеризуется нечетным увеличением плоидности, причем женский мейоз обычно прерывается, приводя к практически 100% образованию апомиктичных семян.
17. Способ по п.16, дополнительно предусматривающий повышение фертильности растения-потомка путем самоопыления или гибридизации с другим растением, получение от них семян, высевание семян и селекцию полученных половым путем апомиктичных растений, которые обнаруживают повышенную частоту не сниженной фертильности яйцеклеток или партеногенез.
18. Способ генетической стабилизации апомиксиса покрытосеменного, апомиктичного, внутривидового, межсортового или межвидового гибридного растения, проявляющего генетическую нестабильность апомиксиса, предусматривающий измерение степени генетической нестабильности апомиксиса внутривидового, межсортовюую или межвидового гибридного растения и скрещивание этого внутривидового, межсортового или межвидового гибридного растения с мейотическим мутантным растением того же самого вида, рода или семейства и селекцию потомства, где женский мейоз обычно прерывается, приводя к практически 100% образованию апомиктичных семян.
19. Способ по п.18, дополнительно предусматривающий повышение фертильности отобранного потомства путем самоопыления или гибридизации с другим растением, получение от них семян, высевание указанных семян и селекцию полученных половым путем апомиктичных растений-потомков, которые обнаруживают повышенную частоту не сниженной фертильности яйцеклеток или партеногенез.
20. Способ получения апомиктичного растения, проявляющего повышенную генетическую стабильность апомиксиса от покрытосеменного апомиктичного родительского растения, которое проявляет генетическую нестабильность апомиксиса, предусматривающий:
(a) измерение степени генетической нестабильности апомиксиса родительского растения;
(b) получение растения-потомка от родительского растения путем удвоения числа хромосом указанного родительского растения или введения хромосомной аберрации, в котором рекомбинация подавляется, так что тормозится сегрегация аллелей во время мейоза; и
(c) измерение степени генетической нестабильности апомиксиса растения-потомка для проверки того, что такое растение проявляет повышенную генетическую стабильность апомиксиса по сравнению с родительским растением.
21. Способ по п.20, где указанная хромосомная аберрация предусматривает транслокацию.
22. Способ по п.20, где указанная хромосомная аберрация предусматривает инверсию.
23. Способ по любому из пп.18-22, дополнительно предусматривающий повышение фертильности растения-потомка путем самоопыления или гибридизации с другим растением, получение от них семян, высевание указанных семян и селекцию полученных половым путем апомиктичных растений-потомков, которые обнаруживают повышенную частоту не сниженной фертильности яйцеклеток или партеногенез.
Текст
006658 Предпосылки изобретения Настоящее изобретение относится к закреплению гибридной силы (гетерозиса) и других признаков посредством апомиксиса (образования семян, не связанного с половым процессом) у цветковых растений(покрытосемянных). Более конкретно, изобретение предоставляет способы стабилизации апомиксиса у встречающихся в природе или искусственных факультативных апомиктов (растений, способных к половому и апомиктичному размножению) так, что потомство, полученное половым путем, которое иногда производится факультативно из таких апомиктичных растений, стремится стать апомиктичным, как материнское растение, несмотря на то, что иначе генетически рекомбинировано, вместо того чтобы быть половыми ревертантами. Настоящее изобретение также предоставляет способы контроля апомиксиса у встречающихся в природе или искусственных апомиктов таким образом, что такие апомикты проявляют облигатный апомиксис (неспособность к образованию семян половым путем), облигатный апомиксис,кроме индуцированных быть факультативно апомиктичными, или факультативный апомиксис, кроме индуцированных быть облигатно апомиктичными. Данное изобретение использует генетические, цитогенетические и молекулярные модификации чтобы предотвращать генетическую рекомбинацию между локусами опасную для экспрессии апомиксиса (стабилизация апомиксиса), и контролирует процент семян, которые получают апомиктически, посредством контролирования частоты семян, полученных половым путем, у встречающихся в природе или искусственных факультативных апомиктов (контроль апомиксиса). Типы апомиксиса, относящиеся к настоящей заявке на патент, вызывают образование семян бесполым путем. Таким образом, семена апомиктичных растений содержат зародыши, которые являются генетическими клонами материнского растения. Такие формы апомиксиса включают адвентициальную (добавочную) эмбрионию и гаметофитный апомиксис (называемый ниже как апомиксис), который обычно разделяют на апоспорию и диплоспорию. S.E. AskerL. Jerling, Apomixis in Plants (CRC Press 1992) (далее, "AskerJerling"). Связанные с развитием сигналы, ответственные за апомиксис, предшествуют мегаспорогенезу при индуцировании образования скороспелого зародышевого мешка или из материнской клетки мегаспоры(ММС) (диплоспория), или из соматических клеток нуцеллуса (апоспория). Фертилизация является также предшествующей при оплодотворении, которое часто случается до того, как рыльце становится восприимчивым к пыльце. Колебание в интенсивности сигналов ответственных за апомиксис учитывает факультативную экспрессию полового размножения среди апомиктичных растений. Следовательно, у большинства апомиктов определенный процент семян, произведенных отдельным апомиктичным растением, будет образовываться половым путем и этот процент часто находится под влиянием факторов внешней среды. AskerJerling. При диплоспории по типу Antennaria, сигналы образования скороспелого зародышевого мешка происходят очень рано, полностью предотвращая мейоз. У диплоспории по типуTaraxacum, сигналы образования зародышевого мешка менее ранние и влияют на ММС после того как начался мейоз. При апоспории по типу Hieracium, клетки нуцеллуса затронуты ранними и эктопическими(неспецифическими) сигналами, индуцирующими зародышевый мешок, и, затронутые соматические клетки нуцеллуса, подвергаются трем циклам эндомитоза, для образования 8-ядерного зародышевого мешка. При апоспории по типу Panicum происходит только два цикла эндомитоза, приводящих к образованию зрелых 4-ядерных зародышевых мешков. При адвентиционной эмбрионии зародыши образуются из клеток, а не из яйцеклетки, включая клетки нуцеллуса, интегумента (интегументов), синергидов и антиподные клетки. AskerJerling. Технологии, которые индуцируют, стабилизируют и контролируют экспрессию апомиксиса у культур, обладают потенциалом революционизирующей селекции растений и становятся существенными для конкурирующего всемирного сельскохозяйственного бизнеса. Такими методами селекционеры будут клонировать весьма желательные растения (демонстрирующие гетерозис, трансгенные черты и тому подобное) через собственное растительное семя - поколение за поколением. Увеличение урожая, происходящее в результате закрепления гетерозиса инбредных культур, таких как, пшеница (15%) и рис (35%),будет впервые экономически использовано в большом масштабе, что придаст апомиксису огромное всемирное коммерческое значение. Поскольку клонирование происходит через семя, то апомиксис может стать наиболее ценным эффективным растительным механизмом для передачи биотехнологических и продуктивных достижений маргинальным (небольшим) фермерским землям в развитом мире и плохообеспеченным природными ресурсами хозяйствам в развивающихся странах. В 21-м веке апомиксис может стать среди наиболее ценных для селекционеров растений генетических инструментов. На недавней конференции по апомиксису было достигнуто следующее заключение: Перспектива введения апомиксиса в культуры, размножающиеся половым путем, предоставляет такие революционные возможности с тем, чтобы оправдать постоянное международное научное усилие. Если бы апомиксис образовывался с достаточно высокой степенью гибкости, то его влияние на сельское хозяйство могло бы быть глубоким по характеру и чрезвычайно широким по масштабу. The Bellagio Apomixis Conference, Why is ApomixisImportant to Agriculture(1998) (http://billie, harvard, edu/apomixis/apotech.html). В течение последних 100 лет было предложено четыре способа наследования апомиксиса: хромосомных негомологий (широкой гибридизации), количественного наследования, простого наследования иUrsache der Apogamie im Pflzanreich (Fisher, Jena 1918), утверждает, что апомиксис является функцией хромосомной негомологии и является одной из нескольких цитогенетических аномалий, вызванной широкой гибридизацией. Согласно этой теории, апомиксис не контролируется непосредственно генами, но является результатом дивергенции в структуре хромосомы. Эта гипотеза больше не считается справедливой главным образом потому, что апомиксис встречается у растений, чьи хромосомы выглядят гомологичными. J.G. Carman, Asynchronous Expression of Duplicate Genes in Angiosperms May Cause Apomixis,Bispory, Tetraspory, and Polyembryony, 61 Biol. J. Linnean Soc. 51-94 (1997). Гипотеза количественного способа наследования также считается недействительной. В середине 20 го века это было подтверждено Мюнтцингом, который полагал, что апомиксис происходит в результате точного равновесия от нескольких до многих рецессивных генов, и Пауэрсом, который полагал, что рецессивные гены приводят к трем главным составляющим апомиксиса: нарушению мейоза, образованию апомиктичного зародышевого мешка и партеногенезу. AskerJerling. В течение последних 40 лет большинство ученых по апомиксису, включая Bashaw, Nogler, Savidan,Sherwood и Harlan (Бэшеу, Ноглера, Савидана, Шервуда и Харлана) подтвердили гипотезу простого наследования, а именно, что один или два доминантных гена приводят к апомиксису. AskerJerling. Исходно это заключение выглядит убедительно в том, что менделевские анализы многократно производят простое соотношение расщепления наследования, например, соотношение 1:1 апомиктичного потомства к потомству, полученному половым путем, является часто продуцированным при скрещиваниях, проведенных между растениями, размножающимися половым путем и апомиктичными растениями. Y.Savidan, Apomixis: Genetics and Breeding, 18 Plant Breed. Rev. 13-86 (2000). Однако, несмотря на продолжительные усилия, ни один ген, отвечающий за апомиксис, не был идентифицирован или выделен. В конце 1990-х для эволюции апомиксиса была предложена гипотеза асинхронии двойных генов или теория цветковой асинхронии, произошедшей в результате гибридизации, (в дальнейшем, "НРА"теория). J.G.Carman, 61 Biol. J. Linnean Soc, 51-94 (1997). Она подразумевает сложное наследование и основывается на синтезе концепций из различных областей биологии. Согласно этой гипотезе, способ наследования апомиксиса не является простым; и не является просто количественным, по крайней мере,не при стандартном способе наблюдения количественного наследования. Наоборот, он является сложным и является наиболее объяснимым посредством серий из пяти принципов, которые построены друг на друге. Первые три принципа опубликованы, J.G. Carman, 61 Biol. J. Linnean Soc. 51-94 (1997), и суммированы ниже. Последние два принципа содержат неопубликованные концепции новые для настоящего изобретения и их представляют здесь. Первый принцип, апомиксис является оторванным в ходе индивидуального развития гибридным фенотипом. Апомиксис является оторванным, не промежуточным, от его родительских женских репродуктивных фенотипов, которые для удобства обозначают родительскими фенотипами А и В. Растения,демонстрирующие фенотипы А или В, подвергаются нормальной репродукции половым путем. Фенотипические различия между А и В обнаруживали цитоэмбриологически посредством известных в этой области микроскопических методов. Они (фенотипические признаки) просто так (легко) не наблюдаются и по этой причине не были описаны ранее. Второй принцип, родительские фенотипы А и В отчетливо отличаются друг от друга в отношении периодов времени, в течение которых происходят мейоз, образование зародышевого мешка и эмбриония,относительно всего периода развития семяпочки. Третий принцип, родительские фенотипы А и В являются сами по себе количественно наследуемыми. Следовательно, почти облигатный апомиксис, в тех случаях, когда большинство семяпочек данного растения производят функциональные апомиктичные зародышевые мешки, выражен вследствие полигенной гетерозиготности. В популяциях агамных комплексов (популяциях интербридинга половых и апомиктичных видов) существуют множественные аллели для многих из критических локусов, то есть критические локусы являются полиморфными. Полигенная гетерозиготность, ответственная за почти облигатный апомиксис, вовлекает, в частности, дивергентные аллели, которые сохраняются в природных популяциях вследствие естественной селекции. Наоборот, факультативный апомиксис, при котором семена, образованные половым путем и апомиктичные семена, обычно развиваются на том же самом растении, происходит, когда некоторые из более критических локусов, требуемых для облигатного апомиксиса, становятся гомозиготными (или приобретают аллели, которые кодируют сходные программы развития семяпочки) посредством генетической сегрегации. Описаны основанные на HFA-теории эффективные процедуры создания факультативно апомиктичных растений из растений, размножающихся половым путем. J.G. Carman, Methods for Producing Apomictic Plants, WO 98/33374 (1998) (здесь приведено в виде ссылки). Эти методы применяют для создания высоко апомиктичных растений, которые могут или не могут быть генетически стабильными как определено выше. Предложенным в WO 98/33374 решением является производство высоко апомиктичных растений, то есть снижение, насколько это возможно, случая образования семени половым путем у апомиктичных гибридов, путем идентификации или производства (посредством селекции) пар родительских линий, которые являются подходяще дивергентными в их женских репродуктивных программах, при-2 006658 условии, что факультативное половое развитие в факультативно апомиктичном гибридном потомстве сведено до минимума. Искусственные апомикты, произведенные таким образом, могут быть использованы в качестве апомиктичных гибридных линий от нескольких до многих поколений прежде, чем выращенное семя станет непригодным для пересева вследствие опасного загрязнения семенами половых ревертантов. Зараженные ревертантами семена являются продуктами генетической сегрегации и их наличие ухудшает агрономическую ценность. Эта ситуация может быть сходной со смешиванием худшего F2 и семян более поздних генераций с элитными F1 гибридными семенами в общепринятой программе по производству семян. Результатом был бы агрономически худший продукт. WO 98/33374 не представила предмет стабилизации и контроля апомиксиса. Следовательно, способы модификации апомикта, если уж он создан, не были предоставлены. Ввиду вышесказанного, было бы выгодно предоставить способы, которые позволяют усовершенствование апомиктичных линий, которые являются облигатными, облигатными если не индуцированы быть факультативными, или факультативными, если не индуцированы быть облигатными. Апомиктичная линия может быть улучшена индуцированием факультативного апомиксиса, традиционными стратегиями селекции и затем возвращена к облигатному апомиктичному состоянию за многие годы полеводства. Должно быть оценено, что эти и другие преимущества настоящей заявки на изобретение (рассмотренные ниже) представляют главные успехи в данной области. Краткое изложение изобретения Задачей настоящего изобретения является предоставление нового селекционного способа, который предлагает, стабилизирует и контролирует апомиксис с целью упрощения производства гибридных семян, так что все культуры покрытосемянных могут быть использованы в качестве гибридов. Другой задачей настоящего изобретения является предоставление специализированных способов селекции растений для успешного улучшения таких апомиктов. Другой задачей настоящего изобретения является предоставление способов, которые контролируют апомиксис путем превращения факультативного апомикта, который ранее был или не был улучшен методами селекции растений или генетической инженерии, в облигатного апомикта, таким образом, сохраняя, как можно дольше, его генотипические и фенотипические свойства. Эти и другие задачи могут быть решены обеспечением способа получения апомиктичного растения, проявляющего повышенную генетическую стабильность апомиксиса, от покрытосеменного апомиктичного родительского растения, которое проявляет генетическую нестабильность апомиксиса, предусматривающий измерение степени генетической нестабильности апомиксиса родительского растения; если родительское растение проявляет генетическую нестабильность апомиксиса, получение одного или нескольких растений-потомков от родительского растения, где каждое из растений-потомков содержит двойной хромосомный набор родительского растения; измерение степени генетической нестабильности апомиксиса одного или нескольких растенийпотомков; сравнение степени генетической нестабильности апомиксиса одного или нескольких растенийпотомков со степенью генетической нестабильности апомиксиса родительского растения; и селекцию, по меньшей мере, одного из одного или нескольких растений-потомков, проявляющих повышенную генетическую стабильность апомиксиса по сравнению с родительским растением,где одно или несколько растений-потомков получают обработкой родительского растения ингибитором веретена,где ингибитор веретена представляет собой колхицин,где одно или несколько растений-потомков получают культивированием родительского растения или его части в тканевой культуре,где одно или несколько растений-потомков получают самоопылением родительского растения или скрещиванием родительского растения с другим растением того же вида, рода или семейства и получением первого потомства; и подсчет хромосом в первом потомстве и выбор амфиплоида или частичного амфиплоида, имеющего все хромосомы от родительского растения в случае самоопыления такого родительского растения,или все хромосомы от родительского растения и один или несколько наборов хромосом от другого растения того же вида, рода или семейства, или все хромосомы от другого растения того же вида, рода или семейства, и один или несколько наборов хромосом от родительского растения в случае скрещивания родительского растения с другим растением того же вида, рода или семейства. Способ дополнительно предусматривает обратное скрещивание частичного амфиплоида с родительским растением или с другим растением того же самого вида, рода или семейства и получение от них второго потомства и селекцию амфиплоида, имеющего равный (четный) уровень плоидности,где частичный амфиплоид является эуплоидом или анэуплоидом,где амфиплоид является эуплоидом или анэуплоидом.-3 006658 Способ дополнительно предусматривает повышение фертильности выбранных растений-потомков путем самоопыления или гибридизации с другим растением, получение от них семян, высевание указанных семян, и селекцию полученных половым путем апомиктичных гибридных растений, которые обнаруживают повышенную частоту не сниженной фертильности яйцеклеток или партеногенез. Другим аспектом настоящего изобретения является способ получения апомиктичного сегментного аллополиплоидного растения, проявляющего повышенную генетическую стабильность апомиксиса, от покрытосеменного межсортового гибридного растения, которое проявляет генетическую нестабильность апомиксиса, предусматривающий измерение степени генетической нестабильности апомиксиса межсортового гибридного растения; если межсортовое гибридное растение проявляет генетическую нестабильность апомиксиса, получение одного или нескольких растений-потомков от межпородного гибридного растения, где каждое из растений-потомков содержит двойной хромосомный набор межсортовое гибридного растения, приводя к появлению одного или нескольких апомиктичных сегментных аллополиплоидных растений; измерение степени генетической нестабильности апомиксиса одного или нескольких апомиктичных сегментных аллополиплоидных растений; и сравнение степени генетической нестабильности апомиксиса одного или нескольких апомиктичных сегментных аллополиплоидных растений со степенью генетической нестабильности апомиксиса межсортового гибридного растения для проверки того, увеличена ли генетическая стабильность апомиксиса одного или нескольких апомиктичных сегментных аллополиплоидных растений по сравнению с межсортовым гибридным растением. Способ дополнительно предусматривает повышение фертильности одного или нескольких апомиктичных сегментных аллополиплоидных растений путем их самоопыления или гибридизации с другим растением, получение от них семян, высевание указанных семян и селекцию полученных половым путем апомиктичных сегментных аллополиплоидных растений, которые обнаруживают повышенную частоту не сниженной фертильности яйцеклеток или партеногенез. Еще одним аспектом настоящего изобретения является способ получения апомиктичного аллополиплоидного растения, проявляющего повышенную генетическую стабильность апомиксиса, от покрытосеменного межвидового гибридного растения, проявляющего генетическую нестабильность апомиксиса, предусматривающий измерение степени генетической нестабильности апомиксиса межвидового гибридного растения; и получение одного или нескольких апомиктичных аллополиплоидных растений-потомков от указанного межвидового гибридного растения и селекцию апомиктичного аллополиплоидного растенияпотомка, проявляющего повышенную генетическую стабильность апомиксиса. Способ дополнительно предусматривает повышение фертильности выбранного апомиктичного аллополиплоидного растения-потомка путем самоопыления или гибридизации с другим растением, получение семян, высевание указанных семян и селекцию полученных половым путем апомиктичных аллополиплоидных растений, которые обнаруживают повышенную частоту не сниженной фертильности яйцеклеток или партеногенез. Другим аспектом настоящего изобретения является способ получения апомиктичного растения, проявляющего повышенную генетическую стабильность апомиксиса, от покрытосеменного, внутривидового, межсортового или межвидового гибридного растения, проявляющего генетическую нестабильность апомиксиса, предусматривающий измерение степени генетической нестабильности апомиксиса внутривидового, межсортового или межвидового гибридного растения; и получение апомиктичных аутополиплоидных, сегментных аллополиплоидных или аллополиплоидных растений-потомков внутривидового, межсортового или межвидового гибридного растения и селекцию апомиктичного растения, проявляющего повышенную генетическую стабильность апомиксиса. Способ дополнительно предусматривает повышение фертильности отобранного апомиктичного растения путем самоопыления или гибридизации с другим растением, получение семян, высевание указанных семян и селекцию полученных половым путем апомиктичных растений-потомков, которые обнаруживают повышенную частоту не сниженной фертильности яйцеклеток или партеногенез. Еще одним аспектом настоящего изобретения является способ генетической стабилизации апомиксиса покрытосеменного, апомиктичного, внутривидового, межсортового или межвидового гибридного растения, проявляющего генетическую нестабильность апомиксиса, предусматривающий измерение степени генетической нестабильности апомиксиса внутривидового, межсортового или межвидового гибридного растения и получение растения-потомка от указанного апомиктичного внутривидового, межсортового или характеризуется нечетным увеличением плоидности, причем женский мейоз обычно прерывается, приводя к практически 100% образованию апомиктичных семян. Способ дополнительно предусматривает повышение фертильности растения-потомка путем самоопыления или гибридизации с другим растением, получение от них семян, высевание семян и селекцию полученных половым путем апомиктичных растений, которые обнаруживают повышенную частоту не сниженной фертильности яйцеклеток или партеногенез. Другим аспектом настоящего изобретения явля-4 006658 ется способ генетической стабилизации апомиксиса покрытосеменного, апомиктичного, внутривидового,межсортового или межвидового гибридного растения, проявляющего генетическую нестабильность апомиксиса, предусматривающий измерение степени генетической нестабильности апомиксиса внутривидового, межсортового или межвидового гибридного растения и скрещивание этого внутривидового, межсортового или межвидового гибридного растения с мейотическим мутантным растением того же самого вида, рода или семейства и селекцию потомства, где женский мейоз обычно прерывается, приводя к практически 100% образованию апомиктичных семян. Способ дополнительно предусматривает повышение фертильности отобранного потомства путем самоопыления или гибридизации с другим растением, получение от них семян, высевание указанных семян и селекцию полученных половым путем апомиктичных растений-потомков, которые обнаруживают повышенную частоту не сниженной фертильности яйцеклеток или партеногенез. Еще одним аспектом настоящего изобретения является способ получения апомиктичного растения, проявляющего повышенную генетическую стабильность апомиксиса от покрытосеменного апомиктичного родительского растения, которое проявляет генетическую нестабильность апомиксиса, предусматривающий измерение степени генетической нестабильности апомиксиса родительского растения; получение растения-потомка от родительского растения путем удвоения числа хромосом указанного родительского растения или введения хромосомной аберрации, в котором рекомбинация подавляется,так что тормозится сегрегация аллелей во время мейоза; и измерение степени генетической нестабильности апомиксиса растения-потомка для проверки того,что такое растение проявляет повышенную генетическую стабильность апомиксиса по сравнению с родительским растением,где указанная хромосомная аберрация предусматривает транслокацию, где указанная хромосомная аберрация предусматривает инверсию. Способ дополнительно предусматривает повышение фертильности растения-потомка путем самоопыления или гибридизации с другим растением, получение от них семян, высевание указанных семян и селекцию полученных половым путем апомиктичных растений-потомков, которые обнаруживают повышенную частоту не сниженной фертильности яйцеклеток или партеногенез. Краткое описание нескольких видов графических материалов Фиг. 1 демонстрирует стадии в эволюции агамных комплексов. Стадии включают экотипичную дифференцировку до образования апомиктов, образование I стадии апомиктов посредством гибридизации, произошедшей в результате вторичных контактов, образование стадии II апомиктов посредством структурной (кариотипической) стабилизации (обычно вовлекающей полиплоидизацию) и образование зрелых, экологически разнообразных агамных комплексов (стадия III) посредством факультативного ауткроссинга, первоначально с половыми родственными формами и вторично с другими родственными апомиктами. Фиг. 2 демонстрирует стадии мегаспороцита (ММС) и диады в пестиках полового диплоида Antennaria racemoza и A. umbiinella. Отмечают различия между видами в длине интегумента на стадиях ММС и диады. Стрелки = элемены ММС или диады. Линии = величина роста интегумента (cравнивают с фиг. 3). Фиг. 3 демонстрирует средние значения длин интегумента и семяпочки (фактические измерения,нижние левая и правая фигуры, и в процентах относительное удлинение зрелого интегумента и семяпочки, верхние левая и правая фигуры) на стадиях диады, 2-ядерного зародышевого мешка и зрелого зародышевого мешка для девяти диплоидных клеток-предшественников апомиктичной Antennaria rosea. Данные на фиг. с 8 по 11 изображают изменчивость в программах развития семяпочки среди растительных экотипов. Это естественное экотипически вызванная изменчивость никогда не была прежде охарактеризована, и она является предпосылкой для возникновения апомиксиса у встречающихся в природе и искусственных гибридов. Фиг. 4 демонстрирует одно из нескольких измерений продолжительности мейоза среди 17 экологически различных районированных рас и сортов Sorghum. Продолжительность мейоза является только одним из нескольких типов экотипично выведенной межрасовой/межвидовой изменчивости, обнаруженной в программах развития семяпочки, сохраненной различными экотипами цветковых растений. Столбцы изображают продолжительность времени между стадией диады и время, при котором инициировалось образование зародышевого мешка (как функция роста внутреннего итегумента), т.е. низкие и высокие столбцы изображают линии с очень небольшой и очень большой задержкой, соответственно, между мейозом и образованием зародышевого мешка. Фиг. 5 демонстрирует созревание цветочной почки во время мегаспорогенеза (женского мейоза) в виде измеренных средних длин внутреннего интегумента (изображенного как относительное удлинение зрелого интегумента в процентах) на стадии диады мейоза для родительских линий трех гибридов Sorghum. Наблюдали апоспоровые зачатки и/или увеличение многоядерных апомиктичных (апоспоровых) зародышевых мешков приблизительно у 5% пестиков гибридов 5 и 18, чьи родители показывали небольшое различие в уровнях созревания почки во время мегаспорогенеза. Наоборот, многоядерные апо-5 006658 миктичные (диплоспровые) зародышевые мешки плюс апоспоровые зачатки и зародышевые мешки образуют приблизительно 10% пестиков гибрида 15, родители которых показывают гораздо большее различие в уровнях созревания почки во время мегаспорогенеза. Апомиктичное формирование зародышевого мешка в родительских линиях происходит только изредка (0,1%). Родительскими линиями гибридов 5, 18 и 15 являются "Early Karlo"/"Karad Local", "Vir-5049"/"Aispuri" (трансформированные) и"Westland"/"Agira" соответственно. Фиг. 6 демонстрирует мегаспорогенез и развитие зародышевого мешка у полового Antennaria плюс апомиктичное (диплоспоровое) развитие зародышевого мешка у искусственного Antennaria corymbosa(2n=2x, половой) X Antennaria racemosa (2n=2x, половой) межвидового апомиктичного гибрида. Приблизительно 7% пестиков в гибриде обнаруживают образование диплоспорового зародышевого мешка. Диплоспорию не наблюдали в родительских линиях. Примечание к фиг. 3 такое, что две родительские линии не являются сильно дивергентными в отношении сроков мейоза. Фиг. 7 демонстрирует мегаспорогенез и развитие зародышевого мешка у полового Sorghum плюс апомиктичное (апоспоровое) развитие зародышевого мешка у искусственного гибрида Sorghum, произведенного от половых линий. Приблизительно 5% пестиков в гибриде демонстрируют апоспоровые зачатки и/или апоспоровое образование зародышевого мешка. Диплоспорию не обнаружили в родительских линиях. Примечание к фиг. 3, гибриды, продуцирующие низкую частоту формирования апоспорового зародышевого мешка, выведены из родительских линий, которые не являются сильно дивергентными в отношении сроков мейоза относительно общего развития почки. Фиг. 8 демонстрирует половой мегаспорогенез и половое и диплоспоровое развитие зародышевого мешка у искусственного факультативно апомиктичного амфиплоида Tripsacum (2n=4x), произведенного от гибрида T.laxum (2n=2x, половой) Х T.pilosum (2n=2x, половой). Приблизительно 50% пестиков в гибриде демонстрируют диплоспоровое образование зародышевого мешка. Партеногенное образование зародыша из редуцированной яйцеклетки наблюдали цитоэмбриологически (наличие глобулярной стадии эмбриона без фертилизации уже образовавшейся центральной клетки). Фиг. 9 демонстрирует половой мегаспорогенез и половое и диплоспоровое развитие зародышевого мешка у искусственно стабилизированного облигатно апомиктичного трехспецифичного триплоидного гибрида Tripsacum, произведенного от половых диплоидов (T.laxum /T.pilosum//T.zopilotense). Приблизительно 80% пестиков у гибрида демонстрируют диплоспоровое формирование зародышевого мешка. Оставшиеся пестики являются абортивными. Подробное описание До раскрытия и описания настоящих способов стабилизации и контроля апомиксиса следует понять, что данное изобретение не ограничивается частными формами, стадиями процессов и материалами,раскрытыми здесь, так как такие формы, стадии процессов и материалы, могут несколько варьироваться. Также должно быть понятно, что терминология, применяемая здесь, используется единственно с целью описания частных воплощений, и она не предназначена для ограничения, поскольку область настоящего изобретения ограничена только прилагаемой формулой изобретения и ее эквивалентами. Публикации и другие справочные материалы, относящиеся к этому изобретению, для описания предпосылки создания изобретения и предоставления дополнительных подробностей относительно его применения, здесь включены в качестве ссылки. Ссылки, рассмотренные здесь, предусмотрены исключительно для раскрытия уровня до даты подачи данной заявки. Ничто здесь не может быть истолковано как допущение того, что изобретатель не имеет право датировать более ранним числом такое раскрытие посредством более раннего изобретения. Должно быть отмечено, что, как применяют в данном описании и прилагаемой формуле изобретения, формы единственного числа "a", "an" и "the" включают множественные объекты ссылок, если контекст ясно не диктует обратное. В описании и пунктах формулы настоящего изобретения будет использована следующая терминология в соответствии с определениями, приведенными ниже. Используемые здесь, содержащий, включающий в себя, содержащий, характеризующийся и их грамматические эквиваленты являются включающими в себя, или незавершенными терминами, которые не исключают дополнительных, не перечисленных элементов или стадий способа. Содержащий- должен быть интерпретирован как включающий более ограниченные термины состоящий из и состоящий по существу из. Используемые здесь состоящий из и его грамматические эквиваленты исключают любой элемент,стадию или ингредиент, не оговоренный в формуле изобретения. Используемые здесь состоящий по существу из и его грамматические эквиваленты ограничивают объем пункта формулы изобретения описанными материалами или стадиями и теми, которые существенно не влияют на основные и новые признак или признаки заявленного изобретения. Используемое здесь генетическая нестабильность апомиктичного растения означает, что средняя частота образования семени половым путем среди полученного половым путем потомства такого растения превышает среднюю частоту образования семени половым путем такого апомиктичного растения.-6 006658 Используемое здесь стабилизация факультативно апомиктичного растения означает гарантированно, что средняя частота формирования семени половым путем среди полученного половым путем потомства такого растения не превосходит среднюю частоту образования семени половым путем такого апомиктичного растения. Используемое здесь, полный апомиксис означает (1) предшествование мегаспорогенеза при образовании раннего зародышевого мешка, (2) предшествование фертилизации при ранней эмбрионии, и (3) образование эндосперма или псевдогамно (посредством фертилизации центральной клетки, но не яйцеклетки), или автономно (без фертилизации центральной клетки). Принципы 4 и 5 HFA-теории апомиксиса являются следующими. Принцип 4 гласит, что в отсутствие структурной или кариотипической гетерозиготности, потомство почти облигатного или факультативного апомикта, полученное половым путем, обычно воспроизводится половым путем, это означает, что оно является половыми ревертантами. В отсутствие структурной гетерозиготности дивергентные аллели, ответственные за родительские фенотипы, расщепляются во время образования половой гаметы, которое у апомиктов происходит то изредка, то часто во время мегаспорогенеза (женский мейоз) и обычно часто во время микроспорогенеза (мужской мейоз). В этом отношении,потеря апомиксиса в половом F2 поколении является аналогичным потере гибридной силы в F2 поколении стандартных гибридных сортов культур. Оба являются сложными полигенными гибридными фенотипами. Принцип 5 гласит, что при наличии структурной гетерозиготности, потомство, произведенное половым путем, почти облигатного или факультативного апомикта обычно воспроизводит или апомиктично, имитируя гомозиготное доминантное состояние, или обоими половым путем и апомиктичным (при коэффициенте расщепления почти 1:1), имитируя гетерозиготное доминантное состояние. У настоящих,репродуктивно стабилизированных, апомиктов высокая частота расщепления к половому типу предотвращается структурной (кариотипической) гетерозиготностью, которая включает, но не ограничивается этим, аллополиплоидию, сегментную аллополиплоидию, половую стерильность или палеополиплоидию. Структурная гетерозиготность является ответственной за апомиксис, имитируя простое наследование. Внутривидовые апомиктичные диплоидные гибриды, половое потомство которых является обычно слабо апомиктичным или полностью половым вследствие рекомбинации полигенной гетерозиготности,необходимой для апомиксиса, стабилизируют путем индуцирующей триплоидии, или другим нечетным полиплоидным уровнем. Это имеет своим результатом почти облигатный апомиксис. При неспаренном уровне плоидности генетически редуцированные и рекомбинированные функциональные яйцеклетки образуются редко и редко оплодотворяются генетически редуцированным и рекомбинированным спермием, выработка которого весьма снижена. Следовательно, внутригеномная полигенная гетерозиготность, ответственная за апомиксис, редко нарушена у полиплоидных апомиктов с неспаренным уровнем плоидности. Аллополиплоидия (полиплоидия, вовлекающая различные виды) представляет собой вообще наиболее удобный механизм для ограничивающей рекомбинации. У аллополиплоида рекомбинация в основном происходит только внутри геномов, не между геномами. Следовательно, гены, ответственные за апомиксис, поддерживаются посредством факультативных половых поколений в гомозиготном состоянии внутри генома, но в гетерозиготном состоянии между геномами. Другие цитогенетические механизмы могут быть использованы для предотвращения рекомбинации внутри или между целыми геномами, или частями геномов. Настоящая заявка распространяется на все такие механизмы, включая гетерозиготную инверсию или транслокационную гетерозиготность и механизмы генетически контролируемого мейотического пуска. Уровни фертильности межвидовых апомиктичных диплоидов, демонстрирующие низкую фертильность, увеличивают полиплоидизацией или четных (например, тетраплоидных, гексаплоидных и тому подобных), или нечетных (например, триплоидных, пентаплоидных и тому подобных) уровней. Апомиктные полиплоиды, созданные таким образом, могут производить некоторое количество потомства,полученного половым путем, то есть они в основном являются факультативными апомиктами. Такое потомство, полученное половым путем, также является факультативными апомиктами поскольку полигенная гетерозиготность, необходимая для апомиксиса, существует между геномами, а невнутри геномов. Аллополиплоиды фиксируют надежную интергеномную гетерозиготность так, что случайная межгеномная рекомбинация не затрагивает аллельный состав дивергентного межгеномного локуса. Сегментообразную аллополиплоидизацию поощряют посредством способов настоящего изобретения, чтобы усилить пыльцевую фертильность, образование нередуцированного зародышевого мешка и яйцеклетки,жизнеспособность и нередуцированный партеногенез яйцеклетки. Развитие HFA-теории Объединением HFA-теории (всех пяти принципов) с принципами эволюционной генетики, настоящий изобретатель развил новую теорию о происхождении, стабилизации и дифференциации природных агамных комплексов (групп интербридинга половых и апомиктичных растений). Теория представлена здесь и формирует основу для производства агамных культур.-7 006658 В течение фазы пре-апомиксиса теории (фиг. 1), естественная селекция происходит вдоль по широтному и другим экологическим градиентам и половые экотипы эволюционируют с дивергентными широкими временными характеристиками развития яйцеклетки. Это является тем, за чем следует гибридизация, произошедшая в результате вторичных контактов. В этом контексте плейстоцен был единственным в истории покрытосемянных, в котором произошли обширные растительные миграции, В.HuntleyТ. Webb III, Vegetation History (Kluwer Academic Publishers 1988), и гибридизации, произошедшие в результате вторичных контактов, в частности, в средне-широтной гетерогенной заповедной флоре. J.G. Carman, 61 Biol. J. Linnean Soc. 51-94 (1997). Новые гибриды, пытающиеся экспрессировать две и более конкретно дивергентные широковременные характеристики развития цветковых, воспроизводили в виде факультативных апомиктов стадии I(фиг. 1). Большинство из этих исчезающих апомиктов были диплоидами, и апомиксис у большинства из них был факультативным и кратковременным, то есть их потомство, произведенное половым путем, было облигатно половым, поскольку сбалансированная многолокусная гетерозиготность, необходимая для апомиксиса, была нарушена рекомбинацией. Следовательно, последующие поколения этих недолговечных линий содержали несколько апомиктов до тех пор, пока все апомикты не были замещены половым потомством. Такое замещение не происходило у апомиктов, или с имеющимися ко времени их образования, или с быстро приобретенными стабилизирующими механизмами, такими как, аллополиплоидия. Большинство механизмов, которые стабилизируют апомиксис, вовлекают полиполидию и все из них весьма ингибируют и иногда элиминируют рекомбинацию различных гетерозиготных генов, критических для апомиксиса и родственных репродуктивных аномалий. Стабилизированные апомикты стадии II могут периодически включаться в ВII и ВIII гибридизацию с родственными апомиктами и с экологически дивергентными половыми родственниками, чтобы произвести гетерогенные агамные комплексы стадии III (фиг. 1). Многие апомикты стадии III в настоящее время продолжают ассимилировать, посредством факультативного ауткроссинга с половыми и апомиктичными родственниками, генетическая емкость продолжает мигрировать в новые и экологически различные ареалы. R.J. Bayer, Evolution of Polyploid Agamic Complexes with Examples from Antennaria (Asteraceae),132 Opera Bot. 53-65 (1996). Механизмы стабилизации генетических систем наследования, ответственных за апомиксис, завершают HFA-модель происхождения, стабилизации и наследования апомиксиса. Что касается апомиксиса,то составляющие механизмы (определенные ниже) не описаны в уровне техники. Согласно HFA-теории, родительские половые фенотипы апомиктов являются полигенными коадаптантами, A.R. Templeton, Coadaptation and Outbreeding Depression, in M.E. Soule, Conversion Biology: TheScience of Scarcity and Diversity 105-116 (Sinauer Assocs. Inc., Sunderland, MA 1986); В. Wallace, Coadaptation Revisited, 82 J. Hered. 89-95 (1991), кодирующимися уникальными группами аллелей, которые действуют кооперативно для подтверждения соответствия специфическим экотипам, адаптированным к специфическим окружающим средам. Любая важная рекомбинация между родительскими геномами, т.е. между этой критической мультилокусной гетерозиготностью у факультативных апомиктов стадии I,имеет следствием потомство, которое демонстрирует раздельнополость или, в лучшем случае, весьма сниженную частоту апомиксиса, т.е. потомство, полученное половым путем, является половым или большей частью половым (высоко факультативным). Следовательно, без стабилизации, апомикты стадииI в конечном счете вытесняются половыми сегрегантами, которые генетически вносят только половое потомство в популяцию. Подавляющее большинство диплоидных апомиктов стадии I, которые успешно продвигаются к стадии II (фиг. 1), стабилизируют аллополиплоидией или сегментной аллополиплоидией. Скорость, при которой происходит стабилизация, зависит от взаимосвязанности родительских линий и от определенных условий в зоне гибридизации, произошедшей в результате вторичных контактов. Одна родительская линия в таких зонах является более многочисленной, чем другая. В таких случаях пыльца от доминирующего родителя, скорее всего, будет вовлечена в ВIII гибридизацию (фертилизация нередуцированных яйцеклеток), чтобы образовать триплоиды с соотношением генома 2:1. Наоборот, гибрид ВIII может быть образован из нередуцированной пыльцы апомикта стадии I, что сказывается на фертильности доминирующего родителя, образующего такое же соотношение генома 2:1. Полагая, что триплоиды также образуют нередуцированные яйцеклетки (демонстрируют тенденции к апомиксису) или пыльцу, второй раунд обратного скрещивания, вовлекающий того же самого доминирующего диплоидного полового родителя, дает в результате соотношение генома 3:1. Такие соотношения, вероятно, являются частыми среди апомиктов, и они (соотношения) объясняют простое отношение расщепления наследования и присущие апомиксису, гемизиготные группы сцепления. Наоборот, триплоид может быть вовлечен в ВIII гибридизацию с другим родителем, в этом случае имеет место соотношение генома 2:2. Другие формы полиплоидизации, вовлекающие нередуцированную пыльцу и яйцеклетки, или соматическое удвоение, могут давать сходные результаты. Большинство апомиктов являются ауткроссинговыми многолетниками, т.е. инбридинг апомиктов с однолетними апомиктами является чрезвычайно редким (AskerJerling). Гипотезы, основанные на мутации, не объясняют это наблюдение. Наоборот, схема гибридизации и ауткроссинга, описанная выше,-8 006658(фиг. 1) зависит от ауткроссинга и наличия многолетников. При диплоидном уровне гибрида, ВС 1 - триплоидном и ВС 2 - тетраплоидных уровнях, наличие многолетников позволяет проанализировать многочисленные генетические рекомбинации (в пыльце). Каждый может предоставить генетическую предпосылку, которая обсуждает различную степень жизнеспособности и факультативности, и генетические предпосылки, обсуждающие поддержание более высокой жизнеспособности. Ауткроссинг и наличие многолетников являются особенностью семейств с высокой степенью естественной гибридизации, a Asteraceae, Poaceae и Rosaceae часто располагаются близко к верху. N.C. Ellstrand et al., Distribution of Spontaneous Plant Hybrids, 93 Proc. Nat'l Acad. Sci. USA 5090-5093 (1996). Эти три семейства содержат 75% всего апомиктичного рода. J.G. Carman, 61 Biol. J. Linnean Soc. 51-94 (1997). Напротив, апомиксис редко наблюдается в семействах, которые располагаются низко в гибридизационной оценке, например, Brassicaceae, Solonaceae и Apiaceae. Опять-таки, хотя гипотеза, основанная на мутагенезе, не объясняет эти ассоциации, они полностью совпадают с происхождением гибридизации и обратного скрещивания, описанными выше (фиг. 1). Поскольку большинство апомиктов являются аллополиплоидами, AskerJerling, аллополиплоидия, вероятно, является наиболее частой формой стабилизации апомиксиса. Рекомбинация у истинных аллополиплоидов происходит только внутри геномов. Следовательно, локусы, критичные для высокой частоты (почти облигатного) апомиксиса, изолируются из интергеномной сегрегации и независимого ассортимента, т.е. они сохраняют гомозиготность внутри геномов, но гетерозиготность между геномами. Потомство, образованное половым путем от факультативно апомиктичных ТТ Т'Т' геномных аллополиплоидов, где Т и Т' являются дивергентными и кодируют дивергентные черты развития яйцеклетки, остается апомиктичным, но является фенотипически вариабельным вследствие внутригеномной рекомбинации, вовлекающей гетерозиготные локусы не критичные для апомиксиса. Если ТТТ Т' апомикты размножают половым путем, то полигенная емкость апомиксиса (от предельно полового до почти облигатного) часто сегрегирует по простому Менделевскому способу. Это происходит из-за того, что косегрегация с нерекомбинантым Т' унивалентом (или большой группой сцепления), который содержат большинство из многих критических дивергентных аллелей, обязательна для экспрессии от низкой до высокой частоты апомиксиса. Похоже, что многие гены, существенные для почти облигатного апомиксиса, встречаются в нескольких хромосомах. Следовательно, в скрещиваниях между ТТТТ половыми линиями и ТТТ Т' апомиктичными линиями, факультативность будет варьировать от 10% до 90% среди сегрегантов, обычно классифицированных в виде апомиктичных. Y. Savidan,Genetics and Utilization of Apomixis for the Improvement of Guineagrass (Panicum maximum Jacq), Proc XIVInduced Tetraploid Brachiaria ruziziensis. 78 Euphytica 19-25 (1994). Такие апомикты часто приближаются к 50% сегрегированной популяции, т.е. отношение сегрегации 1:1 является часто приблизительным, которое является ошибочным в качестве доказательства простого наследования. Если хромосома, что содержит больше всего локусов, критических для апомиксиса, классифицируется как унивалентная, как ожидается в ТТТ Т' геномной совокупности, то частота передачи не достигнет 50% вследствие образования микросателлита. Это объясняет многие коэффициенты расщепления, которые описывают 50% передачи апомиксиса. Такие наслоения на гипотезу простого наследования объясняют это отклонение тетрасомным наследованием с произвольным хроматидным набором. Y. Savidan, Apomixis: Genetics and Breeding,18 Plant Breed. Rev. 13-86 (2000). Хромосомный ассортимент в присущем для апомиксиса гомеологичном ТТТ Т' наборе имеет место,если все четыре хромосомы являются гомологичными. Во время мейоза каждая из трех гомологичных Т хромосом имеет равный шанс ассоциирования с соответствующей ей гомеологичной Т' хромосомой. Следовательно, если общий для всех четырех хромосом локус содержит аллели, которые отличаются друг от друга, тогда все шесть парных комбинаций четырех различных аллелей произойдут случайным образом, т.е. хромосомный набор имитирует аутополиплоид. У многих апомиктов большинство полиплоидных наборов хромосом работают геномно в виде аутополиплоидных наборов, но по меньшей мере один работает в качестве аллополиплоидного набора. Такое хромосомное поведение является типичным для сегментной аллополиплоидии. G.L. Stebbins, Variation and Evolution in Plants (Columbia University Press, New York 1950); J. Sybenga, Chromosome Pairing(1996). Аллополиплодный набор (наборы) поддерживает между геномами пропорциональную мультилокусную гетерозиготность, обязательную для апомиксиса. Согласно HFA теории сегментные аллополиплоидные апомикты эволюционируют от ранней стадии межрасовых аутополиплоидных апомиктов или слабо полиплоидных ТТТ Т' или ТТ Т'Т' апомиктов. Критичная для апомиксиса рекомбинация внутри гомеологичного набора (наборов) хромосом является часто неадаптивной, поскольку она обычно приводит к стерильным половым сегрегантам. Следовательно, аллельные рекомбинации, хромосомные аберрации или даже мутации, которые ингибируют рекомбинацию внутри присущего апомиксису гомеологичного набора, вызывают дальнейшую аллоплоидизацию, G.L.Stebbins, Variation and Evolution in Plants (Columbia University Press, New York 1950) этого набора, кото-9 006658 рая может быть сильно адаптивной, приводящей к накоплению таких модификаций. Также рекомбинации внутри гомеологичных наборов, которые не сильно вовлечены в обсуждаемый апомиксис, могут быть высоко адаптивными. Такие рекомбинации первоначально являются редкими, но с каждой дополнительной рекомбинацией сходство между хромосомами внутри гомеологичных наборов возрастает, т.е. эти цитогенетические события аутополиплоидизируют хромосомные наборы путем комбинирования сегментов из дивергентных гомеологичных хромосом в одну хромосому. J. Sybenga, 39 Genome 11761184 (1996). Поскольку такая рекомбинация не приводит к половым сегрегантам, жизнеспособность апомикта возрастающе увеличивaется путем элиминации дисадаптивных аллельных комбинаций, существующих в исходном гибриде и путем образования новых и адаптивных аллельных комбинаций. Этот механизм может объяснить, почему апомикты у Tripsacum, D.Grimanelly et al., Mapping Diplosporous(Cenchrus ciliaris L.) у Pennisetum squamulatum Fresen, 19 Plant J. 203-208 (1999), и у Brachiaria,S.C.Pessino et al,. 130 Hereditas 1-11 (1999), ведут себя геномно как аутополиплоиды, даже не подвергаются рекомбинации в присущем апомиксису гомеологичном хромосомном наборе или группе сцепления.J. Sybenga, 39 Genome 1176-1184 (1996), убедительно доказывал, что сегментная аллополиплоидия элиминируется посредством аутополиплоидизации в начале эволюции полиплоидов, которые появляются в виде слабых аллополиплоидов или в виде межрасовых аутополиплоидов. Сегментный аллополиплоидный апомикт появляется, чтобы быть исключением. При этом факультативный апомиксис, связанный с сегментной аллополиплоидией является взаимосвязанной и высоко адаптивной особенностью, т.е. они действуют синергично в эволюции и стабилизации зрелых крайне удачных агамных комплексов (фиг. 1). В природе существует несколько, кажущихся стабильными, диплоидных апомиктов и некоторые из них, вероятно, стабилизированы посредством почти облигатной половой стерильности, которая предотвращает сегрегацию. Эти апомикты могут образовываться или посредством внутриспецифичной гибридизации половых диплоидов, или из аллополиплоидных апомиктов путем партеногенеза редуцированных яйцеклеток. Примеры включают диплоидные апомикты у Potentilla, MuntzingMuntzing, The ModeHierochloe, G. Weimarck, Apomixis and Sexuality in Hierochloe australis and in Swedish H. odorata on Different Polyploid Levels, 120 Bot. Not. 209-235 (1967), у Sorbus, A. JankunM. Kovanda, Apomixis at the Diploid Level in Sorbus eximia (Embriological Studies in Sorbus 3), 60 Preslia, Praha 193-213 (1988), и у Arabis,B.A. Roy, The Breeding Systems of Six Species of Arabis (Brassicaceae), 82 Amer. J. Bot. 869-877 (1995). В каждом случае геномы диплоидов являются дивергентными, и половые гаметы образуются редко. Наоборот, полная реверсия к раздельнополости внутри одной до нескольких половых генераций происходит у раздельнополых фертильных диплоидных (или слабых дигаплоидных) апомиктов. Такие нестабильные апомикты образуются или путем межрасовой гибридизации половых диплоидов, или из сегментных аллополиплоидных апомиктов путем партеногенеза редуцированных яйцеклеток. Замечание к последнему случаю, такие стабилизированные полиплоидные апомикты стадии I и III могут быть родительскими для нестабильных неодиплоидных апомиктов стадии I (фиг. 1). Нестабильные апомиктичные диплоиды обнаружены у Parthenium, D.U. GerstelW.M. Mishanec, On the Inheritance of Apomixis inon the Present Status of Research on Apomixis in Sorghum, 64 Cur. Sci. 315-316 (1993), последний из которых появляется, чтобы возникнуть посредством гибридизации половых диплоидов. Если апомиксис контролировали простым доминантным геном, то приблизительно 75% (если гетерозиготные) или 100% (если гомозиготные) всего потомства, полученного половым путем, факультативных диплоидных апомиктов, должно быть апомиктичным. Однако такого коэффициента сегрегации никогда не наблюдали. Вместо этого, полученное половым путем потомство факультативных диплоидных апомиктов является полностью половым, или только слегка апомиктичным. Эти наблюдения являются несовместимыми с простым наследованием, но они полностью согласуются с HFA-теорией, то есть рекомбинация сбалансированной мультилокусной гетерозиготности, критичная для апомиксиса, обычно дает в результате половое потомство. Вкратце, на диплоидном уровне при факультативной рекомбинации слабо гомеологичных геномов апомиксис теряется. На полиплоидном уровне гомеология является достаточной, чтобы ограничить факультативную рекомбинацию до одинаковых геномов. Этот механизм гомеологии поддерживает кросс-геномную гетерозиготность, которая часто вызывает апомиксис, чтобы выглядеть как простое наследование при использовании апомиктов в качестве мужских родительских особей в скрещиваниях между половыми особями и апомиктами.-10 006658 Как рассмотрено выше, эти гипотезы, индорсирующие простое наследование, объясняют 100%-ную реверсию к раздельнополости у потомства, произведенного половым путем, факультативно апомиктичных диплоидов путем утверждения, что доминантная апомиксисная аллель ведет себя как рецессивная летальная в гаплоидных гаметах. Следовательно, согласно этому объяснению, апомиксис не может быть наследован от гаплоидных гамет диплоидных апомиктов. В дополнение к стабилизации определенных диплоидных апомиктов половая стерильность предоставляет добавочную стабилизацию полиплоидным и анеуплоидным апомиктам. Несколько примеров включают (i) триплоидные апомикты у Taraxacum, AskerJerling, Erigeron, D.A. Stratton, Life HistoryMadrid 23-31 (1998), у Tripsacum и Antennana, J.G. Carman, неопубликовано, и (iii) у неравных тетраплоидных (три гомологичных х=5 геномов плюс один гомеологичный х=4 геном) апомиктов (нуцеллярная эмбриония) у Nothoscordum, К. Jones, Robertsonian Fusion and Centric Fission in Karyotype Evolution ofHigher Plants, 64 Bot. Rev. 273-289 (1998). Согласно HFA-теории биспория, тетраспория и полиэмбриония являются также полигенно определенными, аномальными и эволюционно промежуточными (гибридными) фенотипами. J.G. Carman, 61Biol. J. Linnean Soc. 51-94 (1997). Подобно апомиксису они происходят из-за внутригеномной гетерозиготности генов, вовлеченных в синхронизацию мегаспорогенеза, развития зародышевого мешка и/или эмбрионии. Однако, в отличие от апомиктов, многие биспоровые, тетраспоровые и полиэмбрионные виды являются диплоидными и почти все биспоровые и тетраспоровые виды являются полностью раздельнополыми. J.G. Carman, 61 Biol. J. Linnean Soc. 51-94 (1997). Следовательно, мультилокусная гетерозиготность, критичная для этих аномалий, не стабилизируется нормальной полиплоидией или половой стерильностью в случае биспоровых, тетраспоровых или факультативно полиэмбиональных диплоидов. Это поднимает вопросы, как такая гетерозиготность возникает и как она стабилизируется. Биспоровые и тетраспоровые виды и многие полиэмбриональные виды являются палеополиплоидами, которые, по-видимому, должны были образоваться из эволюционно асинхронных половых или апомиктичных полиплоидов. J.G. Carman, 61 Biol. J. Linnean Soc. 51-94 (1997). Возможные механизмы образования включают возрастающую или убывающую анеуплоидию и структурные реорганизации родительских геномов. D.E. SoltisP.S. Soltis, Polyploidy: Recurrent Formation and Genome Evolution, 14Trends Eco. Evol. 348-352 (1999), оба из которых могут быть стабилизированы посредством диплоидизации. Без диплоидизации должна произойти сегрегация к образованию нормального моноспорового зародышевого мешка типа Polygonum. Диплоидизация превращает полиплоидные наборы гомеологичных хромосом, в которых рекомбинация происходит случайно, в рекомбинационно отличные (диплоидные) хромосомы, в которых рекомбинация между вновь отмеченными и потенциально реорганизованными диплоидными парами никогда не происходит. Следовательно, наследственная мультилокусная внутригеномная гетерозиготность, критичная для биспории, тетраспории и полиэмбрионии, постоянно стабилизируется посредством диплоидизации. Апомиксис у несомненных диплоидных апомиктов Arabis и, возможно, у нескольких других апомиктов (диплоидных или полиплоидных), также может постоянно стабилизироваться путем диплоидизации. Наличие экстенсивной анеуплоидии или больших несбалансированных хромосомных перегруппировок перед диплоидизацией могло бы сделать моноспорию (норму) невозможной для некоторых биспоровых и тетраспоровых видов и сделать невозможным половое развитие зародышевого мешка у некоторых апомиктов. Однако, случаи полной облигатной биспории, тетраспории и апомиксиса у растений,вероятно, являются редкими, если они вовсе случаются. Н. Hjelmqvist, Variations in Embrio Sac Development, 14 Phytomorphology 186-196 (1964); AskerJerling; B.M. John et al., Comparative Embriology of Angiosperms, Vol. 1 and 2 (New York: Springer-Verlag 1992). Наоборот многие необычные раздельнополые и бесполые репродуктивные системы насекомых, амфибий и рептилий являются облигатными. В случае с растениями, большинство из аномальных репродуктивных путей отчетливо ассоциировано с гибридизацией, полиплоидией, диплоидизацией и другими цитогенетическими механизмами. E. Suomalainen et al.,Cytology and Evolution in Parthenogenesis (CRC Press, Baca Raton, FL 1987). Следовательно, такие механизмы могут также возникать в виде полигенных гибридных фенотипов, которые стабилизируют путем нормальной или сегментной аллополиплоидии, половой стерильности, диплоидизации или других цитогенетических механизмов, которые предотвращают рекомбинацию мультилокусной гетерозиготности,критичную для их поддержания.-11 006658 Типичный механизм стабилизации дифференциально воздействует на гетерозис и на дрейф генов. Например, аллополиплоидия типа ТТ Т'Т' мгновенно стабилизирует апомиксис, но существует несколько механизмов, закрепляющих мутации и редкий ауткроссинг, для улучшения фертильности таких апомиктов путем модификации исходных коадаптационных программ развития яйцеклетки. Наоборот, среди сегментных аллополиплоидных апомиктов существуют потенциально эффективные механизмы для геномной модификации. У таких апомиктов рекомбинационное смешение происходит внутри таких наборов гомеологичных хромосом, которые не непосредственно вовлечены в обсуждаемый апомиксис, который, вероятно, содержит в себе большинство. Рекомбинации внутри этих наборов могут усиливать половое развитие пыльцы, бесполое развитие яйцеклетки, партеногенез нередуцированных яйцеклеток и гетерозис. В этом смысле апомикты, возникающие как внутривидовые аутополиплоиды или слабо внутривидовые гибриды, могут быстро приобретать, путем естественной селекции и аутополиплоидизации неапомиксисных хромосомных наборов, рекомбинации, которые дают большие партии семян и высокую фертильность пыльцы. Внутригеномные рекомбинации, вредные для проявления пола женских особей,усиливают селекцию против половых ревертантов. Некоторые внутригеномные рекомбинации могут вызывать дупликацию или делецию определенных стадий развития яйцеклетки, как видно при биспории и тетраспории. В этом отношении апомиксис может служить в качестве эволюционного пускового механизма в эволюции репродуктивно новых половых видов и родов, включающих тех, которые являются биспоровыми, тетраспоровыми или полиэмбрионными. J.G. Carman, 61 Biol. J. Linnean Soc. 51-94 (1997). Наоборот, апомикты, возникающие строго в виде геномных аллополиплоидов, или ТТ Т'Т' или ТТТ Т',могут сохранять неограниченно много внутригеномных гетерозиготностей, не вполне адаптированных к апомиксису. Способы настоящего изобретения Настоящее изобретение направлено на способы создания генетически стабилизированных апомиктичных растений и генетически стабилизированных встречающихся в природе или искусственно созданных апомиктичных растений, которые демонстрируют генетическую нестабильность. Настоящее изобретение также направлено к способам контроля экспрессии апомиксиса (факультативности) с целью усовершенствования растения, производства семян и производства культур. Удобно разделить способы настоящего изобретения на 4 категории: а) определение (оценка) геномной гомеологии, факультативности и апомиксисной стабильности, b) селекция растений, амфиплоидизация и процессы мутангенеза, с) способы генного картирования и клонирования и d) способы генетической инженерии. Оценка геномной гомеологии, факультативности и стабильности апомиксиса Особенностью данного изобретения является стабилизация апомиксиса у встречающихся в природе или искусственных апомиктов путем создания кариотипической (структурной) гетерозиготности. Это легко выполнимо, если апомикты получены из растений, размножающихся половым путем, путем отбора внутривидовых или межрасовых родительских линий, которые также соответствуют требованиям дивергенции в репродуктивных программах развития яйцеклетки, как указано в WO 98/33374. Предпочитаемый метод оценки степени кариотипической гомеологии двух половых линий (рассматриваемых в качестве гибридизационных пар) включают в себя общепринятый геномный анализ, где произведенные гибриды и степень хромосомного спаривания оценивают в метафазе I в материнских клетках пыльцыJ.E. Estes et al., Grasses and Grasslands: Systematics and Ecology (University of Oklahoma Press 1982). На диплоидном гибридном уровне гомеологичное хромосомное спаривание в PMCs часто сильно превышает то, что наблюдали при амфиплоидизации диплоидного гибрида. R.R-C. Wang, An assessment of genomeanalysis based on chromosome pairing in hybrids of perennial Triticeae, 32 Genome 179-189 (1989). Следовательно, диплоидные гибриды даже с ограниченной степенью редуцированной хромосомной конъюгации в PMCs могут подходить для создания кариотипической гетерозиготности путем производства амфиплоида. Факультативность измеряют в виде процента жизнеспособных семян, которые образуются половым путем из апомиктичного растения. Предпочитаемым способом для определения этого процента является проведение анализирования потомства, в котором потомство сравнивают с материнским растением. Современные методы молекулярного фингерпринтинга являются предпочтительными вследствие их надежности и простоты применения, когда системы оптимизированы. О. LeblancA.Mazzucato, Screening(FAO, CIMMYT, ORSTOM, в печати). Степень стабильности оценивают путем проведения анализирования потомства в выбранных образцах, идентифицированных в первом поколении потомства. Совокупность потомства, члены которого являются апомиктичными как материнское растение, получают из генетически стабильного (кариотипически гетерогенного) апомиктичного материнского растения. Совокупность потомства, члены которого представлены высоким процентом половых ревертантов, поступает из генетически нестабильных апомиктов. Типично, искусственные, или встречающиеся в природе диплоидные апомикты, или встречаю-12 006658 щиеся в природе дигаплоидные апомикты, являются нестабильными. Искусственные или встречающиеся в природе полиплоидные апомикты могут или не могут быть стабильными. Селекция растений, амфиплоидизация и мутагенез Для нескольких целей настоящего изобретения применяли общепринятые методы размножения растений, как учили в стандартных текстах по селекции растений, например, Poehlman, Breeding FieldCrops (Van Nostrand Reinhold 1987). Предпочтительным способом является увеличения генетического разнообразия и комбинирующей способности половых родительских линий, для производства апомиктичных диплоидов, или полиплоидов. Селекцию растений, или генетическую инженерию применяли,чтобы генетически модифицировать два набора трансдифференцированных родительских линий видов растений, или близкородственной группы видов растений, которые дифференцированы по их репродуктивному фенотипу, таким образом, что гибридизация любого растения одного из двух наборов трансдифференцированных линий с любым из растений из другого набора трансдифференцированных линий производит апомиктичное растение или растение, которое становится апомиктичным посредством амфиплоидизации или дальнейшей гибридизации. Комбинирующую способность родительских линий улучшали методами стандартного скрещивания и селекции, или методами простого скрещивания, двойного скрещивания или мультискрещивания (ауткроссинга), которые сопровождают внутри каждого набора трансдифференцированных линий. Особенностью настоящего изобретения является трансдифференцировка новой гибридной селекционной системы, путем которой получают искусственно выведенные гибридные апомикты. Система (способ) вовлекает не только идентификацию половых инбредных родительских линий, которые выражают хорошую комбинационную способность, но и идентификацию гибридных или размноженных ауткроссингом родительских линий внутри двух наборов трансдифференцированных линий, таким образом, что эта хорошая комбинационная способность экспрессируется при гибридизации растения из одного из двух наборов трансдифференцированных линий с растением из другого набора трансдифференцированных линий. Таким образом, эта новая операционная система производит гибриды от скрещивания двух инбредных линий или множественного скрещивания, которые являются или апомиктичными, или становятся апомиктичными посредством амфиплоидизации или дальнейшей гибридизации. Таким образом,многие апомиктичные гибридные генотипы могут быть произведены (из каждого скрещивания). Кроме того, каждый индивидуальный генотип может быть наработан посредством апомиктичного образования семени для полевого испытания и/или выпуска культурного сорта растений. Следовательно, неограниченное число новых апомиктичных генотипов производят быстро. Этот метод сильно увеличивает генетическое разнообразие растений, применяемых в сельском хозяйстве, и сильно увеличивает возможность селекционеров для обеспечения разновидностями апомиктичных гибридов, которые специфически адаптированы к высоко- средне- или слабопродуктивным сельскохозяйственным регионам. Особенность настоящего изобретения простирается на определение комбинационной способности для включения развития дивергентных, но высоко гетерозиготных половых родительских линий, которые при гибридизации (или гибридизации и амфиплоидизации) дают в результате апомиктичные растения с высшей гибридной силой. Генетически гетерогенное апомиктичное потомство, полученное от скрещиваний, в которые вовлекали гетерогенные родительские линии (половые или апомиктичные) (ауткроссинг), является индивидуально оцененным за агрономически желаемые качества и отобрано для размножения в виде культурного сорта растения. Также, преимуществом способа является скрещивание факультативно апомиктичного растения с генетически дивергентными половыми или апомиктичными линиями для производства производных линий с усиленными агрономическими признаками. Для амфиплоидизации хромосомные наборы гибридов удваивали с использованием стандартных колхициновых методов, например, J. Torabinejad et al., Morphology and Genome Analyses of InterspecificHybrids of Elymus scarbus, 29 Genome 150-55 (1987). Альтернативно, могут быть использованы недавно разработанные методы культуры тканей. O. Leblanc et al., Chromosome Doubling in Tripsacum: the Production of Artificial, Sexual Tetraploid Plants, 114 Plant Breed, 226-30 (1995); CohenYao, In Vitro Chromosome Doubling of Nine Zantedeschia Cultivars, 47 Plant cell Tiss. Org. Cult. 43-49 (1996); ChalakLegave,Oryzalin Combined with Adventitious Regenerartion for an Efficient Chromosome Doubling of Trihaploid Kiwifruit, 16 Plant Cell Rep, 97-100 (1996). Частично амфиплоидные 2n+n (ВIII) гибриды часто образуются с низкой частотой (0,5 до 3%) при межвидовом возвратном скрещивании F1s, например, Z.W. Liu et al., 89 Theor. Appl. Genet. 599-605(1994), и эта частота может быть намного выше, если у гибридов существует тенденция к апомиксисуMaize- Tripsacum Polyhaploid Plants: Implications for the Transfer of Apomixis into Maize, 87 J. Hered. 108111 (1996). Таким образом, предпочитаемым способом для удвоения хромосом внутривидовых и межвидовых гибридов является использование одного или многих методов обработки колхицином (или другим известным химическим ингибитором веретена), перечисленных выше. Также предпочитаемый метод удвоения хромосом внутривидовых гибридов включает возвратное скрещивание с одним из половых родителей и подсчет хромосом в кончиках корня, чтобы определить частичную амфиплоидию (обычно триплоидию). Это является тем, за которым следует возвратное скрещивание с другим родителем для-13 006658 получения полного амфиплоида, или с тем же самым родителем для получения частичного амфиплоида(три генома от одного родителя и один геном от другого). Амфиплоидизация может предшествовать гибридизации, или следовать за гибридизацией. Традиционные методы мутационной селекции, как преподано в открытой печати, например, Poehlman, Breeding Field Crops (Van Nostrand Reinhold 1987), применяют для индукции хромосомных инверсий или транслокаций, которые изолируют от рекомбинации участки хромосом, которые содержат гены,требуемые для апомиксиса. Предпочтительные методы включают регенерацию растений с хромосомной перестройкой из культур растительных тканей, S. Jain et al., Somaclonal Variation and Induced Mutations inCrop Impovement, Current Plant Science and Biotechnology in Agriculture 32, (Kluwer Academic Publishers 1998), полученные растения с перестроенными хромосомами далее обрабатывают ионизирующей радиацией, Р.К. Gupta, Mutation Breeding in Cereals and Legumes, in S.M. Jain et al., Current Plant Scince and Biotechnology in Agriculture 32 (Kluwer Academic Publishers 1998). Использование мужских стерильных линий или процедур кастрации желательно, если растения не являются двудомными или самонесовместимыми. Гибриды производят между половыми видами или линиями, которые демонстрируют соответствующие степени дивергенции в фотопериодических ответах и в программах развития женских органов. Внутривидовые гибриды создают с использованием стандартных приемов, как преподано в текстах по растительной селекции, например, Poehlman, BreedingField Crops (1987). Успешное производство межвидовых или межродовых гибридов может нуждаться в спасительных процедурах обработки гормонами цветков соцветий и зародышей, как преподано в недавних ссылках, относящихся к широкой гибридизации, например, Z.W. Liu et al., Hybrids and Backcrossin Lehm.) A. LoveConnor]: Kariotypic and Genomic Analyses, 89 Theor. Appl. Genet. 599-605 (1994). Гибриды проверяют путем проверки их промежуточного фенотипа. Генное картирование и клонирование Особенностью данного изобретения является вовлечение контроля факультативности путем модификации экспрессии локусов количественного признака (QTLs), необходимых для факультативной экспрессии с использованием антисенсовой технологии. Предпочтительный метод начинается с картирования QTLs дивергентных половых родительских репродуктивных фенотипов, ответственных за апомиксис, встречающихся у гибридов, произведенных путем скрещивания указанных фенотипов. Метод включает производство F2 картированной популяции, состоящей из F2 потомства, полученного половым путем, факультативного искусственного F1 апомикта, произведенного путем гибридизации исходных репродуктивно дивергентных родительских линий, и идентификации молекулярных маркеров, которые ассоциированы с каждым фенотипом, например, A.W. Heusden et al., Three QTLs from Lycopersicon peruvianum Confer a High Level of Resistance to Clavibacter michiganesis ssp. Michiganesis, 99 Theor. Appl.Genet. 1068-1074 (1999). Важные QTLs затем точно картировали для данной хромосомы при помощи большой сегрегированной популяции и искусственных хромосом дрожжей (YACs), окружающий участок хромосомы изолировали с использованием фланкирующих маркеров. Затем производили космидный клон, содержащий QTL, комплементные космиды идентифицировали путем трансформации в мутант. QTL транскрипт идентифицировали путем выделения кДНК с использованием комплементных космид, например, H.Q. Ling et al., Map-based Cloning of Chloronerva, a gene Involved in Iron Uptake ofRegion at the Cre3 Nematode Resistance Locus of Wheat, 40 Genome 659-665 (1997). Альтернативно могут быть использованы бактериальные искусственные хромосомы (BACs), с которыми гораздо легче работать, для клонирования основанного на картировании. ВАС библиотеки получены для многих видов зерновых, например, S.S.Woo et al., Construction and Characterization of a bacterial Artificial Chromosome Library of Sorghum bicolor, 22 Nucleic Acids. Res. 4922-4931 (1994). Генетическая инженерия Особенностью настоящего изобретения является контроль степени факультативности путем контролирования экспрессии QTL, важной для факультативной экспрессии. Другой особенностью данного изобретения является преобразование навсегда (или обратимо) факультативных апомиктов в облигатных апомиктов путем контроля экспрессии мейоз-специфичных генов. Предпочтительным методом для совершенного облигатного апомиксиса явлется выведение или преобразование факультативно апомиктичного растения таким образом, чтобы оно содержало генетический материал, который вызывает прерывание женского мейоза, приводящее по существу к 100% образованию апомиктичных семян. Генетический материал может быть мейотическим мутантом, введенным посредством селекции, или трансгенной конструкцией промотор/ген, экспрессиия которой прерывает женский мейоз. Индуцибельная даун-регуляция трансгенной, конструкции промотор/ген, генная конструкция которой при экспрессии вызывает мейотическое абортирование, который позволяет существовать факультативному апомиксису. Альтернативно, факультативный апомиксис может возникнуть кроме как в течение индуцибельной ап-регуляции трансгенной конструкции промотор/ген, вызывая таким образом,мейотическое абортирование и по существу 100% апомиктичное образование семян.-14 006658 Конструкция промотор/ген может содержать промотор из группы промоторов, которые экспрессируются непосредственно перед или во время женского мейоза и генную конструкцию, экспрессия которой фатально прерывает мейоз, например, V.I. KlimyukJ.D.G. Jones, AtDMС 1, the Arabidopsis homologue of the yeast DMC1 gene: characterization, transposon-induced allelic variation and meiosis-associatedexpression, 11 Plant J. 1-14 (1997); PCT/GB97/03546. Трансгенный материал, который в норме является цитотоксичным для развития женского мейоцита может быть проконтролирован посредством суппрессорной молекулы, кодируемой геном, который контролируется химически индуцибельным промотором,который может быть специфическим промотором к женскому мейоциту, таким образом, что женская фертильность (факультативность) является индуцибельной в таком апомикте. Трансгенный материал может содержать ген из группы смысловых или антисмысловых генов, экспрессия которых во время мейоза фатально нарушает мейоз или является иным образом цитоксичной для женского мейоцита. Кроме того, метод для восстановления низкого уровня женской раздельнополости у трансгенно-полученного облигатного апомикта может вовлечь экспрессию суппрессора путем индукции индуцибельного промотора. Для введения трансгенного материала в растение-хозяина можно применить любой доступный метод хорошо известный в данной области. Примеры Некоторые из особенностей данного изобретения могут быть лучше оценены посредством ссылки на конкретные примеры. Должно быть понятным, что следующие примеры являются по характеру скорее иллюстративными, чем ограничивающими, и они предназначены, чтобы продемонстрировать основные учения и концепции данного изобретения, а не ограничивать изобретение. Ожидается, что специалист в данной области сумеет использовать информацию, содержащуюся в примерах и в другом месте здесь, чтобы применить настоящее изобретение к ситуациям, конкретно здесь не описанным. Пример 1. Селекция линий, подходящих для синтезирования стабильных апомиктичных растений. Особенность настоящего изобретения состоит в предоставлении процедур для отбора половых линий внутри первичных, вторичных или третичных пулов зародышевой плазмы данной сельскохозяйственной культуры с целью синтезирования стабильных факультативно апомиктичных растений (тех, которые непросто образуют половые сегреганты) из растений с половыми признаками или нестабильных факультативно апомиктичных растений. В этом примере иллюстрируют предпочтительные процедуры для использования на растениях из подкласса Dicotyledonae, а именно, половых видов из рода Antennaria и из подкласса Monocotyledonae, а именно, половых видов из родов Tripsacum и Sorghum. Ожидается, что специалист в данной области сможет успешно применить эти процедуры ко многим другим сельскохозяйственным культурам, например, рису, сахарной свекле, яблоне, вишне, томатам, сое и салату. Сейчас предпочтительной процедурой отбора подходящих половых родительских линий является(а) идентификация, из литературы, или из областей изучения, природных экотипов и немелиорированной земли, расе данных видов сельскохозяйственных культур и их близкородственных видов, которые различаются в отношении к тенеустойчивости, широте, фотопериодическим требованиям для цветения, высоте над уровнем моря и предпочитаемым увлажненностям, (b) цитоэмбриологическая характеристика физиологически и экологически дивергентных линий путем соотношения стадий мегаспорогенеза и развития зародышевого мешка со стадиями развития интегумента и массы завязи, (с) характеристика и статистический анализ цитоэмбриологических различий между линиями и (d) отбор линий, которые являются дивергентными физиологически (например, фотопериодизм), цитоэмбриологически и таксономически. В общем, растения, классифицированные как различные виды, например, пары растений, чьи гибриды являются стерильными, должны обладать достаточной геномной гомеологией, чтобы обеспечить кариотипичную гетерозиготноcть, если гибрид, произведенный между ними, является амфиплоидизированным. Половые диплоиды и полиплоиды у Anthenaria, Tripsacum и Sorghum соответствуют географическим, физиологическим, экологическим, цитоэмбриологическим и таксономическим критериям, перечисленным здесь, для создания генетически стабильных факультативно апомиктичных растений из растений с половыми признаками. В пределах всей горы Роки в Кордильерах, от полярного круга северозападной территории Канады до границы США с Мексикой есть многочисленные разновидности половых Antennaria, которые коллективно оккупируют широкий диапазон ареалов, но часто индивидуально сужены до специфичных ареалов. Вауеr, 132 Opera Botanica 53-65 (1996). Значительные различия в синхронизации мейоза относительно развития интегумента наблюдали среди этих видов (фиг. 2 и 3). В пределах Америки от 42 северной до 24 южной широты находятся многочисленные разновидности половых Tripsacum, которые также коллективно оккупируют широкий диапазон ареалов, но часто индивитуально сужены до специфических ареалов. De Wet et al., Systematics of Tripsacum dactyloides (Gramineae),69 Amer. J. Bot. 1251-57 (1982). Существенные различия в синхронизации мейоза относительно развития интегумента, сходные с теми, которые наблюдали среди подвидов Antennaria, наблюдали также среди этих видов (данные не представлены). Систематизация в пределах большей части Африканского континента, Австралии и Южной Азии показывает, что многочисленными являются половые диплоидные и полиплоидные экотипы, расы и виды Sorghum. Существенные различия в синхронизации мейоза относительно развития интегумента также наблюдали среди этих видов (фиг. 4 и 5). Отбор подходящих половых линий для создания факультативно апомиктичных растений может быть сделан из этих данных.-15 006658 Предполагают, что процедуры сбора, характеризации и отбора для частичного изменения всяких однодольных и двудольных будут оценены по достоинству. Пример 2. Создание генетически стабильных факультативных и облигатных апомиктов. В качестве инструкций использовали приемы примера 1 для получения трех и более половых линий с ранним мейозом и ранним развитием гаметофита относительно развития интегумента(-ов). Те же приемы использовали в качестве инструкций для получения трех и более половых линий близкородственных видов с поздним мейозом и поздним развитием гаметофита относительно развития интегумента(-ов). Отбирали несколько линий из каждой категории, так чтобы образование зародышевого мешка в одном наборе линий происходило приблизительно в то же время как и профаза в раннем мейозе в другом наборе линий относительно развития интегумента(-ов). Пары родительских линий (по одному растению из каждой из двух групп) гибридизировали и амфиплоиды производили, применяя стандартные процедуры,описанные выше. Будет оценено то, что генетический фон, из которого получали линии, может влиять на экспрессию апомиксиса. Таким образом, может быть необходим отбор или создание дополнительных линий, объединяющих различные генетические фоны и большее или меньшее расхождение в сроках мейоза. Факультативные апомикты, которые являются нестабильными, означающие, что они производят половых сегрегантов в результате факультативной половой репродукции, синтезировали в результате цветковой асинхронии, полученной в результате гибридизации, посредством создания искусственных диплоидных гибридов разновидностей Antennaria corymbosa (2x половой) х A.racemosa (2x половой)(фиг. 6) и искусственных диплоидных гибридов разновидностей Sorghum (2x половой) (фиг. 7). Апоспоровые зародышевые-мешки образуются у гибридов Sorghum 5-1 X 4-1 и 9-1 X 1-2 с частотой около 5% и диплоспоровые зародышевые мешки, сходные с таковыми у Tripsacum (фиг. 8), образуются у гибридовSorghum 5-2 X 9-2 с частотой около 10%. Отмечают, что дивергенция в сроках мейоза относительно развития интегумента является существенной (фиг. 5) у родительских пар, чье потомство образует диплоспоровые зародышевые мешки. Структурно гетерозиготные (стабильные) факультативные апомикты могут быть произведены от внутривидовых гибридов Antennaria и Sorghum путем удвоения их наборов хромосом с использованием способов, описанных выше. Стабилизация внутривидовых гибридов Sorghum (указанных выше) требует генетической модификации, которая вызывает абортирование женского мейоза, или образование мейотической клетки, которая не только стабилизирует апомикты, но и делает их облигатными. Это достигается внедрением мейотического мутанта в линию посредством стандартных методов гибридизации, индуцированием триплоидии посредством ВIII гибридизации, или амфиплоидизацией с последующей гибридизацией с диплоидом, или трансформацией диплоида конструкцией промотор/ген, которая является цитотоксичной для женского мейоцита, применяя способы, рассмотренные выше. С использованием индуцибельных промоторов, как рассмотрено выше, могут быть произведены генетически стабильные апомикты с индуцированной облигатной или факультативной экспрессией. Искусственный амфиплоид диплоида Tripsacum laxum (2x половой) Х T.pilosum (2x половой) является стабильным факультативным апомиктом с 50% образованием диплоспорового зародышевого мешка(фиг. 8). Скрещивание этого растения с Т. zopilotense (2x половой) или с Т. bravum (2x половой) производит стабильные облигатные апомикты с приблизительно 80% образованием диплоспорового зародышевого мешка и с 20% образованием абортивного мейоцита или образованием зародышевого мешка половым путем (фиг. 9). Пример 3. Картирование и клонирование генов, ответственных за факультативность. Генетические анализы апомиксиса проводили путем опыления половых растений пыльцой из апомиктичных растений и подсчетом яйцеклеток в потомстве при половом или апомиктичном развитии. Обычно в этих исследованиях, если обнаруживали любые апомиктично развивающиеся яйцеклетки, потомство считали апомиктичным. Например, Y. Savidan, Nature et heredite de 1=apomixie chez PanicumNat'l Acad. Sci. USA 5127-5132 (1998), собрали растения в апомиксисную категорию, в которой проценты яйцеклеток, развивающихся апомиктично, были ниже чем 12, 28, 17 и 7%, соответственно. Что же произошло в этих исследованиях (было это намеренно или нет), была идентификация минимального числа сцепленных групп, требуемых для кодирования, по меньшей мере, некоторой степени функционального апомиксиса. В некоторых случаях наблюдали пробелы среди потомства в процентном отношении яйцеклеток, экспрессирующих апомиксис, М. DujardinW.W. Hanna, Apomictic and sexual pearl millet X Pennisetum squamulatum hybrids, 74 J. Hered. 277-279 (1983), но в других случаях диапазон экспрессии был кое-где продолжительным, S. Lutts et al., 78 Euphytica 19-25 (1994). Следовательно полагают, что несколько мажорных и, возможно, минорных генов с количественными эффектами (Y. Savidan, Nature et-16 006658 Особенность данного изобретения состоит в ап-регуляции или даун-регуляции факультативности посредством модификации экспрессии QTLs с применением антисмысловой технологии. С применением способов, описанных выше, проводят QTL картирование для дивергентных половых родительских репродуктивных фенотипов, ответственных за апомиксис, который происходит в гибридах (фиг. 2-5). Важные QTLs затем тонко картировали для данной хромосомы и идентифицировали, как описано выше. Пример 4. Создание генетически стабильных высокофакультативных апомиктов с идуцибельной облигатной экспрессией или генетически стабильных облигатных апомиктов с индуцибельной высокофакультативной экспрессией. Приемы примеров с 1 по 3 применяли как руководства для создания генетически стабильных высокофакультативных апомиктов с индуцибельной облигатной экспрессией или генетически стабильных облигатных апомиктов с высокофакультативной экспрессией. В настоящем изобретении апомиксис является аналогичным компьютерной операционной системе. Особенности этой биологической операционной системы включают следующее: (i) на фермерских полях четкое "клонирование" гибридов из собственно гибридных семян - поколение за поколением, (ii) в растительных селекционных питомниках, частичная раздельнополость для улучшения растения с последующей реверсией к строгому апомиксису, (iii) большое количество быстро производимых и генетически разнообразных культурных сортов растений, специально приспособленных к разнообразным сельскохозяйственным нишам, (iv) увеличение в целом генетического разнообразия для защиты против обложного опустошения вредителями, и (v) выигрышное снижение расходов, а именно, фермеры платят меньше за семена и семеноводческие компании платят меньше на развитие превосходных разновидностей сельскохозяйственных культур. Следует отметить, что настоящее изобретение может быть воплощено в других специфических формах без отклонения от его духа или существенных характеристик, которые находятся в раскрытии пяти принципов HFA теории. Описанные стадии и материалы должны быть рассмотрены во всех отношениях только как иллюстративные, а не ограничительные, а объем изобретения указан в прилагаемой формуле изобретения, а не в приведенном описании. Все изменения, в пределах значения и эквивалентности формулы изобретения должны входить в ее объем. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения апомиктичного растения, проявляющего повышенную генетическую стабильность апомиксиса, от покрытосеменного апомиктичного родительского растения, которое проявляет генетическую нестабильность апомиксиса, предусматривающий:(a) измерение степени генетической нестабильности апомиксиса родительского растения;(b) если родительское растение проявляет генетическую нестабильность апомиксиса, получение одного или нескольких растений-потомков от родительского растения, где каждое из растений-потомков содержит двойной хромосомный набор родительского растения;(c) измерение степени генетической нестабильности апомиксиса одного или нескольких растенийпотомков;(d) сравнение степени генетической нестабильности апомиксиса одного или нескольких растенийпотомков со степенью генетической нестабильности апомиксиса родительского растения и(e) селекцию по меньшей мере одного из одного или нескольких растений-потомков, проявляющих повышенную генетическую стабильность апомиксиса по сравнению с родительским растением. 2. Способ по п.1, где одно или несколько растений-потомков получают обработкой родительского растения ингибитором веретена. 3. Способ по п.2, где ингибитор веретена представляет собой колхицин. 4. Способ по п.1, где одно или несколько растений-потомков получают культивированием родительского растения или его части в тканевой культуре. 5. Способ по п.1, где одно или несколько растений-потомков получают:(а) самоопылением родительского растения или скрещиванием родительского растения с другим растением того же вида, рода или семейства и получением первого потомства и(b) подсчет хромосом в первом потомстве и выбор амфиплоида или частичного амфиплоида,имеющего все хромосомы от родительского растения в случае самоопыления такого родительского растения или все хромосомы от родительского растения и один или несколько наборов хромосом от другого растения того же вида, рода или семейства, или все хромосомы от другого растения того же вида, рода или семейства и один или несколько наборов хромосом от родительского растения в случае скрещивания родительского растения с другим растением того же вида, рода или семейства. 6. Способ по п.5, дополнительно предусматривающий обратное скрещивание частичного амфиплоида с родительским растением или с другим растением того же самого вида, рода или семейства и получение от них второго потомства и селекцию амфиплоида, имеющего равный (четный) уровень плоидности. 7. Способ по п.5, где частичный амфиплоид является эуплоидом или анэуплоидом.-17 006658 8. Способ по п.5 или 6, где амфиплоид является эуплоидом или анэуплоидом. 9. Способ по любому из пп.1-8, дополнительно предусматривающий повышение фертильности выбранных растений-потомков путем самоопыления или гибридизации с другим растением, получение от них семян, высевание указанных семян, и селекцию полученных половым путем апомиктичных гибридных растений, которые обнаруживают повышенную частоту не сниженной фертильности яйцеклеток или партеногенез. 10. Способ получения апомиктичного сегментного аллополиплоидного растения, проявляющего повышенную генетическую стабильность апомиксиса, от покрытосеменного межсортового гибридного растения, которое проявляет генетическую нестабильность апомиксиса, предусматривающий:(a) измерение степени генетической нестабильности апомиксиса межсортового гибридного растения;(b) если межсортовое гибридное растение проявляет генетическую нестабильность апомиксиса, получение одного или нескольких растений-потомков от межсортового гибридного растения, где каждое из растений-потомков содержит двойной хромосомный набор межсортового гибридного растения, приводя к появлению одного или нескольких апомиктичных сегментных аллополиплоидных растений;(c) измерение степени генетической нестабильности апомиксиса одного или нескольких апомиктичных сегментных аллополиплоидных растений и(d) сравнение степени генетической нестабильности апомиксиса одного или нескольких апомиктичных сегментных аллополиплоидных растений со степенью генетической нестабильности апомиксиса межсортового гибридного растения для проверки того, увеличена ли генетическая стабильность апомиксиса одного или нескольких апомиктичных сегментных аллополиплоидных растений по сравнению с межсортовым гибридным растением. 11. Способ по п.10, дополнительно предусматривающий повышение фертильности одного или нескольких апомиктичных сегментных аллополиплоидных растений путем их самоопыления или гибридизации с другим растением, получение от них семян, высевание указанных семян и селекцию полученных половым путем апомиктичных сегментных аллополиплоидных растений, которые обнаруживают повышенную частоту не сниженной фертильности яйцеклеток или партеногенез. 12. Способ получения апомиктичного аллополиплоидного растения, проявляющего повышенную генетическую стабильность апомиксиса, от покрытосеменного межвидового гибридного растения, проявляющего генетическую нестабильность апомиксиса, предусматривающий:(a) измерение степени генетической нестабильности апомиксиса межвидового гибридного растения и(b) получение одного или нескольких апомиктичных аллополиплоидных растений-потомков от указанного межвидового гибридного растения и селекцию апомиктичного аллополиплоидного растенияпотомка, проявляющего повышенную генетическую стабильность апомиксиса. 13. Способ по п.12, дополнительно предусматривающий повышение фертильности выбранного апомиктичного аллополиплоидного растения-потомка путем самоопыления или гибридизации с другим растением, получение семян, высевание указанных семян и селекцию полученных половым путем апомиктичных аллополиплоидных растений, которые обнаруживают повышенную частоту не сниженной фертильности яйцеклеток или партеногенез. 14. Способ получения апомиктичного растения, проявляющего повышенную генетическую стабильность апомиксиса, от покрытосеменного, внутривидового, межсортового или межвидового гибридного растения, проявляющего генетическую нестабильность апомиксиса, предусматривающий:(a) измерение степени генетической нестабильности апомиксиса внутривидового, межсортового или межвидового гибридного растения и(b) получение апомиктичных аутополиплоидных, сегментных аллополиплоидных или аллополиплоидных растений-потомков внутривидового, межсортового или межвидового гибридного растения и селекцию апомиктичного растения, проявляющего повышенную генетическую стабильность апомиксиса. 15. Способ по п.14, дополнительно предусматривающий повышение фертильности отобранного апомиктичного растения путем самоопыления или гибридизации с другим растением, получение семян,высевание указанных семян и селекцию полученных половым путем апомиктичных растений-потомков,которые обнаруживают повышенную частоту не сниженной фертильности яйцеклеток или партеногенез. 16. Способ генетической стабилизации апомиксиса покрытосеменного, апомиктичного, внутривидового, межсортового или межвидового гибридного растения, проявляющего генетическую нестабильность апомиксиса, предусматривающий измерение степени генетической нестабильности апомиксиса внутривидового, межсортового или межвидового гибридного растения и получение растения-потомка от указанного апомиктичного внутривидового, межсортового или характеризуется нечетным увеличением плоидности, причем женский мейоз обычно прерывается, приводя к практически 100% образованию апомиктичных семян. 17. Способ по п.16, дополнительно предусматривающий повышение фертильности растенияпотомка путем самоопыления или гибридизации с другим растением, получение от них семян, высевание-18 006658 семян и селекцию полученных половым путем апомиктичных растений, которые обнаруживают повышенную частоту не сниженной фертильности яйцеклеток или партеногенез. 18. Способ генетической стабилизации апомиксиса покрытосеменного, апомиктичного, внутривидового, межсортового или межвидового гибридного растения, проявляющего генетическую нестабильность апомиксиса, предусматривающий измерение степени генетической нестабильности апомиксиса внутривидового, межсортового или межвидового гибридного растения и скрещивание этого внутривидового, межсортового или межвидового гибридного растения с мейотическим мутантным растением того же самого вида, рода или семейства и селекцию потомства, где женский мейоз обычно прерывается, приводя к практически 100% образованию апомиктичных семян. 19. Способ по п.18, дополнительно предусматривающий повышение фертильности отобранного потомства путем самоопыления или гибридизации с другим растением, получение от них семян, высевание указанных семян и селекцию полученных половым путем апомиктичных растений-потомков, которые обнаруживают повышенную частоту не сниженной фертильности яйцеклеток или партеногенез. 20. Способ получения апомиктичного растения, проявляющего повышенную генетическую стабильность апомиксиса от покрытосеменного апомиктичного родительского растения, которое проявляет генетическую нестабильность апомиксиса, предусматривающий:(a) измерение степени генетической нестабильности апомиксиса родительского растения;(b) получение растения-потомка от родительского растения путем удвоения числа хромосом указанного родительского растения или введения хромосомной аберрации, в котором рекомбинация подавляется, так что тормозится сегрегация аллелей во время мейоза; и(с) измерение степени генетической нестабильности апомиксиса растения-потомка для проверки того, что такое растение проявляет повышенную генетическую стабильность апомиксиса по сравнению с родительским растением. 21. Способ по п.20, где указанная хромосомная аберрация предусматривает транслокацию. 22. Способ по п.20, где указанная хромосомная аберрация предусматривает инверсию. 23. Способ по любому из пп.18-22, дополнительно предусматривающий повышение фертильности растения-потомка путем самоопыления или гибридизации с другим растением, получение от них семян,высевание указанных семян и селекцию полученных половым путем апомиктичных растений-потомков,которые обнаруживают повышенную частоту не сниженной фертильности яйцеклеток или партеногенез.
МПК / Метки
МПК: A01H 1/06, A01H 1/00, C12N 15/09
Метки: получения, способ, апомиктичного, растения
Код ссылки
<a href="https://eas.patents.su/22-6658-sposob-polucheniya-apomiktichnogo-rasteniya.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения апомиктичного растения</a>
Предыдущий патент: Композиция смазочного базового масла и ее применение
Следующий патент: Устройство для доставки лекарств
Случайный патент: Расклиненная трещина с высокоэффективной площадью поверхности