Способ обнаружения активности гепараназы млекопитающих и набор для осуществления способа
Формула / Реферат
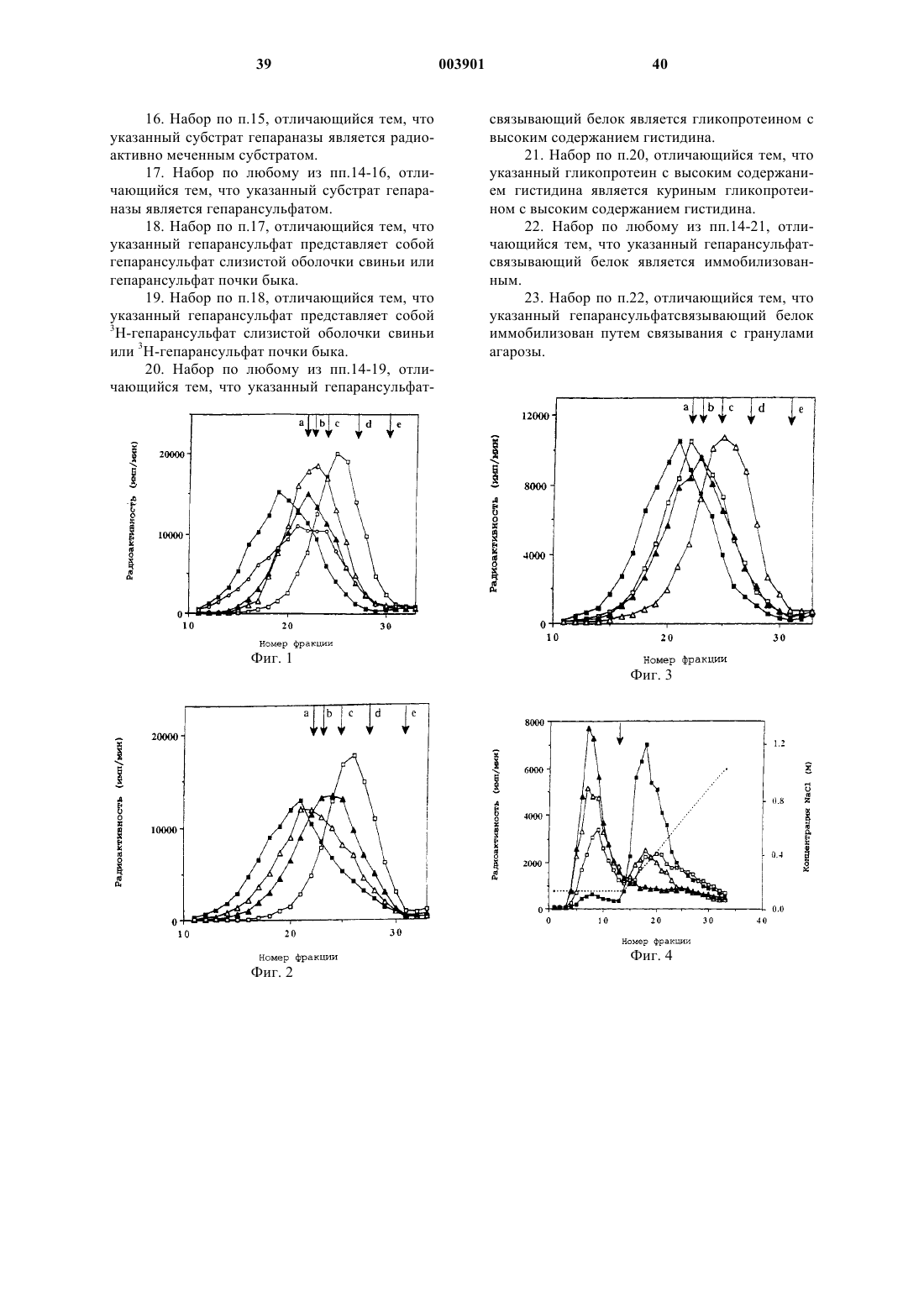
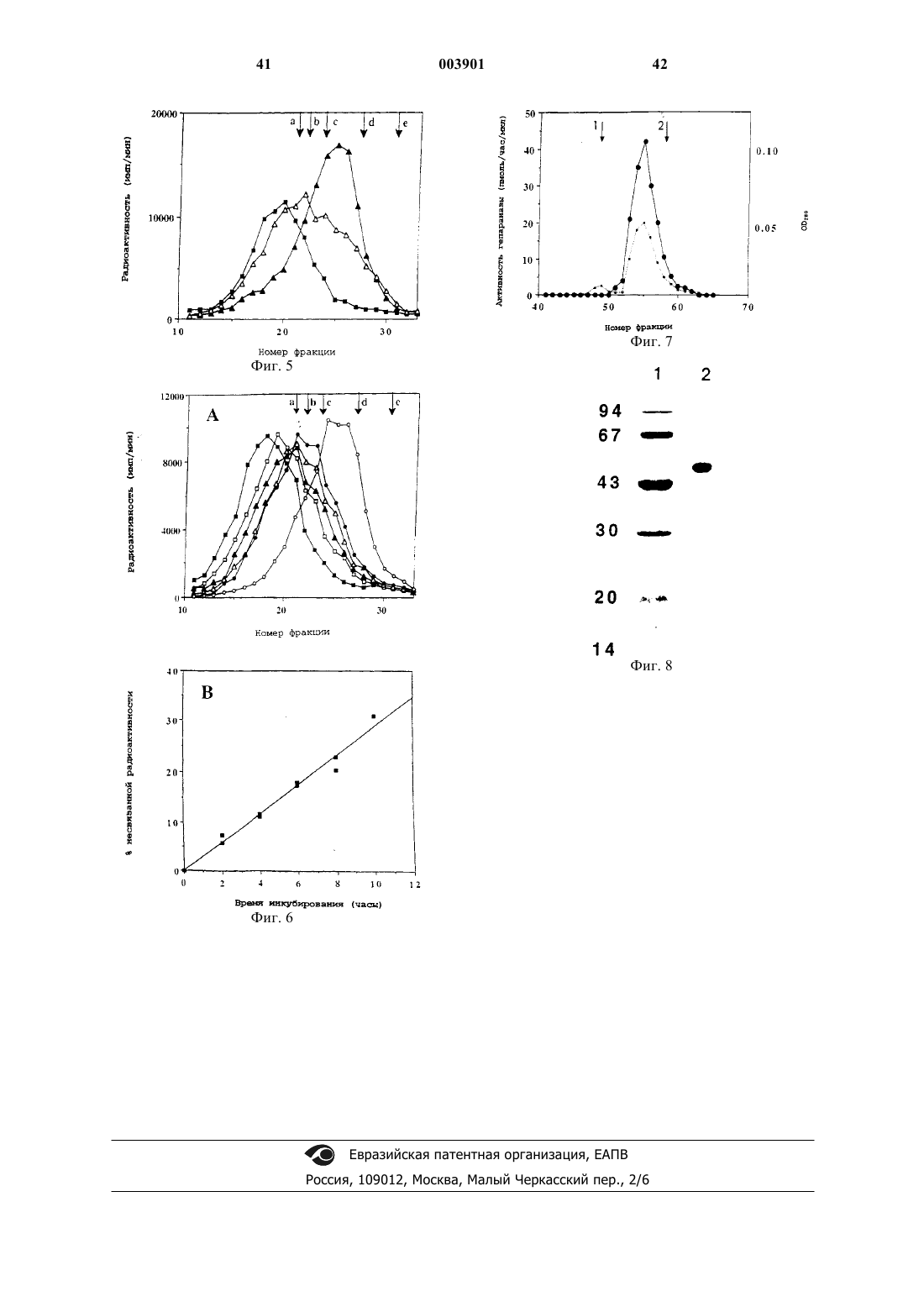
1. Способ обнаружения активности гепараназы млекопитающих в пробе, включающий в себя следующие стадии:
а) контактирование тестируемой пробы с субстратом гепараназы в течение времени и в условиях, достаточных для деградации гепараназой в пробе субстрата гепараназы, где указанный субстрат представляет собой вещество, которое связывается с гепарансульфатсвязывающим белком;
б) отделение продуктов деградации от недеградированного или частично деградированного субстрата гепараназы путем связывания недеградированного или частично деградированного субстрата гепараназы с гепарансульфатсвязывающим белком и
в) обнаружение отделенных продуктов деградации для выявления активности гепараназы в пробе.
2. Способ по п.1, отличающийся тем, что указанная проба представляет собой сыворотку млекопитающего, выбранную из сыворотки человека или сыворотки млекопитающего, не являющегося человеком.
3. Способ по п.1, отличающийся тем, что указанная проба представляет собой клеточный и тканевый гомогенат или экстракт.
4. Способ по любому из пп.1-3, отличающийся тем, что указанный субстрат гепараназы является меченым субстратом.
5. Способ по п.4, отличающийся тем, что указанный субстрат гепараназы является радиоактивно меченным субстратом.
6. Способ по любому из пп.1-5, отличающийся тем, что указанный субстрат гепараназы является гепарансульфатом.
7. Способ по п.6, отличающийся тем, что указанный гепарансульфат представляет собой гепарансульфат слизистой оболочки свиньи или гепарансульфат почки быка.
8. Способ по п.7, отличающийся тем, что указанный гепарансульфат представляет собой 3H-гепарансульфат слизистой оболочки свиньи или 3H-гепарансульфат почки быка.
9. Способ по любому из пп.1-8, отличающийся тем, что указанный гепарансульфатсвязывающий белок является гликопротеином с высоким содержанием гистидина.
10. Способ по п.9, отличающийся тем, что указанный гликопротеин с высоким содержанием гистидина является куриным гликопротеином с высоким содержанием гистидина.
11. Способ по любому из пп.1-10, отличающийся тем, что указанный гепарансульфатсвязывающий белок является иммобилизованным.
12. Способ по п.11, отличающийся тем, что указанный гепарансульфатсвязывающий белок иммобилизован путем связывания с гранулами агарозы.
13. Способ по любому из пп.1-12, отличающийся тем, что указанную пробу приводят в контакт с указанным субстратом гепараназы при температуре в пределах от 35 до 40шC, предпочтительно примерно 37шC, в течение периода времени от 2 до 48 ч, предпочтительно примерно 16 ч, при pH в диапазоне от 4,2 до 7,5, предпочтительно примерно 5,1.
14. Набор, используемый для обнаружения активности гепараназы млекопитающих в пробе способом по любому из пп.1-13, содержащий в компартментализованном виде
а) субстрат гепараназы;
б) гепарансульфатсвязывающий белок и
в) необязательно, инструкции для выполнения способа согласно изобретению по любому из указанных пп.1-13.
15. Набор по п.14, отличающийся тем, что указанный субстрат гепараназы является меченым субстратом.
16. Набор по п.15, отличающийся тем, что указанный субстрат гепараназы является радиоактивно меченным субстратом.
17. Набор по любому из пп.14-16, отличающийся тем, что указанный субстрат гепараназы является гепарансульфатом.
18. Набор по п.17, отличающийся тем, что указанный гепарансульфат представляет собой гепарансульфат слизистой оболочки свиньи или гепарансульфат почки быка.
19. Набор по п.18, отличающийся тем, что указанный гепарансульфат представляет собой 3H-гепарансульфат слизистой оболочки свиньи или 3H-гепарансульфат почки быка.
20. Набор по любому из пп.14-19, отличающийся тем, что указанный гепарансульфатсвязывающий белок является гликопротеином с высоким содержанием гистидина.
21. Набор по п.20, отличающийся тем, что указанный гликопротеин с высоким содержанием гистидина является куриным гликопротеином с высоким содержанием гистидина.
22. Набор по любому из пп.14-21, отличающийся тем, что указанный гепарансульфатсвязывающий белок является иммобилизованным.
23. Набор по п.22, отличающийся тем, что указанный гепарансульфатсвязывающий белок иммобилизован путем связывания с гранулами агарозы.
Текст
1 Область изобретения Данное изобретение относится к способу обнаружения активности гепараназы млекопитающих, присутствующей в различных тканях,клетках и жидкостях тела, в том числе в сыворотке, и как в нормальных, так и раковых клетках и тканях, который может быть применен для определения активности гепараназы млекопитающих из различных тканевых и клеточных источников в качестве диагностического инструмента для определения метастатического потенциала и для разработки специфических ингибиторов активности гепараназы и метастазирования. Данное изобретение относится также к способу очистки гепараназы млекопитающих, в частности гепараназы тромбоцитов человека, и к очищенной гепараназе млекопитающих, полученной этим способом. Доступность очищенной гепараназы млекопитающего, такой как гепараназа тромбоцитов человека, облегчит разработку ингибиторов гепараназной активности млекопитающих, получение моноклональных антител против этого фермента и идентификацию аминокислотной последовательности и последовательности кДНК этого фермента, в конечном счете, для клонирования и экспрессии этого фермента. Предпосылки изобретения Важные процессы в вовлечении в злокачественный процесс ткани переносимыми кровью злокачественными опухолевыми клетками и лейкоцитами включают в себя их адгезию к поверхности сосудистого эндотелия просвета сосуда, их прохождение через слой эндотелиальных клеток сосудов и последующую деградацию расположенной ниже базальной мембраны и внеклеточного матрикса (ЕСМ) набором секретируемых и/или находящихся на поверхности клетки протеазных и гликозидазных активностей (Nakajima et al., 1983; Schmitt et al.,1992; Vlodavsky et al., 1992). Базальная мембрана и расположенная ниже строма соединительной ткани состоит преимущественно из комплексной сети фибронектина, ламинина, коллагена IV типа и витронектина, каждый из которых взаимодействует с боковыми цепями гепарансульфата (HS) гепарансульфатпротеогликанов(Yurichenco and Schittny, 1990). Цепи HS обычно состоят из кластеров сульфатированных дисахаридных единиц (преимущественно N-сульфатированного глюкозамина, связанного 14 с остатками -L-идуроновой кислоты), разделенных слабо сульфатированными или несульфатированными участками (преимущественно дисахаридными единицами N-ацетилированного глюкозамина, связанного 14 с остатками -Dглюкуроновой кислоты) (Turnbull and Gallagher,1990, 1991). Отщепление цепей HS эндогликозидазной или гепараназной активностью, про 003901 2 дуцируемой внедряющимися клетками, может,следовательно, способствовать разрушению ЕСМ и облегчать миграцию клеток. Было показано, что гепараназная активность связана с метастатическим потенциалом линий клеток мышиной и человеческой фибросаркомы и меланомы (Nakajima et al., 1983, 1986a,b, 1988; Ricoveri and Cappelletti, 1986). Кроме того, гепараназная активность была описана в ряде тканей и типов клеток, в том числе в печени крысы (Gallagher et al., 1988; Hook et al., 1975), плаценте человека (Klein and Von Figura, 1979; Lider et al.,1989), тромбоцитах человека (Hoogewerf et al.,1995; Oldberg et al., 1980; Oosta et al., 1982),культивируемых фибробластах кожи человека(Klein and Von Figura, 1976), нейтрофилах человека (Matzner et al., 1985, 1992), активированных, но не покоящихся крысиных Т-лимфоцитах (Naparstek et al., 1984), нормальных и неопластических мышиных В-лимфоцитахet al., 1989) и эндотелиальных клетках пупочной вены человека (Bartlett et al., 1995; Godder et al.,1991). Поскольку расщепление HS является, повидимому, существенным для прохождения метастатических опухолевых клеток и лейкоцитов через базальные мембраны, исследования ингибиторов гепараназы обеспечивают потенциал для разработки новых и высокоизбирательных классов антиметастатических и противовоспалительных лекарственных средств (Coombe etViodavsky et al., 1992; Willenborg and Parish,1988). Экспрессию гепараназной активности тромбоцитами, метастатическими опухолевыми клетками и циркулирующими в кровотоке клетками иммунной системы связывали с их участием в их диапедезе и экстравазации. Исследования показали, что, хотя первоначальное улавливание метастатических опухолевых клеток эндотелием капилляров не зависит от тромбоцитов, агрегация тромбоцитов, которая может иметь место вскоре после этого, может приводить к активации и дегрануляции тромбоцитов,приводя к образованию промежутков и ретракции эндотелиальных клеток с обнажением расположенной ниже базальной мембраны для адгезии опухолевых клеток (Tanaka et al., 1986;Crissman et al., 1985; Yahalom et al., 1985). Было показано, что тромбоциты человека содержат высокие уровни гепараназной активности, способной разрушать поверхность эндотелиальных клеток, происходящих из опухоли и происходящих из ЕСМ HSPG (Bartlett et al., 1995a,1995b; Castellot et al., 1982; Hoogewerf et al.,1995; Wasteson et al., 1976, 1977; Yahalom et al.,1984), a также свободные цепи HS и гепаринаOosta et al., 1982; Wasteson et al., 1976, 1977). До настоящего времени сообщалось о трех отдельных гепараназных активностях клеток млекопи 3 тающих: гепараназа мышиной меланомы В 16,которая расщепляет только HS, гепараназа тромбоцитов человека, которая расщепляет как гепарин, так и HS, и мышиная эндоглюкуронидаза мастоцитомы, которая, как сообщалось,расщепляет синтезируемый de novo предшественник гепарина, но не гепарин или HS (Hoogewerf et al., 1995; Nakajima et al., 1988; Thunberg et al., 1982). Более недавние исследования показали, что экстракты мышиной меланомы и макрофагов были действительно способны разрушать как HS, так и гепарин, но гепарин разрушался в меньшей степени, чем экстрактами тромбоцитов человека (Graham and Underwood,1996). Хотя Hennes et al., (1988) сообщили, что происходящая из опухоли гепараназа была способна разрушать HS матрикса, но не была способна разрушать HS поверхности эндотелиальных клеток, было показано, что тромбоциты человека способствуют деградации HS поверхности эндотелиальных клеток (Wasteson et al.,1977), который является, как показано Gamse etal. (1978), более подобным гепарину по структуре. Таким образом, по-видимому, гепараназа тромбоцитов, которая способна разрушать как гепарин, так и HS, может играть решающую роль в разрушении поверхностного HS в тромбоцитах очаговой адгезии и способствует экстравазации переносимых кровью клеток. После частичной очистки гепараназы тромбоцитов человека Oldberg et al. (1980), которые определили, что этот фермент был эндоглюкуронидазой, которая действовала на Nсульфатированные, содержащие идуроновую кислоту промежуточные продукты биосинтеза гепарина, этот фермент был очищен в 240000 раз до видимой гомогенности с выходом 6% 6 колоночной процедурой (Oosta et al., 1982). Этот фермент был белком с одной субъединицей 134 кДа, который был активен в отношении 125Iгепарина и, как подтвердилось, был эндоглюкуронидазой. В последующих исследованиях было показано, что гепараназа тромбоцитов расщепляет гепариноподобный материал поверхности эндотелиальных клеток, ингибируя пролиферацию клеток гладких мышц (Castellot et al., 1982),и расщепляет антитромбин III (AT III)связывающий октасахарид между GlcAGlcNS3S (Thunberg et al., 1982), предположительно приводя к потере антикоагулянтной активности гепарина после его деградации (Oldberg et al., 1980). Хотя было показано, что очищенный фермент действует на октасахаридный субстрат, было показано, что экстракт тромбоцитов разрушает происходящие из ЕСМ цепиHS до фрагментов в 10 кДа (Yahalom. et al.,1984) и 5 кДа (Freeman and Bartlett, неопубликованные наблюдения), что свидетельствует о существовании специфических структурных мотивов, определяющих сайт расщепления. Размер продуктов расщепления гепарина после действия гепараназы тромбоцитов не был определен(Graham and Underwood, 1996; Oldberg et al.,1980; Oosta et al., 1982). Однако недавно Hoogewerf et al. (1995) опубликовали данные об очистке в 4100 раз гепараназной активности тромбоцитов человека с выходом 8%, которая,как было показано, является эндоглюкозаминидазой, которая расщепляет как гепарин,так и HS в основном до дисахаридов, что определялось по уровню радиоактивной метки продуктов расщепления. Активность обнаруживалась в субъединице 8-10 кДа СХС хемокинов, в активирующем соединительную ткань пептидеIII (CTAP-III) и активирующем нейтрофилы пептиде-2 (NAP-2), которые являются членами семейства основных белков тромбоцитов. В противоположность этому, Graham and Underwood (1996) показали, что гепараназная активность в экстрактах тромбоцитов человека имела молекулярную массу 40-60 кДа и расщепляла как HS, так и гепарин, хотя размер продуктов деградации не был определен. Разрешение указанных выше различий в молекулярном размере (8-134 кДа), субстратной специфичности (является ли этот фермент эндоглюкуронидазой или эндоглюкозаминидазой) и размере продуктов расщепления субстрата(дисахаридов 5-10 кДа) требует очистки фермента (ферментов) до гомогенности с высоким выходом. Хотя некоторые результаты исследования субстратной специфичности фермента тромбоцитов были опубликованы (Oldberg et al.,1980; Oosta et al., 1982; Thunberg et al., 1982),удивительно мало сообщалось об ингибировании этого фермента сульфатированными полисахаридами (подобно исследованиям Nakajimaet al. (1986 а и b, об ингибировании гепараназной активности опухолевых клеток, кроме использования некоторых модифицированных гепаринов и самого гепарина для ингибирования деградации тромбоцитами связанных с ЕСМ HSPG (Eldor et al., 1987). Это особенно удивительно в связи с потенциально важной ролью тромбоцитов во время начальных стадий экстравазации опухолевых клеток. Для очистки и характеристики гепараназных активностей млекопитающих и для скрининга и разработки эффективных ингибиторов гепараназы требуется простой и быстрый тест на гепараназную активность. Однако прежние гепараназные тесты были громоздкими и требующими длительного времени как для приготовления радиоактивно меченного субстрата,так и для отделения продуктов деградации от нерасщепленного субстрата. Часто тесты гепараназы включали в себя биосинтетическое радиоактивное мечение связанных с ЕСМ HSPG и регистрацию деградации цепи HS методом гельфильтрации, радиоактивно меченного материала, высвобождающегося из ЕСМ (Bartlett et al.,1995; Viodavsky et al., 1992 и имеющиеся в них ссылки). Такой подход имеет основной недостаток, заключающийся в том, что деградация це 5 пей HS в ЕСМ включает в себя синергическое действие протеаз, которые необходимы для обнажения цепей HS для последующей гепараназной атаки (Bar-Ner et al., 1986; Benezra et al.,1992; Vlodavsky et al., 1988). Кроме того, большинство гепараназных тестов требовали интенсивной деградации радиоактивно меченного субстрата HS (или происходящих из ЕСМHSPG) для возможности отделения деградированного продукта от субстрата при помощи гель-фильтрации (Bartlett et al., 1995; Klein andVon Figura, 1979; Nakajima et al., 1986a; Vlodavsky et al., 1992), хотя расщепление цепей HS в единственном сайте может быть достаточным для создания возможности прохождения лейкоцитов и опухолевых клеток через базальную мембрану. Были разработаны также твердофазные гепараназные тесты, в которых химически и биосинтетически радиоактивно меченный гепарин и цепи HS были прикреплены к твердому носителю, причем высвобождение радиоактивной метки из этого твердого носителя является мерой активности фермента (Nakajima et al.,1986a; Oosta et al., 1982; Sewell et al., 1989). Однако такие тесты имеют недостаток, заключающийся в том, что иммобилизованный субстрат может быть менее доступным для гепараназного фермента млекопитающих и связывание радиоактивно меченного субстрата с твердым носителем, через восстанавливающий конец субстрата, является сложной и неэффективной процедурой. В предыдущих исследованиях как гепарин, так и HS метили радиоактивным йодом при природно встречающихся остатках глюкозамина (Oosta et al., 1982) или N-ацилированием частично де-N-сульфатированного субстрата(Nakajima et al., 1986a). Однако такие процедуры могут приводить к маскированию или к созданию новых сайтов расщепления гепараназой. Сущность изобретения В одном аспекте данное изобретение обеспечивает способ обнаружения активности гепараназы млекопитающих в пробе, такой как ткань, клетки или жидкости тела человека. В соответствии с этим аспектом, данное изобретение обеспечивает способ обнаружения активности гепараназы человека в пробе, включающий в себя следующие стадии:(i) контактирование тестируемой пробы с субстратом гепараназы в течение времени и в условиях, достаточных для деградации гепараназой в этой пробе субстрата гепараназы;(ii) отделение продуктов деградации от недеградированного или частично деградированного субстрата гепараназы путем связывания недеградированного или частично деградированного субстрата гепараназы гепарансульфатсвязывающим белком; и(iii) регистрацию отделенных продуктов деградации для выявления активности гепараназы в пробе. 6 В этом аспекте данное изобретение обеспечивает также набор для использования в регистрации гепараназной активности млекопитающих в пробе, который включает в себя, в отдельных компартментах:(iii) необязательно, инструкции для выполнения способа данного изобретения, описанного выше в общих чертах. В другом аспекте данное изобретение обеспечивает новую процедуру для быстрой очистки гепараназной активности млекопитающих, более конкретно, гепараназной активности тромбоцитов человека, а также очищенную гепараназу млекопитающих, полученную согласно этой процедуре. В соответствии с этим аспектом, данное изобретение обеспечивает способ очистки гепараназы человека из содержащего гепараназу материала, включающий в себя следующие стадии:(i) контактирование содержащего гепараназу материала с аффинным хроматографическим матриксом с иммобилизованным лектином в присутствии детергента для связывания гепараназной активности с этим матриксом;(ii) элюцию первой очищенной содержащей гепараназу фракции из этого матрикса;(iii) необязательно, контактирование первой очищенной содержащей гепараназу фракции с аффинным хроматографическим матриксом с иммобилизованным ионом металла;(iv) контактирование первой очищенной содержащей гепараназу фракции с матриксом краситель-смола для связывания гепараназной активности с этим матриксом краситель-смола; и(v) элюцию второй очищенной содержащей гепараназу фракции из матрикса красительсмола. В этом аспекте данное изобретение обеспечивает также, по существу, очищенную гепараназу человека, полученную по способу, описанному в общих чертах выше, в частности, по существу, очищенную гепараназу тромбоцитов человека, отличающуюся тем, что она имеет нативную молекулярную массу (Mr) примерно 50 кДа, выявляемую при анализе методами гельфильтрационной хроматографии, и электрофореза в ДСН-ПААГ, и тем, что она деградирует как гепарин, так и гепарансульфат. По существу, очищенная гепараназа тромбоцитов человека данного изобретения деградирует гепарин бычьих легких и слизистой оболочки свиньи от 12 до 6 и 4 кДа соответственно, и гепарансульфат слизистой оболочки свиньи ступенчато от 22 кДа до фрагментов 5 кДа, согласно гель-фильтрационному анализу. Способ очистки гепараназы согласно изобретению, описанный в общих чертах выше,может быть также использован для очистки 7 других гепараназ, в том числе гепараназы печени крысы, клеток 13762 MAT аденокарциномы крысы и клеток карциномы ободочной кишки человека НСТ 116. По существу, очищенная гепараназа клеток MAT и НСТ имеет одинаковую молекулярную массу (Mr) с гепараназой тромбоцитов человека, обсуждаемой выше, тогда как, по существу, очищенная гепараназа печени крысы имеет нативную Mr примерно 45 кДа и обнаруживает 3 полосы при электрофорезе в ДСН-ПААГ между 43 и 47 кДа. Во всем описании, если нет других указаний, слово "включают" или его вариации, такие как "включает" или "включающий", следует понимать как включение указанного целого числа или группы целых чисел, но не исключение какого-либо целого числа или группы целых чисел. Подробное описание изобретения В одном аспекте данное изобретение относится, в частности, к обнаружению гепараназной активности млекопитающих в сыворотке, в том числе в сыворотке раковых пациентов, а также в различных тканевых и клеточных гомогенатах или экстрактах, в том числе, например,гомогенатах тромбоцитов человека, клеток карциномы ободочной кишки, эндотелиальных клеток пупочной вены и клеток аденокарциномы молочной железы крыс (как метастатических, так и неметастатических вариантов) и печени. Этот способ может быть использован для определения гепараназной активности в сыворотках, клеточных и тканевых гомогенатах или экстрактах как человека, так и не человека (например, крысы или мыши). Предпочтительно, субстратом гепараназы является меченный субстрат, более предпочтительно радиоактивно меченный субстрат. Этим субстратом предпочтительно является гепарансульфат (HS) и особенно предпочтительными субстратами являются 3H-HS слизистой оболочки свиньи и 3H-HS бычьих почек. Предпочтительно, HS слизистой оболочки свиньи является частично де-N-ацетилированным и повторно Nацетилированным 3H-уксусным ангидридом с получением желательного радиоактивно меченного субстрата. Как описано в общих чертах выше, тестируемую пробу приводят в контакт с субстратом гепараназы в течение времени и в условиях,достаточных для деградации субстрата гепараназой, если она присутствует в пробе. Подходящие периоды инкубации и условия могут быть легко определены без чрезмерного экспериментирования. Например, инкубация пробы с субстратом может проводиться при температуре в диапазоне 35-40 С, предпочтительно примерно 37 С, в течение периода времени от 2 до 48 ч,предпочтительно примерно 16 ч, при рН в диапазоне от 4,2 до 7,5, предпочтительно примерно рН 5,1. Предпочтительно стадию инкубации проводят в присутствии бычьего сывороточного 8 альбумина, N-ацетилманнозамина и/или детергента, такого как Тритон Х-100. Как описано подробно ниже, гепараназная активность при подходящих периодах инкубирования и условиях вызывает деградацию предпочтительного субстрата гепарансульфата слизистой оболочки свиньи ступенчато от 22 до 17, затем до 8 и, наконец, до фрагментов в 5 кДа. Отделение продуктов деградации от недеградированного или частично деградированного субстрата гепараназы проводят связыванием с гепарансульфат-связывающим белком. В применении здесь, термин "гепарансульфатсвязывающий белок" включает в себя (но не ограничивается ими) гепарин-связывающие белки. Особенно предпочтительным гепарансульфат-связывающим белком для использования в данном изобретении является богатый гистидином гликопротеин. Более предпочтительно, богатым гистидином гликопротеином(HRG) является куриный HRG, но могут быть использованы также другие HRG. Однако должно быть понятно, что данное изобретение простирается и на применение других гепарансульфат- и гепарин-связывающих белков, отличных от HRG, в том числе, например, ингибиторов протеаз, таких как антитромбин III и кофактор гепарина II; липопротеины плазмы, такие как аполипопротеин В-100 и аполипопротеин Е; факторы роста, такие как кислый и щелочной факторы роста фибробластов, фактор роста сосудистого эндотелия, фактор роста гепатоцитов и тромбоцитарный фактор роста; белков внеклеточного матрикса, таких как ламинин, коллаген и эластин; ферментов, таких как липопротеинлипаза, супероксиддимутаза,катепсин G, эластаза и бактериальные гепаринлиазы I, II и III; и других подходящих связывающих белков, таких как тромбоцитарный фактор 4, фактор фон Виллебранда и тромбоглобулин. Данное изобретение охватывает также пептиды, произведенные из этих гепарансульфат- и гепарин-связывающих белков, в частности, HRG, которые содержат область связывания гепарансульфата или гепарина. Предпочтительно отделение проводят путем связывания с иммобилизованным гепарансульфат-связывающим белком. Можно использовать любой подходящий способ иммобилизации, однако, в настоящее время предпочтительно иммобилизовать HRG или другой подходящий связывающий белок путем связывания с гранулами агарозы, более конкретно, Сефарозы. В этом предпочтительном аспекте гранулыHRG-Sepharose могут быть загружены в колонку и инкубационную смесь наносят на нее и промывают через колонку для связывания недеградированного или частично деградированного субстрата, тогда как продукты деградации не связываются или связываются менее эффективно с гранулами HRG-Sepharose. АльтернативноHRG или другой подходящий связывающий 9 белок может быть добавлен к инкубационной смеси для связывания недеградированного или частично деградированного комплекса субстрата гепараназы, и этот комплекс может быть затем отделен, например, иммобилизацией на субстрате (таком как Immobilon или StrataClean),тогда как деградированные фрагменты субстрата гепараназы остаются в инкубационной смеси после удаления иммобилизованного комплекса,например, центрифугированием или фильтрованием. В конечной стадии способа этого аспекта данного изобретения отделенные продукты деградации регистрируют для обнаружения присутствия гепараназной активности в тестируемой пробе. Эта стадия может включать в себя количественное или качественное регистрирование продуктов деградации. При использовании радиоактивно меченного субстрата гепараназы, такого как 3H-HS слизистой оболочки свиньи, стадия регистрирования может состоять из определения уровней радиоактивности несвязанных продуктов деградации. Данное изобретение обеспечивает в этом аспекте новый способ отделения продуктов деградации от субстрата гепараназы с использованием преимущества уменьшенной аффинности расщепленных продуктов деградации гепараназы в отношении гепарансульфат-связывающего белка, такого как HRG, в частности, куриного богатого гистидином гликопротеина (cHRG). Инкубационные смеси наносят на колонкиcHRG-Sepharose, причем несвязанный материал соответствует продуктам гепараназной деградации. Активность гепараназы определяют в гомогенатах различных клеток и тканей человека,крысы и мыши. Например, высокометастатические клеточные линии аденокарциномы молочной железы крысы и мышиной меланомы имели в 4-10 раз большую гепараназную активность в сравнении с неметастатическими вариантами,что подтверждает корреляцию гепараназной активности с метастатическим потенциалом. Раковые пациенты (человек) имели вдвое более высокие уровни гепараназы в сыворотке, чем нормальные здоровые взрослые пациенты. Этот аспект данного изобретения обеспечивает новый, простой и быстрый количественный тест для обнаружения гепараназной активности млекопитающих в отношении природного радиоактивно меченного субстрата, с помощью которого можно зарегистрировать минимальное число расщеплений цепей HS, которое, вероятно, имеет место in vivo, и который основан на новом принципе, а именно, на потере сайта связывания белка на цепях HS после расщепления цепей. В этом тесте используется преимущество исходного наблюдения, что HS-связывающий белок плазмы HRG маскирует сайты расщепления гепараназой на цепях HS. После расщепления гепараназой радиоактивно меченые фрагменты HS (продукты) не связываются мини 003901 10 колонками гранул сефарозы со связанным HRG,в отличие от оставшегося интактным и частично расщепленного субстрата, что делает возможным быстрое отделение расщепленного продукта от субстрата. Тест этого аспекта данного изобретения имеет ряд преимуществ по сравнению с общепринятыми тестами, заключающихся в (а) легкости получения относительно больших количеств радиоактивно меченного природного субстрата при сохранении нативной структуры, (b) возможности быстрого и одновременного определения большого количества проб и (с) возможности точного количественного определения гепараназной активности путем регистрации расщепления одного сайта субстрата. В другом аспекте данное изобретение относится к очистке гепараназы млекопитающих из содержащего гепараназу материала. Содержащий гепараназу материал, который применяют в качестве исходного материала в способе данного изобретения, может быть любым источником гепараназной активности млекопитающих, например, клетками НСТ карциномы ободочной кишки человека, клетками 13762MAT аденокарциномы молочной железы крысы или тканью печени крысы. Однако данное изобретение относится, в частности, к очистке гепараназы тромбоцитов человека, и подходящий источник этого материала получают солюбилизацией ферментативной активности из гомогената замороженных промытых тромбоцитов человека. Содержащий гепараназу материал подвергают аффинной хроматографии с иммобилизованным лектином, предпочтительно хроматографии на конканавалин А-Сефарозе, в присутствии детергента (такого как Тритон Х-100) для связывания гепараназной активности на хроматографической колонке. Элюция связанной гепараназной активности дает первую очищенную содержащую гепараназу фракцию. Затем, необязательно и предпочтительно,первую очищенную содержащую гепараназу фракцию подвергают аффинной хроматографии на колонке с иммобилизованным ионом металла(IMAC), предпочтительно с использованием матрикса, такого как Zn2+-хелатирующая сефароза, который не связывает гепараназную активность, но удаляет другие примесные белки. Затем первую очищенную содержащую гепараназу фракцию подвергают хроматографии на колонке с красителем-смолой, предпочтительно соединенной последовательно с матриксомIMAC, вновь для связывания гепараназной активности. Подходящие матриксы красительсмола включают в себя матрикс Blue-A-agarose(Синий А-агароза), хотя могут быть использованы другие красители, такие как Reactive Red(Реактивный Красный), а также другие носители-матриксы, такие как Сефароза и акриламид. За элюцией второй очищенной содержащей ге 11 параназу фракции из матрикса краситель-смола может следовать хроматография на октилагарозе, которая опять связывает примесные белки без связывания гепараназной активности. Окончательная очистка второй очищенной содержащей гепараназу фракции может проводиться гель-фильтрационной хроматографией,например, хроматографией на Superose 12, с последующим необязательным концентрированием очищенного фермента. Как описано выше, продукт, полученный в соответствии с этим аспектом данного изобретения, является, по существу, очищенной гепараназой млекопитающего, в частности, очищенной гепараназой тромбоцитов человека. Термин "по существу, очищенный" в применении к данному описанию означает, что продукт был подвергнут процедуре очистки таким образом, что активность гепараназного фермента, по меньшей мере, в 1000 раз, предпочтительно, по меньшей мере, в 1500 раз превышает активность исходного содержащего гепараназу материала. Предпочтительно также, чтобы, по существу, очищенная гепараназа млекопитающего являлась гомогенной и предпочтительно содержала, по меньшей мере, 75 вес.%, даже более предпочтительно, по меньшей мере, 85 вес.% и наиболее предпочтительно, по меньшей мере,95-99 вес.% фермента гепараназы, относительно других белков, с которыми она обычно связана в ее нативной форме. В соответствии с этим аспектом данного изобретения гепараназа тромбоцитов человека была очищена до гомогенности из предварительно замороженных, промытых тромбоцитов. Было показано, что тромбоциты человека содержат очень высокие количества гепараназной активности по сравнению с метастатическими опухолевыми клетками и другими типами клеток при выражении активности на мг белка. В одном варианте этого аспекта способа данного изобретения, который описан подробно в примере ниже, гепараназа тромбоцитов человека была очищена в 1900 раз до гомогенности с выходом 19% при помощи 5-колоночной процедуры, которая состоит из хроматографии на конканавалин А-Сефарозе, Zn2+-хелатирующей Сефарозе, Blue А-агарозе, октил-агарозе и гельфильтрационной хроматографии. Та же самая процедура очистки может быть использована для очистки других гепараназных активностей млекопитающих, например, из клеток НСТ 116 карциномы ободочной кишки человека, клеток 13762 MAT аденокарциномы молочной железы крысы и из печени крысы. Гепараназа тромбоцитов человека, которая участвует в деградации как гепарина, так и HS, имела нативную молекулярную массу 50 кДа при анализе методом гель-фильтрационной хроматографии и электрофореза в ДСН-ПААГ. Этот фермент расщеплял HS слизистой оболочки свиньи ступенчато от 22 кДа-фрагментов до фрагментов в 17, 10 и, 003901 12 наконец, в 5 кДа, тогда как гепарин бычьего легкого и гепарин слизистой оболочки свиньи расщеплялся от фрагментов в 12 кДа до фрагментов в 6 и 4 кДа соответственно согласно гель-фильтрационному анализу. Дополнительные детали данного изобретения будут очевидными из подробного описания следующего далее примера, который включен для иллюстрации, но не для ограничения данного изобретения, и сопутствующих чертежей. На чертежах: фиг. 1 - деградация HS в зависимости от рН инкубационной смеси. HS инкубировали с гомогенатом крысиных клеток 13762 MAT при рН 4,2 (О), 5,1 ( ), 6,5 и 7,5 и в отсутствие добавленного фермента при рН 5,1 в течение 16 ч при 37 С. Инкубационные смеси фракционировали методом гель-фильтрационной хроматографии на Superose-6. Представленные стандарты молекулярных масс (Mr): а) 16,7,b) 10,6, с) 6,7, d) 3,1 и е) 0,2 кДа. В отношении деталей см. раздел "Методы"; фиг. 2 - деградация HS в зависимости от времени инкубации. HS инкубировали с гомогенатом крысиных клеток 13762 MAT при рН 5,1 в течение 2 , 4 и 16 ч ( ) и в отсутствие добавленного фермента в течение 4 чпри 37 С. Инкубационные смеси фракционировали гель-фильтрационной хроматографией наSuperose-6. Стандарты Mr а-е соответствуют описанным на фиг. 1. В отношении деталей см. раздел "Методы"; фиг. 3 - деградация HS гомогенатами метастатических и неметастатических клеточных линий аденокарциномы молочной железы крысы. HS инкубировали при рН 5,1 в течение 16 ч при 37 С без фермента , с гомогенатами неметастатических вариантов DMBA-Sask ( ) и 13762 MAT (J-клон)и высокометастатическими клеточными линиями 13762 MAT иDMBA-8A , показанными вместе для удобства. Инкубационные смеси фракционировали гель-фильтрационной хроматографией наSuperose-6. Стандарты Mr а-е соответствуют описанным на фиг. 1. В отношении деталей см. раздел "Методы"; фиг. 4 - деградация HS в зависимости от времени инкубации и аффинности расщепленных продуктов HS в отношении cHRGSepharose. HS при рН 5,1 в течение 2 ( ), 4 и 16 чи в отсутствие добавленного фермента в течение 4 чпри 37 С. Инкубационные смеси наносили на колонку cHRG-Sepharose в PBS,промывали PBS и элюировали градиентом NaCl. Стрелка указывает начало градиента NaCl. -,Концентрация NaCl. В отношении деталей см. раздел "Методы"; фиг. 5 - ингибирование деградации HScHRG. HS инкубировали при рН 5,1 в течение 8 ч при 37 С в отсутствие добавленного фермента или cHRGи с гомогенатом клеток 13762cHRG. Инкубационные смеси фракционировали гель-фильтрационной хроматографией наSuperose-6. Стандарты Mr а-е соответствуют описанным на фиг. 1. В отношении деталей см. раздел "Методы"; фиг. 6 - деградация HS в зависимости от времени инкубации. HS инкубировали с гомогенатом крысиных клеток 13762 MAT при рН 5,1 в течение 2 ( ), 4 , 6 , 8 и 10 ч (О) и в отсутствие добавленного фермента в течение 4 чпри 37 С. Инкубационные смеси разделяли и фракционировали А) гель-фильтрационной хроматографией на Superose-6 и В) связыванием с колонкой cHRG-Sepharose, где несвязанную фракцию определяли в каждой временной точке. Стандарты Mr а-е соответствуют описанным на фиг. 1. В отношении деталей см. раздел "Методы"; фиг. 7 - хроматография на Superose 12 гепараназы тромбоцитов человека. Гепараназу тромбоцитов из стадии 4 очищали гельфильтрацией, как описано в разделе Методы. Фракции анализировали на гепараназную активность (О) и подвергали мониторингу на белок (А 280). Стрелки 1 и 2 указывают Ve для бычьего сывороточного альбумина и овальбумина соответственно; фиг. 8 - электрофорез в ДСН-ПААГ очищенной гепараназы тромбоцитов человека. Очищенную гепараназу тромбоцитов человека стадии 5 восстанавливали дитиоэритритолом и подвергали электрофорезу в 10% полиакриламидном геле. В отношении экспериментальных деталей см. раздел "Методы". Дорожка 1, стандарты Mr; дорожка 2, гепараназа стадии 5. Пример 1. Используемые аббревиатуры: bFGF, щелочной фактор роста фибробластов; BSA, бычий сывороточный альбумин; cHRG, куриный богатый гистидином гликопротеин; CNBr, цианогенбромид; CR-HS, карбоксил-восстановленный гепарансульфат; ЕСМ, внеклеточный матрикс;GlcA, глюкуроновая кислота; GlcNAc, Nацетилированный глюкозамин; GlcNS, Nсульфатированный глюкозамин; GlcNS3S, глюкозамин-N,3-дисульфат; hHRG, богатый гистидином гликопротеин человека; HRG, богатый гистидином гликопротеин; HS, гепарансульфат;HSPG, гепарансульфатпротеогликан; HUVEC,эндотелиальные клетки пупочной вены человека; IdoA2S, 2-сульфат идуроновой кислоты;NAM, N-ацетилманнозамин; PBS, забуференный фосфатом солевой раствор.I. Материалы Произведенные из гепарина стандарты молекулярных масс (Mrave) 16,7, 10,6, 6,7 и 3,1 кДа были получены в виде подарка из Nova NordiskHS слизистой оболочки свиньи (ORG 553) был 14 подарком из Organon Int. Bv, (Oss, The Netherlands). Pharmacia Fine Chemicals (Uppsala, Sweden) поставляла колонки PD-10, ДЭАЭСефарозу и активированную цианогенбромидом Сефарозу 4 В. Sigma Chemical Co. (St. Louis,МО) поставляла кристаллический бычий сывороточный альбумин, бычий легочный гепарин,хондроитин-АВС-лиазу, гидразингидрат и гидразинсульфат. 3H-уксусный ангидрид (500 мКи/ммоль) в виде раствора в толуоле получали из Amersham International (Sydney, Australia).Beckmann (Gladesville, Australia) поставляла готовую к применению сцинтилляционную жидкость. Dowex AG50W-Х 8 (100-200 меш; Н+ форма) получали из Bio-Rad Laboratories (Richmond, CA). Следующие клеточные линии культивировали и собирали, как описано ранее: метастатические карциномы ободочной кишки человека НСТ 116 (Schlechte et al., 1989) и KM 12 SM(Morikawa et al., 1988); метастатическую мышиную меланому B16-F10, высокометастатические аденокарциномы молочной железы крысы 13762MAT и DMBA-8 А и их неметастатические варианты J-клон и DMBA-Sask (Parish et al., 1992); клеточную линию гладких мышц человека,фибробластов легкого человека и кератиноцитов человека (KJD). Тромбоциты человека получали по способу Bartlett et al. (1995). Линии клеток мышиной легочной карциномы Льюиса(LLC) вариант) и мышиной легочной карциномы (метастатический (А 3 а) и неметастатический(SP1) вариант) были подарками от доктораJames W. Dennis, Samuel Lunenfeld Research Institute, Mount Sinai Hospital, Toronto, Canada и доктора Lea Eisenbach, Department of Immunology, The Weizmann Institute of Science, Rehovot,Israel, соответственно. Осадки клеток из этих клеточных линий поставлялись в замороженном виде (-80 С) доктором Robin Anderson, PeterMacCallum Cancer Institute, Melburn, Australia. Гомогенаты клеток готовили суспендированием 106 клеток или 108 тромбоцитов (которые предварительно были промыты в нормальном солевом растворе) в 0,2 мл 0,1% (об/об) водного Тритона Х-100 и разрушением посредством замораживания и оттаивания три раза в смеси твердый СО 2/этанол. Свежеиссеченные печени из 10-недельных крыс Fischer F344 гомогенизировали в 3 объемах (м/об.) 15 мМ диметилглутаратного буфера,рН 6,0, содержащего 0,5 М NaCl, при помощи политронного гомогенизатора. Сыворотку и как онкогенную, так и смежную с ней нормальную ткань легких раковых больных (людей) получали в замороженном виде (-80 С) из Royal NorthShore Hospital, Sydney, Australia. Эту ткань оттаивали и гомогенизировали, как описано выше. Замороженную сыворотку из раковых пациентов и здоровых волонтеров оттаивали и диализовали в течение 16 ч при 4 С против нормаль 15 ного солевого раствора. Концентрации белка определяли при помощи набора для определения белка Bio-Rad Coomassie (Bio-Rad Laboratories, Richmond, CA) с использованием бычьего сывороточного альбумина (БСА) в качестве стандарта.II. Методы Радиоактивно меченный гепарансульфат: Неочищенный гепарансульфат слизистой оболочки кишечника свиньи ORG553 (100 мг) растворяли в 2 мл Н 2 О, диализовали в течение 4 ч против 2 л нормального солевого раствора и в течение 16 ч против 2 л Н 2 О при 4 С в диализной трубке с отсечением 10 кДа. Диализованный раствор смешивали с 2 мл 0,1 М Трис-HCl,рН 8,0, содержащим 0,1 мг/мл БСА и 2 единицы хондроитин-АВС-лиазы, и инкубировали при 37 С в течение 16 ч. После диализа при 4 С в течение 16 ч против 2 л PBS раствор наносили на колонку ДЭАЭ-Сефарозы (1,0 х 6,0 см),уравновешенную в PBS. Колонку последовательно промывали PBS и 0,3 NaCl (пo 12 мл) перед элюцией 10 мл 2 М NaCl и затем лиофилизировали. Твердое вещество растворяли в минимальном количестве H2O и обессоливали при помощи колонки Pharmacia PD-10. Элюент,появляющийся впереди NaCl, регистрируемый добавлением капли 20% раствора нитрата серебра, лиофилизировали с получением 33 мг очищенного гепарансульфата. Очищенный гепарансульфат (26 мг) растворяли в гидразингидрате (1 мл), содержащем гидразинсульфат (20 мг) и смесь нагревали при 100 С в течение 2 ч в закрытом крышкой стеклянном флаконе. Смесь охлаждали и сушили в потоке азота. Добавляли толуол (1 мл), смесь сушили и эту процедуру повторяли еще два раза. Остаток растворяли в 2 мл 1 М NaCl, обессоливали на колонке PD-10 и обессоленный материал пропускали через колонку Dowex 50X-8(Na+ форма), которую промывали еще 10 мл Н 2 О. Объединенные проходящую фракцию и промывки лиофилизировали с получением 19 мг частично де-N-ацетилированного гепарансульфата. Де-N-ацетилированный гепарансульфат(19 мг) растворяли в 1 мл 0,5 М NaHCO3, содержащем 10% (об/об) метанола охлаждали до 0 С в бане со льдом и добавляли 0,1 мл 3Hуксусного ангидрида (5 мКи, 500 мКи/ммоль) в толуоле и смесь перемешивали энергично в течение 3 ч при 0 С. Добавляли еще 0,05 мл метанола, 0,1 мл Nа 2 СО 3 и 0,05 мл уксусного ангидрида при перемешивании в течение 30 мин при 0 С. Эту процедуру повторяли еще два раза,проверяя рН, остающийся щелочным, перед подкислением смеси до рН 4,0 уксусной кислотой. После нагревания этой смеси до 22 С толуол удаляли в струе азота и раствор обессоливали на колонке PD-10, уравновешенной и проявляемой в 10% (об/об) водном этаноле. Радиоактивный материал, появляющийся перед пиком 3H 003901 16 ацетата, лиофилизировали с получением 21 мг радиоактивно меченного гепарансульфата, который растворяли в 10% (об/об) водном этаноле в концентрации 2 мг/мл и хранили при -20 С. Сефароза с гликопротеином, богатым гистидином: куриный богатый гистидином гликопротеин (cHRG) получали из плазмы курицы методом ионообменной хроматографии на фосфоцеллюлозе (Rylatt et al., 1981). Чистоту препарата демонстрировали методом электрофореза в ДСН-ПААГ, где детектировали единственную окрашенную Кумасси синим полосу с молекулярной массой 135 кДа. Этот материал концентрировали до концентрации белка 2 мг/мл,диализовали против PBS и хранили при -20 С до использования. Бычий легочный гепарин (50 мг) растворяли в 10 мл раствора 0,5 М NаНСО 3, содержащего 10% (об/об) метанола и охлаждали до 4 С перед добавлением 5 аликвот 0,04 мл уксусного ангидрида с интервалами 5 мин. рН поддерживали выше 8,0 1 М Na2 СО 3. Смесь перемешивали еще в течение 30 мин перед диализом ацетилированного гепарина в течение 16 ч при 4 С против 5 л 1 М NаНСО 3, содержащего 0,15 МcHRG (10 мг) диализовали в течение 16 ч при 4 С против 2 л буфера для связывания и смешивали при 4 С в течение 30 мин с раствором ацетилированного гепарина, полученного,как описано выше, для предотвращения связывания НS-связывающего сайта cHRG с гранулами Сефарозы. Активированную цианогенбромидом (CNBr)-Сефарозу 4 В (2 г) оставляли набухать в 50 мл 1 мМ НСl в течение 30 мин и промывали 150 мл 1 мМ НСl в стеклянном фильтре под вакуумом перед промывкой 20 мл буфера для связывания. Промытую CNBrСефарозу сразу же добавляли к раствору гепарин-cHRG и осторожно перемешивали в течение 24 ч при 4 С. Добавляли 4 мл раствора 2 М этаноламина в буфере для связывания (доведенном до рН 8,0 1 М НСl) и осторожно перемешивали еще в течение 16 ч. Суспензию выливали в хроматографическую колонку (1,5 х 5,0 см) и промывали последовательно при 4 С 50 мл (каждого) буфера для связывания, 0,05 М Трис-HCl, рН 8,0, содержащего 2 М NaCl, и,наконец, PBS. cHRG-Сефарозу хранили в PBS при 4 С. Связывание давало концентрацию 0,8 мг белка, связанного на мл гранул, который связывал 6,2 и 3,1 нмоль радиоактивного легочного гепарина и HS соответственно. Тест на гепараназу: гранулы cHRGСефарозы (колонка со слоем 0,2 мл) помещали в одноразовые шприцы на 1 мл, утрамбованные стеклянной ватой, и эти миниколонки помещали в центрифужные пробирки на 10 мл, стоящие в бане со льдом. Колонки предварительно промывали 1 мл PBS перед использованием. Все процедуры с колонками проводили на льду. 17 Для определения гепараназной активности пробу до 2 мкл добавляли к инкубационной смеси, состоящей из 90 ммоль радиоактивно меченного HS в 0,05 М натрий-ацетатном буфере, рН 5,1, содержащем 5 мМ Nацетилманнозамин и 0,1 мг/мл БСА, в общем объеме 20 мкл и инкубировали при 37 С в течение подходящего времени. Реакцию останавливали замораживанием пробирок, добавляли 0,3 мл холодного PBS, раствор центрифугировали,если необходимо, при 4 С и 0,1 мл пробы наносили на миниколонку cHRG-Сефарозы, предварительно уравновешенную PBS. Колонки промывали 0,7 мл PBS, промывки и проходящий материал переносили в сцинтилляционный флакон, добавляли 10 мл сцинтилляционной жидкости и определяли радиоактивность. Активность фермента выражали в пмоль продукта, образовавшегося за час на мг белка или 106 клеток или мл сыворотки. Колонки cHRG-Сефарозы регенерировали добавлением 1 мл 0,5 М Трис-НСlбуфера, рН 7,5, содержащего 2 М NaCl, и затем уравновешивали PBS. Активность гепараназы детектировали также гель-фильтрационной хроматографией инкубационной смеси на колонке Superose 6 HR 10/30 (Pharmacia LKB Biotechnology, Uppsala,Sweden), уравновешенной и затем проявляемой в PBS. Система Pharmacia FPLC работала при скорости тока 0,25 мл/мин со сбором фракций 0,5 мл прямо в сцинтилляционные флаконы, к которым добавляли 3 мл сцинтилляционной жидкости и определяли радиоактивность. Колонку калибровали 3H-N-ацетилглюкозамином(221 Да) бычьим легочным гепарином (12,5 кДа) и произведенными из гепарина стандартами молекулярных масс (Mr ave) (16,7, 10,6, 6,7 и 3,1 кДа),которые были частично де-Nацетилированы и повторно N-ацетилированы. 3H-уксусным ангидридом, как описано выше для получения радиоактивно меченного HS. Радиоактивно меченные хондроитин-6-сульфат и карбоксил-восстановленный HS (полученные по способу Karamanos et al, 1988) также получали по этому способу. Связывание HS с cHRG-Сефарозой: пробы в 200 мкл PBS наносили на миниколонку (0,5 х 4,0 см) cHRG-Сефарозы, уравновешенную вPBS, при 4 С. Колонку промывали 2 мл PBS и элюировали линейным градиентом (2 х 10 мл)PBS и 10 мМ натрий-фосфатным буфером, рН 7,2, содержащим 1,2 М NaCl, при скорости тока 0,5 мл/мин со сбором фракций 0,5 мл непосредственно в сцинтилляционные флаконы, к которым добавляли 4 мл сцинтилляционной жидкости, и определяли радиоактивность. Колонки повторно уравновешивали PBS для последующего использования.III. Результаты и обсуждение Получение радиоактивно меченного субстрата гепараназы. 18 Предшествующие исследования активности гепараназы в отношении гепарина или гепарансульфата использовали связывающие реагенты для радиоиодинирования (Oosta et al.,1982), которое могло бы маскировать сайты потенциального расщепления или ацетилирования предварительно де-N-сульфатированногоHS или гепарина радиоактивно меченным уксусным ангидридом (Nakajima et al., 1986a). Однако, как сообщалось, последний способ влиял на среднюю молекулярную массу Mr субстрата и генерировал чувствительные к гепараназе связи в гепарине, который, как было показано ранее, является устойчивым к активности гепараназы мышиной меланомы В 16 (Nakajima et al.,1986a). Для гарантии получения радиоактивно меченного, биологически активного, природного субстрата для определения активности гепараназы в различных биологических пробах очищенный HS слизистой оболочки свиньи частично де-N-ацетилировали и повторно Nацетилировали 3H-уксусным ангидридом до удельной активности 1650-2000 имп/мин/пмоль,что в 100 раз выше, чем сообщалось ранее для 14 С-меченного HS (Nakajima et al., 1986a). Эта процедура мечения имеет основное преимущество, заключающееся в том, что в субстрат не вводятся новые или измененные сайты расщепления. Этот субстрат хранили при -20 С в 10%(об/об) водном этаноле, причем субстрат был стабилен на протяжении года без образования ощутимых продуктов деградации, несмотря на повторяемое замораживание и оттаивание. Было показано, что HS слизистой оболочки свиньи,который был ранее выделен Hahnenberger et al.(Walker et al., 1994). Он также содержит длинные устойчивые к азотистой кислоте (GlcNAcсодержащие) последовательности с dp 6 - 14-16(J.E. Turnbull, неопубликованные наблюдения) и, следовательно, содержит чередующиеся сульфатированные и несульфатированные области, типичные для видов HS. Анализ расщепления гепараназой субстрата HS. Перед разработкой нового теста гепараназы существенным было обоснование того, что радиоактивно меченный HS является подходящим субстратом, достигнутое при помощи общепринятой гель-фильтрации для разделения и характеристики продуктов деградации. Важно было также определение деградирующих свойств гепараназных ферментов, используемых в этом исследовании. Гепараназную деградацию радиоактивно меченного субстрата оценивали с применением гомогенатов высокоинвазивных клеток 13762 MAT аденокарциномы молочной железы крысы и тромбоцитов человека, так как ранее было показано, что опухолевые тромбо 19 цитарные ферменты имеют различную субстратную специфичность, разрушая либо только(Nakajima et al., 1988). Для предотвращения последующего расщепления экзоферментом продуктов деградации гепараназы, к инкубационной смеси добавляли 5 мМ N-ацетилманнозамин (NAM) для ингибирования высвобождения 3H-меченных остатков N-ацетилглюкозамина под действием -N-ацетилглюкозаминидазной активности (Hopwood and Elliott,1982).HS инкубировали с гомогенатом клеток 13762 MAT в присутствии NAM при рН 4,2, 5,1,6,5 и 7,5 в течение 16 ч при 37 С, и реакционную смесь анализировали методом гельфильтрационной хроматографии (фиг. 1). Размеры производимых гепараназой продуктов сравнивали с рядом радиоактивно меченных произведенных из гепарина стандартов Mr. HS максимально расщеплялся при рН 5,1 до фрагментов со средней молекулярной массой (Mr) 5 кДа, в сравнении с фрагментами со средней Mr 8 и 16 кДа при рН 6,5 и 7,5 соответственно. Скорость деградации при рН 4,2 была ниже, чем при рН 6,5 с менее очевидным ступенчатым распадом до продуктов. Пролонгированное инкубирование HS с гомогенатом клеток 13762MAT в течение 40 ч опять приводило к неполной деградации при рН 6,5 и 7,5 (данные не показаны). Для определения того, присутствуют ли при более высоких значениях рН различные ферментативные активности или генерируются отличающиеся сайты расщепления, индивидуальные продукты деградации при рН 5,1, 6,5 и 7,5, после 16 ч инкубации, собирали, обессоливали и инкубировали при рН 5,1 или при рН 6,5 со свежим гомогенатом в течение еще 16 ч. В каждом случае каждый из тестируемых фрагментов расщеплялся до минимального размера 5 кДа (данные не показаны). Нанесение продуктов 5 кДа гепараназного расщепления на ДЭАЭСефарозу приводило к обнаружению всей радиоактивности, остающейся в связанном виде,даже в присутствии 0,3 М NaCl, что свидетельствовало о том, что все фрагменты HS, полученные в результате гепараназой, содержали высокосульфатированные домены HS. Инкубирование во времени гомогенатов клеток 13762 MAT с HS при рН 5,1 в течение периодов времени 2, 4 и 16 ч опять показало явную ступенчатую деградацию HS (фиг. 2), с тремя явными расщеплениями от 22 до 16 до 8 и, наконец, до 5 кДа. Не обнаружили активности в отношении хондроитин-6-сульфата или в отношении карбоксилвосстановленного HS (CRHS) после инкубации в течение 16 ч при рН 5,1,6,5 или 7,5 (результаты не показаны). Активность гепараназы гомогената тромбоцитов человека также не действовала на CR-HS, но расщепляла HS до фрагментов 5 кДа, которые удерживались ДЭАЭ-Сефарозой в 0,3 М NaCl. 20 Было продемонстрировано гель-фильтрационным анализом, что гомогенаты из различных клеточных линий, в том числе из линий высокометастатической карциномы ободочной кишки человека НСТ и KM 12-SM, эндотелиальных клеток пупочной вены человека (HUVEC), клеток мышиной меланомы B16-F10 и экстракт печени крыс гидролизуют (все) HS до фрагментов 17, 8 и, в конце концов, 5 кДа в течение 16 ч инкубации (результаты не показаны), что свидетельствует о том, что гепараназные активности в каждой клеточной линии расщепляли HS до продуктов одинакового размера. Ранее также было показано, что гепараназные активности тромбоцитов, HUVEC, лимфоцитов, нейтрофилов и лейкоцитов человека относительно бычьих связанных с эндотелиальным ЕСМHSPG приводят к образованию конечных продуктов расщепления HS такого же размера (Vlodavsky et al., 1992). Инкубация экстрактов высокометастатических крысиных клеточных линий 13762 MAT иDMBA-8A и неметастатических вариантов Jклона и DMBA-Sask с HS приводила к полной деградации HS до фрагментов 5 кДа гепараназными активностями 13762 MAT и DMBA-8A,тогда как экстракты J-клона и DMBA-Sask только частично деградировали HS до фрагментов со средней Mr 8 и 17 кДа соответственно (фиг. 3). Ранее было показано, что высокометастатические крысиные клеточные линии 13762 MAT и DMBA-8A являются более эффективными в их способности деградировать искусственную базальную мембрану Matrigel, чем варианты Jклон и DMBA-Sask в тесте на проницаемость базальной мембраны (Parish et al., 1992), что,следовательно, подтвердило корреляцию метастатического потенциала с гепараназной активностью (Nakajima et al., 1983). Таким образом, HS слизистой оболочки свиньи предложен в качестве подходящего природного субстрата для обнаружения активности гепараназы в различных типах клеток, экстрактах тромбоцитов и тканевых экстрактах, для оценки содержания гепараназы и метастатического потенциала линий опухолевых клеток. Однако вследствие множества сайтов расщепления, использование гель-фильтрации в качестве способа отделения продуктов от нерасщепленного субстрата делает затруднительным точное количественное определение гепараназной активности, в частности, когда должны присутствовать множественные расщепления для отделения субстрата от продукта. Кроме того, неизвестно, одинакова ли относительная скорость каждого из расщеплений или могут ли начальные продукты расщепления ингибировать дальнейшее расщепление путем ингибирования продуктом, приводя к отсутствию линейности этого теста во времени, которое наблюдалось для большинства исследованных деградирующихHS экзоактивностей (Freeman and Hopwood, 21 1986, 1987, 1989a, 1989b). Отсутствие количественного определения активности гепараназы в сочетании со временем и трудом, требующимися для анализа одной пробы гельфильтрационным анализом, выдвигает на первый план необходимость в быстром, количественном тесте для гепараназы, способном оценивать минимальное количество расщеплений субстрата. Разработка количественного анализа гепараназы. Взаимодействие HS- и гепаринсвязывающих белков, таких как антитромбин III, кислый и щелочной фактор роста фибробластов (FGF),тромбоцитарный фактор 4, -тромбоглобулин и обогащенный гистидином гликопротеин (HRG),с HS было хорошо документировано (Jackson etal., 1991) вместе с более недавними попытками определения их связывающих мотивов на молекуле HS после химического (прежде всего деградации азотистой кислотой) расщепления или расщепления бактериальной гепараназой и гепаритиназой (Turnbull and Gallagher, 1990, 1991;Turnbull et al., 1992; Walker et al., 1994). Однако кроме демонстрации, что гепараназа млекопитающих может высвобождать активный bFGF из ЕСМ (Ishai-Michaeli et al., 1990), публиковалось мало работ по взаимодействию НSсвязывающих белков с HS после деградации гепараназой млекопитающих. При исследовании взаимодействия куриного HRG (cHRG), обильного полученного из плазмы HS-связывающего белка, с HS наблюдали, что cHRG не только маскирует сайты расщепления гепараназой клеток MAT млекопитающих на цепях HS, но после расщепления гепараназой HS терялся cHRG-связывающий мотив на HS. Таким образом, после расщепления гепараназой расщепленные фрагменты HS связывались менее эффективно с гранулами Сефарозы со связанными на них cHRG, что делало возможным разработку эффективного и нового способа отделения субстрата HS от продуктов гепараназного расщепления. При нанесении HS на cHRG-Сефарозную колонку и элюции солевым градиентом при рН 7,2 относительно слабо связывающийся HS элюировался 0,27 М NaCl (фиг. 4) в сравнении с легочным гепарином, который элюировался 0,6 М NaCl (результаты не показаны). Однако фрагменты 5 кДа после полного расщепленияHS гомогенатом клеток 13762 MAT не связывались с cHRG-Сефарозой. Когда затем HS расщепляли гепараназой клеток 13762 MAT с применением стандартного теста при рН 5,1 в течение 2, 4 и 16 ч, реакционную смесь делили на 3 части и анализировали гель-фильтрационной хроматографией, связыванием с ДЭАЭ-Сефарозой и связыванием с cHRG-Сефарозой. Гельфильтрационный анализ давал профиль, сходный с фиг. 1, с продуктами 17, 8 и 5 кДа соответственно. Нанесение реакционной смеси и 22 последующая элюция радиоактивно меченных продуктов HS из колонки cHRG-Сефарозы солевым градиентом, показали, что уменьшение среднего значения Mr фрагментов HS, согласно данным гель-фильтрации, коррелировало с увеличением материала, не связывающегося сHRG-связывающий мотив на HS был утрачен после расщепления гепараназой. Не было видимого изменения в аффинности связанных фрагментов HS в отношении колонки cHRGСефарозы на протяжении периода инкубации. Связывание HS с cHRG-Сефарозой (и средняя величинаHS во время гельфильтрационного анализа) не испытывали влияния в слепых тестах, содержащих только буфер, 0,1 мг/мл БСА, инактивированный нагреванием фермент или активный фермент,хроматографируемый с HS при 4 С (данные не показаны). После нанесения инкубационных смесей на ДЭАЭ-Сефарозу вся радиоактивность оставалась связанной в присутствии 0,3 М NaCl,указывая на то, что продукты расщепления не были обусловлены десульфатированием некой эндосульфатазной активностью (Bartlett et al.,1995; Dawes and Pepper, 1992; Wells and Dawes,1995). Для исследования того, имеет ли место связывание HS с HRG в сайте, чувствительном к расщеплению гепараназой, или вблизи него, HS расщепляли гомогенатом клеток 13762 MAT в отсутствие и в присутствии молярного отношения 3:1 cHRG:HS (HS, по-видимому, имеет 3 потенциальных сайта расщепления, каждый из которых может связываться с молекулой HRG). Фиг. 5 показывает, что в присутствии cHRG скорость деградации HS (приводящей к образованию малых (5 кДа) фрагментов) была значимо замедленной в сравнении с расщеплением в отсутствие cHRG, где субстрат был полностью деградирован. Определение активности гепараназы. При помощи cHRG-Сефарозного теста максимальную гепараназную активность наблюдали при рН 5,1 (результаты не показаны),так же, как в прежних тестах с гельфильтрационным анализом (фиг. 1). NAM добавляли к инкубационной смеси для ингибирования экзогликозидазного высвобождения 3HGlcNAc, который не связывался бы с cHRGСефарозой. На аффинность HS и продуктов расщепления в отношении cHRG-Сефарозы не влияли инкубационные смеси, содержащие конечные концентрации 0,1 мг/мл БСА, 0,1%(об/об) Тритон Х-100 или до 0,2 М NaCl. Однако гепараназная активность тканевого гомогената увеличивалась в 2 раза при проведении теста в присутствии 0,1% Тритона Х-100. В противоположность этому, на активность растворимой гепараназы (после удаления мембран центрифугированием) не влияло добавление БСА или Тритона Х-100 к инкубационной сме 23 си, хотя высокоочищенные препараты фермента требовали присутствия БСА в инкубационной смеси для оптимальной активности и стабильности. Необходимость БСА для определения оптимальной активности высокоочищенного фермента и Тритона Х-100 для максимальной активности тканевых гомогенатов была подробно описана для определения HS-деградирующих активностей экзофермента (Freeman and Hopwood, 1986, 1987, 1989a, b, 1992). cHRGСефарозные колонки рутинно элюировали высокими концентрациями соли и уравновешивали в PBS. Колонки хранили в PBS при 4 С и использовали постоянно на протяжении периода 2 лет без заметного уменьшения связывающей способности. На фиг. 6 приведено сравнение изменения средней Mr после расщепления HS гепараназой гомогената 13762 MAT (фиг. 6 А) с появлением несвязанных радиоактивных фрагментов HS после нанесения инкубационной смеси наcHRG-Сефарозу (фиг. 6 В). Гель-фильтрационный анализ материала, не связанного с cHRGСефарозой, после 6 ч инкубации показал среднюю Mr 17 кДа (результаты не показаны). Активность фермента, определяемая методом анализа на cHRG-Сефарозе, была линейной во времени до 10 ч инкубации и до 30% превращения субстрата в продукт (фиг. 6 В). После продленной (24 ч) инкубации 84% радиоактивности проходило через колонку cHRG-Сефарозы, и средняя Mr продукта составляла 5 кДа. Материал, оставшийся связанным на колонке, предположительно содержал HRG-связывающий мотив более высокой аффинности или был устойчив к гепараназе - феномен, который не был исследован. Материал фона, не связывающийся сcHRG-Сефарозой, обычно имел низкую Mr, менее 6 кДа, и он может представлять собой ранее расщепленные фрагменты HS, полученные во время выделения HS из слизистой оболочки свиньи. Эти фрагменты могут быть удалены предварительной аффинной очисткой субстратаHS при помощи cHRG-Сефарозы или предварительной гель-фильтрацией для удаления молекул с меньшей Mr. Вместо cHRG-Сефарозы, для определения гепараназы может быть успешно использована Сефароза с HRG человека (hHRG-4 Сефароза). Однако связывающая аффинность hHRG в отношении HSPG поверхности клеток BALB/c 3T3 была более слабой, чем наблюдаемая дляcHRG (Brown and Parish, 1994) и это отражало более высокую аффинность cHRG-Сефарозы в отношении HS слизистой оболочки свиньи, чем аффинность, наблюдаемая в отношении hHRGСефарозы (результаты не показаны). КуриныйHRG имеет дополнительное преимущество, заключающееся в том, что он может быть очищен с более высоким выходом из плазмы, чем hHRG 24 17 кДа) может быть использован вместо HS кишечника свиньи для определения гепараназной активности. В противоположность этому, коммерческий HS бычьего кишечника не может быть использован для определения гепараназной активности, так как он имеет Mr менее 5 кДа и, по существу, не является гепараназой млекопитающих, чувствительной как к гельфильтрационному анализу, так и к cHRGСефарозному анализу. Анализ гепараназной активности в различных биологических пробах. Различные клеточные линии, гомогенаты тканей и тромбоцитов, а также сыворотку из нормальных и раковых пациентов тестировали на гепараназную активность при помощи cHRGСефарозного гепараназного теста. Табл. 1 показывает, что гепараназная активность, присутствующая в гомогенатах высокометастатических крысиных клеточных линий 13762 MAT иDMBA-8A, была в 4-10 раз более высокой, чем для соответствующих неметастатических вариантов J-клона и DMBA-Sask. Эти величины тесно коррелируют как с относительной способностью этих линий подвергать деградации искусственную (Matrigel) базальную мембрану (Parishet al., 1992), так и со способностью этих клеточных гомогенатов способствовать деградации(см. ранее). Метастатические варианты мышиной легочной карциномы Льюиса (D122) и легочной карциномы (А 3 а) вызывающие деградацию HS в 2,5-4,8 раз быстрее, чем их соответствующие неметастатические варианты (табл. 1). Ранее, Nakajima et al., (1986 а, b) опубликовали данные о различии только в 1,5-2,2 раза в гепараназной активности между экстрактами слабометастатической сублинии В 16-F1 и более высокометастатическими сублиниями B16-BL6,-F10 и -В 16b при использовании твердофазного теста с де-N-сульфатированным, повторно Nацетилированным HS. Чувствительность гепараназного теста данного изобретения может быть использована для клинической оценки раковых больных. Гепараназную активность определяли в ткани рака легких, взятой у шести пациентов с раком легких. Среди них, гепараназная активность в первичной опухоли пяти пациентов была повышена в 2-4 раза по сравнению со смежной неопухолевой легочной тканью пациентов (результаты не показаны). Хотя гепараназная активность была едва регистрируемой в плазме человека (менее 4 пмоль/ч/мл плазмы), значимую гепараназную активность определяли в сыворотках нормальных взрослых и в сыворотках пациентов с метастатическими злокачественными опухолями. Гепараназная активность в сыворотке обследуемых пациентов была в 2 раза выше, чем наблюдаемая у нормальных контролей 229,728,8 (n=8) для раковых пациентов в сравнении с 116,613,3 (n=5) пмоль/ч/мл сыворотки в кон 25 троле, что подтвердило результаты, наблюдаемые для сывороток пациентов со злокачественной меланомой (Nakajima et al., 1988). В самом деле, эти авторы наблюдали 4-кратное увеличение гепараназной активности у пациентов, у которых присутствовали метастазы. Nakajima etal. (1986 с, 1988) наблюдали также, что уровни гепараназы в сыворотке крыс были в 17 раз выше, чем у нормальных крыс, спустя 30 дней после инъекции высокометастатических клеток аденокарциномы молочной железы 13762 MAT,тогда как активности в сыворотках крыс, несущих опухоли MTLn3, хорошо коррелировали со степенью образования метастазов. Гепараназную активность определяли также в различных клеточных линиях человека и крысы, гомогенатах тромбоцитов и тканей(табл. 2), которые должны были представлять собой ценные источники гепараназного фермента для последующей очистки. Для облегчения сравнения между клетками к тканями гепараназная активность выражена на мг экстрагированного белка. Разработка этого быстрого и количественного анализа гепараназы будет неоценимой для очистки гепараназной активности из различных источников и сделает возможным быстрый скрининг возможных ингибиторов гепараназы. Таблица 1 Активность гепараназы метастатических и неметастатических линий опухолевых клеток Гепараназную активность опухолевых клеток оценивали после фракционирования инкубационной смеси на cHRG-Сефарозе. Активность фермента выражали в виде среднегоSEM (стандартное отклонение) для трех отдельных экспериментов, за исключением особо указанных случаев. В отношении деталей см. раздел Методы. Аденокарцинома молочной железы крысы Карцинома ободочной кишки человека Моноцит человека Картиноцит человека Мышиная легочная карцинома Льюиса Мышиная легочная карцинома Нет Да Нет Да Нет 26 Таблица 2 Активность гепараназы в клетках и тканях человека и крысы Диапазон гепараназной активности в различных гомогенатах тканей и культивируемых клеток человека и крысы оценивали после фракционирования инкубационной смеси наcHRG-Сефарозе. В отношении деталей см. раздел Методы. Клетка или ткань Тромбоциты человека Карцинома ободочной кишки человека (НСТ 116) Эндотелиальные клетки пупочной вены человека Клетки гладких мышц человека Фибробласты легких человека Кератиноцит человека (KJD) Клетки крысы 13762 MAT Печень крыс Пример 2. Используемые аббревиатуры: БСА, бычий сывороточный альбумин; cHRG, куриный богатый гистидином гликопротеин; HRG, богатый гистидином гликопротеин; HS, гепарансульфат;HSPG, гепарансульфатпротеогликан; HUVEC,эндотелиальные клетки пупочной вены человека; PBS, забуференный фосфатом физиологический раствор.I. Материалы Произведенные из гепарина стандарты молекулярных масс (Mrave) 16,7, 10,6, 6,7 и 3,1 кДа были получены в виде подарка из Nova NordiskHS слизистой оболочки свиньи (ORG 553) был подарком из Organon Int. Bv, (Oss, The Netherlands). Pharmacia Fine Chemicals (Uppsala, Sweden) поставляла колонки конканавалин АСефарозы 4 В, хелатирующей Сефарозы 4 В, Суперозы 6 и 12 HR 10/30 для гель-фильтрации,наборы стандартов молекулярных масс для стандартизации гель-фильтрационных колонок и гелей для электрофореза в ДСН-ПААГ, и октил-Сефарозу. Sigma Chemicals Co. (St. Louis,МО) поставляла кристаллический бычий сывороточный альбумин (БСА), бычий легочный гепарин и гепарин слизистой оболочки свиньи,HS бычьих почек, 3,3-диметилглутаровую кислоту. Blue А-агарозу, октил-агарозу, CHAPS,ацетат цинка, Amicon Corp. (Beverly, MA) поставляла микроконцентраторы Centricon 100 и 30. Beckmann (Gladesville, Australia) поставляла готовую к применению сцинтилляционную жидкость. Stratagene USA (La Jolla, CA) поставлял StrataClean Resin. Обогащенную тромбоцитами плазму получали из Canberra Hospital, промывали дважды нормальным солевым раствором центрифугированием суспендированных тромбоцитов при 1600 х g в течение 15 мин при 20 С и осадок хранили в замороженном виде при -80 С. Тромбоциты человека получали также по способуBartlett et al. (1995) и промывали дважды в нормальном солевом растворе. Гомогенаты клеток получали суспендированием 108 тромбоцитов в 0,2 мл 0,1% (об/об) водного Тритона Х-100 и разрушением посредством замораживания и оттаивания три раза в смеси твердыйCO2/этанол. Концентрации белка определяли при помощи набора для определения белка BioRad Coomassie (Bio-Rad Laboratories, Richmond,CA) с использованием БСА в качестве стандарта.II. Методы Получение радиоактивно меченных субстратов. Радиоактивно меченные гепарансульфат слизистой оболочки кишечника свиньи (ORG 553), гепарин слизистой оболочки кишечника свиньи и бычий легочный гепарин получали по способу примера 1 N-деацетилированием гидразином и N-ацетилированием 3H-уксусным ангидридом. Гепараназные тесты. Тест 1. Гепараназную активность тромбоцитов человека определяли в отношении HS и продукты отделяли от субстрата с применением способа разделения с гранулами Сефарозы, связанными с куриным богатым гистидином гликопротеином (cHRG-Сефарозы) примера 1. Пробу до 2 мкл добавляли к инкубационной смеси, состоящей из 90 пмоль радиоактивно меченного HS в 0,05 М натрий-ацетатном буфере, рН 5,1, содержащем 5 мМ Nацетилманнозамин и 0,1 мг/мл БСА, в общем объеме 20 мкл и инкубировали при 37 С в течение подходящего времени с получением 5-20% распада субстрата до продуктов. Реакцию останавливали замораживанием пробирок, добавляли 0,3 мл холодного забуференного фосфатом физиологического раствора (PBS), раствор центрифугировали, если требуется, при 4 С и пробу 0,1 мл наносили на миниколонку cHRGСефарозы (0,2 мл), предварительно уравновешенную PBS. Колонки промывали 0,7 мл PBS, и проходящий через колонку материал переносили в сцинтилляционный флакон, добавляли 10 мл сцинтилляционной жидкости и определяли радиоактивность. Активность фермента выражали в виде пмоль продукта, образованного за час на мг белка. Тест 2. Активность гепараназы в отношении 2 мкг радиоактивно меченного HS или аналогов гепарина определяли, как описано выше, в течение 16 ч при 37 С и детектировали гельфильтрационным анализом инкубационной смеси либо на Суперозе 6 (для деградации HS), либо на Суперозе 12 (для деградации гепарина). Хроматографические колонки уравновешивали и проявляли PBS при скорости тока 0,25 мл/мин со сбором фракций 0,5 мл непосредственно в сцинтилляционные флаконы, к которым добавляли 3 мл сцинтилляционной жидкости и определяли радиоактивность. Колонки калибровалиH-N-ацетилглюкозамином (221 Да), бычьим легочным гепарином (12,5 кДа) и произведенными из гепарина стандартами молекулярных масс (Mrave) (16,7, 10,6, 6,7 и 3,1 кДа), которые были частично де-N-ацетилированы и повторноN-ацетилированы 3H-уксусным ангидридом, как описано выше для получения радиоактивно меченного HS. Очистка гепараназы тромбоцитов. Все процедуры выполняли при 4 С, если нет других указаний. Активность гепараназы в отношении HS определяли с применением теста 1. В каждой стадии (за исключением промывки 0,8 М NaCl Blue А-агарозы в стадии 3) промывки буфером колонок продолжали до тех пор,пока белок не переставал определяться в элюате колонки при помощи белкового теста Bio-Rad. Стадия 1. Солюбилизация ферментативной активности: 50 единиц замороженных промытых тромбоцитов человека оттаивали суспендированием в 4 объемах 15 мМ натрийдиметилглутаратного буфера, рН 6,0, содержащего 0,5 М NaCl (буфера А), и пробу замораживали/оттаивали три раза после погружения в баню со смесью твердого СО 2/этанола. Гомогенат суспендированных тромбоцитов центрифугировали при 35000 х g в течение 60 мин и супернатант использовали в стадии 2. Осажденный материал ресуспендировали в 200 мл буфера А, опять замораживали/оттаивали 1 раз и центрифугировали, как описано выше. Эту процедуру повторяли еще два раза перед гомогенизацией конечного осадка в буфере А, содержащем 1% (об/об) CHAPS, и центрифугировали,как описано выше. Гепараназную активность в супернатанте CHAPS очищали точно так, как описано ниже, за исключением добавления Тритона Х-100 к экстракту в стадии 2. Стадия 2. Хроматография на конканавалин А-Сефарозе: супернатант из стадии 1 делали 0,2% в Тритоне Х-100 (об/об) и наносили при скорости приблизительно 1 мл/мин на конканавалин А-Сефарозную колонку (1,5 х 5,0 см),уравновешенную буфером А, содержащим 0,2% Тритон Х-100 (буфер В). Колонку промывали поочередно 25 мл буфера В и 40 мл буфера А при 4 С перед промывкой 40 мл буфера А, который предварительно нагревали до 20 С. Гепараназную активность элюировали нанесением 40 мл буфера А, содержащего 20% метилманнозид (м/об.), который предварительно нагревали до 20 С. Элюат собирали в контейнер, помещенный в ковш со льдом. Стадия 3. Хроматография на Zn2+хелатирующей Сефарозе/Blue А-агарозе: раствор фермента из стадии 2 наносили при скорости 1 мл/мин на Zn2+-хелатирующую Сефарозную колонку (1,0 х 10,0 см), соединенную последовательно с Blue А-агарозной колонкой (1,0 х 2,0 см). Объединенные колонки промывали 50 мл буфера А перед промыванием отсоединенной Blue А-агарозной колонки поочередно 20Blue А-агарозную колонку в стадии 3 соединяли с октилагарозной колонкой (1,0 х 1,5 см), которую уравновешивали в Трис-буфере,содержащем 2 М NaCl. Blue А-агарозную колонку элюировали при 0,5 мл/мин 15 мл Трисбуфера, содержащего 2 М NaCl. Элюат октилагарозы сразу же концентрировали до объема 5 мл в перемешиваемой ультрафильтрационной ячейке Amicon, содержащей мембрану РМ 10, с последующим концентрированием до объема 0,2 мл центрифугированием в Centricon 30. Добавляли буфер А, содержащий 10% (об/об) глицерина (буфер С) и раствор фермента опять концентрировали до 0,4 мл. Стадия 5. Хроматография на Суперозе 12: концентрированный раствор фермента из стадии 4 наносили в виде двух отдельных партий по 200 мкл на две колонки Суперозы 12 HW 10/30, соединенные последовательно и уравновешенные и проявляемые буфером С при 0,5 мл/мин. Собирали фракции 0,5 мл, анализировали на гепараназную активность и фракции,содержащие гепараназную активность, концентрировали до 0,4 мл центрифугированием вCentricon 30. Очищенный фермент был стабилен в течение месяцев при хранении в буфере С при 4 С. Стадия 6. Центрифугирование в Centricon 100 и 30: в случае препаратов тромбоцитов, полученных из менее 20 единиц промытых тромбоцитов, элюат 2 М NaCl из октил-Сефарозной колонки в стадии 4 концентрировали центрифугированием в микроконцентраторе Centricon 100, и фильтрат, содержащий гепараназную активность, концентрировали и диализовали против буфера С с применением микроконцентратора Centricon 30, как описано в стадии 4. Нативная и субъединичная молекулярная масса. Нативную Mr очищенной гепараназной активности тромбоцитов человека определяли хроматографией на двух колонках Суперозы 12HW 10/30, соединенных последовательно, как описано в стадии 5 выше. Колонки калибровали следующими стандартами Mr: тироглобулин(669 Да), ферритин (440 кДа), каталаза (232 кДа), фруктозобифосфатальдолаза (158 кДа),бычий сывороточный альбумин (67 кДа), овальбумин (43 кДа), химотрипсиноген (25 кДа) и рибонуклеаза А (13 кДа). Непрерывный электрофорез в ДСН-ПААГ проводили согласно способу Laemmli (1981) и окрашивали Coomassie Brilliant Blue R250. 10% полиакриламидные гели калибровали следующими стандартами Mr: фосфорилаза b (94 кДа),бычий сывороточный альбумин (67 кДа), оваль 003901 30 бумин (43 кДа), карбоангидраза (30 кДа), соевый ингибитор трипсина (20 кДа) и лактальбумин (14 кДа). Пробы концентрировали добавлением 10 мкл смолы Strata Clean, перемешиванием на вортексе и центрифугированием суспензии в соответствии с инструкциями изготовителя. Осажденный материал восстанавливали кипячением в дитиотрейтоле и суспензию наносили на концентрирующий гель согласно стандартной процедуре.III. Результаты и обсуждение Очистка гепараназы тромбоцитов. Ранее было показано, что гомогенаты тромбоцитов человека содержат гепараназную активность 2,2-3,6 нмоль/ч/мг белка в отношении HS, в 60 раз более высокую активность по сравнению с наблюдаемой в метастатической опухолевой клеточной линии карциномы ободочной кишки человека НСТ 116 (пример 1). Таким образом, тромбоциты являются богатым источником гепараназной активности млекопитающих. Гепараназная активность может высвобождаться из свежеполученных тромбоцитов индуцируемой тромбином дегрануляцией (Hoogewerf et al., 1995), но было замечено, что уровень гепараназной активности, высвобождаемой стимуляцией тромбином несвежих тромбоцитов, был очень вариабельным. Поэтому гепараназную активность получали солюбилизацией посредством замораживания/оттаивания предварительно замороженных промытых тромбоцитов. Из-за обнаруженной нестабильности этого фермента (Oldberg et al., 1980) и относительно низких выходов активности, получаемой во время очистки фермента (Hoogewerf et al., 1995;Oosta et al., 1982), были разработаны условия хроматографии для получения максимальной концентрации элюированного белка. Это было достигнуто скорее серийной (или изократической), чем градиентной, элюцией и изобретением условий, в которых этот фермент мог бы проходить несвязанным через одну колонку,чтобы связываться следующей колонкой, присоединенной последовательно. Это позволило сэкономить время, затрачиваемое на анализ активности фермента после элюции солевым градиентом, и свело к минимуму потерю активности из-за разведения фермента. Гомогенизация предварительно промытых тромбоцитов в буфере А (который содержал 0,5 М NaCl) не высвобождала какой-либо заметной активности растворимого фермента. Однако приблизительно 75% общей гепараназной активности солюбилизировалось повторяемым замораживанием/оттаиванием тромбоцитов с последующим центрифугированием гомогента(табл. 3). Оставшийся связанный с мембранами фермент мог высвобождаться только гомогенизацией в буфере А, содержащем 1% (об/об)CHAPS. Гомогенизация мембран с буфером А,содержащим 1% Тритон Х-100, солюбилизиро 31 вала фермент, но он быстро терял активность. Мембрано-связанный фермент очищали из 50 единиц промытых тромбоцитов согласно процедуре, используемой для выделения растворимого фермента. Вся ферментативная активность, нанесенная на конканавалин А-Сефарозную колонку,была прочно связана при нанесении в присутствии детергента. Промывание колонки нанесением буфера А при 20 С удаляло больше неспецифически связанного белка, чем промывание колонки только при 4 С. Извлечение ферментатиной активности и скорость элюции (в менее чем 5 объемах колонки элюента) сильно увеличивались при элюировании колонки при 20 С по сравнению с нормальной элюцией при 4 С. Гепараназную активность очищали в 19 раз с выходом 56% из исходного супернатанта тромбоцитов (табл. 3). Выход активности фермента на этой стадии был обычно в диапазоне 55-70%. Дополнительная активность гепараназы не элюировалась из колонки буфером, содержащим-метилманнозид и 0,1% Тритон Х-100 при 20 С. Применение хелатирующей Сефарозы и хроматографии с красителем-матриксом, которая была успешно использована для очистки деградирующих HS активностей экзоферментов(Bielicki et al., 1990; Clements et al., 1985; Freeman and Hopwood, 1986, 1987, 1989), ранее не использовали для выделения гепараназной активности млекопитающих. Фермент, который не связывался с цинк-хелатирующей колонкой,прочно связывался с колонкой со связанным красителем, что делало возможным полное отделение деградирующих гепарин активностей экзоферментов -L-идуроназы, -D-глюкуронидазы и -N-ацетилглюкозаминидазы от гепараназы тромбоцитов (результаты не показаны). Гепараназную активность не определяли в несвязанной фракции или в низкосолевых (0,5 и 0,8 М NaCl) промывках Трис-буфером колонки с красителем. Элюция гепараназы высокой концентрацией соли (2 М NaCl) из Blue А-агарозной колонки приводила к наибольшему связыванию примесного белка с октил-агарозной колонкой,тогда как несвязавшаяся гепараназа концентрировалась в почти чистой форме для конечной очистки методом гель-хроматографии. В то время как этот фермент не связывался с октилагарозой, он действительно связывался с октилСефарозой при нанесении в 2 М NaCl, но элюировался из этой колонки в 1 М NaCl (результаты не показаны). Гепараназную активность очищали дополнительно в 80 раз на стадии 2, что давало общую очистку в 1500 раз с выходом активности 26%. Дополнительная активность не извлекалась из хелатирующей Сефарозной колонки или из октил-агарозной колонки после элюции оставшегося связанного белка из этих колонок буфером А, содержащим 0,1 М имидазол и 1% Тритон Х-100 соответственно. Кроме 32 того, гепараназная активность не детектировалась в фильтрате после концентрирования вCentricon 30 почти чистого фермента в противоположность данным, сообщенным Hoogewerf etal. (1995). Гель-фильтрационная хроматография (фиг. 7) приводила к конечной очистке в 1,1 раза фермента на стадии 4, что давало конечную очистку в 1900 раз с выходом активности 19% из исходного гомогената. Это сравнимо с 240000-кратной очисткой с выходом 5,6% и 4100-кратной очисткой с выходом 8% из обогащенной тромбоцитами плазмы, сообщеннымиOosta et al. (1982) и Hoogewerf et al. (1995) соответственно. Небольшие препараты очищенной гепараназы тромбоцитов человека (с применением менее 20 единиц промытых тромбоцитов) могли бы быть получены в течение 2 дней с выходом до 30% с применением способа, описанного в этом примере. В этом случае применяют пропорционально меньшие колонки и гельфильтрацию стадии 5 заменяют фильтрованием элюата октил-агарозы через Centricon 100 для концентрирования при помощи фильтра Centricon 30. Связанный с мембраной фермент очищают также с 25% выходом активности фермента с удельной активностью 6600 нмоль/ч/мг белка, подобно тому, как это наблюдали для растворимого фермента. Мембрано-связанная форма этого фермента обнаруживала те же самые хроматографические свойства, что и растворимая форма фермента. Нативная молекулярная масса. Гель-фильтрационный анализ как очищенной гепараназы (см. фиг. 7), так и фермента,полученного после хроматографии на конканавалин А-Сефарозе (стадия 2), показал, что этот фермент имеет среднюю Mr 50 кДа. Активность фермента не определялась ни при величинах Mr, соответствующих 8-10 кДа или димерам или тетрамерам гепараназной активности с размерами хемокинов, сообщенных Hoogewerf et al.(1982). Однако результаты, представленные в этом примере, подобны величине Mr 40-60 кДа,полученной Graham and Underwood (1996) для экстрактов тромбоцитов человека. Эта величина подобна также нативной Mr 45 кДа, сообщенной для частично очищенной гепараназы плаценты человека (Gilat et al., 1995), и 50 кДа, сообщенной для частично очищенной гепараназы селезенки человека (Sewell et al., 1989), но отличается от величины Mr 94 кДа, сообщенной для фермента мышиной меланомы (Jin et al., 1990). Кроме того, очищенная гепараназа человека не удерживалась мембранами 100 кДа Centricon 100, но удерживалась мембранами 30 кДа Centricon 30. Гепараназная активность не определялась в фильтрате мембраны 30 кДа, как это сообщалось Hoogewerf et al. (1995). Однако после хроматографии стадии 2 активность фермента 33 удерживалась мембранами 100 кДа Centricon 100, что указывает на прочное взаимодействие с другими белками во время процесса концентрирования, так как материал стадии 2 имел среднюю Mr 50 кДа согласно гель-фильтрации (результаты не показаны). Электрофорез в ДСНПААГ очищенного фермента показал одну окрашивающуюся Кумасси синим полосу, соответствующую величине Mr 50 кДа как при восстанавливающих (фиг. 8), так и при невосстанавливающих условиях (результаты не показаны), которая была идентична величине, полученной гель-фильтрационным анализом. Очищенный мембрано-связанный фермент также имел нативную Mr и субъединичную Mr 50 кДа согласно гель-фильтрации и анализу электрофорезом в ДСН-ПААГ (при восстанавливающих условиях). Неизвестно, каким образом этот фермент связан с мембраной. Поскольку его размер был одинаков с размером растворимого фермента, возможно, что гепараназа может существовать в форме растворимого и в форме мембрано-связанного фермента, подобно лизосомному ферменту кислой фосфатазе, которая транспортируется в лизосому по маннозо-6 фосфат-независимому пути и которая имеет Сконцевой трансмембранный пептид 2 кДа, дающий возможность существования этого фермента в лизосоме как в мембрано-связанной, так и в растворимой формах (Peters et al., 1990). РанееGallagher et al. (1988) сообщили о присутствии гепараназной активности в мембране печени крысы. Однако в противоположность сообщенному здесь ферменту, этот фермент был неактивным при величинах рН ниже 7,5. 34 Субстратная специфичность очищенной гепараназы тромбоцитов. Очищенная гепараназная активность тромбоцитов человека в отношении HS, определяемая при помощи теста 1, была максимальной при рН 5,1, подобно сообщаемой для гепараназной активности гомогената тромбоцитов (пример 1). Очищенный фермент расщеплял как HS,так и гепарин согласно анализу тестом с применением гель-фильтрации. HS слизистой оболочки свиньи (22 кДа) и HS бычьих почек (17 кДа) расщеплялись (оба) до фрагментов 5 кДа, как сообщалось для гепараназной активности гомогената тромбоцитов в отношении HS слизистой оболочки (пример 1). Ранее было показано, чтоHS слизистой оболочки свиньи расщепляется ступенчатым образом от 22 до 17, до 11 и, наконец, до фрагментов у 5 кДа (пример 1). Гепарин слизистой оболочки и более высокосульфатированный легочный гепарин расщеплялись (каждый) от 12,5 кДа до фрагментов в 4 и 6 кДа соответственно. Гепарин слизистой оболочки, по-видимому, расщепляется дважды ступенчато, по сравнению с расщепляемым один раз легочным гепарином. Однако в противоположность сообщению Hoogewerf et al.(1995) не было доказательства образования преимущественно дисахаридных продуктов при расщеплении HS или гепарина (или модифицированных гепаринов) после более продолжительных инкубаций либо очищенного фермента,либо гепараназы гомогената стадии 1, даже после предварительной обработки фермента восстанавливающими или окислительными агентами, как описано этими авторами. Таблица 3 Очистка гепараназы из тромбоцитов человека Стадия Активность гепа- Общий Удельная раназы, нмоль/ч белок, мг активность Гомогенат 12192 3465 3,52 Суспенатант 9892 2098 4,72 Осадок 4480 552 8,12 Конканавалин А-Сефароза 5523 63,1 87,53FASEB J. 4, 1577-1590. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ обнаружения активности гепараназы млекопитающих в пробе, включающий в себя следующие стадии:a) контактирование тестируемой пробы с субстратом гепараназы в течение времени и в условиях, достаточных для деградации гепараназой в пробе субстрата гепараназы, где указанный субстрат представляет собой вещество, которое связывается с гепарансульфатсвязывающим белком; б) отделение продуктов деградации от недеградированного или частично деградированного субстрата гепараназы путем связывания недеградированного или частично деградированного субстрата гепараназы с гепарансульфатсвязывающим белком и в) обнаружение отделенных продуктов деградации для выявления активности гепараназы в пробе. 38 2. Способ по п.1, отличающийся тем, что указанная проба представляет собой сыворотку млекопитающего, выбранную из сыворотки человека или сыворотки млекопитающего, не являющегося человеком. 3. Способ по п.1, отличающийся тем, что указанная проба представляет собой клеточный и тканевый гомогенат или экстракт. 4. Способ по любому из пп.1-3, отличающийся тем, что указанный субстрат гепараназы является меченым субстратом. 5. Способ по п.4, отличающийся тем, что указанный субстрат гепараназы является радиоактивно меченным субстратом. 6. Способ по любому из пп.1-5, отличающийся тем, что указанный субстрат гепараназы является гепарансульфатом. 7. Способ по п.6, отличающийся тем, что указанный гепарансульфат представляет собой гепарансульфат слизистой оболочки свиньи или гепарансульфат почки быка. 8. Способ по п.7, отличающийся тем, что указанный гепарансульфат представляет собой 3H-гепарансульфат слизистой оболочки свиньи или 3H-гепарансульфат почки быка. 9. Способ по любому из пп.1-8, отличающийся тем, что указанный гепарансульфатсвязывающий белок является гликопротеином с высоким содержанием гистидина. 10. Способ по п.9, отличающийся тем, что указанный гликопротеин с высоким содержанием гистидина является куриным гликопротеином с высоким содержанием гистидина. 11. Способ по любому из пп.1-10, отличающийся тем, что указанный гепарансульфатсвязывающий белок является иммобилизованным. 12. Способ по п.11, отличающийся тем, что указанный гепарансульфатсвязывающий белок иммобилизован путем связывания с гранулами агарозы. 13. Способ по любому из пп.1-12, отличающийся тем, что указанную пробу приводят в контакт с указанным субстратом гепараназы при температуре в пределах от 35 до 40 С,предпочтительно примерно 37 С, в течение периода времени от 2 до 48 ч, предпочтительно примерно 16 ч, при рН в диапазоне от 4,2 до 7,5,предпочтительно примерно 5,1. 14. Набор, используемый для обнаружения активности гепараназы млекопитающих в пробе способом по любому из пп.1-13, содержащий в компартментализованном видеa) субстрат гепараназы; б) гепарансульфатсвязывающий белок и в) необязательно, инструкции для выполнения способа согласно изобретению по любому из указанных пп.1-13. 15. Набор по п.14, отличающийся тем, что указанный субстрат гепараназы является меченым субстратом. 39 16. Набор по п.15, отличающийся тем, что указанный субстрат гепараназы является радиоактивно меченным субстратом. 17. Набор по любому из пп.14-16, отличающийся тем, что указанный субстрат гепараназы является гепарансульфатом. 18. Набор по п.17, отличающийся тем, что указанный гепарансульфат представляет собой гепарансульфат слизистой оболочки свиньи или гепарансульфат почки быка. 19. Набор по п.18, отличающийся тем, что указанный гепарансульфат представляет собой 3H-гепарансульфат слизистой оболочки свиньи или 3H-гепарансульфат почки быка. 20. Набор по любому из пп.14-19, отличающийся тем, что указанный гепарансульфат 003901 40 связывающий белок является гликопротеином с высоким содержанием гистидина. 21. Набор по п.20, отличающийся тем, что указанный гликопротеин с высоким содержанием гистидина является куриным гликопротеином с высоким содержанием гистидина. 22. Набор по любому из пп.14-21, отличающийся тем, что указанный гепарансульфатсвязывающий белок является иммобилизованным. 23. Набор по п.22, отличающийся тем, что указанный гепарансульфатсвязывающий белок иммобилизован путем связывания с гранулами агарозы.
МПК / Метки
МПК: C12N 9/24
Метки: способа, активности, способ, обнаружения, осуществления, набор, гепараназы, млекопитающих
Код ссылки
<a href="https://eas.patents.su/22-3901-sposob-obnaruzheniya-aktivnosti-geparanazy-mlekopitayushhih-i-nabor-dlya-osushhestvleniya-sposoba.html" rel="bookmark" title="База патентов Евразийского Союза">Способ обнаружения активности гепараназы млекопитающих и набор для осуществления способа</a>
Предыдущий патент: Усеченные рецепторы фактора некроза опухолей, фармацевтические композиции на их основе и способы применения указанных факторов и композиций
Следующий патент: Индукторы апоптоза, содержащие их противораковые и канцеростатические средства, способ индуцирования апоптоза, полисахариды и способы их получения
Случайный патент: Способ спектрального конфигурирования сигналов, модулированных методом ортогонального частотного уплотнения (очу), для электрической сети