Применение бессывороточной культуральной среды, содержащей антиоксидант, для снижения окисления рекомбинантных гонадотропинов
Формула / Реферат
1. Применение антиоксиданта в составе бессывороточной культуральной среды для снижения окисления рекомбинантных димерных гонадотропинов, продуцируемых культивируемыми клетками.
2. Применение по п.1, отличающееся тем, что выбранный антиоксидант выбран из группы, включающей
L-глутатион в концентрации приблизительно от 1 до приблизительно 20 мг/л;
2-меркаптоэтанол в концентрации приблизительно от 5 до приблизительно 15 мг/л;
L-метионин в концентрации приблизительно от 200 до приблизительно 400 мг/л и
сочетание аскорбиновой кислоты в концентрации приблизительно от 10 до приблизительно 50 мг/л и (+)-альфа-токоферола в концентрации приблизительно от 5 до приблизительно 25 мг/л.
3. Применение по п.2, где указанный антиоксидант выбран из группы, включающей
L-глутатион в концентрации приблизительно 3 мг/л;
2-меркаптоэтанол в концентрации приблизительно 10 мг/л;
L-метионин в концентрации приблизительно 250 мг/л и
сочетание аскорбиновой кислоты в концентрации приблизительно 30 мг/л и (+)-альфа-токоферола в концентрации приблизительно 14 мг/л.
4. Применение по любому из пп.1-3, где указанная культуральная среда представляет собой среду с определенным химическим составом.
5. Применение по любому из пп.1-4, где указанная культуральная среда выбрана из группы, состоящей из SFM 90, SFM 90.1, SupMed300, DMEM, DMEM/F12, SFM CHO 3а, CHP PFM, ProCHO 5, EX-CELL, CHO-CD3, CHO III PFM, CHO-S-SFM II, CHO-DHFR, SFM4CHO, Ultra CHO, HyQ PF CHO, HyQ SFX CHO, HyQ CDM4CHO, IS CHO-CD, IS CHO-V и их производных.
6. Применение по п.5, где указанный рекомбинантный димерный гонадотропин представляет собой фолликулостимулирующий гормон (ФСГ).
7. Применение по любому из пп.1-6, где указанный рекомбинантный димерный гонадотропин продуцируется клетками яичника китайского хомяка (CHO).
8. Способ снижения окисления рекомбинантных димерных гонадотропинов в процессе их получения, включающий культивирование клеток, экспрессирующих указанные рекомбинантные димерные гонадотропины, в бессывороточной культуральной среде, содержащей антиоксидант.
9. Способ по п.8, где указанная культуральная бессывороточная среда, содержащая антиоксидант, представляет собой среду, охарактеризованную в любом из пп.1-5.
10. Способ по п.8 или 9, где стадия культивирования клеток включает в себя следующие этапы:
a) инокуляция указанных клеток в указанную бессывороточную культуральную среду;
b) фаза роста и
c) фаза продукции.
11. Способ по любому из пп.8-10, дополнительно включающий сбор среды, содержащей указанные рекомбинантные димерные гонадотропины.
12. Способ по любому из пп.8-11, дополнительно включающий очистку указанных рекомбинантных димерных гонадотропинов.
13. Способ по любому из пп.7-12, где указанный рекомбинантный гонадотропин представляет собой ФСГ.
14. Способ по любому из пп.7-13, где указанный рекомбинантный димерный гонадотропин продуцирован клетками CHO.
15. Бессывороточная культуральная среда для снижения окисления рекомбинантных димерных гонадотропинов, содержащая антиоксидант, выбранный из группы, включающей
L-глутатион в концентрации приблизительно 3 мг/л;
2-меркаптоэтанол в концентрации приблизительно 10 мг/л;
L-метионин в концентрации приблизительно 250 мг/л и
сочетание аскорбиновой кислоты в концентрации приблизительно от 10 до приблизительно 50 мг/л и (+)-альфа-токоферола в концентрации приблизительно от 5 до приблизительно 25 мг/л.
16. Культуральная среда по п.15, где указанный антиоксидант представляет собой сочетание аскорбиновой кислоты в концентрации приблизительно 30 мг/л и (+)-альфа-токоферола в концентрации приблизительно 14 мг/л.
17. Культуральная среда по п.15 или 16, где указанная культуральная среда представляет собой среду с определенным химическим составом.
Текст
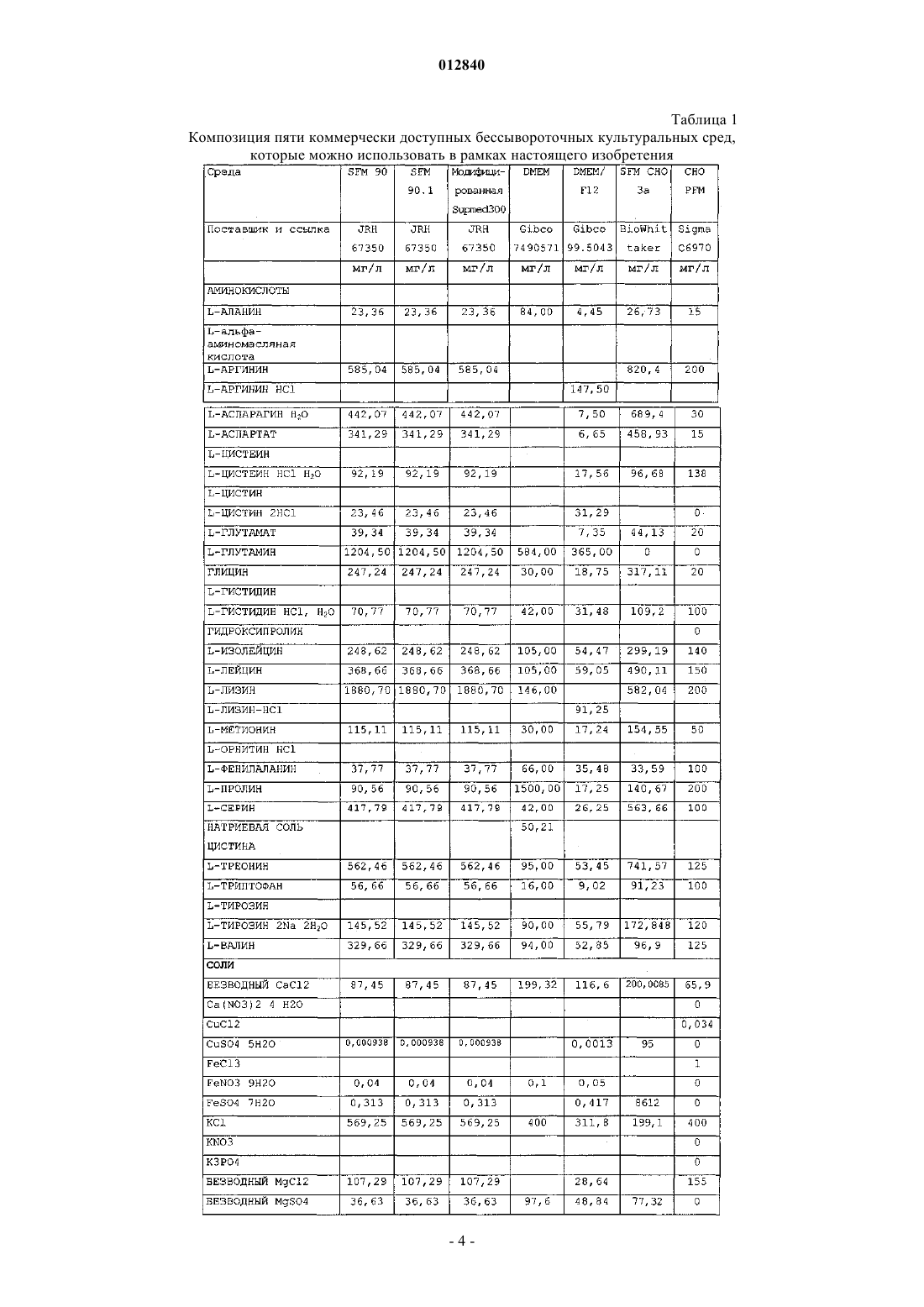
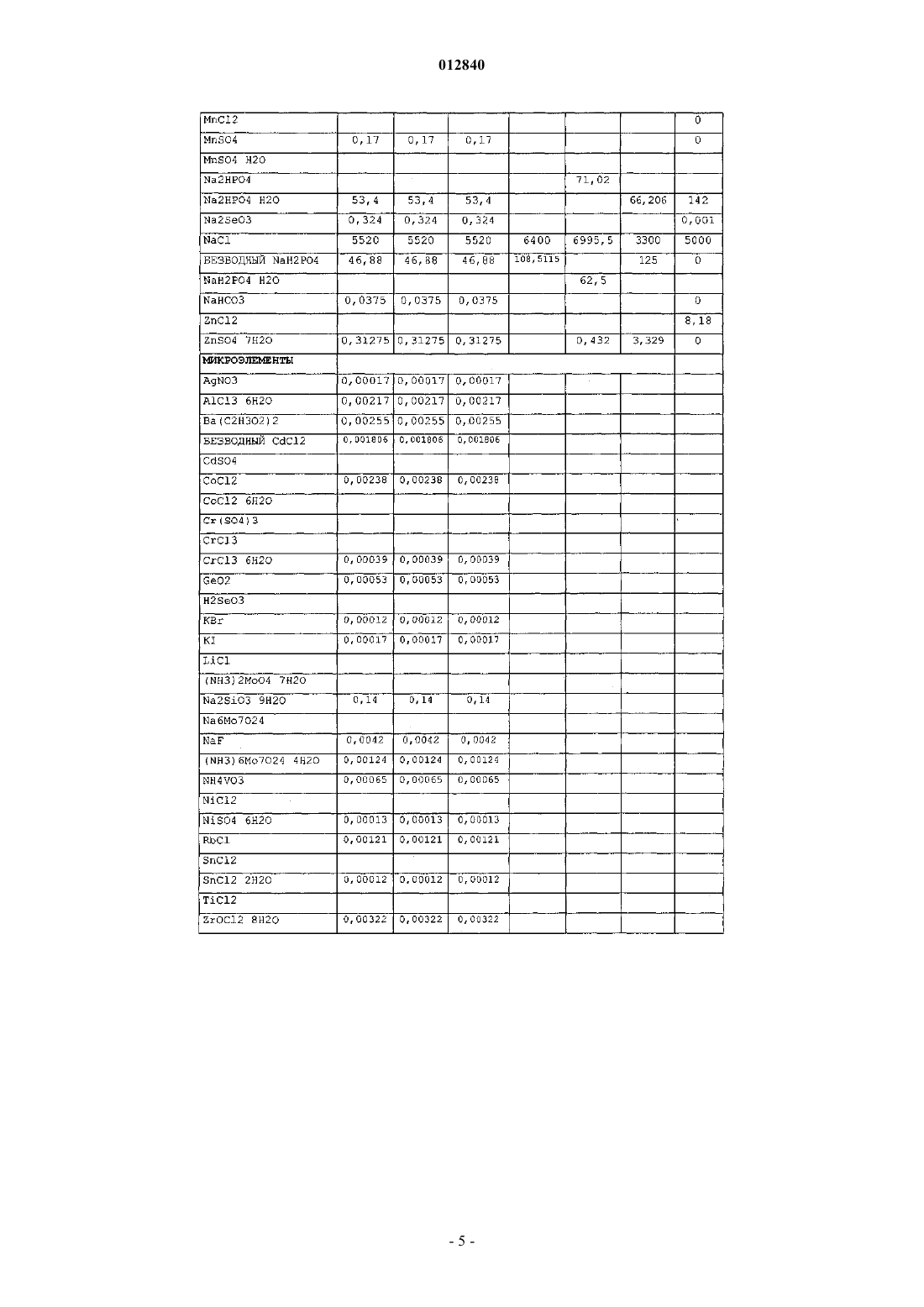
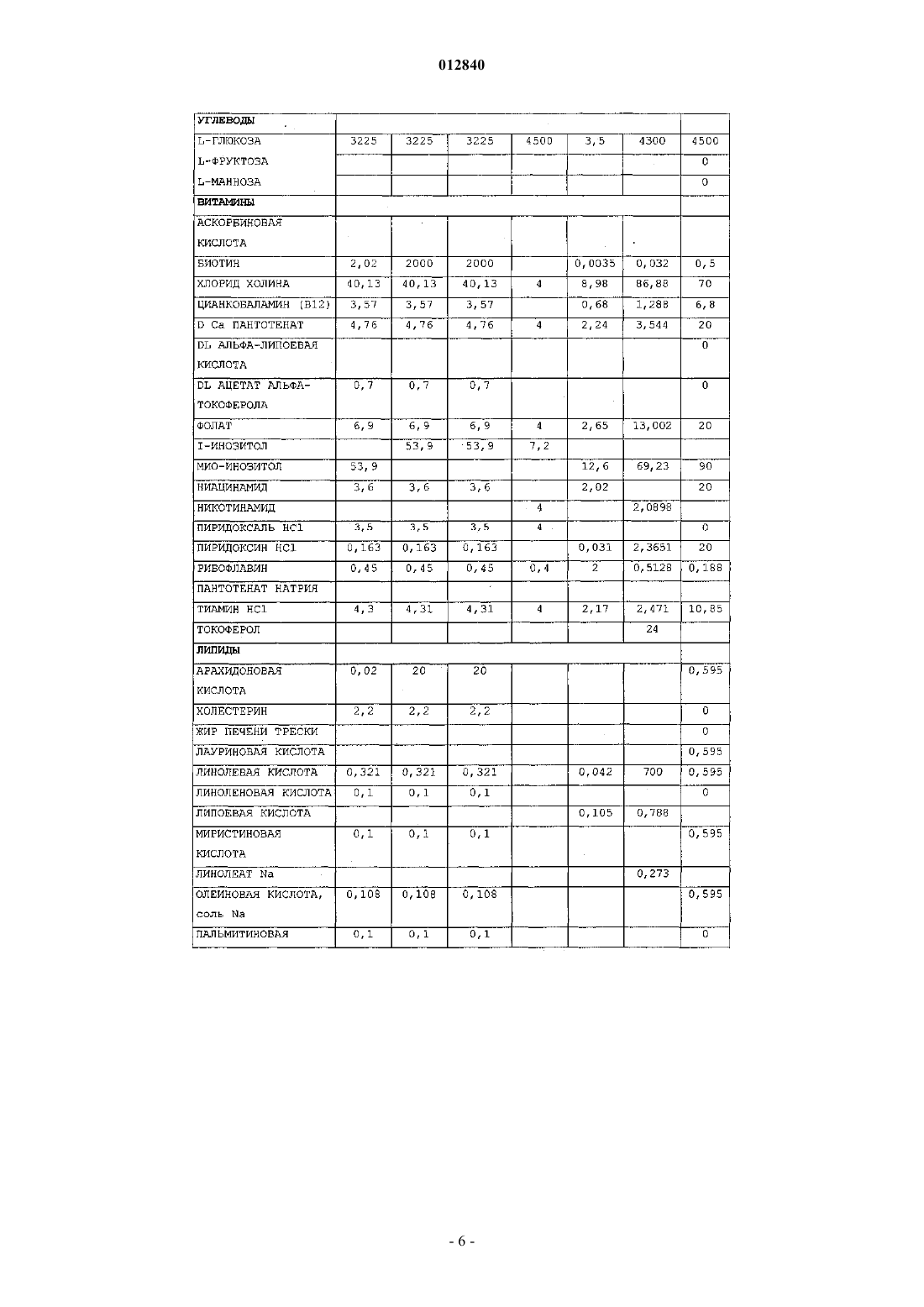
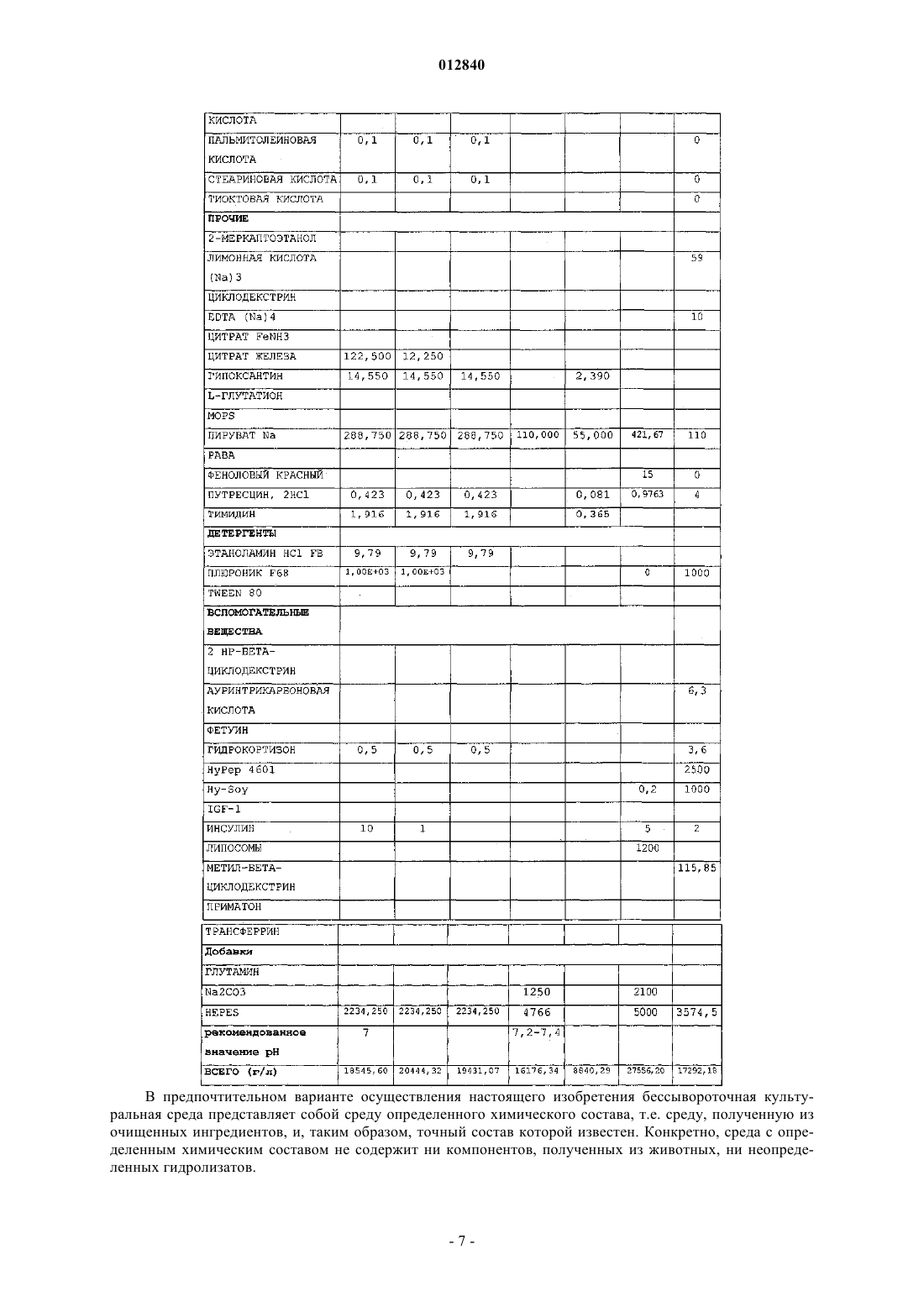
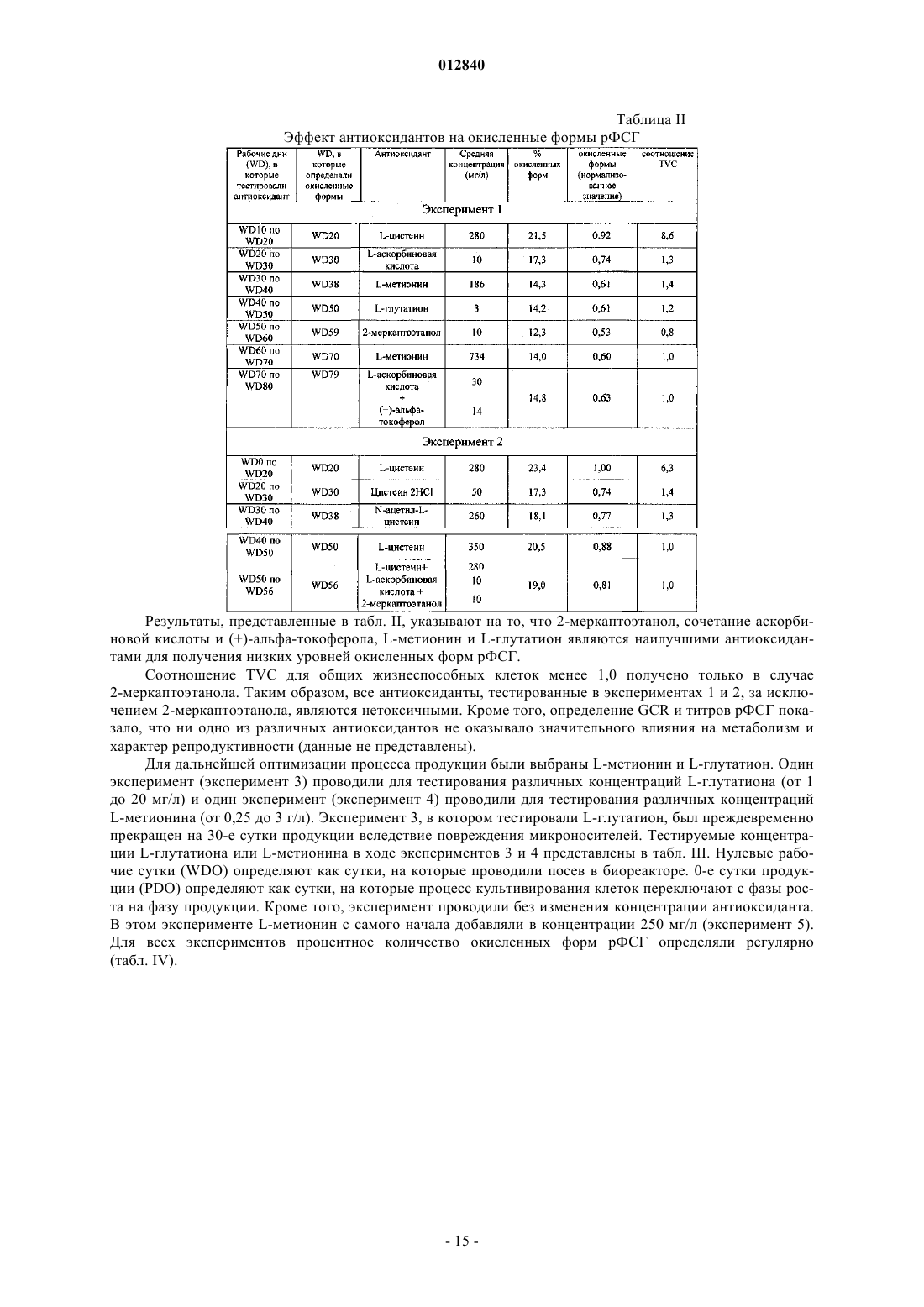
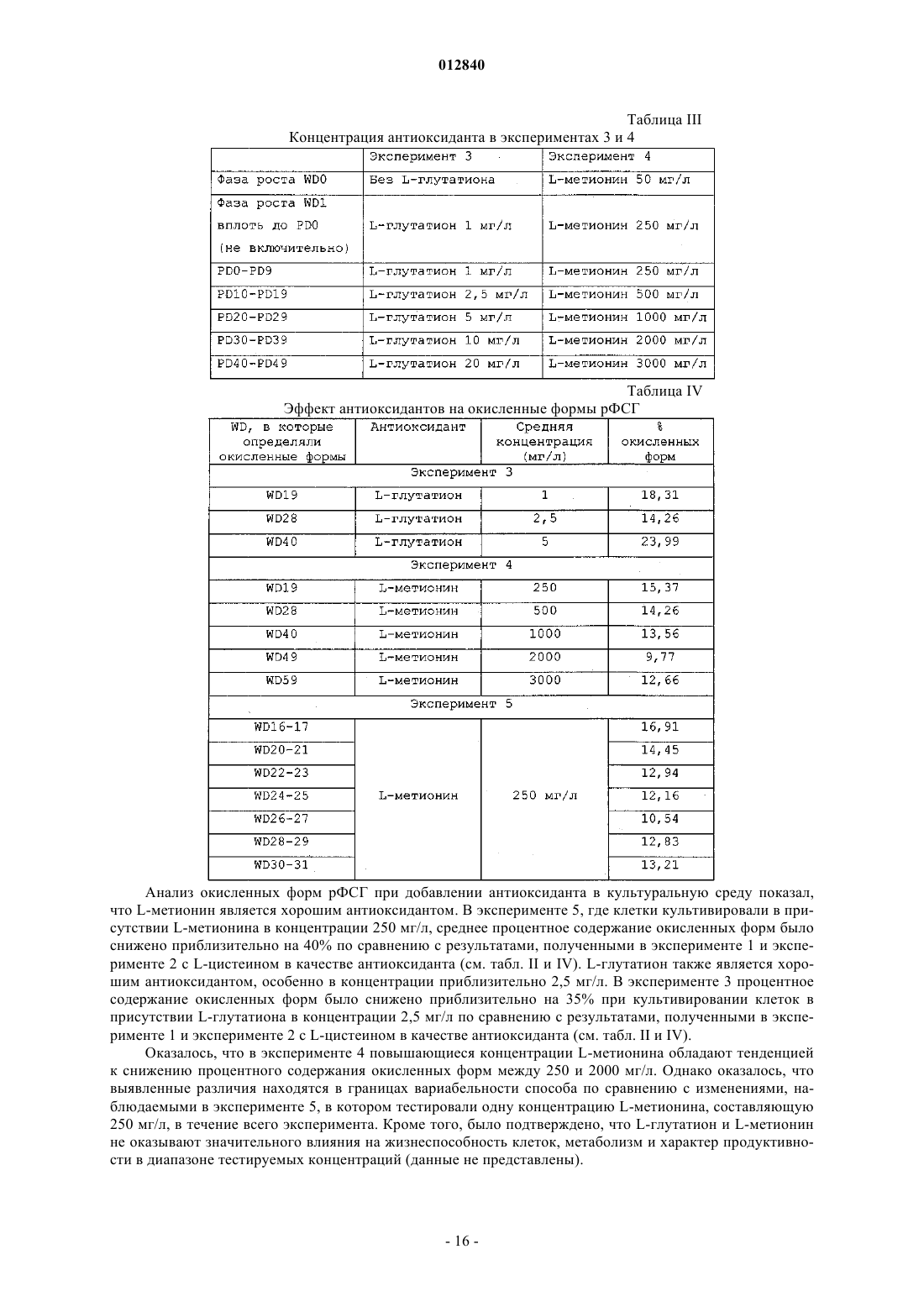
012840 Область изобретения Настоящее изобретение относится к области производства рекомбинантных белков. Более конкретно, оно относится к применению бессывороточной культуральной среды, содержащей антиоксидант, для продукции рекомбинантных димерных гонадотропинов. Антиоксидант может быть выбран из группы,состоящей из L-глутатиона, 2-меркаптоэтанола, L-метионина и сочетания аскорбиновой кислоты и(+)-альфа-токоферола. Предпосылки изобретения Настоящее изобретение относится к получению рекомбинантного фолликулостимулирующего гормона (ФСГ), который относится к классу гонадотропинов. ФСГ используют для лечения бесплодия и нарушений репродуктивной системы у пациентов как женского, так и мужского пола. ФСГ используют у женщин-пациенток для индукции овуляции (OI) и для контролируемой гиперстимуляции яичников (COH), например, во вспомогательных репродуктивных технологиях (ART). При типичной схеме лечения для индукции овуляции пациентке вводят суточные инъекции ФСГ или его производного (приблизительно от 75 до 300 ME РФСГ/сутки) в течение периода приблизительно от 6 до приблизительно 12 суток. При типичной схеме лечения для контролируемой гиперстимуляции яичников пациентке вводят суточные инъекции ФСГ или его производного (приблизительно 150-600 ME РФСГ/сутки) в течение периода приблизительно от 6 до приблизительно 12 суток. Также ФСГ используют для индукции сперматогенеза у мужчин, страдающих олигоспермией. Схема с использованием 150 ME ФСГ 3 раза в неделю в сочетании с 2500 ME hCG 2 раза в неделю является успешной для достижения улучшения показателей подсчета сперматозоидов у мужчин, страдающих гипогонадотропным гипогонадизмом. Вследствие значения ФСГ для лечения нарушений фертильности желательным является предоставление ФСГ с высокой стабильностью и высоко специфичной активностью. В природе ФСГ продуцируется гипофизом. Для фармацевтического применения ФСГ можно получать рекомбинантными способами (рФСГ) или его можно выделять из мочи женщин в постменопаузальном периоде (мФСГ). Для процесса изготовления рФСГ необходимы две основные стадии: 1) культивирование полученной способами генетической инженерии клетки, экспрессирующей ФСГ, и 2) очистка белка. Затем в целях получения фармацевтической композиции белок составляют с фармацевтически приемлемым носителем. Ранее для культивирования клеток использовали культуральную среду, дополненную сывороткой,которая служила в качестве универсальной пищевой добавки для роста и поддержания всех клеточных линий млекопитающих. Однако появление BSE (бычьей спонгиформной энцефалопатии), трансмиссивного нейродегенеративного заболевания крупного рогатого скота с длительным латентным или инкубационным периодом, вызвало опасения регулирующих органов, касающиеся использования полученной из животных сыворотки при получении биологически активных продуктов. Таким образом, в настоящее время является предпочтительной продукция рекомбинантных белков с использованием бессывороточной среды. Такие среды хорошо известны в данной области и их коммерчески производят несколько компаний, например, такие как Sigma, BioWhittaker, Gibco BRL, Cambrex и JRH. Одной из проблем, встречаемых при хранении рФСГ, является наличие окисленных форм ФСГ. Для частичного решения этой проблемы в фармацевтическую композицию можно добавлять антиоксидант в целях стабилизации белка ФСГ в процессе хранения перед введением пациенту, нуждающемуся в лечении. Например, в ЕР 0853945 (Skrabanja and Van den Oetelaar, 1998) описаны жидкие содержащие гонадотропин составы, смешанные со стабилизатором, например, таким как цитрат натрия, в концентрации 25-100 мМ и L-метионин в концентрации 1-10 мМ. Показано, что такие составы позволяют хранить составы ФСГ в течение более длительных периодов времени. WO 92/15614 (Takruri Н., 1992) также относится к способу ингибирования окисления полипептида в жидкой или полужидкой фармацевтической композиции, например, такой как среда для хранения или водный офтальмический раствор. Конкретно, вWO 92/15614 показано, что офтальмический раствор или офтальмическая мазь, содержащая L-метионин в концентрации 10 мг/л, стабилизирует эпидермальный фактор роста человека. Однако в указанных выше документах описано применение антиоксиданта только в фармацевтическом составе, но не в культуральной среде. Также в культуральную среду можно добавлять аминокислоты и соединения, проявляющие антиоксидантную активность, либо в качестве пищевых добавок, либо для защиты клеточных линий от гибели клеток. Например, в патенте США 4560655 описана бессывороточная среда, содержащая приблизительно 30 мг/л L-метионина, где указанную среду используют для культивирования клеток семенника свиньи, клеток миеломы AG 14 и клеток селезенки мыши. В WO 95/12664 описан способ, посредством которого в конкретной клеточной линии можно преодолеть недостаток, являющийся следствием недостаточных количеств различных ограничивающих рост факторов, где один из них представляет собой аминокислоту L-метионин. Конкретно, в WO 95/12664 описан способ адаптации клеточной линии CHOE5F3G, которая экспрессирует M-CSF человека, к росту при повышенной плотности клеток. В этом способе клетки CHO E5F3G выращивают в среде, содержащей 104 мг/л L-метионина (см. пример и табл. 2).Yun et al. описывают, что добавление сочетания глутатиона и хелаторов железа в культуральную среду снижает гибель клеток CHO (Yun et al., 2003). Далее, Saito et al. описывают, что для защиты клеточной линии от гибели в культуральной среде можно использовать различные антиоксиданты (Saito et al.,2003). Однако в WO 95/12664, патенте США 4560655, Yun et al. и Saito et al. не описан потенциальный эффект (если он есть) аминокислот, глутатиона и хелаторов железа на уровень окисления рекомбинантного белка, продуцируемого клеточной линией. В заключение, в этих документах описано только применение L-метионина или глутатиона в сочетании с хелаторами железа для улучшения роста и/или жизнеспособности культивируемых клеток.WO 99/50390 относится к культуральной среде для продукции лейкоцитами интерферона-, где указанная культуральная среда содержит метионин. Посредством ВЭЖХ показано, что качество белка интерферона- после очистки улучшается при добавлении в культуральную среду метионина. Авторы изобретения в WO 99/50390 сделали предположение, что это улучшение может быть следствием снижения окисления белка интерферона-. Далее в WO 99/50390 указано, что слишком низкое количество метионина приводит к снижению эффекта и что слишком большое количество вызывает снижение выхода интерферона. Конкретно, в WO 99/50390 описано, что диапазон приблизительно от 50 до 100 мг/л является особенно предпочтительным диапазоном при продукции интерферона- лейкоцитами. Кроме того, вWO 99/50390 описана только среда для продукции интерферона-, который представляет собой мономерный белок. В WO 99/50390 не упоминается и не предлагается среда для продукции димерных гормонов, например, таких как ФСГ, который секретируется исключительно при димеризации (Matzuk et al.,1988). Таким образом, ни один из упомянутых выше документов не относится к применению антиоксиданта в бессывороточной культуральной среде для снижения окисления димерных гонадотропинов. Сущность изобретения В основе настоящего изобретения лежит неожиданное открытие, что уже в ходе производства рФСГ в супернатанте клеточной культуры появляются окисленные формы рФСГ. Более того, продукция рФСГ в бессывороточной среде приводит к более высоким уровням окисленных форм, чем продукция рФСГ в содержащей сыворотку среде. В рамках настоящего изобретения было неожиданно обнаружено,что уровни окисленных форм рФСГ можно снижать не только в ходе хранения, но и в ходе стадии культивирования. Это снижение можно осуществлять без нарушения продуктивности. Снижение проводят посредством добавления антиоксиданта в культуральную среду. Конкретно, было обнаружено, что дополнение бессывороточной среды либо (i) 2-меркаптоэтанолом, либо (ii) сочетанием аскорбиновой кислоты и (+)-альфа-токоферола, либо (iii) L-метионином, либо (iv) L-глутатионом в ходе культивирования клеток, экспрессирующих рФСГ, снижает уровни окисленных форм рФСГ. Таким образом, в первом аспекте это изобретение относится к применению бессывороточной культуральной среды для получения рекомбинантных димерных гонадотропинов, отличающихся тем, что указанная культуральная среда содержит антиоксидант, выбранный из группы, состоящей изL-глутатиона в концентрации приблизительно от 1 до приблизительно 20 мг/л; 2-меркаптоэтанола в концентрации приблизительно от 5 до приблизительно 15 мг/л;L-метионина в концентрации приблизительно от 200 до приблизительно 500 мг/л и сочетания аскорбиновой кислоты в концентрации приблизительно от 10 до приблизительно 50 мг/л и (+)-альфа-токоферола в концентрации приблизительно от 5 до приблизительно 25 мг/л. Во втором аспекте это изобретение относится к способу снижения уровней окисленных форм рекомбинантного димерного гонадотропина в ходе процесса его изготовления, отличающемуся тем, что клетки, экспрессирующие указанный рекомбинантный димерный гонадотропин, культивируют в бессывороточной культуральной среде, содержащей антиоксидант. Третий аспект этого изобретения относится к бессывороточной культуральной среде для получения рекомбинантных димерных гонадотропинов, отличающейся тем, что указанная культуральная среда содержит антиоксидант, выбранный из группы, состоящей изL-глутатиона в концентрации приблизительно от 1 до приблизительно 20 мг/л; 2-меркаптоэтанола в концентрации приблизительно от 5 до приблизительно 15 мг/л;L-метионина в концентрации приблизительно от 200 до приблизительно 500 мг/л и сочетания аскорбиновой кислоты в концентрации приблизительно от 10 до приблизительно 50 мг/л и (+)-альфа-токоферола в концентрации приблизительно от 5 до приблизительно 25 мг/л. Подробное описание изобретения Настоящее изобретение связано с открытием того, что уровни окисленных форм рФСГ можно значительно снижать при культивировании клеток, экспрессирующих рФСТ, в бессывороточной среде, содержащей антиоксиданты. Как показано в примере 3, для снижения уровней окисленных форм рФСГ в ходе процесса культивирования особенно предпочтительными являются либо (i) 2-меркаптоэтанол, либо(ii) сочетание аскорбиновой кислоты и (+)-альфа-токоферола, либо (iii) L-метионин, либо(iv) L-глутатион. Важно, что этого снижения можно достигать без нарушения жизнеспособности и метаболизма клетки и без снижения титров рФСГ.-2 012840 Таким образом, первый аспект настоящего изобретения относится к применению бессывороточной культуральной среды для получения рекомбинантных димерных гонадотропинов, отличающейся тем,что указанная культуральная среда содержит антиоксидант, выбранный из группы, состоящей изL-глутатиона в концентрации приблизительно от 1 до приблизительно 20 мг/л; 2-меркаптоэтанола в концентрации приблизительно от 5 до приблизительно 15 мг/л;L-метионина в концентрации приблизительно от 200 до приблизительно 500 мг/л и сочетания аскорбиновой кислоты в концентрации приблизительно от 10 до приблизительно 50 мг/л и (+)-альфа-токоферола в концентрации приблизительно от 5 до приблизительно 25 мг/л. Предпочтительно бессывороточная культуральная среда в соответствии с настоящим изобретеним содержит L-глутатион в концентрации приблизительно от 1, 1,5, 2 до приблизительно 4, 5, 6, 7, 8, 9, 10,15 или 20 мг/л. Наиболее предпочтительно бессывороточная культуральная среда содержит L-глутатион в концентрации приблизительно 2,5 или 3 мг/л. Как используют в настоящем описании, термин "глутатион" используют взаимозаменяемо с термином "L-глутатион". Предпочтительно бессывороточная культуральная среда в соответствии с настоящим изобретением содержит 2-меркаптоэтанол в концентрации приблизительно от 5, 6, 7, 8, 9 до приблизительно 11, 12, 13,14 или 15 мг/л. Наиболее предпочтительно бессывороточная культуральная среда содержит 2-меркаптоэтанол в концентрации приблизительно 10 мг/л. Предпочтительно бессывороточная культуральная среда в соответствии с настоящим изобретением содержит сочетание аскорбиновой кислоты в концентрации приблизительно от 10 до приблизительно 50 мг/л и (+)-альфа-токоферола в концентрации в диапазоне приблизительно от 5 до приблизительно 25 мг/л. Более предпочтительно такая среда содержит (+)-альфа-токоферол в концентрации приблизительно от 5, 8, 10 или 12 до приблизительно 16, 18, 20, 22 или 25 мг/л и аскорбиновую кислоту в концентрации приблизительно от 15, 20 или 25 до приблизительно 35, 40 или 45 мг/л. Наиболее предпочтительно такая бессывороточная культуральная среда содержит (+)-альфа-токоферол в концентрации приблизительно 14 мг/л и аскорбиновую кислоту в концентрации приблизительно 30 мг/л. Как используют в настоящем описании, термин "(+)-альфа-токоферол" используют взаимозаменяемо с термином "витамин А" и термин "аскорбиновая кислота" используют взаимозаменяемо с термином "Lаскорбиновая кислота". Предпочтительно бессывороточная культуральная среда в соответствии с настоящим изобретением содержит L-метионин в концентрации приблизительно от 200, 205, 210, 215, 220, 225, 230, 235, 240 или 245 мг/л до приблизительно 300, 325, 350, 375, 400, 425, 450, 475 или 500 мг/л. Наиболее предпочтительно бессывороточная культуральная среда содержит L-метионин в концентрации приблизительно 250 мг/л. Как используют в настоящем описании, термин "метионин" используют взаимозаменяемо с термином "L-метионин". Любую бессывороточную культуральную среду можно дополнять антиоксидантами в соответствии с настоящим изобретением. Коммерчески доступные бессывороточные среды, которые можно использовать в соответствии с настоящим изобретением, включают, например, SFM 90 (JRH, 67350), SFM 90.1 (JRH, 67350), Supmed300 или модифицированная Supmed300 (JRH, 67350), DMEM (Gibco, 7490571), DMEM/F12 (Gibco, 99.5043),SFM CHO 3a (BioWhittaker), CHO PFM (Sigma, C6970), ProCHO 5, среды EX-CELL, такие как EX-CELL 302 (JRH, каталожный 14312-1000M) или EX-CELL 325 (JRH, каталожный 14335-1000M),CHO-CD3 (Sigma, каталожныйC-1490), CHO III PFM (Gibco, каталожный 96-0334SA), CHO-S-SFMScientific, каталожный 91119), IS CHO-V (Irvine Scientific, каталожный 9197) и их производные. Композиция SFM 90, SFM 90.1, SupMed300, DMEM, DMEM/F12, SFM CHO 3 а и СНР PFM, которые можно использовать в соответствии с настоящим изобретением, представлена в табл. 1.-3 012840 Таблица 1 Композиция пяти коммерчески доступных бессывороточных культуральных сред,которые можно использовать в рамках настоящего изобретения В предпочтительном варианте осуществления настоящего изобретения бессывороточная культуральная среда представляет собой среду определенного химического состава, т.е. среду, полученную из очищенных ингредиентов, и, таким образом, точный состав которой известен. Конкретно, среда с определенным химическим составом не содержит ни компонентов, полученных из животных, ни неопределенных гидролизатов.-7 012840 Гонадотропины, которые можно продуцировать в соответствии с настоящим изобретением, включают лютеинизирующий гормон (LH; регистрационный номер OMIM152780), фолликулостимулирующий гормон (ФСГ; регистрационный номер OMIM136530), хорионический гонадотропин, (CG; регистрационный номер OMIM118860) и тиреотропный гормон (TSH; регистрационный номер OMIM188540). Гонадотропины представляют собой димерные гормоны. Каждый из этих гормонов состоит из нековалентного димера из субъединиц альфа и бета. Альфа-субъединица является одинаковой для всех 4 гормонов (регистрационный номер OMIM118850), а бета-субъединица определяет эндокринную функцию димера (Talmadge et al., 1983). В наиболее предпочтительном варианте осуществления настоящего изобретения гонадотропин представляет собой ФСГ человека. Как используют в настоящем описании, термин "ФСГ" относится к димерному белку, состоящему из альфа-субъединицы, соответствующей регистрационному номеруSwissProtP01215, и бета-субъединицы, соответствующей регистрационному номеру SwissProtP01225. Поскольку ФСГ является растворимым секретируемым белком, он высвобождается в супернатант клеточной культуры либо с помощью его природного сигнального пептида, либо с помощью гетерологичного сигнального пептида, т.е. сигнального пептида, образованного из другого секретируемого белка, который может быть более эффективным в конкретной используемой экспрессирующей системе. Кроме того, термин ФСГ включает варианты по сплайсингу, аллельные варианты, мутеины, функциональные производные, активные фракции, слитые белки и белки с круговой перестановкой димерного белка, состоящего из альфа-субъединицы, соответствующей регистрационному номеру SwissProtP01215, и бета-субъединицы, соответствующей регистрационному номеру SwissProtP01225. Как используют в настоящем описании, термин "мутеин" относится к аналогам ФСГ, в которых один или несколько аминокислотных остатков природного ФСГ или вирусного ФСГ замещены другими аминокислотными остатками или удалены или к природной последовательности ФСГ добавлен один или несколько аминокислотных остатков, без существенного изменения активности полученных продуктов по сравнению с ФСГ дикого типа. Эти мутеины получают известными способами синтеза и/или сайтнаправленного мутагенеза или любым другим способом, пригодным для этого. Мутеины в соответствии с настоящим изобретением включают белки, кодируемые нуклеиновой кислотой, такой как ДНК или РНК, которая гибридизуется с ДНК или РНК, которая кодирует ФСГ в строгих условиях. Термин "строгие условия" относится к условиям гибридизации и последующего промывания, которые специалисты в данной области обычно относят к "строгим" (см., например, Ausubel et al.,Current Protocols in Molecular Biology, выше, Intersclence, N.Y., 6.3 и 6.4, 1987, 1992). He ограничиваясь этим, примеры строгих условий включают условия промывания на 12-20 С ниже вычисленной Tm исследуемого гибрида, например в 2 SSC и 0,5% SDS в течение 5 мин, 2 SSC и 0,1% SDS в течение 15 мин; 0,1 SSC и 0,5% SDS при 37 С в течение 30-60 мин, а затем, 0,1 SSC и 0,5% SDS при 68 С в течение 30-60 мин. Специалисты в данной области понимают, что условия строгости также зависят от длины последовательности ДНК, олигонуклеотидного зонда (такой как 10-40 оснований) или смешанных олигонуклеотидных зондов. Если используют смешанные зонды, то вместо SSC предпочтительным является применение хлорида тетраметиламмония (TMAC). См. Ausubel, выше. В предпочтительном варианте осуществления мутеин ФСГ обладает по меньшей мере 40% идентичностью с последовательностью встречающегося в природе ФСГ. Более предпочтительно он обладает по меньшей мере 50, 55, 60, 65, 70, 75, 80, 85% или наиболее предпочтительно по меньшей мере 90, 95,96, 97, 98 или 99% идентичностью с ней. Идентичность отражает взаимосвязь между двумя или более полипептидными последовательностями или двумя или более полинуклеотидными последовательностями, определяемую сравнением последовательностей. Как правило, идентичность относится к точному соответствию нуклеотида с нуклеотидом или аминокислоты с аминокислотой двух полинуклеотидных или двух полипептидных последовательностей соответственно на протяжении длины сравниваемых последовательностей. В случае последовательностей, где соответствие является неполным, можно определять "% идентичности". Как правило, две последовательности, подлежащие сравнению, выравнивают для обеспечения максимальной корреляции между последовательностями. Это включает вставку "делеций" либо в одну,либо в обе последовательности для повышения степени выравнивания. % идентичности можно определять на протяжении полной длины каждой из сравниваемых последовательностей (так называемое "глобальное выравнивание"), что является особенно пригодным для последовательностей одинаковой или очень сходной длины, на протяжении более коротких, определенных длин (так называемое "локальное выравнивание"), которое является более пригодным для последовательностей неравной длины. В рамках настоящего изобретения "% идентичности" относится к глобальной процентной идентичности, определенной на протяжении всей длины каждой из сравниваемых последовательностей. Для определения того, обладает ли конкретный полипептид процентной идентичностью с последовательностью по настоящему изобретению, можно использовать известные компьютерные программы. Такие алгоритмы и программы включают, например, TBLASTN, BLASTP, FASTA, TFASTA иThompson et al., 1994). Гомологию последовательностей белков и нуклеиновых кислот предпочтительно оценивают с использованием базового инструментария поиска локальных блоков ("BLAST"), который хорошо известен в данной области (Altschul et al., 1990; Altschul et al., 1997; Karlin and Altschul, 1990). Программы BLAST идентифицируют гомологичные последовательности посредством идентификации сходных сегментов, которые обозначают в настоящем описании как "пары сегментов с максимальным сходством", между представляющей интерес аминокислотной последовательностью или последовательностью нуклеиновой кислоты и тестируемой последовательностью, которую предпочтительно получают из базы данных последовательностей белков или нуклеиновых кислот. Пары сегментов с максимальным сходством предпочтительно идентифицируют (т.е. выравнивают) посредством оценочных матриц, множество из которых известно в данной области. Используемой оценочной матрицей может быть матрица BLOSUM62 (Gonnet et al., 1992; Henikoff and Henikoff, 1993). Также можно использовать матрицы РАМ или РАМ 250 (см., например, Schwartz and Dayhoff, eds, (1978) Matrices for Detecting DistanceRelationships: Atlas of Protein Sequence and Structure, Washington: National Biomedical Research Foundation). Программы BLAST оценивают статистическую значимость всех идентифицированных пар сегментов с максимальным сходством и предпочтительно отбирают те сегменты, которые удовлетворяют указанному пользователем порогу значимости, такому как указанная пользователем процентная гомология. Предпочтительно статистическую значимость для пары сегментов с максимальным сходством оценивают с использованием формулы статистической значимости Karlin (Karlin and Altschul, 1990). ПрограммыBLAST можно использовать с параметрами по умолчанию или с модифицированными параметрами, установленными пользователем. Предпочтительный способ определения наилучшего полного соответствия между представляющей интерес последовательностью (последовательностью по настоящему изобретению) и подвергаемой выравниванию последовательностью, также обозначаемый как глобальное выравнивание последовательностей, можно определять с использованием компьютерной программы FASTDB на основе алгоритмаBrutlag (Brutlag et al., 1990). При выравнивании последовательностей как представляющая интерес, так и подвергающаяся выравниванию последовательности представляют собой аминокислотные последовательности. Результатом указанного глобального выравнивания последовательностей является процентная идентичность. Предпочтительные параметры, используемые в выравнивании аминокислот FASTDB,представляют собой: Матрица=РАМ 0, k-плет=2, Штраф за несоответствие=1, Штраф за присоединение=20, Группа рандомизации=25, Длина=0, Предельный показатель=1, Размер окна=длина последовательности, Штраф за делецию=5, Штраф за размер делеции=0,05, Размер окна=247 или длина подвергаемой выравниванию аминокислотной последовательности, в зависимости от того, какая из них короче. Если подвергаемая выравниванию последовательность короче представляющей интерес последовательности вследствие N- или С-концевых делеций, но не вследствие внутренних делеций, результаты в виде процентной идентичности необходимо корректировать вручную, поскольку при вычислении глобальной процентной идентичности программа FASTDB не учитывает обособленные N- или С-концевые укорочения подвергаемой выравниванию последовательности. Для подвергаемых выравниванию последовательностей укороченных с N- и С-конца относительно представляющей интерес последовательности процентную идентичность корректируют вычислением количества остатков представляющей интерес последовательности, которые являются N-и С-концевыми для подвергаемой выравниванию последовательности и которые не совпадают/выравниваются с соответствующим остатком подвергаемой выравниванию последовательности, в качестве процентного количества или общего числа оснований представляющей интерес последовательности. Наличие совпадения/выравнивания остатка определяют посредством результатов выравнивания последовательностей FASTDB. Это процентное количество затем вычитают из процентной идентичности, вычисленной посредством указанной выше программы FASTDB с использованием определенных параметров, с получением конечного показателя процентной идентичности. Этот конечный показатель процентной идентичности представляет собой показатель, который используют для целей настоящего изобретения. Только остатки с N- и С-концов подвергаемой выравниванию последовательности, которые не совпадают/выравниваются с представляющей интерес последовательностью, пригодны для целей ручной корректировки показателя процентной идентичности, а именно,только аминокислотные остатки представляющей интерес последовательности снаружи самых отдаленных N- и С-концевых остатков подвергаемой выравниванию последовательности. Например, 90 аминокислотный остаток подвергаемой выравниванию последовательности выравнивают с 100 остатком представляющей интерес последовательности для определения процентной идентичности. Делеция произошла на N-конце представляющей интерес последовательности и, таким образом, выравнивание FASTDB не совпадает/выравнивается в первых остатках на N-конце. 10 неспаренных остатков представляют собой 10% последовательности (не совпавшее количество остатков с N- и С-концов/общее количество остатков в представляющей интерес последовательности), так что 10% вычитают из показателя процентной идентичности, вычисленного программой FASTDB. Если остальные 90 остатков полностью совпадают, то конечная процентная идентичность составляет 90%.-9 012840 Предпочтительные изменения мутеинов в соответствии с настоящим изобретением представляют собой так называемые "консервативные" замены. Консервативные аминокислотные замены ФСГ могут включать синонимичные аминокислоты из группы, которые обладают достаточно сходными физикохимическими свойствами, чтобы замена между членами группы сохраняла биологическую функцию молекулы (Grantham, 1974). Очевидно, что вставки и делеции аминокислот также можно вносить в определенные выше последовательности без изменения их функции, в частности, если вставки или делеции включают только несколько аминокислот, например менее 30 и предпочтительно менее 10, и не приводят к удалению или перемещению аминокислот, которые являются критическими для функциональной конформации, например остатков цистеина. Белки и мутеины, полученные посредством таких делеций и/или вставок, относятся к объему настоящего изобретения. Термин "слитый белок" ФСГ относится к полипептиду, содержащему ФСГ, мутеин или его фрагмент, слитый с другим белком, который, например, обладает удлиненным временем нахождения в жидкостях организма. Например, ФСГ может быть слитым с иммуноглобулином или его фрагментом, таким как Fc-участок иммуноглобулина. Последовательность зрелого ФСГ также может быть слитой с сигнальным пептидом и/или с лидерной последовательностью, обеспечивающей повышенную секрецию. В предпочтительном варианте осуществления по этому изобретению бета-субъединица ФСГ или ее фрагмент является слитой с С-концевым пептидом (СТР) бета-субъединицы hCG. Полученный в результате белок обладает идентичными с ФСГ связыванием рецептора in vitro и видами биологической активности, но повышенным временем полужизни в кровотоке (LaPolt et al., 1992). В качестве "активной фракции" ФСГ или его мутеинов настоящее изобретение включает любой фрагмент или предшественники полипептидной цепи молекулы белка, отдельно или совместно с ассоциированными с ним молекулами или связанными с ним остатками, например с остатками сахара или фосфата, или с агрегатами одних белковых молекул или остатков сахаров при условии, что указанная фракция, по существу, обладает сходной с ФСГ активностью. Как используют в настоящем описании, "функциональные производные" ФСГ включают производные ФСГ или его мутеин, которые можно получать из функциональных групп, которые встречаются в качестве боковых цепей на остатках или N- или С-концевых группах, способами, известными в данной области, и они включены в это изобретение при условии, что они остаются фармацевтически приемлемыми, т.е. они не нарушают активности белка, которая является, по существу, сходной с активностью гонадотропина, и не придают токсических свойств композициям, содержащим их. Эти производные, например, могут включать боковые цепи полиэтиленгликоля, которые могут скрывать антигенные участки и удлинять время нахождения ФСГ в жидкостях организма. Другие производные включают алифатические сложные эфиры карбоксильных групп, амиды карбоксильных групп, полученные реакцией с аммиаком или с первичными или вторичными аминами, N-ацильные производные свободных аминогрупп аминокислотных остатков, образованные с ацильными группами (например, алканоильными или карбоциклическими ароильными группами), или О-ацильные производные свободных гидроксильных групп (например, групп остатков серила или треонила), образованные с ацильными группами. В предпочтительном варианте осуществления функциональное производное соответствует молекуле ФСГ, обладающей дополнительным гликозилированием. В настоящем описании термин "соли" ФСГ относится как к солям карбоксильных групп, так и к кислотно-аддитивным солям аминогрупп ФСГ. Соли карбоксильной группы могут быть образованы способами, известными в данной области, и включают неорганические соли, например соли натрия, кальция,аммония, железа или цинка, и т.п., и соли с органическими основаниями, такие как соли, образованные,например, с аминами, такими как триэтаноламин, аргинин или лизин, пиперидин, прокаин и т.п. Кислотно-аддитивные соли включают, например, соли минеральных кислот, например, таких как хлористоводородная кислота или серная кислота, и соли органических кислот, например, таких как уксусная кислота или щавелевая кислота. Безусловно, любые такие соли должны сохранять биологическую активность гонадотропина. Как используют в настоящем описании, термин "рекомбинантный димерный гонадотропин" относится к гонадотропину, который продуцируется при культивировании полученной способами генетической инженерии клетки. Гонадотропин можно продуцировать в клетке любого происхождения. Полученная способами генетической инженерии клетка, экспрессирующая димерный гонадотропин, экспрессирует обе субъединицы указанного димерного гонадотропина. Как используют в настоящем описании, термин "полученная способами генетической инженерии клетка" относится к клетке, в которую введена экзогенная ДНК таким образом, чтобы обеспечить экспрессию обеих субъединиц требуемого гонадотропина. Экзогенная ДНК может содержать последовательность, кодирующую субъединицы требуемого гонадотропина. Альтернативно, экзогенная ДНК может содержать последовательность, активирующую экспрессию эндогенной последовательности, кодирующей субъединицы требуемого гонадотропина (см., например, WO 91/09955).- 10012840 Клетки могут представлять собой клетки, например, животных, насекомых или микроорганизмов. Как используют в настоящем описании, термин "клетка животного" включает клетки человека и не относящихся к человеку млекопитающих, клетки не млекопитающих и гибридомы. Примеры клеток млекопитающих, в которых можно продуцировать рекомбинантный димерный гонадотропин, включают, например, клетки 3 Т 3, клетки COS, клетки остеосаркомы человека, клетки MRC-5, клетки BHK, клеткиVERO, клетки CHO, клетки rCHO-tPA, клетки rCHO - поверхностный антиген Hep B, клетки HEK 293,клетки rHEK 293, rC127 - поверхностный антиген Hep В, нормальные фибробластные клетки человека,клетки стромы, клетки гепатоцитов, клетки PER.C6 и перманентные амниоцитарные клетки человека. Примеры гибридом, в которых можно получать рекомбинантный димерный гонадотропин, включают,например, клетки DA4.4, клетки 123 А, клетки 127 А, клетки GAMMA и клетки 67-9-В. В рамках настоящего изобретения предпочтительно культивировать клетку яичника китайского хомяка (клетка CHO). Второй аспект настоящего изобретения относится к способу снижения уровней окисленных форм рекомбинантного димерного гонадотропина в ходе процесса его производства, отличающемуся тем, что клетки, экспрессирующие указанный рекомбинантный димерный гонадотропин, культивируют в бессывороточной культуральной среде, содержащей антиоксидант. Как используют в настоящем описании, термин "окисленные формы" относится к полипептиду, в котором окислитель вызвал окисление одного или нескольких аминокислотных остатков. Такие формы можно выявлять, например, посредством ВЭЖХ, как описано в примере 2.1 для ФСГ. Культивирование можно проводить в любых пригодных условиях, таких как чашки Петри,Т-флаконы или вращающиеся флаконы, однако предпочтительно в сосудах, имеющих большие объемы,например, в таких как биореактор. Стадия культивирования включает следующие стадии: инокуляции указанных клеток в указанную бессывороточную культуральную среду; фазы роста и фазы продукции. Фаза роста представляет собой часть процесса в клеточной культуре, в которой параметры процесса установлены в целях поддержания роста клеток. После достижения требуемой клеточной плотности клеточную культуру обычно переключают на фазу продукции, в которой параметры процесса установлены в целях поддержания продуктивности клеток. Параметры процесса могут быть одинаковыми в ходе фазы роста и фазы продукции. В ходе фазы продукции концентрация клеток предпочтительно обладает значением, находящимся в диапазоне от 1106 до 5107 клеток/мл, например приблизительно 1106, 5106, 107 или 5107 клеток/мл. Наиболее предпочтительно указанная клетка представляет собой клетку CHO. В одном варианте осуществления антиоксидант добавляют к бессывороточной культуральной среде до инокуляции клеток. В другом варианте осуществления антиоксидант добавляют к бессывороточной культуральной средевскоре после инокуляции клеток (например, не более чем через 24 ч после инокуляции). Предпочтительно процесс производства включает стадию сбора среды, содержащей рекомбинантный димерный гонадотропин. В предпочтительном варианте осуществления процесс производства далее включает очистку рекомбинантного димерного гонадотропина. Способы очистки гонадотропинов хорошо известны в данной области. Например, ФСГ можно очищать, как описано в ЕР 04105639.1, WO 98/20039, WO 00/63248 илиWO 88/10270. В следующем предпочтительном варианте осуществления процесс производства далее включает составление рекомбинантого димерного гонадотропина с фармацевтически приемлемым носителем с получением фармацевтической композиции. Как используют в настоящем описании, подразумевают, что термин "фармацевтически приемлемый носитель" охватывает любой носитель, который не препятствует эффективности биологической активности активного ингредиента и который является не токсичным для организма хозяина, которому его вводят. Например, для парентерального введения, активный белок(и) можно составлять в единичной дозированной форме для инъекции в носителях, таких как физиологический раствор, раствор декстрозы, сывороточный альбумин и раствор Рингера. Затем фармацевтическую композицию, составленную в соответствии с этим изобретением, можно вводить индивиду различными способами. Способы введения включают интрадермальный, чрескожный(например, в составах с замедленным высвобождением), внутримышечный, внутрибрюшинный, внутривенный, подкожный, пероральный, интракраниальный, эпидуральный, местный, ректальный и интраназальный способы. Можно использовать любой другой терапевтически эффективный способ введения,например всасывание через эпителиальные или эндотелиальные ткани или введение посредством генной терапии, где молекулу ДНК, кодирующую активное вещество, вводят пациенту (например, через вектор),что приводит к экспрессии и секреции активного вещества in vivo. Кроме того, белок(и) в соответствии с этим изобретением можно вводить совместно с другими компонентами биологически активных средств,- 11012840 такими как фармацевтически приемлемые поверхностно-активные вещества, эксципиенты, носители,разбавители и вещества для доставки. Для парентерального (например, внутривенного, подкожного,внутримышечного) введения, активный белок(и) можно составлять в виде раствора, суспензии, эмульсии или лиофилизированного порошка совместно с фармацевтически приемлемым парентеральным носителем (например, водой, физиологическим раствором, раствором декстрозы) и добавками, которые поддерживают изотоничность (например, маннит) или химическую стабильность (например, консерванты и буферы). Состав стерилизуют широко применяемыми способами. В предпочтительном варианте осуществления настоящего изобретения способ снижения уровней окисленных форм рекомбинантного димерного гонадотропина в ходе процесса его производства характеризуется тем, что по меньшей мере две, три, четыре, пять или шесть стадий указанного процесса производства проводят в присутствии антиоксиданта. Предпочтительно все стадии указанного процесса производства проводят в присутствии антиоксиданта, т.е. весь процесс производства проводят в присутствии антиоксиданта. Например, способ снижения уровней окисленных форм рекомбинантного димерного гонадотропина в ходе процесса его производства может включать следующие стадии: культивирование клеток, экспрессирующих указанный рекомбинантный димерный гонадотропин в бессывороточной культуральной среде, содержащей антиоксидант; сбор среды, содержащей указанный рекомбинантный димерный гонадотропин; и очистка указанного рекомбинантного димерного гонадотропина в присутствии антиоксиданта. Предпочтительно способ снижения уровней окисленных форм рекомбинантного димерного гонадотропина в ходе процесса его производства далее включает стадию составления указанного рекомбинантного димерного гонадотропина в фармацевтическую композицию, содержащую антиоксидант. Антиоксидант может быть одинаковым на всех стадиях процесса производства, где используют антиоксидант. Альтернативно, на стадии культивирования, на стадии очистки и/или на стадии составления можно использовать разные антиоксиданты. В данной области известно множество соединений, имеющих антиоксидантный эффект. Эти соединения включают, например, цистеин, аскорбиновую кислоту,L-метионин, L-глутатион, 2-меркаптоэтанол, альфа-токоферол и их производные, ВО-653, трет-бутил-4 метоксифенол, 2,6-бис-(1,1-диметилэтил)-4-метилфенол; биметабисульфит калия или натрия, бисульфит натрия, гистидин, таурин, глицин, аланин, карнозин, ансерин и 1-метилгистидин. Третий аспект настоящего изобретения относится к бессывороточной культуральной среде для получения рекомбинантных димерных гонадотропинов, отличающейся тем, что указанная культуральная среда содержит антиоксидант, выбранный из группы, состоящей изL-глутатиона в концентрации приблизительно от 1 до приблизительно 20 мг/л; 2-меркаптоэтанола в концентрации приблизительно от 5 до приблизительно 15 мг/л;L-метионина в концентрации приблизительно от 200 до приблизительно 500 мг/л и сочетания аскорбиновой кислоты в концентрации приблизительно от 10 до приблизительно 50 мг/л и (+)-альфа-токоферола в концентрации приблизительно от 5 до приблизительно 25 мг/л. Бессывороточная культуральная среда обычно содержит воду, регулятор осмолярности, буфер, источник энергии, аминокислоты, неорганический или рекомбинантный источник железа, рекомбинантный или синтетический фактор роста и необязательно ионы цветных металлов, витамины и кофакторы. Например, в соответствии с настоящим изобретением можно модифицировать любую из коммерчески доступных бессывороточных сред, перечисленных выше. После полного описания этого изобретения, специалисты в данной области поймут, что все указанное выше можно проводить с широким диапазоном эквивалентных параметров, концентраций и условий без отклонения от сущности и объема этого изобретения и без излишнего экспериментирования. Несмотря на то что это изобретение описано применительно к его конкретным вариантам осуществления, будет понятно, что возможны другие модификации. Подразумевается, что это изобретение охватывает любые варианты, применения или адаптации этого изобретения, соответствующие, главным образом, принципам этого изобретения и включающие такие отклонения от настоящего описания, как относящиеся к известной или общепринятой практике в области, к которой относится это изобретение, и применимые в отношении основных признаков, указанных выше, как находящихся в объеме прилагаемой формулы изобретения. Все цитированные в настоящем описании ссылки, включая статьи и рефераты в журналах, опубликованные или неопубликованные патентные заявки США или другой страны, выданные патенты США или других стран или любые другие ссылки, полностью включены в настоящее описании в качестве ссылок, включая все данные, таблицы, фигуры и текст, представленные в цитируемых ссылках. Кроме того,полное содержание ссылок, цитированных в ссылках, цитированных в настоящем описании, полностью включено в качестве ссылок. Ссылка на стадии известных способов, стадии общепринятых способов, известные способы или общепринятые способы никоим образом не являются признанием того, чтобы какой-либо аспект, описание или вариант осуществления настоящего изобретения описан, указан или предложен в данной области.- 12012840 Представленное выше описание конкретных вариантов осуществления настолько полностью раскрывает общий характер этого изобретения, что можно с помощью применения знаний в данной области(включая содержание ссылок, цитированных в настоящем описании) легко модифицировать и/или адаптировать его для различных способов применения, таких как конкретные варианты осуществления, без излишнего экспериментирования, без отклонения от общей концепции настоящего изобретения. Таким образом, подразумевают, что такие адаптации и модификации относятся к значению ряда эквивалентов описанных вариантов осуществления, исходя из описания и руководства, представленного в настоящем описании. Следует понимать, что фразеология и терминология в настоящем описании представлена только для целей описания, а не для ограничения, так что терминологию или фразеологию настоящего описания квалифицированному специалисту следует интерпретировать с учетом указаний и рекомендаций, представленных в настоящем описании, в сочетании со знаниями среднего специалиста в данной области. Пример 1. Процесс культивирования клеток. 1.1. Клеточные линии и среды. Все эксперименты проводили с клеточной линией CHO, экспрессирующей обе субъединицы ФСГ человека. Продуцируемый белок представляет собой димерный гонадотропин, в дальнейшем обозначаемый как рФСГ. Альфа-субъединица соответствует регистрационному номеру SwissProtP01215, и бета-субъединица соответствует регистрационному номеру SwissProtР 01225. Среда, используемая для культивирования клеток, представляла собой основную бессывороточную среду (SFM), разработанную для культивирования клеток CHO. Среда SFM была дополнена антиоксидантом, подлежащим тестированию, как подробно описано в примере 3. Исходная концентрация антиоксидантов, подлежащих тестированию в основной SFM, представлена в табл. I. Таблица I Исходная концентрация антиоксидантов в основной бессывороточной среде 1.2. Условия инокуляции, роста и продукции. Процесс культивирования, также обозначаемый как "эксперимент", включает стадию инокуляции,фазу роста и фазу продукции. Проводили пять различных экспериментов, обозначаемых как эксперименты 1, 2, 3, 4 и 5. По меньшей мере 2,4109 жизнеспособных продуцирующих рФСГ клеток переносили в 15-литровой биореактор с эффективным рабочим объемом 11 л (newMBR, Zurich), содержащий микроносители. Сразу после высевания следовала стадия подпитки, которая длилась в течение двух или трех суток. Затем биореактор постоянно подпитывали посредством SFM до степени разбавления 1 сутки-1 и до скорости перфузии 11 лсутки-1. Фазу роста или продукции проводили при одинаковых значениях рН и температуры (37 С, рН 7). Растворенный кислород (DO) поддерживали при 50% насыщении воздухом в ходе всего эксперимента. Пример 2. Аналитические способы. 2.1. Определение окисленных форм рФСГ. Окисленные формы определяли посредством ОФ-ВЭЖХ на неочищенном собранном образце, как описано Bassett и Driebergen (Bassett and Driebergen, 2005). Процентные количества окисленных форм нормализовали с использованием процентного количества окисленных форм, полученных с L-цистеином в концентрации 280 мг/л в эксперименте 2 в качестве контроля (т.е. процентные количества окисленных форм делили на 23,4%).- 13012840 2.2. Определение общей концентрации жизнеспособных клеток. Общую концентрацию жизнеспособных клеток определяют как сумму концентраций клеток, прикрепленных к микроносителям, и концентрации жизнеспособных клеток в суспензии. Концентрацию клеток, прикрепленных к микроносителям, определяли с использованием способа подсчета ядер с помощью кристаллического фиолетового (Fluka 61135). Концентрацию жизнеспособных клеток в суспензии определяли с использованием способа исключения с помощью трипанового синего (Sigma T-8154). Общее соотношение жизнеспособных клеток (соотношение TVC) вычисляли следующим образом:[общая концентрация жизнеспособных клеток, конец теста]/[общая концентрация жизнеспособных клеток, начало теста],где начало теста определяют как сутки, на которые в культуру добавляют новый антиоксидант, и конец теста определяют как сутки перед добавлением в культуру следующего антиоксиданта. 2.3. Определение титров рФСГ. Титр рФСГ определяли посредством иммунофлуориметрического анализа с использованием набораDelphia hFSH от Wallac-ADL (каталожныйA017-201). 2.4. Определение скорости потребления глюкозы (GCR). Скорость потребления глюкозы (GCR), выраженную в граммах на литр в сутки, вычисляли следующим образом:t: измерение во время t;t-1: измерение во время t-1 Пример 3. Эффект различных антиоксидантов. В целях снижения уровня окисленных форм, полученных с помощью бессывороточных процессов,для тестирования эффекта различных антиоксидантов проводили два эксперимента в объеме 15 л (эксперименты 1 и 2). Эксперимент без добавления какого-либо антиоксиданта проводили в качестве контроляSFM дополняли несколькими антиоксидантами или сочетанием антиоксидантов до конечной концентрации, показанной в табл. II. Каждый антиоксидант или сочетание антиоксидантов тестировали в течение периода приблизительно 10 суток. На 1-е сутки теста добавляли объем раствора антиоксиданта,необходимый для достижения указанного уровня. Каждые последующие сутки определенное количество антиоксиданта вымывали из биореактора посредством перфузии и заменяли однократным добавлением(для скорости разбавления 1 с-1 каждые 24 ч обновляли 63,2% объема биореактора, что отражает количество антиоксиданта, заменяемого каждые сутки). К концу периода тестирования антиоксидант вымывали из биореактора посредством перфузии и заменяли другим антиоксидантом, подлежащим тестированию. Процентное количество окисленных форм рФСГ определяли в конце каждого теста (табл. II). Нормализованное значение менее 1,0 указывает на то, что тестируемый антиоксидант более эффективен, чемL-цистеин, для снижения уровней окисленных форм рФСГ. Общая концентрация жизнеспособных клеток, GCR и титры рФСГ измеряли каждые сутки. В табл. II указано общее соотношение жизнеспособных клеток (соотношение TVC). Соотношение TVC,превышающее или равное 1,0, указывает на то, что тестируемый антиоксидант не оказывает токсического эффекта на клетки.- 14012840 Таблица II Эффект антиоксидантов на окисленные формы рФСГ Результаты, представленные в табл. II, указывают на то, что 2-меркаптоэтанол, сочетание аскорбиновой кислоты и (+)-альфа-токоферола, L-метионин и L-глутатион являются наилучшими антиоксидантами для получения низких уровней окисленных форм рФСГ. Соотношение TVC для общих жизнеспособных клеток менее 1,0 получено только в случае 2-меркаптоэтанола. Таким образом, все антиоксиданты, тестированные в экспериментах 1 и 2, за исключением 2-меркаптоэтанола, являются нетоксичными. Кроме того, определение GCR и титров рФСГ показало, что ни одно из различных антиоксидантов не оказывало значительного влияния на метаболизм и характер репродуктивности (данные не представлены). Для дальнейшей оптимизации процесса продукции были выбраны L-метионин и L-глутатион. Один эксперимент (эксперимент 3) проводили для тестирования различных концентраций L-глутатиона (от 1 до 20 мг/л) и один эксперимент (эксперимент 4) проводили для тестирования различных концентрацийL-метионина (от 0,25 до 3 г/л). Эксперимент 3, в котором тестировали L-глутатион, был преждевременно прекращен на 30-е сутки продукции вследствие повреждения микроносителей. Тестируемые концентрации L-глутатиона или L-метионина в ходе экспериментов 3 и 4 представлены в табл. III. Нулевые рабочие сутки (WDO) определяют как сутки, на которые проводили посев в биореакторе. 0-е сутки продукции (PDO) определяют как сутки, на которые процесс культивирования клеток переключают с фазы роста на фазу продукции. Кроме того, эксперимент проводили без изменения концентрации антиоксиданта. В этом эксперименте L-метионин с самого начала добавляли в концентрации 250 мг/л (эксперимент 5). Для всех экспериментов процентное количество окисленных форм рФСГ определяли регулярно Таблица IV Эффект антиоксидантов на окисленные формы рФСГ Анализ окисленных форм рФСГ при добавлении антиоксиданта в культуральную среду показал,что L-метионин является хорошим антиоксидантом. В эксперименте 5, где клетки культивировали в присутствии L-метионина в концентрации 250 мг/л, среднее процентное содержание окисленных форм было снижено приблизительно на 40% по сравнению с результатами, полученными в эксперименте 1 и эксперименте 2 с L-цистеином в качестве антиоксиданта (см. табл. II и IV). L-глутатион также является хорошим антиоксидантом, особенно в концентрации приблизительно 2,5 мг/л. В эксперименте 3 процентное содержание окисленных форм было снижено приблизительно на 35% при культивировании клеток в присутствии L-глутатиона в концентрации 2,5 мг/л по сравнению с результатами, полученными в эксперименте 1 и эксперименте 2 с L-цистеином в качестве антиоксиданта (см. табл. II и IV). Оказалось, что в эксперименте 4 повышающиеся концентрации L-метионина обладают тенденцией к снижению процентного содержания окисленных форм между 250 и 2000 мг/л. Однако оказалось, что выявленные различия находятся в границах вариабельности способа по сравнению с изменениями, наблюдаемыми в эксперименте 5, в котором тестировали одну концентрацию L-метионина, составляющую 250 мг/л, в течение всего эксперимента. Кроме того, было подтверждено, что L-глутатион и L-метионин не оказывают значительного влияния на жизнеспособность клеток, метаболизм и характер продуктивности в диапазоне тестируемых концентраций (данные не представлены).Bioeng. 95, 124-127. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение антиоксиданта в составе бессывороточной культуральной среды для снижения окисления рекомбинантных димерных гонадотропинов, продуцируемых культивируемыми клетками. 2. Применение по п.1, отличающееся тем, что выбранный антиоксидант выбран из группы, включающейL-глутатион в концентрации приблизительно от 1 до приблизительно 20 мг/л; 2-меркаптоэтанол в концентрации приблизительно от 5 до приблизительно 15 мг/л;L-метионин в концентрации приблизительно от 200 до приблизительно 400 мг/л и сочетание аскорбиновой кислоты в концентрации приблизительно от 10 до приблизительно 50 мг/л и (+)-альфа-токоферола в концентрации приблизительно от 5 до приблизительно 25 мг/л. 3. Применение по п.2, где указанный антиоксидант выбран из группы, включающейL-метионин в концентрации приблизительно 250 мг/л и сочетание аскорбиновой кислоты в концентрации приблизительно 30 мг/л и (+)-альфа-токоферола в концентрации приблизительно 14 мг/л. 4. Применение по любому из пп.1-3, где указанная культуральная среда представляет собой среду с- 17012840 определенным химическим составом. 5. Применение по любому из пп.1-4, где указанная культуральная среда выбрана из группы, состоящей из SFM 90, SFM 90.1, SupMed300, DMEM, DMEM/F12, SFM CHO 3 а, CHP PFM, ProCHO 5, EXCELL, CHO-CD3, CHO III PFM, CHO-S-SFM II, CHO-DHFR, SFM4CHO, Ultra CHO, HyQ PF CHO, HyQSFX CHO, HyQ CDM4CHO, IS CHO-CD, IS CHO-V и их производных. 6. Применение по п.5, где указанный рекомбинантный димерный гонадотропин представляет собой фолликулостимулирующий гормон (ФСГ). 7. Применение по любому из пп.1-6, где указанный рекомбинантный димерный гонадотропин продуцируется клетками яичника китайского хомяка (CHO). 8. Способ снижения окисления рекомбинантных димерных гонадотропинов в процессе их получения, включающий культивирование клеток, экспрессирующих указанные рекомбинантные димерные гонадотропины, в бессывороточной культуральной среде, содержащей антиоксидант. 9. Способ по п.8, где указанная культуральная бессывороточная среда, содержащая антиоксидант,представляет собой среду, охарактеризованную в любом из пп.1-5. 10. Способ по п.8 или 9, где стадия культивирования клеток включает в себя следующие этапы:a) инокуляция указанных клеток в указанную бессывороточную культуральную среду;c) фаза продукции. 11. Способ по любому из пп.8-10, дополнительно включающий сбор среды, содержащей указанные рекомбинантные димерные гонадотропины. 12. Способ по любому из пп.8-11, дополнительно включающий очистку указанных рекомбинантных димерных гонадотропинов. 13. Способ по любому из пп.7-12, где указанный рекомбинантный гонадотропин представляет собой ФСГ. 14. Способ по любому из пп.7-13, где указанный рекомбинантный димерный гонадотропин продуцирован клетками CHO. 15. Бессывороточная культуральная среда для снижения окисления рекомбинантных димерных гонадотропинов, содержащая антиоксидант, выбранный из группы, включающейL-метионин в концентрации приблизительно 250 мг/л и сочетание аскорбиновой кислоты в концентрации приблизительно от 10 до приблизительно 50 мг/л и (+)-альфа-токоферола в концентрации приблизительно от 5 до приблизительно 25 мг/л. 16. Культуральная среда по п.15, где указанный антиоксидант представляет собой сочетание аскорбиновой кислоты в концентрации приблизительно 30 мг/л и (+)-альфа-токоферола в концентрации приблизительно 14 мг/л. 17. Культуральная среда по п.15 или 16, где указанная культуральная среда представляет собой среду с определенным химическим составом.
МПК / Метки
МПК: C07K 14/59, C12N 5/00
Метки: среды, рекомбинантных, содержащей, антиоксидант, бессывороточной, гонадотропинов, снижения, окисления, культуральной, применение
Код ссылки
<a href="https://eas.patents.su/19-12840-primenenie-bessyvorotochnojj-kulturalnojj-sredy-soderzhashhejj-antioksidant-dlya-snizheniya-okisleniya-rekombinantnyh-gonadotropinov.html" rel="bookmark" title="База патентов Евразийского Союза">Применение бессывороточной культуральной среды, содержащей антиоксидант, для снижения окисления рекомбинантных гонадотропинов</a>
Предыдущий патент: Синергические фунгицидные комбинации биологически активных веществ, их получение и применение и способ борьбы с нежелательными фитопатогенными грибами
Следующий патент: Способ получения линейных альфа-олефинов и катализатор для его осуществления
Случайный патент: Способ получения чайного продукта