Лиофилизация виросом
Номер патента: 11881
Опубликовано: 30.06.2009
Авторы: Цурбригген Ринальдо, Рази Сильвия, Амакер Марио
Формула / Реферат
1. Биологически активная композиция, содержащая по меньшей мере одну иммуностимулирующую реконструированную виросому гриппа (IRIV) и катионное производное холестерина для эффективной лиофилизации и восстановления виросомы.
2. Композиция по п.1, где указанное катионное производное холестерина для эффективной лиофилизации и восстановления виросомы присутствует в мембране виросомы.
3. Композиция по п.1 или 2, где указанное производное холестерина имеет положительно заряженный заместитель в 3 положении холестерина и представлено следующей формулой:

где R выбран из группы, состоящей из R', R'-(C=O)-, R'-O-(C=O)-, R'-NH-(С=О)-, R'-O-(C=O)-R"-(C=O)-, R'-NH-(C=O)-R"-(C=O)-;
R' представляет собой С1-С6-алкил, замещенный по меньшей мере одной положительно заряженной группой, предпочтительно N-содержащей группой формулы R1R2R3N+-, и соответствующий противоион представляет собой X-;
R1, R2 и R3 независимо друг от друга выбраны из группы, состоящей из водорода и С1-С6-алкила;
X- выбран из группы, состоящей из галогена, гидросульфата, сульфоната, дигидрофосфата, ацетата, тригалогеноацетата и гидрокарбоната; и
R" представляет собой С1-С6-алкилен.
4. Композиция по п.3, где указанное производное холестерина представлено следующей формулой:
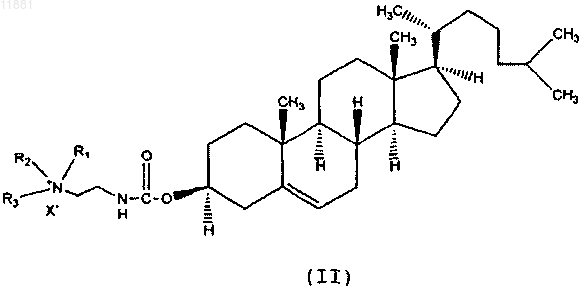
где R1, R2 и R3 независимо друг от друга выбраны из группы, состоящей из водорода и С1-С6-алкила, и
X- представляет собой анион галогена.
5. Композиция по п.4, где R1 и R2 представляют собой метил и R3 представляет собой водород.
6. Композиция по п.4, где R1, R2 и R3 представляют собой метил.
7. Композиция по любому из пп.2-6, где содержание катионного липида составляет от 1,9 до
37 мол.% от общего содержания липидов мембраны.
8. Композиция по п.7, где содержание катионного липида составляет от 1,9 до 16 мол.% от общего содержания липидов мембраны.
9. Композиция по п.7 или 8, где остальные липиды виросомальной мембраны состоят из фосфолипидов.
10. Композиция по п.9, где фосфолипиды представляют собой фосфатидилхолин и фосфатидилэтаноламин.
11. Композиция по п.10, где соотношение фосфатидилхолина и фосфатидилэтаноламина составляет от 3:1 до 5:1, предпочтительно 4:1.
12. Композиция для лиофилизации, содержащая биологически активную композицию, охарактеризованную в любом из пп.1-11, и дополнительно лиопротектор.
13. Композиция по п.12, где лиопротектор выбран из группы, состоящей из сахарозы, трегалозы, декстрозы, лактозы, маннозы, ксилозы и маннита.
14. Композиция по п.13, где лиопротектор присутствует в соотношении от 0,1 до 5% (мас./об.) в растворе перед лиофилизацией.
15. Композиция по любому из пп.12-14, дополнительно содержащая адъювант или систему адъювантов.
16. Композиция по любому из пп.1-11 или 12-15, дополнительно содержащая биологически активное вещество, выбранное из фармацевтического агента или антигенной молекулы.
17. Композиция по п.16, где указанное биологически активное вещество или прикреплено к поверхности виросомы, и/или заключено в виросому.
18. Способ лиофилизации виросом с использованием композиций по любому из пп.12-15, включающий стадии:
(а) замораживания указанной композиции,
(б) первичной сушки указанной замороженной композиции при первом пониженном давлении и
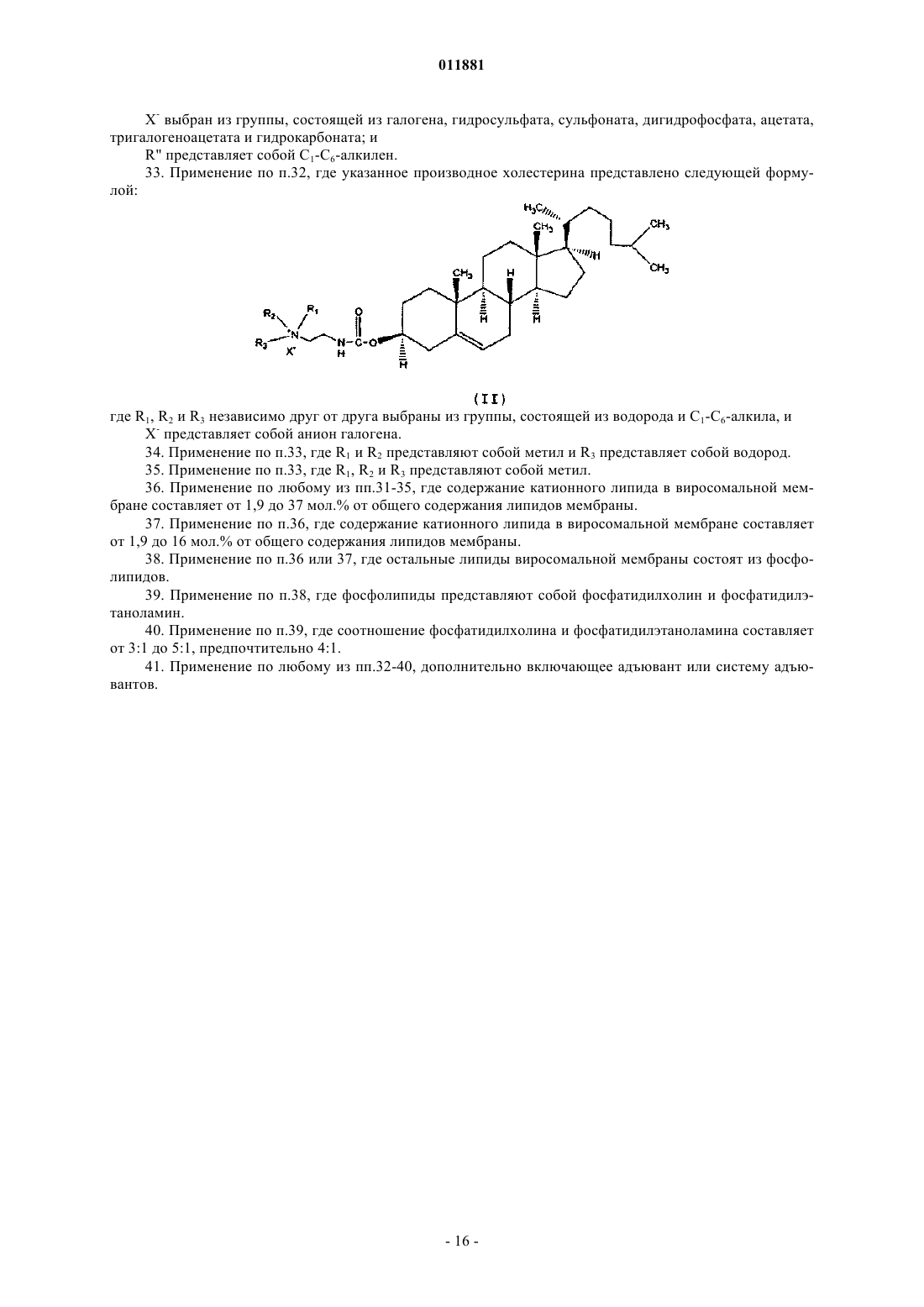
(в) вторичной сушки указанной замороженной композиции при втором пониженном давлении,
где указанную первичную сушку осуществляют при более высоком давлении, чем указанное второе пониженное давление.
19. Способ лиофилизации виросом с использованием композиций по любому из пп.16 или 17, включающий стадии:
(а) замораживания указанной композиции, содержащей указанное биологически активное вещество, выбранное из фармацевтического агента и антигенной молекулы,
(б) первичной сушки указанной замороженной композиции при первом пониженном давлении и
(в) вторичной сушки указанной замороженной композиции при втором пониженном давлении,
где указанную первичную сушку осуществляют при более высоком давлении, чем указанное второе пониженное давление.
20. Виросомальный лиофилизат, получаемый способом по п.18.
21. Виросомальный лиофилизат, получаемый способом по п.19.
22. Способ восстановления виросомального лиофилизата по п.20, включающий стадию растворения виросомального лиофилизата в растворителе для восстановления.
23. Способ по п.22, где растворитель для восстановления содержит указанное биологически активное вещество, выбранное из фармацевтического агента и антигенной молекулы.
24. Способ восстановления виросомального лиофилизата по п.21, включающий стадию растворения виросомального лиофилизата в растворителе для восстановления.
25. Применение любой из композиций по пп.1-17 для изготовления лекарственного средства для вакцинации субъекта.
26. Применение по п.25, где субъект представляет собой человека.
27. Набор, включающий контейнер, содержащий лиофилизат по п.20.
28. Набор по п.27, дополнительно включающий второй контейнер, содержащий растворитель для восстановления и указанное биологически активное вещество, выбранное из фармацевтического агента и антигенной молекулы.
29. Набор, включающий контейнер, содержащий лиофилизат по п.21.
30. Набор по п.29, дополнительно включающий второй контейнер, содержащий растворитель для восстановления.
31. Применение катионного производного холестерина для усиления способности виросомы восстанавливаться после лиофилизации, причем указанная виросома в своем восстановленном состоянии содержит биологически активное вещество, выбранное из фармацевтического агента или антигенной молекулы.
32. Применение по п.31, где указанное производное холестерина имеет положительно заряженный заместитель в 3 положении холестерина и представлено следующей формулой:
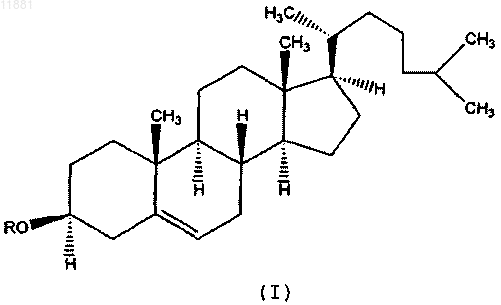
где R выбран из группы, состоящей из R', R'-(C=O)-, R'-O-(C=O)-, R'-NH-(С=О)-, R'-O-(C=O)-R"-(C=O)-, R'-NH-(C=O)-R"-(C=O)-,
R' представляет собой С1-С6-алкил, замещенный по меньшей мере одной положительно заряженной группой, предпочтительно N-содержащей группой формулы R1R2R3N+-, и соответствующий противоион представляет собой X-;
R1, R2 и R3 независимо друг от друга выбраны из группы, состоящей из водорода и С1-С6-алкила;
X- выбран из группы, состоящей из галогена, гидросульфата, сульфоната, дигидрофосфата, ацетата, тригалогеноацетата и гидрокарбоната; и
R" представляет собой С1-С6-алкилен.
33. Применение по п.32, где указанное производное холестерина представлено следующей формулой:
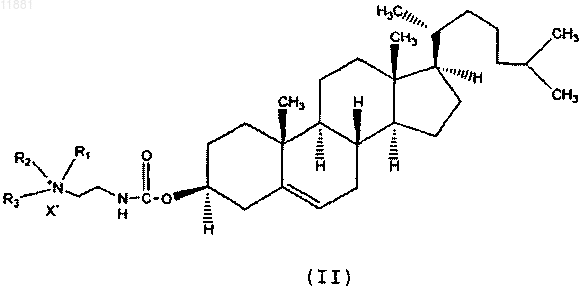
где R1, R2 и R3 независимо друг от друга выбраны из группы, состоящей из водорода и С1-С6-алкила, и
X- представляет собой анион галогена.
34. Применение по п.33, где R1 и R2 представляют собой метил и R3 представляет собой водород.
35. Применение по п.33, где R1, R2 и R3 представляют собой метил.
36. Применение по любому из пп.31-35, где содержание катионного липида в виросомальной мембране составляет от 1,9 до 37 мол.% от общего содержания липидов мембраны.
37. Применение по п.36, где содержание катионного липида в виросомальной мембране составляет от 1,9 до 16 мол.% от общего содержания липифют мембраны.
38. Применение по п.36 или 37, где остальные липиды виросомальной мембраны состоят из фосфолипидов.
39. Применение по п.38, где фосфолипиды представляют собой фосфатидилхолин и фосфатидилэтаноламин.
40. Применение по п.39, где соотношение фосфатидилхолина и фосфатидилэтаноламина составляет от 3:1 до 5:1, предпочтительно 4:1.
41. Применение по любому из пп.32-40, дополнительно включающее адъювант или систему адъювантов.
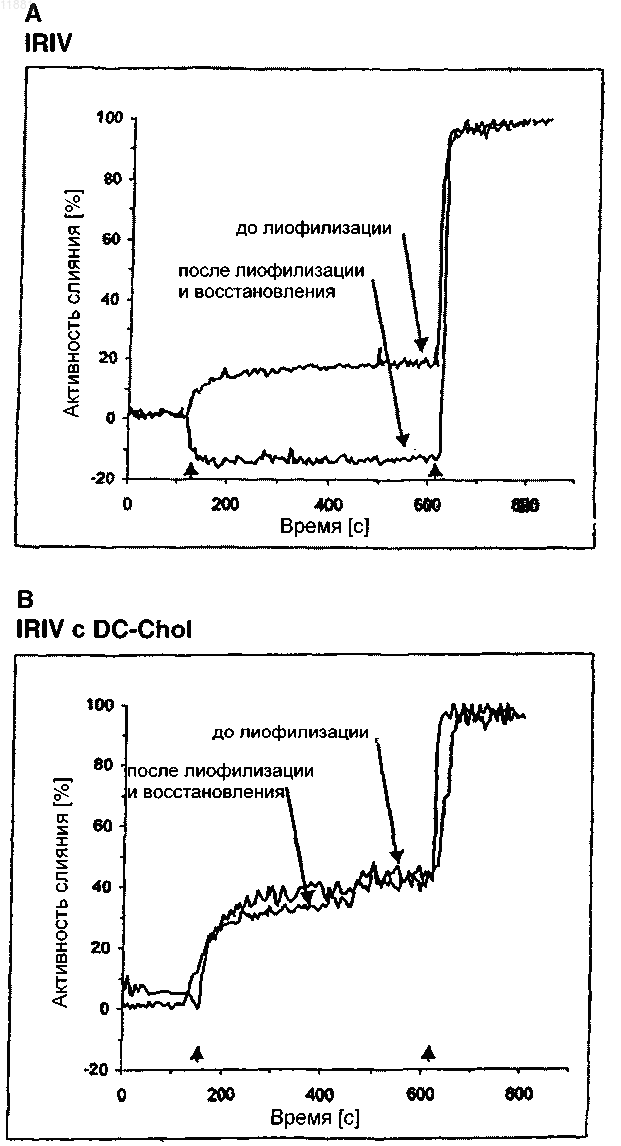
Текст
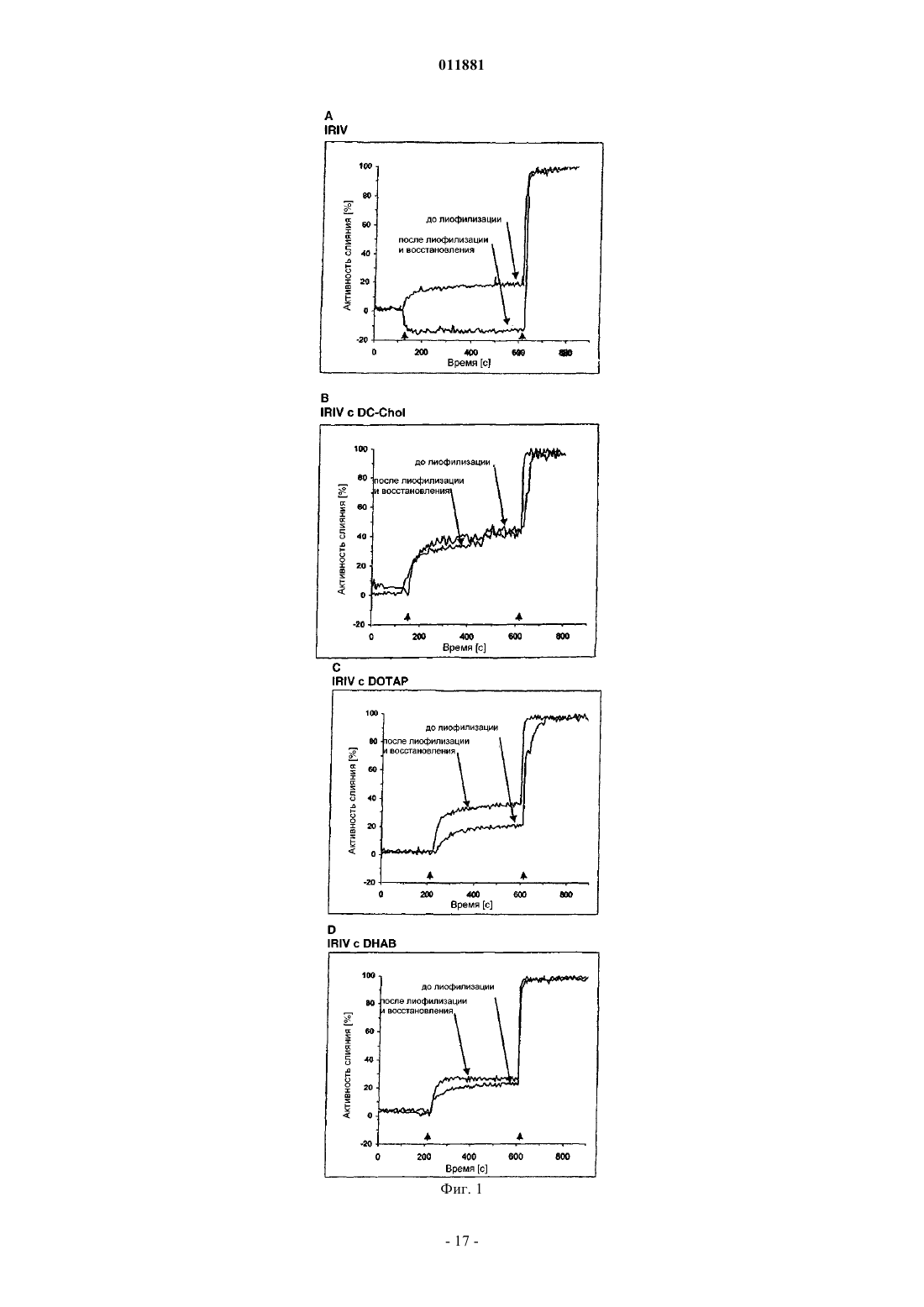
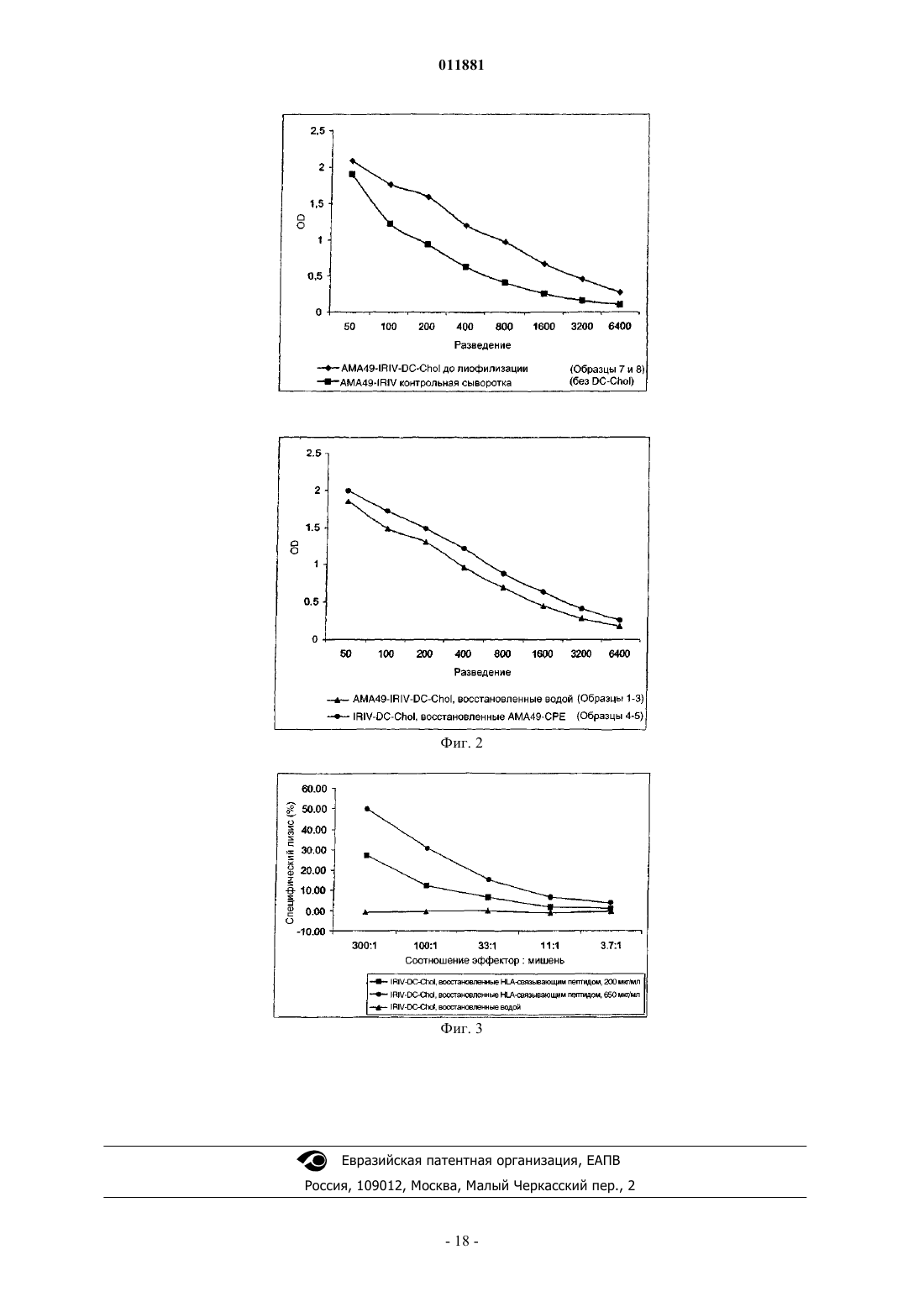
011881 Область изобретения Настоящее изобретение относится к композициям и способам эффективной лиофилизации и восстановления виросом. Предшествующий уровень техники Лиофилизация или "сушка вымораживанием" представляет собой технический процесс удаления воды. В этом способе водный раствор охлаждают ниже его эвтектической точки до тех пор, пока он полностью не заморозится. Затем барометрическое давление снижают до вакуума, так что вода сублимируется и удаляется из раствора. Растворенный агент остается в виде пористого твердого вещества, которое может быть позже снова растворено в воде. Лиофилизация дает твердые вещества с огромной площадью поверхности, приводящей к высокой растворимости в воде. Лиофилизацию широко используют в фармацевтических применениях, поскольку большинство лекарственных средств имеют ограниченный срок хранения в растворе. Их срок хранения может быть существенно увеличен путем получения лиофилизатов, которые растворяют, незадолго до применения, в адекватном растворителе. Хотя доказано, что лиофилизация является лучшей методикой консервации,традиционно использующейся в настоящее время, она имеет присущие ей недостатки. Они в основном связаны с процессами замораживания и восстановления, которые часто являются разрушительными для биологически активных агентов или композиций. Для сохранения функциональности и активности разрабатывались различные методики, особенно применение криопротекторов, включающих, например,сахара, подобные сахарозе или трегалозе. Липосомы и виросомы имеют превосходные свойства в качестве носителей для доставки лекарств. В то время как липосомы представляют собой сферические липидные везикулы, виросомы представляют собой оболочки вирусов, не содержащие инфекционный генетический материал исходного вируса. Различие липосом и виросом состоит в том, что виросомы содержат дополнительные белки на своей поверхности, делающие их частицами, активными в отношении слияния, тогда как липосомы являются неактивными носителями. Таким образом, виросомы представляют собой высокоэффективные системы "адъювант/носитель" в современной вакцинации, обладающие превосходными свойствами в качестве носителей для доставки антигенов и мощным иммуногенным потенциалом и одновременно минимизирующие риск побочных эффектов. До настоящего времени виросомы эффективно использовались в различных вакцинах. Например, в имеющихся в продаже вакцинах против гепатита А и гриппа виросомы используются в качестве адъювантов и безопасных носителей для доставки антигенов. Антитела, индуцированные путем прививки антигенами, реконструированными в виросомах, показали высокое сродство к антигенам, против которых они получены. Лиофилизация липосом может предотвращать гидролиз фосфолипидов и физическую деградацию везикул во время хранения. Кроме того, она может способствовать стабилизации вещества, которое включено в липосомы. Лиофилизация липосомного препарата приводит к получению сухого осадка, который может быть восстановлен в течение нескольких секунд с получением первоначальной дисперсии,а именно если используются соответствующие эксципиенты и если используются подходящие условия лиофилизации. С другой стороны, процесс лиофилизации сам по себе может индуцировать физические изменения липосом, такие как утрата инкапсулированного агента и изменения размера везикул. Наличие такого повреждения не является неожиданным, так как взаимодействие между гидрофильными фосфолипидными концевыми группами и молекулами воды играет ключевую роль в образовании липосомальных бислоев. Таким образом, удаление воды из липосом путем лиофилизации является проблемой. Более того, лиофилизация является трудоемким и энергопотребляющим процессом, безусловно требующим некоторых профессиональных знаний во избежание специфических для него подводных камней. К счастью, были идентифицированы такие эксципиенты, как дисахариды, которые защищают липосомы в процессе замораживания (лиопротекторы), и методика лиофилизации была широко описана в литературе(Pikal et al., 1990, Int. J. Pharm. Sci. 60, 203; Pikal, 1990, Biopharm 10, 18; Essig et al., 1993, "Lyophilization",Wissenschaftliche Verlagsgesellschaft, Stuttgart; Jenning, 1999, "Lyophilization: Introduction and basic principles", Interpharm Press, Englewood, CO). Лиопротекторы защищают липосомы путем: (1) предотвращения слияния липосом, (2) предотвращения разрыва бислоев кристаллами льда и (3) поддерживания целостности бислоев в отсутствие воды. Для того чтобы осуществить это, лиопротекторы должны образовывать аморфный стекловидный матрикс в липосомах и вокруг них. Взаимодействие между лиопротектором и фосфолипидными концевыми группами считается особенно важным для предотвращения просачивания во время регидратации липосом, которые имеют жидкокристаллический бислой в гидратированном состоянии при температурах окружающей среды. В отношении лиофилизации липосомные препараты можно разделить на различные типы: (1) пустые липосомы, которые восстанавливают раствором соединения, подлежащего инкапсуляции, (2) липосомы, нагруженные соединением, которое сильно связано с бислоем, и (3) липосомы, которые содержат водорастворимое соединение, которое не взаимодействует с бислоем. Третий тип представляет собой-1 011881 наиболее сложную задачу, поскольку требуется как предотвращение утечки инкапсулированных растворенных веществ, так и сохранение размера липосом. Состав бислоя является весьма существенным фактором при определении устойчивости липосом к лиофилизационному стрессу, но до настоящего времени было трудно выделить из литературы основные правила, поскольку вовлечены многие другие параметры, включая условия процесса лиофилизации, выбор лиопротекторов и размер везикул. Доказано, как описано выше, что лиофилизация липосом в лучшем случае является требовательной,но лиофилизация виросом сталкивается с еще большими проблемами. Эти проблемы, если сравнивать с липосомами, возникают благодаря дополнительным белкам в оболочке, отвечающим за активность слияния виросомы. Как белки, они являются чрезвычайно чувствительными к индуцированному лиофилизацией стрессу, вызывающему значительную потерю активности. Таким образом, существует потребность в композициях и способах, которые преодолевают проблемы, связанные с эффективной лиофилизацией и восстановлением (получением раствора) частиц, активных в отношении слияния, а именно виросом. Сущность изобретения В настоящем изобретении предложены биологически активные композиции и способы получения высокоустойчивых к лиофилизационному стрессу, гидратируемых виросомальных лиофилизатов и способы их восстановления. Согласно изобретению биологически активные композиции относятся к иммуногенным композициям или фармацевтическим композициям, содержащим виросомы и катионный липид для эффективной лиофилизации и восстановления виросомы, и, в частности, к иммуногенной композиции или фармацевтической композиции, где катионный липид для эффективной лиофилизации и восстановления виросомы присутствует в мембране виросомы. Используя идею изобретения, получают виросомы, которые имеют превосходные свойства лиофилизации и восстановления и которые особенно полезны для доставки антигенов, лекарств и других фармацевтически активных веществ, включая ДНК, РНК или siPHK (малые интерферирующие РНК), в клетки. После лиофилизации они все еще способны доставлять указанные вещества к различным клеткам через систему направленной доставки, которая распознает поверхностные маркеры специфических типов клеток, и поэтому являются гораздо более лучшими, чем другие известные носители для доставки. В предпочтительном воплощении используемые катионные липиды представляют собой катионные производные холестерина. В другом воплощении изобретения указанные производные холестерина представлены следующей формулой:R' представляет собой С 1-С 6-алкил, замещенный по меньшей мере одной положительно заряженной группой, предпочтительно N-содержащей группой формулы R1R2R3N+-, и соответствующий противоион представляет собой X-;R1, R2 и R3 независимо друг от друга выбраны из группы, состоящей из водорода и С 1-С 6-алкила;R" представляет собой С 1-С 6-алкилен. Согласно изобретению R", представляющий собой С 1-С 6-алкилен, означает насыщенную С 1-С 6 алкиленовую группу, которая может представлять собой -CH2-, -(CH2)2- и т.д., которая может быть также представлена в виде разветвленной цепи, такой как -CH(CH3)-(CH2)2- и т.д. В другом воплощении производные холестерина представлены формулой где R1, R2 и R3 независимо друг от друга выбраны из группы, состоящей из водорода и С 1-С 6-алкила, и Xпредставляет собой анион галогена. В другом воплощении катионный липид представлен формулой II, где R1 и R2 представляют собой метил, R3 представляет собой водород и X- представляет собой анион галогена, предпочтительно хлорид,т.е. 3[N-(N',N'-диметиламмониоэтан)карбамоил]холестерина хлорид (DC-Chol). В другом наиболее предпочтительном воплощении катионный липид представлен формулой II, R1, R2 и R3 представляют собой метил, X- представляет собой анион галогена, предпочтительно хлорид, т.е. 3[N-(N',N',N'триметиламмониоэтан)карбамоил]холестерина хлорид (TC-Chol). Виросомы по изобретению представляют собой носители, активные в отношении слияния, доставляющие биологически активное вещество, выбранное из фармацевтического агента и антигенной молекулы, в клетку. В частности, виросомы по изобретению представляют собой носители для доставки антигена, способные вызывать иммунный ответ против целевого антигена, или носители для доставки лекарственного средства, доставляющие лекарственное средство в клетку, и, благодаря составу их мембраны,подходящие для лиофилизации. В наиболее предпочтительном воплощении виросомы представляют собой иммуностимулирующие реконструированные виросомы гриппа (IRIV). Композиции виросомальной мембраны по настоящему изобретению содержат предпочтительно от 1,9 и 37 мол.% DC-Chol или TC-Chol относительно общего содержания липидов виросомальной мембраны. В наиболее предпочтительном воплощении содержание DC-Chol или TC-Chol в мембранах составляет от 1,9 до 16 мол.% общего содержания липидов виросомальной мембраны. Остальные липиды мембраны состоят предпочтительно из фосфолипидов, наиболее предпочтительно из фосфатидилхолина и фосфатидилэтаноламина в соотношении 4:1. Кроме того, виросомальная мембрана может содержать количество гемагглютинина, достаточное для обеспечения активности слияния виросомы. В одном из воплощений изобретения данная композиция может дополнительно содержать в растворе перед лиофилизацией желательное биологически активное вещество, выбранное из фармацевтического агента и антигенной молекулы. В другом воплощении выбранный фармацевтический агент или антиген может быть добавлен к лиофилизату перед восстановлением или добавлен после лиофилизации в процессе восстановления в комбинации с жидким растворителем, т.е. растворен в нем. В других воплощениях композиции по изобретению могут дополнительно содержать лиопротекторы, такие как сахароза, или адъювант или систему адъювантов. Изобретение также включает способы лиофилизации и восстановления упомянутых выше виросомальных композиций и лиофилизата, полученного вследствие этого. Кроме того, также подразумевается, что применение композиций по изобретению для изготовления лекарственного средства для вакцинации и иммунизации субъекта является частью изобретения. Наиболее предпочтительно, субъект представляет собой человека. Кроме того, настоящее изобретение также включает набор, содержащий лиофилизаты, получаемые с использованием способа лиофилизации по настоящему изобретению. Более того, набор может дополнительно содержать растворитель для восстановления и указанное биологически активное вещество, выбранное из фармацевтического агента и антигенной молекулы, при условии, что указанное биологически активное вещество уже не является частью композиции или лиофилизата. В одном из воплощений фармацевтический агент или антигенная молекула должны быть растворены в растворителе для восстановления перед восстановлением виросомального лиофилизата. Набор обеспечивает средства для легкого приготовления иммуногенной композиции с выбранным целевым антигеном, например, для вакцинации, и в то же время обеспечивает продолжительный срок хранения и превосходные характеристики хранения и манипуляций. Кроме того, применение описанного выше катионного липида для усиления иммуногенности виросомы также является частью изобретения. Краткое описание графических материалов На фиг. 1 показана активность слияния IRIV с различными мембранными композициями до и после лиофилизации, измеренная с помощью FRET анализа (см. пример 9). Сравниваются IRIV без дополнительного липида (А), с DC-Chol (В), DOTAP (С) и DHAB (D).-3 011881 На фиг. 2 показаны результаты ELISA (твердофазный иммуноферментный анализ) (см. пример 21) сывороток мышей, иммунизированных IRIV DC-Chol, содержащими пептид АМА 49-СРЕ на виросомальной поверхности. Сравниваются AMA49-IRIV-DC-Chol до лиофилизации, AMA49-IRIV-DC-Chol после лиофилизации и восстановления водой, IRIV-DC-Chol после лиофилизации и восстановления АМА 49-СРЕ пептидом и AMA49-IRIV контрольной сывороткой. На фиг. 3 показан CTL-анализ (с использованием цитотоксических Т-лимфоцитов) (см. пример 20) мышей, иммунизированных IRIV-DC-Chol, содержащими HLA-связывающий пептид (HLA - человеческий лейкоцитарный антиген) внутри виросомы. Сравниваются DC-Chol-IRIV, восстановленные водой,200 и 650 мкг/мл HLA-связывающего пептида. Подробное описание изобретения В настоящем изобретении раскрыты биологически активные композиции и способы лиофилизации и восстановления виросом. Для достижения сохранения активности виросом по настоящему изобретению в отношении слияния в данном описании раскрыты конкретные мембранные композиции. Эти композиции являются неотъемлемой частью изобретения и содержат, наряду с фосфолипидами и вирусным белком гемагглютинином, катионные липиды для обеспечения превосходной устойчивости к лиофилизационному стрессу виросом по изобретению. Катионные липиды. Настоящее изобретение относится к иммуногенной композиции, содержащей виросомы и катионный липид для эффективной лиофилизации и восстановления виросомы, и, в частности, к иммуногенной композиции, где катионный липид для эффективной лиофилизации и восстановления виросомы присутствует в мембране виросомы. В предпочтительном воплощении настоящего изобретения катионные липиды, используемые в качестве неотъемлемых мембранных компонентов, представляют собой DOTMA,DOTAP, DPPES, DOGS, DOSPA, DOSPER, THDOB, DOPA, DOTP, DOSC, DOTB, DOPC, DOPE и предпочтительно производные холестерина. Предпочтительные производные холестерина представлены следующей формулой:R' представляет собой С 1-С 6-алкил, замещенный по меньшей мере одной положительно заряженной группой, предпочтительно N-содержащей группой формулы R1R2R3N+-, и соответствующий противоион представляет собой X-;R1, R2 и R3 независимо друг от друга выбраны из группы, состоящей из водорода и С 1-С 6-алкила;R" представляет собой С 1-С 6-алкилен. Согласно изобретению R", представляющий собой С 1-С 6-алкилен, означает насыщенную С 1-С 6 алкиленовую группу, которая может представлять собой -CH2-, -(CH2)2- и т.д., которая также может быть представлена в виде разветвленной цепи, такой как -CH(CH3)-(CH2)2- и т.д. В еще более предпочтительном воплощении производные холестерина представлены формулой-4 011881 где R1, R2 и R3 независимо друг от друга выбраны из группы, состоящей из водорода и С 1-С 6-алкила, иX- представляет собой анион галогена. В наиболее предпочтительном воплощении катионный липид представлен формулой II, R1 и R2 представляют собой метил, R3 представляет собой водород, и X- представляет собой анион галогена,предпочтительно хлорид, с получением 3[N-(N',N'-диметиламмониоэтан)карбамоил]холестерина хлорида (DC-Chol). В другом наиболее предпочтительном воплощении катионный липид представлен формулой II, R1,R2 и R3 представляют собой метил и X- представляет собой анион галогена, предпочтительно хлорид, с получением 3[N-(N',N',N'-триметиламмониоэтан)карбамоил]холестерина хлорида (TC-Chol). Обнаружили, что и DC-Chol, и TC-Chol обеспечивают превосходные свойства в сохранении виросомальной активности в отношении слияния после лиофилизации и восстановления. Виросомы. Виросомы представляют собой оболочки вирусов и не содержат инфекционный генетический материал исходного вируса. Подобно липосомам виросомы могут быть использованы для доставки терапевтических веществ к широкому спектру клеток и тканей, но в отличие от липосом виросомы обладают преимуществом для эффективного введения в клетки с последующим внутриклеточным высвобождением виросомального содержимого, запускаемым вирусным белком слияния. Более того, благодаря включению активных вирусных белков слияния в их мембраны, виросомы высвобождают свое содержимое в цитоплазму непосредственно после поглощения клеткой, тем самым предотвращая деградацию терапевтического вещества в кислотном окружении эндосомы. Виросомы могут быть дополнительно нагружены одновременно несколькими разными В-клеточными и Т-клеточными эпитопами (Poltl-Frank et al., 1999,Clin. Exp. Immunol. 117:496; Moreno et al., 1993, J. Immunol. 151: 489), включая универсальные эпитопы Т-хелперных клеток (Kumar et al., 1992, J. Immunol. 148: 1499-1505) и другие эпитопы, известные специалистам в данной области. Таким образом, виросомы представляют собой высокоэффективные адъюванты в современной вакцинации, обладающие превосходными свойствами в качестве носителей для доставки антигенов и мощным иммуногенным потенциалом, одновременно минимизирующие риск побочных эффектов. В настоящем изобретении раскрыты биологически активные композиции, которые содержат биологически активное вещество, выбранное из фармацевтического агента и антигенной молекулы, включенное в синтетические сферические виросомы, названные как иммуностимулирующие реконструированные виросомы гриппа (IRIV). IRIV представляют собой сферические, однослойные везикулы со средним диаметром 150 нм и содержат двойную липидную мембрану, состоящую, по существу, из фосфолипидов,предпочтительно фосфатидилхолинов (PC) и фосфатидилэтаноламинов (РЕ). В противоположность липосомам IRIV содержат функциональные вирусные оболочечные гликопротеины гемагглютинин (НА) и нейраминидазу (NA), включенные в фосфолипидную бислойную мембрану. Биологически активный НА не только придает структурную стабильность и гомогенность виросомальным препаратам, но также вносит значительный вклад в иммунологические свойства путем поддержания активности вируса в отношении слияния. Согласно изобретению указанные биологически активные композиции способны доставлять биологически активные вещества в клеточный компартмент организма. Указанное биологически активное вещество выбрано из фармацевтических агентов и антигенных молекул, которые предпочтительно выбраны из группы, состоящей из ДНК, РНК, siPHK, белков, пептидов, аминокислот, лекарств, пролекарств и фармацевтически активных веществ или их производных. Предпочтительно биологически активное вещество представляет собой лекарственное средство, антиген или их смесь. Примеры фармацевтических агентов выбраны из группы, содержащей анестетики, ингибиторы ангиогенеза, противоугревые препараты, противоаллергические средства, антибиотики и химиотерапевтические средства для местного применения, антигистаминные средства, противовоспалительные/антимикробные, противоопухолевые агенты, антигены, противопротозойные средства, противоревматические средства, противовирусные вакцины, противовирусные средства, антиапоптотические средства, бактериальные вакцины, химиотерапевтические средства, цитостатики, иммунодепрессанты, слабительные и психолептические средства. Предпочтительными примерами лекарственного средства или иммуноактивного вещества являются доксорубицин, винбластин, цисплатин, метотрексат, циклоспорин и ибупрофен. Термин "антигенная молекула" относится к молекуле, против которой желателен иммунный ответ. Эта молекула может быть выбрана из группы, включающей, но не ограничивающейся этим, пептиды,белки, липиды, моно-, олиго- и полисахариды, гликопептиды, углеводы, липопротеины, бактериальные или вирусные патогены и токсины, другие небольшие иммуногенные молекулы и ДНК/РНК, кодирующие такие молекулы. "Иммуногенный" относится к способности молекулы вызывать иммунный ответ в организме, вакцинированном этой молекулой. Примерами антигенных молекул являются пептидные Тклеточные антигены и В-клеточные антигены. Предпочтительными примерами антигенных молекул являются Т-клеточные антигены на основе HCV (вируса гепатита С), опухолеассоциированных антигенов,-5 011881 коклюшного токсина, холерного анатоксина и малярии, RSV (респираторно-синцитиального вируса) и пептидных антигенов (в частности, бета-амилоидных) болезни Альцгеймера. Для противораковых терапевтических применений настоящего изобретения любое химиотерапевтическое лекарство могло бы быть подходящим для инкапсуляции в виросомы. Способы и композиции по настоящему изобретению дополнительно адаптированы для любого терапевтически релевантного применения, которое извлекает пользу из направленной доставки веществ к специфическим клеткам и тканям. Такие применения могут включать направленную доставку противораковых лекарств в раковые клетки, противовирусных лекарств в инфицированные клетки и ткани, противомикробных и противовоспалительных лекарств в пораженную ткань, а также доставку терапевтических средств только к тем органам и тканям, которые поражены конкретным заболеванием, тем самым увеличивая терапевтический индекс терапевтического средства и избегая системной токсичности. Например, в противоопухолевой терапии доксорубицин, противоопухолевый антибиотик класса антрациклинов, может быть доставлен с помощью способов и композиций по настоящему изобретению. Антрациклины имеют широкий спектр противоопухолевой активности и оказывают плейотропные эффекты на клетку. Хотя они представляют собой классические ДНК-интеркалирующие агенты, механизм их цитотоксичности, как предполагают,связан с взаимодействием с ферментом топоизомеразой II, разрывом двуцепочечных ДНК и, возможно, с образованием внутриклеточных свободных радикалов, которые являются чрезвычайно цитотоксичными. Таким образом, конъюгированные виросомы могут быть нагружены доксорубицином для того, чтобы селективно и эффективно ингибировать опухолевое прогрессирование rNeu сверхэкспрессирующих опухолей молочной железы. До настоящего времени виросомы эффективно использовались в различных вакцинах. Например, в имеющихся в продаже вакцинах против гепатита А и вируса гриппа. Доказано, что виросомы являются прекрасными и безопасными системами адъювант/носитель. Антитела, индуцированные путем вакцинации антигенами, реконструированными в виросомах, продемонстрировали высокое сродство к антигенам, против которых они получены. При инъекции по одиночке большинство пептидных антигенов проявляет относительно низкую иммуногенность. Но в комбинированной форме антигена и виросомы могут быть получены измеряемые титры высоко специфических антител против антигена. Антигенные пептиды могут быть доставлены посредством виросом либо на виросомальной поверхности, либо в виде, инкапсулированном в виросоме. Различие лежит в типе иммунного ответа. Когда виросомы сливаются с эндосомами после эндоцитоза,их содержимое, включая инкапсулированный антиген, высвобождается в клеточную цитоплазму. В цитоплазме указанное содержимое подвергается процессингу и презентации в комплексе с молекулами МНС класса I на клеточной поверхности, запуская клеточный, CD8+ клеточно-опосредованный, цитотоксический иммунный ответ. В противоположность этому механизму поверхностный антиген распознается и подвергается эндоцитозу В-клетками, которые представляют его в комплексе с молекулами МНС класса II и, таким образом, вызывают гуморальный иммунный ответ и продукцию специфических антител. Для того чтобы увеличить скорость включения биологически активных веществ в виросомы, облегчить манипулирование и сделать возможными более длительные периоды хранения, в настоящем изобретении раскрыты способы и композиции для эффективной лиофилизации виросом по изобретению. При попытке разработать эффективный виросомальный лиофилизат, композиция бислоя является решающим фактором, который должен быть тщательно рассмотрен. В этом контексте термин "лиофилизат" относится к лиофилизированной композиции до ее восстановления выбранным растворителем. Термин "восстановление" относится к процессу растворения лиофилизата подходящим растворителем. Поэтому в настоящем изобретении экспериментально исследовали эффективность различных мембранных композиций, содержащих катионные, нейтральные заряженные и незаряженные липиды, для сохранения размера и функциональности виросом после лиофилизации и восстановления. В результате в настоящем изобретении предложены виросомальные мембранные композиции, которые делают возможным лиофилизацию и восстановление виросом без потери функции. На основании этих экспериментальных результатов в настоящем изобретении предложены гидратируемые виросомальные лиофилизаты с высокой устойчивостью к лиофилизационному стрессу, содержащие катионные производные холестерина, в частности DC-Chol или TC-Chol, в качестве неотъемлемых компонентов мембраны. Такой виросомальный лиофилизат может дополнительно содержать биологически активное вещество, выбранное из фармацевтических агентов и/или антигенных молекул. Эти биологически активные вещества прикреплены к виросомальной поверхности или заключены в ней перед лиофилизацией. В другом воплощении фармацевтический агент и/или антигенную молекулу добавляют вместе с растворителем для восстановления к виросомальному лиофилизату. Эти фармацевтический агент и/или антигенная молекула прикрепляются к вновь образованной виросомальной поверхности. Предпочтительно, фармацевтический агент и/или антигенная молекула конъюгированы с липидами для того, чтобы прикрепиться к виросомальной мембраны через липид. В другом воплощении в настоящем изобретении раскрыты способы и композиции для эффективного включения фармацевтических агентов и/или анти-6 011881 генных молекул внутрь вновь образованных виросом. В предпочтительном воплощении композиция по настоящему изобретению содержит от 1,9 до 37 мол.% DC-Chol или TC-Chol от общего содержания липидов виросомальной мембраны. В наиболее предпочтительном воплощении концентрация DC-Chol или TC-Chol составляет от 1,9 до 16 мол.% общего от содержания липидов виросомальной мембраны. Остальные липиды виросомальной мембраны состоят из фосфолипидов, предпочтительно фосфатидилхолина и фосфатидилэтаноламина. В наиболее предпочтительном воплощении соотношение фосфатидилхолина и фосфатидилэтаноламина, содержащихся в виросомальной мембране, составляет 4:1. Все вышеописанные композиции содержат функциональное количество вирусного гемагглютинина. В этом контексте "функциональное количество" относится к количеству, достаточному для получения виросомных частиц, активных в отношении слияния. Выбранная антигенная молекула может быть либо непосредственно добавлена к одной из композиций, описанных выше, в количестве, достаточном для того, чтобы вызвать иммунный ответ, или, растворенная в буфере для восстановления, добавлена к лиофилизату одной из вышеописанных композиций в процессе восстановления. Таким образом, настоящее изобретение также включает композиции, подходящие для лиофилизации, дополнительно содержащие выбранный целевой антиген. Выбранное фармацевтическое соединение может быть либо непосредственно добавлено к одной из композиций, описанных выше, в количестве, достаточном для достижения биологической активности,или, растворенное в буфере для восстановления, добавлено к лиофилизату одной из вышеописанных композиций в процессе восстановления. Таким образом, настоящее изобретение также включает композиции, подходящие для лиофилизации, дополнительно содержащие выбранный целевой антиген. Композиции по настоящему изобретению могут дополнительно содержать вспомогательные ингредиенты, которые способствуют процессу лиофилизации. Эти вспомогательные ингредиенты включают в себя, но не ограничиваются этим, лиопротекторы, такие как сахароза, трегалоза, декстроза, лактоза, манноза, ксилоза и маннит. Такие соединения класса сахаров особенно полезны в количестве от 0,1 до 5% в растворе перед лиофилизацией. Термин "лиопротекторы" относится к классу соединений, полезных в качестве вспомогательных ингредиентов в процессе лиофилизации, которые способны уменьшать лиофилизационный стресс для виросом. Также частью настоящего изобретения является способ лиофилизации композиции по изобретению,по существу, основанный на стадиях замораживания, первичной сушки и вторичной сушки и последующего процесса восстановления растворителем или буфером, которые могут возможно содержать желательный целевой антиген. Применение описанных композиций для изготовления лекарственного средства для вакцинации или иммунизации этим субъекта также является частью настоящего изобретения. Предпочтительно указанный субъект представляет собой человека. Также частью изобретения является набор, содержащий виросомы по настоящему изобретению, которые уже лиофилизированы. Указанный набор может, в дополнение к виросомальному лиофилизату,дополнительно содержать растворитель для восстановления. В том случае, если антигенная молекула уже не является частью лиофилизированных виросом, указанный набор может дополнительно содержать целевой антиген. В одном из воплощений изобретения набор содержит антигенную молекулу, которая должна быть растворена в растворителе для восстановления перед использованием указанного растворителя для восстановления для растворения лиофилизированных виросом. Кроме того, в настоящем изобретении раскрыто применение вышеописанного катионного липида для дополнительного усиления иммуногенности виросомы. В этой связи авторы изобретения обнаружили, что иммуногенные свойства IRIV как таковых могут быть дополнительно усилены путем применения катионного липида, предпочтительно одного из описанных производных холестерина, в качестве виросомального мембранного компонента. В этом контексте термин "иммуногенность" относится к способности вызывать иммунный ответ. Адъюванты. Композиции по настоящему изобретению могут быть дополнены путем объединения любой из вышеупомянутых композиций с другим соединением, потенцирующим иммунный ответ. Соединения, потенцирующие иммунный ответ, классифицируют либо как адъюванты, либо как цитокины. Дополнительные адъюванты могут дополнительно усиливать иммунологический ответ путем обеспечения резервуара антигена (внеклеточно или внутри макрофагов), активирующего макрофаги и стимулирующего специфические группы лимфоцитов. Многочисленные адъюванты хорошо известны в данной области; конкретные примеры включают адъювант Фрейнда (полный и неполный), микобактерии, такие как BCG,M. vaccae, или липид А, или Corynebacterium parvum, смеси quil-сапонин, такие как QS-21 (SmithKlineBeecham), MF59 (Chiron), и различные эмульсии типа масло в воде (например, IDEC-AF). Другие адъюванты, которые могут быть использованы, включают в себя, но не ограничиваются этим, минеральные соли или минеральные гели, такие как гидроксид алюминия, фосфат алюминия и фосфат кальция; производные ЛПС, сапонины, поверхностно-активные вещества, такие как лизолецитин, плюронные полиолы,полианионы, пептиды или белковые фрагменты, гемоцианины лимфы улитки и динитрофенол; иммуно-7 011881 стимулирующие молекулы, такие как сапонины, мурамилдипептиды и трипептидные производные, CpGдинуклеотиды, CpG-олигонуклеотиды, монофосфориллипид А и полифосфазены; адъюванты в форме частиц и микрочастиц, такие как эмульсии, липосомы, виросомы, кохлеаты (cochleates); или иммунностимулирующие комплексные мукозальные адъюванты. Цитокины также полезны в протоколах вакцинации вследствие лимфоцитстимулирующих свойств. Многие цитокины, полезные для таких целей, известны специалисту в данной области, включая интерлейкин-2 (IL-2), IL-12, GM-CSF (гранулоцитарномакрофагальный колониестимулирующий фактор) и многие другие. Введение. При введении терапевтические композиции по настоящему изобретению вводят в фармацевтически приемлемых препаратах. Такие препараты могут традиционно содержать фармацевтически приемлемые концентрации соли, буферные агенты, консерванты, совместимые носители, дополнительные иммуннопотенцирующие агенты, такие как адъюванты и цитокины, и возможно другие терапевтические агенты. Препараты по изобретению вводят в эффективных количествах. Обычно эффективными считаются дозы иммуногенов, варьирующие от 1 нг/кг до 100 мг/кг в зависимости от способа введения. Предполагают,что предпочтительный диапазон составляет от 500 нг/кг до 500 мкг/кг. Абсолютное количество будет зависеть от множества факторов, включая композицию, выбранную для введения, осуществляется ли введение в однократных или многократных дозах, и индивидуальные параметры пациента, включающие возраст, физическое состояние, размер, массу и стадию заболевания. Эти факторы хорошо известны специалистам в данной области и могут быть определены не более чем рутинным экспериментированием. Примеры Настоящее изобретение проиллюстрировано следующими примерами, которые никоим образом не следует интерпретировать как ограничивающие его объем. Напротив, следует ясно понимать, что можно обратиться к различным другим воплощениям, модификациям и их эквивалентам, которые после прочтения описания данного изобретения могут быть предложены специалистам в данной области, но все же подпадают под объем защиты изобретения. Материалы и методы. Химические реагенты: октаэтиленгликоль-моно-(н-додециловый)эфир (ОЭГ, С 12 Е 8), трифторуксусная кислота (TFA), дигексадецилдиметиламмония бромид (DHAB), L-А-фосфатидил-L-серин из бычьего мозга (PS), 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин (DPPE), 1,2-дилауроил-sn-глицеро-3 фосфохолин (DLPC), холестерин из ланолина, 1-миристоил-sn-глицеро-3-фосфохолин (Lyso-PC), пальмитоил-DL-карнитина хлорид и холестерил-N-(триметиламмониоэтил)карбамата хлорид (TC-Chol) были из Fluka или Sigma (Buchs, Швейцария). Яичный фосфатидилхолин получали из Lipoid (Cham, Швейцария). 1,2-Дипальмитоил-sn-глицеро-3-фосфо-rac-(1-глицерин) натриевая соль (DPPG), 3-[N-(N',N'диметиламиноэтан)карбамоил]холестерина гидрохлорид (DC-Chol), 1,2-дипальмитоил-sn-глицеро-3 фосфата мононатриевая соль (DPPA) и 1,2-дипальмитоил этиленгликоль (DPEG) были приобретены изSM2 и Bio-Gel A-15m были из Bio-Rad Laboratories (Glattbrugg, Швейцария). Lissamine родамин В 1,2-дигексадеканоил-sn-глицеро-3-фосфоэтаноламин, триэтиламмониевая соль (Rh-DHPE), N-(4,4 дифтор-5,7-дифенил-4-бора-3 а,4 а-диаза-5-индацен-3-пропионил)-1,2-дигексадеканоил-sn-глицеро-3 фосфоэтаноламин (Bodipy 530/550-DHPE) были из Molecular Probes Europe (Лейден, Нидерланды). N-[1(2,3-Диолеоилокси)пропил]-N,N,N-триметиламмония хлорид (DOTAP) был приобретен из Roche AppliedScience (Rotkreuz, Швейцария). Доксорубицин HCl доступен из Fluka (Buchs, Швейцария). Вирусы: вирусы гриппа штамма Х-31 и штамма A/Sing (A/Singapore/6/86), размноженные в аллантоисной полости яиц с развивающимися зародышами (Gerhard, J. Exp. Med. 144:985-995, 1976), получали из Berna Biotech AG (Берн, Швейцария). Пептиды: HLA-связывающий пептид (DLMGYIPLV, а.к. 132-140) HLA-A2.1-связывающего вируса гепатита С (HCV) (Cerny et al., J. Clin. Invest. 95(2):521-30, 1995), а также HLA-A2.1-связывающий контрольный пептид и малярийный миметик АМА 49-СРЕ 1,3-дипальмитоил-глицеро-2 фосфоэтаноламино)-Suc-GGCYKDEIKKEIERESKRIKLNDNDDEGNKKIIAPRIFISDDKDSLKCG(дисульфидная связь (Moreno et al., Chembiochem 2:838-43, 2001) получали от Bachem AG (Bubendorf,Швейцария). Мыши: эксперименты по иммунизации осуществляли два раза в независимых лабораториях на мышах HHD, трансгенных по моноцепи HLA-A2.1 (А 0201) молекулы комплекса гистосовместимости классаI и дефектной как по H-2Db, так и по мышиному 2-микроглобулину (Pascolo et al., J. Exp. Med. 185 (12): 2043-51, 1997). Мышей помещали в соответствующие помещения для ухода за животными и обращались с ними в соответствии с международными нормами. Пример 1. Получение иммуностимулирующих реконструированных виросом гриппа (IRIV): виросомы получали способом, описанным ранее (Bron et al., Methods Enzymol. 220:313-331, 1993; Zurbriggen et al., Prog-8 011881 2 мл фосфатно-солевого буферного раствора (ФСБ), содержащего 100 мМ октаэтиленгликоля монодецилового эфира (ФСБ-ОЭГ). 4 мг НА вируса гриппа центрифугировали при 100000g в течение 1 ч при 4 С, и осадок растворяли в 2 мл ФСБ-ОЭГ. Детергент-растворенные фосфолипиды и вирусы смешивали и обрабатывали ультразвуком в течение 1 мин. Эту смесь центрифугировали при 100000g в течение 1 ч при 20 С, и супернатант стерильно фильтровали (0,22 мкм). Виросомы затем получали путем удаления детергента, используя 180 мг влажной смолы SM2 Bio-Beads, в течение 1 ч при комнатной температуре со встряхиванием и три раза в течение 30 мин с 90 мг SM2 Bio-Beads каждый раз. Конечные концентрации липидов составляли 8 мг/мл (10,4 мкмоль/мл) PC и 2 мг/мл (2,7 мкмоль/мл) РЕ. Соотношение гемагглютинин/фосфолипид определяли путем определения фосфолипидов по Бттчеру (Bttcher et al., Anal. Chim. Acta 24:202 -203, 1961) и количественного определения НА после ПААГДСН (электрофорез в полиакриламидном геле с додецилсульфатом натрия) способом окрашивания Кумасси и экстракции по Болу (Ball, Anal. Biochem. 155:23-27, 1986). Пример 2. Получение иммуностимулирующих реконструированных виросом гриппа, содержащих DC-Chol(11,1 мкмоль) РЕ и 0,3-5 мг (0,6-10 мкмоль) DC-Chol растворяли в 2 мл ФСБ, 100 мМ ОЭГ (ОЭГ-ФСБ). 4 мг НА вируса гриппа центрифугировали при 100000g в течение 1 ч при 4 С, и осадок растворяли в 1 мл ФСБ/ОЭГ. Детергент-растворенные фосфолипиды и вирусы и 1 мл 20% (мас./об.) сахарозы смешивали до конечного объема 4 мл и обрабатывали ультразвуком в течение 1 мин. Эту смесь центрифугировали при 100000g в течение 1 ч при 20 С, и супернатант стерильно фильтровали (0,22 мкм). Виросомы затем получали путем удаления детергента, используя 180 мг влажной смолы SM2 Bio-Beads в течение 1 ч при комнатной температуре со встряхиванием и три раза в течение 30 мин с 90 мг SM2 Bio-Beads каждый раз. Конечные концентрации липидов составляли 8 мг/мл (10,4 мкмоль/мл) PC, 2 мг/мл(2,7 мкмоль/мл) РЕ и 0,075-1,25 мг/мл (0,12-2,5 мкмоль/мл) DC-Chol. Соотношение гемагглютинин/фосфолипид определяли путем определения фосфолипидов по Бттчеру (Bttcher et al., Anal. Chim. Acta 24:202-203, 1961) и количественного определения НА после ПААГДСН способом окрашивания Кумасси и экстракции по Болу (Ball, Anal. Biochem. 155:23-27, 1986). Пример 3. Получение AMA49-DIRIV: способ конструирования DIRIV с липидсвязанным антигеном. Получение виросом, где антигены прикреплены к поверхности виросом. Для получения РЕ-миметик-IRIV, раствор очищенного гемагглютинина вируса гриппа A/Singapore (4 мг) в фосфатно-солевом буфере (ФСБ) центрифугировали в течение 30 мин при 100000 g, и осадок растворяли в ФСБ (1,33 мл), содержащем 100 мМ октаэтиленгликоля монодецилового эфира (ФСБ-ОЭГ). Конъюгаты АМА 49-РЕ (4 мг), фосфатидилхолин (32 мг; Lipoid, Ludwigshafen, Германия) и фосфатидилэтаноламин (6 мг) растворяли в общем объеме 2,66 мл ФСБ-ОЭГ. Растворы фосфолипида и гемагглютинина смешивали и обрабатывали ультразвуком в течение 1 мин. Этот раствор затем центрифугировали в течение 1 ч при 100000 g, и супернатант фильтровали (0,22 мкм) в стерильных условиях. Виросомы затем получали путем удаления детергента,используя BioRad SM BioBeads (BioRad, Glattbrugg, Швейцария). DIRIV хранили в аликвотах при -70 С до лиофилизации. Пример 4. Способ конструирования DIRIV с нацеливающим лигандом и спейсером. Этот пример демонстрирует сайтнаправленную конъюгацию Fab'-фрагмента с гибкой спейсерной группой, предназначенной для того, чтобы антигенсвязывающий сайт сохранялся доступным для связывания с клеткой-мишенью. Для того чтобы поместить Fab'-молекулы в положение, которое позволяет их бивалентному связывающему потенциалу оставаться доступным, Fab'-фрагменты конъюгируют с гибкой спейсерной группой посредством сайтнаправленной конъюгации. 100 мг NHS-PEG-MAL, содержащего длинную полиэтиленгликолевую спейсерную группу (PEG), растворяют в 3 мл безводного метанола, содержащего 10 мкл триэтиламина. Затем к раствору добавляют 45 мг диолеоилфосфатидилэтаноламина, растворенного в 4 мл хлороформа и метанола (1/3; об./об.). Реакцию осуществляют в токе азота в течение 3 ч при комнатной температуре (КТ). Метанол/хлороформ удаляют при пониженном давлении, и продукты вновь растворяют в хлороформе. Раствор экстрагируют с помощью 1% NaCl для удаления непрогреагировавшего материала и водорастворимых побочных продуктов. PE-PEG-MAL дополнительно очищают с помощью хроматографии с использованием кремневой кислоты, как описано Martin с соавт. (1982), с некоторыми модификациями: колонка с силикагелем имеет диаметр 1,5 см и наполнена силикагелем 14 (Kieselgel 60, Fluka 60752). Элюцию осуществляют следующим градиентом: хлороформ:метанол 29:1, 28:2, 27:3, 26:4 (мл) и т.д. Собирают фракции по 6 мл. PEG-PEG-MAL получают во фракциях 13-31. Фракции и чистоту PEPEG-MAL анализируют с помощью ТСХ (тонкослойная хроматография) на силикагеле смесью хлороформ-метанол-вода, 65:25:4. PE-PEG-MAL растворяют в Трис-HCl буфере (100 мМ, pH 7,6), содержащем 10 мг/150 мкл октаэтиленгликоля монодецилового эфира (С 12 Е 8). К этому раствору добавляют Fab'фрагменты в соотношении Fab'/PE-PEG-MAL 1:10. Раствор перемешивают при КТ в течение 2 ч в токе-9 011881 азота. Затем добавляют С 12 Е 8 для получения 1%-ного раствора С 12 Е 8, и реакционную смесь перемешивают в течение ночи при 4 С. Непрогреагировавший PE-PEG-MAL удаляют путем добавления 400 мкл промытой, влажной Thiopropyl-Sepharose 6B. После 3-часовой инкубации гель удаляют центрифугированием. PE-PEG-Fab'-раствор (3,6 мл) стерилизуют, пропуская через 0,2-мкм фильтр, и хранят в виде 0,01 М раствора детергента С 12 Е 8. Пример 5. Способ получения FAB' DIRIV: этот пример демонстрирует получение конъюгированных виросом,нацеленных на специфические клетки. Гемагглютинин (НА) из штамма вируса гриппа A/Singapore/6/86 выделяют, как описано в Waelti и Glueck, Int. J. Cancer 77: 728-733, 1998. Супернатант, содержащий растворенный тример НА (2,5 мг/мл) в 0,01 М растворе детергента С 12 Е 8, используют для получения виросом. Фосфатидилхолин (38 мг) в хлороформе добавляют в круглодонную колбу, и хлороформ упаривают с помощью роторного испарителя с получением тонкой PC (фосфатидилхолин) пленки на стеклянной стенке. В эту колбу добавляют супернатант (4 мл, содержащий 10 мг НА) и 3,6 мл PE-PEG-Fab' (содержащий 4 мг Fab'-фрагментов) из примера 3. При легком встряхивании PC пленку, покрывающую стеклянную стенку колбы, солюбилизируют смесью, содержащей детергент С 12 Е 8. Детергент из полученного раствора удаляют путем экстракции стерильной смолой Biobeads SM-2. Контейнер встряхивают в течение 1 ч на шейкере REAX2 (Heidolph, Kelheim, Германия). Для полного удаления детергента эту процедуру повторяют три раза с 0,58 мг Biobeads, после чего получают почти прозрачный раствор Fab'виросом. Количественный анализ обнаружил, что 1 мл Fab'-виросом содержит 1,3 мг НА, 5 мг PC и 0,53 мг Fab'-фрагментов. Концентрации Fab' определяют с помощью иммуноанализа фракций, собранных после гель-фильтрации на колонке High Load Superdex 200, как описано в инструкции Antibodies, ALaboratory Manual. Методика получения виросом без Fab' такая же, за исключением того, что PE-PEGFab' не добавляют. Получение иммуностимулирующих реконструированных виросом гриппа, содержащих DC-CholPE-PEG-Fab' растворяли в 2 мл ФСБ, 100 мМ ОЭГ (ОЭГ-ФСБ). 4 мг НА вируса гриппа центрифугировали при 100000g в течение 1 ч при 4 С, и осадок растворяли в 1 мл ФСБ/ОЭГ. Детергентрастворенные фосфолипиды и вирусы и 1 мл 20% (мас./об.) сахарозы смешивали до конечного объема 4 мл и обрабатывали ультразвуком в течение 1 мин. Эту смесь центрифугировали при 100000g в течение 1 ч при 20 С, и супернатант стерильно фильтровали (0,22 мкм). Виросомы затем получали путем удаления детергента, используя 180 мг влажной смолы SM2 Bio-Beads в течение 1 ч при комнатной температуре со встряхиванием и три раза в течение 30 мин с 90 мг SM2 Bio-Beads каждый раз. Конечные концентрации липидов составляли 8 мг/мл (10,4 мкмоль/мл) PC, 2 мг/мл (2,7 мкмоль/мл) РЕ и 0,075-1,25 мг/мл (0,122,5 мкмоль/мл) DC-Chol. Соотношение гемагглютинин/фосфолипид определяли путем определения фосфолипидов по Бттчеру (Bttcher et al., Anal. Chim. Acta 24:202-203, 1961) и количественного определения НА после ПААГДСН способом окрашивания Кумасси и экстракции по Болу (Ball, Anal. Biochem. 155:23-27, 1986). Пример 6. Загрузка DIRIV интересующей фармацевтической композицией: Доксорубицин загружают на виросомы посредством протонного градиента, образованного сульфатом аммония с включенными виросомами, как описано в Gabizon et al., J. Natl. Cancer Inst. 81: 1484-1488, 1989. Для загрузки виросом сульфатом аммония раствор сульфата аммония (4,17 г/мл) добавляют к раствору DIRIV (7,5 мл), обрабатывают ультразвуком в течение 1 мин и диализуют (Spectra/Por 2,1, Biotech DispoDialyzers, MWCO: 15'000, Spectrum Medical Industries, Houston, TX, США) против 1 л ФСБ, содержащего 5% глюкозы, в течение 24 ч при 4 С. Через 24 ч диализный буфер меняют, и раствор виросом диализуют в течение еще 24 ч. Для приготовления раствора для загрузки доксорубицина, 10 мг доксорубицина растворяют в 3 мл воды и стерилизуют через 0,2-мкм фильтр, затем добавляют 750 мкл стерильного 5 Х концентрированного ФСБ и 5% глюкозы. Раствор виросом и раствор для загрузки доксорубицина нагревают до 33 С, и затем 2 объема раствора виросом смешивают с 1 объемом раствора для загрузки доксорубицина. Смесь инкубируют в течение 10 ч при 33 С и затем инкубируют в течение ночи при 28 С. Неинкапсулированный доксорубицин отделяют от виросом с помощью гель-фильтрации на колонке High Load Superdex 200 (Pharmacia, Uppsala, Швеция), уравновешенной стерильным ФСБ с 5% глюкозы. Фракции пустого объема, содержащиеFab'-виросомы с инкапсулированным доксорубицином, элюируют 5% глюкозы в ФСБ и собирают. Пример 7. Лиофилизация DIRIV: DIRIV хранили в аликвотах при -70 С до лиофилизации. Лиофилизацию осуществляли в speedvac Savant AES1010 согласно инструкциям поставщика. Высушенные образцы использовали непосредственно или хранили при -70 С. Для восстановления лиофилизированных DIRIV к высушенным DIRIV добавляли объем воды, равный объему до лиофилизации. Восстановленные пустыеDIRIV хранили при 4 С. Пример 8. Получение HLA-связывающий пептид-DIRIV: DIRIV хранили в аликвотах при -70 С до лиофилизации. Лиофилизацию осуществляли в speedvac Savant AES1010 согласно инструкциям поставщика. Высушенные образцы использовали непосредственно или хранили при -70 С. Для восстановления лиофилизированных DIRIV к высушенным DIRIV добавляли объем HLA-связывающего пептида, растворенного в воде, равный объему до лиофилизации. Восстановленные HLA-связывающий пептид-DIRIV хранили при 4 С. Определение концентрации инкапсулированного пептида осуществляли с помощью ОФ-ВЭЖХ (обращенно-фазная высокоэффективная жидкостная хроматография). Пример 9.Savant AES1010 согласно инструкциям поставщика. Высушенные образцы использовали непосредственно или хранили при -70 С. Для восстановления лиофилизированных DIRIV к высушенным DIRIV добавляли объем АМА 49-СРЕ, растворенного в воде, равный объему до лиофилизации. ВосстановленныеAMA49-DIRIV хранили при 4 С. Определение концентрации включенного пептида осуществляли с помощью ОФ-ВЭЖХ. Пример 10. Получение доксорубицин-DIRIV: DIRIV хранили в аликвотах при -70 С до лиофилизации. Лиофилизацию осуществляли в speedvac Savant AES1010 согласно инструкциям поставщика. Высушенные образцы использовали непосредственно или хранили при -70 С. Для приготовления раствора для загрузки доксорубицина, 10 мг доксорубицина растворяют в 3 мл воды и стерилизуют через 0,2-мкм фильтр. Для восстановления лиофилизированных DIRIV к высушенным DIRIV добавляли объем доксорубицина, равный объему до лиофилизации. Восстановленные доксорубицин-DIRIV хранили при 4 С. Пример 11. Определение включенного доксорубицина: количество инкапсулированного лекарства, в данном случае доксорубицина, определяли по оптической плотности при 480 нм. Препараты DIRIV содержат в среднем 150 мкг/мл доксорубицина. Средний диаметр виросом определяют с помощью фотоннокорреляционной спектроскопии (PCS) с использованием анализатора субмикронных частиц CoulterN4Plus (Miami, FL, США). Собственную экспрессию вирусной активности слияния виросом измеряют,как описано ранее в Hoekstra et al., Biochemistry 23: 5675-5681, 1984, с помощью анализа на основе гашения флуоресценции октадецилродамина (R18). Пример 12. Получение иммуностимулирующих реконструированных виросом гриппа, содержащих другие липиды: виросомы получали, как описано в примере 3, с единственным отличием, что DC-Chol заменяли одним из следующих веществ: DHAB, DOTAP, PS, холестерин, DPPE, DLPC, Lyso-PC, пальмитоил-DLкарнитин, DPEG или TC-Chol. Конечные концентрации липидов составляли 8 мг/мл (10,4 мкмоль/мл) PC,2 мг/мл (2,7 мкмоль/мл) РЕ и 0,125 мг/мл (0,22 мкмоль/мл) DHAB, или 0,125 мг/мл (0,18 мкмоль/мл)DPEG, или 0,125 мг/мл (0,23 мкмоль/мл) TC-Chol, соответственно. Модифицированные IRIV хранили в аликвотах при -70 С до лиофилизации. Лиофилизацию осуществляли в speedvac Savant AES1010 согласно инструкциям поставщика. Высушенные образцы использовали непосредственно или хранили при -70 С. Для восстановления лиофилизированных виросом к высушенным виросомам добавляли объем воды или HLA-связывающего пептида в ФСБ, равный объему до лиофилизации. Восстановленные виросомы хранили при 4 С. Пример 13. Количественное определение HLA-связывающего пептида: Количественное определение пептида осуществляли с помощью ВЭЖХ на Agilent 1100 Series (Agilent Technologies, Швейцария), используя обращенно-фазную колонку СС 125/4.6 Nucleosil 100-5 С 8 (Macherey-Nagel, Швейцария) (ОФ-ВЭЖХ). Использовали следующие элюенты: буфер А, 10 мМ ТЕАР в воде; буфер В, 100% ацетонитрила. Программа ВЭЖХ: скорость потока 1,3 мл/мин; температура буфера и колонки 25 С; начальная концентрация буфера: 25% В; 0-7 мин: увеличение буфера В до 38%; 7-12,4 мин: увеличение буфера В до 100%; 12,4-16,4 мин: 100% буфера В. Для количественного определения инкапсулированного пептида фракцию(5-30 мкл) виросом наносили на свежеприготовленные, ФСБ-уравновешенные 1 мл гельфильтрационные spin (для центрифугирования) колонки с Sephadex G50 Coarse. Везикулы только с инкапсулированным пептидом получали после центрифугирования spin колонки при 300g в течение 2 мин, поскольку неинкапсулированный пептид удерживался в колонке. Пример 14. Количественное определение пептида АМА 49-СРЕ: Количественное определение пептида осуществляли с помощью ВЭЖХ на Agilent 1100 Series (Agilent Technologies, Швейцария), используя обращен- 11011881 но-фазную колонку ZORBAX Eclipse XDB-C8 (Agilent Technologies, Швейцария) (ОФ-ВЭЖХ). Использовали следующие элюенты: буфер А, 0,1% TFA в воде; буфер В, 0,1% TFA в метаноле. Программа ВЭЖХ: скорость потока 1,0 мл/мин; температура буфера и колонки 60 С; начальная концентрация буфера: 60% В; 0-15 мин: увеличение буфера В до 100%; 15-20 мин: 100% буфера В. Для количественного определения инкапсулированного пептида фракцию (5-30 мкл) виросом наносили на свежеприготовленные, ФСБ-уравновешенные 1 мл гель-фильтрационные spin колонки Sephadex G50 Coarse. Везикулы только с инкапсулированным пептидом получали после центрифугирования spin колонки при 300g в течение 2 мин, поскольку неинкапсулированный пептид удерживался в колонке. Пример 15.FRET-анализ: для измерений слияния in vitro с помощью резонансного переноса энергии флуоресценции (FRET) (Struck et al., Biochemistry 20(14):4093-99, 1981; Loyter et al., Methods Biochem. Anal. 33:129-64, 1988) разработали следующий анализ: 0,75 мол.% Bodipy 530/550-DHPE и 0,25 мол.% N-RhDHPE включали в липосомы, состоящие из PC/DPPG (70:30). Измерения флуоресценции осуществляли при дискретных температурах от 4 до 42 С в 5 мМ натрий-фосфатном буфере, pH 7,5, 100 мМ NaCl, в конечном объеме 0,8 мл в 2,5 мл РММА микрокюветах (VWR, Швейцария) при постоянном перемешивании. Типично, 1 мкл меченых липосом (0,3 нмоль фосфолипида) смешивали с 5-20 мкл виросом (0,10,4 нмоль фосфолипида), и слияние запускали путем добавления 3,75-7 мкл 1 М HCl, приводящего к pH 4,5. Увеличение флуоресценции регистрировали каждые 5 с при длинах волн возбуждения и излучения 538 нм и 558 нм, соответственно, с щелью возбуждения 2,5 нм и с щелью излучения 15,0 нм. Измерения осуществляли с помощью люминисцентного спектрометра LS 55 (Perkin Elmer Instruments, США), снабженного термостатированным штативом для кювет и магнитным устройством для перемешивания. Максимальной флуоресценции при бесконечном разведении проб достигали после добавления Тритона Х 100 (конечная концентрация 0,5% об./об.). Для калибрования шкалы флуоресценции первоначальную остаточную флуоресценцию липосом устанавливали на ноль, а флуоресценцию при бесконечном разведении проб - на 100%. Пример 16. Определение размера частиц осуществляли с помощью светорассеяния, используя прибор Zetasizer 1000HS (Malvern Instruments, UK) в 2 мл РММА кюветах. (Sarstedt AG, Швейцария). 5-20 мкл виросом или липосом, соответственно, разбавляли в профильтрованном (0,22 мкм) ФСБ и измеряли три раза в течение 300 с при 25 С и 633 нм согласно инструкциям поставщика. Пример 17. Получение липосом, содержащих DC-Chol (DC-липосомы): 32 мг (41,7 мкмоль) PC, 8 мг(11,1 мкмоль) РЕ и 0,8-5 мг (1,6-10 мкмоль) DC-Chol растворяли в 4 мл ФСБ, 100 мМ ОЭГ, 5% (мас./об.) сахарозы (ОЭГ-ФСБ), затем смешивали и обрабатывали ультразвуком в течение 1 мин. Эту смесь стерильно фильтровали (0,22 мкм), и липосомы затем получали путем удаления детергента, используя 180 мг влажной смолы SM2 Bio-Beads в течение 1 ч при комнатной температуре со встряхиванием и три раза в течение 30 мин с 90 мг SM2 Bio-Beads каждый раз. Конечные концентрации липидов составляли 8 мг/мл PC (10,4 мкмоль/мл), 2 мг/мл РЕ (2,7 мкмоль/мл) и 0,2-1,25 мг/мл DC-Chol (0,4-2,5 мкмоль/мл). Липосомы хранили в аликвотах при -70 С до лиофилизации. Лиофилизацию осуществляли в speedvacSavant AES1010 согласно инструкциям поставщика. Высушенные образцы использовали непосредственно или хранили при -70 С. Для восстановления лиофилизированных DC-липосом к высушенным DCлипосомам добавляли соответственно воду или HLA-связывающий пептид, растворенный в воде. Восстановленные HLA-связывающий пептид-DC-липосомы хранили при 4 С. Пример 18. Получение липосом: 78 мг (101,6 мкмоль) PC (растворенного в метаноле) и 32,68 мг (43,56 мкмоль)DPPG (растворенного в смеси метанол/хлороформ (1:1 (молярное соотношение 70:30) смешивали вместе, и растворитель удаляли с использованием роторного испарителя (Rotavapor R-205, Bchi Labortechnik, Швейцария) при 40 С при постепенном вакууме 30-10 кПа. Высушенную липидную пленку повторно гидратировали с помощью 1,5 мл 5% (мас./об.) сахарозы в воде. Липосомы хранили в аликвотах при-70 С до лиофилизации. Лиофилизацию осуществляли в speedvac Savant AES1010 согласно инструкциям поставщика. Высушенные образцы использовали непосредственно или хранили при -70 С. Для восстановления лиофилизированных липосом к высушенным липосомам добавляли соответственно ФСБ илиHLA-связывающий пептид, растворенный в ФСБ. Восстановленные HLA-связывающий пептидлипосомы хранили при 4 С. Пример 19. Получение липосом, содержащих DC-Chol (DC-липосомы): 66,8-75,2 мг (87,1-98 мкмоль) PC (растворенного в метаноле) и 32,68 мг (43,56 мкмоль) DPPG (растворенного в смеси метанол/хлороформ(1:1 и 1,82-7,26 мг (3,6-14,5 мкмоль) DC-Chol (растворенного в метаноле) (молярное соотношение 6067,5:30:2,5-10) смешивали вместе, и растворитель удаляли с использованием роторного испарителя (Rotavapor R-205, Buchi Labortechnik, Швейцария) при 40 С при постепенном вакууме 30-10 кПа. Высушенную липидную пленку повторно гидратировали с помощью 1,0 мл 5% (мас./об.) сахарозы в воде. Липо- 12011881 сомы хранили в аликвотах при -70 С до лиофилизации. Лиофилизацию осуществляли в speedvac SavantAES1010 согласно инструкциям поставщика. Высушенные образцы использовали непосредственно или хранили при -70 С. Для восстановления лиофилизированных DC-липосом к высушенным DC-липосомам добавляли ФСБ или HLA-связывающий пептид HCV, растворенный в ФСБ, соответственно. Восстановленные HLA-связывающий пептид-DC-липосомы хранили при 4 С. Пример 20. Иммунизация и анализ цитотоксичности: HLA-2.1 tg мышей иммунизировали подкожно (п/к) в основание хвоста 100 мкл соответствующего препарата виросом. Мыши получали 2 инъекции с 3 недельным интервалом, и ответ анализировали через 2 недели после последней инъекции. Клетки селезенки (4106/лунку) из иммунизированных мышей повторно стимулировали в течение 5 суток в 24 луночных планшетах для культивирования тканей с помощью 2106 облученных (1500 рад) клеток селезенки, которые были обработаны в импульсном режиме 10 мкг/мл пептида в полной среде RPMI (Sigma(Sigma Aldrich), 5 мМ Hepes, 10% FCS (Gibco BRL, Базель, Швейцария) и 510-5 M 2-меркаптоэтанола,при 37 С и 5% CO2. На 2 сутки добавляли 5 ед./мл IL-2 (EuroCetus B.V., Амстердам, Нидерланды). Специфическую цитолитическую активность тестировали в стандартном анализе высвобождения 51Cr против клеток-мишеней EL-4S3Rob HHD, обработанных в импульсном режиме 10 мкг/мл выбранных пептидов или контроля среды. Через 4 ч инкубации измеряли высвобождение 51Cr с использованием -счетчика. Спонтанное и максимальное высвобождение определяли из лунок, содержащих только среду, или после лизиса с помощью 1 М HCl, соответственно. Лизис вычисляли по формуле: (высвобождение в анализе-спонтанное высвобождение)/(максимальное высвобождение-спонтанное высвобождение)100. Пептид-специфический лизис определяли как процент лизиса, полученного в присутствии или в отсутствие пептида. Спонтанное высвобождение всегда составляло менее 15% максимального высвобождения. Пример 21. Твердофазный иммуноферментный анализ ELISA против АМА 49-СРЕ: микротитрационные планшеты для ELISA (PolySorb, Nunc, VWR International AG, Швейцария) покрывали при 4 С в течение ночи 100 мкл/лунку 10 мкг/мл АМА 49-СРЕ в ФСБ. Лунки промывали три раза 300 мкл/лунку ФСБ, содержащего 0,05% Tween-20 перед тем, как их блокировали 5% сухого молока в ФСБ в течение 2 ч при 37 С. Лунки промывали три раза 300 мкл/лунку ФСБ, содержащего 0,05% Tween-20. Планшеты затем инкубировали с двухкратными последовательными разведениями мышиной сыворотки в ФСБ, содержащем 0,05% Tween-20 и 0,5% сухого молока (100 мкл/лунку) в течение 2 ч при 37 С. После промывки планшеты инкубировали с козьим IgG (специфическти к -цепи) антителом против мыши, конъюгированным с щелочной фосфатазой (Sigma, St. Louis, МО, США), в течение 1 ч при 37 С и затем промывали три раза. Фосфатазный субстрат (1 мг/мл паранитрофенилфосфата (Sigma) в 0,14% (мас./об.) Na2CO3, 0,3%(мас./об.) NaHCO3, 0,02% (мас./об.) MgCl2, pH 9,6) добавляли и инкубировали при комнатной температуре в темноте. После соответствующего времени реакцию останавливали путем добавления 100 мкл/лунку 1 М серной кислоты. Оптическую плотность (OD) продукта реакции регистрировали при 405 нм с помощью устройства для считывания микропланшетов (Spectra MAX plus, Molecular Devices, Bucher BiotechAG, Швейцария). Пример 22. Получение препарата вакцины против гриппа, содержащего DC-Chol: три партии виросом гриппа получали способом, описанным ранее (Bron et al., Methods Enzymol. 220:313-331, 1993; Zurbriggen et al.,Prog. Lipid Res. 39(1):3-18, 2000). Кратко, 32 мг (41,7 мкмоль) яичного PC и 0,3-5 мг (0,6-10 мкмоль) DCChol растворяли в 2 мл ФСБ, 100 мМ ОЭГ (ОЭГ-ФСБ). 4 мг НА вируса гриппа (1-я партия A/New Caledonia/20/99 (H1N1); 2-я партия A/Fujian/411/2002 (H3N2), 3-я партия B/Shanghai/361/2002) центрифугировали при 100000g в течение 1 ч при 4 С, и осадок растворяли в 1 мл ФСБ/ОЭГ. Растворенные с детергентом фосфолипиды и вирусы и 1 мл 20% (мас./об.) сахарозы смешивали до конечного объема 4 мл и обрабатывали ультразвуком в течение 1 мин. Эту смесь центрифугировали при 100000g в течение 1 ч при 20 С, и супернатант стерильно фильтровали (0,22 мкм). Три разные партии виросом затем получали путем удаления детергента, используя 180 мг влажной смолы SM2 Bio-Beads в течение 1 ч при комнатной температуре со встряхиванием и три раза в течение 30 мин с 90 мг SM2 Bio-Beads каждый раз. Конечные концентрации липидов составляли 8 мг/мл (10,4 мкмоль/мл) PC, 2 мг/мл (2,7 мкмоль/мл) РЕ и 0,075-1,25 мг/мл (0,12-2,5 мкмоль/мл) DC-Chol. После количественного определения НА три партии смешивали и лиофилизировали. Лиофилизацию осуществляли в speedvac Savant AES1010 согласно инструкциям поставщика. Высушенные образцы использовали непосредственно или хранили при -70 С. Для восстановления лиофилизированного препарата вакцины против гриппа к высушенным DIRIV добавляли объем воды, равный объему до лиофилизации. Восстановленные пустые DIRIV хранили при 4 С.- 13011881 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Биологически активная композиция, содержащая по меньшей мере одну иммуностимулирующую реконструированную виросому гриппа (IRIV) и катионное производное холестерина для эффективной лиофилизации и восстановления виросомы. 2. Композиция по п.1, где указанное катионное производное холестерина для эффективной лиофилизации и восстановления виросомы присутствует в мембране виросомы. 3. Композиция по п.1 или 2, где указанное производное холестерина имеет положительно заряженный заместитель в 3 положении холестерина и представлено следующей формулой:R' представляет собой С 1-С 6-алкил, замещенный по меньшей мере одной положительно заряженной группой, предпочтительно N-содержащей группой формулы R1R2R3N+-, и соответствующий противоион представляет собой X-;R1, R2 и R3 независимо друг от друга выбраны из группы, состоящей из водорода и С 1-С 6-алкила;R" представляет собой С 1-С 6-алкилен. 4. Композиция по п.3, где указанное производное холестерина представлено следующей формулой: где R1, R2 и R3 независимо друг от друга выбраны из группы, состоящей из водорода и С 1-С 6-алкила, иX- представляет собой анион галогена. 5. Композиция по п.4, где R1 и R2 представляют собой метил и R3 представляет собой водород. 6. Композиция по п.4, где R1, R2 и R3 представляют собой метил. 7. Композиция по любому из пп.2-6, где содержание катионного липида составляет от 1,9 до 37 мол.% от общего содержания липидов мембраны. 8. Композиция по п.7, где содержание катионного липида составляет от 1,9 до 16 мол.% от общего содержания липидов мембраны. 9. Композиция по п.7 или 8, где остальные липиды виросомальной мембраны состоят из фосфолипидов. 10. Композиция по п.9, где фосфолипиды представляют собой фосфатидилхолин и фосфатидилэтаноламин. 11. Композиция по п.10, где соотношение фосфатидилхолина и фосфатидилэтаноламина составляет от 3:1 до 5:1, предпочтительно 4:1. 12. Композиция для лиофилизации, содержащая биологически активную композицию, охарактеризованную в любом из пп.1-11, и дополнительно лиопротектор. 13. Композиция по п.12, где лиопротектор выбран из группы, состоящей из сахарозы, трегалозы,декстрозы, лактозы, маннозы, ксилозы и маннита. 14. Композиция по п.13, где лиопротектор присутствует в соотношении от 0,1 до 5% (мас./об.) в растворе перед лиофилизацией.- 14011881 15. Композиция по любому из пп.12-14, дополнительно содержащая адъювант или систему адъювантов. 16. Композиция по любому из пп.1-11 или 12-15, дополнительно содержащая биологически активное вещество, выбранное из фармацевтического агента или антигенной молекулы. 17. Композиция по п.16, где указанное биологически активное вещество или прикреплено к поверхности виросомы, и/или заключено в виросому. 18. Способ лиофилизации виросом с использованием композиций по любому из пп.12-15, включающий стадии:(а) замораживания указанной композиции,(б) первичной сушки указанной замороженной композиции при первом пониженном давлении и(в) вторичной сушки указанной замороженной композиции при втором пониженном давлении,где указанную первичную сушку осуществляют при более высоком давлении, чем указанное второе пониженное давление. 19. Способ лиофилизации виросом с использованием композиций по любому из пп.16 или 17,включающий стадии:(а) замораживания указанной композиции, содержащей указанное биологически активное вещество,выбранное из фармацевтического агента и антигенной молекулы,(б) первичной сушки указанной замороженной композиции при первом пониженном давлении и(в) вторичной сушки указанной замороженной композиции при втором пониженном давлении,где указанную первичную сушку осуществляют при более высоком давлении, чем указанное второе пониженное давление. 20. Виросомальный лиофилизат, получаемый способом по п.18. 21. Виросомальный лиофилизат, получаемый способом по п.19. 22. Способ восстановления виросомального лиофилизата по п.20, включающий стадию растворения виросомального лиофилизата в растворителе для восстановления. 23. Способ по п.22, где растворитель для восстановления содержит указанное биологически активное вещество, выбранное из фармацевтического агента и антигенной молекулы. 24. Способ восстановления виросомального лиофилизата по п.21, включающий стадию растворения виросомального лиофилизата в растворителе для восстановления. 25. Применение любой из композиций по пп.1-17 для изготовления лекарственного средства для вакцинации субъекта. 26. Применение по п.25, где субъект представляет собой человека. 27. Набор, включающий контейнер, содержащий лиофилизат по п.20. 28. Набор по п.27, дополнительно включающий второй контейнер, содержащий растворитель для восстановления и указанное биологически активное вещество, выбранное из фармацевтического агента и антигенной молекулы. 29. Набор, включающий контейнер, содержащий лиофилизат по п.21. 30. Набор по п.29, дополнительно включающий второй контейнер, содержащий растворитель для восстановления. 31. Применение катионного производного холестерина для усиления способности виросомы восстанавливаться после лиофилизации, причем указанная виросома в своем восстановленном состоянии содержит биологически активное вещество, выбранное из фармацевтического агента или антигенной молекулы. 32. Применение по п.31, где указанное производное холестерина имеет положительно заряженный заместитель в 3 положении холестерина и представлено следующей формулой: где R выбран из группы, состоящей из R', R'-(C=O)-, R'-O-(C=O)-, R'-NH-(С=О)-, R'-O-(C=O)-R"-(C=O)-,R'-NH-(C=O)-R"-(C=O)-,R' представляет собой С 1-С 6-алкил, замещенный по меньшей мере одной положительно заряженной группой, предпочтительно N-содержащей группой формулы R1R2R3N+-, и соответствующий противоион представляет собой X-;R1, R2 и R3 независимо друг от друга выбраны из группы, состоящей из водорода и С 1-С 6-алкила;R" представляет собой С 1-С 6-алкилен. 33. Применение по п.32, где указанное производное холестерина представлено следующей формулой: где R1, R2 и R3 независимо друг от друга выбраны из группы, состоящей из водорода и С 1-С 6-алкила, иX- представляет собой анион галогена. 34. Применение по п.33, где R1 и R2 представляют собой метил и R3 представляет собой водород. 35. Применение по п.33, где R1, R2 и R3 представляют собой метил. 36. Применение по любому из пп.31-35, где содержание катионного липида в виросомальной мембране составляет от 1,9 до 37 мол.% от общего содержания липидов мембраны. 37. Применение по п.36, где содержание катионного липида в виросомальной мембране составляет от 1,9 до 16 мол.% от общего содержания липидов мембраны. 38. Применение по п.36 или 37, где остальные липиды виросомальной мембраны состоят из фосфолипидов. 39. Применение по п.38, где фосфолипиды представляют собой фосфатидилхолин и фосфатидилэтаноламин. 40. Применение по п.39, где соотношение фосфатидилхолина и фосфатидилэтаноламина составляет от 3:1 до 5:1, предпочтительно 4:1. 41. Применение по любому из пп.32-40, дополнительно включающее адъювант или систему адъювантов.
МПК / Метки
МПК: A61K 9/127, A61K 9/19
Метки: лиофилизация, виросом
Код ссылки
<a href="https://eas.patents.su/19-11881-liofilizaciya-virosom.html" rel="bookmark" title="База патентов Евразийского Союза">Лиофилизация виросом</a>
Предыдущий патент: Рекомбинантный вирус, содержащий ген теломелизина-gfp
Следующий патент: Pyy – агонисты и их применение
Случайный патент: Переключающее электронное реле