Арилсульфонанилидмочевины
Формула / Реферат
1. Соединение формулы
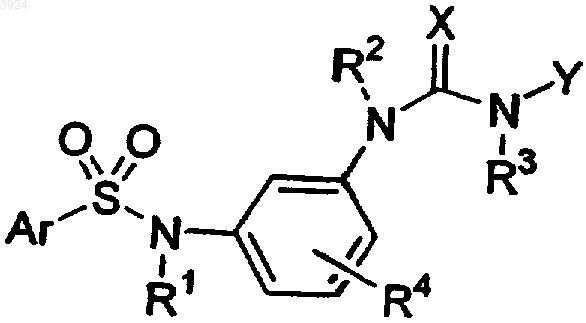
где X представляет собой O;
R1 и R2, каждый независимо, выбирают из группы, состоящей из водорода, (C1-C6)-алкила и (C1-C6)-гетероалкила;
R3 представляет собой заместитель, выбранный из группы, состоящей из водорода, (C1-C6)-алкила и (C1-C6)-гетероалкила или соединяется с Y и атомом азота, к которому присоединяется каждый из них, с образованием 5-, 6- или 7-членного гетероциклического кольца;
R4 представляет собой заместитель, выбранный из группы, состоящей из водорода, галогена, (C1-C8)-алкила, (C1-C8)-гетероалкила, OR11, SR11 и NR11R12, где R11 и R12, каждый независимо, выбирают из группы, состоящей из водорода, (C1-C8)-алкила, (C1-C8)-гетероалкила;
Y представляет собой заместитель, выбранный из группы, состоящей из водорода, (C1-C8)-алкила, (C1-C8)-гетероалкила, арил-(C1-C4)-алкила, арил-(C1-C4)-гетероалкила, или соединяется с R3 и атомом азота, к которому присоединяется каждый из них, с образованием 5-, 6- или 7-членного гетероциклического кольца;
причем гетероалкил представляет собой необязательно замещенный, насыщенный или ненасыщенный, линейный или разветвленный или циклический углеводородный радикал или их сочетания, состоящий из указанного числа атомов углерода и одного-трех гетероатомов, выбранных из группы, состоящей из O, N, Si и S;
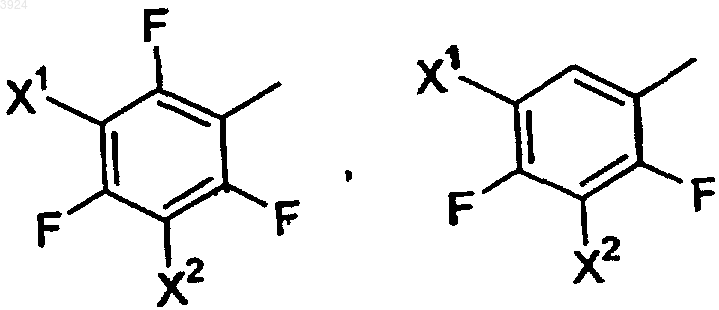
Ar представляет собой заместитель, выбранный из группы, состоящей из
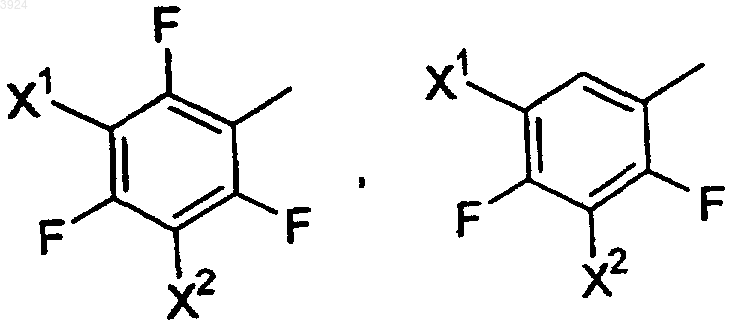
где X1 и X2, каждый независимо, выбирают из группы, состоящей из F, Cl и Br;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где Y представляет собой (C1-C6)-алкил.
3. Соединение по п.1, где Y представляет собой водород.
4. Соединение по п.1, где Y представляет собой необязательно замещенный, насыщенный или ненасыщенный циклический углеводородный радикал, состоящий из 1-8 атомов углерода и одного-трех гетероатомов, выбранных из группы, состоящей из O, N, Si и S.
5. Соединение по п.1, где Y вместе с R3 и атомом азота, к которому присоединяется каждый из них, образуют 5- или 6-членное гетероциклическое кольцо.
6. Соединение по п.1, где Y выбирают из группы, состоящей из 2-тиазолила, 1,2,4-триазолила, 1,3,4-тиадиазолила, пиразолила, 1,2,3,4-тетразолила, имидазолила, оксазолила и 1,2,3-триазолила.
7. Соединение по п.1, где каждый из R1, R2, R3 и Y представляет собой водород.
8. Соединение по п.1, где R4 выбирают из группы, состоящей из водорода, (C1-C3)-алкила, (C1-C3)-алкокси.
9. Соединение по п.1, где каждый из R1, R2 и R3 представляет собой водород и R4 представляет собой (C1-C3)-алкокси.
10. Соединение по п.1, где каждый из R1 и R2 представляет собой водород и Y вместе с R3 и атомом азота, к которому присоединяется каждый из них, образуют 5- или 6-членное гетероциклическое кольцо.
11. Соединение по п.1, где Ar представляет собой пентафторфенил.
12. Соединение по п.1, где Ar представляет собой 2,3,4,5-тетрафторфенил.
13. Соединение по п.1, где каждый из R1, R2 и R3 представляет собой водород, R4 находится в пара-положении относительно сульфонамидной группы и выбирается из группы, состоящей из водорода, (C1-C3)-алкила, (C1-C3)-алкокси и (C1-C3)-тиоалкокси, и Y представляет собой водород или (C1-C3)-алкил.
14. Соединение по п.1, где Ar представляет собой пентафторфенил, каждый из R1, R2 и R3 представляют собой водород, R4 представляет собой 4-метокси и Y представляет собой (C1-C3)-алкил.
15. Соединение по п.1, представленное формулой
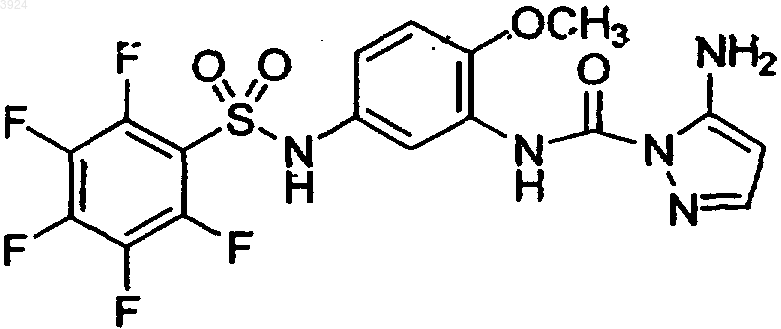
16. Соединение по п.1, представленное формулой
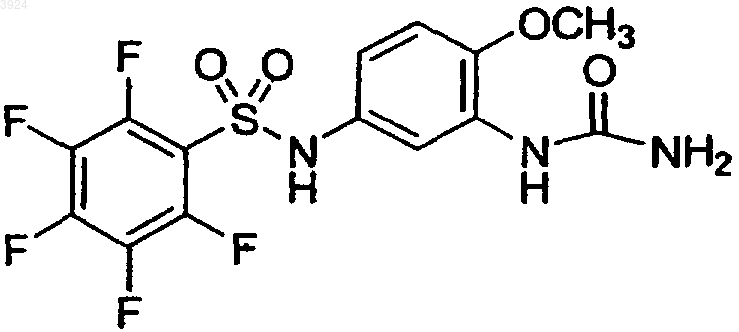
17. Соединение по п.1, представленное формулой
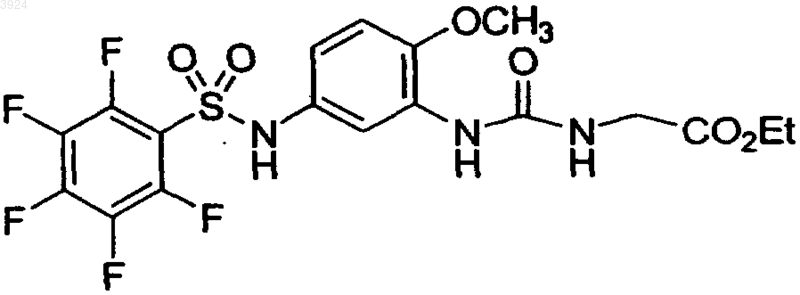
18. Соединение по п.1, представленное формулой
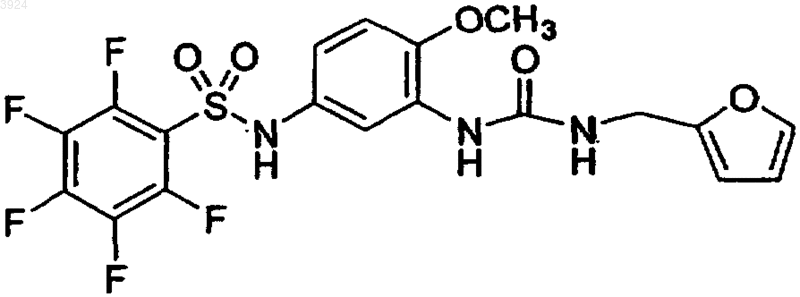
19. Соединение по п.1, представленное формулой
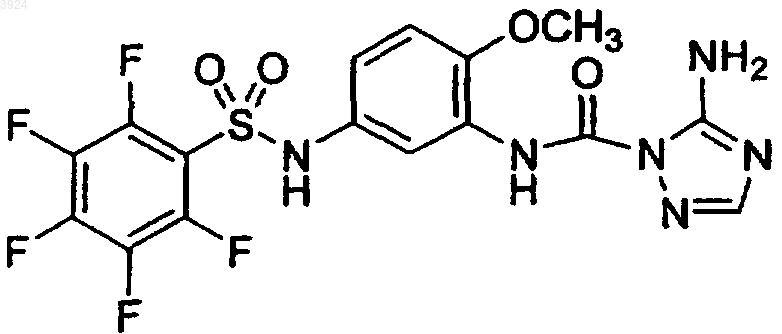
20. Способ лечения или профилактики болезненного состояния, характеризуемого аномально высоким содержанием в крови частиц липопротеина высокой плотности или холестерина или аномально высоким уровнем пролиферации клеток, включающий введение нуждающемуся в этом млекопитающему терапевтически эффективного количества композиции, содержащей соединение формулы

где X представляет собой O;
R1 и R2, каждый независимо, выбирают из группы, состоящей из водорода, (C1-C6)-алкила и (C1-C6)-гетероалкила;
R3 представляет собой заместитель, выбранный из группы, состоящей из водорода, (C1-C6)-алкила и (C1-C6)-гетероалкила или соединяется с Y и атомом азота, к которому присоединяется каждый из них, с образованием 5-, 6- или 7-членного гетероциклического кольца;
R4 представляет собой заместитель, выбранный из группы, состоящей из водорода, галогена, (C1-C8)-алкила, (C1-C8)-гетероалкила, OR11, SR11 и NR11R12, где R11 и R12, каждый независимо, выбирают из группы, состоящей из водорода, (C1-C8)-алкила, (C1-C8)-гетероалкила;
Y представляет собой заместитель, выбранный из группы, состоящей из водорода, (C1-C8)-алкила, (C1-C8)-гетероалкила, арил-(C1-C4)-алкила, арил-(C1-C4)-гетероалкила, или соединяется с R3 и атомом азота, к которому присоединяется каждый из них, с образованием 5-, 6- или 7-членного гетероциклического кольца;
причем гетероалкил представляет собой необязательно замещенный, насыщенный или ненасыщенный, линейный или разветвленный или циклический углеводородный радикал или их сочетания, состоящий из указанного числа атомов углерода и одного-трех гетероатомов, выбранных из группы, состоящей из O, N, Si и S;
Ar представляет собой заместитель, выбранный из группы, состоящей из
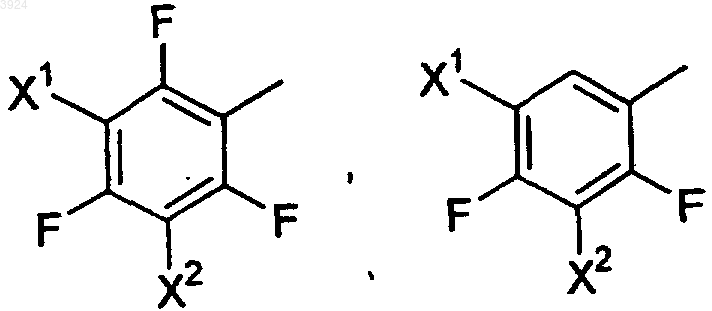
где X1 и X2, каждый независимо, выбирают из группы, состоящей из F, Cl и Br;
или его фармацевтически приемлемую соль.
21. Способ по п.20, где болезненное состояние представляет собой рак или раковое состояние.
22. Способ по п.20, где пролиферативное болезненное состояние является инфекцией, вызванной микроорганизмом.
23. Способ по п.20, где пролиферативное болезненное состояние представляет собой псориаз.
24. Способ по п.20, где пролиферативное болезненное состояние представляет собой рестеноз сосудов.
25. Способ по п.20, где болезненное состояние представляет собой гиперхолестеринемию или другое болезненное состояние, ассоциированное с аномально высоким содержанием холестерина или липопротеинов.
26. Способ по п.20, где указанное соединение ввофят перорально.
27. Способ по п.20, где указанное соединение вводят внутривенно, внутримышечно, подкожно или интрадуоденально.
28. Фармацевтическая композиция, содержащая фармацевтически приемлемый эксципиент и соединение формулы

где X представляет собой O;
R1 и R2, каждый независимо, выбирают из группы, состоящей из водорода, (C1-C6)-алкила и (C1-C6)-гетероалкила;
R3 представляет собой заместитель, выбранный из группы, состоящей из водорода, (C1-C6)-алкила и (C1-C6)-гетероалкила или соединяется с Y и атомом азота, к которому присоединяется каждый из них, с образованием 5-, 6- или 7-членного гетероциклического кольца;
R4 представляет собой заместитель, выбранный из группы, состоящей из водорода, галогена, (C1-C8)-алкила, (C1-C8)-гетероалкила, OR11, SR11 и NR11R12, где R11 и R12, каждый независимо, выбирают из группы, состоящей из водорода, (C1-C8)-алкила, (C1-C8)-гетероалкила;
Y представляет собой заместитель, выбранный из группы, состоящей из водорода, (C1-C8)-алкила, (C1-C8)-гетероалкила, арил-(C1-C4)-алкила, арил-(C1-C4)-гетероалкила, или соединяется с R3 и атомом азота, к которому присоединяется каждый из них, с образованием 5-, 6- или 7-членного гетероциклического кольца;
причем гетероалкил представляет собой необязательно замещенный, насыщенный или ненасыщенный, линейный или разветвленный или циклический углеводородный радикал или их сочетания, состоящий из указанного числа атомов углерода и одного-трех гетероатомов, выбранных из группы, состоящей из O, N, Si и S;
Ar представляет собой заместитель, выбранный из группы, состоящей из
где X1 и X2, каждый независимо, выбирают из группы, состоящей из F, Cl и Br;
или его фармацевтически приемлемую соль.
29. Композиция по п.28, где Ar выбирают из группы, состоящей из
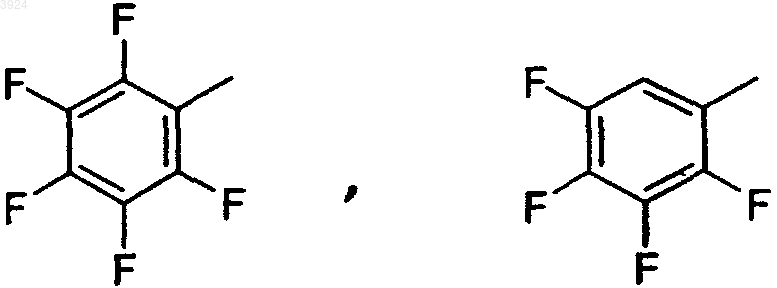
30. Композиция по п.28, где Ar представляет собой пентафторфенил.
31. Композиция по п.28, где Ar представляет собой 2,3,4,5-тетрафторфенил.
32. Композиция по п.28, дополнительно содержащая антипролиферативное средство, выбранное из группы, состоящей из циклофосфамида, метотрексата, адриамицина, цисплатина, дауномицина, винкристина, винбластина, винарелбина, паклитаксела, доцетаксела, тамоксифена, флутамида, гидроксимочевины и их смесей.
33. Композиция по п.28, дополнительно содержащая компонент, выбранный из группы, состоящей из гипохолестеринемических и гиполипемических средств.
Текст
1 Область техники, к которой относится изобретение Настоящее изобретение относится к арилсульфонанилидмочевинам и их применению в качестве фармакологически активных средств,способных снижать уровень холестерина в плазме и ингибировать аномальную пролиферацию клеток. Предшествующий уровень техники В последнее время описан ряд арилсульфонамидов, пригодных для лечения расстройств и состояний, возникающих в результате аномальной пролиферации клеток и в результате повышенного содержания холестерина в плазме. См., например, публикации РСТ WO 97/30677 иWO 98/05315. Наиболее распространенным заболеванием среди заболеваний, возникающих в результате аномальной пролиферации клеток, является рак- общее название широкого ряда клеточных злокачественных образований, отличающихся нерегулируемым ростом, утратой дифференциации и способностью поражать ткани в месте появления и метастазировать. Эти злокачественные опухоли с разной степенью частоты поражают каждую ткань и орган в организме. В последние десятилетия разработано много лечебных средств для лечения различных типов рака. Наиболее часто применяемыми противораковыми средствами являются ДНК-алкилирующие средства (например, циклофосфамид,ифосфамид), антиметаболиты (например, метотрексат-фолат-антагонист и пиримидинантагонист 5-флуороурацил), разрушители микроканальцев (например, винкристин, винбластин, паклитаксел), вставки в ДНК (например,доксорубицин, дауномицин, цисплатин) и средства гормонотерапии (например, тамоксифен,флутамид). Идеальное противоопухолевое лекарственное средство должно селективно убивать раковые клетки с широким терапевтическим индексом относительно своей токсичности в отношении доброкачественных клеток. Оно также должно сохранять свою эффективность в отношении злокачественных клеток даже после длительного воздействия лекарственного средства. К несчастью, ни одно из современных химиотерапевтических средств не обладает идеальным профилем. Большинство имеет очень узкие терапевтические индексы и, в частности, в каждом случае раковые клетки, подвергаемые воздействию едва сублетальных концентраций химиотерапевтического средства, будут вырабатывать резистентность к такому средству и достаточно часто кросс-резистентность к некоторым другим противоопухолевым средствам. Псориаз - широко распространенное хроническое кожное заболевание характеризуется наличием сухих чешуек и бляшек, которые, как полагают, являются, как правило, результатом аномальной пролиферации клеток. Болезнь возникает вследствие гиперпролиферации эпидер 003924 2 миса и неполной дифференциации кератиноцитов. Псориаз часто поражает волосистую часть кожи головы, локти, колени, спину, ягодицы,ногти, брови и области половых органов и может колебаться по тяжести от легкой формы до формы, в высшей степени подтачивающей здоровье, приводящей к псориатическому артриту,пустулезному псориазу и эксфолиативному псориатическому дерматиту. Не существует способа лечения дерматита. Более легкие случаи часто излечиваются кортикостероидами местного применения, но в более тяжелых случаях можно лечиться только антипролиферативными средствами, такими как антиметаболит метотрексат,ингибитор синтеза ДНК гидроксимочевина и разрушитель микроканальцев колхицин. К другим заболеваниям, связанным с аномально высокой пролиферацией клеток, относятся рестеноз, где участвуют клетки гладких мышц сосудов, воспалительные состояния с участием эндотелиальных клеток, клеток области воспаления и клеток клубочковой зоны коры надпочечников, инфаркт миокарда с участием клеток сердечной мышцы, гломерулонефрит с участием клеток почек, отторжение трансплантата с участием эндотелиальных клеток, инфекционные заболевания, такие как ВИЧ-инфекция и малярия, с участием некоторых иммунокомпетентных клеток и/или других инфицированных клеток, и т.п. Инфицирующие и паразитарные средства сами по себе (например, бактерии,трипаносомы, грибы и т.п.) также часто являются предметом селективной пролиферативной регуляции с использованием обсуждаемых композиций и соединений. Соответственно одним из объектов настоящего изобретения являются соединения,которые прямо или косвенно являются токсичными для активно делящихся клеток и полезны при лечении рака, вирусных и бактериальных инфекций, рестеноза сосудов, воспалительных заболеваний, аутоиммунных заболеваний и псориаза. Другим объектом настоящего изобретения являются лечебные композиции для лечения состояний, описанных здесь. Также следующими объектами являются способы уничтожения активно пролиферирующих клеток, таких как раковые, бактериальные или эпителиальные клетки, и лечение всех типов рака, инфекций, воспалений и, вообще, пролиферативных состояний. Еще одним объектом являются способы лечения других болезненных состояний, характеризующихся наличием быстро пролиферирующих клеток, таких как псориаз и другие кожные нарушения. Дополнительные объекты, особенности и преимущества станут очевидны для специалистов в этой области техники из последующего описания и формулы изобретения. 3 Сущность изобретения Изобретение относится к новым арилсульфонанилидным соединениям, а также к способам и композициям, относящимся к новым арилсульфонанилидмочевинам, и их применению в качестве фармакологически активных средств. Соединения и композиции находят применение в качестве фармакологических средств при лечении болезненных состояний, в частности, гиперхолестеринемии, атеросклероза, рака, бактериальных инфекций и псориаза,или в качестве исходных соединений для разработки таких средств. Соединения изобретения имеют формулу или представляют собой фармацевтически приемлемые соли таких соединений. В приведенной выше формуле Х представляет атом кислорода, атом серы или NH, предпочтительно атом кислорода.Y обозначает водород, гетероциклическое кольцо, (C1-C8)-алкил, (C1-C8)-гетероалкил,арил, арил-(C1-C4)-алкил, арил-(C1-C4)-гетероалкил, гетероарил-(C1-C4)-алкил, гетероарил(C1-C4)-гетероалкил, или, необязательно, связывается с R3 с образованием 5-, 6- или 7-членного гетероциклического кольца, которое может быть ароматическим или неароматическим. Символы R1, R2 и R3, каждый независимо,представляют водород, (C1-C6)-алкил или (C1C6)-гетероалкил. Кроме того, как отмечалось выше, в некоторых вариантах воплощения изобретения R3 соединяется с Y и соседним атомом азота с образованием гетероциклического кольца.NR11R12, где R11 и R12, каждый независимо,представляют водород, (C1-C8)-алкил или (C1C8)-гетероалкил. Аr представляет замещенную арильную группу, выбранную среди где X1 и X2, каждый независимо, представляют собой F, Cl или Br. Способы согласно настоящему изобретению используют фармацевтические композиции, содержащие соединения, указанные выше как соединения общей формулы I, для лечения паталогии, такой как рак, бактериальные инфекции, псориаз, гиперхолестеринемия, атеросклероз, панкреатит и гиперлипопротеинемия. Вкратце, изобретение включает введение паци 003924 4 енту эффективного состава из одной или нескольких целевых композиций. Подробное описание изобретения Определения Термин "алкил", как таковой или как часть определения другого заместителя, обозначает,если нет иных указаний, радикал с линейной или разветвленной цепью или циклический углеводородный радикал, или их сочетание, которые могут быть полностью насыщенными, моно- или полиненасыщенными и могут включать два и несколько радикалов, имеющие указанное число атомов углерода (например, C1-C10 означает от одного до десяти атомов углерода). Примерами насыщенных углеводородных радикалов являются такие группы, как метил, этил,н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, циклогексил, циклогексилметил, циклопропилметил, гомологи и изомеры,например, н-пентил, н-гексил, н-гептил, н-октил и т.п. Ненасыщенная алкильная группа представляет собой группу с одной или несколькими двойными связями или тройными связями. Примерами ненасыщенных алкильных групп являются винил, 2-пропенил, кротил, 2-изопентенил, 2-бутадиенил, 2,4-пентадиенил, 3(1,4-пентадиенил), этинил, 1- и 3-пропинил, 3 бутинил и более высокие гомологи и изомеры. Термин "алкил", если нет иных указаний, также включает производные алкила, подробнее определенные ниже как "циклоалкил" и "алкилен". Термин "алкилен" сам по себе или как часть определения другого заместителя обозначает двухвалентный радикал, образованный от алкана, например, -CH2CH2CH2CH2-. Как правило,алкильная группа будет содержать 1-24 атома углерода, причем в настоящем изобретении предпочтительны алкильные группы с 10 или меньшим числом атомов углерода. "Низший алкил" или "низший алкилен" представляет собой алкильную или алкиленовую группу с более короткой цепью, как правило, с 8 или меньшим числом атомов углерода. Термин "алкокси", используемый один или в сочетании с другими терминами, обозначает,если нет иных указаний, алкильную группу,имеющую значения, указанные выше, присоединяемую к остальной части молекулы через атом кислорода, такую как, например, метокси,этокси, 1-пропокси, 2-пропокси и более высокие гомологи и изомеры. Термин "тиоалкокси", используемый один или в сочетании с другими терминами, обозначает, если нет иных указаний, алкильную группу, имеющую значения, указанные выше, присоединяемую к остальной части молекулы через атом серы, такую как, например, тиометокси(метилтио), тиоэтокси (этилтио), 1-тиопропокси,2-тиопропокси и более высокие гомологи и изомеры. Термин "гетероалкил" сам по себе или в сочетании с другим термином обозначает, если 5 нет иных указаний, углеводородный радикал с устойчивой линейной или разветвленной цепью или циклический углеводородный радикал, или их сочетания, которые могут быть полностью насыщенными, моно- или полиненасыщенными и могут включать ди- или полирадикалы, состоящий из установленного числа атомов углерода и одного-трех гетероатомов, выбранных из группы, состоящей из О, N, Si и S, и, где атомы азота или серы, необязательно, могут быть окисленными, а атом азота может быть, необязательно, кватернизован. Гетероатом(ы) О, N иS могут размещаться в любом промежуточном положении гетероалкильной группы. Гетероатом Si может размещаться в любом положении гетероалкильной группы, включая положение, в котором алкильная группа присоединяется к остальной части молекулы. Примерами являются -СН 2-СН 2-О-СН 3, -СН 2-СН 2-NН-СН 3, -CH2CH2-N(СН 3)-СН 3, -CH2-S-CH2-СН 3, -СН 2-СН 2S(O)-СН 3, -СН 2-СН 2-S(O)2-СН 3, -СН=СН-O-СН 3,-Si(СН 3)3, -СН 2-СН=N-ОСН 3 и -CH=CH-N(СН 3)СН 3. Гетероатомы, до двух, могут располагаться последовательно, так как, например, в -CH2-NHOCH3 и -CH2-O-Si(СН 3)3. Термин "гетероалкил" также включает радикалы, описанные подробнее ниже как "гетероалкилен" и "гетроциклоалкил". Термин "гетероалкилен" сам по себе или как часть определения другого заместителя обозначает двухвалентный радикал, образованный от гетероалкила, например, -CH2-CH2-S-CH2 СН 2- и -CH2-S-CH2-CH2-NH-CH2-. В случае гетероалкиленовых групп гетероатомы также могут занимать любой один или оба конца цепи. Кроме того, в случае гетероалкиленовых связывающих групп, а также всех других связывающих групп, описанных здесь, конкретная ориентация связывающей группы не предполагается. Термины "циклоалкил" и "гетероциклоалкил" сами по себе или в сочетании с другими терминами, представляют, если нет иных указаний, циклические варианты "алкила" и "гетероалкила", соответственно. Кроме того, в случае гетероциклоалкила гетероатом может занимать положение, в котором гетероцикл присоединяется к остальной части молекулы. Примерами циклоалкила являются циклопентил, циклогексил, 1-циклогексенил, 3-циклогексенил, циклогептил и т.п. Примерами гетероциклоалкила являются 1-(1,2,5,6-тетрагидропиридил), 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4 морфолинил, 3-морфолинил, тетрагидрофуран 2-ил, тетрагидрофуран-3-ил, тетрагидротиен-2 ил, тетрагидротиен-3-ил, 1-пиперазинил, 2-пиперазинил и т.п. Термины "гало" или "галоген" сами по себе или как часть определения другого заместителя, обозначают, если нет иных указаний, атом фтора, хлора, брома или иода. Термин "арил", используемый один или в сочетании с другими терминами (например,арилокси, арилтиокси, арилалкил), обозначает, 003924 6 если нет иных указаний, ароматический заместитель, который может представлять собой один цикл или несколько циклов (до трех циклов),сконденсированных вместе или связанных ковалентно. Каждое кольцо может содержать от 0 до 4 гетероатомов, выбранных среди N, О и S, где атомы азота и серы могут, необязательно, быть окисленными, а атом(ы) азота может(могут) необязательно быть кватернизован(ы). Арильные группы, содержащие гетероатомы, можно отнести к "гетероарилу", и они могут присоединяться к остальной части молекулы через атом углерода или через гетероатом. Примеры арильных групп, не являющиеся ограничительными,включают фенил, 1-нафтил, 2-нафтил, 4-бифенил, 1-пирролил, 2-пирролил, 3-пирролил, 3-пиразолил, 2-имидазолил, 4-имидазолил, пиразинил, 2-оксазолил, 4-оксазолил, 5-оксазолил, 3 изоксазолил, 4-изоксазолил, 5-изоксазолил, 2 тиазолил, 4-тиазолил, 5-тиазолил, 2-фурил, 3 фурил, 2-тиенил, 3-тиенил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 5 бензотиазолил, пуринил, 2-бензимидазолил, 5 индолил, 1-изохинолил, 5-изохинолил, 2-хиноксалинил, 5-хиноксалинил, 3-хинолил и 6-хинолил. Заместители для каждой из вышеуказанных арильных систем выбирают из группы приемлемых заместителей, описанных ниже. Термины "арилалкил" и "арилгетероалкил" предназначены для обозначения радикалов, в которых арильная группа связана с алкильной группой (таких как, например, бензил, фенетил, пиридилметил и т.п.) или с гетероалкильной группой(таких как, например, феноксиметил, 2-пиридилоксиметил, 1-нафтилокси-3-пропил и т.п.). Арилалкильные и арилгетероалкильные группы,как правило, будут содержать 1-3-арильных группы, связанных с алкильной или гетероалкильной частью ковалентной связью или посредством конденсации с циклом, например, циклоалкильной или гетероциклоалкильной группой. В случае арилгетероалкильных групп гетероатом может занимать положение, в котором группа присоединяется к остальной части молекулы. Например,термин "арилгетероалкил" означает, что он включает бензилокси, 2-фенилэтокси, фенетиламин и подобные группы. Используемый здесь термин "гетероцикл" относится к любому циклу, содержащему по меньшей мере один гетероатом в качестве члена цикла. Термин предназначен для обозначения как гетероциклоалкильных групп и гетероарильных групп, так и других циклов с одним или несколькими гетероатомами и, необязательно, одной или несколькими ненасыщенными связями (как правило, двойной связью). В дополнение к приведенным выше примерам гетероциклоалкильных и гетероарильных групп,термин "гетероцикл" включает 1,2,4-триазолил,1,3,4-тиадиазолил, пиразолил, 1,2,3,4-тетразолил и 1,2,3-тиазолил. Как и гетероарильные группы,гетероциклические группы могут присоединять 7 ся к остальной части молекулы через или атом углерода, или гетероатом, входящий в цикл. Каждый из приведенных выше терминов(например, "алкил", "гетероалкил", "арил" и "гетероцикл") предназначен для обозначения как замещенных, так и незамещенных форм указанного радикала. Предпочтительные заместители для каждого типа радикала приводятся ниже. Заместители для алкильных и гетероалкильных радикалов (в том числе, групп, часто называемых алкилен, алкенил, гетероалкилен,гетероалкенил, алкинил, циклоалкил, гетроциклоалкил, циклоалкенил и гетероциклоалкенил) могут представлять собой самые разные группы,выбранные среди -OR', =O, =NR', =N-OR',-NR'R", -SR', -галогена, -SiR'R"R"', -OC(O)R',-CO2R', -CONR'R", -OC(O)NR'R", -NR"C(O)R',-NR"C(O)2R', -NH-C(NH2)=NH, -NR'C(NH2)=NH,-NH-C(NH2)=NR', -S(O)R', -S(O)2R', -S(O)2NR'R",-CN и -NO2, в количестве в интервале от 0 до(2N+1), где N равен общему числу атомов углерода в таком радикале. R', R" и R"', каждый независимо, обозначают водород, незамещенный(C1-C8)-алкил и гетероалкил, незамещенный арил, арил, замещенный 1-3 атомами галогена,незамещенные алкильные, алкокси- или тиоалкоксигруппы или арил-(C1-C4)-алкильные группы. Когда R' и R" присоединяются к одному и тому же атому азота, они могут соединяться с атомом азота с образованием 5-, 6- или 7 членного цикла. Например, -NR'R" включает 1 пирролидинил и 4-морфолинил. Подобным образом заместители для арильных групп варьируют и выбирают среди -галогена, -OR',-OC(O)R', -NR'R", -SR', -R', -CN, -NO2, -CO2R',-CONR'R", -OC(O)NR'R", -NR"C(O)R', -NR"C(O)2-R',-NH-C(NH2)=NH, -NR'C(NH2)=NH, -NH-C(NH2)=NR',-S(O)R', -S(O)2R', -S(O)2NR'R", -N3, -CH(Ph)2, перфтор-(C1-C4)-алкокси и перфтор-(C1-C4)-алкила, в количестве в интервале от 0 до величины общей открытой валентности ароматической циклической системы; и где R' и R" выбирают независимо среди водорода, (C1-C8)-алкила и гетероалкила, незамещенного арила, (незамещенный арил)-(C1-C4)-алкила и (незамещенный арил) окси-(C1-C4)-алкила. Два заместителя у соседних атомов арильного кольца можно, необязательно, заменить заместителем формулы -Т-С(О)-(CH2)q-U-, где Т и U представляют собой, независимо, -NH-, -О-,-СН 2- или простую связь, и q равен целому числу от 0 до 2. С другой стороны, два заместителя у соседних атомов арильного цикла можно, необязательно, заменить заместителем формулы-А-(СН 2)r-В-, где А и В представляют собой,независимо, -СН 2-, -О-, -NH-, -S-, -S(O)-, -S(O)2-,-S(O)2NR'- или простую связь, и r равен целому числу от 1 до 3. Одну из простых связей нового цикла, образованного таким образом, можно заменить двойной связью. С другой стороны,два заместителя у соседних атомов арильного кольца можно, необязательно, заменить замес 003924 8 тителем формулы -(СН 2)s-Х-(CH2)t-, где s и t равны, независимо, целым числам от 0 до 3, и Х представляет собой -О-, -NR'-, -S-, -S(O)-,-S(O)2- или -S(O)2NR'-. Заместитель R' в -NR'- и-S(O)2NR'- выбирают среди водорода или незамещенного (C1-C6)-алкила. Используемый здесь термин "гетероатом" обозначает атом кислорода (О), азота (N), серы(S) и кремния (Si). Термин "фармацевтически приемлемые соли" обозначает соли активных соединений,которые получают с относительно нетоксичными кислотами или основаниями, в зависимости от конкретных заместителей, имеющихся у соединений, описанных здесь. Когда соединения согласно настоящему изобретению содержат функциональные группы относительно кислотного характера, можно получить соли присоединения оснований посредством приведения в контакт нейтральной формы таких соединений с достаточным количеством нужного основания или в чистом виде или в подходящем инертном растворителе. Примерами фармацевтически приемлемых солей присоединения оснований являются натриевая, калиевая, кальциевая, аммониевая, или магниевая соли, или соль органического основания, или подобная соль. Когда соединения согласно настоящему изобретению содержат функциональные группы относительно основного характера, можно получить соли присоединения кислот посредством приведения в контакт нейтральной формы таких соединений с достаточным количеством нужной кислоты или в чистом виде или в подходящем инертном растворителе. Примерами фармацевтически приемлемых солей присоединения кислот являются соли, образованные неорганическими кислотами, такими как хлороводородная, бромоводородная, азотная, угольная, замещаемая по одному атому водорода угольная, фосфорная,замещаемая по одному атому водорода фосфорная, замещаемая по двум атомам водорода фосфорная, серная, замещаемая по одному атому водорода серная, иодоводородная или фосфористая кислоты, и т.п., а также соли, образованные относительно нетоксичными органическими кислотами, такими как уксусная, пропионовая,изомасляная, щавелевая, малеиновая, малоновая, бензойная, янтарная, субериновая, фумаровая, миндальная, фталевая, бензолсульфоновая,п-толуолсульфоновая, лимонная, винная, метансульфоновая кислоты, и т.п. К таким солям также относятся соли аминокислот, такие как аргинаты и подобные соли, и соли органических кислот, подобных глюкуроновой или галактуроновой кислотам, и т.п. (см., например, Веrgе,S.M., et al., "Pharmaceutical Salts", Journal ofPharmaceutical Science, 1977, 66, 1-19). Некоторые конкретные соединения согласно настоящему изобретению содержат функциональные группы как кислотного, так и основного характера, что позволяет превращать такие соедине 9 ния в соли присоединения или оснований или кислот. Нейтральные формы соединений можно восстановить посредством приведения соли в контакт с основанием или кислотой и выделения исходного соединения обычным способом. Исходная форма соединения отличается от различных солевых форм по некоторым физическим свойствам, таким как растворимость в полярных растворителях, но для целей настоящего изобретения в других отношениях соли равноценны исходному соединению. В дополнение к формам солей, настоящее изобретение относится к соединениям, представляющим собой пролекарственные формы. Пролекарства соединений, описанных здесь,представляют собой такие соединения, которые легко претерпевают химические изменения в условиях в организме с образованием соединения формулы I. Кроме того, пролекарства можно превратить в соединения настоящего изобретения с помощью химических или биохимических способов в окружении ex vivo. Например,пролекарства могут постепенно превращаться в соединения настоящего изобретения, когда помещены в объем трансдермального участка с подходящим ферментом. Некоторые соединения согласно настоящему изобретению могут существовать в несольватированных формах, а также в сольватированных формах, в том числе в гидратированных формах. Вообще, сольватированные формы равноценны несольватированным формам, и подразумевается, что они охватываются объемом настоящего изобретения. Некоторые соединения согласно настоящему изобретению могут существовать во многих кристаллических или аморфных формах. Вообще, все физические формы равноценны для применений, предполагаемых настоящим изобретением, и подразумевается, что они охватываются объемом настоящего изобретения. Некоторые соединения согласно настоящему изобретению имеют асимметричные атомы углерода (оптические центры) или двойные связи; подразумевается, что рацематы, диастереомеры, геометрические изомеры и отдельные изомеры - все они охватываются объемом настоящего изобретения. Соединения согласно настоящему изобретению также могут содержать один или несколько атомов, составляющих такие соединения, с необычным соотношением атомных изотопов. Например, соединения могут быть помечены радиоактивными изотопами, такими как,например, тритий (3 Н), иод-125 (125I) или углерод-14 (14 С). Подразумевается, что все содержащие изотопы варианты соединений согласно настоящему изобретению, являются ли они радиоактивными или нет, охватываются объемом настоящего изобретения. 10 Общие замечания Соединения, описанные в настоящей заявке, аналогичны соединениям, описанным в публикациях РСТ WO 97/30677 и WO 98/05315, и соединениям, описанным в рассматриваемой совместно заявке за регистр.08/917025 (поданной 22 августа 1997) и заявке за регистр.60/090681 (реестр поверенногоТ 98-014, подана 25 июня 1998). Конкретнее, в настоящей заявке описываются соединения, в которых остаток мочевины или замещенной мочевины,тиомчевины или замещенной тиомочевины или гуанидина или замещенного гуанидина связан с арилсульфонамидобензолом. Предпочтительные варианты воплощения изобретения Настоящее изобретение относится к новым арилсульфоанилидным производным формулы или их фармацевтически приемлемым солям. В приведенной выше формуле Х представляет О, S или NH, предпочтительно О. Y обозначает водород, гетероциклическое кольцо,(C1-C8)-алкил, (C1-C8)-гетероалкил, арил, арил(C1-C4)-алкил, арил-(C1-C4)-гетероалкил, гетероарил-(C1-C4)-алкил или гетероарил-(C1-C4)гетероалкил. Необязательно, Y связывается с R3 с образованием 5-, 6- или 7-членного гетероциклического кольца. В одной группе предпочтительных вариантов воплощения изобретения Y представляет собой замещенный или незамещенный (C1-C8)алкил или замещенный или незамещенный (C1C8)-гетероалкил. Предпочтительно Y выбирают среди 2-метоксиэтила, 2-гидроксиэтила, 2,3 дигидроксипропила и 3-гидроксипропила. В другой группе предпочтительных вариантов воплощения изобретения Y представляет собой замещенный или незамещенный гетероцикл (например, 2-тиадиазолил, 5-тетразолил, 2 тиазолил и т.п.) или замещенную или незамещенную арильную группу. Еще в одной группе предпочтительных вариантов воплощения изобретения Y представляет собой замещенную или незамещенную арил(C1-C4)-алкильную, арил-(C1-C4)-гетероалкильную, гетероарил-(C1-C4)-алкильную или гетероарил-(C1-C4)-гетероалкильную группу. Примерами таких групп являются бензил, фенетил,фурфурилметил, фурфурилэтил, тиенилметил,тиенилэтил и подобные группы. Особенно предпочтительным членом этой группы вариантов является 2-фурфурилметил. И еще в одной группе предпочтительных вариантов воплощения изобретения Y соединяется с R3 и атомом азота, к которому присоединен каждый из них, с образованием гетероциклического кольца, предпочтительно - моноцик 11 лического с пятью или шестью атомами. Гетероциклическое кольцо, образованное Y, N и R3,может быть замещенным или незамещенным. Примерами таких колец являются 3-аминопиразол, 3-амино-1,2,4-триазол и 4-морфолин. Особенно предпочтительны 3-амино-1,2,4-триазольное кольцо и 3-аминопиразольное кольцо. В приведенной выше формуле R1 и R2, каждый независимо, представляют собой водород,(C1-C6)-алкил или (C1-C6)-гетероалкил. Предпочтительно R1 и R2, каждый независимо, представляют собой водород или (C1-C4)-алкил. Предпочтительнее R1 и R2 оба представляют собой водород.R3 представляет водород, (C1-C6)-алкил или (C1-C6)-гетероалкил, или, как описано выше, R3 может соединяться с Y с образованием пяти- или шестичленного гетероциклического кольца.NR11R12, где R11 и R12, каждый независимо,представляют водород, (C1-C8)-алкил или (C1C8)-гетероалкил. В предпочтительных вариантах воплощения изобретения R4 присоединяется в пара- положении к сульфонамидной группе (и в орто- к мочевине). Особенно предпочтительны такие варианты, где R4 представляет собой водород, (C1-C3)-алкил или (C1-C3)-алкокси, предпочтительнее (C1-C3)-алкокси. Аr представляет замещенную арильную группу, выбранную среди где Х 1 и X2, каждый независимо, представляют собой F, Cl или Вr. В одной из групп предпочтительных вариантов воплощения изобретения Аr представляет собой пентафторфенил. В другой группе предпочтительных вариантов воплощения изобретения Аr представляет собой 2,3,4,5 тетрафторфенил. Еще в одной группе предпочтительных вариантов воплощения изобретения Аr представляет собой 3,4,5-триметоксифенил. И в еще одной группе предпочтительных вариантов воплощения изобретения Аr представляет собой 3-метокси-4,5-метилендиоксифенил. Особенно предпочтительны некоторые сочетания указанных выше предпочтительных вариантов. В первой группе предпочтительных вариантов воплощения изобретения соединения имеют формулу В этой группе R4 предпочтительно представляет собой водород, (C1-C3)-алкил, (C1-C3)алкокси или (C1-C3)-тиоалкокси, предпочтительнее метил, метокси, этокси или тиометокси.Y представляет собой предпочтительно водо 003924 12 род, гетероциклическое кольцо, (C1-C8)-алкил,(C1-C8)-гетероалкил, арил или арил-(C1-C4)алкил, наиболее предпочтительно водород. В другой группе предпочтительных вариантов воплощения изобретения соединения имеют формулу В этой группе R4 имеет значения, указанные в случае формулы Ia. R3 и Y, предпочтительно,объединяются с образованием замещенного или незамещенного гетероциклического кольца. Предпочтительными группами в случае цикла,определяемого R3, Y и атомом азота, к которому присоединен каждый из них, являются 3-аминопиразол, 3-амино-1,2,4-триазол и 4-морфолин. Синтез Соединения согласно настоящему изобретению можно получить с использованием некоторых промежуточных соединений и способов,описанных в WO 97/30677 и WO 98/05315. В одной из групп вариантов воплощения изобретения арилсульфонамидоанилины можно получить так, как описано, и затем анилиноаминогруппу можно ацилировать с помощью подходящего изоцианата с использованием обычных способов. Например, 2-метокси-5-пентафторфенилсульфонамидоанилин можно обработать изоцианатом (например, этилизоцианатоацетатом, изоцианатом калия и т.п.) с образованием соединений согласно настоящему изобретению(см. примеры 5 и 6). Подобным образом можно получить другие соединения, исходя из соответствующего производного анилина. Использование тиоизоцианатов вместо изоцианатов позволяет синтезировать соответствующие тиомочевины. Общая схема получения мочевин и тиомочевин с использованием изоцианатов и тиоизоцианатов, соответственно, приводится на схеме 1, которая также иллюстрирует получение производных гуанидина из тиомочевины. Схема 1 Как показано на схеме 1, арилсульфонамидоанилин i можно обработать изоцианатом в присутствии основания с образованием мочевинii согласно настоящему изобретению. Используемые основания действуют как акцепторы кислоты и представляют собой, как правило,третичные амины, такие как триэтиламин, диэтилизопропиламин, N-метилморфолин, пиридин и т.п. Подобным образом, обработка i соответствующим изотиоцианатом дает целевые тиомочевины iii. Конверсию iii в гуанидины iv можно осуществить посредством обработки iii метилиодидом с образованием соответствующей S-метилтиомочевины, которую можно обработать гидроксидом аммония с образованием соответствующего гуанидина iv. С другой стороны, анилины, такие как 2 метокси-5-пентафторфенилсульфонамидоанилин, можно обработать трифосгеном и подходящим амином в присутствии акцептора кислоты и получить мочевины в соответствии с настоящим изобретением (см. примеры 7 и 8). Подобная реакция с тиофосгеном позволяет синтезировать соответствующие тиомочевины. Эти подходы иллюстрируются на схеме 2. Схема 2 Другие способы получения приводятся на схеме 3. Способы, представленные на этой схеме, используют, как правило, когда группа Аr несовместима с условиями синтеза мочевины,тиомочевины или гуанидина. Соответственно,обработка подходящего производного нитроанилина v или изоцианатом или тиоизоцианатом дает vi или viii соответственно. Восстановление нитрогруппы, присутствующей в vi или viii,можно осуществить с использованием или гидрирования с катализатором палладием-на-угле(для vi), или хлорида олова и НСl (для vi илиviii). Анилины (vii и ix), полученные таким образом, можно, каждый, сульфировать соответствующим арилсульфонилхлоридом (ArSO2Cl) в присутствии основания-акцептора кислоты. Кроме того, ix можно превратить в производное гуанидина х с использованием метилиодида и аммиака (подобно способу, описанному на схеме 1). Конверсию х в целевые соединения iv осуществляют посредством обработки анилина х арилсульфонилхлоридом. Соединения, используемые в данном изобретении в качестве начальных исходных материалов, можно закупить в коммерческих источниках или, с другой стороны, можно легко синтезировать стандартными способами, хорошо известными специалистам в этой области техники. Некоторые соединения формулы I могут существовать в виде стереоизомеров, и изобретение включает все активные стереоизомерные формы этих соединений. В случае оптически активных изомеров такие соединения можно получить из соответствующих оптически активных предшественников с использованием процедур, описанных выше, или посредством расщепления рацемических смесей. Расщепление можно осуществить с использованием различных методов, таких как хроматография, повторная перекристаллизация полученных асимметричных солей или дериватизация, и такие методы хорошо известны специалистам в этой области техники. Соединения согласно изобретению можно пометить различными способами. Например,соединения могут содержать радиоактивные изотопы, такие как, например, 3H (тритий) и 14 С(углерод-14). Подобным образом может быть выгодным объединение соединений, ковалентно или нековалентно, непосредственно или через линкерную молекулу, с самыми разными другими соединениями, которые могут давать пролекарства или функционировать как носители,метки, адъюванты, соактиваторы, стабилизаторы и т.п. Такие меченные и объединенные со 15 единения рассматриваются в рамках настоящего изобретения. Анализ соединений Показано, что характерные соединения и композиции обладают фармакологической активностью при анализах in vitro, например, они способны специфически модулировать физиологию клеток и ослаблять ассоциированную патологию или обеспечивать или усиливать профилактику. Некоторые предпочтительные соединения и композиции способны специфически регулировать экспрессию генов LDL-рецепторов. Соединения можно оценить in vitro на их способность повышать экспрессию генов LDLрецепторов, используя анализ методом вестернблоттинга, например, как описано у Tam et al. (J.Biol. Chem., 1991, 266, 16764). В технике известны установленные животные модели для оценки гипохолестеринемического действия соединений. См., например, Spady et al., J. Clin.Invest., 1988, 81, 300; Evans et al., J. Lipid Res.,1994, 35, 1634, и Lin et al., J. Med. Chem., 1995,38, 277. Некоторые предпочтительные соединения и композиции показывают специфическую токсичность в отношении разных типов клеток. Некоторые соединения и композиции согласно настоящему изобретению проявляют свое цитотоксичное действие посредством взаимодействия с клеточным тубулином. В случае некоторых предпочтительных соединений и композиций согласно настоящему изобретению такое взаимодействие является ковалентным и необратимым. Другие соединения связываются нековалентно. Соединения и композиции можно оценить in vitro на их способность ингибировать рост клеток, например, так, как описано в Ahmed et al., J. Immunol. Methods, 1994, 170, 211. Установленные животные модели для оценки антипролиферативного действия соединений также известны в технике. Например, соединения можно оценивать на их способность ингибировать рост опухолей человека, пересаженных мышам с иммунодефицитом с использованием методологии, подобной методологии, описанной в Rygaard and Povlsen, Acta Pathol. Microbiol. Scand., 1969, 77, 758, и в Giovanella andFogh, Adv. Cancer Res., 1985, 44, 69. Составление и введение соединений и фармацевтических композиций Настоящее изобретение относится к способам применения целевых соединений и композиций для лечения болезни или осуществления медицинской профилактики, чтобы замедлить и/или уменьшить рост опухолей, позитивно регулировать экспрессию генов LDLpeцепторов в клетке или снизить концентрацию холестерина в плазме у хозяина, и т.п. Эти способы, как правило, включают приведение в контакт с клеткой или введение хозяину эффектив 003924 16 ного количества целевых соединений или фармацевтически приемлемых композиций. Композиции и соединения согласно изобретению и их фармацевтически приемлемые соли можно вводить любым эффективным способом, таким как пероральный, парентеральный или топический способы. Как правило, соединения вводят в дозах в интервале от примерно 2 до примерно 2000 мг в сутки, хотя будет необходимо производить изменения в зависимости от заболевания, особенностей пациента и способа введения. Предпочтительные дозы вводят перорально или внутривенно в интервале от примерно 0,05 до примерно 20 мг/кг, предпочтительнее в интервале от примерно 0,05 до примерно 2 мг/кг, наиболее предпочтительно в интервале от примерно 0,05 до примерно 0,2 мг/кг,на кг массы тела, в сутки. В одном из вариантов изобретение относится к целевым соединениям, соединенным с фармацевтически приемлемым эксципиентом,таким как стерильный физиологический раствор или другая среда, вода, желатин, масло и т.п., с образованием фармацевтически приемлемых композиций. Композиции и/или соединения можно вводить одни или в сочетании с любым подходящим носителем, разбавителем и т.п., и такое введение можно осуществлять в виде однократной дозы или нескольких доз. Полезными носителями являются твердые, полутвердые или жидкие среды, в том числе, вода и нетоксичные органические растворители. В другом варианте изобретение относится к целевым соединениям в форме пролекарства,которое может метаболически превращаться в целевое соединение в организме реципиентахозяина. В технике известно множество пролекарственных композиций. Композиции можно получить в любой удобной форме, включая таблетки, капсулы,лепешки, пастилки, твердые свечи, порошки,спреи, кремы, суппозитории и т.п. Как таковые,композиции, в фармацевтически приемлемых стандартных лекарственных формах или в объеме, можно заключать в самые разные контейнеры. Например, стандартные лекарственные формы можно включать в разные контейнеры, в том числе, в капсулы, пилюли и т.п. Композиции можно с выгодой соединить и/или использовать в сочетании с другими гипохолестеринемическими или антипролиферативными лечебными или профилактическими средствами, отличающимися от целевых соединений. Во многих случаях введение в сочетании с целевыми композициями усиливает эффективность таких средств. Примерами антипролиферативных средств являются циклофосфамид,метотрексат, адриамицин, цисплатин, дауномицин, винкристин, винбластин, винарелбин, паклитаксел, доцетаксел, тамоксифен, флутамид,гидроксимочевина и их смеси. Примерами гипохолестеринемических и/или гиполипемиче 17 ских средств являются вещества, усиливающие секрецию желчных кислот, такие как четвертичные амины (например, холестирамин и колестипол); никотиновая кислота и ее производные; ингибиторы HMG-CoA-редуктазы, такие как мевастатин, правастатин и симвастатин; гемифиброзил и другие фибриновые кислоты, такие как клофибрат, фенофибрат, бензофибрат и ципофибрат; пробукол; ралоксифен и его производные и их смеси. Соединения и композиции также находят применение во многих анализах in vitro и invivo, в том числе, в диагностических анализах. Например, различные процессы аллотипической экспрессии генов LDL-рецепторов можно различить по чувствительности при анализах с целевыми соединениями и композициями или с их наборами. При некоторых анализах и исследованиях распределения in vivo желательно использовать меченые варианты целевых соединений и композиций, например, при анализах с замещением радиолиганда. Соответственно,изобретение относится к целевым соединениям и композициям, содержащим детектируемую метку, которая может быть спектроскопической(например, флуоресцентной), радиоактивной и т.п. Сведения, подтверждающие возможность осуществления изобретения Приведенные далее примеры даются для иллюстрации, и никоим образом не ограничивают настоящее изобретение. Примеры Спектры 1H-ЯMP регистрировали на ЯМРспектрометре Varian Gemini, 400 МГц. Значимые пики описываются в следующем порядке мультиплетность (с - синглет; д - дублет; т триплет; к -квартет; м - мультиплет; ушс - уширенный синглет), константа(ы) сочетания в Гц и число протонов. Масс-спектры при ионизации методом электронного удара (EI) регистрировали на масс-спектрометре Hewlett Packard 5989A. Результаты масс-спектрометрии приводятся в виде отношения массы к заряду с последующим относительным содержанием каждого иона (в круглых скобках). Примеры 1-4 относятся к синтезу некоторых полезных промежуточных соединений. Остальные примеры относятся к получению пентафторфенилсульфонамидобензолмочевин. Специалистам в этой области техники следует иметь в виду, что подобные схемы реакций можно использовать для получения соответствующих производных 2,3,4,5-тетрафторфенилсульфонамидобензола, 3,4,5-триметоксифенилсульфонамидобензола и 3-метокси-4,5-метилендиоксифенилсульфонамидобензола. Получение исходных анилинов для каждого такого ряда можно осуществить посредством восстановления соответствующих нитросодержащих сульфонанилидов способами, подобными способу,описанному в примере 3. Эти нитросоединения 18 получают посредством взаимодействия соответствующих арилсульфонилхлоридов (описанных в совместно рассматриваемых заявках за регистр.08/917025 и 08/896827) с соответствующими нитроанилинами (известными из химической литературы). Пример 1. Этот пример иллюстрирует получение промежуточного соединения 4-метокси-3 нитроанилина.(16,7 г, 107 ммоль, от Aldrich Chemical Co., Милуоки, Висконсин, США) в безводном метаноле при температуре окружающей среды добавляют метоксид натрия (23,1 г, 428 ммоль), и полученный раствор кипятят с обратным холодильником при перемешивании в течение 21 ч. Затем реакционную смесь охлаждают до 0 С, и добавляют по каплям 12 М раствор НСl (13,4 мл), а затем воду (250 мл). Сырую смесь экстрагируют три раза Et2O (200 мл). Органические слои объединяют, промывают рассолом (300 мл), сушат над Na2SO4 и концентрируют в вакууме, и получают 17,5 г (97%) продукта реакции в виде темно-коричневого твердого вещества, которое используют без дополнительной очистки. 1H ЯМР (400 МГц, ДМСО-d6)7,09 (д, J=9 Гц, 1 Н), 7,01 (дд, J=2,8, 1,3 Гц, 1 Н), 6,85 (ддд,J=9, 2,8, 1,4 Гц, 1 Н), 5,2 (с, 2 Н), 3,75 (с, 3 Н). Пример 2. Этот пример иллюстрирует синтез промежуточного соединения 2-нитро-4-пентафторфенилсульфонамидоанизола. 2-Нитро-4-пентафторфенилсульфонамидоанизол. К 0,4 М раствору 4-метокси-3-нитроанилина (17,5 г, 104 ммоль, получен в примере 1) в безводном метаноле добавляют по каплям пентафторфенилсульфонилхлорид (7,7 мл, 52 ммоль, от Аldrich Chemical Co.), и полученную смесь перемешивают при температуре окружающей среды в течение 1 ч. Реакционную смесь концентрируют в вакууме, и остаток очищают посредством колоночной хроматографии (10-30% EtOAc в гексане), и получают 18,1 г (87%) названого в заголовке соединения в виде оранжевого твердого вещества, т.пл. 95-97 С. 1 19 Гц, 1 Н), 3,95 (с, 3 Н). М.-с. (EI): m/e 817 (30,2M+Na-2H), 398 (30, М+), 397 (100, М-Н). Пример 3. Этот пример иллюстрирует получение промежуточного соединения 2-метокси-5-пентафторфенилсульфонамидоанилина. 2-Метокси-5-пентафторфенилсульфонамидоанилин. К 0,15 М раствору 2-нитро-4-пентафторфенилсульфонамидоанизола (18,1 г, 45,5 ммоль,получен в примере 2) в 100% безводном этаноле добавляют 10% Pd/C (4,84 г, 4,55 ммоль). Через полученный раствор в течение 1 мин барботируют газообразный водород, и полученную смесь перемешивают в течение 24 ч при давлении водорода в 1 атмосферу. Сырую реакционную смесь фильтруют через слой целита, и фильтровальный слой промывают этанолом(500 мл). Фильтрат и промывную жидкость объединяют и концентрируют в вакууме, и получают 16,5 г (99%) продукта реакции в виде не совсем белого твердого вещества, которое используют без дополнительной очистки, т.пл. 142143 С. 1H ЯМР (400 МГц, ДМСО-d6)10,64 (с,1 Н), 6,68 (д, J=8,4 Гц, 1 Н), 6,44 (д, J=2,1 Гц, 1 Н),6,3 (дд, J=8,4, 2,1 Гц, 1 Н), 4,88 (ушс, 2 Н), 3,69 (с,3 Н). М.-с. (EI): m/е 369 (100, М+Н). Пример 4. Этот пример иллюстрирует получение промежуточного соединения 3-метиламино-4 метокси-1-пентафторфенилсульфонамидобензола. 3-Метиламино-4-метокси-1-пентафторфенилсульфонамидобензол. К 0,5 М раствору 2-формамидо-4 нитроанизола (745 мг, 3,8 ммоль) в диоксане добавляют борогидрид натрия (722 мг, 19 ммоль), и затем по каплям добавляют ледяную уксусную кислоту (1,09 мл, 19 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 40 мин, затем охлаждают до 0 С и постепенно гасят МеОН. Затем добавляют избыток МеОН, и раствор концентрируют в вакууме, и получают 2-метиламино-4-нитроанизол. Неочищенный продукт растворяют в безводном МеОН (20 мл), добавляют Pd/C (795 мг, 0,76 ммоль), и затем через раствор в течение 1 мин барботируют газообразный водород. Затем реакционную смесь перемешивают в течение 1,5 ч при давлении водорода в 1 атмосферу. 20 Реакционную смесь фильтруют через слой целита, и фильтровальный слой промывают МеОН(40 мл). К объединенным фильтрату и промывной жидкости добавляют пентафторфенилсульфонилхлорид (282 мл, 0,26 ммоль). После перемешивания в течение 30 мин реакционную смесь концентрируют в вакууме, и остаток очищают посредством колоночной хроматографии (10-25% EtOAc в гексане), и получают 153 мг (21% за три стадии) названного в заголовке соединения в виде бледно-желтого твердого вещества. 1 Цианат калия (36 мг, 0,45 ммоль), растворенный в деионизированной воде (0,75 мл), добавляют к 3 (150 мг, 0,41 ммоль), растворенному в ледяной уксусной кислоте (3 мл). Мутную реакционную смесь перемешивают при комнатной температуре в течение 3 ч. Реакционную смесь выливают в деионизированную воду (50 мл) и 3 раза эктрагируют этилацетатом (25 мл). Объединенные органические слои промывают насыщенным раствором NаНСО 3 и крепким рассолом. Раствор сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Полученное белое твердое вещество перекристаллизовывают из горячего этилацетата и гексана, и получают 5 (75 мг, 45%) в виде белого кристаллического твердого вещества. Т.пл. 226 С. 1H ЯМР (CD3CN)8,73 (ушс, 1 Н); 7,95 (д,J=2,4 Гц, 1 Н); 7,39 (ушс, 1 Н); 6,92-6,91 (м, 3 Н); 5,14 (ушс, 2 Н); 3,83 (с, 3 Н). М.-с. (ESI): m/e 410,0 (М-Н). Калиевую соль 5 получают посредством суспендирования 5 в деионизированной воде и добавления 1,0 эквивалента 1 N раствора (водн.) КОН. Смесь встряхивают до тех пор, пока не завершится растворение, и затем лиофилизуют досуха. Т.пл. 250 С. 1 Этилизоцианатоацетат (17 мл, 0,15 ммоль) добавляют к 3 (50 мг, 0,13 ммоль), растворенному в хлороформе (1,5 мл). Мутную реакционную смесь перемешивают при комнатной тем 21 пературе в течение 1 ч, и в это время реакционная смесь затвердевает. Добавляют ацетон (2 мл) и этилизоцианатоацетат (50 мл, 0,45 ммоль),и гомогенную реакционную смесь греют при 50 С. Через 1,5 ч растворители удаляют при пониженном давлении, и полученный остаток непосредственно очищают посредством флэшхроматографии (силикагель, от 40% до 60% этилацетата в гексане). Фракции, содержащие нужый продукт, концентрируют, и остаток перекристаллизовывают из горячей смеси этилацетата и гексана, и получают 6 (45 мг, 67%) в виде белого кристаллического твердого вещества. Т.пл. 164-170 С. 1 В круглодонную 25 мл колбу загружают 204 мг (0,55 ммоль) 3 и 2,0 мл сухого ТГФ. Смесь перемешивают до тех пор, пока не растворится твердое вещество, и затем колбу охлаждают до 0 С на бане со смесью воды со льдом. К смеси в течение 2 мин добавляют твердый трифосген (54 мг, 0,18 ммоль), и смесь перемешивают еще в течение 5 мин. Затем добавляют по каплям 154 мкл (112 мг, 1,11 ммоль) триэтиламина (смесь становится мутной, белого цвета). Затем реакционную смесь нагревают до комнатной температуры и перемешивают в течение 15 мин. После повторного охлаждения до 0 С добавляют по каплям раствор 46 мг (0,55 ммоль) 3-аминопиразола в 2,0 мл сухого ТГФ. Реакционную смесь снова нагревают до комнатной температуры и перемешивают в течение 3 ч. Сырую смесь выливают в 5 мл 1 N НСl и экстрагируют этилацетатом тремя объемами по 20 мл. Объединенные органические экстракты промывают рассолом, сушат над MgSO4 и концентрируют в вакууме, и получают не совсем белое твердое вещество. Это вещество очищают посредством флэш-хроматографии на силикагеле (этилацетат:гексан, 1:3). Полученное белое твердое вещество перекристаллизовывают из этилацетата и гексана, и получают 172 мг (65%) белого кристаллического вещества. Т.пл. 140144 С. М.-с. (ESI): m/e 476,0 (М-Н). 1 В круглодонную 25-мл колбу загружают 206 мг (0,56 ммоль) 3 и 2,0 мл сухого ТГФ. Смесь перемешивают до тех пор, пока не растворится твердое вещество, и затем колбу охлаждают до 0 С на бане со смесью воды со льдом. К смеси в течение 2 мин добавляют твердый трифосген (55 мг, 0,19 ммоль), и смесь перемешивают еще в течение 5 мин. Затем добавляют по каплям 78 мкл (57 мг, 1,12 ммоль) триэтиламина (смесь становится мутной, белого цвета). Затем реакционную смесь нагревают до комнатной температуры и перемешивают в течение 15 мин. После повторного охлаждения до 0 С добавляют по каплям раствор 55 мг (0,56 ммоль) 2-фурфуриламина в 2,0 мл сухого ТГФ. Реакционную смесь снова нагревают до комнатной температуры и перемешивают в течение 2 ч. Сырую смесь выливают в 5 мл 1 N НСl и экстрагируют этилацетатом тремя объемами по 20 мл. Объединенные органические экстракты промывают рассолом, сушат над МgSO4 и концентрируют в вакууме, и получают прозрачное масло. Это масло очищают посредством флэшхроматографии на силикагеле(этилацетат:гексан, 1:1). Полученное белое твердое вещество обрабатывают метанолом и собирают посредством фильтрации, и получают 234 мгC19H14F5N3O5S: С - 46,44, Н - 2,87, N - 8,55; найдено: С - 46,64, Н - 2,89, N - 8,52. Пример 9. Данный пример иллюстрирует другой синтез соединения 5. 9.1. Формилирование 2-метокси-5-нитроанилина. К уксусному ангидриду (100 мл, 1,05 моль) при 0 С в течение 15 мин добавляют по каплям муравьиную кислоту (45 мл, 98%, 1,2 моль). Смесь греют при 45-50 С в течение 30 мин и затем охлаждают до 0 С. Затем к реакционной смеси добавляют безводный ТГФ (100 мл). С помощью капельной воронки в течение 30 мин добавляют раствор 2-метокси-5-нитроанилина(200 мл). С началом добавления к реакционной смеси оранжево-красная окраска исходного вещества мгновенно исчезает, и в ходе добавления постепенно выпадает в осадок бледно-желтое твердое вещество. Капельную воронку ополаскивают 50 мл сухого ТГФ. После завершения добавления реакционную смесь нагревают до комнатной температуры в течение 30 мин. Бледно-желтый осадок собирают посредством фильтрации. Затем фильтрат концентрируют,остаток обрабатывают эфиром, и твердое вещество снова собирают посредством фильтрации. После сушки в высоком вакууме получают 70,4 г (96%) формамида 9.2. 1 В 500-мл трехгорловую колбу загружают 10 г формамида 9.2 и 1 г катализатора 3% Pd на угле. Смесь суспендируют в 100 мл МеОН и помещают в атмосферу водорода (давление в баллоне). После энергичного перемешивания в течение 4 ч ТСХ показывает, что исходное вещество израсходовано. Реакционную смесь фильтруют и остаток 3 раза промывают 100 мл горячего ацетона, чтобы гарантировать полное растворение продукта. Фильтрат концентрируют, остаток обрабатывают ацетоном, и продукт реакции собирают посредством фильтрации. После сушки в высоком вакууме получают 7,51 г (88%) анилина 9.3. 1C6F5SO2Cl (41,8 мл, 282 ммоль) и добавляют сульфонилхлорид в течение 15 мин. Во время добавления исходное вещество растворяется, и образуется новый осадок (гидрохлорид 2,6 лутидина). Через 30 мин гидрохлорид 2,6 лутидина удаляют посредством фильтрации, и фильтрат концентрируют при пониженном давлении. Полученное таким образом коричневое 24 маслянистое твердое вещество обрабатываютCH2Cl2, и твердое вещество собирают. Вторую партию продукта реакции получают, повторяя концентрирование, обработку и фильтрацию. После сушки в высоком вакууме получают 95,5 г (90%) сульфонамида 9.4 в виде бледножелтого твердого вещества. 1H ЯМР (СD3 СОСD3):9,55 (ушс, 1 Н); 9,01 (ушс, 1 Н); 8,39 (с, 1 Н); 8,17 (д, J=2,6 Гц,1 Н); 7,06 (дд, J=2,6, 8,8 Гц, 1 Н); 6,99 (д, J=8,8 Гц, 1 Н); 3,86 (с, 3 Н). М.-с. (ESI): m/e 395,0 (МН), 812,9 (2[M-H]+Na). 9.4. Удаление формильной группы из 9.4. Ацетилхлорид (18,8 мл, 265 ммоль) осторожно добавляют к абсолютному этанолу (360 мл). Смесь становится горячей (60 С) . После охлаждения этанольного раствора НСl до комнатной температуры добавляют суспензию сульфонамида 9.4 (95,4 г, 241 ммоль) в 360 мл абсолютного этанола. Используют еще 280 мл абсолютного этанола для смывания всех исходных веществ в реакционную смесь. Все твердые вещества растворяются в пределах 2,5 ч. Через 20 ч реакционную смесь концентрируют при пониженном давлении до общего объема 100 мл. Выпавшее в осадок белое вещество собирают посредством фильтрации и затем последовательно промывают этанолом и гексаном. Фильтрат снова концентрируют, и выпавший осадок собирают и промывают. После сушки в высоком вакууме получают 103,6 г (95%) сульфонамида 9.5 (гидрохлорид в виде сольвата с одним молем этанола) в виде мелких белых кристаллов. 1 Цианат калия (1,72 г, 21 ммоль), растворенный в деионизированной воде (7 мл), при 0 С добавляют к сульфонамиду 9.5 (7,13 г, 19,4 ммоль), растворенному в ледяной уксусной кислоте (70 мл) и воде (10 мл). Мутную реакционную смесь перемешивают в течение 2 ч. Реакционную смесь выливают в деионизированную воду (300 мл), и выпавшее в осадок белое вещество собирают посредством фильтрации. После сушки в потоке воздуха продукт растворяют вEtOAc (400 мл), и раствор кипятят с обратным холодильником. Этилацетат отгоняют из колбы до тех пор, пока раствор не станет слегка мутным. Раствор охлаждают до комнатной температуры и затем ставят в холодильник на 16 ч. Белое кристаллическое вещество собирают посредством фильтрации, промывают гексаном и сушат в высоком вакууме, и получают 7,33 г 5.(Анализ методом ЯМР показывает, что это кристаллическое вещество содержит 20 мас.% этилацетата даже после сушки в высоком вакууме. Дополнительное количество 5 можно извлечь посредством концентрирования маточного раствора и повторения процесса кристаллизации). 1H ЯМР (СD3 ОD):7,82 (с, 1 Н); 6,88 (с,2 Н); 7,39 (ушс, 1 Н); 3,85 (с, 3 Н). М.-с. (ESI): m/е 410,0 (М-Н). 9.6. Получение натриевой соли 5. Соединение 5 (1,0 г, 2,41 ммоль) суспендируют в деионизированной воде (10 мл). При энергичном перемешивании добавляют по каплям раствор гидроксида натрия (2,51 М, 1,0 мл,2,5 ммоль) . Добавляют еще раствор NaOH по каплям до тех пор, пока рН среды не станет 10,5 и не растворятся все твердые вещества. Водный раствор натриевой соли 5 фильтруют для удаления совсем небольшого количества нерастворившегося вещества. Затем раствор насыщают NaCl. Через 10 мин выпавший осадок натриевой соли соединения 5 собирают и промывают крепким рассолом. Собранное твердое вещество сушат в потоке воздуха в течение 5 мин, и затем для растворения натриевой соли соединения 5 добавляют ацетон. Раствор фильтруют (чтобы избавиться от избытка NaCl), и остаток промывают ацетоном. Ацетоновый раствор фильтруют во второй раз и затем концентрируют при пониженном давлении. Остаток растворяют в горячем ацетоне и, и добавляют достаточное количество гексана до появления очень слабой мути. После охлаждения кристаллизуется названное в заголовке соединение. Выпавшее в осадок вещество собирают, промывают гексаном и сушат в высоком вакууме, и получают 0,73 г (70%) натриевой соли соединения 5 в виде белого кристаллического вещества. 1(д, J=8,8 Гц, 1 Н); 6,74 (дд, J=2,5, 8,7 Гц, 1 Н); 3,80 (с, 3 Н). М.-с. (ESI): m/e 410,0 (М-Н). Пример 10. Оценка биологической активности. Способность испытываемых соединений останавливать рост опухолевых клеток в культуре оценивали с использованием клеток HeLa, 003924 26 происходящих от цервикальной аденокарциномы человека и полученных из Американской коллекции типовых культур (АТСС, Роквилл,Мэриленд). Клетки выращивали в культуре обычным способом. Испытываемые соединения добавляли при трехкратном повторе в концентрациях в интервале от 5 нМ до 50 мкМ, и вычисляли скорость роста клеток, собирая клетки после обработки в течение 72 ч и измерения их метаболической активности с использованием анализа с Alamar Blue (Biosource International,Камарилло, Калифорния). Степень метаболической активности в культуре пропорциональна числу живых клеток. См. Ahmed et al., J. Immunol. Methods, 1994, 170, 211. Изменение скорости роста клеток для клеток, обработанных испытываемыми соединениями, нормировали к росту необработанных клеток, и строили график зависимости нормализованного роста от концентрации соединения. Определяли концентрацию, при которой происходило полное ингибирование роста (TGI). Подобным образом оценивали соединения на ингибирование роста клеток с использованием клеток MCF-7/ADR. Таблица 1 Арилсульфонанилидмочевины 27 Все публикации и заявки на патенты, цитированные в данном описании, включены в описание в качестве ссылок, как если бы каждая отдельная публикация или заявка на патент включалась в описание в качестве ссылки по отдельности. Хотя вышеописанное изобретение представлено с некоторыми подробностями и примерами в целях ясности понимания, специалисты в этой области техники, с учетом указаний данного изобретения, легко поймут, что можно осуществлять определенные изменения и модификации без отхода от сущности и объема прилагаемой формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулыR3 представляет собой заместитель, выбранный из группы, состоящей из водорода, (C1 С 6)-алкила и (C1-С 6)-гетероалкила или соединяется с Y и атомом азота, к которому присоединяется каждый из них, с образованием 5-, 6- или 7-членного гетероциклического кольца;Y представляет собой заместитель, выбранный из группы, состоящей из водорода, (C1 С 8)-алкила, (C1-С 8)-гетероалкила, арил-(C1-С 4)алкила, арил-(C1-С 4)-гетероалкила, или соединяется с R3 и атомом азота, к которому присоединяется каждый из них, с образованием 5-, 6- или 7-членного гетероциклического кольца; причем гетероалкил представляет собой необязательно замещенный, насыщенный или ненасыщенный, линейный или разветвленный или циклический углеводородный радикал или их сочетания, состоящий из указанного числа атомов углерода и одного-трех гетероатомов,выбранных из группы, состоящей из О, N, Si и 28 2. Соединение по п.1, где Y представляет собой (C1-С 6)-алкил. 3. Соединение по п.1, где Y представляет собой водород. 4. Соединение по п.1, где Y представляет собой необязательно замещенный, насыщенный или ненасыщенный циклический углеводородный радикал, состоящий из 1-8 атомов углерода и одного-трех гетероатомов, выбранных из группы, состоящей из О, N, Si и S. 5. Соединение по п.1, где Y вместе с R3 и атомом азота, к которому присоединяется каждый из них, образуют 5- или 6-членное гетероциклическое кольцо. 6. Соединение по п.1, где Y выбирают из группы, состоящей из 2-тиазолила, 1,2,4 триазолила, 1,3,4-тиадиазолила, пиразолила,1,2,3,4-тетразолила, имидазолила, оксазолила и 1,2,3-триазолила. 7. Соединение по п.1, где каждый из R1, R2,3R и Y представляет собой водород. 8. Соединение по п.1, где R4 выбирают из группы, состоящей из водорода, (C1-С 3)-алкила,(C1-С 3)-алкокси. 9. Соединение по п.1, где каждый из R1, R2 3 и R представляет собой водород и R4 представляет собой (C1-С 3)-алкокси. 10. Соединение по п.1, где каждый из R1 и 2R представляет собой водород и Y вместе с R3 и атомом азота, к которому присоединяется каждый из них, образуют 5- или 6-членное гетероциклическое кольцо. 11. Соединение по п.1, где Аr представляет собой пентафторфенил. 12. Соединение по п.1, где Аr представляет собой 2,3,4,5-тетрафторфенил. 13. Соединение по п.1, где каждый из R1,2R и R3 представляет собой водород, R4 находится в пара-положении относительно сульфонамидной группы и выбирается из группы, состоящей из водорода, (C1-С 3)-алкила, (C1-С 3)алкокси и (C1-С 3)-тиоалкокси, и Y представляет собой водород или (C1-С 3)-алкил. 14. Соединение по п.1, где Аr представляет собой пентафторфенил, каждый из R1, R2 и R3 представляют собой водород, R4 представляет собой 4-метокси и Y представляет собой (C1 С 3)-алкил. 15. Соединение по п.1, представленное формулой 16. Соединение по п.1, представленное формулой где X1 и X2, каждый независимо, выбирают из группы, состоящей из F, Сl и Вr; или его фармацевтически приемлемая соль. 20. Способ лечения или профилактики болезненного состояния, характеризуемого аномально высоким содержанием в крови частиц липопротеина высокой плотности или холестерина или аномально высоким уровнем пролиферации клеток, включающий введение нуждающемуся в этом млекопитающему терапевтически эффективного количества композиции, содержащей соединение формулыR3 представляет собой заместитель, выбранный из группы, состоящей из водорода, (C1 С 6)-алкила и (C1-С 6)-гетероалкила или соединяется с Y и атомом азота, к которому присоединяется каждый из них, с образованием 5-, 6- или 7-членного гетероциклического кольца;Y представляет собой заместитель, выбранный из группы, состоящей из водорода, (C1 С 8)-алкила, (C1-С 8)-гетероалкила, арил-(C1-С 4)алкила, арил-(C1-С 4)-гетероалкила, или соединяется с R3 и атомом азота, к которому присоединяется каждый из них, с образованием 5-, 6- или 7-членного гетероциклического кольца; причем гетероалкил представляет собой необязательно замещенный, насыщенный или ненасыщенный, линейный или разветвленный или циклический углеводородный радикал или их сочетания, состоящий из указанного числа атомов углерода и одного-трех гетероатомов, 003924 где Х 1 и X2, каждый независимо, выбирают из группы, состоящей из F, Сl и Вr,или его фармацевтически приемлемую соль. 21. Способ по п.20, где болезненное состояние представляет собой рак или раковое состояние. 22. Способ по п.20, где пролиферативное болезненное состояние является инфекцией,вызванной микроорганизмом. 23. Способ по п.20, где пролиферативное болезненное состояние представляет собой псориаз. 24. Способ по п.20, где пролиферативное болезненное состояние представляет собой рестеноз сосудов. 25. Способ по п.20, где болезненное состояние представляет собой гиперхолестеринемию или другое болезненное состояние, ассоциированное с аномально высоким содержанием холестерина или липопротеинов. 26. Способ по п.20, где указанное соединение вводят перорально. 27. Способ по п.20, где указанное соединение вводят внутривенно, внутримышечно, подкожно или интрадуоденально. 28. Фармацевтическая композиция, содержащая фармацевтически приемлемый эксципиент и соединение формулыR3 представляет собой заместитель, выбранный из группы, состоящей из водорода, (C1 С 6)-алкила и (C1-С 6)-гетероалкила или соединяется с Y и атомом азота, к которому присоединяется каждый из них, с образованием 5-, 6- или 7-членного гетероциклического кольца; няется каждый из них, с образованием 5-, 6- или 7-членного гетероциклического кольца; причем гетероалкил представляет собой необязательно замещенный, насыщенный или ненасыщенный, линейный или разветвленный или циклический углеводородный радикал или их сочетания, состоящий из указанного числа атомов углерода и одного-трех гетероатомов,выбранных из группы, состоящей из О, N, Si и где X1 и X2, каждый независимо, выбирают из группы, состоящей из F, Сl и Вr,или его фармацевтически приемлемую соль. 29. Композиция по п.28, где Аr выбирают из группы, состоящей из 30. Композиция по п.28, где Аr представляет собой пентафторфенил. 31. Композиция по п.28, где Аr представляет собой 2,3,4,5-тетрафторфенил. 32. Композиция по п.28, дополнительно содержащая антипролиферативное средство,выбранное из группы, состоящей из циклофосфамида, метотрексата, адриамицина, цисплатина, дауномицина, винкристина, винбластина,винарелбина, паклитаксела, доцетаксела, тамоксифена, флутамида, гидроксимочевины и их смесей. 33. Композиция по п.28, дополнительно содержащая компонент, выбранный из группы,состоящей из гипохолестеринемических и гиполипемических средств.
МПК / Метки
МПК: C07D 231/38, C07C 311/21, A61P 35/00, A61K 31/18
Метки: арилсульфонанилидмочевины
Код ссылки
<a href="https://eas.patents.su/17-3924-arilsulfonanilidmocheviny.html" rel="bookmark" title="База патентов Евразийского Союза">Арилсульфонанилидмочевины</a>
Предыдущий патент: Циклопентеноны, способы их получения и применение
Следующий патент: Замещенные пиразолы, как ингибиторы p 38 киназы
Случайный патент: Средство фиксации горлышка пробки незаполняемого повторно типа







