Выделенный промотор из палочковидного тунгро-вируса риса и способы его применения
Формула / Реферат
1. Выделенный промотор из палочковидного тунгровируса риса (промотор RTBV), состоящий из фрагмента нуклеотидной последовательности SEQ ID NO: 1, управляющий экспрессией функционально связанных последовательностей нуклеиновых кислот в однодольных и двудольных растениях, клетках, тканях и органах растений.
2. Выделенный промотор по п.1, содержащий по меньшей мере основания 1-254 SEQ ID NO: 1.
3. Выделенный промотор по п.1, содержащий нуклеотидную последовательность, выбранную из группы, включающей SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 и SEQ ID NO: 15.
4. Химерный конструкт плазмидной ДНК, содержащий промотор по п.1, функционально связанный с интересующей последовательностью гетерологичной нуклеиновой кислоты.
5. Химерный конструкт плазмидной ДНК, содержащий промотор по п.3, функционально связанный с интересующей последовательностью гетерологичной нуклеиновой кислоты.
6. Химерный конструкт плазмидной ДНК по п.4, где указанная последовательность гетерологичной нуклеиновой кислоты кодирует полипептид, способный придавать растению улучшенные агрономические признаки.
7. Химерный конструкт плазмидной ДНК по п.5, где указанная последовательность гетерологичной нуклеиновой кислоты кодирует полипептид, способный придавать растению улучшенные агрономические признаки.
8. Химерный конструкт плазмидной ДНК по п.4, представляющий собой вектор для трансформации растений.
9. Химерный конструкт плазмидной ДНК по п.5, где указанная плазмида представляет собой вектор для трансформации растений.
10. Рекомбинантная клетка, содержащая химерный конструкт плазмидной ДНК по п.4.
11. Рекомбинантная клетка, содержащая химерный конструкт плазмидной ДНК по п.5.
12. Рекомбинантная клетка по п.10, выбранная из Е.coli или Agrobacterium.
13. Рекомбинантная клетка по п.11, выбранная из Е.coli или Agrobacterium.
14. Трансформированные растения или клетки, содержащие химерный конструкт по п.5.
15. Потомство, полученное от трансформированных растений по п.14.
16. Семена, полученные от трансформированных растений по п.14.
17. Трансформированное растение по п.14, где указанное растение является однодольным или двудольным.
18. Трансформированное растение по п.14, которое является однодольным растением, выбранным из группы, состоящей из риса, кукурузы, пшеницы, ячменя и сорго.
19. Трансформированное растение по п.14, которое является двудольным растением, выбранным из группы, состоящей из табака, томата, гороха, сои, капусты, нута, хлопчатника и голубиного гороха.
20. Способ получения трансформированного растения, экспрессирующего гетерологичную нуклеиновую кислоту, функционально связанную с промотором RTBV, включающий стадии:
a) конструирования химерного конструкта плазмидной ДНК по п.9,
b) введения конструкта со стадии (а) в штамм Agrobacterium для получения рекомбинантных штаммов Agrobacterium,
c) получения пригодных эксплантатов из растения для трансформации растения,
d) совместного культивирования эксплантатов со стадии (с) с рекомбинантным штаммом Agrobacterium со стадии (b) для получения трансформированных растительных клеток,
e) отбора трансформированных растительных клеток со стадии (d),
f) получения побегов из трансформированных растительных клеток со стадии (е),
g) получения укоренившихся ростков из побегов со стадии (f),
h) выращивания укоренившихся ростков со стадии (g) для получения трансформированных растений, которые способны экспрессировать указанную гетерологичную нуклеиновую кислоту.
21. Способ по п.20, где указанный промотор RTBV содержит нуклеотидную последовательность, выбранную из группы, включающей SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 и SEQ ID NO: 15.
Текст
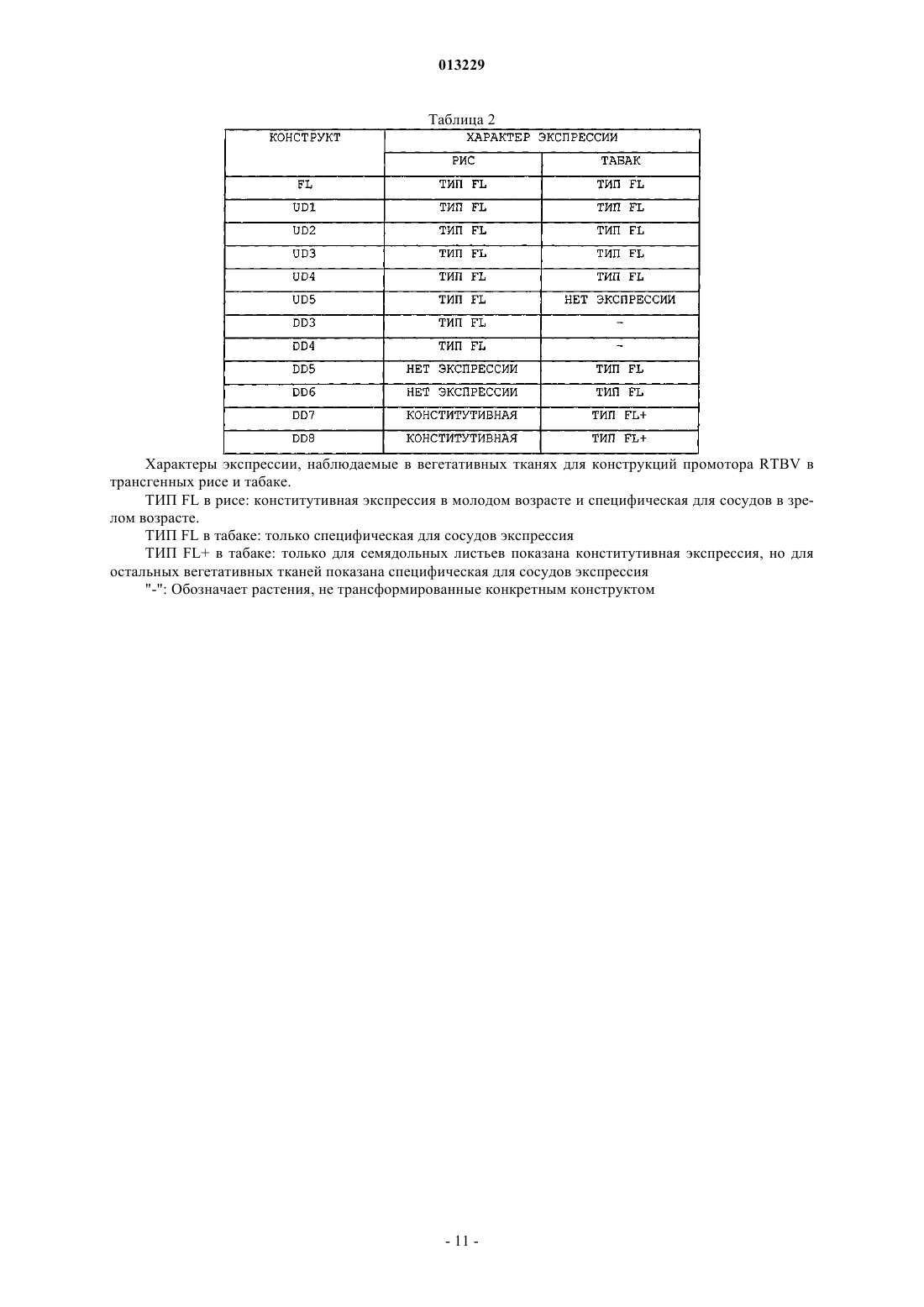
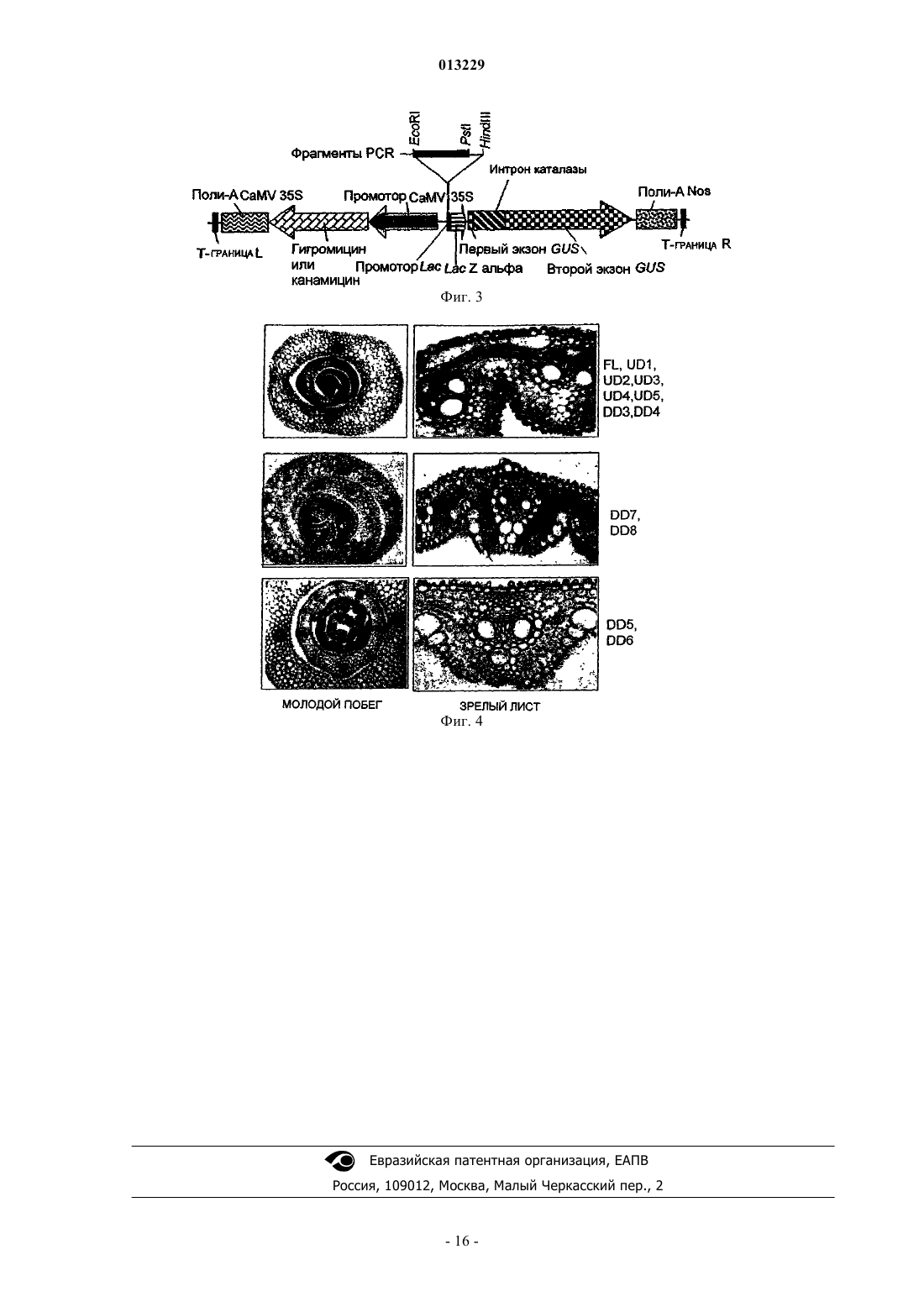
013229 Техническая область Настоящее изобретение относится к выделению новых нуклеотидных последовательностей из палочковидного тунгро-вируса риса (RTBV), обладающих промоторной активностью в трансгенных растениях. Кроме того, оно относится к характеризации функциональных доменов в промоторе RTBV, где промоторные последовательности функционируют конститутивным тканеспецифическим образом для управления экспрессией последовательностей гетерологичной нуклеиновой кислоты, как в однодольных,так и в двудольных растениях, их клетках и тканях. Вводная информация и предшествующая область техники Рис считают наиболее важной продовольственной культурой в мире, так как он является первичным источником калорий в рационе для большинства людей. Чтобы продолжать поставлять достаточно калорий и улучшать качество пищи на основе риса в будущие годы для растущей популяции потребителей риса, растение рис необходимо улучшить для увеличения урожайности с применением гибридной мощности для противостояния неблагоприятным условиям, таким как вредители, заболевания, засуха,затопление, засоленность почвы и экстремальные температуры, и для получения дополнительных питательных продуктов. Для большинства данных улучшений гены из других организмов, общеизвестные как трансгены, необходимо вводить в рис и экспрессировать в нем. С агрономической точки зрения для получения лучших вариантов риса, множество генов, сообщающих желательные генетические признаки, необходимо вводить в один и тот же трансгенный фон. Однако построение генной пирамиды не является простым. Чтобы обеспечить стабильную экспрессию трансгенов, их необходимо сливать с конкретными элементами ДНК, известными как промоторы, которые функционируют как контролирующие звенья для получения мРНК с генов, наиболее важной стадии экспрессии генов. Данные последовательности являются в основном регуляторными по природе, в том смысле, что они инициируют процесс транскрипции и могут регулировать скорость транскрипции. Относительно небольшое число промоторов являются общеупотребительными для экспрессии трансгенов в растениях. Кроме того, число промоторов, которые могут управлять экспрессией как в однодольных, так и в двудольных растениях, еще меньше. Существует также только небольшое количество промоторов, управляющих ткане- или органоспецифической экспрессией. Конкретная настоящая задача, таким образом, состоит в идентификации новых регуляторных элементов для введения большей гибкости с точки зрения достижения желательных пространственновременных картин экспрессии мРНК. Исследования показали, что использование одного и того же промотора для управления экспрессией двух различных гетерологичных генов в одном и том же растении может приводить к молчанию генов. Данную проблему, однако, можно обойти, используя различные промоторы для каждого из гетерологичных генов. Таким образом, существует необходимость идентификации новых промоторов, для которых можно показать специфическую для ткани и/или стадии развития экспрессию и которые можно использовать для экспрессии трансгена в различных растениях. Настоящий документ предоставляет такую информацию об идентифицированном и охарактеризованном новом промоторе из палочковидного тунгро-вируса риса (RTBV), выделенного и модифицированного из инфицированных вирусом растений риса, выращенных на полях в Западной Бенгалии, Индия. Промотор 35S вируса мозаики цветной капусты (CaMV 35S) и его производные являются одними из наиболее широко применяемых промоторов для этой цели. CaMV 35S является активным в двудольных растениях, но его относительная сила в однодольных растениях по существу ниже, чем в двудольных растениях. Другие промоторы двудольных растений также использовали для трансформации однодольных растений, однако активность для промоторов однодольных растений имела тенденцию быть ниже (Wilmink et al., 1995). Идентифицировали несколько промоторов, направляющих высокий уровень экспрессии трансгена в однодольных растениях, например, промотор риса Act1 (McElroy et al., 1991),промотор риса rbcS (Kyozuka et al., 1993), промотор кукурузы Ubi1 (Toki et al., 1992; Cornejo et al., 1993) и промотор гена цитохрома С риса OsCc1 (Jang et al., 2002). Из них только CaMV 35S (Terada and Shimamoto, 1990), Act1 риса, Ubi1 кукурузы и OsCc1 риса являются конститутивными по природе. Только немногие тканеспецифические промоторы идентифицированы для риса. Например, промотор белка сохранения глютелина семян (Gt1) использовали для экспрессии трансгенов в семенах риса (Ye et al., 2000) и промотор риса Glu-B1 использовали для специфической для эндосперма экспрессии гена ферритина сои(Goto et al., 1999). Некоторые другие охарактеризованные в рисе промоторы включают в себя промоторpin2 картофеля, индуцируемый, как показано, повреждением (Xu et al., 1993), промотор кукурузы Adh1,сильно индуцируемый в корнях в анаэробных условиях (Kyozuka et al., 1991) и промоторы кукурузы pep и rbcS, специфические для мезофилла (Matsuoka et al., 1994).RTBV, выделенный на Филиппинах (патент США 5824857). Использование промотора заключалось в управлении специфической для сосудов экспрессией в трансгенных растениях. Однако настоящее исследование относится к идентификации и характеризации фрагмента промотора из RTBV, выделенного в Западной Бенгалии, Индия, не обладающего значительной гомологией с ранее охарактеризованным промотором RTBV. Последовательность ДНК данного полноразмерного клона помещена на хранение в базу-1 013229 данных последовательностей EMBL, и ей присвоен следующий инвентарный номер: AJ314 596, однако,ранее не была определена функция последовательности ДНК. Настоящее изобретение относится к идентификации новых промоторов из RTBV (изолят West Bengal) и их применению для экспрессии трансгена в растениях. Цели изобретения Основной целью настоящего изобретения является предоставление выделенного промотора из палочковидного тунгро-вируса риса (RTBV), обладающего нуклеотидными последовательностями, как показано на SEQ ID NO: 1 в списке последовательностей. Другой целью настоящего изобретения является предоставление делеционных вариантов промотораNO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13,SEQ ID NO: 14 и SEQ ID NO: 15, как показано в списке последовательностей. Другой целью настоящего изобретения является предоставление химерного вектора для трансформации растений, содержащего промотор RTBV (полноразмерный, FL) или его делеционные вариантыUD1, UD2, UD3, UD4, UD5 и UD6 (вышележащие делеции в положении апстрим, UD) и DD1, DD2,DD3, DD4, DD5, DD6, DD7 и DD8, (нижележащие делеции в положении даунстрим, DD), функционально связанные с интересующей последовательностью гетерологичной нуклеиновой кислоты. Другой целью изобретения является предоставление химерного вектора для трансформации растений, где последовательность гетерологичной нуклеиновой кислоты, кодирующая полипептид, способный сообщать растению улучшенные агрономические признаки или устойчивость к заболеваниям или насекомым, функционально связана с промотором RTBV и его производными, описанными выше. Другой целью настоящего изобретения является предоставление растительных клеток, тканей, органов и растений (однодольных или двудольных), трансформированных различными последовательностями промотора RTBV (SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12,SEQ ID NO: 13, SEQ ID NO: 14 и SEQ ID NO: 15), слитыми с последовательностями гетерологичной нуклеиновой кислоты. Другой целью изобретения является предоставление способа экспрессии одной или нескольких интересующих последовательностей гетерологичной нуклеиновой кислоты под регуляторным контролем последовательностей промотора RTBV (FL) или с вышележащими делециями (UD1, UD2, UD3, UD4,UD5, UD6), или с нижележащими делециями (DD1, DD2, DD3, DD4, DD5, DD6, DD7 и DD8). Другой целью настоящего изобретения является предоставление способа получения трансгенных однодольных или двудольных растений, экспрессирующих последовательности гетерологичной нуклеиновой кислоты под контролем последовательностей промотора RTBV (FL) или с вышележащими (в положении апстрим) делециями (UD1, UD2, UD3, UD4, UD5, UD6), или с нижележащими (в положении даунстрим) делециями (DD1, DD2, DD3, DD4, DD5, DD6, DD7 и DD8). Сущность изобретения Настоящее изобретение относится к выделению новых нуклеотидных последовательностей из палочковидного вируса риса tungro (RTBV), обладающих промоторной активностью в растениях. Предоставленные здесь последовательности нуклеиновой кислоты (выделенные из RTBV) управляют экспрессией функционально связанных нуклеотидных последовательностей в клетках, тканях и органах как однодольных, так и двудольных растений. Изобретение относится к промотору RTBV (FL, 876 п.о.), обладающему нуклеотидными последовательностями, как показано на SEQ ID NO: 1 (список последовательностей). Настоящее изобретение относится также к делеционным вариантам промотора RTBV, представляющим собой UD1 (818 п.о., SEQ IDDD6 (325 п.о., SEQ ID NO: 13); DD7 (289 п.о., SEQ ID NO: 14) и DD8 (254 п.о., SEQ ID NO: 15). Кроме того, настоящее изобретение относится к анализу функциональных доменов промоторовRTBV, как показано на SEQ ID NO: 1, посредством слияния полноразмерного и делеционных вариантов последовательности RTBV с бактериальным репортерным геном GUS и исследования экспрессии репортерного гена в различных тканях трансгенных растений риса и табака в течение различных стадий развития. В предпочтительном варианте осуществления идентифицировали промоторные последовательности из RTBV, обозначенные как FL, длиной 876 п. о., как показано на SEQ ID NO: 1, вышележащую (в положении апстрим) делецию FL, такую как UD1, UD2, UD3, UD4, UD5 и UD6, как показано на SEQ IDNO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6 и SEQ ID NO: 7, соответственно. Кроме того, идентифицировали нижележащие (в положении даунстрим) делеции последовательностей FL,такие как DD1, DD2, DD3, DD4, DD5, DD6, DD7 и DD8, как показано на SEQ ID NO: 8, SEQ ID NO: 9,SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 и SEQ ID NO: 15, соответственно. Данные последовательности использовали для управления экспрессией бактериального ре-2 013229 портерного гена GUS в растениях, клетках, тканях и органах риса и табака. Настоящее изобретение также относится к промотору RTBV и его делециям, функционирующим конститутивным или тканеспецифическим образом для управления экспрессией последовательностей гетерологичной нуклеиновой кислоты в однодольных и двудольных растениях, их клетках, органах и тканях. В другом аспекте настоящее изобретение относится к полноразмерному (FL) промотору RTBV и его вышележащим и нижележащим делециям, экспрессирующимся в рисе предсказуемо тканеспецифическим образом (FL, UD1, UD2, UD3, UD4, UD5, DD3 и DD4) или конститутивно (DD7 и DD8). В другом аспекте изобретение относится к конструированию химерного вектора для трансформации растений, содержащего последовательности промотора FL, с вышележащей и нижележащей делецией, слитые с интересующими последовательностями гетерологичной нуклеиновой кислоты. Кроме того, настоящее изобретение относится к способу получения трансгенных растений (однодольных или двудольных) введением химерного вектора для трансформации растений в клетки растений,где химерный вектор для трансформации растений содержит последовательности промотора RTBV (илиFL, или вышележащие или нижележащие делеции), слитые с гетерологичным структурным геном. Настоящее изобретение относится также к способу экспрессии последовательностей гетерологичной нуклеиновой кислоты в трансгенном растении под регуляторным контролем указанных последовательностей промотора RTBV (или FL, или вышележащей или нижележащей делеции), где указанная последовательность гетерологичной нуклеиновой кислоты выполняет функции, способные сообщать растению улучшенные агрономические признаки или устойчивость к заболеваниям или насекомым. Настоящее изобретение относится также к способу экспрессии гетерологичного гена в трансгенном растении под регуляторным контролем указанных последовательностей промотора RTBV (или FL, или мутантов промотора с вышележащей или нижележащей делецией), где растение является однодольным,например, рис, пшеница или кукуруза. Настоящее изобретение относится также к способу экспрессии последовательностей гетерологичной нуклеиновой кислоты в трансгенном растении под регуляторным контролем указанных последовательностей промотора RTBV (или FL, или мутантов с вышележащей или нижележащей делецией), где растение является двудольным, например, табак, хлопчатник или томат. Настоящее изобретение относится также к растениям, клеткам или тканям, содержащим промоторRTBV и последовательности гетерологичной нуклеиновой кислоты под контролем последовательностей промотора RTBV (FL), или с вышележащими делециями (UD1, UD2, UD3, UD4, UD5 и UD6), или с нижележащими делециями (DD1, DD2, DD3, DD4, DD5, DD6, DD7 и DD8). Краткое описание сопутствующих чертежей Фиг. 1: Полноразмерная последовательность промотора RTBV с SEQ ID NO: 1, показаны положения прямых праймеров (FP) или обратных праймеров (RP), применяемых для амплификации с помощьюPCR. 2. Праймеры указаны сверху 5'-основания (прямой праймер, FP) или 3'-основания (обратный праймер, RP) праймера и окрашены красным. Прямой и обратный тип праймера обозначен остриями стрелок. Фиг. 2: Схематическое представление полученных с помощью PCR делеционных фрагментов промотора RTBV. Прямые праймеры обозначены как FP1-FP7, а обратные праймеры как RP1-RP9. Прямоугольный блок обозначает отрезок генома RTBV размером 900 п.о., острия стрелок обозначают приблизительное положение праймеров, а соединяющая их горизонтальная линия - ожидаемые фрагменты. Соответствующие конструкции с делецией в промоторе записаны справа от фрагментов, где вышележащие делеции обозначены как UD1-6, а нижележащие делеции обозначены как DD1-8. Фиг. 3: Схематическое представление области Т-ДНК лишенного промотора вектора,pCAMBIA1381z, используемого для клонирования в рисе или табаке, обладающего генами селективных маркеров для гигромицина или канамицина, соответственно. Фиг. 4: Срезы трансгенных тканей риса, обладающих активностью GUS с различными конструктами. Конструкты, для которых показана картина, обозначены справа как FL, UD1-5, DD3-8. Подробное описание предпочтительных вариантов осуществления Предпочтительный вариант осуществления настоящего изобретения относится к выделению и характеризации промотора из палочковидного вируса риса tungro (RTBV), способного управлять экспрессией функционально связанных последовательностей нуклеиновой кислоты в клетках, тканях и органах однодольных и двудольных растений, обладающего нуклеотидными последовательностями, как показано на SEQ ID NO: 1. Другой вариант осуществления настоящего изобретения относится к делеционным вариантам (UD1,UD2, UD3, UD4, UD5, UD6, DD1, DD2, DD3, DD4, DD5, DD6, DD7 и DD8) промотора RTBV, содержащим по меньшей мере 59-876 п.о. (UD1) SEQ ID NO: 1, как показано на SEQ ID NO: 2. Номенклатура иID последовательности различных делеционных вариантов промотора RBTV даны следующим образом:UD2 (88-876 п.о. из SEQ ID NO: 1), как показано на SEQ ID NO: 3. UD3 (123-876 п.о. из SEQ ID NO: 1),как показано на SEQ ID NO: 4. UD4 (159-876 п.о. из SEQ ID NO: 1), как показано на SEQ ID NO: 5. UD5(196-876 п.о. из SEQ ID NO: 1), как показано на SEQ ID NO: 6. UD6 (206-876 п.о. из SEQ ID NO: 1), как показано на SEQ ID NO: 7. DD1 (1-862 п.о. из SEQ ID NO: 1), как показано на SEQ ID NO: 8. DD2 (1-793-3 013229 п.о. из SEQ ID NO: 1), как показано на SEQ ID NO: 9. DD3 (1-691 п.о. из SEQ ID NO: 1), как показано наSEQ ID NO: 10. DD4 (1-581 п.о. из SEQ ID NO: 1), как показано на SEQ ID NO: 11. DD5 (1-426 п.о. изSEQ ID NO: 1), как показано на SEQ ID NO: 12, DD6 (1-325 п.о. из SEQ ID NO: 1), как показано на SEQID NO: 13. DD7 (1-289 п.о.) из SEQ ID NO: 1, как показано на SEQ ID NO: 14. DD8 (1-254 п.о.) из SEQ IDNO: 1, как показано на SEQ ID NO: 15. Другой вариант осуществления настоящего изобретения относится к FL и его вышележащим и нижележащим делециям, экспрессирующимся в рисе предсказуемо тканеспецифическим образом (UD1,UD2, UD3, UD4, UD5, DD3 и DD4) или конститутивно (DD7 и DD8). Другой вариант осуществления настоящего изобретения относится к химерному вектору для трансформации растений, содержащему промотор RTBV (FL, UD1, UD2, UD3, UD4, UD5, UD6, DD1,DD2, DD3, DD4, DD5, DD6, DD7 и DD8), функционально связанный с интересующей последовательностью гетерологичной нуклеиновой кислоты. Другой предпочтительный вариант осуществления настоящего изобретения относится к получению химерного вектора для трансформации растений, содержащего указанные промоторы RTBV (FL, UD1,UD2, UD3, UD4, UD5, UD6, DD1, DD2, DD3, DD4, DD5, DD6, DD7 и DD8), связанные с гетерологичным геном, кодирующим полипептид, способный сообщать растению улучшенные агрономические признаки или устойчивость к заболеваниям или насекомым. Другой вариант осуществления настоящего изобретения относится к трансформированным клеткам, тканям и органам однодольных и двудольных растений. Другой вариант осуществления настоящего изобретения относится к трансгенному растению, где указанное растение принадлежит к семейству злакоцветных, как рис, пшеница и кукуруза. Другой вариант осуществления настоящего изобретения относится к трансгенному растению, где указанное растение является двудольным, таким как табак, хлопчатник и томат. Другой вариант осуществления настоящего изобретения относится к способу экспрессии одной или нескольких интересующих последовательностей гетерологичной нуклеиновой кислоты, содержащих промотор RTBV (FL, UD1, UD2, UD3, UD4, UD5, UD6, DD1, DD2, DD3, DD4, DD5, DD6, DD7 и DD8),где указанный способ включает стадии:(a) Получения химерного конструкта плазмидной ДНК (вектор для трансформации растений), содержащей последовательности промотора, как показано на любом из SEQ ID NO: 1, SEQ ID NO: 2, SEQID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 или SEQ ID NO: 15, функционально связанные с интересующей последовательностью гетерологичной нуклеиновой кислоты.(b) Введения плазмиды со стадии (а) в подходящую клетку-хозяина.(c) Трансформации растительных клеток или тканей с использованием клеток со стадии (b) для получения трансгенного растения, экспрессирующего указанную последовательность гетерологичной нуклеиновой кислоты. Другой вариант осуществления настоящего изобретения относится к способу экспрессии, где указанная последовательность гетерологичной нуклеиновой кислоты кодирует полипептид, способный сообщать растению улучшенные агрономические свойства. Другой вариант осуществления настоящего изобретения относится к способу экспрессии, где указанная последовательность гетерологичной нуклеиновой кислоты кодирует полипептид, способный сообщать растению улучшенные агрономические свойства, или устойчивость к заболеванию или насекомым, где указанное трансгенное растение является однодольным. Другой вариант осуществления настоящего изобретения относится к способу экспрессии, где указанная последовательность гетерологичной нуклеиновой кислоты кодирует полипептид, способный сообщать растению улучшенные агрономические свойства, или устойчивость к заболеванию или насекомым, где указанное трансгенное растение принадлежит к семейству злакоцветных, например рис. Другой вариант осуществления настоящего изобретения относится к способу экспрессии, где указанная последовательность гетерологичной нуклеиновой кислоты кодирует полипептид, способный сообщать растению улучшенные агрономические свойства, или устойчивость к заболеванию или насекомым, где указанное трансгенное растение является двудольным, таким как табак. ДНК RTBV (изолят West Bengal) очищали, как приведено в примере 1. Фрагмент вышеуказанной ДНК характеризовали по промоторной активности. Для анализа промоторной активности в вышеуказанном фрагменте промотора выполняли вышележащие и нижележащие делеции, и подробности приведены в примере 2. Полная последовательность промотора RTBV показана на фиг. 1. Праймеры обозначены сверху 5'основания в случае прямого праймера или 3'-основания в случае обратного праймера. Различные делеции, полученные для промотора RTBV FL, схематически представлены на фиг. 2. Прямые праймеры обозначены как FP1-FP7, а обратные праймеры как RP1-RP9. Прямоугольный блок обозначает приблизительно отрезок генома RTBV из 900 п.о. Острия стрелок обозначают приблизительное положение праймеров, а соединяющая их горизонтальная линия -ожидаемые фрагменты PCR (см. фиг. 2). Последовательность FL промотора RTBV (876 п.о., SEQ ID NO:1) амплифицировали с использова-4 013229 нием олигонуклеотидных праймеров FP1 (SEQ ID NO: 16) и RP1 (SEQ ID NO: 23). Фрагмент FL использовали для получения как 5'-, так и 3'-делеционных фрагментов промотора. 5'-делеционные фрагменты представляют собой UD1, UD2, UD3, UD4, UD5 и UD6. 3'-делеционные фрагменты представляют собойID NO: 30). Делеционный фрагмент DD8 (254 п.о., SEQ ID NO: 15) амплифицировали с использованием праймеров FP1 и RP9 (SEQ ID NO: 31). Детали различных делеционных фрагментов, их размеры, праймеры, используемые для получения этих фрагментов и их номера SEQ ID приведены в табл. 1. Различные фрагменты ДНК клонировали в лишенный промотора остов вектора для трансформации растений, такого как pCAMBIA1381z для управления экспрессией гена GUS с интроном. Схематическое представление области Т-ДНК между левой и правой границей вектора для трансформации растенийpCAMBIA1381z показано на фиг. 3. Лишенный промотора вектор, pCAMBIA1381z, использовали с маркерным геном устойчивости к гигромицину для клонирования в рисе или с маркерным геном устойчивости к канамицину для клонирования в табаке. Получили различные химерные векторы для трансформации растений, обладающие остовом pCAMBIA1381z, каждый из которых обладал различными фрагментами ДНК, а именно FL, UD1, UD2, UD3, UD4, UD5, UD6, DD1, DD2, DD3, DD4, DD5, DD6, DD7 и DD8 выше гена GUS (с интроном). Эти векторные конструкции вводили в штамм Agrobacterium EHA105, как указано в примере 3. Штамм Agrobacterium использовали для трансформации растений, таких как табак и рис. Трансформацию риса проводили, как указано в примере 4. Трансформацию табака проводили, как указано в примере 5. Затем трансформированные растения анализировали по активности GUS с использованием стандартного способа, приведенного в примере 6. Характеры экспрессии для промоторной активности в рисе исследовали для полноразмерного (FL) промотора с 876 парами оснований, как показано на SEQ ID NO: 1, так же как мутантов промотора с вышележащей делецией UD1, UD2, UD3, UD4 и UD5, как показано на SEQ ID NO: 2, SEQ ID NO: 3, SEQ IDNO: 4, SEQ ID NO: 5 и SEQ ID NO: 6, соответственно. Мутанты с нижележащей делецией DD3, DD4,DD5, DD6, DD7 и DD8, как показано на SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13,SEQ ID NO: 14 и SEQ ID NO: 15, соответственно, идентифицировали и использовали для анализа экспрессии бактериального репортерного гена GUS в рисе. Активность GUS в нарезанной вручную ткани трансформированного риса показана на фиг. 4, где голубым цветом, как правило, показана промоторная активность. Промотор FL, как показано на SEQ ID NO: 1, фрагменты промотора с вышележащей делецией UD1,UD2, UD3, UD4 и UD5, как показано на SEQ ID NO: 2, SEQ ID, NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 иSEQ ID NO: 6, соответственно, так же как мутанты с нижележащей делецией DD5, DD6, DD7 и DD8, как показано на SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 и SEQ ID NO: 15, использовали для трансформации растений и тканей табака для управления экспрессией бактериального репортерного генаGUS. Активность GUS в трансформированных тканях табака анализировали для исследования экспрессии в различных тканях. В рисе для фрагмента промотора FL (SEQ ID NO: 1) показана сильная конститутивная экспрессия активности репортерного гена во всех клетках побега и корня за исключением эпидермиса и кончиков корня на 7 сутки после прорастания (dpg). Экспрессия постепенно уменьшалась с возрастом ткани, сохраняясь сильной в сосудистых тканях, подобных флоэме и обкладке сосудистых пучков на 30 dpg. Экспрессия становилась слабой до незначительной к 100 dpg. Подобный характер экспрессии наблюдали для конструктов UD1, UD2, UD3, UD4, UD5, DD3 и DD4. Однако для двух из их вариантов с нижележащими делециями, DD7 и DD8, наблюдали другой характер экспрессии. Для этих двух конструктов промоторная активность являлась конститутивной в течение всей жизни растения за исключением эпидермиса и кончиков корня, где не существовало экспрессии. Для другого набора конструктов с нижележащей деле-5 013229 цией DD5 и DD6 показан третий характер экспрессии, где не существовало визуально детектируемой активности GUS на какой-либо стадии развития растения. Характеры экспрессии для промоторов RTBVFL и его различных делеционных фрагментов в эксплантатах молодого побега и зрелого листа риса показаны на фиг. 4. В рисе, в соцветии, верхней цветковой чешуе и нижней цветковой чешуе показана активность GUS только в проводящих тканях для FL, UD1, UD2, UD3, UD4, UD5, DD3 и DD4, тогда как для DD7 и DD8 ее можно было обнаружить также во внутрисосудистых тканях. Для всех этих конструктов, для волокон и соединительной ткани тычинок показана промоторная активность, но для гнезд пыльника и пыльцы не показана. В гинецее промоторная активность являлась ограниченной опушенным рыльцем и раздвоенным столбиком, но не завязью. Активность GUS оценивали в тканях молодого листа второго поколения трансгенов (Т 1) риса, что позволяло предполагать, что промотор RTBV является сравнимым по степени экспрессии с общепринятым Ubi1 кукурузы, так же как с промотором CaMV 35S, со значениями, сравнимыми с приблизительно 25000 нмоль 4-MU (4-метилумбеллиферона) на мг белка в час. Обнаружили также, что промотор RTBV является активным в гетерологичной системе, такой как табак, однако в отличие от промотора RTBV трансгенного риса, экспрессия с FL, UD1, UD2, UD3, UD4,DD5, DD6, DD7 и DD8 являлась ограниченной сосудистой сетью в стебле, листьях и корнях даже в молодых тканях, характер, справедливый для зрелого трансгенного риса с FL. В то время как для DD7 иDD8, только семядольные листья экспрессировали активность GUS конститутивно, затем экспрессия становилась ограниченной сосудистыми тканями при созревании растения. В отличие от риса, для UD5 не наблюдали экспрессии в какой-либо ткани. Не обнаружили четко выраженных различий в характерах экспрессии в цветах для FL, UD или DD, где экспрессия являлась ограниченной сосудистыми тканями в чашелистиках и лепестках. Не наблюдали промоторной активности в андроцее или гинецее для какоголибо из конструктов. Для трансгенных растений риса, специфическая для флоэмы активность полноразмерного промотора RTBV из Филиппин опубликована ранее (Bhattacharyya-Pakrasi et al., 1993; Yin and Beachy, 1995; Yinet al., 1997), однако идентифицированная промоторная последовательность была из другого изолята (Филиппины), чем в настоящем исследовании (Западная Бельгия, Индия). Позднее, опубликовано, что при вставке 278 нуклеотидов ниже промоторных последовательностей (dps), такой же промотор RTBV обладает активностью в более широком диапазоне клеток, чем наблюдали ранее в отсутствии dps (Klti et al.,1999). В основном в молодых тканях обнаруживали промоторную активность, которая постепенно терялась с увеличением возраста растения. В настоящем исследовании 3'-делециями (DD7 и DD8) описывают промоторную последовательность, конститутивно экспрессирующую гетерологичный ген во всех тканях в течение всей жизни растения риса. Такую активность ранее не описывали для трансгенов риса с промотором RTBV. Для всех описанных ранее промоторов RTBV, активность полноразмерного промотора уменьшалась с возрастом растения и становилась очень низкой в старом возрасте, становясь ограниченной сосудистыми тканями. В отличие от этого некоторые из опубликованных здесь промоторных конструктов (DD7 и DD8) оставались активными даже в зрелых растениях. Для FL, UD1, UD2, UD3, UD4, UD5, DD3 и DD4 характер экспрессии являлся похожим на описанный Klti et al., (1999). Кроме того, тканеспецифичность настоящего промотора также отличалась от опубликованных ранее промоторов RTBV другим образом; для двух конструктов, соответствующих DD5 и DD6, не показали экспрессии в течение всей жизни растения. Результаты указывают на присутствие определенных положительных и отрицательных элементов, которые во взаимодействии с клеточными транс-действующими факторами определяют силу и тканевую специфичность промотора. Таким образом, по-видимому, активность описанных здесь промоторов будет очень полезной для экспрессии трансгенов в рисе предсказуемым тканеспецифическим образом (FL, UD1,UD2, UD3, UD4, UD5, DD3 и DD4) или конститутивно (DD7 и DD8). Однако экспрессия в растениях табака являлась тканеограниченной, активность являлась ограниченной сосудистыми тканями. Такие характеры дифференциальной экспрессии показывают, что в различных растительных системах различные белки взаимодействуют с одной и той же химерной последовательностью ДНК (промотором RTBV). Характеристики экспрессии обобщены в табл. 2. Примеры Приведенные примеры являются просто иллюстративными для применений, процессов и продуктов, включенных в формулу данного изобретения, и собственно осуществление изобретения не является ограниченным описанными примерами или посредством них. Пример 1. Выделение ДНК и идентификация промоторов Инфицированный вирусом материал собирали из экспериментальных ферм Bidhan Chandra KrishiViswavidyalaya, Kalyani, Западная Бенгалия, Индия. ДНК RTBV выделяли с использованием неочищенных препаратов вируса по способу Jones et al., (1991). Затем вирусную ДНК полностью расщепляли рядом рестрикционных ферментов и клонировали в pUC19 с использованием общепринятых процедур. Сочетание вложенных делеций и прогулки праймеров использовали для получения полной последовательности полноразмерного клона RTBV, который являлся клоном BamHI (Nath et al., 2002). Затем по-6 013229 следовательность ДНК полноразмерного клона депонировали в базу данных последовательностейEMBL, и ей присвоен следующий инвентарный номер: AJ314596. Пример 2. Анализ промотора Полная последовательность полноразмерного промотора RTBV (SEQ ID NO: 1) показана на фиг. 1,и номера праймеров, используемых для получения различных вариантов промотора посредством PCR обозначены сверху 5'-конца (прямой праймер) или 3'-конца (обратный праймер). Полная последовательность всех праймеров, последовательности RTBV (FL) и делеций RTBV (UD и DD) приведены также в виде списка последовательностей посредством программного обеспечения Patent-In. Последовательности набора праймеров, синтезированных для полноразмерного (876 п. о.) конструкта, следующие:RP1 (SEQ ID NO: 23) 5'-AACTGCAGTCAATATTTGAGAAAGTAAGATCCCTC-3'. Для конструкта с 3'-делецией DD1 (862 п.о.) прямой праймер, FP1, является таким же, однако последовательность обратного праймера является следующей:RP2 (SEQ ID NO: 24) 5'-AACTGCAGTAAGATCCCTCTTCAGAACATATGT-31 . Для конструкта с 3'-делецией DD2 (793 п.о.) прямой праймер FP1 является таким же, однако последовательность обратного праймера является следующей:RP3 (SEQ ID NO: 25) 5'-AACTGCAGAACATCGCTCTGATACCAGATG-3' Для конструкта с 3'-делецией DD3 (691 п.о.) прямой праймер FP1 является таким же, однако последовательность обратного праймера является следующей:RP4 (SEQ ID NO: 26) 5'-AACTGCAGCGTGATGAGGAAGAGCTACTTG-3' Для конструкта с 3'-делецией DD4 (581 п.о.) прямой праймер FP1 является таким же, однако последовательность обратного праймера является следующей:RP5 (SEQ ID NO: 27) 5'-AACTGCAGCTTGTTCCCTTGGCATCAC-3' Для конструкта с 3'-делецией DD5 (426 п.о.) прямой праймер FP1 является таким же, однако последовательность обратного праймера является следующей:RP6 (SEQ ID NO: 28) 5'-AACTGCAGCAGCGGATAAGTTCTTGATG-3' Для конструкта с 3'-делецией DD6 (325 п.о.) прямой праймер FP1 является таким же, однако последовательность обратного праймера является следующей:RP7 (SEQ ID NO: 29) 5'-AACTGCAGCAGCTAATCCTTCTTTGAAGAGG-3' Для конструкта с 3'-делецией DD7 (289 п.о.) прямой праймер FP1 является таким же, однако последовательность обратного праймера является следующей:RP8 (SEQ ID NO: 30) 5'-AACTGCAGCTCTTCTCTTGCTCTTGTGGAAG-3' Для конструкта с 3'-делецией DD8 (254 п.о.) прямой праймер FP1 является таким же, однако последовательность обратного праймера является следующей:RP9 (SEQ ID NO: 31) 5'-AACTGCAGCTCTGGGTGTGTGGATTTCG-3' Для конструкта с 5'-делецией UD1 (818 п.о.) обратный праймер RP1 является таким же, однако последовательность прямого праймера является следующей:FP2 (SEQ ID NO: 17) 5'-CGGAATTCTGATCCAAAGATAAAGGAACAAAG-3' Для конструкта с 5'-делецией UD2 (789 п.о.) обратный праймер RP1 является таким же, однако последовательность прямого праймера является следующей:FP3 (SEQ ID NO: 18) 5'-CGGAATTCAAGCATCAATAAAAGAAGACTGAAG-3' Для конструкта с 5'-делецией UD3 (754 п.о.) обратный праймер RP1 является таким же, однако последовательность прямого праймера является следующей:FP4 (SEQ ID NO: 19) 5'-CGGAATTCGGAATCCACTTTAAATTATTGTACCTC-3' Для конструкта с 5'-делецией UD4 (718 п.о.) обратный праймер RP1 является таким же, однако последовательность прямого праймера является следующей: FP5 (SEQ ID NO: 20) 5'-CGGAATTCTGTAAGAGTGTGTAAAATCTAGCCTACC-3' Для конструкта с 5'-делецией UD5 (681 п.о.) обратный праймер RP1 является таким же, однако последовательность прямого праймера является следующей:FP6 (SEQ ID NO: 21) 5'-CGGAATTCCTATATAAGGAGAAGTAGTCTGCATG-3' Для конструкта с 5'-делецией UD6 (671 п.о.) обратный праймер RP1 является таким же, однако последовательность прямого праймера является следующей:FP7 (SEQ ID NO: 22) 5'-CGGAATTCGGAGAAGTAGTCTGCATGTAATAGGC-3' Во всех последовательностях праймеров участки для ферментов EcoRI и PstI подчеркнуты. Полная последовательность полноразмерного промотора RTBV показана на фиг. 1. Номера праймеров, используемых для получения различных вариантов промотора, обозначены над 5'-концом (прямой праймер) или 3'-концом (обратный праймер). ДНК из клонированной ДНК RTBV использовали в качестве матрицы для амплификации фрагментов промотора с использованием Hi-Fidelity Taq ДНКполимеразы (Roche Applied Science, Германия) в следующих условиях: начальная денатурация при 94 С в течение 5 мин с последующими 10 циклами тепловой денатурации при 94 С в течение 30 с, отжига при 58 С в течение 30 с и удлинения при 72 С в течение 1 мин, с последующими 25 циклами тепловой дена-7 013229 турации при 94 С в течение 30 с, отжига при 58 С в течение 30 с и удлинения при 72 С в течение 1 мин и дополнительным удлинением на 5 с для каждого удлинения в цикле, в конце проводили удлинение 7 мин. Фрагменты PCR очищали посредством набора для очистки после PCR (Qiagen, Германия), расщепляли в течение ночи с использованием рестрикционных ферментов EcoRI и PstI с последующим клонированием в расщепленный EcoRI и PstI лишенный промотора вектор для трансформации растений, pCAMBIAl381z, содержащий репортерный ген GUS (с интроном каталазы) и устойчивость к гигромицину в качестве селективного маркера. Так как устойчивость к гигромицину нельзя эффективно использовать для селекции трансформантов в табаке, ген устойчивости к гигромицину из лишенного промотора вектора pCAMBIAl381z вырезали рестрикционным ферментом XhoI, и вводили в вектор XhoI фрагмент, содержащий ген устойчивости к канамицину из pCAMBIА 2300. Область Т-ДНК лишенного промотора вектора показана на фиг. 3. Различные фрагменты делетированного промотора элюировали и лигировали с вновь сконструированным векторным остовом для получения серии делеционных конструктов промотора RTBV для трансформации табака с использованием канамицина в качестве селективного маркера. Схематическое представление полученных PCR делеционных фрагментов промотора RTBV показано на фиг. 2. Пример 3. Трансформация Agrobacterium двойными векторами/конструктами Эти химерные векторы для трансформации растений вводили в Agrobacterium штамма ЕНА 105 способом замораживания-оттаивания (An et al. 1988). Приблизительно 1 мкг плазмидной ДНК смешивали с компетентными клетками Agrobacterium и затем замораживали в жидком азоте с последующей инкубацией при 37 С в течение 5 мин. К этим трансформированным клеткам добавляли 1 мл среды ЛурияБертани (LB) и инкубировали состав при 28 С в течение 4-5 ч. Затем бактериальную суспензию осаждали и распределяли по чашке с LB с агаром, содержащей подходящие антибиотики. Чашки содержали при 28 С в течение 2 суток, и отдельные колонии анализировали на присутствие правильной конструкции обычными способами. Пример 4. Трансформация риса Полученные из щитка каллюсы риса сорта РВ 1, субкультивированные в течение полутора месяцев в темноте в среде для индукции каллюса, CIM [среда N6B5 (Chu, 1978/ Gamborg et al., 1968) содержащая 2 мг/л 2,4-D (2,4-дихлорфеноксиуксусной кислоты) и отвержденная 0,8% агаром] при 28 С, подвергали опосредованной Agrobacterium трансформации согласно протоколу Wang et al., (1997). Каллюсы риса инфицировали суспензией клеток Agrobacterium в жидкой среде N6B5, содержащей 100 мкМ ацетосирингона и 2 мг/л 2,4-D, при конечной плотности клеток 2 х 108 клеток/мл в течение двадцати минут. Затем каллюсы помещали в среду для совместного культивирования (CIM, содержащую 100 мкМ ацетосирингона) при 28 С на двое с половиной суток в темноте. Проводили промывки бактериостатическим средством аугментином при 150 мг/л и помещали каллюсы в селективную среду (CIM, содержащую 30 мг/л гигромицина и 150 мг/л аугментина) в темноту на полтора месяца. Предположительно трансформированные каллюсы кремового цвета далее содержали на селективных чашках от пяти до шести суток перед переносом на среду для предварительной регенерации (среда N6B5, содержащая 0,5 мг/л бензиламинопурина [ВАР], 10 мкМ абсцизовой кислоты, 30 мг/л гигромицина и 150 мг/л аугментина) на неделю, при инкубации трое суток в темноте и четверо суток на свету. Затем каллюсы переносили на среду для регенерации (среда N6B5, содержащая 1 мг/л ВАР, 30 мг/л гигромицина и 150 мг/л аугментина) до начала появления побегов. Затем их переносили в культуральные пробирки, содержащие среду для регенерации. Чтобы обеспечить хорошо развитую корневую систему (укрепление), предположительные трансгены переносили в жидкую среду MS (Murashige and Scoog, 1962) и, наконец, сажали в горшки, содержащие соилрит и грунт в соотношении 1:1, и переносили в оранжерею до созревания. Пример 5. Трансформация табака Для трансформации табака использовали способ листовой пластинки (Savda and Binns, 2000). Срезали листовые пластинки размером приблизительно 1 см 2 с 2-3 верхних листьев растений табака в возрасте 3-4 недель, выращенных в бутылках с пробками на среде MS в асептических условиях, и использовали в качестве эксплантатов для опосредованной Agrobacterium трансформации. Эти листовые пластинки совместно культивировали с суспензией бактерий Agrobacterium, содержащих промоторный конструкт (конструкты) при OD600 приблизительно 0,6 в жидкой среде MS в течение 20 мин. Затем листовые пластинки промокали куском стерильного листа 3 ММ Whatman и помещали на среду MS, отвержденную 0,8% агаром, содержащую 0,1 мг/л нафталинуксусной кислоты (NAA) и 1 мг/л ВАР, при рассеянном свете на двое с половиной суток при 28 С. Листовые пластинки тщательно промывали бактериостатическим средством, цефотаксимом 500 мг/л, и помещали пластинки в селективную среду (отвержденная 0,8% агаром среда MS, содержащая 0,1 мг/л NAA и 1 мг/л ВАР, 500 мг/л цефотаксима и 50 мг/л канамицина) на свет на полтора месяца. Предположительно трансгенные ростовые почки вырезали и помещали в отвержденную 0,8% агаром среду MS, содержащую 50 мг/л канамицина, для укоренения. Укоренившиеся растения вырезали и отрезок стебля, обладающий по меньшей мере одним узлом, далее включали во второй цикл селекции на среде для укоренения. Те растения, которые снова укоренялись, переносили в горшки в оранжерее до созревания.-8 013229 Пример 6. Анализ трансформантов Предположительно трансгенные растения проверяли по присутствию области Т-ДНК проведениемPCR с ген- или промотор-специфичными праймерами. Затем геномную ДНК выделяли с использованием протокола Dellaporta et al., (1983). Для детекции активности репортерного гена в различных тканях сделанные вручную срезы листовой пластинки/корня окрашивали в течение ночи в растворе X-Gluc (5 бром-4-хлор-3-индолилD-глюкуронида) при 37 С, затем удаляли окраску в смеси ацетон:этанол 1:3 до полного удаления хлорофилла и фотографировали под сложным микроскопом (фиг. 4). Для флуорометрического анализа GUS, использовали приблизительно 100 мг ткани листа, как описано у Jefferson(1987). Преимущества данного изобретения 1. Идентифицирован промотор, активный как в однодольных, так и в двудольных. 2. Идентифицирован сильный промотор для конститутивной экспрессии в рисе. 3. Идентифицирован промотор, обладающий тканеспецифической экспрессией. 4. Идентифицирован промотор для управления экспрессией гена, где необходимо осуществление генной пирамиды, чтобы избежать молчания гена, где один и тот же промотор управляет двумя различными генами. Цитируемые ссылки Ссылки на патентные документы США 6528701 March, 2003 Wang et al. 800/278 6713665 March, 2004 Crane III et al. 800/298 6693227 Feb., 2004 Gittins et al. 800/287 6664387 Dec, 2003 Chung et al. 536/24 5824857 Oct., 1998 Beachy et al. 800/287 Другие ссылки 1. An G., Ebert P.R., Mitra A. and Ha S.B. (1988). Binary Vectors. Plant Mol Biol Manual A3: 1-19. 2. Bhattacharyya-Pakrasi M., Peng J., Elmer J.S., Laco G., Shen P., Kaniewska M.B., Kononowizc H.,Wen F., Hodges Т.K. and Beachy R.N.(1993). Specificity of a promoter from the rice tungro bacilliform virus Характеры экспрессии, наблюдаемые в вегетативных тканях для конструкций промотора RTBV в трансгенных рисе и табаке. ТИП FL в рисе: конститутивная экспрессия в молодом возрасте и специфическая для сосудов в зрелом возрасте. ТИП FL в табаке: только специфическая для сосудов экспрессия ТИП FL+ в табаке: только для семядольных листьев показана конститутивная экспрессия, но для остальных вегетативных тканей показана специфическая для сосудов экспрессия"-": Обозначает растения, не трансформированные конкретным конструктом ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Выделенный промотор из палочковидного тунгровируса риса (промотор RTBV), состоящий из фрагмента нуклеотидной последовательности SEQ ID NO: 1, управляющий экспрессией функционально связанных последовательностей нуклеиновых кислот в однодольных и двудольных растениях, клетках,тканях и органах растений. 2. Выделенный промотор по п.1, содержащий по меньшей мере основания 1-254 SEQ ID NO: 1. 3. Выделенный промотор по п.1, содержащий нуклеотидную последовательность, выбранную из группы, включающей SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ IDNO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13,SEQ ID NO: 14 и SEQ ID NO: 15. 4. Химерный конструкт плазмидной ДНК, содержащий промотор по п.1, функционально связанный с интересующей последовательностью гетерологичной нуклеиновой кислоты. 5. Химерный конструкт плазмидной ДНК, содержащий промотор по п.3, функционально связанный с интересующей последовательностью гетерологичной нуклеиновой кислоты. 6. Химерный конструкт плазмидной ДНК по п.4, где указанная последовательность гетерологичной нуклеиновой кислоты кодирует полипептид, способный придавать растению улучшенные агрономические признаки. 7. Химерный конструкт плазмидной ДНК по п.5, где указанная последовательность гетерологичной нуклеиновой кислоты кодирует полипептид, способный придавать растению улучшенные агрономические признаки. 8. Химерный конструкт плазмидной ДНК по п.4, представляющий собой вектор для трансформации растений. 9. Химерный конструкт плазмидной ДНК по п.5, где указанная плазмида представляет собой вектор для трансформации растений. 10. Рекомбинантная клетка, содержащая химерный конструкт плазмидной ДНК по п.4. 11. Рекомбинантная клетка, содержащая химерный конструкт плазмидной ДНК по п.5. 12. Рекомбинантная клетка по п.10, выбранная из Е.coli или Agrobacterium.- 14013229 13. Рекомбинантная клетка по п.11, выбранная из Е.coli или Agrobacterium. 14. Трансформированные растения или клетки, содержащие химерный конструкт по п.5. 15. Потомство, полученное от трансформированных растений по п.14. 16. Семена, полученные от трансформированных растений по п.14. 17. Трансформированное растение по п.14, где указанное растение является однодольным или двудольным. 18. Трансформированное растение по п.14, которое является однодольным растением, выбранным из группы, состоящей из риса, кукурузы, пшеницы, ячменя и сорго. 19. Трансформированное растение по п.14, которое является двудольным растением, выбранным из группы, состоящей из табака, томата, гороха, сои, капусты, нута, хлопчатника и голубиного гороха. 20. Способ получения трансформированного растения, экспрессирующего гетерологичную нуклеиновую кислоту, функционально связанную с промотором RTBV, включающий стадии:a) конструирования химерного конструкта плазмидной ДНК по п.9,b) введения конструкта со стадии (а) в штамм Agrobacterium для получения рекомбинантных штаммов Agrobacterium,c) получения пригодных эксплантатов из растения для трансформации растения,d) совместного культивирования эксплантатов со стадии (с) с рекомбинантным штаммом Agrobacterium со стадии (b) для получения трансформированных растительных клеток,e) отбора трансформированных растительных клеток со стадии (d),f) получения побегов из трансформированных растительных клеток со стадии (е),g) получения укоренившихся ростков из побегов со стадии (f),h) выращивания укоренившихся ростков со стадии (g) для получения трансформированных растений, которые способны экспрессировать указанную гетерологичную нуклеиновую кислоту. 21. Способ по п.20, где указанный промотор RTBV содержит нуклеотидную последовательность,выбранную из группы, включающей SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID
МПК / Метки
МПК: A01H 5/00, C12N 5/14, C12N 15/82
Метки: риса, промотор, способы, применения, палочковидного, тунгро-вируса, выделенный
Код ссылки
<a href="https://eas.patents.su/17-13229-vydelennyjj-promotor-iz-palochkovidnogo-tungro-virusa-risa-i-sposoby-ego-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Выделенный промотор из палочковидного тунгро-вируса риса и способы его применения</a>
Предыдущий патент: Способ получения обогащённого поликлонального антитела, высокоспецифичного к антигену поверхностного полисахарида липоарабиноманнана микобактерий, и способы его применения
Следующий патент: Пептиды механо-фактора роста и их применение
Случайный патент: Способ и устройства для рециркуляции волокон из осадка сточных вод