Новые фторированные соединения бензотиадиазина, способ их получения и фармацевтические композиции, которые их содержат
Номер патента: 9698
Опубликовано: 28.02.2008
Авторы: Пиротт Бернар, Франкотт Пьер, Де Тюллио Паскаль, Фрекен Пьер, Геньяр Даниель-Анри, Данобер Лоранс, Лестаж Пьер, Ренар Пьер
Формула / Реферат
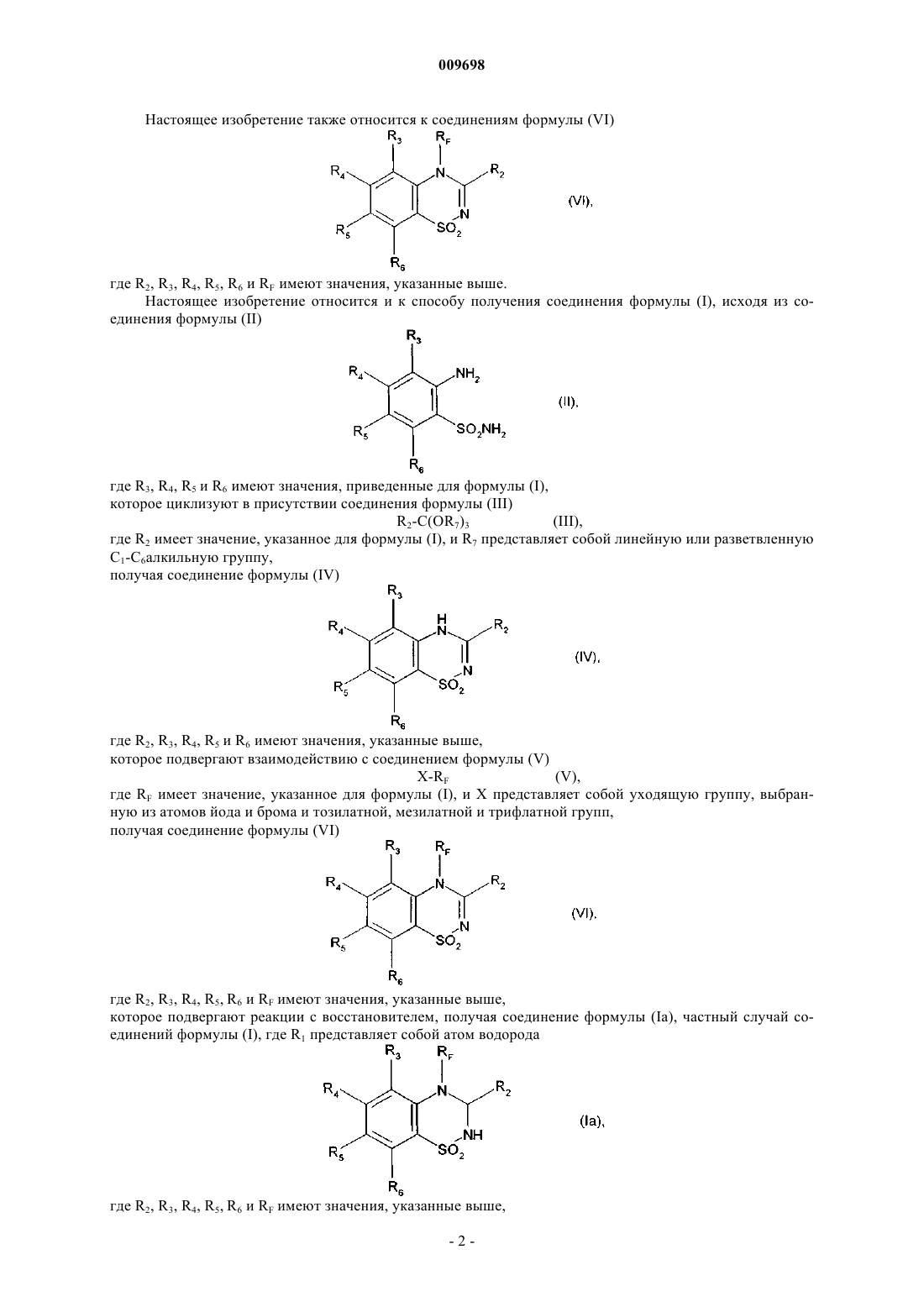
1. Фторированные соединения бензотиадиазина формулы (I)
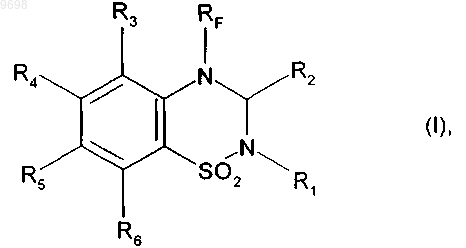
в которой RF представляет собой линейную или разветвленную монофтор- или полифтор-C1-C6алкильную группу,
R1 представляет собой атом водорода или группу, выбранную из линейного или разветвленного C1-C6алкила и из линейного или разветвленного C1-C6алкиламинокарбонила,
R2 представляет собой атом водорода,
R3, R4, R5 и R6, которые могут быть одинаковыми или разными, каждый представляет собой атом или группу, выбранный(ую) из атомов водорода и галогена и нитрогруппы, линейного или разветвленного C1-C6алкилсульфонила, линейного или разветвленного C1-C6алкокси и линейного или разветвленного C1-C6алкила, необязательно замещенного одним или несколькими атомами галогена,
а также их соли присоединения с фармацевтически приемлемой кислотой или основанием, и подразумевают, что R3 представляет собой атом водорода, если R6 не представляет собой атом водорода.
2. Фторированные соединения бензотиадиазина формулы (I) в соответствии с п.1, отличающиеся тем, что RF представляет собой линейную или разветвленную монофтор-C1-C6алкильную группу.
3. Фторированные соединения бензотиадиазина формулы (I) в соответствии с п.2, отличающиеся тем, что RF представляет собой фторметильную, 2-фторэтильную, 3-фторпропильную или 4-фторбутильную группу.
4. Фторированные соединения бензотиадиазина формулы (I) в соответствии с п.1, отличающиеся тем, что RF представляет собой 2,2-дифторэтильную или 2,2,2-трифторэтильную группу.
5. Фторированные соединения бензотиадиазина формулы (I) в соответствии с любым из пп.1-4, отличающиеся тем, что R1 представляет собой атом водорода.
6. Фторированные соединения бензотиадиазина формулы (I) в соответствии с любым из пп.1-5, отличающиеся тем, что R3 представляет собой атом водорода.
7. Фторированные соединения бензотиадиазина формулы (I) в соответствии с любым из пп.1-6, отличающиеся тем, что R4 представляет собой атом водорода или галогена.
8. Фторированные соединения бензотиадиазина формулы (I) в соответствии с любым из пп.1-7, отличающиеся тем, что R5 представляет собой атом галогена.
9. Фторированные соединения бензотиадиазина формулы (I) в соответствии с любым из пп.1-8, отличающиеся тем, что R6 представляет собой атом водорода или галогена.
10. Соединение формулы (I) в соответствии с п.1, которое представляет собой 7-хлор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид.
11. Соединение формулы (I) в соответствии с п.1, которое представляет собой 6,7-дихлор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид.
12. Соединение формулы (I) в соответствии с п.1, которое представляет собой 6-хлор-7-фтор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид.
13. Соединение формулы (I) в соответствии с п.1, которое представляет собой 6-хлор-7-бром-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид.
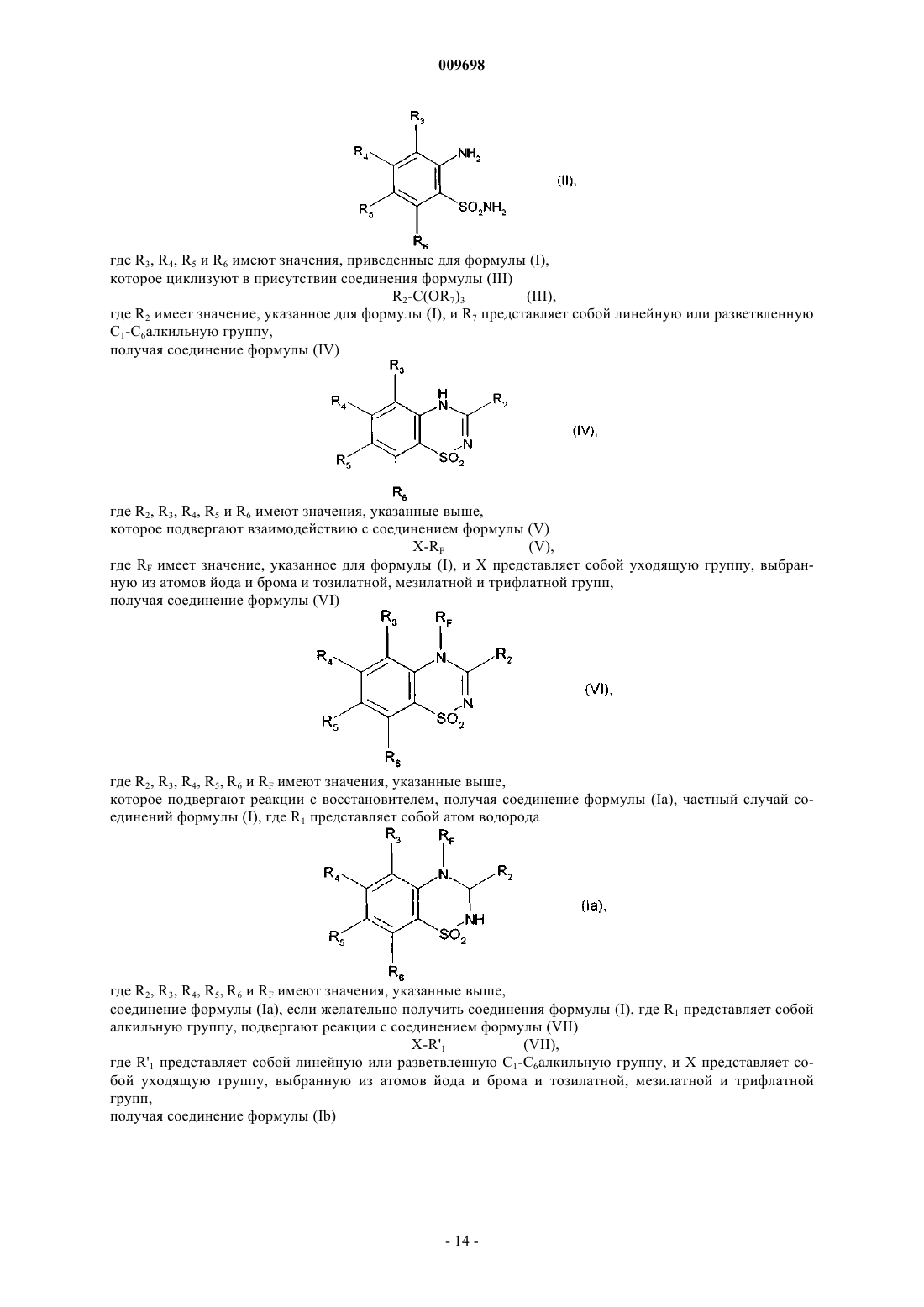
14. Соединение формулы (VI)
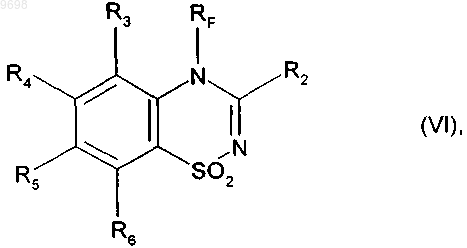
где R2, R3, R4, R5, R6 и RF имеют значения, указанные в п.1.
15. Способ получения соединения формулы (I) в соответствии с п.1, исходя из соединения формулы (II)

где R3, R4, R5 и R6 имеют значения, приведенные для формулы (I),
которое циклизуют в присутствии соединения формулы (III)
| R2-C(OR7)3 | (III), |
где R2 имеет значение, указанное для формулы (I), и R7 представляет собой линейную или разветвленную C1-C6алкильную группу,
получая соединение формулы (IV)
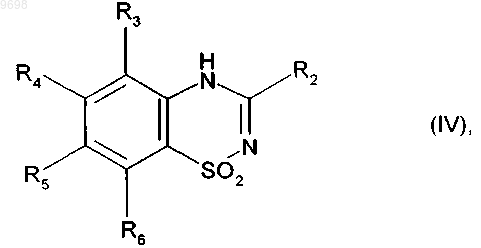
где R2, R3, R4, R5 и R6 имеют значения, указанные выше,
которое подвергают взаимодействию с соединением формулы (V)
| X-RF | (V), |
где RF имеет значение, указанное для формулы (I), и X представляет собой уходящую группу, выбранную из атомов йода и брома и тозилатной, мезилатной и трифлатной групп,
получая соединение формулы (VI)
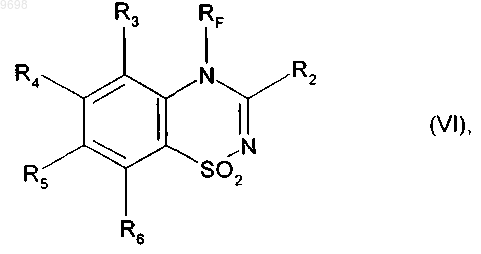
где R2, R3, R4, R5, R6 и RF имеют значения, указанные выше,
которое подвергают реакции с восстановителем, получая соединение формулы (Ia), частный случай соединений формулы (I), где R1 представляет собой атом водорода

где R2, R3, R4, R5, R6 и RF имеют значения, указанные выше,
соединение формулы (Ia), если желательно получить соединения формулы (I), где R1 представляет собой алкильную группу, подвергают реакции с соединением формулы (VII)
| X-R'1 | (VII), |
где R'1 представляет собой линейную или разветвленную C1-C6алкильную группу, и X представляет собой уходящую группу, выбранную из атомов йода и брома и тозилатной, мезилатной и трифлатной групп,
получая соединение формулы (Ib)
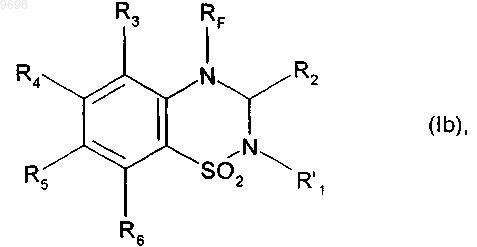
где R2, R3, R4, R5, R6, RF и R'1 имеют значения, указанные выше,
или соединение формулы (Ia), если желательно получить соединения формулы (I), где R1 представляет собой алкиламинокарбонильную группу, подвергают реакции с соединением формулы (VIII)
| R8-N=C=O | (VIII), |
где R8 представляет собой линейную или разветвленную C1-C6алкильную группу,
получая соединение формулы (Ic)
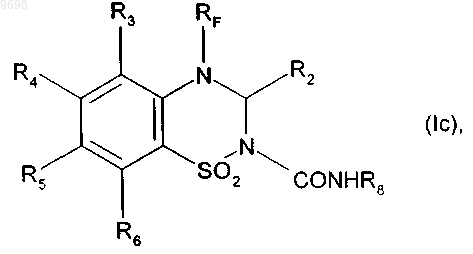
где R2, R3, R4, R5, R6, RF и R8 имеют значения, указанные выше,
соединения формулы (Ia), (Ib) и (Ic) составляют совокупность соединений формулы (I).
16. Фармацевтическая композиция, содержащая в качестве активного компонента соединение в соответствии с любым из пп.1-13 в сочетании с одним или несколькими инертными, нетоксичными, фармацевтически приемлемыми носителями для применения в качестве АМРА модуляторов.
17. Применение соединений формулы (I) в соответствии с любым из пп.1-13 для приготовления лекарственных средств для применения для лечения или профилактики расстройств памяти и познавательной способности, связанных с возрастом, с синдромами тревоги или депрессии, с прогрессирующими нейродегенеративными заболеваниями, болезнью Альцгеймера, болезнью Паркинсона, болезнью Пика, хореей Хантингтоэр, корсаковским психозом, с шизофренией, с последствиями острых нейродегенеративных заболеваний, с деменцией лобной доли и подкорковой деменцией, с последствиями ишемии и с последствиями эпилепсии.
Текст
009698 Настоящее изобретение относится к новым фторированным соединениям бензотиадиазина, к способу их получения, к фармацевтическим композициям, которые их содержат, и к их применению в качестве положительных аллостерических модуляторов АМРА рецепторов. В настоящее время известно, что инициирующие аминокислоты, особенно глутамат, играют очень важную роль в физиологических процессах приспосабливаемости нейронов к воздействиям внешней среды и в механизмах, лежащих в основе обучения и памяти. Патофизиологические исследования свидетельствуют о том, что нарушение в глутаматэргической нейротрансмиссии тесно связано с развитием болезни Альцгеймера (Neuroscience and Biobehavioral reviews, 1992, 16, 13-24; Progress in Neurobiology, 1992, 39, 517-545). Кроме того, во многих исследованиях в последние годы показано, что существуют подтипы рецепторов инициирующих аминокислот и их функциональное взаимодействие (Molecular Neuropharmacology, 1992, 2, 15-31). Среди этих рецепторов рецептор АМРА (-амино-3-гидрокси-5-метил-4-изоксазол-пропионовая кислота) в наибольшей степени вовлечен в процессы физиологической возбудимости нейронов и, в особенности, в те процессы, которые связаны с запоминанием. Например, было показано, что обучаемость связана с увеличением связывания АМРА с его рецептором в гиппокампе, одном из участков головного мозга, который отвечает за процессы памяти и распознавания. Также в последнее время описаны ноотропные средства, такие как анирацетам, в качестве положительных модуляторов рецепторов АМРА нейронов (Journal of Neurochemistry, 1992, 58, 1199-1204). Соединения бензотиадиазина описаны в качестве модуляторов рецепторов АМРА в патентных заявках WO 98/12185 и WO 01/40210. Уже описан синтез новых соединений, представляющих собой модуляторы АМРА рецепторы, который является особенно полезным для повышения эффективности, избирательности и биодоступности соединений. Сущность изобретения Настоящее изобретение относится к фторированным соединениям бензотиадиазина формулы (I) в которой RF представляет собой линейную или разветвленную монофтор- или полифтор-C1C6 алкильную группу,R1 представляет собой атом водорода или группу, выбранную из линейного или разветвленного C1C6 алкила и из линейного или разветвленного C1-C6 алкиламинокарбонила,R2 представляет собой атом водорода,R3, R4, R5 и R6, которые могут быть одинаковыми или разными, каждый представляет собой атом или группу, выбранный(ую) из атомов водорода и галогена и нитрогруппы, линейного или разветвленного C1-C6 алкилсульфонила, линейного или разветвленного C1-C6 алкокси и линейного или разветвленногоC1-C6 алкила, необязательно замещенного одним или несколькими атомами галогена,а также к их солям присоединения с фармацевтически приемлемой кислотой или основанием, причем подразумевают, что R3 представляет собой атом водорода, если R6 не представляет собой атом водорода. Предпочтительно соединения формулы (I) содержат в качестве заместителя RF линейную или разветвленную монофтор-C1-C6 алкильную группу, которая представляет собой фторметильную, 2 фторэтильную, 3-фторпропильную или 4-фторбутильную группу. Особенно предпочтительно, когда RF представляет собой 2,2-дифторэтильную или 2,2,2-трифторэтильную группу. Предпочтительно, если R1 представляет собой атом водорода, R3 представляет собой атом водорода, R4 представляет собой атом водорода или галогена, R5 представляет собой атом галогена, a R6 представляет собой атом водорода или галогена. Наиболее предпочтительно, когда соединение формулы (I) представляет собой 7-хлор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид,6,7-дихлор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид,6-хлор-7-фтор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид или 6-хлор-7-бром-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид.-1 009698 Настоящее изобретение также относится к соединениям формулы (VI) где R2, R3, R4, R5, R6 и RF имеют значения, указанные выше. Настоящее изобретение относится и к способу получения соединения формулы (I), исходя из соединения формулы (II) где R3, R4, R5 и R6 имеют значения, приведенные для формулы (I),которое циклизуют в присутствии соединения формулы (III)(III),где R2 имеет значение, указанное для формулы (I), и R7 представляет собой линейную или разветвленную(V),где RF имеет значение, указанное для формулы (I), и X представляет собой уходящую группу, выбранную из атомов йода и брома и тозилатной, мезилатной и трифлатной групп,получая соединение формулы (VI) где R2, R3, R4, R5, R6 и RF имеют значения, указанные выше,которое подвергают реакции с восстановителем, получая соединение формулы (Ia), частный случай соединений формулы (I), где R1 представляет собой атом водорода где R2, R3, R4, R5, R6 и RF имеют значения, указанные выше,-2 009698 соединение формулы (Ia), если желательно получить соединения формулы (I), где R1 представляет собой алкильную группу, подвергают реакции с соединением формулы (VII)(VII),где R'1 представляет собой линейную или разветвленную C1-C6 алкильную группу, и X представляет собой уходящую группу, выбранную из атомов йода и брома и тозилатной, мезилатной и трифлатной групп,получая соединение формулы (Ib) где R2, R3, R4, R5, R6, RF и R'1 имеют значения, указанные выше,или соединение формулы (Ia), если желательно получить соединения формулы (I), где R1 представляет собой алкиламинокарбонильную группу, подвергают реакции с соединением формулы (VIII)(VIII),где R8 представляет собой линейную или разветвленную C1-C6 алкильную группу,получая соединение формулы (Ic) где R2, R3, R4, R5, R6, RF и R8 имеют значения, указанные выше,где соединения формулы (Ia), (Ib) и (Ic) составляют совокупность соединений формулы (I). Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей в качестве активного компонента соединение формулы (I), в сочетании с одним или несколькими инертными, нетоксичными, фармацевтически приемлемыми носителями для применения в качестве АМРА модуляторов, а также к применению соединений формулы (I) для приготовления лекарственных средств для применения для лечения или профилактики расстройств памяти и познавательной способности, связанных с возрастом, с синдромами тревоги или депрессии, с прогрессирующими нейродегенеративными заболеваниями, болезнью Альцгеймера, болезнью Паркинсона, болезнью Пика, хореей Хантингтона,корсаковским психозом, с шизофренией, с последствиями острых нейродегенеративных заболеваний, с деменцией лобной доли и подкорковой деменцией, с последствиями ишемии и с последствиями эпилепсии. Раскрытие изобретения Также описаны соединения формулы (I) в которой RF представляет собой линейную или разветвленную монофтор- или полифтор-C1C6 алкильную группу или монофтор- или полифтор-циклоалкилалкильную группу, в которой алкильная часть представляет собой C1-C6 и является линейной или разветвленной, а циклоалкильная часть представляет собой C3-C7,R1 представляет собой атом водорода или группу, выбранную из линейного или разветвленного C1C6 алкила, необязательно замещенного одним или несколькими атомами галогена, предпочтительно фтором, и из линейного или разветвленного C1-C6 алкиламинокарбонила,R2 представляет собой атом водорода или галогена или группу, выбранную из линейного или разветвленного C1-C6 алкила, необязательно замещенного одним или несколькими атомами галогена, и изC3-C7 циклоалкила,R3, R4, R5 и R6, которые могут быть одинаковыми или разными, каждый представляет собой атом или группу, выбранный(ую) из атомов водорода и галогена и нитрогруппы, цианогруппы, линейного или разветвленного C1-C6 алкилсульфонила, гидрокси, линейного или разветвленного C1-C6 алкокси, линейного или разветвленного C1-C6 алкила, необязательно замещенного одним или несколькими атомами галогена, и аминогруппы, необязательно замещенной одной или двумя линейными или разветвленными C1C6 алкильными группами,и также их соли присоединения с фармацевтически приемлемой кислотой или основанием и их оптические изомеры, если они существуют,и подразумевают, что R3 представляет собой атом водорода, если R6 не представляет собой атом водорода. Среди фармацевтически приемлемых кислот можно отметить, но не ограничиваясь только ими, соляную кислоту, бромисто-водородную кислоту, серную кислоту, фосфорную кислоту, уксусную кислоту,трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, щавелевую кислоту, метансульфоновую кислоту, бензолсульфоновую кислоту, камфорную кислоту. Среди фармацевтически приемлемых оснований можно отметить, но не ограничиваясь только ими,гидроокись натрия, гидроокись калия, триэтиламин, трет-бутиламин. Предпочтительными группами RF являются линейные или разветвленные монофтор-C1C6 алкильные группы, и более предпочтительно группы фторметил, 2-фторэтил, 3-фторпропил и 4 фторбутил. Предпочтительными полифторалкильными группами являются 2,2-дифторэтил и 2,2,2 трифторэтил.R1, R2 и R3 предпочтительно каждый представляет собой атом водорода. Если R2 представляет собой атом галогена, то он предпочтительно является атомом фтора.R4 и R6 предпочтительно каждый представляет собой атом водорода или галогена.R5 предпочтительно представляет собой атом галогена. Наиболее предпочтительными являются соединения, в которых R4 представляет собой атом водорода и R5 представляет собой атом галогена, и соединения, в которых R4 и R5 каждый представляет собой атом галогена. Предпочтительными соединениями в соответствии с изобретением являются 7-хлор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид,6,7-дихлор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид,6-хлор-7-фтор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид и 6-хлор-7-бром-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Также описан способ получения соединений формулы (I), исходя из соединения формулы (II) где R3, R4, R5 и R6 имеют значения, приведенные для формулы (I),которое циклизуют в присутствии соединения формулы (III)(III),где R2 имеет значение, указанное для формулы (I), и R7 представляет собой линейную или разветвленную где R2, R3, R4, R5 и R6 имеют значения, указанные выше,-4 009698 которое подвергают взаимодействию с соединением формулы (V)(V),X-RF где RF имеет значение, указанное для формулы (I), и X представляет собой уходящую группу, выбранную из атомов йода и брома и тозилатной, мезилатной и трифлатной групп,получая соединение формулы (VI) где R2, R3, R4, R5, R6 и RF имеют значения, указанные выше,которое подвергают реакции с восстановителем, получая соединение формулы (Ia), частный случай соединений формулы (I), где R1 представляет собой атом водорода где R2, R3, R4, R5, R6 и RF имеют значения, указанные выше,соединение формулы (Ia), если желательно получить соединения формулы (I), где R1 представляет собой необязательно замещенную алкильную группу, подвергают реакции с соединением формулы (VII) Х-R'1(VII),где R'1 представляет собой линейную или разветвленную C1-C6 алкильную группу, необязательно замещенную одним или несколькими атомами галогена, и X представляет собой уходящую группу, выбранную из атомов йода и брома и тозилатной, мезилатной и трифлатной групп,получая соединение формулы (Ib) где R2, R3, R4, R5, R6, RF и R'1 имеют значения, указанные выше,или соединение формулы (Ia), если желательно получить соединения формулы (I), в которых R1 представляет собой алкиламинокарбонильную группу, подвергают реакции с соединением формулы (VIII)(VIII),где R8 представляет собой линейную или разветвленную C1-C6 алкильную группу,получая соединение формулы (Ic) где R2, R3, R4, R5, R6, RF и R8 имеют значения, указанные выше,соединения формулы (Ia), (Ib) и (Ic) составляют совокупность соединений формулы (I). Соединение формулы (II) может быть получено при помощи способа, описанного Girard и др. (J.Chem. Soc. Perkin I, 1979, 1043-1047), или путем хлорсульфонирования подходящего анилина при помощи хлорсульфоновой кислоты с последующим превращением полученного сульфонилхлорида в соответствующий сульфонамид, используя гидроокись аммония.-5 009698 Соединения формулы (VI) являются новыми и, являясь промежуточными продуктами для синтеза соединений формулы (I), также представляют собой часть изобретения. Соединения формулы (VIa), частный случай соединений формулы (VI), в которой RF представляет собой монофтор- или полифтор-C2-C6 алкильную группу где R2, R3, R4, R5 и R6 имеют значения, приведенные для формулы (I), и R'F представляет собой монофтор- или полифтор-C1-C5 алкильную группу,также могут быть получены путем ацилирования соединения формулы (II) в присутствии соединения формулы (IX) где R3, R4, R5, R6 и R'F имеют значения, указанные выше,которое подвергают реакции с литийалюминийгидридом, получая соединение формулы (XI) где R3, R4, R5, R6 и R'F имеют значения, указанные выше,которое циклизуют в присутствии соединения формулы (III), получая соединение формулы (VIa). Соединения согласно настоящему изобретению обладают активирующим действием по отношению к рецепторам АМРА, что делает их пригодными для лечения или профилактики расстройств памяти и познавательной способности, связанных с возрастом, с синдромами тревоги или депрессии, с прогрессирующими нейродегенеративными заболеваниями, болезнью Альцгеймера, болезнью Паркинсона, болезнью Пика (предстарческой органической атрофией мозга), хореей Хантингтона, корсаковским психозом,с шизофренией, с последствиями острых нейродегенеративных заболеваний, с деменцией лобной доли и подкорковой деменцией, с последствиями ишемии и с последствиями эпилепсии. Также описаны фармацевтические композиции, которые содержат в качестве активного компонента по крайней мере одно соединение формулы (I) совместно с одним или более подходящими, инертными,нетоксичными наполнителями. Среди фармацевтических композиций особенно можно отметить те, которые являются пригодными для перорального, парентерального (внутривенного или подкожного) или назального введения, таблетки или драже, подъязычные таблетки, желатиновые капсулы, лепешки, суппозитории, кремы, мази, кожные гели, составы для инъекций и суспензии для питья. Полезная дозировка может изменяться в зависимости от природы и тяжести расстройства, пути введения, а также от возраста и веса пациента, и находится в диапазоне от 0,01 до 500 мг в сутки на одно или больше введений. Последующие примеры подтверждают изобретение. Используемые исходные вещества являются известными продуктами или их получают в соответствии с известными способами.-6 009698 Структуры соединений, описанных в примерах, были определены в соответствии с обычными спектрофотометрическими способами (инфракрасная спектрометрия, ядерный магнитный резонанс, массспектрометрия). Пример 1. 7-Хлор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Этап А. 7-Хлор-4H-1,2,4-бензотиадиазин 1,1-диоксид. 40 мл этилортоформиата добавляли к 4,75 г 2-амино-5-хлорбензолсульфонамида, получение которого описано в журнале J. Chem. Soc. Perkin I, 1979, 1043-1047. Смесь нагревали при 110 С в течение 30 мин в открытом сосуде. Сначала наблюдали растворение, а затем появление осадка. После этого объем реакционной смеси уменьшали в два раза при пониженном давлении. Полученный осадок собирали путем фильтрации и затем промывали простым эфиром и высушивали, получая ожидаемое соединение в виде белых кристаллов при выходе 85-90%. Точка плавления: 243-244 С. Этап В. 7-Хлор-4-(2-фторэтил)-4 Н-1,2,4-бензотиадиазин 1,1-диоксид. 600 мг соединения, полученного на предыдущем этапе, растворяли при помощи нагревания в 15 мл ацетонитрила; затем добавляли 1,2 г карбоната калия и 0,6 мл 1-фтор-2-йодэтана и реакционную смесь нагревали при 70 С в герметично закрытом сосуде, при перемешивании, в течение 30 ч. После этого растворители удаляли при пониженном давлении. Полученный таким образом твердый остаток ресуспендировали в 5 мл воды и сразу собирали на фильтре. Содержимое фильтра несколько раз промывали водой,высушивали и затем суспендировали в небольшом количестве этилацетата и собирали на фильтре. Полученный таким образом порошок перекристаллизовывали из теплого ацетона, получая указанное в заглавии соединение при выходе 75-80%. Точка плавления: 211-218 С. Этап С. 7-Хлор-4-(2-фторэтил)-3,4-дигидро-2 Н-1,2,4-бензотиадиазин 1,1-диоксид. К 500 мг соединения, полученного на предыдущем этапе, растворенного в 25 мл изопропанола, добавляли 750 мг боргидрида натрия и затем смесь нагревали при 50 С в течение 40 мин. После этого растворитель удаляли при пониженном давлении; затем полученный остаток ресуспендировали в 10 мл воды, охлаждали на ледяной бане и значение pH доводили до 5 путем добавления концентрированной соляной кислоты. После экстракции хлороформом объединенные органические фазы высушивали, фильтровали и выпаривали, и полученный остаток кристаллизовали из метанола, получая, после фильтрации и последующего высушивания, ожидаемое соединение при выходе 85%. Точка плавления: 120-121 С. Пример 2. 7-Хлор-4-(2-фторэтил)-2-метил-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. 360 мг соединения из примера 1 вносили в 8 мл ацетонитрила. Затем добавляли 600 мг карбоната калия, а также 0,5 мл метилйодида. Раствор нагревали при 55 С в течение 5 ч. После этого растворитель удаляли при пониженном давлении и остаток суспендировали в 5 мл воды. Нерастворимое вещество собирали путем фильтрации, промывали водой и затем высушивали. После этого остаток перекристаллизовывали из метанола путем нагревания. После охлаждения полученный осадок собирали путем фильтрации, промывали небольшим количеством холодного метанола и высушивали, получая ожидаемое соединение. Точка плавления: 112-114 С. Пример 3. 7-Фтор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Этап А. 2-Амино-5-фторбензолсульфонамид. Ожидаемое соединение получали, исходя из 4-фторанилина, в соответствии с методикой, описанной в J. Chem. Soc. Perkin I, 1979, 1043-1047. Этап В. 7-Фтор-4-(2-фторэтил)-4 Н-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапах А и В примера 1, исходя из соединения, полученного на предыдущем этапе. Точка плавления: 197-198 С. Этап С. 7-Фтор-4-(2-фторэтил)-3,4-дигидро-2 Н-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе С примера 1, исходя из соединения, полученного на предыдущем этапе. Точка плавления: 133-134 С. Пример 4. 6,7-Дихлор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Этап А. 2-Амино-4,5-дихлорбензолсульфонамид. Ожидаемое соединение получали, исходя из 3,4-дихлоранилина, путем хлорсульфонирования в соответствии с методикой, описанной в J. Med. Chem. 1971, 15, 118-120, с последующим превращением полученного сульфонилхлорида в сульфонамид при помощи гидроокиси аммония. Этап В. 6,7-Дихлор-4-(2-фторэтил)-4H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапах А и В примера 1, исходя из соединения, полученного на предыдущем этапе. Точка плавления: 233-234 С. Этап С. 6,7-Дихлор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид.-7 009698 Ожидаемое соединение получали в соответствии с методикой, описанной на этапе С примера 1, исходя из соединения, полученного на предыдущем этапе. Точка плавления: 156-157 С. Пример 5. 6-Хлор-7-фтор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Этап А. 6-Хлор-7-фтор-4-(2-фторэтил)-4H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапах А и В примера 4, исходя из 3-хлор-4-фторанилина. Точка плавления: 195-196 С. Этап В. 6-Хлор-7-фтор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе С примера 1, исходя из соединения, полученного на предыдущем этапе. Точка плавления: 183-184 С. Пример 6. 6-Хлор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Этап А. 6-Хлор-4-(2-фторэтил)-4H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапах А и В примера 3, исходя из 3-хлоранилина. Точка плавления: 182-184 С. Этап В. 6-Хлор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе С примера 1, исходя из соединения, полученного на предыдущем этапе. Точка плавления: 171-175 С. Пример 7. 6-Фтор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Этап А. 6-Фтор-4-(2-фторэтил)-4H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапах А и В примера 3, исходя из 3-фторанилина. Точка плавления: 155-160 С. Этап В. 6-Фтор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе С примера 1, исходя из соединения, полученного на предыдущем этапе. Точка плавления: 107-109 С. Пример 8. 7-Бром-6-хлор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Этап А. 7-Бром-6-хлор-4-(2-фторэтил)-4H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапах А и В примера 4, исходя из 4-бром-3-хлоранилина. Точка плавления: 219-224 С. Этап В. 7-Бром-6-хлор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе С примера 1, исходя из соединения, полученного на предыдущем этапе. Точка плавления: 159-162 С. Пример 9. 4-(2-Фторэтил)-7-метил-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Этап А. 4-(2-Фторэтил)-7-метил-4H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапах А и В примера 1, исходя из 2-амино-5-метилбензолсульфонамида, получение которого описано в J. Chem. Soc. Perkin I,1979, 1043-1047. Точка плавления: 179-184C. Этап В. 4-(2-Фторэтил)-7-метил-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе С примера 1, исходя из соединения, полученного на предыдущем этапе. Точка плавления: 88-90 С. Пример 10. 7-Хлор-4-(4-фторбутил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Этап А. 7-Хлор-4-(4-фторбутил)-4H-1,2,4-бензотиадиазин 1,1-диоксид. 150 мг соединения, полученного на этапе А примера 1, растворяли в 8 мл ацетонитрила, к которому добавляли 300 мг K2CO3 и 0,15 мл 1-бром-4-фторбутана. Реакционную смесь вносили в герметичный автоклав и нагревали при 100 С в течение 3 ч. После охлаждения растворитель выпаривали при пониженном давлении и остаток ресуспендировали в небольшом количестве воды. Нерастворимое вещество собирали путем фильтрации, промывали водой и высушивали. Затем осадок перекристаллизовали из небольшого количества этилацетата при помощи нагревания. После охлаждения указанное в заглавии соединение собирали путем фильтрации, промывали небольшим количеством этилацетата и высушивали. Точка плавления: 135-138 С. Этап В. 7-Хлор-4-(4-фторбутил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе С примера 1, исходя из соединения, полученного на предыдущем этапе.-8 009698 Точка плавления: 154-156 С. Пример 11. 6,8-Дихлор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Этап А. 6,8-Дихлор-4-(2-фторэтил)-4H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапах А и В примера 3, исходя из 3,5-дихлоранилина. Этап В. 6,8-Дихлор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе С примера 1, исходя из соединения, полученного на предыдущем этапе. Точка плавления: 180-184 С. Пример 12. 7-Хлор-4-(3-фторпропил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Этап А. 7-Хлор-4-(3-фторпропил)-4H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе А примера 10,заменяя 1-бром-4-фторбутан 1-бром-3-фторпропаном. Точка плавления: 209-212 С. Этап В. 7-Хлор-4-(3-фторпропил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе С примера 1, исходя из соединения, полученного на предыдущем этапе. Точка плавления: 143-145 С. Пример 13. 7-Хлор-4-(фторметил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Этап А. 7-Хлор-4-(фторметил)-4H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе А примера 10,заменяя 1-бром-4-фторбутан бромфторметаном. Точка плавления: 227-232 С. Этап В. 7-Хлор-4-(фторметил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе С примера 1, исходя из соединения, полученного на предыдущем этапе. Пример 14. 7-Бром-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Этап А. 7-Бром-4-(2-фторэтил)-4H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапах А и В примера 3, исходя из 4-броманилина. Точка плавления: 229-232 С. Этап В. 7-Бром-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе С примера 1, исходя из соединения, полученного на предыдущем этапе. Точка плавления: 122-124 С. Пример 15. 7-Йод-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Этап А. 7-Йод-4-(2-фторэтил)-4H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапах А и В примера 3, исходя из 4-йоданилина. Точка плавления: 220-223 С. Этап В. 7-Йод-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе С примера 1, исходя из соединения, полученного на предыдущем этапе. Точка плавления: 156-158 С. Пример 16. 4-(2-Фторэтил)-7-нитро-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Этап А. 4-(2-Фторэтил)-7-нитро-4H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапах А и В примера 3, исходя из 4-нитроанилина. Этап В. 4-(2-Фторэтил)-7-нитро-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе С примера 1, исходя из соединения, полученного на предыдущем этапе. Точка плавления: 165-166 С. Пример 17. 7-Нитро-4-(2,2,2-трифторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Этап А. 7-Нитро-4-(2,2,2-трифторэтил)-4H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапах А и В примера 3, исходя из 4-нитроанилина и 1,1,1-трифтор-2-йодэтана. Этап В. 7-Нитро-4-(2,2,2-трифторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе С примера 1, исходя из соединения, полученного на предыдущем этапе. Точка плавления: 191-193 С. Пример 18. 7-Хлор-4-(2,2-дифторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Этап А. 5-Хлор-2-(2,2-дифторацетамидо)бензолсульфонамид.-9 009698 К 1 г 2-амино-5-хлорбензолсульфонамида (полученного в соответствии с J. Chem. Soc. Perkin I,1979, 1043-1047), растворенного в 4 мл диоксана, добавляли, в охлажденном состоянии (+5 С), 0,6 мл пиридина и 0,6 мл хлорида дифторуксусной кислоты. Колбу сразу герметически закрывали и интенсивно перемешивали при температуре окружающей среды в течение 10 мин. После этого растворители удаляли при пониженном давлении. Твердый остаток ресуспендировали в воде (12 мл) и нерастворимое вещество собирали путем фильтрации, промывали водой и высушивали, получая ожидаемое соединение. Точка плавления: 180-181 С. Этап В. 5-Хлор-2-(2,2-дифторэтиламино)бензолсульфонамид. 1 г соединения, полученного на предыдущем этапе, суспендировали в 15 мл безводного простого эфира; и к нему добавляли 500 мг LiAlH4. Смесь перемешивали. Через 30 мин смесь охлаждали на ледяной бане и медленно добавляли воду; затем смесь подкисляли до pH 4 путем добавления концентрированной HCl. Смесь экстрагировали этилацетатом; органические фазы высушивали, удаляли при пониженном давлении. Затем безводный остаток перекристаллизовывали из смеси ацетон/вода (1:10). Точка плавления: 127-131 С. Этап С. 7-Хлор-4-(2,2-дифторэтил)-4H-1,2,4-бензотиадиазин 1,1-диоксид. 300 мг соединения, полученного на предыдущем этапе, суспендировали в 1,5 мл этилортоформиата. Смесь нагревали при 180 С в открытом сосуде в течение 45 мин. После охлаждения образованное нерастворимое вещество собирали путем фильтрации и несколько раз промывали диэтиловым эфиром и высушивали. Точка плавления: 183-186 С. Этап D. 7-Хлор-4-(2,2-дифторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. 250 мг соединения, полученного на предыдущем этапе, растворяли при помощи нагревания в 15 мл изопропанола. К раствору добавляли 370 мг тонкоизмельченного NaBH4, который затем нагревали при 60 С в течение 20 мин. После этого растворитель выпаривали при пониженном давлении и остаток ресуспендировали в 10 мл воды. Значение pH полученной суспензии доводили до 5 при помощи 6 н. HCl и три раза экстрагировали хлороформом. Органическую фазу высушивали над сульфатом магния и выпаривали при пониженном давлении. Затем остаток перекристаллизовывали из метанола при помощи нагревания. После охлаждения полученный осадок собирали путем фильтрации, промывали холодным метанолом и высушивали. Точка плавления: 126-128 С. Пример 19. 6,7-Дифтор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Этап А. 6,7-Дифтор-4-(2-фторэтил)-4H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапах А и В примера 3, исходя из 3,4-дифторанилина. Точка плавления: 198-202 С. Этап В. 6,7-Дифтор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе С примера 1, исходя из соединения, полученного на предыдущем этапе. Точка плавления: 128-130 С. Пример 20. 7-Хлор-2-этиламинокарбонил-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1 диоксид. К 500 мг соединения из примера 1, растворенного в 2,5 мл ацетонитрила, добавляли 0,5 мл триэтиламина и 2,5 мл этилизоцианата. Реакционную смесь перемешивали при температуре окружающей среды в течение 5 ч. После этого растворитель удаляли при пониженном давлении. Остаток ресуспендировали в 10 мл ацетона; к полученному раствору добавляли древесный уголь, после этого раствор фильтровали,затем к фильтрату добавляли воду. Полученный осадок собирали путем фильтрации, промывали водой и высушивали. Точка плавления: 138-140 С. Пример 21. 6,7-Дихлор-4-(3-фторпропил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Этап А. 6,7-Дихлор-4 Н-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе А примера 1, исходя из соединения, полученного на этапе А примера 4. Этап В. 6,7-Дихлор-4-(3-фторпропил)-4 Н-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе А примера 12,исходя из соединения, полученного на предыдущем этапе. Этап С. 6,7-Дихлор-4-(3-фторпропил)-3,4-дигидро-2 Н-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе С примера 1, исходя из соединения, полученного на предыдущем этапе. Точка плавления: 180-182 С. Пример 22. 6,7-Дихлор-4-(4-фторбутил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Этап А. 6,7-Дихлор-4-(4-фторбутил)-4 Н-1,2,4-бензотиадиазин 1,1-диоксид.- 10009698 Ожидаемое соединение получали в соответствии с методикой, описанной на этапе А примера 10,исходя из соединения, полученного на этапе А примера 21. Этап В. 6,7-Дихлор-4-(4-фторбутил)-3,4-дигидро-2 Н-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе С примера 1, исходя из соединения, полученного на предыдущем этапе. Точка плавления: 141-143 С. Пример 23. 4-(2-Фторэтил)-7-(метилсульфонил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Этап А. 4-(2-Фторэтил)-7-(метилсульфонил)-4 Н-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапах А и В примера 1, исходя из 2-амино-5-(метилсульфонил)бензолсульфонамида. Этап В. 4-(2-Фторэтил)-7-(метилсульфонил)-3,4-дигидро-2 Н-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной на этапе С примера 1, исходя из соединения, полученного на предыдущем этапе. Точка плавления: 193-195 С. Пример 24. 6,7-Дихлор-4-(2,2-дифторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой из примера 18, заменяя, на этапе А, 2 амино-5-хлорбензолсульфонамид соединением, полученным на этапе А примера 4. Точка плавления: 141-145 С. Пример 25. 7-Хлор-4-(2,2-дифторэтил-6-фтор)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой из примера 18, заменяя, на этапе А, 2 амино-5-хлорбензолсульфонамид 2-амино-5-хлор-4-фторбензолсульфонамидом. Точка плавления: 155-159 С. Пример 26. 8-Хлор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной в примере 1, исходя из 2 амино-6-хлорбензолсульфонамида и 1-фтор-2-йодэтана. Пример 27. 4-(2-Фторэтил)-7-(трифторметил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной в примере 1, исходя из 2 амино-5-(трифторметил)бензолсульфонамида и 1-фтор-2-йодэтана. Пример 28. 4-(2-Фторэтил)-7-метокси-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной в примере 1, исходя из 2 амино-5-метоксибензолсульфонамида и 1-фтор-2-йодэтана. Пример 29. 7-Хлор-4-(2,2,2-трифторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной в примере 1, исходя из 2 амино-5-хлорбензолсульфонамида и 1,1,1-трифтор-2-йодэтана. Пример 30. 4-(2-Фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной в примере 1, исходя из 2 амино-бензолсульфонамида и 1-фтор-2-йодэтана. Пример 31. 7,8-Дихлор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной в примере 1, исходя из 2 амино-5,6-дихлорбензолсульфонамида и 1-фтор-2-йодэтана. Точка плавления: 230-232 С. Пример 32. 6,8-Дифтор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной в примере 1, исходя из 2 амино-4,6-дифторбензолсульфонамида и 1-фтор-2-йодэтана. Точка плавления: 146-147 С. Пример 33. 5,8-Дифтор-4-(2-фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Ожидаемое соединение получали в соответствии с методикой, описанной в примере 1, исходя из 2 амино-3,6-дифторбензолсульфонамида и 1-фтор-2-йодэтана. Точка плавления 118-120 С. Фармакологические исследования соединений по изобретению Пример 34. Исследование действия соединений на ионный ток, вызванный АМРА, на ооцитах лягушки. Получали мРНК из коры головного мозга самцов крыс Wistar при помощи способа с использованием хлорида цезия/тиоцианата гуанидина. Выделяли поли-(А+) мРНК при помощи набора для выделения мРНК PolyATtract (Promega, США) и вводили в дозе 50 нг на ооцит. Ооциты инкубировали 3-4 дня при 18 С, чтобы позволить проявиться экспрессии рецепторов и затем хранили при 4 С до использования. Электрофизиологическую регистрацию осуществляли непрерывно при температуре окружающей среды в камере Plexiglass в среде OR2 (J. Exp. Zool., 1973, 184, 321-334) при помощи 2-электродного"voltage-clamp" метода, третий электрод, помещенный в ванну, был контрольным, как описано в ссылке. Все соединения и АМРА применяли при помощи перфузионной среды. (S)-АМРА использовали в концентрации 10 мкМ. Измеряли ионный ток, индуцированный использованием АМРА, при наличии и отсутствии соединений. Для каждого исследуемого соединения определяли концентрацию, которая вы- 11009698 зывает двукратное увеличение (ЕС 2 Х) или пятикратное увеличение (ЕС 5 Х) интенсивности тока, вызванного одним АМРА (5-50 нА). Соединения по изобретению значительно усиливают возбуждающие действия АМРА. Например,соединение из примера 1 обеспечивает ЕС 2 Х при концентрации 6,71,4 мкМ и ЕС 5 Х при концентрации 14,50,6 мкМ. Пример 35. Распознавание предметов у взрослых 3-месячных крыс Wistar. Исследование распознавания предметов у крыс Wistar изначально было разработано ENNACEUR иDELACOUR (Behav. Brain Res., 1988, 31, 47-59). Тест основывается на самопроизвольной исследовательской активности животного и характеризует эпизодическую память у людей. Это исследование памяти чувствительно к старению (SCALI и др., Eur. J. Pharmacol., 1997, 325, 173-180) и нарушению функции холинергической системы (BARTOLINI и др., Pharm. Biochem. Behav. 1996, 53(2), 277-283) и оно основывается на различиях в исследовании 2 объектов с достаточно сходной формой, один из которых является обычным, а другой - новым. Перед исследованием животные (3-месячные самцы крыс Wistar: CERJ,Франция) привыкали к окружающей среде (отделенной от объекта). В течение первого сеанса крыс помещали (3 мин) в отделенное пространство, в котором находилось 2 идентичных объекта. Измеряли продолжительность исследования каждого объекта. В течение второго сеанса (3 мин), который осуществляли через 24 ч, один из двух объектов заменяли новым. Измеряли продолжительность исследования каждого объекта. Критерием оценки являлась разница, дельта, выраженная в секундах, между временем исследования нового объекта и обычного (сходного) объекта в течение второго сеанса. Контрольные животные, которым предварительно за 60 мин до каждого сеанса перорально вводили носитель, исследуют обычный объект и новый объект одинаково, что свидетельствует о том, что объект, введенный ранее,забывается. Животные, которым вводили соединение, улучшающее процессы памяти и познавательные способности, предпочтительно исследуют новый объект, что указывает на то, что объект, введенный ранее, запоминается. Полученные результаты свидетельствуют о том, что соединения по изобретению значительно усиливают запоминание при введении в низких дозах. Например, соединение из примера 1 при пероральном введении в дозе от 0,03 до 1 мг/кг существенно улучшает сохранение объекта в памяти. Пример 36. Распознавание предметов у 17-месячных крыс Wistar. У старых крыс наблюдается недостаточность сохранения объектов в памяти при исследовании распознавания предметов. Перед исследованием животные (17-месячные самцы крыс Wistar: CERJ, Франция) привыкали к окружающей среде (отделенной от объекта). В течение первого сеанса крыс помещали(3 мин) в отделенное пространство, в котором находилось 2 идентичных объекта. Измеряли продолжительность исследования каждого объекта. В течение второго сеанса (3 мин), который осуществляли через 1 ч, один из двух объектов заменяли новым. Измеряли продолжительность исследования каждого объекта. Критерием оценки являлась разница, дельта, выраженная в секундах, между временем исследования нового объекта и обычного (сходного) объекта в течение второго сеанса. Контрольные животные, которым предварительно за 60 мин до каждого сеанса перорально вводили носитель, исследуют обычный объект и новый объект одинаково, что свидетельствует о том, что объект, введенный ранее, забывается. Животные, которым вводили соединение, улучшающее процессы памяти и познавательные способности,предпочтительно исследуют новый объект, что указывает на то, что объект, введенный ранее, запоминается. Полученные результаты свидетельствуют о том, что соединения по изобретению при введении в низких дозах противодействуют возрастной недостаточности сохранения объекта в памяти при исследовании распознавания предметов. Например, при исследовании сохранения объекта в памяти соединение из примера 1 существенно противодействует возрастной недостаточности сохранения объекта в памяти, даже при пероральном введении в дозе 0,1 мг/кг. Пример 37. Фармацевтическая композиция. Состав для приготовления 1000 таблеток, каждая из которых содержит 10 мг активного компонента: соединение из примера 1 10 г гидроксипропилцеллюлоза 2 г картофельный крахмал 10 г лактоза 100 г стеарат магния 3 г тальк 3 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фторированные соединения бензотиадиазина формулы (I) в которой RF представляет собой линейную или разветвленную монофтор- или полифтор-C1C6 алкильную группу,R1 представляет собой атом водорода или группу, выбранную из линейного или разветвленного C1C6 алкила и из линейного или разветвленного C1-C6 алкиламинокарбонила,R2 представляет собой атом водорода,R3, R4, R5 и R6, которые могут быть одинаковыми или разными, каждый представляет собой атом или группу, выбранный(ую) из атомов водорода и галогена и нитрогруппы, линейного или разветвленного C1-C6 алкилсульфонила, линейного или разветвленного C1-C6 алкокси и линейного или разветвленногоC1-C6 алкила, необязательно замещенного одним или несколькими атомами галогена,а также их соли присоединения с фармацевтически приемлемой кислотой или основанием, и подразумевают, что R3 представляет собой атом водорода, если R6 не представляет собой атом водорода. 2. Фторированные соединения бензотиадиазина формулы (I) в соответствии с п.1, отличающиеся тем, что RF представляет собой линейную или разветвленную монофтор-C1-C6 алкильную группу. 3. Фторированные соединения бензотиадиазина формулы (I) в соответствии с п.2, отличающиеся тем, что RF представляет собой фторметильную, 2-фторэтильную, 3-фторпропильную или 4 фторбутильную группу. 4. Фторированные соединения бензотиадиазина формулы (I) в соответствии с п.1, отличающиеся тем, что RF представляет собой 2,2-дифторэтильную или 2,2,2-трифторэтильную группу. 5. Фторированные соединения бензотиадиазина формулы (I) в соответствии с любым из пп.1-4, отличающиеся тем, что R1 представляет собой атом водорода. 6. Фторированные соединения бензотиадиазина формулы (I) в соответствии с любым из пп.1-5, отличающиеся тем, что R3 представляет собой атом водорода. 7. Фторированные соединения бензотиадиазина формулы (I) в соответствии с любым из пп.1-6, отличающиеся тем, что R4 представляет собой атом водорода или галогена. 8. Фторированные соединения бензотиадиазина формулы (I) в соответствии с любым из пп.1-7, отличающиеся тем, что R5 представляет собой атом галогена. 9. Фторированные соединения бензотиадиазина формулы (I) в соответствии с любым из пп.1-8, отличающиеся тем, что R6 представляет собой атом водорода или галогена. 10. Соединение формулы (I) в соответствии с п.1, которое представляет собой 7-хлор-4-(2 фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. 11. Соединение формулы (I) в соответствии с п.1, которое представляет собой 6,7-дихлор-4-(2 фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. 12. Соединение формулы (I) в соответствии с п.1, которое представляет собой 6-хлор-7-фтор-4-(2 фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. 13. Соединение формулы (I) в соответствии с п.1, которое представляет собой 6-хлор-7-бром-4-(2 фторэтил)-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. 14. Соединение формулы (VI) где R2, R3, R4, R5, R6 и RF имеют значения, указанные в п.1. 15. Способ получения соединения формулы (I) в соответствии с п.1, исходя из соединения формулы где R3, R4, R5 и R6 имеют значения, приведенные для формулы (I),которое циклизуют в присутствии соединения формулы (III)(III),где R2 имеет значение, указанное для формулы (I), и R7 представляет собой линейную или разветвленную(V),где RF имеет значение, указанное для формулы (I), и X представляет собой уходящую группу, выбранную из атомов йода и брома и тозилатной, мезилатной и трифлатной групп,получая соединение формулы (VI) где R2, R3, R4, R5, R6 и RF имеют значения, указанные выше,которое подвергают реакции с восстановителем, получая соединение формулы (Ia), частный случай соединений формулы (I), где R1 представляет собой атом водорода где R2, R3, R4, R5, R6 и RF имеют значения, указанные выше,соединение формулы (Ia), если желательно получить соединения формулы (I), где R1 представляет собой алкильную группу, подвергают реакции с соединением формулы (VII)(VII),где R'1 представляет собой линейную или разветвленную C1-C6 алкильную группу, и X представляет собой уходящую группу, выбранную из атомов йода и брома и тозилатной, мезилатной и трифлатной групп,получая соединение формулы (Ib) где R2, R3, R4, R5, R6, RF и R'1 имеют значения, указанные выше,или соединение формулы (Ia), если желательно получить соединения формулы (I), где R1 представляет собой алкиламинокарбонильную группу, подвергают реакции с соединением формулы (VIII)(VIII),где R8 представляет собой линейную или разветвленную C1-C6 алкильную группу,получая соединение формулы (Ic) где R2, R3, R4, R5, R6, RF и R8 имеют значения, указанные выше,соединения формулы (Ia), (Ib) и (Ic) составляют совокупность соединений формулы (I). 16. Фармацевтическая композиция, содержащая в качестве активного компонента соединение в соответствии с любым из пп.1-13 в сочетании с одним или несколькими инертными, нетоксичными, фармацевтически приемлемыми носителями для применения в качестве АМРА модуляторов. 17. Применение соединений формулы (I) в соответствии с любым из пп.1-13 для приготовления лекарственных средств для применения для лечения или профилактики расстройств памяти и познавательной способности, связанных с возрастом, с синдромами тревоги или депрессии, с прогрессирующими нейродегенеративными заболеваниями, болезнью Альцгеймера, болезнью Паркинсона, болезнью Пика,хореей Хантингтона, корсаковским психозом, с шизофренией, с последствиями острых нейродегенеративных заболеваний, с деменцией лобной доли и подкорковой деменцией, с последствиями ишемии и с последствиями эпилепсии.
МПК / Метки
МПК: A61P 25/28, A61K 31/549, C07D 285/24
Метки: способ, содержат, которые, получения, соединения, композиции, фармацевтические, бензотиадиазина, новые, фторированные
Код ссылки
<a href="https://eas.patents.su/16-9698-novye-ftorirovannye-soedineniya-benzotiadiazina-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-kotorye-ih-soderzhat.html" rel="bookmark" title="База патентов Евразийского Союза">Новые фторированные соединения бензотиадиазина, способ их получения и фармацевтические композиции, которые их содержат</a>