Способ получения комплексных оксидов металла
Формула / Реферат
1. Способ получения комплексных оксидов по меньшей мере одного металла, выбираемого из элементов групп 13, 4, 5, 6 и 7 Периодической системы Менделеева, кобальта и никеля с щелочным металлом и/или щелочно-земельным металлом, который включает реакцию оксида по меньшей мере одного металла, выбираемого из группы, состоящей из элементов групп 13, 4, 5, 6 и 7 Периодической системы, кобальта и никеля и/или предшественника оксида металла, или материала, содержащего оксид металла и/или его предшественник, с солью щелочного металла и/или солью щелочно-земельного металла, отличающийся тем, что совместно размалывают смесь оксида металла и/или его предшественника, или смесь материала, содержащего оксид металла и/или его предшественник, с солью щелочного металла и/или солью щелочно-земельного металла до размера частиц для оксида металла и/или его предшественника или для оксида металла и/или материала, содержащего оксид металла и/или предшественник, равного 10 mм или меньше, и нагревают смесь размолотого продукта до температуры по меньшей мере 200шС, но ниже температуры разложения или температуры плавления, в зависимости от того, которая из них ниже, соли щелочного металла и/или соли щелочно-земельного металла таким образом, чтобы инициировать твердофазную реакцию.
2. Способ по п.1, отличающийся тем, что включает стадию экстракции комплексного оксида по меньшей мере одного металла, выбираемого из элементов групп 13, 4, 5, 6 и 7 Периодической системы, кобальта и никеля с щелочным металлом и/или щелочно-земельным металлом из содержащего комплексный оксид продукта реакции с помощью водного растворителя, в результате чего получают комплексный оксид в водном растворителе.
3. Способ по п.1 или 2, отличающийся тем, что необработанная руда, рафинированная руда, зола мусоросжигательной печи, промышленные отходы или непромышленные отходы являются содержащим оксид металла материалом.
4. Способ по п.1 или 2, отличающийся тем, что предшественником оксида металла является ферросплав, сплав, соль или сульфат металла.
5. Способ по п.1 или 2, отличающийся тем, что металлом в оксиде металла является ванадий, цирконий, ниобий, никель или вольфрам.
6. Способ по п.1 или 2, отличающийся тем, что солью щелочного металла и/или солью щелочно-земельного металла является карбонат, галогенид, сульфат, борат или гидроксид.
7. Способ по п.6, отличающийся тем, что солью щелочного металла и/или солью щелочно-земельного металла является карбонат натрия, карбонат калия, сульфат натрия, карбонат кальция или гидроксид натрия.
8. Способ по п.1 или 2, отличающийся тем, что реакция оксида металла и/или предшественника оксида металла или материала, содержащего оксид металла и/или его предшественник, с солью щелочного металла и/или солью щелочно-земельного металла проводится при температуре не ниже 250шС, но ниже температуры разложения или температуры плавления, в зависимости от того, которая из них ниже, соли щелочного металла и/или соли щелочно-земельного металла.
Текст
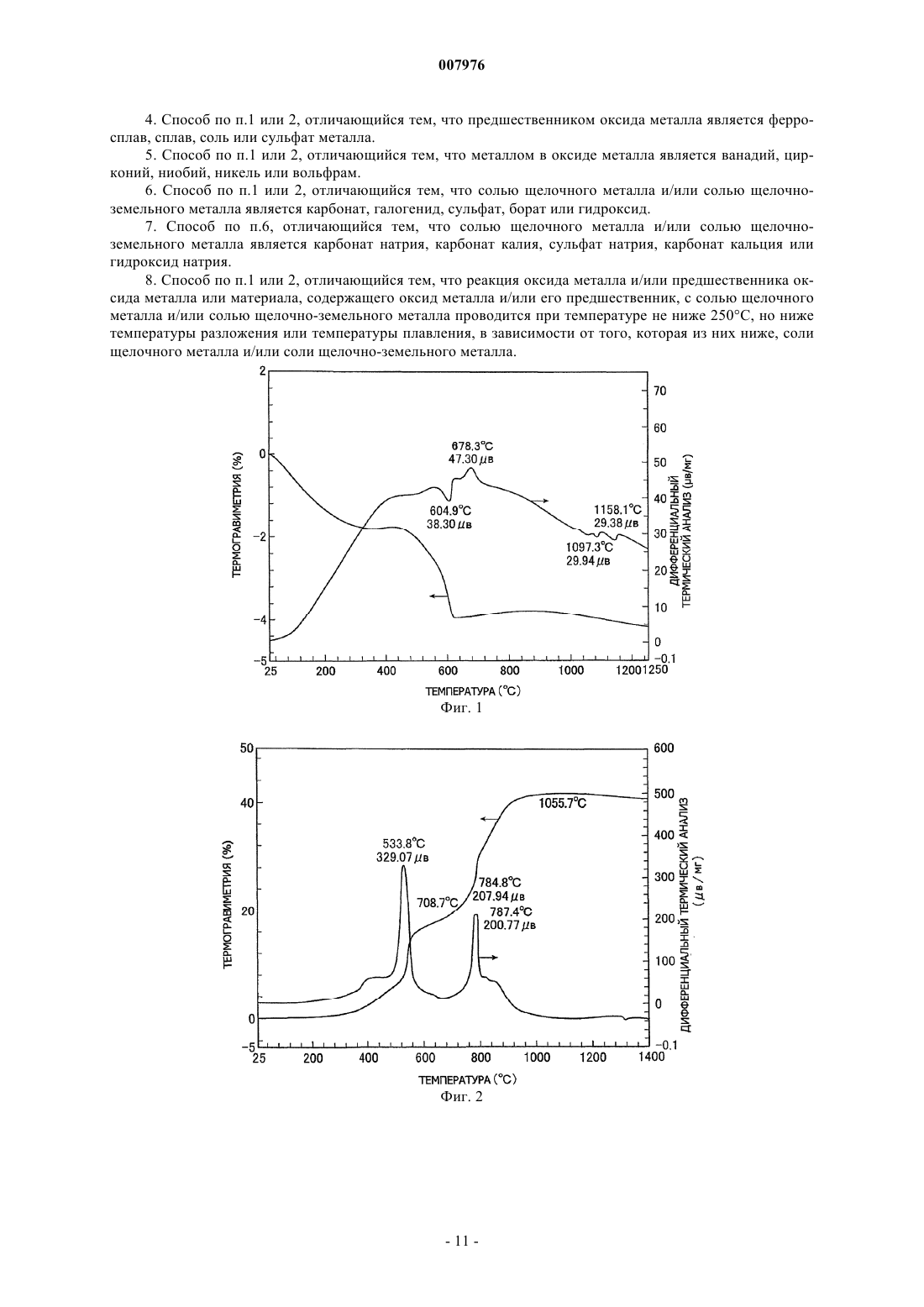
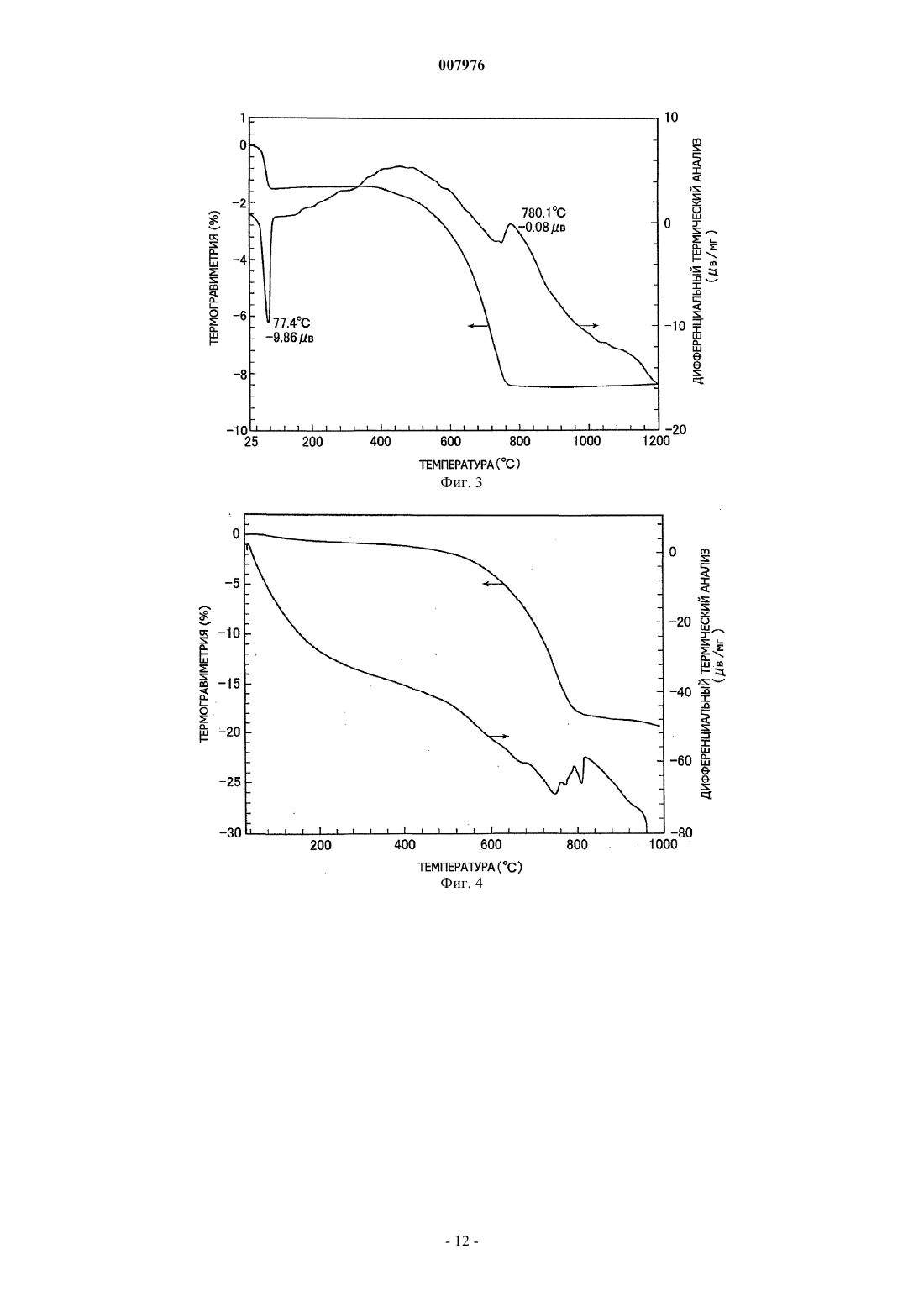
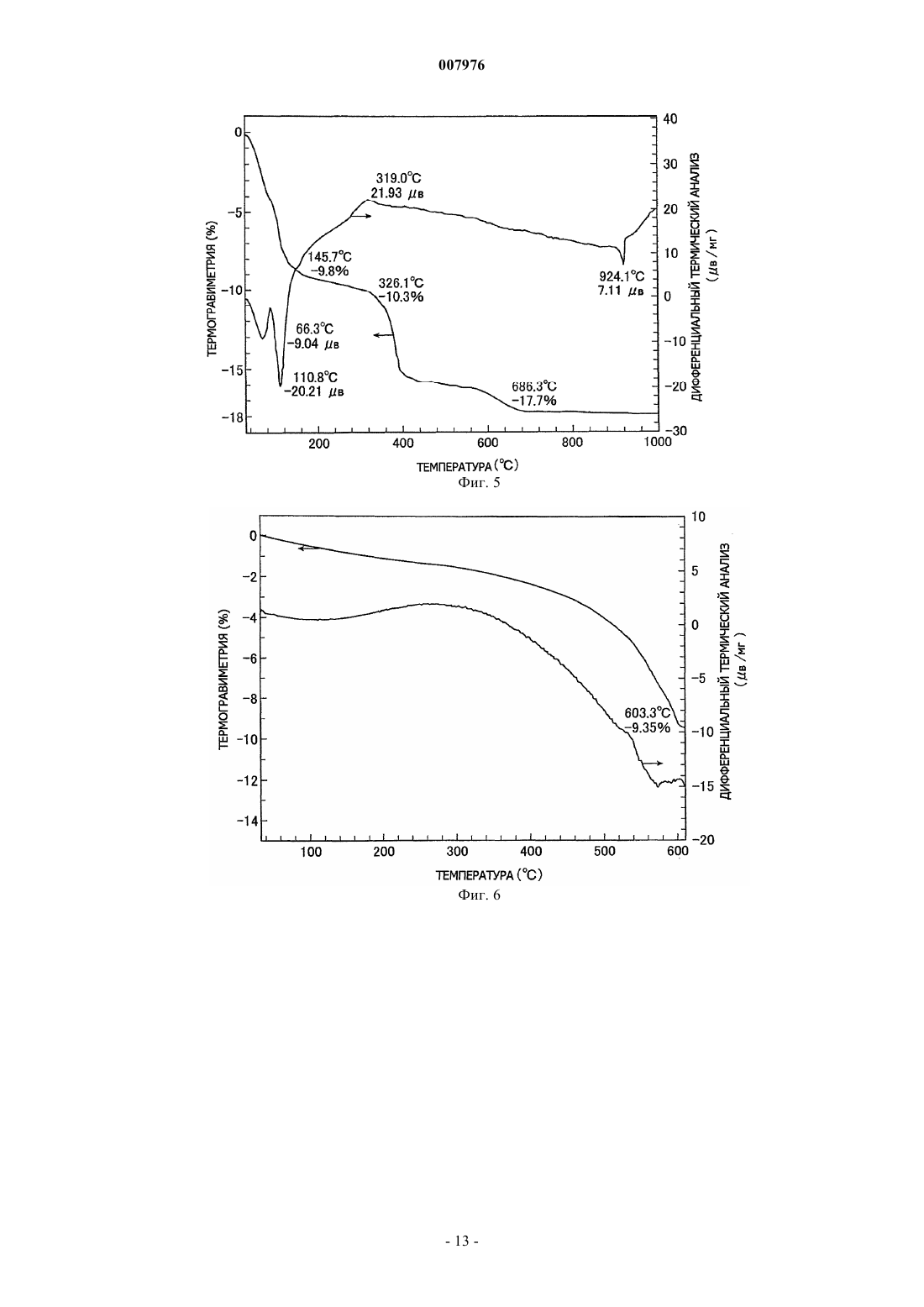
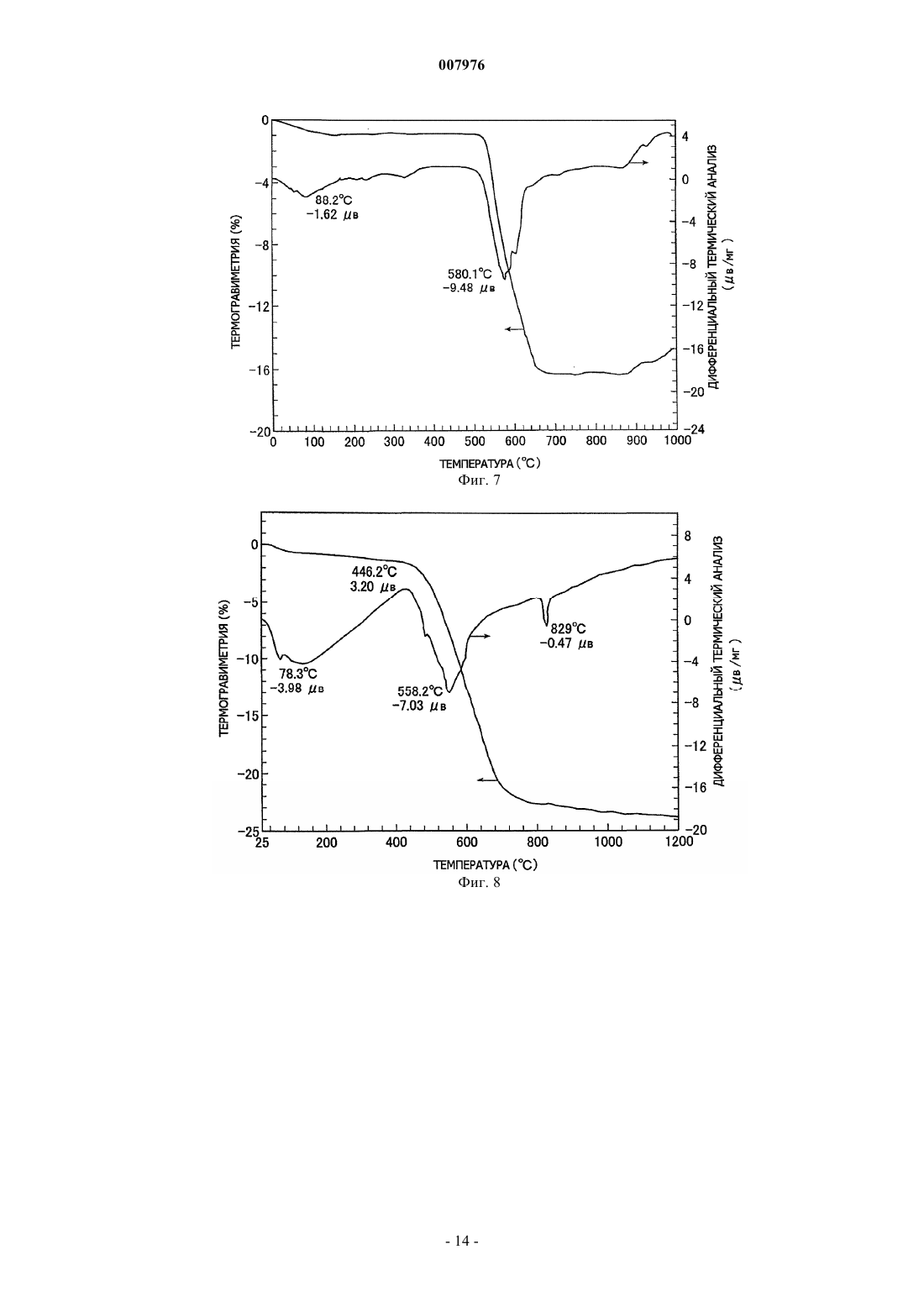
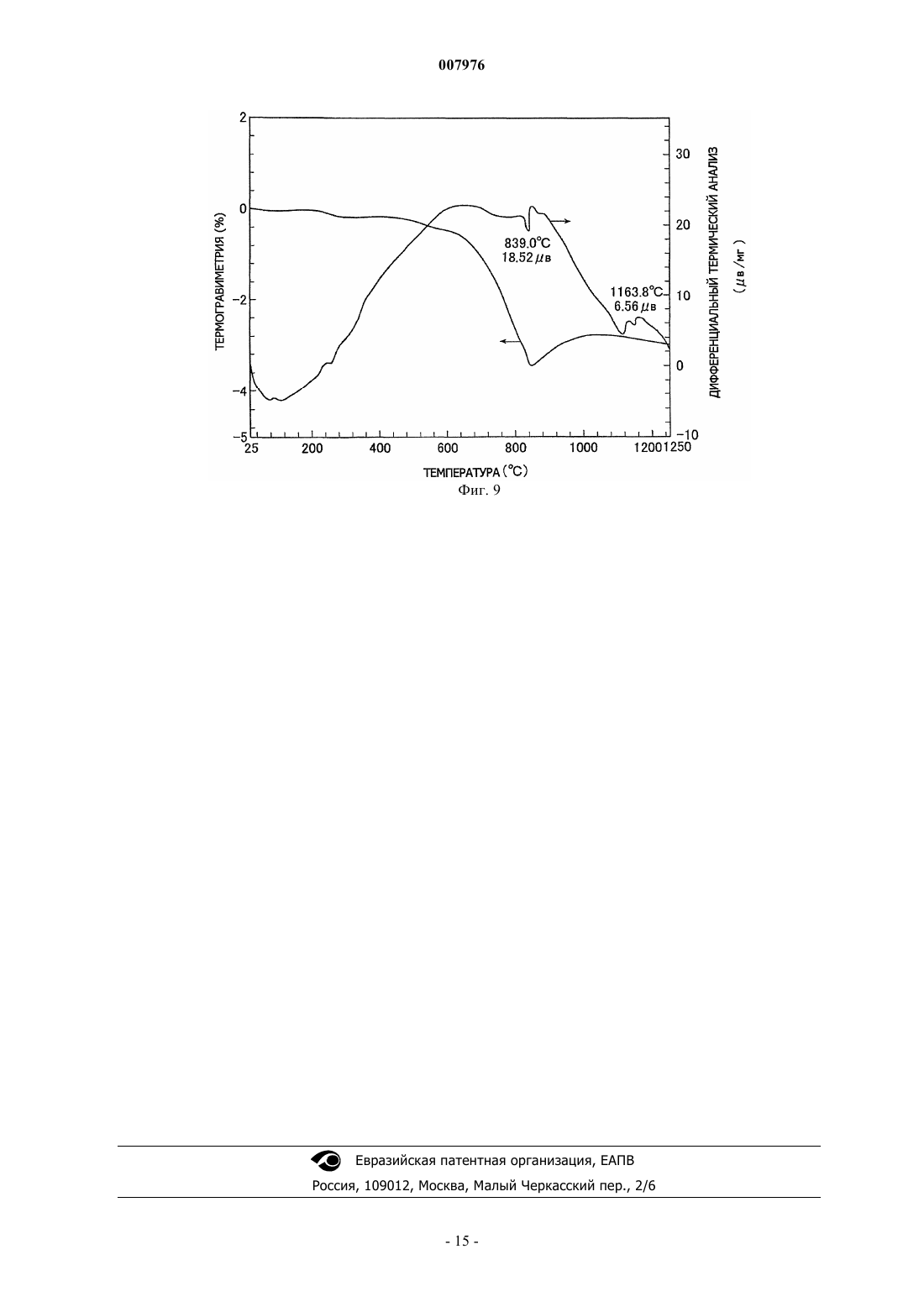
007976 Область техники, к которой относится изобретение Настоящее изобретение относится к способу получения комплексных оксидов металла с помощью щелочного металла и/или щелочно-земельного металла путем проведения твердофазной реакции между оксидом металла и/или его предшественником, или материалом, содержащим оксид металла и/или материалом, содержащим его предшественник, с солью щелочного металла и/или солью щелочно-земельного металла. Предшествующий уровень техники Содержание оксидов металлов и/или их предшественников, содержащихся в необработанной руде,рафинированной руде, золе мусоросжигательной печи и т.п., составляет не более нескольких маc.%. Например, один из известных способов извлечения оксида ванадия из необработанной руды включает: обжиг в течение нескольких часов руды, содержащей оксид ванадия, совместно с кальцинированной содой(карбонатом натрия) в окислительной атмосфере при повышенной температуре от 900 до 1200 С, в результате чего образуется ванадат натрия; экстракцию ванадата натрия водой с получением водного раствора ванадата натрия; и последующую рафинацию, дающую окончательно оксид ванадия (US 3320024). Однако применяемый в способе извлечения нагрев нескольких мас.% оксида ванадия в руде в течение длительного времени при повышенной температуре порядка 1000 С требует больших количеств энергии. Дополнительной проблемой являются большие размеры необходимого оборудования, высокие инвестиционные расходы и строгие технические условия, необходимые для обеспечения долговечности аппаратуры при высокой температуре. Кроме того, поскольку процесс включает высокотемпературную реакцию со щелочью, кирпичи, из которых выполнено оборудование, подвергаются щелочной коррозии,что осложняет техническое обслуживание (JP 2001-519751 А). Подобным же образом при получении комплексного оксида обжигом хромовой руды, содержащей несколько десятков мас.% оксида хрома вместе с соединением щелочного металла, поскольку необходимо нагревать соединение щелочного металла до 1000-1200 С, возникают те же проблемы, которые имеют место в случае оксида ванадия (JP 48-38817 А). Был предложен способ проведения реакции содержащего оксид вольфрама вольфрамита или шеелита с соединением щелочного металла при 500-800 С с получением водорастворимых ценных вольфрамовых материалов, которые после этого экстрагируются водой. Однако такой способ характеризуется низким выходом и, кроме этого, имеется необходимость в нагреве и проведении повторной реакции с остатком экстракции (JP 55-89446 А). Известна также механохимическая обработка, под которой подразумеваются химические процессы,осуществляемые в отсутствие нагрева. Такую обработку обычно проводят путем воздействия механической энергией на твердое вещество, например путем резки ножницами, сжатия, удара, размола, сгибания или растяжки с последующим воздействием на химическое состояние, например путем внесения химических изменений в газообразные и жидкие вещества, окружающие твердое вещество, или непосредственным инициированием или усилением химических изменений между этими газообразными и жидким веществами и поверхностью твердого вещества. Имеются описания различных способов, относящихся к этому типу. Например, в JP 11-71111 А описывается способ экстракции материалов, содержащих редкоземельные металлы, в котором материал, содержащий редкоземельные металлы, механохимически обрабатывают в планетарной мельнице, после чего выщелачивают разбавленной кислотой. В JP 2011-11549 А раскрывается способ выщелачивания индийсодержащего соединения, которое включает механохимическую обработку индийсодержащего соединения в присутствии керамического порошка с последующим выщелачиваем этого соединения разбавленной кислотой при комнатной температуре. Наряду с этим, в JP 11-310442 А раскрывается способ, в котором оксид кальция смешивают с угольной золой и подвергают механохимической обработке, получая в результате этого гидравлически обработанный продукт в порошковой форме. Однако поскольку механохимическая обработка основана на усилении реакций путем точечного контакта на активных центрах на поверхностях твердых веществ, обновляемых при механическом воздействии типа удара, увеличение объема протекающей реакции (т.е. количества продукта) требует того,чтобы были использованы средства для проведения такой обработки в течение длительного периода времени с целью постоянного обновления поверхности. По этой причине названный способ принципиально непригоден для производства в промышленном масштабе. Раскрытие сущности изобретения Заявители обнаружили, что, хотя механохимическая обработка действительно имеет большие проблемы с точки зрения производительности, если такую обработку применить для реакции между оксидом целевого металла и солью щелочного или щелочно-земельного металла и затем продукт такой обработки нагревать до определенной температуры, то реакция после этого будет происходить со скоростью,превышающей ожидаемую скорость. Иными словами, в результате обширных исследований, проведенных с целью использования преимуществ механохимической обработки для повышения производительности, было обнаружено, что нагревание соли щелочного металла или соли щелочно-земельного метал-1 007976 ла, которая была введена в контакт и оставалась в контакте с целевым металлом, который был превращен в тонкие частицы путем размешивания или размола с целью обновления поверхности, соль щелочного металла или соль щелочно-земельного металла диффундирует с твердой поверхности внутрь оксида целевого металла, существенно увеличивая возможность контакта (т.е. возможность для реакции) между оксидом целевого металла и солью щелочного металла или солью щелочно-земельного металла даже внутри твердого материала, повышая тем самым скорость реакции и снижая начальную температуру реакции по сравнению с температурой в способах предшествующего уровня техники. Таким образом, при той же температуре объем протекающей реакции увеличивается, что приводит к более высокой производительности по сравнению с предшествующим уровнем техники. Краткое описание чертежей Фиг. 1 демонстрирует результаты термического анализа, полученные для совместно размолотого ванадийсодержащего магнетита в примере 1 согласно изобретению. Фиг. 2 демонстрирует результаты термического анализа, полученные для размолотого железониобиевого сплава примера 2 согласно изобретению. Фиг. 3 демонстрирует результаты термического анализа, полученные для совместно размолотого ниобата железа в примере 2 согласно изобретению. Фиг. 4 демонстрирует результаты термического анализа, полученные для совместно размолотого ниобата железа в примере 3 согласно изобретению. Фиг. 5 демонстрирует результаты термического анализа, полученные для совместно размолотой вольфрамитсодержащей руды в примере 4 согласно изобретению. Фиг. 6 демонстрирует результаты термического анализа, полученные для совместно размолотой шеелитсодержащей руды в примере 5 согласно изобретению. Фиг. 7 демонстрирует результаты термического анализа, полученные для совместно размолотой гарниеритной руды в примере 6 согласно изобретению. Фиг. 8 демонстрирует результаты термического анализа, полученные для совместно размолотой цирконсодержащей руды в примере 7 согласно изобретению. Фиг. 9 демонстрирует результаты термического анализа, полученные для смеси, содержащей ванадийсодержащий магнетит в сравнительном примере 2 согласно изобретению. Наилучший способ осуществления изобретения В своем первом варианте настоящее изобретение предлагает способ получения комплексного оксида по меньшей мере одного металла, выбираемого из элементов групп 13, 4, 5, 6 и 7 Периодической системы Менделеева, кобальта и никеля с щелочным металлом и/или щелочно-земельным металлом, который включает реакцию оксида по меньшей мере одного металла, выбираемого из группы, состоящей из элементов групп 13, 4, 5, 6 и 7 Периодической системы, кобальта и никеля и/или предшественника оксида металла, или материала, содержащего оксид металла и/или его предшественник, с солью щелочного металла и/или солью щелочно-земельного металла. Способ отличается совместным размолом смеси оксида металла и/или его предшественника, или смеси материала, содержащего оксид металла и/или его предшественник, с солью щелочного металла и/или солью щелочно-земельного металла до размера частиц для оксида металла и/или его предшественника или для оксида металла и/или материала, содержащего предшественник, равного 10 м или меньше, и нагревом совместно размолотого продукта до температуры не ниже 200 С, что инициирует твердофазную реакцию. Способ получения комплексного оксида по изобретению преимущественно включает стадию экстрагирования комплексного оксида по меньшей мере одного металла, выбираемого из элементов групп 13, 4, 5, 6 и 7 Периодической системы, кобальта и никеля с щелочным металлом и/или щелочноземельным металлом из продукта реакции, содержащего комплексный оксид, и, таким образом, извлечения комплексного оксида в водном растворе. В предлагаемом способе получения комплексного оксида содержащим оксид металла материалом является преимущественно необработанная руда, рафинированная руда, зола мусоросжигательной печи,промышленные отходы и непромышленные отходы. В предлагаемом способе получения комплексного оксида предшественником оксида металла преимущественно является ферросплав, сплав или сульфат металла. В предлагаемом способе получения комплексного оксида металлом в оксиде металла преимущественно является ванадий, цирконий, ниобий, никель или вольфрам. В предлагаемом способе получения комплексного оксида солью щелочного металла и/или солью щелочно-земельного металла преимущественно является карбонат, галогенид, сульфат, борат или гидроксид. В предлагаемом способе получения комплексного оксида солью щелочного металла и/или солью щелочно-земельного металла преимущественно является карбонат натрия, карбонат калия, сульфат натрия, карбонат кальция или гидроксид натрия. В предлагаемом способе получения комплексного оксида реакция оксида металла и/или предшественника оксида металла или материала, содержащего оксид металла и/или его предшественник, с солью щелочного металла и/или солью щелочно-земельного металла проводится преимущественно при темпе-2 007976 ратуре не ниже 250 С, но ниже температуры разложения или температуры плавления, в зависимости от того, которая из них ниже, соли щелочного металла и/или соли щелочно-земельного металла. Далее изобретение описывается более полно. Используемое в изобретении размалывающее оборудование не ограничивается каким-либо типом или конструкцией при условии, что оно способно размалывать оксид целевого металла и/или его предшественник, или материал, содержащий оксид металла и/или его предшественник, до размера частиц 10 м или меньше. Иллюстративные примеры включают месилки типа месилок, работающих под давлением, и двухвалковые мельницы. Предпочтительна вибрационная мельница. Условия размола подбираются эмпирически для используемой аппаратуры. Если, например, используется вибрационная мельница, амплитуда вибраций будет меняться в зависимости от того, производится ли работа в периодическом или непрерывном режиме. Помимо этого амплитуда вибраций будет зависеть от емкости бака, хотя движущую силу обычно устанавливают на уровень, обеспечивающий частоту несколько выше 10 Гц. Так, сырье, соль щелочного металла или щелочно-земельного металла, мелющие шары и т.п. помещают в бак, регулируя степень загрузки в соответствии со свойствами сырья,после чего устанавливают условия таким образом, чтобы время совместного размола, необходимого для достижения целевого размера частиц, составляло примерно от 30 мин до 8 ч. Если размол не будет производиться до среднего размера частиц сырья 10 м или меньше, предпочтительно до 5 м или меньше,поверхность сырья будет иметь мало активных центров и количество соли щелочного металла или щелочно-земельного металла, которое окажется в контакте с такими активными центрами, будет небольшим. В результате этого твердофазная реакция между сырьем и солью щелочного металла или щелочноземельного металла на поверхности сырья в процессе совместного размола не будет происходить в достаточной степени и фиксированная граница раздела образовываться не будет. Если такой совместно размолотый продукт затем нагреть, то из-за отсутствия фиксированной границы раздела соль щелочного металла или щелочно-земельного металла не сможет легко проникать внутрь сырья и, кроме того, окажется увеличенным расстояние, которое соль должна преодолеть для попадания внутрь сырья. По этой причине твердофазная реакция не сможет происходить в нужном объеме. Следовательно, необходимо,чтобы совместный размол проводился до среднего размера частиц 10 м или меньше и предпочтительно 5 м или меньше. Средним размером частиц является центральное значение в распределении частиц сырья по массе. В случае тонко измельченного порошка подобного порошку в настоящем изобретении, распределение частиц по массе может быть получено с помощью лазерно-дифракционного метода. Средний размер частиц может быть в данном случае определен как размер частиц, который является центральным значением в названном распределении частиц по массе. Используемый в изобретении оксид целевого металла является оксидом по меньшей мере одного металла, выбираемого из элементов групп 13, 4, 5, 6 и 7 Периодической таблицы, кобальта и никеля и/или их предшественника, или материалом, содержащим этот оксид металла и/или его предшественник. Металлы группы 13 включают галлий, индий и таллий, металлы группы 4 включают цирконий, металлы группы 5 включают ванадий, ниобий и тантал, металлы группы 6 включают хром, молибден и вольфрам и металлы группы 7 включают технеций и рений. Примеры используемого в изобретении материала, содержащего оксид целевого металла, включают необработанную руду, рафинированную руду, золу мусоросжигательной печи, промышленные отходы и непромышленные отходы. Примеры необработанных руд включают ванадийсодержащую руду, хромсодержащую руду, цирконсодержащую руду, ниобийсодержащую руду, никельсодержащую руду и вольфрамсодержащую руду. Примеры рафинированных руд включают обогащенные формы таких минералов в названных необработанных рудах, таких как ванадатсодержащая руда, железохромная руда, циркон,шеелит, гарниерит, магнетит и вольфрамит. К числу промышленных отходов относятся сажа, шлак, отработавший катализатор, лом, угольная зола и отходы, получаемые из электронных деталей и материалов. Предшественниками названных оксидов ценных металлов являются соединения, которые могут быть превращены в оксид целевого металла. В число таких соединений входят ферросплавы, сплавы,соли и сульфаты металлов. Примеры солей металлов включают карбонаты, галогениды, сульфаты, бораты, силикаты, алюминат и гидроксиды. Примеры сплавов включают ферровольфрам, феррониобий, феррованадий, ферроникель и ферромолибден. Например, для получения комплексного оксида ниобия предпочтителен феррониобиевый сплав, состоящий на две трети из ниобия. Примеры соли щелочного металла и/или соли щелочно-земельного металла, которая реагирует в соответствии с изобретением с оксидом целевого металла, включают карбонаты, галогениды, сульфаты и бораты. В целях удобства, согласно логике настоящего изобретения, соли металлов включают также гидроксиды и оксиды. Разумеется, могут быть использованы и их смеси. Некоторые соли металлов, в частности соли щелочных металлов, разлагаются до того, как произойдет их расплавление. Однако, если продукты такого разложения находятся в активном состоянии, они могут функционировать совершенно-3 007976 так же, как реагирующее вещество изобретения будучи в расплаве. Предпочтительными являются разлагаемые карбонаты и гидроксиды. Щелочным металлом преимущественно является натрий или калий, а щелочно-земельным металлом является преимущественно кальций. Конкретные примеры соли щелочного металла и/или соли щелочно-земельного металла включают карбонаты, такие как карбонат натрия, карбонат калия, карбонат лития и карбонат кальция; гидроксиды,такие как гидроксид натрия и гидроксид калия; бикарбонаты, такие как бикарбонат натрия; галогениды,такие как хлорид натрия и фторид лития; бораты, такие как борат натрия и метаборат натрия. Особо предпочтительными являются карбонат натрия и карбонат калия. Соль щелочного металла или щелочно-земельного металла используется, по меньшей мере, в стехиометрическом количестве, которое реагирует с оксидом целевого металла с образованием комплексного оксида. Мольное отношение меняется в зависимости от желаемого комплексного оксида. Например,для получения комплексного оксида конкретного состава с использованием одного типа соли металла и одного типа оксида целевого металла, последние обычно смешивают в количествах, представляющих стехиометрическое отношение, после чего подвергают совместному размолу и реакции. Для того чтобы при этом получить желаемый комплексный оксид из соединений в сложной системе, такой как рафинированная руда, и достичь более высокого выхода реакции в процессе экстракции и извлечения, предпочтительно использовать количество соли щелочного металла или соли щелочно-земельного металла, которое в 1,2-3 раза превышает стехиометрическое отношение по отношению к содержащемуся в системе оксиду целевого металла. При осуществлении изобретения после завершения совместного размола сырья совместно размолотый продукт либо нагревают внутри размалывающего аппарата, либо выгружают и затем нагревают. Нагрев способствует диффузии соли металла или продуктов его разложения с твердой поверхности внутрь твердого продукта совместного размола (т.е. оксида целевого металла), в результате чего твердофазная реакция предположительно протекает не только на поверхности оксида целевого металла, но также и внутри него. Поскольку нагрев производится для ускорения диффузии соли щелочного металла или щелочноземельного металла или продуктов ее разложения с твердой поверхности внутрь твердого продукта совместного размола оксида целевого металла, предпочтительно производить нагрев сразу же после размола. Если все же время до начала нагрева после совместного размола окажется продолжительным, время завершения твердофазной реакции просто увеличится при том же выходе. С точки зрения управления процессом, все, что является для этого необходимым - это надлежащее регулирования стадии нагрева. В некоторых случаях, однако, например, когда используется расплывающаяся соль щелочного металла или щелочно-земельного металла, если совместный размол производится в течение длительного времени перед началом нагрева, образование комплексного оксида может занять больше времени. В крайних случаях, твердофазная реакция может даже не произойти. Отсюда желательно осуществлять надлежащий контроль сырья и соли щелочного металла или щелочно-земельного металла. Способ нагрева не является предметом каких-либо особых ограничений. Например, один из простых и удобных способов состоит в помещении совместно размолотого продукта в обычную электрическую печь и нагревании его с помощью электричества. Другие подходящие способы нагрева состоят в пропускании горячего воздуха через печь, в которую был загружен совместно размолотый продукт, и радиационный способ нагрева, включающий внешний нагрев стенок печи, в которую был помещен совместно размолотый продукт. Температура нагрева может быть установлена в соответствии с типом оксида целевого металла. Однако при температуре ниже 200 С диффузия внутри твердого материала займет время, которое мало приемлемо для промышленного применения. Следовательно, нагрев должен производиться при температуре не ниже 200 С и преимущественно не ниже 250 С. Существенно, чтобы верхний предел температуры нагрева был ниже температуры разложения или температуры плавления, в зависимости от того, которая из них ниже, соли щелочного металла и/или соли щелочно-земельного металла. Нагрев до более высокой температуры приводит к ненужному расходу тепловой энергии, что невыгодно экономически и,кроме того, приводит к тому, что соль щелочного металла и/или щелочно-земельного металла вместо того, чтобы оставаться в твердом состоянии, будет испаряться или плавиться, что является причиной таких нежелательных эффектов, как щелочная коррозия печи или отложение продуктов реакции. Если сырье содержит различные примеси, в качестве конечного продукта будет получен комплексный оксид, включающий содержащиеся в сырье примеси. Если полученный твердофазной реакцией комплексный оксид растворим в воде, то, согласно обычной практике, комплексный оксид может быть отделен и выделен путем добавления к продукту твердофазной реакции после нагрева водного растворителя с целью перевода комплексного оксида в водный раствор с последующим проведением экстракции и фильтрации экстракта. Для повышения концентрации экстракта и эффективного проведения экстракции желательно принимать во внимание температурную зависимость растворимости комплексного оксида и устанавливать такую температуру экстракции, которая позволит получить высококонцентрированный раствор.-4 007976 Если полученный твердофазной реакцией комплексный оксид является нерастворимым, то, согласно обычной практике, комплексный оксид может быть отделен и выделен путем растворения и удаления отличных от комплексного оксида веществ с помощью кислоты или щелочи. Выделенный комплексный оксид восстанавливают сначала до содержащегося в нем оксида целевого металла и затем до целевого металла, согласно стандартной практике. Приведенные ниже примеры служат целям иллюстрации и их не следует принимать как ограничение изобретения. В этих примерах экстракционное отношение для комплексного оксида рассчитывается следующим образом. Экстракционное отношение комплексного оксида = [(количество целевого металла в фильтрате)/(количество целевого металла в фильтрате + количество целевого металла в остатке)] х 100 Пример 1. Ванадийсодержащий магнетит был отделен с помощью электромагнита с образованием рафинированной руды, которая имела более низкий уровень минералов пустой породы типа кремнезема и глинозема и определенный методом ICP (методом индуцированной плазмы) элементный состав, приведенный в табл. 1 (исключая кислород, в мас.%). После первичного грубого размола до размера частиц 0,3 мм или меньше эта рафинированная руда размалывалась в течение 10 мин на вращающейся шаровой мельнице(модель JIS-M=4002, производитель Yoshida Seisakusho Co., Ltd.). Полученный путем рассева продукта порошок с размером частиц 300 м или более подвергался повторному размолу. Операция размалывания повторялась пока не оставалось порошка с размером частиц 300 м или более, в результате чего была получена размолотая рафинированная руда со средним размером частиц 32,3 м. Средний размер частиц определялся с помощью анализатора размера частиц лазерно-дифракционного типа (HR850B, производитель Cilas). Это производилось добавлением 1 г размолотой рафинированной руды и 0,05 г гексаметафосфата натрия в качестве диспергента к 400 мл ионообменной воды, диспергированием в течение 5 мин в ультразвуковом гомогенизаторе и последующим измерением размера частиц в кварцевой ячейке. Таблица 1 400 г размолотой рафинированной руды и 40 г карбоната натрия совместно размалывают в течение 80 мин при амплитуде 4 мм и скорости вращения 1200 об./мин в вибрационной мельнице (VibropotYAMP-6SND, производитель Murakami Seiki Mfg. Co., Ltd.), в которую было добавлено 280 окисноалюминиевых шаров (диаметр 10 мм). Полученная путем совместного размола смесь рафинированной руды и карбоната натрия характеризуется размером частиц, выраженным в виде среднего размера частиц, равным 4,3 м. Далее, 100 г совместно размолотой смеси помещают в муфельную печь и нагревают 1 ч в атмосфере окружающего воздуха при 600 С с целью прохождения твердофазной реакции между оксидом ванадия и карбонатом натрия, после чего осуществляют охлаждение. 50 г охлажденного продукта реакции и 200 мл кипящей воды (чистой воды) помещают в оборудованную конденсатором колбу и перемешивают в течение 45 мин мешалкой, производя нагрев при 90 С с помощью нагревательной рубашки, и осуществляют тем самым экстракцию комплексного оксида ванадия. По окончании экстракции еще горячий экстракт фильтруют с использованием вакуума на фильтровальной бумаге 5 С. Остаток фильтрации промывают четыре раза кипящей водой. Фильтрат собирают, помещают в 250-мл градуированную колбу и доводят объем до 250 мл добавлением чистой воды. Изменение веса для 50 мг полученной совместным размолом смеси рафинированной руды с карбонатом натрия измеряют с помощью термовесов в потоке воздуха (200 мл/мин) при скорости подъема температуры 10 К/мин. Результаты представлены в виде графика (фиг. 1), где на оси х отложена температура, на оси у слева - вес и на оси у справа - показания дифференциального термоэлемента. Из фиг. 1 следует, что уменьшение веса смеси после совместного размола заканчивается при приблизительно 600 С и одновременно появляется эндотермический пик. Это дает возможность предположить, что реакция, сопровождаемая удалением диоксида углерода из карбоната натрия, происходит до примерно 600 С. Концентрации ванадия в фильтрате и остатке измеряют методом ICP и рассчитывают на основе этих концентраций абсолютные количества ванадия в остатке и фильтрате: эти количества в остаточной массе и в объеме жидкости (250 мл) равны, соответственно, 35 мг и 696 мг. Экстракционное отношение ванадия рассчитывают с помощью приведенной выше формулы, получая высокое экстракционное отношение, равное 95,2%. Экстракция ванадия при высоком отношении обусловлена образованием метаванадата натрияNaVO3, который является водорастворимым комплексным оксидом. Предположительно до 600 С происходит следующая твердофазная реакция, сопровождаемая удалением диоксида углерода:-5 007976 Пример 2. Феррониобиевый сплав, имеющий определенный методом ICP элементный состав, приведенный в табл. 2 (исключая кислород, в мас.%), вначале грубо размалывают до размера частиц 0,3 мм или меньше,затем размалывают с помощью описанной в примере 1 вибрационной мельницы до тех пор, пока часть материала не будет иметь средний размер частиц 200 меш (75 м) или меньше, отнесенный к 50 мас.% от всего количества материала, в результате чего получают молотый феррониобиевый сплав со средним размером частиц 71,0 м. Изменение массы для 50 мг молотого феррониобиевого сплава измеряют с помощью термовесов в потоке воздуха (200 мл/мин) при скорости подъема температуры 10 К/мин. Результаты представлены в виде графика (фиг. 2), где на оси х отложена температура, на оси у слева - вес и на оси у справа - показания дифференциального термоэлемента. Из фиг. 1 следует, что при приблизительно 900 С увеличение веса феррониобиевого сплава останавливается и окисление завершается. Таблица 2 Далее, 300 г молотого феррониобиевого сплава помещают в муфельную печь и нагревают 1 ч в потоке воздуха при 950 С, после чего охлаждают. Охлажденный продукт подвергают рентгеноструктурному анализу, подтвердив, что феррониобиевый сплав превращен в ниобат железа FeNBO4. 400 г охлажденного содержащей ниобат железа смеси и 40 г карбоната натрия совместно размалывают в течение 90 мин при амплитуде 4 мм и скорости вращения 1200 об./мин в описанной выше вибрационной мельнице, в которую было добавлено 280 алюминийоксидных шариков (диаметр 19 мм). Смесь содержащей ниобат железа смеси и карбоната натрия, полученная при размоле, характеризуется размером частиц, выраженным в виде среднего размера частиц, равный 3,3 м. Изменение массы для 50 мг смеси содержащей ниобат железа смеси и карбоната натрия, полученной совместным размолом, измеряют с помощью термовесов в потоке воздуха (200 мл/мин) при скорости подъема температуры 10 К/мин. Результаты представлены в виде графика (фиг. 3), где на оси х отложена температура, на оси у слева - масса и на оси у справа - показания дифференциального термоэлемента. Из фиг. 3 следует, что уменьшение массы смеси начинается при примерно 400 и заканчивается при 780 С и одновременно при 780 С появляется эндотермический пик. Далее, 100 г совместно размолотой смеси содержащей ниобат железа смеси и карбоната натрия помещают в муфельную печь и нагревают 1 ч в атмосфере окружающего воздуха при 800 С с целью осуществления твердофазной реакции между оксидом ниодима и карбонатом натрия, после чего осуществляют охлаждение. После охлаждения продукт твердофазной реакции подвергают рентгеноструктурному анализу, который подтверждает содержание в продукте комплексного оксида метаниобата натрияNaNbO3. Метаниобат натрия экстрагируют водой при экстракционном отношении 94,7%. На основании этих данных предполагается прохождение твердофазной реакции, приводящей к образованию метаниобата железа 2FeNbO4 + Na2CO3 2NaNbO3 + Fе 2O3 + СO2 Пример 3. 200 г содержащей ниобат железа смеси из примера 2 и 200 г карбоната натрия совместно размалывают в течение 120 мин при амплитуде 4 мм и скорости вращения 1200 об./мин в описанной в примере 1 вибрационной мельнице, в которую было добавлено 280 оксиноалюминиевых шаров (диаметр 19 мм). Смесь содержащей ниобат железа смеси и карбоната натрия, полученная совместным размолом, имела размер частиц, выраженный в виде среднего размера частиц, равный 2,5 м. Изменение массы для 50 мг смеси содержащей ниобат железа смеси и карбоната натрия, полученной совместным размолом, измеряют с помощью термовесов в потоке воздуха (200 мл/мин) при скорости подъема температуры 10 К/мин. Результаты представлены в виде графика (фиг. 4), где на оси х отложена температура, на оси у слева - масса и на оси у справа - показания дифференциального термоэлемента. Из фиг. 4 следует, что уменьшение массы смеси начинается при примерно 400 и заканчивается при 800 С и одновременно при 800 С появляется эндотермический пик. В примере 2, как это видно на фиг. 3,имеется только один эндотермический пик. Следовательно, в примере 3 очевидно имеет место фазовое изменение. Далее, 100 г совместно размолотой смеси содержащей ниобат железа смеси и карбоната натрия помещают в муфельную печь и нагревают 1,5 ч в атмосфере окружающего воздуха при 800 С с целью проведения твердофазной реакции между этим ниобатом железа FeNbO4 и карбонатом натрия, после чего осуществляют охлаждение. После охлаждения продукт твердофазной реакции подвергают рентгеноструктурному анализу, который подтверждает содержание в продукте ортониобата натрия Na3NbO4, который является комплексным оксидом ниобия. 2 г охлажденного продукта реакции и 200 мл кипящей воды(чистой воды) помещают в оборудованную конденсатором колбу и перемешивают мешалкой в течение-6 007976 60 мин, осуществляя тем самым экстракцию ортониобата натрия. По окончании экстракции экстракт фильтруют с использованием вакуума на фильтровальной бумаге 5 С. Остаток фильтрации промывают четыре раза кипящей водой. Фильтрат собирают, помещают в 250-мл градуированную колбу и доводят объем до 250 мл добавлением чистой воды. Концентрации ниобия в фильтрате и остатке измеряют методом ICP и рассчитывают на основе этих концентраций абсолютные количества ниобия в остатке и фильтрате: эти количества в остаточной массе и в объеме жидкости (250 мл) равны, соответственно, 0,06 г и 5,38 г. При расчете экстракционного отношения ниобия получают высокое значение, равное 98,9%. На основании этих данных предполагается прохождение твердофазной реакции, приводящей к образованию ортониобата железа 2FeNbO4 + 3Na2CO32NаNbO4 + Fе 2O3 + 3 СO2 Пример 4. Вольфрамитсодержащую необработанную руду, имеющую определенный методом ICP элементный состав, приведенный в табл. 3 (исключая кислород, в мас.%), грубо размалывают до размера частиц 0,3 мм или меньше, затем размалывают с помощью описанной в примере 1 ротационной шаровой мельницы до тех пор, пока часть материала не будет иметь средний размер частиц 200 меш (75 м) или меньше,отнесенный к 80 мас.% от всего количества материала, в результате чего получают молотую вольфрамитсодержащую руду со средним размером частиц 52,3 м. 200 г измельченной вольфрамитсодержащей руды и 95 г карбоната калия совместно размалывают в течение 90 мин при амплитуде 4 мм и скорости вращения 1200 об./мин в описанной выше вибрационной мельнице, в которую было добавлено 260 железных шаров (диаметр 19 мм). Полученная смесь, содержащая руду и карбонат калия, характеризуется размером частиц, выраженным в виде среднего размера частиц, равным 3,9 м. Изменение массы для 50 мг полученной совместным размолом смеси руды с карбонатом калия измеряют с помощью термовесов в потоке воздуха (200 мл/мин) при скорости подъема температуры 10 К/мин. Результаты представлены в виде графика (фиг. 5), где на оси х отложена температура, на оси у слева - масса и на оси у справа - показания дифференциального термоэлемента. Потеря массы, связанная с острым эндотермическим пиком до 100 С, обусловлена испарением водяного пара, поглощенного карбонатом калия. Потеря массы, которая имеет место после 300 С, обусловлена выделением диоксида углерода из карбоната калия. Карбонат калия плавится при 800 С и разлагается при более высокой температуре. Изменения массы в этой смеси указывают на то, что твердофазная реакция, сопровождающаяся потерей диоксида углерода, протекает при неожиданно низкой температуре. Далее, 100 г совместно размолотой смеси, содержащей руду и карбонат калия, помещают в муфельную печь и нагревают 2 ч в атмосфере окружающего воздуха при 400 С, после чего охлаждают. Часть охлажденной смеси подвергают рентгеноструктурному анализу, на основании которого отмечают исчезновение (Fe,Mn)WO4 и образование комплексного оксида вольфрамата калия K2WO4. При рассмотрении этих данных совместно с результатами термического анализа выясняется, что до 400 С завершается следующая твердофазная реакция:(Fe,Mn)WO4 + K2 СО 3(Fe,Mn)O + K2WO4 + CO2 50 г охлажденной смеси, содержащей руду и карбонат калия, и 200 мл кипящей воды (чистой воды) помещают в оборудованную конденсатором колбу и перемешивают с помощью мешалки в течение 30 мин, производя нагрев при 90 С с помощью нагревательной рубашки, и осуществляют тем самым экстракцию комплексного оксида вольфрама. По окончании экстракции экстракт фильтруют с использованием вакуума на фильтровальной бумаге 5 С. Остаток фильтрации промывают четыре раза кипящей водой. Фильтрат собирают, помещают в 250-мл градуированную колбу и доводят объем до 250 мл добавлением чистой воды. Концентрации вольфрама в фильтрате и остатке анализируют с помощью метода ICP и рассчитывают на основе этих концентраций абсолютные количества комплексного оксида вольфрама в остатке и фильтрате: эти количества в остаточной массе и в объеме жидкости (250 мл) равны, соответственно, 0,4 г и 15,1 г. Рассчитывают экстракционное отношение вольфрама, получая высокое экстракционное отношение, равное 97,4%. На основании результатов термического анализа и рентгеноструктурного анализа и учитывая, что вольфрам был экстрагирован водным раствором, делается предположение, что имеет место твердофазная реакция, приводящая к образованию вольфрамата калия. Пример 5. Шеелитсодержащую необработанную руду, имеющую определенный методом ICP элементный состав, приведенный в табл. 3 (исключая кислород, в мас.%), грубо размалывают до размера частиц 0,3 мм или меньше, затем размалывают с помощью описанной в примере 1 ротационной шаровой мельницы до тех пор, пока часть материала не будет иметь средний размер частиц 400 меш (36 м) или меньше, отнесенный к 80 мас.% от всего количества материала, в результате чего получают молотую шеелитсодержащую руду со средним размером частиц 49,0 м. 250 г размолотой шеелитсодержащей руды и 80 г карбоната натрия совместно размалывают в течение 1 ч при амплитуде 4 мм и скорости вращения 1200 об./мин в описанной в примере 1 вибрационной мельнице, в которую было добавлено 260 железных шаров (диаметр 19 мм). Полученная в результате совместного размола смесь шеелитсодержащей руды и карбоната натрия характеризуется размером частиц, выраженным в виде среднего размера частиц, равным 3,1 м. Изменение массы для 20 мг полученной результате совместного размола смеси руды с карбонатом натрия измеряют с помощью термовесов в потоке воздуха (200 мл/мин) при скорости подъема температуры 2 К/мин. Результаты представлены в виде графика (фиг. 6), где на оси х отложена температура, на оси у слева - масса и на оси у справа - показания дифференциального термоэлемента. Потеря массы, имеющая место после 400 С, обусловлена выделением диоксида углерода из карбоната натрия. Карбонат натрия плавится при 850 С и разлагается при более высокой температуре. Изменения массы в этой смеси указывают на то, что твердофазная реакция, сопровождающаяся удалением диоксида углерода из карбоната натрия, протекает при неожиданно низкой температуре. Далее, 100 г полученной в результате совместного размола смеси, содержащей руду и карбонат натрия, помещают в муфельную печь и нагревают 1,5 ч в атмосфере окружающего воздуха при 600 С, после чего охлаждают. Часть охлажденной смеси подвергают рентгеноструктурному анализу, на основании которого отмечают исчезновение CaWO4 и образование комплексного оксида вольфрамата калияNa2WO4. При рассмотрении этих данных совместно с результатами термического анализа, выясняется,что до 600 С завершается следующая твердофазная реакция:CaWO4 + Na2CO3 СаО + Na2WO4 + СО 2 50 г охлажденной смеси, содержащей руду и карбонат натрия, и 200 мл кипящей воды (чистой воды) помещают в оборудованную конденсатором колбу и перемешивают с помощью мешалки в течение 30 мин при комнатной температуре, осуществляя тем самым экстракцию комплексного оксида вольфрама. По окончании экстракции экстракт фильтруют с использованием вакуума на фильтровальной бумаге 5 С. Остаток фильтрации промывают четыре раза кипящей водой. Фильтрат собирают, помещают в 250 мл градуированную колбу и доводят объем до 250 мл добавлением чистой воды. Концентрации вольфрама в фильтрате и остатке анализируют с помощью метода ICP и рассчитывают на основе этих концентраций абсолютные количества комплексного оксида вольфрама в остатке и фильтрате: эти количества в остаточной массе и в объеме жидкости (250 мл) равны, соответственно, 0,13 г и 7,83 г. Рассчитывают экстракционное отношение вольфрама, получая высокое экстракционное отношение, равное 98,4%. Пример 6. Гарниеритсодержащую необработанную руду, имеющую определенный методом ICP элементный состав, показанный на фиг. 5 (исключая кислород, в мас.%), грубо размалывают до размера частиц 0,3 мм или меньше, затем размалывают с помощью описанной в примере 1 ротационной шаровой мельницы до тех пор, пока часть материала не будет иметь средний размер частиц 400 меш (36 м) или меньше,отнесенный к 90 мас.% от всего количества материала, в результате чего получают молотую гарниеритсодержащую руду со средним размером частиц 38,1 м. Наряду с этим, используя систему термического анализа с масс-спектрометром (Thermo Mass, производитель Rigaku Corporation), 2 мг молотой гарниеритной руды нагревают со скоростью 10 К/мин с целью определения профиля потери массы и, кроме того, анализа выделяющегося газа. С учетом того,что выделение газа в значительной степени прекращается при 700 С и что газ полностью состоит из воды, предполагается, что происходит реакция дегидратации, включающая превращение гидроксида в оксид. Таблица 5 Далее, 300 г молотой гарниеритной руды помещают в муфельную печь и подвергают дегидратации путем нагрева в течение 2 ч при 700 С а атмосфере окружающего воздуха, после чего охлаждают. 200 г дегидратированной гарниеритной руды и 80 г сульфата натрия совместно размалывают в течение 2 ч при амплитуде 4 мм и скорости вращения 1200 об./мин в описанной в примере 1 вибрационной мельнице, в которую было добавлено 260 железных шаров (диаметр 19 мм). Полученная в результате совместного размола смесь гарниеритной руды и сульфата натрия характеризуется размером частиц, выраженным в виде среднего размера частиц, равным 2,1 м.-8 007976 Изменение массы для 30 мг полученной в результате совместного размола смеси гарниеритной смолы и сульфата натрия измеряют с помощью термовесов в потоке воздуха (200 мл/мин) при скорости подъема температуры 10 К/мин. Результаты представлены в виде графика (фиг. 7), где на оси х отложена температура, на оси у слева - масса и на оси у справа - показания дифференциального термоэлемента. Потеря массы, которая происходит после 520 С, обусловлена выделением диоксида серы из сульфата натрия. Выделение диоксида серы заканчивается при 660 С. Сульфат натрия плавится при 880 С и разлагается при более высокой температуре. Изменения массы в этой смеси указывают на то, что твердофазная реакция, сопровождающаяся удалением диоксида серы, протекает при температуре, начиная от температуры, которая не менее чем на 200 С ниже температуры разложения для самого сульфата натрия. Далее, 100 г совместно размолотой смеси, содержащей руду и сульфат натрия, помещают в муфельную печь и нагревают 2 ч при 400 С в атмосфере окружающего воздуха, после чего охлаждают. Часть охлажденной смеси подвергают рентгеноструктурному анализу, на основании которого отмечают образование комплексного оксида NaNiO2. При рассмотрении этих данных совместно с результатами термического анализа выясняется, что до 700 С завершается следующая твердофазная реакция: 2NiO + Na2SO42NaNiO2 + SO2 50 г охлажденной смеси, содержащей гарниеритовую руду и сульфат калия, и 200 мл 0,1 н. водной серной кислоты помещают в оборудованную конденсатором колбу и перемешивают с помощью мешалки в течение 30 мин при комнатной температуре, осуществляя тем самым экстракцию комплексного оксида никеля. По окончании экстракции экстракт фильтруют с использованием вакуума на фильтровальной бумаге 5 С. Остаток фильтрации промывают четыре раза 0,1 н. серной кислотой. Фильтрат собирают,помещают в 250-мл градуированную колбу и доводят объем до 250 мл добавлением чистой воды. Концентрации никеля в фильтрате и остатке измеряют с помощью метода ICP и рассчитывают на основе этих концентраций абсолютные количества никеля в остатке и фильтрате: эти количества в остаточной массе и в объеме жидкости (250 мл) равны, соответственно, 0,16 г и 1,95 г. Рассчитывают экстракционное отношение никеля, получая высокое экстракционное отношение, равное 92,4%. Пример 7. 150 г цирконсодержащей необработанной руды (100% которой имеет размер зерна 250 м или меньше; 30% которой имеет размер зерна 100 м или меньше при среднем размере зерна 98,2 м), элементный состав которой, определенный с помощью метода ICP, приведен в табл. 6 (исключая кислород,в мас.%), и 203 г карбоната кальция совместно размалывают в течение 2,5 ч с при амплитуде 4 мм и скорости вращения 1200 об./мин на описанной в примере 1 вибрационной мельнице, в которую было добавлено 260 железных шаров (диаметр 19 мм). Полученная в результате размола смесь цирконсодержащей руды и карбоната кальция характеризуется размером частиц, выраженным в виде среднего размера частиц, равным 6,0 м. Изменение массы 50 мг полученной в результате совместного размола смеси цирконсодержащей руды и карбоната кальция измеряют с помощью термовесов в потоке воздуха (200 мл/мин) при скорости подъема температуры 10 К/мин. Результаты представлены в виде графика (фиг. 8), где на оси х отложена температура, на оси у слева - масса и на оси у справа - показания дифференциального термоэлемента. Потеря массы, которая имеет место после 500 С, обусловлена выделением диоксида углерода из карбоната кальция. Такое выделение завершается при 730 С. Карбонат кальция разлагается при 825 С. Изменения массы в этой смеси указывают на то, что твердофазная реакция, сопровождающаяся удалением диоксида углерода из карбоната кальция, начинается при температуре не менее чем на 190 С ниже температуры разложения для самого карбоната кальция. Таблица 6 Далее, 100 г полученной в результате размола смеси цирконсодержащей руды и карбоната кальция помещают в муфельную печь и нагревают 2 ч при 750 С в атмосфере окружающего воздуха, после чего охлаждают. Часть охлажденной смеси подвергают рентгеноструктурному анализу, на основании которого были отмечены пики для комплексного оксида цирконата кальция СаZrO3 и для метасиликата кальция СаSiO3. При рассмотрении этих данных совместно с результатами термического анализа выясняется, что до 750 С завершается следующая твердофазная реакция:ZrSiO4 + 2 СаСО 3 СаZrO3 + СаSiO3 + 2 СO2 50 г охлажденного продукта реакции цирконсодержащей руды с карбонатом кальция и 200 мл 0,1 н. соляной кислоты помещают в оборудованную конденсатором колбу и перемешивают с помощью мешалки в течение 30 мин при комнатной температуре, осуществляя тем самым растворение и удаление меткасиликата кальция и других веществ. Полученное при этом твердое вещество промывают четыре раза 0,1 н. соляной кислотой и затем промывают четыре раза чистой водой. Часть твердого вещества подвергают рентгеноструктурному анализу, на основании которого подтверждается образование цирконата кальция.-9 007976 Сравнительный пример 1. Смесь рафинированной руды и карбоната натрия со средним размером частиц 4,3 м, полученная путем совместного размола рафинированной руды и карбоната натрия в примере 1, была подвергнута(без нагрева) экстракции горячей водой. Экстракционное отношение было очень низким, а именно 0,24 мас.%. Поверхность экстракта представляла собой предположительно метаванадат натрия NaVO3, являющийся комплексным оксидом. Сравнительный пример 2. Рафинированную руду со средним размером частиц 32,3 м примера 1 дополнительно размалывают с использованием описанной в примере 1 вибрационной мельницы, в результате чего получают молотый продукт со средним размером частиц 4,0 м. Затем к 400 г размолотой руды и 40 г карбоната натрия добавляют 200 мл воды и месят, после чего тесто сушат в течение 8 ч при 120 С. Изменение массы 50 мг замешанного продукта после сушки измеряют с помощью термовесов в потоке воздуха (200 мл/мин) при скорости подъема температуры 10 К/мин. Результаты представлены в виде графика (фиг. 9), где на оси х отложена температура, на оси у слева - масса и на оси у справа - показания дифференциального термоэлемента. Из фиг.9 очевидно, что потеря веса в замешанном продукте начинается при 600 С и заканчивается при 840 С. Одновременно при 839 С появляется эндотермический пик. Далее, 100 г замешанного продукта после сушки помещают в муфельную печь и нагревают 1 ч при 600 С в атмосфере окружающего воздуха, после чего охлаждают. 50 г замешанного продукта после охлаждения и 200 мл кипящей воды (чистой воды) помещают в оборудованную конденсатором колбу и перемешивают мешалкой в течение 60 мин, осуществляя тем самым экстракцию. По окончании экстракции еще горячий экстракт фильтруют с использованием вакуума на фильтровальной бумаге 5 С. Остаток фильтрации промывают четыре раза кипящей водой. Фильтрат собирают, помещают в 250-мл градуированную колбу и доводят объем до 250 мл добавлением чистой воды. Экстракционное отношение составляет 3,8%, т.е. является низким. Возможность применения в промышленности Настоящее изобретение способно ускорить реакцию образования комплексного оксида целевого металла из оксида металла и/или его предшественника, или материала, содержащего оксид металла или его предшественник, повысить степень конверсии и обеспечить высокую селективность, избегая при этом плавления образующей эвтектику соли щелочного или щелочно-земельного металла, т.е. без нагрева до чрезмерно высокой температуры. Результатом является прекрасная производительность в отношении комплексных оксидов целевых металлов. Кроме того, независимо от содержания оксидов целевых металлов способ изобретения позволяет эффективно выделять и получать в товарном виде такие оксиды из различных типов необработанной руды, промышленных отходов и непромышленных отходов и может оказаться очень выгодным для производства в промышленном масштабе. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения комплексных оксидов по меньшей мере одного металла, выбираемого из элементов групп 13, 4, 5, 6 и 7 Периодической системы Менделеева, кобальта и никеля с щелочным металлом и/или щелочно-земельным металлом, который включает реакцию оксида по меньшей мере одного металла, выбираемого из группы, состоящей из элементов групп 13, 4, 5, 6 и 7 Периодической системы,кобальта и никеля и/или предшественника оксида металла, или материала, содержащего оксид металла и/или его предшественник, с солью щелочного металла и/или солью щелочно-земельного металла, отличающийся тем, что совместно размалывают смесь оксида металла и/или его предшественника, или смесь материала, содержащего оксид металла и/или его предшественник, с солью щелочного металла и/или солью щелочно-земельного металла до размера частиц для оксида металла и/или его предшественника или для оксида металла и/или материала, содержащего оксид металла и/или предшественник, равного 10 м или меньше, и нагревают смесь размолотого продукта до температуры по меньшей мере 200 С, но ниже температуры разложения или температуры плавления, в зависимости от того, которая из них ниже,соли щелочного металла и/или соли щелочно-земельного металла таким образом, чтобы инициировать твердофазную реакцию. 2. Способ по п.1, отличающийся тем, что включает стадию экстракции комплексного оксида по меньшей мере одного металла, выбираемого из элементов групп 13, 4, 5, 6 и 7 Периодической системы,кобальта и никеля с щелочным металлом и/или щелочно-земельным металлом из содержащего комплексный оксид продукта реакции с помощью водного растворителя, в результате чего получают комплексный оксид в водном растворителе. 3. Способ по п.1 или 2, отличающийся тем, что необработанная руда, рафинированная руда, зола мусоросжигательной печи, промышленные отходы или непромышленные отходы являются содержащим оксид металла материалом.- 10007976 4. Способ по п.1 или 2, отличающийся тем, что предшественником оксида металла является ферросплав, сплав, соль или сульфат металла. 5. Способ по п.1 или 2, отличающийся тем, что металлом в оксиде металла является ванадий, цирконий, ниобий, никель или вольфрам. 6. Способ по п.1 или 2, отличающийся тем, что солью щелочного металла и/или солью щелочноземельного металла является карбонат, галогенид, сульфат, борат или гидроксид. 7. Способ по п.6, отличающийся тем, что солью щелочного металла и/или солью щелочноземельного металла является карбонат натрия, карбонат калия, сульфат натрия, карбонат кальция или гидроксид натрия. 8. Способ по п.1 или 2, отличающийся тем, что реакция оксида металла и/или предшественника оксида металла или материала, содержащего оксид металла и/или его предшественник, с солью щелочного металла и/или солью щелочно-земельного металла проводится при температуре не ниже 250 С, но ниже температуры разложения или температуры плавления, в зависимости от того, которая из них ниже, соли щелочного металла и/или соли щелочно-земельного металла.
МПК / Метки
МПК: C01G 31/00, C01G 33/00, C01B 13/32, C01G 49/00, C01B 13/18
Метки: металла, способ, комплексных, получения, оксидов
Код ссылки
<a href="https://eas.patents.su/16-7976-sposob-polucheniya-kompleksnyh-oksidov-metalla.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения комплексных оксидов металла</a>
Предыдущий патент: Устройство и способ для лечения магнитными полями
Следующий патент: Способ получения кристаллической формы i кислого сульфата клопидогреля
Случайный патент: Композиции антител