Таблетки валацикловира, содержащие коллоидный диоксид кремния
Формула / Реферат
1. Таблетка, содержащая, по меньшей мере, приблизительно 50% (мас./мас.) валацикловира или его соли, наполнитель на основе целлюлозы, связьшающий агент, смазывающее вещество и приблизительно от 0,05 до приблизительно 3% (мас./мас.) коллоидного диоксида кремния, причем валацикловир или его соль присутствуют внутри гранул таблетки, смазывающее вещество, диоксид кремния и, по меньшей мере, часть наполнителя на основе целлюлозы присутствуют внегранулярно; причем хрупкость таблетки не превышает 1%, твердость составляет, по меньшей мере, 9 кПа, а сила выталкивания не превышает 1000 Н.
2. Таблетка по п. 1, отличающаяся тем, что коллоидный диоксид кремния присутствует в количестве от приблизительно 0,1 до приблизительно 0,5% (мас./мас).
3. Таблетка по п. 1 или 2, отличающаяся тем, что наполнитель на основе целлюлозы присутствует в количестве от приблизительно 3% (мас./мас.) до приблизительно 30% (мас./мас).
4. Таблетка по п.З, отличающаяся тем, что наполнитель на основе целлюлозы присутствует в количестве от приблизительно 5 до приблизительно 15% (мас./мас).
5. Таблетка по п.4, отличающаяся тем, что наполнитель на основе целлюлозы присутствует в количестве приблизительно 10% (мас./мас).
6. Таблетка по любому из пп. 1-5, отличающаяся тем, что наполнитель представляет собой микрокристаллическую целлюлозу.
7. Таблетка по любому из пп. 1-6, отличающаяся тем, что размер частиц наполнителя на основе целлюлозы составляет от приблизительно 20 до приблизительно 300 мкм.
8. Таблетка по любому из пп. 1-7, отличающаяся тем, что связывающий агент присутствует в количестве от приблизительно 1 до приблизительно 5% (мас./мас).
9. Таблетка по любому из пп. 1-8, отличающаяся тем, что связывающий агент представляет собой метилцеллюлозу или повидон.
10. Таблетка по п. 9, отличающаяся тем, что связывающий агент представляет собой повидон.
11. Таблетка по п. 10, отличающаяся тем, что повидон представляет собой повидон марки К90.
12. Таблетка по любому из пп. 1-11, отличающаяся тем, что смазывающее вещество присутствует в количестве от приблизительно 0,1 до приблизительно 2,0% (мас./мас).
13. Таблетка по п. 12, отличающаяся тем, что смазывающее вещество представляет собой производное стеарата.
14. Таблетка по п. 13, отличающаяся тем, что смазывающее вещество представляет собой стеарат магния и присутствует в количестве от приблизительно 0,1 до приблизительно 1,0% (мас/мас).
15. Таблетка по любому из пп. 1-14, отличающаяся тем, что валацикловир или его соль присутствуют в количестве от приблизительно 65 до приблизительно 85% (мас./мас).
16. Таблетка по любому из пп. 1-15, отличающаяся тем, что она содержит гидрохлорид валацикловира.
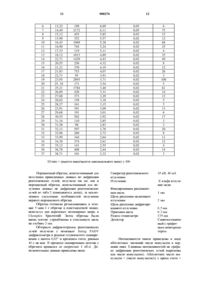
17. Таблетка по п. 16, отличающаяся тем, что гидрохлорид валацикловира представляет собой безводную кристаллическую форму, по существу имеющую следующие значения расстояний d между кристаллографическими плоскостями:
d, расстояние между кристаллографическими плоскостями (в ангстремах):
10,20 + 0,08; 8,10 + 0,06; 7,27 + 0,06; 6,08 + 0,05; 5,83 ± 0,03; 5,37 + 0,02; 5,23 + 0,02; 4,89 ± 0,02; 4,42 + 0,02; 4,06 +0,02; 3,71 + 0,02; 3,39 ± 0,02; 3,32 + 0,02; 2,91 + 0,02; 2,77 + 0,02.
18. Таблетка по любому из пп. 1-17, отличающаяся тем, что насыпная объемная плотность валацикловира или его соли составляет от приблизительно 0,1 до приблизительно 0,9 г/см3.
19. Таблетка по любому из пп. 1-18, отличающаяся тем, что дополнительно содержит разрыхлитель в количестве от приблизительно 0,5 до приблизительно 20% (мас./мас).
20. Таблетка по п. 19, отличающаяся тем, что разрыхлитель представляет собой разрыхлитель неионной природы.
21. Таблетка по п.20, отличающаяся тем, что разрыхлитель представляет собой кросповидон в количестве от приблизительно 0,5 до приблизительно 7% (мас./мас).
22. Таблетка по п. 1, отличающаяся тем, что она содержит от приблизительно 65 до приблизительно 85% (мас./мас.) безводного кристаллического гидрохлорида валацикловира, характеризующегося дифракционной картиной со значениями расстояний d между кристаллографическими плоскостями по п. 17, от приблизительно 1 до приблизительно 5% (мас./мас.) повидона, от приблизительно 3 до приблизительно 30% (мас./мас.) наполнителя на основе целлюлозы, приблизительно от 0,5 до приблизительно 7% (мас./мас.) разрыхлителя неионной природы, от приблизительно 0,1 до приблизительно 1,0% смазывающего вещества на основе стеарата и от приблизительно 0,1 до приблизительно 0,5% (мас/мас) коллоидного диоксида кремния, причем гидрохлорид валацикловира присутствует внутригранулярно, а наполнитель на основе целлюлозы, смазывающее вещество на основе стеарата и коллоидный диоксид кремния присутствуют внегранулярно.
23. Таблетка по любому из пп. 1-22, отличающаяся тем, что она покрыта оболочкой.
24. Способ лечения вирусной герпесной инфекции у человека, при котором реципиенту вводят одну или большее число таблеток по любому из пп. 1-23 так, чтобы реципиент получил эффективное против вируса герпеса количество валацикловира или его соли.
25. Способ получения таблетки, содержащей, по меньшей мере, приблизительно 50% (мас./мас.) валацикловира или его соли, связывающий агент, наполнитель на основе целлюлозы, смазывающее вещество и от приблизительно 0,05 до приблизительно 3,0% (мас./мас.) коллоидного диоксида кремния, причем хрупкость таблетки не превышает 1%, твердость составляет, по меньшей мере, 9 кПа, а сила выталкивания не превышает 1000 Н, при котором формуют гранулы, которые содержат валацикловир или его соль, а затем смешивают смазывающее вещество, коллоидный диоксид кремния и, по меньшей мере, часть наполнителя на основе целлюлозы с указанными гранулами.
26. Способ по п.25, отличающийся тем, что формуют гранулы путем смешивания указанного валацикловира или его соли, связывающего агента или его части и части наполнителя на основе целлюлозы; гранулируют с помощью гранулирующего раствора до образования гранул или растворяют связывающий агент или его часть в гранулирующем растворе перед добавлением к валацикловиру; высушивают гранулы; смешивают гранулы со смазывающим веществом, коллоидным диоксидом кремния и наполнителем на основе целлюлозы или его частью; и затем прессуют перемешанную смесь для формования таблетки.
27. Способ по п.25, отличающийся тем, что содержание наполнителя на основе целлюлозы в таблетке составляет приблизительно от 3 до 30% (мас./мас), гранулы формуют посредством смешивания валацикловира или его соли, связывающего агента или его части и части наполнителя на основе целлюлозы; гранулируют с помощью гранулирующего раствора до образования гранул или растворяют связывающий агент или его часть в гранулирующем растворе перед добавлением к валацикловиру; высушивают гранулы; смешивают гранулы со смазывающим веществом, коллоидным диоксидом кремния и, по меньшей мере, частью наполнителя на основе целлюлозы; а затем прессуют перемешанную смесь для формования таблетки.
Текст
Изобретение относится к таблетке антивирусного лекарственного средства валацикловира.Соединение 9-[(2-гидроксиэтокси)метил] гуанин, иначе известное как ацикловир, обладает сильной антивирусной активностью и широко применяется для лечения и профилактики вирусных инфекций человека, в особенности инфекций, вызываемых вирусами герпесной группы (Зспаейег ет а 1, Машге, 272, 583-585(1978), патент Великобритании Мг 1523865, патент США Не 4199574). Однако при пероральном введении ацикловир плохо абсорбируется из желудочно-кишечного тракта, и такая низкая биодоступность обуславливает необходимость ВВСДСНИЯ многократных ВЫСОКИХ ДОЗ орального лекарственного препарата, особенно при лечении менее чувствительных вирусов или инфекций, для достижения и поддержания эффективНЬ 1 Х противовирусных уровней в плазме.Показано, что Ь-валиновый эфир ацикловира, (2-[(2-амино-1,6-дигидро-6-оксопурин-9 ил)метокси]этил-Ь-валинат] (называемый далее валацикловиром), сохраняя антивирусные свойства ацикловира, характеризуется значительно лучшей биодоступностью. Предпочтительной формой этого соединения является его соль гидрохлорид, называемая далее гидрохлоридом валацикловира. Валацикловир и его соли, включая гидрохлорид, описаны (патент США Мг 4957924 (в частности, см. пример 1 В); Европейский патент Мг 0308065 (в частности, см. пример 1 В); Веаиспашр е: а 1, Аш 1 у 1 га 1 Спеппзтгу апд СЬешоШегару, 3(3), 157-164 (1992) (см. в частности страницу 162, колонку 1. Описаны (патент США Мг 4957924 и Европейский патент Не 0308065) таблетки валацикловира.При разработке прописи таблетки, содержащей валацикловир в значительной пропорции, очень часто встречались трудности, связанные с получением таблеток достаточной степени твердости и хрупкости, необходимой для фармацевтического обращения и покрытия таблеток оболочкой.Если таблетка слишком хрупкая, она будет ломаться в процессе упаковки и транспортировки. Существует требование (ИЗ Рпагшасороеш(ПЗР) по. 23, 1995, р.1981 ат птопогарп 1216),согласно которому хрупкость фармацевтических таблеток не должна превышать 1%. Если таблетка слишком мягкая, она будет крошиться в процессе обработки в барабане для покрытия оболочкой.Среди прочего рекомендуется (справочное руководство "РгоЫеш Зо 1 уег" (составлено РМС Согрогапоп), р. 8 апа 9) в качестве средства для устранения недостаточной твердости таблеток увеличение силы прессования, прилагаемого для формования таблетки, или уменьшение доли смазывающего вещества в прописи таблетки.Были предприняты попытки улучшения показателей твердости и хрупкости таблетоквалацикловира с помощью увеличения силы прессования, уменьшения доли смазывающего вещества и увеличения доли связующего вещества, но каждый раз обнаруживалась невозможНОСТЬ практического ПОЛУЧСНИЯ ДОСТЗТОЧНО твердой нехрупкой таблетки.Кроме того, в некоторых таблетках, как результат ПОВЫШСНИЯ СИЛЫ ПРСССОВЗНИЯ, бЫЛИ обнаружены трещины. Вдобавок "адгезивные" свойства валацшловира проявляются в том, что ОН МОЖСТ прилршать К матрицам ДЛЯ ИЗГОТОВЛСния таблеток, что обуславливает необходимость в эффективном умягчении. Вследствие этого трудно уменьшить долю смазывающего вещества, не вызывая при этом прилипания таблеток. К тому же время распадаемости таблетки валацикловира достаточно велико, и поэтому любое возможное решение проблемы твердости и хрупкости не должно существенным образом отрицательно сказываться на ни на времени распадаемости, ни на показателе смягчения (измеряемом как сила выталкивания ) таблетированного препарата.Таким образом, задачей данного изобретения является создание прочного таблетированного препарата валацикловира и его солей, допускающего покрытие оболочкой и предусматривающего получение таблеток с хрупкостью,не превышающей 1%, твердостью, по меньшей мере, 9 кПа и силой выталкивания, не превь 1 шающей 1000 ньютонов (1 кН).Твердость таблетки должна быть таковой,чтобы она не только обладала приемлемой устойчивостью к размельчению (измеряемой в величинах кПа), но и также не разрушалась при барабанной обработке.В задачу данного изобретения входило также создание прочного препарата, обеспечивающего получение таблеток без трещин.Для решения этой задачи найден эффективный способ преодоления вышеуказанных проблем хрупкости и твердости, заключающийся во внегранулярном применении коллоидного диоксида кремния и наполнителя на основе целлюлозы в таблетированном препарате.Коллоидный диоксид кремния не упоминается в качестве агента, повышающего твердость таблеток (НапаЬооК от Рпагшасепйса] Ехстртешз 1994, р.253-256; ТЬе ТЬеогу апа Ргасйсе оГ 1 пс 1 изгг 1 а 1 Рпагшасу (кыш еашоп) Ьу Ьаспшап, ЫеЬегшап апб Капйв).В данном изобретении предлагается таблетка, содержащая, по меньшей мере, приблизительно 50% (мас./мас.) валацшловира или его соли внутри гранул таблетки, наполнитель на основе целлюлозы, связывающий агент, смазь 1 вающее вещество и приблизительно от 0,05 до приблизительно 3% (мас./мас.) коллоидного диоксида кремния, причем смазывающее вещество, диоксид кремния и, по меньшей мере,часть наполнителя на основе целлюлозы присутствуют внегранулярно, при этом хрупкостьтаблетки не превышает 1%, твердость составляет, по меньшей мере, 9 кПа, а сила вЬ 1 талкивания не превышает 1000 ньютонов.Таблетка по данной прописи, содержащая от 0,05 до 3% (мас./мас.) коллоидного диоксида кремния и наполнитель на основе целлюлозы,является прочной и имеет значительно улучшенные показатели хрупкости и твердости. Кроме того, подобные улучшенные свойства достигаются при сохранении удовлетворительными таких параметров, как время распадаемости и смазываемость, даже тогда, когда препарат смешивают при большом срезывающем усилии. Таким образом, согласно данному изобретению, предлагается превосходная таблетка,обеспечивающая высокую биодоступносгь ацикловира.Предпочтительно, чтобы время распадаемости таблетки не превышало приблизительно 30 мин, еще предпочтительнее, чтобы оно не превышало приблизительно 25 мин, и наиболее предпочтительно, не превышало приблизительно 20 мин.СИЛЗ ВЫТЗЛКИВЗНИЯ не должна превышать приблизительно 1000 Н, предпочтительно не превышать приблизительно 800 Н, более предпочтительно не превышать приблизительно 500 Н для таблеток, прессование которых проводят в условиях приблизительно от 10 до 30 кН,предпочтительно от 10 до 20 кН.Здесь и далее валацикловир и его соль обозначаются в основном как "активный ингредиент" или "лекарственное средство".Известно (Т 11 е 1994 [15 Рпатшасороета (монография следующее описание коллоидного диоксида кремния: субмшсроскопический парообразный диоксид кремния, полученный с помощью гидролиза в паровой фазе соединения диоксида кремния.Предпочтительно, чтобы коллоидный диоксид кремния присутствовал в количествах от приблизительно 0,05 до приблизительно 1%(мас./мас.) от массы всего препарата, более предпочтительно от приблизительно 0,1 до приблизительно 1% (мас./мас.) и наиболее предпочтительно от приблизительно 0,1 до приблизительно 0,5% (мас./мас.). Достаточно приемлемыми оказались Аего 5 т 1 (торговая марка) и СаЬо-511 (торговая марка).Содержание лекарственного средства в таблетке составляет, по меньшей мере, приблизительно 50% (мас./мас.), предпочтительно от приблизительно 60 (мас./мас.) до приблизительно 90% (мас./мас.), более предпочтительно от приблизительно 65 (мас./мас.) до приблизительно 85% (мас./мас.) и наиболее предпочтительно приблизительно 80% (мас./мас.). Предпочтительно, чтобы (насыгшая) объемная плотность лекарственного средства составляла приблизительно от 0,1 до 0,9 г/смз, более предпочтительно от 0,3 до 0,7 г/смз, еще более предпочтительно от 0,34 до 0,66 г/см 3 и наиболее предпочти 000276тельно от 0,4 до 0,6 г/см 3. Приемлемое лекарственное средство представляет собой гидрохлорид валацикловира, предпочтительно в безводной кристаллической форме, по существу характеризующейся следующими значениями расстояний между кристаллографическими плоскостями (1 (полученной для дифракции рентгеновских лучей на порошке):(1, расстояния между кристаллографическими плоскостями (в ангстремах):Здесь и далее согласно данному изобретению под термином "безводная кристаллическая форма" понимают кристаллическую форму,имеющую по существу такую же картину дифракции рентгеновских лучей на порошке, как показана на фиг. 1-3, или имеющая, по существу,такие же значения расстояний между кристаллографическими плоскостями а, как определены ВЫШС.Предпочтительно, чтобы чистота кристаллической формы в любой подобной лекарственной партии безводного кристаллического гидрохлорида валацикловира, применяемого для приготовления таблеток валацикловира, составляла, по меньшей мере, 70%, более предпочтительно, по меньшей мере, 80%, еще более предпочтительно, по меньшей мере, 90% и наиболее предпочтительно, по меньшей мере, 95% безводного кристаллического гидрохлорида валацикловира (охарактеризованного выше).Поскольку безводная кристаллическая форма гидрохлорида валацикловира не содержит гидратной воды, то в другом способе определения чистоты кристаллической формы можно оценить уровень других гидратированных форм гидрохлорида валацикловира в любой партии лекарства, используемого для приготовления таблеток, путем определения содержания гидратной воды. Предпочтительно, чтобы любая подобная лекарственная партия безводного кристаллического гидрохлорида валацикловира содержала гидратной воды не более 3%(мас./мас.), более предпочтительно не более 2%(мас./мас.), еще более предпочтительно не более 1% (мас./мас.) и наиболее предпочтительно не более 0,5% (мас./мас.).Содержание гидратной воды измеряют известным (1990 ЦЗ. Рпагшасороеш радез 16191621; Ье Епгореап РЬагптасороеш, зесопа есйтйоп(1992), рагт 2, зтхтеептп Гастсп 1 е, у.3.5.6-1) методом Карла Фишера (Каг 1 Р 15 сЬег).Преимущественным наполнителем является наполнитель на основе целлюлозы, по меньшей мере, частично представленный внегранулярно, что уменьшает напряжение, вЬ 1 зЬ 1 вающее появление трещин в таблетке. ТаблетированнЬцЙ препарат по изобретению, содержащий коллоидный диоксид кремния и внегрануляр ный наполнитель на основе целлюлозы (например мшсрокристаллической целлюлозы), повидимому, обладает синергическим эффектом и является наиболее удобным и прочным в виде таких таблеток валацикловира, которые могут быть соответственно изготовлены с приемлемой твердостью и без возникновения трещин даже при высокой силе прессования.Согласно предпочтительному воплощению данного изобретения предлагается таблетка,содержащая, по меньшей мере, 50% (мас./мас.) валацикловира или его соли, связывающий агент, смазывающее вещество, от 0,05 до 3%(мас./мас.) коллоидного диоксида кремния и от 3 до 30% наполнителя на основе целлюлозы. При этом валацикловир или его соль заключены внутри гранул таблетки, смазывающее вещество, коллоидный диоксид кремния и, по меньшей мере, часть наполнителя на основе целлюлозы присутствуют внегранулярно, причем хрупкость таблетки не превышает 1%, твердость составляет, по меньшей мере, 9 кПа, а сила вЬ 1 талкивания не превышает 1000 ньютонов.Предпочтительно, чтобы наполнитель на основе целлюлозы представлял собой микрокристаллическую целлюлозу (например Ау 1 се 1) и составляет предпочтительно от 5 до 15%(мас./мас.), наиболее предпочтительно приблизительно 10% (мас./мас.). Размер частиц наполнителя на основе целлюлозы предпочтительно составляет от 20 до 300 мкм, более предпочтительно от 30 до 200 мкм и наиболее предпочтительно от 50 до 100 мкм.Связывающий агент служит, например,ДЛЯ СВЯЗЫВЗНИЯ ВОСДИНО ПСрВИЧНЪ 1 Х И ВТОрИЧНЫХ частиц И ПОВЫШСНИЯ ТВСрДОСТИ таблетки. Связывающий агент предпочтительно представлен в количестве от приблизительно 1 до приблизительно 5% (мас./мас.), более предпочтительно от приблизительно 2 до приблизительно 4% (мас./мас.) и представляет собой соответствующее связывающее вещество некрахмальной природы, например мегилцеллюлозу, или, более ПрСДПОЧТИТСЛЬНО, ПОВИДОН. ПРСШИУЩССТВСННО используется марка повидона К 30, более предпочтительна марка К 90.Связывающий агент, например повидон,перед добавлением к лекарственному средству может быть растворен в гранулирующем растворителе (например воде), но предпочтительно его добавляют к лекарственному средству и другим эксципиентам в сухом виде (по меньшей мере, частично) и только затем добавляют гранулирующий раствор (например раствор повидона в воде).Смазывающее вещество присутствует, как правило, в количестве от приблизительно 0,1 до приблизительно 2,0% (мас./мас.), предпочтительно от приблизительно 0,1 до приблизительно 1,0% (мас./мас.). Несмотря на то, что такие смазывающие вещества, как тальк или лаурилсульфат натрия, являются приемлемыми, сма 000276зывающее вещество предпочтительно представляет собой производное стеарата, более предпочтительно стеарат щелочно-земельного металла, например стеарат магния. ВЬ 1 шеуказанные количества относятся к стеарату, в идеале представленному в количестве от приблизительно 0,3 до приблизительно 0,6% (мас./мас.).Хотя валацикловир и хорошо растворим,особенно в виде соли, предпочтительно, чтобы в таблетированном препарате присутствовал разрыхлитель, приемлемо в количестве от приблизительно 0,5 до приблизительно 20% (мас./мас.),более предпочтительно от приблизительно 0,5 до 7,0% (мас./мас.). Разрыхлитель преимущественно находится внутри гранул таблетки и может быть добавлен до или после связывающего агента. В качестве разрыхлителей могут быть использованы глины, например каолин, бентонит или Х/еедпш (товарный знак), целлюлозы,например микрокрисгаллическая целлюлоза или натриевая соль кроскармеллозы, в частности Ас-Ы-Бо] (товарный знак). Предпочтительно применяют разрыхлитель неионной природы,например кросповидон. Предпочтительное содержание кросповидона составляет от приблизительно 0,5 до приблизительно 7,0%(мас./мас.), более предпочтительно от приблизительно 2 до приблизительно 5% (мас./мас.) и предпочтительно, чтобы часть его присутствовала внутригранулярно.Согласно еще одному воплощению данного изобретения предлагается способ получения таблетки, содержащей, по меньшей мере, приблизительно 50% (мас./мас.) валацикловира или его соли, связывающий агент, наполнитель на основе целлюлозы, смазывающее вещество и приблизительно от 0,05 до 3,0% (мас./мас.) коллоидного диоксида кремния; причем твердость таблетки составляет, по меньшей мере, 9 кПа,хрупкость не превышает 1%, а сила вЬ 1 талкивания не превышает 1000 Н. Указанный способ включает формование гранул, содержащих валацшловир или его соль, а затем смешивание смазывающего вещества, диоксида кремния и,по меньшей мере, части наполнителя на основе целлюлозы с указанными гранулами.Предпочтительно указанный способ включает формование гранул путем смешивания валацшловира или его соли, возможно, связывающего агента или его части и, возможно, части наполнителя на основе целлюлозы; гранулирование с помощью гранулирующего раствора с образованием гранул или растворение связывающего агента или его части в гранулирующем растворе перед добавлением к валацикловиру; высушивание гранул; смешивание гранул со смазывающим веществом, коллоидным диоксидом кремния и, возможно, наполнителем или его частью; и затем прессование перемешанной композиции с получением таблетки.В ПрСДПОЧТИТСЛЬНОМ ВОПЛОЩСНИИ ДЗННОГО изобретения предлагается способ получения(мас./мас.) валацикловира или его соли, связывающий агент, смазывающее вещество, от 0,05 до 3,0% (мас./мас.) коллоидного диоксида кремния и от 3 до 30% (мас./мас.) наполнителя на основе целлюлозы; причем твердость таблетки составляет, по меньшей мере, 9 кПа, хрупкость не превышает 1%, а сила выталкивания не превышает 1000 Н. Указанный способ включает формование гранул посредством смешивания валацикловира или его соли, возможно, связывающего агента или его части и, возможно, части наполнителя на основе целлюлозы; гранулирование с помощью гранулирующего раствора с образованием гранул или растворение связывающего агента или его части в гранулирующем растворе перед добавлением к валацикловиру; высушивание гранул; смешивание гранул со СМЗЗЫВЗЮЩИМ ВСЩССТВОМ, КОЛЛОИДНЫМ ДИОКСИдом кремния и, по меньшей мере, частью наполнителя на основе целлюлозы; а затем пресСОВЗНИС перемешанной КОМПОЗИЦИИ С ПОЛУЧСНИем таблетки.Коллоидный диоксид кремния перед смешиванием с гранулами может сначала быть смешан со смазывающим веществом, предпочтительно производным стеарата (например стеаратом магния), либо он может быть добавлен отдельно от смазывающего вещества. Если смазывающее вещество представляет собой производное стеарата, то предпочтительное значение соотношения стеарата к коллоидному диоксиду кремния составляет приблизительно от 1:1 до 1021, более предпочтительно, приблизительно от 1:1 до приблизительно 3:1.Кроме того, согласно настоящему изобретению предлагается таблетка (описанная выше) для применения в медгщине, например при лечении заболеваний вирусной природы у животНЫХ, В ЧЗСТНОСТИ МЛСКОПИТЗЮЩИХ, а ШИСННО человека. Указанное соединение является наиболее полезным при лечении заболеваний, вызванных различными ДНК-вирусами, например ГСрПССНЪ 1 МИ ИНфСКЦИЯМИ, В ЧЗСТНОСТИ, ПРОСТЫМ герпесом 1 и 2, вирусом ветряной оспы, цитомегаловирусом, Эпстайна-Барр вирусом (ЕрзтептВагг) или вирусом герпеса человека-6 (ЪШУ-б),равно как и заболеваъшй, вызванных вирусом гепатита В. Указанное активное соединение ТЗКЖС МОЖСТ ПрИМСНЯТЬСЯ ДЛЯ ЛСЧСНИЯ ИНфСКций вируса папилломы или бородавочного вируса и, кроме того, может вводиться в сочетаНИИ С ДрУГШИИ терапевтическими агентами, например с зидовудином, для лечения ретровирусных сопутствующих инфекций, в частности ВИЧ-инфекций.Помимо применения в лекарственной терапии человека активное соединение, с целью лечения заболеваний вирусной природы, может бЫТЬ ВВСДСНО И ДрУГИМ ЯСИВОТНЫМ, В ЧЗСТНОСТИ МЛСКОПИТЗЮЩИМ.В соответствии с настоящим изобретением также предлагается способ лечения вирусной инфекции, в частности герпесной вирусной инфСКЦИИ, у ЯСИВОТНОГО, В ЧЗСТНОСТИ МЛСКОПИТЗЮщего, например человека, включающий введение реципиенту одной или большего числа таблеток по изобретению с целью обеспечения эффективного антивирусного количества активноГО СОСДИНСНИЯ.Помимо этого, согласно настоящему изобретению предлагается применение активного соединения в препаративной форме в виде таблетки по изобретению для лечения вирусной инфекции.В зависимости от подлежащего лечению состояния таблетка по изобретению может быть введена любым способом, но предпочтителен пероральный способ введения. Несмотря на то,что в пределы объема изобретения попадают разные таблетки, например диспергируемая таблетка или таблетка для жевания, предпочтительной таблеткой является таблетка для глотаъшя, более предпочтительной таблетка для глотания, покрытая оболочкой. Однако ясно, что ПРСДПОЧТИТСЛЬНЫЙ СПОСОб ПрИМСНСНИЯ МОЖСТ меняться в зависимости, например, от состояния рецигшента.Для каждого из указанных выше применеъшй и показаний к применению требуемые количества активного ингредиента (определенного выше) будут зависеть от ряда факторов, включая тяжесть состояния, подлежащего лечению, и ШЩИВИДУЗЛЬНОСТЬ реципиента, И, В КОНСЧНОМ счете, они выбираются по усмотрению лечащих врача или ветеринара. Однако обычно для каждого из этих применений и показаний к применению приемлемая эффективная доза будет лежать в интервале от 1 до 150 мг на килограмм ВССЗ тела реципиента В ДСНЬ, ПрСДПОЧТИТСЛЬНО В интервале от 5 до 120 мг на килограмм веса тела в день (если не определено иначе, то все значеНИЯ МЗССЫ ЗКТИВНОГО ишредиента ВЬГЧИСЛШОТ относительно валацикловира в форме свободного основания). Желаемую дозу предпочтительно представляют в виде одной, двух, трех или четырех, либо большего числа поддоз, вводимых ЧСрСЗ СООТВСТСТВУЮЩИС интервалы В ТСЧСНИС ДНЯ. ЭТИ ПОДДОЗЫ МОГУТ ВВОДИТЬСЯ В СДИНИЧНЪ 1 Х дозовых формах, например, содержащих приблизительно от 50 до 2000 мг, предпочтительно приблизительно 250, 500, 1000 или 2000 мг активного ингредиента в единичной дозовой форме.В качестве рекомендуемых приводят следующие схемы приема:лечение инфекции, вызываемой вирусом простого герпеса 1 и 2 типа:- общая дневная доза приблизительно 1 или 2 г, вводимая по 500 мг два раза в день или по 1 г два раза в день в течение от 5 до 10 дней;подавление инфекций, вызываемых вирусом простого герпеса 1 и 2 типа:
МПК / Метки
МПК: A61K 9/20
Метки: содержащие, кремния, диоксид, валацикловира, таблетки, коллоидный
Код ссылки
<a href="https://eas.patents.su/16-276-tabletki-valaciklovira-soderzhashhie-kolloidnyjj-dioksid-kremniya.html" rel="bookmark" title="База патентов Евразийского Союза">Таблетки валацикловира, содержащие коллоидный диоксид кремния</a>
Предыдущий патент: Способ смены передаточного отношения и устройство для его осуществления
Следующий патент: Способ экстракции клавулановой кислоты
Случайный патент: Охлаждающий элемент пирометаллургического реактора и его изготовление