Способ электролитического получения металлов
Формула / Реферат
1. Способ электролитического получения титана и титановых сплавов из металлических соединений металлов, в котором применяют устройство для электролитического получения металлов, содержащее
катод-тигель, содержащий твердый металлический гарнисаж, жидкий электролит, имеющий плотность ниже, чем у металла, и жидкую ванну полученного металла;
один или несколько нерасходуемых анодов, частично погруженных в электролит, со средствами для регулирования расстояния их от поверхности катода;
средства для подачи соединений металлов, компонентов электролита и легирующих материалов в электролит;
средства питания энергией для подвода постоянного тока к ванне металла и через электролит к анодам, вызывающего катодное восстановление металла в жидком состоянии и анодное выделение анодного газа с выделением тепла, поддерживающего электролит в расплавленном состоянии;
герметичный сосуд, в который перемещаются анодные газы, выделенные при электролизе.
2. Способ по п.1 получения титана, в котором электролит представляет собой смесь фторида кальция, хлорида кальция и металлического кальция.
3. Способ по п.1 или 2, в котором электролит содержит соединения щелочных и щелочнo-земельных металлов.
4. Способ по п.1 или 2, в котором соединениями металлов, подаваемыми в устройство электролитического получения, являются фториды, хлориды, бромиды и иодиды.
5. Способ по п.1, в котором катод-тигель представляет собой медный тигель.
6. Способ по п.1, в котором тигель охлаждают и вызывают затвердевание защитного слоя электролита на внутренних поверхностях.
7. Способ по п.1, в котором герметичный сосуд охлаждают для конденсации паров, выходящих из электролита, на его внутренние поверхности для защиты сосуда от воздействия анодных газов.
8. Способ по п.1, в котором анодные газы, образованные в процессе электролитического выделения металлов, отводят через каналы, выполненные в нерасходуемых анодах.
9. Способ по п.1, в котором соединения получаемых металлов подают в электролит через каналы, выполненные в нерасходуемых анодах.
10. Способ по п.1, в котором подачу соединений получаемого металла осуществляют посредством трубки из электроизолирующего и химически инертного материала, чтобы отделить объем, в котором восстанавливают указанные соединения, от анодной граничной фазы, в которой выделяются анодные газы.
11. Способ по п.1, в котором сплавы получают путем подачи в устройство элементов и соединений в количестве, пропорциональном их электрохимическим характеристикам, чтобы обеспечить заданный химический состав.
12. Способ по п.1, в котором устройство для электролитического получения металлов содержит средства для непрерывного отвода затвердевшего полученного металла.
13. Способ по п.1, в котором металл, полученный в жидком состоянии, отводят посредством холодного пальца-сопла с индукционным нагревом.
14. Способ по п.1 в применении к производству листов, слябов, блюмов, заготовок из металлов и сплавов.
15. Способ по п.1, в котором анод, погружаемый в электролит, имеет нижний конец, профилированный и механически обработанный так, чтобы усилить выделение анодных газов.
16. Способ по п.1, в котором ток подводят посредством охлаждаемых анодных токоподводящих шин.
17. Способ по п.1, в котором устройство содержит вакуум-плотную втулку для механизма привода анодов.
18. Способ по п.1, в котором используют компьютерную систему для контроля установившегося режима, чтобы поддерживать установившееся состояние путем регулирования расстояния между анодами и жидкой катодной поверхностью.
19. Устройство для электролитического получения металлов, имеющее характеристики, указанные в п.1.
20. Способ по пп.1, 2 или 3, в котором электролит содержит добавки одновалентных щелочных и двухвалентных щелочно-земельных металлов, такие как Саш + Кш или Саш + Мgш.
Текст
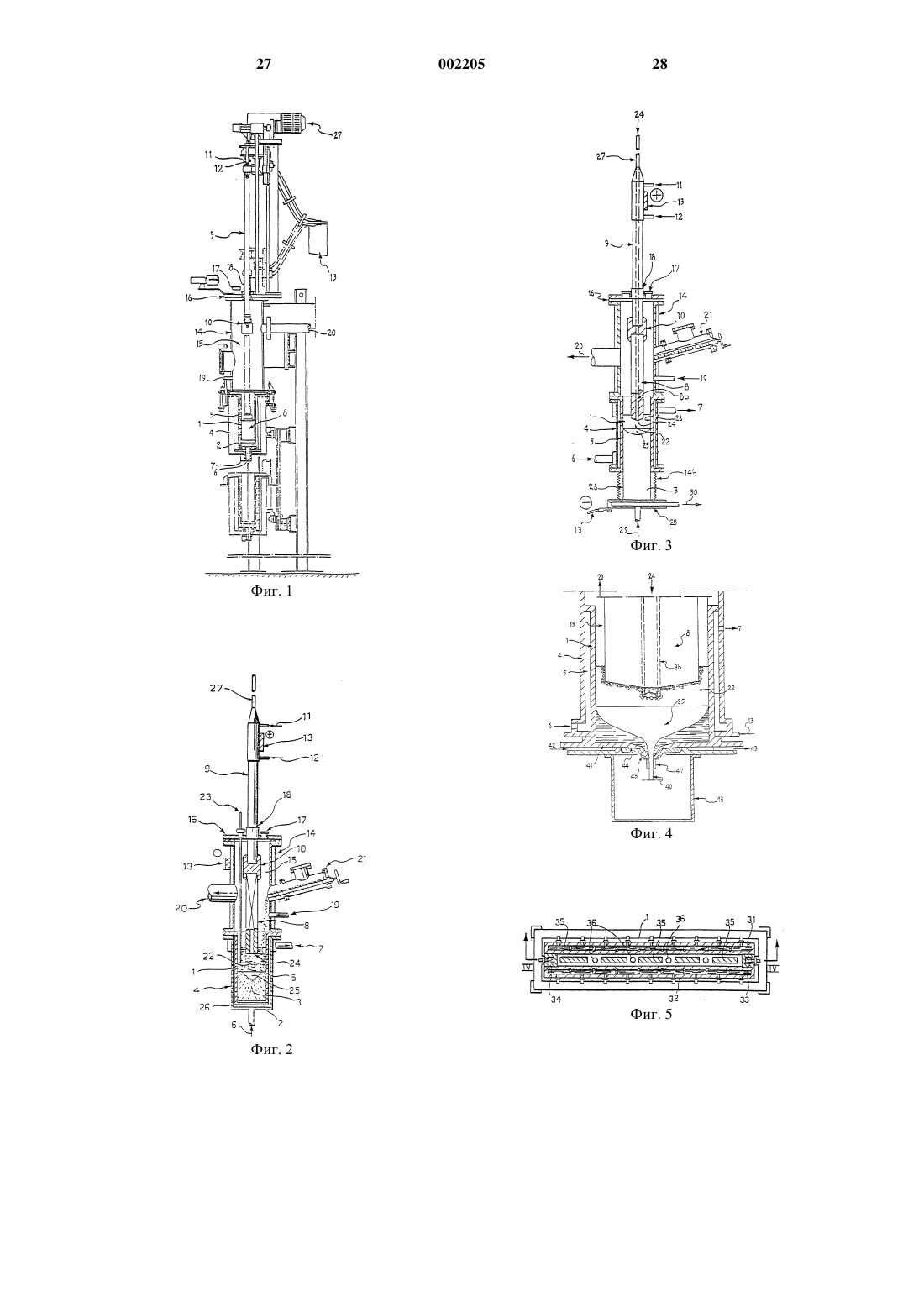
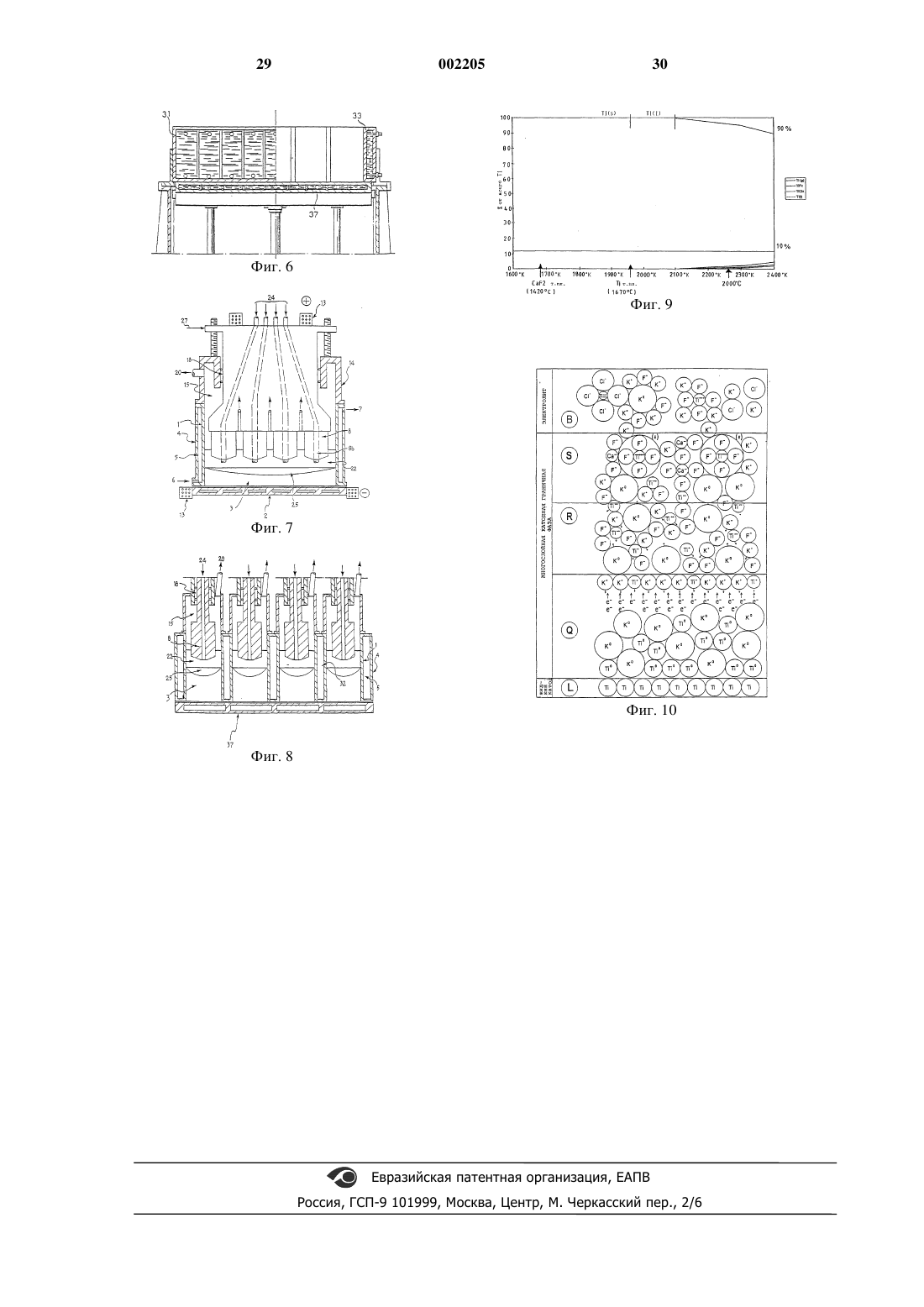
1 Вводная часть Для усовершенствования промышленных электролитических способов нужно принимать такие решения, которые включают изменения физических рабочих условий. Следовательно, необходимо практическое понимание физического смысла данных, описывающих рабочие условия способа. Первой причиной технологического отставания в развитии электролитического способа получения Ti является недостаточное теоретическое понимание системы Ti. Вторая причина заключается в том, что невозможно взять информацию из сведений об электролитическом способе получения Аl, поскольку их теоретическая формулировка далека от общепринятой. Это состояние дела является следствием отсутствия фундаментальной работы по электрохимии, а формальные представления, использованные в опубликованной литературе по данному предмету, часто лишены рациональной основы и физического смысла. Действительно, когда металлург пытается объяснить явления, происходящие у отдельного рабочего электрода (а это именно то, что его интересует), он запутывается в вопросе о принципах, касающихся термодинамики электрически заряженных частиц. Это состояние науки особенно удручает,если вспомнить, как велик вклад электрохимии в развитие термодинамики. Читая опубликованную литературу, можно видеть, что электрохимики все еще боятся глубоко вникать в дело, то есть отказаться от условий обратимого равновесия, бесполезных для металлургов, и отказаться от нереалистичной модели двухмерной границы раздела. Описанная ниже работа является попыткой получения какой-либо практически полезной понятной информации о способах, происходящих у отдельного электрода (при установившихся динамических режимах), на микроскопическом уровне, далеко от условий обратимого равновесия. Полученные практические данные являются предметом настоящего изобретения. Основанные на этой работе размышления содержатся в M.V. Ginatta Ph.D. Thesis (Ссылка 1). Следующее далее описание предназначено для иллюстрации характеристик системы Ti в пределах, необходимых для заявки на патент, и потому без использования точных формул необратимых процессов термодинамики. Задачей является обеспечиваемое лучшим пониманием достижение одной из целей настоящего изобретения, а именно усовершенствования технологии электролитических процессов. Предпосылки создания изобретения В настоящее время титан получают электролитическим путем в системах, состоящих из 2 расплавленных хлоридов, причем полученный металл имеет форму чистых кристаллов. Промышленная проблема электролиза хлоридов состоит в том, что титан осаждается на катодах в твердом состоянии с кристаллической морфологией больших участков поверхности и низкой объемной плотностью. Рост твердого катодного осадка требует частого удаления осадка из электролита посредством манипулятора описанного в патенте США 4670121 типа. Титановый осадок, содранный с катодов,удерживает некоторое количество электролита,захваченного между кристаллами, и последующая операция удаления захваченного остаточного электролита неизбежно снижает чистоту полученного металла, очень чистого в момент его электролитического восстановления на катодах. Кроме того, электрохимическая характеристика титанового осадка на твердых катодах ограничивает максимальную плотность тока,при которой может проходить электролиз, до относительно низких значений с соответствующим снижением производительности конкретной установки. Далее, для получения кристаллических осадков концентрация ионов титана в электролите должна находиться в диапазоне, требующем разделения между анолитом и каталитом,как описано в патенте США 5015342. Электролитическое получение титана в жидком состоянии имеет некоторые эксплуатационные преимущества по отношению к получению твердых осадков, как, например:- площадь катода не изменяется в ходе электролиза, что облегчает достижение и контроль установившегося режима процесса;- отделение чистого металла, полученного из электролита, является полным и не требует никакой дополнительной операции, кроме отверждения и охлаждения в защитной атмосфере;- отвод полученного металла может быть осуществлен без нарушения хода электролиза,как это будет объяснено в описании изобретения. Электролитическое получение титана при температурах около его точки плавления имеет очень важное термохимическое преимущество,поскольку соединения титана с более низкой валентностью в электролите имеют при указанных температурах очень низкую для данного режима концентрацию и потому отсутствуют реакции диспропорционирования или окислительно-восстановительные реакции, влияющие на выход процесса по току (фиг. 9). Электролитическое получение титана при температурах выше его точки плавления имеет очень важное электрохимическое преимущество, поскольку значения плотности тока обмена на жидких Ti катодах очень намного выше, чем на твердых Ti катодах. 3 Кроме того, добавление к основному компоненту электролита вспомогательного ионного соединения дополнительно увеличивает значения плотности тока обмена, поскольку не позволяет образования ионных металлических комплексов; ответственных за замедление процессов в катодной граничной фазе. Краткое изложение сущности изобретения Предмет настоящего изобретения определен в прилагаемых пунктах формулы изобретения. Одной из задач, решаемых настоящим изобретением, является электролитическое восстановление металлического титана в жидком состоянии. В основу настоящего изобретения положена задача использовать термический защитный слой, созданный электролитом, для сохранения большого объема жидкого титана, что обеспечивает возможность работы совершенно жидких катодов. Этот способ работы позволяет использовать намного более высокие плотности тока по сравнению с твердыми катодами. Другой задачей настоящего изобретения является полное отделение титана от электролита в катодной граничной фазе во время электрохимического восстановления при высоких плотностях тока. Следующей задачей настоящего изобретения является точное регулирование электрохимических полуреакций, происходящих у катода,посредством контролирующей системы, которая также управляет изменениями электрохимических параметров процесса. Следующей задачей настоящего изобретения является использование дополнительного преимущества электролиза с жидкими катодами, состоящего в возможности восстановления металла при низкой концентрации ионов титана в электролите с обеспечением высоких плотностей тока и получения высоких выходов по току. Для титановых электрохимических систем не существует особого электролита, то есть эквивалента криолита для алюминия, который мог бы позволить подачу в электролизер оксидов титана и получение металлического титана с содержанием кислорода в пределах общепринятых торговых технических условий. Однако преимуществом титана является крупносерийное мировое производство тетрахлорида титана высокой чистоты, который является наиболее подходящим для промышленности пигментов. Поскольку титановые минеральные концентраты всегда должны быть очищены от примесей, для очистки титанового сырья можно использовать хорошо известный способ карбохлорирования так же, как используют байеровский (Вауеr) способ рафинирования оксида алюминия в производстве алюминия. 4 Что могло бы быть дополнительно выгодным для снижения стоимости электролитического производства титана, так это промышленное внедрение второго типа тетрахлорида титана более низкой чистоты и более низкой стоимости по сравнению с сортом, используемым для пигментов. Следует учитывать два фактора:- собственную очищающую способность расплавленных солевых электролитов, которые могут сохранять в растворе некоторые из примесей или могут выделять другие в виде пара;- некоторые из элементов, которые в промышленности пигментов считают примесями,фактически являются легирующими металлами для титановых сплавов (например, V, Zr, Al,Nb). Понятно, что этот второй тип тетрахлорида титана может быть получен лишь производителями с увеличенным объемом производства электролитического титана. Следующей задачей настоящего изобретения является способ растворения тетрахлорида титана в электролите. Так как TiCl4 имеет очень низкую растворимость в расплавленных солях, а кинетика реакции TiCl4 с кальцием очень быстра, то в соответствии с рабочими условиями процесса по настоящему изобретению электролит должен содержать элементарный кальций. Кальций совместно восстанавливается у катода, когда поддерживаются низкие значения концентрации ионов титана, и, будучи почти нерастворимым в титане, элементарный кальций диффундирует в массе электролита в направлении к объему, в который подают TiCl4. Следующей задачей настоящего изобретения является способ подачи титанового сырья в электролит. Одним из возможных вариантов подачиTiCl4 является подача через канал в теле нерастворимого анода с вставленной в него трубкой,предпочтительно изготовленной из химически инертного и электрически непроводящего материала, такого как BN и тому подобное, с возможностью отделения объема, в котором TiCl4 реагирует с кальцием, от анодной граничной фазы, где выделяется газообразный хлор. В соответствии с другим вариантом осуществления настоящего изобретения газообразный хлор, выходящий из электролита, поступает в пространство между боковой стороной электрода и внутренней стенкой кожуха электролизера. Стенку электролизера предпочтительно охлаждают, чтобы способствовать затвердеванию превращенных в пар составляющих ванны на внутренней стенке для обеспечения защиты металла конструкции от воздействия газообразного хлора. Следующей задачей настоящего изобретения является способ минимизации реакции дисмутации (3Ti2+=2Ti3+ + Ti0) и извлечения выгоды из этого. 5 Низкая концентрация титана в электролите, предлагаемая в настоящем изобретении, благоприятствует созданию и поддержанию равновесия. Циркуляционные перемещения электролита при рабочих условиях переносят элементарный титан в зону вблизи катодной граничной фазы, где он коалесцирует в жидкий металл. Наоборот, некоторые из ионов титана, перенесенные в зону вблизи анодной граничной фазы, окисляются до тетрахлорида, что очень полезно для исключения ограничения плотности тока, создаваемого анодным эффектом. Кроме того, элементарный титан, находящийся вблизи точки подачи тетрахлорида титана, взаимодействует с ним с образованием ионов титана с более низкой валентностью. Следующей задачей настоящего изобретения является способ минимизации абсолютного количества всех указанных реакций путем обеспечения предлагаемой концентрации растворенного в электролите элементарного кальция,который реагирует очень эффективно и поддерживает установившийся режим процесса. Следующей задачей настоящего изобретения является способ содействия предварительному восстановлению TiCl4 путем использования электроннопроводящего средства для подачи соединения, соединенного с отрицательной клеммой отдельного источника энергии или с источником тока в устройстве через средство регулирования тока по аналогии с тем, что предлагается в патенте США 5015342. Этот способ работы предлагается для обеспечения полной абсорбции TiCl4 электролитом при высоких скоростях производства титана, но это требуется не всегда. Следующей задачей настоящего изобретения является способ контроля температуры электролита, обеспечивающий показания, которые не нарушаются токами в устройстве. Датчик температуры удобно устанавливать в трубке в теле анода, через которую подают титановое сырье. Температура в этом месте является показателем резистивного (омического) тепла, создаваемого током электролиза, и показание температуры является точным. На наружной же стороне анода охлаждающее действие охлаждаемой стенки конструкции вызывает образование твердой электролитной корки, которая затрудняет измерение температуры. Следующей задачей настоящего изобретения является способ регулирования температуры электролита для поддержания установившегося режима процесса при катодной ванне жидкого металла оптимальной глубины. Следующей задачей настоящего изобретения является способ поддержания стабилизированного производства электролитического титана. 6 При рабочих условиях, предлагаемых в соответствии с настоящим изобретением, ТiСl4 представляет собой газ, но при температуре окружающей среды он является жидкостью, которую очень удобно перемещать дозирующим насосом. Входя в канал в рабочем аноде, TiCl4 испаряется и затем дополнительно нагревается,проходя по питающей трубке. При описанных условиях скорость поглощения TiCl4 электролитом очень высока, и кпд поглощения почти равен единице. Совокупность рабочих условий по настоящему изобретению очень облегчает регулирование скорости подачи TiCl4 пропорционально постоянному току, подводимому к устройству. Следующей задачей настоящего изобретения является способ использования графита в качестве материала нерастворимого анода в расплавленных фторидах. При выборе TiCl4 в качестве сырья, как это предлагается в настоящем изобретении, углеродные электроды ведут себя как нерастворимые, минимизируя тем самым возможность образования фторхлоруглеродных соединений,которые неустойчивы, по крайней мере, при рабочих температурах в диапазоне, используемом для термического разложения указанных соединений в печах для прокаливания. Следующей задачей настоящего изобретения является геометрическая конфигурация анода, в частности его части, погруженной в электролит. Создатели данного изобретения установили, что для обеспечения равномерного распределения тока по электролиту является предпочтительным делать анод в форме перевернутого конуса. Кроме того, наличие радиальных канавок улучшает выделение пузырьков анодного газа. Следующей задачей настоящего изобретения являются способы отвода полученного металла. Более простым способом является тот, в котором ванна жидкого металла в охлаждаемом тигле постепенно затвердевает и становится слитком, который растет в высоте в ходе электролиза. В устройстве по настоящему изобретению анод нерастворим и, следовательно, не меняет своей длины во время получения металла, а поэтому предусмотрено средство для подъема анода, с тем, чтобы сохранять постоянными все параметры электрохимического процесса. Подъем прекращают, когда слиток вырастает настолько, что заполняет весь тигель, и в этот момент электролиз прерывают, чтобы обеспечить возможность извлечения полученного слитка, и затем вновь запускают для продолжения процесса. Более разработанный способ сбора полученного металла аналогичен тому, который ис 7 пользуют при непрерывной разливке металлов,где растущий слиток постепенно выводят через сквозной кристаллизатор. В устройстве по настоящему изобретению система регулирования уровня поднимает и опускает нерастворимый анод в интервале, необходимом для того, чтобы следовать за ростом слитка и перемещением вниз, для сохранения постоянными рабочих параметров электролиза. Способ сбора полученного металла все еще в жидком состоянии предлагается в патенте США 5160532 (Mark G. Benz), касающемся холодного пальца-сопла, управляемого путем индукционного плавления. Следующей задачей настоящего изобретения является модернизация электролизера путем снабжения его индукционной системой управления холодным пальцем-соплом как предпочтительной конструкцией для слива полученного жидкого титана. Это система периодического действия, которое должно быть синхронизировано с регулированием уровня анода, но она является системой, по существу, непрерывного действия для электролизеров с большими площадями катодов. Следующей задачей настоящего изобретения является непосредственное получение титановых сплавов путем применения описанного устройства. Легирующие элементы вводят в электролит как вместе с подаваемым TiCl4, используя их растворимость, так и через отверстие для подачи твердого сырья в виде металлов, лигатур, соединений. Требуемый химический состав полученных сплавов зависит от электрохимических характеристик сплавляемых металлов и поэтому время и вводимые количества назначают так,чтобы обеспечить заданные технические условия для получаемых сплавов. Следующей задачей настоящего изобретения является высокая гомогенность полученных сплавов по сравнению с традиционными технологиями плавления. Это обусловлено низкой скоростью переноса металлов по сравнению со скоростью переноса при плавке слитков, что в сочетании с электромагнитным перемешиванием ванны жидкого металла, вызываемым прохождением электрического тока, обеспечивает получение очень однородных металлических сплавов. Следующей задачей настоящего изобретения является непосредственное получение металлических листов с большой площадью поверхности, что позволяет сократить затраты на металлургическую работу по переделу цилиндрических слитков в блюмы и слябы и затем в листы, особенно для труднопрокатываемых сплавов. Следующей задачей настоящего изобретения является непосредственное получение ме 002205 8 таллических заготовок, предназначенных для металлургического передела в длинные изделия из металлов и сплавов, что сокращает количество дорогостоящих металлургических работ и металлического скрапа, образующегося при обработке крупных цилиндрических слитков. Краткое описание чертежей Способ и устройство по настоящему изобретению описаны ниже более подробно на следующих далее рабочих примерах со ссылкой на прилагаемые чертежи, на которых фиг. 1 - вид спереди в частичном разрезе устройства для осуществления способа по настоящему изобретению; фиг. 2 - вид спереди в частичном разрезе устройства для осуществления способа в соответствии с вариантом примера 1; фиг. 3 - вид спереди в частичном разрезе устройства для осуществления способа в соответствии с вариантом примера 2; фиг. 4 - вертикальный разрез тигля для осуществления способа в соответствии с вариантом примера 3; фиг. 5 - вертикальный разрез тигля для осуществления способа в соответствии с вариантом примера 4; фиг. 6 - разрез по линии IV-IV на фиг. 5; фиг. 7 - вертикальный разрез устройства для осуществления способа в соответствии с вариантом примера 5; фиг. 8 - вертикальный разрез аноднокатодной части устройства для осуществления способа в соответствии с вариантом примера 6; фиг. 9 - диаграмма равновесия, иллюстрирующая изменение концентрации разновидностей титана в зависимости от температуры; фиг. 10 - схематическое изображение микроскопической модели катодной граничной фазы при динамическом установившемся режиме процесса. Определения 1) Катодная граничная фаза - это трехмерная среда (не двухмерная граница раздела), то есть объем, в котором происходят электродные полуреакции; он находится между электроннопроводящим катодом и ионно-проводящим электролитом. По толщине катодной граничной фазы существуют большие градиенты концентрации ионов и атомов и всех физико-химических переменных. Например, значение электрической проводимости находится в пределах от электронного типа при 10000 Ом-1 см-1 в массе металлического электрода до ионного типа при 1 Ом-1 см-1 в массе электролита. Внутри граничной фазы плотность энергии имеет очень высокие значения, то есть понятия твердое вещество,жидкость и газ неприменимы. О деталях смотри стр. 163 ссылки 1. 2) Все катодные и анодные процессы приводят в действие от источника постоянного тока(который находится вне электролизра, но является частью электрохимической системы), который создает электрическое поле (разность потенциальной энергии электронов) между электронно-проводящим катодом и электроннопроводящим анодом. 3) При обычных режимах работы титановых электролизеров разность потенциалов разложения между соединением Ti и соединением К мала, то есть можно сказать, что процесс восстановления Ti лишь чуть-чуть лучше термодинамически, чем процесс восстановления К. 4) Диаметр иона Ti+ составляет примерно 1,92 ; можно сказать, что процесс восстановления Ti0 не имеет, с точки зрения кинетики,преимуществ по отношению к восстановлению К 0. 5) Роль носителя ионного тока в электролите почти полностью выполняет К+: t+= 0,99. Основа изобретения В соответствии со способом по настоящему изобретению предлагаются условия для восстановления многовалентных разновидностей титана до металлического титана. Прилагаемое схематическое изображение(фиг. 10) сжато иллюстрирует микроскопический механизм, происходящий, как полагают, в пределах толщины катодной граничной фазы при электролитическом получении жидкого Ti в соответствии с электродинамической моделью,предложенной by M.V. Ginatta, Ph.D. Thesis,Colorado School of Mines (ссылка 1). Определения терминов, использованных в описании настоящего изобретения, даны в разделе 4. Микроскопический механизм представляет реальный динамический установившийся режим, при котором одновременно, но в разных местах протекают химические и электрохимические реакции, запускаемые градиентом электрохимических потенциалов, то есть локального химического потенциала разновидностей, индуцированного извне приложенным электрическим полем. Для облегчения иллюстрации способа по настоящему изобретению описание начинается с операций запуска электролизера и ведется далее до установившегося режима, причем предполагается, что катодная граничная фаза многослойна. Система содержит электролит, состоящий из СаF2, KF, KCl и элементарных К, Са, ванну жидкого металлического титана в качестве катода и средство ввода TiCl4. Постоянный ток, подаваемый с выпрямителя при низком напряжении и низкой катодной плотности тока, вызывает восстановление К 0 на катоде в виде ванны жидкого металлическогоTi, где К имеет очень низкую растворимость, с одновременным выделением Сl2 у нерасходуемого анода. 10 С ходом электролиза концентрация К 0 в слое Q повышается относительно низкой концентрации К 0 в слое В. При запуске слоев R и S, как полагают,еще нет. Этот режим работы создает разность химических потенциалов между Q и В, которая перемещает К 0 из Q в В. К 0 поступает в В, где он реагирует с TiCl4,который начинают вводить, с образованиемK3TiF6, который является устойчивым комплексом Ti3+, и КСl, который является устойчивым хлоридом. При кулоновском взаимодействии трехзарядный (мелкий) ион Ti3+ может способствовать связыванию 6F- с очень малым межионным расстоянием и потому с большой энергией связи.Ti3+ является мелким ионом, так как у него потеряны 3 электрона из 22 и поэтому при неизменном положительном заряде ядра, остальные 19 электронов, обобществляя один и тот же общий положительный заряд, притягиваются намного ближе к ядру. Действительно, атомный диаметр Ti0 равен 2,93 , а диаметр иона Тi3+ равен 1,52 , что составляет 1/7 по объему. Таким образом, при низкой плотности тока(например, 1,0 А/см 2) катодная система состоит только из слоя В, в котором образуетсяK3TiF6 с образованием TiF6(3-) и 3 К+, в результате чего образуется слой S. Комплекс TiF6(3-) нe может войти в R, намного меньший, чем Q, потому что его полный заряд сильно отрицательный. К 0, поступающий из R, доходит до комплекса TiF6(3-) в S и использует F- для переноса 1 электрона к Ti3+, который увеличивается до Ti(диаметр иона 1,88- это вдвое увеличенный объем) и в результате освобождает F-. Эта реакция дает в качестве продукта Ti,который является двухзарядным ионом, то есть имеет средние размер, не образует комплекса сF- и перемещается ионным электрическим полем в направлении к катоду, в основном так же,как другие катионы. Таким образом, Ti, поступающий в R вместе с К+, сталкивается с имеющим более высокий химический потенциал К 0, поступающим из Q, который в результате восстанавливает Ti до Ti+. Фактически химический потенциал К в R больше, чем в S, но недостаточно высок для получения Ti0. Теперь Ti+ представляет собой однозарядный ион с размерами, сравнимыми с К+, и, перемещаясь ионным электрическим полем, входит вместе с К+ в Q, где присутствующие там 11 электроны обеспечивают совместное восстановление их до Ti0 и К 0.Ti0 коалесцирует в ванну жидкого титана, а 0 К , имеющий очень низкую растворимость в Ti,накапливается на поверхности ванны титана. Таким образом, при средних плотностях тока (например, 1,0 А/см 2) образуются слой S,в котором разлагается K3TiF6 и образуется Ti,и слой R, в котором К 0 производит дальнейшее восстановление Тi до Ti+. Циклический вольтамперометрический анализ частично подтверждает описанный выше микроскопический механизм для пускового режима; действительно, при 0,1 В/с от анодного до катодного потенциалов имеется ряд пиков,который, как можно предположить, представляет ряд стадий, на которых происходят частичные реакции восстановления-окисления. Однако результаты циклического вольтамперометрического анализа дают лишь ограниченную информацию, поскольку они являются результатами измерений при неустановившемся переходном режиме. Кроме того, некоторые из частичных реакций на указанных стадиях имеют чрезвычайно быструю кинетику, и плотности тока обмена указанных катодных систем имеют очень высокие значения. Увеличение разности электрических потенциалов между ванной титана и границей между слоями Q/R путем увеличения напряжения питания дает в результате, как было установлено создателями настоящего изобретения, больше электронов в Q (более высокая катодная плотность тока), что позволяет восстановить больше К+ и Ti+ и в конечном счете получить больше К 0 и металлического титана. Химический потенциал К 0 в Q становится намного выше, чем в R и, следовательно, в S, в результате чего из R в S поступает больше К 0,взаимодействующего с большим числом TiF6(3-),и восстанавливается больше Ti, который затем входит в R, где поступающим в большем числе К 0 восстанавливается до Ti+. При использовании больших значений плотности тока, вместе с повышением химического потенциала К 0 в R и Q увеличивается также физическая толщина слоев Q, R и S. Продолжая предполагать многослойность для облегчения иллюстрации настоящего изобретения, можно сказать, что более высокие катодные разности потенциалов, создаваемые подводом энергии, и, следовательно, повышенные катодные плотности тока обеспечивают утолщение катодной граничной фазы с образованием ряда четко выраженных слоев, внутри каждого из которых проходит специфическая стадия многостадийной реакции восстановления. Многослойную структуру катодной граничной фазы динамически поддерживают путем подвода постоянного тока от выпрямителя. 12 В каждом из слоев, составляющих катодную граничную фазу, имеются различные значения электрохимических потенциалов для рассматриваемых частиц. Этот динамический установившийся режим обеспечивает возможность постадийного восстановления многовалентных ионов, один электрон за раз, в четко выраженных различных слоях. Имеются геометрические места дискретных разрывов, что является основной характеристикой электрохимических систем. Для установившегося режима можно вкратце представить, где какие реакции одновременно происходят в соответствии с микроскопическим механизмом, следующим образом:- в S: K3TiF6 + К 0 = 4KF + TiF2, оба неустойчивые ионизированные продукты;- в Q; 3K+ + 3 = 3 К 0 и Ti+ += Ti0. Далее, рассматривая этот предлагаемый микроскопический механизм более подробно,можно видеть возможность переноса электронов через биполярный механизм К 0, то есть обмен электронов между К 0 (атом) и соседним К+(ион), и, следовательно, переноса электрического заряда в направлении к электролиту без физического массопереноса. Это может объяснить, почему нет скольконибудь значительного катодного перенапряжения в этого типа электролизере, даже при высоких значениях плотности тока. По некоторой аналогии с процессом электролитического рафинирования металлов с использованием биполярных электродов можно,идя дальше, полагать, что при установившемся режиме может больше не потребоваться восстановление дополнительного числа К 0, поскольку его градиент химического потенциала от Q до S сохраняют перенос электронов и встречная миграция Ti+. Понимание важности роли, которую играют К 0 и К+ в электролизерах этого типа, может также объяснить:- почему содержание К в полученном Ti ниже данных равновесия,- почему выход по току увеличивается с повышением плотности тока, и- почему после прекращения подачи энергии противо-эдс остается в течение нескольких минут, давая кривую деполяризации определенной формы; то есть сначала слой Q, как можно полагать, работает как разрядный отрицательный электрод батареи, расходуя К 0 = К + , а затем возникающее в результате этого снижение химического потенциала К 0 в Q заставляет К 0 перемещаться из R и S в Q, что побуждает граничную фазу работать как анод топливного элемента, пока имеется К 0 в В. 13 Однако пусковой механизм электролиза не является точно обратным явлению деполяризации. На твердых катодах лишь самые начальные условия запуска могут быть представлены микроскопическим механизмом, поскольку сразу же после них кристаллизация создает прерывности на поверхности металла, которые нарушают равномерность распределения плотности тока. Микроскопический механизм может иметь место лишь на вершине растущих дендритов, в то время как корни на запускающей катодной поверхности еще не работают электрохимически. Некоторые из вариантов, проиллюстрированных в настоящем изобретении, основаны на создании вышеописанного механизма для электролиза. Однако другие варианты осуществления настоящего изобретения основаны на следующих соображениях. Крупномасштабная эксплуатация хлоридного процесса, предложенного в патенте США 5015342, всегда показывала, что анолит, заключенный в составном электроде (ТА), содержащем биполярный титановый электрод (ТЕВ),был свободен от ионных частиц титана (всегда это был чистый белый NaCl). Ионы титана более низкой валентности, которые просачивались через ТЕВ, полностью осаждались в виде кристаллов титана элементарным натрием, который присутствовал на передней поверхности ТЕВ. Это было подтверждено отсутствием TiCl4 при выделении газообразного Cl2 на аноде при установившемся режиме.TiCl4 был обнаружен в анодных газах лишь при накоплении в больших количествах кристаллов титана в нижней части ТА в результате нарушения работы ТЕВ. Накопленные кристаллы титана покрывали графитовые аноды и выделяющийся Сl2 начинал их хлорировать. Анализ термодинамических равновесий,сделанный в 1980-ых годах, подтвердил, что в присутствии щелочных и щелочно-земельных металлов восстановление TiCl4 до кристаллического титана при 1100 К заканчивается вблизи нулевой равновесной концентрации низших хлоридов титана в электролите. Последующее решение описанной выше проблемы хлоридного процесса заключалось в непрерывном удалении кристаллического титана, полученного в ТА, но это включало проектирование усовершенствованной технологической установки (внимание: этот объект не был запатентован). Однако дальнейший анализ термодинамических равновесий показал, что описанные выше рабочие условия существуют до 2200 К и для хлоридов, и для фторидов, причем при этих температурах весь присутствующий титан является жидкостью с почти нулевой концентрацией ионов титана низших валентностей (фиг. 9). 14 Существуют некоторые причины, почему электролитический способ, предлагаемый в настоящем изобретении, дает титан в жидком состоянии и не требует диафрагм. Дальнейший термодинамический анализ показал выгоды способа по настоящему изобретению, обеспечиваемые объединенным действием одновалентных щелочных металлов и двухвалентных щелочно-земельных металлов,присутствующих в электролите, например Са + К, Са+ Na или любой другой комбинации типа Са + Мg. Указанные рабочие условия, не позволяющие образования устойчивых металлических комплексов, обеспечивают дополнительное увеличение значений плотностей тока обмена и,следовательно, допускаемой плотности тока процесса. Работать при высокой температуре более выгодно, потому что разность потенциала разложения при 2100 К между фторидами щелочных и щелочно-земельных металлов и фторидами титана намного меньше, чем при 1100 К. Действительно, отрицательное значение температурного коэффициента для фторидов титана (0,63) намного меньше, чем для фторидов щелочных и щелочно-земельных металлов(1,06), а это означает, что с повышением температур потенциал разложения KF уменьшается более быстро, чем потенциал разложения TiF2. Наконец, наиболее подходящие концентрации частиц для соосаждения определяют путем вычисления коэффициента активности. В заключение, точка плавления титана(1943 К), находясь в указанном выше интервале температур, позволяет работать с жидкими катодами со всеми указанными выше электрохимическими и эксплуатационными выгодами. По результатам микроскопического механизма и термодинамического анализа становится совершенно очевидной потребность в конструкторских усилиях изобрести электролизеры,работающие при указанных выше условиях. То есть одной из задач настоящего изобретения является создание электролизеров с очень быстрой кинетикой и очень высокими плотностями тока обмена расплавленных солевых электролитов, которые бы работали лучше всего в режимах получения жидких металлов при высоких плотностях тока. Присутствие второстепенных компонентов в электролите, то есть добавление хлоридов,повышает ионную электропроводимость электролита; следовательно, для постоянной скорости образования джоулева тепла можно использовать более толстый слой электролита, чем при использовании чистого CaF2, то есть можно поддерживать большее расстояние между катодом и анодом для одного и того же приложенного напряжения. 15 Этот способ работы выгоден для ограничения обратной реакции рекомбинации Сl2 с растворенным Са в электролите. Подробное описание изобретения Способ по настоящему изобретению включает одновременное проведение химических реакций в массе электролита и электрохимических реакций в анодной и катодной граничных фазах. Для облегчения иллюстрации изобретения способ и устройство по настоящему изобретению подробно описаны на следующих вариантах рабочих примеров. Пример 1. Устройство, описанное ниже, обеспечивает возможность электролитического получения титана и титановых сплавов из его соединений,в частности фторидов, хлоридов, бромидов и иодидов, путем электролиза в расплавленном солевом электролите, поддерживаемом при температуре более высокой, чем температура плавления титана и его сплавов. Устройство в вертикальном виде фиг. 1 полусхематически показано на фиг. 2 и содержит катод 1, предпочтительно состоящий из медного цилиндра, закрытого на нижнем конце 2 для обеспечения возможности кристаллизации титанового слитка 3. Внутренний диаметр медного цилиндра составляет, например, 165 мм, высота - 400 мм,толщина стенок - 12 мм. Катод-кристаллизатор 1 помещен в сосуд 4, который закрыт на нижнем конце и по размеру больше, чем медный кристаллизатор, в результате чего образуется полое пространство 5,которое составляет водяную рубашку для циркуляции охлаждающей воды. Воду или другую охлаждающую жидкость подают в рубашку через впускное отверстие 6 при температуре около 15 С и отводят через выпускное отверстие 7 при температуре около 30 С со скоростью 3 м/с. Позицией 8 обозначен анод, который является цилиндрическим электродом, соосным и концентрическим с кристаллизатором, изготовлен из графита и имеет диаметр 80-120 мм. Рабочий конец анода предпочтительно выполнен в форме перевернутого конуса для лучшего распределения тока по электролиту и имеет радиальные канавки для улучшения выделения газообразного хлора. Анод соединен с водоохлаждаемой токоподводящей штангой 9 посредством никелированного медного зажима 10. Впускное и выпускное отверстия для охлаждающей воды обозначены соответственно позициями 11 и 12. Токоподводящая штанга 9 соединена с положительной клеммой источника 13 энергии. Катод-кристаллизатор соединен с обеспечением воздухонепроницаемого уплотнения с изготовленным из нержавеющей стали колпаком 14, образующим внутреннюю камеру 15, 002205 16 чтобы избежать прохождения кислорода из атмосферы к слитку. Колпак снабжен крышкой 16, имеющей смотровое окно 17, причем в крышку вставлена токоподводящая штанга 9,посредством вакуум-плотной втулки 18. Но способ может быть осуществлен также в установках без закрывающего колпака с использованием защиты, обеспечиваемой коркой затвердевшего электролита. Защитная среда аргона может быть введена в камеру 15 через впускное отверстие 19 и выпущена через выпускное отверстие 20. Колпак 14, находящийся в электрическом контакте со стенками катода-кристаллизатора,соединен с отрицательной клеммой источника 13 энергии с обеспечением возможности коаксиального подвода тока. Устройство снабжено конвейерным питателем 21, выполненным за одно целое с колпаком, для ввода твердых электролитов и легирующих элементов в условиях контролируемой атмосферы. Позицией 22 обозначен расплавленный солевой электролит в кристаллизаторе. Электролит состоит предпочтительно из смеси CaF2 (чистота 99,9%) и кальция (чистота 99%) в зернах размером 3-6 мм, чтобы обеспечить правильный запуск процесса, и его поддерживает жидким при требуемой температуре около 1750 С энергия, рассеиваемая эффектом Джоуля тока, проходящего через электролит. Массовое отношение Ca/CaF2 в электролите составляет, например, 1:10; кроме того, в электролит могут быть добавлены другие соли для оптимизации анодных и катодных реакций. Для обеспечения получения металлов наивысшей чистоты расплавление электролита методом ESR (электрошлаковый переплав) является предпочтительной технологией очистки CaF2. Его осуществляют в водоохлаждаемом тигле из сплава Mo-Ti-Zr с титановым электродом при температуре ниже температуры плавления Ti,чтобы расплавить только CaF2 (т.пл. 1420 С),исключая его примеси. Количество соли, вводимой в тигель,должно обеспечить высоту электролита около 25-75 мм, а уровень погружения графитового электрода 8 в расплавленные соли определяют,считая, что CaF2 имеет удельное электрическое сопротивление 0,20-0,25 Омсм при 19001650 С. Между анодом и катодом прилагают разность потенциалов, например, 5-40 В путем подвода постоянного тока, который может быть отрегулирован между примерно 3000 и 15000 А. При запуске и всегда, когда это может оказаться необходимым, подводят переменный ток для обеспечения требуемой температуры в расплавленном электролите. Процесс можно также проводить с комбинированными нагревательными системами, используя дополнительный источник тепла (например, плазменные горелки, индукционный 17 нагрев, резистивный нагрев и тому подобное) для подвода части энергии, необходимой для удерживания солевой ванны в предпочтительном температурном интервале между 1700 и 1900 С. Соединения, содержащие подлежащий экстрагированию металл (например, TiCl4, TiF3,TiBr4, TiI4, TiC в случае получения титана), подают как в жидком, так и в твердом состоянии посредством питателя 21. TiCl4 и другие соединения, которые могут быть поданы в жидком и газообразном состояниях, предпочтительно подают в электролит через трубку 23. Количество добавляемых легирующих материалов определяют с учетом их значений парциального термодинамического равновесия в режиме процесса; например, для получения титанового сплава ASTM Gr 5 в данном варианте осуществления настоящего изобретения подают АlСl3 и VCl4 (вместо которого может бытьVOCl3; при использовании TiCl4). В предпочтительном варианте к ним подмешивают легирующие элементы, которые образуют хлориды, растворимые в TiCl4, и подают вместе в электролит через трубку 23. Цикл подачи легирующих материалов, подаваемых в твердом состоянии, находится в интервале 10-30 мин, в зависимости от пределов растворимости легирующих материалов в электролите при рабочих условиях, причем их подают предпочтительно посредством питателя 21. Газообразные продукты, выделяемые при электролизе, такие как Сl2, F2, Вr2, I2, СО и СO2,отводят предпочтительно через соосный канал 24 в аноде 8. Происходят, как полагают, следующие реакции в электролите: 2 Са+ TiCl4 = 2CaCl2 + Ti Са + TiCl4 = CaCl2 + TiCl2CaCl2 = Ca + Cl2 Вышеуказанные реакции лишь подводят итог конечного результата химических и электрохимических механизмов, имеющих место в электролизре, и получаемых продуктов. Думается, что аналогичные реакции охватывают и легирующие элементы и соединения в варианте осуществления настоящего изобретения для получения металлических сплавов. Металлический кальций, высвобождаемый его хлоридом, диффундирует в электролит и может использоваться для восстановления тетрахлорида титана. В соответствии с другим вариантом в электролит можно добавлять хлорид кальция вместо элементарного кальция. 18 Титан, полученный при температуре электролита, собирают в жидком состоянии в катод путем образования ванны 25 жидкого металла,где ему дают возможность затвердеть. Медный кристаллизатор защищают от коррозионного воздействия ионов фторида слоем шлака 26, который затвердевает при контакте с охлажденными стенками. Толщину этого слоя поддерживают на уровне примерно 1-3 мм. В ходе процесса при установившемся режиме металлический слиток, образующийся в кристаллизаторе, растет по высоте. Устройство по настоящему изобретению снабжают системой управления процессом для регулирования вертикального перемещения системы катод-электролит-анод посредством устройства 27 привода анода, чтобы обеспечить постоянные условия получения металла. Управление электролитическим процессом предпочтительно осуществляют посредством регулятора тока, обеспечивающего непрерывный подъем анода для поддержания постоянных условий подвода тока. В ходе процесса система управления регулирует глубину погружения анода в электролит,следуя перемещению поверхности ванны металла, чтобы поддерживать ток постоянным при заданном значении. Этот способ работы можно коротко суммировать следующим образом:L - расстояние между анодными и катодными поверхностями;Ve - падение напряжения через электролит;rе - удельное сопротивление электролита. Только в качестве примера, который не следует считать ограничивающим, значения используемых катодных плотностей тока находятся в пределах от 1 до 60 А/см 2, предпочтительно от 10 до 50 А/см 2. Значения плотностей тока, используемых в устройстве по настоящему изобретению, выше,чем для получения алюминия, так как для случая, например, восстановления титана явление металлического тумана менее важно. Действительно, разница в плотности между жидким металлом и электролитом при соответственных рабочих условиях электролиза составляет лишь 0,25 г/см 3 для алюминия, а для титана примерно 1,80 г/см 3. Это является также причиной того, почему в вариантах осуществления настоящего изобретения можно использовать восстановление кальцием ионов титана в массе электролита с последующим слиянием капелек в жидкий катод. 19 В частности, катодная граничная фаза является высоковосстановительной средой для ионов титана, восстанавливаемых непосредственно электронами или с помощью кальциевого окислительно-восстановительного механизма. Действительно, при рабочих условиях электролиза кальций соосаждается с титаном на поверхности жидкого катода, но, имея очень низкую растворимость в титане, возвращается в электролит. Кроме того, прохождение тока процесса вызывает интенсивное электромагнитное перемешивание ванны жидкого металла, что дополнительно увеличивает массоперенос в катодной граничной фазе. Выделение при электролизе газа у анодов обеспечивает дополнительное ускорение массопереноса, что позволяет использовать высокие плотности тока. Поскольку CaF2 имеет очень низкую электронную проводимость и очень высокую ионную проводимость, механизм переноса электрических зарядов по электролиту является полностью ионным. Для лучшей иллюстрации физического значения массопереноса важно подчеркнуть, что способ по настоящему изобретению относится к способу электролитического получения металлов из их соединений, растворенных в электролите. Этот способ является наиболее глубоким из всех металлургических способов, поскольку он начинается с сырья, то есть соединения, в котором металл находится в окисленной ионной форме, и приходит к получению металла в восстановленной элементарной беспримесной форме в только одном устройстве. Таким образом, массоперенос полностью обеспечивается ионным током, который проходит через электролит между анодом, остающимся геометрически неизменным, поскольку он нерастворим в условиях электролиза, и жидким катодом, использующим энергию для обеспечения потенциала разложения растворенного в электролите соединения металла и для раздельного высвобождения металла и анодного газа. Этот способ электролитического получения металлов эксплуатационно намного более сложен и энергетически намного более интенсивен, чем способ простого электролитического рафинирования, в котором анод делают из очищаемого нерафинированного металла, то есть уже в его элементарной восстановленной форме. Другим способом упрощенного и ускоренного массопереноса является электрошлаковый переплав, в котором очистка металла минимальна и доходит, по существу, до физического коллапса из-за расплавления верхнего электрода, анода, потому что температура, достигаемая шлаком в результате прохождения тока, превосходит температуру плавления металла, состав 002205 20 ляющего верхний электрод. В этом случае массоперенос почти совершенно элементарен, так как происходит в виде падения металла в форме капель через шлак, и вклад процесса электролитического рафинирования в ионный массоперенос минимален. В устройстве же по настоящему изобретению положительный электрод, анод, не только нерастворим в электролите, но и имеет очень высокую температуру плавления, которой не могут достичь температуры режима, что обеспечивает возможность осуществления только ионного механизма электрохимического массопереноса для электролитического извлечения металла из электролита. Пример 2. Устройство, описанное в этом примере,отличается от устройства примера 1 геометрической конфигурацией катода-кристаллизатора,которая приспособлена для получения длинных слябов и слитков по некоторой аналогии со способом непрерывной разливки стали. Основные параметры способа аналогичны описанным, а те же самые или подобные компоненты на фиг. 3 обозначены теми же самыми номерами позиций. Катод состоит из прямоугольного водоохлаждаемого медного кристаллизатора 1, нижний конец которого закрыт отводящейся водоохлаждаемой опорной плитой 28, снабженной впускным отверстием 29 и выпускным отверстием 30 для воды, с возможностью извлечения титанового слитка 3. Опорная плита 28 электрически соединена с отрицательной клеммой источника 13 питания и охлаждается через впускное отверстие 29 и выпускное отверстие 30. Кристаллизатор имеет, например, следующие размеры: площадь поперечного сечения: 200 см 3,отношение сторон: 2-4,высота: 1,5 х самую длинную внутреннюю сторону. Анод 8 выполнен прямоугольным, причем отношение площадей поперечных сечений анода и слитка находится в пределах от 0,3 до 0,7. Анод изготовлен из графита, погружаемая часть которого может быть покрыта огнеупорным материалом. С ходом электролиза при установившемся режиме количество металла, образующегося в кристаллизаторе, увеличивается. Так как кристаллизатор неподвижен, опорная плита должна быть выполнена с возможностью перемещения вниз с помощью приводного средства, чтобы отводить слиток со скоростью, синхронной со скоростью восстановления металла. Движением опорной плиты 28 вниз вслед за ростом титанового слитка 3 управляют посредством электронной системы, которая поддерживает постоянным местоположение по вертикали поверхности жидкого катода, ванны 25, 21 внутри медного цилиндра. Таким же образом поддерживают постоянным и положение по вертикали анода 8, чтобы обеспечить постоянную толщину слоя электролита. Благодаря отводящейся опорной плите,устройство позволяет получать слитки более 3 м длиной. Выходящий слиток уже затвердел, но все еще имеет высокую температуру и в случае реакционноспособного металла (например, титана и титановых сплавов) его предпочтительно защищают от наружной атмосферы посредством нижнего чехла 14b. Соединения, содержащие получаемые металлы, предпочтительно подают через канал 24 в аноде 8, в который вставлена трубка 8b, предпочтительно выполненная химически инертной и электрически непроводящей, для отделения объема, в котором восстанавливают TiCl4, от анодной граничной фазы, в которой выделяются анодные газы. Геометрия инертной трубки 8b такова, что она может скользить в канале 24, что обеспечивает возможность втягивания ее, чтобы не мешать операциям запуска, и выдвижения вниз до заданного положения, когда электролит расплавлен. Газообразные побочные продукты предпочтительно выпускают через выпускное отверстие 20. Питатель 21 используют предпочтительно для введения твердых соединений металлов,компонентов электролита, и легирующих элементов и соединений при получении слитков сплавов. Этот пример относится к устройству с системой отводящейся опорной плиты, но такой же самый результат может быть получен при использовании кристаллизатора, который может быть перемещен вместе со всем его вспомогательным оборудованием, и неподвижной опорной плиты. Возможна также комбинация обеих систем. Устройство, описанное в этом примере,позволяет получать слитки с прекрасной отделкой поверхности, которые можно посылать на прокатный стан без всякой дополнительной металлургической операции. Пример 3. Устройство, описанное в этом примере,отличается от устройства примера 1 конструкцией катода-кристаллизатора, которая приспособлена для отвода металла, полученного в жидком состоянии. Как показано на фиг. 4, устройство содержит катод-тигель 1, состоящий предпочтительно из медного цилиндра, закрытого на нижнем конце посредством холодного пода 41, снабженного радиально сегментированным тиглем 44 и холодным пальцем-соплом 47 для отвода струи 40 жидкого металла. Объем ванны 25 жидкого металла регулируют интенсивностью охлаждения через впуск 002205 22 ное 42 и выпускное 43 отверстия для воды,уравновешиваемой интенсивностью нагревания сегментированного тигля 44 посредством индукционных катушек 45 и источника 46 энергии. Холодный под 41 электрически соединен с отрицательной клеммой источника 13 энергии для приведения в действие электролитического процесса катодного восстановления металла и его сплавов. Отвод жидкого металла, накопленного в ванне 25, предпочтительно осуществляют периодически, причем для регулирования вертикального перемещения электролита и анода с помощью узла 27 привода электрода предусмотрена система управления процессом, такая как описанная в примере 1. Чтобы активировать отвод жидкого металла, постепенно увеличивают электрическую энергию, подаваемую на индукционные катушки холодного пальца-сопла 47, для создания струи жидкого металла, текущей в нижний резервуар 48, который герметически уплотнен с холодным подом 41 и находится под контролируемой атмосферой для обеспечения чистоты полученного металла. Отвод жидкого металла может быть непрерывным, в частности для устройств с большими катодными поверхностями. Пример 4. Устройство, описанное в этом примере,отличается от устройства примера 2 тем, что геометрическая конфигурация катода-кристаллизатора выполнена с возможностью получения плоских тонких слябов, в то время как основные параметры процесса и характерные функции аналогичны. Катод-кристаллизатор 1, показанный в поперечном разрезе на фиг. 5, состоит из двух водоохлаждаемых медных плит 31 и 32 шириною 600-1300 мм, соединенных друг с другом посредством боковых водоохлаждаемых медных проставок 33 и 34 толщиною 100-15 мм. Указанные размеры следует рассматривать не как ограничивающие область применения изобретения, а лишь в качестве примера. Толщину узла для вмещения жидкого металла обеспечивает слой электролита, затвердевающий в местах соединения между водоохлаждаемыми медными элементами. Вдоль длинной стороны катода-кристаллизатора проходят несколько вставленных в кристаллизатор графитовых анодов 35. Несколько питателей 36 для подачи соединений металлов установлены таким образом,что нижний конец каждого из них погружен в электролит между анодами 35. По аналогии с устройством, показанным на фиг. 2, кристаллизатор снабжен отводящейся водоохлаждаемой опорной плитой 37, показанной на фиг. 6, которая обеспечивает возможность постепенного отвода полученного метал 23 лического сляба снизу кристаллизатора на длину, пригодную для металлургических операций прокатки. Величину тока и толщину слоя электролита регулируют для оптимального выравнивания температур с помощью электронного оборудования управления. Пример 5. Устройство, описанное в этом примере,отличается от устройств, описанных в примерах 1 и 2 тем, что геометрическая конфигурация катода-кристаллизатора выполнена с возможностью получения широких плоских листов, слябов и слитков, в то время как основные параметры способа и характерные функции аналогичны. Как показано на фиг. 7, катод состоит из прямоугольного водоохлаждаемого медного кристаллизатора 1, нижний конец которого закрыт водоохлаждаемой медной плитой 2. Внутренние размеры медного кристаллизатора составляют, например, 1000 мм по ширине и 2000 мм по длине. Высота находится в пределах между 500 и 1000 мм, что позволяет получать титановый плоский лист толщиною,например, 250 мм. В этом варианте осуществления изобретения конструкция, содержащая кристаллизатор 1,вмещающий резервуар 4, колпак 14, несколько анодов 8, приводной узел 27 анодов, стоит в процессе электролиза на опорной плите 2. В предпочтительном варианте эту конструкцию в конце процесса поднимают, чтобы обеспечить возможность извлечения титанового листа 3, причем токоподводящие шины, соединяющиеся с положительным полюсом 13 источника питания, выполнены гибкими. Аноды 8 имеют геометрическую конфигурацию, подобную той, которую используют в одном из типов электролизеров для получения хлора, и предпочтительно имеют множество каналов для отвода анодных газов. Между анодами и предпочтительно в теле анодов установлены трубы 24, по которым подают соединения металлов, подлежащих извлечению. Узел 27 привода анодов позволяет регулировать вертикальное положение анодов, чтобы поддерживать постоянной толщину слоя электролита, следуя за ростом титанового листа во время электролиза. Ток в 200 кА обеспечивает производство листа, например, около 1,8 т в сутки. Атмосферу во внутренней камере 15 регулируют посредством вакуумплотной втулки 18 и прокладки в канавке на нижнем конце кристаллизатора 1. Пример 6. Устройство, описанное в этом примере,отличается от устройств, описанных в примерах 4 и 5, геометрической конфигурацией катодакристаллизатора и анодов, выполненной с воз 002205 24 можностью получения заготовок квадратного сечения, в то время как основные параметры процесса и характерные функции аналогичны. Как показано на фиг. 8, катод-кристаллизатор состоит из ряда водоохлаждаемых медных перегородок 32, соединенных друг с другом посредством боковых водоохлаждаемых медных проставок 33 с образованием ряда прямоугольных удлиненных кристаллизаторов, опирающихся на водоохлаждаемую медную плиту 37. Высоту перегородок и ширину проставок назначают так, чтобы обеспечить получение заготовок, например, сечением 140 х 140 мм и длиною более 3 м. Другое отличие от предшествующего примера 5 состоит в наличии механизма независимого регулирования высоты для каждого ряда анодов для обеспечения равномерного катодного восстановления металла во всех камерах. Поскольку это есть предпочтительный вариант получения заготовок из сплавов металлов,идущих на изготовление длинных изделий, то вводят легирующий материал в жидком или газообразном состоянии через трубы 24 и в твердом состоянии посредством питателей 36,21, как показано в предшествующих примерах. Пример 7. Устройство, описанное в этом примере,отличается от тех, что описаны в примерах 1-6,составом электролита, который делают таким,чтобы использовать выгоды совместного присутствия одновалентных щелочных металлов с двухвалентными щелочно-земельными металлами. Устройство и основные параметры процесса аналогичны тем, что описаны в связи со всеми фигурами от 1 до 8. Один из возможных составов электролита состоит предпочтительно из CaF2 с, например,9% KF и некоторыми количествами CaCl2 и КСl и Са и К, которые зависят от скорости подачиTiCl4 относительно общего тока (например, 3% Са и 3% К). Более низкое удельное электросопротивление составов электролита, предлагаемых в этом примере, обеспечивает возможность работы электролизера с более толстым слоем электролита при более высоких плотностях тока с поддержанием требуемой температуры системы. При этом режиме работы получают 100%ный выход реакции восстановления TiCl4 в сочетании с очень высокой производительностью электролизера. КСl и CaCl2 обеспечивают возможность продолжения анодного выделения газообразного Cl2 в случае перерывов в подаче 25 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ электролитического получения титана и титановых сплавов из металлических соединений металлов, в котором применяют устройство для электролитического получения металлов, содержащее катод-тигель, содержащий твердый металлический гарнисаж, жидкий электролит, имеющий плотность ниже, чем у металла, и жидкую ванну полученного металла; один или несколько нерасходуемых анодов, частично погруженных в электролит, со средствами для регулирования расстояния их от поверхности катода; средства для подачи соединений металлов,компонентов электролита и легирующих материалов в электролит; средства питания энергией для подвода постоянного тока к ванне металла и через электролит к анодам, вызывающего катодное восстановление металла в жидком состоянии и анодное выделение анодного газа с выделением тепла, поддерживающего электролит в расплавленном состоянии; герметичный сосуд, в который перемещаются анодные газы, выделенные при электролизе. 2. Способ по п.1 получения титана, в котором электролит представляет собой смесь фторида кальция, хлорида кальция и металлического кальция. 3. Способ по п.1 или 2, в котором электролит содержит соединения щелочных и щелочнoземельных металлов. 4. Способ по п.1 или 2, в котором соединениями металлов, подаваемыми в устройство электролитического получения, являются фториды, хлориды, бромиды и иодиды. 5. Способ по п.1, в котором катод-тигель представляет собой медный тигель. 6. Способ по п.1, в котором тигель охлаждают и вызывают затвердевание защитного слоя электролита на внутренних поверхностях. 7. Способ по п.1, в котором герметичный сосуд охлаждают для конденсации паров, выходящих из электролита, на его внутренние поверхности для защиты сосуда от воздействия анодных газов. 8. Способ по п.1, в котором анодные газы,образованные в процессе электролитического выделения металлов, отводят через каналы, выполненные в нерасходуемых анодах. 26 9. Способ по п.1, в котором соединения получаемых металлов подают в электролит через каналы, выполненные в нерасходуемых анодах. 10. Способ по п.1, в котором подачу соединений получаемого металла осуществляют посредством трубки из электроизолирующего и химически инертного материала, чтобы отделить объем, в котором восстанавливают указанные соединения, от анодной граничной фазы, в которой выделяются анодные газы. 11. Способ по п.1, в котором сплавы получают путем подачи в устройство элементов и соединений в количестве, пропорциональном их электрохимическим характеристикам, чтобы обеспечить заданный химический состав. 12. Способ по п. 1, в котором устройство для электролитического получения металлов содержит средства для непрерывного отвода затвердевшего полученного металла. 13. Способ по п.1, в котором металл, полученный в жидком состоянии, отводят посредством холодного пальца-сопла с индукционным нагревом. 14. Способ по п.1 в применении к производству листов, слябов, блюмов, заготовок из металлов и сплавов. 15. Способ по п. 1, в котором анод, погружаемый в электролит, имеет нижний конец,профилированный и механически обработанный так, чтобы усилить выделение анодных газов. 16. Способ по п.1, в котором ток подводят посредством охлаждаемых анодных токоподводящих шин. 17. Способ по п.1, в котором устройство содержит вакуум-плотную втулку для механизма привода анодов. 18. Способ по п.1, в котором используют компьютерную систему для контроля установившегося режима, чтобы поддерживать установившееся состояние путем регулирования расстояния между анодами и жидкой катодной поверхностью. 19. Устройство для электролитического получения металлов, имеющее характеристики,указанные в п.1. 20. Способ по п.1, 2 или 3, в котором электролит содержит добавки одновалентных щелочных и двухвалентных щелочно-земельных металлов, такие как Са + К или Са + Мg.
МПК / Метки
МПК: C25C 7/00
Метки: получения, способ, металлов, электролитического
Код ссылки
<a href="https://eas.patents.su/16-2205-sposob-elektroliticheskogo-polucheniya-metallov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ электролитического получения металлов</a>
Предыдущий патент: Способы и промежуточные соединения для получения замещенных производных хроманола
Следующий патент: Электрическое соединительное устройство и защитное устройство, содержащее это электрическое устройство
Случайный патент: Производные морфолина в качестве ингибиторов повторного захвата норадреналина