Андрогенные 7-замещенные-11-галогенированные стероиды
Номер патента: 6674
Опубликовано: 24.02.2006
Авторы: Нуббемейер Райнхард, Цопф Дитер, Больманн Рольф, Кюнцер Германн
Формула / Реферат
1. 11b-Галогенстероиды общей формулы I
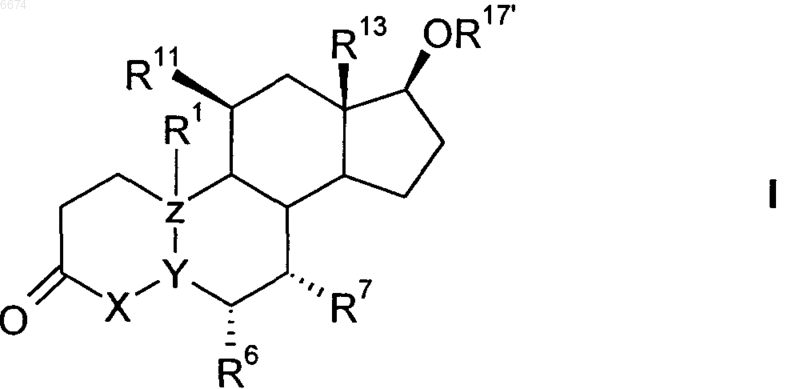
в которой
X-Y-Z означает группу CH=C-C или CH2-C=C,
R1 может находиться в a- или в b-положении, означает водород,
R6 означает водород,
R7 означает R или группу P-Q-R, связанную со стероидной циклической системой через группу P, причем эти группы имеют значения, указанные выше,
R11 означает галоген,
R13 означает метил или этил,
R17 означает водород или C(O)-R18, где R18 означает прямой или разветвленный радикал C1-C18алкил, C1-C18алкенил, C1-C18алкинил или радикал арил, или группу T-U-V, связанную с C(O) через группу T, где T и U означают прямые или разветвленные группы C1-C18алкилен, C1-C18алкенилен, C1-C18алкинилен, C3-C12алициклические группы или группы арил и являются одинаковыми или различными, а V означает прямой или разветвленный радикал C1-C18алкил, C1-C18алкенил, C1-C18алкинил или радикал арил, или R18 имеет одно из значений, указанных выше, и, кроме того, замещен одной или более группами NR19R20 или одной или более группами SOxR21, где x равно 0, 1 или 2, а R19, R20 и R21 в каждом случае означают водород или группу T-U-V, связанную с N, S через группу T, имеющую значение, указанное выше,
и их физиологически приемлемые кислотно-аддитивные соли органических и неорганических кислот.
2. 11b-Галогенстероиды по п.1, в которых R11 означает фтор.
3. 11b-Галогенстероиды по любому из пп.1-2, в которых R7 означает метил, этил или трифторметил.
4. 11b-Галогенстероиды по любому из пп.2-3, в которых R13 означает метил.
5. 11b-Галогенстероиды по любому из пп.2-6, в которых R17' означает водород или C(O)-R18, где R18 означает C1-C18алкил с прямой или разветвленной цепью.
6. 11b-Галогенстероиды общей формулы I по п.1
11b-фтор-17b-гидрокси-7a-метилэстр-4-ен-3-он,
11b-хлор-17b-гидрокси-7a-метилэстр-4-ен-3-он,
11b-бром-17b-гидрокси-7a-метилэстр-4-ен-3-он,
17b-гидрокси-11b-иод-7a-метилэстр-4-ен-3-он,
7a-этил-11b-фтор-17b-гидроксиэстр-4-ен-3-он,
11b-фтор-7a-(фторметил)-17b-гидроксиэстр-4-ен-3-он,
11b-фтор-17b-гептаноилокси-7a-метилэстр-4-ен-3-он,
11b-фтор-7a-метил-17b-ундеканоилоксиэстр-4-ен-3-он,
11b-фтор-17b-гидрокси-7a-метилэстр-5(10)-ен-3-он.
7. Способ получения 11b-галогенстероидов общей формулы I по любому из пп.1-6, в котором из соединения общей формулы Б, Г
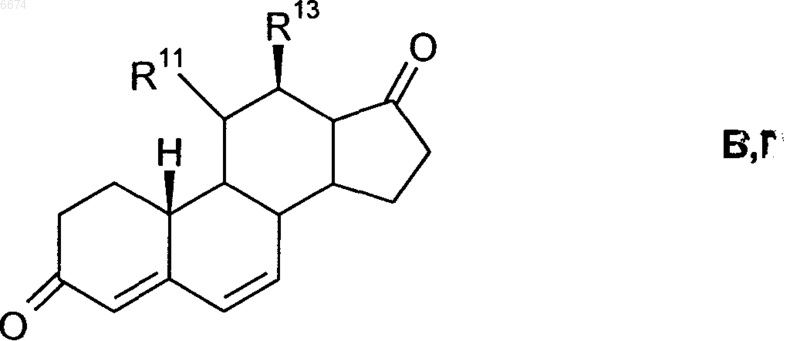
где R11 означает гидроксил, галоген или нуклеофильную уходящую группу, а R13 имеет значения, указанные выше, по реакции 1,6-присоединения с металлированным алкилом формулы R7-M или R7-M'X, где M означает щелочной металл, M' означает щелочно-земельный металл, X означает галоген, а R7 имеет значения, указанные выше, сначала получают соединение общей формулы Б', Д

а затем это соединение или селективно восстанавливают с образованием соединения общей формулы I, или, если R11 не является галогеном, вводят в реакцию нуклеофильного замещения в 11-положении с галогенирующим агентом, а затем селективно восстанавливают с образованием соединения общей формулы I
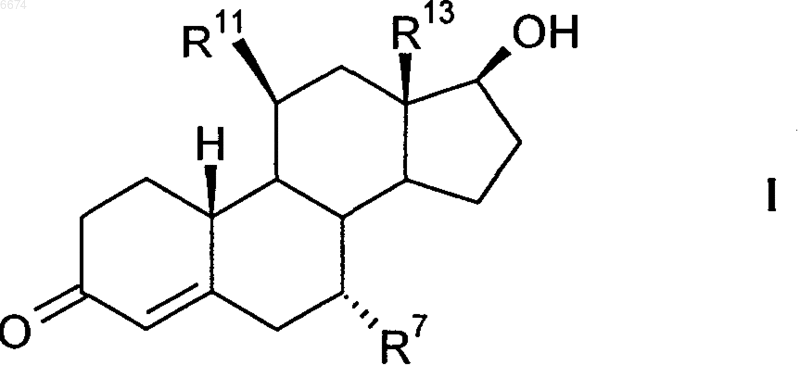
8. Применение 11b-галогенстероидов по любому из пп.1-6 для получения фармацевтических агентов.
9. Фармацевтические препараты, содержащие по меньшей мере один 11b -галогенстероид по любому из пп.1-6, а также по меньшей мере один фармацевтически приемлемый носитель.
Текст
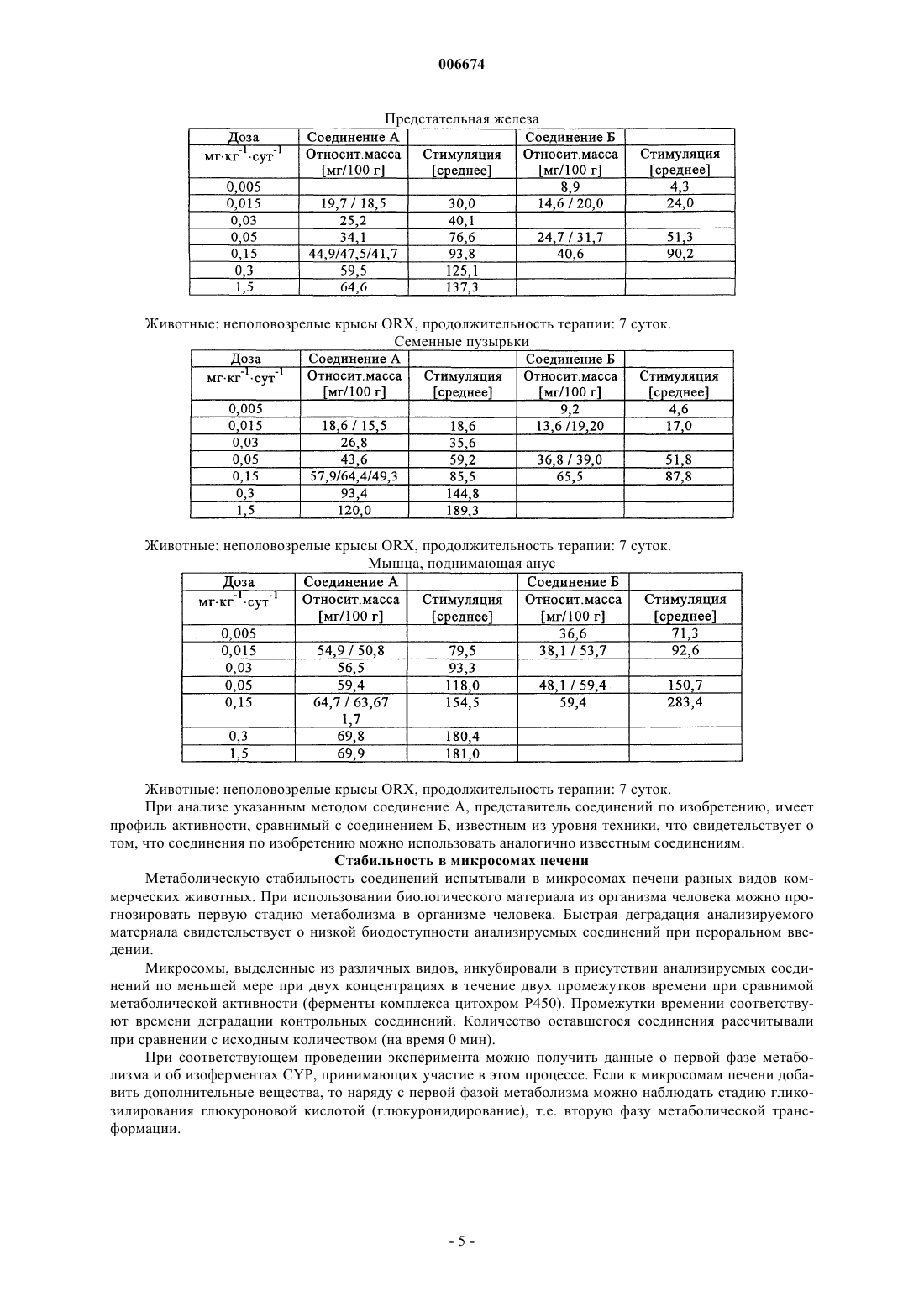
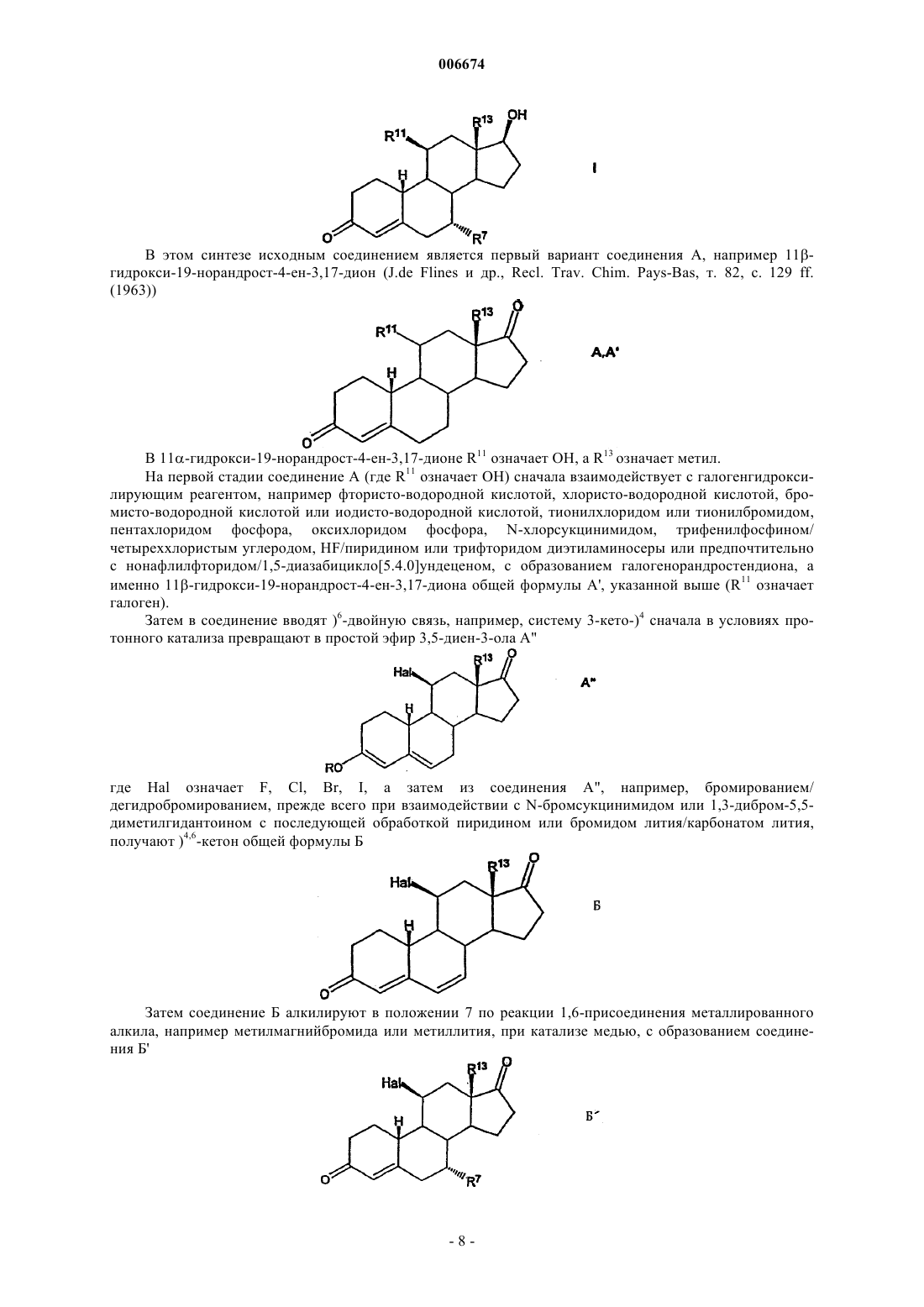
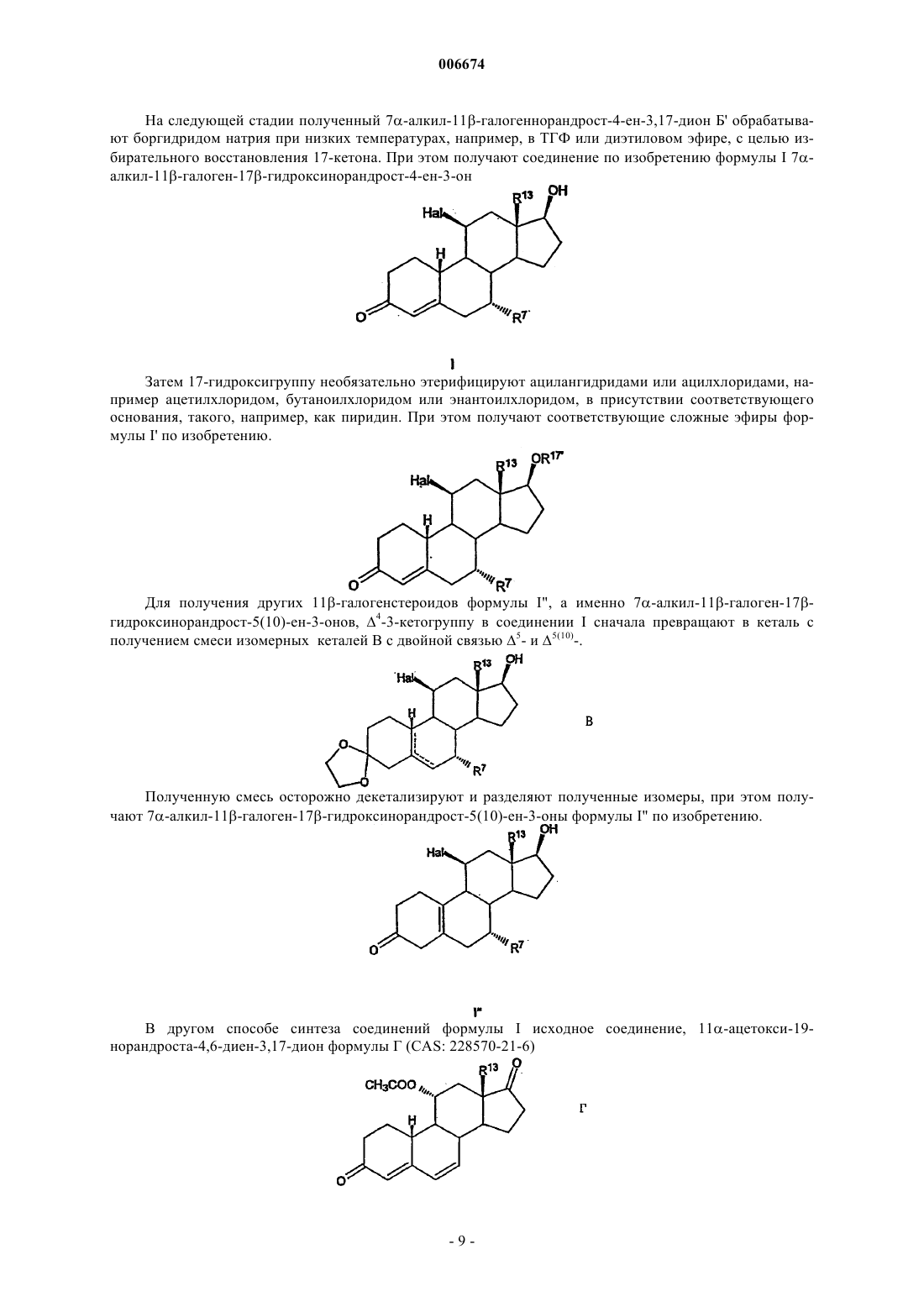
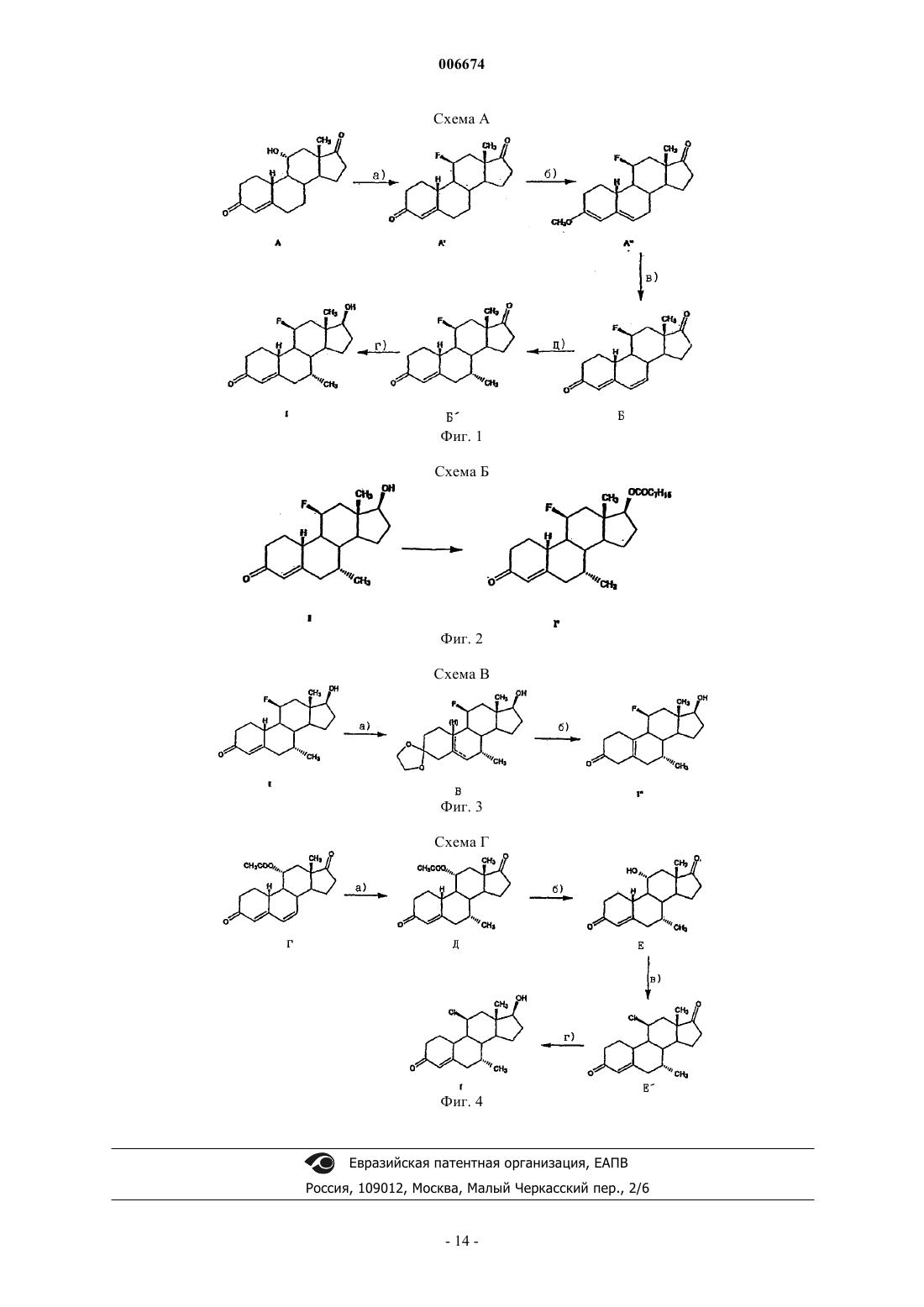
Изобретение относится к 11-галогенстероидам, их получению и применению для получения фармацевтических агентов, фармацевтических препаратов, содержащих 11-галогенстероиды, а также к применению некоторых производных 11-стероидов в качестве составной части соединений, обладающих андрогенным действием. Андрогены, прежде всего тестостерон, используются при терапии мужской менопаузы и для развития мужских половых органов, а также для регулирования репродуктивной функции у мужчин. Кроме того, эти гормоны частично включают анаболически активные компоненты, которые стимулируют, наряду с прочим, рост мышечной массы. Для мужской менопаузы характерно зависимое от возраста снижение продуцирования эндогенного андрогена, для лечения которого используют гормон-заместительную терапию (ГЗТ). Введение рилизинг-фактора лютеинизирующего гормона (РФ-ЛГ) с целью регулирования репродуктивной функции у мужчин приводит, наряду со снижением сперматогенеза, к высвобождению ЛГ,снижению уровня тестостерона и либидо, что компенсируется введением фармацевтических агентов,содержащих тестостерон (D.E.Cummings и др., Prostate-Sparing Effects of the Potent Androgen 7-Methyl19-Nortestosterone: A Potential Alternative to Testosteron for Androgen Replacememnt and Male Contraception, Journal of Clinical Endocrinology and Metabolism, т. 83,12, c. 4212-4219 (1998. Композиции, включающие андроген и прогестерон, можно использовать для регулирования репродуктивной функции у мужчин (см., например, WO 01/60376 и источники, цитированные в тексте заявки). Установлено, что лечение тестостероном сопровождается побочными действиями, прежде всего,гипертрофией предстательной железы за счет роста численности клеток и желез стромы (доброкачественная гиперплазия предстательной железы, ДГПЖ). В процессе метаболизма тестостерона с участием 5-редуктазы может образовываться дигидротестостерон (ДГТ), что действительно наблюдается при ДГПЖ (Cummings и др., WO 99/13883 А 1). В связи с этим в клинической практике для лечения ДГПЖ используют ингибирование 5-редуктазы (финастериды). Кроме того, высокая скорость метаболической трансформации андрогенного стероида тестостерона в организме человека с образованием нежелательного ДГТ вызывает необходимость перорального введения более высоких доз с целью достижения необходимого уровня тестостерона. Поэтому приходится использовать альтернативные формы введения, такие как внутримышечные инъекции или пластыри большого размера. При вышеуказанных показаниях вместо тестостерона предлагается использовать 7-метил-19 нортестостерон (МеНТ), который обладает более высокой эффективностью по сравнению с тестостероном, благодаря более высокому сродству к андрогенным рецепторам. Вместе с тем предполагается, что благодаря стерическому ингибированию за счет 7-метильной группы МеНТ более устойчив к метаболической трансформации под действием 5-редуктазы (Cummings и др., WO 99/13883 A1, WO 99/13812A1, US-A-5342834). В процессе метаболизма тестостерона незначительная часть этого соединения трансформируется за счет ароматизации кольца А стероидной системы с образованием эстрадиола, прежде всего в ткани мозга, печени и жировой ткани. В свете общего действия тестостерона и его метаболитов, эстрадиол в основном отвечает за поведение, зависимое от пола, и регуляцию гонадотропина. Следовательно, его действие, как и действие тестостерона на взрослых мужских особей, принято считать благоприятным (Cummings и др., см. выше). Однако установлено, что тестостерон характеризуется неудовлетворительной фармакокинетикой. Тестостерон, прежде всего при пероральном введении, быстро выводится из организма, и, следовательно, эффективность и продолжительность действия полученных таким образом фармацевтических агентов является неудовлетворительной. Следовательно, были синтезированы другие производные тестостерона. Такие производные, описанные, например, в US-A-5952319, прежде всего включают 7,11 диметилпроизводные 19-нортестостерона, а именно, 7,11-диметил-17-гидроксиэстр-4-ен-3-он,7,11-диметил-17-гептаноилоксиэстр-4-ен-3-он, 7,11-диметил-17-(2-циклопентилэтил)карбонил] окси]эстр-4-ен-3-он, 7,11-диметил-17-(фенилацетилокси)эстр-4-ен-3-он и 7,11-диметил-17(транс-4-[н-бутил]циклогексил)карбонил]окси]эстр-4-ен-3-он. Указанные 7,11-диметилпроизводные обладают теми же преимуществами, что и МеНТ, включая улучшенную фармакокинетику, т.е. обладают более высокой эффективностью и продолжительностью действия по сравнению с тестостероном. Однако указанные производные получают дорогостоящим синтезом. Объектом изобретения являются производные тестостерона, которые устойчивы к восстановлению 5-редуктазой, которые обладают улучшенными фармакокинетическими свойствами по сравнению с 7 метил-19-нортестостероном и которые можно синтезировать более простым способом по сравнению с 7,11-диметилпроизводными. Цель изобретения достигается благодаря получению 11-галогенстероидов по п.1, применению 11-галогенстероидов в качестве составной части соединений, обладающих андрогенным действием по п.9, а также благодаря способу получения этих соединений по п.10 и-1 006674 применению указанных стероидов для получения фармацевтических средств по п.11 и фармацевтических препаратов по п.12. Предпочтительные варианты осуществления изобретения представлены в зависимых пунктах формулы изобретения. 11-Галогенстероиды по настоящему изобретению, которые предлагаются в качестве составных частей соединений с андрогенной активностью, имеют следующую основную структуруR13 не означают водород, а R11 означает галоген. В других положениях стероидной циклической системы могут, соответственно, находиться другие заместители, включая водород. Кроме того, изобретение, по существу, относится к следующим двум основным структурам, а именно 11-галогенэстр-5(10)-ен-3-ону формулы В настоящем изобретении прежде всего предлагаются андрогенные стероиды общей формулы I где X-Y-Z означает группу СН=С-С или СН 2-С=С,R1 может находиться в - или в -положении и означает водород, R или группу P-Q-R, которая связана со стероидной циклической системой через группу Р, причем Р и Q означают прямые или разветвленные, необязательно частично или полностью фторированные группы С 1-С 8 алкилен, С 1-С 8 алкенилен,C1-С 8 алкинилен, причем указанные группы могут быть одинаковыми или различными, a R означает радикал СН 3 или CF3, при условии, что Z не содержит заместитель R1, если X-Y-Z означает группу СН 2 С=С,R6 означает водород или может иметь значения, указанные для R7,R7 означает R или группу P-Q-R, связанную со стероидной циклической системой через группу Р,причем эти группы имеют значения, указанные выше,R11 означает галоген,R13 означает метил или этил,R17 означает водород или C(O)-R18, где R18 означает прямой или разветвленный радикал С 1 С 18 алкил, С 1-С 18 алкенил, С 1-С 18 алкинил или радикал арил, или группу T-U-V, связанную с С(О) через группу Т, где Т и U означают прямые или разветвленные группы С 1-С 18 алкилен, С 1-С 18 алкенилен, C1-2 006674 С 18 алкинилен, С 3-С 12 алициклические группы или группы арил, и являются одинаковыми или различными, а V означает прямой или разветвленный радикал С 1-С 18 алкил, С 1-С 18 алкенил, С 1-С 18 алкинил или радикал арил, илиR18 имеет одно из значений, указанных выше, и, кроме того, замещен одной или более группами 19 20NR R или одной или более группами SOxR21, где х равно 0, 1 или 2, a R19, R20 и R21 в каждом случае означают водород или группу Т-U-V, связанную с N, S через группу Т, имеющую значение, указанное выше, и их физиологически приемлемые кислотно-аддитивные соли органических и неорганических кислот. Группа R11 предпочтительно означает фтор, однако, в другом варианте может означать хлор, бром или иод. Группа R6 прежде всего означает водород, метил, этил или фторметил, предпочтительно водород. Группа R7 прежде всего означает метил, этил или фторметил, предпочтительно метил.R1 прежде всего означает водород, например, в производном 19-нортестостерона. Однако R1 может также означать метил, этил, пропил или бутил или фтор- или прежде всего перфторпроизводные указанных радикалов.R13 означает метил или этил, прежде всего метил.R17 предпочтительно означает водород или C(O)-R18, где R18 означает радикал алкил с прямой или разветвленной цепью. Когда R18 в составе группы C(O)-R18 (одного из значений R17) означает алкил,примеры радикала алкил включают метил, этил, пропил, бутил, пентил, гексил, октил, нонил, децил, ундецил, додецил, тридецил, тетрадецил, пентадецил, гексадецил, гептадецил и октадецил, а также радикалы с прямой или разветвленной цепью, такие как изопропил, изобутил, трет-бутил, изопентил, третпентил и неопентил, прежде всего предпочтительны гексил, гептил, октил, нонил и децил. Если R18 означает алкенил, то прежде всего R18 означает этенил, а также 1- или 2-пропенил. Если 18R означает алкинил, то прежде всего R18 означает этинил, а также 1- или 2-пропинил. Если R18 означает группу T-U-V, то прежде всего R18 означает метиленциклогексил, связанный с группой СО через метиленовую группу, или этиленциклогексил, связанный с группой СО через этиленовую группу в 1 или 2 положении. Прямая углеродная цепь в группах P-Q-R и T-U-V может включать до 22 атомов углерода. Арильные радикалы в составе группы C(O)-R18 прежде всего могут означать фенил, 1-нафтил или 2 нафтил. Аналогичным образом, аралкильные радикалы в группе T-U-V могут означать бензил, фенилэтил, фенилпропил, нафтилметил и нафтилэтил. Аналогичным образом, арил в составе группы C(O)-R18 может означать гетероарил. Примеры радикалов гетероарил включают 2-, 3- и 4-пиридинил, 2- и 3-фурил, 2- и 3-тиенил, 2- и 3-пирролил, 2-, 4- и 5 имидазолил, пиридазинил, 2-, 4- и 5-пиримидинил, а также 2- и 4-пиридазинил. Кроме того, если R18 замещен группой NR19R20, то R18 может означать метиламино, диметиламино,этиламино, диэтиламино, циклогексиламино, дициклогексиламино, фениламино, дифениламино, бензиламино или дибензиламино. В этом случае объект изобретения включает также физиологически приемлемые кислотноаддитивные соли органических и неорганических кислот. Пригодными физиологически приемлемыми кислотно-аддитивными солями являются соли неорганических кислот, такие как гидрохлориды, гидробромиды, и органических кислот, такие как ацетаты, цитраты, оксалаты, тартраты и метансульфонаты. Предпочтительными 11-галогенстероидами являются следующие соединения: 11-фтор-17-гидрокси-7-метилэстр-4-ен-3-он,11-хлор-17-гидрокси-7-метилэстр-4-ен-3-он,11-бром-17-гидрокси-7-метилэстр-4-ен-3-он,17-гидрокси-11-иод-7-метилэстр-4-ен-3-он,7-этил-11-фтор-17-гидроксиэстр-4-ен-3-он,11-фтор-7-(фторметил)-17-гидроксиэстр-4-ен-3-он,11-фтор-17-гептаноилокси-7-метилэстр-4-ен-3-он,11-фтор-7-метил-17-ундеканоилоксиэстр-4-ен-3-он,11-фтор-17-гидрокси-7-метилэстр-5(10)-ен-3-он. Для получения фармацевтических агентов прежде всего пригодны указанные 11-галогенстероиды общей формулы I. Кроме того, изобретение относится к фармацевтическим препаратам, содержащим по меньшей мере один фармацевтически приемлемый носитель в смеси по меньшей мере с одним указанным 11 галогенстероидом. 11-Галогенстероиды общей формулы I по изобретению представляют собой соединения, обладающие сильным андрогенным действием и не оказывающие указанного побочного действия, такого,например, как стимуляция предстательной железы (прежде всего доброкачественной гиперплазии предстательной железы). Кроме того, эти соединения можно легко синтезировать. Установлено, что 11 галогенстероиды можно использовать не только для гормонзаместительной терапии мужских заболева-3 006674 ний, но и в качестве эффективных мужских контрацептивов в отсутствии других активных ингредиентов, причем в той дозировке, которая достаточна для снижения в крови уровней ЛГ (лютеинизирующего гормона), тестостерона и ФСГ (фоликулостимулирующего гормона), которые в достаточном количестве продуцируются в организме. Уровни указанных гормонов зависят от 11-галогенстероидов по изобретению, которые ингибируют высвобождение ЛГ и ФСГ. ЛГ стимулирует клетки Лейдига, которые секретируют тестостерон. При низком уровне ЛГ снижается также высвобождение эндогенного тестостерона. Тестостерон необходим для сперматогенеза, в то время как ФСГ стимулирует половые клетки. Следовательно, для эффективного сперматогенеза необходим высокий уровень в крови ФСГ и ЛГ, причем достаточно высокий уровень ЛГ вызывает высвобождение тестостерона, который необходим для сперматогенеза. Поскольку терапия одними 11-галогенстероидами в отсутствии дополнительных активных ингредиентов с целью стерилизации может обеспечить эффективную контрацепцию у мужчин, процедуру введения пригодного фармацевтического агента можно сделать существенной более простой и при этом значительно снизить стоимость лечения. 11-Галогенстероиды по настоящему изобретению можно также применять для регуляции репродуктивной функции у мужчин в комбинации с прогестероном. Кроме того, 11-галогенстероиды по изобретению эффективно ингибируют 5-редуктазу и стероид-11-гидроксилазу [CYP11B (P450c11), G. Zhang, W.L. Miller, Journal of Clinical Endocrinology and Metabolism, т. 81, c. 3254-3256 (1996)], что позволяет, например, избирательно исключить стимуляцию предстательной железы. Кроме того, эти соединения обладают улучшенными фармакокинетическими свойствами. Ингибирование стероид-11-гидроксилазы приводит к торможению инактивации андрогенных соединений и снижению их выведения из организма. В результате повышается эффективность и продолжительность действия этих соединений по сравнению с известными соединениями, прежде всего,при пероральном введении. Ввиду вышеизложенного эти соединения, прежде всего, пригодны для регуляции репродуктивной функции у мужчин, а также для андрогензаместительной терапии при одновременном снижении тенденции восстановления в 5-положении, при одновременном образовании ароматического цикла с получением эстрогенных стероидов и при благоприятном влиянии на сывороточные липиды и центральную нервную систему. Андрогенное действие и отсутствие указанного выше побочного действия подтверждается в экспериментах in vivo на крысах. Анаболическая и андрогенная активность в организме неполовозрелых самцов крыс В качестве метода анализа андрогенных свойств соединений по изобретению использовали методHershberger и др. (1953). Принцип метода. Функция и размеры вторичных реподуктивных желез (семенных пузырьков, предстательной железы) и мышц (например, мышцы, поднимающей анус) являются андрогензависимыми. Кастрация приводит к атрофии этих органов, замещение андрогенными соединениями стимулирует их рост и функцию дозозависимым образом. Описание метода. У кастрированных неполовозрелых самцов крысы фармакологически активные агонисты андрогенов стимулируют рост предстательной железы, семенных пузырьков (андрогенные свойства) и мышцы, поднимающей анус (анаболические свойства). Для определения андрогенных и анаболических свойств eF-MENT неполовозрелым кастрированным самцам крыс в течение семи дней один раз в сутки вводили соединение А (11-фтор-17-гидрокси-7-метилэстр-4-ен-3-он, различные дозы),соединение Б (7-метил-19-нортестостерон, различные дозы), пропионат тестостерона (контрольное соединение) и бензилбензоат/рициновое масло (растворитель и контрольное соединение) соответственно. Затем определяли относительую массу предстательной железы, семенных пузырьков и мышцы, поднимающей анус. (Hershberger, L.G., Shipley, E.G., Meyer, R.K. (1953). Миотрофную активность 19 нортестостерона и других стероидов определяли модифицированным методом на мышце, поднимающей анус. Proc. Soc. Exp. Biol. Med., 83, 175-180). Сравнение активностей соединения А (11-фтор-17-гидрокси-7-метилэстр-4-ен-3-она) и соединения Б (7-метил-19-нортестостерона). Животные: неполовозрелые крысы ORX, продолжительность терапии: 7 суток. При анализе указанным методом соединение А, представитель соединений по изобретению, имеет профиль активности, сравнимый с соединением Б, известным из уровня техники, что свидетельствует о том, что соединения по изобретению можно использовать аналогично известным соединениям. Стабильность в микросомах печени Метаболическую стабильность соединений испытывали в микросомах печени разных видов коммерческих животных. При использовании биологического материала из организма человека можно прогнозировать первую стадию метаболизма в организме человека. Быстрая деградация анализируемого материала свидетельствует о низкой биодоступности анализируемых соединений при пероральном введении. Микросомы, выделенные из различных видов, инкубировали в присутствии анализируемых соединений по меньшей мере при двух концентрациях в течение двух промежутков времени при сравнимой метаболической активности (ферменты комплекса цитохром Р 450). Промежутки времении соответствуют времени деградации контрольных соединений. Количество оставшегося соединения рассчитывали при сравнении с исходным количеством (на время 0 мин). При соответствующем проведении эксперимента можно получить данные о первой фазе метаболизма и об изоферментах CYP, принимающих участие в этом процессе. Если к микросомам печени добавить дополнительные вещества, то наряду с первой фазой метаболизма можно наблюдать стадию гликозилирования глюкуроновой кислотой (глюкуронидирование), т.е. вторую фазу метаболической трансформации. Видоспецифичная стабильность анализируемых соединений в печени при концентрации 3 мкМ Метаболическая стабильность соединения А, представителя соединений по настоящему изобретению, является более высокой по сравнению с соединениями, известными из уровня техники. Соединения по изобретению или фармацевтические препараты по изобретению, содержащие эти соединения, в высшей степени пригодны для терапии полноценных (не стерильных) пациентов мужского пола, а также самцов других млекопитающих. Терапия с целью контрацепции приводит к тому, что мужчины становятся стерильными только временно. После завершения терапии активными ингредиентами по изобретению или фармацевтическими препаратами, восстанавливается исходное состояние организма, т.е. пациент, прошедший терапию, больше не является стерильным и сперматогенез восстанавливается до прежнего уровня. Для поддержания временной стерильности на постоянном уровне в течение необходимого периода времени активный ингредиент или препарат вводят в непрерывном режиме, причем введение в зависимости от формы введения осуществляют ежедневно через короткие интервалы или же периодически через более продолжительные интервалы. После завершения одноразового или повторного введения активного ингредиента или препарата полноценное состояние пациента необязательно восстанавливается не сразу, а только постепенно, причем время реабилитации зависит от ряда факторов, например, от дозировки, телосложения пациента и одновременного введения других фармацевтических препаратов. Если целью терапии является контрацепция, то 11-галогенстероиды вводят в более высокой дозе,чтобы уровень в крови ЛГ и ФСГ в каждом случае составлял максимально 2,5 МЕ/мл (ME означает международную единицу), прежде всего максимально 1,0 МЕ/мл, а уровень в крови тестостерона составлял максимально 10 нмоль/л, прежде всего 3 нмоль/л. Если соединения по изобретению используют с целью гормонзаместительной терапии без стимуляции контрацепции, дозы являются более низкими. В этом случае стремятся создать такой уровень (активного агента) в крови, чтобы возможные уровни в крови ЛГ и ФСГ составляли, соответственно, более 2,5 МЕ/мл, а тестостерона более 10 нмоль/л. Дозы 11-галогенстероидов по изобретению, необходимые для поддержания в крови соответствующего уровня ЛГ, ФСГ и тестостерона, зависят от ряда факторов и, следовательно, должны определяться в зависимости от способа введения. Во-первых, доза естественным образом зависит от типа терапии. Если соединения используют для мужской контрацепции, то следует назначать более высокие дозы,чем в случае гормонзаместительной терапии. Кроме того, дозы зависят от типа 11-галогенстероида и его биодоступности. Способ применения зависит также от количества вводимого агента. Наконец, доза также зависит от телосложения пациента, подлежащего лечению, и прочих факторов, например, от одновременного применения других фармацевтических препаратов. Соединения можно вводить пероральным или парентеральным способом, например, внутрибрюшинным, внутривенным, внутримышечным или чрескожным способом. Кроме того, соединения можно имплантировать в ткани. Количество соединений, подлежащих введению, если их вводят в эффективном количестве, может изменяться в широких пределах. Количество соединения, подлежащего введению,может изменяться в широких пределах в зависимости от состояния больного, необходимого результата лечения и способа введения. Для человека суточная доза составляет от 0,1 до 100 мг, предпочтительная суточная доза составляет от 0,1 до 10 мг. Продолжительность лечения зависит от цели лечения. Пригодными лекарственными формами являются капсулы, пилюли, таблетки, таблетки в оболочке,кремы, мази, лосьоны, жидкости, такие, как сиропы, гели, инъекционные растворы, например, для внутрибрюшинной, внутривенной, внутримышечной или подкожной инъекции и т.п., включая лекарственные формы, которые высвобождают соединения по изобретению в организме пациента постепенно или сразу за короткое время в зависимости от типа лекарственной формы. В качестве фармацевтических препаратов для перорального введения используют капсулы, пилюли,таблетки, таблетки в оболочке и жидкости или другие известные формы для доставки пероральным способом. В этом случае фармацевтические препараты можно приготовить таким образом, чтобы высвобождение и доставка в организм активных ингредиентов происходили за короткое время, или чтобы они оказывали депонирующее, т.е. пролонгированное действие благодаря медленному высвобождению активного ингредиента в организме пациента. Наряду с 11-галогенстероидом стандартные формы могут содержать один или более фармацевтически приемлемых носителей, например, веществ, регулирующих реологические свойства фармацевтического препарата, ПАВ, солюбилизирующих агентов, микрокапсул,микрочастиц, гранулятов, разбавителей, связывающих веществ, таких как крахмал, сахароза, сорбит и-6 006674 желатин, а также наполнителей, таких как кремневая кислота и тальк, смазывающих веществ, красителей, ароматизаторов и других веществ. 11-Галогенстероиды по изобретению прежде всего можно приготовить в виде раствора, который предназначен для перорального введения и который наряду с активным 11-галогенстероидом содержит фармацевтически приемлемое масло, и/или фармацевтически приемлемое липофильное ПАВ, и/или фармацевтически приемлемое гидрофильное ПАВ, и/или фармацевтически приемлемый смешивающийся с водой растворитель. Подобные композиции описаны в WO-A-97/21440. Для улучшения биодоступности стероида можно также приготовить клатраты соединений с циклодекстрином. Для этого соединения вводят в реакцию с -, - или -декстрином или его производными(РСТ/ЕР 95/02656). Необходимые кремы, мази, лосьоны и жидкости для введения местным способом готовят таким образом, чтобы соединения по изобретению поступали в организм в достаточном количестве. Эти формы доставки содержат адъюванты, например соединения, которые регулируют реологические свойства фармацевтических препаратов, ПАВ, консерванты, солюбилизирующие агенты, разбавители, вещества, способствующие впитыванию стероидов по изобретению через кожу, красители, ароматизаторы и средства защиты кожи, такие как кондиционеры и увлажнители. Наряду со стероидами по изобретению фармацевтический препарат может содержать другие активные ингредиенты. Для парентерального введения активные ингредиенты растворяют или суспендируют в физиологически приемлемом разбавителе. В качестве разбавителя часто используют масла без добавок или в смеси с солюбилизирующим агентом, ПАВ, суспендирующим агентом или эмульгатором. Примеры используемых масел включают оливковое масло, арахисовое масло, хлопковое масло, соевое масло, касторовое масло и кунжутное масло. Для изготовления инъекционного препарата можно использовать любой жидкий носитель, в котором соединения по изобретению растворяются или образуют эмульсии. Такие жидкости часто содержат вещества, регулирующие вязкость, ПАВ, консерванты, солюбилизирующие агенты, разбавители и прочие добавки, придающие раствору изотонические свойства. Наряду с 11 галогенстероидами раствор может также содержать другие активные ингредиенты. 11-Галогенстероиды можно вводить в форме инъекции для замедленного всасывания или имплантированного препарата, например, подкожным способом, причем препарат можно приготовить таким образом, что он будет обеспечивать медленное высвобождение активных ингредиентов. Наконец, можно использовать известные способы, например, создание депо, которое растворяется или взаимодействует с мембраной. В качестве инертных материалов имплантаты могут содержать биодеградируемые полимеры или синтетические кремнийорганические соединения, например кремнийорганическую смолу. 11 Галогенстероиды можно также включить, например, в пластырь для чрескожной доставки. 11-Галогенстероиды по изобретению синтезируют различными методами. Два таких метода иллюстрируются ниже на конкретных примерах. Из соединения общей формулы Б, Г где R11 означает гидроксил, галоген или нуклеофильную уходящую группу, a R13 имеет значения, указанные выше, по реакции 1,6-присоединения с металлированным алкилом формулы R7-М или R7-М'Х, где М означает щелочной металл, М' означает щелочно-земельный металл, X означает галоген, а R7 имеет значения, указанные выше, сначала получают соединение общей формулы Б', Д а затем это соединение или селективно восстанавливают с образованием соединения общей формулы I,или, если R11 не является галогеном, вводят в реакцию нуклеофильного замещения в 11-положении с галогенирующим агентом, а затем селективно восстанавливают с образованием соединения общей формулы I В этом синтезе исходным соединением является первый вариант соединения А, например 11 гидрокси-19-норандрост-4-ен-3,17-дион (J.de Flines и др., Reсl. Trav. Chim. Pays-Bas, т. 82, с. 129 ff. В 11-гидрокси-19-норандрост-4-ен-3,17-дионе R11 означает ОН, a R13 означает метил. На первой стадии соединение А (где R11 означает ОН) сначала взаимодействует с галогенгидроксилирующим реагентом, например фтористо-водородной кислотой, хлористо-водородной кислотой, бромисто-водородной кислотой или иодисто-водородной кислотой, тионилхлоридом или тионилбромидом,пентахлоридом фосфора, оксихлоридом фосфора, N-хлорсукцинимидом, трифенилфосфином/ четыреххлористым углеродом, HF/пиридином или трифторидом диэтиламиносеры или предпочтительно с нонафлилфторидом/1,5-диазабицикло[5.4.0]ундеценом, с образованием галогенорандростендиона, а именно 11-гидрокси-19-норандрост-4-ен-3,17-диона общей формулы А', указанной выше (R11 означает галоген). Затем в соединение вводят )6-двойную связь, например, систему 3-кето-)4 сначала в условиях протонного катализа превращают в простой эфир 3,5-диен-3-ола А" где Hal означает F, Cl, Br, I, а затем из соединения А", например, бромированием/ дегидробромированием, прежде всего при взаимодействии с N-бромсукцинимидом или 1,3-дибром-5,5 диметилгидантоином с последующей обработкой пиридином или бромидом лития/карбонатом лития,получают )4,6-кетон общей формулы Б Затем соединение Б алкилируют в положении 7 по реакции 1,6-присоединения металлированного алкила, например метилмагнийбромида или метиллития, при катализе медью, с образованием соединения Б' На следующей стадии полученный 7-алкил-11-галогеннорандрост-4-ен-3,17-дион Б' обрабатывают боргидридом натрия при низких температурах, например, в ТГФ или диэтиловом эфире, с целью избирательного восстановления 17-кетона. При этом получают соединение по изобретению формулы I 7 алкил-11-галоген-17-гидроксинорандрост-4-ен-3-он Затем 17-гидроксигруппу необязательно этерифицируют ацилангидридами или ацилхлоридами, например ацетилхлоридом, бутаноилхлоридом или энантоилхлоридом, в присутствии соответствующего основания, такого, например, как пиридин. При этом получают соответствующие сложные эфиры формулы I' по изобретению. Для получения других 11-галогенстероидов формулы I", а именно 7-алкил-11-галоген-17 гидроксинорандрост-5(10)-ен-3-онов, 4-3-кетогруппу в соединении I сначала превращают в кеталь с получением смеси изомерных кеталей В с двойной связью 5- и 5(10)-. Полученную смесь осторожно декетализируют и разделяют полученные изомеры, при этом получают 7-алкил-11-галоген-17-гидроксинорандрост-5(10)-ен-3-оны формулы I" по изобретению. В другом способе синтеза соединений формулы I исходное соединение, 11-ацетокси-19 норандроста-4,6-диен-3,17-дион формулы Г (CAS: 228570-21-6)-9 006674 где R13 означает метил, вводят в реакцию 1,6-присоединения, катализируемую медью, с металлалкилом,таким, например, как метилмагнийбромид или метиллитий, например, в ТГФ или диэтиловом эфире, при низкой температуре, с образованием соединений общей формулы Д Полученные соединения вводят в реакцию с галогенгидроксилирующими реагентами, например фтористо-водородной кислотой, хлористо-водородной кислотой, бромисто-водородной кислотой или иодисто-водородной кислотой, тионилхлоридом или тионилбромидом, пентахлоридом фосфора, оксихлоридом фосфора, N-хлорсукцинимидом, трифенилфосфином/четыреххлористым углеродом,HF/пиридином или трифторидом диэтиламиносеры или предпочтительно с нонафлилхлоридом/1,5 диазабицикло[5.4.0]ундеценом, с образованием 7-алкил-11-галоген-17-гидроксинорандрост-4-ен 3,17-диона, который затем избирательно восстанавливают в положении 17 боргидридом натрия при низкой температуре, например в ТГФ или диэтиловом эфире, с образованием 7-алкил-11-галоген-17 гидроксиандрост-4-ен-3-она формулы I. Ниже изобретение поясняется на примерах. Пример 1. Получение 11-фтор-17-гидрокси-7-метилэстр-4-ен-3-она (соединение формулы I).(Схема А, фиг. 1) а). 11-Фторэстр-4-ен-3,17-дион (А'). К 5,0 г 11-гидроксиэстр-4-ен-3,17-диона (A) (J. de Flines и др., Recl. Trav. Chim. Pays-Bas, т. 82, с. 129 ff. (1963 в 100 мл толуола и 7,3 мл 1,8-диазабицикло[5.4.0]ундец-7-ена при 0 С добавляли по каплям 4,6 мл фторангидрида перфторбутан-1-сульфокислоты. Через 30 мин раствор разбавляли этилацетатом, промывали солевым раствором, сушили и концентрировали упариванием в вакууме. Неочищенный продукт очищали хроматографией на силикагеле (элюент: градиент гексан/этилацетат), при этом получали 3,8 г 11-фторэстр-4-ен-3,17-диона (A'), tпл. l73-174C. б). 11-Фтор-3-метоксиэстр-4-ен-3,17-он (А"). 7,8 г 11-Фторэстр-4-ен-3,17-диона (А') и 780 мг толуол-4-сульфоната пиридиния в 40 мл 2,2 диметоксипропана перемешивали при 80 С в течение 5 ч, а затем добавляли 1,5 мл триэтиламина. Реакционную смесь разбавляли этилацетатом и промывали солевым раствором. Продукт кристаллизовали из метанола, при этом получали 5,3 г 11-фтор-3-метоксиэстр-4-ен-3,17-она (А"), tпл. 173C. в). 11-Фторэстра-4,6-диен-3,17-дион (Б). К 5,0 г 11-фтор-3-метоксиэстра-3,5-диен-17-она (А") в 50 мл ДМФ при 0 С добавляли 5 мл 10 мас.% раствора ацетата натрия, а затем порциями добавляли 2,5 г 1,3-дибром-5,5-диметилгидантоина. Через 30 мин добавляли 2,3 г сульфита натрия, а затем 2,5 г бромида лития и 2,0 г карбоната лития и перемешивали при 100 С в течение 2 ч. Реакционную смесь перемешивали в ледяной воде. Осадок отделяли фильтрованием в вакууме, растворяли в этилацетате, полученный раствор промывали водой, сушили и концентрировали упариванием в вакууме. Продукт перекристаллизовывали из этилацетата, при этом получали 3,6 г 11-фторэстра-4,6-диен-3,17-диона (Б), tпл. 198 С. г). 11-Фтор-7-метилэстр-4-ен-3,17-дион (Б'). К раствору 2 г 11-фторэстра-4,6-диен-3,17-диона (Б) в 36 мл тетрагидрофурана при комнатной температуре добавляли 68,7 мг хлорида меди(I). Реакционную смесь охлаждали до -15 С, перемешивали в течение 10 мин, добавляли 427 г хлорида алюминия, перемешивали при указанной температуре в течение 30 мин, добавляли по каплям 4,63 мл раствора метилмагнийбромида и перемешивали при -10 С в течение еще 5 ч. Затем в реакционную смесь при -10 С добавляли 4 н. хлористо-водородную кислоту, перемешивали при комнатной температуре в течение 1,5 ч, выливали в воду, трижды экстрагировали этилацетатом, экс- 10006674 тракт сушили над сульфатом натрия и концентрировали упариванием в вакууме. Продукт очищали хроматографией на силикагеле (элюэнт: гексан/этилацетат), при этом получали 1,0 г очищенного 11-фтор 7-метилэстр-4-ен-3,17-диона (Б'), tпл. 101,4C, []D20 +135,8 (с = 0,525%, хлороформ). Из последней фракции получали 0,17 г изомера 11-фтор-7-метилэстр-4-ен-3,17-диона, tпл. 84,8C, []D20 +93,7 (с = 0,525%, хлороформ). д). 11-Фтор-17-гидрокси-7-метилэстр-4-ен-3-он (I). Раствор 500 мг 11-фтор-7-метилэстр-4-ен-3,17-диона (Б') в 10 мл тетрагидрофурана, 5,8 мл этанола и 1,15 мл воды перемешивали при -55 С в течение 2,5 ч в присутствии 175,6 мг боргидрида натрия. Затем добавляли еще 351,2 мг боргидрида натрия, перемешивали при -55 С в течение еще 1,5 ч, выливали в ледяную воду, трижды экстрагировали этилацетатом, экстракт промывали до нейтральной реакции,сушили над сульфатом натрия и концентрировали упариванием в вакууме. Продукт очищали хроматографией на силикагеле (элюэнт: гексан/этилацетат), при этом получали 230 мг очищенного 11-фтор 17-гидрокси-7-метилэстр-4-ен-3-она (I). tпл. 126,7C, []D20 +79,9 (с = 0,53%, хлороформ). Указанный синтез можно модифицировать с целью введения в стероидную циклическую систему высших гомологов 7-метильной группы и их производных. Модификация заключается в использовании на стадии г) вместо метилмагнийбромида соответствующего алкилмагнийбромида или соответствующих производных. Таким образом можно получить, например, 7-этил-11-фтор-17-гидроксиэстр-4-ен-3-он и 11-фтор-7-(фторметил)-17-гидроксиэстр-4-ен-3-он. Пример 2. Получение 11-фтор-17-гептаноилокси-7-метилэстр-4-ен-3-она (соединение формулы(Схема Б, фиг. 2). К раствору 220 мг 11-фтор-17-гидрокси-7-метилэстр-4-ен-3-она (I) в 5 мл тетрагидрофурана и 1,09 мл пиридина при 0 С добавляли по каплям 1,09 мл гептаноилхлорида и перемешивали в течение 1 ч. Затем добавляли раствор бикарбоната натрия, трижды экстрагировали этилацетатом, экстракт промывали до нейтральной реакции, сушили над сульфатом натрия и концентрировали упариванием в вакууме. Продукт очищали хроматографией на силикагеле (элюэнт: гексан/этилацетат), при этом получали 210 мг очищенного 11-фтор-17-гептаноилокси-7-метилэстр-4-ен-3-она (Г) в виде пены. []D20 +40,8 (с = 0,56%, хлороформ). Вышеуказанный синтез можно модифицировать с целью введения в стероидную циклическую систему высших гомологов 17-гептаноильной группы. Модификация заключается в использовании вместо гептаноилхлорида соответствующего алканоилхлорида. Таким образом можно получить 11-фтор-7 метил-17-ундеканоилоксиэстр-4-ен-3-он. Пример 3. Получение 11-фтор-17-гидрокси-7-метилэстр-5(10)-ен-3-она (соединение формулы(Схема В, фиг. 3). а). 3-Этилендиокси-11-фтор-7-метилэстр-5(10)-ен-17-ол (В). К раствору 500 мг 11-фтор-17-гидрокси-7-метилэстр-4-ен-3-она (I) в 6,35 мл дихлорметана добавляли 3,63 мл этиленгликоля, 1,82 мл триметилортоформиата и 23,6 мл гидрата паратолуолсульфокислоты. Реакционную смесь перемешивали при комнатной температуре в течение 20 ч,затем добавляли раствор бикарбоната натрия, разбавляли этилацетатом, экстракт промывали до нейтральной реакции, сушили над сульфатом натрия и концентрировали упариванием в вакууме. Продукт очищали хроматографией на силикагеле (элюэнт: гексан/этилацетат), при этом получали 170 мг 3 этилендиокси-11-фтор-7-метилэстр-5(10)-ен-17-ола (В), который содержал некоторое количество изомерного по двойной связи 3-этилендиокси-11-фтор-7-метилэкстр-5-ен-17-ола (В). б). 11-Фтор-17-гидрокси-7-метилэстр-5(10)-ен-3-он (I"). Раствор 170 мг продукта (В), полученного на стадии 3 а), в 22,5 мл метанола перемешивали при комнатной температуре в течение 24 ч в присутствии 300 мг щавелевой кислоты и 3 мл воды. Затем добавляли раствор бикарбоната натрия, трижды экстрагировали этилацетатом, экстракт промывали до нейтральной реакции, сушили над сульфатом натрия и концентрировали упариванием в вакууме. Продукт очищали хроматографией на силикагеле (элюэнт: гексан/этилацетат), при этом получали 62,7 мг очищенного 11-фтор-17-гидрокси-7-метилэстр-5(10)-ен-3-она (I"). После кристаллизации из гексана получали 47,6 мг соединения формулы I". tпл. 169,9C, []D20 +134,4 (с = 0,56%, хлороформ). Пример 4. Получение 11-хлор-17-гидрокси-7-метилэстр-4-ен-3-она (I).(Схема Г, фиг. 4). а). 11-Ацетокси-7-метилэстр-4-ен-3,17-дион (Д). К предварительно приготовленному раствору 20 г иодида меди(I) в 200 мл тетрагидрофурана и 70 мл метилмагнийбромида при -30 С в течение 1 ч добавляли по каплям раствор 20 мг 11-ацетоксиэстра 4,6-диен-3,17-диона (Г) в 500 мл тетрагидрофурана, 20 мл 1,3-диметил-3,4,5,6-тетрагидро-2(1 Н)пиримидинона и 20 мл триметилхлорсилана и полученную смесь перемешивали при -20 С в течение 1 ч. Затем к реакционной смеси при -20 С добавляли 20 мл ледяной уксусной кислоты, перемешивали при- 11006674 комнатной температуре в течение 1 ч, выливали в воду, трижды экстрагировали этилацетатом, экстракт сушили над сульфатом натрия и концентрировали упариванием в вакууме. Продукт очищали хроматографией на силикагеле (элюэнт: гексан/этилацетат), при этом получали 12,8 г очищенного 11-ацетокси 7-метилэстр-4-ен-3,17-диона (Д). tпл. 182,7C, []D20 +24,7 (с = 0,525%, хлороформ). б). 11-Гидрокси-7-метилэстр-4-ен-3,17-дион (Е). Раствор 1 г 11-ацетокси-7-метилэстр-4-ен-3,17-диона (Д) в 20 мл 0,2 М раствора гидроксида калия в метаноле перемешивали при комнатной температуре в течение 3 ч. Затем смесь выливали в воду,трижды экстрагировали этилацетатом, экстракт промывали до нейтральной реакции, сушили над сульфатом натрия и концентрировали упариванием в вакууме. Продукт перекристаллизовывали из диэтилового эфира/ацетона, при этом получали 878 мг очищенного 11-гидрокси-7-метилэстр-4-ен-3,17-диона (Е).tпл. 202,3C,[]D20 +44,8 (с = 0,5%, хлороформ). в). 11-Хлор-7-метилэстр-4-ен-3,17-дион (Е'). Раствор 800 мг 11-гидрокси-7-метилэстр-4-ен-3,17-диона (Е) в 8 мл дихлорметана при 0 С смешивали с 1,21 мл гексахлорацетона и 764 мг трифенилфосфина и перемешивали при комнатной температуре в течение 4 ч. Затем реакционную смесь разбавляли дихлорметаном, экстракт промывали до нейтральной реакции, сушили над сульфатом натрия и концентрировали упариванием в вакууме. Продукт очищали хроматографией на силикагеле (элюэнт: гексан/этилацетат), при этом получали 430 мг очищенного 11-хлор-7-метилэстр-4-ен-3,17-диона (Е'). tпл. 215,1C, []D20 +182,7 (с = 0,5%, хлороформ). г). 11-Хлор-17-гидрокси-7-метилэстр-4-ен-3-он (I). К раствору 380 мг 11-хлор-7-метилэстр-4-ен-3,17-диона (Е') в 7,6 мл тетрагидрофурана, 4,4 мл этанола и 1,15 мл воды при -55 С порциями добавляли 596 мг боргидрида натрия и полученную смесь перемешивали при -55 С в течение 7 ч. Затем реакционную смесь выливали в ледяную воду, трижды экстрагировали этилацетатом, экстракт промывали до нейтральной реакции, сушили над сульфатом натрия и концентрировали упариванием в вакууме. Продукт очищали хроматографией на силикагеле (элюэнт: гексан/этилацетат), при этом получали 130 мг очищенного 11-хлор-17-гидрокси-7-метилэстр-4-ен-3 она (I), tпл. 183,2C, []D20 +136,9 ( хлороформ). Указанный синтез можно модифицировать с целью получения 11-бром- и 11-иодпроизводных,используя бромирующие и иодирующие агенты. Таким образом можно получить, например, 11-бром 17-гидрокси-7-метилэстр-4-ен-3-он и 17-гидрокси-11-иод-7-метилэстр-4-ен-3-он. 7-Этил-11-фтор-17-гидроксиэстр-4-ен-3-он, tпл. 115,lC, []D20 +62,1 (хлороформ) получали из промежуточного соединения 7-этил-11-фторэстр-4-ен-3,17-диона, tпл. l74,9C, []D20 +107,1 (хлороформ) и этилмагнийбромида (вместо метилмагнийбромида) аналогично тому, как описано в примере 1. Другие соединения по изобретению можно получить по известным методикам, описанным в данной области техники. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. 11-Галогенстероиды общей формулы IX-Y-Z означает группу СН=С-С или СН 2-С=С,R1 может находиться в - или в -положении, означает водород,R6 означает водород,R7 означает R или группу P-Q-R, связанную со стероидной циклической системой через группу Р,причем эти группы имеют значения, указанные выше,R11 означает галоген,R13 означает метил или этил,R17 означает водород или C(O)-R18, где R18 означает прямой или разветвленный радикал С 1 С 18 алкил, С 1-С 18 алкенил, С 1-С 18 алкинил или радикал арил, или группу T-U-V, связанную с С(О) через группу Т, где Т и U означают прямые или разветвленные группы С 1-С 18 алкилен, С 1-С 18 алкенилен, С 1 С 18 алкинилен, С 3-С 12 алициклические группы или группы арил и являются одинаковыми или различными, а V означает прямой или разветвленный радикал С 1-С 18 алкил, С 1-С 18 алкенил, С 1-С 18 алкинил или радикал арил, или R18 имеет одно из значений, указанных выше, и, кроме того, замещен одной или более группами NR19R20 или одной или более группами SOxR21, где х равно 0, 1 или 2, a R19, R20 и R21 в каждом- 12006674 случае означают водород или группу T-U-V, связанную с N, S через группу Т, имеющую значение, указанное выше,и их физиологически приемлемые кислотно-аддитивные соли органических и неорганических кислот. 2. 11-Галогенстероиды по п.1, в которых R11 означает фтор. 3. 11-Галогенстероиды по любому из пп.1-2, в которых R7 означает метил, этил или трифторметил. 4. 11-Галогенстероиды по любому из пп.2-3, в которых R13 означает метил. 5. 11-Галогенстероиды по любому из пп.2-6, в которых R17' означает водород или C(O)-R18, где R18 означает С 1-С 18 алкил с прямой или разветвленной цепью. 6. 11-Галогенстероиды общей формулы I по п.1 11-фтор-17-гидрокси-7-метилэстр-4-ен-3-он,11-хлор-17-гидрокси-7-метилэстр-4-ен-3-он,11-бром-17-гидрокси-7-метилэстр-4-ен-3-он,17-гидрокси-11-иод-7-метилэстр-4-ен-3-он,7-этил-11-фтор-17-гидроксиэстр-4-ен-3-он,11-фтор-7-(фторметил)-17-гидроксиэстр-4-ен-3-он,11-фтор-17-гептаноилокси-7-метилэстр-4-ен-3-он,11-фтор-7-метил-17-ундеканоилоксиэстр-4-ен-3-он,11-фтор-17-гидрокси-7-метилэстр-5(10)-ен-3-он. 7. Способ получения 11-галогенстероидов общей формулы I по любому из пп.1-6, в котором из соединения общей формулы Б, Г где R11 означает гидроксил, галоген или нуклеофильную уходящую группу, a R13 имеет значения, указанные выше, по реакции 1,6-присоединения с металлированным алкилом формулы R7-М или R7-М'Х, где М означает щелочной металл, М' означает щелочно-земельный металл, X означает галоген, а R7 имеет значения, указанные выше, сначала получают соединение общей формулы Б', Д а затем это соединение или селективно восстанавливают с образованием соединения общей формулы I,или, если R11 не является галогеном, вводят в реакцию нуклеофильного замещения в 11-положении с галогенирующим агентом, а затем селективно восстанавливают с образованием соединения общей формулы I 8. Применение 11-галогенстероидов по любому из пп.1-6 для получения фармацевтических агентов. 9. Фармацевтические препараты, содержащие по меньшей мере один 11-галогенстероид по любому из пп.1-6, а также по меньшей мере один фармацевтически приемлемый носитель.
МПК / Метки
МПК: C07J 1/00, A61P 5/26, A61K 31/565
Метки: 7-замещенные-11-галогенированные, андрогенные, стероиды
Код ссылки
<a href="https://eas.patents.su/15-6674-androgennye-7-zameshhennye-11-galogenirovannye-steroidy.html" rel="bookmark" title="База патентов Евразийского Союза">Андрогенные 7-замещенные-11-галогенированные стероиды</a>
Предыдущий патент: Антитела против il-12 и способы их применения
Следующий патент: Фармацевтическая композиция, содержащая гамма-бутиробетаин
Случайный патент: Углеродный восстановитель и способ его получения