Способ лечения инсульта
Номер патента: 20776
Опубликовано: 30.01.2015
Авторы: Зенген Мариола, Эбель Алиса, Аль-Рави Ясир Алаа Шафеек
Формула / Реферат
1. Способ лечения инсульта, включающий введение десмотеплазы у пациентов с закупоркой мозговой артерии, у которых балльная оценка по шкале NIHSS составляет по меньшей мере 4, а балльная оценка по шкале TIMI составляет 0 или 1.
2. Способ по п.1, где закупорка мозговой артерии или стеноз высокой степени локализованы в средней мозговой артерии (МСА), передней мозговой артерии (АСА) или задней мозговой артерии (РСА) или в их ветвях.
3. Способ по п.2, где закупорка мозговой артерии или стеноз высокой степени локализованы в ветви M1 или М2 МСА, АСА или РСА.
4. Способ по любому из предыдущих пунктов, где пациент имеет инсульт с балльной оценкой NIHSS, составляющей по меньшей мере 8.
5. Способ по любому из предыдущих пунктов, где пациент имеет инсульт с балльной оценкой NIHSS, составляющей от 8 до 24.
6. Способ по любому из предыдущих пунктов, где десмотеплазу вводят пациенту в дозе от приблизительно 90 до приблизительно 125 мкг/кг веса тела.
7. Способ по любому из предыдущих пунктов, который проводят позднее чем 3 ч после появления инсульта.
8. Способ по п.7, который проводят в промежутке времени от 3 до 9 ч после появления симптомов инсульта.
9. Способ отбора пациента для лечения инсульта способом по п.1, в котором указанного пациента отбирают по проявлению на исходном уровне следующих признаков:
a) закупорка мозговой артерии;
b) балльная оценка NIHSS составляет по меньшей мере 4 и
с) балльная оценка TIMI составляет 0 или 1.
Текст
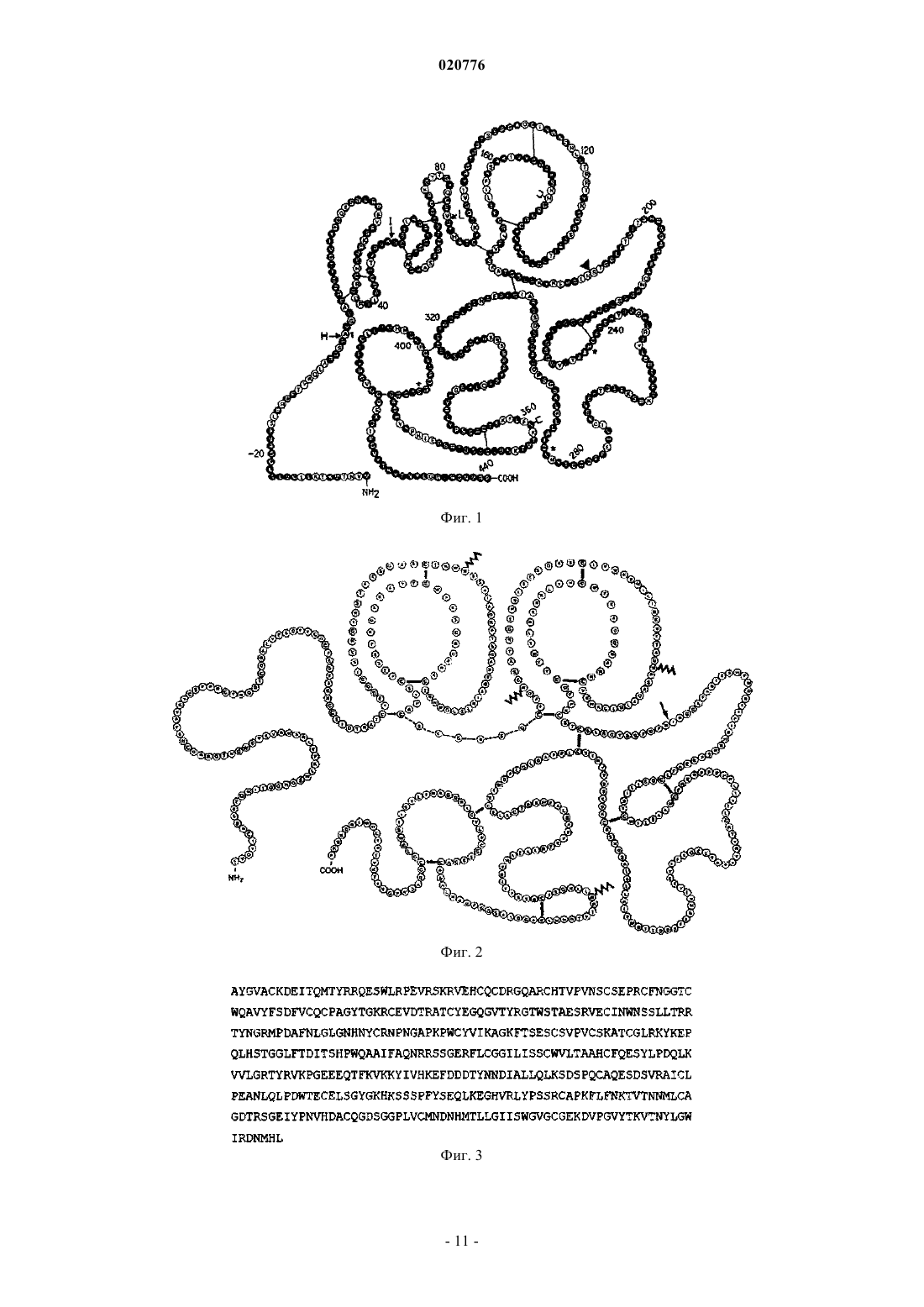
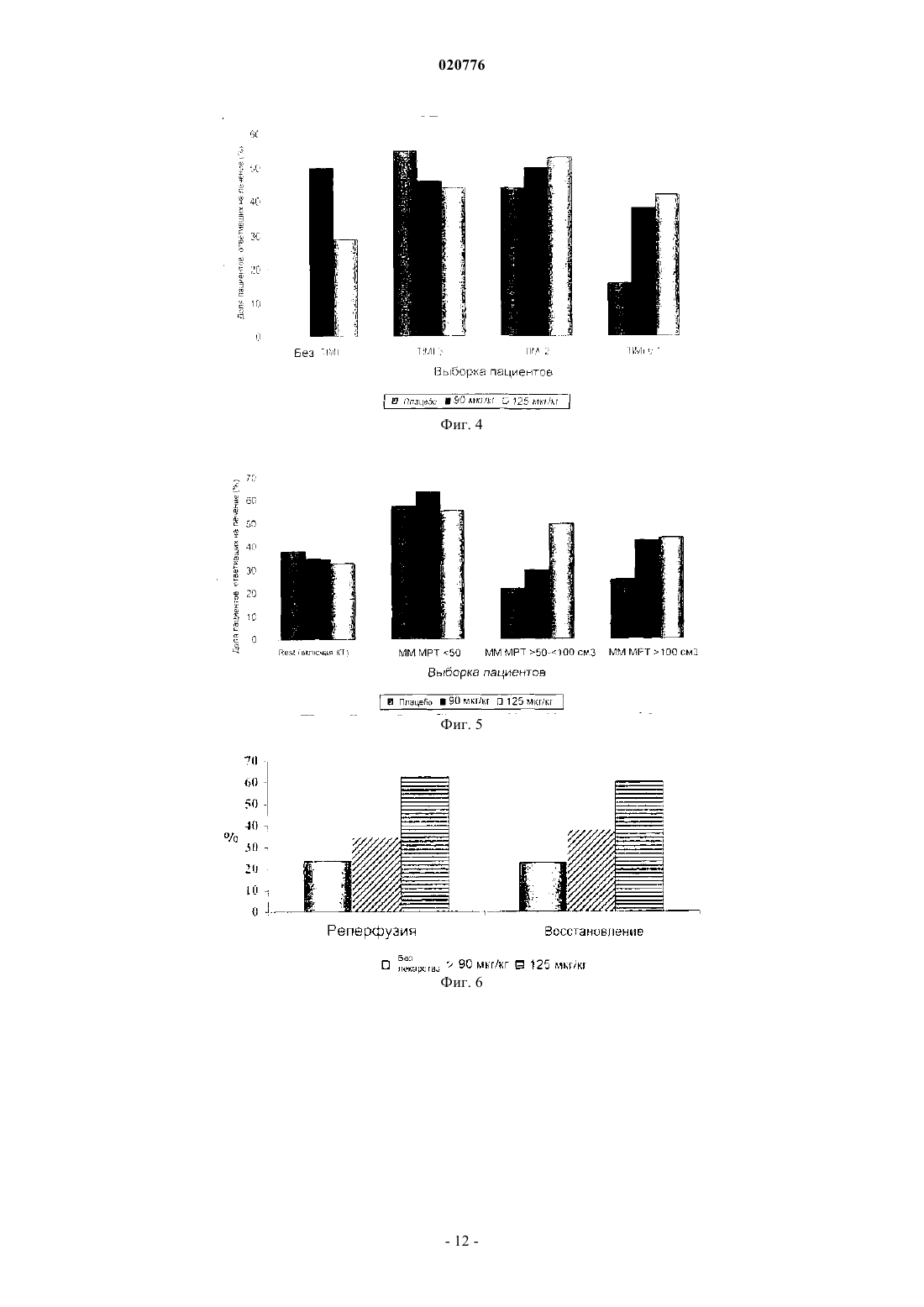
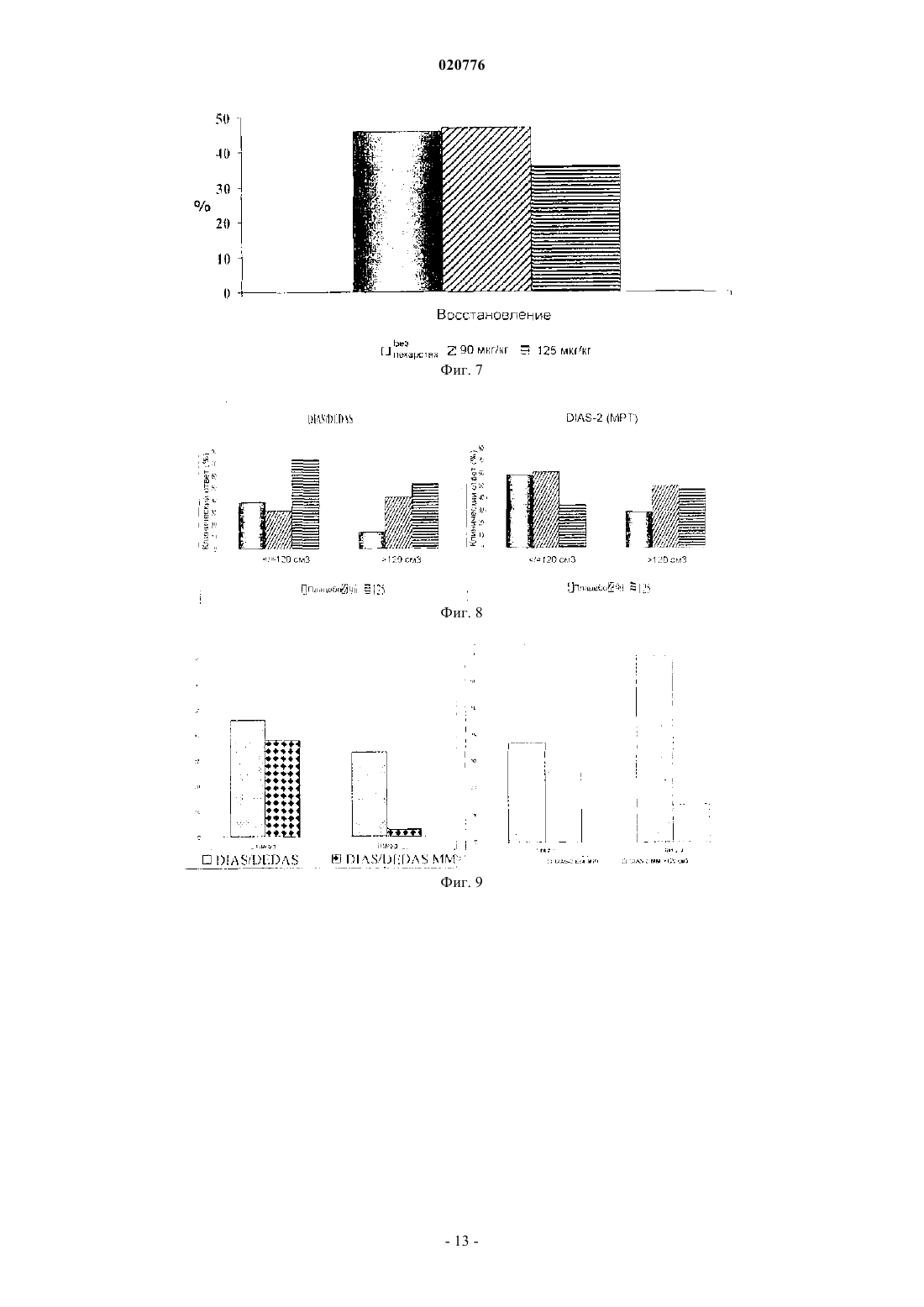
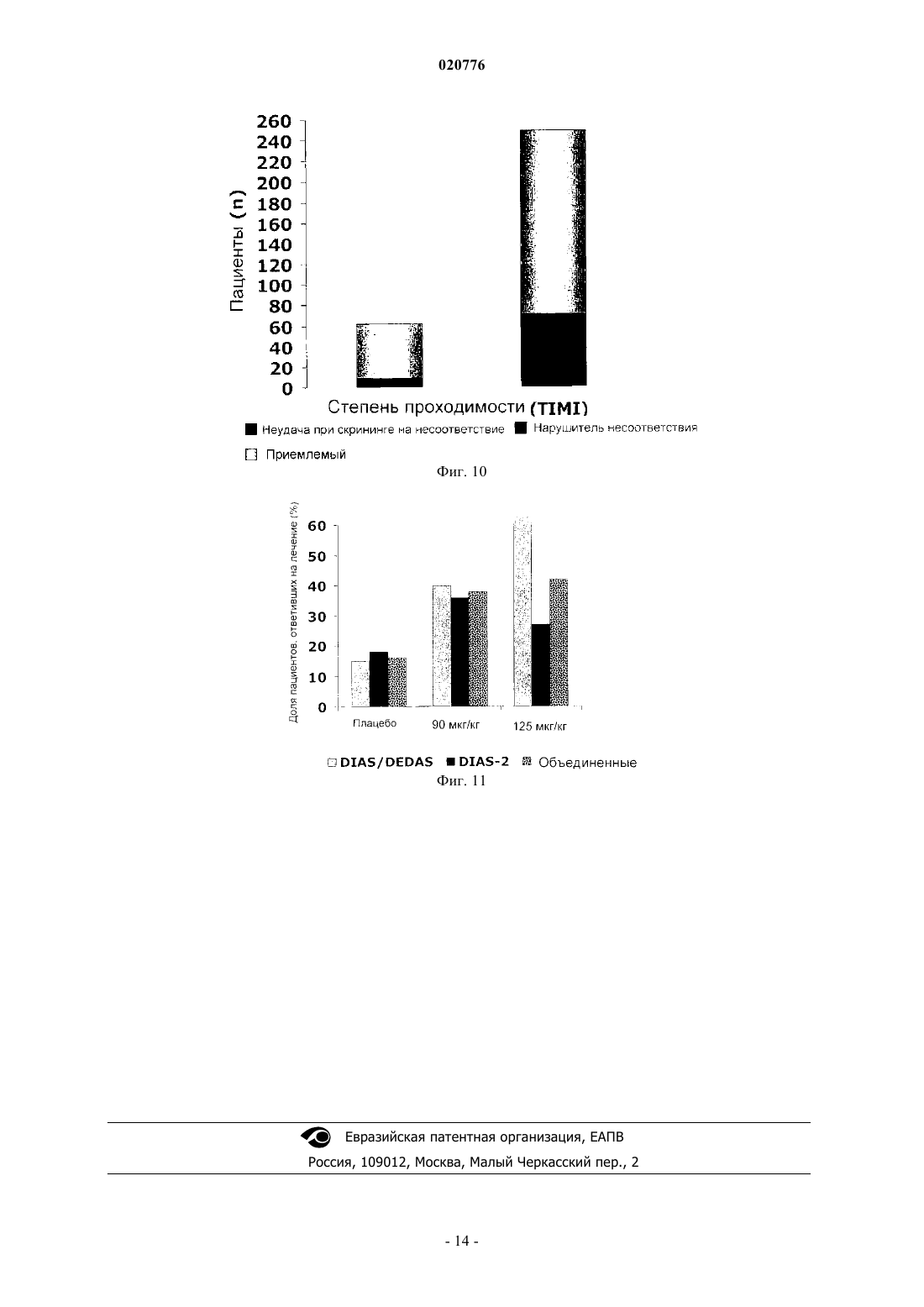
Изобретение относится к способу лечения инсульта, включающему введение десмотеплазы у пациентов с закупоркой мозговой артерии, у которых балльная оценка по шкале NIHSS составляет по меньшей мере 4, а балльная оценка по шкале TIMI составляет 0 или 1, а также к способу отбора пациента для лечения инсульта указанным способом. Зенген Мариола, Эбель Алиса (DE),Аль-Рави Ясир Алаа Шафеек (AE) Медведев В.Н. (RU) Изобретение относится к способу лечения инсульта и к способу отбора пациентов для лечения указанным способом. Инсульт является третьей из ведущих причин смерти после сердечно-сосудистого заболевания и рака. Ежегодно инсульт диагностируется у 750000 пациентов и является причиной приблизительно 168000 смертей только в Соединенных Штатах Америки. Влияние инсульта на личность и общество велико, поскольку это заболевание сопряжено с тяжелой инвалидностью. Введение тромболитиков, таких как активаторы плазминогена, пациентам, проходящим терапевтическое лечение по поводу острого ишемического инсульта, помогает спасти "ткань, подверженную риску" (которая в научной литературе также иногда упоминается под названием "пенумбра"), и уменьшить конечный размер инфаркта, т.е. улучшает клинический исход для пациента. Доступные в настоящее время и официально разрешенные к применению схемы внутривенной тромболитической терапии основаны на промежутке времени, прошедшем после появления симптомов инсульта. Другими словами, только пациенты с инсультом, наступившим не далее как за 180 мин (3 ч) до начала лечения, рассматриваются как перспективные кандидаты на лечение разрешенными к применению тромболитиками. Недавние клинические исследования ("ECASS-3") с альтеплазой rt-PA показали, что rt-PA (рекомбинантный тканевой активатор плазминогена) эффективен даже спустя 3-4,5 ч после появления инсульта. Однако в этом расширенном окне времени наблюдалось значительное увеличение частоты внутричерепных кровоизлиянийEngland Journal of Medicine, 2008, vol. 359, No 13, p. 1317-1329). Таким образом, при расширении временного окна в связи с лечением инсульта альтеплазой остаются большие сомнения по вопросам безопасности. Перед лечением пациенты, которым предстоит тромболитическая терапия, проходят оценочное обследование методом бесконтрастной компьютерной томографии (КТ), позволяющее подтвердить отсутствие кровоизлияния в мозг и отсутствие гиподенситивности (участков пониженной плотности) в головном мозге, охватывающих более одной трети территории, снабжаемой средней мозговой артерией(МСА). Они также проходят оценку для исключения противопоказаний к тромболизису, составляющих факторы риска кровотечения (например, злокачественных опухолей, недавней травмы, недавнего хирургического вмешательства, опухоли мозга, порока развития сосудов или сосудистой аневризмы). Однако даже при таких ограничительных критериях тромболизис сопряжен со значительным риском внутричерепного кровоизлияния (ICH), которое наблюдается с частотой до 15% из числа всех пациентов, получающих такое лечение. Клиническая польза доступной в настоящее время тромболитической терапии не перевешивает этот риск. Таким образом, отбор пациентов, которых с учетом действующих в настоящее время критериев можно включить в протокол тромболизиса, не является в достаточной степени удовлетворительным. В соответствии с этим цель настоящего изобретения заключается в том, чтобы предложить новые подгруппы пациентов, которые могут получить пользу от лечения инсульта, и вместе с этим исключить тех пациентов, для которых тромболизис предположительно не принесет пользы. Посредством этого должна возрасти общая эффективность и безопасность тромболитической терапии инсульта. Авторами настоящего изобретения недавно было обнаружено, что отбор пациентов для тромболитической терапии только на основе визуальной оценки индивидуальных изображений (мозга) пациентов с инсультом и времени, прошедшего после появления инсульта, несет риск привлечь к лечению пациентов лишь с малыми или транзиторными явлениями инсульта и тем самым подвергнуть этих пациентов риску ICH без обоснованной медицинской потребности. Кроме того, было обнаружено, что число пациентов, пригодных для лечения инсульта, можно на рациональной основе ограничить теми пациентами, у которых проявилось такое событие инсульта, которое нельзя преодолеть за счет способностей организма к самоисцелению, т.е. нуждающихся в медицинском лечении. Такие случаи инсульта можно классифицировать по выявлению согласно определенным свойствам, как это описано ниже. В соответствии с этим в одном из вариантов осуществления изобретения отбирают различные подгруппы пациентов для лечения тромболитиками. В соответствии с одним из вариантов осуществления изобретения отобранные подгруппы пациентов перед лечением пройдут индивидуальное обследование для получения визуальных изображений головного мозга с целью оценки возможной ткани, подверженной риску, причем это обследование показывает также потенциально восстанавливаемую ткань мозга. В другом варианте осуществления изобретения отбирают пациентов, проявляющих закупорку артерии. Еще в одном варианте осуществления изобретения отбирают пациентов по наличию ткани, подверженной риску, и по закупорке артерии. В соответствии с дальнейшими вариантами осуществления изобретения отобранных пациентов можно лечить болюсной инъекцией активатора плазминогена, не обладающего нейротоксичностью. В случае применения десмотеплазы в одном из вариантов осуществления изобретения можно вводить болюсом приблизительно 90 или приблизительно 125 мкг активатора плазминогена на 1 кг веса тела. Лечение можно начинать позже 3 ч после появления инсульта. Уровень техники изобретения Тканью-мишенью тромболитической терапии является так называемая ткань, подверженная риску. Разумное патофизиологическое обоснование этого заключается в следующем. Сразу же после закупорки артерии, снабжающей кровью мозг, региональный церебральный кровоток (rCBF) снижается. Ткань мозга с критически малой перфузией, называемая "ишемической тканью",первой утрачивает функцию и в конечном счете целостность из-за отсутствия глюкозы и кислорода. Участок, в котором целостность ткани мозга в значительной степени утрачивается, известен как "сердцевина инфаркта" и развивается в первые минуты закупорки сосуда в центре ишемической области. Сердцевина инфаркта характеризуется необратимым повреждением нейронных клеток и окружена ишемической, но все еще поддающейся восстановлению тканью, подверженной риску инфаркта. Ткань, подверженная риску, также упоминается под названием "пенумбра". В зависимости от промежутка времени, прошедшего с момента появления инсульта, тяжести церебральной ишемии, величины коллатерального кровотока и метаболического статуса пациента ткань,подверженная риску, в конечном итоге утрачивает свою структурную целостность, т.е. ее патологическое состояние прогрессирует до инфаркта. В случае постоянной закупорки сосуда сердцевина инфаркта со временем расширяется до тех пор,пока почти вся ткань, подверженная риску, не переходит в состояние инфаркта. Однако в случае ранней реканализации (восстановления проходимости) питающего сосуда ишемические изменения в ткани, подверженной риску, обратимы, и, потенциально, такая ткань может восстановиться. Следовательно, ткань,подверженная риску, является объектом-мишенью текущей тромболитической терапии. Хотя вышеупомянутые факторы развития инфаркта как таковые известны, отсутствует понимание возможных взаимодействий и последствий. В соответствии с этим все еще нет убедительной идеи для отбора перспективных в плане лечения групп пациентов, которая была бы приемлема для стандартной клинической практики. Для того чтобы свести к минимуму риск геморрагической трансформации, единственное тромболитическое лечение, официально разрешенное в настоящее время, строго ограничено промежутком времени, не превышающим 3 ч с момента проявления первых симптомов инсульта. Сущность изобретения Настоящее изобретение относится к способу лечения инсульта, включающему введение десмотеплазы у пациентов с закупоркой мозговой артерии, у которых балльная оценка по шкале NIHSS составляет по меньшей мере 4, а балльная оценка по шкале TIMI составляет 0 или 1. В частности, в одном из вариантов осуществления закупорка мозговой артерии или стеноз высокой степени локализованы в средней мозговой артерии (МСА), передней мозговой артерии (АСА) или задней мозговой артерии (РСА) или в их ветвях. В еще одном варианте изобретения закупорка мозговой артерии или стеноз высокой степени локализованы в ветви M1 или M2 МСА, АСА или РСА. В следующем варианте осуществления способ лечения инсульта по изобретению проводят для пациентов, имеющих инсульт с балльной оценкой NIHSS, составляющей по меньшей мере 8. В одном из вариантов осуществления способ лечения по изобретению проводят для пациентов,имеющих инсульт с балльной оценкой NIHSS, составляющей от 8 до 24. Согласно еще одному варианту осуществления изобретения десмотеплазу вводят пациенту в дозе от приблизительно 90 до приблизительно 125 мкг/кг веса тела. В одном из вариантов осуществления изобретения способ по изобретению проводят позднее чем через 3 ч после появления инсульта, предпочтительно в промежутке времени от 3 до 9 ч после появления симптомов инсульта. Настоящее изобретение относится также к способу отбора пациента для лечения инсульта указанным способом, в котором указанного пациента отбирают по проявлению на исходном уровне следующих признаков:b) балльная оценка NIHSS составляет по меньшей мере 4 иc) балльная оценка TIMI составляет 0 или 1. В отличие от принятого в настоящее время подхода к тромболитической терапии изобретение, с одной стороны, основано на индивидуальной оценке (диагнозе) у пациента ткани, подверженной риску(пенумбры), независимо от промежутка времени после появления инсульта. С другой стороны, изобретение основано на отборе (диагнозе) пациентов, страдающих инсультом вследствие закупорки кровеносного сосуда, питающего мозг. В одном из вариантов осуществления изобретения закупорку определяют посредством получения визуальных изображений. В соответствии с этим пациентов для лечения инсульта отбирают, учитывая их ткань, подверженную риску, и/или закупорку артериального сосуда. В целях настоящего изобретения термин "закупорка" определяется как любая структура или сужение кровеносного сосуда, которые приводят к снижению кровотока в ткани, расположенной дистальнее них, по сравнению со здоровым или нормальным кровеносным сосудом. Закупорка может быть либо частичной, либо полной. Поэтому термин "закупорка" также охватывает стеноз, т.е. аномальное сужение кровеносного сосуда, все еще допускающее дистальную перфузию. В соответствии с изобретением можно использовать любой инструментальный способ получения изображений, который приводит к визуализации внутреннего устья структур, заполненных кровью, т.е. позволяет идентифицировать артериальную закупорку. Возможные модальности получения изображений включают магнитно-резонансную ангиографию (МРА) или компьютерно-томографическую ангиографию (КТА), а также их дальнейшие развития и модификации, однако не ограничиваются ими. Визуализацию кровеносных сосудов также можно считать ангиографией. Специалисту, компетентному в данной области, известны различные способы дальнейшей оценки изображений МРТ и КТ (например, МТТ, ТТР или Tmax в виде карт постпроцессинга). В следующем варианте осуществления изобретения закупорка локализована в проксимальном отделе мозговой артерии, в особенности средней мозговой артерии (МСА), передней мозговой артерии(АСА) и/или задней мозговой артерии (РСА), включая все их ветви, особенно M1 и/или М 2. Еще один вариант осуществления изобретения направлен на подгруппу пациентов, отобранных для тромболизиса, с закупоркой на исходном уровне, которая характеризуется степенью TIMI менее 3. В следующих вариантах осуществления изобретения степень закупорки по шкале TIMI составляет 2, или 1,или еще менее. Степень закупорки также может быть равна 0, что означает полную закупорку. В целях настоящего изобретения степень TIMI 1 или менее (т.е. 0 или 1) называется "стенозом высокой степени". Предпочтительно, чтобы закупорка в сегментах M1 и/или М 2 проксимального отдела(средней) мозговой артерии характеризовалась степенью TIMI 0 или 1. Шкала TIMI (шкала тромболизиса при инфаркте миокарда) изначально была разработана для оценки закупорок артерий при инфаркте миокарда и охватывает следующие 4 степени: степень 3: нормальный кровоток; степень 2: артерия полностью проходима, но кровоток замедлен; степень 1: контрастный материал проникает в артерию, но дистальная перфузия отсутствует; степень 0: полная закупорка сосуда. Шкала TIMI была установлена в клинических исследованиях по инфаркту миокарда и с тех пор известна специалистам, компетентным в тромболизисе, например, из работы Chesebro J.H. et al.:Circulation, 1987; 76; 142-154. В следующем варианте осуществления изобретения отобранная группа пациентов страдает инсультом, который может быть описан балльной оценкой NIHSS, составляющей по меньшей мере 4, предпочтительно до 24 (и включая 24). Однако изобретение также может иметь отношение к пациентам с инсультом с балльной оценкой NIHSS, составляющей по меньшей мере 8. В соответствии с одним из предпочтительных вариантов осуществления изобретения отбирают группу пациентов для лечения инсульта, которая характеризуется степенью TIMI, составляющей от 1 до 0 (т.е. степенью TIMI менее 2), особенно в проксимальных сегментах M1 и/или М 2 средней мозговой артерии, и балльной оценкой NIHSS, составляющей по меньшей мере 4. В частном варианте осуществления изобретения балльная оценка NIHSS составляет по меньшей мере от 8 до 24 (включительно). Предпочтительно, чтобы пациенты проявляли кинические признаки полушарного инфаркта. Поэтому, не ориентируясь строго на фиксированное 3-часовое окно времени, принятое в современной терапии, согласно одному из вариантов осуществления изобретения, пациенты, не имеющие ткани,подверженной риску, не рассматриваются как подлежащие лечению, даже в том случае, если они поступили в больницу не позже 3 ч, что рекомендуется в настоящее время для лечения rt-PA; в то же время пациенты, имеющие ткань, подверженную риску, и/или с закупоркой артериального сосуда считаются открытыми для получения тромболитического лекарства даже в том случае, если они поступили в больницу позднее 3 ч после появления инсульта. В соответствии с настоящим изобретением для оценки ткани, подверженной риску, и/или закупорки сосуда можно использовать методики получения изображений, поскольку они дают более глубокое проникновение в патофизиологические параметры ишемического инсульта. Благодаря методикам получения изображений можно идентифицировать пациентов с ишемией, выходящей за пределы сердцевины инфаркта, т.е. тех пациентов, которые составят целевой контингент для тромболитической терапии в соответствии с данным вариантом осуществления изобретения. Таким образом, основанное на патофизиологическом подходе получение изображений для оценки ткани, подверженной риску, а также сердцевины инфаркта представляет собой способ определения того, будет ли пациент восприимчив к лечению в соответствии с настоящим изобретением. Пригодна любая методика получения изображений, способная дать оценку ткани, подверженной риску, и/или закупорки сосуда, например такие методики, как МРТ или КТ, однако не ограничиваясь ими. Получение изображений также можно использовать в целях безопасности, поскольку это позволит исключить пациентов с высоким риском кровоизлияний после лечения и пациентов, не имеющих видимой ткани, подверженной риску, которые вряд ли получат пользу от лечения. К числу факторов риска,которые на регулярной основе (хотя и не всегда) могут исключить лечение в соответствии с изобретением, относятся данные о внутричерепном кровоизлиянии (ICH), субарахноидальном кровоизлиянии(SAH), артериовенозной мальформации (AV), мозговой аневризме или мозговой опухоли. Кроме того, в соответствии с одним из вариантов осуществления изобретения пациентов с острым инфарктом, затрагивающим более приблизительно 1/3 территории средней мозговой артерии (МСА) или, по существу, всю территорию передней мозговой артерии (АСА) и/или задней мозговой артерии (РСА) также можно исключить из лечения в соответствии с изобретением. В дополнение к этому, пациенты с признаками проницаемости гематоэнцефалического барьера (ГЭБ) представляют фактор риска для тромболитической терапии и в соответствии с одним из вариантов осуществления изобретения подлежат исключению. Хотя концепция получения индивидуальных изображений не ограничена определенными временными рамками, предпочтительно проводить лечение пациентов в промежутке времени до 9 ч после появления инсульта, т.е. лечение возможно даже позднее 3 ч после появления инсульта. Как упоминалось выше, подгруппы пациентов, отобранные в соответствии с изобретением, страдают инсультом, который требует медицинского лечения. Эти подгруппы характеризуются одним или несколькими клиническими признаками, как это будет подробно описано ниже. Эффективность лечения инсульта в соответствии с изобретением можно показать, оценив различие в процентном изменении объема сердцевинного повреждения от его состояния перед началом лечения по данным изображений до 30-го дня после лечения между группами с активным лечением (настоящий лекарственный препарат) и плацебо или сравнив клинический ответ на 90-й день после лечения. В одном из вариантов осуществления изобретения лечение отобранных пациентов с инсультом может включать введение приблизительно от 50 до 125 мкг активатора плазминогена на 1 кг веса тела пациента, в особенности от приблизительно 90 до приблизительно 125 мкг на 1 кг веса тела пациента. В предпочтительном варианте осуществления изобретения пациенту вводят 90 или 125 мкг десмотеплазы(DSPA альфа 1) на 1 кг веса тела. В следующем варианте осуществления изобретения из лечения исключают пациентов, которые не страдают закупоркой сегментов M1 или M2 МСА и/или пропускают на исходном уровне несоответствующий объем менее чем приблизительно 120, 100 см 3, в особенности 75, или 50 см 3, или менее. Поэтому для лечения могут быть отобраны пациенты, проявляющие на исходном уровне абсолютный несоответствующий объем по меньшей мере приблизительно 50, 75, или 100, или 120 см 3. Подробное описание изобретения Как описано выше, в одном из аспектов изобретения индивидуальное получение изображений используют для диагностики или идентификации (отбора) кандидатов на тромболитическую терапию (реканализацию и/или реперфузию). Можно использовать любой подходящий инструментальный способ получения изображений. Например, можно использовать такой инструментальный способ получения изображений как МРТ, который можно проводить в диффузионно-взвешенной последовательности(DWI). Сильная гиперинтенсивность на DWI указывает на сердцевинное повреждение, подверженное инфаркту как при терапевтической реперфузии, так и без нее. Обычно она окружена участком с пониженной перфузией, измеряемым при помощи PWI (получения перфузионно-взвешенных изображений). Некоторые пациенты демонстрируют на DWI гиперинтенсивность, которая охватывает почти весь объем ткани с пониженной перфузией, идентифицированной при помощи PWI. Это "совпадение" размера повреждения на DWI и PWI указывает на минимальную ткань, подверженную риску. Пациенты, отобранные в соответствии с одним из вариантов осуществления изобретения, демонстрируют на PWI повреждение значительно большего размера, чем повреждение на DWI, т.е. представляют "несовпадение",которое указывает на потенциально поддающийся восстановлению участок ткани, подверженной риску(пенумбры). Предпочтительно, чтобы участок ткани, подверженной риску, превосходил по размерам участок сердцевины инфаркта по меньшей мере приблизительно на 20%. Ткань, подверженная риску,может быть локализована, например, в области средней мозговой артерии (МСА), в области передней мозговой артерии (АСА) или в области задней мозговой артерии (РСА). В одном из вариантов осуществления изобретения эти группы пациентов с "несовпадением", т.е. пациентов с пенумброй, размеры которой превышают размеры сердцевины инфаркта по меньшей мере на 20%, в соответствии с изобретением представляют целевую группу для тромболитической терапии. Кроме того, для идентификации места закупорки сосуда можно применить МРА (магнитнорезонансную ангиографию). В тех случаях, когда закупорка сосуда носит стойкий характер, ткань, которая ранее рассматривалась как подверженная риску, по-видимому, перейдет в состояние инфаркта. После ранней реканализации перфузия ткани, подверженной риску, нормализируется, что приведет к восстановлению ткани. МРТ, как инструментальный способ получения изображений, приведен только в качестве примера. Идентификация пенумбры ("ткани, подверженной риску") также возможна, например, при помощи КТ с применением способа перфузионной КТ (ПКТ) или позитронной эмиссионной томографии (ПЭТ). Еще одним примером может служить ультразвуковая визуализация. Шкала NIHSS представляет собой систематический оценочный инструмент, который обеспечивает количественное измерение связанного с инсультом неврологического дефицита. Шкала NIHSS сначала была разработана как исследовательский инструмент для измерения базисных (исходных) показателей у пациентов в клинических исследованиях по острому инсульту. Сейчас эта шкала также широко исполь-4 020776 зуется как инструмент для клинической оценки остроты состояния у пациентов с инсультом, определения подходящего лечения и предсказания исхода заболевания у пациента. В соответствии с NIHSS по предварительно определенной системе баллов оцениваются такие параметры, как уровень сознания,движения глаз, паралич лицевого нерва и двигательная способность рук или ног. На постоянной основе балльная оценка NIHSS 6 или менее расценивается как довольно легкий инсульт, тогда как балльная оценка NIHSS от 6 до приблизительно 15 квалифицируется как инсульт средней тяжести. Балльная оценка 15 или более по шкале NIHSS указывает на довольно тяжелый инсульт. Часто инсульт с балльной оценкой по шкале NIHSS 20 или более расценивают как неизлечимый. Однако следует отметить, что оценка тяжести инсульта зависит также от индивидуальной оценки пациента врачом, которая включает аспекты общего клинического впечатления о пациенте. В соответствии с одним из вариантов осуществления изобретения требуется, чтобы начальная балльная оценка пациента по шкале NIHSS составляла по меньшей мере 4 или по меньшей мере 8. Максимальная балльная оценка для отбора составляет 24. Следовательно, в одном из вариантов осуществления изобретения балльная оценка NIHSS на исходном уровне составляет от 4 до 24 (включительно) или от 8 до 24 (включительно). Как описано выше, можно также использовать инструментальные способы получения изображений для исключения определенных групп пациентов из тромболизиса, а именно для исключения определенных факторов риска. В соответствии с одним из вариантов осуществления изобретения отобранные группы пациентов не проявляют одного или нескольких из следующих признаков: острый инфаркт, затрагивающий более чем приблизительно 1/3 территории МСА или, по существу,всю территорию АСА и/или РСА; данные о ICH, SAH, артериовенозной мальформации (AV), мозговой аневризме или опухоли мозга. Этих пациентов предпочтительно лечить позже 3 ч, позже 4,5 ч или позже 6 ч после появления инсульта. Наиболее предпочтительно лечить их в промежутке времени от 3 до 9 ч после появления симптомов инсульта. Клинический исход можно измерить, например, как "степень клинического ответа" на 90-й день после лечения, которая определяется, например, как достижение одного или нескольких из трех следующих параметров:i) улучшение оценки NIHSS по меньшей мере на 8 баллов или конечная оценка NIHSS 0-1 на 90-й день, например улучшение балльной оценки NIHSS от 24 до 16 или до 0-1 (если пациент на исходном уровне имел балльную оценку NIHSS 9 или ниже);ii) балльная оценка по модифицированной шкале Ранкина (mRS) 0-2;iii) индекс Бартеля приблизительно от 75 до 100. Кроме того, эти группы пациентов могут демонстрировать снижение объема повреждения в сердцевине инфаркта на 30-й день по сравнению с состоянием до лечения (исходным уровнем). Активатор плазминогена, используемый для лечения инсульта в соответствии либо с одним, либо с обоими вариантами осуществления изобретения, можно вводить пациенту в виде единственной болюсной инъекции с дозой активатора плазминогена приблизительно от 50 до 125 мкг на 1 кг веса тела, в особенности порядка приблизительно 90 или приблизительно 125 мкг на 1 кг веса тела пациента. Поэтому изобретение также относится к производству лекарственного средства (т.е. определенной стандартной лекарственной формы) для лечения отобранных пациентов с инсультом, содержащего дозу, которая позволяет в готовом для употребления лекарственном составе вводить пациенту приблизительно от 50 до 125 мкг активного вещества на 1 кг веса тела или приблизительно 90 или приблизительно 125 мкг активного вещества на 1 кг веса тела. Стандартная лекарственная форма может представлять собой, например,твердое вещество, такое как лиофилизат, или жидкость во флаконе или ампуле. В конкретном варианте осуществления изобретения стандартная лекарственная форма содержит приблизительно от 5,0 до 12,5 мг, предпочтительно приблизительно 9,0 или приблизительно 12,5 мг активатора плазминогена, не обладающего нейротоксичностью, такого как десмотеплаза. Пациенты, отобранные в соответствии с изобретением, демонстрируют уменьшение объема повреждения в сердцевине инфаркта на 30-й день по сравнению с состоянием до лечения (исходным уровнем). Тромболитическое лечение в соответствии с изобретением можно проводить, используя любой активатор плазминогена (АП). В настоящем документе термин "активатор плазминогена" относится ко всем веществам (природным или синтетическим, имеющим происхождение от человека или не от человека), которые стимулируют лизис сгустка крови через активацию плазминогена в плазмин. Типичные АП, известные компетентному специалисту, представляют собой, например, тканевой активатор плазминогена (tPA), который доступен в рекомбинантной форме rt-PA (альтеплаза), стрептокиназу или урокиназу, а также их соответствующие производные, фрагменты или мутанты, которые сохраняют протеолитическую активность (например, тенектеплаза или ретеплаза для rt-PA). В одном из вариантов осуществления изобретения используют активатор плазминогена, не обладающий нейротоксичностью, т.е. активатор плазминогена, который сам по себе проявляет достаточно низкий потенциал активации глутаматного рецептора типа NMDA. Такой активатор плазминогена, по существу, не активируется бета-амилоидным или прионным белком и демонстрирует в присутствии фибрина повышенную активность, которая превосходит его же активность при отсутствии фибрина при-5 020776 близительно более чем в 550 раз, приблизительно более чем в 5500 раз или приблизительно более чем в 10000 раз. Еще в одном варианте осуществления изобретения увеличение активности АП в присутствии фибрина по сравнению с его активностью при отсутствии фибрина составляет приблизительно более 100000 раз. Поскольку увеличение активности rt-PA составляет приблизительно 550 раз, в одном из вариантов осуществления изобретения применяют АП, который обладает приблизительно 180-200-кратной специфичностью/избирательностью к фибрину по сравнению с rt-PA. Нейротоксичность можно оценивать способами, известными компетентному специалисту, например, на животных моделях, в особенности на моделях с каиновой кислотой, как это подробно описано в международном документе WO 03/037363, опубликованном для всеобщего ознакомления. Далее эта модель подробно описана в ссылках Liberatore et al. (Liberatore, G.T.; Samson, A.; Bladin, C.;Department of Medicine, Version November 20, 2003). Еще в одном варианте осуществления изобретения АП имеет период полувыведения из плазмы более 2,5, более 50 или более 100 мин. В одном из вариантов осуществления изобретения применяется DSPA альфа 1 или АП с биологической активностью и фармакологическими свойствами, по существу, соответствующими DSPA альфа 1.DSPA альфа 1 имеет период полувыведения приблизительно 138 мин и проявляет 105000-кратное увеличение активности в присутствии фибрина по сравнению с его активностью при отсутствии фибрина.DSPA альфа 1 представляет собой активатор плазминогена, который первоначально был выделен или извлечен из слюны Desmodus rotundus (слюнной активатор плазминогена Desmodus). В слюне были выделены четыре варианта, которые, подобно альтеплазе и урокиназе, состоят из разных консервативных доменов, ранее установленных в родственных семействах белков. Варианты rDSPA альфа 1 и rDSPA альфа 2 проявляют структурную формулу Finger (F), эпидермального фактора роста (EGF) (иногда также упоминаемого как "(Е)"), Kringle (K), протеазы (Р), в то время как бета rDSPA и гамма rDSPA характеризуются формулами EKP и KP соответственно. Едва уловимые различия в последовательности и данные гибридизационного анализа с саузерн-блоттингом указывают на то, что четыре фермента кодируются четырьмя разными генами, а не появляются в результате дифференциального сплайсинга единственного первичного транскрипта. Вариант DSPA альфа 1 имеет по меньшей мере 70% структурную гомологию с альтеплазой (rt-PA),разница заключается в том, что альтеплаза имеет два крингла (FEKKP), тогда как DSPA альфа 1 имеет только один (FEKP). DSPA альфа 1 представляет собой сериновую протеазу с 441 аминокислотой. Подобно другим активаторам плазминогена (АП), DSPA альфа 1 активирует плазминоген, катализируя превращение плазминогена в плазмин, который, в свою очередь, разрушает поперечно сшитый фибрин, изобильно содержащийся в сгустках крови. Было обнаружено, что DSPA альфа 1 имеет высокую специфичность по отношению фибрину, связанному с плазминогеном, высокую избирательность по фибрину (определяемую по активации фибрином относительно активации фибриногеном), по существу, не обладает нейротоксичностью, а также в пренебрежимо малой степени активируется бета-амилоидом и клеточным прионным белком человека в дополнение к преобладающему длительному периоду полувыведения, составляющему более 2 ч(см. выше). Рекомбинантную DSPA альфа 1 можно получить из клеток яичника китайского хомяка, содержащих рекомбинантную плазмиду, несущую ген DSPA альфа 1 от Desmodus rotundus. Фиг. 1 и 2 показывают структуры DSPA альфа 1 и альтеплазы. Последовательность зрелой DSPA альфа 1 показана на фиг. 3. Активаторы плазминогена от Desmodus rotundus и их рекомбинантные формы впервые были раскрыты в патентах США 6008019 и 5830849. Патент США 6008019 раскрывает данные о последовательности DSPA альфа 1. Оба патента включены в настоящее описание в качестве ссылки с точки зрения структуры, свойств и производства активаторов плазминогена от Desmodus rotundus, в особенностиDSPA альфа 1. Рекомбинантное производство и дальнейшая обработка также являются предметом документа ЕР 1015568 В 1, который также включен в настоящее описание в качестве ссылки по причине раскрытия в нем рекомбинантного производства DSPA альфа 1. В соответствии с настоящим изобретением термин "десмотеплаза" используется для любого активатора плазминогена с идентичной или, по существу, такой же биологической активностью, что и DSPA альфа 1 в отношении активации плазминогена и усиленной избирательностью/специфичностью к фибрину. В следующем варианте осуществления изобретения избирательность по отношению к фибрину имеет по меньшей мере 180-кратный уровень по сравнению с rt-PA. АП, определяемые как десмотеплаза в соответствии с изобретением, могут быть по меньшей мере на 80 или 90%, по меньшей мере на 95% или по меньшей мере на 98% идентичны аминокислотной последовательности, представленной на фиг. 3 (DSPA альфа 1). Активаторы плазминогена могут включать микрогетерогенности, например, в смысле гликози-6 020776 лирования и/или N-концевых вариаций, которые просто являются следствием различных производственных систем. Пример 1. Клинические преимущества десмотеплазы при лечении пациентов с инсультом от средней тяжести до тяжелого. Результаты клинического исследования DIAS-2. Предпосылка. Проект под названием Десмотеплаза при остром ишемическом инсульте-2 [Desmoteplase in Acute Ischemic Stroke-2] (DIAS-2) представлял собой рандомизированное, двойное слепое исследование с контролем плацебо, в котором изучали безопасность и эффективность десмотеплазы, DSPA,(90 и 125 мкг/кг) при остром инсульте через 3-9 ч после появления симптомов. Отрицательные результаты анализа в выборке цель-результат и атипично высокая степень ответной реакции на плацебо (46%) послужили основанием для более подробного анализа клинических данных и данных, полученных из инструментальных методик визуализации. Методы. Пациенты в возрасте 18-85 лет, с оценкой NIHSS, составляющей 4-24, с визуально очевидным характером несоответствия пенумбры, по мнению исследователя, на КТ (n=64) или МРТ (n=122) были рандомизированы на группы, получавшие плацебо (n=63), 90 мкг/кг (n=57) или 125 мкг/кг (n=66)DSPA. Визуальные изображения (головного мозга) были централизованно обработаны и оценены по слепому принципу. Клинический ответ как основной результат исследования оценивали по улучшению показателей всех трех шкал инсульта (NIHSS, mRS и индекса Бартеля) через 90 дней. Пациенты, отобранные по КТ, не были включены в анализы, основанные на несоответствии, поскольку у них оказались более вариабельными объемные измерения и клинические корреляции. Результаты. Пациенты в исследовании DIAS-2 имели менее тяжелый инсульт по сравнению с предыдущими исследованиями DSPA (DEDAS и DIAS): средняя оценка NIHSS = 9 по сравнению с 12; закупорки сегментов М 1/М 2 МСА не имели 46% пациентов (82/179) по сравнению с 37% пациентов (33/89). У пациентов, прошедших МРТ, средний объем сердцевинного повреждения на исходном уровне составлял 9,7 см 3, а средний объем несоответствия 78,4 см 3. По сравнению с DSPA абсолютный объем несоответствия на исходном уровне увеличился, а степень ответной реакции на плацебо снизилась. Наивысшие показатели ответной реакции на плацебо были обнаружены у пациентов с абсолютным объемом несоответствия 75 см 3 (67%, 12/18) или с отсутствием закупорки сегментов M1 или М 2 МСА (63%, 12/19). При исключении этих легких пациентов показатели клинического ответа составили 27% для плацебо (6/22) и 46% для DSPA (25/54) в выборке МРТ. Клинические результаты в исследованиях DIAS и DEDAS составили 23% для плацебо и 49% для 90 или 125 мкг/кг DSPA. При объединении всех пациентов, отобранных по МРТ в 3 исследованиях, показатели клинического ответа составили 34% для плацебо (n=73) и 48% для 90 или 125 мкг/кг DSPA (n=141). Выводы. Инсульты умеренной тяжести, включенные в исследование DIAS-2, могут объяснить неожиданно высокие показатели клинического ответа на плацебо. Доказанная закупорка сегментов М 1/М 2 МСА или объем несоответствия на МРТ 75 см 3 на исходном уровне ассоциировались с лучшими клиническими результатами для DSPA в исследовании DIAS-2, что подтверждало положительные результаты по эффективности, достигнутые в исследованиях DIAS и DEDAS. В настоящее время планируется добавочное клиническое исследование с DSPA, в котором будут применены усовершенствованные методики получения изображений и клинические критерии отбора. Пример 2. Клинические преимущества десмотеплазы при лечении пациентов с инсультом от средней тяжести до тяжелого. Дальнейшие результаты исследования DIAS-2, основанные на тщательном повторном анализе данных DIAS-2. Предпосылка: см. выше. Методы: см. выше. Результаты. Показатели ответа в сопоставлении со степенью TIMI. Данные исследований DIAS/DEDAS показали, что 38 пациентов (42,75%) имели на исходном уровне степень TIMI 2-3, а 51 пациент (57,3%) - степень TIMI 0-1. Это отличается от данных исследованияDIAS-2, где 70,4% пациентов имели на исходном уровне степень TIMI 2-3. Наивысший процентный показатель TIMI на исходном уровне (2-3) был обнаружен в группе 90 мкг/кг (74,1%), а самый низкий - в группе 125 мкг/кг (64,5%) (см. табл. 1). Хотя десмотеплаза не превосходила плацебо в суммарной выборке субъектов, участвовавших в исследовании DIAS-2, анализ подгруппы субъектов с проксимальной закупоркой артерии и степенью TIMI 0 или 1 либо стенозом высокой степени на исходном уровне отразил улучшенный ответ на десмотеплазу по сравнению с плацебо (плацебо: 17,6%, 90 мкг/кг: 35,7%, 125 мкг/кг: 27,3%). В объединенной выборкеDIAS/DEDAS/DIAS-2 десмотеплаза показала превосходство над плацебо с эффектом дозовой зависимости для пациентов с TIMI 0-1 и TIMI 2, но не для пациентов с TIMI 3. Эти данные показаны в табл. 2 а-2 с и на фиг. 4. Показатели ответа в сопоставлении с объемом несоответствия. Как уже упоминалось выше, абсолютный объем несоответствия в исследовании DIAS-2 проявлял обратную связь со степенью ответа на плацебо, так что пациенты с меньшим объемом несоответствия(т.е. 50 см 3 или менее) показывали более высокую степень ответа на плацебо. В соответствии с этим анализ подгрупп, включая пациентов, обследованных способом МРТ в исследованияхDIAS/DEDAS/DIAS-2, показал, что превосходство десмотеплазы над плацебо с эффектом дозовой зависимости можно наблюдать у пациентов с абсолютным объемом несоответствия от 50 до 100 см 3 и для пациентов с объемом несоответствия более 100 см 3, тогда как в подгруппе с абсолютным объемом несоответствия менее 50 см 3 превосходство десмотеплазы над плацебо оказалось статистически незначимым(фиг. 5). Корреляция между степенью TIMI и объемом несоответствия/NIHSS. В исследовании DIAS-2 подгруппа пациентов с TIMI 0-1 демонстрировала на исходном уровне балльную оценку NIHSS 13,0, тогда как пациенты с TIMI 2-3 демонстрировали на исходном уровне балльную оценку NIHSS 9,0 (табл. 3). Эта корреляция основана на том факте, что пациенты с более тяжелой закупоркой, по всей видимости, могут иметь более тяжелый инфаркт. В соответствии с этим степень TIMI также показывает корреляцию с абсолютным объемом несоответствия, поскольку пациенты сTIMI 0-1 проявляют объем несоответствия 167,7 см 3, а пациенты с TIMI 2-3 - объем несоответствия 53,5 см 3 (табл. 3). Степень TIMI и нарушения протокола, связанные с несоответствием. Анализ карт-указателей выявил, что 23 пациента в исследовании DIAS-2 демонстрировали отсутствие несовпадения/явной пенумбры. 11 из 23 пациентов без пенумбры оказались респондерами (дали положительную реакцию на лечение). Выводы. Эти данные показывают, что пациенты с очевидной закупоркой при TIMI (0-1) имеют меньше шансов на выздоровление без тромболитической терапии, тогда как пациенты с TIMI 2-3 на исходном уровне, вероятно, могут достичь неплохого выздоровления даже без терапевтического вмешательства. На основе повторного анализа степени TIMI на исходном уровне, которая коррелируется с балльной оценкой NIHSS и абсолютным объемом несоответствия, можно считать, что степень TIMI оказалась важным фактором, влияющим на результаты исследования DIAS-2. Краткое описание таблиц. Табл. 1. Исходные характеристики для исследования DIAS-2. Табл. 2 а. Показатель ответа на группу TIMI в исследовании DIAS-2 по сравнению с объединенной выборкой пациентов в исследованиях DIAS и DEDAS. Табл. 2b. Показатель ответа на группу TIMI в исследовании DIAS-2. Табл. 2 с. Показатель ответа на группу TIMI (только по данным M1) в исследовании DIAS-2 по сравнению с объединенной выборкой пациентов в исследованиях DIAS и DEDAS. Табл. 3. Степень TIMI в сопоставлении с балльной оценкой NIHSS и объемом несоответствия в исследовании DIAS-2. Табл. 4. Обзорный анализ исследований DIAS/DEDAS и DIAS-2 показывает, что исследованиеDIAS-2 включает пациентов с более легким инсультом при меньшем объеме несоответствия и отсутствии закупорки сосуда. Краткое описание чертежей. Фиг. 1. Структура белка DSPA альфа 1. Фиг. 2. Структура белка альтеплазы. Фиг. 3. Аминокислотная последовательность зрелого белка DSPA альфа 1. Фиг. 4. Показатель ответа в зависимости от степени TIMI в объединенной выборке пациентов исследований DIAS, DEDAS и DIAS-2. Фиг. 5. Показатель ответа в зависимости от несоответствия по данным МРТ в объединенной выборке пациентов исследований DIAS, DEDAS и DIAS-2. Фиг. 6. DIAS/DEDAS: Основные результаты. Фиг. 7. DIAS-2: Основные результаты. Фиг. 8. Клинический ответ по объему несоответствия (120 см 3 в сопоставлении с 120 см 3). При высоком объеме несоответствия обе дозы десмотеплазы демонстрируют значительное превосходство над плацебо. Фиг. 9. Распределение TIMI у пациентов с объемом несоответствия 120 см 3. При высоком объеме несоответствия большинство пациентов с отсутствием закупорки сосуда/стенозом низкой степени исключаются. Фиг. 10. Несоответствие в сопоставлении с закупоркой сосуда: DIAS-2. Отбор пациентов сTIMI 0-1 = подавляющее большинство с несоответствием. Фиг. 11. Клинический ответ у пациентов с закупоркой сосуда/стенозом высокой степени (TIMI 0-1). В выборке TIMI 0-1 клинический ответ на десмотеплазу (90 мкг/кг) и плацебо был согласующимся эффектом во всех исследованиях. Общий размер эффекта для дозы 90 мкг/кг: 22%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения инсульта, включающий введение десмотеплазы у пациентов с закупоркой мозговой артерии, у которых балльная оценка по шкале NIHSS составляет по меньшей мере 4, а балльная оценка по шкале TIMI составляет 0 или 1. 2. Способ по п.1, где закупорка мозговой артерии или стеноз высокой степени локализованы в средней мозговой артерии (МСА), передней мозговой артерии (АСА) или задней мозговой артерии(РСА) или в их ветвях. 3. Способ по п.2, где закупорка мозговой артерии или стеноз высокой степени локализованы в ветви M1 или М 2 МСА, АСА или РСА. 4. Способ по любому из предыдущих пунктов, где пациент имеет инсульт с балльной оценкойNIHSS, составляющей по меньшей мере 8. 5. Способ по любому из предыдущих пунктов, где пациент имеет инсульт с балльной оценкойNIHSS, составляющей от 8 до 24. 6. Способ по любому из предыдущих пунктов, где десмотеплазу вводят пациенту в дозе от приблизительно 90 до приблизительно 125 мкг/кг веса тела. 7. Способ по любому из предыдущих пунктов, который проводят позднее чем 3 ч после появления инсульта. 8. Способ по п.7, который проводят в промежутке времени от 3 до 9 ч после появления симптомов инсульта. 9. Способ отбора пациента для лечения инсульта способом по п.1, в котором указанного пациента отбирают по проявлению на исходном уровне следующих признаков:b) балльная оценка NIHSS составляет по меньшей мере 4 и с) балльная оценка TIMI составляет 0 или 1.
МПК / Метки
МПК: A61K 38/49, A61P 9/10
Метки: способ, инсульта, лечения
Код ссылки
<a href="https://eas.patents.su/15-20776-sposob-lecheniya-insulta.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения инсульта</a>
Предыдущий патент: Устройство и способ получения полимерных гранул
Следующий патент: 4-пиразолил-n-арилпиримидин-2-амины, 4-пиразолил-n-пиразолилпиримидин-2-амины и 4-пиразолил-n-пиридилпиримидин-2-амины в качестве ингибиторов киназ janus
Случайный патент: Способ получения 3,4,5-тризамещённых 1-арилпиразолов