Способ производства циклических ундекапептидов
Формула / Реферат
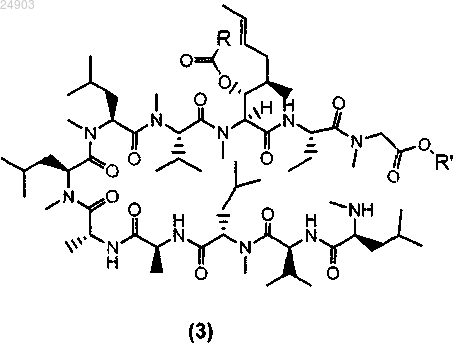
1. Способ получения химического соединения структурной формулы 3 или его соли
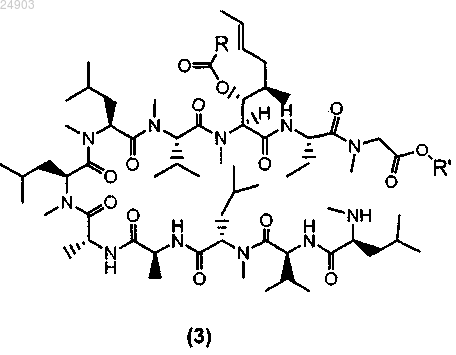
где R представляет собой метил, этил, пропил или фенил и R' представляет собой метил или этил, включающий стадии ацилирования циклоспорина A с образованием ацетил-циклоспорина A; раскрытия кольца ацетил-циклоспорина A и кристаллизации ацетил-циклоспорина A с раскрытым кольцом для получения химического соединения структурной формулы 3.
2. Способ по п.1 получения химического соединения структурной формулы 4 или его соли
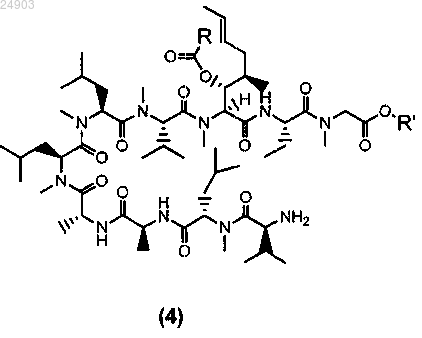
где R представляет собой метил, этил, пропил или фенил и R' представляет собой метил или этил, включающий стадии расщепления химического соединения структурной формулы 3 по методу Эдмана и последующую кристаллизацию этого химического соединения для получения химического соединения структурной формулы 4.
3. Способ получения химического соединения структурной формулы 4 или его соли
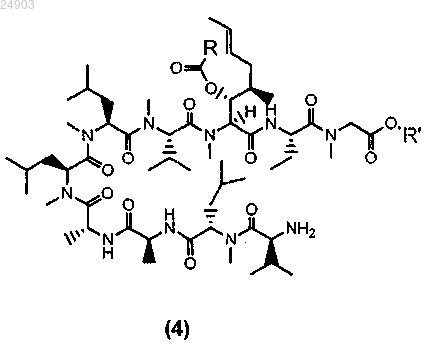
где R представляет собой метил, этил, пропил или фенил и R' представляет собой метил или этил, включающий стадии:
i) ацилирования циклоспорина A с образованием ацетил-циклоспорина A;
ii) раскрытия кольца ацетил-циклоспорина A и
iii) кристаллизации ацетил-циклоспорина A с раскрытым кольцом для получения химического соединения структурной формулы 3
или его соли;
iv) расщепления химического соединения структурной формулы 3 по методу Эдмана и последующую
v) кристаллизацию этого химического соединения для получения химического соединения структурной формулы 4 или его соли.
4. Химическое соединение структурной формулы 3 или его соль
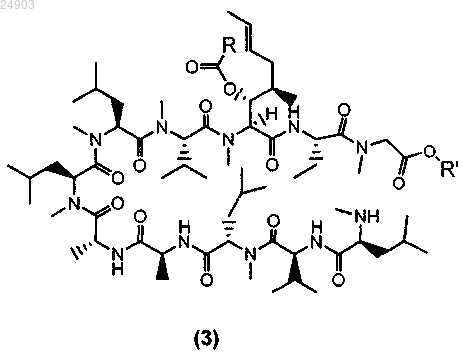
где R представляет собой метил, этил, пропил или фенил и R' представляет собой метил или этил.
5. Химическое соединение структурной формулы 4 или его соль
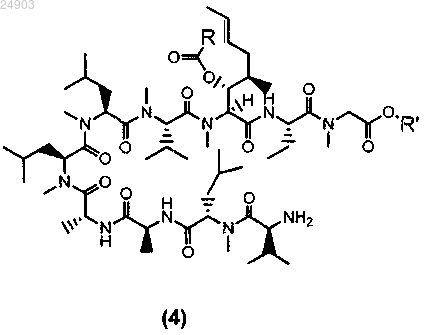
где R представляет собой метил, этил, пропил или фенил и R' представляет собой метил или этил.
6. Способ по п.1 или 3, в котором чистота исходного материала циклоспорина A составляет >80 мас.%.
7. Способ по п.6, в котором чистота исходного материала циклоспорина А составляет >85 мас.%.
8. Способ по п.1 или 3, в котором чистота исходного материала циклоспорина A составляет от 60 до 80 мас.% по результатам анализа.
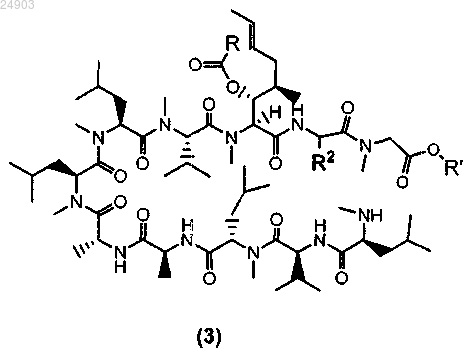
9. Способ получения химического соединения структурной формулы 3 или его соли из циклоспорина A, циклоспорина B, или из циклоспорина D, или из циклоспорина G
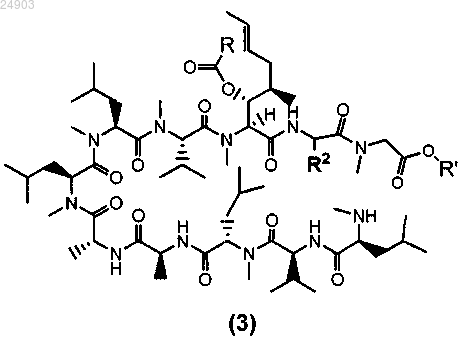
где R представляет собой метил, этил, пропил или фенил, R' представляет собой метил или этил и R2 представляет собой метил, этил или пропил, включающий стадии ацилирования циклоспорина A, B, D или G с образованием ацетил-циклоспорина A, B, D или G; раскрытия кольца ацетил-циклоспорина A, B, D или G и кристаллизации ацетил-циклоспорина A, B, D или G с раскрытым кольцом для получения химического соединения структурной формулы 3.
10. Способ по п.9 получения химического соединения структурной формулы 4 или его соли
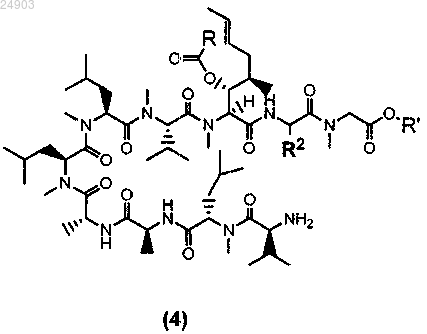
где R представляет собой метил, этил, пропил или фенил, R' представляет собой метил или этил и R2 представляет собой метил, этил или пропил, включающий стадии расцепления химического соединения структурной формулы 3 по методу Эдмана и последующей кристаллизации этого химического соединения для получения химического соединения структурной формулы 4.
11. Способ получения химического соединения структурной формулы 4 или его соли
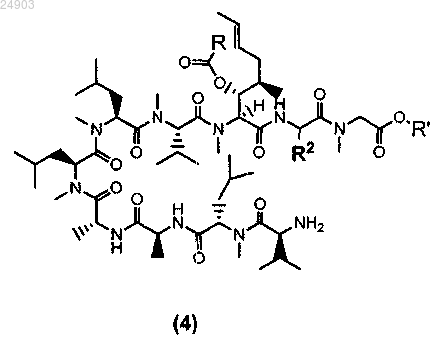
где R представляет собой метил, этил, пропил или фенил, R' представляет собой метил или этил и R2 представляет собой метил, этил или пропил, включающий стадии:
vi) ацилирования циклоспорина A, B, D или G с образованием ацетил-циклоспорина A, B, D или G;
vii) раскрытия кольца ацетил-циклоспорина A, B, D или G и
viii) кристаллизации ацетил-циклоспорина A, B, D или G с раскрытым кольцом для получения химического соединения структурной формулы 3 или его соли
ix) расщепления химического соединения структурной формулы 3 по методу Эдмана и последующей
x) кристаллизации этого химического соединения для получения химического соединения структурной формулы 4 или его соли.
12. Способ по п.9 или 11, в котором чистота исходного материала циклоспорина А составляет >90 мас.%.
13. Способ по п.12, в котором чистота исходного материала циклоспорина A составляет >92 мас.%.
14. Способ по п.9 или 11, в котором чистота исходного материала циклоспорина A составляет от 60 до 80 мас.% по результатам анализа.
15. Химическое соединение структурной формулы 3 или его соль
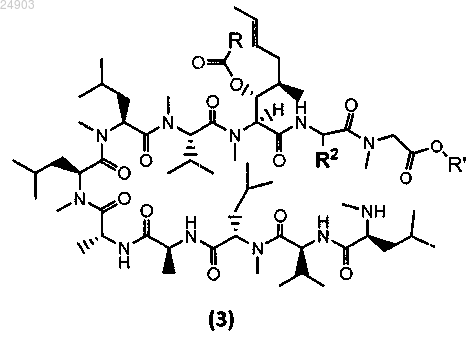
где R представляет собой метил, этил, пропил или фенил, R' представляет собой метил или этил и R2 представляет собой метил, этил или пропил.
16. Химическое соединение структурной формулы 4 или его соль
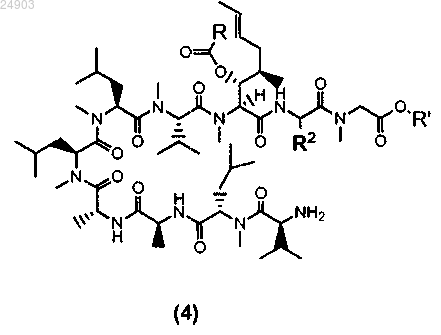
где R представляет собой метил, этил, пропил или фенил, R' представляет собой метил или этил и R2 представляет собой метил, этил или пропил.
Текст
СПОСОБ ПРОИЗВОДСТВА ЦИКЛИЧЕСКИХ УНДЕКАПЕПТИДОВ Настоящее изобретение относится к способам и промежуточным соединениям, применимым для производства циклических ундекапептидов, таких как неиммуносупрессорное производное циклоспорина - алиспоривир. Циклоспорин ацилируют по боковой цепи бутенил-метил-треонина и затем подвергают реакции раскрытия кольца (раскрытие кольца происходит между остатками саркозина и N-метиллейцина). Это линейное пептидное промежуточное соединение подвергают расщеплению по методу Эдмана (удаление N-концевого остатка) для получения второго линейного декапептидного промежуточного соединения, например последовательности Val-N(Me)Leu-AlaAla-N(Me)Leu-N(Me)Leu-N(Me)Val-N(Me)Bmt-Abu-Sar, если использовался CsA. Область техники, к которой относится изобретение Настоящее изобретение относится к новым способам, новым стадиям способа и новым промежуточным соединениям, применимым для раскрытия кольца в производных циклоспорина и последующего получения циклических полипептидов, а именно циклических ундекапептидов, таких как алиспоривир(также известный как DEB025, Debio025 или Debio). Уровень техники изобретения Настоящее изобретение относится к способам получения циклических полипептидов, таких как,например, циклические ундекапептиды, такие как алиспоривир. Алиспоривир представляет собой ингибитор циклофилина (Cyp), применяемый для лечения инфекции, вызванной вирусом гепатита С (ВГС), или вызванных ВГС нарушений, как описано в международной патентной заявке WO 2006/038088. Кроме того, в международной патентной заявке WO 2009/042892 описаны способы применения алиспоривира в лечении рассеянного склероза; в международной патентной заявке WO 2009/098577 описаны способы применения алиспоривира в лечении мышечной дистрофии; в международной патентной заявке WO 2008/084368 описаны способы применения алиспоривира в лечении врожденной мышечной дистрофии Улльриха. Алиспоривир и его синтез описаны в международной патентной заявке WO 00/01715. Алиспоривиру был присвоен регистрационный номер CAS 254435-95-5. Способы получения алиспоривира в лабораторном масштабе описаны J.F. Guichoux в "De nouveauxLausanne, 2002, в международной патентной заявке WO 2006/038088 и в международной патентной заявке WO 2008/084368. Циклические ундекапептиды, как показано ниже, представляют собой циклические полипептиды структурной формулы (Ia), где n=2. Алиспоривир (структурная формула I) представляет собой циклический ундекапептид структурной формулы (Ib), где n=2, aa1 представляет собой D-MeAla и aa2 представляет собой EtVal. Общая структурная формула цикло-(AXX1-AXX2-AXX3-AXX4-AXX5-AXX6-AXX7-AXX8-AXX9-AXX10-AXX11) должна охватывать примеры из международной патентной заявки WO 2010/052559 A1 как фрагментации, выполненной в ключевом фрагменте Sar.AXX4 = MeLeu, Val,AXX5 = Val, Nva,AXX6 = MeLeu, Leu,AXX7 = Ala, Abu,AXX8 = D-Ala,AXX9 = MeLeu, Leu,AXX10 = MeLeu, Leu,AXX11 = MeVal, Val, D-M,eVal и все другие комбинации, охватываемые WO 2010/052559 A1. В течение последних нескольких лет циклоспорин А (CyA) использовался в качестве сырья для различных синтетических циклических ундекапептидов, которые являются пригодными для лечения воспалительных или вирусных заболеваний. Циклические ундекапептиды могут быть получены путем отбора штаммов, однако для получения большинства не встречающихся в природе производных необходимо химическое преобразование, которое основано на раскрытии кольца циклических полипептидов, например структурной формулы (Ia) или структурной формулы (Ib) и последующей аминокислотной замене. Обычно циклический полипептид, например, структурной формулы (Ia), раскрывают высокоселективным способом, и аминокислотный остаток удаляют путем расщепления по методу Эдмана для того,чтобы получить раскрытый циклический полипептид в качестве ключевого промежуточного соединенияWenger, R.M. et al., Tetrahedron Letters 2000, 41, 7193). Многие ученые и компании применяют эту надежную и избирательную стратегию, в которой чистый циклоспорин А и очистка при помощи колоночной хроматографии используются для получения циклических ундекапептидов. Кроме того, очистка продуктов, таких как раскрытый циклоспорин А, включает в себя несколько стадий очистки при помощи жидкостной хроматографии на силикагеле. Кроме получаемого умеренного общего выхода, основным недостатком этой схемы очистки является очень высокая стоимость стадий хроматографии. Крупномасштабные способы очистки таких продуктов, полученных из циклоспорина А или его структурных аналогов, описанные в литературе, как правило, включают в себя хроматографическую очистку или предварительную очистку при помощи адсорбционной хроматографии. За такой предварительной очисткой может следовать, например, экстракция, противоточная экстракция и/или сверхкритическая флюидная экстракция. Однако, по-видимому, ни один из этих методов не является полностью удовлетворительным с точки зрения получения ключевых раскрытых промежуточных соединений с желаемыми требованиями к качеству, с приемлемым общим выходом и с приемлемой для производства в промышленных масштабах стоимостью, так как необходимы дорогостоящие предшественники высокого качества. Авторы настоящего изобретения установили, что диметоксикарбениевые ионы (описанные в европейской патентной заявке EP 0908461 A1 (заявитель Novartis обладают тем же химизмом, что и оксониевые ионы (триметил или триэтилоксониевые соли Меервейна) при раскрытии кольца макроциклического полипептида. Новые условия предпочтительно могут быть получены in situ, что позволяет избежать контакта с опасными и гигроскопичными веществами, и могут осуществляться в различных растворителях, таких как, например, толуол, ксилол, анизол, без необходимости использования нежелательных хлорсодержащих растворителей, таких как дихлорметан или дихлорэтан, и без использования оксониевых солей Меервейна, которые являются производными генотоксичного эпихлоргидрина. Или определенная специальная карбениевая тетрафторборатная соль или образующаяся in situ реакционноспособная молекула, получаемая путем реакции трехфтористого бора и ортоэфирного производного, предпочтительно триметилортоформиата, будет обеспечивать получение желаемых раскрытых полипептидов, таких как приведенное ниже химическое соединение 3. Авторы настоящего изобретения разработали улучшенный способ, который сохраняет преимущество высокоизбирательной стратегии расщепления по методу Эдмана, но при этом включает в себя все преимущества вновь идентифицированных кристаллических промежуточных соединений. Следующее изобретение относится к новым выделенным и кристаллизованным промежуточным соединениям, полученным в результате раскрытия кольца циклоспорина A и способу их получения и очистки при помощи таких методов, как кристаллизация. Этот подход позволяет быстро, практично и намного более эффективно получать раскрытый циклоспорин A, циклоспорин B, циклоспорин D или циклоспорин G и может применяться для получения циклических ундекапептидов, таких как алиспоривир. Кроме того, способ настоящего изобретения может также применяться в отношении других циклоспоринов, которые могут быть раскрыты через ту же самую последовательность стадий. Было обнаружено, что на некоторых стадиях могут образовываться соли раскрытых циклоспоринов, такие как соли соляной кислоты (HCl), фтороборной кислоты (HBF4) или гексафторфосфорной кислоты (HPF6). Настоящее изобретение относится к новым кристаллическим промежуточным соединениям, таким как сложные эфиры циклоспоринов, такие как ацетат, пивалат, и солям раскрытых циклоспорина А, циклоспорина B, циклоспорина D или циклоспорина G, таким как соль HCl, соль HBF4 или соль HPF6, и способам их получения. Сущность изобретения Предложен способ получения химического соединения структурной формулы 3 или его соли где R представляет собой метил, этил, пропил или фенил и R' представляет собой метил или этил. Данный способ включает в себя стадии ацилирования циклоспорина A с образованием ацетил-циклоспоринаA; раскрытия кольца ацетил-циклоспорина A и кристаллизации ацетил-циклоспорина A с раскрытым кольцом для получения химического соединения структурной формулы 3. Предложен способ получения химического соединения структурной формулы 4 или его соли где R представляет собой метил, этил, пропил или фенил и R' представляет собой метил или этил. Данный способ включает в себя стадии расщепления химического соединения структурной формулы 3 по методу Эдмана и затем кристаллизации этого химического соединения для получения химического соединения структурной формулы 4. Предложен способ получения химического соединения структурной формулы 4 или его соли где R представляет собой метил, этил, пропил или фенил и R' представляет собой метил или этил. Данный способ включает в себя стадии ацилирования циклоспорина A с образованием ацетил-циклоспоринаA; раскрытия кольца ацетил-циклоспорина A и кристаллизации ацетил-циклоспорина A с раскрытым кольцом для получения химического соединения структурной формулы 3 расщепления химического соединения структурной формулы 3 по методу Эдмана и затем кристаллизации этого химического соединения для получения химического соединения структурной формулы 4 или его соли. Предложено химическое соединение структурной формулы 3 или его соль где R представляет собой метил, этил, пропил или фенил и R' представляет собой метил или этил. Предложено химическое соединение структурной формулы 4 или его соль где R представляет собой метил, этил, пропил или фенил и R' представляет собой метил или этил. Краткое описание чертежей На фиг. 1 представлены спектры протонного ЯМР химического соединения 3. На фиг. 2 представлены спектры протонного ЯМР химического соединения 4. Подробное описание изобретения В общем виде способ настоящего изобретения для получения циклических полипептидов, а именно циклических ундекапептидов, таких как алиспоривир, показан на схеме ниже, однако эта общая схема может также быть использована для получения циклических полипептидов, а именно циклических ундекапептидов, являющихся производными циклоспорина A, B, D или G. В частности, алиспоривир может быть получен путем преобразования циклоспорина A (химическое соединение (1), в котором R2 представляет собой этил) в химическое соединение формулы 4, как показано выше, путем ацилирования циклоспорина A с образованием ацетил-циклоспорина A (2); раскрытия кольца; кристаллизации для получения химического соединения 3, расщепления химического соединения 3 по методу Эдмана; кристаллизации для получения химического соединения 4 и затем циклизации химического соединения 4 для получения алиспоривира (как показано ниже). Настоящее изобретение, в частности, относится к способам, описанным в каждом разделе. Настоящее изобретение также относится, независимо, к каждой отдельной стадии, описанной в последовательности осуществления способа в соответствующем разделе. Таким образом, любая и каждая отдельная стадия любого способа, состоящего из последовательности стадий, описанная здесь, сама по себе является предпочтительным вариантом осуществления настоящего изобретения. Таким образом, настоящее изобретение также относится к тем вариантам осуществления способа, в которых химическое соединение, получаемое в качестве промежуточного соединения на любой стадии этого способа, используется в качестве исходного материала. Настоящее изобретение также относится к промежуточным соединениям, которые были специально созданы для получения химических соединений настоящего изобретения, к их применению и к способам их получения. Следует отметить, что в настоящем описании пояснения, данные в одном разделе, также могут быть применимы для других разделов, если не указано иное. Циклоспорин A, циклоспорин B, циклоспорин D или циклоспорин G или их соли могут быть получены, например, путем ферментации. В одном варианте осуществления настоящее изобретение относится к способу получения химического соединения структурной формулы 3, включающему в себя стадии ацилирования циклоспорина A,циклоспорина B, циклоспорина D или циклоспорина G с образованием ацетил-циклоспорина A, B, D илиG; раскрытия кольца и кристаллизации. В одном варианте осуществления настоящее изобретение относится к способу получения химического соединения структурной формулы 4 или его соли, включающему в себя расщепление химического соединения структурной формулы 3 по методу Эдмана (реакции, хорошо известной в данной области техники) и его кристаллизацию для получения химического соединения структурной формулы 4. В другом варианте осуществления настоящее изобретение относится к способу получения химического соединения структурной формулы 3 или структурной формулы 4, в котором чистота исходного материала циклоспорина A составляет 80 по мас.%. В другом варианте осуществления настоящее изобретение относится к способу получения химического соединения структурной формулы 3 или структурной формулы 4, в котором чистота исходного материала циклоспорина A составляет 85 по мас.%. В еще одном варианте осуществления настоящее изобретение относится к способу получения химического соединения структурной формулы 3 или структурной формулы 4, в котором чистота исходного материала циклоспорина A составляет от 60 до 80 мас.% по результатам анализа. В вышеуказанных способах используются новые химические соединения настоящего изобретения. Следовательно, дополнительными объектами настоящего изобретения являются химические соединения,представленные ниже. Химические соединения структурной формулы 3 или их соли где R представляет собой метил, этил, пропил или фенил, R' представляет собой метил, этил или пропил. Химические соединения структурной формулы 4 или их соли где R представляет собой метил, этил, пропил или фенил, R' представляет собой метил, этил или пропил. Химические соединения структурной формулы 3 или их соли где R представляет собой метил, этил, пропил или фенил, R' представляет собой метил или этил. Химические соединения структурной формулы 4 или их соли где R представляет собой метил, этил, пропил или фенил, R' представляет собой метил или этил. Следующие примеры представляют собой предпочтительные варианты осуществления стадий реакции, промежуточных соединений и/или способа настоящего изобретения и служат для иллюстрации настоящего изобретения без ограничения его объема. Получение HBF4 соли химического соединения 3 с солью Меервейна. Проводили реакцию ацетил-циклоспорина A (100 г как есть) с тетрафторборатом триметилоксония(32 г) при температуре 20-25C в дихлорметане (180 мл). Через 20 ч добавляли ацетонитрил (200 мл) и воду (650 мл) для того, чтобы осуществить гидролиз. После 3 ч при температуре 20-25C фазы разделяли и реакционную смесь сушили путем азеотропной дистилляции с 2-метилтетрагидрофураном (замена растворителя дихлорметан на 2-метилтетрагидрофуран). Затем желаемый продукт кристаллизовали из 2 метилтетрагидрофурана (900 мл) и 2-метокси-2-метилпропана (400 мл) для получения HBF4 соли химического соединения 3 в виде белого кристаллического порошка (63,9 г после высушивания, чистота 92%). 0,69, (3H, д, J=6,6 Гц); 0,71, (3H, д, J=6,5 Гц); 0,81, (6H, м); [0,82, 0,89], (24H, м); 0,90, (3H, д, J=6,6 Гц); 0,93, (3H, д, J=6,6 Гц); 1,16, (6H, м); [1,23, 1,50], (4H, м); 1,52, (1H, м); [1,32, 1,73], (8H, м); 1,59, (3H,-7 024903 д, J=6,0 Гц); 1,65, (2H, м); 1,65, 2,13, (2H, м); 1,93, 1,94, (3H, с); 2,03, (1H, м); 2,19, (1H, м); 2,45, (3H, с); 2,72, (3H, с); 2,84, (3H, с); 2,86, (3H, с); 2,99, (3H, с); 3,02, (3H, с); 3,06, (3H, с); 3,62, 3,68, (3H, с); 3,78,(1 Н, м); 3,87, 4,53, (1 Н, д, J=17,2 Гц, 18,6 Гц); 4,10, 4,26, (1 Н, д (J=18,6 Гц, 16,8 Гц); 4,23, (1 Н, м); 4,60,(1 Н, м); 4,62, (1 Н, м); 4,66, (1H, м); 5,02, (1H, м); 5,13, (1 Н, дд, J=11,3 Гц, 4,7 Гц); 5,26, (1H, м); 5,29, (1H,м); 5,32, (1H, м); 5,36, (1H, м); 5,39, (2H, м); 7,72, (1 Н, д, J=7,3 Гц); 8,14, (1 Н, д, J=7,3 Гц); 8,21, 8,35, (1 Н,д, J=7,3 Гц, 8,1 Гц); 8,85, (2 Н, с, ушир); 8,96, (1 Н, д, J=8,4 Гц). Получение HBF4 соли химического соединения 3 с использованием триметилортоформиата и эфирата трехфтористого бора. Раствор ацетил-циклоспорина A (10 г) в дихлорметане (20 мл) добавляли при температуре -15C в суспензию диметоксикарбения тетрафторбората, полученную при температуре -20C путем медленного добавления трехфтористого бора (2 мл) в раствор триметилортоформиата (2 мл) в дихлорметане (20 мл). После добавления суспензии давали нагреться до комнатной температуры и перемешивали в течение 20 ч. После этого добавляли ацетонитрил (10 мл) и воду (10 мл). После 2 ч перемешивания при температуре 0C проводили разделение фаз. Затем после промывания органической фазы водой, замены растворителя на 2-метилтетрагидрофуран и насыщения 2-метокси-2-метилпропаном получали химическое соединение 3 в виде твердого белого вещества, которое сушили под вакуумом (5,1 г, чистота 90%) (см. фиг. 1). Получение HBF4 соли химического соединения 4. Ранее полученную соль химического соединения 3 (34,62 г) загружали в реактор вместе с карбонатом натрия (4,8 г), толуолом (50 мл) и водой (50 мл). Полученную смесь перемешивали при температуре 20-25C в течение 30 мин и проводили разделение фаз. Фенилизотиоцианат (3,81 г) добавляли по каплям в течение 1 ч при температуре 20-25C и полученную реакционную смесь перемешивали до завершения реакции. Затем добавляли метанол (20 мл) и 48%-ный раствор фтороборной кислоты в воде (2,5 г) и эту смесь перемешивали в течение еще 1 ч. Затем добавляли воду (25 мл) и проводили разделение фаз. Водные фазы экстрагировали еще раз толуолом (50 мл) и затем экстрагировали 2-метилтетрагидрофураном(100 мл). Органический экстракт азеотропно сушили и желаемый продукт кристаллизовали из 2 метилтетрагидрофурана (100 мл) и 2-метокси-2-метилпропана (50 мл) для получения HBF4 соли химического соединения 4 в виде белого кристаллического порошка (приблизительно 30 г после высушивания,чистота 93%) (см. фиг. 2). 0,69, (3H, д, J=6,2 Гц); 0,73, (3H, д, J=7,0 Гц); 0,81, (3H, т, J=7,3 Гц, 7,3 Гц); 0,82, (3H, м); 0,85, (9 Н, м); 0,88, (6 Н, м); 0,91, (3H, д, J=7,0 Гц); 0,93, (3H, д, J=6, 6 Гц); 0,99, (3H, д, J=7,0 Гц); 1,17, (6 Н, д, J=6,6 Гц); [1,301,55], (9 Н, м); 1,60, (3H, д, J=5,5 Гц); [1,561,72], (4 Н, м); 1,93, 1,95(3H, с); 2,09, (1H, м); 2,14, (1 Н, м), 2,20, (1 Н, м); 2,74, (3H, с); 2,82, 3,06, (3H, с); 2,84, (3H, с); 2,87, (3H, с); 2,94, (3H, с); 3,02, (3H, с); 3,63, 3,68, (3H, с); 3,88, 4,52, (1 Н, д, J=17,2 Гц, 18,6 Гц); 4,10, 4,24, (1 Н, д,J=18,7 Гц, м); 4,24, (2 Н, м); 4,39, 4,62, (1 Н, м); 4,66, (1 Н, м); 5,02, (1 Н, м); 5,08, (1H, м); 5,26, (2 Н, м); 5,32,(1 Н, м); 5,37, (1 Н, м); 5,39, (2 Н, м); 7,84, 8,51 (1 Н, д, J=7,3 Гц, 8,1 Гц); 7,98, (3H, с, ушир); 8,07, 8,18 (1 Н,д, J=7,7 Гц, 7,3 Гц); 8,13, 8,27, (1 Н, д, J=7,3 Гц, 8,1 Гц). Получение алиспоривира. Вышеописанное промежуточное соединение 4 (приблизительно 109 г) порциями добавляли при температуре 15C в смесь толуола и карбоната натрия/воды и перемешивали в течение 3 ч при температуре 15C. Водную фазу отделяли. Дипептид (приблизительно 28 г) и N-гидроксибензотриазол моногидрат (8,1 г) добавляли при температуре 0C. В смесь добавляли воду (2,5 мл) и прибавляли Nметилморфолин (17,9 г) при температуре 10C с последующим прибавлением раствора дициклогексилкарбодиимида (21,9 г) в толуоле при температуре -10C и перемешивали при этой температуре в течение 3 ч. Реакционную смесь нагревали до 0C в течение периода времени, равного 10 ч. После завершения реакционную смесь фильтровали и фильтрат экстрагировали 5%-ным раствором карбоната натрия, 5%ным солевым раствором, 2 М соляной кислотой и 10%-ным солевым раствором. Органическую фазу снова фильтровали и концентрировали при температуре 50C в вакууме. Борогидрид натрия (0,59 г) растворяли в диглиме (14,3 г) при температуре от 20 до 40C. Мутный раствор охлаждали до 12-16C. При этой температуре добавляли глицин (0,59 г). Ранее полученный продукт (6,2 г) в растворе в приблизительно 6 г толуола прибавляли к белой суспензии при температуре 1216C. Затем ускоряли восстановление путем добавления метанола в толуоле при температуре 12-16C. Это добавление было контролируемым и осуществлялось 3 порциями. Реакционную смесь перемешивали в течение еще 3 ч и добавляли останавливающий раствор (водная уксусная кислота) при внутренней температуре 10-20C. Скорость добавления изменяли сообразно с выделением водорода (не накоплением). Фазы разделяли, верхнюю органическую фазу продукта экстрагировали водой и затем концентрировали. Ранее полученный продукт (5 г) растворяли в толуоле (приблизительно 5 г) и прибавляли в течение периода времени 40-60 мин к раствору серной кислоты (0,8 г) в метаноле (50 мл) при температуре 50C. Спустя приблизительно 2 ч раствор охлаждали до температуры 15-20C и прибавляли к нему 25%-ный раствор гидроксида бензилтриметиламмония (приблизительно 12 г) в метаноле (экзотермическая реакция). После 2 ч прибавляли воду и смесь перемешивали в течение приблизительно 20 ч при температуре 22C. После завершения раствор охлаждали до температуры 10-15C, разбавляли водой и нейтрализовали разбавленной серной кислотой. После отделения верхней толуоловой фазы из нижней фазы продукта удаляли метанол путем дистилляции. Отделенный маслянистый продукт экстрагировали этилацетатом и последовательно промывали водой и солевым раствором, доводя значение рН до 7,0-7,5 разбавленной серной кислотой. Затем органическую фазу азеотропно сушили и осаждали холодным гептаном с температурой 0-5C. Суспензию продукта фильтровали, промывали гептаном и сушили под вакуумом при температуре 60C. Растворенный в дихлорметане предшественник "аминокислоты ундекапептида" (от 5 до 13% от общей конечной массы) и растворенный в дихлорметане ДЦК добавляли одновременно и непрерывно в течение примерно 10 ч в смесь 6-хлоргидроксибензотриазола (Cl-HOBT) и N-метилморфолина (NMM) в дихлорметане при температуре 40C. В конце добавления смесь перемешивали в течение еще 2 ч, фильтровали для удаления соли ДЦМ и концентрировали для получения алиспоривира в виде неочищенного продукта. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения химического соединения структурной формулы 3 или его соли где R представляет собой метил, этил, пропил или фенил и R' представляет собой метил или этил, включающий стадии ацилирования циклоспорина A с образованием ацетил-циклоспорина A; раскрытия кольца ацетил-циклоспорина A и кристаллизации ацетил-циклоспорина A с раскрытым кольцом для получения химического соединения структурной формулы 3. 2. Способ по п.1 получения химического соединения структурной формулы 4 или его соли где R представляет собой метил, этил, пропил или фенил и R' представляет собой метил или этил, включающий стадии расщепления химического соединения структурной формулы 3 по методу Эдмана и последующую кристаллизацию этого химического соединения для получения химического соединения структурной формулы 4. 3. Способ получения химического соединения структурной формулы 4 или его соли где R представляет собой метил, этил, пропил или фенил и R' представляет собой метил или этил, включающий стадии:iii) кристаллизации ацетил-циклоспорина A с раскрытым кольцом для получения химического со-9 024903 единения структурной формулы 3iv) расщепления химического соединения структурной формулы 3 по методу Эдмана и последующуюv) кристаллизацию этого химического соединения для получения химического соединения структурной формулы 4 или его соли. 4. Химическое соединение структурной формулы 3 или его соль где R представляет собой метил, этил, пропил или фенил и R' представляет собой метил или этил. 5. Химическое соединение структурной формулы 4 или его соль где R представляет собой метил, этил, пропил или фенил и R' представляет собой метил или этил. 6. Способ по п.1 или 3, в котором чистота исходного материала циклоспорина A составляет 80 мас.%. 7. Способ по п.6, в котором чистота исходного материала циклоспорина А составляет 85 мас.%. 8. Способ по п.1 или 3, в котором чистота исходного материала циклоспорина A составляет от 60 до 80 мас.% по результатам анализа. 9. Способ получения химического соединения структурной формулы 3 или его соли из циклоспорина A, циклоспорина B, или из циклоспорина D, или из циклоспорина G- 10024903 где R представляет собой метил, этил, пропил или фенил, R' представляет собой метил или этил и R2 представляет собой метил, этил или пропил, включающий стадии ацилирования циклоспорина A, B, D или G с образованием ацетил-циклоспорина A, B, D или G; раскрытия кольца ацетил-циклоспорина A, B,D или G и кристаллизации ацетил-циклоспорина A, B, D или G с раскрытым кольцом для получения химического соединения структурной формулы 3. 10. Способ по п.9 получения химического соединения структурной формулы 4 или его соли где R представляет собой метил, этил, пропил или фенил, R' представляет собой метил или этил и R2 представляет собой метил, этил или пропил, включающий стадии расщепления химического соединения структурной формулы 3 по методу Эдмана и последующей кристаллизации этого химического соединения для получения химического соединения структурной формулы 4. 11. Способ получения химического соединения структурной формулы 4 или его соли где R представляет собой метил, этил, пропил или фенил, R' представляет собой метил или этил и R2 представляет собой метил, этил или пропил, включающий стадии:viii) кристаллизации ацетил-циклоспорина A, B, D или G с раскрытым кольцом для получения химического соединения структурной формулы 3 или его солиix) расщепления химического соединения структурной формулы 3 по методу Эдмана и последующейx) кристаллизации этого химического соединения для получения химического соединения структурной формулы 4 или его соли. 12. Способ по п.9 или 11, в котором чистота исходного материала циклоспорина А составляет 90 мас.%. 13. Способ по п.12, в котором чистота исходного материала циклоспорина A составляет 92 мас.%. 14. Способ по п.9 или 11, в котором чистота исходного материала циклоспорина A составляет от 60 до 80 мас.% по результатам анализа. 15. Химическое соединение структурной формулы 3 или его соль где R представляет собой метил, этил, пропил или фенил, R' представляет собой метил или этил и R2 представляет собой метил, этил или пропил. 16. Химическое соединение структурной формулы 4 или его соль где R представляет собой метил, этил, пропил или фенил, R' представляет собой метил или этил и R2 представляет собой метил, этил или пропил.
МПК / Метки
МПК: C07K 7/64
Метки: ундекапептидов, способ, циклических, производства
Код ссылки
<a href="https://eas.patents.su/14-24903-sposob-proizvodstva-ciklicheskih-undekapeptidov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ производства циклических ундекапептидов</a>
Предыдущий патент: Дуплексная нержавеющая сталь
Следующий патент: Способ дегазации пластического материала
Случайный патент: Способ и система для хранения серы












